Как распознать вирус Коксаки | Справочник медицинской лаборатории Оптимум (Сочи, Адлер)
Зимина Альбина Валерьевна
Врач-инфекционист,
Как выявить вирус Коксаки?
Вирус Коксаки представляет собой группу РНК-содержащих энтеровирусов, благоприятной средой для обитания и размножения которых является пищеварительный тракт человека. В окружающую среду патогены выделяются с испражнениями, загрязняя воду, почву, овощи и фрукты. Вирус переносится тараканами и мухами, именно поэтому вспышки инфекции наблюдаются в теплое время года. Наиболее подвержены заражению дети до 10-ти летнего возраста, однако заболеть могут и взрослые.
Пути передачи и развития вируса
Источник инфекции – больной человек или бессимптомный вирусоноситель. Заражение происходит при:
Заражение происходит при:
- Бытовых контактах – вирус выделяется с фекалиями и, при несоблюдении гигиенических требований, попадает на предметы домашнего обихода и продукты питания. Проникая в человеческий организм через ротовую полость, патогенные микроорганизмы оказываются в кишечных лимфоузлах, где активно размножаются.
- Купании в водоемах (в том числе – бассейнах).
- Вдыхании воздуха, содержащего частицы вируса, при разговоре с больным человеком. В этом случае размножение вируса происходит в носоглотке.
- Развитии ребенка в утробе инфицированной матери (встречается редко).
Проявления вируса Коксаки
Инкубационный период длится около 10 дней. У детей инфекционный процесс характеризуется:
- специфическими высыпаниями на слизистых и кожных покровах – в ротовой полости, на ступнях, наружных половых органах и ладонях появляются мелкие красные пузырьки;
- резким повышением температуры;
- общей слабостью;
- увеличением шейных лимфоузлов;
- потерей аппетита;
- болью в горле.

Многие родители могут принять клинические признаки вируса Коксаки за симптомы ветрянки. Однако патоген может спровоцировать развитие миокардита, менингита, плевродинии. Взрослые пациенты отмечают появление лихорадки, диареи, ухудшения общего самочувствия, головной боли, увеличения печени, ригидности мышц.
Методы диагностики
Диагностирование и клиническое разграничение инфекционных заболеваний основывается на итоговых данных:
1. Анамнеза.
2. Физикального осмотра пациента.
3. Консультаций узкопрофильных специалистов – инфекциониста, гастроэнтеролога, невропатолога.
4. Инструментального обследования:
- ультрасонографии брюшных органов;
- гастроскопии;
- электрокардиограммы.
5. Лабораторных исследований:
- гемограммы – для определения скорости оседания эритроцитов, численности белых кровяных телец и процентного соотношения их разновидностей;
- биохимического анализа крови – для определения печеночных трансфераз, общего белка и его фракций;
- копрограммы – общеклинического анализа каловых масс;
- иммунологического анализа крови – для выявления наличия специфических иммуноглобулинов и определения их количества;
- молекулярно-биологического анализа крови – для выявления фрагментов генетического материала возбудителя инфекции.

Лечение
При неосложненном течении инфекции Коксаки (отсутствии поражения сердечной мышцы, мозговых оболочек, печени) проводят симптоматическую терапию – применяют:
- жаропонижающие средства;
- спазмолитики;
- кишечные адсорбенты;
- препараты для обезболивания пораженных участков;
- средства для заживления изъязвлений в ротовой полости;
- антигистаминные препараты.
При тяжом течении заболевания пациенту назначают противовирусные препараты и интерфероногены.
Вирусы Коксаки и ЕСНО пришли в Москву – Москва 24, 12.09.2017
Вирусы Коксаки и ECHO пришли в Москву. О первом подобном диагнозе, поставленном 9-месячному младенцу в столичной больнице, в середине августа сообщал МК. А переболевший экзотической болезнью горожанин Павел Ковбасюк поделился своей историей с порталом Москва 24. Эксперты утверждают, что в России к вспышкам вирусов могут быть не готовы.
Фото: ТАСС/ Руслан Шамуков
О своей болезни Павел Ковбасюк узнал случайно.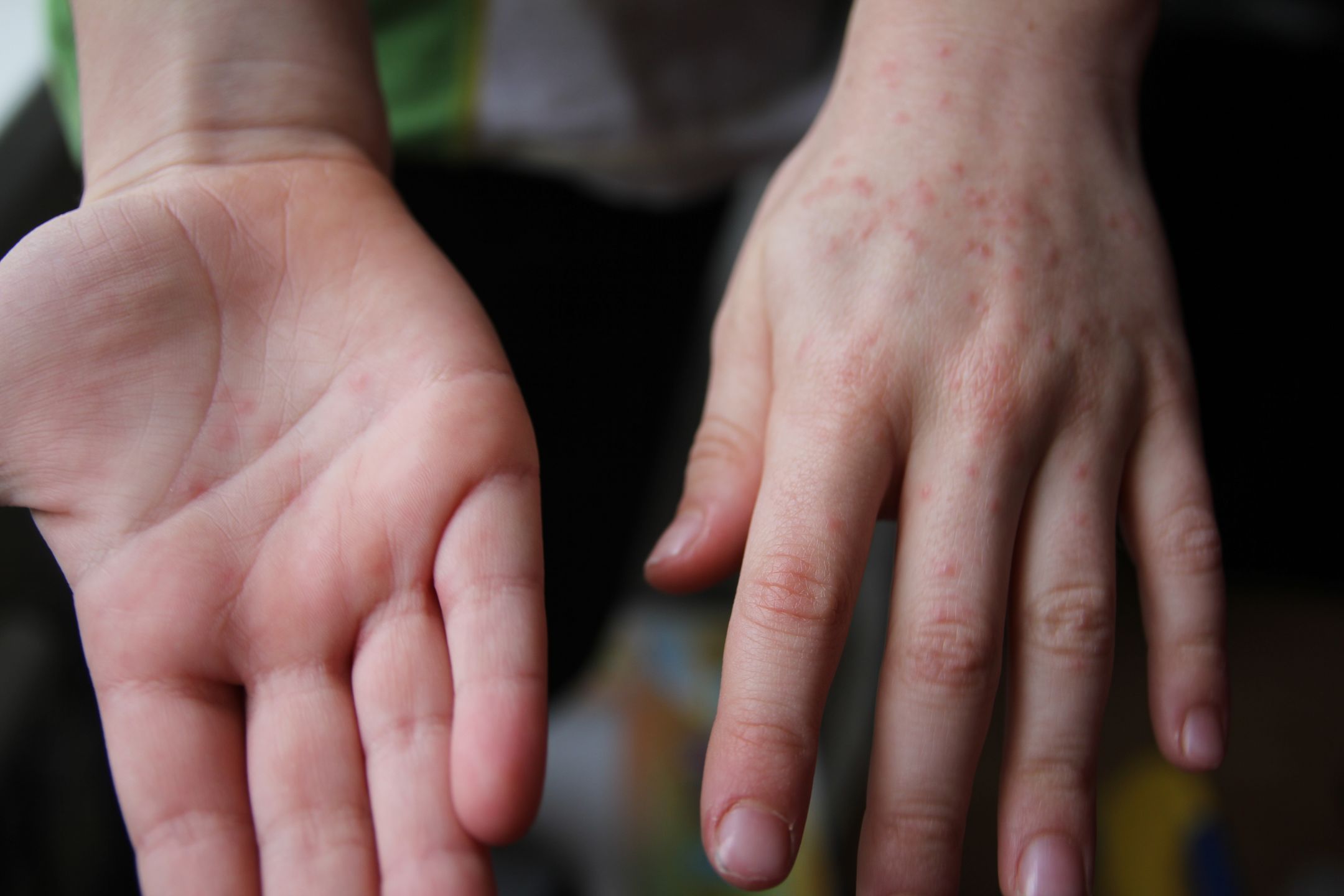 По пути в спортзал почувствовал сильную слабость и вернулся домой. Оказалось, что у него поднялась температура – 38,5. Никаких других симптомов не было. Утром добавились боль в горле и насморк. А когда на ладонях и ступнях появились странные красные пятна, стало ясно – это не простуда.
По пути в спортзал почувствовал сильную слабость и вернулся домой. Оказалось, что у него поднялась температура – 38,5. Никаких других симптомов не было. Утром добавились боль в горле и насморк. А когда на ладонях и ступнях появились странные красные пятна, стало ясно – это не простуда.
Сначала Коксаки москвич диагностировал себе сам, пролистав список симптомов в интернете, но никто не верил, что он действительно мог заразиться Коксаки: ни он сам, ни его ближайшее окружение за рубежом в этом году не были.
Врачи сомнения развеяли и подтвердили диагноз. Причем в скорой помощи отметили – это далеко не первый и не единичный случай. Ковбасюк также обратил внимание на то, что в бумагах диагноз поставили общий: энтеровирус.
Позднее москвич выяснил, что среди его друзей этой заразой переболели уже четыре человека. Тем не менее, никто из них, как и Павел, за границей в этом году не был.
Чем опасны вирусы Коксаки и ECHO
Вирусы Коксаки и ECHO – это целая группа острых заболеваний – от легких лихорадок до миокардитов, менингоэнцефалитов и миалгий.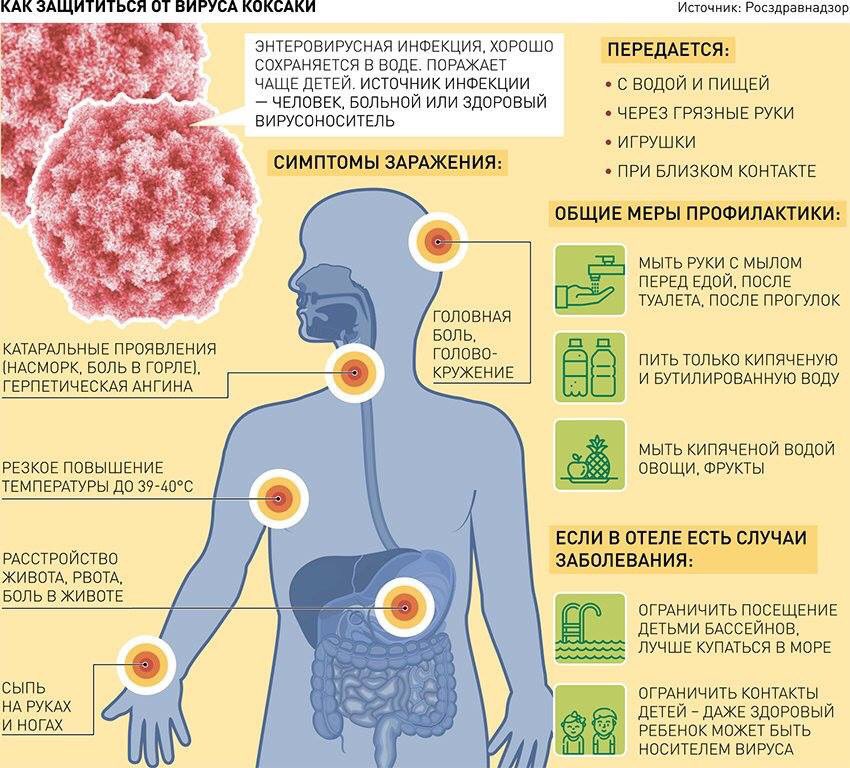
Инфекция передается воздушно-капельным путем. Также заразиться можно фекально-оральным путем и через воду и еду. Вирус размножается в кишечнике человека, и долгое время выделяется во внешнюю среду.
Больше всего подвержены заболеванию дети в возрасте от 3 до 10 лет. Малыши до 3 месяцев вне опасности, поскольку обладают врожденным иммунитетом. Дети старше 10 лет и взрослые заболевают в редких случаях, поскольку часто переносят инфекцию без клинических проявлений, в результате которой приобретают иммунитет к болезни.
Если вирус будет занесен в детский коллектив, инфекцию подхватят до 80% детей. Фото: портал Москва 24
Вирус быстро передается от больных к здоровым. Если он будет занесен в детский коллектив, инфекцию подхватят до 80% детей. Такие вспышки схожи с эпидемиями ОРВИ.
Существуют также 4 других типа энтеровируса, помимо Коксаки и ECHO. Два из них возбуждают респираторные кишечные заболевания, один – приводит к геморрагическому конъюнктивиту. «Вирус типа 71» – к менингитам и энцефалитам.
Вирусы Коксаки и ЕСНО уже давно в России
Владимир Студеникин
Профессор и доктор медицинских наук
По мнению главного научного сотрудника психоневрологического отделения НИИ педиатрии ГУ НЦЗД РАМН, профессора и доктора медицинских наук Владимира Студеникина, появление вирусов Коксаки и ЕСНО в России частично связано с отпускным периодом, когда в страну возвращаются отдыхающие из-за рубежа, а частично с тем, как легко заразиться Коксаки-инфекцией.
«Собственно говоря, они (вирусы – прим. Москва 24) не появились, а всегда были (описаны в США в 1948 году). Широкого распространения вируса Коксаки в нашей стране не ожидается, хотя это вполне возможно. Распознать инфицирование вирусом Коксаки несложно по характерным симптомам болезни. Например, синдром «рука-нога-рот» (болезненные язвы в полости рта и небольшие везикулы (сероватые пузырьки) на конечностях – прим. Москва 24) или герпетическая ангина», – пояснил доктор медицинских наук в беседе с порталом Москва 24.
Роспотребнадзор готов к оперативному предупреждению распространения энтеровирусной инфекции из Китая.
Лаборатории ведомства обеспечены диагностическими препаратами для проведения исследований на энтеровирусные инфекции и квалифицированным персоналом. Кроме того, медработников обучили методикам диагностики, лечения и профилактики таких инфекций.
Особой опасности вирусы Коксаки и ЕСНО не представляют, хотя инфекционные заболевания, вызванные этими вирусами, могут сопровождаться серьезными осложнениями. Но чаще всего болезнь проходит естественным путем по прошествии полутора-двух недель, добавил Студеникин.
Больше всего подвержены заболеванию дети в возрасте до 10 лет. Фото: ТАСС/Дмитрий Рогулин
«Специфического эффективного лечения для таких вирусных инфекций не существует, используется симптоматическая терапия и обильное питье. Вакцины не разработаны и иммунопрофилактика невозможна. Осложнениями коксаки-инфекции (самыми тяжелыми) являются менингит, миокардит, артрит (соответственно, поражение мозга, сердца или суставов)», – отметил профессор.
Уверенности в том, что в России готовы к вспышке вируса Коксаки, нет
Владимир Студеникин
Профессор и доктор медицинских наук
Он подчеркнул, что уверенности в том, что в Москве и в России готовы к возможным вспышкам этого заболевания, нет.
«До недавнего времени не только немедицинская общественность, но и многие врачи не имели какого-либо представления о вирусе Коксаки и ассоцированных с ним инфекциях», – заключил Студеникин.
Россиян предупреждают о возможной вспышке серозного менингита.
По данным Роспотребнадзора, смертельно опасное заболевание пришло из Китая. Первые случаи уже зафиксированы в шести регионах страны за Уралом и в центральной части.
Вирус поражает в основном детей. Главная особенность опасной болезни в том, что инкубационный период чрезвычайно короткий – всего сутки. Симптомами являются сонливость, высокая температура, головокружение, рвота, тяжесть в животе. В настоящий момент принимаются превентивные меры для выявления возможных заболевших.
Подробности – в сюжете телеканала Москва 24.
Кристина Оленева, Джо Халдон
РОЛЬ НЕОНАТАЛЬНОГО FC РЕЦЕПТОРА В ДЕПРОТЕИНИЗАЦИИ ВИРУСОВ ECHO И КОКСАКИ А9 | Усольцева
Аннотация
Цель настоящей работы — определение функции человеческого неонатального рецептора для Fc фрагмента IgG (hFcRn) в качестве общего депротеинизирующего клеточного рецептора для вирусов ECHO (эховирусов) и Коксаки A9 при заражении культуры клеток рабдомиосаркомы человека (RD). Материал и методы. Исследовали протективный эффект человеческого сывороточного альбумина, очищенного от глобулинов (HSA-GF) и антител к hFcRn, при заражении культур клеток RD штаммами и клонами энтеровирусов вида В с разной рецепторной специфичностью (эховирусы 3, 9, 11, 30-го типов и вирусы Коксаки A9, B4, B5). Результаты. Было показано, что HSA-GF при концентрациях 4% и менее защищал клетки RD от инфицирования эховирусами 3, 9, 11-го типов и вирусом Коксаки A9. Аналогичный спектр протективной активности проявляли антитела к hFcRn в концентрациях ≥2,5 мкг/мл, защищавшие клетки RD от инфицирования эховирусами 3, 9, 11, 30-го типов и вирусом Коксаки A9. Протективный эффект HSA-GF и антител к hFcRn не наблюдался при заражении клеток RD вирусами Коксаки B4 и B5, депротеинизация которых требует участия коксакивирусного-аденовирусного рецептора. Обсуждение. Использование ранее охарактеризованных клонов эховируса 11-го типа с разной рецепторной специфичностью позволило определить функцию hFcRn как каньон-связывающего и депротеинизирующего рецептора в культуре клеток RD. Корреляция величины и динамики наблюдавшихся протективных эффектов с рецепторной специфичностью использованных в работе энтеровирусов указывала на двухэтапность взаимодействия DAF-зависимых эховирусов с рецепторами клеток. Заключение. Определена роль hFcRn как каньон-связывающего и депротеинизирующего рецептора для эховирусов и вируса Коксаки А9 при репродукции в клетках RD. Подтверждена двухэтапная схема взаимодействия с рецепторами DAF-зависимых эховирусов при входе в клетку: сначала со связывающим рецептором (DAF), затем — с депротеинизирующим (hFcRn).
Протективный эффект HSA-GF и антител к hFcRn не наблюдался при заражении клеток RD вирусами Коксаки B4 и B5, депротеинизация которых требует участия коксакивирусного-аденовирусного рецептора. Обсуждение. Использование ранее охарактеризованных клонов эховируса 11-го типа с разной рецепторной специфичностью позволило определить функцию hFcRn как каньон-связывающего и депротеинизирующего рецептора в культуре клеток RD. Корреляция величины и динамики наблюдавшихся протективных эффектов с рецепторной специфичностью использованных в работе энтеровирусов указывала на двухэтапность взаимодействия DAF-зависимых эховирусов с рецепторами клеток. Заключение. Определена роль hFcRn как каньон-связывающего и депротеинизирующего рецептора для эховирусов и вируса Коксаки А9 при репродукции в клетках RD. Подтверждена двухэтапная схема взаимодействия с рецепторами DAF-зависимых эховирусов при входе в клетку: сначала со связывающим рецептором (DAF), затем — с депротеинизирующим (hFcRn).
Вирус Коксаки — симптомы и методы лечения
19 ноября 2019, 15:33
Случаи заболевания уже зафиксированы на юге Украины
В Одессе сразу несколько классов средней школы закрыли на карантин в связи со вспышкой вируса Коксаки. Эта болезнь чаще всего поражает детей, но течение ее традиционно сложнее переносится взрослыми пациентами. Заболевание уже несколько лет подряд фиксируют в Украине. Обычно его привозят туристы с южных курортов.
Эта болезнь чаще всего поражает детей, но течение ее традиционно сложнее переносится взрослыми пациентами. Заболевание уже несколько лет подряд фиксируют в Украине. Обычно его привозят туристы с южных курортов.
Вирус Коксаки, поразивший учеников одесской школы, привел к закрытию сразу восьми классов на карантин на время инкубационного периода. Эта болезнь — разновидность энтеровирусов. По мнению инфекционистов, Коксаки, скорее неприятная болезнь, чем опасная для здоровья.
“Чаще все такое заболевание не тяжелое. Внешние признаки могут быть в виде сыпи. Чаще всего проявления видны на руках и ногах. Характерный признак — сыпь на ладошках и стопах. Но кроме этого, могут чаще встречаться варианты заболевания, когда сыпь проявляется на слизистой оболочке полости рта”, — говорит врач.
По его словам, паниковать из-за вируса Коксаки все-таки не стоит. Однако важно чаще мыть руки и избегать скопления людей в тех регионах, где зафиксированы случаи болезни.
“За последние годы мы тяжелых последствий от этой болезни не фиксировали, — говорит Евтушенко. — Вспышки возможны потому, что он передается через руки, пораженную кожу. У него два основных пути передачи. Во-первых, это кашель, так как вирус размножается на слизистых оболочках, то есть передается как обычный ОРВИ, с кашлем и чиханием. Во-вторых — через руки, пищевые продукты, посуду. Вирус достаточно устойчив в окружающей среде”, — объясняет медик.
Известно, что существует около 30 видов вируса Коксаки, обладающих разной избирательной способностью по отношению к тканям. Для одних разновидностей излюбленным местом поселения становится кожа, для других – мышцы, для третьих – внутренние органы. Но большинство серотипов паразитирует в нервных клетках.
На сегодняшний день вакцины от вируса Коксаки, впрочем, как и от других энтеровирусов, не получено. Единственная профилактика – соблюдение личной гигиены. Но поскольку основным путем передачи вируса является все-таки воздушно-капельный, то и этот способ – не панацея.
МЕТОДЫ ЛЕЧЕНИЯ
Специфического лечения от вируса Коксаки не существует. Симптомы проходят примерно через 2-10 дней. Симптоматическое лечение необходимо. Как правило, это жаропонижающие и антигистаминные средства, чтобы сбить температуру, снять болевые ощущения и облегчить зуд из-за сыпи.
Вакцины от группы вирусов Коксаки не существует.
Инкубационный период — 2-10 дней. Проявления заболевания, как правило, заметны на 3-4 день.
Жертвы инфекции: вирус Коксаки не ушел из Татарстана
Элина Исмагилова вместе с мужем и двумя детьми отправилась в Турцию в конце июля. Исмагиловы каждый год выбирались на один и тот же курорт, и отдыхали в одном и том же отеле – особых проблем никогда не возникало. Женщина призналась, что, скорее всего, это и ослабило их бдительность.
«Моему сыну 14 лет, он купался в море, катался на водных горках. Спустя десять дней отдыха у него на ногах и бедрах начали появляться небольшие волдыри, я подумала, что сын натёр мозоль, катаясь на горке.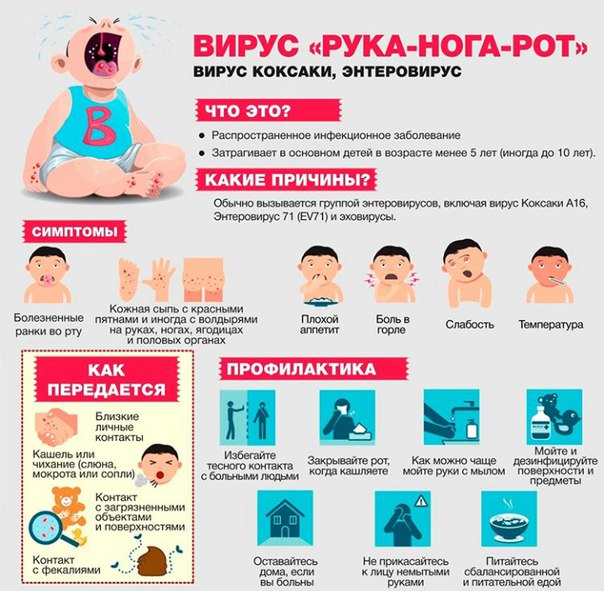 Через 2 дня поднялась температура до 37,8, начался насморк, кашель. Тогда мы не стали обращаться к врачу – ребенок чувствовал себя более-менее хорошо, мы списали всё на акклиматизацию», – вспоминает она.
Через 2 дня поднялась температура до 37,8, начался насморк, кашель. Тогда мы не стали обращаться к врачу – ребенок чувствовал себя более-менее хорошо, мы списали всё на акклиматизацию», – вспоминает она.
Когда отдых подходил к концу, похожие симптомы появились и у одиннадцатилетней дочки. На руках между пальцев высыпали белые волдыри, они лопались, кожа на этом месте трескалась. Также поднялась температура и начался насморк.
По приезду в Казань родители поспешили отвести детей к врачу.
«Сдав анализы, мы услышали диагноз – вирус Коксаки. Оказалось, что активного вируса у нас уже нет, заболевание почти прошло. Но вирус дал осложнение: у старшего – ринит, у младшей – отит. На протяжении недели мы давали детям антибиотики и всячески поднимали иммунитет, сейчас им значительно лучше. Мы с мужем не заболели, похоже, что нам повезло», –рассказала Элина.
Маленькие жертвы вируса
Энтеровирусные инфекции – это группа инфекционных заболеваний, вызываемых различными энтеровирусами, в том числе вирусами Коксаки, всего более 70 серотипов, рассказала заместитель главного врача по эпидемиологическим вопросам республиканской клинической инфекционной больницы Татьяна Мартынова.
«Один и тот же тип вируса может вызвать как легкие, стертые формы болезни с поражением респираторного тракта или кишечника, так и крайне тяжелые варианты. В то же время энтеровирусы разных серотипов могут являться причиной одних и тех же клинических синдромов. Лечение не зависит от типа вируса, оно зависит от тяжести и симптомов», – объясняет Татьяна Мартынова.
Заразиться энтеровирусом можно в любом возрасте, но чаще всего он «прилипает» к детям. По данным ВОЗ, почти три четверти случаев приходится на детей до 15 лет, а малыши первых лет жизни страдают от вируса в несколько раз чаще старших детей и взрослых.
«Существуют разные пути заражения. Можно заразиться через грязные руки, продукты питания и при купании в зараженных водоемах. В острый период вирус выделяется из носоглоточной слизи, поэтому возникает риск передачи и воздушно-капельным путем», – рассказывает заместитель главврача.
Как оказалось, вирус весьма коварен – зачастую люди являются носителями инфекции, сами о том не догадываясь. Заразившись, человек может почувствовать недомогание через сутки или в течение 7-10 дней, отмечает Мартынова.
Заразившись, человек может почувствовать недомогание через сутки или в течение 7-10 дней, отмечает Мартынова.
«Энтеровирусная инфекция, как любое инфекционное заболевание, начинается с температуры и слабости. Болезнь может протекать в различных формах: у одного это будет ангина, у другого рвота и диарея. У третьего, что встречается достаточно часто, может появиться сыпь на руках, ногах и теле», – рассказывает врач.
Но не всем удается отделаться ангиной и сыпью. В тяжелых случаях участью заразившихся может стать серозный менингит.
«Головная боль может проявляться при различных вирусных болезнях, но при серозном менингите она будет наиболее выраженной. Также отмечается гипертонус мышц затылка, когда человек не сможет наклонить голову и прижать подбородок к груди. Может быть рвота. Это тяжелая форма заболевания, которая, конечно же, подлежит обязательной госпитализации», – отмечает Мартынова.
Чтобы не стать жертвой вируса нужно соблюдать элементарные правила гигиены – тщательно мыть руки с мылом, мыть фрукты и овощи, обязательно обдавая кипятком, для питья употреблять только кипяченую или бутилированную воду.
Заразиться можно как при купании в непроточных водоемах (бассейнах и фонтанах), так и в открытых водоемах. Нельзя заглатывать воду при купании, нельзя купаться в местах несанкционированных пляжей. Если вы отдыхаете на морском побережье, лучше купаться в море, но только в специально отведенных местах», – советует заместитель главврача.
Стоит отказаться от купания в бассейне, если вы видите, что в нем плещется человек, покрытый сыпью. Конечно, это может быть и аллергия, но лучше не рисковать.
На протяжении 10 лет были зафиксированы крупные вспышки энтеровирусных заболеваний в Китае, Южной Корее, в США, на Тайване и некоторых странах Европы. Отмечены они были и в России. В Татарстане случаи заражения энтеровирусными инфекциями еще пять-семь лет назад были единичными, рассказывает специалист.
В инфекционную больницу с подобными заболеваниями обращаются с мая по ноябрь. В основном они имеют легкую или среднюю тяжесть заболевания. К счастью, в этом году, вспышечной заболеваемости в республике не наблюдалось, заключила Татьяна Мартынова.
Стоит ли паниковать?
Статистика Роспотребнадзора утешает – в этом году число заболевших значительно снизилось. Но из всех случаев заражения лишь малая часть была привезена с курортов.
В 2018 году с мая по июль мы зафиксировали 41 случай заболевания энтеровирусной инфекцией. Из них у 16 диагностировали вирус Коксаки. В основном инфекция поражает маленьких детей в возрасте до 3 лет. Как только мы ставим диагноз – вирусная инфекция, сразу же выясняем все детали заражения и проводим проверки в местах, где находился больной», – рассказала начальник отдела эпидемиологического надзора Управления Роспотребнадзора по РТ Лилия Юзлибаева.
В этом году очагов распространения энтеровирусных заболеваний в Татарстане не выявлено, все случаи заражений – частные. Статистика показывает, что за этот сезон вирус из-за рубежа привезли всего шесть человек – четверо из ОАЭ, двое из Турции. Остальные 35 случаев – были зафиксированы в Татарстане.
Стоит отметить, что в прошлом году число зараженных было в три раза больше и составило 119 случаев.
The virus-immune hypothesis for cardiac dilatation | Kozhevnikov
The paper gives an update on the pathogenetic role of viral infection and immune mechanisms in the development of cardiac dilatation at the cellular, ultrastructural, and molecular levels. Particular attention is given to the discussion of the possible role of herpesvirus infection in the mechanisms of cardiomyocyte damage with the direct or indirect impact of viral infection through immunoinflammatory responses. Data on the protective and damaging action of a number of cytokines in the immunopathogenesis of viral myocarditis are considered.
ВПГ — вирус простого герпеса ВЭБ — вирус Эпштейна—Барр ГМКС — гладкие мышечные клетки сосудов ДКМП — дилатационная кардиомиопатия ИЛ — интерлейкин ИНФ — интерферон КМП — кардиомиопатия КМЦ — кардиомиоцит ЛЖ — левый желудочек ПЦР — полимеразная цепная реакция MMP — матриксная металлопротеиназа Th-17 — T-хелперы 17-го типа В настоящее время в отношении этиопатогенеза кардиомиопатий (КМП) уточняются многие факты, лежащие в основе действующих классификаций [1, 2]. Но, не смотря на успех в молекулярно-генетических исследованиях этиологии КМП, с определением ее генетических форм, причины развития многих КМП по-прежнему остаются неясными. Среди известных причин, вызывающих или способствующих развитию КМП, некоторые можно отнести к общим как для первичных КМП (смешанные — дилатационная — ДКМП, приобретенные — воспалительная КМП), так и для вторичных КМП при ишемической болезни сердца (ИБС) и приобретенных пороках сердца. В качестве таких причин выступают инфекционные (особенно вирусные), аутоиммунные и воспалительные [1, 3—7]. Зачастую при установлении диагноза КМП сложно определить истинную ее первопричину, а при вторичных ее формах, когда на этиопатогенез оказывает существенное влияние основное заболевание, это становится практически невозможным. Расширение полостей сердца со снижением сократительной функции миокарда — один из наиболее частых синдромов у больных ИБС и с клапанной патологией с перегрузкой левого желудочка (ЛЖ) [8—10]. Причины данного состояния даже при наличии таких факторов, как ишемия, артериальная гипертония, клапанные пороки сердца с их известной картиной патогенеза, во многом неясны. Возможно, в развитии вторичных КМП заложены те же причины, что и при ДКМП негенетической природы. Современные представления о причинах развития дилатации камер сердца и сократительной дисфункции миокарда у больных с ДКМП все чаще стали рассматриваться с позиции вирусной цитопатологии и иммуновоспалительных реакций, что сформировало вирусно-иммунную гипотезу [6, 11]. Изучение механизмов повреждения кардиомиоцитов (КМЦ) при непосредственном влиянии вирусных инфекций или же опосредованном их действии через иммунные, воспалительные реакции породило надежду на раскрытие сущности патогенеза многих из КМП. Среди множества вирусов, таких как аденовирусы, энтеровирусы, парвовирус B19, вирус простого герпеса (ВПГ) 1-го и 2-го типов, цитомегаловирус, вирус Эпштейна—Барр (ВЭБ), вирус герпеса 6А типа, вирус герпеса 6 В типа и др., которые удается обнаружить в эндомиокардиальных биоптатах при сердечной недостаточности [12—19] остается неясным, какой из вирусов оказывает большее цитопатическое действие на КМЦ. Мало работ посвящено выявлению вирусной инфекции внутри КМЦ на клеточном, субклеточном и молекулярном уровнях. Так, в работе U. Kühl и соавт. [19] приводится описание вирусных частиц в КМЦ на ультраструктурном уровне и принимается автором за вирусы герпеса 6А и В типов. При этом внутриклеточные повреждения КМЦ не оцениваются, признаки вирусной инфекции в КМЦ также определены иммуногистохимически и подтверждены результатами молекулярно-генетических исследований миокарда. По данным автора, вирусы герпеса 6А и В типов выявляются методом полимеразной цепной реакции (ПЦР) в биоптатах эндомиокарда у 16,5% больных с сердечной недостаточностью с клиническими признаками миокардита, идиопатической ДКМП, причем в 98,2% случаев из них определяется 6 В тип и в 1,8% — 6А тип. Методом иммуногистохимии выявлены антигены гликопротеина 60/110 для вирусов герпеса 6А/В типов и структурного белка р101 вируса герпеса 6 В типа. При этом автор уточняет, что в КМЦ обнаружен только антиген вируса герпеса 6А типа, а в интерстициальных клетках и эндотелиоцитах — 6 В типа. Более того, по эндомиокардиальным биоптатам у 1,1% больных установлены признаки интеграции вирусов герпеса 6А и В типа в хромосомы клеток миокарда, что обеспечивало его латентное состояние, в 37% случаев отмечалась хромосомная интеграция у вируса герпеса 6А типа, предполагается, что он ассоциирован с высоким риском развития миокардита [19]. Полученные в работе U. Kühl и соавт. [19] данные представляются весьма интригующими с точки зрения скрытой инфекции, способной передаваться по наследству и оказывать повреждающее действие на КМЦ. Известно, что только вирусы герпеса 6А и В типов способны интегрироваться в геном клетки хозяина, остальные представители семейства вирусов герпеса обычно поддерживают свои геномы как внехромосомные круговые эписомы в ядрах инфицированных клеток [20]. Тем не менее следует отметить, что процент обнаружения данного вируса остается низким, возможно, его следует рассматривать как коинфекцию, способную усилить повреждающее действие на миокард или может быть это связано с трудностями его определения. В работе U. Kühl и соавт. [19] указывается, что чаще всего вирусы герпеса 6А и В типов сочетались с парвовирусом В19, который по данным S. Greulich и соавт. [17], исходя из вирусной нагрузки миокарда, не является предиктором неблагоприятного прогноза у больных с ДКМП. В работах C. Chimenti и соавт. [14] при попытках определить ВЭБ в КМЦ, выделенных лазерной микродиссекцией, лишь у 6,3% больных с воспалительной КМП с дилатацией и систолической дисфункцией ЛЖ выявлен данный вирус. Известны также сообщения Л.Б. Митрофановой и соавт. [13] о присутствии энтеровирусов в КМЦ правого предсердия и ЛЖ во всех случаях с фибрилляцией предсердий и без нее, при ревматических пороках сердца и при ИБС, что, по мнению авторов, свидетельствует о персистенции этих вирусов в миокарде. Вирус Коксаки В3 считают основной причиной миокардита [21]. Парвовирус В19 определялся в КМЦ почти с такой же частотой, что и энтеровирусы. При этом антигены к гликопротеинам оболочки ВПГ 1-го типа и цитомегаловируса в КМЦ методом иммуногистохимии не выявлены [13]. В то же время при гибридизации in situ цитомегаловирус все же определялся в КМЦ у больных с ДКМП [22]. Очевидно, что продуктивная герпесвирусная инфекция в КМЦ отсутствует, но латентная ее форма рассматривалась только в работе U. Kühl и соавт. [19] для вируса герпеса 6А и 6 В типов; других сообщений о латентном состоянии вирусов герпеса в КМЦ мы не встречали. На основании данных литературы по-новому представляется роль апоптоза КМЦ в механизмах развития ремоделирования миокарда при вирусной инфекции. Апоптоз КМЦ у человека, индуцированный вирусами, до конца не изучен, но хорошо охарактеризован в культивируемых клетках и у мышей. Известно, что он является защитным механизмом, направленным на элиминацию инфицированных клеток и ограничение распространения вируса в соседние КМЦ [23—25]. Однако также показано, что при инфицировании КМЦ вирусом Коксаки В3 целостность сарколеммы является одним из важнейших факторов, который предотвращает распространение вируса за пределы инфицированной клетки, и в случае разрушения сарколемного барьера при активации апоптоза возникает угроза заражения других клеток. В отличие от делящихся клеток КМЦ способны запускать антиапоптотические механизмы не только для собственного выживания, но и для сдерживания распространения вируса, который, напротив, может попытаться активировать проапоптотические механизмы на поздней стадии своей репликации, чтобы распространить инфекцию в миокарде. Так, между КМЦ и вирусом Коксаки В3 могут формироваться симбиотические отношения на основе баланса про- и антиапоптотических механизмов сдерживания вирусной инфекции, что приводит к хроническому ее течению, а при срыве этих механизмов — к гибели КМЦ и развитию ДКМП [24]. Исследования показали, что ВПГ эволюционировал свою стратегию противодействия активации каспаз и апоптоза посредством вирусных антиапоптотических белков gD, gJ, Us3, регуляторных белков ICP4, ICP24 и ICP27, а также LAT (от англ. Latency-associated transcript) и большой субъединицы рибонуклеотидредуктазы (R1). Все больше стало появляться доказательств, что R1 ВПГ регулирует процесс гибели клетки путем некроза через RHIM-зависимую инактивацию или активацию рецептора RIP3 [25, 26]. Установлено, что в покоящихся фибробластах человека цитомегаловирус может регулировать митохондриальный апоптоз на уровне транскрипции гена bcl-2, двунаправлено, оказывая как антиапоптотическое, так и проапоптотическое действие [27]. По-видимому, возможность вирусов регулировать механизмы гибели клеток создает им благоприятные условия для длительной персистенции в миокарде. По данным литературы, в механизмах развития дилатации сердца и снижении сократительной способности миокарда играют роль процесс аутофагии в КМЦ [28] и влияние на нее вирусной инфекции [21, 29]. Известно, что ВПГ 1-го типа, цитомегаловирус, вирус Коксаки В3 и другие вирусы могут не только инициировать аутофагию в КМЦ и других клетках в экспериментальных исследованиях, но и подавлять ее путем ингибирования созревания аутофагосом через прямое взаимодействие вирусных белков с аутофагосомальными белками, таким образом блокируя один из защитных противовирусных механизмов клетки [21]. Однако не всем вирусам выгодно подавлять аутофагию. Вирус Коксаки В3 может использовать механизмы образования аутофагосом для собственной репликации в клетке, диаметр таких индуцированных вирусом аутофагосом составляет 200—400 нм, что отличает их от классических аутофагосом размером 800 нм и более крупных ее вариантов при макроаутофагии; в остальном вакуоли имеют схожую характеристику: наличие двойной мембраны, цитоплазматической локализации, коэкспрессии белка LC3 (главного маркера образования аутофагосом) и лизосомального мембранного белка LAMP-1, накопление липидсвязанной формы LC3-II, маркирующей мембраны аутофагосом [23]. По результатам электронно-микроскопического исследования, миокарда ушка правого предсердия у больных с приобретенными пороками сердца с перегрузкой ЛЖ в КМЦ обнаружены множественные вакуоли диаметрос от 1 до 3,4 мкм, которые различались по содержимому, формировались из скоплений гранул гликогена, крошковидной зернистости, мембранных структур, ассоциировались (у 6 человек, 100%) с систолической дисфункцией [30]. Эту зернистость вполне возможно было бы принять за продукт протеолиза компонентов клетки, подвергшихся естественному аутофагоцитозу [21, 29]. Вместе с тем с позиций вирусной цитопатологии такая зернистость в КМЦ [30] может иметь и другое происхождение [31]. Установлено, что при абортивном типе герпесвирусной инфекции, при котором вирус пытается себя воспроизвести, но репликации не происходит, в цитоплазме инфицированных клеток могут накапливаться α-белки, и происходить это может двумя путями. Во-первых, при существовании вируса в латентном состоянии, благодаря LAT-транскрипту, РНК которого транскрибируется с одного из регионов вирусного генома (эписомы), и при этом могут выявляться не только транскрипты сверхранних α-генов (ICP4), но и ранних β-генов (ICP8, ген тимидинкиназы) [32]. Во-вторых, при мутациях по α-, β-, γ-генам; в этом случае инфекция может быть как абортивной, так и частично продуктивной [31]. Возможно, в нашем исследовании [30] скопления зернистого содержимого около ядра и под сарколеммой КМЦ представляют собой наиболее ранние α-белки вируса герпеса, при абортивном типе герпесвирусной инфекции, что могло бы объяснить отрицательные результаты по ее обнаружению и помочь в поиске других подходов в диагностике данной инфекции или же обнаруженная зернистость является модифицированным белком внутриклеточных компонентов, подвергшихся аутофагоцитозу. Известно, что в нейронах нейротропные α-герпесвирусы (ВПГ 1-го и 2-го типов) могут длительное время находиться в латентном состоянии, а при реактивации существенно не нарушать функции клетки [33]. Не исключено, что КМЦ имеют схожесть с нейронами по чувствительности к ВПГ и при рассмотрении вопросов возможного их инфицирования вирусной ДНК следовало бы учитывать подобные нейронам механизмы взаимодействия вируса и клетки. Наличие вирусной инфекции в КМЦ, фибробластах, эндотелиоцитах, гладких мышечных клетках сосудов (ГМКС) неотъемлемо связано с ответной реакцией иммунной системы, направленной на элиминацию вируса, что тесно сопряжено с развитием повреждающего действия аутоиммунной и воспалительной реакций. По данным литературы, у больных с дилатацией ЛЖ со снижением его сократимости вследствие ишемии или длительной артериальной гипертонии, клапанных пороков сердца доминирует вирусно-иммунный миокардит, при котором отмечается высокий титр антикардиальных антител: антинуклеарный фактор, антитела к антигенам эндотелия, КМЦ, ГМКС, волокнам проводящей системы сердца и наличие признаков миокардита [34, 35]. При этом, по данным ПЦР миокардиальных биоптатов, чаще определялся парвовирус В19 (у 9 человек, или 38%) и вирус герпеса 6-го типа (у 4 человек, или 17%), вероятно, А и В типы, не уточняется, также определялись ВЭБ у 3 (13%), цитомегаловирус у 2 (8%) [34] и ВПГ 1-го и 2-го типов у 5 (12,9%) в составе микст-инфекции [35]. Известно, что миокардит может развиваться на разных стадиях инфекционного процесса, протекать бессимптомно и на момент морфологической верификации признаков миокардита вирус может элиминироваться из миокарда [36] или в случае герпесвирусной инфекции переходить в латентное состояние и не определяться, поэтому доказать вирусную этиологию миокардита сложно и такие случаи относятся к идиопатическим. Считается, что идиопатический миокардит соответствует иммунному миокардиту, индуцированному вирусами [35]. При этом в крови определяются антикардиальные антитела в отсутствие вирусного генома. В экспериментальных исследованиях у мышей показано, что острый миокардит, вызванный вирусом Коксаки В3, тесно связан с развитием фиброзных изменений в миокарде, и при снижении вирусной нагрузки отмечается уменьшение воспаления и фиброза по следующим маркерам: миелопероксидаза, перфорин, интерферон (ИНФ) γ, интерлейкин (ИЛ) 17 и TGF-β-зависимый Smad3 и матриксная металлопротеиназа (MMP) 2-го типа [37]. При такой же модели вирусного миокардита выявлено, что регуляторные Т-клетки посредством синтеза главным образом ИЛ-10 уменьшают фиброз в миокарде, что оценивалось по таким маркерам, как коллаген I типа, MMP-1, MMP-3 и TIMP-1. Авторами отводится защитная роль ИЛ-10 при фиброзе, индуцированном вирусом Коксаки В3 [38]. По данным A. Ghosh и соавт. [39], ИНФ-γ, ИЛ-10 и эпигенетические факторы, такие как микроРНК, также играют ключевую роль в регуляции воспаления и синтеза основных матриксных белков коллагена в различных органах. Показано, что CD4+ T-хелперы 2-го типа посредствам синтеза ИЛ-4 приводят к развитию фиброза в миокарде [40]. Напротив, среди цитокинов В-лимфоцитов (ИЛ-1β, ИЛ-6, ИЛ-10, ИЛ-17, TNF-α и TGF-β) только секреция TNF-α связана с развитием фиброза в миокарде больных с ДКМП при вирусном миокардите [41]. Авторы указывает на ключевую роль T-хелперов 17-го типа (Th-17), субпопуляции активированных Т-лимфоцитов CD4+ в иммунопатогенезе миокардита у мышей [42]. Оказалось, что ИЛ- 17 — основной цитокин Th-17-лимфоцитов, участвуя в реализации защитных механизмов, направленных против вне- и внутриклеточных бактериальных и вирусных патогенов, может способствовать развитию избыточной воспалительной реакции и деструкции тканей миокарда. Между парвовирусом В19 и Th-17 существует тесная связь в развитии вирусно-иммунного миокардита в патогенезе ДКМП у больных с системной красной волчанкой [43]. Кроме того, установлено, что при высоких титрах антимиокардиальных антител отмечается высокая экспрессия рецепторов к ИЛ-17 на В-лимфоцитах у больных с острым вирусным миокардитом и ДКМП. Это указывает на важную роль Th-17 в опосредованном развитии гуморального ответа [44]. В экспериментальных работах на животных также показано, что более тяжелое течение миокардита связано с нарушением апоптоза активированных эффекторных лимфоцитов CD4+, инфильтрирующих миокард, а также с неспособностью лимфоцитов CD8+ подавлять иммунные реакции при утрате способности к синтезу ИНФ-γ или рецептора к этому цитокину [42]. Известно, что цитотоксические лимфоциты CD8+, осуществляя клиренс вирусных частиц, непосредственно участвуют в повреждении миокарда [32, 45]. Однако известна также способность лимфоцитов CD8+ контролировать латентную инфекцию вируса герпеса и сдерживать ее реактивацию, не разрушая клетки [33]. Одним из факторов противовирусной устойчивости нейронов является ИФН-γ, синтезируемый преимущественно Т-клетками CD8+. Этот цитокин может производиться Т-хелперами 1-го типа и натуральными киллерами CD16—CD56+[32, 45]. Предполагается, что ИНФ-γ может подавлять реактивацию вируса герпеса на стадиях до включения генов γ-2, экспрессия которых необходима для начала синтеза вирусной ДНК. Таким образом, подавляя активность вируса, Т-клетки CD8+ не проявляют свою потенциальную цитолитическую активность по отношению к нейронам, поэтому им отводится главная роль в механизмах сдерживания реактивации герпесвирусной инфекции [45]. Возможно, наличие лимфоцитов CD8+ в тканях миокарда при воспалении связано не только с их цитотоксической активностью по отношению к инфицированным клеткам, но и c обеспечением сдерживания вируса герпеса в латентном состоянии посредством ИНФ-γ, что особенно важно в тех случаях, когда вирус является слабым индуктором ИНФ-α и ИНФ-β. Не исключено, что именно дефицит ИФН в условиях иммуносупрессии при вирусной инфекции в миокарде способствует развитию инфильтрации миокарда лимфоцитами. На экспериментальных моделях хронического аутоиммунного миокардита, вызванного цитомегаловирусной инфекцией у мышей, показано, что применение ИНФ-β снижало количество цитотоксических лимфоцитов CD8+ в миокарде и купировало развитие заболевания. Авторы также заметили, что на начальных этапах воспаления наличие лимфоцитов CD8+ важно для реализации противовирусной активности, при хроническом же процессе, напротив, накопление лимфоцитарного инфильтрата в миокарде приводит к прогрессированию заболевания [46]. Таким образом, представления о возможной роли кардиотропных вирусов в развитии дилатации сердца систолической дисфункцией ЛЖ тесно связаны с иммуновоспалительными реакциями в миокарде больных. При этом знания о механизмах межклеточных взаимодействий иммунокомпетентных клеток с КМЦ в присутствии вирусного агента и ключевых участников цитокинового ряда, несомненно, помогут в раскрытии сущности патогенеза многих КМП, проявляющихся дилатацией камер сердца и снижением сократимости Л.Ж. По мнению Р. Libby [47], необходимо искать наиболее важное звено в механизмах воспаления для того, чтобы точечно воздействовать на проблему. Авторы заявляют об отсутствии конфликта интересов.
- Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, Moss AJ, Seidman CE, Young JB. American Heart Association; Councilon Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; Council on Epidemiology and Prevention. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006;113:1807-1816. https://doi.org/10.1161/CIRCULATIONAHA.106.174287
- Elliott P, Andersson B, Arbustini E, Bilinska Z, Cecchi F, Charron P, Dubourg O, Kuhl U, Maisch B, McKenna WJ, Monserrat L, Pankuweit S, Rapezzi C, Seferovic P, Tavazzi L, Keren A. Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur Heart J. 2008:29(2):270-276. https://doi.org/10.1093/eurheartj/ehm342
- Cooper LT. Myocarditis. N Engl J Med. 2009;360:1526-1538. https://doi.org/10.1056/NEJMra0800028
- Tatrai E, Bedi K, Kovalszky I, Hartyanszky I, Laszik A, Acsady G, Sotonyi P, Hubay M. No mutation but high mRNA expression of Coxsackie-Adenovirus Receptor was observed in both dilated and ischemic cardiomyopathy. Forensic Science International. 2011; 212(1-3):47-50. https://doi.org/10.1016/j.forsciint.2011.05.010
- Boudoulas KD, Borer JS, Boudoulas H. Etiology of Valvular Heart Disease in the 21st Century. Cardiology. 2013;126:139-152. https://doi.org/10.1159/00035422
- Kawai C, Matsumori A. Dilated cardiomyopathy update: infectious-immune theory revisited. Heart Fail Rev. 2013;18(6):703-714. https://doi.org/10.1007/s10741-013-9401-z
- Massilamany C, Huber SA, Cunningham MW, Reddy J. Relevance of molecular mimicry in the mediation of infectious myocarditis. J. Cardiovasc Transl Res. 2014;7(2):165-171. https://doi.org/10.1007/s12265-013-9519-3
- Carabello BA. Ischemic Mitral Regurgitation and Ventricular Remodeling. Journal of the American College of Cardiology. 2004;43(3):384-385. https://doi.org/10.1016/j.jacc.2003.11.009
- Chang S-A, Chang H-J, Sang IC, Chun EJ, Yoon YE, Kim H-K, Kim Y-J, Choi D-J, Sohn D-W, Helm RH, Lardo AC. Usefulness of Left Ventricular Dyssynchrony After Acute Myocardial Infarction, Assessed by a Tagging Magnetic Resonance Image Derived Metric, as a Determinant of Ventricular Remodeling. Am J Cardiol. 2009;104(1):19-23. https://doi.org/10.1016/j.amjcard.2009.02.042
- Gaasch WH, Meyer TE. Left ventricular response to mitral regurgitation: implications for management. Circulation. 2008;118(22): 2298-2303. https://doi.org/10.1161/CIRCULATIONAHA.107.755942
- Caforio AL, Marcolongo R, Jahns R, Fu M, Felix SB. Immune-mediated and autoimmune myocarditis: clinical presentation, diagnosis and management. Heart Fail Rev. 2013;18(6):715-732. https://doi.org/10.1007/s10741-012-9364-5
- Литасова Е.Е., Чернявский А.М., Мироненко С.П., Суслопаров М.А., Пак И.А., Слайковская Л.Е. Системный подход к оценке факторов риска у больных с сердечно-сосудистой патологией. Глава 3. Инфицированность ангиокардиальных структур в патогенезе атеросклероза и ишемической болезни сердца. ГП «Новосибирский полиграфкомбинат». Новосибирск 2002; 128-147.
- Митрофанова Л.Б., Кудайбергенова А.Г., Антонова И.В. Фибрилляция предсердий, амилоидоз, миокардит и вирусная инфекция. Артериальная гипертензия. 2009;15(2):203-208.
- Chimenti C, Andrea R, Maurizio P, Fiorella C, Romina V, Gaetano T, Matteo A R, Attilio M, Andrea F. Intramyocyte detection of Epstein-Barr virus genome by laser capture microdissection. Circulation. 2004;110:3534-3539. https://doi.org/10.1161/01.CIR.0000148823.08092.0E
- Dennert R, Crijns HJ, Heymans S. Acute viral myocarditis. European Heart J. 2008;29:2073-2082. https://doi.org/10.1093/eurheartj/ehn296
- Mangini S, Higuchi ML, Reis MM, Ikegami R, Kawakami J, Palomino S, Pomerantzeff PM, Fiorelli AI, Bacal F, Bocchi EA. Infectious agents in the myocardium of patients with dilated cardiomyopathy: idiopathic, chagasic, ischemic and other etiologies. Eur Heart J. 2013;34(1):2823.
- Greulich S, Schumm J, Perne A, Gruen S, Ong P, Klingel K, Kandolf R, Sechtem U, Mahrholdt H. Predictors of outcome in patients with Parvovirus B19 positive endomyocardial biopsy. Eur Heart J. 2013;34(1):3508.
- Gkouziouta A, Karavolias G, Xatzianastasiou S, Cokkinos PH, Katsianis A, Fekos J, Kourkoveli P, Degiannis J, Saroglou G, Adamopoulos S. Persistence of viral activity associated with inflammation in endomyocardial biopsy specimens of patients with left ventricular dysfunction predicts better unfavourable outcomes. Eur Heart J. 2013;34(1):3009.
- Kühl U, Lassner D, Wallaschek N, Gross UM, Krueger GRF, Seeberg B, Kaufer ВB, Escher F, Poller W, Schultheiss HP. Chromosomally integrated human herpesvirus in heart failure: prevalence and treatment. European Journal of Heart Failure. 2015;17:9-19. https://doi.org/10.1002/ejhf.194
- Никольский М.А., Голубцова В.С. Хромосомно-интегрированный вирус герпеса человека 6 типа. Инфекция и иммунитет. 2015;5(1):7-14. https://doi.org/10.15789/2220-7619-2015-1-7-14
- Koenig A, Sateriale A, Budd RC, Huber SA, Buskiewicz IA. The role of sex differences in autophagy in the heart during coxsackievirus B3 induced myocarditis. J Cardiovasc Transl Res. 2014;7(2):182-191. https://doi.org/10.1007/s12265-013-9525-5
- Yajima T, Knowlton KU. Viral Myocarditis From the Perspective of the Virus. Circulation. 2009;119(19):2615-2624. https://doi.org/10.1161/CIRCULATIONAHA.108.766022
- Yajima Т. Viral myocarditis: potential defense mechanisms within the cardiomyocyte against virus infection. Future Microbiol. 2011;6:551-566. https://doi.org/10.2217/fmb.11.40
- Esfandiarei M, McManus BM. Molecular biology and pathogenesis of viral myocarditis. Annu Rev Pathol. 2008;3:127-155. https://doi.org/10.1146/annurev.pathmechdis.3.121806.151534
- Mandal P, Berger SB, Pillay S, Moriwaki K, Huang C, Guo H, Lich JD, Finger J, Kasparcova V, Votta B, Ouellette M, King BW, Wisnoski D, Lakdawala AS, DeMartino MP, Casillas LN, Haile PA, Sehon CA, Marquis RW, Upton J, Daley-Bauer LP, Roback L, Ramia N, Dovey CM, Carette JE, Chan F, Bertin J, Gough PJ, Mocarski ES, Kaiser WJ. RIP3 induces apoptosis independent of pro-necrotic kinase activity. Mol Cell. 2014;56(4):481-495. https://doi.org/10.1016/j.molcel.2014.10.021
- Yu X, He S. The interplay between human herpes simplex virus infection and the apoptosis and necroptosis cell death pathways. Virology Journal. 2016;13:77. https://doi.org/10.1186/s12985-016-0528-0
- Федорова Н.Е., Соколова Т.М., Меджидова М.Г., Кущ А.А. Различная регуляция митохондриального апоптоза и экспрессии гена bcl-2 в покоящихся и делящихся фибробластах человека, зараженных цитомегаловирусом. Цитология. 2010;52(2): 168-176.
- Saito T, Asai K, Sato S, Hayashi M, Adachi A, Sasaki Y, Takano H, Mizuno K., Shimizu W. Autophagic vacuoles in cardiomyocytes of dilated cardiomyopathy with initially decompensated heart failure predict improved prognosis. Autophagy. 2016;12(3):579-587. https://doi.org/10.1080/15548627.2016.1145326
- Abdelaziz DHA, Khalil H, Cormet-Boyaka E, Amer AO. The cooperation between the autophagy machinery and the inflammasome to implement an appropriate innate immune response: do they regulate each other? Immunol Rev. 2015;265(1):194-204. https://doi.org/10.1111/imr.12288
- Кожевников М.Л., Казаков В.А., Стасев А.Н., Суходоло И.В., Шипулин В.М., Миллер А.А. Ультраструктурные особенности кардиомиоцитов ушка правого предсердия при хронической недостаточности кровообращения у больных с приобретенными пороками сердца. Вопросы морфологии XXI века. Выпуск 1. Сборник научных трудов, посвященный 100-летию кафедры медицинской биологии СПбГМА им. И.И. Мечникова. СПб.: СПбГМА им. И.И. Мечникова, изд. ДЕАН. 2008;151-158.
- Филдс Б., Найп Д., Ченок Р., Ройзман Б., Мельник Дж., Шоуп Р. Вирусология: В 3-х т. Т.3: Пер. с англ. М.: Мир. 1989;186-227.
- Nash AA. T cells and the regulation of Herpes simplex virus latency and reactivation. J Exp Med. 2000;191(9):1455-1458.
- Серебряная Н.Б., Егорова В.Н. Новые подходы к терапии герпесвирусной инфекции: пособие для врачей. Санкт-Петербург: Новая альтернативная полиграфия. 2007;28.
- Ризун Л.И., Воронина Т.С., Домбровская А.В., Фролова Ю.В., Благова О.В., Ван Е.Ю., Ховрин В.В., Морозова М.М., Куприянова А.Г., Зайденов В.А., Донников А.Е., Раскин В.В., Дземешкевич А.С., Маликова М.С., Дземешкевич С.Л. Некоронарогенная дилатационная кардиомиопатия после операции обратного ремоделирования сердца. Кардиология. 2013;12:52-57.
- Благова О.В., Недоступ А.В. Синдром ДКМП: нозологическая диагностика как основа дифференцированного диагноза. Клиническая и экспериментальная хирургия. Журнал им. акад. Б.В. Петровского. 2014;1:29-41.
- Антонова Т.В., Жевнерова Н.С. Вирусные миокардиты: этиология и патогенез, проблемы диагностики. Журнал инфектологии. 2013;5(2):13-21.
- Li M, Su Y, Yu Y, Wang X, Zou Y, Ge J, Chen R. Dual roles of calpain in facilitating Coxsackievirus B3 replication and prompting inflammation in acute myocarditis. Int J Cardiol. 2016;221:1123-1131. https://doi.org/10.1016/j.ijcard.2016.07.121
- Cao Y, Xu W, Xiong S. Adoptive transfer of regulatory T cells protects against coxsackievirus B3-induced cardiac fibrosis. PLOS ONE. 2013;8(9):e74955. https://doi.org/10.1371/journal.pone.0074955
- Ghosh AK, Quaggin SE, Vaughan DE. Molecular basis of organ fibrosis: potential therapeutic approaches. Exp Biol Med. 2013;238(5):461-481. https://doi.org/10.1177/1535370213489441
- Wei L. Immunological aspect of cardiac remodeling: T lymphocyte subsets in inflammation-mediated cardiac fibrosis. Exp Mol Pathol. 2011;90(1):74-78. https://doi.org/10.1016/j.yexmp.2010.10.004
- Yu M, Wen S, Wang M, Liang W, Li HH, Long Q, Guo HP, Liao YH, Yuan J. TNF-α-secreting B cells contribute to myocardial fibrosis in dilated cardiomyopathy. J Clin Immunol. 2013;33(5):1002-1008. https://doi.org/10.1007/s10875-013-9889-y
- Палеев Н.Р., Палеев Ф.Н., Островский Е.И., Карандашов В.И., Санина Н.П., Хишова Н.Н., Москалец О.В., Линник А.П., Макарков А.Н. Эволюция представлений о роли иммунной системы в патогенезе воспалительных поражений миокарда: Th-17 опосредованные механизмы иммунорегуляции. Кубанский научный медицинский вестник. 2014;1(143): 191-195.
- Chen D-Y, Chen Y-M, Tzang B-S, Lan JL, Hsu T-C. Th27-related cytokines in systemic lupus erythematosus patients with dilated cardiomyopathies: a possible linkage to parvovirus B19 infection. PLOS ONE. 2014;9(12):e113889. https://doi.org/10.1371/journal.pone.0113889
- Yuan J, Cao AL, Yu M, Lin QW, Yu X, Zhang JH, Wang M, Guo HP, Liao YH. Th27 cells facilitate the humoral immune response in patients with acute viral myocarditis. J Clin Immunol. 2010;30:226-234. https://doi.org/10.1007/s10875-009-9355-z
- Suvas S, Azkur AK, Rouse BT. Qa-1b and CD94-NKG2a interaction regulate cytolitic activity of Herpes simplex virus-specific memory CD8+ T cells in the latency infected trigeminal ganglia. J Imunol. 2006;176:1703-1711. https://doi.org/10.4049/jimmunol.176.3.1703
- Bartlett EJ, Lenzo JC, Sivamoorthy S, Mansfield JP, Cull VS, James CM. Type I IFN-β gene therapy suppresses cardiac CD8 T-cell infiltration during autoimmune myocarditis. Immunology and Cell Biology. 2004;82:119-126. https://doi.org/10.1046/j.0818-9641.2004.01234.x
- Libby P. Fanning the flames: Inflammation in Cardiovascular Diseases Cardiovascular Research. 2015;107:307-309. https://doi.org/10.1093/cvr/cvv188
Views
Abstract — 169
PDF (Russian) — 23
Cited-By
Article Metrics
PlumX
Dimensions
Refbacks
- There are currently no refbacks.
Заболевания рук, стопы и рта
Что такое болезнь рук, ящура и рта?
Заболевания рук, ящура и рта (HFMD) — распространенное заболевание младенцев и детей.
HFMD характеризуется:
- Слабая лихорадка
- Плохой аппетит
- Недомогание («тошнота»)
- Больное горло
- Кожная сыпь с волдырями
Через день-два после начала жара во рту появляются язвочки:
- Они начинаются с маленьких красных пятен, которые покрываются волдырями, а затем часто становятся язвами.
- Обычно они располагаются на языке, деснах и внутренней стороне щек.
Кожная сыпь появляется в течение одного-двух дней с плоскими или приподнятыми красными пятнами, некоторые с волдырями.
- Сыпь не чешется и обычно располагается на ладонях рук и подошвах ног.
- Также он может появиться на ягодицах.
У человека с HFMD может быть только сыпь или язвы во рту.
HFMD — это то же самое, что ящур?
Нет. HFMD — это болезнь, отличная от ящура крупного рогатого скота, овец и свиней. Хотя названия схожи, эти две болезни никак не связаны и вызываются разными вирусами.
HFMD серьезно?
Обычно нет. Почти все люди с HFMD выздоравливают без лечения. HFMD обычно проходит через 10-XNUMX дней. Обычных осложнений нет.
Редко это заболевание может быть связано с асептическим или вирусным менингитом, при котором у человека есть:
- Лихорадка
- Головная боль
- Жесткая шея или боль в спине
- Может потребоваться госпитализация на несколько дней
Что вызывает HFMD?
Несколько разных вирусов вызывают HFMD.
- Наиболее частая причина — вирус Коксаки A16.
- Другие причины:
- Другие штаммы вируса Коксаки А
- Энтеровирус 71
Вирусы Коксаки являются членами группы вирусов, называемых энтеровирусами.
В группу энтеровирусов, вызывающих заболевания рук, ног и рта, входят:
- полиовирусы
- Вирусы Коксаки
- Эховирусы
Это заразно?
- Да, HFMD умеренно заразен.
- Инфекция передается от человека к человеку при прямом контакте с выделениями из носа и горла или калом инфицированных людей.
- Человек наиболее заразен в первую неделю болезни.
- HFMD не передается домашним или другим животным или от них.
Как скоро кто-то заболеет после заражения?
Обычный период от заражения до появления симптомов составляет от трех до шести дней. Лихорадка часто является первым признаком HFMD.
Кто подвержен риску HFMD?
HFMD встречается в основном у детей в возрасте до 10 лет, но взрослые также могут подвергаться риску. Заразению подвержены все.
Инфекция приводит к появлению иммунитета к конкретному вирусу, но второй эпизод может возникнуть после заражения другим членом группы энтеровирусов.
Когда и где возникает HFMD?
Отдельные случаи и вспышки HFMD происходят во всем мире, чаще летом и в начале осени.
Как диагностируется HFMD?
HFMD — одна из многих инфекций, которые приводят к язвам во рту.
Другой частой причиной является оральная герпесвирусная инфекция, которая вызывает воспаление ротовой полости и десен (иногда называемое стоматитом).
Обычно врач может различить HFMD и другие причины язв во рту в зависимости от возраста пациента, характера симптомов, о которых сообщает пациент или его родители, а также появления сыпи и язв при осмотре.
Мазок из зева или образец стула можно отправить в лабораторию, чтобы определить, какой энтеровирус вызвал заболевание. Поскольку для получения окончательного ответа часто требуется от двух до четырех недель, врач обычно не назначает эти тесты.
Как лечится HFMD? Можно ли это предотвратить?
Специального лечения этой инфекции не существует. Симптоматическое лечение применяется для облегчения лихорадки, болей или боли из-за язв во рту.
Профилактические меры включают:
- Частое мытье рук, особенно после смены подгузников
- Обеззараживание загрязненных поверхностей бытовыми чистящими средствами
- Стирка загрязненных предметов одежды
Дети часто исключаются из программ по уходу за детьми, школ или других групп в течение первых нескольких дней болезни. Эти меры могут снизить распространение инфекции, но не остановят ее полностью.
Где я могу получить больше информации?
Обратитесь к врачу или в отдел эпидемиологии Южного Невады по телефону (702) 759-1300.
Вышеупомянутая информация предоставлена Отделом вирусных и риккетсиозных заболеваний, Национальным центром инфекционных заболеваний, Центрами по контролю и профилактике заболеваний.
Рекомендации по подходу, лабораторные исследования, исследования изображений
Лим Б.К., Цзюй Э.С., Лао Д.Х., Юн Ш., Ли Й.Дж., Ким Д.К. и др. Разработка системы диагностики энтеровирусов для диагностики вирусного миокардита у человека. Микробиол Иммунол . 2013 Апрель 57 (4): 281-7. [Медлайн].
Muehlenbachs A, Bhatnagar J, Zaki SR. Тканевый тропизм, патология и патогенез энтеровирусной инфекции. Дж. Патол . 2014 11 сентября [Medline].
Kadambari S, Bukasa A, Okike IO, Pebody R, Brown D, Gallimore C.Энтеровирусные инфекции в Англии и Уэльсе, 2000-2011 гг .: влияние расширенной молекулярной диагностики. Clin Microbiol Infect . 2014 г. 4 июля [Medline].
Хецуриани Н., Ламонте А., Оберсте М.С. и др. Неонатальные энтеровирусные инфекции, зарегистрированные в национальной системе эпиднадзора за энтеровирусами в Соединенных Штатах, 1983–2003 гг. Pediatr Infect Dis J . 2006 25 октября (10): 889-93. [Медлайн].
Стюарт К.Л., Чу Е.Ю., Introcaso CE, Шаффер А., Джеймс В.Д.Заболевание рук и ног, вызванное вирусом Коксаки А6. JAMA Dermatol . 2013 декабрь 149 (12): 1419-21. [Медлайн].
Кинг Р.Л., Лорч С.А., Коэн Д.М. и др. Регулярное тестирование спинномозговой жидкости энтеровирусной полимеразной цепной реакцией сокращает количество госпитализаций и использование антибиотиков у младенцев в возрасте 90 дней и младше. Педиатрия . 2007 Сентябрь 120 (3): 489-96. [Медлайн].
Шифф GM, Шервуд младший. Клиническая активность плеконарила при экспериментально индуцированной респираторной инфекции, вызванной вирусом Коксаки А21. J Заразить Dis . 2000 Январь 181 (1): 20-6. [Медлайн].
Брунетти Л., ДеСантис ER. Лечение вирусного миокардита, вызванного вирусом Коксаки B. Am J Health Syst Pharm . 2008 15 января. 65 (2): 132-7. [Медлайн].
Юэ-Чун Л., ЛиШа Г., Цзян-Хуа Р., Пэн-Линь Ю., Цзя-Фэн Л., Цзи-Фей Т. и др. Защитные эффекты карведилола на мышиной модели с вирусным миокардитом, индуцированным вирусом Коксаки В3. J Cardiovas Pharmacol .Янв / 2008. 51: 92-98. [Медлайн].
Shi L, Xiong H, He J, et al. Противовирусная активность арбидола против вируса гриппа A, респираторно-синцитиального вируса, риновируса, вируса Коксаки и аденовируса in vitro и in vivo. Arch Virol . 2007. 152 (8): 1447-55. [Медлайн].
Ang LW, Koh BK, Chan KP, Chua LT, James L, Goh KT. Эпидемиология и борьба с болезнями рук, ящура и рта в Сингапуре, 2001-2007 гг. Ann Acad Med Singapore .2009 Февраль 38 (2): 106-12. [Медлайн].
Bergman I, Painter MJ, Wald ER, et al. Исход у детей с энтеровирусным менингитом первого года жизни. J Педиатр . 1987 май. 110 (5): 705-9. [Медлайн].
Берлин Л.Е., Рорабо М.Л., Хелдрих Ф. и др. Асептический менингит у детей младше 2 лет: диагностика и этиология. J Заразить Dis . 1993 Октябрь 168 (4): 888-92. [Медлайн].
Cheung CT, Deisher TA, Luo H, et al.Нейтрализующее лечение анти-4-1BBL улучшает сердечную функцию при вирусном миокардите. Лаборатория Инвест . 2007 Июль 87 (7): 651-61. [Медлайн].
Даган Р., Жениста Ж.А., Менегус М.А. Связь клинических проявлений, лабораторных данных и серотипов вируса с наличием менингита у госпитализированных младенцев с энтеровирусной инфекцией. J Педиатр . 1988 декабрь 113 (6): 975-8. [Медлайн].
Даган Р., Менегус Массачусетс. Комбинация четырех типов клеток для быстрого обнаружения энтеровирусов в клинических образцах. J Med Virol . 1986 июля 19 (3): 219-28. [Медлайн].
Дульбекко Р., Гинзберг Х. Вирусология . 2-е изд. 1988. 207-209.
Эпиднадзор за энтеровирусами — США, 2002-2004 гг. MMWR Morb Mortal Wkly Rep . 2006 17 февраля. 55 (6): 153-6. [Медлайн].
Джайдан Х., Хобер Д. Роль вируса Коксаки B4 в патогенезе диабета 1 типа. Метаб. Диабета . 2008, декабрь 34 (6, часть 1): 537-48.[Медлайн].
Джениста Дж. А., Пауэлл КР, Менегус Массачусетс. Эпидемиология неонатальной энтеровирусной инфекции. J Педиатр . 1984 Май. 104 (5): 685-90. [Медлайн].
Левинсон В., Явец Э. Медицинская микробиология и иммунология: экспертиза и проверка совета . 6-е изд. Нью-Йорк, штат Нью-Йорк: McGraw Hill Text; 2000. 238-239.
Мао Ц., Ван И, Яо Х, Бянь Л., Ву Х, Сюй М. и др. Вирус Коксаки A16: эпидемиология, диагностика и вакцина. Hum Vaccin Immunother . 2014 10 февраля (2): 360-7. [Медлайн].
Modlin JF. Вирусы Коксаки, эховирусы, новые энтеровирусы и пареховирусы. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . 7-е изд. Филадельфия, Пенсильвания: Черчилль-Ливингстон; 2009. 2353-2365.
Мур М. Центры по контролю за заболеваниями. Энтеровирусное заболевание в США, 1970–1979 гг. J Заразить Dis .1982 Июль 146 (1): 103-8. [Медлайн].
Моренс Д.М., Палланш Массачусетс. Эпидемиология. Инфекции, вызванные энтеровирусами человека . 1995. 1:
.
Морган Н.Г., Ричардсон С.Дж. Энтеровирусы как возбудители диабета 1 типа: незавершенные дела или безнадежное дело ?. Trends Endocrinol Metab . 2014 28 августа. [Medline].
Палланш М.А., Андерсон Л.Дж. Вирус Коксаки, эховирус и другие энтеровирусы. Горбач С.Л., изд. Инфекционные болезни .2-е изд. Филадельфия, Пенсильвания: WB Saunders Co; 1998. 2164-2170.
Piqueur MA, Verstrepen WA, Bruynseels P, Mertens AH. Улучшение анализа RT-PCR в реальном времени для обнаружения РНК энтеровируса. Вирол J . 2009 г. 7 июля, 6:95. [Медлайн]. [Полный текст].
Рантала Х., Ухари М. Возникновение детского энцефалита: популяционное исследование. Pediatr Infect Dis J . 1989 июл.8 (7): 426-30. [Медлайн].
Richer MJ, Horwitz MS.Инфекция, вызванная вирусом Коксаки, как фактор окружающей среды в этиологии диабета 1 типа. Аутоиммунная Ред. . 2009 июн.8 (7): 611-5. [Медлайн].
Рорабо М.Л., Берлин Л.Е., Хелдрих Ф. и др. Асептический менингит у детей младше 2 лет: острые заболевания и неврологические осложнения. Педиатрия . 1993 августа 92 (2): 206-11. [Медлайн].
Rotbart HA. Терапия Плеконарилом потенциально опасных для жизни энтеровирусных инфекций. 36-е ежегодное собрание Американского общества инфекционистов . 1998.
Rotbart HA. Плеконарил для лечения энтеровирусных и риновирусных инфекций. Инфекция Мед . 2000. 17: 488.
Rotbart HA. Лечение пикорнавирусных инфекций. Антивирусная защита . 2002 Февраль 53 (2): 83-98. [Медлайн].
Rotbart HA, Ahmed A, Hickey S, et al. Диагностика энтеровирусной инфекции методом полимеразной цепной реакции на нескольких типах образцов. Pediatr Infect Dis J . 1997 г., 16 (4): 409-11. [Медлайн].
Rotbart HA, McCracken GH Jr, Whitley RJ и др. Клиническое значение энтеровирусов при тяжелых летних фебрильных заболеваниях детей. Pediatr Infect Dis J . 1999, 18 октября (10): 869-74. [Медлайн].
Rotbart HA, Webster AD. Лечение потенциально опасных для жизни энтеровирусных инфекций плеконарилом. Clin Infect Dis . 2001 15 января.32 (2): 228-35. [Медлайн].
Заутер П., Хобер Д. Механизмы и результаты антителозависимого усиления вирусных инфекций и роль в патогенезе заболеваний, вызванных вирусом Коксаки B. Микробы заражают . 2009 г., 11 (4): 443-51. [Медлайн].
Сойер М.Х., Голландия Д., Эйнтаблиан Н. и др. Диагностика энтеровирусной инфекции центральной нервной системы с помощью полимеразной цепной реакции во время крупной вспышки болезни. Pediatr Infect Dis J .1994 13 марта (3): 177-82. [Медлайн].
Тебрюгге М., Кертис Н. Энтеровирусные инфекции у новорожденных. Semin Fetal Neonatal Med . 2009 14 августа (4): 222-7. [Медлайн].
Ворошилова М.К., Чумаков М.П. Полиомиелитоподобные свойства вирусов группы AB-IV Coxsackie A7. Прог Мед Вирол . 1959. 2: 106.
Веллер Т.Х., Эндерс Дж. Ф., Бэкингем М. и др. Этиология эпидемической плевродинии: исследование двух вирусов, выделенных из типичной вспышки. Дж Иммунол . 1950 Сентябрь 65 (3): 337-46. [Медлайн].
Йунг В.С., Роулинсон В.Д., Крейг М.Э. Энтеровирусная инфекция и сахарный диабет 1 типа: систематический обзор и метаанализ наблюдательных молекулярных исследований. BMJ . 3 февраля 2011. 342: 1-9. [Медлайн]. [Полный текст].
Teo FM, Chu JJ. Диагностика энтеровирусов человека, вызывающих заболевания рук, ягодиц и рта. Expert Rev Anti Infect Ther . 2016. 14 (5): 443-5.[Медлайн].
Луго Д., Крогстад П. Энтеровирусы в начале 21 века: новые проявления и проблемы. Curr Opin Pediatr . 2016 28 февраля (1): 107-13. [Медлайн].
Таппени М. Вирусный менингит и энцефалит. Crit Care Nurs Clin North Am . 2013 Сентябрь 25 (3): 363-80. [Медлайн].
Борсанёва М., Кубасчикова Л., Сармирова С., Вари С. Г., Бопегамейдж С. Оценка метода взятия мазков без транспортной среды для ПЦР-диагностики инфекций, вызванных вирусом Коксаки. Дж. Вироловые методы . 2018 Апрель 254: 18-20. [Медлайн].
Эспозито С., Принципи Н. Заболевания рук, ящура: современные знания о клинических проявлениях, эпидемиологии, этиологии и профилактике. евро J Clin Microbiol Infect Dis . 2018 марта 37 (3): 391-398. [Медлайн].
Кокс Б., Левент Ф. Болезни рук, ног и рта. JAMA . 2018 декабря 18.320 (23): 2492. [Медлайн].
Garmaroudi FS, Marchant D, Hendry R, Luo H, Yang D, Ye X и др.Репликация и патогенез вируса Коксаки В3. Микробиол будущего . 2015. 10 (4): 629-53. [Медлайн].
Харвала Х., Броберг Э., Беншоп К. и др. Рекомендации по диагностике и характеристике энтеровирусов в Европе и за ее пределами. Дж. Клин Вирол . 2018 Апрель 101: 11-17. [Медлайн].
Шабани А., Макванди М., Самарбафзаде А., Теймури А., Расти М., Карами С. и др. Инфекция эховирусом 30 и вирусом Коксаки A9 среди новорожденных с сепсисом в Иране. Иран Дж. Микробиол . 2018 10 августа (4): 258-265. [Медлайн].
Ван М., Рен Кью, Чжан З., Чжан Л., Карр М.Дж., Ли Дж. И др. Быстрое определение генотипов энтеровирусов ящура, кисты и рта с помощью мультиплексной ПЦР. Дж. Вироловые методы . 2018 Август 258: 7-12. [Медлайн].
CDC. Неполиомиелитный энтеровирус: вспышки и эпиднадзор. CDC. Доступно по адресу https://www.cdc.gov/non-polio-enterovirus/outbreaks-surveillance.html. 14 ноября 2018 г .; Доступ: 6 декабря 2019 г.
CDC. Неполиомиелитный энтеровирус: для медицинских работников. CDC. Доступно по адресу https://www.cdc.gov/non-polio-enterovirus/hcp.html. 14 ноября 2018 г .; Дата обращения: 6 декабря 2019 г.
CDC. Острый вялый миелит: исследование AFM. CDC. Доступно по адресу https://www.cdc.gov/acute-flaccid-myelitis/afm-investigation.html. 4 ноября 2019 г .; Дата обращения: 6 декабря 2019 г.
Эпидемиологическое исследование вируса Коксаки A6, раскрывающее характер эпидемий заболеваний рук, ящура и рта в Гуандуне, Китай
Yi, L., Лу, Дж., Кунг, Х. Ф. и Хе, М. Л. Вирусология и разработки по борьбе с энтеровирусом человека 71. Crit. Ред. Microbiol., 10.3109 / 1040841X.2011.580723 (2011).
Fujimoto, T. et al. Вспышка заболевания центральной нервной системы, связанного с болезнью рук, ящура, в Японии летом 2000 года: обнаружение и молекулярная эпидемиология энтеровируса 71. Microbiol. Иммунол. 46, 621–627 (2002).
CAS
Статья
Google Scholar
Чан, Л.G. et al. Смерть детей во время вспышки болезни рук, ящура в Сараваке, Малайзия: клинические и патологические характеристики болезни. Для исследовательской группы вспышек. Clin. Заразить. Дис. 31, 678–683, 10.1086 / 314032 (2000).
CAS
Статья
PubMed
Google Scholar
Ho, M. et al. Эпидемия энтеровирусной 71 инфекции на Тайване. Тайваньская рабочая группа по эпидемии энтеровируса. N. Engl. J. Med. 341, 929–935, 10.1056 / NEJM1993411301 (1999).
CAS
Статья
PubMed
Google Scholar
Ang, L. W. et al. Эпидемиология и борьба с ящуром рук в Сингапуре, 2001-2007 гг. Аня. Акад. Med. Сингапур 38, 106–112 (2009).
PubMed
Google Scholar
Chatproedprai, S. et al. Клиническая и молекулярная характеристика ящура и ящура в Таиланде, 2008-2009 гг.Jpn. J. Infect. Дис. 63, 229–233 (2010).
PubMed
Google Scholar
Blomqvist, S. et al. Совместная циркуляция вирусов Коксаки A6 и A10 во время вспышки болезней рук, ящура в Финляндии. J. Clin. Virol. 48, 49–54, 10.1016 / j.jcv.2010.02.002 (2010).
CAS
Статья
PubMed
Google Scholar
(CDC), C. f. D. C. a. P. Примечания с мест: тяжелая болезнь рук, ящура, связанная с вирусом Коксаки A6 — Алабама, Коннектикут, Калифорния и Невада, ноябрь 2011 г. — февраль 2012 г.MMWR Morb. Mortal Wkly Rep. 61, 213–214 (2012).
Liu, M. Y. et al. Характеристика вспышки болезней рук, ящура и рта в Наньчане, Китай, в 2010 г. PLoS One 6, e25287, 10.1371 / journal.pone.0025287 (2011).
CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
PubMed Central
Google Scholar
Mao, L. X. et al. Эпидемиология рук, ящура и характеристика генотипа энтеровируса 71 в Цзянсу, Китай.J. Clin. Virol. 49, 100–104, 10.1016 / j.jcv.2010.07.009 (2010).
Артикул
PubMed
Google Scholar
Wang, Y. et al. Болезни рук, ящура и рта в Китае: закономерности распространения и передаваемость. Эпидемиология 22, 781–792, 10.1097 / EDE.0b013e318231d67a (2011).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Хамагучи, Т.и другие. Острый энцефалит, вызванный внутрисемейной передачей энтеровируса 71 у взрослых. Emerg. Заразить. Дис. 14, 828–830 (2008).
Артикул
Google Scholar
AbuBakar, S. et al. Идентификация изолята энтеровируса 71 в результате вспышки болезни рук, ящура (HFMD) со смертельным исходом от энцефаломиелита в Малайзии. Virus Res. 61, 1–9, 10.1016 / S0168-1702 (99) 00019-2 (1999).
CAS
Статья
PubMed
Google Scholar
Чжу, Ф.C. et al. Эффективность, безопасность и иммунология вакцины с инактивированным квасцами с адъювантом энтеровируса 71 у детей в Китае: многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3. Ланцет 381, 2024–2032, 10.1016 / S0140-6736 (13) 61049-1 (2013).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Zhu, F. et al. Эффективность, безопасность и иммуногенность вакцины против энтеровируса 71 в Китае. N. Engl.J. Med. 370, 818–828, 10.1056 / NEJMoa1304923 (2014).
CAS
Статья
PubMed
Google Scholar
Cabrerizo, M. et al. Молекулярная эпидемиология энтеровируса 71, вируса Коксаки A16 и A6, связанного с болезнью рук, ящура и рта в Испании. Clin. Microbiol. Infect., 10.1111 / 1469-0691.12361 (2013).
Wu, Y. et al. Самая крупная вспышка руки; ящур в Сингапуре в 2008 г .: роль штаммов энтеровируса 71 и вируса Коксаки А.Int. J. Infect. Дис. 14, e1076–1081, 10.1016 / j.ijid.2010.07.006 (2010).
Артикул
PubMed
Google Scholar
Wei, S.H. et al. Вспышка заболевания рук, ящура, вызванного вирусом Коксаки A6, связанного с онихомадезом, на Тайване, 2010 г. BMC Infect. Дис. 11, 346, 10.1186 / 1471-2334-11-346 (2011).
Артикул
PubMed
PubMed Central
Google Scholar
Фудзимото, Т.и другие. Заболевания рук, ящура, вызываемые вирусом Коксаки A6, Япония, 2011. Emerg. Заразить. Дис. 18, 337–339, 10.3201 / eid1802.111147 (2012).
Артикул
PubMed
PubMed Central
Google Scholar
Гопалкришна В., Патил П. Р., Патил Г. П. и Читамбар С. Д. Циркуляция нескольких серотипов энтеровирусов, вызывающих заболевания рук, ящура и рта в Индии. J. Med. Microbiol. 61, 420–425, 10.1099 / jmm.0.036400-0 (2012).
CAS
Статья
PubMed
Google Scholar
Xing, W. et al. Заболевания рук, ящура и рта в Китае, 2008–2012 гг .: эпидемиологическое исследование. Lancet Infect. Дис. 14, 308–318, 10.1016 / S1473-3099 (13) 70342-6 (2014).
Артикул
PubMed
PubMed Central
Google Scholar
Lu, J. et al. Заболевания рук, ящура в Гуандуне, Китай, в 2013 г .: новые тенденции в продолжающейся эпидемии.Clin. Microbiol. Заразить. 20, O442–445, 10.1111 / 1469-0691.12468 (2014).
CAS
Статья
PubMed
Google Scholar
Han, J. F. et al. Вспышка болезни рук, ящура, вызванной вирусом Коксаки A6, Китай, 2013 г. J. Infect. 69, 303–305, 10.1016 / j.jinf.2014.03.015 (2014).
Артикул
PubMed
Google Scholar
Hongyan, G. et al. Заболевания рук, стопы и рта, вызванные вирусом Коксаки A6, Пекин, 2013 г.Педиатр Инфекция. Дис. J., 10.1097 / INF.0000000000000467 (2014).
Zhang, J. et al. Характеристика заболеваний рук, ящура и рта в Китае в период с 2008 по 2009 гг. Biomed. Environ. Sci. 24, 214–221, 10.3967 / 0895-3988.2011.03.002 (2011).
Артикул
PubMed
Google Scholar
Сан, Л. М. и др. Эпидемия энтеровируса 71 в китайской провинции Гуандун, 2008 г .: эпидемиологические, клинические и вирогенные проявления.Jpn. J. Infect. Дис. 64, 13–18 (2011).
PubMed
Google Scholar
Chen, Y. J. et al. Сравнительный геномный анализ штаммов вируса Коксаки А6 различных клинических форм болезни. PLoS One 7, e52432, 10.1371 / journal.pone.0052432 (2013).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google Scholar
Mirand, A. et al. Вспышка болезни рук, ящура / герпангины, связанной с инфекциями вируса Коксаки A6 и A10, в 2010 г., Франция: крупное общегородское проспективное обсервационное исследование.Clin. Microbiol. Заразить. 18, E110–118, 10.1111 / j.1469-0691.2012.03789.x (2012).
CAS
Статья
PubMed
Google Scholar
Osterback, R. et al. Последовательность генома вируса Коксаки A6, выделенного во время вспышки заболевания рук, ног и рта в Финляндии в 2008 году. Genome Announc 2, 10.1128 / genomeA.01004-14 (2014).
Osterback, R. et al. Вирус Коксаки А6 и болезнь рук, ящура, Финляндия.Emerg. Заразить. Дис. 15, 1485–1488, 10.3201 / eid1509.0
(2009).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Брачо, М. А., Гонсалес-Канделас, Ф., Валеро, А., Кордова, Дж. И Салазар, А. Сопутствующие инфекции энтеровируса и онихомадез после болезней рук, ящура, Испания, 2008. Emerg. Заразить. Дис. 17, 2223–2231, 10.3201 / eid1712.110395 (2011).
Артикул
PubMed
PubMed Central
Google Scholar
Пуэнпа, Дж.и другие. Заболевание рук, ящура, вызываемое вирусом Коксаки A6, Таиланд, 2012 г. Emerg. Заразить. Дис. 19, 641–643, 10.3201 / eid1904.121666 (2013).
Артикул
PubMed
PubMed Central
Google Scholar
Yang, F. et al. Тяжелая болезнь рук, ящура и вирус Коксаки a6-shenzhen, китай. Clin. Заразить. Дис. 59, 1504–1505, 10.1093 / cid / ciu624 (2014).
CAS
Статья
PubMed
Google Scholar
Стюарт, К.L., Chu, E.Y., Introcaso, C.E., Schaffer, A. & James, W.D. Coxsackievirus A6-индуцированная болезнь рук и ног. JAMA Dermatol 149, 1419–1421, 10.1001 / jamadermatol.2013.6777 (2013).
Артикул
PubMed
Google Scholar
Ло, С. Х. и др. Клинические и эпидемиологические особенности инфекции Coxsackievirus A6 у детей на севере Тайваня в период с 2004 по 2009 год. J Microbiol Immunol. Заразить. 44, 252–257, 10.1016 / j.jmii.2011.01.031 (2011).
CAS
Статья
PubMed
Google Scholar
Chung, W. H. et al. Клинико-патологический анализ нового варианта вируса Коксаки a6 вызывал широко распространенные кожно-слизистые буллезные реакции, имитирующие тяжелые кожные побочные реакции. J. Infect. Дис. 208, 1968–1978, 10.1093 / infdis / jit383 (2013).
CAS
Статья
PubMed
Google Scholar
Ди, Б.и другие. Циркуляция вируса Коксаки А6 при болезни рук и ног в Гуанчжоу, 2010-2012 гг. Virol. J. 11, 157, 10.1186 / 1743-422X-11-157 (2014).
Артикул
PubMed
PubMed Central
Google Scholar
Lu, Q. B. et al. Циркуляция вируса Коксаки A10 и A6 при болезни рук и полости рта в Китае, 2009-2011 гг. PLoS One 7, e52073, 10.1371 / journal.pone.0052073 (2012).
CAS
ОБЪЯВЛЕНИЯ
Статья
PubMed
PubMed Central
Google Scholar
Ли, Дж.L. et al. Эпидемические характеристики болезней рук, ящура и рта на юге Китая, 2013 г .: вирус Коксаки А6 стал преобладающим возбудителем. J. Infect. 69, 299–303, 10.1016 / j.jinf.2014.04.001 (2014).
Артикул
PubMed
Google Scholar
He, Y.Q. et al. Возникновение, циркуляция и пространственно-временной филогенетический анализ инфекций рук, ящура, ассоциированных с вирусом Коксаки A6 и вирусом Коксаки A10, с 2008 по 2012 год в Шэньчжэне, Китай.J. Clin. Microbiol., 10.1128 / JCM.01231-13 (2013).
Hosoya, M. et al. Генетическое разнообразие вируса Коксаки А16, связанное с эпидемиями болезней рук, ящура и рта в Японии с 1983 по 2003 гг. J. Clin. Microbiol. 45, 112–120, 10.1128 / JCM.00718-06 (2007).
CAS
Статья
PubMed
Google Scholar
Chang, L. Y. et al. Сравнение клинических заболеваний энтеровируса 71 и вируса Коксаки A16 во время тайваньской эпидемии энтеровируса, 1998 г.Педиатр. Заразить. Дис. J. 18, 1092–1096 (1999).
CAS
Статья
Google Scholar
Tu, P. V. et al. Эпидемиологическое и вирусологическое исследование болезней рук, ящура и рта, Южный Вьетнам, 2005 г. Emerg. Заразить. Дис. 13, 1733–1741, 10.3201 / eid1311.070632 (2007).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чоу, А.H. et al. Иммунологическая оценка и сравнение различных вакцин-кандидатов EV71. Clin. Dev. Иммунол. 2012, 831282, 10.1155 / 2012/831282 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
De, W. et al. Крупная вспышка болезни рук, ящура, вызванной EV71 и CAV16, в Гуандуне, Китай, 2009 г. Arch. Virol. 156, 945–953, 10.1007 / s00705-011-0929-8 (2011).
CAS
Статья
PubMed
Google Scholar
Холл, Т.A. BioEdit: удобный редактор выравнивания биологических последовательностей и программа анализа для Windows 95/98 / NT. Nucleic Acids Symp Series, 4 (1999).
Тамура, К., Стечер, Г., Петерсон, Д., Филипски, А., Кумар, С. MEGA6: молекулярно-эволюционный генетический анализ, версия 6.0. Мол. Биол. Evol. 30, 2725–2729, 10.1093 / molbev / mst197 (2013).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Болезнь кисти, стопы и рта, вызванная вирусом Коксаки А6 | Дерматология | JAMA дерматология
Важность
Болезнь «рука-ступня» (HFMD) — это острое, самоизлечивающееся, очень заразное вирусное заболевание, которое обычно поражает детей младше 5 лет.Чаще всего он вызывается энтеровирусом 71 или вирусом Коксаки А16 и приводит к бессимптомной инфекции или легкой форме заболевания. Иммунокомпетентные взрослые страдают редко. В последнее время появляется все больше сообщений о более тяжелой форме HFMD, связанной с лихорадкой, болями в суставах и широко распространенными болезненными высыпаниями. Некоторым из этих пациентов потребовалась госпитализация для поддерживающей терапии. Эти тяжелые случаи чаще всего были вызваны вирусом Коксаки А6.
Наблюдения
Мы описываем 37-летнего белого человека с широко распространенными покрытыми коркой зудящими папулами на коже черепа, ушах и лице, а также болезненными везикулярными высыпаниями пурпурного и таргетоидного типа на руках и ногах с сопутствующими лихорадками, неврологическими симптомами и артритом. потребовалась госпитализация для поддерживающей терапии.Его инфекция вирусом Коксаки А6 была подтверждена на основании полимеразной цепной реакции слизистой оболочки полости рта и жидкости кожных пузырьков.
Выводы и актуальность
Дерматологи должны быть знакомы с тяжелым вариантом HFMD, вызываемым вирусом Коксаки А6, включать его в свой дифференциальный диагноз острых фебрильных пузырей и знать, что некоторым пациентам может потребоваться госпитализация.
Болезнь «кисть-лапка-рот» (HFMD) — это острое, самоограничивающееся, очень заразное вирусное заболевание, которое обычно поражает детей младше 5 лет.Чаще всего он вызывается энтеровирусом 71 или вирусом Коксаки А16 и приводит к бессимптомной инфекции или легкой форме заболевания. Иммунокомпетентные взрослые страдают редко. В последнее время появляется все больше сообщений о более тяжелой форме HFMD, связанной с лихорадкой, болями в суставах и широко распространенными болезненными высыпаниями. Некоторым из этих пациентов потребовалась госпитализация для поддерживающей терапии. Эти тяжелые случаи чаще всего были вызваны вирусом Коксаки A6 (CVA6).
У 37-летнего мужчины появилось зудящее папулезное высыпание с коркой на задней части черепа.Через три дня после появления сыпи у него поднялась температура; усталость; поты; головные боли с светобоязнью; боли в суставах рук, шеи и спины; тошнота; понос; и жгучая боль в ладонях и подошвах, ограничивающая передвижение и повседневную активность. Его сыпь на ладонях и подошвах переросла в таргетоидные пурпурные пятна и несколько таргетоидных папуловезикул с прозрачной жидкостью. На черепе, ушах и щеках, вокруг рта и кожной губы, были многочисленные красно-розовые папулы с покрывающей их желто-коричневой коркой.Его мошонка была темно-красной с мелкими белыми трещинами (рис. 1). Его семейный анамнез имел важное значение для 10-месячного младенца, находившегося дома, с клинически диагностированной HFMD за 1 неделю до появления симптомов у пациента.
Рис. 1. Тяжелое заболевание кисти, стопы и рта у взрослых, вызванное вирусом Коксаки A6
У 37-летнего мужчины развились сгруппированные папулы с желтой коркой, расположенные на периорифициальной поверхности лица (A), затылочной части черепа (B) и наружном ухе. (С).У пациента также были пурпурные мишеневидные пятна и пузырьки на ладонях (D) и трещинная мошонка с мелкой белой чешуей (E).
Пациент был госпитализирован по поводу системных симптомов. Он был эмпирически покрыт пероральным доксициклином при возможном риккетсиозе и внутривенным ацикловиром при возможной герпесвирусной инфекции, пока результаты лабораторных исследований еще не получены.
Образцы биопсии, полученные с его правой щеки и левой ладони, выявили воспалительную чешуйчатую корку, паракератоз, поверхностный дерматит, папиллярное кожное кровоизлияние и смешанный периваскулярный инфильтрат.При биопсии пузырька правого тыльного запястья обнаружен внутриэпидермальный булл с очаговой ретикулярной дегенерацией и сливным некрозом крыши волдыря (рис. 2). Тельца включения вируса или многоядерные кератиноциты не наблюдались. Результат окрашивания периодической кислотой-Шиффом был отрицательным на грибковые элементы. Результаты анализов крови, включая полный подсчет клеток крови с дифференциалом, полную метаболическую панель, быстрый плазменный реагин, антитела к риккетсиозу и антитела к вирусу Коксаки от B1 до B6, не были примечательными.Жидкость везикул была отрицательной на вирус простого герпеса и вирус ветряной оспы с помощью полимеразной цепной реакции (ПЦР) и прямого флуоресцентного тестирования антител соответственно. Обычный бактериальный посев везикулярной жидкости был отрицательным. Результат ПЦР был положительным для энтеровируса из полости рта и везикулы правого тыльного запястья, а вирусный штамм был идентифицирован как CVA6, что подтвердило диагноз HFMD.
Рисунок 2. Образец биопсии запястья пациента
Образец биопсии везикулы правого тыльного запястья пациента показал внутриэпидермальный булл с очаговой ретикулярной дегенерацией и сливным некрозом крыши волдыря (A, гематоксилин-эозин, исходное увеличение × 4; B, гематоксилин-эозин, исходное увеличение × 20).
Системные симптомы у пациента исчезли в течение 2 дней, и он был выписан из больницы. В течение 7 дней его кожные поражения в основном зажили с минимальной поствоспалительной эритемой.
Заболевание, связанное с конечностями, является острым, очень заразным вирусным заболеванием, которое обычно поражает детей младше 5 лет, обычно летом и осенью. Обычно он мягкий и купируется самостоятельно; однако некоторые необычные штаммы вирусов вызывают тяжелые заболевания у детей и взрослых.Инфекция часто протекает бессимптомно, но клинические проявления включают легкую лихорадку с характерными везикулярными высыпаниями на руках, ногах и в полости рта. 1 Эти симптомы проходят через 7-10 дней; однако онихомадез может произойти через 1-2 месяца после заражения. 2 , 3 Чаще всего HFMD вызывается вирусом Коксаки A16 и энтеровирусом 71, но может быть вызван вирусом Коксаки A5, A6, A7, A9, A10, B2 и B5. 4
В период с 2004 по 2011 год произошло несколько вспышек более тяжелого варианта HFMD, связанного с CVA6, в Сингапуре, Тайване, Финляндии, Испании и Японии. 1 , 5 Совсем недавно, с ноября 2011 года по февраль 2012 года, в Центры по контролю и профилактике заболеваний Алабамы, Коннектикута, Калифорнии и Невады было зарегистрировано 63 случая тяжелой тяжелой формы тяжелой болезни. Семьдесят четыре процента протестированных случаев дали положительный результат ПЦР на CVA6. Примерно 25% этих зарегистрированных случаев были у взрослых, большинство из которых контактировали с детьми. Эти случаи в целом были более серьезными, чем типичные HFMD, с более высокими температурами и обширными кожными высыпаниями, и многие пациенты были госпитализированы из-за обезвоживания и сильной боли. 1 Со времени первого отчета Центров по контролю и профилактике заболеваний сообщалось, что несколько случаев тяжелой атипичной HFMD у детей были вызваны CVA6. 6
В этом отчете мы демонстрируем клинические и гистопатологические особенности этого тяжелого варианта HFMD у взрослого с подтвержденной ПЦР инфекцией CVA6. Патологические данные соответствовали HFMD с областями ретикулярной баллонной дегенерации эпидермиса, периваскулярного воспаления и интерфейсного дерматита. 4 , 7 Наш случай иллюстрирует необычные аспекты этого варианта HFMD: взрослый с тяжелым заболеванием и системными симптомами, который проявился весной. Как правило, HFMD редко встречается у иммунокомпетентных взрослых. 7 У пациента были изнуряющие системные и неврологические симптомы, артрит и боль в руках и ногах, которые требовали госпитализации, тогда как в большинстве случаев классического HFMD лечили дома. 5 -7 Его сыпь отличалась от классической HFMD, потому что его кожа головы, ушей и мошонки была серьезно поражена.
Учитывая, что большая часть населения США еще не подвергалась воздействию CVA6, вполне вероятно, что в ближайшие годы в клиниках и больницах появится больше таких случаев. Для дерматологов важно распознать это атипичное проявление HFMD, включить его в свой дифференциал для острых фебрильных пузырей как у детей, так и у взрослых и обеспечить госпитализацию пациентов для соответствующей поддерживающей терапии, когда это необходимо. 6
Принята к публикации: 12 июля 2013 г.
Автор для переписки: Уильям Д. Джеймс, доктор медицины, факультет дерматологии, Пенсильванский университет, 3600 Spruce St, 2 Maloney, Philadelphia, PA 19104 ([email protected]).
Опубликовано в Интернете: 30 октября 2013 г. doi: 10.1001 / jamadermatol.2013.6777.
Вклад авторов: Доктора Стюарт и Джеймс имели полный доступ ко всем данным в исследовании и несли ответственность за целостность данных и точность анализа данных.
Концепция и дизайн исследования: Все авторы.
Сбор данных: Стюарт, Чу, Шаффер, Джеймс.
Анализ и интерпретация данных: Все авторы.
Составление рукописи: Стюарт, Шаффер.
Критический пересмотр рукописи на предмет важного интеллектуального содержания: Все авторы.
Административная, техническая и материальная поддержка: Стюарт, Introcaso, Джеймс.
Руководитель исследования: Schaffer, James.
Раскрытие информации о конфликте интересов: Не сообщалось.
1. Центры по контролю и профилактике заболеваний (CDC). Примечания с мест: тяжелая болезнь рук, ног и рта, связанная с вирусом Коксаки A6 — Алабама, Коннектикут, Калифорния и Невада, ноябрь 2011 г. — февраль 2012 г. MMWR Morb Mortal Wkly Rep . 2012; 61 (12): 213-214.PubMedGoogle Scholar2.Osterback
Р., Вуоринен
Т, Линна
M, Susi
P, Hyypiä
Т, Варис
М.Вирус Коксаки А6 и болезнь рук, ягодиц и рта, Финляндия. Emerg Infect Dis . 2009; 15 (9): 1485-1488. PubMedGoogle ScholarCrossref 3.Wei
SH, Хуанг
Ю.П., Лю
MC,
и другие. Вспышка болезни рук, ног и рта, вызванной вирусом Коксаки A6, связанной с онихомадезом, на Тайване, 2010 г. BMC Infect Dis . 2011; 11: 346.PubMedGoogle ScholarCrossref 4.Shin
Ю, о
SH, Ли
JH. Случай заболевания ладонью-ногой у взрослого с иммунодефицитом. Энн Дерматол . 2010; 22 (2): 216-218.PubMedGoogle ScholarCrossref 5. Фуджимото
Т, Иидзука
S, Эномото
М,
и другие. Заболевания рук, ног и рта, вызываемые вирусом Коксаки A6, Япония, 2011 г. Emerg Infect Dis . 2012; 18 (2): 337-339.PubMedGoogle ScholarCrossref 6.Flett
K, Юноша
Я, Хуан
J,
и другие. Заболевания рук, ног и рта, вызываемые вирусом Коксаки А6. Emerg Infect Dis . 2012; 18 (10): 1702-1704. PubMedGoogle ScholarCrossref 7.Тойя
М, Эндо
Y, Танизаки
H, Фудзисава
А, Таниока
М, Миячи
Y. Взрослый случай тяжелого заболевания ладонно-ягодичной области, сопровождающегося стойкой лихорадкой и системным артритом. Dermatol Online J . 2012; 18 (8): 14. PubMedGoogle Scholar
границ | Анализ генома изолятов вируса Коксаки А4, выявленных при заболеваниях рук, ног и рта в Шаньдуне, Китай,
Введение
Человеческие энтеровирусы (EV), вирусы с одноцепочечной РНК без оболочки, таксономически классифицируются по роду Enterovirus (Dalldorf, 1953), семейству Picornaviridae и состоят из четырех видов: EV-A, EV-B, EV-C и EV-D (Ноулз и др., 2012). Вирус Коксаки A4 (CVA4), представитель вида EV-A, в настоящее время состоит из 25 типов, включая общие возбудители энтеровируса A71 (EVA71) и вируса Коксаки A16 (CVA16), которые являются наиболее распространенными агентами, выделенными в педиатрических случаях кистей рук и ног. — болезнь рта (HFMD), распространенное инфекционное заболевание среди детей, которое спорадически встречается во всем мире (Wang et al., 2017).
Штамм-прототип CVA4, High Point (инвентарный номер GenBank: AY421762), был впервые выделен из городских сточных вод во время вспышки полиомиелита в Северной Каролине, США, в 1948 году (Melnick, 1950; Oberste et al., 2004). В Carey and Myers (1969) другой штамм CVA4 был выделен из сыворотки крови ребенка со смертельным исходом, отмеченным тяжелыми проявлениями центральной нервной системы. В Estrada Gonzalez and Mas (1977) было обнаружено, что CVA4 был связан с возникновением острого полирадикулоневрита. Примечательно, что CVA4 также упоминался как патоген при вспышках HFMD (Hu et al., 2011). Связь между инфекцией CVA4 и герпангиной (Cai et al., 2015), синдромом кожно-слизистых лимфатических узлов (Ueda et al., 2015) и двусторонним идиопатическим васкулитом сетчатки (Mine et al., 2017). Эти клинические данные подчеркивают, что инфекции CVA4 представляют собой бремя болезней для глобального общественного здравоохранения, особенно для новорожденных и маленьких детей, что требует более глубокого понимания генетического разнообразия этого патогена.
Несколько полных геномов штаммов CVA4 были секвенированы до 2004 г. и были преимущественно из Азии и США (Oberste et al., 2004). Однако в 2004 и 2006 годах CVA4 вызвал две эпидемии HFMD на Тайване (Chu et al., 2011). После 2006 г. большее количество штаммов CVA4 было выделено в Европе и Азии, в основном из Китая. Например, в семи образцах от пациентов с острым вялым параличом (ОВП) в провинции Шэньси, собранных в период с 2006 по 2010 год, была диагностирована инфекция CVA4 (Wang et al., 2016). С 2008 г. в клинических образцах из педиатрических случаев HFMD в материковом Китае, таких как Gansu, были зарегистрированы преимущественно частичные последовательности VP1 и гораздо меньшее количество полных последовательностей генома нескольких штаммов CVA4 (Liu et al., 2009), Шэньчжэнь (Hu et al., 2011; Cai et al., 2015), Гуандун (Zhen et al., 2014) и Пекин (Li et al., 2015).
Геном РНК CVA4 (~ 7434 нуклеотида) можно подразделить на 5′-нетранслируемую область (UTR), 3′-UTR и открытую рамку считывания (ORF) (~ 6606 нуклеотидов), кодирующую один полипротеин, содержащий четыре структурных белков ( VP4, VP2, VP3 и VP1 в области P1) и семь неструктурных белков ( 2A, 2B и 2C в области P2 и 3A, 3B, 3C и 3D в области P3).Ген VP1 обычно используется для таксономической классификации типов EV в пределах рода Enterovirus (Palacios et al., 2002). В настоящее время в базе данных GenBank доступно несколько полноразмерных последовательностей генома CVA4 ( n = 10), что ограничивает понимание эволюции генома CVA4 и требует более глубокого понимания генетического разнообразия этого патогена для обеспечения доказательной базы для рациональное развитие молекулярной диагностики, разработки лекарств и дизайна вакцин.
В настоящем исследовании мы описываем полноразмерные последовательности генома ( n = 21) изолятов CVA4 от педиатрических пациентов с HFMD из провинции Шаньдун, Китай, идентифицированные между 2014 и 2016 годами, а также филогенетические и молекулярные характеристики последовательностей CVA4 VP1 ( n = 175). Эти результаты углубляют наше понимание разнообразия и эволюции CVA4 и имеют важное значение для снижения глобального бремени болезней, связанных с этим патогеном.
Материалы и методы
Клинические образцы
В этом исследовании образцы стула у детей младше 6 лет с HFMD были собраны в период с 2014 по 2016 год, а клинические образцы, которые были лабораторно подтверждены как инфекции, не связанные с EVA71 и CVA16, были любезно предоставлены Шаньдун. Центр по контролю и профилактике заболеваний.
Выделение CVA4 и извлечение РНК из клинических образцов
Клетки рабдомиосаркомы человека (RD) выращивали в MEM (минимальная необходимая среда, Gibco) с добавлением 10% FBS (фетальная бычья сыворотка, Gibco), 50 МЕ / мл пенициллина и 50 мкг / мл стрептомицина. Образцы трижды размножали в клетках RD человека при 37 ° C во влажной атмосфере в атмосфере 5% CO 2 .
Тотальную РНК экстрагировали из супернатанта RD после развития цитопатического эффекта (CPE) с использованием набора RNAiso Plus (TaKaRa, 9109).РНК подвергали обратной транскрипции в кДНК с использованием случайных гексамеров с помощью набора реагентов PrimeScript RT (TaKaRa, RR037A). Анализ ПЦР в реальном времени на основе TaqMan проводился для обнаружения присутствия ЭВ с использованием системы ПЦР в реальном времени ABI 7500, как описано ранее (Zhang et al., 2017a, b). EV-положительные образцы ( n = 21) были секвенированы с использованием платформы высокопроизводительного секвенирования MiSeq, и данные секвенирования были проанализированы с использованием программы CLC для получения полных последовательностей вирусного генома.Образцы не-EVA71 и не-CVA16 из случаев HFMD были дополнительно протестированы с помощью CVA4-специфичного ПЦР-анализа в реальном времени с использованием олигонуклеотидных праймеров и зонда, разработанного на основе гена VP1 прототипа штамма CVA4 (номер доступа в GenBank: AY421762): CVA4-F: TATGGGCTTTGTCCAACTCC, CVA4-R: GTCTAGGGACCCATGCCCTCACT, CVA4-зонд: FAM-TGGGGACATTTTCAGCTAGAGTTGTGAGCAAG-BHQ1.
Филогенетический анализ CVA4
Для филогенетического анализа из GenBank были загружены два набора данных, включающие все доступные полные геномные последовательности ( n = 10) и полноразмерные последовательности гена VP1 ( n = 154) штаммов CVA4.Множественное выравнивание последовательностей для двух наборов данных было выполнено с использованием Muscle (Edgar, 2004) вместе с геномами, секвенированными Шаньдун CVA4 ( n = 21). Модель нуклеотидного замещения была выбрана с помощью jModeltest (Darriba et al., 2012), а общая модель обратимого времени (GTR) всегда была лучшей моделью для анализа обоих наборов данных. Филогенетический анализ двух наборов данных был проведен с использованием RAxML v8.1.6 (Stamatakis et al., 2005) с моделью нуклеотидных замен GTRGAMMA с 1000 повторениями начальной загрузки.Нуклеотидные и аминокислотные расстояния оценивали с помощью MEGA 5 (Tamura et al., 2011).
Генетическое разнообразие по генам полипротеина CVA4
Среднее попарное генетическое разнообразие геномов CVA4 было рассчитано с помощью Phylip со скользящим окном в 300 нуклеотидов и размером шага в 50 нуклеотидов (Faria et al., 2017). Чтобы определить, в каком сайте кодонов чаще всего встречаются нуклеотидные вариации, энтропия Шеннона (Sn) в положениях 1, 2 и 3 каждого кодона выровненных генов полипротеина и VP4, VP2, VP3, VP1, 2A , Гены 2B, 2C, 3A, 3B, 3C и 3D соответственно были рассчитаны, как сообщалось ранее (Ramirez et al., 2013). Обработка данных выполнялась в среде R с открытым исходным кодом (R Development Core Team, 2012) с использованием пакета ggplot2.
Эволюционная динамика глобальных штаммов CVA4
Для определения структуры, подобной молекулярным часам, в данных CVA4 VP1 , дерево максимального правдоподобия последовательностей гена VP1 , оцененных на предыдущем этапе, использовалось для изучения связи между дивергенцией последовательностей и временем выборки с помощью TempEst (Rambaut et al. al., 2016). Чтобы лучше понять эволюционную динамику CVA4, набор данных последовательности VP1 ( n = 175) был использован для оценки скорости нуклеотидных замен с использованием выборки методом Монте-Карло байесовской цепи Маркова (MCMC), реализованной в пакете BEAST v1.8.4 (Drummond и Рамбаут, 2007). Модель SRD09 была использована в качестве модели нуклеотидного замещения. Байесовский процесс MCMC выполнялся для 100 миллионов шагов с частотой дискретизации каждые 5000 шагов, и первые 10% шагов отбрасывались как выгорание.Чтобы выбрать лучшую комбинацию молекулярных часов и предшествующего дерева, использовались как выборка пути, так и выборка ступеньки (Baele et al., 2012). Лучшая комбинация моделей — это предшествующее байесовское дерево горизонта и некоррелированная расслабленная модель молекулярных часов с логарифмически нормально распределенными вариациями скоростей между ветвями (дополнительная таблица S1) (Drummond et al., 2005). Апостериорные распределения оценивались с помощью Tracer v1.6, где предполагаемый размер выборки (ESS) составлял не менее 200. Байесовское дерево максимального доверия (MCC) было создано с помощью TreeAnnotator v1.8.4, а затем визуализировали с помощью FigTree v1.4.3. Кроме того, мы выполнили байесовский анализ графика горизонта с помощью программы Tracer v1.6 для реконструкции эволюционной истории на основе 175 полноразмерных последовательностей гена VP1 штаммов CVA4.
Результаты
Сводка набора данных
В этом исследовании в общей сложности 21 штамм CVA4 был выделен из образцов стула пациентов с HFMD в провинции Шаньдун, в том числе пять из Ляочэна, три из Хэцзэ, по два из Дэчжоу, Линьи, Вэйхай, Яньтай и отдельные образцы из Биньчжоу, Лайу и др. Тайан, Циндао и Жичжао (рис. 1 и дополнительная таблица S2).Полногеномные последовательности 21 изолята были депонированы в базу данных GenBank: MH086030-MH086050 (дополнительная таблица S2).
Рисунок 1. Филогенетическое дерево максимального правдоподобия последовательностей полного генома CVA4 ( n = 31). 21 изолят CVA4, описанный в этом исследовании, окрашен в розовый цвет, а узлы эталонных красителей, загруженных из GenBank, окрашены в сиреневый. Три клады (I, II и III) окрашены в синий, фиолетовый и светло-зеленый цвета, а штамм-прототип CVA4 High Point (AY421762) окрашен в красный цвет.
Десять полных геномов CVA4 в период с 1948 по 2015 год были общедоступны в GenBank, восемь штаммов из Китая и два из США. Полноразмерные последовательности гена CVA4 VP1 ( n = 175) штаммов также были извлечены. Они были изолированы от Азербайджанской Республики ( n = 1), Китая ( n = 145), Индии ( n = 8), Кении ( n = 1), России ( n = 15). ), Туркменистан ( n = 1) и США ( n = 4) (дополнительный рисунок S1), соответственно.Даты сбора варьировались с 1948 по 2016 год (дополнительный рисунок S1). Примечательно, что 94,9% ( n = 166) из них были отобраны с 2006 года, а 84,9% ( n = 141) были собраны из 16 провинций и городов Китая, включая Шаньдун ( n = 60), Сычуань ( человек). n = 18), Пекин ( n = 14), Шанхай ( n = 11), Шэньчжэнь ( n = 9), Хунань ( n = 7), Юньнань ( n = 4) , Чунцин ( n = 4), Цзилинь ( n = 3), Нинся ( n = 2), Цзянсу ( n = 2), Хайнань ( n = 2), Гуандун ( n = 2), Аньхой ( n = 1), Хэнань ( n = 1) и Чжэцзян ( n = 1).
Филогенетическая характеристика CVA4
Филогенетический анализ 31 целого генома показал, что 21 изолят из настоящего исследования разделились на три строго поддерживаемые клады (рис. 1). 17 штаммов были локализованы в основной кладе вместе с семью китайскими штаммами, собранными в период с 2008 по 2011 гг. Два изолята, SDLC / 16114 / China / 2016-05-08 и SDQD / QD384R / China / 2016-06-17, сгруппированы в одну независимую кладу а изоляты SDLY / 2014LY124R / China / 2014-04-23 и SDHZ / h437 / China / 2015-04-28, а также ранее описанные KP289442 / P1033 / 2013 / China / 2013 принадлежали к отдельной третьей кладе.Кроме того, 21 шаньдунский изолят имел более высокую гомологию нуклеотидных последовательностей с восемью ранее описанными китайскими штаммами (82,0–99,8%), чем с штаммом-прототипом High Point / United States / 1948 (77,8–79,3%) и американским штаммом 2015-OB2038. / TN / United States / 2015-04-16 (75,5–78,3%).
В дереве максимального правдоподобия для генов VP1 (дополнительный рисунок S2) изоляты CVA4 были разделены на четыре высоко поддерживаемых генотипа: A ( n = 1), B ( n = 1), C ( n = 28) и D ( n = 145).Прототип штамма High Point, выделенного из США в 1948 г., был классифицирован как генотип A, а один изолят из Кении в 1999 г. был обозначен как генотип B. Штаммы CVA4, расщепляющиеся с генотипом C, были собраны в России в 2006–2014 гг. = 14), Индия в 2010 г. ( n = 8), США в 1999 г. ( n = 1) и 2015 г. ( n = 1), провинция Сычуань, Китай в 2006 г. ( n = 1) и 2007 ( n = 1), Азербайджан ( n = 1) и Туркменистан ( n = 1), соответственно.Поразительно, но генотип D был преобладающим генотипом в Китае. Генотип D можно разделить на два субгенотипа с высокой степенью поддержки: D1 ( n = 5) и D2 ( n = 140). Более подробно, пять китайских штаммов, выделенных до 2006 года, принадлежали к субгенотипу D1, а остальные китайские штаммы сгруппированы в субгенотипе D2, включая 21 изолят, описанный в настоящем исследовании. Однако наши секвенированные штаммы не группировались вместе, а были вкраплены в субгенотип D2.Примечательно, что был один штамм CVA4 из России, KC879539 / 40238 / Russia / 2011, подпадающий под субгенотип D2 и обладающий высокой гомологией (97,5%) с KY978552 / 11142 / SD / China / 2011.
Среднее значение между групповыми нуклеотидными и аминокислотными расстояниями составляло 21,8 и 2,4% (генотип CVA4 A против B), 22,5 и 2,8% (A против C), 21,7 и 2,3% (A против D), 28,9 и 2,6% (B против C), 28,0 и 2,9% (B против D) и 20,4 и 3,2% (C против D) соответственно. Кроме того, среднее расстояние между нуклеотидами (и аминокислотами) между группами D1 и D2 составляло 15.2% (2,2%). Средние нуклеотидные (и аминокислотные) расстояния в группах C и D составляли 13,2% (2,8%) и 6,0% (1,3%), соответственно, т.е. 15%. Средние нуклеотидные (и аминокислотные) расстояния в группах D1 и D2 составляли 10,4% (2,0%) и 5,3% (1,2%) соответственно.
Парное генетическое разнообразие вдоль генома CVA4
Используя анализ скользящих окон по геномам CVA4 ( n = 31), мы обнаружили, что попарное генетическое разнообразие в регионах P2 (включая гены 2A, 2B, и 2C, ) и P3 (включая 3A, 3B , 3C и 3D ) был выше, чем в области P1 (включая гены VP4, VP2, VP3 и VP1 ) (Рисунок 2A).Кроме того, 3A, 3B и 3′-конец 3D показали более высокое попарное генетическое разнообразие, чем другие области гена. Ген полипротеина 21 генома CVA4 из настоящего исследования имел 82,6–99,2% гомологии нуклеотидной последовательности и соответствующую гомологию аминокислотной последовательности 97,1–99,9%, что позволяет предположить наличие многочисленных синонимичных мутаций. В соответствии с этим наблюдением, среднее значение Sn в третьей позиции кодонов гена полипротеина штаммов CVA4 было равно 0.224, что значительно выше, чем в положениях 1 и 2 кодонов (Рисунок 2B). Кроме того, средние значения Sn в третьей позиции кодонов 2B, 2C, 3A, 3C и 3D генов были значительно выше, чем у VP1, VP2, VP3 и VP4 . гены в области P1 (рис. 2C).
Рисунок 2. Генетическое разнообразие генов полипротеина CVA4 ( n = 31). (A) Среднее попарное генетическое разнообразие всех генов полипротеина CVA4 было рассчитано с использованием скользящего окна в 300 нт с размером шага 50 нс. (B) значения позиционной энтропии и значения Sn в разделах 1, 2 и 3 каждого кодона были оценены, соответственно. ∗∗∗ p -значение <0,001 в тесте суммы рангов Вилкоксона. (C) Значения Sn нуклеотидов в трех положениях кодонов были оценены в генах VP4, VP2, VP3, VP1, 2A, 2B, 2C, 3A, 3B, 3C и 3D соответственно. . ∗∗∗ p -значение <0,001 в тесте суммы рангов Вилкоксона между генами 2B, 2C, 3A, 3C, 3D и генами VP4, VP2, VP3, VP1 соответственно.
Эволюционная динамика мирового CVA4
Байесовское филогенетическое дерево всех генов CVA4 VP1 ( n = 175), реконструированное с использованием модели параметров наилучшего соответствия, выявило ту же топологию, что и филогенетическое дерево максимального правдоподобия (рис. 3). Анализ структуры молекулярных часов Tempest выявил сильную временную корреляцию в гене VP1 ( R 2 = 0,86). Средняя скорость нуклеотидных замен для генов CVA4 VP1 была оценена как 5.12 × 10 -3 замен / участок / год (95% наивысшая апостериорная плотность (HPD): 4,45 × 10 -3 –5,81 × 10 -3 замен / участок / год). Примерно в 1941 году (95% HPD: 1931–1948) вирусы CVA4, по оценкам, разделялись на генотип A и общее происхождение генотипов B, C и D. Предполагалось, что генотип B отклонился от общего происхождения примерно в 1951 году. (95% HPD: 1933–1966), и, наконец, генотипы C и генотип D разошлись примерно в 1970 году (95% HPD: 1961–1977).Кроме того, генотип D был далее разделен на субгенотипы D1 и D2, которые произошли примерно в 1979 году (95% HPD: 1974–1985), и можно было проследить время до последнего общего предка (tMRCA) субгенотипа D2. назад в 2001 г. (95% HPD: 1999–2003 гг.).
Рисунок 3. Байесовский филогенетический анализ и демографическая реконструкция последовательностей гена CVA4 VP1 (915 нт). (A) Байесовская филогения была проведена BEAST с предварительным байесовским деревом горизонта и расслабленной моделью молекулярных часов. (B) — ось x — это шкала времени (в годах), а ось y — эффективный размер популяции в логарифмической шкале Neτ. Толстая сплошная линия указывает средние оценки, а заштрихованная область указывает на 95% -ную самую высокую апостериорную плотность.
Кроме того, мы выполнили байесовский анализ графика горизонта, чтобы восстановить демографическую историю CVA4 на основе последовательностей гена VP1 (рис. 3). Наши результаты показали, что эффективный размер популяции (аналог числа инфицированных особей) вируса CVA4 прошел пять основных стадий с момента описания прототипа штамма High Point в 1948 году (рис. 3).Первый этап охватывал период с 1948 по 2000 год, когда численность популяции была относительно постоянной, с признаками небольшого увеличения. На этом этапе генотипы B, C и D уже присутствовали до 1975 года, а также возникновение генотипа D1 в начале 1980-х и последующая совместная циркуляция генотипов B, C и субгенотипа D1. На втором этапе размер популяции резко и быстро уменьшился с 2000 г. до примерно середины 2003 г., возможно, из-за снижения распространенности генотипа B и субгенотипа D1 (или, возможно, отсутствия данных наблюдения), поскольку генотип C и субгенотип D2 разнообразились за этот период.Вскоре после середины 2003 г. численность популяции CVA4 значительно и быстро росла до 2010 г., когда широко распространялись генотип C в России и Индии и субгенотип D2 в Китае. После 2010 г. произошло еще одно резкое и резкое уменьшение эффективного размера популяции, которое могло быть вызвано уменьшением распространенности генотипа C. С 2011 г. CVA4, по-видимому, вступил в стадию восстановления, и размер популяции снова стал стабильным с субгенотипом. D2 доминирует в Китае.
Молекулярные характеристики
По сравнению с прототипом штамма CVA4 High Point, 40 аминокислотных замен были идентифицированы в полипротеине в> 75% наших изолятов, в том числе 1 в VP4 , 2 в VP2 , 2 в VP3 , 6 в VP1 , 6 дюймов 2A , 1 дюйм 2B , 5 дюймов 2C , 1 дюйм 3A , 3 дюйма 3C и 11 дюймов 3D (дополнительная таблица S3). В EVA71 ранее сообщалось, что 14 критических аминокислотных остатков и два генных мотива связаны с вирусной инфекционностью in vitro и in vivo (Таблица 1) (30–43).Интересно, что штаммы CVA4 содержали те же аминокислотные остатки в нескольких сайтах, что и штамм EVA71 BrCr, такие как остатки 37, 113 и 192 белка VP1 , 84, 82–86 и 154–156 белка Белка 3C и 73 и 363 белка 3D (таблица 1). Однако, в отличие от VP1 169L прототипа штамма EVA71, VP1 169F был обнаружен в High Point и в каждом из наших 21 изолята CVA4, что указывает на то, что CVA4, возможно, адаптировался для связывания с классом рецепторов мышиного мусорщика. Участник B 2 (SCARB2) (Victorio et al., 2016). Примечательно, что присутствовали разные аминокислотные остатки в VP2 149 , VP1 97 , VP1 98 , VP1 123 , VP1 167 24688 между EVA71 BrCr и штаммами CVA4, и VP1 145K наблюдалось среди наших изолятов CVA4.
Таблица 1. Сравнение потенциальных критических аминокислотных остатков прототипных штаммов EV71 и CVA4 и 21 изолята, описанного в настоящем исследовании.
Обсуждение
Хотя EVA71 и CVA16 известны как основные возбудители HFMD в Китае, сообщалось, что ряд других видов EV-A, включая CVA6, CVA10, CVA2 и CVA4, связаны с HFMD. Кроме того, CVA4 также был одним из распространенных патогенов, связанных со случаями асептического менингита, герпетической ангины и вирусного миокардита (Carey and Myers, 1969; Estrada Gonzalez and Mas, 1977; Lee et al., 2014; Wang et al., 2016), что вызвало серьезную обеспокоенность общественным здравоохранением и вызвало предположения о том, существует ли измененный тропизм или патогенность, связанная с этим типом сердечно-сосудистых заболеваний.Однако подробный анализ генома был проблематичным, поскольку на сегодняшний день в базе данных GenBank доступно только десять полных геномов CVA4 (Hu et al., 2011). Следовательно, молекулярно-эпидемиологическая характеристика CVA4 остается гораздо менее понятной из-за нехватки доступных геномных данных.
В этом исследовании мы описали 21 новый геном CVA4, выделенный от детей с HFMD, и выявили, что наши изоляты сгруппированы в три хорошо поддерживаемых клады на дереве максимального правдоподобия, оцененном с использованием полных геномов.Это свидетельствует о наличии определенного генетического разнообразия китайских вирусов CVA4, которое было бы недооценено из-за ограниченности имеющихся данных эпиднадзора. Филогенетический анализ последовательностей гена VP1 показал, что штаммы CVA4 можно разделить на четыре отдельных генотипа, A-D, со средним генетическим расстоянием в пределах генотипа 0,00–13,2% и средним генетическим расстоянием между генотипами 20,4–28,9%. Следовательно, в соответствии с предыдущими отчетами (Rico-Hesse et al., 1987; Hu et al., 2011), различные генотипы CVA4 могут быть определены с> 15% нуклеотидного расстояния между генотипами в гене VP1 . Однако, в отличие от предыдущего отчета (Hu et al., 2011), штамм-прототип High Point образовал независимую ветвь как генотип А в нашей классификации. Подавляющее большинство китайских штаммов, включая 21 изолят в этом исследовании, принадлежали к генотипу D, и только два штамма, идентифицированные в провинции Сычуань в 2006 и 2007 годах, принадлежали к генотипу C.Кроме того, на основании имеющихся данных субгенотип D2, по-видимому, вытеснил D1 и стал преобладающим в Китае за предыдущее десятилетие.
Дальнейший анализ показал, что мутации с большей вероятностью возникают в областях P2 и P3, кодирующих неструктурные белки, и в третьем положении кодонов, что согласуется с предыдущими сообщениями о том, что существует общий образец использования синонимичных кодонов для многих типов энтеровирусов ( Liu et al., 2011; Ma et al., 2014; Zhang et al., 2014; Su et al., 2017). Более того, ген VP1 был наиболее консервативной областью в нашем анализе, что позволяет предположить, что он может быть потенциальной мишенью для разработки чувствительного и специфичного к CVA4 диагностического анализа RT-qPCR, а также может быть эпитопом-кандидатом для разработки вакцин.
С середины 1950-х годов генетическое разнообразие CVA4 постепенно увеличивалось с 1948 по 1999 год и резко увеличивалось с середины 2003 по 2009 год, параллельно с увеличением распространенности CVA4 в Китае. Однако численность популяции, по оценкам, испытала более существенное сокращение в 1999 г., середине 2003 г. и с 2009 по 2011 г., чем в предыдущем отчете (Chen et al., 2018). Учитывая, что точность анализа демографической реконструкции чувствительна к выборке, определение резкого уменьшения размера популяции CVA4 в период с 1999 по середину 2003 года потребует дополнительных усилий по выборке. Следовательно, срочно необходим национальный надзор за различными энтеровирусами человека, вызывающими HFMD, для выяснения сложной эволюционной динамики и совместной циркуляции энтеровирусов, чтобы обеспечить доказательную базу для рациональных диагностических и профилактических подходов к снижению бремени болезней.
Средняя скорость эволюции гена CVA4 VP1 была оценена как 5,12 × 10 -3 замен / сайт / год, немного ниже, но в том же диапазоне, что и 6,4 × 10 -3 замен / сайт / год. Чен и др. (2018). По нашим оценкам, общий предок известного CVA4 существовал приблизительно 75 лет назад, что также аналогично предыдущей оценке (71,8 года назад) (Tee et al., 2010). Интересно, что скорость эволюции EVA71 VP1 оценивается примерно в 4.6 × 10 -3 замен / сайт / год для обеих геногрупп EVA71 B и C (Tee et al., 2010; Chen et al., 2018). Скорость эволюции CVA6 оценивается в 8,1 × 10 -3 замен / сайт / год (Puenpa et al., 2016), а CVA16 — 6,7 × 10 -3 замен / сайт / год (Zhao et al. ., 2016). Следовательно, CVA4, по-видимому, эволюционирует с той же скоростью, что и другие основные патогены HFMD, что заслуживает дальнейшего внимания.
Вирус Коксаки А4 имел общие фенотип-ассоциированные аминокислотные замены по сравнению с прототипным штаммом EVA71, BrCr.Особо следует отметить, что VP1 169F , идентифицированный в EVA71, возможно, придавал вирусную связывающую способность рецептору SCARB2 млекопитающих, также обнаруженному в изолятах CVA4 (Yamayoshi et al., 2012). Кроме того, у вирусов BrCr и CVA4 было несколько сайтов с разными аминокислотными мотивами. Однако следует отметить, что, хотя биологическая значимость этих сайтов со специфическими аминокислотными заменами была подтверждена в EVA71, они были идентифицированы путем сравнения последовательностей между CVA4 и EVA71. Следовательно, влияние этих критических аминокислот в CVA4 на связывание рецептора , вирусная инфекционность, адаптация млекопитающих к репликации и патогенез требуют дальнейших исследований.
Кроме того, мы также обнаружили потенциальные события генетической рекомбинации в геномах CVA4 ( n = 31) с помощью программы обнаружения рекомбинации (RDP) v4.16 (Martin et al., 2015) и Simplot v3.5.1 (Hu et al. , 2011). Однако нам не удалось обнаружить убедительные события рекомбинации в 21 недавно секвенированном вирусе CVA4 (данные не показаны). В целом, похоже, что генетическая замена, а не рекомбинация, сыграла более важную роль в эволюции и диверсификации CVA4, несмотря на то, что события рекомбинации часто идентифицируются в других энтеровирусах человека (Hu et al., 2011). Однако ограниченные данные эпиднадзора могли также привести к недооценке количества событий генетической рекомбинации в эволюции CVA4.
Таким образом, мы описали 21 новую последовательность генома CVA4, которая значительно обогащает доступные геномные данные для CVA4. Филогенетический анализ показал, что генотипы C, D1 и D2 совместно циркулировали в начале 2000-х годов, а теперь D2 вытеснил D1 и стал преобладающим субгенотипом в Китае. Генетическое разнообразие китайского CVA4 обнаруживается в областях, кодирующих неструктурные белки, и в третьей позиции колебания кодонов.Напротив, меньше мутаций произошло в области гена VP1 , что делает ее оптимальной областью-кандидатом для разработки молекулярных анализов и потенциально в качестве консервативного эпитопа для вакцинации. Примечательно, что CVA4 может обладать более высокой аффинностью связывания с SCARB2 из-за замены L169F в белке VP1 , и то, как эта замена влияет на вирусную инфекционность и клинические исходы, следует исследовать в будущем. Помимо мониторинга EVA71 и CVA16, в Китае срочно необходимо усиленное наблюдение за все более распространенными, а также вирулентными агентами, включая CVA4, для лучшего понимания динамики циркуляции и эволюции энтеровирусов человека, что предоставит бесценную информацию для диагностических и профилактических подходов содержать болезнь.
Авторские взносы
MW, JL и W-FS разработали исследование, участвовали во всех тестах и составили рукопись. M-XY, Y-WZ, S-JD и X-JW участвовали в сборе и тестировании образцов. TH, MC, SD, X-CZ, Z-JZ, HZ и Y-GT разработали исследование, внесли свой вклад в анализ результатов и подготовку исправленных версий рукописей. Все авторы прочитали и одобрили окончательную рукопись.
Финансирование
Работа поддержана Национальной программой исследований и разработок в области ключевых технологий Китая (проект №2017ZX10104001-006), Фонд естественных наук провинции Шаньдун (ZR2018PH034), Проекты развития медицины и здравоохранения провинции Шаньдун (2013WS0157 и 2017WS066), Муниципальная программа развития науки и технологий Тайань (2017NS0107) и Национальный фонд естественных наук Китая (81601773). W-FS был поддержан программой стипендиатов Тайшань провинции Шаньдун (ts201511056).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2019.01001/full#supplementary-material
Сноски
- http: /beast.bio.ed.ac.uk/Tracer
- http: /tree.bio.ed.ac.uk/software/figtree/
- www.picornaviridae.com
Список литературы
Арита, М., Симидзу, Х., Нагата, Н., Ами, Ю., Сузаки Ю., Сата Т. и др. (2005). Чувствительные к температуре мутанты энтеровируса 71 демонстрируют ослабление у яванских макак. J. Gen. Virol. 86 (Pt 5), 1391–1401. DOI: 10.1099 / vir.0.80784-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баэле, Г., Лемей, П., Бедфорд, Т., Рамбаут, А., Сушард, М. А., Алексеенко, А. В. (2012). Повышение точности сравнения моделей демографических и молекулярных часов с учетом филогенетической неопределенности. Мол. Биол. Evol. 29, 2157–2167. DOI: 10.1093 / molbev / mss084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цай, К., Яо, X., Чжо, Ф., Хэ, Ю. и Ян, Г. (2015). [Генная характеристика области VP1 вируса Коксаки A4 из случаев герпетической ангины в Шэньчжэне, Китай]. Чжунхуа И Сюэ За Чжи 95, 1226–1229.
PubMed Аннотация | Google Scholar
Кейн, Э. А., Монкла, Л. Х., Рондерос, М. Д., Фридрих, Т. К., и Осорио, Дж.Э. (2016). Единственная мутация в VP1 энтеровируса 71 ответственна за повышенную вирулентность и нейротропизм у взрослых мышей с дефицитом интерферона. J. Virol. 90, 8592–8604. DOI: 10.1128 / JVI.01370-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэри Д. Э. и Майерс Р. М. (1969). Выделение вируса Коксаки типа A4 из сыворотки крови ребенка с быстро смертельным заболеванием с тяжелыми проявлениями центральной нервной системы. Индиан Дж.Med. Res. 57, 765–769.
PubMed Аннотация | Google Scholar
Chen, P., Wang, H., Tao, Z., Xu, A., Lin, X., Zhou, N., et al. (2018). Множественные цепи передачи вируса Коксаки A4, одновременно циркулирующего в Китае и соседних странах в последние годы: филогенетический и пространственно-временной анализ на основе вирусологического надзора. Мол. Филогенет. Evol. 118, 23–31. DOI: 10.1016 / j.ympev.2017.09.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чу П.Ю., Лу, П. Л., Цай, Ю. Л., Си, Э., Яо, К. Ю., Чен, Ю. Х. и др. (2011). Пространственно-временной филогенетический анализ и молекулярная характеристика вируса Коксаки A4. Заражение. Genet. Evol. 11, 1426–1435. DOI: 10.1016 / j.meegid.2011.05.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чуа, Б. Х., Фуэктес, П., Сандерс, С. А., Николлс, П. К., и Макминн, П. К. (2008). Молекулярные основы адаптации мышей к энтеровирусу человека 71. J. Gen.Virol. 89 (Pt 7), 1622–1632. DOI: 10.1099 / vir.0.83676-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cordey, S., Petty, T. J., Schibler, M., Martinez, Y., Gerlach, D., van Belle, S., et al. (2012). Идентификация сайт-специфических адаптаций, вызывающих повышенный тропизм нервных клеток во время инфицирования энтеровирусом человека 71. PLoS Pathog. 8: e1002826. DOI: 10.1371 / journal.ppat.1002826
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дальдорф, Г.(1953). Группа вирусов Коксаки. Ann. Акад. Sci. 56, 583–586. DOI: 10.1111 / j.1749-6632.1953.tb30251.x
CrossRef Полный текст | Google Scholar
Драммонд, А. Дж., Рамбо, А., Шапиро, Б., и Пибус, О. Г. (2005). Байесовский объединенный вывод прошлой динамики популяции на основе молекулярных последовательностей. Мол. Биол. Evol. 22, 1185–1192. DOI: 10.1093 / molbev / msi103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эстрада Гонсалес, Р., и Мас, П. (1977). Вирусологические исследования при остром полирадикулоневрите ЛГБС-типа. Различные выводы в отношении вируса Коксаки A4. Neurol. Neurocir. Psiquiatr. 18 (2–3 приложения), 527–531.
PubMed Аннотация
Фариа, Н. Р., Квик, Дж., Кларо, И. М., Тезе, Дж., Де Хесус, Дж. Г., Джованетти, М. и др. (2017). Установление и скрытая передача вируса Зика в Бразилии и Америке. Природа 546, 406–410. DOI: 10.1038 / природа22401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Ю.F., Yang, F., Du, J., Dong, J., Zhang, T., Wu, Z.Q., et al. (2011). Полный анализ генома штаммов вируса Коксаки A2, A4, A5 и A10, выделенных от пациентов с заболеваниями рук, ног и рта в Китае, выявил частую рекомбинацию энтеровируса человека A. J. Clin. Microbiol. 49, 2426–2434. DOI: 10.1128 / JCM.00007-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, С. В., Ван, Ю. Ф., Ю, К. К., Су, И. Дж. И Ван, Дж. Р. (2012). Мутации в капсидных белках VP2 и VP1 увеличивают инфекционность и летальность энтеровируса 71 для мышей за счет связывания вируса и увеличения накопления РНК. Вирусология 422, 132–143. DOI: 10.1016 / j.virol.2011.10.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Келли, Дж. Т., Де Колибус, Л., Эллиотт, Л., Фрай, Э. Э., Стюарт, Д. И., Роулендс, Д. Дж., И др. (2015). Сильные противовирусные агенты не вызывают генетически стабильных мутаций устойчивости ни в энтеровирусе 71, ни в вирусе Коксаки А16. Антивирь. Res. 124, 77–82. DOI: 10.1016 / j.antiviral.2015.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ноулз, Н.J., Hovi, T., Hyypiä, T., King, A.MQ., Lindberg, A.M., Pallansch, M.A., et al. (2012). «Picornaviridae» в таксономии вирусов : классификация и номенклатура вирусов: девятый отчет Международного комитета по таксономии вирусов , ред. А. М. К. Кинг, М. Дж. Адамс, Э. Лефковиц и Э. Б. Карстенс (Сан-Диего, Калифорния: Эльзевьер).
Google Scholar
Ли, К.Дж., Хуанг, Ю.С., Янг, С., Цао, К.С., Чен, К.Дж., Сие, Ю.С., и др. (2014). Клинические особенности инфекций, вызванных вирусом Коксаки A4, B3 и B4, у детей. PLoS One 9: e87391. DOI: 10.1371 / journal.pone.0087391
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж. С., Дун, Х. Г., Цинь, М., Се, З. П., Гао, Х. С., Ян, Дж. Й. и др. (2015). Вспышка лихорадочного заболевания, вызванного вирусом Коксаки A4, в детском саду в Пекине, Китай. Virol. J. 12:92. DOI: 10.1186 / s12985-015-0325-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Дж. Ф., Чжан Ю. и Ли Х.(2009). [Генетическая характеристика VP4-VP2 двух вирусов Коксаки A4, выделенных от пациентов с болезнью рук, ящура и рта]. Чжунго И Мяо Хэ Мянь И 15, 345–349.
PubMed Аннотация | Google Scholar
Лю, Ю.С., Чжоу, Дж. Х., Чен, Х. Т., Ма, Л. Н., Пейсак, З., Дин, Ю. З. и др. (2011). Характеристики использования синонимичных кодонов в вирусе энтеровируса 71 и влияние хозяина на вирус в структуре использования кодонов. Заражение. Genet. Evol. 11, 1168–1173.DOI: 10.1016 / j.meegid.2011.02.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, М. Р., Хуэй, Л., Ван, М. Л., Тан, Ю., Чанг, Ю. В., Цзя, К. Х. и др. (2014). Общая картина использования кодонов энтеровируса 71. Genet. Мол. Res. 13, 336–343. DOI: 10.4238 / 2014. 21.1 января
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин Д. П., Мюррелл Б., Голден М., Хосал А. и Мухир Б. (2015). RDP4: обнаружение и анализ паттернов рекомбинации в вирусных геномах. Virus Evol. 1: vev003. DOI: 10.1093 / ve / vev003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мельник, Дж. Л. (1950). Исследования вирусов Коксаки; свойства, иммунологические аспекты и распространение в природе. Бык. Акад. Med. 26, 342–356.
PubMed Аннотация | Google Scholar
Mine, I., Taguchi, M., Sakurai, Y., and Takeuchi, M. (2017). Двусторонний идиопатический васкулит сетчатки после инфицирования вирусом Коксаки A4: отчет о клиническом случае. BMC Ophthalmol. 17: 128. DOI: 10.1186 / s12886-017-0523-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миямура, К., Нисимура, Ю., Або, М., Вакита, Т., и Симидзу, Х. (2011). Адаптивные мутации в геномах штамма энтеровируса 71 после инфицирования клеток мыши, экспрессирующих лиганд-1 гликопротеина Р-селектина человека. J. Gen. Virol. 92 (Pt 2), 287–291. DOI: 10.1099 / vir.0.022418-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нисимура, Ю., Ли, Х., Хафенштейн, С., Катаока, К., Вакита, Т., Бергельсон, Дж. М. и др. (2013). Связывание энтеровируса 71 с PSGL-1 на лейкоцитах: VP1-145 действует как молекулярный переключатель, контролирующий взаимодействие рецепторов. PLoS Pathog. 9: e1003511. DOI: 10.1371 / journal.ppat.1003511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оберсте, М.С., Пенаранда, С., Махер, К., и Палланш, М.А. (2004). Полные последовательности генома всех представителей вида Энтеровирус человека А. J. Gen. Virol. 85 (Pt 6), 1597–1607. DOI: 10.1099 / vir.0.79789-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паласиос, Г., Касас, И., Тенорио, А., Фрейре, К. (2002). Молекулярная идентификация энтеровируса путем анализа частичной области генома VP1 различными методами. J. Clin. Microbiol. 40, 182–192. DOI: 10.1128 / jcm.40.1.182-192.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пуэнпа, Дж., Vongpunsawad, S., Osterback, R., Waris, M., Eriksson, E., Albert, J., et al. (2016). Молекулярная эпидемиология и эволюция вируса Коксаки человека A6. J. Gen. Virol. 97, 3225–3231. DOI: 10.1099 / jgv.0.000619
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Основная группа разработчиков
R (2012 г.). R: язык и среда для статистических вычислений . Вена: Фонд R для статистических вычислений.
Google Scholar
Рамбаут, А., Лам, Т. Т., Макс Карвалью, Л., и Пибус, О. Г. (2016). Изучение временной структуры гетерохронных последовательностей с помощью TempEst (ранее Path-O-Gen). Virus Evol. 2: vew007. DOI: 10.1093 / ve / vew007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамирес К., Грегори Дж., Бути М., Табернеро Д., Камос С., Касильяс Р. и др. (2013). Сравнительное исследование сверхглубокого пиросеквенирования и клонирования для количественного анализа квазивидов вируса с использованием инфекции вируса гепатита В в качестве модели. Антивирь. Res. 98, 273–283. DOI: 10.1016 / j.antiviral.2013.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рико-Гессе, Р., Палланш, М.А., Ноттай, Б.К., и Кью, О.М. (1987). Географическое распространение генотипов дикого полиовируса типа 1. Вирусология 160, 311–322. DOI: 10.1016 / 0042-6822 (87)
-8
CrossRef Полный текст | Google Scholar
Ши, С. Р., Чанг, К., Чен, Т. К., Ву, К. Н., Сюй, Дж. Т., Ли, Дж.C., et al. (2004a). Мутации в доменах KFRDI и VGK протеазы 3C энтеровируса 71 влияют на его РНК-связывающую и протеолитическую активность. J. Biomed. Sci. 11, 239–248. DOI: 10.1159 / 000076036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши, С. Р., Цай, М. К., Ценг, С. Н., Вон, К. Ф., Шиа, К. С., Ли, В. Т. и др. (2004b). Мутация в капсидном белке VP1 энтеровируса 71 придает устойчивость к ингибирующим эффектам пиридилимидазолидинона. Антимикробный.Агенты Chemother. 48, 3523–3529. DOI: 10.1128 / AAC.48.9.3523-3529.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стаматакис А., Людвиг Т. и Мейер Х. (2005). RAxML-III: быстрая программа для вывода больших филогенетических деревьев на основе максимального правдоподобия. Биоинформатика 21, 456–463. DOI: 10.1093 / биоинформатика / bti191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Су, В., Ли, X., Чен, М., Дай, В., Сан, С., Wang, S., et al. (2017). Анализ использования синонимичных кодонов вирусов болезней рук, ящура: сравнительное исследование вирусов Коксаки A6, A10, A16 и энтеровируса 71 с 2008 по 2015 годы. Infect. Genet. Evol. 53, 212–217. DOI: 10.1016 / j.meegid.2017.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тамура, К., Петерсон, Д., Петерсон, Н., Стечер, Г., Ней, М., и Кумар, С. (2011). MEGA5: анализ молекулярной эволюционной генетики с использованием методов максимального правдоподобия, эволюционного расстояния и максимальной экономии. Мол. Биол. Evol. 28, 2731–2739. DOI: 10.1093 / molbev / msr121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ти, К. К., Лам, Т. Т., Чан, Ю. Ф., Библия, Дж. М., Камарулзаман, А., Тонг, К. Ю. и др. (2010). Эволюционная генетика энтеровируса человека 71: происхождение, популяционная динамика, естественный отбор и сезонная периодичность гена VP1. J. Virol. 84, 3339–3350. DOI: 10.1128 / JVI.01019-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Целигка, Е.Д., Собо, К., Стоппини, Л., Каньо, В., Абдул, Ф., Пиуз, И. и др. (2018). Мутация VP1, приобретенная во время диссеминированной инфекции энтеровируса 71, придает способность связывать гепарансульфат и модулирует тропизм ex vivo. PLoS Pathog. 14: e1007190. DOI: 10.1371 / journal.ppat.1007190
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэда, Ю., Кензака, Т., Нода, А., Ямамото, Ю., и Мацумура, М. (2015). Болезнь Кавасаки у взрослых (синдром кожно-слизистых лимфатических узлов) и сопутствующая инфекция, вызванная вирусом Коксаки A4: отчет о болезни. Внутр. Med. Case Rep. J. 8, 225–230. DOI: 10.2147 / IMCRJ.S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Викторио, К. Б., Сюй, Ю., Нг, К., Мэн, Т., Чоу, В. Т., и Чуа, К. Б. (2016). Кооперативный эффект аминокислот 98E, 145A и 169F VP1 в продуктивной инфекции линий мышиных клеток энтеровирусом 71 (штамм BS). Emerg. Микробы заражают. 5: e60. DOI: 10.1038 / emi.2016.56
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Д., Xu, Y., Zhang, Y., Zhu, S., Si, Y., Yan, D., et al. (2016). [Генетические характеристики вируса Коксаки группы А типа 4, выделенного от пациентов с острым вялым параличом в Шэньси, Китай]. Бинг Ду Сюэ Бао 32, 145–149.
PubMed Аннотация | Google Scholar
Wang, J., Hu, T., Sun, D., Ding, S., Carr, M.J., Xing, W., et al. (2017). Эпидемиологические характеристики болезней рук, ног и рта в Шаньдуне, Китай, 2009-2016 гг. Sci. Отчет 7: 8900. DOI: 10.1038 / s41598-017-y, мы выполнили байесовский sk09196-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямаёси, С., Иидзука, С., Ямасита, Т., Минагава, Х., Мизута, К., Окамото, М., и др. (2012). SCARB2-зависимая инфекция человека, вызванная вирусом Коксаки А7, А14 и А16 и энтеровирусом 71. J. Virol. 86, 5686–5696. DOI: 10.1128 / JVI.00020-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зайни, З., Макминн, П. (2012).Одиночная мутация в капсидном протеине VP1 (Q145E) штамма геногруппы C4 энтеровируса человека 71 генерирует вирулентный фенотип мыши. J. Gen. Virol. 93 (Pt 9), 1935–1940. DOI: 10.1099 / vir.0.043893-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zaini, Z., Phuektes, P., and McMinn, P. (2012). Мышиная адаптация штамма подгеногруппы B5 энтеровируса 71 человека связана с заменой нового лизина на глутаминовую кислоту в положении 244 в белке VP1. Virus Res. 167, 86–96. DOI: 10.1016 / j.virusres.2012.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, H., Cao, H. W., Li, F. Q., Pan, Z. Y., Wu, Z. J., Wang, Y. H., et al. (2014). Анализ использования синонимичных кодонов в энтеровирусе 71. Вирусная болезнь 25, 243–248. DOI: 10.1007 / s13337-014-0215-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Z., Dong, Z., Li, J., Carr, M.J., Zhuang, D., Wang, J., et al. (2017a). Защитная эффективность инактивированной формальдегидом цельновирусной вакцины и противовирусных препаратов на мышиной модели инфекции Коксаки вируса a10. J. Virol. 91: e00333-17. DOI: 10.1128 / JVI.00333-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Z., Dong, Z., Wei, Q., Carr, M.J., Li, J., Ding, S., et al. (2017b). Модель инфекции Коксаки вируса А6 на неонатальных мышах для оценки противовирусной эффективности и эффективности вакцины. Дж.Virol. 91: e02450-16. DOI: 10.1128 / JVI.02450-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Г., Чжан, X., Ван, К., Ван, Г., и Ли, Ф. (2016). Характеристика последовательности VP1 изолятов вируса Коксаки А16 байесовским эволюционным методом. Virol. J. 13: 130. DOI: 10.1186 / s12985-016-0578-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhen, R., Zhang, Y., Xie, H., Chen, C., Geng, J., He, P., et al.(2014). [Анализ последовательности VP1-области вируса Коксаки А4 и вируса Коксаки А10 в городе Гуанчжоу, 2010-2012 гг.]. Чжунхуа Ю Фанг И Сюэ За Чжи 48, 445–450.
PubMed Аннотация | Google Scholar
Две вспышки вируса Коксаки В3, связанные с болезнью рук, ног и рта, в Китае и эволюционная история во всем мире | BMC Infectious Diseases
Zell R, Delwart E, Gorbalenya AE, Hovi T., King AMQ, Knowles NJ, Lindberg AM, Pallansch MA, Palmenberg AC, Reuter G, et al.Профиль таксономии вируса ICTV: Picornaviridae. J Gen Virol. 2017; 98 (10): 2421–2.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Sin J, Mangale V, Thienphrapa W., Gottlieb RA, Feuer R. Недавний прогресс в понимании репликации, распространения и патогенеза вируса Коксаки. Вирусология. 2015; 484: 288–304.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Линдберг AM, Stålhandske POK, Петтерссон У. Геном вируса Коксаки B3. Вирусология. 1987. 156 (1): 50–63.
CAS
Статья
Google Scholar
Ли СиДжей, Хуанг Ю.К., Ян С., Цао К.С., Чен СиДжей, Се Ю.С., Чиу СН, Лин Т.Ю. Клинические особенности инфекций, вызванных вирусом Коксаки A4, B3 и B4, у детей. PLoS One. 2014; 9 (2): e87391.
Артикул
PubMed
PubMed Central
Google Scholar
Chu P, Ke G, Chen Y, Lu P, Chen H, Lee M, Chen B, Huang T, Li Y, Chou L и др. Молекулярная эпидемиология вируса Коксаки B3. Заразить Genet Evol. 2010. 10 (6): 777–84.
CAS
Статья
Google Scholar
Wu Z, Du J, Zhang T, Xue Y, Yang F, Jin Q. Рекомбинантный человеческий вирус Коксаки B3 от детей с острым миокардитом в Китае. J Clin Microbiol. 2013. 51 (9): 3083–6.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Гао Ф., Бянь Л., Мао К., Чен П., Яо Х, Ли Дж., Чжу Ф., Лян З. Эпидемия инфекции, вызванной вирусом Коксаки B3, у младенцев и детей в провинции Цзянсу, Китай: проспективное когортное исследование. Arch Virol. 2016; 161 (7): 1945–7.
CAS
Статья
Google Scholar
Tao Z, Li B, Xu A, Liu Y, Song L, Wang S, Xiong P, Lin X, Song Y. Распространенность вируса Коксаки B3 в Яньтае, Китай. Jpn J Infect Dis. 2013. 66 (6): 537–8.
Артикул
Google Scholar
Читамбар SD, Ерголкар П., Лакшмивандана Р., Чериан СС. Геномная характеристика штаммов вируса Коксаки типа B3, ассоциированных с острым вялым параличом в Юго-Западной Индии. J Gen Virol. 2016; 97 (3): 694–705.
Артикул
Google Scholar
Calderón KI, Díaz-de Cerio M, Otero A, Muñoz-Almagro C, Rabella N, Martínez-Rienda I, Moreno-Docón A, Trallero G, Cabrerizo M. Молекулярная эпидемиология инфекции, вызванной вирусом Коксаки В3 в Испании , 2004-2014 гг.Arch Virol. 2016; 161 (5): 1365–70.
Артикул
Google Scholar
Хецуриани Н., Ламонте-Фаулкс А., Оберст С., Палланш М.А. Эпиднадзор за энтеровирусами — США, 1970-2005 гг. MMWR Surveill Summ. 2006; 55 (8): 1–20.
Google Scholar
Антона Д., Левек Н., Чомель Дж. Дж., Дуброу С., Леви-Брюль Д., Лина Б. Эпиднадзор за энтеровирусами во Франции, 2000–2004 гг.Eur J Clin Microbiol. 2007. 26 (6): 403–12.
CAS
Статья
Google Scholar
Рот Б., Эндерс М., Аренц А., Пфицнер А., Терлецкая-Ладвиг Э. Эпидемиологические аспекты и лабораторные особенности энтеровирусных инфекций в Западной Германии, 2000–2005 гг. J Med Virol. 2007. 79 (7): 956–62.
Артикул
Google Scholar
Wong AH, Lau CS, Cheng PKC, Ng AYY, Lim WWL.Асептический менингит, связанный с вирусом Коксаки B3: возникающая инфекция в Гонконге. J Med Virol. 2011; 83 (3): 483–9.
Артикул
Google Scholar
Zhang Y, Tan X, Cui A, Mao N, Xu S, Zhu Z, Zhou J, Shi J, Zhao Y, Wang X и др. Полный анализ генома штаммов субгенотипа C4 энтеровируса 71: преобладающие рекомбинационные вирусы C4, устойчиво циркулирующие в Китае в течение 14 лет. PLoS One. 2013; 8 (2): e56341.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Zhang Y, Wang D, Yan D, Zhu S, Liu J, Wang H, Zhao S, Yu D, Nan L, An J и др. Молекулярные доказательства стойкой эпидемии и эволюции заболевания рук, ног и рта, ассоциированного с вирусом Коксаки под генотипом B1 A16, в Китае. J Clin Microbiol. 2010. 48 (2): 619–22.
CAS
Статья
Google Scholar
Сон Й, Чжан И, Цзи Т, Гу X, Ян Цюй, Чжу С, Сюй В, Сюй И, Ши И, Хуанг Х и др. Устойчивая циркуляция вируса Коксаки А6 генотипа D3 на материковой части Китая в период с 2008 по 2015 гг.Научный доклад 2017; 7 (1): 5491.
Артикул
PubMed
PubMed Central
Google Scholar
Mizuta K, Abiko C, Murata T., Matsuzaki Y, Itagaki T., Sanjoh K, Sakamoto M, Hongo S., Murayama S., Hayasaka K. Частый завоз энтеровируса 71 из соседних стран в местное сообщество Ямагата , Япония, между 1998 и 2003 гг. J Clin Microbiol. 2005. 43 (12): 6171–5.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ding X, Nie K, Shi L, Zhang Y, Guan L, Zhang D, Qi S, Ma X. Улучшенный предел обнаружения при быстром обнаружении человеческого энтеровируса 71 и вируса Коксаки А16 с помощью нового изотермического множественного самосопоставления с обратной транскрипцией — инициированный анализ амплификации. J Clin Microbiol. 2014; 52 (6): 1862–70.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Пуэнпа Дж., Вонгпунсавад С., Остербак Р., Варис М., Эрикссон Э, Альберт Дж., Мидгли С., Фишер Т.К., Эйс-Хюбингер А.М., Кабреризо М. и др.Молекулярная эпидемиология и эволюция вируса Коксаки человека A6. J Gen Virol. 2016. 97 (12): 3225–31.
CAS
Статья
Google Scholar
Wu Y, Yeo A, Phoon MC, Tan EL, Poh CL, Quak SH, Chow VT. Самая крупная вспышка руки; ящур в Сингапуре в 2008 г .: роль штаммов энтеровируса 71 и вируса Коксаки А. Int J Infect Dis. 2010; 14 (12): e1076–81.
Артикул
Google Scholar
Mirand A, le Sage FV, Pereira B, Cohen R, Levy C, Archimbaud C, Peigue-Lafeuille H, Bailly J, Henquell C. Амбулаторный педиатрический надзор за заболеваниями рук, ящура и рта как сигнал о вспышке инфекций, вызванных вирусом Коксаки А6 , Франция, 2014–2015 гг. Emerg Infect Dis. 2016; 22 (11): 1884–93.
Артикул
PubMed
PubMed Central
Google Scholar
Anh NT, Nhu LNT, Van HMT, Hong NTT, Thanh TT, Hang VTT, Ny NTH, Nguyet LA, Phuong TTL, Nhan LNT и др.Новый вирус Коксаки А6, вызывающий болезнь рук, ящура и рта, Вьетнам. Emerg Infect Dis. 2018; 24 (4): 654–62.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tian H, Zhang Y, Sun Q, Zhu S, Li X, Pan Z, Xu W., Xu B. Распространенность множественных энтеровирусов, связанных с болезнями рук, ног и рта в городе Шицзячжуан, провинция Хэбэй, Китай: вспышки вирусов Коксаки a10 и b3. PLoS One. 2014; 9 (1): e84233.
Артикул
PubMed
PubMed Central
Google Scholar
Оберсте М.С., Махер К., Уильямс А.Дж., Дибдаль-Сиссоко Н., Браун Б.А., Гукин М.С., Пенаранда С., Мишрик Н., Уддин М., Палланш М.А. Видоспецифическая RT-ПЦР-амплификация энтеровирусов человека: инструмент для быстрой видовой идентификации не охарактеризованных энтеровирусов. J Gen Virol. 2006; 87 (Pt 1: 119–28.
CAS
Статья
Google Scholar
Кронеман А., Веннема Х, Дефорче К., В. ДАХ, Пенаранда С., Оберсте М.С., Винье Дж., Купманс М. Инструмент автоматического генотипирования энтеровирусов и норовирусов. J Clin Virol. 2011. 51 (2): 121–5.
CAS
Статья
Google Scholar
Кумар С., Стечер Г., Тамура К. MEGA7: молекулярно-эволюционный генетический анализ версии 7.0 для больших наборов данных. Mol Biol Evol. 2016; 33 (7): 1870–4.
CAS
Статья
PubMed
Google Scholar
Nguyen L, Schmidt HA, von Haeseler A, Minh BQ. IQ-TREE: быстрый и эффективный стохастический алгоритм для оценки филогении максимального правдоподобия. Mol Biol Evol. 2015; 32 (1): 268–74.
CAS
Статья
Google Scholar
Каляанамурти С., Минь Б.К., Вонг ТКФ, фон Хезелер А., Джермейн Л.С. ModelFinder: быстрый выбор модели для точных филогенетических оценок. Нат методы. 2017; 14 (6): 587–9.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Драммонд AJ, Suchard MA, Xie D, Rambaut A. Байесовская филогенетика с BEAUti and the BEAST 1.7. Mol Biol Evol. 2012; 29 (8): 1969–73.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Darriba D, Taboada GL, Doallo R, Posada D. jModelTest 2: больше моделей, новая эвристика и параллельные вычисления. Нат методы. 2012; 9 (8): 772.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ronquist F, Teslenko M, van der Mark P, Ayres DL, Darling A, Höhna S, Larget B, Liu L, Suchard MA, Huelsenbeck JP. MrBayes 3.2: эффективный байесовский филогенетический вывод и выбор модели в большом модельном пространстве. Syst Biol. 2012. 61 (3): 539–42.
Артикул
PubMed
PubMed Central
Google Scholar
Стаматакис А. RAxML версия 8: инструмент для филогенетического анализа и постанализа крупных филогений. Биоинформатика.2014; 30 (9): 1312–3.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Рамбаут А., Драммонд А.Дж., Се Д., Баэле Г., Сушард М.А. Апостериорное обобщение в байесовской филогенетике с использованием индикатора 1.7. Syst Biol. 2018; 67 (5): 901–4.
Артикул
PubMed
PubMed Central
Google Scholar
Rieux A, Khatchikian CE. TipDatingBeast: пакет R для помощи в реализации филогенетических тестов датировки подсказок с использованием beast.Мол Экол Ресур. 2017; 17 (4): 608–13.
CAS
Статья
Google Scholar
Pybus OG. Эпидемиология и ятрогенная передача вируса гепатита С в Египте: объединяющий байесовский подход. Mol Biol Evol. 2003. 20 (3): 381–7.
CAS
Статья
Google Scholar
Паркер Дж., Рамбаут А, Пибус О.Г. Корреляция вирусных фенотипов с филогенезом: учет филогенетической неопределенности.Заразить Genet Evol. 2008. 8 (3): 239–46.
CAS
Статья
Google Scholar
Ян З. PAML 4: филогенетический анализ методом максимального правдоподобия. Mol Biol Evol. 2007. 24 (8): 1586–91.
CAS
Статья
Google Scholar
Косаковский пруд С.Л., Мороз ТБО. В конце концов, не такая уж и большая разница: сравнение методов определения выбранных аминокислотных сайтов.Mol Biol Evol. 2005. 22 (5): 1208–22.
Артикул
Google Scholar
Муррелл Б., Вертхайм Дж.О., Мула С., Вейгхилл Т., Шеффлер К., Косаковский пруд С.Л. Выявление отдельных сайтов, подлежащих эпизодическому диверсификационному отбору. PLoS Genet. 2012; 8 (7): e1002764.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tao Z, Song Y, Li Y, Liu Y, Jiang P, Lin X, Liu G, Song L, Wang H, Xu A.Coxsackievirus B3, провинция Шаньдун, Китай, 1990–2010 гг. Emerg Infect Dis. 2012. 18 (11): 1865–7.
Артикул
PubMed
PubMed Central
Google Scholar
Хуанг Ю., Лин Т., Чен Й, Хсу Ц, Лин Т., Ву Х. Филогенетический анализ и разработка иммунофлуоресцентного анализа для нетипируемых штаммов вируса Коксаки В3. J Microbiol Immunol Infect. 2014. 47 (6): 447–54.
CAS
Статья
Google Scholar
Takahashi S, Liao Q, Van Boeckel TP, Xing W, Sun J, Hsiao VY, Metcalf CJE, Chang Z, Liu F, Zhang J, et al. Болезни рук, ящура и рта в Китае: моделирование эпидемической динамики серотипов энтеровирусов и последствия для вакцинации. PLoS Med. 2016; 13 (2): e1001958.
Артикул
PubMed
PubMed Central
Google Scholar
Хуанг Дж., Ляо Кью, Оои М.Х., Каулинг Б.Дж., Чанг З., Ву П, Лю Ф, Ли И, Луо Л., Ю С. и др. Эпидемиология рецидивов болезней рук, ящура, Китай, 2008–2015 гг.Emerg Infect Dis. 2018; 24 (3): 432–42
Чжан Ю., Чжу З., Ян В., Рен Дж, Тан X, Ван И, Мао Н., Сюй С., Чжу С., Цуй А. и др. Возникающий рекомбинантный энтеровирус человека 71 стал причиной вспышки ящура рук в 2008 году в городе Фуян, Китай. Вирол Дж. 2010; 7: 94.
Артикул
PubMed
PubMed Central
Google Scholar
Chen SP, Huang YC, Li WC, Chiu CH, Huang CG, Tsao KC, Lin TY.Сравнение клинических характеристик вируса Коксаки А2 и энтеровируса 71 во время вспышки энтеровируса на Тайване, 2008 г .: опыт детской больницы. J Microbiol Immunol Infect. 2010. 43 (2): 99–104.
Артикул
Google Scholar
Не К., Чжан И, Ло Л, Ян MJ, Ху XM, Ван М, Чжу С.Л., Хан Ф, Сюй ВБ, Ма XJ. Визуальное обнаружение субгенотипа С4 энтеровируса 71 человека и вируса Коксаки А16 с помощью изотермической амплификации, опосредованной обратной транскрипцией, с красителем гидроксинафтоловым синим.J Virol Methods. 2011; 175 (2): 283–6.
CAS
Статья
Google Scholar
Хуанг Ю.П., Линь Т.Л., Линь ТХ, Ву ХС. Антигенное и генетическое разнообразие энтеровируса человека 71 с 2009 по 2012 год, Тайвань. PLoS One. 2013; 8 (11): e80942.
Артикул
PubMed
PubMed Central
Google Scholar
Ху YF, Ян Ф, Du J, Dong J, Zhang T, Wu ZQ, Xue Y, Jin Q.Полный анализ генома штаммов вируса Коксаки A2, A4, A5 и A10, выделенных у пациентов с заболеваниями рук, ног и рта в Китае, выявил частую рекомбинацию энтеровируса человека a. J Clin Microbiol. 2011. 49 (7): 2426–34.
CAS
Статья
PubMed
PubMed Central
Google Scholar
Толен И., Лемей П., Ван дер Донк И., Бойзелинк К., Линдберг А.М., Ван Ранст М. Молекулярное типирование и эпидемиология энтеровирусов, выявленных в результате вспышки асептического менингита в Бельгии летом 2000 года.J Med Virol. 2003. 70 (3): 420–9.
CAS
Статья
Google Scholar
Lee ST, Ki CS, Lee NY. Молекулярная характеристика энтеровирусов, выделенных от пациентов с асептическим менингитом в Корее, 2005 г. Arch Virol. 2007. 152 (5): 963–70.
CAS
Статья
Google Scholar
Harvala H, Broberg E, Benschop K, Berginc N, Ladhani S, Susi P, Christiansen C., McKenna J, Allen D, Makiello P, et al.Рекомендации по диагностике и характеристике энтеровирусов в Европе и за ее пределами. J Clin Virol. 2018; 101: 11–7.
CAS
Статья
Google Scholar
Гао ГФ. От «а» IV до «Z» IKV: атаки возникающих и повторно появляющихся патогенов. Клетка. 2018; 172 (6): 1157–9.
CAS
Статья
Google Scholar
Число случаев заболевания HFMD среди взрослых в США растет
Недавняя заболеваемость болезнями рук, ног и рта (HFMD) у американских бейсболистов катапультировала это заболевание — обычно редкое среди взрослых — в массовое сознание.Заболевание, проявляющееся поражениями на руках и ногах, а также вокруг рта, обычно не приводит к летальному исходу и проходит в течение недели. В то время как инфекционная HFMD чаще встречается у детей, наблюдается рост числа людей всех возрастов, что делает осведомленность о распознавании, диагностике и лечении обязательной необходимостью для обеспечения надлежащей помощи среди населения, которое редко лечится от этого состояния.
Взрослый HFMD: этиология и диагностика
Вирус Коксаки из семейства Enterovirus является основным причинным компонентом HFMD, при этом вирус Коксаки A16 и энтеровирус A71 являются основными серотипами, связанными с этим заболеванием.Вспышки обычно происходят в детских садах, летних лагерях и в семьях, а летом и ранней осенью, как правило, возникают эти вспышки. Члены семьи, независимо от возраста, подвергаются более высокому риску развития HFMD, если они постоянно находятся в тесном контакте с больными детьми, поскольку болезнь выделяется в стуле в течение нескольких недель. Одно исследование показало, что совместное использование мобильных устройств может также увеличить вероятность заражения взрослых вирусом HFMD.
Диагноз HFMD часто можно сделать путем анализа образцов кала или взятия мазков из ротоглотки на наличие вируса.Обычно вирус, вызывающий HFMD, имеет инкубационный период от 4 до 6 дней, за которым быстро следуют такие симптомы, как ангина с пузырьками, лихорадка, недомогание и пузырьки на руках. В течение первой недели пациенты наиболее заразны; однако многие пациенты остаются заразными в течение 4-8 недель после появления симптомов из-за остаточного выделения стула. Хотя осложнения (например, вирусный менингит и энцефалит), связанные с этим заболеванием, встречаются нечасто, иногда происходит временная потеря ногтей на руках и ногах.Ногти снова отрастут в течение нескольких недель после того, как болезнь закончится.
Лечение для взрослых HFMD
Хотя симптомы HFMD вызывают дискомфорт и могут привести к пропущенным дням работы и ограничению социального взаимодействия, болезнь обычно протекает в легкой форме и проходит в течение 7-10 дней. У детей и взрослых нет известных эффективных методов лечения HFMD. Поддерживающее лечение или общее лечение симптомов является основным подходом к лечению этого состояния.Ацетаминофен и нестероидные противовоспалительные препараты могут быть включены в поддерживающую терапию для снятия боли и лихорадки. Жидкая смесь комбинации ибупрофена и дифенгидрамина также может использоваться для лечения язвенной боли в горле путем обычного полоскания горла.
Кроме того, некоторые лекарственные препараты, не указанные по назначению, в том числе амантадин, рибавирин и хинакрин, были названы полезными дополнительными средствами лечения тяжелой HFMD, вызванной энтеровирусом 71. В некоторых тяжелых случаях HFMD у взрослых может потребоваться искусственная вентиляция легких.Исследователи сосредоточили усилия на разработке специфических методов лечения HFMD, вызванного энтеровирусом 71 из-за его влияния на неврологическую функцию; Однако ни одно лечение не было одобрено для использования. Антагонисты рецепторов, ингибиторы трансляции, молекулярные ловушки и ингибиторы репликации представляют собой новые варианты лечения, которые могут иметь потенциал для будущего лечения HFMD. Кроме того, в настоящее время проводятся исследования по оценке ценности плеконарила для лечения HFMD, вызванного энтеровирусом 71.
Домой
Из-за высокой распространенности HFMD у младенцев и детей многие клиницисты хорошо разбираются в лечении этого заболевания в педиатрической популяции.Тем не менее, поскольку HFMD поражает все больше взрослых, многие врачи могут не полностью осознавать, как выявлять и / или вести таких пациентов из-за отсутствия информации о подходах взрослых. К счастью, многие стратегии диагностики и лечения педиатрической HFMD распространяются на взрослых пациентов. Управление симптомами может быть наиболее оптимальной стратегией лечения, особенно в большинстве случаев легкой формы HFMD, для облегчения боли при язве и лихорадки. Однако необходимы дальнейшие исследования для разработки методов лечения взрослых с тяжелой формой HFMD.
Энтеровирусы, включая полиовирус, эховирус, вирус Коксаки
ОБЗОР: Что нужно знать каждому врачу
Название и классификация возбудителя
Энтеровирусы — это роды в семействе Picornaviridae. У них одноцепочечный геном РНК. Каждый капсид состоит из 60 субъединиц, образованных из четырех структурных белков (V1-V4), и имеет размер 27 нм. Энтеровирусы делятся на 5 видов (полиовирусы и энтеровирусы человека A, B, C, D) на основе гомологии генома, который кодирует белок капсида V1.Неполиомиелитные энтеровирусы включают реклассифицированные, как указано выше, вирусы Коксаки группы A и группы B, эховирусы и энтеровирусы.
Какое лечение лучше всего?
Большинство энтеровирусных инфекций проходят самостоятельно и не требуют лечения.
Полиовирус также лечится с помощью поддерживающих мер, включая обезболивание, искусственную вентиляцию легких и интубацию, если это необходимо.
Продолжить чтение
При тяжелом стоматите контроль боли, контроль гидратации и статуса питания являются ключевыми, особенно у детей раннего возраста
Клиницисты могут стремиться обеспечить лечение серьезных энтеровирусных инфекций, таких как миокардит и острый менингит, но клинических исследований для руководства этими стратегиями нет.
И сывороточный иммунный глобулин, и внутривенный иммунный глобулин (ВВИГ) использовались у детей и взрослых с миокардитом или персистирующим менингоэнцефалитом, но нет никаких проспективных данных для оценки этих стратегий, а имеющиеся данные об их эффективности неоднозначны.
Существуют противоречивые данные о том, что пероральный противовирусный препарат плеконарил может иметь некоторую пользу при серьезных энтеровирусных инфекциях, однако в настоящее время этот препарат недоступен или не рекомендован для клинического использования.
Нет никаких серьезных проблем с противовирусной устойчивостью.
Как пациенты заражаются этой инфекцией и как предотвратить ее распространение среди других пациентов?
Эпидемиология:
В умеренном климате энтеровирусные инфекции наиболее высоки летом и осенью, однако инфекции могут возникать круглый год.
Однако общая картина широко варьируется в зависимости от конкретного вируса. Некоторые эховирусы присутствуют, например, круглый год, в то время как другие серотипы (эховирусы 9, 11, 70 и другие) вызывают периодические эпидемии, когда в популяции достаточно восприимчивых людей.
Энтеровирусы в основном передаются оральным путем с фекалиями, и младенцы особенно сильно выделяют стул; при смене подгузников может произойти прямой контакт. Передача также может происходить через загрязненную воду и фомиты.
Некоторые энтеровирусы могут также передаваться напрямую или через фомиты через респираторные выделения и слезы.
Полиовирус передается через оральные фекалии или, реже, через глотку. Девяносто процентов инфекций протекают бессимптомно.
Энтеровирусные инфекции широко распространены во всем мире.
В частности, полиовирус был в значительной степени искоренен в результате всемирной согласованной кампании вакцинации. В период с 1998 по 2003 год заболеваемость острым вялым параличом, вызванным вирусом, снизилась на 99%.
Эндемичная передача никогда не прерывалась в Нигерии, Индии, Афганистане и Пакистане и повторялась в нескольких странах, включая Судан, Чад, Конго, Анголу, Таджикистан и Россию.
После резкого снижения заболеваемости острым вялым параличом, вызванным полиовирусом, заболеваемость снова растет в некоторых странах из-за неполного охвата вакцинами, миграции и ограниченности систем общественного здравоохранения.
Было проведено несколько исследований, показывающих связь между энтеровирусными инфекциями и диабетом 1 типа, но убедительных доказательств того, что существует причинный путь, нет.
Вопросы инфекционного контроля:
Контактные меры предосторожности важны для уменьшения фекально-орального распространения энтеровирусов, включая полиовирус. Также важно поддерживать гигиену среды обитания и воды.
Вакцинация — самый эффективный способ предотвратить острый вялый паралич, вызванный полиовирусом.
Не существует эффективной профилактики вирусов до или после контакта.
Какие факторы хозяина защищают от этой инфекции?
Ответ интактных антител хозяина является защитным фактором против инфекции, в частности IgA в секретах слизистой оболочки.
Клеточный иммунитет может фактически усилить воспаление и, таким образом, усугубить клинические последствия, такие как миокардит, без излечения инфекции.
Новорожденные восприимчивы к молниеносным инфекциям (особенно с серотипами 2-5 вируса Коксаки группы B и эховирусом 11), как и взрослые с нарушениями функции B-лимфоцитов, такими как общий вариабельный иммунодефицит.
Люди, контактирующие с инфицированным человеком, подвергаются высокому риску заражения. В частности, лица, ухаживающие за младенцами, меняющими подгузники, имеют высокую вероятность фекального заражения полости рта.
Младенцы в возрасте до одного года имеют один из самых высоких показателей заболеваемости инфекцией в целом.
Мужчины имеют больший риск заражения, чем женщины.
Патогенез полиовирусов лучше всего изучен среди энтеровирусов на животных моделях.После первичного проглатывания вируса возникает сначала незначительная, а затем серьезная системная виремия, симптомы которой проявляются у меньшинства пациентов. Это позволяет вирусу перемещаться в ЦНС и реплицироваться в ней, что приводит к гибели мотонейронов переднего рога спинного мозга. Неизвестно, является ли это распространение гематогенным или через ретроградный аксональный транспорт. Также может возникнуть инфекция нейронов ствола головного мозга, что приведет к энцефалиту.
Каковы клинические проявления заражения этим организмом?
Полиомиелит обычно вызывает острый вялый паралич как его наиболее тяжелое клиническое проявление.
Первичное попадание вируса в организм приводит к репликации в глотке и тонком кишечнике.
Затем возникает «незначительная» виремия, которая позволяет вирусу распространяться в лимфоидную ткань по всему телу, а затем менее чем у 10% людей возникает «большая» виремия с лихорадкой, недомоганием, усталостью, тошнотой, рвотой и симптомами со стороны ЦНС 8 -12 дней после заражения.
Затем следует асимметричная мышечная слабость, распределение которой зависит от степени инфекции.
Ноги поражаются чаще, чем руки, и чаще поражаются проксимальные, чем дистальные мышцы.
Рефлексы отсутствуют или ослаблены, но ощущения в норме.
В некоторых случаях может развиться энцефалит или дыхательная недостаточность.
Симптомами неполиомиелитных энтеровирусов могут быть неспецифические вирусные экзантемы.
Вирусы Коксаки группы А вызывают у детей синдром кисти, стопы и рта, который вызывает лихорадку, образование пузырьков на слизистой оболочке щеки и языка и, особенно, болезненные поражения кожи на периферических руках и ногах.Симптомы обычно проходят в течение недели без последствий, но инфицированные дети могут продолжать выделять вирус со стулом в течение нескольких недель.
Другие кожные проявления включают пурпурную или петехиальную сыпь, а также герпангины, пузырьки миндалин и неба, вызываемые вирусами Коксаки А и встречающиеся в основном у детей.
Проявления со стороны ЦНС (помимо острого вялого паралича полиовируса, описанного выше) включают асептический менингит и энцефалит.Энтеровирус 71 также редко может вызывать острый вялый паралич, подобный полиовирусу, но обычно не постоянный.
Другие синдромы включают миокардит или перикардит и плевродинию (острое заболевание с болью в грудной стенке и лихорадкой). Все они тесно связаны с вирусами Коксаки группы B
.
В США в 2014 г. энтеровирус D68 был связан со всплеском респираторных инфекций у детей, включая тяжелые заболевания. Многие из серьезно пострадавших детей в анамнезе страдали астмой или одышкой.
Какие общие осложнения связаны с инфицированием этим возбудителем?
У беременных женщин без иммунитета перинатальные заболевания на поздних сроках беременности, вызванные энтеровирусами, редко могут приводить к фульминантной неонатальной инфекции в послеродовом периоде.
В редких случаях вакцинация живой оральной полиомиелитной вакциной (ОПВ) может привести к вакцино-ассоциированному полиомиелиту у вакцинированного лица или контакта (вакциноассоциированный полиомиелит).Это происходит только в 1 из 2,5 миллиона случаев вакцинации. Также были задокументированы вспышки полиомиелита со штаммами, обнаруженными в пероральной вакцине (полиомиелит вакцинного происхождения). Существует также неактивная вакцина против полиомиелита (ИПВ), не связанная с этими побочными эффектами.
Выше отмечены осложнения полиовирусной инфекции. Еще одно осложнение — постполиомиелитный синдром, при котором слабость внезапно усиливается через много лет или даже десятилетий после первоначального заболевания.Это может сопровождаться болями и общей утомляемостью.
Лечение постполиомиелитного синдрома является поддерживающим, с контролем боли и регулярными, но не требующими больших усилий режимом физических упражнений или физиотерапии.
У некоторых детей энтеровирус D68 был связан с острым параличом, подобным полиомиелиту.
Как идентифицировать организм?
Мазки из стула или ректальные мазки — самый высокий результат для энтеровирусов.Также можно использовать мазки из горла, сыворотку или мочу или спинномозговую жидкость (CSF).
Культивирование вирусных клеток является трудоемким процессом, требует инокуляции нескольких клеточных линий и поиска цитопатического эффекта. Преимущество этого метода заключается в том, что изолят доступен для дальнейшего типирования и определения характеристик.
Полимеразная цепная реакция (ПЦР) доступна и широко используется, особенно для образцов спинномозговой жидкости, где она имеет повышенную чувствительность по сравнению с культурой клеток.Другие образцы, которые можно использовать, — это респираторные и сывороточные образцы. Как правило, невозможно определить серотип энтеровируса с помощью ПЦР, хотя специальные тесты на энтеровирус D68 доступны в CDC.
Серологический анализ с использованием типоспецифичных иммуноанализов можно использовать для сывороток в острой стадии и в период выздоровления (собранных во время острого заболевания, а затем через 3-4 недели). Поскольку это отдельные тесты для каждого серотипа, они могут иметь ограниченную полезность при определении причины острого заболевания.
Относительные преимущества и недостатки каждого метода могут быть дополнительно обсуждены с лаборантом или консультантом по инфекционным заболеваниям.
Как этот организм вызывает болезнь?
КАКИЕ ДОКАЗАТЕЛЬСТВА для конкретных рекомендаций по ведению и лечению?
Неполиомиелитный энтеровирус
Фостер, CB, Фридман, Н., Карл, Дж., Пьедимонте, Г. «Энтеровирус D68: клинически важный респираторный энтеровирус». Cleve Clin J Med. об. 82. 2015 Январь. С. 26–31. (Предоставляет обзор эпидемиологии и клинических особенностей, связанных со вспышкой в США в 2014 г.)
Ooi, MH, Wong, SC, Lewthwaite, P, Cardosa, MJ, Solomon, T. «Клинические особенности, диагностика и лечение энтеровируса 71». Lancet Neurol. об. 9. Ноябрь 2010. С. 1097-105. (Хороший обзор многих аспектов энтеровирусных инфекций.)
Dennert, R, Crijns, HJ, Heymans, S. «Острый вирусный миокардит». Eur Heart J. vol.29. 2008 Сентябрь, стр. 2073–82. (Описывает особенности этого состояния.)
Полиомиелит
Минор, ПД. «Программа ликвидации полиомиелита и вопросы конца игры». J Gen Virol. об. 93. 2012 Март. С. 457–74. (Краткое изложение материально-технических и этических проблем, с которыми сталкиваются в настоящее время усилия по ликвидации полиомиелита во всем мире.)
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.


