Самый беззащитный пациент (проблемы недоношенных детей)
Природа установила человеку срок вынашивания ребенка около 280 дней. Допустимы индивидуальные колебания продолжительности нормальной беременности от 258 до 294 дней. Недоношенным считается ребенок от 22 до неполных 37 недель. Частота преждевременных родов составляет 5-12% для развитых стран и 4,5% в Республике Беларусь. Причины преждевременного появления на свет разнообразны: патологическое (нетипичное) течение беременности, предшествующие аборты, болезни, физическая и психическая травмы, в том числе отравление никотином и алкоголем, гормональные нарушения, почечная и сердечная патологии, воспаления половых органов.
Как выглядит недоношенный ребенок?
Внешне недоношенный ребенок очень отличается от ребенка, рожденного в срок. Подкожно-жировая клетчатка выражена очень слабо или совсем отсутствует, склонна к отеку. Кожа истончена, морщинистая, обильно покрыта густым пушком на лице, спине и конечностях. Голова непропорционально большая относительно размеров туловища, швы между костями черепа и малый родничок открыты (между костями черепа и в области малого родничка имеются участки, не закрытые костной тканью). Ушные раковины мягкие, ногтевые пластинки тонкие, не доходят до кончиков пальцев. Яички не опущены в мошонку, половая щель зияет. Пуповина у таких детей отпадает позже, чем у доношенных, и пупочная ранка заживает к седьмому-десятому дню жизни.
В целом, детский организм нельзя рассматривать как огранизм взрослого в миниатюре, а организм недоношенного и подавно. Учитывая незрелость всех органов и систем (центральной нервной, сердечно-сосудистой, дыхательной, пищеварительной), неблагоприятные воздействия переносятся недоношенными детьми особенно остро. Недоношенные дети в силу незрелости всех систем жизнеобеспечения, подвержены заболеваниям, которые чаще всего приводят к серьезным проблемам со здоровьем и носят название — инвалидизирующие заболевания. Даст ли каждая из этих болезней о себе знать, в какой форме она себя проявит, сможет ли ребенок догнать своих здоровых сверстников по развитию — это очень сложные вопросы, которые прояснятся сами собой по мере взросления ребенка.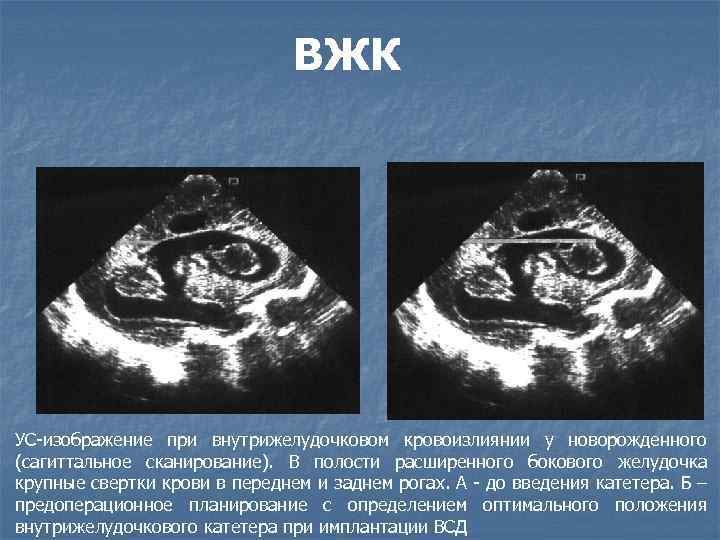
Бронхолегочная дисплазия — это заболевание бывает только у недоношенных из-за того, что на незрелые легкие воздействуют различные патологические факторы. Одними из них становятся кислород и искусственная вентиляция легких. Вот такой парадокс: кислород в высокой концентрации и искусственная вентиляция легких проводятся во спасение ребенка, помогают ему выжить и в то же время в ряде случаев поражают его легкие, приводя к серьезному хроническому заболеванию. Поражаются бронхиолы и сама легочная ткань, развивается эмфизема и фиброз. Ставится такой диагноз недоношенному ребенку, если по истечении 28 суток со дня рождения у него остается зависимость в кислороде. Могут появиться: одышка, бронхообструкция и другие признаки дыхательной недостаточности. При нетяжелом поражении возможно полное восстановление легочной ткани. Но у ряда детей остаются стойкие нарушения приводящие к развитию хронических болезней, таких как хронический бронхит, рецидивирующие обструкции и др.
Ретинопатия недоношенных— патологические изменения сетчатки у детей, родившихся раньше срока. Именно ретинопатия занимает одну из лидирующих позиций среди причин детской слепоты в развитых странах. Это не обязательно приводит к слепоте, так как болезнь протекает в несколько стадий и фаз. Если удастся остановить патологический процесс на ранних стадиях, то есть шанс сохранить зрение у малыша на нормальном уровне. Если же болезнь будет прогрессировать до полной или частичной отслойки сетчатки, то ребенок может значительно потерять зрение вплоть до полной слепоты. Но даже такая стадия болезни — не является «приговором», потому что есть шанс вернуть ребенку зрение путем хирургического лечения.
Внутрижелудочковые кровоизлияния в мозг могут быть разной степени, что отражает тяжесть процесса. Чем меньше срок гестации, на котором родился кроха, тем выше риск возникновения тяжелых степеней ВЖК. Чем выше степень кровоизлияния, тем меньше шансов у ребенка полностью выздороветь. Одним из грозных осложнений ВЖК является формирование гидроцефалии, то есть, водянки головного мозга, когда формируется препятствие для оттока спинно-мозговой жидкости из желудочков мозга. Это бывает после любой степени ВЖК, но чаще после самых тяжелых 3 или 4 степени. 4 степень еще характеризуется кровоизлиянием в саму ткань головного мозга, что также грозит тяжелыми неврологическими последствиями( судорожный синдром, детский церебральный паралич). Врачи, выхаживающие недоношенных, делают все возможное,но на данный момент невозможно полностью предотвратить этот процесс.
Одним из грозных осложнений ВЖК является формирование гидроцефалии, то есть, водянки головного мозга, когда формируется препятствие для оттока спинно-мозговой жидкости из желудочков мозга. Это бывает после любой степени ВЖК, но чаще после самых тяжелых 3 или 4 степени. 4 степень еще характеризуется кровоизлиянием в саму ткань головного мозга, что также грозит тяжелыми неврологическими последствиями( судорожный синдром, детский церебральный паралич). Врачи, выхаживающие недоношенных, делают все возможное,но на данный момент невозможно полностью предотвратить этот процесс.
Перивентрикулярная лейкомаляция— необратимые изменения белого вещества головного мозга, которое прилежит к его боковым желудочкам. То есть, происходит гибель нейронов, размягчение белого вещества с последующим образованием кист на этом месте. Иногда перивенкрикулярная лейкомаляция (ПВЛ) распространяется на всю толщу белого вещества, но это бывает нечасто. Характер неврологических нарушений будет зависеть от того, какие именно нейроны пострадали. То есть, у одного ребенка ПВЛ проявится лишь расстройствами зрения, а у другого тяжелым спастическим параличом. К сожалению, полностью вылечить ребенка от наступивших заболеваний вследствие ПВЛ невозможно. Но и родителям, и врачам придется приложить немало усилий, чтобы реабилитировать ребенка, насколько это возможно.
Выше была перечислена лишь малая часть того, что может случиться с ребенком, родившимся раньше срока. Почему именно такие крохи столь серьезно страдают? Во-первых, сказывается незрелость органов и тканей, которая тем более выражена, чем меньше срок гестации. Во-вторых, сказываются патологические факторы,влияющие на ребенка, такие как: инфекционный процесс; сопутствующая родовая травма; длительная искусственная вентиляция легких с высокими концентрациями кислорода; гормональные нарушения; гипоксия, начавшаяся внутриутробно или возникшая в родах; лекарственное влияние; влияние сопутствующих болезней и пороков развития; уровень профессионализма медицинского персонала; условия выхаживания ребенка и другие факторы.
Самым эффективным мероприятием по борьбе с инвалидизирующими болезнями недоношенных является профилактика самой недоношенности. Как именно? Совсем несложно: не вести беспорядочную половую жизнь; регулярно проверяться на половые инфекции; использовать адекватные методы контрацепции (в том числе, барьерные; отказаться как можно раньше от вредных привычек; правильно питаться, достаточно спать, заниматься физкультурой, гулять; регулярно проходить медицинские осмотры, особенно лицам с хроническими болезнями; готовиться к беременности заранее; заниматься половым воспитанием своих детей.
Казалось бы, эти прописные истины не нуждаются в том, чтобы о них вообще говорить и напоминать, но так сложно встретить в настоящее время пару, которая соблюдает все то, что перечислено выше. А это очень важно: в борьбе с любой проблемой нужно начать именно с себя.
%PDF-1.6
%
1 0 obj
>
endobj
4 0 obj
/ModDate (D:20160628092933+03’00’)
/Subject
>>
endobj
2 0 obj
>
stream
application/pdf
Библиотека УО «ВГМУ»2016-06-28T09:29:33+03:002016-06-28T09:29:33+03:002016-06-28T09:29:33+03:00uuid:031b9de0-2a1f-4174-9f35-21e687c3fd51uuid:8b194579-61eb-4a9b-887c-4c4270aabc5d
endstream
endobj
3 0 obj
>
endobj
5 0 obj
>
endobj
6 0 obj
>
endobj
7 0 obj
>
endobj
8 0 obj
>
endobj
9 0 obj
>
stream
HWrF}Wp!
Особенности течения неонатального периода у доношенных и недоношенных новорожденных с внутрижелудочковыми кровоизлияниями гипоксического генеза
Черняховский, О. Б. и Кулакова, Наталья Ивановна и Кузнецова, В.А. и Кушнир, Семен Михайлович и Chernyakhovskiy, O.B. и Kulakova, Natalia Ivanovna и Kuznetsova, V.A. и Kushnir, Semyon Mikhaylovich
Б. и Кулакова, Наталья Ивановна и Кузнецова, В.А. и Кушнир, Семен Михайлович и Chernyakhovskiy, O.B. и Kulakova, Natalia Ivanovna и Kuznetsova, V.A. и Kushnir, Semyon Mikhaylovich
(2008)
Особенности течения неонатального периода у доношенных и недоношенных новорожденных с внутрижелудочковыми кровоизлияниями гипоксического генеза.
Вопросы практической педиатрии, 3 (6).
С. 78-80.
Полный текст
Резюме
Внутрижелудочковые кровоизлияния (ВЖК) представляют серьезную проблему в неонатологии, поскольку являются одной из главных причин летальных исходов и психоневрологических нарушений у новорожденных. Обследован 171 новорожденный ребенок: 20 здоровых детей и 151 с гипоксическими поражениями ЦНС (80 доношенных детей с церебральной ишемией 1-2-й степени тяжести, ВЖК 1-й и ВЖК 2-й степени; 71 недоношенный ребенок со сроком гестации 32-36 нед с ВЖК I, II, III). Проводили общеклиническое динамическое наблюдение, оценку неврологического статуса, биохимическое исследование, ультразвуковое сканирование головного мозга. Результаты исследования показали, что у доношенных детей с ВЖК в 2 раза чаще встречался отечный синдром и в 4 раза чаще — коньюгационная желтуха, чем у детей с церебральной ишемией. Максимальную убыль первоначальной массы тела более 10% имел каждый четвертый ребенок с ВЖК I и каждый пятый с ВЖК II. Внутриутробные инфекции выявлены у 60% детей с ВЖК II, у 44%-с ВЖК I и только у 13,2% — с церебральной ишемией. У недоношенных детей конъюгационная желтуха и отечный синдром отмечались во всех исследуемых группах, чаще при ВЖК III. Внутриутробные инфекции с одинаковой частотой (около 70%) встречались у всех недоношенных детей. Таким образом, полученные данные свидетельствуют о значительном напряжении адаптационного периода как у доношенных, так и у недоношенных детей с внутрижелудочковыми кровоизлияниями гипоксического генеза, а сопутствующая патология усугубляет течение основного заболевания. Intraventricular hemorrhages (IVH) are a serious problem of neonatology, since they are one of the main causes of lethal outcomes and psychoneurological disorders in the neonate. The examination involved 171 newborn infants: 20 healthy infanls and 151 with hypoxic lesions of the CNS (80 full-term infants with cerebral ischemia grade 1-2, IVH grade 1 and IVH grade 2; 71 premature infants with the term of gestation 32-36 wks with IVH I, II, III). A general dynamic observation was carried out, the neurological status was evaluated, biochemical investigation and ultrasonic imaging of the brain were performed. The results of the examination showed that full-term infants with IVH had edema syndrome 2 times more frequently and conjugated jaundice 4 times more frequently than the infants with cerebral ischemia. The maximal loss of the initial body mass more than 10% was observed in every fourth infanl IVH I and every fifth with IVH II. Intrauterine infections were revealed in 60% of infants with IVH II, in 44% with IVH I, and only in 13.2% of infants with cerebral ischemia. In premature infants conjugated jaundice and edema syndrome were noted in all groups of study, more frequently in IVH III. Intrauterine infections occurred in all premature infants with similar frequency (about 70%). Therefore, the evidence is indicative of a considerable strain of the adaptation period in both full-torm and premature infants with intraventricular hemorrhages of hypoxic genesis, and of aggravation of the course of the main disease by concomitant pathologies.
Intraventricular hemorrhages (IVH) are a serious problem of neonatology, since they are one of the main causes of lethal outcomes and psychoneurological disorders in the neonate. The examination involved 171 newborn infants: 20 healthy infanls and 151 with hypoxic lesions of the CNS (80 full-term infants with cerebral ischemia grade 1-2, IVH grade 1 and IVH grade 2; 71 premature infants with the term of gestation 32-36 wks with IVH I, II, III). A general dynamic observation was carried out, the neurological status was evaluated, biochemical investigation and ultrasonic imaging of the brain were performed. The results of the examination showed that full-term infants with IVH had edema syndrome 2 times more frequently and conjugated jaundice 4 times more frequently than the infants with cerebral ischemia. The maximal loss of the initial body mass more than 10% was observed in every fourth infanl IVH I and every fifth with IVH II. Intrauterine infections were revealed in 60% of infants with IVH II, in 44% with IVH I, and only in 13.2% of infants with cerebral ischemia. In premature infants conjugated jaundice and edema syndrome were noted in all groups of study, more frequently in IVH III. Intrauterine infections occurred in all premature infants with similar frequency (about 70%). Therefore, the evidence is indicative of a considerable strain of the adaptation period in both full-torm and premature infants with intraventricular hemorrhages of hypoxic genesis, and of aggravation of the course of the main disease by concomitant pathologies.
Изменить (необходимо войти в систему)
| Посмотреть объект |
Геморрагические инсульты и геморрагическая болезнь новорожденных
Мало кто знает, что инсульт бывает не только у взрослых. Среди подопечных фонда есть дети, в том числе те, кто борется с последствиями перинатального инсульта. Мы попросили детского гематолога НМИЦ ДГОИ им. Д.Рогачева Федорову Дарью Викторовну рассказать про детские инсульты, почему они случаются и как распознать симптомы инсульта у младенца.
Д.Рогачева Федорову Дарью Викторовну рассказать про детские инсульты, почему они случаются и как распознать симптомы инсульта у младенца.
Детский гематолог НМИЦ ДГОИ им. Д.Рогачева Федорова Дарья Викторовна
Инсульты у новорожденных детей, как и в
более старших возрастных группах, являются следствием закупорки кровеносного
сосуда головного мозга тромбом или разрыва такого сосуда. Обе эти причины
вызывают повреждение окружающего сосуд вещества головного мозга. Говоря
медицинскими терминами, перинатальный инсульт – это остро возникшее нарушение
мозгового кровообращения с хроническими последствиями, развившееся в период с
20 недели внутриутробного развития до 28 дня жизни ребенка. У новорожденных
детей геморрагические инсульты (кровоизлияния) встречаются приблизительно в 3-4
раза реже ишемических (то есть вызванных тромбозами). Внутричерепное
кровоизлияние может быть первичным, а может развиться вторично после эпизода
тромбоза (так называемое геморрагическое пропитывание очагов ишемии). Перинатальный
инсульт часто становится причиной хронического неврологического дефицита.
Клиническими проявлениями инсульта у
новорожденного ребенка могут быть отсутствие реакции на внешние раздражители, эпизоды
судорог, нарушения мышечного тонуса, слабость в конечностях, апноэ (нарушения дыхания),
отказ от груди.
Обследование ребенка с подозрением на инсульт включает в себя осмотр невролога и педиатра, проведение визуализации вещества головного мозга (компьютерная томография или, предпочтительно, магнитно-резонансная томография, а также ультразвуковая нейросонография для выявления кровоизлияний в желудочки мозга), а также лабораторные анализы, направленные на выявление причины случившегося (в частности нарушений свертывания крови). Если первым клиническим проявлением у ребенка являются судороги, необходимым является также обследование, направленное на исключение других их возможных причин, помимо инсульта (инфекции, электролитные нарушения, врожденные нарушения метаболизма), а также ЭЭГ-мониторинг.
Для недоношенных детей (особенно
рожденных раньше 28 недели гестации) характерны кровоизлияния в желудочки мозга,
связанные прежде всего с анатомо-физиологическими особенностями глубоко
недоношенного малыша. В то же время в большинстве случае (до 75%) геморрагических
инсультов у доношенных новорожденных причину первичного внутричерепного кровоизлияния
установить не удается. Только небольшая их часть является явным следствием
нарушений свертывания крови (тромбоцитопении, гемофилии, геморрагической
болезни новорожденных и др.) или аномалий сосудов головного мозга (кавернозные
и артериовенозные мальформации или аневризмы).
Высоким риском внутричерепного
кровоизлияния (до 25%) сопровождается такое редкое заболевание, как неонатальная
аллоиммунная тромбоцитопения (НАИТ). При этом заболевание организм матери
вырабатывает антитела к тромбоцитам плода. Проходя через плаценту, антитела
разрушают тромбоциты плода, вызывая у ребенка глубокую тромбоцитопению еще до
рождения, в то время как число тромбоцитов матери остается нормальным. До
половины всех внутричерепных кровоизлияний при НАИТ происходят внутриутробно. Значительно
реже внутричерепные кровоизлияния встречаются у новорожденных с наследственными
нарушения свертывания. При тяжелой гемофилии внутричерепное кровоизлияние
становится первым проявлением патологической кровоточивости в 2-3% случаев.
Другим важным и, главное, потенциально
предотвратимым, фактором риска внутричерепного кровоизлияния у новорожденных
детей является дефицит витамина К.
Новорожденные дети находятся в группе риска по развитию витамина К, потому что их функционально незрелая печень еще не может эффективно утилизировать витамин К. Кроме того, витамин К плохо проходит через плаценту, что приводит к отсутствию его резервов в организме ребенка к моменту рождения. Ребенок первых месяцев жизни получает мало витамина К с пищей (это особенно справедливо для детей на чисто грудном вскармливании, так как грудное молоко содержит меньше витамина К по сравнению с адаптированными молочными смесями).
У более старших детей и взрослых значительная доля витамина К образуется бактериями, живущими в кишечники, однако микрофлора новорожденного ребенка находится в стадии становления и еще не может восполнить дефицит витамина К. В норме концентрация витамина К в крови достигает «взрослых» значений к возрасту 1 месяца.
Выраженный дефицит витамина К может
привести к развитию так называемой геморрагической болезни новорожденных (более
современное название – витамин К-дефицитное кровотечение, англ. vitamin K deficient bleeding (VKDB)). Риск развития геморрагической
болезни новорожденных возрастает у малышей, мамы которых при беременности
принимали некоторые антибиотики (например, цефалоспорины), противосудорожные
препараты и антикоагулянты кумаринового ряда (например, варфарин).
Клинические проявления геморрагической
болезни новорожденных включают появление синячков, кровотечения со слизистых и
из пуповинной ранки, срыгивание с прожилками крови или примесь крови в стуле и
внутричерепные кровоизлияния.
Выделяют три формы геморрагической
болезни новорожденных:
- Ранняя (развивается в первые 24ч жизни
ребенка и обычно связана с приемом матерью препаратов, блокирующих метаболизм
витамина К, например, некоторых антиконвульсантов, риск внутричерепного
кровоизлияния составляет до 25%, - Классическая (развивается между 2 и 7 днями
жизни и в большинстве случаев может быть предотвращена профилактическим
введением витамина К при рождении), - Поздняя (фактически уже не относится к
периоду новорожденности и развивается между 2 неделей и 6-8 месяцами жизни,
факторами риска являются патология желудочно-кишечного тракта, нарушающая
всасывание жиров, чисто грудное вскармливание и отказ от профилактического
введения витамина К в родильном доме), по некоторым данным риск развития
внутричерепного кровоизлияния достигает 50%.
Витамин К-дефицитное кровотечению должно
быть включено в ряд дифференциальной диагностики во всех случаях повышенной
кровоточивости и, тем более, внутричерепного кровоизлияния у детей первого
полугодия жизни, в особенности находящихся на чисто грудном вскармливании и не
получивших профилактику витамином К в родильном доме.
Подтвердить диагноз витамин К-зависимого
кровотечения позволяет исследование коагулограммы (удлинение протромбинового и
активированного частичного тромбопластинового времени при нормальной
концентрации фибриногена и нормальном числе тромбоцитов). Лечение состоит в
немедленном введении витамина К, в случае тяжелого кровотечения может
потребоваться переливание свежезамороженной плазмы.
Геморрагическая болезнь новорожденных является хорошо известным фактором риска внутричерепных кровоизлияний и других тяжелых кровотечений. Поэтому в последние десятилетия общепринятой практикой является профилактическое внутримышечное введение витамина К новорожденным в первые сутки жизни. Согласно рекомендация Российского общества неонатологов, препарат витамина К (Викасол) должен вводиться всем новорожденным в первые часы после рождения однократно внутримышечно в дозе 1мг/кг (0,1мл/кг). Аналогичные рекомендации (внутримышечное введение витамина К всем новорожденным детям) существуют в США, Канаде, странах Европейского Союза, Израиле, Австралии, Японии.
В случае отсутствия у пациента врожденных
нарушений метаболизма витамина К, встречающихся крайне редко, и выраженной
патологии желудочно-кишечного тракта, затрудняющей адекватное усвоение жиров и
жирорастворимых витаминов, после проведенного лечения витамин К-зависимые
кровотечения не рецидивируют в более старшем возрасте и не требуют регулярного
контроля коагулограммы. Геморрагическая болезнь новорожденного в анамнезе ни
коим образом не является противопоказанием к реабилитационными мероприятиям,
направленным на коррекцию сформировавшегося неврологического дефицита.
Вызванные дефицитом витамина К внутричерепные кровоизлияния могут привести к глубокой инвалидизации и даже летальному исходу. Введение витамина К не является вакцинацией, для его введения в родильном доме практически не существует абсолютных противопоказаний. Поэтому, даже если Вы по каким-то причинам отказываетесь от проведения Вашему малышу вакцинации в родильном доме, не отказывайтесь от введения витамина К. Эта простая манипуляция позволяет значительно снизить риск очень серьезных осложнений.
Эта простая манипуляция позволяет значительно снизить риск очень серьезных осложнений.
Поддержите работу фонда пожертвованием. Помогите нам бороться с инсультом!
Публичная оферта о заключении договора пожертвования
Фонд по борьбе с инсультом «ОРБИ» (Исполнительнный директор: Александр Николаевич Комаров),
предлагает гражданам сделать пожертвование на ниже приведенных условиях:
1. Общие положения
1.1. В соответствии с п. 2 ст. 437 Гражданского кодекса Российской Федерации данное предложение является публичной офертой (далее – Оферта).
1.2. В настоящей Оферте употребляются термины, имеющие следующее значение:
«Пожертвование» — «дарение вещи или права в общеполезных целях»;
«Жертвователь» — «граждане, делающие пожертвования»;
«Получатель пожертвования» — «Фонд по борьбе с инсультом «ОРБИ»».
1.3. Оферта действует бессрочно с момента размещения ее на сайте Получателя пожертвования.
1.4. Получатель пожертвования вправе отменить Оферту в любое время путем удаления ее со страницы своего сайта в Интернете.
1.5. Недействительность одного или нескольких условий Оферты не влечет недействительность всех остальных условий Оферты.
2. Существенные условия договора пожертвования:
2.1. Пожертвование используется на содержание и ведение уставной деятельности Получателя пожертвования.
2.2. Сумма пожертвования определяется Жертвователем.
3. Порядок заключения договора пожертвования:
3.1. В соответствии с п. 3 ст. 434 Гражданского кодекса Российской Федерации договор пожертвования заключается в письменной форме путем акцепта Оферты Жертвователем.
3.2. Оферта может быть акцептована путем перечисления Жертвователем денежных средств в пользу Получателя пожертвования платежным поручением по реквизитам, указанным в разделе 5 Оферты, с указанием в строке «назначение платежа»: «пожертвование на содержание и ведение уставной деятельности», а также с использованием пластиковых карт, электронных платежных систем и других средств и систем, позволяющих Жертвователю перечислять Получателю пожертвования денежных средств.
3.3. Совершение Жертвователем любого из действий, предусмотренных п. 3.2. Оферты, считается акцептом Оферты в соответствии с п. 3 ст. 438 Гражданского кодекса Российской Федерации.
3.4. Датой акцепта Оферты – датой заключения договора пожертвования является дата поступления пожертвования в виде денежных средств от Жертвователя на расчетный счет Получателя пожертвования.
4. Заключительные положения:
4.1. Совершая действия, предусмотренные настоящей Офертой, Жертвователь подтверждает, что ознакомлен с условиями Оферты, целями деятельности Получателя пожертвования, осознает значение своих действий и имеет полное право на их совершение, полностью и безоговорочно принимает условия настоящей Оферты.
4.2. Настоящая Оферта регулируется и толкуется в соответствии с действующим российском законодательством.
5. Подпись и реквизиты Получателя пожертвования
Фонд по борьбе с инсультом «ОРБИ»
ОГРН: 1107799030349
ИНН/КПП: 7728123272/772801001
Адрес места нахождения: 117321 г. Москва, ул. Профсоюзная, д. 126, к. 1
Банковские реквизиты:
Номер банковского счёта: 40703810438180000307
Банк: ПАО «Сбербанк России» г. Москвы
БИК банка: 044525225
Номер корреспондентского счёта банка: 30101810400000000225
Исполнительнный директор
Александр Николаевич Комаров
Соглашаюсь с офертой
Согласие на обработку персональных данных
Пользователь, оставляя заявку, оформляя подписку, комментарий, запрос на обратную связь, регистрируясь либо совершая иные действия, связанные с внесением своих персональных данных на интернет-сайте https://orbifond.ru, принимает настоящее Согласие на обработку персональных данных (далее – Согласие), размещенное по адресу https://orbifond.ru/personal-data-usage-terms/.
Принятием Согласия является подтверждение факта согласия Пользователя со всеми пунктами Согласия. Пользователь дает свое согласие организации «Фонд по борьбе с инсультом «ОРБИ»», которой принадлежит сайт https://orbifond. ru на обработку своих персональных данных со следующими условиями:
ru на обработку своих персональных данных со следующими условиями:
Пользователь дает согласие на обработку своих персональных данных, как без использования средств автоматизации, так и с их использованием.
Согласие дается на обработку следующих персональных данных (не являющимися специальными или биометрическими):
• фамилия, имя, отчество;
• адрес(а) электронной почты;
• иные данные, предоставляемые Пользователем.
Персональные данные пользователя не являются общедоступными.
1. Целью обработки персональных данных является предоставление полного доступа к функционалу сайта https://orbifond.ru.
2. Основанием для сбора, обработки и хранения персональных данных являются:
• Ст. 23, 24 Конституции Российской Федерации;
• Ст. 2, 5, 6, 7, 9, 18–22 Федерального закона от 27.07.06 года №152-ФЗ «О персональных данных»;
• Ст. 18 Федерального закона от 13.03.06 года № 38-ФЗ «О рекламе»;
• Устав организации «Фонд по борьбе с инсультом «ОРБИ»»;
• Политика обработки персональных данных.
3. В ходе обработки с персональными данными будут совершены следующие действия с персональными данными: сбор, запись, систематизация, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передача (распространение, предоставление, доступ), обезличивание, блокирование, удаление, уничтожение.
4. Передача персональных данных, скрытых для общего просмотра, третьим лицам не осуществляется, за исключением случаев, предусмотренных законодательством Российской Федерации.
5. Пользователь подтверждает, что указанные им персональные данные принадлежат лично ему.
6. Персональные данные хранятся и обрабатываются до момента ликвидации организации «Фонд по борьбе с инсультом «ОРБИ»». Хранение персональных данных осуществляется согласно Федеральному закону №125-ФЗ «Об архивном деле в Российской Федерации» и иным нормативно правовым актам в области архивного дела и архивного хранения.
7. Пользователь согласен на получение информационных сообщений с сайта https://orbifond. ru. Персональные данные обрабатываются до отписки Пользователя от получения информационных сообщений.
ru. Персональные данные обрабатываются до отписки Пользователя от получения информационных сообщений.
8. Согласие может быть отозвано Пользователем либо его законным представителем, путем направления Отзыва согласия на электронную почту – [email protected] с пометкой «Отзыв согласия на обработку персональных данных». В случае отзыва Пользователем согласия на обработку персональных данных организация «Фонд по борьбе с инсультом «ОРБИ»» вправе продолжить обработку персональных данных без согласия Пользователя при наличии оснований, указанных в пунктах 2 — 11 части 1 статьи 6, части 2 статьи 10 и части 2 статьи 11 Федерального закона №152-ФЗ «О персональных данных» от 27.07.2006 г. Удаление персональных данных влечет невозможность доступа к полной версии функционала сайта https://orbifond.ru.
9. Настоящее Согласие является бессрочным, и действует все время до момента прекращения обработки персональных данных, указанных в п.7 и п.8 данного Согласия.
10. Место нахождения организации «Фонд по борьбе с инсультом «ОРБИ»» в соответствии с учредительными документами: 117321 г. Москва, ул. Профсоюзная, д. 126, к. 1.
Соглашаюсь на обработку моих Согласие на обработку данных
Перенаправление на безопасную страницу платежа…
Инсульт в детском возрасте — Областная детская больница
29 октября — Всемирный день борьбы с инсультом
ИНСУЛЬТ – это острое нарушение кровообращения мозга, которое длится более суток и проявляется симптомами стойкого поражения центральной нервной системы. Чрезвычайную актуальность инсульты у детей приобрели по причине высоких показателей постинсультной инвалидности и смертности маленьких пациентов. А связано это с тем, что выявить недуг у малышей не всегда представляется возможным.
Статистика
Частота детских инсультов колеблется в широких пределах – средний показатель 2–3:100 000 детей до 14 лет в год. Максимальное количество случаев – 38% зарегистрировано у детей до 3 лет жизни, с наибольшей частотой до 28 дня жизни. Встречаемость в подростковом возрасте – не более 1%.
Максимальное количество случаев – 38% зарегистрировано у детей до 3 лет жизни, с наибольшей частотой до 28 дня жизни. Встречаемость в подростковом возрасте – не более 1%.
Полового разграничения нет, однако, многие специалисты отмечают, что среди детей до 3 лет немного чаще страдают мальчики, среди школьников и подростков – девочки.
Разновидности
Детский инсульт, в отличие от такового у взрослых, имеет 2 понятия:
- Перинатальный. Развивается между 28 неделей беременности и 1 месяцем жизни ребенка.
- Детский. С 29 суток жизни до совершеннолетия.
По механизму развития выделяют 2 вида:
- ишемический;
- геморрагический.
Существуют два основных типа инсульта: ишемический и геморрагический
Ишемический инсульт развивается в результате острого нарушения кровообращения, кровь к мозгу не поступает вовсе или поступает в недостаточном количестве. Геморрагичский тип – не что иное, как кровоизлияние, встречается реже ишемического. Разорванный сосуд прекращает подачу крови к определенному участку мозга, а образовавшаяся гематома сдавливает близлежащие сосуды. Его причиной, как правило, служат аномалии развития сосудов, заболевания крови, травмы головы. Симптомы и проявления будут зависеть от того, в каком месте произошло кровоизлияние: в паренхиму (собственно мозг), мозговые оболочки или желудочки.
Факторы риска у новорожденных детей
- Черепно-мозговая травма, травма шейных позвонков.
- Серповидно-клеточная анемия, которая наблюдается у чернокожих малышей, соответственно и недуг у таких детей встречается чаще.
- Недоразвитие и закупорка сосудов.
- Заболевания сердца, пороки сердца.
- Ветрянка. Доказано, что дети, перенесшие ветрянку, имеют в 3 раза больше шансов получить инсульт.
- Лейкоз.
Одним из факторов риска ОНМК у новорожденных считаются перинатальные ЧМТ либо родовые травмы в шейном отделе позвоночника
Кровоизлияние в мозг у новорожденных чаще ассоциировано со стремительными родами, задержкой внутриутробного развития, разрывами патологических анастамозов между артериями и венами мозга, разрывами патологических расширений сосудов.
Ишемические инсульты у детей связаны с нейроинфекциями, энцефалитами, менингитами, наблюдаются при врожденных пороках сердца, сдавлении позвоночной артерии, при обезвоживании организма, повышенной свертываемости крови, врожденном сужении сосудов мозга (болезнь Моямоя).
Факторы риска у дошкольников
- Кровоизлияние в мозг связано с разрывами патологических артериально-венозных соединений, с васкулитами различного происхождения, заболеваниями свертываемости крови.
- Ишемический инсульт наблюдается при врожденных пороках развития сердца, аномалиях развития сосудов мозга, ассоциирован с диссеминированным внутрисосудистым свертыванием крови при онкологии, специфическим воспалением в стенке артерий (болезнь Такаясу, Кавасаки, красная волчанка), при гомоцистеинэмии, полицитэмии, при травмах шейного отдела позвоночника, артериальной гипертонии.
У детей школьного возраста и у подростков риск развития ишемического инсульта увеличивается при употреблении кокаина, амфетамина, отравлении манинилом, изониазидом.
Как заболевание проявляется?
Родители, воспитатели и даже медработники часто не ассоциируют инсульт с детьми, в результате многие ребята вовремя не получают адекватного лечения
Симптомы инсульта у детей ничем не отличаются от проявления болезни у взрослого населения. Сложность кроется в том, что у детей до года и первых 2–3 лет жизни заподозрить заболевание сложнее – малыши не могут описать свои ощущения, не понимают, что со здоровьем случилась проблема. А родители и педиатр проявления болезни связывают с нейроинфекцией, неврологическими заболеваниями или переутомлением ребенка.
Когда стоит заподозрить у ребенка инсульт?
- Внезапное нарушение чувствительности ноги, руки, лица.
- Если ребенок стал трудно произносить слова, понимать речь родителей или разговаривать.
- Если ребенок внезапно стал плохо видеть или зрение пропало совсем (чаще один глаз).
- В глазах стало двоиться.
 Ребенок может не сказать об этом родителям и для компенсации глаз начал прищуривать или закрывать ладошкой.
Ребенок может не сказать об этом родителям и для компенсации глаз начал прищуривать или закрывать ладошкой. - Беспричинная головная боль.
- Появились головокружение, потеря равновесия и ориентации в пространстве.
- Если ребенок временно потерял контроль над мочеиспусканием и дефекацией.
- На фоне вышеперечисленного родители могут замечать изменение умственных способностей у ребенка, несобранность, рассеянность, плохую память.
При появлении этих симптомов необходимо срочно вызывать скорую помощь
Последствия
Сосудистые катастрофы у детей являются основным фактором, приводящим к стойкой инвалидности и смертности детского населения, ведь десятая часть детей, перенесших инсульт, нуждается в постоянной помощи и уходе со стороны. Выраженность последствий зависит от типа инсульта, его локализации и объема. Огромную роль играет время, за которое был выставлен верный диагноз и начато лечение:
- у вовремя пролеченных детей повторные случаи наблюдаются крайне редко;
- у 70% остаются стойкие неврологические нарушения;
- смертность наблюдается примерно у каждого пятого пациента, причем чаще от геморрагического инсульта.
Кровоизлияние в головной мозг
Кровоизлияние в головной мозг
Кровоизлияние в мозг — это попадание крови в ткань головного мозга из-за разрыва кровеносного сосуда или значительного повышения проводимости стенок кровеносных сосудов головного мозга. Вследствие внутримозгового кровоизлияния и разрушения нервной ткани происходит геморрагический инсульт. Симптомы кровоизлияния в мозг — головная боль, рвота, редкий пульс и расстройство сознания. В тяжелых случаях — паралич, эпилептические припадки. Иногда кровоизлияние связано с разрывом кровеносного сосуда мозговых оболочек. Тогда кровь распределяется по поверхности головного мозга, образуются гематомы.
Головной мозг человека окружен ликвором (мозговая жидкость) и тремя мозговыми оболочками. Ликвор выполняет много разных функций, но в первую очередь он служит амортизатором, предохраняя мозг от повреждения в случае резкого инерционного движения. Головной мозг покрыт тремя оболочками: твердой — наружной, паутинной — средней (обеспечивает кровоснабжение головного мозга), сосудистой — внутренней. Оболочки и мозг пронизаны густой сетью кровеносных сосудов. На поверхности головного мозга расположены крупные венозные синусы, например, продольный синус. Они представляют собой своеобразные провода, по которым кровь из мозга поступает в кровеносные сосуды шеи, а затем движется к сердцу. С поверхностью мозга они соединены посредством небольших вен. При травме черепа повреждаются кровеносные сосуды головного мозга, и кровь изливается в мозг.
Различают три вида кровоизлияний в мозг. При разрыве артерии или вены и кровоизлиянии над твердой оболочкой головного мозга образуется гематома. Вследствие травмы может произойти и кровоизлияние под твердую оболочку головного мозга — в этом случае гематома называется субдуральной. При повреждении кровеносных сосудов головного мозга образуется интрацеребральная гематома. Кровоизлияние сопровождается увеличением внутричерепного давления, в результате чего происходит сдавление головного мозга. В этом случае мозг смещается по направлению к большому затылочному отверстию, что может вызвать осложнения, так как в этой области находятся жизненно важные центры, регулирующие дыхание, мышечный тонус и кровяное давление.
Симптомы кровоизлияния в головной мозг
- Ощущение «сдавленности» головного мозга.
- Головная боль и головокружение.
- Тошнота.
- Редкий пульс — менее 55 ударов в минуту.
- Нарушение речи.
- Паралич и нарушение ощущений.
- Нарушение сознания.
- Судороги и эпилептические припадки.
- Изменение зрачков.
Причины кровоизлияния в мозг
Во время несчастных случаев часто происходит разрыв средней артерии оболочки головного мозга. Кровь, излившаяся под кости черепа, оказывает давление на головной мозг. В результате ударов по голове кровь распределяется по поверхности головного мозга или между мозговыми оболочками, появляются кровоподтеки. Однако чаще причиной кровоизлияния в мозг является повышенное кровяное давление или атеросклероз. Эти осложнения обычно возникают у человека в возрасте 50-60 лет. Причиной может быть и разрыв внутричерепной аневризмы — участка артерии, расширенного из-за патологических изменений его стенки. Реже в головном мозге бывают гемангиомы — доброкачественные опухоли из кровеносных сосудов. Кровоподтеки могут возникнуть и из-за патологического изменения сосудистой стенки или состава крови, например, при геморрагическом диатезе.
Кровь, излившаяся под кости черепа, оказывает давление на головной мозг. В результате ударов по голове кровь распределяется по поверхности головного мозга или между мозговыми оболочками, появляются кровоподтеки. Однако чаще причиной кровоизлияния в мозг является повышенное кровяное давление или атеросклероз. Эти осложнения обычно возникают у человека в возрасте 50-60 лет. Причиной может быть и разрыв внутричерепной аневризмы — участка артерии, расширенного из-за патологических изменений его стенки. Реже в головном мозге бывают гемангиомы — доброкачественные опухоли из кровеносных сосудов. Кровоподтеки могут возникнуть и из-за патологического изменения сосудистой стенки или состава крови, например, при геморрагическом диатезе.
Как правило, кровоизлияние в мозг является следствием сильного удара, полученного, например, во время автомобильной аварии. Если бы люди, садясь в автомобиль, всегда пристегивались ремнями безопасности, то таких травм было бы намного меньше.
Лечение кровоизлияния в мозг
Если кровоподтеки небольшие, достаточно несколько недель соблюдать постельный режим. В тяжелых случаях образовавшуюся кисту с кровяным содержимым удаляют оперативным методом. При параличе проводят необходимое лечение, больного обучают специальным упражнениям по лечебной гимнастике.
Особых профилактических средств не существует. Рекомендуется вести здоровый образ жизни. После операции показано регулярное выполнение рекомендованных врачом упражнений.
После травмы головы надо обязательно обратиться к врачу, особенно, если наблюдается головная боль, тошнота и рвота. Тревожными симптомами могут быть также ощущение «сдавленности» головы, редкий пульс и нарушение сознания.
При подозрении на внутримозговое кровоизлияние врач незамедлительно направит пациента в неврологическое отделение больницы, т. к. в тяжелых случаях степень выраженности остаточных явлений (поражений ЦНС) во многом зависит от своевременности врачебной помощи. Компьютерная томография или магнитный резонанс позволяет установить величину и локализацию кровоподтека. При необходимости проводится экстренная операция.
Течение болезни
При незначительных кровоподтеках и своевременном лечении остаточные явления чаще всего не наблюдаются. Иногда внутримозговое кровоизлияние сопровождается инсультом (у больного отмечаются потеря сознания, параличи или парезы конечностей, возможно нарушение речи). При более крупном кровоподтеке излившаяся кровь через несколько часов начинает сдавливать головной мозг.
Опасно ли кровоизлияние в головной мозг?
Внутримозговое кровоизлияние всегда опасно, так как существует вероятность поражения головного мозга, вследствие которого у пациента может наступить паралич и потеря сознания. При более значительном кровоподтеке и отсутствии своевременного хирургического вмешательства или хотя бы медикаментозного лечения жизнь пациента находится под угрозой.
Любая травма головы является опасной для здоровья человека. Зачастую степень выраженности ее последствий решают минуты. Чем скорее оказана помощь и начато лечение, тем больше вероятность того, что остаточных явлений будет меньше.
Первая помощи при кровоизлиянии в мозг
- Уложить пострадавшего на бок.
- Подложить под голову небольшую подушечку.
- Срочно вызвать врача.
- Контролировать жизненно важные функции.
причины и последствия для недоношенных детей, как лечить кровоизлияние в желудочки головного мозга
Беременность и роды непросто даются женщинам. Но в своих тяготах они не одиноки: не менее сложным считается внутриутробный период и последующее рождение для малыша.
К сожалению, не всегда все протекает ровно, и возможны определенные опасные осложнения. К одному из таких осложнений беременности и родов относится кровоизлияние в мозг у новорожденного. Что это такое и почему это происходит, мы расскажем в этом материале.
О патологии
Кровоизлияние в мозг относится к разряду самых тяжелых родовых травм, имеющих обычно неблагоприятное протекание и прогнозы. Происходит оно из-за нарушения целостности кровеносных сосудов, в результате чего под оболочками мозга, в межполушарном пространстве начинает скапливаться кровь, порой ей оказывается пропитана вся мозговая ткань.
Естественно, функции мозга нарушаются, деятельность центральной нервной системы претерпевает изменения, зачастую летальные или необратимые. Именно церебральное кровоизлияние считается самой распространенной причиной неонатальной смерти малышей, а также развития ДЦП у выживших.
Конечно, многое зависит от того, какой сосуд, в какой области мозга поврежден, сколько скопилось крови, каковы изменения мозговой ткани и оболочек из-за давления кровяной массы и вымываний, но в целом прогнозы все-таки, увы, считаются неблагоприятными.
В зависимости от точного места расположения кровоизлияния различают несколько видов патологии:
- эпидуральное — скопление крови наблюдается между черепной коробкой и серым мозговым веществом, мозговые ткани не затронуты;
- субдуральное — скопление крови присутствует между мягкими и твердыми мозговыми оболочками;
- субарахноидальное — кровотечение локализуется между оболочкой и серым веществом;
- межжелудочковое — кровь скапливается в пространстве между желудочками головного мозга и в них;
- паренхиматозное (внутримозговое) — кровь скапливается в самом мозговом веществе, пропитывает его.
Нужно отметить, что все эти виды считаются опасными, но наиболее тяжелыми принято называть паренхиматозное и эпидуральное кровотечения.
Их довольно сложно установить, а потому на момент диагностики патология уже может иметь масштаб глобальной катастрофы.
Степеней патологии, по рекомендации ВОЗ, существует три. Российские врачи пользуются четырехступенчатой классификацией.
- 1 степени соответствует кровоизлияние, затрагивающее лишь стенки желудочков головного мозга, не их полости.
- 2 степени соответствует патология с проникновением крови в желудочки головного мозга.
- При 3 степени кровь распространяется за пределы желудочков и заполняет боковые желудочки
- При 4 степени происходит массированное кровоизлияние с поражением желудочков, боковых желудочков и мозгового вещества.
Размеры кровоизлияния тоже имеют значение.
Если площадь поражения не более сантиметра, говорят о легкой форме патологии, при увеличении площади кровоизлияния до полутора сантиметров ставят средне-тяжелую форму, если же площадь поражения превысит полтора сантиметра, речь будет идти о патологии в тяжелой форме.
Причины
Церебральное кровоизлияние может развиться по самым разным причинам, связанным с развитием ребенка в материнской утробе, либо с действиями медиков и некими осложнениями в процессе родов.
Довольно часто кровоизлияние в мозг происходит у глубоко недоношенных детей, которые появились на свет до 32 недели беременности. Их мозг незрелый, слабый, он не способен противостоять перемене давления при родах, целостность сосудов нарушается уже по причине преждевременности рождения малыша.
Нейрохирурги отмечают, что процент вероятности кровоизлияния в мозгу у недоношенного ребенка с весом более полутора килограммов составляет около 50%. У малышей же, вес которых при рождении составляет менее килограмма, инсульт той или иной степени тяжести наблюдается в 100% случаев.
Среди других причин можно отметить следующие.
- Острая гипоксия при родах. Резкое кислородное голодание может развиться при резких стремительных родах, а также при затяжных родах с длительным пребыванием малыша в безводном периоде (после отхождения амниотической жидкости). Нетравматическая природа кровоизлияния в этом случае несколько повышает шансы более благоприятного исхода для жизни.
- Действия акушера. Наложение щипцов, неправильное извлечение головки плода могут привести к перелому костей черепа, и тогда развивается травматическое кровоизлияние.
- Переношенная беременность. Если роды происходят после 42 недель, повышается вероятность получения малышом черепной травмы во время родов, ведь кости черепа на таком сроке начинают утрачивать эластичность, необходимую для беспрепятственного прохождения по родовым путям. Родовая травма черепа может стать основной причиной последующего церебрального излития крови.
- Неблагоприятная беременность. Кровоизлияние острого характера в мозг во время вынашивания плода обычно приводит к прерыванию беременности, гибели плода. После рождения может развиться патология из-за некоторых пороков развития сосудов, сердца, головного мозга. Также причиной может стать внутриутробное инфицирование плода опасными вирусами и бактериями.
Если женщина относится к группе риска (возраст роженицы старше 40 лет, беременность сопровождалась гестозом, сильным токсикозом, вынашивает крупный плод при узком тазе и т. д. ), женщине предлагают обычно снизить риски возникновения у ребенка кровоизлияния путем хирургического родоразрешения.
После кесарева сечения мозговые нарушения, нарушение кровообращения у малышей развиваются нечасто.
Симптомы и признаки
Ребенок, у которого при рождении возникло небольшое кровоизлияние, даст знать об этом не сразу. Возможно, при рождении он будет более вялым, возможно, позднее закричит, но уже через несколько часов симптомы проявятся, и врачи смогут диагностировать патологию.
Манифестируют симптомы церебрального кровоизлияния, остро, внезапно. Состояние малыша резко ухудшается. Какими будут конкретные признаки, сказать сложно, все зависит от размера и локализации гематомы внутри черепа.
Чаще всего появляются судороги, открывается рвота, ребенок теряет сознание. Может резко проявиться косоглазие (зрачки начинают «смотреть» в сторону пораженного полушария). У многих малышей возникают проблемы с дыханием, оно становится прерывистым, а потом может прекратиться.
Обычно в роддоме успевают оказать первую помощь и обеспечить ребенку аппарат искусственной вентиляции легких.
Постоянный крик может говорить о субарахноидальном кровоизлиянии, низкое давление и косоглазие — об эпидуральном кровотечении.
У опытных неонатологов существует множество признаков, по которым они могут различить не только патологию, но и предположить ее размеры и локализацию. Однако без точной диагностики заключение не выносится.
Для подтверждения кровоизлияния грудничку проводят в экстренном порядке нейросонографию и компьютерную томографию мозга.
Лечение
Лечить ребенка начинают сразу же, как только диагноз подтверждается. При необходимости оказывают реанимационную помощь. Терапия направлена в первую очередь на нормализацию кровообращения в головном мозге, на уменьшение внутричерепного давления. Если гематома большая, а состояние ребенка тяжелое, ему могут провести экстренную нейрохирургическую операцию.
Если жизнь ребенка удается спасти, родителей предупреждают о длительном восстановительном периоде без каких-либо гарантий, ведь последствия церебрального кровоизлияния могут быть самыми разнообразными.
В процессе восстановления, который может длиться и несколько месяцев, и несколько лет, а порой и всю жизнь, ребенку будет показано диспансерное наблюдение у невролога, рекомендации которого родителям придется неукоснительно выполнять.
Прогнозы и последствия
Младенческий мозг по-своему уникален.
Он обладает высокими способностями к адаптации и компенсации. И именно поэтому с легкими кровоизлияниями в мозг, если их правильно лечить, в большинстве случаев удается справиться. Но и при них процесс реабилитации ребенка займет длительное время.
Если степень кровоизлияния была выше второй, а течение тяжелое, то велика вероятность инвалидизации ребенка в будущем. Степень поражения функций головного мозга будет зависеть от того, насколько разрушительной для него оказалась гематома. Распространенными в таких случаях поражениями являются детский церебральный паралич, эпилепсия, гидроцефалия, слабоумие.
В случае с тяжелым кровоизлиянием паренхиматозного вида выживаемость детей крайне мала. Почти стопроцентный летальный исход регистрируется в случае кровоизлияния с разрывом серпа или намета мозжечка.
Отзывы
По отзывам мам, главное, не терять самообладания, когда детский врач в роддоме сообщает о кровоизлиянии в мозг малыша. Кровоизлияния происходят чаще, чем мы привыкли думать, и далеко не каждому ребенку предстоит стать инвалидом из-за этого.
Мамы охотно делятся своими историями и подчеркивают, что длительное лечение и восстановительный период сделали свое дело — в большинстве случаев дети растут вполне нормальными, посещают садики, учатся в школе на пятерки, ни на что не жалуются.
Тяжелые формы кровоизлияний у ребенка — повод для обращения к психологу. Поверьте, в каждом роддоме есть психолог для работы с беременными и роженицами. Он поможет поверить в лучшее, настроиться на волну малыша.
Опытные неонатологи утверждают, что дети, мамы которых плачут и нервничают, хуже выбираются из тяжелого состояния, чем детки, мамы которых внутренне собираются и нацеливаются на лучшее. Дети чувствуют поддержку, даже находясь без сознания в реанимации.
О кровоизлияниях в мозг у новорожденных и сложившейся мировой практике лечения и ухода можно узнать из следующего видео.
Общие сведения о внутрижелудочковом кровотечении (ВЖК) у недоношенных
Внутрижелудочковое кровоизлияние, также называемое ВЖК, — это кровотечение в желудочки головного мозга. ВЖК может быть легким или тяжелым, в зависимости от степени кровотечения. У некоторых детей, перенесших ВЖК, долгосрочных эффектов не будет, в то время как у детей с более обширными кровотечениями может наблюдаться задержка в развитии или другие долгосрочные эффекты.
Если у вашего ребенка диагностировано внутрижелудочковое кровоизлияние, узнав как можно больше об этом состоянии, вы сможете понять, что происходит с вашим ребенком и как он или она выздоровеют.
Сики Санчес / Getty Images
Симптомы
У младенцев, страдающих легкими кровотечениями, могут отсутствовать какие-либо симптомы. Симптомы более серьезных внутрижелудочковых кровотечений у недоношенных детей включают:
- Увеличение эпизодов апноэ и брадикардии
- Пониженный мышечный тонус
- Снижение рефлексов
- Слабый отсос
- Чрезмерный сон
У младенцев внутрижелудочковые кровоизлияния классифицируются по степени тяжести кровотечения.Взаимодействие с другими людьми
- Степень 1: Кровотечение ограничивается зародышевым матриксом, хрупкой областью около желудочков, содержащей множество мелких капилляров. ВЖК 1 степени также называют кровоизлиянием в зародышевый матрикс.
- Grade 2: Кровотечение обнаруживается в желудочках, но желудочки остаются того же размера.
- Grade 3: В желудочках обнаружено кровотечение, которое привело к расширению или увеличению желудочков.
- Класс 4: Кровь обнаружена в расширенных желудочках и в близлежащих областях мозга.ВЖК 4 степени также называют внутричерепным кровоизлиянием.
Младенцы с кровотечением 1-2 степени не могут иметь длительных эффектов. Люди с ВЖК 3-4 степени могут испытывать задержку в развитии, плохую когнитивную функцию и повышенный риск синдрома дефицита внимания с гиперактивностью (СДВГ).
Причины
Неясно, почему возникает ВЖК, но считается, что это может быть результатом тяжелых или травматических родов или осложнений после родов. Кровотечение возникает из-за того, что кровеносные сосуды в головном мозге недоношенного ребенка все еще очень хрупкие и уязвимы для разрыва.Взаимодействие с другими людьми
Недоношенность является основной причиной внутрижелудочкового кровоизлияния, и большинство случаев ВЖК возникает у детей менее 30 недель беременности или менее 1500 граммов (3 фунта 5 унций).
Врачи считают, что сочетание нескольких факторов делает недоношенных детей восприимчивыми к ВЖК. Помимо хрупкости кровеносных сосудов, недоношенные дети также могут страдать от повторяющихся эпизодов низкого уровня кислорода в крови и подверженности более сильным колебаниям артериального давления.
Внутрижелудочковые кровоизлияния, как правило, возникают в раннем возрасте, 90% из которых происходят в течение первых трех дней после рождения.
Диагностика
Внутрижелудочковые кровоизлияния диагностируются при УЗИ головы. Многие больницы регулярно проверяют всех недоношенных детей на ВЖК в течение первой недели жизни и еще раз перед выпиской из больницы.
Лечение
К сожалению, невозможно остановить внутрижелудочковое кровоизлияние, если оно началось. Лечение ВЖК направлено на симптомы кровотечения и может включать усиление респираторной поддержки или прием лекарств от апноэ и брадикардии.Взаимодействие с другими людьми
До 10% младенцев с внутрижелудочковым кровотечением разовьется гидроцефалия, скопление спинномозговой жидкости в желудочках (полостях, содержащих жидкость) головного мозга.
Гидроцефалия, также известная как «вода на головном мозге», вызывает отек черепа и оказывает давление на нежные ткани мозга. Гидроцефалия может пройти сама по себе, или может потребоваться операция. При необходимости врач может ввести вентрикулоперитонеальный шунт (ВП-шунт), чтобы слить жидкость и снизить давление на мозг.Взаимодействие с другими людьми
Профилактика
Поскольку ВЖК может вызвать серьезные осложнения и не может быть остановлена после начала, врачи и ученые сосредоточили свои усилия на профилактике. Профилактика преждевременных родов — лучший способ предотвратить ВЖК, поэтому будущим мамам с риском преждевременных родов следует поговорить со своими врачами о снижении риска.
Некоторые лекарства были изучены на предмет их роли в предотвращении ВЖК. Доказано, что дородовые стероиды у женщин с риском преждевременных родов обеспечивают некоторую защиту, но их следует назначать в ограниченном временном окне.Другое лекарство, индометацин, также оказывает некоторую защиту.
Внутрижелудочковое кровоизлияние | IVH | Группа ДЦП
Обзор внутрижелудочкового кровотечения
Внутрижелудочковое кровоизлияние (ВЖК) — это особый тип кровотечения в головном мозге. Он поражает детей, рожденных недоношенными на 10 и более недель. Поскольку кровеносные сосуды достигают полной зрелости в последние 10 недель беременности, младенцы подвержены повреждениям при слишком раннем контакте с внешним миром.
Травма, возникшая во время родов или вскоре после этого, также может вызвать ВЖК. Последствия кровотечения зависят от множества факторов, в том числе от количества потерянной крови и места повреждения.
Что такое внутрижелудочковое кровоизлияние?
Когда происходит ВЖК, кровеносные сосуды головного мозга кровоточат в соседние желудочки. Кровотечение может исходить как из артерий, так и из вен. Артериальную форму ВЖК труднее контролировать из-за размера сосуда и скорости кровотока.
ВЖК может влиять как на умственное, так и на физическое развитие ребенка, а также влиять на различные части мозга. В головном мозге есть четыре различных, но взаимосвязанных желудочка. Каждый помогает производить и циркулировать спинномозговую жидкость. Существует несколько различных степеней и форм ВЖК, от относительно безвредных до крайне тяжелых.
Более тяжелые типы ВЖК могут привести к отеку мозга, известному как гематома. ВЖК обычно не обнаруживается в момент рождения, но часто обнаруживается через несколько дней.Когда ребенку исполняется месяц, вероятность кровотечения из-за хрупких кровеносных сосудов намного меньше. ВЖК, возникающий после этого возраста, обычно вызван каким-либо типом травмы головы.
Какие четыре степени IVH?
Каждая степень ВЖК указывает на какой-либо тип кровотечения, хотя эффекты различаются в зависимости от количества потерянной крови.
Grade 1: Кровотечение происходит только в зародышевом матриксе (иногда его называют кровоизлиянием в зародышевый матрикс). Зародышевый матрикс представляет собой сложную и чувствительную систему желудочков, которая может быть легко повреждена даже при кратковременном отсутствии воздуха или наличии давления.
2 степень: Кровотечение происходит внутри желудочков.
Grade 3: Желудочки становятся больше из-за избыточного количества крови.
Класс 4: Кровотечение увеличивает желудочки и выходит в окружающие ткани мозга. Эту форму ВЖК иногда называют внутрипаренхиматозным кровоизлиянием.
Мозг рассчитан на то, чтобы справляться с определенным количеством травм, и младенцы устойчивы к ряду рисков, даже если они родились недоношенными.Как правило, первые две степени ВЖК не вызывают серьезных повреждений, если ребенок не рождается очень рано. Последние степени могут значительно навредить ребенку и потенциально привести к церебральному параличу. ВЖК также может вызвать гидроцефалию, что может означать пожизненные проблемы с позвоночником.
Когда в мозгу слишком много крови, как в случае гематомы, организм останавливает кровотечение через сгустки. Эти сгустки могут в конечном итоге блокировать кровоток, вызывая скопление жидкости. В случае ВЖК сгустки блокируют спинномозговую жидкость, которая должна двигаться к столбу, чтобы способствовать регулярному движению и гибкости.
ВЖК обычно возникает у недоношенных детей, но известно, что это случается и у доношенных детей. Важно отметить, что врачи не могут остановить кровотечение, но есть меры, которые могут помочь на ранних стадиях.
Переливание крови может скорректировать артериальное давление и обеспечить, чтобы в организме ребенка было достаточно литров, чтобы поддерживать сердцебиение. Или врач может слить лишнюю жидкость, используя шунт в головном мозге, тем самым освобождая пространство для тканей и желудочков, чтобы они могли выполнять свою работу.
Какие факторы риска связаны с ВЖК?
Некоторые факторы в большей степени связаны с ВЖК, хотя родителям важно знать все факторы риска как для профилактических, так и для профилактических целей.
- Респираторный дистресс-синдром (RDS): Преждевременные легкие могут испытывать недостаток сурфактанта, который поддерживает легкие наполненными воздухом и надутыми воздушными мешками. RDS также может возникать из-за здоровья матери или генетического заболевания.
- Использование вентилятора: Младенцы, рожденные слишком рано, часто помещаются на искусственную вентиляцию легких.Даже когда медицинские работники проявляют осторожность, иногда дыхание может стать рассинхронизированным, что может оказать слишком сильное давление на сосуды.
- Нестабильное кровяное давление: Повышенное кровяное давление увеличивает вероятность чрезмерного кровотечения из хрупких артерий и артериол (крошечных кровеносных сосудов). Похоже, что нет точного порога с точки зрения показателей артериального давления, указывающего на опасность для младенцев, но оно может усугубляться такими заболеваниями, как диабет матери.
- Травма головы или синдром тряски младенца: У детей, подвергшихся травмам, больше шансов получить повреждение головного мозга из-за ВЖК.
- Здоровье матери: Артериальное давление, наличие инфекции и сгустки плацентарной крови могут играть роль в ВЖК. Хотя определенные факторы риска (например, курение матери, быстрые роды и тазовые предлежания) не вызывают кровотечения в головном мозге, они могут вызвать преждевременные роды или экстренные роды, которые затем могут привести к повреждению сосудов младенца.
Каковы признаки кровотечения?
Младенцы могут проявлять или не проявлять симптомы. Ваш врач должен внимательно следить за признаками ВЖК, если ваш ребенок родился на 10 недель раньше срока. Возможные показатели включают:
- Проблемы с дыханием: Младенцы, которые не могут даже дышать, могут иметь ВЖК. Это особенно верно, если у них апноэ или затрудненное дыхание во время сна.
- Синий цвет: Бледность ребенка может указывать на количество циркулирующей крови.Если ребенок выглядит синим, это может означать, что в его мозгу сконцентрирована кровь.
- Изменения частоты пульса: Проверка пульса ребенка может дать вам хорошее представление об артериальном давлении ребенка. Проконсультируйтесь со специалистом, если от одного теста к другому происходят серьезные изменения.
- Падение количества крови: Кровотечение приведет к снижению количества детей.
- Отсутствие мышечного тонуса: Спинномозговая жидкость играет важную роль в развитии, поэтому обратите внимание на ее определение в мышцах вашего ребенка.
- Отсутствие рефлексов: Если у вашего ребенка проблемы с реакцией на различные раздражители, это может быть признаком ВЖК.
- Избыточный сон или общая летаргия: Новорожденные должны спать около 17 часов в сутки. Если они постоянно выглядят уставшими или их трудно просыпать, это может означать, что мозгу необходимо экономить энергию из-за ВЖК.
- Слабое сосание: Подобно развитию рефлекса, слабое сосание во время кормления может быть поводом для беспокойства.
- Припадки или судорожные движения: Дети с церебральным параличом и подобными нарушениями имеют очень отчетливые непроизвольные движения.Аномальные движения глаз и пронзительный болезненный крик также являются симптомами ВЖК.
Простая, бесплатная и бесплатная оценка случая может помочь улучшить качество жизни вашего ребенка и дать вам душевное спокойствие.
Какие формы IVH?
Существует несколько форм ВЖК. В их числе:
Внутрижелудочковое кровоизлияние
Этот тип кровотечения означает, что в крови содержится больше билирубина, чем необходимо. Нормальное количество этого соединения гарантирует, что определенные отходы, такие как старые клетки, расщепляются должным образом.Кровотечение обычно происходит в тканях, соединяющих полушария головного мозга. Здесь это нарушит общение и потенциально может привести к респираторным проблемам, таким как коллапс легкого или длительной инвалидности, такой как церебральный паралич.
Когда у младенца диагностируют эту форму, врачи обнаруживают кровь в боковых желудочках головного мозга. Причины, как правило, связаны с инсультом плода, инфекцией матери или каким-либо типом травмы во время родов или вскоре после них, например, синдром тряски ребенка.Гипертония у матери и сгустки плацентарной крови также могут быть потенциальными факторами. Как правило, если у младенца развивается ВЖК, несмотря на то, что он родился доношенным, это будет именно эта форма.
Эпидуральная гематома
Эпидуральная гематома возникает при разрыве артерий и венозных синусов, и это может произойти как у детей, так и у младенцев. Как правило, эта форма ВЖК связана с переломом черепа, поскольку перелом обычно встречается в 90% всех случаев. Разрыв может привести к скоплению крови, которая в конечном итоге сжимает окружающие ткани и оказывает давление на вещество в головном мозге.Если не лечить, это может привести к смерти.
Эпидуральная гематома почти всегда возникает в результате какого-либо типа травмы головы или несчастного случая, например, в результате падения ребенка на голову. Эпидуральная гематома возникает у детей старшего возраста, как правило, в результате падения. Врачи могут порекомендовать операцию по поводу эпидуральной гематомы, чтобы снять давление, вызванное кровотечением.
Субдуральная гематома
Эта форма ВЖК также связана с травмой, хотя последствия могут быть даже более серьезными, чем эпидуральная гематома.Кровотечение, как правило, быстрое и обильное, что означает, что компрессия происходит намного быстрее и сильнее. Обычно это вызвано травмой, такой как жестокое обращение с детьми или тяжелые роды. Симптомы включают летаргию, рвоту или вздутие мягкого места.
После кровотечения ребенок может казаться раздражительным или проявлять общее изменение личности. В случае жестокого обращения ребенок может сразу потерять сознание. Или признаками могут быть только лихорадка, головные боли или скованность шеи. Родители также должны следить за расширением зрачков, судорогами и рвотой.Субдуральную гематому можно пережить, но шанс на полное выздоровление редок. Обычно всегда бывает необратимое повреждение головного мозга из-за тяжести кровотечения.
Субарахноидальная гематома
Этот тип ВЖК возникает после родовой травмы и поражает вены и оболочки, окружающие мозг младенца. Субарахноидальное пространство служит защитной подушкой между мозгом и тканями, которые его окружают. Субарахноидальная гематома обычно вызывает судороги в течение первых двух дней после травмы.Другими признаками могут быть ригидность шеи или общее чувство вялости.
Кровотечения можно обнаружить с помощью компьютерной томографии, хотя, возможно, врач также сделает люмбальную пункцию, чтобы убедиться в отсутствии менингита. Помимо тяжелых родов, субарахноидальная гематома также может быть вызвана жестоким обращением с детьми, например, синдромом тряски ребенка. Время имеет существенное значение, если вы видите какие-либо признаки, которые могут указывать на это состояние.
Внутримозговое кровоизлияние
Мозг может поглощать определенную силу во время травмы головы.Однако, когда мозг не может справиться с ударом, может произойти внутримозговое кровоизлияние. В этом случае кровотечение происходит между мозгом и черепом при разрыве кровеносных сосудов. Устойчивое повреждение происходит, если есть чрезмерное кровотечение, которое также содержит спинномозговую жидкость. Обычно это происходит в передней части височной доли или задней части лобной доли головного мозга.
Это необычно, чтобы увидеть этот тип травмы у маленьких детей, но известно, что такое случается. К сожалению, симптомы могут быть практически несуществующими, и причиной этого могут быть, казалось бы, незначительные удары головой.Операция часто необходима как можно скорее, чтобы уменьшить давление, в противном случае вероятно длительное повреждение.
Как эти формы влияют на детей с церебральным параличом?
ВЖК — один из нескольких факторов риска церебрального паралича. Каждый ребенок по-разному реагирует на каждое состояние, и последствия обычно зависят от тяжести кровотечения, силы травмы и количества времени, необходимого для оказания ребенку надлежащей медицинской помощи. Чем больше повреждены артерии, желудочки или вены, тем больше вероятность того, что у ребенка разовьются более серьезные симптомы церебрального паралича.
Источники, используемые в этой статье
Внутричерепное кровоизлияние — как оно вызывает церебральный паралич
Что такое внутричерепное кровоизлияние?
Врачи используют термин «внутричерепное кровоизлияние» для обозначения кровотечения в головном мозге или между мозгом и черепом. Сильное внутричерепное кровоизлияние может вызвать необратимое повреждение мозга и проблемы со здоровьем на всю жизнь.
Как и другие виды внутреннего кровотечения, внутричерепные кровоизлияния опасны, потому что вы можете не сразу узнать, что произошло.Внутричерепные кровоизлияния могут повредить или убить части мозга, которые контролируют развитие и двигательную функцию. Поэтому они часто приводят к церебральному параличу, если их не выявлять и не лечить быстро.
Многие проблемы могут вызвать внутричерепное кровоизлияние, причем травмы головы являются наиболее частой причиной для людей моложе 50 лет. Младенцы также могут подвергаться более высокому риску внутричерепного кровоизлияния.
Во время родов у младенца может возникнуть внутричерепное кровоизлияние из-за осложнений во время родов.У будущего плода могут быть проблемы со свертыванием крови или неправильное формирование кровеносных сосудов в головном мозге. На них также может влиять материнская гипертензия (высокое кровяное давление у матери). В хаосе родильного зала специалисты-медики могут не заметить внутричерепного кровоизлияния.
Рекомендуется проверить наличие внутричерепного кровоизлияния как фактора церебрального паралича или родовой травмы сразу после рождения.
Симптомы внутричерепного кровоизлияния у младенца включают:
- Вялость
- Острый плач
- Изменение цвета кожи
- Изменения в анализе крови
- Неравномерное движение глаз
Внутричерепная гематома
Внутричерепное кровоизлияние может вызвать локальный отек мозга, называемый внутричерепной гематомой.Это происходит, когда кровотечение изолировано в определенной части мозга, и кровь давит на ткани мозга.
Гематома — это комок или сгусток поврежденных клеток крови. Когда возникает внутричерепная гематома, это может быть опасно для жизни и требует немедленного лечения. Если не лечить, внутричерепная гематома может вызвать серьезные осложнения.
Врачи могут прописать лекарства или выполнить операцию для удаления собранной крови и уменьшения давления на мозг.
Внутрижелудочковое кровоизлияние
Внутрижелудочковое кровоизлияние (ВЖК) у новорожденных возникает, когда кровь попадает в желудочки (полые пространства) головного мозга или между ними. Кровь не должна возвращаться в желудочковую систему. Если это произойдет, это может вызвать серьезное повреждение головного мозга или церебральный паралич.
По данным Национального института здоровья (NIH), внутрижелудочковые кровоизлияния подразделяются на четыре степени. Чем выше оценка, тем сильнее кровотечение.
Четыре класса:
- Степень 1: Кровотечение ограничивается зародышевым матриксом или перивентрикулярными областями мозга.Это также называется кровоизлиянием в зародышевый матрикс.
- Класс 2: Кровотечение распространяется в желудочки (полые пространства) в головном мозге, но они не расширяются.
- Класс 3: Из-за количества крови в желудочках они увеличиваются.
- Класс 4: Кровотечение достигает ткани головного мозга. Это также называется перивентрикулярным кровоизлиянием (ПВГ). Это самый высокий риск необратимого повреждения.
1 и 2 степени обычно не вызывают осложнений.3 и 4 степени являются наиболее серьезными и могут привести к длительной травме головного мозга или внутрижелудочковому кровоизлиянию, вызывающему церебральный паралич.
Недоношенные дети подвергаются наибольшему риску внутрижелудочкового кровотечения, особенно если они весят менее 3 фунтов 4 унции. Они подвержены высокому риску, потому что у них много хрупких кровеносных сосудов в головном мозге, которым можно легко повредить в процессе родов и / или респираторной недостаточности.
Около 25% недоношенных детей будут испытывать внутрижелудочковое кровоизлияние.
Лучший способ предотвратить внутрижелудочковое кровоизлияние — это предотвратить преждевременные роды. Матерям, которые подвержены риску преждевременных родов, часто назначают дородовые стероиды, чтобы помочь с созреванием легких плода. Это помогает снизить риск респираторного дистресс-синдрома у ребенка, который может привести к кровотечениям.
Внутрижелудочковые кровоизлияния можно диагностировать с помощью УЗИ черепа или компьютерной томографии. УЗИ головы рекомендуется всем детям, родившимся до 30 недель беременности.Она проводится в возрасте от 1 до 2 недель и повторяется примерно до предполагаемой даты родов.
Кроме того, с помощью люмбальной пункции в спинномозговой жидкости ребенка проверяется наличие высоких концентраций белка и красных кровяных телец, которые присутствуют у младенцев, перенесших внутрижелудочковое кровоизлияние.
Симптомы внутрижелудочкового кровотечения
Это несколько характерных симптомов внутрижелудочкового кровоизлияния. Каждый ребенок может испытывать симптомы по-разному.
Эти симптомы включают:
- Остановка дыхания (апноэ)
- Низкая частота пульса
- Бледно-голубая окраска
- Слабый отсос
- Высокий крик
- Припадки, отек или вздутие «мягких мест» на голове ребенка
- Низкий анализ крови
Переливание крови может улучшить кровяное давление и количество крови. Для уменьшения давления на мозг может потребоваться операция. Насколько хорошо ребенок себя чувствует, зависит от количества кровотечений и отеков.
Рекомендуется регулярно посещать врача в течение нескольких лет после постановки диагноза внутрижелудочкового кровоизлияния для выявления осложнений.
Внутримозговое кровоизлияние
Внутримозговое кровоизлияние — это тяжелый инсульт в головном мозге. Инсульт иногда называют «мозговой атакой».
Внутримозговые кровоизлияния могут вызвать необратимое повреждение головного мозга, тяжелую инвалидность или смерть, если их не выявить и не лечить на ранней стадии.
У широкой публики инсульт обычно ассоциируется со взрослыми, особенно пожилыми.Однако инсульты могут возникнуть в любом возрасте. Плод, новорожденный, младенец или маленький ребенок могут быть подвержены риску инсульта.
Инсульт может произойти, когда сгусток или другое препятствие блокирует кровеносный сосуд. Инсульты также могут возникать при разрыве кровеносного сосуда в головном мозге. При внутримозговом кровоизлиянии кровь разливается в пространства вокруг клеток и повреждает их. Если кровоизлияние повреждает области мозга, контролирующие движения, результатом может быть частичный или полный паралич.
Инсульт случается примерно у 1 из 3000 рождений, как во время беременности, так и в раннем периоде новорожденности.Дети с гематологическими нарушениями, такими как серповидноклеточная анемия, подвержены более высокому риску инсульта.
Субарахноидальная гематома
Субарахноидальная гематома — очень опасное состояние, при котором кровь собирается под паутинной оболочкой, тонкой оболочкой, покрывающей мозг.
Субарахноидальная гематома может привести к многочисленным осложнениям, включая инсульт, судороги или смерть. Субарахноидальная гематома также может вызвать церебральный паралич, когда это аномальное кровотечение повреждает мозг.Особенно это актуально для младенцев, перенесших черепно-мозговые травмы.
Субарахноидальные гематомы и церебральный паралич диагностируются в первую очередь с помощью сканирования мозга, такого как УЗИ черепа. Прогноз зависит от того, где и как нанесен ущерб, но часто бывает не лучшим.
Для младенцев, рожденных с субарахноидальной гематомой, вызывающей церебральный паралич, шансы на самостоятельную жизнь серьезно подорваны. Ребенок, рожденный с церебральным параличом, вызванным субарахноидальной гематомой, часто нуждается в пожизненной медицинской помощи и помощи.
Субдуральная гематома
Субдуральная гематома — очень серьезное заболевание, обычно вызываемое травмой головы. В субдуральной гематоме крошечные вены между поверхностью мозга и его внешним покрытием (твердой мозговой оболочкой) растягиваются и разрываются, позволяя собираться крови.
Это может случиться с младенцем во время вынашивания или родов, а иногда может быть результатом халатности врача. Субдуральные гематомы могут вызвать церебральный паралич, когда кровотечение повреждает мозг.
Субдуральные гематомы и церебральный паралич диагностируются в первую очередь с помощью визуализационных исследований головного мозга, таких как ультрасонография черепа.Подобно субарахноидальным гематомам, субдуральные гематомы могут вызвать серьезные необратимые повреждения.
Ребенок, рожденный с церебральным параличом, вызванным субдуральной гематомой, скорее всего, будет нуждаться в медицинской помощи и помощи на протяжении всей жизни. Для многих семей оплата специального лечения и ухода за ними может быть сложной задачей и стрессом.
Эпидуральная гематома
Эпидуральные гематомы возникают в результате инсульта. При эпидуральной гематоме сгусток располагается между внутренней стороной черепа или костей позвоночника и внешней «кожей», покрывающей головной или спинной мозг.
Кровь, которая выходит из каналов или свертывается в головном мозге, может повредить нейроны, которые контролируют мышцы и контроль движений. Повреждение этих клеток приводит к церебральному параличу.
У младенцев инсульт может возникнуть во время беременности, родов, родов или сразу после рождения. Инсульт у ребенка поражает мозг, который еще не вырос. Если вовремя не лечить, у ребенка может развиться эпидуральная гематома и / или церебральный паралич.
Внутрижелудочковое кровоизлияние (ВЖК) — Американская ассоциация беременных
Внутрижелудочковое кровоизлияние (ВЖК) — это кровотечение в желудочках мозга или вокруг них.Это состояние чаще всего встречается у недоношенных детей (хотя его разновидности встречаются во всех возрастных группах). ВЖК может оказывать давление на нервы в головном мозге и вызывать травмы и необратимые повреждения.
Когда случается внутрижелудочковое кровоизлияние?
Это состояние обычно не проявляется при рождении, а возникает в течение первых трех-четырех дней после рождения. Важно понимать признаки и меры, которые следует предпринять, если ребенок может страдать от этого заболевания.
Для младенцев, родившихся до 30 недель или с массой тела менее 5 фунтов 3 унции, всегда полезно попросить УЗИ в первые дни после рождения.Это один из самых эффективных способов узнать, есть ли у ребенка ВЖК. После 1 месяца выхода из матки риск ВЖК практически отсутствует.
Степени внутрижелудочковых кровотечений
I-IV степени:
- Степень I — Кровотечение желудочков на небольших участках (также известное как кровоизлияние в зародышевый матрикс)
- Степень II — Внутри желудочков обнаружено кровотечение
- Степень III — Кровь вызывает расширение желудочков и давит на ткани мозга
- Степень IV — Кровь обнаруживается в тканях мозга, окружающих желудочки (также известное как внутрипаренхиматозное кровоизлияние).
Степени 1 и 2 являются наиболее распространенными и относятся к меньшему количеству кровотечений. Как правило, кровотечение 1 или 2 степени не вызывает необратимых повреждений и поддается лечению.
Степень 3 и 4 диагностируется, когда в желудочки попало такое сильное кровотечение, что они увеличены и сгустки крови могут препятствовать оттоку спинномозговой жидкости. Это увеличивает количество жидкости в головном мозге, иначе известное как гидроцефалия.
Причины:
Нет легко определяемой причины внутрижелудочкового кровоизлияния.Состояние возникает из-за того, что кровеносные сосуды не полностью развиты или недостаточно сильны, чтобы поддерживать кровоток (вот почему это редко встречается у более развитых детей).
Хотя это может быть вызвано травмой головы или давлением при родах, это также может произойти без особого предупреждения или причины.
На вероятность возникновения этого состояния могут влиять многие факторы. Наибольшему риску подвержены недоношенные дети, особенно родившиеся на десять недель раньше или раньше. Чем более недоношенный ребенок, тем больше он подвержен этому и другим осложнениям со здоровьем.
Недоношенные дети, рожденные с респираторными проблемами (например, RDS) или другими осложнениями из-за недоношенности, также подвержены более высокому риску. Младенцы, у которых наблюдаются другие проблемы с кровью, инфекции и / или синдром тряски младенца, имеют повышенный риск внутрижелудочкового кровоизлияния.
Симптомы »
Иногда у младенцев с внутрижелудочковым кровотечением могут наблюдаться незначительные симптомы или их отсутствие. В других случаях могут возникать различные симптомы.
Поскольку многие из этих симптомов также могут указывать на другие состояния, важно проконсультироваться с врачом, если вы заметили любое из следующего:
- Апноэ или затрудненное дыхание
- Снижение или замедление рефлексов
- Летаргия или ребенок спит ненормально длительное время / часто
- Изменения ЧСС
- Слабое сосание при кормлении грудью
- Изъятия
- Плач высокий
- Бледная или голубая окраска кожи
- Пониженный мышечный тонус
Хотя ни один из этих симптомов не является верным признаком внутрижелудочкового кровоизлияния, все они могут указывать на серьезную проблему, и на них следует обратить внимание медицинского работника.
УЗИ головы и анализы крови могут определить, страдает ли ребенок внутрижелудочковым кровоизлиянием и в какой степени.
Ультразвук также может помочь определить, страдает ли ребенок другим заболеванием или осложнением.
Общие методы лечения:
Не существует естественного лекарства от внутрижелудочкового кровотечения, но есть шаги, которые врачи и матери могут предпринять, чтобы предотвратить или уменьшить последствия этого состояния.
Матери с высоким риском преждевременных родов могут быть прописаны определенные стероиды, чтобы снизить риск их развития у недоношенного ребенка.
Если обнаруживается, что у ребенка внутрижелудочковое кровоизлияние, врачи могут попытаться уменьшить симптомы и стабилизировать состояние ребенка, чтобы предотвратить дальнейшие повреждения, пока он заживет. В более крайних случаях можно использовать хирургическое вмешательство, чтобы попытаться стабилизировать состояние ребенка. Перед операцией врачи могут слить спинномозговую жидкость с помощью иглы или с помощью менее инвазивной хирургии, чтобы уменьшить давление на желудочки.
Как правило, младенцы с менее тяжелыми оценками выздоравливают самостоятельно; однако медицинская помощь может дать им наилучшие шансы на выздоровление без повреждений или с минимальными повреждениями.
Прогноз внутрижелудочкового кровоизлияния:
Результат зависит от тяжести внутрижелудочкового кровоизлияния и от того, насколько недоношенным будет ребенок, когда он разовьется. Чем более развит ребенок, тем меньше для него риска. Большинство младенцев, страдающих 1 или 2 степенью, выживут с минимальным ущербом. Менее одной трети детей с 3-й или 4-й степенью заболевания умирают из-за этого или могут получить серьезные долгосрочные повреждения.
Однако при правильном лечении и своевременном выявлении прогноз в большинстве случаев может быть очень многообещающим.
Советы по профилактике внутрижелудочкового кровотечения:
Трудно предотвратить внутрижелудочковое кровоизлияние, если не считать некоторых лекарств, которые могут снизить риск, и, конечно же, обеспечения отличного ухода за недоношенными детьми.
Другие факторы, которые могут помочь снизить вероятность, включают:
- Роды в больнице с отделением интенсивной терапии (чтобы младенцев можно было лечить быстрее и с минимальными движениями)
- Отсроченное пережатие пуповины или доение пуповины
- Прием витамина К перед родами (особенно для женщин, которые могут принимать лекарства, изменяющие кровоток и повышающие риск кровотечения)
Если ваш ребенок недоношенный или вас особенно беспокоит это состояние, поговорите со своим врачом, чтобы узнать, какие меры можно предпринять для предотвращения и лечения внутрижелудочкового кровоизлияния.
Составлено с использованием информации из следующих источников:
1. NIH.gov. Национальная медицинская библиотека США. «Внутрижелудочковое кровоизлияние у новорожденного»
https://medlineplus.gov/ency/article/007301.htm
2. StanfordChildrens.org. Стэндфордская медицина. «Внутрижелудочковое кровоизлияние»
https://www.stanfordchildrens.org/en/topic/default?id=intraventricular-hemorrhage-90-P02608
3. CerebralPalsy.org. «Внутрижелудочковое кровоизлияние или ВЖК»
https://www.cerebralpalsy.org/about-cerebral-palsy/cause/intraventricular-hemorrhage
4. URMC.Rochester.edu Медицинский центр Университета Рочестера: Энциклопедия здоровья. «Внутрижелудочковое кровоизлияние»
https://www.urmc.rochester.edu/encyclopedia/content.aspx?contenttypeid=90&contentid=P02608
5. Бостонская детская больница: внутрижелудочковое кровоизлияние.
https://www.childrenshospital.org/conditions-and-treatments/conditions/intraventricular-hemorrhage
факторов риска, влияющих на тяжесть доношенного неонатального кровоизлияния в сетчатку
Цель . Целью этого исследования было изучить основные клинические факторы, связанные со степенью кровоизлияния в сетчатку (RH) у доношенных новорожденных. Методы . В это исследование было включено 3054 доношенных ребенка. Офтальмологические обследования проводились с помощью RetCamIII в течение одной недели после рождения для всех младенцев.Материнские, акушерские и неонатальные параметры сравнивали между новорожденными с RH и контрольной группой. Группа RH была разделена на три секции (I, II и III) в зависимости от степени RH. Результатов . В этом исследовании RH наблюдался у 1202 из 3054 младенцев (39,36%). Количество и доля новорожденных в группах I, II и III составили 408 (13,36%), 610 (19,97%) и 184 (6,03%) соответственно. Самопроизвольные роды через естественные родовые пути (SVD), увеличенная продолжительность второго периода родов, пожилой возраст матери и внутричерепное кровоизлияние у новорожденных положительно коррелировали с ухудшением степени RH у новорожденных.И наоборот, кесарево сечение защитило от развития резус-фактора риска. Выводы . СВД, увеличенная продолжительность второго периода родов, пожилой возраст матери и неонатальное внутричерепное кровоизлияние были потенциальными факторами риска ухудшения степени резус-фактора у доношенных детей. Соответственно, младенцам с этими факторами риска может потребоваться большее внимание в отношении развития резус-фактора.
1. Введение
Неонатальное кровоизлияние в сетчатку (RH) — это клинически распространенное заболевание глазного дна новорожденного, возникающее у новорожденных в течение одного месяца после рождения [1].В целом неонатальный резус не влияет на развитие зрительной функции, хотя кровоизлияние в желтое пятно может привести к амблиопии из-за задержки абсорбции, вызванной кровотечением [2]. Прогноз часто неблагоприятный при клинически тяжелой RH, и качество жизни пострадавшего ребенка может серьезно пострадать. В настоящее время факторы риска и механизмы, лежащие в основе неонатального резус-фактора, изучены недостаточно. Хотя существуют клинические исследования, в которых сообщается об анализе факторов риска RH, нет известных систематических исследований корреляции между различными факторами риска и степенью RH.Чтобы изучить факторы риска, связанные с повышением относительной влажности RH у новорожденных, мы провели статистический анализ заболеваемости и степени RH в большой выборке доношенных новорожденных.
2. Методы
2.1. Субъекты
В исследование были включены три тысячи пятьдесят четыре доношенных ребенка, родившихся в дочерней больнице Чжуншань Университета Сунь Ятсена (Городская народная больница Чжуншань) в период с января 2013 года по декабрь 2014 года. Все младенцы имели гестационный возраст более 37 недель и балл по шкале Апгар 9 или выше; они прошли обследование глазного дна с согласия их семей.Младенцы с тяжелыми системными заболеваниями (например, тетралогия Фалло и фенилкетонурия) или другими заболеваниями глаз (например, врожденная катаракта и первичная врожденная глаукома) или чьи матери знали о наследственных заболеваниях, были исключены из исследования. Исследование было одобрено этическим комитетом при филиале больницы Чжуншань Университета Сунь Ятсена (Народная больница города Чжуншань).
2.2. Сбор данных
Мы собрали подробную информацию по каждому новорожденному с учетом общих, материнских, акушерских и неонатальных параметров.Общие параметры включали возраст матери, гестационный возраст, пол младенца и массу тела при рождении. Параметры матери включали кесарево сечение, гестационный диабет (ГСД), гипертензию, вызванную беременностью, анемию, талассемию, отслойку плаценты, преждевременный разрыв плодных оболочек, преэклампсию и эклампсию. Акушерские параметры включали способ родоразрешения (спонтанные вагинальные роды (SVD) по сравнению с кесаревым сечением (CS)), использование щипцов, послеродовое кровотечение, экстренные роды, инерцию матки, продолжительность первого и второго периода родов, разрыв родовых путей ( е.g., разрыв шейки матки, разрыв влагалища и разрыв промежности), бипариетальный диаметр плода и индекс околоплодных вод (в пределах одной недели до рождения) и измерения в тазу (включая диаметр передней верхней подвздошной ости, диаметр подвздошной ости, диаметр крестцового стыка и диаметр седалищного бугра). Неонатальные параметры включали внутричерепное кровоизлияние, черепную гематому, пуповину вокруг шеи плода, неонатальную гипербилирубинемию (NHB), несовместимость групп крови ABO матери и экстракорпоральное оплодотворение до переноса эмбриона (ЭКО-ЭТ).
2.3. Осмотр глаз
Осмотр глаз был проведен в течение одной недели после рождения (среднее значение = 1,92 ± 2,12 дня). Все обследования глаз, визуализация и считывание показаний проводились командой опытных специалистов по сетчатке и медсестер. Сначала был исследован передний сегмент путем выполнения стандартного теста качающегося фонарика на зрачковый световой рефлекс. Затем зрачки расширяли с помощью трех капель 1% составных глазных капель тропикамида (Santen Pharmaceutical Co. Ltd, Япония), вводимых с интервалом в десять минут, и применяли местную анестезию (глазные капли Alcaine, Alcon).Детское зеркало использовалось, чтобы держать глаза открытыми, и цифровые изображения с широким углом обзора 130 ° были получены с помощью RetCamIII (Clarity Medical Systems, Плезантон, Калифорния, США). Два опытных рецензента (Чжан Яньли и Линь Ю) независимо прочитали изображения, и разногласия были разрешены третьим старшим рецензентом (Чжао Ци).
2.4. Классификационная степень неонатального RH
На основании Egge et al. [3] критерии классификации (рис. 1, из нашего исследования), были идентифицированы три степени неонатального RH, которые были степенью I: небольшое кровотечение в ограниченном диапазоне с мелким линейным кровотечением, ограниченным областью вокруг диска зрительного нерва; степень II: кровоизлияние несколько больше с пятнистым пламенеющим кровотечением на площади, не превышающей диаметр диска зрительного нерва; III степень: кровоизлияние, превышающее диаметр области диска зрительного нерва, с пламенеющим кровотечением по сосудам и кровоизлиянием в желтое пятно.Младенцы без RH были включены в качестве контроля (группа 1), а дети с RH I, II и III степеней были разделены на группы 2, 3 и 4 соответственно. Когда степень RH была разной в обоих глазах, младенцев сгруппировали по глазу, у которого было более сильное кровотечение.
2.5. Статистический анализ
Используя SPSS 19.0, мы провели одномерные логистические регрессии, сравнивая различия в материнских, акушерских и неонатальных факторах между новорожденными с RH (степени I, II и III) и без RH (контрольная группа).Для факторов со значениями ниже 0,1 мы затем выполнили еще одну полиномиальную логистическую регрессию, чтобы удалить мешающие факторы, и факторы со значениями ниже 0,05 считались статистически значимыми.
3. Результаты
3.1. Описательная статистика общих, материнских, акушерских и неонатальных параметров у доношенных новорожденных
См. Таблицу 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа 1 = контроль; Группа 2 = степень I RH; Группа 3 = степень II RH; Группа 4 = степень III RH. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Влияние общих факторов на степень RH у доношенных новорожденных
Всего 3054 доношенных новорожденных прошли обследование RetCamIII; 44 были близнецами и 3010 — одиночками. Соотношение мужчин и женщин было 1.15: 1, средний гестационный возраст составил 39,30 ± 1,06 недели, а средний вес при рождении — 3220,56 ± 385,51 г. Среди 3054 новорожденных 1202 (39,36%) имели RH. Из них 408 (13,36%) были классифицированы как RH I степени, 610 (19,97%) были классифицированы как RH II степени и 184 (6,03%) были классифицированы как RH III степени. Остальные 1852 новорожденных (60,64%) не имели RH. Одномерная логистическая регрессия показала, что вес при рождении и пол новорожденного были значимыми факторами (см. Таблицу 2).
| ||||||||||||||||||||||||||||||
| a a .1234 | ||||||||||||||||||||||||||||||
3.3. Влияние материнских, акушерских и неонатальных факторов на степень RH у доношенных новорожденных
Результаты одномерной логистической регрессии показали, что способ родоразрешения, кесарево сечение, разрыв родовых путей, продолжительность второго периода родов, шнур вокруг шеи плода и внутричерепное кровоизлияние оказали значительное влияние (см. Таблицу 3).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| a Статистически значимо. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4. Анализ многомерной логистической регрессии факторов, влияющих на степень относительной влажности
Результаты одномерной логистической регрессии показали, что пол новорожденного, масса тела при рождении, внутричерепное кровоизлияние, способ родоразрешения, история кесарева сечения, возраст матери, продолжительность первого периода родов, продолжительность родов второй период родов, экстренные роды, преждевременный разрыв плодных оболочек, диаметр передней верхней подвздошной ости, разрыв родовых путей и пуповина вокруг шеи плода коррелировали со степенью RH у новорожденных ().Эти факторы были дополнительно проанализированы с помощью многомерной логистической регрессии, которая показала, что способ родоразрешения (SVD / CS), продолжительность второго периода родов, возраст матери и внутричерепное кровоизлияние у новорожденного оказали значительное влияние на степень RH у новорожденных (; см. Таблицу 4). Таким образом, самопроизвольные роды через естественные родовые пути, увеличенная продолжительность второго периода родов, преклонный возраст матери и внутричерепное кровоизлияние новорожденного являются факторами, которые усугубляют степень резус-фактора у доношенных новорожденных, в то время как кесарево сечение является защитным фактором против возникновения резус-фактора.
| ||||||||||||||||||||||||||||||||||||||||||
| a Статистически значимо. | ||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение
RH является одним из наиболее часто наблюдаемых глазных аномалий у новорожденных, и он может серьезно повлиять на зрительную функцию и качество жизни пострадавшего ребенка, когда он влияет на макулу. В последние годы мы стали свидетелями увеличения частоты выявления неонатального RH с быстрым развитием методов неонатального обследования сетчатки глаза, а также развитием RetCamIII и других новых технологий, и растет беспокойство по поводу неонатальной ретинопатии [4].Как распространенная форма неонатальной патологии, неонатальный резус-фактор все чаще привлекает внимание педиатров и офтальмологов.
В этом исследовании частота неонатального RH составила 39,36%, что согласуется с результатами нашего предыдущего исследования [5], а также с данными Mao et al. [6] и Liu et al. [7]. В последние годы исследователи начали изучать факторы и механизмы риска, лежащие в основе неонатального RH. Например, Choi et al. [8] предположили связь между RH и давлением на головку плода в родовых путях, например, сжатие головки плода во время родов вызывает деформацию, которая приводит к повышенному внутричерепному венозному давлению, периферическому сосудистому застою, расширению или разрыву, что приводит к кровоизлияние.Неонатальная асфиксия и неонатальная гипоксическая ишемическая энцефалопатия могут способствовать гипоксии сетчатки, а разрыв лизосом, образующихся во время гипоксии, запускает автолиз, что приводит к некрозу и кровоизлиянию эндотелиальных клеток капилляров сетчатки. Кроме того, гипоксия может привести к спазму сосудов, стенозу просвета, набуханию эндотелия сосудов и увеличению доступа к сосудам, что приводит к кровотечению. Вена сетчатки расширяется во время гипоксии, а увеличенный объем крови и повышенная вязкость крови вызывают расширение сосудов сетчатки или кровоизлияние [9].
Результаты этой серии исследований показывают, что СВД является фактором риска неонатального резус-фактора, а кесарево сечение является защитным фактором [5]. Аналогичным образом, в текущем исследовании мы обнаружили, что СВД была связана с увеличением степени RH, в то время как кесарево сечение было связано с уменьшением степени RH [10]. Watts et al. [2] также сообщают, что, по сравнению с SVD, кесарево сечение значительно снижает частоту неонатального RH. Основной механизм может быть вызван сдавлением головки плода во время родов через естественные родовые пути.В частности, внутричерепное давление внезапно увеличивается во время вагинальных родов, что сопровождается повышением давления в центральной вене сетчатки. В то же время вены скальпа и внутричерепные вены расширяются из-за обструкции венозного возврата. Поскольку стенки сосудов у новорожденных тоньше, они легко разрываются, что приводит к возможному развитию резус-фактора и соответствующему увеличению его тяжести.
На основе одностороннего логистического регрессионного анализа мы узнали, что наличие пуповины вокруг шеи плода является фактором риска кровоизлияния в сетчатку новорожденного.Как связующее звено между плодом и плацентой, пуповина является единственным источником питания плода и каналом для материального обмена с матерью. Пуповина вокруг шеи плода — частое осложнение в акушерстве [11–13], которое может приводить к задержке внутриутробного развития плода, внутричерепному кровоизлиянию новорожденных, асфиксии и другим неблагоприятным исходам беременности [14–16]. Механизм, с помощью которого спинной мозг вокруг шеи плода вызывает кровоизлияние в сетчатку, включает неонатальную гипоксию, гипоплазию сосудистой стенки и повышенную проницаемость сосудов, что в дальнейшем приводит к аномальной коагуляции.По мере прогрессирования родов в процессе родоразрешения плод сначала постепенно опускается вниз по мере увеличения сокращений, а артериовенозные сосуды пуповины испытывают натяжение пуповины вокруг шеи плода, снижая артериальное кровоснабжение плода, что затем приводит к кратковременному сокращению. ишемия и гипоксия кровеносных сосудов головного мозга, включая артерию сетчатки. В то же время обструкция венозного возврата и кровообращения также приводит к ишемии тканей и гипоксии [17]. При возникновении этого осложнения шея плода подвергается давлению пуповиной.В то же время кровообращение затруднено из-за обструкции венозного возврата и закупорки и расширения капилляров. Под совместным действием этих факторов нарушается клеточный метаболизм в стенке периферических сосудов сетчатки и нарушается функция внеклеточного матрикса, что в конечном итоге приводит к телеангиэктазии, разрыву и повышенной проницаемости [18]. Однако результаты этого исследования показали, что связь между наличием пуповины вокруг шеи плода и степенью кровоизлияния в сетчатку не была значительной.Это может быть связано с тем, что большинство матерей, испытывающих это осложнение, выбирают кесарево сечение, чтобы избежать или уменьшить сжатие кровеносных сосудов в шейке плода во время процесса родов, а также внутривенное сжатие из-за чрезмерного натяжения и движения самой пуповины.
В этом исследовании мы обнаружили, что увеличенная продолжительность второго периода родов является фактором риска увеличения кровоизлияния в сетчатку. Во втором периоде родов шейка матки полностью раскрыта, головка плода опущена вниз, схватки сильнее.В то же время плод предрасположен к внутриутробной ишемии и гипоксии плода из-за сдавливания, натяжения пуповины и т. Д. Более того, гипоксия вызывает повышенную рефлексивность кислых метаболитов, которые возбуждают блуждающий нерв. В свою очередь, опорожнение кишечника ускоряется, а загрязнение околоплодных вод выделениями мекония также может усилить гипоксию плода. Следовательно, чем дольше второй период родов, тем серьезнее повреждение вены сетчатки и эндотелиальных клеток сосудов, в результате чего первые становятся фактором риска увеличения неонатального кровоизлияния в сетчатку [19].Мы также обнаружили, что пожилой возраст матери является фактором риска увеличения кровоизлияния в сетчатку. Женщины пожилого возраста матери, как правило, испытывают тревогу, депрессию и другие негативные эмоции, повышая риск для себя и своих плодов [20]. Такие негативные эмоции и психологическая нагрузка могут вызвать инертность матки и продлить второй период родов, увеличивая степень кровоизлияния в сетчатку.
С помощью многомерного логистического регрессионного анализа мы обнаружили, что внутричерепное кровоизлияние является фактором риска увеличения кровоизлияния в сетчатку.Основываясь на экспериментах на животных, Каур и Тейлор [21] сообщили, что при повышении внутричерепного давления вена сетчатки расширяется и венозный возврат затруднен, что вызывает отек диска и кровоизлияние в сетчатку. Таким образом, новорожденных с серьезным кровоизлиянием в сетчатку следует рассматривать как подозреваемых на сопутствующее внутричерепное кровоизлияние, в то время как новорожденные с внутричерепным кровоизлиянием должны проходить обследование глазного дна, чтобы исключить наличие кровоизлияния в сетчатку.
В Китае нет единого стандарта для классификации неонатального RH; большинство из них используют международно признанные критерии классификации из Watts et al.и Egge et al. [2, 3], которые мы приняли в данной работе. Поскольку эти критерии были установлены до появления широкоугольной визуализации сетчатки, эта система классификации не принимает во внимание периферический RH. С ростом популярности RetCamIII при скрининге глазного дна новорожденных было обнаружено, что эти критерии имеют определенные ограничения. Более того, критерии классификации Эгге и Ватта сосредоточены на количестве кровоизлияний в сетчатке в целом, игнорируя потенциальное клиническое значение воздействия, которое может иметь макулярное кровоизлияние и время абсорбции на долгосрочную зрительную функцию.Следовательно, существует необходимость в исследовании более строгих методов классификации неонатального RH.
Поскольку такие симптомы, как отслойка плаценты, эклампсия, гематома черепа и связанные с ними состояния, не проявлялись во всех различных группах новорожденных с резус-фактором, наши данные не отражают в полной мере демографические характеристики, и в настоящее время нет возможности их оценить. оценить их влияние на степень неонатального RH. Поэтому следует проводить более централизованные крупномасштабные эпидемиологические исследования, чтобы помочь выяснить факторы, влияющие на степень неонатального RH, и облегчить эффективную профилактику и лечение неонатальных глазных заболеваний.
Таким образом, наши результаты позволяют предположить, что СВД, увеличенная продолжительность второго периода родов, преклонный возраст матери и внутричерепное кровоизлияние у новорожденных являются факторами риска, которые усугубляют степень неонатального резус-фактора. Самое главное, пристальное внимание к новорожденным с этими факторами риска поможет в раннем обнаружении и своевременном лечении нарушений зрительной функции, улучшая качество жизни пострадавших детей. Рекомендуется, чтобы клинические акушеры, неонатологи и офтальмологи обращали внимание на эти факторы и проводили целенаправленный скрининг глазного дна новорожденных, чтобы помочь в раннем вмешательстве.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Границы | У недоношенных новорожденных внутрижелудочковое кровоизлияние вызывает церебральный вазоспазм и связанную с ним нейродизбализацию из-за индуцированной гемом продукции интерлейкина-1, опосредованной инфламмасомами, и истощения оксида азота
Введение
Артериальное развитие сначала завершается в стволе мозга и мозжечке (20-24 недели), затем в базальных ганглиях и промежуточном мозге к 24-28 неделям и, наконец, в коре и зародышевом матриксе.Разрыв хрупких капилляров в субэпендимном зародышевом матриксе может вызвать внутрижелудочковое кровоизлияние (ВЖК). Незрелость сосудистой сети головного мозга в пограничных зонах между сосудистыми территориями делает мозг недоношенных уязвимым для кровотечения (1). Незрелая вазорегуляция в сочетании с повышением артериального давления из-за стресса постнатальной адаптации после крайне преждевременных родов вносит свой вклад в патогенез ВЖК. ВЖК происходит через 12–72 ч после рождения (2). ВГК вызывает значительную заболеваемость и смертность в группе недоношенных детей.ВЖК встречается у 60–70% новорожденных с массой тела 500–750 г и у 10–20% новорожденных с массой тела 1000–1500 г (3). ВЖК можно разделить на четыре степени тяжести согласно Papile (4):
.
• Степень I — кровотечение происходит только в зародышевом матриксе.
• Степень II — кровотечение также происходит внутри желудочков, но они не увеличены.
• III степень — желудочки увеличены скопившейся кровью.
• IV степень — кровотечение распространяется в ткани мозга вокруг желудочков.
Недоношенность и низкая масса тела при рождении являются наиболее важными факторами риска кровотечения IV степени. Другие выявленные факторы риска ВЖК включают отсутствие пренатальной стероидной терапии у женщин с риском преждевременных родов, симптомы внутриутробной инфекции у новорожденных, лечение гипотонией болюсов жидкостью и катехоламинами и лечение метаболического ацидоза, нарушений свертываемости крови, тромбоцитопении и гипогликемия. Большинство упомянутых факторов риска связаны с системной воспалительной реакцией, связанной с высвобождением цитокинов (5).Недоношенные дети с ВЖК IV степени подвержены высокому риску развития невропатологических осложнений, включая постгеморрагическую гидроцефалию, перивентрикулярный геморрагический инфаркт, разрушение зародышевого матрикса и перивентрикулярную лейкомаляцию. Это приводит к значительным нарушениям нервного развития. В одном исследовании случай-контроль с участием 1472 новорожденных с преждевременными родами в анамнезе (гестационный возраст 23–28 недель), у детей с ВЖК III – IV степени значительно увеличилась частота церебрального паралича (30%), задержка развития (17.5%), глухота (8,6%) и слепота (2,2%). Младенцы с ВЖК I – II степени также имели по сравнению с младенцами без ВЖК повышенную частоту нейросенсорных нарушений (22 против 12,1%), церебрального паралича (10,4 против 6,5%), задержки развития (7,8 против 3,4%) и глухоты (6,0 против 2,3%). %) (1). Тот факт, что более низкие степени ВЖК также связаны со значительной неврологической заболеваемостью, был подтвержден Patra et al. которые обнаружили, что у младенцев с чрезвычайно низкой массой тела при рождении с ВЖК I – II степени исходы в области нервного развития к 20 месяцам были хуже, чем у младенцев с нормальным УЗИ черепа (6).
Последствия экстравазации крови вокруг кровеносных сосудов очевидны из того, что мы узнали о патофизиологии повреждения головного мозга при субарахноидальном кровоизлиянии (САК) (7, 8). Экстравазированные эритроциты высвобождают свободный гемоглобин, который действует как поглотитель оксида азота (NO) (7). NO, который генерируется из l-аргинина эндотелиальной NO-синтазой, стимулирует растворимую гуанилатциклазу в сосудистой мышце, что приводит к увеличению внутриклеточной концентрации гуанозин-3 ‘, 5’-циклического монофосфата, что приводит к расслаблению гладких мышц сосудов (9).Истощение запасов NO впоследствии приводит к сужению сосудов, вызывая ишемию и последующее повреждение тканей (7).
Свободный гем и повреждение ткани вызывают локализованный воспалительный ответ с участием инфламмасомы, а именно активацию белка 3, содержащего домен пиринового домена (NLRP3), связывающего нуклеотид и домен олигомеризации (10). Гем активирует NLRP3 через рецепторы P2X, особенно P2X7R и P2X4R. Молекулярный механизм, с помощью которого гем способствует активации NLRP3 в присутствии сыворотки, требует фосфорилирования Syk, активных форм кислорода и оттока K + .Затем активация NLRP3 приводит к увеличению продукции интерлейкина-1 (IL-1) в макрофагах. Все формы нейровоспаления, которые связаны с выработкой ИЛ-1, были связаны с церебральным вазоспазмом (11).
Интерлейкин-1 индуцирует продукцию IL-6. Было обнаружено, что повышенные концентрации IL-6 в спинномозговой жидкости связаны с повреждением белого вещества у недоношенных детей (12).
Интерлейкин-1 вызывает сужение сосудов за счет зависимых от кальция и независимых механизмов.Исследования пациентов с САК показали, что уровни IL-1-бета в спинномозговой жидкости были увеличены и коррелировали с более поздним развитием церебрального вазоспазма. IL-1 действует через рецепторы, связанные с G-белком, путем активации внутриклеточной фосфолипазы C и активации протеинкиназы C (PKC), опосредованной фосфолипазой (11):
1. Фосфатидилинозитолтрифосфат, продуцируемый активностью фосфолипазы C, приводит к высвобождению кальция, что вызывает активацию киназы легкой цепи миозина (MLC), запускающую активацию MLC и кальций-зависимый вазоспазм.
2. Активация PKC диацилглицерином, вызванная действием фосфолипазы C из фосфатидилинозитол (4,5) бисфосфата, может действовать через фосфорилирование и, следовательно, активацию киназы MLC. Было обнаружено, что с этим механизмом связано длительное сокращение кровеносных сосудов, продолжающееся до 2 недель.
3. Фосфорилирование MLC после активации PKC увеличивается за счет активации rho-киназы и миозин-связывающей субъединицы (MBS) фосфатазы MLC (MLCPh). Таким образом, Rho-киназа фосфорилирует MBS, что приводит к ингибированию MLCPh.Сниженная активность MLCPh связана с повышенным фосфорилированием и, следовательно, сократительной способностью MLC, что приводит к кальций-независимому вазоспазму. Существует очень значимая корреляция между степенью фосфорилирования MBS и сокращениями.
Гипотеза
У недоношенных новорожденных ВЖК вызывает церебральный вазоспазм и связанную с ним нейродезависимость через индуцированное гемом усиление продукции IL-1, опосредованной инфламмасомами, и истощение NO.
Объяснение гипотезы
Эта гипотеза утверждает, что эффекты продуктов распада экстравазированных эритроцитов вызывают сокращение кровеносных сосудов на артериальной стороне кровообращения, и что это сокращение вызывает недостаток кровоснабжения, что приводит к гибели нейрональных клеток, вызывая необратимое повреждение мозга и, как следствие, нейродизабильность.Предыдущие теории связывали повреждение головного мозга после кровоизлияния в основном с ишемией из-за разрыва питательных сосудов, застоем кровотока из-за нарушения венозного оттока, ишемией из-за эффекта давления, вызванного экстравазированной кровью или блокадой дренажа спинномозговой жидкости, а также цитотоксическими эффектами постгеморрагического воспалительного процесса. ответ (13, 14).
Эти эффекты могут присутствовать и способствовать повреждению головного мозга, но за исключением мер по снижению внутричерепного давления, которые в значительной степени недоступны для терапевтических вмешательств, необходимо изучить обратимые факторы, такие как спазм сосудов, чтобы найти способы улучшения результата.Вазоспазм — обратимая причина ишемии, и ее можно устранить с помощью профилактических и терапевтических вмешательств.
Доказательства в поддержку гипотезы
• У пациентов с САК дополнительная ВЖК IV степени достоверно связана с ультраранним ангиографическим вазоспазмом, который был связан с симптомами, отсроченной церебральной ишемией и инфарктом, неблагоприятным исходом при последующем наблюдении и большей смертностью (15).
• С помощью транскраниальной допплерографии признаки церебрального вазоспазма были обнаружены при всех формах ВЖК, включая те, которые возникают в результате гипертонии под влиянием антикоагулянтов и антитромботических средств и артериовенозных мальформаций (АВМ).Это подтверждает гипотетическое предположение, что не процесс, вызывающий кровотечение, а сама кровь участвует в возникновении церебрального вазоспазма. У взрослых старше 50 лет церебральный вазоспазм был обычным явлением при ВЖК и наблюдался у 62,9% пациентов ( n = 62) при серийном транскраниальном ультразвуковом допплеровском сканировании, которое проводилось через 48 часов между 4 и 6 днями и между 7 и 7 днями. 9 после постановки диагноза ВЖК, включая озвучивание средней, передней и задней церебральных артерий, а также сифона, позвоночных артерий в сегменте V4 и базилярной артерии с градацией по пиковой систолической скорости (16).В исследовании с использованием более строгих критериев церебрального вазоспазма, включая в дополнение к критериям скорости, коэффициент Линдегаарда (отношение> 3 в потоке средней мозговой артерии к потоку внутренней сонной артерии как показатель церебрального вазоспазма) около 6% пациентов с ВЖК были обнаружены спазм сосудов (17).
• Подробные описания характеристик вазоспазма и попыток лечения доступны в отчетах о случаях. Имеется 13 предыдущих сообщений о церебральном вазоспазме, связанном с ВЖК, как осложнении разрыва АВМ, в том числе несколько без САК (см. Таблицу 1).Было обнаружено, что у одного ребенка с ВЖК ранняя лихорадка является предиктором вазоспазма, аналогичным тому, который наблюдался у пациентов с САК, что подтверждает роль воспаления и эндогенного пирогенного IL-1 в возникновении обнаруженного спазма сосудов (18). Отсутствие успеха антагонистов кальция в снижении вазоспазма, о чем сообщалось в отчетах о случаях (см. Таблицу 1), и отсутствие влияния на исход внутримозговых кровотечений может быть связано с тем, что IL-1 вызывал вазоспазм преимущественно через кальций-независимый путь.
• Если индуцированный инфламмасомой ИЛ-1 вызывает повреждение головного мозга, вызванное спазмом сосудов, у недоношенных новорожденных с синдромом системной воспалительной реакции, не связанным с менингитом, должно быть повреждение головного мозга, связанное со стерильным воспалением головного мозга. Это действительно подтверждено. У недоношенных новорожденных с ранним клиническим сепсисом без менингита в 22% случаев были обнаружены признаки повреждения белого вещества на МРТ. Новорожденные со смертью или аномальным исходом нейровизуализации имели значительно более высокие уровни цереброспинального ИЛ-1 (19).
• Эффект ВЖК на спазм сосудов в артериях, удаленных от места расположения ВЖК, согласуется с одним или несколькими медиаторами, переносимыми ЦСЖ и передающими этот эффект от сгустка крови в артерии. Отсроченное начало спазма сосудов после ВЖК будет соответствовать пороговому значению концентрации медиаторов в спинномозговой жидкости, выше или ниже которого возникает вазоконстрикция. Спазм сосудов может также зависеть как от продолжительности эффекта, так и от количества задействованного медиатора. Таким образом, циркуляция спинномозговой жидкости может модулировать концентрацию любых вовлеченных медиаторов; Блэк ранее сообщал о значительной связи между гидроцефалией и вазоспазмом у пациентов с САК; в 62% случаев вазоспазм и гидроцефалия возникали одновременно, а у 11% пациентов вазоспазм не был связан с гидроцефалией (20).Тот факт, что количество медиатора имеет решающее значение для запуска спазма сосудов, подтверждается наблюдаемой корреляцией количества крови, вводимой в экспериментальной модели САК и спазма сосудов (21).
• Сильное вазодилататор, вдыхаемый NO, вводимый для поддержки легочного кровотока и улучшения оксигенации у новорожденных с тяжелой дыхательной недостаточностью, улучшает исходы нервного развития в возрасте 2 лет и старше 5 лет, главным образом за счет снижения риска когнитивных функций на 47%. нарушение (определяется по шкале индекса умственного развития Бейли менее 70 баллов) ( p = 0.03) (22, 23).
• Мощный релаксант гладкой мускулатуры внутривенно сульфат магния при внутриутробном введении матерям частично отвечает за уменьшение ультразвуковых свидетельств церебрального повреждения у недоношенных новорожденных менее 32 недель беременности и церебрального паралича в возрасте 2 лет (24).
Таблица 1 . Характеристика пациентов с внутрижелудочковым кровоизлиянием (ВЖК) как осложнением артериовенозной мальформации, у которых выявлен церебральный вазоспазм.
Доказательства против гипотезы
• В недавнем Кокрановском обзоре влияния вазодилататора, вдыхаемого NO, на исход дыхательной недостаточности у недоношенных новорожденных, не было обнаружено влияния его использования на долговременную нейродизбольность (36).
• Любое воздействие NO на нейродизибилизирующее действие могло быть вызвано не влиянием на спазм сосудов, а просто улучшением церебральной оксигенации (37).
• Влияние сульфата магния на церебральные поражения и церебральный паралич могло быть связано с улучшением плацентарной перфузии (38).
• Внутривенное введение вазодилатирующего антагониста кальция никардипина, снижающего артериальное давление у пациентов с внутримозговым кровоизлиянием и способного проникать через гематоэнцефалический барьер, не улучшало неврологический исход у взрослых (39).
Проверка гипотезы
Прежде чем приступить к испытаниям вмешательства, церебральный вазоспазм при ВЖК новорожденных необходимо задокументировать и оценить в продольных исследованиях в те моменты времени, когда церебральный вазоспазм после ВЖК был обнаружен у взрослых, а именно через 48 часов, между 4 и 6 днями и между 7 днями и 9 после диагноза ВЖК. Чтобы оценить наличие церебрального вазоспазма у недоношенных новорожденных, необходимо использовать неинвазивные методы. Измерения скорости кровотока с помощью транскраниального допплеровского ультразвука можно использовать у недоношенных новорожденных для обнаружения церебрального вазоспазма.Коэффициент Линдегаарда (описанный ранее) снова можно использовать для диагностики вазоспазма (40). Необходимо сравнить отдаленные неврологические исходы у новорожденных с церебральным вазоспазмом и без него, обнаруженного этим методом.
В будущих исследованиях можно будет измерять метаболиты NO и IL-1 в спинномозговой жидкости недоношенных с ВЖК серийно (например, ежедневно), чтобы определить, может ли увеличение (IL-1) или снижение (метаболиты NO) концентрации с течением времени предсказать пересечение «Вазоспазмогенный порог» и, таким образом, прогнозировать церебральный вазоспазм.Абсолютная концентрация в этом контексте также может быть коррелирована со временем до развития вазоспазма. Гем или его метаболит билирубин можно было измерить одновременно, чтобы оценить его прогностическую ценность в отношении спазма сосудов и необходимость профилактического вмешательства.
Последствия подтверждения гипотезы
Наиболее важным вмешательством, имеющим значительный потенциал в будущем для уменьшения и предотвращения церебрального вазоспазма и связанной с ним нейродизабильности при неонатальной ВЖК, является быстрое удаление скопившейся крови всеми доступными способами.Было продемонстрировано, что отсроченное удаление периваскулярного сгустка при САК связано с недостаточным разрешением вазоспазма, поскольку удаление сгустка в течение 3 дней после кровотечения уменьшало вазоспазм, но через 5 дней оно оказывало незначительное влияние (41). Дренаж, ирригация и фибринолитическая терапия (DRIFT) у младенцев с постгеморрагической дилатацией желудочков, наблюдавшейся до 2 лет, показали следующие результаты: из 39 младенцев, включенных в DRIFT, 21 (54%) умерли или получили тяжелую инвалидность по сравнению с 27 из 38 ( 71%) в стандартной группе (скорректированное отношение шансов 0.25 [95% доверительный интервал: 0,08–0,82]). Среди выживших 11 из 35 (31%) в группе DRIFT имели тяжелую когнитивную инвалидность по сравнению с 19 из 32 (59%) в стандартной группе (скорректированное отношение шансов: 0,17 [95% доверительный интервал: 0,05–0,57]). Средний индекс умственного развития составил 68 при DRIFT и <50 при стандартном лечении. Тяжелая сенсомоторная инвалидность существенно не уменьшилась (42). Частично этот эффект мог быть связан с лечением развивающейся гидроцефалии, но решающее значение могло иметь удаление продолжающихся источников гема, поглощающих NO и вызывающих продолжающееся высвобождение вазоспазма, вызывающего IL-1.Чтобы оценить влияние вмешательства DRIFT на все степени ВЖК, необходимо изучить ультразвуковые допплеровские исследования, оценивающие корреляты вазоспазма до и после вмешательства, и сопоставить их с отдаленными неврологическими исходами. В то же время, можно было измерить уровни кислотного белка глиального фибриллярного фибриллятора периферической крови - чувствительного маркера повреждения головного мозга - до и после вмешательства, а также в контрольной группе без вмешательства. Нейроэндоскопический лаваж для удаления сгустка был успешно и безопасно применен, и было показано, что он, возможно, превосходит процедуры, связанные с DRIFT, в предотвращении гидроцефалии и требует дальнейших исследований (43).
Оптимизация церебрального перфузионного давления с помощью гиперволемии с помощью внутривенных жидкостей и индукция гипертензии с помощью неосинефрина, по-видимому, является важной вспомогательной мерой, которую следует ввести в действие, как показывают неофициальные данные (см. Таблицу 1).
Как показано в перечисленных отчетах о случаях, более крупные церебральные артерии могут быть вовлечены в спазм сосудов, связанный с ВЖК. Ангиопластика оказалась успешной в разрешении спазма сосудов при САК и ВЖК (44, 45), и ее необходимо изучить при установленном спазме сосудов у недоношенных новорожденных.
Сообщения о клинических случаях подтверждают будущее использование периферической внутривенной инфузии донора NO молсидомина и интратекального введения нитропруссида натрия у пациентов с ВЖК, поскольку они, по-видимому, уменьшают церебральный вазоспазм (46).
Для поддержки DRIFT, когда-то зарекомендовавшего себя как эффективное вмешательство, интратекальный адъювант, следует использовать высокие дозы сосудорасширяющего, противовоспалительного и очищающего от гемоглобина и гема лечения с использованием препаратов с медленным высвобождением, если они доступны. Такие препараты могут включать тканевой активатор плазминогена или доноры NO по отдельности или в комбинации (47) и акцепторы гема, гемопексин и гаптоглобин (48, 49).Можно возразить, что выводы из данных о вазоспазме при ВЖК у взрослых не могут быть перенесены на недоношенных новорожденных, потому что воспаление может быть другим у плода и, следовательно, у недоношенного ребенка из-за незрелости иммунной системы. Однако неясно, влияет ли эта незрелость на выработку IL-1 после ВЖК: эксперименты с использованием липополисахарид-индуцированной секреции IL-1 у младенцев с очень низкой массой тела при рождении (VLBWI) и у новорожденных после 30 недель гестации по сравнению со взрослыми, показали снижение ex vivo LPS стимулировал секрецию ИЛ-1 бета в цельную кровь при VLBWI (50).В соответствии с этими выводами Brochu et al. обнаружили более слабый ответ на IL-1beta в незрелом мозге по сравнению с более зрелым термообразным мозгом. В этой модели на крысах, а также у недоношенных людей, реакция IL-1b происходит в основном в глубоком белом веществе, которое соответствует зоне уязвимости к ВЖК. Преждевременные роды могут быть связаны с дисбалансом соотношения антагонистов рецептора IL-1beta / IL-1 (IL-1-Ra) из-за снижения позитивной регуляции экспрессии IL-1Ra (51, 52). Это может означать, что снижение экспрессии IL-1 в ответ на стимулы, по крайней мере, частично компенсируется еще более сниженным ответом против IL-1.Полногеномный анализ транскриптома синдрома воспалительного ответа плода в пуповинной крови недоношенных новорожденных с синдромом воспалительного ответа плода выявил при микроматричном анализе лейкоцитарной РНК существенную степень сходства с синдромом системного воспалительного ответа у взрослых (53).
Для подавления нейровоспаления, связанного с активацией инфламмасом, индуцированной гемом, и с увеличением выработки ИЛ-1, ведущим к повышенному риску вазоспазма, можно лечить пораженных новорожденных ингибиторами инфламмасом, такими как телмисартан, который, как было показано, снижает активность NLRP3 и ИЛ-1. уровни и связанное церебральное повреждение (54–56).Эти противовоспалительные вмешательства могут быть безопасными при любой степени тяжести ВЖК, но их необходимо сначала изучить в исследованиях на животных. Вмешательство, направленное на уменьшение нейродизбируемости, связанной с вазоспазмом, должно применяться, как только обнаруживается ВЖК, чтобы действовать как эффективное профилактическое средство. В таких экспериментах на животных также необходимо изучить эффект внутриартериального верапамила, который, как было показано, снимает спазм сосудов у пациента с ВЖК (см. Таблицу 1). Все медикаментозные вмешательства, включая интратекальное введение, можно было оценить на модели глицерин-индуцированной ВЖК у недоношенных кроликов, которая была разработана для этой цели (57).В таких исследованиях можно было бы проанализировать влияние ингибиторов инфламмасом и доноров NO на транскраниальные допплер-ультразвуковые доказательства вазоспазма на неврологические симптомы и гистологическую картину повреждения головного мозга.
Авторские взносы
ME сформулировал гипотезу, составил план обзора и написал окончательную версию рукописи. SC внес существенный вклад в сбор данных и их пересмотр. Оба автора окончательно утвердили версию, которая будет опубликована, согласились нести ответственность за все аспекты работы, обеспечивая анализ или интерпретацию данных для работы, и согласились нести ответственность за все аспекты работы, чтобы вопросы связанные с точностью или целостностью любой части работы, надлежащим образом исследуются и решаются.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Болисетти С., Дхаван А., Абдель-Латиф М., Баджук Б., Стэк Дж., Луи К. Сбор данных отделений интенсивной терапии новорожденных на территории Нового Южного Уэльса и столицы Австралии внутрижелудочкового кровоизлияния и исходов нервного развития у крайне недоношенных новорожденных. Педиатрия (2014) 133: 55–62. DOI: 10.1542 / педс.2013-0372
CrossRef Полный текст | Google Scholar
3. Мукерджи А., Шах В., Шах П.С. Перивентрикулярное / внутрижелудочковое кровоизлияние и исходы нервного развития: метаанализ. Педиатрия (2015) 136: 1132–43. DOI: 10.1542 / peds.2015-0944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Бурштейн Дж., Папил Л.А., Бурштейн Р. Внутрижелудочковое кровоизлияние и гидроцефалия у недоношенных новорожденных: проспективное исследование с помощью КТ. AJR Am J Roentgenol (1979) 132: 631–5. DOI: 10.2214 / ajr.132.4.631
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Szpecht D, Wiak K, Braszak A, Szymankiewicz M, Gadzinowski J. Роль отдельных цитокинов в этиопатогенезе внутрижелудочкового кровотечения у недоношенных новорожденных. Childs Nerv Syst (2016) 32: 2097–103. DOI: 10.1007 / s00381-016-3217-9
CrossRef Полный текст | Google Scholar
6. Патра К., Уилсон-Костелло Д., Тейлор Х. Г., Меркури-Миних Н., Хак М.Внутрижелудочковое кровоизлияние I-II степени у младенцев с крайне низкой массой тела при рождении: влияние на развитие нервной системы. J Pediatr (2006) 9: 169–73. DOI: 10.1016 / j.jpeds.2006.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Сехба Ф.А., Шварц А.Ю., Черешнев И., Бедерсон Ж.Б. Резкое снижение уровня оксида азота в мозге после субарахноидального кровоизлияния. J Cereb Blood Flow Metab (2000) 20: 604–11. DOI: 10.1097 / 00004647-200003000-00018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.Тода Н, Аядзики К., Окамура Т. Регулирование мозгового кровотока с помощью NO: последние достижения. Pharmacol Rev (2009) 61: 62–97. DOI: 10.1124 / pr.108.000547
CrossRef Полный текст | Google Scholar
10. Дутра Ф. Ф., Алвес Л. С., Родригес Д., Фернандес П. Л., де Оливейра Р. Б., Голенбок Д. Т. и др. Смертельность, вызванная гемолизом, связана с активацией инфламмасом гемом. Proc Natl Acad Sci U S A (2014) 111: E4110–8. DOI: 10.1073 / pnas.1405023111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Эллисон В.Дж., Мокатта Т.Дж., Уинтерборн С.К., Дарлоу Б.А., Вольпе Дж.Дж., Индер Т.Э. Связь уровней цитокинов в спинномозговой жидкости и плазме с повреждением белого вещества головного мозга у недоношенных новорожденных. Pediatr Res (2005) 57: 282–6. DOI: 10.1203 / 01.PDR.0000148286.53572.95
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Адлер И., Баттон Д., Бец Б., Безинк С., Эклунд К., Джунуик Дж. И др. Механизмы поражения белого вещества, прилегающего к крупному внутрижелудочковому кровоизлиянию в головной мозг недоношенных. J Clin Ultrasound (2010) 38: 254–8. DOI: 10.1002 / jcu.20683
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Лекич Т., Клебе Д., Поблете Р., Краффт П.Р., Роллан В.Б., Тан Дж. И др. Неонатальное кровоизлияние в мозг (NBH) недоношенных: механизмы трансляции сосудисто-нервной сети. Curr Med Chem (2015) 22: 1214–38. DOI: 10.2174 / 0929867322666150114152421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.Phan K, Moore JM, Griessenauer CJ, Xu J, Teng I., Dmytriw AA, et al. Ультраранний ангиографический вазоспазм после аневризматического субарахноидального кровоизлияния: систематический обзор и метаанализ. World Neurosurg (2017) 102: 632–8.e1. DOI: 10.1016 / jwneu.2017.03.057
CrossRef Полный текст | Google Scholar
16. Регула Ю.Ю., Шилл Дж., Ринглеб П.А., Сикора М. Церебральный вазоспазм и отсроченная церебральная ишемия при внутрижелудочковом кровотечении. Neurocrit Care (2014) 20: 460–5.DOI: 10.1007 / s12028-013-9897-z
CrossRef Полный текст | Google Scholar
17. Kiphuth IC, Huttner HB, Breuer L, Engelhorn T., Schwab S, Koehrmann M. Вазоспазм при внутримозговом кровотечении с вовлечением желудочков: проспективное пилотное исследование транскраниальной допплерографии. Cerebrovasc Dis (2011) 32: 420–5. DOI: 10.1159 / 000330652
CrossRef Полный текст | Google Scholar
18. Спейдер Х.С., Доберштейн С.Е., Рао А.Дж., Джаяраман М.В. Центральная лихорадка как ранний предиктор вазоспазма у ребенка с изолированным внутрижелудочковым кровотечением. Clin Neurol Neurosurg (2011) 113: 146–9. DOI: 10.1016 / j.clineuro.2010.09.005
CrossRef Полный текст | Google Scholar
19. Басу С., Агарвал П., Анупурба С., Шукла Р., Кумар А. Повышенная концентрация интерлейкина-1 бета и фактора некроза опухоли альфа в плазме и спинномозговой жидкости и комбинированный исход смерти или аномального нейровизуализации у недоношенных новорожденных с ранним клиническим проявлением сепсис. J Perinatol (2015) 35: 855–61. DOI: 10.1038 / jp.2015.86
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20.Черный PM. Гидроцефалия и спазм сосудов после субарахноидального кровоизлияния из разорванных внутричерепных аневризм. Нейрохирургия (1986) 18: 12–6. DOI: 10.1227 / 00006123-198601000-00003
CrossRef Полный текст | Google Scholar
21. Liszczak TM, Varsos VG, Black PM, Kistler JP, Zervas NT. Сужение церебральной артерии после экспериментального субарахноидального кровоизлияния связано с компонентами крови в стенке артерии. J Neurosurg (1983) 58: 18–26. DOI: 10.3171 / jns.1983.58.1.0018
CrossRef Полный текст | Google Scholar
22. Местан К.К., Маркс Д.Д., Хекокс К., Хо Д., Шрайбер М.Д. Результаты нервного развития недоношенных детей, получавших ингаляционный NO. N Engl J Med (2005) 353: 23–32. DOI: 10.1056 / NEJMoa043514
CrossRef Полный текст | Google Scholar
23. Патрианакос-Хублер А.И., Маркс Д.Д., Мсалл М.Э., Хо Д., Шрайбер М.Д. Безопасность и эффективность лечения ингаляционным NO для недоношенных детей с респираторным дистресс-синдромом: последующая оценка в раннем школьном возрасте. Acta Paediatr (2011) 100: 524–8. DOI: 10.1111 / j.1651-2227.2010.02077.x
CrossRef Полный текст | Google Scholar
24. Hirtz DG, Weiner SJ, Bulas D, DiPietro M, Seibert J, Rouse DJ и др. Антенатальный магний и церебральный паралич у недоношенных детей. J Pediatr (2015) 167: 834–9. DOI: 10.1016 / j.jpeds.2015.06.067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Yanaka K, Hyodo A, Tsuchida Y, Yoshii Y, Nose T. Симптоматический церебральный вазоспазм после внутрижелудочкового кровоизлияния в результате разрыва артериовенозной мальформации. Surg Neurol (1992) 38: 63–7. DOI: 10.1016 / 0090-3019 (92)
-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Пак Б.С., Вон Ю.С., Чой К.С., Ким Б.М. Тяжелый симптоматический вазоспазм после внутрижелудочкового кровоизлияния из артериовенозной фистулы. J Korean Neurosurg Soc (2009) 45: 300–2. DOI: 10.3340 / jkns.2009.45.5.300
CrossRef Полный текст | Google Scholar
27. Джерард Э., Фронтера Дж. А., Райт CB. Спазм сосудов и инфаркт мозга после изолированного внутрижелудочкового кровоизлияния. Neurocrit Care (2007) 7: 257–9. DOI: 10.1007 / s12028-007-0057-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Йокобори С., Ватанабэ А., Накаэ Р., Онда Х., Фьюз А., Кусимото С. и др. Спазмы сосудов головного мозга после внутрижелудочкового кровоизлияния из-за артериовенозной мальформации: клинический случай. Neurol Med Chir (Токио) (2010) 50: 320–3. DOI: 10.2176 / nmc.50.320
CrossRef Полный текст | Google Scholar
30. Маэда К., Курита Х., Накамура Т., Усуи М., Цуцуми К., Моримото Т. и др.Возникновение тяжелого вазоспазма после внутрижелудочкового кровоизлияния из-за артериовенозной мальформации. Отчет о двух случаях. J Neurosurg (1997) 87: 436–9. DOI: 10.3171 / jns.1997.87.3.0436
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Кобаяши М., Такаяма Х., Милхара Б., Кавасе Т. Сильный вазоспазм, вызванный повторным внутрижелудочковым кровотечением из-за небольшой артериовенозной мальформации. Acta Neurochir (Wien) (2002) 144: 405–6. DOI: 10.1007 / s007010200059
CrossRef Полный текст | Google Scholar
33.Котбауэр К., Шрот Г., Зайлер Р. В., До ДД. Тяжелый симптоматический вазоспазм после разрыва артериовенозной мальформации. AJNR Am J Neuroradiol (1995) 16: 1073–5.
PubMed Аннотация | Google Scholar
34. Пендхаркар А.В., Гусман Р., Додд Р., Корнфилд Д., Эдвардс М.С. Успешное лечение тяжелого церебрального вазоспазма после кровотечения из артериовенозной мальформации. История болезни. J Neurosurg Pediatr (2009) 4: 266–9. DOI: 10.3171 / 2009.4.PEDS09126
CrossRef Полный текст | Google Scholar
35.Де Карвалью Дж. К., Мачин Ф. Дж., Манзанера Л. С., Андалуз Дж. Б., Ног С. С., Сориано Н. П. и др. Внутрижелудочковое кровоизлияние после эмболизации твердой мозговой фистулы. Rev Bras Anestesiol (2017) 67: 199–204. DOI: 10.1016 / j.bjan.2016.09.002
CrossRef Полный текст | Google Scholar
36. Barrington KJ, Finer N, Pennaforte T. Вдыхаемый NO при дыхательной недостаточности у недоношенных детей. Кокрановская база данных Syst Rev (2017) 3 (1): CD000509. DOI: 10.1002 / 14651858.CD000509.pub5
CrossRef Полный текст | Google Scholar
37.Peliowski A. Канадское педиатрическое общество, комитет по плодам и новорожденным не вдыхали NO для новорожденных. Детский педиатр (2012) 17: 95–100. DOI: 10.1093 / pch / 17.2.95
CrossRef Полный текст | Google Scholar
38. Holcberg G, Sapir O, Hallak M, Alaa A, Shorok HY, David Y, et al. Селективное сосудорасширяющее действие сульфата магния на плаценту человека. Am J Reprod Immunol (2004) 51: 192–7. DOI: 10.1111 / j.1600-0897.2004.00115.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39.Куреши А.И., Палеш Ю.Ю., Барсан В.Г., Хэнли Д.Ф., Хсу С.Й., Мартин Р.Л. и др. Интенсивное снижение артериального давления у больных с острым кровоизлиянием в мозг. N Engl J Med (2016) 375: 1033–43. DOI: 10.1056 / NEJMoa1603460
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Линдегаард К.Ф., Норнес Х., Бакке С.Дж., Сортеберг В., Накстад П. Диагностика церебрального вазоспазма с помощью ангиографии и измерения скорости кровотока. Acta Neurochir (1989) 100: 12–24.DOI: 10.1007 / BF01405268
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Стодли М., Макдональд Р.Л., Вейр Б., Мартон Л.С., Джонс Л., Ду Чжан З. и др. Субарахноидальное кровоизлияние как причина адаптивного ответа мозговых артерий. J Neurosurg (2000) 93 (3): 463–70. DOI: 10.3171 / jns.2000.93.3.0463
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Whitelaw A, Jary S, Kmita G, Wroblewska J, Musialik-Swietlinska E, Mandera M, et al.Рандомизированное исследование дренажной, ирригационной и фибринолитической терапии недоношенных детей с постгеморрагической дилатацией желудочков: исходы развития через 2 года. Педиатрия (2010) 125: 852–8. DOI: 10.1542 / педс.2009-1960
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Schulz M, Bührer C, Pohl-Schickinger A, Haberl H, Thomale UW. Нейроэндоскопический лаваж для лечения внутрижелудочкового кровоизлияния и гидроцефалии у новорожденных. J Neurosurg Pediatr (2014) 13: 626–35.DOI: 10.3171 / 2014.2.PEDS13397
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Barnwell SL, Higashida RT, Halbach VV, Dowd CF, Wilson CB, Hieshima GB. Транслюминальная ангиопластика внутримозговых сосудов при спазме церебральных артерий: устранение неврологического дефицита после отсроченного лечения. Нейрохирургия (1989) 25: 424–9. DOI: 10.1227 / 00006123-198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Зубков Ю.Н., Никифоров Б.М., Шустин В.А.Техника баллонного катетера для расширения суженных церебральных артерий после аневризматической САК. Acta Neurochir (Wien) (1984) 70: 65–79. DOI: 10.1007 / BF01406044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Ehlert A, Manthei G, Hesselmann V, Mathias K, Bein B, Pluta R. Случай сверхострого начала вазоспазма после аневризматического субарахноидального кровоизлияния и рефрактерного вазоспазма после лечения внутривенным и внутрижелудочковым NO: мини-обзор. World Neurosurg (2016) 91: 673.e11–8. DOI: 10.1016 / j.wneu.2016.04.047
CrossRef Полный текст | Google Scholar
47. Омейс И., Нил Дж. А., Мурали Р., Абрахамс Дж. М.. Лечение церебрального вазоспазма с помощью биосовместимых систем с контролируемым высвобождением для внутричерепной доставки лекарств. Нейрохирургия (2008) 63: 1011–9. DOI: 10.1227 / 01.NEU.0000327574.32000.9A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Шаер Д. Д., Бюлер П. У., Алаяш А. И., Белчер Дж. К., Верчеллотти Г. М.. Еще раз о гемолизе и свободном гемоглобине: изучение гемоглобина и поглотителей гемина как нового класса терапевтических белков. Кровь (2013) 121: 1276–84. DOI: 10.1182 / кровь-2012-11-451229
CrossRef Полный текст | Google Scholar
49. Винчи Ф., де Франчески Л., Гиго А., Таунс Т., Чимино Дж., Силенго Л. и др. Терапия гемопексином улучшает сердечно-сосудистую функцию, предотвращая индуцированную гемом эндотелиальную токсичность на мышиных моделях гемолитических заболеваний. Тираж (2013) 127: 1317–29. DOI: 10.1161 / CIRCULATIONAHA.112.130179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50.Foerster-Waldl E, Sadeghi K, Tamandl D, Gerhold B, Hallwirth U, Rohrmeister K и др. Экспрессия толл-подобного рецептора 4 моноцитов и индуцированная ЛПС продукция цитокинов увеличиваются во время гестационного старения. Pediatr Res (2005) 58: 121–4. DOI: 10.1203 / 01.PDR.0000163397.53466.0F
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Брошу М.Э., Жирар С., Лавуа К., Себир Г. Регуляция развития нейровоспалительных ответов на ЛПС и / или гипоксия-ишемия между недоношенными и доношенными новорожденными: экспериментальное исследование. J Нейровоспаление (2011) 8:55. DOI: 10.1186 / 1742-2094-8-55
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Girard S, Sebire G, Kadhim H. Провоспалительная ориентация системы интерлейкина 1 и последующая индукция матричной металлопротеиназы 9 в патофизиологии перинатального повреждения белого вещества человека. J Neuropathol Exp Neurol (2010) 69: 1116–29. DOI: 10.1097 / NEN.0b013e3181f971e4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53.Madsen-Bouterse SA, Romero R, Tarca AL, Kusanovic JP, Espinoza J, Kim CJ и др. Транскриптом синдрома воспалительной реакции плода. Am J Reprod Immunol (2010) 63: 73–92. DOI: 10.1111 / j.1600-0897.2009.00791.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Вэй X, Ху CC, Zhang YL, Yao SL, Mao WK. Телмисартан уменьшал отек мозга за счет ингибирования инфламмасомы NLRP3 у мышей с холодовой травмой головного мозга. J Huazhong Univ Sci Technolog Med Sci (2016) 36: 576–83.DOI: 10.1007 / s11596-016-1628-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Цао Г, Цзян Н., Ху И, Чжан И, Ван Г, Инь М. и др. Рускогенин ослабляет дисфункцию гематоэнцефалического барьера, вызванную церебральной ишемией, подавляя активацию инфламмасом TXNIP / NLRP3 и путь MAPK. Int J Mol Sci (2016) 17: 1418. DOI: 10.3390 / ijms170
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Эйзенхут М. Повышенная активность инфламмасом как осмосенсоров как причина отека мозга при диабетическом кетоацидозе. J Syst Integr Neurosci (2016) 2: 210–2. DOI: 10.15761 / JSIN.1000137
CrossRef Полный текст | Google Scholar
57. Лей Д., Романцик О., Валлиус С., Свейнсдоттир К., Свейнсдоттир С., Агиеманг А.А. и др. Высокое присутствие внеклеточного гемоглобина в перивентрикулярном белом веществе после преждевременного внутрижелудочкового кровоизлияния. Front Physiol (2016) 7: 330. DOI: 10.3389 / fphys.2016.00330
CrossRef Полный текст | Google Scholar
моделей машинного обучения для выявления недоношенных детей с риском кровоизлияния в мозг
Abstract
Внутримозговое кровоизлияние у недоношенных детей является основной причиной повреждения головного мозга и церебрального паралича.Патогенез кровоизлияния в мозг многофакторен. К факторам риска относятся нарушение ауторегуляции головного мозга, инфекции и нарушения свертывания крови. Методы машинного обучения позволяют идентифицировать комбинации клинических факторов, чтобы лучше всего дифференцировать недоношенных детей с внутримозговым кровотечением, а также разрабатывать модели для пациентов с риском кровоизлияния в мозг. В текущем исследовании метод случайного леса применяется для разработки таких моделей для крайне и очень недоношенных детей (срок беременности 23–30 недель) на основе данных, собранных в когорте из 229 человек.Построенные модели демонстрируют хорошую точность прогнозов и могут быть использованы в клинической практике для снижения риска церебрального кровотечения у недоношенных.
Образец цитирования: Турова В., Сидоренко И., Эккардт Л., Ригер-Факелдей Е., Фельдерхофф-Мюзер Ю., Алвес-Пинто А. и др. (2020) Модели машинного обучения для выявления недоношенных детей с риском кровоизлияния в мозг. PLoS ONE 15 (1):
e0227419.
https://doi.org/10.1371/journal.pone.0227419
Редактор: Emma Duerden, Western University, CANADA
Поступила: 26 апреля 2019 г .; Дата принятия: 18 декабря 2019 г .; Опубликован: 15 января 2020 г.
Авторские права: © 2020 Turova et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные доступны в репозитории СМИ и публикаций Мюнхенского технического университета (mediaTUM) по следующей ссылке: https://mediatum.ub.tum.de/1521746.
Финансирование: Эта работа финансировалась Фондом Буля-Штромайера для VT и AAP; Фонд Клауса Чира для IS и LE и Фонд Маркуса Вюрта для RL.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Внутрижелудочковая мозговое кровоизлияние (ВЖК) является частым осложнением у недоношенных детей, влияющие на нервную систему и приводит к обесценению опорно-двигательного аппарата и когнитивных функций, развития речи и зрения.В большинстве случаев кровотечение начинается в так называемом зародышевом матриксе (ГМ) — области мозга, плотно пронизанной кровеносными сосудами. GM отвечает за образование незрелых нейрональных и глиальных клеток и исчезает к 32-й неделе беременности (WG). Многие факторы влияют на начало кровоизлияния в мозг [1]. Согласно исследованиям [2–4], наиболее важную роль играет недостаточная и незрелая церебральная ауторегуляция, приводящая к значительным колебаниям церебрального кровотока (CBF), в результате чего хрупкие, лишенные мышц кровеносные сосуды GM уничтожены.Но также было обнаружено, что с возникновением ВЖК связаны различные воспалительные заболевания, влияющие на деформируемость эритроцитов, а также нарушения свертывания крови [5, 6].
Хотя в последние десятилетия выживаемость недоношенных детей значительно увеличилась, зарегистрированный процент кровоизлияний в мозг у новорожденных с гестационным возрастом <30 недель и массой тела при рождении <1500 г остается между 22% и 25% [7]. Перспективным направлением предотвращения кровоизлияния в мозг у новорожденных является создание моделей машинного обучения (ML), способных с определенной долей вероятности выявлять пациентов с риском развития кровоизлияния в мозг.Анализируя истории болезни важных параметров у недоношенных детей, можно ретроспективно разработать такие прогностические модели, найдя оптимальную комбинацию параметров, которая позволяет отделить недоношенных детей с кровотечением и без него. Предварительная работа по ассоциации пониженных или повышенных значений различных клинических параметров, таких как количество лейкоцитов (Leu) и тромбоцитов (Thro), гематокрит (Ht), C-реактивный белок (CRP), парциальное давление кислорода в артериальной крови (pO 2 ) ), насыщение крови кислородом (SaO 2 ), парциальное давление углекислого газа в артериальной крови (pCO 2 ), кислотность крови (pH) и среднее артериальное давление (MAP) с возникновением кровоизлияния в мозг, а также наличие Корреляции между некоторыми параметрами, проведена авторами в [8, 9].
ML-методы успешно применяются для диагностики и прогноза различных заболеваний, в том числе инсульта (см., Например, [10]). Использование ML-методов в неонатологии ограничено. В настоящее время доступно немного исследований, разрабатывающих инструменты машинного обучения для прогнозирования выживаемости недоношенных новорожденных; см., например, [11], где описываются ML-модели для оценки риска смерти очень недоношенных новорожденных. В недавних работах [12] были разработаны ML-модели для более точной оценки гестационного возраста и улучшения идентификации недоношенных новорожденных.
В данной статье рассматривается разработка ML-моделей для выявления недоношенных детей с риском кровоизлияния в мозг. Для обучения и тестирования моделей использовались клинические данные когорты из 229 чрезвычайно (с 23–26 WG) и очень недоношенных детей (с 27-30 WG), ретроспективно собранные в двух немецких клиниках. Собранные данные служили входными данными для метода случайного леса, доступного в программном пакете R, для нахождения хороших прогностических характеристик, а также оптимального сочетания характеристик из проанализированных данных и для разработки ML-моделей, которые могут предсказать церебральное кровоизлияние в чрезвычайно тяжелых условиях. очень недоношенные дети.
Материалы и методы
Данные были ретроспективно собраны из историй болезни 265 недоношенных новорожденных, лечившихся в двух отделениях неонатологии Германии. Данные были анонимными. Проект и его процедуры были одобрены комитетами по этике обеих клиник, комитетом по этике университетской клиники rechts der Isar, Техническим университетом Мюнхена (Ref. 364/15) и этическим комитетом университетской клиники Эссена. Университет Дуйсбург-Эссен (Ref. 16–7284-BO).
Пациенты были разделены на две группы: с кровоизлиянием в мозг (группа поражения) и без кровоизлияния в мозг (группа контроля). Умершие новорожденные без кровоизлияния в мозг были исключены из контрольной группы, в то время как новорожденные с кровотечением были сопоставлены с новорожденными пострадавшей группы по возрасту (неделя беременности) и весу. Этот критерий соответствия был выбран, чтобы сделать контрольную и пораженную группы сопоставимыми по физиологическим и анатомическим факторам, которые критически определяют церебральный кровоток.На последнее влияет количество и размер церебральных кровеносных сосудов [9], которые зависят от веса мозга, оцениваемого по весу при рождении [13]. Кроме того, размер ГМ как источник кровоизлияний в мозг зависит также от гестационного возраста и массы тела при рождении [14]. ГМ достигает своего максимального размера в 5% от общего объема мозга к 22-й неделе беременности и неуклонно уменьшается с 23-й недели беременности и в большинстве случаев исчезает к 34-й неделе беременности. После всех исключений и сопоставления 118 пациентов с ВЖК (75 крайне недоношенных; 43 очень недоношенных) и 111 контрольных (62 крайне недоношенных; 49 очень недоношенных) остались в анализе.Их акушерские данные приведены в Таблице 1 .
Обратите внимание, что контрольная группа на 6% меньше пораженной, потому что не удалось найти в когорте количество контрольных младенцев, сопоставимых по возрасту и весу, равное пораженным. Как следствие, некоторые контрольные группы были сопоставлены с двумя пораженными новорожденными того же гестационного возраста и веса. Однако, поскольку обычно было больше измерений для контрольной группы, чем для пораженных новорожденных, мы решили включить в исследование всех пораженных младенцев.Точное соответствие между группами по полу также было невозможно из-за более высокой распространенности ВЖК у мужчин по сравнению с женщинами, которые не могли быть сопоставлены в контрольной группе. Тем не менее, эта разница в относительном количестве мужчин между группами не была статистически значимой.
Имеются предварительные данные о разнице в частоте ВЖК между крайне и очень недоношенными детьми: 45% среди крайне недоношенных детей [15] и 24% среди очень недоношенных детей [16]. Кроме того, в нашем предыдущем исследовании [8] значительные различия в некоторых клинических параметрах были обнаружены между крайне и очень недоношенными новорожденными.Поэтому в настоящем исследовании группа крайне недоношенных детей анализировалась отдельно от группы очень недоношенных детей.
ВЖК диагностировано при ультразвуковом исследовании черепа. В соответствии со стандартной практикой, УЗИ черепа обычно проводят на 1, 3, 7 и 14 дни, а иногда и чаще, если есть клинические признаки или если ультразвуковое исследование указывает на патологию.
Образцы данных новорожденных из пораженной группы, использованные при разработке ML-модели, были взяты до кровотечения.Отбор образцов данных производился в соответствии с протоколом, приведенным в таблице 2, следующим образом: клинические измерения младенцев, у которых ВЖК был диагностирован в первый день жизни, в анализ не включались. В случаях, когда диагноз ВЖК был диагностирован на второй день жизни, использовались записи, сделанные в первый день жизни. Для младенцев, у которых ВЖК был диагностирован на 3-й день жизни или позже, образцы данных рассматривались до того дня, когда было проведено предыдущее плановое ультразвуковое исследование (например,g., только 1-й день жизни, когда ВЖК был диагностирован на 3-й день, и первые 3 дня жизни, когда ВЖК был диагностирован на 4-7-й день). Для новорожденных контрольной группы в анализ были включены все доступные образцы данных.
Стоит отметить, что количество образцов для измерений для контроля обычно больше, чем для пораженных младенцев. Разница по сравнению с пораженной группой объясняется тем, что при анализе пораженных новорожденных используются только записи, сделанные до кровотечения.Это различие отражено в таблице 3. Как будет показано ниже, наш конвейер машинного обучения учел этот дисбаланс путем передискретизации затронутой группы.
Клинические параметры были получены из образцов артериальной и капиллярной крови и включали pH, pCO 2 , pO 2 , Leu, Ht, Thro, CRP, а также измерения MAP, SaO 2 и значений Apgar-Score. Через 1, 5 и 10 минут после рождения (A1, A5, A10). Чтобы иметь полные записи в заданный момент времени, более редкие измерения Leu, Ht, Thro и CRP были согласованы по времени (в течение одного дня) с более частыми записями значений газов крови (pH, pO 2 , pCO 2 ) и MAP и SaO 2 .
В дополнение к упомянутым клиническим параметрам, значениям, взятым из историй болезни, мы также включили церебральный кровоток (CBF) в качестве дополнительного параметра для обучения и проверки модели. Используемые здесь значения CBF соответствуют смоделированным значениям, полученным с использованием математической модели, разработанной авторами в предыдущем исследовании [9]. Вкратце, эта модель математически описывает зависимость CBF от различных анатомических и физиологических переменных и была адаптирована из ранее существовавшей модели для мозга взрослого [17] к мозгу недоношенных детей.Как и в [17], цереброваскулярная система представлена в модели в виде 19 последовательно соединенных отсеков: 9 артериальных, 1 капиллярного и 9 венозных. Каждый отсек имеет собственное количество сосудов и характеристики кровеносных сосудов (длина, диаметр, pCO 2 -реактивность). На уровне капилляров наличие ГМ с его характерными особенностями (более высокая плотность сосудов, увеличенный диаметр и меньшая длина сосудов по сравнению с другими областями мозга и сниженный ответ сосудов на колебания pCO 2 ) и количество сосудов в соответствии с возраст ребенка объясняется параллельной связью его кровеносной системы с остальными капиллярами головного мозга.Сопротивление этой мозговой сети вычисляется как сумма сопротивлений 19 отделов, а общий CBF рассчитывается в соответствии с законом Кирхгофа. Реактивность сосудов (способность сужаться или расширяться в зависимости от содержания pCO 2 в крови) моделируется путем зависимости диаметра сосудов от отклонения уровня pCO 2 от некоторого номинального значения. Механизм миогенной ауторегуляции (изменение диаметра сосудов при колебаниях артериального давления) учитывается путем корректировки модели в соответствии с опубликованными измерениями CBF у недоношенных детей (подробнее см. [9]).Несмотря на сложность модели, математическое моделирование CBF также было реализовано в удобном для пользователя программном интерфейсе, не требующем глубоких математических знаний.
Наборы клинических данных пораженных и контрольных младенцев, использованные для построения и оценки ML-моделей, вводились без различия между отдельными людьми. Учитывались только наличие / отсутствие ВЖК и принадлежность к группе крайне или очень недоношенных новорожденных. Возраст, в котором составлялись истории болезни, в модели не учитывался.
ML-моделей были разработаны с использованием пакета программ R [18, 19]. Применялся метод случайного леса (РФ). RF считается особенно хорошо подходящим, когда рассматривается большое количество функций [20] (13 в нашем случае). Кроме того, RF имеет то преимущество, что вычисляет важность каждого признака в процессе классификации.
Данные были случайным образом разделены на обучающий набор (90%) и невидимый проверочный набор (10%).
Точность модели на этапе обучения оценивалась с помощью повторной 10-кратной перекрестной проверки с тремя повторениями.Эта процедура включает случайное разделение набора наблюдений на 10 групп или сверток примерно равного размера. Затем ML-модель обучается на 9 складках и тестируется на последней складке, так что каждая складка становится тестовой выборкой один раз. Процедура повторяется трижды и результаты усредняются. Складки выбираются случайным образом в каждом из трех повторов. Чтобы справиться с упомянутым выше дисбалансом данных, была принята опция «SMOTE» (Synthetic Minority Oversampling Technique) [21], которая позволяет изменять частоту различных классов обучающих данных.В частности, вызов функции
‘train (hemorr ~., Data = dataset, method =» rf «, metric =» Accuracy «, trControl = control)’
с параметром «control», являющимся выходом вызова
‘trainControl (method =» duplicatecv «, number = 10, repeat = 3, sampling =» smote «)’.
Важность характеристик для каждой из двух групп оценивалась с помощью стандартной R-функции «varImp». Стандартный метод рекурсивного исключения признаков (RFE), предоставляемый пакетом каретки R, использовался для выбора количества функций.
Два основных показателя, средняя точность и характеристическая каппа Коэна (см. Таблицу 4), были использованы для характеристики качества модели. На этапе проверки производительность модели оценивалась на невидимых данных путем вычисления следующих показателей (таблица 4): 1) наблюдаемая точность, 2) уровень отсутствия информации (классификатор, который относит образец к классу с вероятностью, равной к процентному соотношению класса в данных), 3) чувствительности (процент правильно классифицированных новорожденных с кровотечением) и 4) специфичности (процент правильно классифицированных новорожденных без кровотечения).
Категориальные характеристики (такие как пол, многоплодные роды, нормальные роды через естественные родовые пути и разрыв амниотического мешка) сравнивали по их относительным значениям в% вместе с p-значением, рассчитанным с помощью точного критерия Фишера. Для непрерывных переменных (таких как гестационный возраст, вес при рождении и клинические измерения) средние значения сравнивались с использованием двустороннего критерия суммы рангов Вилкоксона. Значение p <0,05 считалось статистически значимым.
Результаты
В таблице 5 перечислены переменные, используемые для построения ML-моделей, их средние значения (± стандартное отклонение), вычисленные по всем доступным записям для каждой группы, и p-значения для нулевой гипотезы о том, что средние значения для контрольная и пораженная группы равны.
Оптимальное количество признаков, установленных для крайне недоношенных новорожденных, составляет 5 (рис. 1). Для очень недоношенных новорожденных, хотя 9 атрибутов обеспечили самую высокую точность, 5 атрибутов дали практически такой же результат (рис. 2).
Важность переменных для группы крайне и очень недоношенных детей представлена на рисунках 3 и 4 соответственно. Для построения ML-моделей три основных переменных (Thro, pH и Leu для крайне недоношенных детей и Thro, Ht и Leu для очень недоношенных детей) были дополнены двумя переменными, выбранными путем перечисления всех возможных вариантов оставшихся 10 переменных.Кроме того, для каждой группы также тестировались комбинации переменных, которые были эффективны в другой группе. Переменные, которые были коррелированы, считались избыточными, и только одна из них использовалась для каждой модели. Для крайне недоношенных детей была установлена корреляция (абсолютное значение коэффициента корреляции> 0,5) между pCO 2 и CBF, MAP и CBF, A1 и A5, A1 и A10, A5 и A10. Для очень недоношенных детей, помимо этих корреляций, также были обнаружены корреляции между Leu и CRP, CBF и CRP, pH и pCO 2 .
Таблица 6 (чрезвычайно недоношенные дети) и таблица 7 (очень недоношенные дети) демонстрируют наилучшие полученные результаты. В первом столбце каждой таблицы показаны переменные, использованные для построения ML-модели. Второй столбец показывает среднюю точность полученной модели, а третий столбец — каппа Коэна. Четвертый столбец показывает точность модели на невидимых данных; 95% доверительный интервал (ДИ) и степень точности, которая может быть достигнута без модели, показаны в пятом и шестом столбцах соответственно.В седьмом столбце показано значение p, указывающее вероятность соблюдения такой же или лучшей точности классификации для классификатора без скорости передачи информации; чувствительность и специфичность модели приведены в восьмом и девятом столбцах соответственно.
Согласно таблице 6, для группы чрезвычайно недоношенных детей наиболее эффективные наборы переменных модели включали Thro, pH, Leu, Ht, A10, A5, A1, CRP, pO 2 , CBF и SaO 2 .
Для очень недоношенных детей наиболее эффективными предикторами были Thro, Ht, Leu, pH, A1, A5, pCO 2 , CBF и SaO 2 .
В обеих группах прогноз был наиболее точным для наборов переменных, включая Thro, Ht, Leu, pH и один из показателей по шкале Апгар (A1 для крайне недоношенных детей и A5 для очень недоношенных детей).
Обсуждение
Возникновение кровоизлияния в мозг у недоношенных детей может стать причиной пожизненной инвалидности. Поэтому его предотвращение является важной целью.
ML-модели представляют собой многообещающий инструмент в этой области, позволяющий идентифицировать недоношенных детей с риском развития церебрального кровотечения.Представленные выше результаты по характеристикам модели показывают, что хорошая прогностическая способность может быть достигнута с помощью различных комбинаций клинических параметров. Переменные Thro, Leu, Ht, pH, CBF, SaO 2 , A1 и A5 являются общими для наиболее эффективных наборов переменных модели, как для групп с крайне недоношенными детьми, так и с очень недоношенными.
Связь между этими переменными и развитием ВЖК у недоношенных новорожденных была описана в нескольких предыдущих исследованиях [22–31]. Возникновение ВЖК тесно связано с тромбоцитопенией (меньшим количеством тромбоцитов в крови) [22] и, у младенцев с очень низкой массой тела при рождении, с увеличением количества лейкоцитов [23].Более того, было обнаружено, что количество лейкоцитов и СЛР связаны с гистологическим хориоамнионитом [24], который, в свою очередь, также был идентифицирован как фактор риска ВЖК [25]. Было показано, что низкие исходные уровни Ht у недоношенных новорожденных с WG <28 были связаны с возникновением ВЖК [26], при этом начальные значения Ht <45% были связаны с двукратным увеличением вероятности кровоизлияния в мозг при чрезвычайно низком уровне родов. вес новорожденных [27]. Согласно [28], пониженные значения pH вместе с гиперкапнией (pCO 2 > 45 мм рт. Ст.) Также могут увеличивать риск возникновения ВЖК, а колебания CBF могут увеличивать риск кровоизлияния в мозг [29].Хотя нет прямых доказательств связи между насыщением кислородом и ВЖК, снижение подачи кислорода может привести к повышению CBF в попытке поддерживать уровни SaO 2 . Баллы по шкале Апгар используются как индикаторы неблагоприятного исхода, включая тяжелую ВЖК [30, 31].
Методы машинного обучения были использованы для определения комбинаций клинических переменных, которые могут наиболее эффективно идентифицировать младенцев с риском церебрального кровотечения. Для крайне недоношенных детей почти все наиболее эффективные комбинации рассматриваемых здесь переменных включали Thro, pH и Leu.Две другие переменные представляли собой комбинации Ht, A1, A5, CBF, CRP, SaO 2 и pO 2 . Для очень недоношенных новорожденных переменные Thro, Ht и Leu всегда присутствовали в наиболее эффективных комбинациях, которые дополнялись двумя переменными из следующего списка: pH, A1, A5, CBF, SaO 2 и pCO 2 . Отсутствие CRP в этом списке по сравнению со списком для крайне недоношенных можно объяснить корреляцией между CRP и наблюдаемым Leu, так что одна из переменных является избыточной для процесса идентификации в этой популяции.Эта разница в прогностической роли СРБ между крайне и очень недоношенными новорожденными может отражать сообщаемое влияние гестационного возраста на уровни СРБ в течение первых нескольких недель после рождения [32].
Также стоит упомянуть, что переменная pO 2 присутствует в наборах переменных модели для крайне недоношенных, но не для очень недоношенных детей. Эту функцию можно использовать, чтобы отличить контрольных детей от пораженных крайне недоношенных детей (см. Таблицу 6). Рис. 5 иллюстрирует разницу в распределении вероятностей pO 2 -записей между контрольной и пораженной группами для крайне (левая панель) и очень недоношенных (правая панель) детей.Явно различное распределение pO 2 между контрольными и пораженными крайне недоношенными новорожденными с более высоким средним значением pO 2 для последней группы (см. Таблицу 5) может отражать рекомендуемое ведение крайне недоношенных новорожденных, которое нацелено на высокие ( 91–95%) значения сатурации артериальной крови кислородом [33, 34]. Хотя это нацелено на снижение смертности, было замечено, что частота возникновения других осложнений не меняется в зависимости от значений сатурации артериальной крови кислородом.Напротив, очень недоношенные дети с 27–30 WG лучше различаются по pCO 2 , чем крайне недоношенные дети, на что указывает присутствие pCO 2 в наборах переменных для этой возрастной группы (таблица 7). На рис. 6 показана разница в распределении вероятностей pCO 2 -записей между контрольной и пораженной группами для крайне (левая панель) и очень недоношенных (правая панель) детей. Это изменение набора параметров, позволяющее лучше разделить контрольную и пораженную группы, может отражать различия в развитии, например, функции легких, между крайне и очень недоношенными новорожденными.Хотя и короткий, этот период времени, который разделяет чрезвычайно и очень недоношенных детей, может быть достаточным для того, чтобы у очень недоношенных детей было более развитое состояние по сравнению с крайне недоношенными, так что им не нужна та же поддержка вентиляции O 2 . Однако, по сравнению с контрольной группой той же возрастной группы, младенцы в пораженной очень недоношенной группе могут все еще иметь менее эффективную функцию дыхания, что отражается в различиях в уровнях CO 2 в крови по сравнению с контрольной группой.Однако необходимы дальнейшие клинические исследования и дальнейшее развитие моделей машинного обучения, чтобы прояснить обнаруженные различия.
Представленные здесь модели машинного обучения основаны на лабораторных переменных, которые, помимо CBF, в настоящее время собираются во время рутинного клинического мониторинга. Например, колебания артериального давления могут привести к гипоперфузии и гиперперфузии головного мозга и могут потребовать медикаментозного лечения. При гипоперфузии часто рекомендуется сердечно-сосудистая терапия с объемной нагрузкой и фармакологическая терапия.И хотя для изменения конкретных параметров требуются специальные методы лечения, окончательных или строгих рекомендаций нет. Рассматривая несколько клинических факторов, вместо того, чтобы анализировать эффекты отдельных или небольшой группы параметров, представленные модели машинного обучения учитывают возможность кровотечения в мозг при сочетании нескольких факторов. Обнаружение таких многомерных состояний повышенного риска непросто для человека в клинических условиях, но может быть облегчено с помощью вычислений, поддерживаемых моделями.
В дополнение к вышесказанному, помогая выявлять недоношенных с риском мозгового кровотечения, представленные модели машинного обучения могут способствовать тщательному мониторингу этих недоношенных раньше, чем это происходит сейчас, и, таким образом, позволяют раньше вмешиваться и контролировать разработка клинических параметров, УЗИ головного мозга и заметных неврологических проблем.
Тот факт, что несколько моделей с хорошей прогностической способностью были получены как для крайне, так и для очень недоношенных новорожденных, позволяет использовать те модели, для которых имеется наибольший объем необходимых данных, при оценке риска кровоизлияния в мозг у отдельного новорожденного.Кроме того, выводы об индивидуальном риске кровотечения можно сделать на основе результатов тестирования нескольких моделей, сосредоточив внимание на наихудшем случае.
Помимо лабораторных переменных, представленные ML-модели основывались также на информации о CBF для различных комбинаций значений MAP и pCO 2 . Это также важно для оценки риска кровотечения в мозг. Однако значения CBF не могут быть получены экспериментально (стандартными клиническими измерениями), их необходимо рассчитать с помощью моделирования [9].
Отметим некоторые ограничения представленного исследования. 1) Поскольку данные собирались ретроспективно, у пациентов было другое количество измерений. 2) Контрольная и затронутая группы не были полностью сопоставлены по полу, но этот фактор не был включен в модели. Объективная трудность сопоставления по полу заключается в том, что недоношенные новорожденные мужского пола имеют более высокий риск ВЖК по сравнению с недоношенными женщинами [35, 36]. 3) Хотя в модель вводились измерения только до того дня, когда было проведено предыдущее плановое ультразвуковое исследование (таблица 2), некоторые измерения могли быть включены, которые на самом деле были сделаны уже после кровотечения.Это связано с тем, что точное время кровотечения невозможно определить. Например, ВЖК может произойти в первый день жизни сразу после первого ультразвукового исследования, но диагностироваться на второй или третий день жизни. Тем не менее, все измерения, сделанные в первый день, были включены. Однако мы ожидаем, что количество таких измерений «после кровотечения» невелико по сравнению с количеством измерений «до кровотечения» и не окажет существенного влияния на полученные результаты. 4) Данные были собраны ретроспективно за десятилетний период (2006–2016 гг.), В течение которого могли произойти изменения в ведении недоношенных детей.
Хотя используемые RF-модели показали хорошую производительность, в будущей работе мы планируем протестировать другие алгоритмы машинного обучения (например, kNN, SVM и CART) с учетом дополнительных функций. Планируется проверка разработанных моделей на новых данных. Для этого необходимо будет собрать дополнительные данные и ввести их в модели. Дополнительные клинические записи позволят продолжить разработку ML-моделей для разных возрастов, для которых были получены измерения, что будет способствовать повышению предсказательной силы моделей.Мы ожидаем, что разрабатываемые модели могут помочь неонатологам в будущем своевременно выявлять младенцев с риском кровоизлияния в мозг и, таким образом, снизить частоту его возникновения и связанных с этим нарушений.
Благодарности
Авторы благодарны Кристине Клиндт-Шустер (клиника «rechts der Isar», Технический университет Мюнхена) за организационную поддержку. Автор RL выражает признательность Маркусу Вюрту за звание профессора Мюнхенского технического университета.
Ссылки
- 1.Баллаб П. Внутрижелудочковое кровоизлияние у недоношенных детей: механизм заболевания. Pediatr Res. 2010; 67 (1): 1. pmid: 19816235
- 2.
Кайзер-младший, Гаусс СН, Уильямс ДК. Влияние гиперкапнии на ауторегуляцию головного мозга у детей с очень низкой массой тела при рождении, находящихся на ИВЛ. Pediatr Res. 2005; 58 (5): 931. pmid: 16257928 - 3.
Soul JS, Hammer PE, Tsuji M, Saul JP, Bassan H, Limperopoulos C и др. Колеблющаяся пассивность к давлению часто встречается в мозговом кровообращении у больных недоношенных детей.Pediatr Res. 2007; 61 (4): 467. pmid: 17515873 - 4.
О’Лири Х., Грегас М.С., Лимперопулос С., Зарецкая И., Бассан Х., Соул Дж. С. и др. Повышенная пассивность церебрального давления связана с внутричерепным кровоизлиянием, связанным с недоношенностью. Педиатрия. 2009. 124 (1): 302–309. pmid: 19564313 - 5.
Порё М., Бекх Дж. К., Гортнер Л., Землин М., Дуппре П., Эбрахими-Фахари Д. и др. Анте-, пери- и постнатальные факторы, связанные с внутрижелудочковым кровотечением у очень недоношенных детей.Early Hum Dev. 2017; 116: 1–8. pmid: 282
- 6.
Duppré P, Sauer H, Giannopoulou EZ, Gortner L, Nunold H, Wagenpfeil S. Профили клеточной и гуморальной коагуляции и возникновение ВЖК у младенцев с VLBW и ELWB. Early Hum Dev. 2015. 91 (12): 695–700. pmid: 26529174 - 7.
Шмид МБ, Рейстер Ф., Майер Б., Хопфнер Р.Дж., Фукс Х., Хаммлер HD. Проспективный мониторинг факторов риска снижает частоту внутричерепных кровотечений у недоношенных детей. Deutsches Ärzteblatt International.2013; 10 (29–30): 489. - 8.
Лампе Р., Турова В., Боткин Н., Эккардт Л., Фельдерхофф-Мюзер У., Ригер-Факелдей Э. и др. Постнатальные параклинические параметры, связанные с возникновением внутримозгового кровоизлияния у недоношенных детей. Нейропедиатрия. 2019; 50 (02): 103–110. - 9.
Сидоренко И., Турова В., Боткин Н., Эккардт Л., Алвес-Пинто А., Фельдерхофф-Мюзер У и др. Моделирование зависимости мозгового кровотока от углекислого газа и среднего артериального давления в незрелом мозге с учетом зародышевого матрикса.Фронт Neurol. 2018; 9: 812. pmid: 30356709 - 10.
Асади Х., Доулинг Р., Ян Б., Митчелл П. Машинное обучение для прогнозирования исходов острого ишемического инсульта после внутриартериальной терапии. PloS One 2014; 9 (2): e88225. pmid: 24520356 - 11.
Podda M, Bacciu D, Micheli A, Bellù R, Placidi G, Gagliardi L. Подход машинного обучения к оценке выживаемости недоношенных детей: разработка предиктора оценки выживаемости недоношенных детей (PISA). Научный представитель 2018; 8 (1): 13743.pmid: 30213963 - 12.
Риттенхаус К.Дж., Ввалика Б., Кейл А., Уинстон Дж., Стоунер М., Прайс Дж. Т. и др. Улучшение идентификации недоношенных новорожденных в условиях ограниченных ресурсов с помощью машинного обучения. PloS One. 2019; 14 (2): e0198919. pmid: 30811399 - 13.
Гихард-Коста А.М., Ларрош JC. Дифференциальный рост головного мозга плода и его инфратенториальной части. Early Hum Dev. 1990; 23: 27–40. pmid: 2209474 - 14.
Киношита Й, Окудера Т, Цуру Э, Йокота А.Объемный анализ зародышевого матрикса и боковых желудочков, выполненный с использованием МР-изображений посмертных плодов. AJNR Am J Neuroradiol. 2001. 22 (2): 382–388. pmid: 11156787 - 15.
Уилсон-Костелло Д., Фридман Х., Миних Н., Фанарофф А.А., Хак М. Повышение выживаемости с повышенными нарушениями развития нервной системы для младенцев с крайне низкой массой тела при рождении в 1990-х годах. Педиатрия. 2005; 115: 997–1003. pmid: 15805376 - 16.
Christian EA, Jin DL, Attenello F, Wen T, Cen S, Mack WJ и др.Тенденции госпитализации недоношенных новорожденных с внутрижелудочковым кровотечением и гидроцефалией в США, 2000–2010 гг. J из Neurosurg Pediatr. 2016; 17 (3): 260–269. - 17.
Пехник С.К., Кьярелли П.А., Джеззард П. Моделирование сосудистой реактивности для исследования основы взаимосвязи между объемом церебральной крови и потоком при манипуляции с CO2. Нейроизображение. 2008. 39 (1): 107–118. pmid: 175
- 18.
Брауни Дж. Мастерство машинного обучения с Р.2014. Доступно по адресу: http://machinelearningmastery.com/discover-feature-engineering-howtoengineer-features-and-how-to-getgood-at-it. - 19.
Лесмейстер К. Освоение машинного обучения с R. Packt Publishing Ltd; 2015. - 20.
Couronné R, Probst P, Boulesteix A-L. Случайный лес против логистической регрессии: крупномасштабный эталонный эксперимент. Технический отчет № 205. 2017. Статистический факультет Мюнхенского университета. - 21.
Чавла Н.В., Бойер К.В., Холл ЛО, Кегельмейер В.П.SMOTE: метод передискретизации синтетического меньшинства. J Artif Intell Res. 2002. 16: 321–357. - 22.
Rastogi S, Olmez I, Bhutada A, Rastogi D. Классификация NCI тромбоцитопении у чрезвычайно недоношенных новорожденных и ее связь со смертностью и заболеваемостью. J Perinat Med. 2011. 39 (1): 65–69. pmid: 20954853 - 23.
Пол Д.А., Лиф К.Х., Стефано Дж.Л. Повышение лейкоцитов у младенцев с внутрижелудочковым кровоизлиянием. Pediatr Neurol. 2000. 22 (3): 194–199. pmid: 10734249 - 24.Яре К., Карли Т., Луковник М., Премру-Срсен Т., Церар Л., Дерганк М. С-реактивный белок и количество лейкоцитов в материнской сыворотке в прогнозе хориоамнионита и воспалительной реакции плода после преждевременного разрыва плодных оболочек. Gynaecologia et Perinatologia. 2013; 22: 165–169.
- 25.
Вилламор-Мартинес Э., Фумагалли М., Мохаммед РО, Пассера С., Кавалларо Г., Дегреуве П. и др. Хориоамнионит — фактор риска внутрижелудочкового кровотечения у недоношенных детей: систематический обзор и метаанализ.Front Physiol. 2018; 11 (09): 1253. - 26.
Poralla C, Hertfelder HJ, Oldenburg J, Müller A, Bartmann P, Heep A. Повышенная концентрация интерлейкина-6 и изменения системы свертывания крови связаны с развитием внутрижелудочкового кровотечения у крайне недоношенных детей. Неонатология. 2012. 102 (4): 270–275. pmid: 226
- 27.
Dekom S, Vachhani A, Patel K, Barton L, Ramanathan R, Noori S. Исходные значения гематокрита после рождения и пери / внутрижелудочкового кровотечения у младенцев с крайне низкой массой тела при рождении.J Perinatol. 2018; 38: 1471. pmid: 30206347 - 28.
Левен М.И., Фавер К.Л., Ламонт РФ. Факторы риска развития внутрижелудочкового кровотечения у недоношенных новорожденных. Arch Dis Child. 1982. 57 (6): 410–417. pmid: 70 - 29.
Перлман Дж. М., Гудман С., Креуссер К. Л., Вольпе Дж. Дж. Уменьшение внутрижелудочкового кровотечения за счет устранения колеблющейся скорости мозгового кровотока у недоношенных новорожденных с респираторным дистресс-синдромом. N Engl J Med. 1985. 312 (21): 1353–1357.pmid: 3887165 - 30.
Ананд В. Неонатальные судороги: предикторы неблагоприятного исхода.

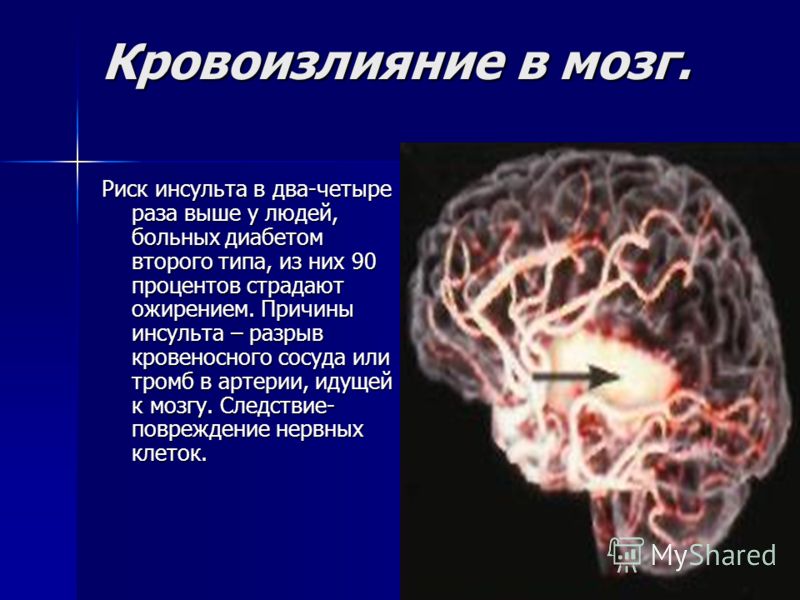 У более старших детей и взрослых значительная доля витамина К образуется бактериями, живущими в кишечники, однако микрофлора новорожденного ребенка находится в стадии становления и еще не может восполнить дефицит витамина К. В норме концентрация витамина К в крови достигает «взрослых» значений к возрасту 1 месяца.
У более старших детей и взрослых значительная доля витамина К образуется бактериями, живущими в кишечники, однако микрофлора новорожденного ребенка находится в стадии становления и еще не может восполнить дефицит витамина К. В норме концентрация витамина К в крови достигает «взрослых» значений к возрасту 1 месяца. Ребенок может не сказать об этом родителям и для компенсации глаз начал прищуривать или закрывать ладошкой.
Ребенок может не сказать об этом родителям и для компенсации глаз начал прищуривать или закрывать ладошкой.