Микоплазма пневмония у детей
Микоплазма пневмония у детей.
В органах дыхания человека поддаются развитию 5 типов возбудителя микоплазма. Одной из опасных считается микоплазма пневмония у детей. Было зафиксировано около 20% эпизодов, когда микробы данного типа вызывали воспаление органов дыхания. Больше всего заражаются дети до 15-летнего возраста.
Болезнь переходит воздушно-капельным путем, причем особо опасны капли крупного размера. Чаще всего по развивающимся признакам болезни только врач с опытом способен выявить пневмонию, которая была вызвана микоплазмой. Болезнь легких на этапе развития напоминает вирусную инфекцию. Данный вид воспаления практически не имеет специфических симптомов. Время инкубации может составлять от 7 до 21 дня.
Характерные особенности болезни
Микоплазменная пневмония у детей относится к воспалению легких атипичной формы. Возбудителем заболевания является микоплазма пневмония. Развитие микоплазмома начинается с катаральных проявлений, потому нередко становится причиной неправильного диагностирования и несвоевременного посещения врача.
Развитие микоплазмома начинается с катаральных проявлений, потому нередко становится причиной неправильного диагностирования и несвоевременного посещения врача.
Болезнь чаще возникает за стенами больниц, за что и получила название внебольничная. Около 50% случаев заражения именно этой пневмонии. Зачастую недуг поражает детей и подростков. Чаще можно заразиться в детских учреждениях.
Бывают случаи, когда пневмония возникает сразу после рождения малыша. Это врожденная форма микоплазмоза. У новорожденного она развивается очень тяжело. Может возникнуть и генерализованная форма недуга, при которой поражаются внутренние органы.
Различают очаговую и долевую микоплазменную пневмонию. Для очаговой болезни характерно поражение незначительного участка легкого (несколько долек органа). Долевой пневмонии свойственно вовлечение в процесс поражения всей доли легкого. Чаще всего воспалительный процесс односторонний.
Особенность течения пневмонии заключается в частой хронизации процесса, по причине запоздалого лечения и генерализацией микоплазменной инфекции в раннем возрасте у детей. Это объясняется строением микроорганизма, напоминающего по структуре отдельные собственные клетки. Потому выработка защитных антител происходит поздно, с возможным поражением собственной ткани, вызывая аутоиммунные процессы у взрослых, детей.
Это объясняется строением микроорганизма, напоминающего по структуре отдельные собственные клетки. Потому выработка защитных антител происходит поздно, с возможным поражением собственной ткани, вызывая аутоиммунные процессы у взрослых, детей.
Если не лечить заболевание, могут возникнуть серьезные последствия.
Категории риска
Опасность заболеть воспалением легких, которое вызвано микоплазмой, обусловлено защитной силой организма человека, возрастной категорией. Зачастую заражению пневмонией предрасположены дети. Исходя из различных групп детей по возрасту, можно наблюдать различную стадию предрасположенности заражению органов дыхания.
- У малышей до 3-х летнего возраста болезнь протекает достаточно легко, без проявлений признаков.
- Дети от 3-х лет имеют ярко выраженную клиническую картину.
- В школьном возрасте до 15-ти лет болезнь проявляется намного чаще.
Способы и причины заражения
Заражение происходит через воздух. Микоплазмы с потоком вдыхаемого воздуха попадают в верхние пути дыхания с прохождением далее в бронхи, легкие. Источник заражения – больной человек либо носитель, без проявления признаков.
Микоплазмы с потоком вдыхаемого воздуха попадают в верхние пути дыхания с прохождением далее в бронхи, легкие. Источник заражения – больной человек либо носитель, без проявления признаков.
Микоплазма размножается в альвеолах, что способствует формированию интернационального типа пневмонии, при которой возникает утолщение перегородок посередине альвеол. После перенесенной болезни у детей появляется иммунитет на 10 лет.
Факторы развития недуга следующие:
- иммунодефицит;
- хронические болезни в тяжелой форме;
- переохлаждение;
- плохое питание.
Признаки заболевания
При проникновении микоплазмы в организм у ребенка возникают признаки следующих болезней:
- фарингит;
- ларингит;
- бронхиолит;
- синусит;
- ринит.
Проникая ниже в легкие, бронхи, болезнь способствует развитию бронхопневмонии.
Изначально пневмония у детей не проявляется специфическими признаками и зачастую схожа с признаками гриппа.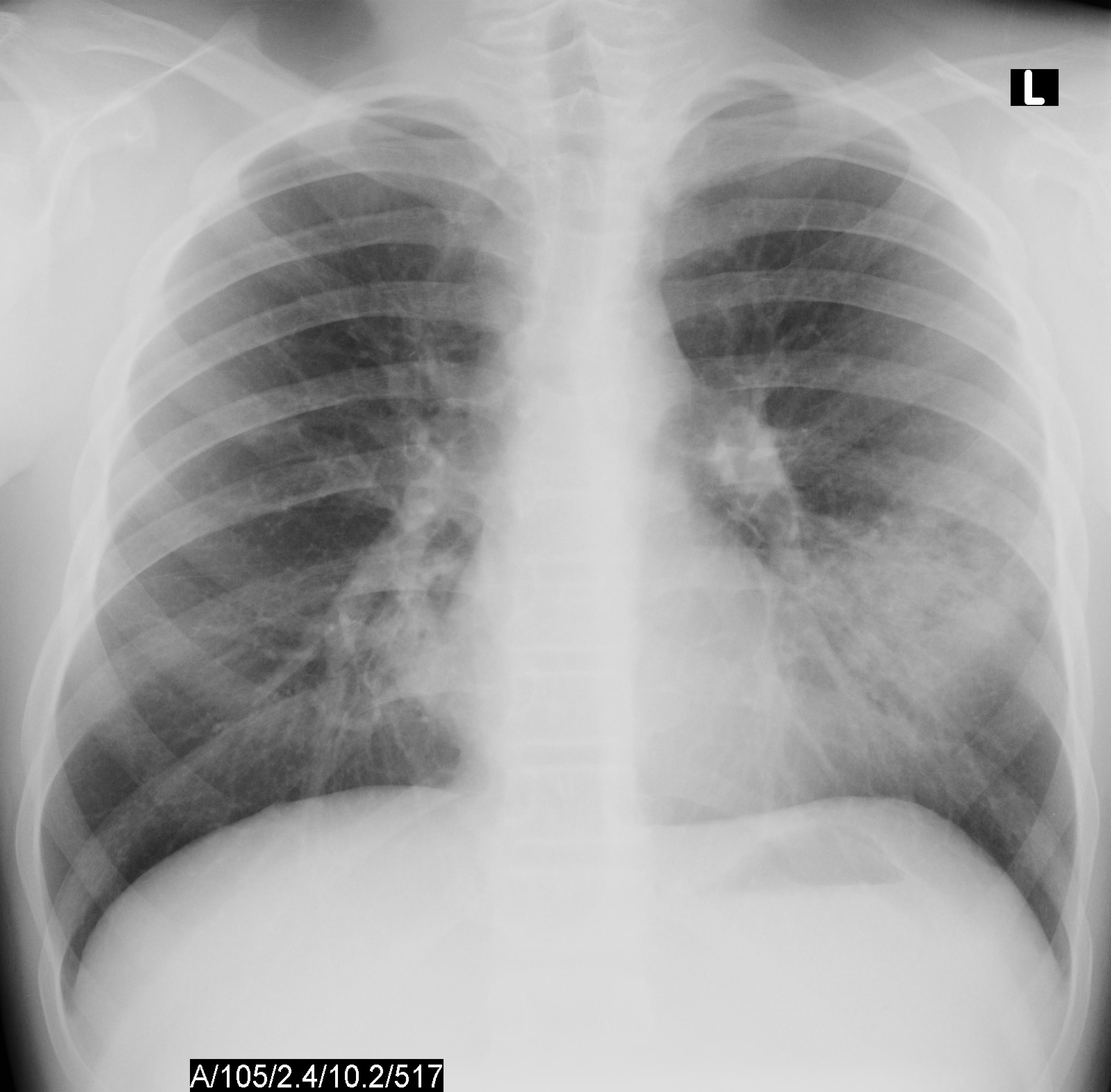
- Болит голова.
- Температура, озноб.
- Присутствует насморк.
- Болит горло.
- Сухой надрывной кашель, с возможным выделением у малыша мокроты в виде белого цвета пены.
В зависимости от течения пневмонии поднимается температура, кашель, выраженный и частый, бывает, проявляется одышка.
При первичном посещении специалиста при прослушивании органов дыхания, физикальные симптомы пневмонии могут не проявляться ярко. Изначально они вообще не проявляются. Основной признак – это влажные хрипы в органах дыхания, похожие на хрипы со свистом, как при астме.
При сопротивлении бронхов кашель может присутствовать у детей 2-3 недели. Признаки отравления могут выражаться слабо. Отличие микоплазменной пневмонии в том, что при ней часто присутствуют признаки, возникающие вне легкого.
- Высыпания на коже.
- Болит живот.
- Боль в мышцах и суставах.
- Покалывание.

Высыпания проявляются у детей в 12-15% случаев. Сыпь пятнисто-пупулезная, уртикарная.
Некоторые больные дети имеют смешанную этиологию. Это указывает на присоединение вторичной бактериальной инфекции. Тяжелое течение замечено у сливной пневмонии, когда мелкие очаги соединяются между собой и затрагивают несколько сегментов легкого либо целую долю.
У половины больных детей наблюдают увеличенную печень. Работа органа нарушается. Увеличение селезенки возникает в редких случаях. У дошкольников нередко увеличиваются лимфоузлы.
Как вылечить болезнь?
Лечебный процесс у детей проводится после установления диагноза и исключения иных болезней органов дыхания.
Диагностика включает ряд исследований.
- Рентгенография грудной клетки.
- Компьютерная томография.
- Физикальное исследование.
- Исследование слизи, чтобы уточнить вид возбудителя.
- Осмотр зева, анализ мочи и крови.

На рентгеновском изображении при сегментарном воспалении органов дыхания видны очаговые инфильтраты в нижних сегментах нечетких контуров, также интерстициальные нарушения. При исследовании слизи микоплазмы не выявляют.
Лечение больных детей микоплазменной пневмонии направлено на прием антибактериальных средств.
- Тетрациклины – доксициклин.
- Макролиды – азитромицин, эритромицин.
Перед назначением этих препаратов врач опирается на возраст ребенка. Так, доксициклином лечить детей до 12 лет нельзя, так и старших по возрасту детей, у которых масса тела меньше 45 кг.
Для новорожденных детей, макролиды намного безопаснее фторхинолонов, тетрациклинов. Лечение заключается в нарушении процесса синтеза белка в клетке чувствительного микроорганизма.
Так как антибиотики пенициллиновой и цефалоспориновой группы малоэффективны, их не назначают детям.
Лечение детей не проходит без осуществления ряда рекомендаций:
- обильное питье;
- постельный режим;
- дезинтоксикация организма;
- физиопроцедуры;
- массаж.

Помимо данных процедур и приема антибиотиков, лечение проходит с приемом отхаркивающих лекарств, это сиропы, микстуры.
Если лечение правильное, отсутствуют осложнения, тогда выздоровление можно наблюдать спустя 2 недели от начала терапии соответствующими препаратами.
Осложнения
Очень часто дети сталкиваются с геморрагическими поражениями слизистой оболочки, кожи, высыпаниями и воспалением конъюнктивы. Часть представленных симптомов проходит самостоятельно к концу 2 недели заболевания.
При осложнениях кардиального характера возникает миокардит, перикардит. Встречаются такие болезни редко.
Также дети подвержены таким симптомам, как рвота, тошнота, понос. Они проявляются в 25% случаев микоплазменной пневмонии.
Бывают осложнения на суставы, которые выражаются возникновением артрита.
После перенесенного микоплазменного воспаления органов дыхания рекомендуют диспансерное наблюдение у врача — пульманолога на протяжении 1-2 месяцев.
назад
Микоплазменная инфекция у детей (обзор литературы) | Зайцева С.В., Застрожина А.К., Муртазаева О.А.
Этиологическим фактором ОРЗ у детей нередко является Mycoplasma pneumoniae. Особенности данного возбудителя определяют возможность длительной персистенции микроорганизма и ускользание его из-под контроля иммунной системы хозяина. Несмотря на то, что эффективность лечения ОРЗ, особенно микоплазменной инфекции, тесно связана с точностью этиологической диагностики, в практическом здравоохранении это представляется практически невыполнимой задачей. Отсутствуют специфические клинические и рентгенологические признаки заболевания, которые позволили бы практическому врачу провести дифференциальную диагностику ОРЗ. Вместе с этим лабораторная диагностика в амбулаторных условиях в России часто недоступна и осложнена возможностью получения ложноположительных и ложноотрицательных результатов. Результатами этого нередко становятся рецидивирование респираторных симптомов верхних и нижних дыхательных путей, в частности длительный кашель у детей, и отсутствие рационального лечения. В то время как внебольничные инфекции у детей после 5 лет до 40% случаев могут быть этиологически обусловлены M. pneumoniae, терапия их начинается не с группы макролидов, а, в соответствии с клиническими рекомендациями, с бета-лактамных антибиотиков. Пациенты нередко получают несколько неэффективных курсов антибиотиков, что способствует формированию устойчивости бактерий к антибактериальным препаратам. Соответственно, необходимо расширение диагностической базы для своевременной диагностики инфекции, связанной с M. pneumoniae. С другой стороны, требуется продолжение исследований по созданию препаратов для специфической профилактики такой непростой инфекции, как респираторный микоплазмоз.
Результатами этого нередко становятся рецидивирование респираторных симптомов верхних и нижних дыхательных путей, в частности длительный кашель у детей, и отсутствие рационального лечения. В то время как внебольничные инфекции у детей после 5 лет до 40% случаев могут быть этиологически обусловлены M. pneumoniae, терапия их начинается не с группы макролидов, а, в соответствии с клиническими рекомендациями, с бета-лактамных антибиотиков. Пациенты нередко получают несколько неэффективных курсов антибиотиков, что способствует формированию устойчивости бактерий к антибактериальным препаратам. Соответственно, необходимо расширение диагностической базы для своевременной диагностики инфекции, связанной с M. pneumoniae. С другой стороны, требуется продолжение исследований по созданию препаратов для специфической профилактики такой непростой инфекции, как респираторный микоплазмоз.
Ключевые слова: дети, респираторные инфекции, Mycoplasma pneumoniae, антибиотики, макролиды, азитромицин.
Для цитирования: Зайцева С. В., Застрожина А.К., Муртазаева О.А. Микоплазменная инфекция у детей (обзор литературы). РМЖ. 2017;5:327-334.
В., Застрожина А.К., Муртазаева О.А. Микоплазменная инфекция у детей (обзор литературы). РМЖ. 2017;5:327-334.
Mycoplasma infection in children (literature review)
Zaitseva S.V., Zastrozhina A.K., Murtazaeva O.A.
Moscow State Medical Stomatological University named after A.I. Evdokimov
Mycoplasma pneumoniae is often the main etiological factor of acute respiratory infections (ARI) in children. The features of this causative agent determine its long-term persistence and its ability to escape the control of the host’s immune system. Despite the fact that the effectiveness of the treatment of ARI, and especially mikoplasma infection, is closely related to the accuracy of etiological diagnosis, it seems almost an impossible in the practical health care. There are no specific clinical and radiological signs of the disease, which would allow a practical doctor to make a differential diagnosis of ARI.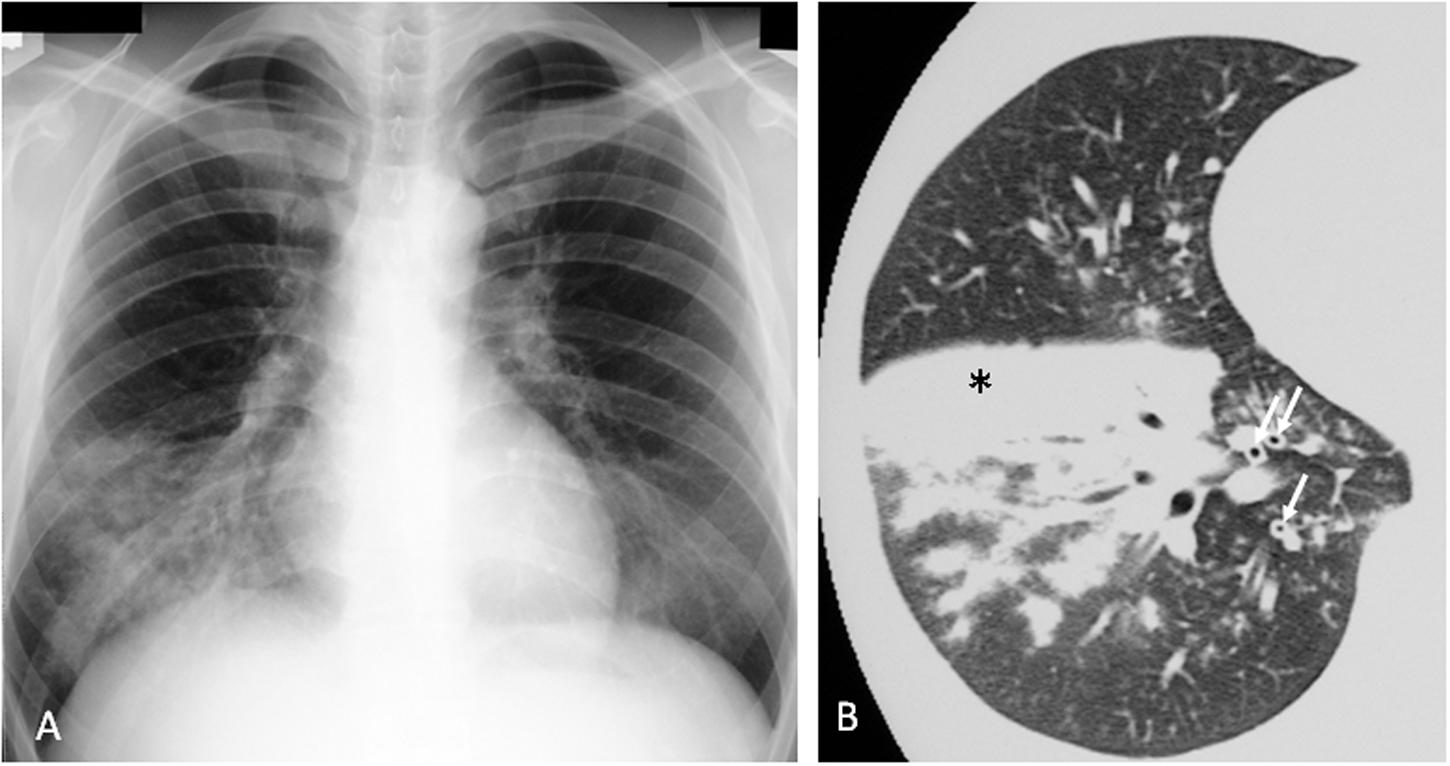 In addition to this, the outpatient laboratory diagnostics in Russia is often unavailable and complicated by the possibility of false positive and false negative results. It often results in a recurrence of respiratory symptoms of the upper and lower respiratory tract, in particular in a prolonged cough in children, and the lack of rational treatment. Despite the fact that up to 40% of the out-of-hospital infections in children aged 5 years and more are etiologically caused by Mycoplasma pneumoniae, in accordance with clinical recommendations the therapy of these infections begins with beta-lactam antibiotics, and not with a group of macrolides. Patients often receive several ineffective courses of antibiotics, thus contributing to the formation of resistance of bacteria to antibacterial drugs. That’s why it is necessary to expand the diagnostic base for the timely diagnosis of infection associated with Mycoplasma pneumoniae. On the other hand, further researches are needed to develop drugs for specific prevention of such a complex infection as respiratory mycoplasmosis.
In addition to this, the outpatient laboratory diagnostics in Russia is often unavailable and complicated by the possibility of false positive and false negative results. It often results in a recurrence of respiratory symptoms of the upper and lower respiratory tract, in particular in a prolonged cough in children, and the lack of rational treatment. Despite the fact that up to 40% of the out-of-hospital infections in children aged 5 years and more are etiologically caused by Mycoplasma pneumoniae, in accordance with clinical recommendations the therapy of these infections begins with beta-lactam antibiotics, and not with a group of macrolides. Patients often receive several ineffective courses of antibiotics, thus contributing to the formation of resistance of bacteria to antibacterial drugs. That’s why it is necessary to expand the diagnostic base for the timely diagnosis of infection associated with Mycoplasma pneumoniae. On the other hand, further researches are needed to develop drugs for specific prevention of such a complex infection as respiratory mycoplasmosis.
Key words: children, Mycoplasma pneumoniae respiratory infections, antibiotics, macrolides, azithromycin.
For citation: Zaitseva S.V., Zastrozhina A.K., Murtazaeva O.A. Mycoplasma infection in children (literature review) // RMJ. 2017. № 5. P. 327–334.
Обзор посвящен микоплазменной инфекции у детей
Введение
Ежегодно в осенне-зимний период отмечается повышение заболеваемости острыми респираторными заболеваниями (ОРЗ). В России ежегодно регистрируют от 27,3 до 41,2 млн заболевших гриппом и другими ОРВИ [1]. Наиболее часто от инфекций страдают дети, особенно в возрасте от 3 до 14 лет. Несмотря на то, что большинство детей способны справиться с инфекцией с помощью защитных сил собственного организма, они болеют чаще, чем взрослые, и имеют высокую вероятность развития осложнений.
Наиболее тяжелым проявлением ОРЗ является пневмония. В 2016 г. в Российской Федерации зарегистрировано на 23,8% больше случаев внебольничных пневмоний (ВП), чем в 2015 г.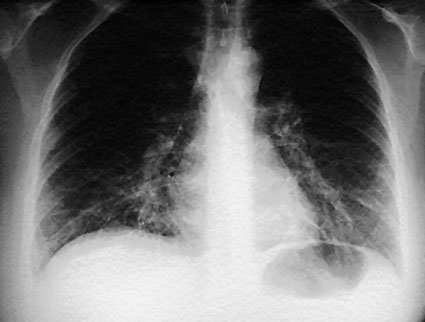 Средний по стране показатель заболеваемости составил 418,3 на 100 тыс. населения против 337,8 в 2015 г. [2].
Средний по стране показатель заболеваемости составил 418,3 на 100 тыс. населения против 337,8 в 2015 г. [2].
Высокая распространенность пневмоний сочетается с высокой смертностью детей от этого заболевания во всем мире. Так, по данным ВОЗ, в 2015 г. от пневмонии умерли 920 136 детей в возрасте до 5 лет, что составляет 15% всех случаев смерти детей этого возраста [3]. Причин такой неблагополучной статистики немало. Среди них можно выделить факторы, непосредственно определяющие тяжесть инфекционного процесса, и факторы, косвенно влияющие на течение заболевания. Так, особенности возбудителя, поздняя диагностика, повторные нерациональные курсы антимикробной терапии, состояние иммунной системы пациентов во многом определяют течение заболевания, в то время как воздействие внешних факторов (экологических, социальных) может способствовать возникновению рекуррентных инфекций и персистенции микроорганизмов.
Этиология
Большое внимание в настоящее время уделяется изучению значения различных микроорганизмов при респираторных заболеваниях. Понимание их этиологической и патогенетической роли в возникновении патологических симптомов очень важно для своевременной диагностики и рациональной терапии ОРЗ. Особенно важно понимание вклада атипичных патогенов в структуру ОРЗ. К этой группе чаще всего относятся Mycoplasma pneumoniae, Legionella spp. (прежде всего Legionella pneumophila), Chlamydophila (Chlamydia), Coxiella burnetti (возбудитель Q-лихорадки), респираторные вирусы (вирусы гриппа А и В, респираторный синцитиальный вирус), а также более редко встречающиеся микроорганизмы: возбудители туляремии (Francisella tularensis), лептоспироза (Leptospira spp.), хантавирусы, хламидиеподобный «возбудитель Z». В современной медицинской литературе более распространена лаконичная трактовка термина «атипичные возбудители», включающая только M. pneumoniae, Chlamydophila pneumoniae и Legionella spp. Наибольшее значение при ОРЗ у детей из данной группы патогенов имеет M. pneumoniae. Данный микроорганизм может вызывать воспаление как верхних, так и нижних дыхательных путей.
Понимание их этиологической и патогенетической роли в возникновении патологических симптомов очень важно для своевременной диагностики и рациональной терапии ОРЗ. Особенно важно понимание вклада атипичных патогенов в структуру ОРЗ. К этой группе чаще всего относятся Mycoplasma pneumoniae, Legionella spp. (прежде всего Legionella pneumophila), Chlamydophila (Chlamydia), Coxiella burnetti (возбудитель Q-лихорадки), респираторные вирусы (вирусы гриппа А и В, респираторный синцитиальный вирус), а также более редко встречающиеся микроорганизмы: возбудители туляремии (Francisella tularensis), лептоспироза (Leptospira spp.), хантавирусы, хламидиеподобный «возбудитель Z». В современной медицинской литературе более распространена лаконичная трактовка термина «атипичные возбудители», включающая только M. pneumoniae, Chlamydophila pneumoniae и Legionella spp. Наибольшее значение при ОРЗ у детей из данной группы патогенов имеет M. pneumoniae. Данный микроорганизм может вызывать воспаление как верхних, так и нижних дыхательных путей. В человеческой популяции респираторный микоплазмоз составляет 10–16% всех случаев ОРЗ. Эти цифры в период эпидемических вспышек могут достигать 30–40%. Согласно данным литературы, M. pneumoniae вызывает до 40% ВП у детей и около 18% инфекций у пациентов, нуждающихся в госпитализации [4]. Необходимо отметить возрастные особенности распространенности данного патогена у детей. Наиболее часто M. pneumoniae выявляется у детей старше 5-летнего возраста. В ходе эпидемиологического исследования, проведенного в США в 2010–2012 гг. с целью определения этиологического фактора ВП у 2222 детей, M. pneumoniae была выявлена у 19% детей в возрасте старше 5 лет и у 3% детей младше 5 лет [5].
В человеческой популяции респираторный микоплазмоз составляет 10–16% всех случаев ОРЗ. Эти цифры в период эпидемических вспышек могут достигать 30–40%. Согласно данным литературы, M. pneumoniae вызывает до 40% ВП у детей и около 18% инфекций у пациентов, нуждающихся в госпитализации [4]. Необходимо отметить возрастные особенности распространенности данного патогена у детей. Наиболее часто M. pneumoniae выявляется у детей старше 5-летнего возраста. В ходе эпидемиологического исследования, проведенного в США в 2010–2012 гг. с целью определения этиологического фактора ВП у 2222 детей, M. pneumoniae была выявлена у 19% детей в возрасте старше 5 лет и у 3% детей младше 5 лет [5].
Таким образом, M. pneumoniae имеет большое значение в генезе ОРЗ и ВП в детском возрасте. Однако этиологическая диагностика, имеющая решающее значение для выбора рациональной терапии данной инфекции, является сложной задачей для практического здравоохранения и часто запаздывает на длительное время. Обусловлено это особенностями строения и жизнедеятельности микроорганизма, которые определяют своеобразную клиническую картину, течение заболевания и иммунный ответ пациента на данную инфекцию.
Особенности Mycoplasma pneumoniae
Первые сведения о микоплазмах были опубликованы Nocard и Roux в 1898 г. Они выделили контагиозную культуру плевропневмонии крупного рогатого скота и стали изучать эту группу патогенов, объединенных однотипными биологическими свойствами, назвав их «плевропневмониеподобные микроорганизмы». В 1929 г. Novac предложил назвать эту группу микроорганизмов «микоплазмой». С 1956 г. было установлено, что данные микроорганизмы являются фильтрующимися, не имеющими клеточной стенки. Изучение микоплазм как патогенов человеческого организма началось с 1942 г. Тогда из мокроты больного атипичной пневмонией человека M.D. Eaton впервые выделил возбудитель, который был отнесен к вирусам и длительное время назывался по имени исследователя – «агент Eaton» [6]. Главными особенностями этого агента были малые размеры, он свободно проходил через фильтры и был не способен расти на стандартных биологических средах. Изначально его рассматривали как вирус. Однако вирусная природа его была опровергнута в связи с губительным действием на него антибактериальных препаратов – хлортетрациклина и стрептомицина. Только в 1963 г. были окончательно определены свойства данного микроорганизма, и он был назван Mycoplasma pneumoniae [7, 8].
Однако вирусная природа его была опровергнута в связи с губительным действием на него антибактериальных препаратов – хлортетрациклина и стрептомицина. Только в 1963 г. были окончательно определены свойства данного микроорганизма, и он был назван Mycoplasma pneumoniae [7, 8].
Согласно современной номенклатуре, микроорганизм M. pneumoniae относится к роду Mycoplasma, семейству Mycoplasmataceae, порядку Mycoplasmatales, классу Mollicutes. Среди семейства Mycoplasmataceae в патогенезе инфекций человека общепризнанной является роль 4-х основных видов микоплазм. К ним относятся M. pneumoniae, которая является частым возбудителем респираторных инфекций, M. genitalium, M. hominis и U. urealyticum вызывают инфекции мочеполового тракта. Последние два возбудителя также могут быть причиной инфекций у новорожденных [9, 10].
Согласно результатам ряда исследований, развитие и распространение микоплазменной инфекции носят эпидемический характер.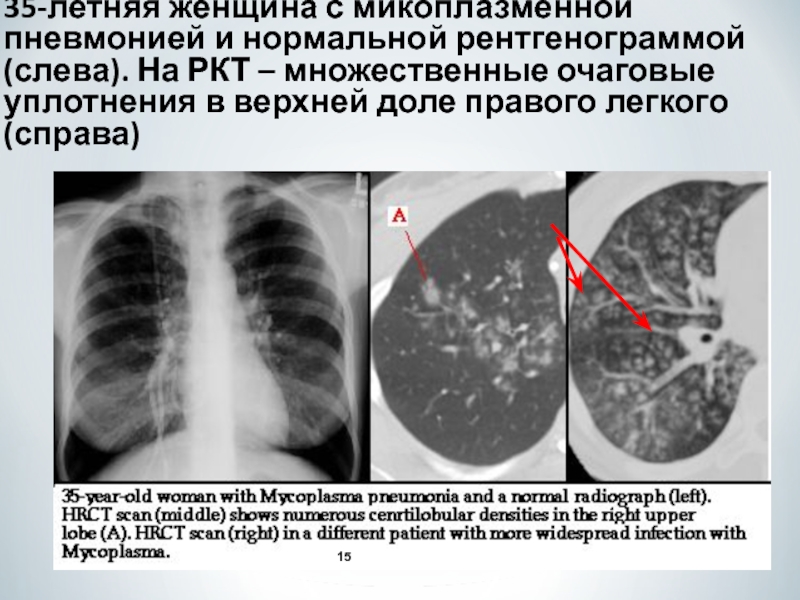 Вспышки возникают с интервалами от 3 до 7 лет и продолжаются в течение 1–3 лет с пиками заболеваемости в осенний и зимний период. Предположительно этот факт обусловлен наличием как минимум 2-х основных подтипов M. pneumoniae, которые часто выделяют при клинических исследованиях [11]. Вместе с этим в последние годы все больше внимания уделяется внешним факторам (климатическим изменениям), влияющим на сезонность циркуляции M. pneumoniae в естественных условиях в различных географических зонах [12].
Вспышки возникают с интервалами от 3 до 7 лет и продолжаются в течение 1–3 лет с пиками заболеваемости в осенний и зимний период. Предположительно этот факт обусловлен наличием как минимум 2-х основных подтипов M. pneumoniae, которые часто выделяют при клинических исследованиях [11]. Вместе с этим в последние годы все больше внимания уделяется внешним факторам (климатическим изменениям), влияющим на сезонность циркуляции M. pneumoniae в естественных условиях в различных географических зонах [12].
Многочисленными исследованиями установлено, что микоплазмы по своим структурным свойствам находятся как бы между вирусами и бактериями. С одной стороны, возможность расти на бесклеточной среде и чувствительность к некоторым антибиотикам приближают их к бактериям. С другой стороны, по размерам генома и склонности к внутриклеточному паразитизму они похожи на вирусы. Малые размеры данного микроорганизма позволяют ему широко распространяться воздушно-капельным путем. Хорошо известна способность этих патогенов преодолевать слизистые барьеры дыхательных путей, сливаться с клетками хозяина и выживать внутриклеточно. Нередко даже после лечения антибактериальными препаратами M. pneumoniae способны синтезировать собственную ДНК и размножаться, что приводит к латентному, хроническому течению микоплазменной инфекции [13, 14].
Нередко даже после лечения антибактериальными препаратами M. pneumoniae способны синтезировать собственную ДНК и размножаться, что приводит к латентному, хроническому течению микоплазменной инфекции [13, 14].
Точный механизм внутриклеточной жизнедеятельности данного патогена до настоящего времени неизвестен, однако потенциал для цитоплазматической секвестрации объясняет трудность полного устранения M. pneumoniae. Согласно данным литературы, некоторые пациенты могут оставаться заразными в течение длительного времени, несмотря на исчезновение многих симптомов [15].
Характерной особенностью M. pneumoniae является отсутствие клеточной стенки, т. к. они не способны синтезировать жесткие пептидогликаны [7, 8]. Клетки микоплазмы окружены мембраной, покрытой снаружи капсулоподобным слоем. Мембрана содержит видоспецифический антиген. Отсутствием ригидной клеточной стенки обусловлена природная устойчивость M. pneumoniae к антибиотикам, действующим на мембрану бактериальной клетки. Эти микроорганизмы устойчивы ко всем бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам) и гликопептидам (ванкомицину), полимиксину, рифампицину, сульфаниламидам, триметоприму и налидиксовой кислоте.
Эти микроорганизмы устойчивы ко всем бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам) и гликопептидам (ванкомицину), полимиксину, рифампицину, сульфаниламидам, триметоприму и налидиксовой кислоте.
Отсутствием клеточной стенки обусловлены невысокая выживаемость M. pneumoniae вне организма-хозяина и повышенная чувствительность к факторам внешней среды. В силу нестойкости в окружающей среде инфицирование происходит лишь при тесном контакте между людьми. Поэтому часто очаги респираторного микоплазмоза бывают в семьях и организованных коллективах [16, 17].
Таким образом, M. pneumoniae в силу своих структурных особенностей является мембранным паразитом. Промежуточное положение между вирусами и бактериями, способность паразитировать на мембране респираторного тракта, возможность саморепликации и длительной персистенции определяют патогенность M. pneumoniae для респираторного тракта человека и клиническую картину инфекции.
Заболевание начинается с попадания M. pneumoniae на слизистую респираторного тракта. Наиболее часто это происходит воздушно-капельным путем, через дыхательные пути. Уже через 24 ч после заражения [18] начинается прилипание M. pneumoniae к эпителию респираторного тракта при помощи белка Р1 (антиген с молекулярной массой 169 кДа), который играет также большую роль в формировании иммунного ответа на патоген. Существование множественных вариаций белка Р1 M. pneumoniae объясняет кратковременность постинфекционного иммунитета при данной инфекции [7, 8].
pneumoniae на слизистую респираторного тракта. Наиболее часто это происходит воздушно-капельным путем, через дыхательные пути. Уже через 24 ч после заражения [18] начинается прилипание M. pneumoniae к эпителию респираторного тракта при помощи белка Р1 (антиген с молекулярной массой 169 кДа), который играет также большую роль в формировании иммунного ответа на патоген. Существование множественных вариаций белка Р1 M. pneumoniae объясняет кратковременность постинфекционного иммунитета при данной инфекции [7, 8].
Как было указано ранее, M. pneumoniae является мембранным паразитом. После прикрепления к рецепторам и мембране эпителиоцитов дыхательных путей липидные компоненты мембраны микоплазмы диффундируют в клеточную мембрану хозяина, а стеролы клетки хозяина поступают в мембрану микоплазмы. В момент прикрепления клетка вытягивается и располагается между ресничками эпителиальных клеток, что позволяет микоплазмам колебаться вместе с ресничками и не выноситься с отгоняемой ресничками слизью. Расположение микоплазмы в инвагинатах клеточной мембраны и окружение ресничками эпителия защищают микоплазму от действия антител хозяина. После проникновения в клетки реснитчатого эпителия микоплазма размножается в их цитоплазме, образуя микроколонии. В фагоцитирующих клетках микоплазма может длительное время персистировать и заноситься в разные органы [7].
Расположение микоплазмы в инвагинатах клеточной мембраны и окружение ресничками эпителия защищают микоплазму от действия антител хозяина. После проникновения в клетки реснитчатого эпителия микоплазма размножается в их цитоплазме, образуя микроколонии. В фагоцитирующих клетках микоплазма может длительное время персистировать и заноситься в разные органы [7].
Перекись водорода и супероксид, вырабатываемые M. pneumoniae, повреждают эпителий и приводят к воспалению. В последнее десятилетие исследования по изучению патогенности M. pneumoniae позволили выделить уникальный для микроорганизмов, специфический CARDS-токсин (community acquired respiratory distress syndrome toxin), который вызывает вакуолизацию клеток бронхиального эпителия и снижает двигательную активность ресничек. CARDS-токсин обладает прямым цитотоксическим действием на эпителий слизистой оболочки респираторного тракта и вызывает обширные зоны перибронхиального и периваскулярного воспаления. Была выявлена прямая зависимость между количеством CARDS-токсина, выделяемого M. pneumoniae, и тяжестью поражения легочной ткани. Анализ структуры указывает на то, что CARDS-токсин обладает сходством аминокислотной последовательности с экзотоксином Bordetella коклюша (коклюшный токсин) [19, 20]. Цитотоксическое действие M. pneumoniae проявляется клинически сухостью в носу, першением в горле и сухим, отрывистым кашлем, которые обычно ассоциируются с ранней микоплазменной инфекцией [4].
pneumoniae, и тяжестью поражения легочной ткани. Анализ структуры указывает на то, что CARDS-токсин обладает сходством аминокислотной последовательности с экзотоксином Bordetella коклюша (коклюшный токсин) [19, 20]. Цитотоксическое действие M. pneumoniae проявляется клинически сухостью в носу, першением в горле и сухим, отрывистым кашлем, которые обычно ассоциируются с ранней микоплазменной инфекцией [4].
В ходе многих исследований было установлено, что воспалительный ответ при микоплазменной инфекции характеризуется низкой степенью инфильтрации нейтрофилов, что, вероятно, определяет хронический, а не острый характер заболевания, как при инфицировании легкого патогенами других видов [12]. Клинические симптомы: першение в горле, хрипы в легких, затрудненное дыхание развиваются постепенно и являются следствием медленного отмирания эпителия. Микоплазменную инфекцию нижних дыхательных путей – пневмонию называют «walking pneumonia», что можно условно перевести с английского языка как «никуда не торопящаяся» [14].
Однако тяжесть поражения легких, вызванного M. pneumoniae, зависит не только от биологических свойств возбудителя, но и от индивидуальных особенностей иммунного ответа макроорганизма на воздействие инфекционного агента. Так, в поздние сроки микоплазменной инфекции цитолиз эпителиальных клеток в нижних дыхательных путях может быть причиной развития гиалиновых мембран у детей раннего возраста. Отмечено, что в результате тяжелого респираторного микоплазмоза может развиться хронический интерстициальный легочный фиброз [21]. Описаны случаи молниеносного течения микоплазменной инфекции с развитием тяжелой дыхательной недостаточности и респираторного дистресс-синдрома у маленьких детей и пожилых людей, которые ассоциируют с действием CARDS-токсина, продуцируемого M. pneumoniae [22, 23].
Все чаще обсуждается роль M. pneumoniae в патогенезе хронической бронхолегочной патологии. Особое внимание уделяется значению M. pneumoniae в патогенезе бронхиальной астмы (БА).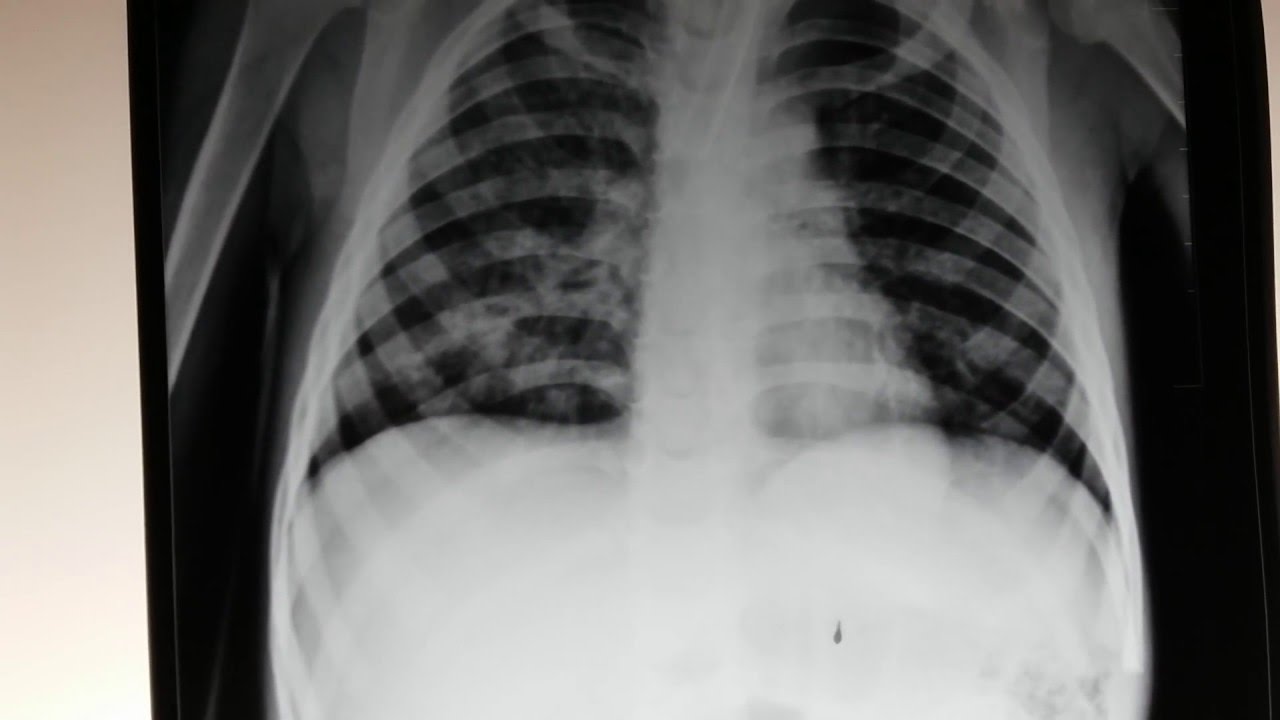 Так, в экспериментах было показано, что рекомбинантный CARDS-токсин способствует развитию мощного аллергического воспаления в легких, продукции цитокинов Тh3-типа и выраженной гиперреактивности дыхательных путей [24]. Также установлено, что взаимодействие между клетками респираторного эпителия и поверхностных липопротеидов M. pneumoniae может индуцировать через Toll-подобный рецептор макроорганизма (TLR) -2 [25] или TLR-4 [26] синтез внутриклеточной молекулы адгезии (ICAM) рецепторов.
Так, в экспериментах было показано, что рекомбинантный CARDS-токсин способствует развитию мощного аллергического воспаления в легких, продукции цитокинов Тh3-типа и выраженной гиперреактивности дыхательных путей [24]. Также установлено, что взаимодействие между клетками респираторного эпителия и поверхностных липопротеидов M. pneumoniae может индуцировать через Toll-подобный рецептор макроорганизма (TLR) -2 [25] или TLR-4 [26] синтез внутриклеточной молекулы адгезии (ICAM) рецепторов.
Таким образом, установлено, что M. pneumoniae в течение длительного времени может быть причиной обострения БА [27]. Более того, в некоторых исследованиях были выделены бактерии с более высокой распространенностью среди пациентов с БА [28]. Другие исследования указывают на вероятность участия M. pneumoniae в развитии БА [29].
Несмотря на то, что многочисленными исследованиями подтверждена связь M. pneumoniae с пневмонией и БА, механизм развития болезни остается изученным не до конца. Рассматриваются теории воспаления в дыхательных путях, связанного с Th3-направленным ответом иммунной системы. Так, установлено, что при респираторной инфекции, ассоциированной с M. pneumoniae, увеличивается высвобождение цитокинов 2-го типа, включая интерлейкины (IL) -4 и -5 [30]. Эти цитокины, в свою очередь, способствуют гиперпродукции иммуноглобулина (Ig) Е, играющего основную роль в патогенезе БА у детей.
Рассматриваются теории воспаления в дыхательных путях, связанного с Th3-направленным ответом иммунной системы. Так, установлено, что при респираторной инфекции, ассоциированной с M. pneumoniae, увеличивается высвобождение цитокинов 2-го типа, включая интерлейкины (IL) -4 и -5 [30]. Эти цитокины, в свою очередь, способствуют гиперпродукции иммуноглобулина (Ig) Е, играющего основную роль в патогенезе БА у детей.
Таким образом, морфологические и физиологические особенности M. pneumoniae определяют клиническую картину микоплазменной инфекции. Внутриклеточная локализация возбудителя защищает его от иммунного ответа хозяина и позволяет длительно персистировать в его организме. Специфика патогенного действия микроорганизма на клетки реснитчатого эпителия определяет соответствующую клиническую картину заболевания, которая чаще не имеет манифестного начала и характеризуется длительным рецидивированием таких симптомов, как кашель. В то же время M. pneumoniae усугубляет течение неспецифической хронической бронхолегочной патологии, нередко являясь триггером обострения заболевания.
Клиника
Выраженность клинических проявлений микоплазменной инфекции весьма вариабельна и может характеризоваться как субклиническим, так и манифестным течением. M. pneumoniae может поражать как верхние, так и нижние дыхательные пути. Инкубационный период при микоплазменной инфекции составляет около 2–3 нед.
Поражение верхних дыхательных путей при микоплазменной инфекции может проявляться различными синдромами. Чаще ведущим клиническим вариантом инфекции является фарингит. Реже развиваются микоплазменные ринит, синусит, средний отит, мирингит (воспаление барабанной перегородки), который может быть буллезным, и ларингит. Следует отметить, что симптоматика поражения верхних дыхательных путей при микоплазменной инфекции имеет мало специфических черт и практически не отличается от таковой аналогичных заболеваний иной этиологии.
В педиатрической практике чаще наблюдается постепенное начало заболевания. В первые дни появляются жалобы на вялость, сонливость ребенка при нормальных цифрах температуры тела. Отмечаются катаральные явления: боль при глотании, заложенность носа и слизистое отделяемое из носа. Ребенка могут беспокоить болезненные ощущения в мышцах и области поясницы. Однако наиболее ярким клиническим симптомом при микоплазменной инфекции является сухой, приступообразный, интенсивный кашель. Нередко больные жалуются на боль за грудиной во время кашля и рвоту в конце приступа. Такое проявление респираторного микоплазмоза по типу острой респираторной инфекции может продолжаться 2–4 нед., а иногда и дольше [16, 18, 31].
Отмечаются катаральные явления: боль при глотании, заложенность носа и слизистое отделяемое из носа. Ребенка могут беспокоить болезненные ощущения в мышцах и области поясницы. Однако наиболее ярким клиническим симптомом при микоплазменной инфекции является сухой, приступообразный, интенсивный кашель. Нередко больные жалуются на боль за грудиной во время кашля и рвоту в конце приступа. Такое проявление респираторного микоплазмоза по типу острой респираторной инфекции может продолжаться 2–4 нед., а иногда и дольше [16, 18, 31].
При манифестной форме микоплазменной инфекции респираторного тракта инфекция начинается остро, с подъема температуры тела до фебрильных цифр. В ряде случаев отмечаются головная боль и другие симптомы интоксикации. Возникают першение и боли в горле, чувство заложенности носа. Реже отмечаются насморк, боль в ушах и проявления конъюнктивита (чаще – «сухого»). Лихорадка, как правило, купируется в течение 3–5 дней, но субфебрилитет может сохраняться еще на протяжении 1–2 нед. Катаральные симптомы заболевания в подавляющем большинстве случаев регрессируют в течение 7–10 дней, однако выделение возбудителя с носоглоточным секретом может отмечаться еще длительное время – до нескольких недель [16]. Согласно некоторым исследованиям, M. pneumoniae часто обнаруживается у детей школьного возраста с постоянным кашлем, особенно во время активных эпидемий [15], или одновременно с Bordetella pertussis [32]. В некоторых исследованиях сообщается об обнаружении M. pneumoniae у здоровых людей [33]. В исследовании Н.М. Foy культуры M. pneumoniae были выявлены у пациентов даже через 4 мес. после болезни [34]. Эти пациенты могут выступать в качестве резервуара возбудителя инфекции.
Катаральные симптомы заболевания в подавляющем большинстве случаев регрессируют в течение 7–10 дней, однако выделение возбудителя с носоглоточным секретом может отмечаться еще длительное время – до нескольких недель [16]. Согласно некоторым исследованиям, M. pneumoniae часто обнаруживается у детей школьного возраста с постоянным кашлем, особенно во время активных эпидемий [15], или одновременно с Bordetella pertussis [32]. В некоторых исследованиях сообщается об обнаружении M. pneumoniae у здоровых людей [33]. В исследовании Н.М. Foy культуры M. pneumoniae были выявлены у пациентов даже через 4 мес. после болезни [34]. Эти пациенты могут выступать в качестве резервуара возбудителя инфекции.
Поражение нижних отделов респираторного тракта может протекать по типу бронхита или пневмонии. При этом наиболее частой клинической формой заболевания является бронхит. Однако при эпидемическом подъеме заболеваемости частота развития микоплазменных пневмоний значительно возрастает. Как уже отмечалось, в этот период до 40–60% всех пневмоний у детей школьного возраста имеют микоплазменную этиологию.
Для клинической картины микоплазменной пневмонии характерен «инфлюенцеподобный» синдром [35] с выраженной и длительной лихорадкой, ознобом, сильной болью в горле и кашлем. Может развиться бронхообструктивный синдром. При этом симптомы интоксикации обычно не выражены, что является одним из немногих специфических признаков микоплазменной пневмонии. Кашель навязчивый, непродуктивный, без лечения может продолжаться несколько недель, иногда – месяцев. Возможны рецидивы кашля после выздоровления. В 20–30% случаев воспалительный процесс охватывает сразу оба легких. Пневмония чаще нетяжелая, хотя описаны случаи развития плеврита. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы.
Примерно у 10% детей с микоплазменной пневмонией отмечают преходящую макулопапулезную сыпь. В подавляющем большинстве случаев заболевание протекает нетяжело, характеризуется гладким течением и отсутствием дыхательной недостаточности или слабой ее выраженностью. В то же время у детей с иммунодефицитами, серповидно-клеточной анемией, тяжелыми сердечно-легочными заболеваниями, а также у пациентов с синдромом Дауна имеется риск развития осложненных форм микоплазменной пневмонии [16].
Диагностика
Рентгенологически в легких выявляются очаги негомогенной инфильтрации, более плотные у корня, с неровными краями, часто тяжистые, «мохнатые». Эти изменения двусторонние, несимметричные и чаще наблюдаются в нижних отделах легких. У ряда пациентов изменения сегментарные. Плевральная реакция и плевриты с необильным экссудатом наблюдаются у 1/4–1/3 больных, реакция часто ограничивается междолевой плеврой [18]. В случаях тяжелой пневмонии могут наблюдаться типичные инфильтративные изменения в легочной ткани. Однако это встречается редко и, по данным литературы, обусловлено коинфекцией Streptococcus pneumoniae или Chlamydophila pneumoniae [18, 36]. Гематологические сдвиги при микоплазменной инфекции могут помочь в диагностике микоплазменной этиологии пневмонии – число лейкоцитов обычно нормальное, может быть умеренный лейкоцитоз. Однако общее количество лейкоцитов не превышает 15 000/мкл [18, 37].
Микоплазменная инфекция может быть ассоциирована, помимо респираторных, с другими проявлениями. Описаны случаи мультиформной эритемы или синдрома Стивенса – Джонса, поражения ЦНС (психозы, менингиты, менингеальные синдромы, менингоэнцефалиты, трансверзальные миелиты, синдром Гийена – Барре), поражения кожи и слизистых оболочек, крови (гемолитическая анемия, коагулопатия, тромбоэмболический феномен), поражения сердца (миокардиты, фокальные некрозы миокарда, перикардиты), функциональные нарушения органов пищеварения, поражения печени (гепатиты, фокальные некрозы), почек (нефрит), полиартрит [16, 37].
Таким образом, клиническая картина микоплазменной инфекции верхних и нижних дыхательных путей не имеет строго специфических признаков, на основании которых можно с высокой степенью достоверности диагностировать ее у постели больного. Однако наличие выраженной сухости слизистых в начале заболевания, приступообразный навязчивый кашель до рвоты, отсутствие явлений интоксикации и выраженных гематологических изменений могут свидетельствовать в пользу микоплазменной инфекции. Данные рентгенологического обследования при ВП могут также помочь в диагностике атипичных пневмоний.
С учетом отсутствия четких клинических, рентгенологических и гематологических критериев диагностики микоплазменной инфекции верификация диагноза может быть проведена только на основании лабораторных тестов. К методам выявления и идентификации M. pneumoniae относят культуральное исследование, иммунологические методы (выявление антигенов и специфических антител) и методы амплификации нуклеиновых кислот (МАНК) [17, 37].
Классические микробиологические методы малопригодны для выявления M. pneumoniae в силу их низкой чувствительности (световая микроскопия), что связано с очень малыми размерами возбудителя, или значительной продолжительности исследования – от 1 до 3–6 нед. (посев и культивирование на специально обогащенных средах), что не подходит для использования при диагностике острых форм заболевания.
Наиболее распространенным методом идентификации M. pneumoniae является серологический метод. Среди серологических (иммунологических) методов диагностики наиболее часто на современном этапе используется иммуноферментный анализ (ИФА). Для диагностики во время острой инфекции определяют IgM или IgA. IgM-антитела появляются в 1-ю нед. болезни и достигают своих самых высоких титров в течение 3-й нед. IgA-антитела также продуцируются на ранних стадиях заболевания. Поэтому выявление IgM-антител к M. рneumoniae в ИФА свидетельствует о текущей или недавно перенесенной инфекции. Наличие специфического инфекционного процесса подтверждается также 4-кратным и более нарастанием концентрации IgG-антител к M. pneumoniae при исследовании парных сывороток пациента, собранных с интервалом не менее 2–3 нед. При отсутствии парных сывороток, которые трудно получить у детей раннего возраста, признаком острой микоплазменной инфекции является диагностический титр специфических IgM-антител в значениях, указанных фирмой-производителем [16, 17, 38].
Однако необходимо учитывать, что, несмотря на универсальность, серологические методы не обладают высокой чувствительностью. При интерпретации результатов серологических методов исследования следует знать, что достаточно высокий уровень антител класса IgG к M. pneumoniae может сохраняться длительное время после перенесенной инфекции, нарастание титра IgG может быть отсроченным во времени, а IgM у взрослых могут вообще не выявляться. В ряде случаев положительные результаты ИФА на M. pneumoniae могут быть связаны с перекрестным реагированием на микоплазмы других видов (фальш-позитивный результат). Нельзя исключить и фальш-негативные результаты ИФА. Кроме того, антитела к M. pneumoniae могут появляться только через 2 нед. после появления симптомов. Врачи должны также учитывать статус иммунной системы пациента. В частности, у части иммунокомпрометированных пациентов реакция на IgM может быть неспецифической или отсутствовать [17, 38].
Именно поэтому наибольшее значение в диагностике M. pneumoniae имеют МАНК, к которым относятся классическая полимеразная цепная реакция (ПЦР), «гнездная» ПЦР, ПЦР в реальном времени, мультиплексная ПЦР. «Гнездная» ПЦР характеризуется более высокой, по сравнению с классической ПЦР, чувствительностью; ПЦР в реальном времени позволяет выявлять уровень микробной нагрузки [37, 39]; мультиплексная ПЦР обеспечивает синхронное определение в исследуемом образце нескольких микроорганизмов. Необходимо отметить, что более высокая диагностическая ценность при выявлении M. pneumoniae у больных с ВП отмечается при исследовании мокроты по сравнению с орофарингеальными, назофарингеальными мазками или назофарингеальным аспиратом, что объясняется большей концентрацией возбудителя в нижних дыхательных путях. Поэтому у пациентов с ВП для культурального исследования и ПЦР следует использовать мокроту, и только при невозможности ее получения – образцы из верхних дыхательных путей [17, 37].
Таким образом, при лабораторной диагностике респираторного микоплазмоза необходимо использование комбинации методов, направленных на выявление в исследуемых материалах антигенов возбудителя методом ИФА или его генома при помощи ПЦР, с методами, характеризующими иммунный ответ пациента на M. pneumoniae, – определение специфических антител классов IgМ, IgА и IgG при проведении ИФА.
Лечение
Лечение респираторного микоплазмоза базируется на антимикробной терапии. Выбор антибактериального препарата обусловлен биологическими свойствами возбудителя. С учетом структурных особенностей строения M. pneumoniae – отсутствия у него клеточной стенки в терапии микоплазмоза рекомендуется использовать антимикробные препараты, блокирующие репликацию возбудителя на этапе синтеза ДНК, например хинолоны, или синтеза белка, такие как макролиды и тетрациклины. В педиатрической практике выбор лекарственного препарата определяется его профилем безопасности, поэтому в арсенале педиатра для лечения микоплазменной инфекции у детей до 8 лет основной группой антибактериальных препаратов являются макролиды [31, 38–41].
Макролиды – группа бактериостатических антибиотиков, химическая структура которых представлена макроциклическим лактонным кольцом [41]. В зависимости от числа атомов углерода в лактонном кольце различают 3 основных подкласса макролидов:14-, 15- и 16-членные макролидные антибиотики, а в зависимости от происхождения выделяют природные и полусинтетические препараты. Установлено, что микробиологическая эффективность макролидов по отношению к M. pneumoniae практически одинакова.
Одним из представителей группы макролидов, применяемых для лечения респираторных инфекций в педиатрической практике, является азитромицин (Сумамед®).
Азитромицин – полусинтетический антибиотик, представитель группы «новых» макролидов, который был синтезирован в 1983 г. путем включения атома азота в 14-членное лактонное кольцо эритромицина. 15-членный азитромицин выделен в отдельную группу азалидов и по структуре молекулы существенно отличается от других макролидов. Азитромицин, как и другие макролиды, обладает высокой активностью в отношении многих грамположительных бактерий: стафилококков (метициллин-чувствительных), стрептококков (включая Streptococcus pneumoniae), Listeria monocytogenes, Corynebacterium diphtheriae. Однако азитромицин отличается от других макролидов существенно большей активностью в отношении грамотрицательных бактерий. Он превосходит другие препараты группы по эффективности против Haemophilus spp., Moraxella catarrhalis, Neisseria spp., Bartonella spp. и Campylobacter jejun, что достаточно важно при лечении ВП у детей. Азитромицин в отличие от других макролидов в больших концентрациях способен подавлять рост многих бактерий семейства Enterobacteriaceae (Escherichia coli, Salmonella spp., Shigella spp. и др.). Препарат также проявляет активность в отношении Bordetella pertussis, Helicobacter pylori. Доказана его высокая эффективность в отношении внутриклеточных возбудителей: Mycoplasma spp., Chlamydia spp., Legionella pneumophila [40–42].
Для азитромицина характерен постантибиотический эффект, т. е. сохранение антимикробного действия препарата после его удаления из среды [39, 40, 43, 44]. Под действием азитромицина в концентрации даже ниже минимальной подавляющей (МПК) микроорганизмы, в т. ч. и резистентные к антибиотику, становятся более чувствительными к факторам иммунной защиты – отмечается так называемый суб-МПК-постантибиотический эффект.
Азитромицин, как и другие макролиды, обладает противовоспалительным и иммуномодулирующим действием. Существуют данные о том, что макролиды регулируют работу иммунной системы. Они влияют на окислительные реакции в фагоцитах и способствуют их дегрануляции, повышают продукцию противовоспалительного цитокина (IL-10) моноцитами, уменьшают выработку провоспалительных цитокинов моноцитами (IL-1, TNFA) и лимфоцитами (IL-2), снижают образование медиаторов воспаления: простагландинов, лейкотриенов и тромбоксанов [40]. Макролиды повышают активность Т-киллеров и усиливают фагоцитарную активность и миграцию макрофагов в очаг воспаления. Наличие противовоспалительного эффекта у азитромицина успешно используется у пациентов с муковисцидозом, не отвечающих на стандартную терапию [45].
Азитромицин в большом количестве накапливается внутриклеточно, благодаря чему его концентрация во многих тканях организма в 10–200 раз превышает концентрацию в крови. Наиболее высокие концентрации препарата создаются в миндалинах, аденоидах, бронхиальном секрете, слизистой бронхов, жидкости, выстилающей эпителий альвеол, экссудате среднего уха. Именно там они намного превышают МПК для большинства бактериальных возбудителей, вызывающих инфекции данной локализации. Накапливаясь в большом количестве в фагоцитах, азитромицин с помощью этих клеток транспортируется в очаг воспаления, где происходит постепенное высвобождение препарата. При вымывании из очага воспаления азитромицин вновь доставляется фагоцитами в очаг воспаления. В то же время азитромицин имеет очень большой период полувыведения – от 2 до 4 сут (в среднем 68 ч). Все это способствует тому, что эффективная концентрация препарата в тканях сохраняется в течение 5–7 дней [31, 42].
Азитромицин имеет высокий профиль безопасности. По данным большинства исследований, частота нежелательных явлений на фоне приема азитромицина составляет около 9%. При этом в большинстве случаев отмечаются умеренные реакции со стороны ЖКТ (боли в животе, тошнота, рвота, диарея и др.), которые, как правило, не требуют отмены препарата. Редко или очень редко наблюдаются изменения со стороны нервной системы (головная боль, головокружение, сонливость и др.), изменения лабораторных показателей (уровень печеночных ферментов и др.), аллергические реакции (кожная сыпь, отек Квинке и др.), развитие вагинального кандидоза и интерстициального нефрита [31, 39, 41, 46].
Необходимо отметить, что азитромицин не оказывает ингибирующего влияния на цитохром Р-450, участвующий в биотрансформации многих лекарственных средств [42]. Соответственно, использование азитромицина не приводит к возникновению лекарственных взаимодействий препаратов, ассоциированных с этим ферментом. Азитромицин метаболизируется в небольшой степени, в связи с чем не влияет на метаболизм других лекарственных средств. 50% препарата выделяются с желчью в неизмененном виде, около 6% – с мочой.
В России оригинальный препарат азитромицина – Сумамед® зарегистрирован в виде капсул в дозе 250 мг, таблеток, покрытых оболочкой, в дозе 125 и 500 мг, порошка для приготовления суспензии для приема внутрь в дозе 100 мг / 5 мл и 200 мг / 5 мл (Сумамед® форте), лиофилизата для приготовления раствора для инфузии в дозе 500 мг. Пероральные формы препарата не имеют возрастных ограничений, но рекомендуются для применения детьми старше 6 мес. в виде суспензии для приема внутрь и таблеток в дозе 125 мг. Необходимо отметить, что препарат в форме порошка для приготовления суспензии поставляется в комплекте с дозировочной 2-сторонней ложкой (на 2,5 и 5 мл) и дозировочным шприцем (на 5 мл), что обеспечивает удобство приема препарата.
Фармакокинетические свойства препарата дают основания применять его при большинстве инфекций дыхательных путей и ЛОР-органов у детей 1 р./сут в виде коротких курсов (до 5 дней) в суммарной дозе от 30 до 60 мг/кг.
Длительность антибактериальной терапии определяется тяжестью и течением инфекции, а также наличием фоновых заболеваний. При ВП, вызванной типичными бактериями, длительность антибактериальной терапии обычно составляет 7–10 дней, атипичными бактериями — 10–14 дней. Согласно современным рекомендациям, антибактериальная терапия может быть завершена через 3–4 дня после стойкой нормализации температуры тела. В последние годы наблюдается тенденция к сокращению сроков использования антибактериальной терапии, даже при тяжелом варианте течения ВП. Однако в в клинических рекомендациях «Внебольничная пневмония у детей» (2015 г.) указано, что эксперты считают, что продолжительность антибактериальной терапии при ВП должна составлять не менее 5 дней [46]. В то же время использование азитромицина позволяет сократить длительность курса терапии микоплазменной инфекции до 5–7 сут с учетом фармакокинетических особенностей препарата.
Таким образом, азитромицин, первый представитель 15-членных макролидных антибиотиков (азалидов), может рассматриваться как один из препаратов выбора для терапии внебольничных инфекций дыхательных путей у детей в том случае, если есть основания считать, что заболевание вызвано внутриклеточными возбудителями. По сравнению с другими макролидами азитромицин более активен в отношении грамотрицательной флоры (особенно H. influenzae). Он не разрушается в кислой среде желудка, создает более высокие и стабильные концентрации в тканях, имеет длительный период полувыведения (что делает возможным однократный прием препарата в день), используется коротким курсом (3 или 5 дней), редко вызывает нежелательные реакции и лекарственные взаимодействия.
В 2014 г. ВОЗ был опубликован «Глобальный отчет по надзору за резистентностью к антимикробным препаратам», согласно которому проблема устойчивости возбудителей к антибактериальным препаратам создает все большую угрозу для профилактики и лечения инфекционных заболеваний. Основной причиной резистентности микроорганизмов к антибактериальным препаратам становится их избыточное потребление, связанное как с необоснованным назначением препаратов, так и с отсутствием своевременной этиологической диагностики инфекции. В то время как внебольничные инфекции у детей после 5 лет до 40% случаев могут быть обусловлены M. pneumoniae, отсутствие этиологической диагностики ведет к необоснованному назначению данной группе пациентов, в соответствии с клиническими рекомендациями, бета-лактамных антибиотиков. Пациенты нередко получают несколько неэффективных курсов антимикробных препаратов, что способствует формированию к ним устойчивости бактерий.
Однако недостаточное использование антимикробных препаратов также ведет к росту антибиотикорезистентности. Обусловлено это может быть неправильным выбором лечения, неверной дозировкой, незавершенным курсом терапии. Одной из причин сложившейся тенденции в отношении макролидов является широкое использование некачественных дженериков. Несколько исследований, проведенных в РФ, продемонстрировали наличие более низких концентраций активных субстанций в ряде псевдодженериков и их низкую биодоступность, что потенциально может приводить к росту резистентности [48].
С 2001 г. появились данные об устойчивости к макролидам M. pneumoniae, выделяемой при инфекциях дыхательных путей у детей и взрослых в странах Азии (Япония, Китай). Так, макролидоустойчивая M. pneumoniae впервые была зарегистрирована в Японии [49] в 2001 г., и с тех пор постоянно сообщается об увеличении процента ее выявления среди таких пациентов [50–52]. Однако распространенность макролидорезистентной пневмонии различается в разных странах. В Китае зарегистрировано 69% пациентов с респираторным микоплазмозом, не чувствительным к терапии макролидами, в то время как в Нидерландах с 1997 по 2008 г. не было обнаружено случаев резистентности к макролидам M. pneumoniae [53]. Данных о распространенности подобных штаммов в Российской Федерации нет.
Резистентность M. pneumoniae к макролидам обусловлена точечными мутациями в генах р-РНК 23S субъединицы рибосомы у макролидорезистентных штаммов M. pneumoniae, поэтому в терапевтической практике необходимо учитывать, что резистентность микроорганизма отмечается ко всем макролидам, линкозамидам и кетолидам [14, 54, 55].
Однако, согласно данным литературы, резистентность M. pneumoniae к антибиотикам не составляет проблемы – подавляющее большинство штаммов чувствительно к макролидам [37]. В настоящее время не описано клинических изолятов, имеющих резистентность к тетрациклинам и фторхинолонам, однако селектировать такие штаммы in vitro удавалось. Несмотря на распространенность макролидоустойчивых форм M. pneumoniae в мире, вопрос об изменении рекомендаций по терапии респираторного микоплазмоза в России, США и странах Европы не стоит [56].
В связи с распространенностью респираторных заболеваний, вызванных M. pneumoniae, участием данного патогена в развитии хронических бронхолегочных заболеваний все острее возникает вопрос о мерах специфической профилактики. С учетом того, что M. pneumoniae является вторым по частоте возбудителем ВП у детей старше 5 лет, в мире стоит цель создания действенной вакцины для борьбы с данным возбудителем. В 1960–1970-х гг. был проведен ряд исследований, посвященных иммуногенности и защитной эффективности нескольких вакцин. Метаанализ Linchevski et al. [57] показал, что общая эффективность профилактики пневмонии в этих исследованиях составила 41% (54% – для пневмонии, вызванной M. pneumoniae). Исследования по созданию действенной вакцины продолжаются и в настоящее время [58]. Создание вакцины для лиц с высоким риском заболеваемости, таких как школьники, призывники и пожилые люди, поможет снизить заболеваемость от пневмонии и вторичных осложнений. Своевременная вакцинация может также снизить развитие резистентных к макролидам штаммов M. pneumoniae.
Заключение
Таким образом, M. pneumoniae – достаточно распространенный возбудитель ОРЗ у детей. Он является вторым по значимости этиологическим фактором в развитии ВП у детей после 5 лет. Особенности данного возбудителя определяют возможность длительной персистенции микроорганизма и ускользание его из-под контроля иммунной системы хозяина, а также отсутствие стойкого постинфекционного иммунитета, что нередко способствует персистенции возбудителя и вызывает затяжное течение заболевания. Несмотря на то, что эффективность лечения ОРЗ и особенно микоплазменной инфекции тесно связана с точностью этиологической диагностики, эта задача пока не решена. Отсутствуют специфические клинические и рентгенологические признаки заболевания, которые позволили бы практическому врачу с высокой степенью достоверности уточнить этиологическую диагностику ОРЗ. Вместе с этим лабораторные исследования с целью определения возбудителя в амбулаторных условиях в России часто недоступны и сложны. В этой связи наиболее перспективным является создание препаратов для специфической профилактики такой непростой инфекции, как респираторный микоплазмоз.
Литература
1. Новости [Электронный ресурс]. Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, ФБГУ «Центр гигиены и эпидемиологии в городе Москве». URL http://www.mossanexpert.ru/novosti/?ELEMENT_ID=1877 (дата обращения: 08.03.2017) [Novosti. Federal’naja sluzhba po nadzoru v sfere zashhity prav potrebitelej i blagopoluchija cheloveka Federal’noe bjudzhetnoe uchrezhdenie zdravoohranenija «Centr gigieny i jepidemiologii v gorode Moskve» URL http://www.mossanexpert.ru/novosti/?ELEMENT_ID=1877 08.03.2017 (in Russian)].
2. Инфекционная заболеваемость в Российской Федерации за январь – декабрь 2016 г. (по данным формы №1 «Сведения об инфекционных и паразитарных заболеваниях») [Электронный ресурс]. URL http://www.rospotrebnadzor.ru/activities/statisticalmaterials/statictic [Infekcionnaja zabolevaemost’ v Rossijskoj Federacii za janvar’ – dekabr’ 2016 g. (po dannym formy №1 «Svedenija ob infekcionnyh i parazitarnyh zabolevanijah») URL: http://www.rospotrebnadzor.ru/activities/statisticalmaterials/statictic (in Russian)].
3. Информационный обзор о пневмонии [Электронный ресурс]. Всемирная организация здравоохранения. Ноябрь 2016 г. URL http://www.who.int/topics/pneumococcal_infections/ru [Informacionnyj obzor o pnevmonii. Vsemirnaja organizacija zdravoohranenija. Nojabr’ 2016 g. URL: http://www.who.int/topics/pneumococcal_infections/ru (in Russian)].
4. Waites K.B., Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen // Clin Microbiol Rev. 2004. Vol. 17(4). Р. 697–728.
5. Jain S., Williams D.J., Arnold S.R. Community-acquired pneumonia requiring hospitalization among US children // N Engl J Med. 2015. Vol. 372(9). Р. 835–845.
6. Борисов Л.Б. Медицинская микробиология,вирусология, иммунология: Учебник. М.: Медицинское информационное агентство, 2001. С. 469–471 [Borisov L.B. Medicinskaja mikrobiologija,virusologija, immunologija: Uchebnik. M.: Medicinskoe informacionnoe agentstvo, 2001. S. 469–471 (in Russian)].
7. Широбоков В.П. Медицинская микробиология, вирусология и иммунология. Винница: Нова книга, 2015. 898 с. [Shirobokov V. P. Medicinskaja mikrobiologija, virusologija i immunologija. Vinnica: Nova kniga, 2015. 898 s. (in Russian)].
8. Aujard Y., Maury L., Doit C. et al. Ureaplasma urealyticum and Mycoplasma hominis infections in newborns: personal data and review of the literature // Arch Pediatr. 2005. Vol. 12(1). Р. 12–18.
9. Taylor-Robinson D. Infections due to species of Mycoplasma and Ureaplasma: an update // Clin Infect Dis. 1996. Vol. 23. Р. 671–682.
10. Kenri T., Okazaki N., Yamazaki T. et al. Genotyping analysis of Mycoplasma pneumoniae clinical strains in Japan between 1995 and 2005: type shift phenomenon of M. pneumoniae clinical strains // J Med Microbiol. 2008. Vol. 57(4). Р. 469–475.
11. Saraya T., Nakata K., Nakagaki K. et al. Identification of a mechanism for lung inflammation caused by Mycoplasma pneumoniae using a novel mouse model // Results Immunol. 2011. Vol. 1. Р. 76–87.
12. Dallo S., Baseman J. Intracellular DNA replication and long-term survival of pathogenic mycoplasmas // Microb. Pathog. 2000. Vol. 29. Р. 301–309.
13. Waites К.B., Talkington D.F. Mycoplasma pneumoniae and Its Role as a Human Pathogen // Clin. Microbiol. Rev. 2004. Vol. 17(4). Р. 697-728; doi:10.1128/CMR.17.4.697-728.2004.
14. Wang K., Chalker V., Bermingham A. et al. Mycoplasma pneumoniae and respiratory virus infections in children with persistent cough in England: a retrospective analysis // Pediatr Infect Dis J. 2011. Vol. 30(12). Р. 1047–1051.
15. Коровина Н.А., Заплатников А.Л. Респираторный микоплазмоз у детей // РМЖ. 2004. № 13. С. 778–779 [Korovina N.A., Zaplatnikov A.L. Respiratornyj mikoplazmoz u detej // RMZh. 2004. № 13. S. 778–779 (in Russian)].
16. Рачина С.А., Бобылев А.А., Козлов Р.С. Особенности внебольничной пневмонии, вызванной Mycoplasma pneumoniae: обзор литературы и результаты собственных исследований // Клин. Микробиол. Антимикроб. Химиотер. 2013. Т. 15. № 1. С. 4–13 [Rachina S.A., Bobylev A.A., Kozlov R.S. Osobennosti vnebol’nichnoj pnevmonii, vyzvannoj Mycoplasma pneumoniae: obzor literatury i rezul’taty sobstvennyh issledovanij// Klin mikrobiol antimikrob himioter. 2013. T.15. № 1. S. 4–13 (in Russian)].
17. Рачинский С.В., Таточенко В.К. Болезни органов дыхания у детей: руководство для врачей. М.: Медицина,1988. С. 238–240 [Rachinskij S.V., Tatochenko V.K. Bolezni organov dyhanija u detej: rukovodstvo dlja vrachej. M.: Medicina, 1988. S. 238–240 (in Russian)].
18. Kannan T.R., Baseman J.B. ADP-ribosylating and vacuolating cytotoxin of Mycoplasma pneumoniae represents unique virulence determinant among bacterial pathogens // Proc Natl Acad Sci USA. 2006. Vol. 103. Р. 6724–6729.
19. Kannan T.R., Coalson J.J., Cagle M. et al. Synthesis and distribution of CARDS toxin during Mycoplasma pneumoniae infection in a murine model // J Infect Dis. 2011. Vol. 204. Р.1596–1604.
20. Tablan O., Reyes M.P. Chronic intestinal pulmonary fibrosis following Mycoplasma pneumonia // Amer. J. Med. 1985. Vol. 79. Р. 268–270.
21. Izumikawa K., Izumikawa K., Takazono T. et al. Clinical features, risk factors and treatment of fulminant Mycoplasma pneumoniae pneumonia: a review of the Japanese literature // J. Infect.Chemother. 2014. Vol. 20. Р. 181–185.
22. Techasaensiri C., Tagliabue C., Cagle M. et al. Variation in colonization, ADP-ribosylating and vacuolating cytotoxin, and pulmonary disease severity among Mycoplasma pneumoniae strains // Am. J. Respir. Crit. Care Med. 2010. Vol. 182. Р. 797–804.
23. Medina J.L., Coalson J.J., Brooks E.G. et al. Mycoplasma pneumoniae CARDS toxin induces pulmonary eosinophilic and lymphocytic inflammation // Am J Respir Cell Mol Biol. 2012. Vol. 46(6). Р. 815–822.
24. Chu H.W., Jeyaseelan S., Rino J.G. et al. TLR2 signaling is critical for Mycoplasma pneumoniae-induced airway mucin expression // J Immunol. 2005. Vol. 174(9). Р. 5713–5719.
25. Shimizu T., Kimura Y., Kida Y. et al. Cytadherence of Mycoplasma pneumoniae induces inflammatory responses through autophagy and toll-like receptor 4 // Infect Immun. 2014. Vol. 82(7). Р. 3076–3086.
26. Hong S. J. The Role of Mycoplasma pneumoniae Infection in Asthma // Allergy Asthma Immunol. Res. 2012. Vol. 4. Р. 59–61; doi: 10.4168/aair.2012.
27. Smith-Norowitz T.A., Silverberg J.I., Kusonruksa M. et al. Asthmatic children have increased specific anti-Mycoplasma pneumoniae IgM but not IgG or IgE-values independent of history of respiratory tract infection. Pediatr // Infect. Dis. J. 2013. Vol. 32. Р. 599–603.
28. Biscardi S., Lorrot M., Marc E. et al. Mycoplasma pneumoniae and asthma in children // Clin. Infect. Dis. 2004. Vol. 38. Р. 1341–1346.
29. Jeong Y.C., Yeo M.S., Kim J.H. et al. Mycoplasma pneumoniae infection affects the serum levels of vascular endothelial growth factor and interleukin-5 in atopic children // Allergy Asthma Immunol. Res. 2012. Vol. 4. Р. 92–97.
30. Геппе Н.А., Дронов И.А. Антибактериальная терапия при остром бронхите у детей: показания, выбор препарата и режима применения // Вопросы практической педиатрии. 2015. № 5. С. 61–64 [Geppe N.A., Dronov I.A. Antibakterial’naja terapija pri ostrom bronhite u detej: pokazanija, vybor preparata i rezhima primenenija // Voprosy prakticheskoj pediatrii. 2015. № 5. S. 61–64 (in Russian)].
31. Hallander H.O., Gnarpe J., Gnarpe H., Olin P. Bordetella pertussis, Bordetella parapertussis, Mycoplasma pneumoniae, Chlamydia pneumoniae and persistent cough in children // Scand. J. Infect. Dis. 1999. Vol. 31. Р. 281–286.
32. Gnarpe J., Lundback A., Sundelof B., Gnarpe H. Prevalence of Mycoplasma pneumoniae in subjectively healthy individuals // Scand. J. Infect. Dis. 1992. Vol. 24. Р. 161–164.
33. Foy H.M., Grayston J.T., Kenny G.E. et al. Epidemiology of Mycoplasma pneumoniae infection in families // JAMA. 1996. Vol. 197. Р. 859–866.
34. Инфекции респираторного тракта у детей раннего возраста / под ред. Г.А. Самсыгиной. М.: Миклош, 2008. С. 215–217 [Infekcii respiratornogo trakta u detej rannego vozrasta / pod red. G.A. Samsyginoj. M.: Miklosh, 2008. S. 215–217 (in Russian)].
35. Nambu A., Saito A., Araki T. et al. Chlamydia pneumoniae: comparison with findings of Mycoplasma pneumoniae and Streptococcus pneumoniae at thin-section CT // Radiology. 2006. Vol. 238. Р. 330–338.
36. Parrott G.L., KinjoT, Fujita J. A Compendium for Mycoplasma pneumoniaе // Front Microbiol. 2016. Vol. 7. Р. 513; doi: 10.3389/fmicb.2016.00513.
37. Стратегия и тактика рационального применения антимикробных средств в амбулаторной практике: Российские практические рекомендации / под ред. С.В. Яковлева, С.В. Сидоренко, В.В. Рафальского, Т.В. Спичак. М.: Престо, 2014. 121 с. [Strategija i taktika racional’nogo primenenija antimikrobnyh sredstv v ambulatornoj praktike: Rossijskie prakticheskie rekomendacii / pod red. S.V. Jakovleva, S.V. Sidorenko, V.V. Rafal’skogo, T.V. Spichak. M.: Presto, 2014. 121 s. (in Russian)].
38. Грацианская А.Н. Антибиотики в педиатрической практике: азитромицин // Трудный пациент. 2014. Т. 12. № 1-2. С. 25–28 [Gracianskaja A.N. Antibiotiki v pediatricheskoj praktike: azitromicin // Trudnyj pacient. 2014. Т. 12. № 1-2. S. 25–28 (in Russian)].
39. Лукьянов С.В. Фармакология и клиническое применение азитромицина у детей // Consilium Medicum. 2005. Т. 7. № 1. С. 18–25 [Luk’janov S.V. Farmakologija i klinicheskoe primenenie azitromicina u detej // Consilium Medicum. 2005. Т. 7. № 1. S. 18–25 (in Russian)].
40. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. Смоленск: Русич, 1998. 304 с. [Strachunskij L.S., Kozlov S.N. Makrolidy v sovremennoj klinicheskoj praktike. Smolensk: Rusich, 1998. 304 s. (in Russian)].
41. Инструкция по медицинскому применению препарата Сумамед. URL http://www.grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=9279f992-1164-418c-a521-386b554c3e1b»and»t= [Instrukcija po medicinskomu primeneniju preparata Sumamed. URL http://www.grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=9279f992-1164-418c-a521-386b554c3e1b»and»t= (in Russian)].
42. Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. М.: Ремедиум, 2001 [Belousov Ju.B., Shatunov S.M. Antibakterial’naja himioterapija. M.: Remedium, 2001 (in Russian)].
43. Практическое руководство по антиинфекционной химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск: МАКМАХ, 2007. 464 с. [Prakticheskoe rukovodstvo po antiinfekcionnoj himioterapii / pod red. L.S. Strachunskogo, Ju.B. Belousova, S.N. Kozlova. Smolensk: MAKMAH, 2007. 464 s. (in Russian)].
44. Лубская Т.В., Капранов Н.И., Каширская Н.Ю. и др. Клинический эффект длительного применения малых доз макролидов в комплексном лечении муковисцидоза у детей // Пульмонология. 2001. № 3. С. 41–45 [Lubskaja T.V., Kapranov N.I., Kashirskaja N.Ju. i dr. Klinicheskij jeffekt dlitel’nogo primenenija malyh doz makrolidov v kompleksnom lechenii mukoviscidoza u detej // Pul’monologija. 2001. № 3. S. 41–45 (in Russian)].
45. Веселов А.В., Козлов Р.С. Азитромицин: современные аспекты клинического применения // Клиническая микробиология и антимикробная химиотерапия. 2006. Т. 8. № 1. С. 18–32 [Veselov A.V., Kozlov R.S. Azitromicin: sovremennye aspekty klinicheskogo primenenija // Klinicheskaja mikrobiologija i antimikrobnaja himioterapija. 2006. T. 8. № 1. S. 18–32 (in Russian)].
46. Внебольничная пневмония у детей. Клинические рекомендации. М., 2015. 64 с. URL http://mosgorzdrav.ru/uploads/imperavi/ru-RU/028.pdf [Vnebol’nichnaja pnevmonija u detej. Klinicheskie rekomendacii. M., 2015. 64 s. URL http://mosgorzdrav.ru/uploads/imperavi/ru-RU/028.pdf (in Russian)].
47. Красильникова А.В. Сравнительная эффективность генериков азитромицина при внебольничной пневмонии у взрослых (клинические и фармакоэкономические аспекты): Дисс. … к.м.н. Волгоград , 2004. 137 с. [Krasil’nikova A.V. Sravnitel’naja jeffektivnost’ generikov azitromicina pri vnebol’nichnoj pnevmonii u vzroslyh (klinicheskie i farmakojekonomicheskie aspekty): Diss. … k.m.n. Volgograd , 2004. 137 s. (in Russian)].
48. Okazaki N., Ohya H., Sasaki T. Mycoplasma pneumoniae isolated from patients with respiratory infection in Kanagawa Prefecture in 1976-2006: emergence of macrolide-resistant strains // Jpn J Infect Dis. 2007. Vol. 60 (5). Р. 325–326.
49. Hanada S., Morozumi M., Takahashi Y. et al. Community-acquired pneumonia caused by macrolide-resistant Mycoplasma pneumoniae in adults // Intern. Med. 2014. Vol. 53. Р. 1675–1678.
50. Kawai Y., Miyashita N., Kubo M. et al. Nationwide surveillance of macrolide-resistant Mycoplasma pneumoniae infection in pediatric patients // Antimicrob. Agents Chemother. 2013. Vol. 57. Р. 4046–4049.
51. Miyashita N., Kawai Y., Akaike H. et al. Macrolide-resistant Mycoplasma pneumoniae in adolescents with community-acquired pneumonia // BMC Infect. Dis. 2012. Vol. 12. Р. 126; doi: 10.1186/1471-2334-12-126.
52. Spuesens E.B., Meijer A., Bierschenk D. et al. Macrolide resistance determination and molecular typing of Mycoplasma pneumoniae in respiratory specimens collected between 1997 and 2008 in the Netherlands // J. Clin. Microbiol. 2012. Vol. 50. Р. 1999–2004.
53. Li X., Atkinson T.P., Hagood J. et al. Emerging macrolide resistance in Mycoplasma pneumoniae in children: detection and characterization of resistant isolates // Pediatr Infect Dis J. 2009. Vol. 28(8). Р. 693–696.
54. Pereyre S., Charron A., Renaudin H. et al. First report of macrolide-resistant strains and description of a novel nucleotide sequence variation in the P1 adhesin gene in Mycoplasma pneumoniae clinical strains isolated in France over 12 years // J Clin Microbiol. 2007. Vol. 45(11). Р. 3534–3539.
55. Cardinale F., Chironna M., Chinellato I. et al. Клиническая значимость резистентности к макролидам Mycoplasma pneumoniae у детей // J Clin Microbiol. 2013. Vol. 51. Р. 723–734.
56. Linchevski I., Klement E., Nir-Paz R. Mycoplasma pneumoniae vaccine protective efficacy and adverse reactions–Systematic review and meta-analysis // Vaccine. 2009. Vol. 27. Р. 2437–2446.
57. Szczepanek S.M., Majumder S., Sheppard E.S. et al. Vaccination of BALB/c mice with an avirulent Mycoplasma pneumoniae P30 mutant results in disease exacerbation upon challenge with a virulent strain // Infect. Immun. 2012. Vol. 80. Р. 1007–1014.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Внебольничная пневмония микоплазменной этиологии | ФГБУЗ ЦМСЧ № 31 ФМБА России
Микоплазменная пневмония – заболевание из группы атипичных пневмоний. В практике пульмонолога частота микоплазменных пневмоний составляет от 5 до 50% случаев внебольничных воспалений легких или около трети пневмоний небактериального происхождения.
Возбудителем является Mycoplasma pneumoniae — микроорганизм, обладающий способностью длительно существовать и паразитировать на стенках и мембранах клеток хозяина.
Защитные механизмы возбудителя обеспечивают устойчивость к некоторым антибиотикам.
Источником микоплазменных пневмоний является человек, больной микоплазмозом или здоровый носитель микробов. Заболевание передается воздушно-капельным путем.
Заболевание регистрируется в видеединичных случаев и эпидемических вспышек. Характерны сезонные колебания заболеваемости с пиком в осенне-зимний период. Микоплазменная пневмония наблюдается преимущественно у детей, подростков и молодых пациентов до 35 лет, намного реже – в среднем и зрелом возрасте.
Легочная инфекция чаще встречается в организованных коллективах с тесными контактами (в дошкольных, школьных и студенческих группах, у военнослужащих и др.), возможны семейные случаи инфекции.
Микоплазма провоцирует развитие бронхита и пневмонии у детей и взрослых. Из-за того, что симптомы болезни похожи на распространенные заболевания, выявить микоплазменную пневмонию лишь по внешним признакам невозможно. Поэтому требуются тщательная диагностика и сдача дополнительных анализов для подтверждения диагноза. В связи с тем, что течение такой пневмонии вялое и постепенное, в первую неделю болезни ее диагностика существенно затруднена. По одним клиническим симптомам такую пневмонию диагностировать крайне сложно. Помочь могут только данные о том, что в окружении имеются больные микоплазменной инфекцией. Но и в этом случае необходимо проведение рентгенографии и компьютерной томографии грудной клетки.
С момента попадания в организм человека M.pneumoniae до появления первых признаков заболевания проходит от 4 до 25 суток (инкубационный период).
Клинически респираторный микоплазмоз может протекать в виде назофарингита, трахеита, бронхита, атипичной пневмонии.
Для микоплазменной пневмонии характерно вялое течение со стертой клинической картиной. Течение микоплазменной пневмонии, как правило, легкое или среднетяжелое. После инкубационного периода наступает непродолжительный период (1-2 суток), в течение которого беспокоит сухость слизистых верхних дыхательных путей, першение в горле, сухой кашель, головная боль и незначительное недомогание, что часто встречается при различных респираторных инфекциях. Клиника собственно атипичной микоплазменной пневмонии характеризуется субфебрильной температурой, не поднимающейся выше 38°С, приступообразным непродуктивным кашлем, который беспокоит около 2-3 недель.
При микоплазмозе, протекающем в виде острого респираторного заболевания, возникают синуситы, отиты, а при пневмонической форме болезни – плеврит, тромбофлебит и крайне редко – полиневрит, перикардит, миокардит, отек легкого, гемолитическая анемия, тромбогеморрагический синдром.
Прогноз при всех формах микоплазмозов благоприятный. В большинстве случаев болезнь заканчивается полным выздоровлением. После заболевания образуется иммунитет, но он нестойкий.
Вакцины против возбудителя микоплазменной пневмонии на данный момент не существует. Профилактика микоплазменной пневмонии аналогична профилактике других сезонных респираторных заболеваний. Во время вспышек эпидемии рекомендуется избегать людных мест или пользоваться масками. Также следует избегать контактов с больными пневмонией и другими респираторными инфекциями, часто мыть руки, проветривать помещение.
Микоплазменная пневмония у детей — ОГБУЗ «СМОЛЕНСКИЙ КОЖНО-ВЕНЕРОЛОГИЧЕСКИЙ ДИСПАНСЕР»
Чем опасна для ребенка микоплазма: пневмония у детей
Нередко в педиатрической практике встречается вызванная таким возбудителем, как микоплазма, пневмония у детей. Пневмонией называется инфекционное заболевание, при котором воспаляется легочная ткань. Любая пневмония является серьезной патологией. Особенно она опасна для детского организма, который менее устойчив к микробам. В большинстве случаев заболевание протекает в легкой форме, но при отсутствии лечебных мер могут развиться осложнения (менингоэнцефалит, поражение сосудов глаз, плеврит). Каковы причины, симптомы и лечение этой патологии легких?
Характеристика микоплазменной пневмонии
Микоплазменная пневмония относится к атипичным формам воспаления легких.Возбудителями болезни являются Mycoplasma pneumoniae. Микоплазмоз начинается с катаральных явлений, что зачастую становится причиной неправильной диагностики и несвоевременного обращения к врачу. Микоплазменная пневмония чаще всего развивается вне стен лечебного учреждения. Такие пневмонии называются внебольничными. На ее долю приходится до 50% случаев воспаления легких. Болезнь поражает преимущественно детей и подростков. Часто дети заражаются в стенах детских учреждений (школ, детских садов, школ-интернатов, средних и высших учебных заведений).
В некоторых случаях болезнь развивается сразу после рождения малыша. В данной ситуации речь идет о врожденной форме микоплазменной пневмонии. У новорожденных она протекает наиболее тяжело. Возможно развитие генерализованной формы болезни с поражением внутренних органов. Микоплазменная пневмония бывает очаговой и долевой. В первом случае воспаление затрагивает незначительный участок легкого в пределах нескольких легочных долек. При долевой пневмонии в процесс вовлекается целая доля легкого. В большинстве случаев воспаление является односторонним.
Свойства возбудителя
Возбудителями заболевания являются микоплазмы. Это мелкие одноклеточные микроорганизмы. Они относятся к типу простейших организмов. Эти микроорганизмы имеют следующие отличительные черты:
- не имеют клеточной стенки и ядра;
- величиной от 100 до 600 нм;
- способны менять свою форму;
- чувствительны к высокой температуре, дезинфицирующим средствам и ультрафиолетовому излучению;
- содержат ДНК и РНК;
- неспособны долго жить во внешней среде.
Ребенок заражается через воздух. Микоплазмы с током воздуха проникают в верхние дыхательные пути, а оттуда в бронхи и легочную ткань. Источником инфекции является больной или бессимптомный носитель. Размножение микоплазм происходит в альвеолах. На фоне это формируется интерстициальный тип воспаления легких, при котором происходит утолщение перегородок между альвеолами. После перенесенного ребенком заболевания у него формируется иммунитет продолжительностью до 10 лет.
Способствуют развитию болезни следующие факторы:
- курение;
- иммунодефицит;
- тяжелые хронические заболевания;
- переохлаждение;
- несбалансированное питание.
В группу риска входят дети в возрасте от 3 до 15 лет.
Клинические проявления
Симптомы микоплазменной пневмонии имеют свои особенности. Вначале наблюдаются симптомы поражения верхних дыхательных путей (насморк, боль в горле, снижение аппетита, сухой кашель). Постепенно повышается температура тела.
Воспаление легких проявляется следующими симптомами у детей:
- лихорадкой;
- болью в груди, усиливающейся при вдохе и выдохе;
- приступообразным кашлем с отделением небольшого количества мокроты.
При обструкции бронхов кашель может беспокоить ребенка на протяжении нескольких недель. Симптомы интоксикации могут быть выражены слабо. Микоплазменная пневмония отличается тем, что часто присутствуют внелегочные симптомы. К ним относится кожная сыпь, боль в животе, мышцах и суставах, парестезия. Сыпь выявляется у 12-15% больных детей. Она пятнисто-папулезная или уртикарная. У маленьких детей симптомы выражены слабо.
У некоторых больных заболевание имеет смешанную этиологию. В данной ситуации присоединяется вторичная бактериальная инфекция. Наиболее тяжело протекает сливная пневмония, когда мелкие очаги сливаются между собой, затрагивая несколько легочных сегментов или целую долю. У половины больных детей при пневмонии наблюдается увеличение печени. Функция органа при этом не нарушена. Реже увеличивается селезенка. У детей дошкольного возраста часто увеличиваются лимфатические узлы.
Обследование и лечение
Лечение больных детей проводится после постановки диагноза и исключения других заболеваний легких. Диагностика включает в себя рентгенографию грудной клетки или компьютерную томографию, физикальное исследование (выслушивание и перкуссию легких), исследование мокроты для уточнения типа возбудителя, осмотр зева, общий анализ крови и мочи. На рентгенограмме при сегментарной пневмонии обнаруживается наличие очаговых инфильтратов в нижних сегментах с нечеткими контурами, интерстициальные изменения. При микроскопическом исследовании мокроты микоплазмы не обнаруживаются. Проводится полимеразная цепная реакция или серологические методы исследования (ИФА).
Основу лечения больных микоплазменной пневмонией детей составляет антибиотикотерапия.
Назначаются тетрациклины (Доксициклин) или макролиды (Азитромицин, Эритромицин). При этом во внимание берется возраст ребенка. Доксициклином нельзя лечить детей младше 12 лет и детей более старшего возраста с массой тела менее 45 кг. Лечение также включает обильное питье, дезинтоксикацию организма, физиопроцедуры, массаж, применение отхаркивающих средств в виде сиропов или микстур. Таким образом, микоплазменная пневмония у детей редко протекает в тяжелой форме и практически всегда заканчивается выздоровлением.
Микоплазменная пневмония — mon-crb
– атипичная легочная инфекция, возбудителем которой является Мycoplasma pneumoniae. Заболевание сопровождается катаральными и респираторными проявлениями (заложенностью носа, першением в горле, приступами навязчивого малопродуктивного кашля), интоксикационным синдромом (субфебрилитетом, слабостью, головной болью, миалгией), явлениями диспепсии (дискомфортом в ЖКТ). Микоплазменная этиология пневмонии подтверждается данными рентгенографии и КТ легких, серологического и ПЦР исследований. При микоплазменной пневмонии показаны макролиды, фторхинолоны, бронходилататоры, отхаркивающие средства, иммуномодуляторы, физиолечение, массаж.
Причины микоплазменной пневмонии
Микоплазменную пневмонию вызывают высоковирулентные штаммы анаэробных микроорганизмов рода Мycoplasma – M. pneumoniae. Возбудитель представлен мелкими (по размеру сравнимыми с вирусными частицами), не имеющими клеточной стенки (аналогично L-формам бактерий), прокариотическими организмами. Микоплазмы легко адсорбируются на поверхностных рецепторах клеток-мишеней (эпителиоцитов трахеи и бронхов, альвеолоцитов, эритроцитов и др.) и паразитируют на мембране или внутри клетки-хозяина. Интеграция микоплазмы в клеточную мембрану или ее проникновение внутрь клетки превращает последнюю в иммунологически инородную, что провоцирует развитие аутоиммунных реакций. Именно аутоантителообразование служит причиной нереспираторных проявлений микоплазменной инфекции.
Микоплазмы способны длительно персистировать в эпителиальных клетках и лимфоглоточном кольце; легко передаются воздушно-капельным путем от больных и бессимптомных носителей со слизью из носоглотки и респираторного тракта. Микоплазмы малоустойчивы во внешних условиях: чувствительны к перепаду pH, нагреванию и высушиванию, ультразвуку и УФО, не растут на недостаточно влажных питательных средах.
Кроме микоплазменной пневмонии, микроорганизмы также могут стать причиной острого воспаления верхних дыхательных путей (фарингита), бронхиальной астмы, обострений хронического обструктивного бронхита и развития нераспираторной патологии (перикардита, отита, энцефалита, менингита, гемолитической анемии) у практически здоровых людей.
Отсутствие клеточной оболочки обеспечивает микоплазмам резистентность к β-лактамным антибиотикам – пенициллинам, цефалоспоринам. При микоплазменной инфекции отмечается развитие локального воспаления с выраженной иммуноморфологической реакцией, местным антителогенезом (всех классов иммуноглобулинов — IgM, IgA, IgG), активацией клеточного иммунитета. Симптомы микоплазменной пневмонии обусловлены преимущественно агрессивной ответной воспалительной реакцией макроорганизма (постинфекционной гиперсенситивностью, опосредованной Т-лимфоцитами).
Симптомы микоплазменной пневмонии
Инкубационный период при микоплазменной пневмонии может длиться 1-4 недели (обычно 12-14 дней). Начало заболевания, как правило, постепенное, но может быть подострым или острым. Выделяют респираторные, нереспираторные и генерализованные проявления микоплазменной пневмонии.
В начальном периоде возникает поражение верхних дыхательных путей, которое протекает в виде катарального назофарингита, ларингита, реже острого трахеобронхита. Отмечается заложенность носа, сухость в носоглотке, першение в горле, осиплость голоса. Ухудшается общее состояние, постепенно нарастает температура до субфебрильных значений, появляется слабость, потливость. В острых случаях симптомы интоксикации возникают в первые сутки заболевания, при постепенном развитии — только на 7-12 день.
Характерен продолжительный (не менее 10-15 дней) малопродуктивный пароксизмальный кашель. Во время приступа кашель очень сильный, изнурительный с выделением незначительного количества вязкой слизистой мокроты. Кашель может приобретать хронический характер, сохраняясь на протяжении 4-6 недель из-за обструкции дыхательных путей и гиперреактивности бронхов. Спектр проявлений микоплазменной пневмонии может включать признаки острой интерстициальной пневмонии.
Из внелегочной симптоматики для микоплазменной пневмонии наиболее характерны высыпания на коже и барабанных перепонках (по типу острого мирингита), миалгия, дискомфорт в ЖКТ, нарушение сна, умеренная головная боль, парестезии. Присоединение нереспираторных проявлений утяжеляет течение микоплазменной пневмонии.
Может возникать умеренный фибринозный или экссудативный плеврит, иногда — плевритическая боль. При наличии сопутствующей хронической обструкции микоплазменная пневмония способствует обострению обструктивного синдрома. Для детей младше 3-летнего возраста характерно малосимптомное течение.
В неосложненных случаях симптомы микоплазменной пневмонии в течение 7-10 дней постепенно исчезают, заболевание разрешается самостоятельно. Имеется риск перехода в смешанную (микоплазменно-бактериальную) форму пневмонии вследствие присоединения вторичной инфекции (обычно, пневмококка). Осложнениями микоплазменной пневмонии выступают синдром Стивенса-Джонсона, синдром Гийена-Барре, миелит, энцефалит, менингит.
Особенности клиники, диагностики, лечения микоплазменной пневмонии у детей Текст научной статьи по специальности «Клиническая медицина»
о
IÜ
Л
УДК 616.24-002:579.887]-053.2-07-085
ЮЛИШ Е.И., ЧЕРНЫШЕВА O.E., КОНЮШЕВСКАЯ A.A., ТАЛАЛАЕНКО А.К. Донецкий национальный медицинский университет им. М. Горького
ОСОБЕННОСТИ КЛИНИКИ, ДИАГНОСТИКИ, ЛЕЧЕНИЯ МИКОПЛАЗМЕННОЙ ПНЕВМОНИИ У ДЕТЕЙ
Резюме. В работе представлены особенности клиники, методы диагностики, принципы рационального лечения микоплазменной пневмонии в детском возрасте. Ключевые слова: микоплазменная пневмония, дети.
С конца 1980-х годов наблюдается тенденция к росту заболеваемости детей пневмонией, количества случаев ее осложненного течения [10]. В экономически благополучных странах частота регистрации пневмонии у детей первых 5 лет жизни составляет 5—10 случаев на 1000 детей, в возрасте младше 5 лет — 34—40 случаев в год [1, 5, 7]. Ежегодно в мире регистрируется около 155 миллионов случаев заболевания пневмонией у детей, из них примерно 1,8 миллиона в возрасте до 5 лет погибает [6].
В последние годы появились многочисленные данные об изменении этиологии пневмоний и их течения. В частности, результаты исследований, проведенных в 2003—2013 гг. среди детей в Финляндии (8851 чел.), показали, что заболеваемость хламидо-фильными пневмониями составила 2,3 на 1000 детей, а микоплазменными — 5,0 на 1000 детей в год [8].
Несмотря на достижения современной педиатрии, пневмония по-прежнему является важнейшей отдельно взятой причиной смерти детей во всем мире — 20 % всех случаев смерти детей в возрасте до пяти лет [9]. В развивающихся странах внебольнич-ная пневмония остается частой причиной смертельных исходов среди детского населения [6], в то время как в развитых странах наблюдается уменьшение частоты смертельных исходов [9].
Экономические потери, связанные с лечением данного заболевания в США, составляют 8,4— 10 миллиардов долларов США в год, из них 92 % приходится на госпитализированных больных. Лечение одного пациента в условиях стационара обходится в 2430-8970, а на дому — 300 долларов США [11]. А стоимость лечения детей, страдающих пневмонией, во всем мире составляет около 600 миллионов долларов США [6].
Согласно данным многочисленных исследований, этиология заболеваний верхних и нижних дыха-
тельных путей у детей, в том числе и внебольничной пневмонии, связана с микрофлорой, колонизующей верхние отделы дыхательных путей — пневмококками — S.pneumoniae (от 50 до 80 % случаев), гемо-фильной палочкой (10—15 %), гемолитическими стрептококками группы А, чаще S.pyogenis и Viridans [12—15]. В последние годы среди причин заболеваний респираторного тракта называют Chlamydophila pneumoniae и Mycoplasma pneumoniae, выявляемые в 20—25 % случаев [16—19]. В результате исследований, проведенных в Италии, была выявлена роль M.pneumoniae и C.pneumoniae в развитии внебольничной пневмонии у детей от 2 до 14 лет. Микоплазменная инфекция была диагностирована у 21 % детей в возрасте 2—4 лет, у 41 % детей в возрасте 5—7 лет и у 60 % детей старше 7 лет. Хламидофильная пневмония была диагностирована у 10 % детей в возрасте 2—4 лет, у 19 % — 5—7 лет и у 21 % детей старше 7 лет [20]. Из 145 исследованных детей (средний возраст — 2,5 года) в Турции доля микоплазменных пневмоний составила 27 %, а хламидофильных — 5 % [21]. R. Samransamruajkit с соавторами показали лидирующую роль хламидий и микоплазм в развитии пневмоний, вызываемых у детей в Таиланде (из 58 пациентов у 25 % наблюдалась микоплазменная пневмония и у 15 % — хламидийная). Согласно данным российских авторов, при внебольничной пневмонии у пациентов молодого возраста S.pneumoniae выделялась у 29 % пациентов, C.pneumoniae — у 27 %, M.pneumoniae — у 9 %, ассоциация S.pneumoniae с M.pneumoniae и C.pneumoniae — у 24 % больных, а ассоциация M.pneumoniae и C.pneumoniae — у 11 %.
© Юлиш Е.И., Чернышева О.Е., Конюшевская А.А.,
Талалаенко А.К., 2014 © «Здоровье ребенка», 2014 © Заславский А.Ю., 2014
Причем в 30—40 % случаев микоплазменная пневмония наблюдалась у детей старше 5 лет и подростков, особенно среди детей, посещающих детские коллективы, в то время как среди людей зрелого возраста — всего лишь в 2—3 %. Кроме того, микоплазменная инфекция наблюдалась и у детей раннего возраста, в том числе умерших в первые дни после рождения и у мертворожденных, что свидетельствует о возможности передачи микоплазм от матери плоду [5].
Этиологическая структура внебольничных пневмоний различается в зависимости от возраста больных. Так, микоплазменная пневмония встречается у 15 % больных детей в возрасте от 6 месяцев до 5 лет, старше 5 лет — уже в 23—44 % случаев [39].
Согласно статистическим исследованиям, каждые 3—8 лет наблюдаются эпидемиологические подъемы заболеваемости микоплазменной пневмонией, которые длятся несколько месяцев. При этом заболеваемость может достигать 20 % от общего числа внебольничных пневмоний, что является самым высоким показателем среди небактериальных поражений легочной паренхимы [22, 28].
Согласно принятой в настоящее время классификации, все микоплазмы объединены в одно семейство Mycoplasmataceae, которое имеет два рода: Mycoplasma и Ureaplasma urealyticum. M.pneumoniae относится к роду Mycoplasma, семейству Mycoplasmataceae, порядку Mycoplasmatales, классу Mollicutes. Первый представитель рода микоплазм был открыт еще в 1898 г. французскими исследователями Е. Nocard и Е. Rous, но только в течение последних десятилетий было установлено, что люди страдают от инфекций, вызываемых микоплазмами. Впервые микоплазма была выделена от больного пневмонией М. Eaton в 1944 г. и отнесена к вирусам, получив название «агент Итона». Лишь в 1962 г. R. Chanock доказал, что этот микроорганизм является микоплазмой [2, 26].
Являясь мембраноассоциированным микроорганизмом, M.pneumoniae занимает промежуточное положение между вирусами, бактериями и простейшими. Это мелкий полиморфный, грамотрицательный, факультативно-анаэробный, прокариотический микроорганизм, содержащий РНК и ДНК, лишенный внешней мембраны и имеющий вместо клеточной стенки трехслойную цитоплазматическую мембрану. Данная особенность строения обусловливает резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего — резистентность к пенициллину и остальным, без исключения, ß-лактамам. За счет особой выпуклой терминальной структуры микоплазма обладает уникальной скользящей подвижностью и адсорбцией к поверхностным структурам клеток хозяина, в частности эритроцитам, клеткам реснитчатого эпителия трахеи, бронхов, в которых под действием токсического фактора M.pneumoniae нарушается биосинтез РНК, белка, что приводит к гибели клеток. Структурное сходство мембран клеток человека и мембран микоплазм ведет к «маскировке» антигенов микоплазм, слабому распознаванию их как чужеродных агентов. В связи
с этим существует возможность аутоиммунизации организма. Прикрепляясь к клеткам респираторного эпителия, М.рпвитотав вызывает дисфункцию ресничек, вплоть до цитолиза, после чего происходит цитоадсорбция микроорганизма и встраивание участков мембраны возбудителя в мембрану клеток. Это приводит к тому, что микоплазма обеспечивает себя всеми необходимыми питательными веществами [23-25].
Одним из первых признаков поражения клеток является потеря подвижности ресничек эпителия. Микоплазмы, разрушая терминальные перемычки между клетками эпителия, дезорганизуют тканевую архитектонику и, интраканаликулярно распространяясь, поражают альвеолоциты. Обнаружить возбудителя в альвеолоцитах можно как при имму-нолюминесцентном анализе, так и при гисторадио-автографическом. Микроколонии микоплазмы обнаруживаются в цитоплазме альвеолоцитов, претерпевающих в результате этого ряд характерных морфологических изменений, приводящих их к гибели. В дальнейшем из легких М.рпвитотав попадает в регионарные лимфатические узлы, далее — в кровеносное русло, в результате чего развивается генерализованная инфекция с поражением внутренних органов и ЦНС. Подобные формы заболевания чаще отмечаются у детей раннего возраста. Помимо поражения альвеолоцитов и бронхиального эпителия, в легких наблюдается выраженная иммуноморфоло-гическая реакция, характеризующаяся утолщением и инфильтрацией межальвеолярных перегородок лимфоидными и гистиоцитарными элементами, появлением в них клеток плазматического ряда, гиперплазией и плазмоклеточной реакцией в перибронхи-альных лимфатических фолликулах и узлах. Кроме того, М.рпвитотав способна к саморепликации и, как следствие, к длительной персистенции.
Основным фактором, способствующим циркуляции и распространению возбудителя, является скопление людей внутри одного коллектива, плохая циркуляция воздуха в непроветриваемых помещениях, что чаще встречается в осенне-зимний период. Источником микоплазменной инфекции являются больные и носители. Инфицированный человек выделяет вирус при разговоре, чихании или кашле. Возбудитель относительно неустойчив во внешней среде, разрушается при нагревании до 40 °С в течение 20 минут. Механизм передачи инфекции — аэрогенный. Инкубационный период длится от 1 до 4 недель (в среднем 2-3 недели) [25-27]. Вирулентность инфекции в отношении мальчиков выше, чем девочек, но меньше по сравнению с такими инфекционными заболеваниями, как корь, коклюш, ветряная оспа, краснуха и грипп [30].
После внедрения М.рпвитотав в организм ребенка заболевание может протекать по нескольким сценариям. С одной стороны, возбудитель, длительно находясь внутри организма и не вызывая болезнь, делает ребенка здоровым носителем инфекции. С другой — возбудитель может вызывать типичный мико-
плазменный бронхолегочный процесс или инфекцию верхних дыхательных путей. В случае неблагоприятного течения развивается генерализация инфекции с развитием артрита, энцефалита, менингита. Разнообразие клинических проявлений зависит от патогенеза микоплазменной инфекции. Так, возможно прямое действие возбудителя на различные органы и системы за счет выработки токсинов, ферментов. Воздействие иммунных комплексов на мембраны клеток обусловливает генерализованные и местные иммунные реакции. Кроме того, микоплазмы, прикрепляясь к эритроцитам, вызывают их гемолиз.
Вследствие того, что входными воротами для M.pneumoniae является слизистая оболочка респираторного тракта, одним из самых ранних симптомов респираторного микоплазмоза, протекающего по типу острой респираторной инфекции, является сухость и першение в горле, заложенность или сухость в носовых ходах, сухой длительный кашель [29]. При остром развитии заболевания у ребенка отмечается лихорадка до 39,0—40,0 °С, сохраняющаяся до 10 дней. В дальнейшем, при неблагоприятном течении инфекционного процесса, появляются выраженные признаки интоксикации, появляется сухой интенсивный кашель, заложенность носа, першение в горле. Происходит снижение температуры, и яркие симптомы заболевания постепенно исчезают.
В случае постепенного начала заболевания, что наблюдается чаще, в первые дни заболевания отмечается вялость, сонливость ребенка при нормальных цифрах температуры тела. У него появляются нарушение носового дыхания с незначительным слизистым отделяемым, боль при глотании, сухой интенсивный кашель, возможно с болью за грудиной, рвотой в конце приступа кашля, болезненные ощущения в мышцах и в области поясницы. При осмотре могут определяться гиперемия слизистой оболочки глотки, небных миндалин, незначительное их увеличение. Такое проявление респираторного микоплаз-моза, по типу острой респираторной инфекции, может продолжаться 2—4 недели, а иногда и более.
Нередко инфекционный процесс распространяется на терминальные отделы респираторного тракта, что приводит к развитию микоплазменной пневмонии. В 20—30 % случаев воспалительный процесс охватывает сразу оба легких. Обычно заболевание начинается постепенно, с умеренной головной и мышечной боли, повышения температуры тела. Основными и наиболее постоянными симптомами мико-плазменной пневмонии являются непродуктивный обильный кашель, возникающий через 3—5 дней после начала инфекции, сохраняющийся в течение 3—4 недель, лихорадка, головные боли, выраженное недомогание, боли во всем теле [30].
Температура тела в течение всего периода болезни может оставаться субфебрильной, но может и достигать 38,5—39 °С, держаться на этом уровне до 7, а иногда и до 10—12 дней. Снижается температура литически, а затем длительно (иногда до месяца) может сохраняться субфебрилитет. Длительность и высота лихорадки
зависят от тяжести процесса в легких. Так, при интер-стициальной пневмонии лихорадка менее выражена, а при очаговой и субдолевой — более выражена.
Если у больного отсутствует кашель, то диагноз микоплазменной пневмонии практически можно исключить. При данной патологии кашель обычно сухой, иногда сопровождается отделением небольшого количества слизистой мокроты, в тяжелых случаях — с прожилками крови. Как правило, кашель длится от нескольких недель до нескольких месяцев и сопровождается болью за грудиной, болью в грудной клетке при дыхании, усиливающейся при глубоком вдохе. У детей раннего возраста может развиться бронхообструктивный синдром. У детей старшего возраста и подростков кашель постепенно становится продуктивным. В легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы. Примерно у 10 % детей с ми-коплазменной пневмонией отмечают преходящую макулопапулезную сыпь.
При исследовании крови отсутствует нейтро-фильный лейкоцитоз, характерен моноцитоз и незначительное увеличение СОЭ.
При рентгенологическом исследовании органов грудной клетки отмечается неоднородная негомогенная инфильтрация легких без четких границ, в виде небольших пятнистых или сливных затемнений, чаще в виде тумана, облака. Также характерным является выраженное усиление и сгущение легочного рисунка. Обычно процесс носит односторонний характер и локализуется в нижних отделах. Усиление бронхососудистого рисунка остается длительное время и после клинического выздоровления.
Наиболее специфичным и чувствительным методом лабораторной диагностики микоплазменной пневмонии является микробиологическое исследование. Однако выделение культуры M.pneumoniae не всегда представляется возможным. Это обусловлено тем, что, как правило, у большинства пациентов отмечается сухой кашель, особенно в начале заболевания, что затрудняет получение мокроты. С другой стороны, для выделения M.pneumoniae из клинического материала — мокроты, плевральной жидкости, легочной ткани, смывов с задней стенки глотки — требуются специфические среды, которые способны обеспечить микоплазмы источниками энергии, сте-ролами, фосфолипидами с определенным осмотическим давлением. К тому же даже при наличии богатой питательной среды рост M.pneumoniae происходит крайне медленно, в среднем 7—14 суток, а часто требует и гораздо более длительных, в течение нескольких недель, сроков инкубации, что нередко приводит к контаминации посева другими, менее прихотливыми микроорганизмами [33]. Чувствительность куль-турального исследования даже при четко выполненных требованиях не превышает 60 % [33, 34].
В то же время специфичность при использовании дополнительных тестов для видовой идентификации M.pneumoniae достигает 100 %. Поэтому вследствие трудности диагностики микоплазменной инфекции
путем культурального исследования этиологическая расшифровка основывается на серотипировании. Для этого используется реакция связывания комплемента (РСК), реакция непрямой иммунофлюо-ресценции (РНИФ), латекс-агглютинации, ИФА, позволяющие обнаружить специфические антитела к M.pneumoniae — иммуноглобулины классов А, M, G [31, 32, 39]. Наличие специфического инфекционного процесса подтверждается нарастанием концентрации IgG- и IgM-антител к M.pneumoniae при исследовании парных сывороток пациента с интервалом в 2 недели. Свидетельством острой или недавно перенесенной инфекции может считаться как минимум 4-кратное нарастание титра антител. При интерпретации результатов серологических методов исследования следует учитывать то, что достаточно высокий уровень антител класса IgG к M.pneumoniae может сохраняться длительное время после перенесенной инфекции либо нарастание титра IgG может быть отсроченным во времени [35].
В последнее время для диагностики микоплаз-менной инфекции все большее значение приобретает полимеразная цепная реакция (ПЦР) для определения ДНК возбудителя [33]. Метод ПЦР актуален в диагностике пневмонии, вызванной M.рneumoniae, так как характеризуется чувствительностью 85—95 % и специфичностью более 90 % [39]. Разрабатываются методики детекции микоплазм при помощи «гнездной» ПЦР, которая отличается более высокой чувствительностью, ПЦР в реальном времени [34]. Последняя, в отличие от классической ПЦР, по аналитическим характеристикам позволяет определять уровень микробной нагрузки. По мнению исследователей, это может использоваться для дифференциации инфекции c носительством M.pneumoniae и оценки степени тяжести инфекционного процесса [36].
Исследования по оценке приемлемости различного клинического материала для выявления M.pneumoniae определили более высокую диагностическую ценность мокроты по сравнению с оро-фарингеальными, назофарингеальными мазками или назофарингеальным аспиратом, что объясняется большей концентрацией возбудителя в нижних дыхательных путях [37]. Поэтому у пациентов с внебольничной пневмонией для культурального исследования и ПЦР следует использовать мокроту, и только при невозможности ее получения — образцы из верхних дыхательных путей [33].
Обследование на микоплазмоз следует проводить в случаях длительно протекающего заболевания с кашлем, а также при длительном субфебрилитете.
Терапия микоплазменной пневмонии включает назначение постельного режима на лихорадочный период, оксигенотерапию в случае насыщения крови кислородом менее 92 %, антипиретики только при повышении температуры тела до фебрильных цифр, исключая плановое назначение, что может создать иллюзию благополучия и затруднить оценку эффективности антибактериальной терапии. Кроме того,
назначаются муколитические и отхаркивающие препараты. Бронхоспазмолитическая терапия в виде бета-2-агонистов короткого действия монотерапией или в составе комбинированных лекарственных препаратов (беродуал) назначается в случае сопутствующего бронхообструктивного синдрома, что часто может наблюдаться при микоплазменной пневмонии, а также при возникновении пневмонии у больных бронхиальной астмой [39].
При микоплазменной пневмонии возбудитель находится внутри нейтрофилов, альвеолярных макрофагов, и это защищает его от действия таких антибиотиков, как пенициллины, цефалоспорины, аминогликозиды. Поэтому антибиотиками первого ряда в лечении больных являются макролиды: ази-тромицин, спиромицин, кларитромицин. Механизм действия макролидов связан с нарушением синтеза белка в клетках чувствительных микроорганизмов. Для большинства этих препаратов характерен постантибиотический эффект, в основе которого лежат необратимые изменения в рибосомах микроорганизма, благодаря чему антибактериальное действие усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки [22, 38]. Кроме того, макролиды обладают противовоспалительными и иммуномодулирующими свойствами, которые обусловлены модулирующим влиянием на такие функции нейтрофилов, как фагоцитоз, хемотаксис, киллинг. Под влиянием 14-членных макролидов происходит ингибирование окислительного «взрыва», в результате чего уменьшается образование высокоактивных окисляющих соединений, способных повреждать не только бактериальные клетки, но и собственные ткани. Взаимодействуя с клетками иммунной системы, макролиды могут ингибировать синтез и/или секрецию таких провоспалительных цитокинов, как интерлейкины — IL-1, IL-6, IL-8, фактор некроза опухоли а, и, наоборот, усиливать секрецию противовоспалительных интерлейки-нов — IL-2, IL-4, IL-10 [22]. Наиболее активными в отношении M.pneumoniae является азитромицин, джозамицин, спирамицин.
Фармакокинетические параметры азитромицина выгодно отличают препарат от других макролидов. Так, азитромицин более устойчив к действию соляной кислоты желудочного сока, не оказывает ин-гибирующего влияния на микросомальную систему цитохрома Р-450 (что характерно для 14-членных макролидов) и, следовательно, характеризуется низкой вероятностью лекарственных взаимодействий.
Кроме того, азитромицин максимально накапливается в легочной ткани, в слизистых оболочках бронхов и альвеол, среднего уха, синусов, бронхиальном секрете, слюне, миндалинах. Активный захват антибиотика фибробластами, альвеолярными макрофагами и полиморфноядерными лейкоцитами создает в них концентрации, многократно превышающие таковые в сыворотке крови. Мигрируя в очаг воспаления, фагоциты выполняют транспортную функцию, достав-
Таблица 2. Способ применения Азитро САНДОЗ® в суспензии у детей при концентрации азитромицина
200 мг/5 мл
Таблица 1. Способ применения Азитро САНДОЗ® в суспензии у детей при концентрации азитромицина
100 мг/5 мл
Масса тела, кг 3-дневная терапия, мл 5-дневная терапия, мл
1-3-й день 10 мг/кг/сутки 1-й день 10 мг/кг/сутки 2-5-й день 5 мг/кг/сутки
10 5 5 2,5
12 6 6 3
Масса тела, кг 3-дневная терапия, мл 5-дневная терапия, мл
1-3-й день 10 мг/кг/сутки 1-й день 10 мг/кг/сутки 2-5-й день 5 мг/кг/сутки
10 2,5 2,5 1,25
12 3 3 1,5
14 3,5 3,5 1,75
16 4 4 2
17-25 5 5 2,5
26-35 7,5 7,5 3,75
36-45 10 10 5
Более 45 кг 12,5 12,5 6,25
ляя антибиотик непосредственно к месту локализации бактерий. Под влиянием микробных стимулов происходит выделение препарата из клеток в пораженные ткани и создание его более высокой и длительно сохраняющейся концентрации в очаге инфекции.
Согласно данным метаанализа, включившего 45 клинических исследований, общая частота нежелательных явлений при приеме азитромицина составила не более 9 %, наиболее типичными из которых являлись нарушения со стороны ЖКТ — боли и дискомфорт в животе, тошнота, диарея. В другом мета-анализе показано, что частота отмены азитромицина из-за нежелательных явлений при лечении инфекций нижних и верхних отделов дыхательных путей составляет 0,7 и 0,8 % соответственно. В отличие от эритромицина и кларитромицина азитромицин не приводит к повышению уровня трансаминаз и развитию холестаза, также при его применении не отмечается удлинение интервала QT.
В последние годы при изучении влияния ази-тромицина на белки, образующие межклеточные соединения в респираторном эпителии, были получены новые данные о неантибактериальных свойствах азитромицина, которые носят обратимый и дозозависимый характер. Установлено, что азитро-мицин увеличивает электрическое сопротивление респираторного эпителия за счет влияния на регуляцию транспорта ионов и растворов через межклеточное пространство и регулирует локализацию белков межклеточных контактов эпителия (клаудин-1, клаудин-4, адгезивная молекула), обеспечивающих целостность эпителиальной ткани и являющихся ключевым компонентом структурной и функциональной защиты эпителия дыхательных путей. Этими свойствами не обладают другие антибиотики. Важным является отсутствие отрицательного влияния азитромицина на жизнеспособность респираторного эпителия [40].
В настоящее время среди макролидов широко используется Азитро САНДОЗ® (Sandoz), как в педиатрии, так и во взрослой практике. Азитро САНДОЗ® — это единственная на украинском рынке суспензия, содержащая азитромицина моногидрат. В соответствии с информацией, содержащейся в краткой характеристике продукта (SmPC), суспензия азитромицина моногидрата может приниматься вместе с едой. Формы выпуска — таблетки по 250 и 500 мг и суспензия по 100 и 200 мг азитромицина в 5 мл раствора. Важным преимуществом Азитро САНДОЗ® являются европейское качество и доступная цена.
Способ применения и дозирование Азитро САНДОЗ®. Взрослым по 500 мг в сутки в течение 3 дней или 500 мг в первый день и в последующие 4 дня по 250 мг. Детям — из расчета 10 мг/кг 1 раз в сутки на протяжении 3 дней или 10 мг/кг в сутки в первый день с переходом на 5 мг/кг в последующие 4 дня.
Методика применения Азитро САНДОЗ® в зависимости от концентрации суспензии представлена в табл. 1 и 2.
Список литературы
1. Заплатников А.Л. Внебольничные пневмонии у детей раннего возраста: принципы антимикробной терапии // Лечащий врач. — 2007. — № 7. — С. 3-9.
2. Таточенко В.К. Практическая пульмонология детского возраста. — М, 2001. — 268 с.
3. Острые респираторные заболевания у детей: лечение и профилактика /Научно-практическая программа Союза педиатров России. — М.: Международный фонд охраны здоровья матери и ребенка, 2002. — 69 с.
4. Самсыгина Г.А. Пневмонии у детей // http://medvuz.com/ med1808/t5/7.php
5. Горбич О.А, Чистенко Т.Н. Эпидемиологические аспекты пневмоний // http://www.bsmu.by/index.php?option=com_content &view=article&id=4478:2011-03-10-10-18-17&catid=297:42010-&Itemid=196
6. Пневмония / Информационный бюллетень ВОЗ. — 2009. — № 331. — 3 с.
7. Mcintosh K. Community-acquired pneumonia in children / K. Mcintosh //New England Journal of Medicine. — 2002. — Vol. 346, № 6. — P. 429-437.
8. Heiskanen-Kosma T. Chlamydia pneumoniae is an important cause of community-acquired pneumonia in school-aged children: serological results of a prospective, population-based study / T. Heiskanen-Kosma [et al.] // Scandinavian journal of infectious diseases. — 1999. — Vol. 31, № 3. — P. 255-259.
9. Dowell S.F. Mortality from pneumonia in children in the United States, 1939 through 1996/ S.F. Dowell // New England Journal of Medicine. — 2000. — Vol. 342, № 19. — P. 1399-1407.
10. Tan T. Clinical characteristics of children with complicated pneumonia caused by Streptococcus pneumoniae / T. Tan [et al.] // Pediatrics. — 2002. — Vol. 110, № 1. — P. 1-6.
11. Гучев И.А. Современные руководства по ведению внеболь-ничной пневмонии у взрослых: путь к единому стандарту/И.А. Гучев, А.И. Синопальников // Клиническая микробиология и антимикробная химиотерапия. — 2008. — Т. 10, № 4. — С. 305-321.
12. Волосовець О.П., Юлш 6.1. Рацюнальна антибютикоте-рапы рестраторних захворювань у дтей. — Тернопшь: Укрмед-книга, 2003. — 399 с.
13. Таточенко В.К. Клинические рекомендации. Педиатрия (Пневмония у детей) / Под ред. А.А. Баранова. — М.: ГЭОТАР-Медиа, 2005. — 28 с.
14. Community Acquired Pneumonia Guideline Team, Cincinnati Children’s Hospital Medical Center: Evidence-based care guideline for medical management ofCommunity Acquired Pneumonia in children 60 days to 17 years ofage. http://www.cincinnatichildrens.org/svc/alpha/h/ healthpolicy/based/pneumonia. htm. Guideline 14, pages 1—16, 2005.
15. Малахов А.Б., Дронов И.А., Волков И.К., Геппе НА., Кир-даков Ф.И. Оптимальный выбор терапии при внебольничной пневмонии у детей//Лечащий врач. — 2011. — № 1. — С. 28-34.
16. Юлиш Е.И., Кривущев Б.И. Подходы к направленной эти-отропной терапии при бактериальных респираторных заболеваниях у детей //Здоровье ребенка. — 2010. — № 6 (33). — С. 82-87.
17. Mcintosh K Community-Acquired pneumonia in children // N. Engl. J. Med. — 2002. — Vol. 346, № 6. — P. 429-437.
18. Crawford S.E., Daum R.S. Bacterial pneumonia, lung abscess and empyema / Pediatric respiratory medicine// Ed. by Taussig L.M., Landau L.I. — Mosby Inc. — 2008. — P. 501-553.
19. Niederman M.S., Mandell L.A., Anzueto A. et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention // Am. J. Respir. Crit. Care Med. — 2001. — Vol. 163. — P. 1730-1754.
20. Principi N.M. Pneumoniae and Chlamydia pneumoniae cause not only atypical pneumonias/ N. Principi [et al.] // Clinical Infectious Diseases. — 2001. — Vol. 32, № 9. — P. 1281-1289.
21. Somer A. Chlamydia pneumoniae in children with community-acquired pneumonia in Istanbul, Turkey/ A. Somer[et al.] // Journal of tropical pediatrics. — 2006. — Vol. 52, № 3. — P. 173-178.
22. Мусалимова Г.Г., Саперов В.Н., Никонорова Т.А. Диагностика и лечение микоплазменной и хламидийной пневмоний // Лечащий врач. — 2004. — № 8. — С. 21-25.
23. Mandell L.A., Marrie T.J, Grossman R.F. et al. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society // Clin.вання мь коплазмено1 пневмони в дитячому вщ.
Kro40Bi слова: мшоплазмена пневмон1я, дии.
25. British Thoracic Society Guidelines for the management of community-acquired pneumonia in adults // Thorax. — 2001. — Vol. 56, № 4. — Р. 1-64.
26. Российский терапевтический справочник / Под ред. А.Г. Чучалина. — М, 2005. — 308 с.
27. Simberkoff M.S., Cross A.P., Al-Ibrahim M. et al. Etlicacy of pnevmococcal vaccine in hiqh- risk patients: results of a Veterans Administration cooperative study//N. Engl. J. Med. —1986. — Р. 43-45.
28. Сторожаков Г.И., Утешев Д.Б. Некоторые аспекты диагностики и лечения внебольничных пневмоний, вызванных атипичными возбудителями //Лечащий врач. — 2005. — № 8. — С. 34-39.
29. Лебедева М.В. Особенности кашля у детей дошкольного возраста, посещающих детский сад и находящихся на дому, и его лечение//Лечащий врач. — 2013. — № 8. — С. 25-31.
30. Reither M. Mykoplasmenpneumonie im Kindes- und Jugendalter // Padiat. prax. — 55. — 619-627.
31. Marrie T.J, Peeling R.W., Fane M.J. et al. Ambulatory patients with community — acquired pneumonia the freguency of atypical agents and clinical course //Am. J. Med. — 1996. — Vol. 5. — P. 67-90.
32. Ноников В.Е. Диагностика и лечение атипичных пневмоний // Consilium medicum. — 2001. — T. 3, № 12. — C. 569-574.
33. Рачина С.А., Козлов Р.С. Современные подходы к микробиологической диагностике при внебольничной пневмонии//Пульмонология. — 2010. — № 5. — С. 5-14.
34. Waites K.B., Talkington D.F. M. pneumoniae and its role as a human pathogen // Clin. Microbiol. Rev. — 2004. — 17. — 697-728.
35. Razin S. Diagnosis of mycoplasmal infections// Ed. by Razin S., Herrmann R. Molecular biology and pathogenicity of mycoplasmas. — New York: Kluwer Academic/ Plenum Publishers; 2002. — 531-544.
36. Dorigo-Zetsma J.W., Zaat S.A., Vriesema A.J. et al. Demonstration by a nested PCRfor M. pneumoniae that M. pneumoniae load in the throat is higher in patients hospitalized for M. pneumoniae infection than in non-hospitalised subjects // J. Med. Microbiol. —
1999. — 48. — 1115-1122.
37. Loens K., Beck T., Ursi D. et al. Evaluation of different nucleic acid amplification techniques for the detection of M. pneumoniae, C. pneumoniae and Legionella spp. in respiratory specimens from patients with community-acquired pneumonia // J. Microbiol. Meth. — 2008. — 73. — 257-262.
38. Макаревич А.Э. Болезни органов дыхания. — Минск,
2000. — 369 с.
39. Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика. Научно-практическая программа / Под ред. Чучалина А.Г. — М, 2011. — 63 с.
40. Применение антибиотиков у детей в амбулаторной практике /Подред. А.А. Баранова, Л.С. Страчунского//Клин. микро-биол. антимикроб. химиотер. — 2007. — 9 (3). — 200-10.
41. Охотникова Е.Н., Поночевная Е.В., Усова Е.И. и др. Ази-тро Сандоз в лечении заболеваний респираторной системы у детей // Здоровье Украины. — 2010. — № 1. — С. 41.
42. Summary of Product Characteristics (SmPC) Azithromycin 200 mg/ 5ml Powder for Oral Suspension HYPERLINK (https://www. medicines.org.uk/emc/medicine/22608/SPC/Az,ithromycin+200mg+ 5ml+Powder+for+Oral+Suspension)
43. Инструкция по медицинскому применению препарата.
44. Електронна база Морюн. Програмний комплекс «Аптека». Оптовi та роздрiбнi пропозици, ачень 2014 (http://pharmabase. com.ua/poisk/)
Получено 07.02.14 4-03-АЗД-РЕЦ-0114 □
Yulish Ye.!., Chernyshova O.Ye., Konyushevskaya A.A., Talalayenko A.K.
Donetsk National Medical University named after M. Gorky, Donetsk, Ukraine
FEATURES OF CLINICAL PRESENTATION, DIAGNOSIS AND TREATMENT OF MYCOPLASMAL PNEUMONIA IN CHILDREN
Summary. This paper presents the features of clinical presentation, diagnostic methods, principles of rational treatment of mycoplasmal pneumonia in childhood.
Key words: mycoplasmal pneumonia, children.
Особенности микоплазменной инфекции при вспышечной и спорадической заболеваемости у детей
В последние годы в детских коллективах отмечается стойкая тенденция к росту вспышек и спорадической заболеваемости респираторным микоплазмозом.
Цель. Изучить особенности течения микоплазменных пневмоний при вспышках и спорадических заболеваниях.
Материалы и методы. Обследовано 55 детей с микоплазменной пневмонией из очага инфекции и 90 детей с различными формами респираторного микоплазмоза при спорадической заболеваемости, госпитализированных в стационар за последние три года. Этиология заболевания подтверждалась выявлением ДНК микоплазмы в мазках из зева и носа и IgM к M.Pneumonia в сыворотке крови.
Результаты и обсуждение. Микоплазменная пневмония у детей протекает с лихорадкой, значительными аускультативными изменениями со стороны легких при умеренно выраженной интоксикации.
Особенностью респираторного микоплазмоза при вспышке является преобладание среднетяжелых форм пневмонии с наличием катарального синдрома у каждого второго ребенка, поражение ЖКТ в 34,4% наблюдений, развитие артралгий -у 20% обследованных. При спорадической заболеваемости чаще госпитализировались дети с обструктивным синдром, дыхательной недостаточностью. Внелегочные проявления регистрировались в 4 раза реже, чем при вспышке респираторного микоплазмоза в детском коллективе.
Заключение. Респираторный микоплазмоз сохраняет выраженную осенне-зимнюю сезонность и типичные клинические симптомы. Чаще болеют дети школьного возраста. Анализ вспышки респираторного микоплазмоза выявил редкое развитие обструктивного синдрома при пневмонии, преобладание среднетяжелых форм заболевания с внелегочными проявлениями болезни и катаральным синдромом.
При спорадической заболеваемости микоплазменной пневмонией госпитализируются паценты с более тяжелым течением болезни и явлениями дыхательной недостаточности за счет обструктивного синдрома.
Острые респираторные инфекции являются лидером в структуре детской инфекционной заболеваемости. В Российской Федерации острые респираторные заболевания (ОРЗ)
составляют 90% детской патологии, при этом наиболее подвержены развитию ОРЗ дети, посещающие организованные коллективы [1, 2]. По данным Воронежской областной детской клинической больницы, за последние 5 лет сохраняется устойчивая тенденция к росту числа детей, госпитализированных в стационар с острыми респираторными инфекциями. За этот период рост составил около 30% [3]. В этиологической структуре острых респираторных заболеваний на долю микоплазмозов приходится от 7 до 30% [4]. Как правило, микоплазменную инфекцию связывают с развитием бронхитов и атипичных пневмоний, но в настоящее время доказана роль M. Pneumonia в развитии ринитов, назофарингитов, трахеитов, синуситов, отитов, ларингитов. Возбудитель может длительно персистировать в клетках эпителия, повышая, тем самым, сенсибилизацию организма, вызывая длительные, рецидивирующие формы болезни. Течение микоплазменной инфекции не имеет патогномоничных клинических проявлений и подтверждение этиологии возможно лишь при лабораторной диагностике, что вызывает трудности в выборе этиотропной
терапии, учитывая узкий спектр чувствительности возбудителя.
Микоплазменная инфекция имеет выраженную эпидемическую сезонность, которая приходится на осенне-зимнее время, а также носит циклический характер с подъемами заболеваемости каждые 3-5 лет [5, 6]. В периоды роста циркуляции возбудителя отмечается значимый подъем заболеваемости микоплазменной пневмонией у детей школьного возраста (до 60% пневмоний у детей имеют микоплазменную этиологию), возможны вспышки микоплазменной инфекции в закрытых детских коллективах. По данным Всемирной организации здравоохранения, в мире регистрируется около 155 миллионов случаев пневмоний у детей, при этом из них 1,4 миллиона детей умирает. В Российской Федерации приходится от 10 до 30 случаев пневмонии на 1000 детского населения [7]. Пневмонии, наряду с патологией ЛОР-органов, являются наиболее частыми осложнениями заболеваний верхних дыхательных путей, но если речь идет об атипичных возбудителях, поражение легких может быть первичным очагом инфекции [8].
В настоящее время имеет место выраженный рост и распространенность заболеваемости микоплазменной инфекцией, в 2012-2013 годах в Москве и Московской области зарегистрирован ряд вспышек микоплазменной инфекции, выявлено 99 заболевших детей [9, 10]. По данным нашего стационара, доля респираторного микоплазмоза в структуре острых респираторных заболеваний возросла за 4 года с 10,9% до 27,4%. В 2013 году были зафиксированы вспышки респираторного микоплазмоза в трех районах Воронежской области.
Цель исследования
Изучить особенности течения микоплазменных пневмоний при вспышках и спорадических заболеваниях.
Материалы и методы
Под нашим наблюдением находилось 55 детей с микоплазменной пневмонией из очага инфекции и 90 детей с различными формами респираторного микоплазмоза при спорадической заболеваемости, поступившие в стационар за последние три года.
Всем детям проводилось общеклиническое исследование, биохимическое исследование крови, рентгенография органов грудной клетки. Этиология заболевания подтверждалась методом ПЦР – выявление ДНК микоплазмы в мазках из зева и носа, цитоскопией мазков из зева и носа, серологическими методами: определением IgM и IgG к хламидиям и микоплазме (savyon diagnostics версия М1262-01Е09-07/09). Исследование проводилось при госпитализации на 8,6±1,7 день заболевания, при этом у 65,5% при первичном обследовании специфические антитела не обнаруживались, при повторном исследовании крови на 12,0±2,4 день у всех пациентов определялись IgM к M. Pneumonia. Статистический анализ проводился с помощью лицензионных программных средств Microsoft Word, Microsoft Excel.
Результаты и обсуждение
В октябре 2013 года в одной из школ Воронежской области зафиксирована вспышка микоплазменной инфекции. На прилегающей к школе территории имел место резкий скачок заболеваемости детей острыми респираторными инфекциями, о чем свидетельствует рост вызовов участкового педиатра на дом. На отдельных участках их количество увеличилось на 73,5%. В стационар направлялись дети с локальными аускультативными изменениями со стороны легких, не отвечающие на проводимую терапию полусинтетическими пенициллинами и цефалоспоринами и с очаговыми инфильтративными изменениями на рентгенограмме органов грудной клетки. Поступление детей в стационар имело групповой характер, за сутки госпитализировалось до 10 человек, в течение 8 дней поступило 81,2% всех пациентов с лабораторно подтвержденной микоплазменной пневмонией. Среди них количество мальчиков и девочек было одинаковым. Пневмонии встречались во всех возрастных группах, но наиболее часто – среди детей среднего школьного звена, 58,1% (32). В начале заболевания у 30,9% (17) детей отмечалось повышение температуры до фебрильных цифр. У трети больных температура в начале болезни и на всем ее протяжение также не превышала субфебрильных значений. У остальных детей имело место постепенное нарастание температуры в течение 4±0,9 дней, от субфебрилитета до гипертермических цифр. В среднем лихорадка сохранялась 7,04±2,8 дней. У одного ребенка пневмония протекала на фоне нормальной температуры в течение всего периода болезни. Явлений токсикоза не отмечалось, интоксикация была умеренно выражена, а у трети детей, даже на фоне гипертермии, самочувствие не страдало. Однако большинство детей с начала заболевания жаловались на быструю утомляемость, нарушение аппетита. У всех пациентов с первого-второго дня болезни регистрировался сухой кашель. У большинства детей (69%) имело место постепенное усиление кашля в виде нарастания частоты и интенсивности, преимущественно кашель возникал в ночные часы, к моменту разгара он носил «коклюшеподобный» характер. У 30,9% пациентов с первых дней кашель был сильным, мучительным, непродуктивным.
Половину заболевших детей (54,5%) беспокоили головные боли, которые преимущественно (72,7%) возникали в первые два дня болезни. У каждого третьего ребенка с головной болью регистрировалась повторная рвота, что не исключает поражения центральной нервной системы при микоплазмозе, но из-за отсутствия менингеального симптомо-комплекса и кратковременности клинических проявлений (1-2 дня), люмбальная пункция не проводилась.
Катарально-респираторный синдром проявлялся в виде катарального фарингита у 20% (11) детей, ринита –25,4% (14),ларингита –30,9%, отита или евстахиита –27,3% пациентов (15).
К 4-6 дню заболевания у детей выявлялись аускультативные изменения в легких, у 54,5% было ослабление дыхания, у 78,2% выслушивалась крепитация или влажные мелкопузырчатые хрипы.
Явлений дыхательной недостаточности у наблюдаемых детей не было, бронхообструктивный синдромитакже не диагностировался. При анализе рентгено-графических данных у одного ребенка выявлен очаговый процесс, поражение одного сегмента легкого было у 33,7%, наиболее часто встречались полисегментарные пневмонии –52,1%, инфильтративные изменения доли легкого выявлялись у 10,6% детей, у одного ребенка развился плеврит на фоне полисегментарной пневмонии.
Из внелегочных проявлений респираторного микоплазмоза отмечались миалгии –11,0% (6), артралгии –20% (11), у 34,4% (19) отмечены нарушения со стороны желудочно-кишечного тракта в первые дни болезни: гастрит –9% (5), энтерит–20 % (11), явления гастроэнтерита –5,4% (3). Результат комплексного обследования на энтеропатогенные бактериальные и вирусные агенты был отрицательным.
Со стороны периферической крови умеренный лейкоцитоз (до 13,1×109/л) регистрировался только у 7,2% (4) детей, у остальных количество лейкоцитов соответствовало возрастной норме, но у всех больных отмечен резкий сдвиг лейкоцитарной формулы влево, значительное ускорение СОЭ –максимально до 44 мм/ч. Основные биохимические показатели крови не были изменены, у 65,4% (36) детей имело место 2–-х кратное повышение уровня С-реактивного белка относительно нормы
Клиническое и рентгенологическое выздоровление наступало на 12,7±2,5 день пребывания в стационаре. У 9% (5) детей разрешение пневмонии затягивалось до 19,2±1,7 дней.
Проведен анализ спорадических случаев респираторного микоплазмоза у 90 госпитализированных детей. Заболевание протекало в форме пневмонии у 27,8% (25) детей. Среди них мальчиков и девочек было 60 и 40% соответственно. Наиболее часто микоплазменную пневмонию переносили дети школьного возраста, младший школьный возраст – 32%, дети среднего звена – 28%. Дети первого года жизни и в возрасте от года до трех лет составили по 8%, от 3 до 7 лет – 20%. Наиболее выраженная сезонность отмечалась в 2012/13 годах – 55% детей с респираторным микоплазмозом госпитализированы в октябре-сентябре, в то время как на другие месяцы пришлось не более 7,5% детей. В 2014 году отмечалось расширение сезона, респираторный микоплазмоз с одинаковой частотой встречался в осеннее и зимнее время – по 35%.
Дети с микоплазменной пневмонией госпитализировались на 6,24±2,3день болезни. У всех детей имело место повышение температуры тела: у 56% – до гипертермических цифр, у 32% – в пределах фебрильных цифр, субфебрилитет был у 8% детей, у одного ребенка заболевание протекало на фоне нормальной температуры. Продолжительность лихорадки составила 7,95±3,1 сутки. Катаральный синдром встречался у 28% и проявлялся в виде ринита. У половины пациентов (52%) в дебюте заболевания начинался сухой кашель, который к 5,8±2,1 дню становился влажным, продуктивным. У 44% с первого дня болезни формировался влажный, продуктивный кашель, который сохранялся в течение 8,3±3,2 дней.
У большинства детей при поступлении отмечались клинические проявления дыхательной недостаточности: у 68% (17) – первой степени, у 8% (2) – второй степени. У 24% (6) детей диагностированы явления бронхообструкции.
При поступлении только у одного ребенка не было аускультативных изменений со стороны легких, у остальных детей регистрировались сухие или влажные мелкопузырчатые хрипы, крепитация. Изменения сохранялись в течение 6,76±4,3 дней. При проведении рентгенографии органов грудной клетки у 32% детей было сегментарное поражение легких, у 36% – полисегментарная пневмония, у 28% – долевая пневмония, у одного ребенка была поли-сегментарная плевропневмония.
При сравнении течения микоплазменной пневмонии у детей дошкольного и школьного возраста, была получена достоверная разница только по частоте развития явлений дыхательной недостаточности: 89% – у детей дошкольного возраста и 68,75% – у школьников (р<0,05).
Только у одного ребенка было поражение тонкого кишечника, у двух детей отмечалась пятнисто-папулезная экзантема, при этом аллергологический анамнез у данных детей отягощен не был. Анализ лабораторных данных показал, что в общем анализе крови у 40% детей выявлен лейкоцитоз, у 76% (19) – отмечался сдвиг лейкоцитарной формулы влево, у всех детей имела место резко повышенная скорость оседания эритроцитов, максимально до 53 мм/ч. В общем анализе мочи у трети детей выявлена транзиторная лейкоцитурия. Выздоровление детей наступало на 13,96±4,1 день пребывания в стационаре.
Заключение
Таким образом, можно отметить, что респираторный микоплазмоз имеет выраженную осенне-зимнюю сезонность. Наиболее часто заболевание развивается у детей школьного возраста, преимущественно среднего звена (11–15 лет). При респираторном микоплазмозе серологическое обследование методом ИФА целесообразно проводить не ранее 11-12 дня болезни, так как у 65,5% обследованных детей на первой неделе заболевания специфические антитела класса М выявить не удается.
Для микоплазменной пневмонии не характерен выраженный токсикоз, хотя заболевание преимущественно протекает с фебрильной температурой. Особенностью клинических проявлений микоплазменной пневмонии в описанной нами вспышке является отсутствие бронхообструктивного синдрома и дыхательной недостаточности, частое развитие внелегочных проявлений микоплазмоза. Поступление детей в этот же эпидемический сезон при спорадической заболеваемости показало более тяжелое течение респираторного микоплазмоза с частым развитием при пневмонии обструкции бронхов, дыхательной недостаточности, особенно у дошкольников. При этом внелегочные проявления инфекции встречались в 4 раза реже, чем при вспышке в детском коллективе. Проведенный анализ свидетельствует о том, что при вспышечной заболеваемости возможно более детальное изучение всех проявлений болезни. В то же время при обследовании госпитализированных детей при спорадической заболеваемости чаще выявляются наиболее тяжелые клинические синдромы.
Литература
- Кокорева С.П., Сахарова Л.А., Куприна Н.П. Этиологическая
характеристика и осложнения острых респираторных
инфекций у детей. Вопросы современной педиатрии. 2008.
Т. 7. № 1. С. 47-50.
- Bartlett J. G. Management of respiratory tract infection – 3rd. –
Philadelphia, 2001. – P. 178–182.
- Кокорева С.П., Трушкина А.В., Разуваев О.А. Оптимизация
этиотропной терапии острых респираторных вирусных
инфекций у детей. Детские инфекции. 2013. Т. 12. № 4.С. 42-46.
- Fraaij P. L. A., Visser E. G., Hoogenboezem T., Hop W. C. J., van
Adricgem L. N. A., Weber F., Moll H. A., Broekman B., Berger M.
Y., van Rijsoort-Vos T., van Belkum A., Schutten M., van Rossum
- M. C. Published: Carriage of Mycoplasma pneumoniae in
the Upper respiratory Tract of Symptomatic and Asymptomatic
Children: An Observational Study: May 14, 2013. DOI: 10.1371/
journal.pmed.1001444
- Hauksdottir G.S., Jonsson T., Sigurdardottir V., Love A.
Seroepidemiology of Mycoplasma pneumonia infections in
Iceland // Scan. J. Epidemiol. 1998, 30(2): 177-80.
- Ito I., Ishida T., Osawa M., Arita M., et al. Culturally verified
Mycoplasma pneumonia in Japan: a long-term observation from
1979-1999. Epidemiol. Infekt. Dis. 1998, 30 (2): 177-80.
- Козлов Р.С. Пневмококки: уроки прошлого – взгляд в будущее.
– Смоленск: МАКМАХ, 2010 – 128 с.
- Нагаева Т.А., Фурманова Е.А., Пономарева Д.А. Роль
матриксной металлопротеиназы-9 при патологии
миндалин и аденоидов у часто болеющих детей. Лечение и
профилактика 2015, №1(13), с. 48-51.
- Целипанова Е.Е., Россошанская Н. В. Вспышки пневмонии
микоплазменной этиологии у детей Московской области.
Лечение и профилактика. 2014, №4(12), с. 64-66.
- Гадлия Д.Д., Бакрадзе М.Д., Таточенко В.К., Петровская
М. ., Хохлова Т.А., Зубкова И. В. Вспышка микоплазменной
инфекции Фарматека № 11 (304), 2015 с. 63-67.
Рубрики: Статьи для докторов
Mycoplasma pneumoniae Infections — HealthyChildren.org
Некоторые легочные инфекции, включая многие случаи легкой пневмонии (также называемой ходячей пневмонией), вызываются организмом, называемым Mycoplasma pneumoniae. Он передается от человека к человеку с выделениями, такими как мокрота из дыхательных путей, и имеет инкубационный период от 2 до 3 недель. Передача этого организма обычно происходит при тесном контакте. Вспышки произошли и являются обычным явлением в летних лагерях и колледжах, а также внутри домашних хозяйств среди членов семьи.
В то время как M pneumoniae инфекции редко встречаются у детей младше 5 лет, они являются основной причиной пневмонии у детей школьного возраста и молодых людей. Эпидемии этого заболевания в общинах происходят каждые 4-7 лет.
Признаки и симптомы
M pneumoniae Инфекции вызывают симптомы, обычно легкие. У некоторых детей со временем они могут ухудшиться. Наиболее частые симптомы:
.
- Бронхит
Инфекции верхних дыхательных путей, включая боль в горле, а иногда и инфекции уха.
У детей с этой инфекцией также может быть высокая температура, продолжительная слабость, а в некоторых случаях — головные боли и сыпь.Их кашель может измениться с сухого на мокрый. В редких случаях у детей может развиться круп и инфекция носовых пазух (синусит).
Когда звонить педиатру
Если эти симптомы, включая жар, длятся более нескольких дней, обратитесь к педиатру.
Как ставится диагноз?
Ваш педиатр проведет медицинское обследование вашего ребенка. Врач может назначить анализ крови на антитела к M pneumoniae или холодовых агглютининах, , которые представляют собой особый тип антител.Разрабатываются специальные тесты для выявления микроорганизмов в пробах из горла и дыхательных путей, но они пока недоступны.
Лечение
В большинстве случаев бронхит и заболевания верхних дыхательных путей, связанные с инфекциями M pneumoniae , протекают в легкой форме и проходят самостоятельно без лечения антибиотиками. Однако антибиотики, такие как эритромицин, азитромицин или доксициклин, могут быть назначены при более серьезных симптомах, связанных с пневмонией и ушными инфекциями.
Каков прогноз?
Эта инфекция часто вызывает хрипы у детей с астмой или реактивными дыхательными путями. Большинство людей полностью выздоравливают от этой инфекции, даже если не используются антибиотики. Смертность довольно низкая.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать лечение по-разному, исходя из индивидуальных фактов и обстоятельств.
Детские микоплазменные инфекции: основы практики, патофизиология, эпидемиология
Баум С.Г. Введение в микоплазмы и уреаплазмы. Манделл Г.Л., Беннетт Дж. Э., Долин Р., ред. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . Седьмое изд. Филадельфия, Пенсильвания: Эльзевьер Черчилль Ливингстон; 2010. 2477-81.
Санчес-Варгас FM, Гомес-Дуарте О.Г. Mycoplasma pneumoniae — появляющийся внелегочный возбудитель. Clin Microbiol Инфекция . 2008 14 февраля (2): 105-17. [Медлайн].
Аткинсон Т.П., Балиш М.Ф., Уэйтс КБ. Эпидемиология, клинические проявления, патогенез и лабораторное определение инфекций Mycoplasma pneumoniae. FEMS Microbiol Ред. . 2008, ноябрь 32 (6): 956-73. [Медлайн].
Grosher M, Alexandre M, Poszepczynska-Guigne E, Revuz J, Roujeau J. Рецидивирующая мультиформная эритема в сочетании с рецидивирующими инфекциями Mycoplasma pneumoniae. Дж. Акада Дерматол . 2007. 56: S118-9.
Guleria R, Nisar N, Chawla TC, Biswas NR. Mycoplasma pneumoniae и осложнения со стороны центральной нервной системы: обзор. Дж. Лаборатория Клин Мед. . 2005 Август 146 (2): 55-63. [Медлайн].
Манвани Н.С., Баласубраманиан С., Дханалакшми К., Сумант А. Синдром Стивенса Джонсона в сочетании с микоплазменной пневмонией. Индийский Дж. Педиатр . 2012 августа 79 (8): 1097-9.
Tam CC, O’Brien SJ, Rodrigues LC.Инфекции гриппа, Campylobacter и Mycoplasma и госпитализация по поводу синдрома Гийена-Барре, Англия. Emerg Infect Dis . 2006 12 (12) декабря: 1880-7. [Медлайн].
Нарита М. Патогенез внелегочных проявлений инфекции Mycoplasma pneumoniae с особым упором на пневмонию. J Заразить Chemother . 2010 июн. 16 (3): 162-9.
Банерджи Б., Петерсен К. Психоз после микоплазменной пневмонии. Мил Мед . 2009 Сентябрь 174 (9): 1001-4.
Шах СС. Mycoplasma pneumoniae. Лонг СС, Пикеринг Л.К., Пробер К.Г. Принципы и практика детских инфекционных болезней . 4-е изд. Филадельфия, Пенсильвания: Эльзевьер Черчилль Ливингстон; 2012. 993-998.
Гольденберг Р.Л., Эндрюс В.В., Гёпферт А.Р. и др. Исследование преждевременных родов в Алабаме: культуры Ureaplasma urealyticum и Mycoplasma hominis из пуповинной крови у очень недоношенных новорожденных. Am J Obstet Gynecol . 2008, январь 198 (1): 43.e1-5. [Медлайн].
Sanchez PJ, Seigel JD. Генитальные микоплазмы. Макмиллан Дж. А., Фейгин Р. Д., ДеАнгелис К. Д., Джонс М. Д., ред. Педиатрия Оски: принципы и практика . 4-е изд. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс; 2006. 539-41.
Андерсен Б., Соколовски И., Остергаард Л. и др. Mycoplasma genitalium: распространенность и поведенческие факторы риска в общей популяции. Заражение, передаваемое половым путем . Июнь 2007. 83 (3): 237-41.
Viscardi RM. Виды уреаплазмы: роль в неонатальных заболеваемости и исходах. Arch Dis Child Fetal Neonatal Ed . Январь 2014 г. 99 (1): F87-92.
Дон М., Канчиани М., Корппи М. Внебольничная пневмония у детей: сколько лет? Какие новости?. Акта Педиатр . Ноябрь 2010. 99 (11): 1602-8.
Уэйтс КБ, Аткинсон Т.П. Роль микоплазмы при инфекциях верхних дыхательных путей. Карр Инфекция Дис Репа . 2009 Май. 11 (3): 198-206.
Yamada M, Buller R, Bledsoe S, Storch GA. Рост числа устойчивых к макролидам Mycoplasma pneumoniae в центральной части США. Педиатр Инфекция Дис. J . Апрель 2012. 31 (4): 409-0.
Лю К.Л., Цао Дж. Г., Чжоу П. и др. [Вспышка микоплазменной пневмонии в детском саду]. Чжунхуа Ю Фанг И Сюэ За Чжи . Мар 2009. 43 (3): 206-9.
Newcomb DC, Peebles RS Jr.Ошибки и астма: другое заболевание ?. Proc Am Thorac Soc . 1 мая 2009 г. 6 (3): 266-71.
Hassan J, Irwin F, Dooley S, Connell J. Инфекция Mycoplasma pneumoniae в педиатрической популяции: анализ растворимых иммунных маркеров как факторов риска астмы. Хум Иммунол . Декабрь 2008 г. 69 (12): 851-5.
Пападопулос Н.Г., Христодулу И., Роде Г. и др. Вирусы и бактерии при обострениях астмы — систематический обзор GA² LEN-DARE. Аллергия . Апрель 2011. 66 (4): 458-68.
Корппи М. Бактериальные инфекции и детская астма. Immunol Allergy Clin North Am . Ноябрь 2010. 30 (4): 565-74.
Guilbert TW, Denlinger LC. Роль инфекции в развитии и обострении астмы. Эксперт Рев Респир Мед . Февраль 2010. 4 (1): 71-83.
Miller ST. Как я лечу острый грудной синдром у детей с серповидно-клеточной анемией. Кровь . Май 2011. 117 (20): 5297-305.
Manhart LE, Holmes KK, Hughes JP, Houston LS, Totten PA. Mycoplasma genitalium среди молодых людей в США: возникающая инфекция, передаваемая половым путем. Am J Общественное здравоохранение . Июнь 2007. 97 (6): 1118-25.
Юн Ю.С., Ли К.Ю. Пневмония Mycoplasma pneumoniae у детей. Корейский J Pediatr . Февраль 2012. 55 (2): 42-7.
Suzuki Y, Itagaki T, Seto J, Kaneko A, Abiko C, Mizuta K и др.Вспышка устойчивой к макролидам Mycoplasma pneumoniae в общине в Ямагате, Япония, в 2009 г. Pediatr Infect Dis J . Март 2013. 32 (3): 237-40.
Inchley CS, Berg AS, Vahdani Benam A, Kvissel AK, Leegaard TM, Nakstad B. Mycoplasma Pneumoniae: Популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Педиатр Инфекция Дис. J . 2017 Октябрь, 36 (10): 930-936. [Медлайн].
Корппи М.Лечение бактериальных инфекций у детей с астмой. Expert Rev Anti Infect Ther . Сентябрь 2009 г. 7 (7): 869-77.
Christie LJ, Honarmand S, Talkington DF, Gavali SS, Preas C, Pan CY. Детский энцефалит: какова роль Mycoplasma pneumoniae ?. Педиатрия . 2007 августа 120 (2): 305-13.
Cairns C, Adler K, Moss T, Crews A, Chu H, Kraft M. Mycoplasma pneumoniae увеличивает выработку муцина в дыхательных путях у астматиков. Acad Emerg Med . 2007. 14: S193.
Diederen BM, van der Valk PD, Kluytmans JA, Peeters MF, Hendrix R. Роль атипичных респираторных патогенов в обострениях хронической обструктивной болезни легких. Eur Respir J . Август 2007. 30 (2): 240-4.
Kenny GE. Генитальные микоплазмы: виды Mycoplasma genitalium, Mycoplasma hominis и Ureaplasma. Манделл Г.Л., Беннетт Дж. Э., Долин Р., ред. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета .7-е изд. Филадельфия, Пенсильвания: Эльзевьер Черчилль Ливингстон; 2010. Vol 2: 2491-5.
Росс Дж. Д., Дженсен Дж. С.. Mycoplasma genitalium как инфекция, передающаяся половым путем: значение для скрининга, тестирования и лечения. Заражение, передаваемое половым путем . Август 2006 г. 82 (4): 269-71.
Kos L, Galbraith SS, Lyon VB. Язвы влагалища при острой микоплазменной инфекции. Дж. Акада Дерматол . 2007. 56: S117-8.
Тейлор-Робинсон Д.Роль микоплазм в исходе беременности. Лучшая практика клиники акушерства Gynaecol . 2007 июн., 21 (3): 425-38.
Тош А.К., Ван дер Пол Б., Фортенберри Д.Д. и др. Mycoplasma genitalium у женщин-подростков и их партнеров. Дж. Здоровье подростков . 2007 май. 40 (5): 412-7.
Здродовская-Стефанов Б., Клосовская В.М., Осташевская-Пухальская I, Булхак-Козиол В., Котович Б. Инфекции Mycoplasma hominis и Ureaplasma urealyticum при мужском уретрите и его осложнениях. Адв. Мед. Наук . 2006. 51: 254-7.
Grzesko J, Elias M, Manowiec M, Gabrys MS. Генитальные микоплазмы — заболеваемость и возможное влияние на фертильность человека. Med Wieku Rozwoj . 2006. 10: 985-92.
Daxboeck F. Инфекции центральной нервной системы Mycoplasma pneumoniae. Curr Opin Neurol . 2006. 19: 374-8.
Хата А., Хонда Ю., Асада К., Сасаки Ю., Кенри Т., Хата Д. Менингит Mycoplasma hominis у новорожденного: отчет о болезни и обзор. J Заражение . Октябрь 2008 г. 57 (4): 338-43.
Hsieh SC, Kuo YT, Chern MS, Chen CY, Chan WP, Yu C. Микоплазменная пневмония: клинические и рентгенологические особенности у 39 детей. Педиатр Интерн. . Июнь 2007. 49 (3): 363-7.
Нисар Н., Гулерия Р., Кумар С. и др. Mycoplasma pneumoniae и ее роль при астме. Постградская медицина J . 2007 февраль 83 (976): 100-4.
Осман Н., Исаакс Д., Дейли А.Дж., Кессон А.М.Инфекция Mycoplasma pneumoniae в клинических условиях. Педиатр Интерн. . 2008 Октябрь 50 (5): 662-6.
Гарсия С., Угальде Е., Монтеагудо I, Саез А., Агуэро Дж., Мартинес-Мартинес Л. и др. Выделение Mycoplasma hominis у тяжелобольных пациентов с легочными инфекциями: клинико-микробиологический анализ в отделении интенсивной терапии. Центр интенсивной терапии . 2007. 33: 143-7.
Schalock PC, Dinulos JG, Pace N, Schwarzenberger K, Wenger JK.Многоформная эритема, вызванная инфекцией Mycoplasma pneumoniae, у двоих детей. Педиатр дерматол . Ноябрь-декабрь 2006 г. 23 (6): 546-55.
Латч К., Гиршик Х. Дж., Абеле-Хорн М. Синдром Стивенса-Джонсона без поражения кожи. J Med Microbiol . Dec 2007. 56 (Pt 12): 1696-9.
Веттер Д.А., Камиллери MJ. Клинические, этиологические и гистопатологические особенности синдрома Стивенса-Джонсона в течение 8-летнего периода в клинике Мэйо. Февраль 2010 г .; Mayo Clin Proc . Февраль 2010. 85 (2): 131-8.
CDC. Вспышка узловатой эритемы неизвестной причины — Нью-Мексико, ноябрь 2007 г. — январь 2008 г. MMWR Morb Mortal Wkly Rep . 2009 11 декабря. 58 (48): 1347-51.
Кано И., Мицуяма Ю., Хирахара К., Шиохара Т. Инфекция, вызванная микоплазмой пневмонии, узловатой эритемой, анафилактоидной пурпурой и острой крапивницей у 3 человек в одной семье. Дж. Акада Дерматол . 2007 Август.57 (2 доп.): S33-5.
Fearon D, Hesketh EL, Mitchell AE, Grimwood K. Инфекция Mycoplasma pneumoniae, осложненная пневмомедиастинумом и тяжелым мукозитом. J Детский педиатр . 2007 май. 43 (5): 403-5.
Wu CC, Kuo HC, Yu HR, Wang L, Yang KD. Связь острой крапивницы с инфекцией Mycoplasma pneumoniae у госпитализированных детей. Ann Allergy Asthma Immunol . 2009 август 103 (2): 134-9.
Smith LG.Микоплазменная пневмония и ее осложнения. Инфекция Dis Clin North Am . 2010 24 марта (1): 57-60.
Нарита М. Патогенез неврологических проявлений инфекции Mycoplasma pneumoniae. Педиатр Нейрол . 2009 Сентябрь 41 (3): 159-66.
Аслан М., Касапкопур О, Ясар Х и др. Вызывают ли инфекции ювенильный идиопатический артрит? Ревматол Инт . 2011 Февраль 31 (2): 215-20.
Адзумагава К., Камбара Ю., Мурата Т., Тамай Х.Четыре случая артрита, связанного с инфекцией Mycoplasma pneumoniae. Педиатр Интерн. . Август 2008. 50 (4): 511-3.
Harjacek M, Ostojic J, Djakovic Rode O. Юношеские спондилоартропатии, связанные с инфекцией Mycoplasma pneumoniae. Клин Ревматол . 2006 июл.25 (4): 470-5.
Хан Ф.Ю., Ясин А. М. Mycoplasma pneumoniae, связанная с тяжелой аутоиммунной гемолитической анемией: отчет о болезни и обзор литературы. Зараженный Заразить Дис .Февраль 2009. 13 (1): 77-9.
Гюрсель О, Алтун Д, Атай АА, Бедир О, Курекчи АЕ. Инфекция Mycoplasma pneumoniae, связанная с панцитопенией: описание случая. J Педиатр Hematol Oncol . 2009 31 октября (10): 760-2.
Witmer CM, Steenhoff AP, Shah SS, Raffini LJ. Mycoplasma pneumoniae, инфаркт селезенки и преходящие антифосфолипидные антитела: новая ассоциация ?. Педиатрия . Январь 2007 г. 119 (1): e292-5.
Турман К.А., Уолтер Н.Д., Шварц С.Б., Митчелл С.Л., Диллон М.Т., Бауман А.Л.Сравнение лабораторных диагностических процедур для выявления Mycoplasma pneumoniae во вспышках заболеваний в сообществе. Клин Инфекция Дис . 1 мая 2009 г. 48 (9): 1244-9.
Nir-Paz R, Michael-Gayego A, Ron M, Block C. Оценка восьми коммерческих тестов на антитела Mycoplasma pneumoniae при отсутствии острой инфекции. Clin Microbiol Инфекция . Июль 2006. 12 (7): 685-8.
Лю ФК, Чен ПЙ, Хуанг Ф, Цай ЧР, Ли ЦЙ, Ван ЛК.Быстрая диагностика инфекции Mycoplasma pneumoniae у детей с помощью полимеразной цепной реакции. J Microbiol Immunol Infect . Декабрь 2007. 40 (6): 507-12.
Ким Н.Х., Ли Дж.А., Ын Б.В., Шин С.Х., Чанг Э.Х., Пак К.В. Сравнение полимеразной цепной реакции и теста на антитела к непрямой агглютинации частиц для диагностики пневмонии Mycoplasma pneumoniae у детей во время двух вспышек. Педиатр Инфекция Дис. J . 2007 октября, 26 (10): 897-903.
Nilsson AC, Bjorkman P, Persson K.Полимеразная цепная реакция лучше серологии для диагностики острой инфекции Mycoplasma pneumoniae и выявляет высокий уровень стойкой инфекции. BMC Microbiol . 2008. 8:93.
Морозуми М., Такахаши Т., Убуката К. Устойчивые к макролидам Mycoplasma pneumoniae: характеристики изолятов и клинические аспекты внебольничной пневмонии. J Заразить Chemother . Апрель 2010. 16 (2): 78-86.
Принципи Н, Эспозито С.Устойчивые к макролидам Mycoplasma pneumoniae: ее роль в респираторной инфекции. J Антимикробный препарат Chemother . 2013 Март 68 (3): 506-11.
Ли X, Аткинсон Т.П., Хагуд Дж., Макрис С., Даффи Л. Б., Уэйтс КБ. Возникающая устойчивость к макролидам в Mycoplasma pneumoniae у детей: обнаружение и характеристика устойчивых изолятов. Педиатр Инфекция Дис. J . Август 2009. 28 (8): 693-6.
Чжэн Х, Ли С., Селваранган Р., Цинь Икс, Тан Ю.В., Стайлз Дж. И др.Устойчивые к макролидам Mycoplasma pneumoniae, США 1 . Emerg Infect Dis . 2015 21 августа (8): 1470-1472. [Медлайн]. [Полный текст].
Шамберт-Луар С., Уаши М., Коллинз К., Эврард П., Серве Л. Немедленное облегчение симптомов энцефалита Mycoplasma pneumoniae после внутривенного введения иммуноглобулина. Педиатр Нейрол . Ноябрь 2009. 41 (5): 375-7.
Ямазаки Т., Сасаки Т., Такахата М. Активность гареноксацина против чувствительной к макролидам и резистентной Mycoplasma pneumoniae. Антимикробные агенты Chemother . Июнь 2007. 51 (6): 2278-9.
Микоплазменная инфекция (ходячая пневмония, атипичная пневмония)
Последняя редакция: октябрь 2011 г.
Что такое микоплазменная инфекция?
Микоплазменная инфекция — респираторное заболевание, вызываемое Mycoplasma pneumoniae, микроскопическим организмом, связанным с бактериями.
Кто заражается микоплазмой?
Заболеть может каждый, но чаще всего поражает детей старшего возраста и молодых людей.
Когда возникают микоплазменные инфекции?
Микоплазменные инфекции возникают спорадически в течение года. Также могут происходить массовые вспышки среди населения. Инфекция микоплазмой чаще всего встречается в конце лета и осенью.
Как распространяется микоплазма?
Микоплазма передается через контакт с каплями из носа и горла инфицированных людей, особенно когда они кашляют и чихают. Считается, что передача инфекции требует длительного тесного контакта с инфицированным человеком.Распространение в семьях, школах и учреждениях происходит медленно. Период заразности, вероятно, составляет менее 10 дней, а иногда и дольше.
Каковы симптомы микоплазменной инфекции?
Типичные симптомы включают жар, кашель, бронхит, боль в горле, головную боль и усталость. Частым результатом микоплазменной инфекции является пневмония (иногда называемая «ходячей пневмонией», потому что она обычно легкая и редко требует госпитализации). Также могут возникнуть инфекции среднего уха (средний отит).Симптомы могут сохраняться от нескольких дней до более месяца.
Как скоро после контакта появляются симптомы?
Симптомы обычно появляются через две-три недели после заражения, но могут варьироваться от одной до четырех недель.
Как диагностируется микоплазменная инфекция?
Микоплазменная инфекция обычно диагностируется на основании типичных симптомов и рентгенологического исследования грудной клетки. Могут быть сданы анализы крови.
Делает ли перенесенное заражение микоплазмой иммунитетом человека?
Иммунитет после заражения микоплазмой действительно возникает, но не сохраняется на всю жизнь.Известно, что случаются вторичные инфекции, хотя они могут быть более легкими. Продолжительность иммунитета неизвестна.
Как лечить микоплазменную инфекцию?
Антибиотики, такие как эритромицин, кларитромицин или азитромицин, являются эффективным средством лечения. Однако, поскольку микоплазменная инфекция обычно проходит сама по себе, лечение легкими симптомами антибиотиками не всегда необходимо.
Что можно сделать, чтобы предотвратить распространение микоплазмы?
В настоящее время нет вакцин для предотвращения заражения микоплазмой и нет надежно эффективных мер борьбы.Как и при любом респираторном заболевании, все люди должны соблюдать гигиену рук и прикрывать нос и рот при кашле или чихании.
Рациональный пошаговый подход к Mycoplasma pneumoniae pneumoniae у детей
Доступно онлайн 17 октября 2020 г.
Реферат
Mycoplasma pneumoniae — распространенный патоген, вызывающий внебольничную пневмонию. В прошлом M. pneumoniae были чувствительны к макролидным антибиотикам, а M. pneumoniae pneumonia (MPP) обычно была доброкачественным и самоизлечивающимся заболеванием.Однако, несмотря на использование соответствующих антибиотиков, может наблюдаться стойкая лихорадка и клиническое ухудшение, ведущие к тяжелому заболеванию. Два основных сложных состояния, с которыми можно столкнуться клинически, — это резистентный к макролидам MPP и рефрактерный MPP. Что касается эпидемий на Тайване, то до 2017 года средний уровень устойчивости к макролидам был ниже 30%. Примечательно, что с 2018 года распространенность устойчивых к макролидам MPP на Тайване быстро увеличилась. Устойчивый к макролидам MPP показывает стойкую лихорадку и / или отсутствие радиологической регрессии к макролидным антибиотикам и может даже прогрессировать до тяжелой и сложной пневмонии.Тетрациклины (доксициклин или миноциклин) или фторхинолоны являются альтернативными препаратами для лечения резистентных к макролидам MPP. Рефрактерный MPP характеризуется чрезмерным иммунным ответом против патогена. В этом контексте кортикостероиды были предложены в качестве иммуномодулятора для подавления сверхактивной иммунной реакции хозяина. Чрезмерное употребление макролидов может способствовать развитию устойчивости к макролидам и, как следствие, повышению уровня MPP, устойчивого к макролидам. Отсроченное эффективное противомикробное лечение связано с длительным и / или более тяжелым заболеванием.Таким образом, важны правильное назначение антибиотиков, а также быстрая и точная диагностика MPP. Точная начальная точка, доза и продолжительность иммуномодулятора еще не установлены. Мы обсуждаем эти важные вопросы в этом обзоре.
Ключевые слова
M. pneumoniae пневмония
Устойчивость к макролидам
Рефрактерная микоплазменная пневмония
Кортикостероид
Сокращения
MPP
M.pneumoniae пневмония
CAP
внебольничная пневмония
RMPP
рефрактерная Mycoplasma pneumoniae pneumonia
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотацию
© 2020 Тайваньское общество микробиологии. Опубликовано Elsevier Taiwan LLC.
Рекомендуемые статьи
Ссылки на статьи
Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae
Абстрактные
Фон
Mycoplasma pneumoniae — частая причина внебольничной пневмонии у детей старшего возраста.Легочные и внелегочные симптомы, связанные с M . Сообщается о pneumoniae инфекциях. М . pneumoniae — это в основном эпидемия в Дании с рецидивами каждые 4-7 тыс. лет.
Цели
Ретроспективно для описания эпидемиологии и клинических проявлений у младенцев и детей во время исследования M . pneumoniae эпидемия в 2010 и 2011 гг.
Методы
Все дети в возрасте до 16 лет, прошедшие тестирование на M . pneumoniae за период 01.02.2010–31.01.2012 включены. Медицинские карты, а также рентгенологические данные были проанализированы для всех детей с M . пневмония . Для части когорты был проведен апостериорный анализ сопутствующих вирусных инфекций.
Результаты
Из 746 детей
134 дали положительный результат на M . pneumoniae с помощью ПЦР или серологии. Положительные тесты были обнаружены у 65% детей семи лет и старше, у 30% детей от 2 до 6 лет и у 4% детей младше 2 лет.Сопутствующая вирусная инфекция была обнаружена в 27% исследованных образцов. Клиническими проявлениями были кашель, симптомы астмы и субфебрильная температура. Внелегочные симптомы были обычными и проявлялись в виде тошноты / рвоты у 33% детей и кожных проявлений у 25%. 84% детей сделали рентген грудной клетки, и у 94% из них были получены положительные результаты рентгенологического исследования.
Заключение
М . pneumoniae также поражали младенцев и детей младшего возраста, и симптомы были аналогичны инфекциям респираторными вирусами, но также наблюдались тяжелые инфекции нижних дыхательных путей.Во время надвигающейся эпидемии оценка внелегочных проявлений может быть полезной при диагностике M . pneumoniae инфекций.
Образец цитирования: Søndergaard MJ, Friis MB, Hansen DS, Jørgensen IM (2018) Клинические проявления у младенцев и детей с инфекцией Mycoplasma pneumoniae . PLoS ONE 13 (4):
e0195288.
https://doi.org/10.1371/journal.pone.0195288
Редактор: Оливер Шильдген, Kliniken der Stadt Köln gGmbH, ГЕРМАНИЯ
Поступила: 21 октября 2016 г .; Одобрена: 14 февраля 2018 г .; Опубликован: 26 апреля 2018 г.
Авторские права: © 2018 Søndergaard et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Участвующие отделения (педиатрическое отделение, больница Нордшелланд, Хиллерод, Дания и отделение клинической микробиологии, больница Херлев, Херлев, Дания) спонсировали это исследование, финансируя микробиологические анализы, которые проводились в дополнение к клиническим исследованиям и исследованиям. по заработной плате в MJS, MBF, DSH и IMJ.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Mycoplasma pneumoniae ( M . pneumoniae ) является важной причиной инфекций дыхательных путей, особенно у детей и молодых людей, и, по оценкам, является причиной до 30-40% внебольничных пневмоний. (CAP) [1–4].Легочные проявления — это, как правило, трахеобронхит и пневмония, сопровождающиеся кашлем, но также и хрипом. Считается, что маленькие дети не так восприимчивы к M . pneumoniae в школьном возрасте [5,6]. В Дании M . pneumoniae в основном эпидемия с частотой рецидивов каждые 4-7 -й год [7].
Дания испытала M . Эпидемия pneumoniae , пик которой пришелся на осень 2010 г. и снова на осень 2011 г.Statens Serum Institut (SSI), отвечающий за национальную систему эпиднадзора в Дании, охарактеризовал это как две волны одной и той же эпидемии [7].
Осознание того, что дети дошкольного возраста и даже младенцы могут быть восприимчивыми и иметь клинические симптомы из M . pneumoniae Инфекция , получившая развитие в последние годы, сообщается в исследованиях, проведенных в Европе и Австралии [8–14]. С клинической точки зрения важно установить, M . pneumoniae играет важную роль в развитии инфекций нижних дыхательных путей и обострений, подобных астме, у детей младшего и младшего возраста.В последние годы проблема коинфекций и бессимптомного носительства M . pneumoniae и, следовательно, избыточный диагноз M . pneumoniae с помощью ПЦР обсуждались [15].
Целью данного исследования было описание и характеристика модели M . pneumoniae в условиях стационара, а также для оценки возможных возрастных клинических проявлений у младенцев, детей младшего возраста и детей старшего возраста, госпитализированных и диагностированных с помощью M . pneumoniae инфекция. Исследование было начато после того, как мы испытали сдвиг в клинической картине нашего M . pneumoniae больных во время эпидемии. Литература в этой области обширна, с различными мнениями, как уже упоминалось, о патогенности бактерий и показаниях к лечению, а также о значении инфекций у детей дошкольного возраста. Наш отчет — еще один кирпичик в понимании этого возбудителя.
Материалы и методы
Мы разработали ретроспективный анализ всех детей младше 16 лет, поступивших в педиатрическое отделение больницы Нордшелланд, Хиллерод, Дания, которые были исследованы на предмет M . pneumoniae либо методом полимеразной цепной реакции (ПЦР), либо серологическим путем (тест на антитела M . pneumoniae и тест на холодовые агглютинины). Период исследования — с 01.02.2010 по 31.01.2012. Мы собрали результаты ПЦР и результаты образцов крови как в нашей местной микробиологической лаборатории (ПЦР), так и в SSI (ПЦР и серология). Данные сопоставлялись по номеру социального страхования, чтобы избежать двойной выборки. ПЦР проводилась на мазках из ротоглотки, которые хранились и транспортировались охлажденными в лабораторию.Диагностика М . pneumoniae был основан на коммерчески доступном наборе для ПЦР в реальном времени (RT-PCR) (Minerva Biolabs Venor R Mp Mycoplasma pneumoniae -Diagnostic Kit for qPCR type I), нацеленного на ген цитоадгезии P1. ПЦР представляла собой мультиплексный анализ, также нацеленный на Chlamydophila pneumoniae / psittaci . Анализ проводили в соответствии с описанием производителя. Короче говоря, 10 мкл образца добавляли к 14,4 мкл мастер-смеси, содержащей 14 мкл буфера, 0.2 мкл Taq-полимеразы и 0,2 мкл урацил-N-гликозилазы. ОТ-ПЦР выполняли в следующих условиях на аппарате Stratagene Mx 3005P RT-PCR: 10 минут при 95 ° C, затем 45 циклов по 30 секунд при 95 ° C, 30 секунд при 55 ° C и 30 секунд при 60 ° C. . М . pneumoniae обнаружен в фильтре FAM.
Серологические тесты были выполнены внешним коммерческим поставщиком (SSI) и основывались на M . pneumoniae специфические антитела IgM (MPT) вместе с холодовыми агглютининами (KAT).Титр как MPT, так и KAT выше или равный 64 считался положительным тестом. Поскольку титры KAT падают быстрее после перенесенной инфекции, его использовали для повышения вероятности продолжающейся инфекции. Подсчитано, что 95% людей в возрасте до 20 лет имеют положительные титры KAT в ответ на M . pneumoniae инфекция (тест-информация SSI).
Дети, у которых в течение трех месяцев были получены два или более положительных результата ПЦР-теста, рассматривались как один и тот же инфекционный эпизод и включались только один раз.
Детей направили врачи общей практики или отделение неотложной помощи больницы. Дежурный врач заказал M . pneumoniae отбор проб согласно клинической оценке.
Демографические и клинические данные были собраны для 134 детей, у которых был положительный результат теста на M . pneumoniae , согласно обзору медицинской карты. Карты 612 детей с отрицательными тестами не проверялись. Медицинский анамнез систематически просматривался с использованием компьютеризированных медицинских карт, радиологических отчетов и лабораторных отчетов.Анализируемые характеристики включали демографические данные (возраст, пол, история болезни до поступления), клинические проявления (легочные и внелегочные симптомы, клиническое обследование; частота дыхания, аускультация, температура, сатурация кислорода), рентгенологические данные, биохимия (С-реактивный белок ( СРБ), количество лейкоцитов при поступлении) сопутствующие инфекции, осложнения и лечение. Для анализа данных дети были разделены на возрастные группы: младше двух лет (далее в тексте — младенцы), от 2 до 6 лет и от 7 до 15 лет (дети школьного возраста).
Для дальнейшего ответа на вопрос о сопутствующих вирусных инфекциях был проведен апостериорный анализ исходного замороженного образца ротоглоточного мазка из 49 из M . pneumoniae положительных когорт были протестированы с помощью ПЦР с использованием коммерчески доступного набора (Biomerieux Respiratory MWS R-Gene range) для широкого спектра респираторных вирусов (включая респираторно-синцитиальный вирус (RSV), грипп A и B, метапневмовирус человека, риновирус , вирус парагриппа, коронавирус, бокавирус и аденовирус).Короче говоря, ПЦР выполняли в четырех двойных сплетениях; 10 мкл образца добавляли к 15 мкл основной смеси, содержащей буфер, обратную транскриптазу и смесь праймер / зонд. ОТ-ПЦР выполняли в следующих условиях на аппарате Stratagene Mx 3005P RT-PCR: 5 мин при 50 ° C, 15 мин при 95 ° C, затем 45 циклов по 10 секунд при 95 ° C, 40 секунд при 60 ° C. ° C и 25 секунд при 72 ° C. Al-мишени были обнаружены в фильтре FAM или HEX.
Образцы, положительные после более чем 35 Ct-циклов, были повторно оценены для подтверждения истинно положительного результата.
Этический комитет региона Ховедстаден (номер протокола: H-2-2012-132), а также Датское агентство по защите данных одобрили исследование. Это одобрение включало согласие на просмотр медицинских карт без информированного согласия пациентов.
Статистический анализ проводился в STATA 10.0, программных пакетах SPSS версии 22 и Microsoft Excell. Chi 2 -тест, точный критерий Фишера или тест Z-score использовался для анализа категориальных данных и двухвыборочного T-теста для числовых данных.Значение p <0,05 считалось значимым.
Результаты
Выводы эпидемиологии
Из 885 пациентов протестировано M . pneumoniae в период исследования, 139 были исключены из-за возраста (старше 15 лет), двойного отбора проб или повторных проб в течение трех месяцев. В исследование были включены 746 детей с инфекциями дыхательных путей (ИРО), и 134 ребенка имели положительный тест на M . пневмония .Из 740 M . pneumoniae ПЦР-анализов включены, 132 были положительными, а из 20 серологических тестов 3 были положительными. Четырнадцать детей были протестированы как с помощью ПЦР в реальном времени, так и с помощью серологии.
На рис. 1 показано количество детей, протестированных для M . pneumoniae и число положительных случаев по месяцам. Пик эпидемии пришелся на октябрь 2010 года и снова в октябрь-декабрь 2011 года. Число M . pneumoniae положительных случаев были 50 (из 386) в первом эпидемическом сезоне и 84 (из 360) во втором периоде эпидемии, со значительно более высокой частотой (0,13 против 0,23) положительных случаев в последнем сезоне. (p = 0,0002, chi 2 -тест).В целом 18% детей, протестированных на M. pneumonia, дали положительный результат.
Максимальная скорость M . pneumoniae положительных проб было у детей школьного возраста (65%), но особенно у детей дошкольного возраста (30%), и даже у шести детей в возрасте до двух лет (4%) было M . pneumoniae положительных тестов.
Клиническая картина, рентгенологические данные и лабораторные исследования
Характеристики пациентов с разбивкой по возрастным группам представлены в таблице 1.
Дети в возрасте до двух лет были госпитализированы значительно раньше после появления симптомов, чем дети более старшего возраста (p = 0,01, двухвыборочный t-критерий). 61% детей выписаны из стационара в день поступления.
Наиболее частым респираторным проявлением был кашель (100%) вместе с возрастной степенью хрипов (Таблица 1). При поступлении в больницу у 92% младенцев и детей был диагностирован эпизод болезненных симптомов со стороны легких, продолжающийся не менее трех дней.Значительно больше детей младшего возраста (младше трех лет) имели объективные хрипы и кашель (симптомы астмы), чем дети более старшего возраста (p = 0,01, тест Z-score). Перенесенное и клинически значимое хроническое заболевание диагностировано у 10% детей. Из них 4/13 (31%) имели ранее диагностированную и текущую астму и имели тяжелое обострение во время M . pneumoniae инфекция.
Большинству пациентов (84%) сделали рентген грудной клетки, и 96% из них имели положительные рентгенологические данные (Таблица 1).Среди младенцев и маленьких детей чаще встречалась исключительно внутригрудная лимфаденопатия, в то время как у детей старшего возраста на рентгенограмме грудной клетки обычно наблюдалась значительная периферическая инфильтрация (таблица 1). Дети с ателектазом находились в больнице значительно дольше; более трех дней (35% против 25%; p = 0,05). Частота легочных осложнений была такой же для детей с СРБ более 50 мг / л (POCT (Point of Care Testing), часть определения значимой пневмонии для взрослых) и ниже 50 мг / л (18% против 19%, p> 0.05). В возрастной группе до двух лет не было зарегистрировано легочных осложнений. Количество тяжелых проявлений пневмонии было одинаковым в возрастных группах; 2–6 лет и 7–15 лет (таблица 1). В целом 20% детей имели повышенный уровень СРБ более 50 мг / л, и все они были старше трех лет.
В общей сложности лечение антибиотиками прошли 120 детей. Большинство из них получали кларитромицин в соответствии с местными рекомендациями. Шестьдесят четыре пациента, или 46%, лечились по подозрению.Из них 53% получали другие антибиотики (бета-лактам) до M . pneumoniae тестирование. 56 пациентов (42%) начали лечение после получения положительного результата теста. Только шесть детей получали антибиотики из группы макролидов дважды из-за подозрений на рецидив или неэффективность лечения. Один образец был протестирован на устойчивость к макролидам и оказался отрицательным.
Наиболее частым внелегочным проявлением была тошнота с рвотой или без нее, о которой сообщила треть всех детей.У 23% всех детей была сыпь того или иного типа, а у 9% — крапивница. У грудных детей кожные проявления наблюдались в 33% случаев. У двоих детей развился синдром Стивена Джонсона (SJS) с симптомами со стороны слизистой оболочки, возникшими до или одновременно с началом лечения антибиотиками.
В общей сложности 37 детей одновременно были протестированы с посевом мокроты на наличие других бактериальных патогенов. В 41% из них была диагностирована коинфекция. Наиболее распространенными бактериями были Moraxella catarrhalis , Haemophilus influenzae и S . пневмония . В соответствии с методологическими установками, все дети были протестированы на Chlamydophila pneumoniae. ни один из них не был признан положительным.
Только двое детей были протестированы на вирусные инфекции во время клинической практики. Апостериорный анализ 49 мазков из ротоглотки показал, что 27% из них имели однократную или смешанную вирусную коинфекцию (RSV (1 ребенок), грипп A (2), метапневмовирус человека (1), риновирус (2), коронавирус). (3), бокавирус (2) и аденовирус (5)). Четверо детей дали положительный результат ПЦР на два вируса, а также на M . пневмония . Таблица 2 показывает, аналогично таблице 1, клинические характеристики детей с неизвестной вирусной инфекцией, без нее и с ней. Данные свидетельствуют о том, что значительно больше детей со смешанной инфекцией M . pneumoniae и респираторный вирус имели ринорею (p = 0,02) и хрипы (тенденция, p = 0,07) по сравнению с теми, которые были положительными только для M . пневмония . Мы не смогли выявить других различий между двумя группами, включая отсутствие радиологических расхождений.
Обсуждение
Мы представляем данные большой когорты детей с M . pneumoniae инфекция. Все включенные в исследование дети были направлены из системы первичной медико-санитарной помощи в госпитализацию в связи с характером и тяжестью симптомов. Большинство из M . pneumoniae детей с положительным результатом ПЦР имели ИНДП, что мы подтвердили высокой частотой рентгенологических данных (94%).
Мы обнаружили более высокий уровень положительных проб на более поздней волне эпидемии в 2010 и 2011 годах.Детей школьного возраста чаще было M . pneumoniae положительных (65%), чем у детей младшего возраста, но даже среди детей от 2 до 6 лет 30% были M . pneumoniae положительный результат, подтверждающий наше первоначальное подозрение, что M . pneumoniae также поражает маленьких детей. Даже небольшое количество младенцев; Диагноз поставлен 6 из 276.
Это исследование было проведено как ретроспективное исследование. Дежурный врач решил, кого тестировать на M . пневмония . Детский с М . Инфекция pneumoniae могла быть недооценена, если бы у них были незначительные респираторные симптомы, особенно во время первой волны эпидемического периода. Из-за общепринятых концепций эпидемиологии ВП, первоначально основанных на долгосрочном исследовании, проведенном в учреждениях первичной медико-санитарной помощи с 1963 по 1975 годы, мы ожидаем, что младенцы и маленькие дети будут недооценены из-за смещения отбора [6].
Даже самые маленькие дети могут заболеть от M . pneumoniae , хотя встречается реже. Необходимо учитывать дифференциальный диагноз респираторных вирусных инфекций и обострения астматических симптомов. Клинические проявления с кашлем, хрипом, субфебрильной температурой, уровнем СРБ ниже 50 мг / л и хрипами при аускультации у 33% детей младшего возраста также можно рассматривать как обострение астмы у детей, в первую очередь из-за вирусной инфекции у детей. дошкольники. Действительно, в нашем апостериорном анализе у нас также была обнаружена небольшая степень смешанных вирусных сочетанных инфекций.Можно только предполагать, какой патоген был основной причиной заболевания в этих случаях. В связи с нашими апостериорными выводами мы бы посоветовали маленьким детям с хрипом и ринореей пройти обследование как на M, так и на . pneumoniae и респираторные вирусные инфекции одновременно. Во время норвежского M . pneumoniae эпидемия, Inchly et al. описали аналогичное относительное количество сопутствующих вирусных инфекций [14].
В голландском детском исследовании осанки M . pneumoniae в верхних дыхательных путях (ВДП), сезон и год включения повлияли на распространенность бессимптомных носителей в диапазоне от 3% до 52% [17]. В нашем исследовании некоторые из детей, выписанных из палаты в тот же день, что и госпитализированные, могли быть носителями M . пневмония . Тем не менее, некоторые из этих детей получали лечение антибиотиками первой линии до госпитализации и были направлены в наше отделение из-за недостаточной реакции на лечение бета-лактамными антибиотиками.
Kroppi et al. [18] обнаружили, что у 50% детей ИДП вызывается M . pneumoniae были коинфицированы преимущественно S . pneumoniae или Chlamydiae spp . Лишь небольшая часть этой когорты была протестирована на бактериальную коинфекцию, но мы не считали это серьезной проблемой. Опять же, стоит отметить, что 59% детей лечились бета-лактамным антибиотиком перед обследованием на M . pneumoniae без улучшения инфекции.
В периоды того же эпидемического периода в Дании (2010–2011 гг.) Stockholm et al. выявили влияние азитромицина (макролидный антибиотик) на продолжительность приступа астматических симптомов у детей раннего возраста. Нет исследований для M . pneumoniae , и критерии исключения, такие как частота дыхания более 50 / мин, температура более 39 ° C и CRP более 50 мг / л, не исключали всех детей с возможным M . pneumoniae инфекция [19–21]. Два недавно опубликованных норвежских исследования описали несоответствие частоты клинических симптомов M . pneumoniae инфекций у детей дошкольного возраста между эпидемическим и эндемическим периодами [14,21]. Рандомизированные контролируемые испытания эффективности макролидов в отношении симптомов, подобных астме, следует проводить в эндемические периоды или лучше контролировать для M . pneumoniae инфекций, особенно у детей раннего возраста, рожденных после эпидемического периода. Противовоспалительный эффект макролидов требует дальнейшего изучения [22].
10% этой когорты страдали хроническими заболеваниями, в основном тяжелыми респираторными заболеваниями.У текущих астматиков диагностированы тяжелые обострения бронхиальной астмы.
Детей старшего возраста, как правило, осматривали позже, после появления симптомов, и на их долю приходились более длительные госпитализации. Это может указывать на то, что у детей старшего возраста были более тяжелые инфекции или что задержка с поступлением в больницу привела к более тяжелому заболеванию и, следовательно, к более длительному периоду реабилитации. Несмотря на это, мы также выявили тяжелую пневмонию на основании рентгенологических данных (ателектаз, плевральный выпот) у детей 2-6 лет.Если учесть размер популяции, у этих дошкольников был повышенный риск развития тяжелой пневмонии по сравнению со школьниками во время этой эпидемии. Inchley et al. показали ту же картину, даже если их определение тяжелой пневмонии различалось [14]. Раннее лечение инфекций может снизить тяжелую заболеваемость и продолжительность пребывания в больнице.
Обработка М . pneumoniae инфекций с помощью макролидных антибиотиков является спорным вопросом, поскольку в Кокрановском обзоре сделан вывод о недостаточности доказательств, чтобы сделать какие-либо конкретные выводы об эффективности антибиотиков в M . pneumoniae инфекций у детей [17,22]. Эффективность лечения антибиотиками следует обсуждать в свете правильного диагностического теста [15]. Бессимптомные носители М . pneumoniae следует дифференцировать от детей, страдающих симптоматическими инфекциями, НИДП, вызванными M . pneumoniae [23]. Гардинер и др. подчеркивают необходимость РКИ по этой теме [17]. В Дании SSI по-прежнему рекомендует лечение M . pneumoniae положительных ИДПТ у детей [24].Устойчивость к макролидам — растущая проблема во всем мире. В Дании частота встречаемости оценивается в 2% [25]. В нашей детской когорте не было выявлено устойчивости к макролидам.
Мы обнаружили радиологические изменения в 94% рентгеновских снимков грудной клетки, сделанных в этом исследовании. Рентгенологические результаты были весьма разнообразными, но примечательно, что более 80% детей старше двух лет имели долевую инфильтрацию, в то время как у младших детей результаты были значительно более тонкими. Это было в соответствии с итальянским проспективным исследованием детства [9].
Даже у детей старшего возраста нельзя было отличить симптомы от ВП, вызванного другими патогенами. Рентгенологические находки в M . pneumoniae пневмонии в целом не отличались от ВП.
Почти у 25% всех детей во время болезни была сыпь (эритема / крапивница), а у 33% были желудочно-кишечные симптомы, такие как тошнота и / или рвота. Тяжелые внелегочные проявления, сопровождающие респираторные инфекции, вызванные M .Ожидается, что возникнет pneumoniae [26]. Двум детям в нашей когорте был поставлен диагноз SJS, который является известным осложнением M . pneumoniae [27]. Вспышки M . Сообщалось, что pneumoniae -ассоциированный ССД у детей [28]. Мы не видели детей с неврологическими симптомами в этой когорте, чего можно было ожидать.
Заключение
M . pneumoniae является серьезной причиной инфекций нижних дыхательных путей у детей и может вызывать инфекции, которые трудно отличить от ВП, вызванных другими респираторными патогенами. М . pneumoniae также поражают младенцев и детей младшего возраста в периоды эпидемий, и мы полагаем, что M . pneumoniae следует рассматривать как дифференциальный диагноз респираторных вирусных инфекций и как причину болезненных симптомов легких и пневмонии у младенцев и детей. Рентген грудной клетки не выявил патогномоничных признаков ВП. Во время надвигающейся эпидемии оценка внелегочных проявлений, особенно кожных реакций на иммунологической основе, может быть полезной при диагностике M . pneumoniae инфекций.
Список литературы
- 1.
Уэйтс КБ. Новые концепции инфекций Mycoplasma pneumoniae у детей. Педиатр Пульмонол. 2003. 36: 267–278. pmid: 12950038 - 2.
Хорнслет А. Вирусология острых респираторных инфекций. 1. Обследование по этиологии у детей. Ugeskr Laeger. 1967; 129: 1253–1258. pmid: 4299986 - 3.
Хорнслет А. Вирусология острых респираторных инфекций.2. Выделение вирусов у госпитализированных детей. Ugeskr Laeger. 1967. 129: 1259–1265. pmid: 4299987 - 4.
Харрис М., Кларк Дж., Кут Н., Флетчер П., Харден А., Маккин М. и др. Рекомендации Британского торакального общества по ведению внебольничной пневмонии у детей: обновление 2011 г. Thorax. 2011; 66 Дополнение 2: ii1–23. pmid: 211 - 5.
Заленцинк Д., Вальехо Дж. Инфекция микоплазменной пневмонии у детей. 2009-е изд. До настоящего времени. - 6.
Глезен В.П., Лода Ф.А., Клайд В.А., старший RJ, Шеффер К.И., Конли В.Г. и др.Эпидемиологические закономерности острых заболеваний нижних дыхательных путей у детей в педиатрической практике. J Pediatr. 1971; 78: 397–406. pmid: 5101436 - 7.
Uldum SA, Bangsborg JM, Gahrn-Hansen B, Ljung R, Mølvadgaard M, Føns Petersen R, et al. Эпидемия инфекции Mycoplasma pneumoniae в Дании, 2010 и 2011 годы. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012; 17. - 8.
Соренсен К.М., Шённинг К., Розенфельдт В. Клинические характеристики детей с инфекцией Mycoplasma pneumoniae, госпитализированных во время датской эпидемии 2010–2012 гг.Дэн Мед Дж. 2013; 60: A4632. pmid: 23673264 - 9.
Defilippi A, Silvestri M, Tacchella A, Giacchino R, Melioli G, Di Marco E и др. Эпидемиология и клинические особенности инфекции Mycoplasma pneumoniae у детей. Respir Med. 2008. 102: 1762–1768. pmid: 18703327 - 10.
Gadsby NJ, Reynolds AJ, McMenamin J, Gunson RN, McDonagh S, Molyneaux PJ и др. Увеличение количества сообщений о Mycoplasma pneumoniae из лабораторий Шотландии в 2010 и 2011 годах — влияние эпидемии на младенцев.Евро Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull. 2012; 17. - 11.
Осман Н., Исаакс Д., Кессон А. Инфекции Mycoplasma pneumoniae у австралийских детей. J Paediatr Child Health. 2005. 41: 671–676. pmid: 16398873 - 12.
Чалкер В., Стоки Т., Литт Д., Бермингем А., Уотсон Дж., Флеминг Д. и др. Повышенное выявление инфекции Mycoplasma pneumoniae у детей в Англии и Уэльсе с октября 2011 г. по январь 2012 г. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull.2012; 17. - 13.
Алмасри М., Диза Э., Папа А., Эбориаду М., Сулиу Э. Инфекции дыхательных путей Mycoplasma pneumoniae среди греческих детей. Гиппократия. 2011; 15: 147–152. pmid: 22110297 - 14.
Inchley CS, Berg AS, Vahdani Benam A, Kvissel AK, Leegaard TM, Nakstad B. Mycoplasma Pneumoniae: Популяционное сравнение тяжести заболевания у детей дошкольного и школьного возраста. Pediatr Infect Dis J. 2017; 36: 930–936. pmid: 28471864 - 15.Испанский EBM, Fraaij PLA, Visser EG, Hoogenboezem T, Hop WCJ, van Adrichem LNA и др. Носительство Mycoplasma pneumoniae в верхних дыхательных путях у детей с симптомами и без симптомов: обсервационное исследование. PLoS Med. 2013; 10: e1001444. pmid: 236
- 16.
Флеминг С., Томпсон М., Стивенс Р., Хенеган С., Плюддеманн А., Маконочи И. и др. Нормальные диапазоны частоты сердечных сокращений и частоты дыхания у детей от рождения до 18 лет: систематический обзор наблюдательных исследований.Ланцет. 2011; 377: 1011–1018. pmid: 21411136 - 17.
Гардинер SJ, Гавранич JB, Чанг AB. Антибиотики для лечения внебольничных инфекций нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. В: Кокрановское сотрудничество, редактор. Кокрановская база данных систематических обзоров. Чичестер, Великобритания: John Wiley & Sons, Ltd; 2015. https://doi.org/10.1002/14651858.CD004875.pub5 pmid: 25566754 - 18.
Корппи М., Хейсканен-Косма Т., Клемола М. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae: серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи.Respirol Carlton Vic. 2004. 9: 109–114. pmid: 14982611 - 19.
Стокгольм Дж., Чавес Б.Л., Виссинг Н.Х., Бьярнадоттир Э., Педерсен Т.М., Виндинг Р.К. и др. Азитромицин при эпизодах с астматическими симптомами у маленьких детей в возрасте 1-3 лет: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Респир Мед. 2016; 4: 19–26. pmid: 26704020 - 20.
Стокгольм Дж., Бисгаард Х. Хроническая инфекция легких, вызванная Chlamydia pneumoniae: игнорируемое объяснение эффектов макролидов при хрипе и астме? — ответ авторов.Ланцет Респир Мед. 2016; 4: e8 – e9. - 21.
Berg AS, Inchley CS, Aase A, Fjaerli HO, Bull R, Aaberge I, et al. Этиология пневмонии в педиатрической популяции с высоким охватом пневмококковой вакциной: проспективное исследование. Pediatr Infect Dis J. 2016; 35: e69–75. pmid: 26599568 - 22.
Малхолланд С., Гавранич Дж. Б., Гиллис МБ, Чанг А.Б. Антибиотики для лечения внебольничных инфекций нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae, у детей. Кокрановская база данных Syst Rev.2012; 9: CD004875. pmid: 22972079 - 23.
Испанцы EBM, Meyer Sauteur PM, Vink C, van Rossum AMC. Инфекции Mycoplasma pneumoniae — помогает ли лечение? J Infect. 2014; 69 Приложение 1: S42–46. pmid: 25267596 - 24.
Statens Serum Institut. Инфекционер Mycoplasma pneumoniae. В: ssi.dk [Интернет]. 27 декабря 2015 г. Доступно: http://www.ssi.dk/Service/Sygdomsleksikon/M/Mycoplasma%20pneumoniae%20infektioner.aspx - 25.
Ульдум С.А., Амберг П., Дженсен Дж. С..[Устойчивость к макролидам Mycoplasma pneumoniae в результате рецидивов и длительных заболеваний]. Ugeskr Laeger. 2012; 174: 730–731. pmid: 22409896 - 26.
Bjørn A-MB, Lebech A-MK. [Внелегочные осложнения инфекций Mycoplasma pneumoniae]. Ugeskr Laeger. 2002; 164: 1805–1809. pmid: 11957438 - 27.
Цай В., Оман Дж. Синдром Стивенса-Джонсона после инфекции Mycoplasma pneumoniae. J Emerg Med. 2011; 40: 324–327. pmid: 18614318 - 28.
Olson D, Watkins LKF, Demirjian A, Lin X, Robinson CC, Pretty K и др.Вспышка синдрома Стивенса-Джонсона, связанного с Mycoplasma pneumoniae. Педиатрия. 2015; 136: e386–394. pmid: 26216320
Бронхиолит, ассоциированный с Mycoplasma Pneumoniae у младенцев в Сучжоу, Китай, с 2010 по 2012 год
Одобрения
Все эксперименты проводились в соответствии с соответствующими руководящими принципами и правилами Университета Сучжоу. Методы выполнялись в соответствии с утвержденными методическими рекомендациями. Исследование было одобрено Комитетом по медицинской этике Университета Сучжоу (No.Сдфей201005). Перед включением в исследование родители всех участников исследования дали как устное, так и письменное информированное согласие.
Пациенты
Это ретроспективное исследование проводилось с января 2010 года по декабрь 2012 года на педиатрических пациентах в отделении респираторных заболеваний дочерней детской больницы Университета Сучжоу. Диагноз бронхиолита был основан на следующих критериях: 29 . (1) Заболевание возникло в течение двух лет после рождения. (2) Начало было острым, сопровождалось хрипом и одышкой, а также инфекцией верхних дыхательных путей в анамнезе.(3) Пациент пожаловался на беспокойство, учащенное дыхание и частоту сердечных сокращений, симптомы из носа и цианоз. (4) Физикальное обследование выявило распространенное двойное хрип в легких в начале хрипа, сопровождающееся тонкими хрипами или крепитацией. В это исследование были исключены пациенты с врожденным пороком сердца, иммунодефицитом, бронхами или легочной дисплазией.
Сбор образцов мокроты
Носоглоточный секрет собирали у каждого участника исследования в течение 24 часов после приема лаборантом, как описано ранее.Вкратце, асептический пластиковый катетер для сбора мокроты вводили в ноздрю на глубину примерно 7-8 см до глотки. Примерно 2 мл назофарингеального секрета было собрано путем приложения отрицательного давления. Образец смешивали с 4–8 мл PBS и центрифугировали 10 минут при 300–500 об / мин. Супернатант сливали, осадок смешивали с 4-8 мл PBS и центрифугировали еще 10 минут. Гранулы хранили при -80 ° C до начала испытаний.
Обнаружение и оценка MP-ДНК мокроты
Лизат ДНК (биотехнологическая компания Shanghai Shenyou, Шанхай, Китай) добавляли к осадку мокроты после промывания PBS.Образец нагревали до 95 ° C в течение 10 минут, центрифугировали в течение 5 минут при 12 000 об / мин, а затем собирали супернатант. После извлечения ДНК из образца мокроты ДНК МП детектировали с помощью флуоресцентной ПЦР в реальном времени (BIO-RAD iCycler, США). Установки циклической температуры составляли 93 ° C, 2 мин; 93 ° C, 45 с; 55 ° С, 60 с → 10 циклов; 93 ° C 30 с → 55 ° C, 45 с → 30 циклов. Точка сбора флуоресценции была установлена на 55 ° C, 45 с. Значение C t использовали для количественной оценки результатов количественной ПЦР флуоресценции.Последовательности праймера и зонда MP показаны в таблице 3. Последовательность связывания зонда располагалась между праймером выше и ниже по течению. Флуоресцентный репортерный краситель на 5′-конце зонда представлял собой 6-карбоксифлуоресцеин (FAM), а гасителем на 3′-конце зонда был 6-карбокситетраметилродамин (TAMRA). Праймеры и зонд были приобретены у Guangzhou Daan Gene Ltd. (Гуанчжоу, Китай). MP-отрицательный образец был определен как имеющий кривую амплификации, которая не была S-образной, или значение C t = 30.Оба результата показали, что содержание ДНК МП было ниже предела обнаружения. Положительный образец MP был определен как имеющий S-образную кривую амплификации и значение C t <30. Содержание ДНК в мокроте определяли по следующим критериям. Если образец C <5,00 × 10 2 , содержание ДНК было <2,5 × 10 3 копий гена / мл; если 5,00 × 10 2 ≤ C ≤ 5,00 × 10 8 , содержание ДНК = 5 × 10 3 копий гена / мл; и если C> 5.00 × 10 8 , содержание ДНК было> 5 × 10 3 копий гена / мл.
Таблица 3 Амплификация генов MP , hMPV и hBoV
Обнаружение респираторного вируса мокроты
Прямая иммунофлуоресценция использовалась для обнаружения синцитиальной вирусной инфекции (RSV), вируса гриппа A (IVA), вируса гриппа B ( IVB), вирус парагриппа (PIV) I, PIV II, PIV III и аденовирус (ADV). Все наборы для анализа были приобретены в Chemicon (США), и все процедуры окрашивания выполнялись в соответствии с инструкциями производителя.Иммуноокрашенные препараты просматривали с помощью флуоресцентного микроскопа (Leica 020-518.500, Германия).
Экстракция РНК и ПЦР в реальном времени для обнаружения гена метапневмовируса человека (hMPV).
РНК экстрагировали из образцов мокроты с помощью Trizol (Invitrogen, США). кДНК синтезировали методом обратной транскрипции. Циклические настройки температуры: 94 ° C, 30 с; 55 ° C, 30 с; 68 ° C, 30 с; усиливается на 45 циклов, последний при 68 ° C в течение 7 мин. hMPV анализировали с помощью флуоресцентной ПЦР в реальном времени (BIO-RAD iCycler).Циклические настройки температуры: 94 ° C, 30 с; 56 ° C, 30 с; 72 ° C, 30 с; усиленный, 40 циклов. Последовательности праймеров для hMPV показаны в таблице 3.
Экстракция ДНК и ПЦР в реальном времени для обнаружения гена бокавируса человека (hBoV)
ДНК мокроты экстрагировали, как описано выше, и ДНК hBoV детектировали флуоресцентной ПЦР в реальном времени. . Циклические настройки температуры: 94 ° C, 30 с; 56 ° C, 30 с; 72 ° C, 30 с; усиливается на 40 циклов. Последовательности праймеров и зонд hBoV показаны в таблице 3.
Статистический анализ
Все данные анализировали с помощью статистического программного обеспечения PASW 20.0 (IBM, США). Сравнение между группами проводилось с использованием критерия хи-квадрат. Для данных, которые не соответствовали условиям критерия хи-квадрат, использовался точный вероятностный критерий Фишера. Данные с ненормальным распределением были выражены как медианы и квартильные диапазоны (M; P25 P75), а различия оценивались с помощью U-критерия Манна-Уитни. P <0,05 считалось значимым.
Mycoplasma Pneumonia — Консультант по терапии рака
ОБЗОР: Что нужно знать каждому практикующему
Вы уверены, что у вашего пациента инфекция Mycoplasma pneumoniae? Каковы типичные признаки этого заболевания?
Mycoplasma pneumoniae — частая причина инфекций верхних дыхательных путей и остается самой частой причиной бактериальной пневмонии. Термин «ходячая пневмония» использовался для описания обычного случая инфекции нижних дыхательных путей, поскольку болезнь обычно не изнуряет.Внелегочные проявления и осложнения микоплазменной инфекции встречаются регулярно и включают сыпь, артрит, гемолитическую анемию, расстройства центральной нервной системы, перикардит, почечную дисфункцию и жалобы со стороны желудочно-кишечного тракта.
Типичная респираторная инфекция, вызываемая M. pneumoniae, представляет собой медленно развивающийся синдром фарингита, заложенности носовых пазух и сухого кашля. На этом этапе кашель вторичен по отношению к трахеобронхиту. Когда инфекция прогрессирует и поражает нижние дыхательные пути, чаще всего встречается атипичная пневмония с двусторонними диффузными легочными инфильтратами.
Внелегочные проявления инфекции
Примерно у 20% пациентов, госпитализированных с инфекцией M. pneumoniae, развиваются внелегочные осложнения. Дерматологические заболевания, включая эритематозную пятнисто-папулезную сыпь, являются одними из наиболее частых внелегочных проявлений болезни. Сыпь обычно проходит самостоятельно; тем не менее, тяжелые формы многоформной эритемы, конъюнктивита, язвенного стоматита и буллезных экзантем действительно встречаются.
Большая многоформная эритема и микоплазменная инфекция
Большая мультиформная эритема, или синдром Стивена Джонсона, может быть вызвана несколькими известными возбудителями инфекции.Одним из наиболее распространенных факторов, вызывающих это мультисистемное воспалительное заболевание, является M. pneumoniae. Пациенты, у которых развивается эта проблема, должны быть обследованы на предмет возможности заражения микоплазмой.
Какое еще заболевание / состояние имеет некоторые из этих симптомов?
Другие бактериальные причины атипичной пневмонии включают Chlamydophila pneumoniae, C. psittaci и Legionella pneumophila. Вирусную пневмонию нелегко отличить от атипичной бактериальной пневмонии по клиническим показаниям.Причины внебольничной вирусной пневмонии включают грипп, парагрипп, аденовирус, энтеровирус, метапневмовирус человека и респираторно-синцитиальный вирус.
Что послужило причиной развития этой болезни в это время?
Инфекции Mycoplasma pneumoniae могут возникать в виде кластеров и вспышек во всех возрастных группах. Климат, сезонность и география, по-видимому, не способствуют распространению возбудителя, хотя большинство вспышек, описанных в США, происходит в конце лета и в начале осени.
Дети с серповидноклеточной анемией, синдромом Дауна и иммуносупрессией подвержены более высокому риску тяжелой микоплазменной болезни, включая фульминантную пневмонию. Дети с синдромами дефицита антител подвержены большему риску заболевания легких и имеют предрасположенность к развитию артрита, вызванного M. pneumoniae.
Какие лабораторные исследования следует запросить для подтверждения диагноза? Как следует интерпретировать результаты?
Серологический диагноз считается золотым стандартом для подтверждения заболевания, когда обнаруживается четырехкратное повышение уровня антител в сыворотке крови между образцами в острой стадии и в период выздоровления.Посев на микоплазмы и ПЦР также используются, но поскольку организм может сохраняться в течение различного периода времени, значимость положительного результата посева или ПЦР может быть поставлена под сомнение без подтверждения свидетельств сероконверсии.
Серологические исследования
Титры острых и выздоравливающих должны быть получены с интервалом примерно 4-6 недель. Клинический диагноз подтверждается четырехкратным или более высоким увеличением титра антител против микоплазмы. Серологический диагноз остается «золотым стандартом», используемым для подтверждения микробиологической этиологии заболевания, хотя другие результаты тестов, такие как титры холодовых агглютининов и ПЦР микоплазмы, могут предоставить подтверждающие доказательства во время острой фазы инфекции.
Титры холодных агглютининов
Холодовые агглютинины — это антитела класса IgM, которые вырабатываются примерно у половины пациентов с инфекцией Mycoplasma pneumoniae через 7-10 дней после начала болезни. Считается, что эти антитела представляют собой перекрестно-реактивные антитела, вырабатываемые против I-антигена эритроцитов. Так называемое «прикроватное» тестирование холодного агглютинина включает сбор крови в пробирку с антикоагулянтом и помещение пробирки в ледяную воду на 30 секунд. Затем пробирку проверяют на макроагглютинацию в холодном состоянии, затем медленно нагревают для наблюдения за отделением эритроцитов.При повторном воздействии холода макроагглютинация возобновляется.
Более точный тест включает серийное разведение сывороток и реакцию сывороток с эритроцитами группы крови O для определения титра, до которого все еще происходит агглютинация. Этот тест обычно проводится в лабораториях банка крови. Было показано, что реакция холодовых агглютининов напрямую коррелирует с тяжестью респираторного заболевания; однако этот тест нечувствителен и крайне неспецифичен. По мере того, как серологическая диагностика и диагностика с помощью ПЦР стали более рутинными, популярность и полезность этого теста снизились.Однако положительный прикроватный тест на холодовой агглютинин, проведенный на крови, взятой у пациента с атипичной пневмонией или мультиформной эритемой, может быть клинически удовлетворительным, поскольку он предлагает убедительные подтверждающие доказательства причины болезни пациента.
Посев на микоплазмы
Лабораторная культура Mycoplasma pneumoniae технически сложна и доступна только в специализированных справочных лабораториях. Для поддержки его роста требуется селективная и дифференциальная культуральная среда, организм растет очень медленно (3 недели и более), и бактериальные колонии должны визуализироваться под микроскопом опытным микробиологом, чтобы подтвердить рост и идентифицировать вид микоплазмы как пневмония.Таким образом, посев непрактичен и имеет мало клинического применения, потому что пациент, вероятно, выздоровеет от болезни до того, как станет известен результат посева.
ПЦР на микоплазмы
Полимеразная цепная реакция — это быстрый, высокочувствительный и специфический анализ, используемый для обнаружения присутствия специфичных для микробов нуклеотидов. Посев является нечувствительным и медленным, а серологический анализ требует получения образцов в остром периоде и выздоравливающих с интервалом не менее месяца, поэтому понятно, что ПЦР-тесты были разработаны для помощи в диагностике микоплазменных инфекций.
Необходимо признать ограничения на тестирование ПЦР. Во-первых, положительные образцы ПЦР могут быть обнаружены у лиц без клинических проявлений. Микоплазменные организмы и / или специфическая ДНК микоплазм могут присутствовать в течение недель или месяцев после заражения, поэтому обнаружение ампликонов ПЦР у пациента может не отражать активную инфекцию. Чтобы преодолеть это ограничение, у детей было предложено комбинированное использование тестирования IgM микоплазмы с тестированием ПЦР. Клинические образцы, подходящие для ПЦР, включают респираторные выделения, полученные из ротоглотки, носоглотки, мокроты или жидкости бронхоальвеолярного лаважа.Прямая ПЦР из легочной ткани также оказалась успешной.
Роль для тестирования IgA
Поскольку M. pneumoniae представляет собой инфекцию слизистых оболочек, была предложена возможность использования специфичных для организма IgA-ответов для установления диагноза. В настоящее время очень немногие анализы включают реагенты для тестирования IgA, и в настоящее время IgA-специфические тесты недоступны в Соединенных Штатах.
Могут ли быть полезны визуализирующие исследования? Если да, то какие?
Рентгенограмма грудной клетки должна быть сделана у пациентов с респираторными симптомами от умеренной до тяжелой, чтобы задокументировать степень поражения легких, выявить наличие плеврального выпота и оценить редкое осложнение абсцесса легкого.
Рентгенографические данные при инфекции Mycoplasma pneumoniae чрезвычайно разнообразны и, следовательно, могут имитировать множество других состояний. Наиболее вероятны рентгенологические находки при бронхопневмонии перихилярных областей. Реже встречаются крупозная пневмония и наличие плеврального выпота. Рентгенологические признаки абсцесса легкого были описаны во время микоплазменной инфекции, но их наличие всегда должно повышать вероятность альтернативного диагноза.
Если вы можете подтвердить, что у пациента инфекция Mycoplasma pneumoniae, какое лечение следует начать?
Надлежащее лечение микоплазменной инфекции антибиотиками сокращает течение болезни и ускоряет облегчение симптомов.Антибиотики группы макролидов являются препаратами выбора, но также эффективны тетрациклины и фторхинолоны.
Mycoplasma не имеет клеточной стенки и, следовательно, по своей природе устойчива к активным агентам клеточной стенки, таким как бета-лактамные антибиотики. Сульфаниламиды, триметоприн и рифампицин также неэффективны. Линкозамины (клиндамицин), по-видимому, имеют низкие минимальные ингибирующие концентрации in vitro, но не являются клинически эффективными. Оксазолидиноны (препараты, нацеленные на 30S-рибосомы) in vitro не имеют перспектив, и их следует избегать.Кетолиды (такие как телитромицин) перспективны против M. pneumoniae in vitro, но клинические данные у детей отсутствуют, а возможность токсического действия на печень привела к осторожности при использовании этого антибиотика.
Сообщается, что высокие дозы глюкокортикоидов полезны в качестве дополнительной терапии у пациентов с микоплазменным энцефалитом. Плазмаферез и внутривенная терапия иммуноглобулинами также использовались в таких условиях, но неясно, приносят ли эти стратегии существенную клиническую пользу.
Макролиды и устойчивость к макролидам
Исследования у детей с внебольничной пневмонией, вызванной микоплазмой, показали, что азитромицин и кларитромицин столь же эффективны, как и эритромицин. Азитромицин и кларитромицин обычно предпочтительнее эритромицина из-за их большей переносимости, дозирования один или два раза в день и более короткой продолжительности лечения азитромицином, хотя их стоимость выше.
Устойчивый к макролидам M. pneumoniae был впервые описан в 2000 году и, как полагают, является результатом селективного давления, вторичного к повсеместному увеличению использования азитромицина.В глобальном масштабе Китай и Япония сообщают о показателях устойчивости к макролидам на уровне 90% и выше. В 2011 году в отчете из Израиля отмечена 30% -ная резистентность организмов, изолированных от госпитализированных пациентов. В некоторых регионах Европы сопротивление достигает 26%. Напротив, уровень сопротивления в западном полушарии остается ниже на уровне 13% по состоянию на 2015 год.
Тестирование на чувствительность не всегда доступно и проводится редко, но появление устойчивых к макролидам M. pneumoniae вызывает опасения по поводу обычных эмпирических вариантов охвата в некоторых частях мира.Встречающиеся в природе штаммы, устойчивые к тетрациклину или фторхинолонам, еще не описаны.
Хинолоны
Левофлоксацин, моксифлоксацин, гатифлоксацин и спарфлоксацин обладают большей in vitro активностью против микоплазмы, чем хинолоны старшего поколения (ципрофлоксацин, офлоксацин), хотя минимальные ингибирующие концентрации для всех хинолонов выше (и, таким образом, препараты теоретически менее эффективны), чем для группа макролидов.
Какие побочные эффекты связаны с каждым вариантом лечения?
Эритромицин часто вызывает спазмы в животе, потерю аппетита и тошноту.Рвота или диарея — частые жалобы во время лечения. Редко возникают аллергические реакции. Описаны сердечные аритмии, в том числе torsades de pointes.
Терапия азитромицином и кларитромицином реже связана с желудочно-кишечными жалобами. Головные боли возникают у ~ 1% пациентов. Редко эти макролиды связаны с клинически значимой гепатотоксичностью или синдромами гиперчувствительности к лекарствам.
Антибиотики группы хинолонов связаны с повышенным риском тендинита и разрыва сухожилий во всех возрастных группах.Риск еще больше возрастает при одновременном применении глюкокортикоидов и у пациентов с трансплантацией твердых органов.
Каковы возможные исходы инфекции Mycoplasma pneumoniae?
Почти все инфекции Mycoplasma pneumoniae имеют отличный прогноз; однако описаны редкие случаи летального исхода от дыхательной недостаточности, острой гемолитической анемии, осложнений, вызванных большой многоформной эритемой, и энцефалита.
Что вызывает это заболевание и как часто оно встречается?
Эпиднадзор в США показывает, что микоплазма ответственна за 15-20% всех внебольничных пневмоний (ВП).В Скандинавии M. pneumoniae была обнаружена в 30% всех педиатрических ВП и более чем в 50% среди детей старше 5 лет. Заболеваемость наиболее высока среди детей школьного возраста и снижается после подросткового возраста.
Серологические исследования показали, что передача болезни происходит циклическими эпидемиями каждые 3-5 лет. Длительный инкубационный период, относительно низкая скорость передачи и сохранение организма в дыхательных путях в течение различных периодов после заражения могут объяснить, почему эпидемии длятся в течение длительного периода времени.
Инкубационный период может длиться до 3 недель.
Как эти патогены / гены / воздействия вызывают болезнь?
Инфекция приводит к изъязвлению и разрушению мерцательного эпителия дыхательных путей с инфильтрацией макрофагов, нейтрофилов, лимфоцитов и плазматических клеток. В самых тяжелых случаях может развиться диффузное альвеолярное повреждение. Плевральный выпот, бронхоэктазы, абсцессы и фиброз легких — редкие, но серьезные последствия.
Другие клинические проявления, которые могут помочь в диагностике и лечении
Заражение M.pneumoniae подозревают, что они играют роль в нескольких хронических воспалительных заболеваниях. Доказательства роли астмы более убедительны, чем для других заболеваний, и инфекция была связана с искаженным Th3-доминантным воспалительным ответом во время длительной или хронической инфекции.
Какие осложнения вы можете ожидать от болезни или лечения болезни?
Осложнения пневмонии включают развитие плеврального выпота или развитие дыхательной недостаточности, редкую, но опасную для жизни проблему.Также описано образование абсцесса легкого.
У пациентов с дерматологическими проявлениями инфекции необходимо сохранять бдительность в отношении развития большой многоформной эритемы. Таким пациентам может потребоваться агрессивная жидкостная и электролитная поддержка, а в серьезных случаях требуется помощь дыхательных путей с помощью механической вентиляции, позволяющей заживить язвенный процесс в верхних дыхательных путях.
Как можно предотвратить Mycoplasma pneumoniae?
Антибиотикопрофилактика не рекомендуется после заражения.Вакцины нет.
Какие доказательства?
Гардинер, С.Дж., Гавранич, Дж.Б., Чанг, А.Б. «Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к детям». Кокрановская база данных Syst Rev .. vol. 1. 2015. pp. CD004875 (Это традиционный Кокрановский обзор по теме, специфической для детей.)
Zheng, X, Lee, S, Selvarangan, R. «Устойчивые к макролидам, США». Emerg Infect Dis. т. 21.2015. С. 1470-1472. (В этом отчете был оценен 91 образец из 6 участков в США, и было обнаружено, что высокий уровень устойчивости к макролидам впервые в этой области мира превышает 10%.)
Waites, KB, Talkington, DF. «И его роль в качестве патогена для человека». Clin Micro Rev. vol. 17. 2004. С. 697-728. (Самый последний полный и авторитетный обзор, доступный по этой теме. Обзор заканчивается сводной таблицей всех клинических испытаний, проведенных у детей и взрослых для оценки вариантов лечения.Краткое обсуждение проблем в разработке вакцины является основным моментом.)
Аткинсон, Т.П., Уэйтс, КБ. «Инфекции в детстве». Pediatr Infect Dis J. vol. 33. 2014. С. 92-94. (Предлагает отличный обзор современных знаний в области эпидемиологии и лечения детей.)
Аткинсон, Т.П., Балиш, М.Ф., Уэйтс, КБ. «Эпидемиология, клинические проявления, патогенез и лабораторное определение инфекций». FEMS Microbiol Rev. vol. 32.2008. С. 956-973. (Отличный обзор для тех, кто хочет больше узнать о патогенезе и базовой биологии микоплазмы. Раздел, посвященный лабораторным исследованиям, является сильной стороной этого обзора, так как в нем представлена сбалансированная критика методов серологического, посевного и ПЦР-анализа.)
Аль-Заиди, С.А., МакГрегор, Д., Махант, С. «Неврологические осложнения инфекций, подтвержденных методом ПЦР, у детей: продолжительность продромального заболевания может отражать патогенетический механизм». Clin Infect Dis. т.61. 2015. С. 1092-1098. (Обсуждаются предлагаемые механизмы патогенеза неврологических проявлений у детей после обобщения опыта большой педиатрической когорты.)
Продолжающиеся споры относительно этиологии, диагностики и лечения
Клинические данные предложили потенциальную связь между аутоиммунными нарушениями периферической нервной системы и образованием патологических антител против углеводных составляющих ганглиозидов, в основном GM1. От 5 до 15% случаев синдрома Гийена-Барре (СГБ) были связаны с предшествующей инфекцией микоплазмы, но окончательное доказательство причинно-следственной связи остается неуловимым.
Недавнее инфицирование M. pneumoniae было связано с развитием острого демиелинизирующего энцефаломиелита (ADEM) и неврита зрительного нерва. Доказательства, связывающие такие случаи с производством аутоантител, вызванных микоплазмами, не так надежны, как для GBS.
Считается, что аутоиммунные явления, наблюдаемые после заражения микоплазмой, возникают в результате молекулярной мимекрии. Белки Mycoplasma adhesin и некоторые ткани человека имеют гомологию аминокислотных последовательностей. В частности, аутоиммунные антитела могут развиваться против антигена I на эритроцитах, активности CD4 рецептора Т-клеток и антигенов главного комплекса гистосовместимости класса II, обнаруженных на лимфоцитах.
M. pneumoniae очень редко культивировали из спинномозговой жидкости пациентов с менингоэнцефалитом, но при проведении более чувствительного тестирования полимеразной цепной реакции чаще обнаруживается специфическая для организма ДНК. Эта неспособность идентифицировать организмы в культуре поддерживает утверждение о том, что большинство проявлений микоплазменной инфекции в центральной нервной системе являются вторичными по отношению к аутоиммунным явлениям, а не к активной инфекции ЦНС.



