Бесплатные консультации врачей онлайн
Вопрос создается. Пожалуйста, подождите…
Только зарегистрированные пользователи могу задавать вопрос.
Зарегистрируйтесь на портале, задавайте вопросы и получайте ответы от квалифицированных специалистов!
Напоминаем, что стоимость публикации вопроса — 10 бонусов.
Зарегистрироваться
Как получить бонусы
К сожалению, у вас недостаточно бонусов для оплаты вопроса.
Напоминаем, что стоимость публикации вопроса — 10 бонусов.
Как получить бонусы
Раздел медицины*:
— Не указано —КоронавирусАкушерствоАллергология, иммунологияАнестезиологияВенерологияВертебрологияВетеринарияГастроэнтерологияГематологияГепатологияГериатрияГинекологияГирудотерапияГомеопатияДерматологияДиетологияИглотерапия и РефлексотерапияИнфектология и паразитологияКардиологияКардиохирургияКосметологияЛабораторная и функциональная диагностикаЛечение травмЛогопедияМаммологияМануальная терапияМРТ, КТ диагностикаНаркологияНеврологияНейрохирургияНетрадиционные методы леченияНефрологияОбщая хирургияОнкологияОстеопатияОториноларингологияОфтальмологияПедиатрияПлазмаферезПластическая хирургияПодологияПроктологияПсихиатрияПсихологияПсихотерапияПульмонология, фтизиатрияРадиология и лучевая терапияРеабилитологияРеаниматология и интенсивная терапияРевматологияРепродукция и генетикаСексологияСомнологияСпортивная медицинаСтоматологияСурдологияТерапияТравматология и ортопедияТрансфузиологияТрихологияУЗИУльтразвуковая диагностикаУрология и андрологияФармакологияФизиотерапияФлебологияЧелюстно-лицевая хирургияЭндокринологияЗатрудняюсь выбрать (будет выбрана терапия)
Кому адресован вопросВопрос адресован:
ВсемКонсультантам
Консультант, которому задается вопрос:
Всем. ..Агабекян Нонна Вачагановна (Акушер, Гинеколог)Айзикович Борис Леонидович (Иммунолог, ЛОР (Оториноларинголог), Невролог, Педиатр, Терапевт, Аллерголог, Гастроэнтеролог)Акмалов Эдуард Альбертович (Аллерголог, Врач спортивной медицины)Александров Павел Андреевич (Венеролог, Гепатолог, Инфекционист, Паразитолог, Эпидемиолог)Александрова Анна Михайловна (Педагог, Психолог, Психотерапевт)Али Мохамед Гамал Эльдин Мансур (Педиатр)Аристова Анастасия Михайловна (Андролог, Уролог, Хирург)Армашов Вадим Петрович (Хирург)Афанасьева Дарья Львовна (Кардиолог, Терапевт)Беляева Елена Александровна (Гинеколог, Невролог, Рефлексотерапевт)Бушаева Ольга Владимировна (Пульмонолог, Терапевт)Врублевская Елена (Педиатр)Гензе Ольга Владимировна (Генетик, Педиатр)Глазной Василий Иванович (Сурдолог)Горохова Юлия Игоревна (Венеролог, Врач общей практики, Дерматолог)Григорьева Алла Сергеевна (Врач общей практики, Терапевт)Демидова Елена Леонидовна (Психолог, Психотерапевт)Денищук Иван Сергеевич (Андролог, Уролог)Дибиров Магомед Гусейнович (Стоматолог)Довгаль Анастасия Юрьевна (Маммолог, Онколог, Радиолог)Долгова Юлия Владимировна (Педиатр)Дьяконова Мария Алексеевна (Гериатр, Терапевт)Жердакова Дарья Владимировна (Акушер, Гинеколог)Загумённая Анна Юрьевна (Врач спортивной медицины, Гирудотерапевт, Диетолог, Косметолог, Терапевт)Зверев Валентин Сергеевич (Ортопед, Травматолог)Згоба Марьяна Игоревна (Окулист (Офтальмолог))Зинченко Вадим Васильевич (Рентгенолог, Хирург)Зорий Евген Владимирович (Невролог, Психолог, Терапевт, Хирург)Извозчикова Нина Владиславовна (Гастроэнтеролог, Дерматолог, Иммунолог, Инфекционист, Пульмонолог)Илона Игоревна (Врач общей практики, Гастроэнтеролог, Терапевт, Эндокринолог)Калявина Светлана Николаевна (Акушер, Гинеколог)Калягина Екатерина (Другая специальность)Карпенко Алик Викторович (Ортопед, Травматолог)Касимов Анар Физули оглы (Онколог, Хирург)Киреев Сергей Александрович (Психиатр, Психолог, Психотерапевт)Кирнос Марина Станиславовна (Стоматолог, Стоматолог детский, Стоматолог-терапевт)Копежанова Гульсум (Акушер, Гинеколог)Корж Анна Анатольевна (Акушер, Гинеколог, Маммолог, Эндокринолог)Кравцов Александр Васильевич (Нарколог, Психиатр)Красильников Андрей Викторович (Врач ультразвуковой диагностики, Медицинский директор, Флеболог, Хирург)Кряжевских Инна Петровна (Терапевт, Гастроэнтеролог)Кудряшова Светлана Петровна (Эндокринолог)Куртанидзе Ираклий Малхазович (Окулист (Офтальмолог))Кущ Елена Владимировна (Диетолог, Терапевт)Лазарева Татьяна Сергеевна (ЛОР (Оториноларинголог))Лаптева Лариса Ивановна (Невролог)Лебединская Татьяна Александровна (Психолог, Психотерапевт)Ледник Максим Леонидович (Венеролог, Дерматолог)Леонова Наталья Николаевна (Детский хирург)Литвиненко Станислав Григорьевич (Ортопед, Травматолог)Лямина Ирина Алексеевна (Акушер)Максименко Татьяна Константиновна (Инфекционист)МАЛЬКОВ РОМАН ЕВГЕНЬЕВИЧ (Диетолог, Остеопат, Реабилитолог)Мамедов Рамис (ЛОР (Оториноларинголог))Мартиросян Яков Ашотович (Детский хирург, Проктолог, Травматолог, Уролог, Хирург)Маряшина Юлия Александровна (Акушер, Венеролог, Врач ультразвуковой диагностики, Гинеколог, Педиатр)Матвеева Ярослава Дмитриевна (Педиатр)Мельшина Алёна Игоревна (Окулист (Офтальмолог))Мершед Хасан Имадович (Вертебролог, Нейрохирург)Миллер Ирина Васильевна (Невролог)Мильдзихова АЛЬБИНА Бексолтановна (Врач общей практики, Гинеколог, ЛОР (Оториноларинголог), Педиатр, Терапевт)Муратова Наталья Сергеевна (Врач общей практики, Диетолог)Мухорин Виктор Павлович (Нефролог)Наумов Алексей Алексеевич (Мануальный терапевт)Никитина Анна Алексеевна (Окулист (Офтальмолог))Никишин Андрей Александрович (Психиатр, Психолог, Психотерапевт)Ольга Викторовна (Невролог, Неонатолог, Педиатр, Реабилитолог, Терапевт)Павлова Мария Игоревна (Стоматолог, Стоматолог-хирург, Челюстно-лицевой хирург)Панигрибко Сергей Леонидович (Венеролог, Дерматолог, Косметолог, Массажист, Миколог)Пантелеева Кристина Алексеевна (Невролог)Пастель Владимир Борисович (Ортопед, Ревматолог, Травматолог, Хирург)Паунок Анатолий Анатольевич (Андролог, Уролог)Першина Наталия Сергеевна (Невролог)Пикульская Вита Григорьевна (Терапевт)Прокофьева Анастасия Михайловна (ЛОР (Оториноларинголог))Прохоров Иван Алексеевич (Нейрохирург, Хирург)Пушкарев Александр Вольдемарович (Гинеколог, Психотерапевт, Реабилитолог, Репродуктолог (ЭКО), Эндокринолог)Пьянцева Екатерина Вячеславна (Педиатр)Радевич Игорь Тадеушевич (Андролог, Венеролог, Сексолог, Уролог)Сапрыкина Ольга Александровна (Невролог)Свечникова Анастасия Евгеньевна (Стоматолог, Стоматолог детский, Стоматолог-ортопед, Стоматолог-терапевт, Стоматолог-хирург)Семений Александр Тимофеевич (Врач общей практики, Реабилитолог, Терапевт)Сергейчик Никита Сергеевич (Анестезиолог, Гомеопат)Силуянова Валерия Викторовна (Акушер, Врач ультразвуковой диагностики, Гинеколог)Соболь Андрей Аркадьевич (Кардиолог, Нарколог, Невролог, Психиатр, Психотерапевт)Солдатов Вадим Александрович (Невролог)Сошникова Наталия Владимировна (Эндокринолог)Степанова Татьяна Владимировна (ЛОР (Оториноларинголог))Степашкина Анастасия Сергеевна (Гематолог, Пульмонолог, Терапевт)Сурова Лидия (Гирудотерапевт, Невролог, Терапевт)Суханова Оксана Александровна (Клинический фармаколог, Психолог)Сухих Данил Витальевич (Психиатр)Тимченко Алла Владимировна (Дерматолог, Косметолог)Тихомиров Сергей Евгеньевич (Нейрохирург)Тумарец Кирилл Михайлович (Врач лечебной физкультуры, Врач спортивной медицины, Кинезитерапевт, Реабилитолог, Физиотерапевт)Турлыбекова Венера Равильевна (Врач общей практики, Педиатр)Устимова Вера Николаевна (Гематолог, Терапевт, Трансфузиолог)Фатеева Анастасия Александровна (Гастроэнтеролог, Диетолог, Психотерапевт, Эндокринолог)Федотова Татьяна Владимировна (Врач ультразвуковой диагностики, Гематолог, Терапевт)Фомина Ольга Владимировна (Гематолог, Маммолог, Нарколог, Онколог)Фоминов Олег Эдуардович (Сексолог)Фоминов Олег Эдуардович (Сексолог)Фурманова Елена Александровна (Аллерголог, Иммунолог, Инфекционист, Педиатр)Хасанов Эльзар Халитович (Андролог, Врач ультразвуковой диагностики, Онколог, Уролог, Хирург)Хасанова Гульнара Сунагатулловна (Акушер, Врач ультразвуковой диагностики)Чупанова Аида (Акушер, Гинеколог)Чупанова Аида Идаятовна (Акушер, Гинеколог, Репродуктолог (ЭКО))Швайликова Инна Евненьевна (Окулист (Офтальмолог))Шибанова Мария Александровна (Нефролог, Терапевт)Щепетова Ольга Александровна (Терапевт)Ягудин Денар Лукманович (ЛОР (Оториноларинголог))Ярвела Марианна Юрьевна (Психолог)
..Агабекян Нонна Вачагановна (Акушер, Гинеколог)Айзикович Борис Леонидович (Иммунолог, ЛОР (Оториноларинголог), Невролог, Педиатр, Терапевт, Аллерголог, Гастроэнтеролог)Акмалов Эдуард Альбертович (Аллерголог, Врач спортивной медицины)Александров Павел Андреевич (Венеролог, Гепатолог, Инфекционист, Паразитолог, Эпидемиолог)Александрова Анна Михайловна (Педагог, Психолог, Психотерапевт)Али Мохамед Гамал Эльдин Мансур (Педиатр)Аристова Анастасия Михайловна (Андролог, Уролог, Хирург)Армашов Вадим Петрович (Хирург)Афанасьева Дарья Львовна (Кардиолог, Терапевт)Беляева Елена Александровна (Гинеколог, Невролог, Рефлексотерапевт)Бушаева Ольга Владимировна (Пульмонолог, Терапевт)Врублевская Елена (Педиатр)Гензе Ольга Владимировна (Генетик, Педиатр)Глазной Василий Иванович (Сурдолог)Горохова Юлия Игоревна (Венеролог, Врач общей практики, Дерматолог)Григорьева Алла Сергеевна (Врач общей практики, Терапевт)Демидова Елена Леонидовна (Психолог, Психотерапевт)Денищук Иван Сергеевич (Андролог, Уролог)Дибиров Магомед Гусейнович (Стоматолог)Довгаль Анастасия Юрьевна (Маммолог, Онколог, Радиолог)Долгова Юлия Владимировна (Педиатр)Дьяконова Мария Алексеевна (Гериатр, Терапевт)Жердакова Дарья Владимировна (Акушер, Гинеколог)Загумённая Анна Юрьевна (Врач спортивной медицины, Гирудотерапевт, Диетолог, Косметолог, Терапевт)Зверев Валентин Сергеевич (Ортопед, Травматолог)Згоба Марьяна Игоревна (Окулист (Офтальмолог))Зинченко Вадим Васильевич (Рентгенолог, Хирург)Зорий Евген Владимирович (Невролог, Психолог, Терапевт, Хирург)Извозчикова Нина Владиславовна (Гастроэнтеролог, Дерматолог, Иммунолог, Инфекционист, Пульмонолог)Илона Игоревна (Врач общей практики, Гастроэнтеролог, Терапевт, Эндокринолог)Калявина Светлана Николаевна (Акушер, Гинеколог)Калягина Екатерина (Другая специальность)Карпенко Алик Викторович (Ортопед, Травматолог)Касимов Анар Физули оглы (Онколог, Хирург)Киреев Сергей Александрович (Психиатр, Психолог, Психотерапевт)Кирнос Марина Станиславовна (Стоматолог, Стоматолог детский, Стоматолог-терапевт)Копежанова Гульсум (Акушер, Гинеколог)Корж Анна Анатольевна (Акушер, Гинеколог, Маммолог, Эндокринолог)Кравцов Александр Васильевич (Нарколог, Психиатр)Красильников Андрей Викторович (Врач ультразвуковой диагностики, Медицинский директор, Флеболог, Хирург)Кряжевских Инна Петровна (Терапевт, Гастроэнтеролог)Кудряшова Светлана Петровна (Эндокринолог)Куртанидзе Ираклий Малхазович (Окулист (Офтальмолог))Кущ Елена Владимировна (Диетолог, Терапевт)Лазарева Татьяна Сергеевна (ЛОР (Оториноларинголог))Лаптева Лариса Ивановна (Невролог)Лебединская Татьяна Александровна (Психолог, Психотерапевт)Ледник Максим Леонидович (Венеролог, Дерматолог)Леонова Наталья Николаевна (Детский хирург)Литвиненко Станислав Григорьевич (Ортопед, Травматолог)Лямина Ирина Алексеевна (Акушер)Максименко Татьяна Константиновна (Инфекционист)МАЛЬКОВ РОМАН ЕВГЕНЬЕВИЧ (Диетолог, Остеопат, Реабилитолог)Мамедов Рамис (ЛОР (Оториноларинголог))Мартиросян Яков Ашотович (Детский хирург, Проктолог, Травматолог, Уролог, Хирург)Маряшина Юлия Александровна (Акушер, Венеролог, Врач ультразвуковой диагностики, Гинеколог, Педиатр)Матвеева Ярослава Дмитриевна (Педиатр)Мельшина Алёна Игоревна (Окулист (Офтальмолог))Мершед Хасан Имадович (Вертебролог, Нейрохирург)Миллер Ирина Васильевна (Невролог)Мильдзихова АЛЬБИНА Бексолтановна (Врач общей практики, Гинеколог, ЛОР (Оториноларинголог), Педиатр, Терапевт)Муратова Наталья Сергеевна (Врач общей практики, Диетолог)Мухорин Виктор Павлович (Нефролог)Наумов Алексей Алексеевич (Мануальный терапевт)Никитина Анна Алексеевна (Окулист (Офтальмолог))Никишин Андрей Александрович (Психиатр, Психолог, Психотерапевт)Ольга Викторовна (Невролог, Неонатолог, Педиатр, Реабилитолог, Терапевт)Павлова Мария Игоревна (Стоматолог, Стоматолог-хирург, Челюстно-лицевой хирург)Панигрибко Сергей Леонидович (Венеролог, Дерматолог, Косметолог, Массажист, Миколог)Пантелеева Кристина Алексеевна (Невролог)Пастель Владимир Борисович (Ортопед, Ревматолог, Травматолог, Хирург)Паунок Анатолий Анатольевич (Андролог, Уролог)Першина Наталия Сергеевна (Невролог)Пикульская Вита Григорьевна (Терапевт)Прокофьева Анастасия Михайловна (ЛОР (Оториноларинголог))Прохоров Иван Алексеевич (Нейрохирург, Хирург)Пушкарев Александр Вольдемарович (Гинеколог, Психотерапевт, Реабилитолог, Репродуктолог (ЭКО), Эндокринолог)Пьянцева Екатерина Вячеславна (Педиатр)Радевич Игорь Тадеушевич (Андролог, Венеролог, Сексолог, Уролог)Сапрыкина Ольга Александровна (Невролог)Свечникова Анастасия Евгеньевна (Стоматолог, Стоматолог детский, Стоматолог-ортопед, Стоматолог-терапевт, Стоматолог-хирург)Семений Александр Тимофеевич (Врач общей практики, Реабилитолог, Терапевт)Сергейчик Никита Сергеевич (Анестезиолог, Гомеопат)Силуянова Валерия Викторовна (Акушер, Врач ультразвуковой диагностики, Гинеколог)Соболь Андрей Аркадьевич (Кардиолог, Нарколог, Невролог, Психиатр, Психотерапевт)Солдатов Вадим Александрович (Невролог)Сошникова Наталия Владимировна (Эндокринолог)Степанова Татьяна Владимировна (ЛОР (Оториноларинголог))Степашкина Анастасия Сергеевна (Гематолог, Пульмонолог, Терапевт)Сурова Лидия (Гирудотерапевт, Невролог, Терапевт)Суханова Оксана Александровна (Клинический фармаколог, Психолог)Сухих Данил Витальевич (Психиатр)Тимченко Алла Владимировна (Дерматолог, Косметолог)Тихомиров Сергей Евгеньевич (Нейрохирург)Тумарец Кирилл Михайлович (Врач лечебной физкультуры, Врач спортивной медицины, Кинезитерапевт, Реабилитолог, Физиотерапевт)Турлыбекова Венера Равильевна (Врач общей практики, Педиатр)Устимова Вера Николаевна (Гематолог, Терапевт, Трансфузиолог)Фатеева Анастасия Александровна (Гастроэнтеролог, Диетолог, Психотерапевт, Эндокринолог)Федотова Татьяна Владимировна (Врач ультразвуковой диагностики, Гематолог, Терапевт)Фомина Ольга Владимировна (Гематолог, Маммолог, Нарколог, Онколог)Фоминов Олег Эдуардович (Сексолог)Фоминов Олег Эдуардович (Сексолог)Фурманова Елена Александровна (Аллерголог, Иммунолог, Инфекционист, Педиатр)Хасанов Эльзар Халитович (Андролог, Врач ультразвуковой диагностики, Онколог, Уролог, Хирург)Хасанова Гульнара Сунагатулловна (Акушер, Врач ультразвуковой диагностики)Чупанова Аида (Акушер, Гинеколог)Чупанова Аида Идаятовна (Акушер, Гинеколог, Репродуктолог (ЭКО))Швайликова Инна Евненьевна (Окулист (Офтальмолог))Шибанова Мария Александровна (Нефролог, Терапевт)Щепетова Ольга Александровна (Терапевт)Ягудин Денар Лукманович (ЛОР (Оториноларинголог))Ярвела Марианна Юрьевна (Психолог)
Описание проблемы:
Пол:
—укажите пол—ЖенщинаМужчина
Возраст:
Категория 18+:
Обычный18+
Staphylococcus aureus 10 в 5 степени — Вопрос лору
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.16% вопросов.
Оставайтесь с нами и будьте здоровы!
что это значит и что делать
В мире, помимо животных и растений, обитает масса микроорганизмов, которые могут быть полезными или вредными для человека. Это бактерии и вирусы. И если говорить об одном из наиболее сложных в лечении и, соответственно, опасном виде, то это золотистый стафилококк, по латыни – Staphylococcus aureus.
Что же делать в такой ситуации ? Для начала советуем почитать эту статью. В данной статье подробно описываются методы борьбы с паразитами. Также рекомендуем обратиться к специалисту. Читать статью >>>
Общая информация о золотистом стафилококке
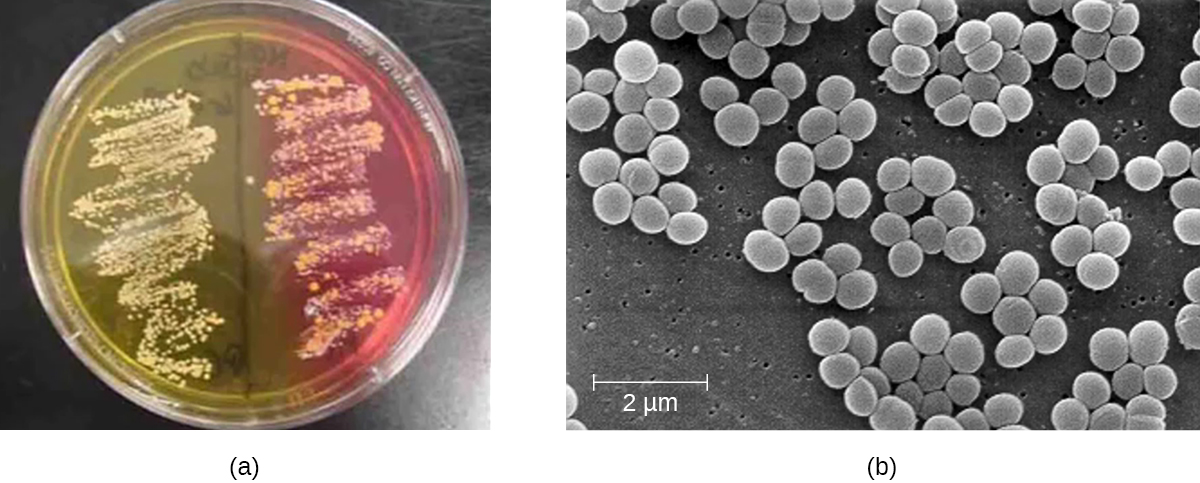
Что это? Бактерия, относящаяся к классу анаэробных, то есть, способных жить без воздуха, неподвижная, Грам-положительная. Существует немало типов стафилококка, но именно золотистый наиболее опасный. Назвали его так не из-за цвета. Ауреус – потому что при посеве в питательную среду колония бактерий дает желто-золотистое окрашивание.
Сразу можно подумать, что микроорганизм редко встречается, но на самом деле, его можно обнаружить везде. Бактерия живет на коже и слизистых человека, прекрасно себя чувствует в окружающей среде: на мебели, игрушках, посуде, деньгах.
Это объясняется высокой устойчивостью микроорганизма к антисептикам, моющим средства, даже кипячению (гибнет только через 10 минут), замораживанию. Не боится стафилококк и спирта, перекиси водорода. Единственное из доступных средств, которое может убить бактерию – обычная «Зеленка».
Чаще всего обнаруживается золотистый стафилококк в носу.
Впрочем, несмотря на распространенность, этот микроорганизм вызывает заболевания редко, даже живя на теле человека. Для того чтобы развилось воспаление, необходимо снижение иммунитета. Только в этом случае бактерии начнут активную деятельность и вызовут самые разные болезни кожи и слизистых.
Опасность золотистого стафилококка в том, что он устойчив к пенициллиновым антибиотикам за счет выработки лидазы и пенициллиназы – ферментов, разрушающих белки. Эти же вещества расплавляют кожу и слизистые, помогая бактериям проникнуть в организм.
Эти же вещества расплавляют кожу и слизистые, помогая бактериям проникнуть в организм.
Кроме того, стафилококк вырабатывает эндотоксин, вызывающий у человека интоксикацию, пищевое отравление и инфекционно-токсический шок – опасное состояние, которое крайне сложно поддается лечению.
Стоит прибавить к этому отсутствие постоянного иммунитета к таким бактериям. То есть, переболев инфекцией, человек все так же рискует заболеть вновь.
Подобрать лекарства от паразитов
Этот сервис — небольшой помощник в поиске лекарств от паразитов. Чтобы начать им пользоваться, выберите вид паразита. Если вы не знаете, каким паразитом заражены – вам поможет этот определитель паразитов по симптомам.
Норма показателей золотистого стафилококка
Как уже было сказано выше, бактерия есть везде. Но если был обнаружен стафилококк, это еще не повод для паники, есть определенные нормы содержания его на коже, слизистых, предметах.
Многие начинают переживать, получив результаты анализа: стафилококк золотистый 10 в 4, или, к примеру, золотистый стафилококк 10 в 3.
Чтобы разобраться, нужно понимать принципы определения количества микроорганизмов в биоматериале.
Существует 4 степени роста бактерий:
- – слабый рост;
- – рост до 10 колоний одного вида;
- – рост от 10 до 100 колоний;
- – рост больше 100 колоний;
Понятно, что чем больше степень, тем выше количество бактерий, соответственно, активнее патологический процесс. Первые две степени говорят о присутствии бактерии в биоматериале, третья – о том, что началась болезнь, стафилококк 4 степени – это уже выраженная патология.
Как расшифровать данные посева? Для каждого органа есть свои нормы. Так, золотистый стафилококк 10 в 6 степени – верхняя граница нормы. Обнаруживаемый микроорганизм в носу, зеве или горле, посевах кала пока еще не несет опасности.
То есть, если анализы показывают золотистый стафилококк 10 в 5 степени или ниже, причин для особой паники нет. Возможно, потребуется лечение, но в каждом конкретном случае решает врач, учитывая многие нюансы.

Конечно же, чем меньше цифра, тем лучше, но если обнаруживается стафилококк 10 в 3 степени, это вариант нормы.
Пройти тест на наличие глистов
Диагностика и степени заражения
Данный микроорганизм присутствует в организме каждого человека. Нормальным показателем является 10 в 3 степени. Если степень заражения превышает эти показатели, но негативная симптоматика не наблюдается, лечение не проводят – иммунная система может самостоятельно справиться с таким количеством бактерий.
Для обнаружения бактерии назначают:
- коагулазный тест;
- латекс-агглютинацию;
- общий анализ крови;
- анализ мочи;
- посев на питательные среды;
- реакция Видаля;
- фаготипирование;
- посев кала.
Лечение Staphylococcus Aureus
Обычно лечение staphylococcus aureus назначают, если анализы дают результат КОЕ 10*4. Однако важно учитывать – если такая степень заражения не проявляется негативной симптоматикой, лечение не требуется.
Показатели 10*5 характеризуются массивным инфицированием, обычно сопровождаются выраженной, интенсивной симптоматикой. В таких случаях необходимо подобрать антибактериальное лечение. Терапия проходит комплексно и включает в себя симптоматическое лечение.
Врач подбирает наиболее эффективные антибиотики, которые могут воздействовать на бактерию. Курс лечения сопровождается приемом иммуномодуляторов и витаминных комплексов, пробиотиков.
Все препараты направлены на борьбу с инфекцией, восстановление местной микрофлоры, укрепления защитных функций организма и исключение вероятности рецидива, чему способствует соблюдение профилактических правил.
В некоторых случаях требуется удаление поврежденных тканей с помощью хирургических методов.
Золотистый стафилококк является опасным для человека микроорганизмом. Он присутствует в организме каждого и никак себя не проявляет, но если иммунная система ослабевает, человек сталкивается с развитием серьезных патологических состояний.
Самолечение в этом случае крайне не рекомендуется – оно может значительно усугубить проблему, осложнить процесс дальнейшей терапии и выздоровления. Без своевременной медицинской помощи инфекция может стать причиной гибели человека.
Какой должна быть норма?
Норма результата зависит от того, из какой среды взят мазок. В основном действует правило, чем меньше, тем лучше.
- Кровь и моча у здорового человека стерильны, не содержат бактерий.
- В кале здорового пациента содержится незначительное количество микроорганизмов – стафилококки не являются основой кишечной микрофлоры. Положительный результат говорит о бактерионосительстве или гнойном заболевании.
- Наличие инфекции в ране говорит о гнойной инфекции или высоком риске её развития.
- На слизистых верхней границей нормы считается 10*6 степени – если бактерий больше, это говорит о наличии заболевания.
Отдельные показатели
Результат выдаётся в виде цифры – это количество бактериальных клеток, ставших основами колонии (КОЕ) на 1 мл среды. Тест проводится на питательной среде для бактерий – исследуемый материал помещают в специальную закрытую ёмкость, и если возбудители присутствуют, то они начнут активно размножаться.
Тест проводится на питательной среде для бактерий – исследуемый материал помещают в специальную закрытую ёмкость, и если возбудители присутствуют, то они начнут активно размножаться.
10 в 2 степени
- Если такой показатель обнаружен на коже, в носу или глотке – это вариант нормы. Никаких действий в этом случае предпринимать не надо. Если есть какие-либо проблемы с кожей, то вызваны они другими микроорганизмами.
- Если такая концентрация обнаружена в кале, то при хорошем самочувствии она считается нормой. Возможно, врач выдаст рекомендации по питанию. Если имеются симптомы расстройства пищеварения, то пациенту необходимо начать лечение от дисбактериоза.
- Во влагалище такой результат характерен для мазка на степень чистоты 3 или 4. Это ещё не означает заболевание, но предрасполагает к нему. Желательно пройти санацию влагалища, но это не срочно. Опасным такой результат становится только при беременности.
- В моче небольшое количество стафилококка может говорить о воспалительном процессе или кратковременной бактериурии.
 Требуется повторный забор мочи через 2-3 дня.
Требуется повторный забор мочи через 2-3 дня. - В крови любое количество микроорганизмов – опасный признак. Если нет симптомов сепсиса, требуется повторный анализ через 2-3 дня после получения результатов.
- В ране появление такого количества микроорганизмов не является важным диагностическим признаком. Требуется повторный анализ.
10 в 3
- Для кожи такое значение вполне нормально. Слизистая рта и носа показывает такой результат как в норме, так и при начинающихся заболеваниях.
- Обнаружение в кале – возможное бактерионосительство, требуется повторный анализ.
- Во влагалище ситуация аналогична предыдущему пункту.
- В моче – скорее всего имеет место воспалительный процесс в мочевыводящих путях (мочекаменная болезнь, реже – цистит).
- В ране – признак высокого риска развития гнойной инфекции.
10 в 4
- На коже фиксируется при угревой болезни лёгкой степени, но может наблюдаться в норме.
- Слизистая носа и глотки – признак хронических респираторных инфекций.

- В кале – бактерионосительство или дисбактериоз, пациенту не рекомендована работа с пищевыми продуктами или контакт с детьми (требуется санация), в других случаях она не обязательна.
- Во влагалище – показатель активного роста патогенной микрофлоры.
- В моче характерен для мочекаменной болезни и цистита в стадии ремиссии.
- В ране – указывает на начавшийся инфекционный процесс.
10 в 5
- На коже – угревая сыпь, фурункулёз, может наблюдаться у здоровых людей.
- Носоглотка – хронические респираторные патологии, простуда с риском осложнений.
- Кал – носительство или активно протекающая инфекция.
- Во влагалище — бактериальный вагинит.
- Моча – острый цистит.
10 в 6
- На коже – верхняя граница нормальных значений, может встречаться при угревой болезни разной степени выраженности.
- В носоглотке – при инфекционных болезнях.
- Другие среды – острый воспалительный процесс.
Заключение
Своевременное обнаружение возбудителя необходимо для лечения и профилактики различных проблем со здоровьем. В первую очередь это касается кожного покрова и слизистых оболочек, поскольку именно там чаще всего выявляется патогенная микрофлора. Бороться с ней можно антибиотиками и средствами, повышающими иммунитет (общий и местный). Также не следует забывать о личной гигиене, правильном питании и закаливании.
В первую очередь это касается кожного покрова и слизистых оболочек, поскольку именно там чаще всего выявляется патогенная микрофлора. Бороться с ней можно антибиотиками и средствами, повышающими иммунитет (общий и местный). Также не следует забывать о личной гигиене, правильном питании и закаливании.
Победить паразитов можно!
Антипаразитарный комплекс® — Надежное и безопасное избавление от паразитов за 21 день!
- В состав входят только природные компоненты;
- Не вызывает побочных эффектов;
- Абсолютно безопасен;
- Защищает от паразитов печень, сердце, легкие, желудок, кожу;
- Выводит из организма продукты жизнедеятельности паразитов.
- Эффективно уничтожает большую часть видов гельминтов за 21 день.
Сейчас действует льготная программа на бесплатную упаковку. Читать мнение экспертов.
Список литературы
- Centers for Disease Controland Prevention.
 Brucellosis. Parasites. Ссылка
Brucellosis. Parasites. Ссылка - Corbel M. J. Parasitic diseases // World Health Organization. Ссылка
- Young E. J. Best matches for intestinal parasites // Clinical Infectious Diseases. — 1995. Vol. 21. — P. 283-290. Ссылка
- Ющук Н.Д., Венгеров Ю. А. Инфекционные болезни: учебник. — 2-е издание. — М.: Медицина, 2003. — 544 с.
- Распространенность паразитарных болезней среди населения, 2009 / Коколова Л. М., Решетников А. Д., Платонов Т. А., Верховцева Л. А.
- Гельминты домашних плотоядных Воронежской области, 2011 / Никулин П. И., Ромашов Б. В.
Статья для пациентов с диагностированной доктором болезнью. Не заменяет приём врача и не может использоваться для самодиагностики.
Лучшие истории наших читателей
Тема: Во всех бедах виноваты паразиты!
От кого: Людмила С. ([email protected])
Кому: Администрации Noparasites.ru
Не так давно мое состояние здоровья ухудшилось. Начала чувствовать постоянную усталость, появились головные боли, лень и какая-то бесконечная апатия. С ЖКТ тоже появились проблемы: вздутие, понос, боли и неприятный запах изо рта.
Начала чувствовать постоянную усталость, появились головные боли, лень и какая-то бесконечная апатия. С ЖКТ тоже появились проблемы: вздутие, понос, боли и неприятный запах изо рта.
Думала, что это из-за тяжелой работы и надеялась, что само все пройдет. Но с каждым днем мне становилось все хуже. Врачи тоже ничего толком сказать не могли. Вроде как все в норме, но я-то чувствую, что мой организм не здоров.
Решила обратиться в частную клинику. Тут мне посоветовали на ряду с общими анализами, сдать анализ на паразитов. Так вот в одном из анализов у меня обнаружили паразитов. По словам врачей – это были глисты, которые есть у 90% людей и заражен практически каждый, в большей или меньшей степени.
Мне назначили курс противопаразитных лекарств. Но результатов мне это не дало. Через неделю мне подруга прислала ссылку на одну статью, где какой-то врач паразитолог делился реальными советами по борьбе с паразитами. Эта статья буквально спасла мою жизнь. Я выполнила все советы, что там были и через пару дней мне стало гораздо лучше!
Улучшилось пищеварение, прошли головные боли и появилась та жизненная энергия, которой мне так не хватало. Для надежности, я еще раз сдала анализы и никаких паразитов не обнаружили!
Для надежности, я еще раз сдала анализы и никаких паразитов не обнаружили!
Кто хочет почистить свой организм от паразитов, причем неважно, какие виды этих тварей в вас живут — прочитайте эту статью, уверена на 100% вам поможет! Перейти к статье>>>
Надежное и эффективное средство для борьбы с глистами. Выводит всех паразитов за 21 день.
Как Избавить свой организм от опасных для жизни паразитов, пока не поздно!
Врач паразитолог рассказывает, каке существуют эффективные методы борьбы с гельминтами.
Поиск лекрств от паразитов
Этот сервис — небольшой помощник в поиске лекарств от паразитов. Чтобы начать им пользоваться, выберите вид паразита. Если вы не знаете, каким паразитом заражены – вам поможет этот определитель паразитов по симптомам.
Советуем почитать
Инфекция в горле — вопрос от пациента медицинского центра «ГУТА КЛИНИК»
Функциональная диагностика и УЗИ
Дудин
Михаил Михайлович
Врач УЗИ диагностики
Карпочев
Максим Викторович
Ведущий врач УЗ диагностики
Баранова
Юлия Викторовна
Акушер-гинеколог, гинеколог-эндокринолог, врач УЗ диагностики
Фроловская
Людмила Викторовна
Акушер-гинеколог, врач УЗД
Базарнова
Евгения Васильевна
Врач УЗД
Басаков
Кирилл Сергеевич
Хирург-маммолог, врач УЗД, рентгенолог
Муртазалиева
Айна Абдулаевна
Маммолог-онколог, рентгенолог, врач УЗД
Рентгенология
Кивасев
Станислав Александрович
Рентгенолог, замдиректора по лучевой диагностике
Нечаев
Валентин Александрович
Рентгенолог
Басарболиев
Алексей Викторович
Рентгенолог
Тихонова
Валерия Сергеевна
Рентгенолог
Мухин
Андрей Андреевич
Рентгенолог
Крысанова
Александра Владимировна
Рентгенолог
Васильева
Юлия Николаевна
Рентгенолог
Шульц
Евгений Игоревич
Рентгенолог
Звездина
Дарья Максимовна
Рентгенолог
Андрианова
Вера Николаевна
Рентгенолог
Гончар
Анна Павловна
Рентгенолог
Терапия
Горбачева
Елена Владимировна
Кардиолог, терапевт
Карданова
Ольга Дмитриевна
Кардиолог, терапевт (ведущий специалист)
Шашкова
Татьяна Валерьевна
Терапевт, кардиолог, врач функц. диагностики
диагностики
Комиссаренко
Ирина Арсеньевна
Гастроэнтеролог, терапевт, кардиолог
Кускунова
Евгения Александровна
Терапевт
Михейкина
Ирина Васильевна
Терапевт
Ахкямова
Мария Альбертовна
Физиотерапия
Родина
Елена Вячеславовна
Физиотерапевт
Хан
Иннокентий Евгеньевич
Врач ЛФК
Кардиология
Горбачева
Елена Владимировна
Кардиолог, терапевт
Карданова
Ольга Дмитриевна
Кардиолог, терапевт (ведущий специалист)
Шашкова
Татьяна Валерьевна
Терапевт, кардиолог, врач функц. диагностики
диагностики
Комиссаренко
Ирина Арсеньевна
Гастроэнтеролог, терапевт, кардиолог
Ветрова
Зарема Давлетовна
Кардиолог, врач функциональной диагностики
Андреев
Дмитрий Александрович
Кардиолог
Сапожникова
Ольга Алексеевна
Кардиолог
Аудиология и слухопротезирование
Паукова
Марина Владимировна
Сурдолог-оториноларинголог
Колтышева
Екатерина Борисовна
Врач функциональной диагностики
Левина
Юлия Викторовна
Сурдолог-оториноларинголог
Неврология и мануальная терапия
Замерград
Максим Валерьевич
Невролог, консультант Центра головокружения и нарушения равновесия
Небожин
Александр Иванович
Мануальный терапевт, невролог
Иванова
Татьяна Андреевна
Невролог
Екушева
Евгения Викторовна
Невролог-алголог
Толстенева
Александра Игоревна
Невролог, детский невролог
Новиков
Сергей Александрович
Невролог, руководитель Центра алгологии
Лабораторные услуги
Дерматология и трихология
Захарова
Наталья Викторовна
Дерматолог, трихолог, косметолог
Шуляк
Ирина Степановна
Дерматолог, трихолог, косметолог
Массаж
Ермуш
Станислав Геннадьевич
Массажист
Эндокринология
Бахтеева
Ирина Владимировна
Эндокринолог
Аллергология-иммунология
Козулина
Ирина Евгеньевна
Аллерголог-иммунолог
Стационар
Гнелица
Николай Викторович
Анестезиолог-реаниматолог
Добролюбов
Евгений Евгеньевич
Анестезиолог-реаниматолог
Цыба
Николай Александрович
Анестезиолог-реаниматолог
Антоненко
Дмитрий Валерьевич
Анестезиолог-реаниматолог
Сагалович
Михаил Абрамович
Анестезиолог-реаниматолог
Флебология
Даньков
Дмитрий Васильевич
Хирург-флеболог, врач УЗД
Косметология
Захарова
Наталья Викторовна
Дерматолог, трихолог, косметолог
Шуляк
Ирина Степановна
Дерматолог, трихолог, косметолог
Гепатология
Комиссаренко
Ирина Арсеньевна
Гастроэнтеролог, терапевт, кардиолог
Мухамеджанова
Эльвира Равиловна
Гастроэнтеролог
Гинекология
Душкина
Ирина Александровна
Акушер-гинеколог, гинеколог-эндокринолог
Горский
Сергей Леонидович
Ведущий хирург-гинеколог
Егорова
Елена Анатольевна
Акушер-гинеколог, гинеколог-эндокринолог
Афанасьев
Максим Станиславович
Акушер-гинеколог, онкогинеколог
Баранова
Юлия Викторовна
Акушер-гинеколог, гинеколог-эндокринолог, врач УЗ диагностики
Фроловская
Людмила Викторовна
Акушер-гинеколог, врач УЗД
Проктология
Мормышев
Вячеслав Николаевич
Проктолог
Бабаджанян
Арутюн Радионович
Проктолог
Педиатрия
Варенкова
Ольга Владимировна
Оториноларинголог
Поддо
Галина Николаевна
Психотерапевт (ведущий специалист)
Небожин
Александр Иванович
Мануальный терапевт, невролог
Маркина
Елена Александровна
Нефролог, руководитель Центра нефрологии
Строк
Ирина Викторовна
Педиатр, неонатолог
Болучевский
Дмитрий Николаевич
Уролог-андролог, детский уролог-андролог
Фроловская
Людмила Викторовна
Акушер-гинеколог, врач УЗД
Малышева
Ольга Дмитриевна
Оперирующий оториноларинголог
Шафоростова
Екатерина Васильевна
Стоматолог-ортодонт
Толстенева
Александра Игоревна
Невролог, детский невролог
Маргиева
Диана Анатольевна
Детский уролог-андролог, хирург
Цибиков
Илья Владимирович
Травматолог-ортопед
Криворотько
Михаил Сергеевич
Травматолог-ортопед
Верещагин
Лев Владиславович
Офтальмолог, детский офтальмолог
Кибизова
Лаура Георгиевна
Офтальмолог
Щербакова
Елена Михайловна
Детский офтальмолог
Эндоскопия
Мардачев
Олег Александрович
Эндоскопист
Хайдурова
Татьяна Константиновна
Эндоскопист
Бабаджанян
Арутюн Радионович
Проктолог
Центр травматологии и ортопедии
ЛОР (оториноларингология)
Боклин
Андрей Кузьмич
Оториноларинголог
Варенкова
Ольга Владимировна
Оториноларинголог
Марковская
Наталья Геннадьевна
Оториноларинголог
Харина
Дарья Всеволодовна
Оториноларинголог, фониатр
Мирошниченко
Андрей Петрович
Оперирующий оториноларинголог,
Коршунова
Наталья Александровна
Оториноларинголог
Малышева
Ольга Дмитриевна
Оперирующий оториноларинголог
Джафарова
Марьям Зауровна
Оперирующий оториноларинголог
Гастроэнтерология
Комиссаренко
Ирина Арсеньевна
Гастроэнтеролог, терапевт, кардиолог
Мухамеджанова
Эльвира Равиловна
Гастроэнтеролог
Урология-андрология
Долженок
Андрей Николаевич
Уролог-андролог
Болучевский
Дмитрий Николаевич
Уролог-андролог, детский уролог-андролог
Маргиева
Диана Анатольевна
Детский уролог-андролог, хирург
Шамов
Денис Алексеевич
Уролог — андролог
Шарунов
Вячеслав Викторович
Уролог — андролог
Стоматология. Терапия
Терапия
Орлова
Елизавета Сергеевна
Стоматолог-терапевт, детский стоматолог
Бабкина
Екатерина Сергеевна
Стоматолог-терапевт
Сизова
Елизавета Игоревна
Стоматолог-терапевт
Хирургия
Трофимова
Ольга Викторовна
Хирург
Туманов
Андрей Борисович
Хирург
Кипарисов
Владислав Борисович
Хирург
Терехин
Алексей Алексеевич
Хирург
Психотерапия
Поддо
Галина Николаевна
Психотерапевт (ведущий специалист)
Офтальмология
Миронкова
Елена Александровна
Офтальмолог
Паршунина
Ольга Алексеевна
Офтальмолог, ретинолог. лазерный хирург
лазерный хирург
Верещагин
Лев Владиславович
Офтальмолог, детский офтальмолог
Кибизова
Лаура Георгиевна
Офтальмолог
Щербакова
Елена Михайловна
Детский офтальмолог
Центр головокружения и нарушения равновесия
Паукова
Марина Владимировна
Сурдолог-оториноларинголог
Замерград
Максим Валерьевич
Невролог, консультант Центра головокружения и нарушения равновесия
Колтышева
Екатерина Борисовна
Врач функциональной диагностики
Мельников
Олег Анатольевич
Отоневролог, руководитель Центра головокружения и нарушения равновесия
Иванова
Татьяна Андреевна
Невролог
Травматология и ортопедия
Герасимов
Денис Олегович
Хирург травматолог-ортопед, ведущий специалист
Цибиков
Илья Владимирович
Травматолог-ортопед
Криворотько
Михаил Сергеевич
Травматолог-ортопед
Николаев
Антон Валерьевич
Травматолог-ортопед
Загородний
Николай Васильевич
Травматолог-ортопед
Шнайдер
Лев Сергеевич
Травматолог-ортопед
МРТ Ingenia 3. 0T
0T
Кивасев
Станислав Александрович
Рентгенолог, замдиректора по лучевой диагностике
Нечаев
Валентин Александрович
Рентгенолог
Басарболиев
Алексей Викторович
Рентгенолог
Тихонова
Валерия Сергеевна
Рентгенолог
Мухин
Андрей Андреевич
Рентгенолог
Крысанова
Александра Владимировна
Рентгенолог
Васильева
Юлия Николаевна
Рентгенолог
Шульц
Евгений Игоревич
Рентгенолог
Звездина
Дарья Максимовна
Рентгенолог
Компьютерная томография
Кивасев
Станислав Александрович
Рентгенолог, замдиректора по лучевой диагностике
Нечаев
Валентин Александрович
Рентгенолог
Басарболиев
Алексей Викторович
Рентгенолог
Тихонова
Валерия Сергеевна
Рентгенолог
Мухин
Андрей Андреевич
Рентгенолог
Крысанова
Александра Владимировна
Рентгенолог
Васильева
Юлия Николаевна
Рентгенолог
Шульц
Евгений Игоревич
Рентгенолог
Звездина
Дарья Максимовна
Рентгенолог
Маммография
Кивасев
Станислав Александрович
Рентгенолог, замдиректора по лучевой диагностике
Крысанова
Александра Владимировна
Рентгенолог
Басаков
Кирилл Сергеевич
Хирург-маммолог, врач УЗД, рентгенолог
Муртазалиева
Айна Абдулаевна
Маммолог-онколог, рентгенолог, врач УЗД
Гончар
Анна Павловна
Рентгенолог
Денситометрия
Кивасев
Станислав Александрович
Рентгенолог, замдиректора по лучевой диагностике
Нечаев
Валентин Александрович
Рентгенолог
Басарболиев
Алексей Викторович
Рентгенолог
Тихонова
Валерия Сергеевна
Рентгенолог
Мухин
Андрей Андреевич
Рентгенолог
Звездина
Дарья Максимовна
Рентгенолог
Нефрология
Маркина
Елена Александровна
Нефролог, руководитель Центра нефрологии
Центр нефрологии
Детская стоматология
Орлова
Елизавета Сергеевна
Стоматолог-терапевт, детский стоматолог
Стоматология. Хирургия
Хирургия
Кулиш
Александр Александрович
Стоматолог-хирург, имплантолог
Стоматология. Ортопедия
Богословский
Владимир Александрович
Стоматолог-ортопед
Захарченко
Александр Валериевич
Стоматолог-ортопед
Диагностика COVID-19
Маммология
Басаков
Кирилл Сергеевич
Хирург-маммолог, врач УЗД, рентгенолог
Муртазалиева
Айна Абдулаевна
Маммолог-онколог, рентгенолог, врач УЗД
Запиров
Гаджимурад Магомедович
Маммолог-хирург, онколог, рентгенолог
Online-консультация врача от 1490 ₽
Паукова
Марина Владимировна
Сурдолог-оториноларинголог
Варенкова
Ольга Владимировна
Оториноларинголог
Карданова
Ольга Дмитриевна
Кардиолог, терапевт (ведущий специалист)
Марковская
Наталья Геннадьевна
Оториноларинголог
Шашкова
Татьяна Валерьевна
Терапевт, кардиолог, врач функц.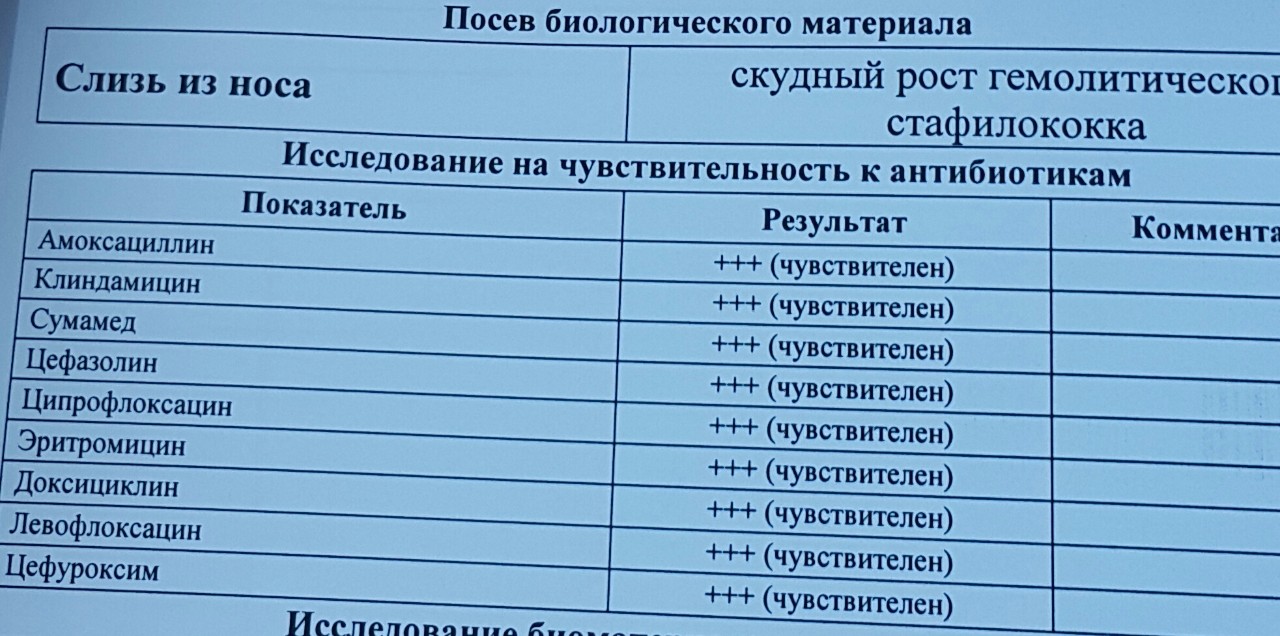 диагностики
диагностики
Поддо
Галина Николаевна
Психотерапевт (ведущий специалист)
Комиссаренко
Ирина Арсеньевна
Гастроэнтеролог, терапевт, кардиолог
Иванова
Татьяна Андреевна
Невролог
Маркина
Елена Александровна
Нефролог, руководитель Центра нефрологии
Бахтеева
Ирина Владимировна
Эндокринолог
Строк
Ирина Викторовна
Педиатр, неонатолог
Коршунова
Наталья Александровна
Оториноларинголог
Малышева
Ольга Дмитриевна
Оперирующий оториноларинголог
Туманов
Андрей Борисович
Хирург
Герасимов
Денис Олегович
Хирург травматолог-ортопед, ведущий специалист
Толстенева
Александра Игоревна
Невролог, детский невролог
Цибиков
Илья Владимирович
Травматолог-ортопед
Депозитная система
Служба помощи на дому
Слащева
Ольга Михайловна
терапевт
Коршунова
Наталья Александровна
Оториноларинголог
Ахкямова
Мария Альбертовна
Медицинские справки
Стоматология. Имплантология
Имплантология
Кулиш
Александр Александрович
Стоматолог-хирург, имплантолог
МРТ открытого типа
Кивасев
Станислав Александрович
Рентгенолог, замдиректора по лучевой диагностике
Нечаев
Валентин Александрович
Рентгенолог
Басарболиев
Алексей Викторович
Рентгенолог
Тихонова
Валерия Сергеевна
Рентгенолог
Мухин
Андрей Андреевич
Рентгенолог
Крысанова
Александра Владимировна
Рентгенолог
Васильева
Юлия Николаевна
Рентгенолог
Шульц
Евгений Игоревич
Рентгенолог
Звездина
Дарья Максимовна
Рентгенолог
Центр маммологии
Стоматология.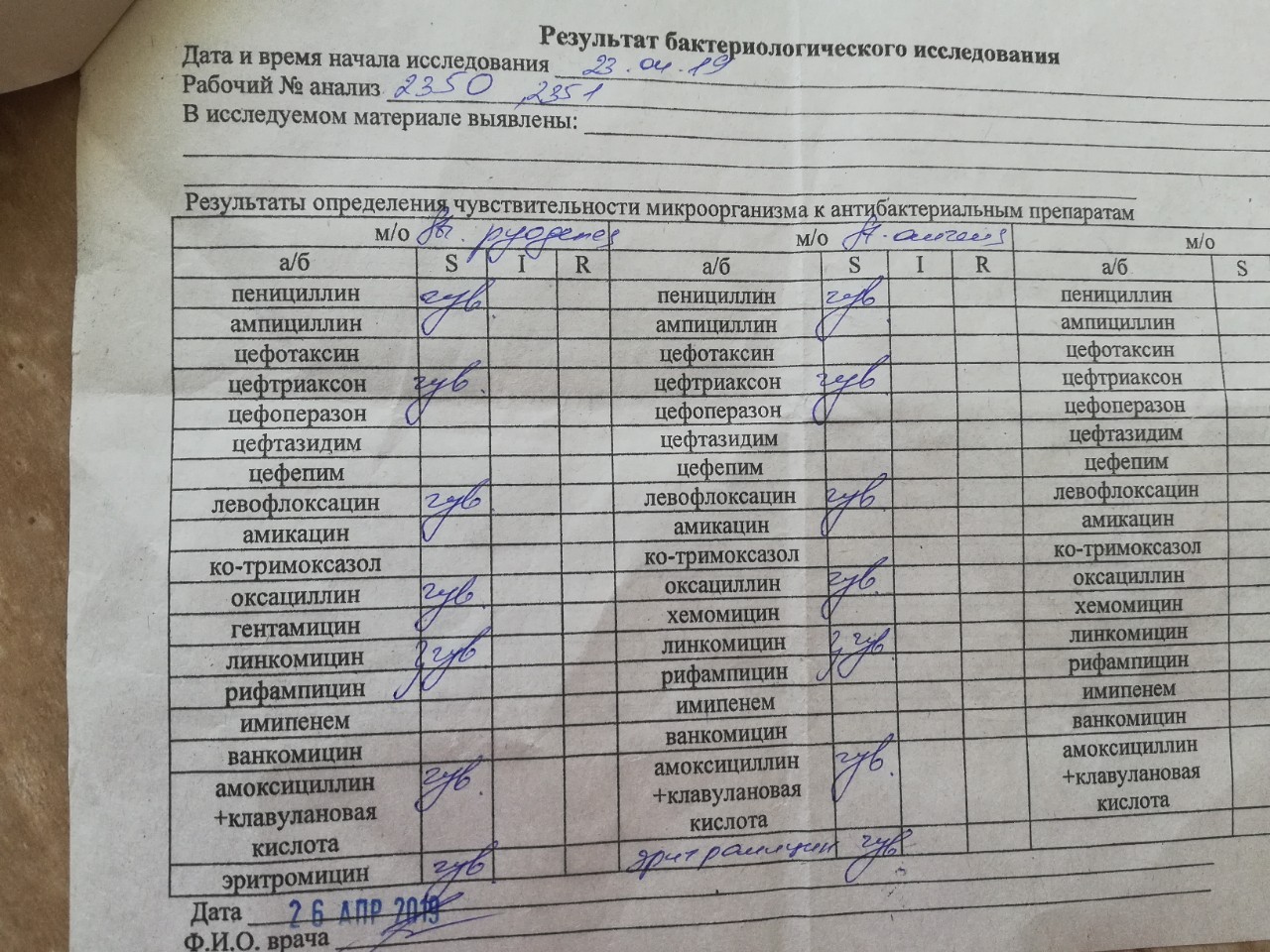 Ортодонтия
Ортодонтия
Шафоростова
Екатерина Васильевна
Стоматолог-ортодонт
Ревматология
Ушакова
Мария Анатольевна
Ревматолог
Старовойтова
Майя Николаевна
Ревматолог
Вакцинация от COVID-19
Центр алгологии
нормы содержания и вызываемые патологии
В мире, помимо животных и растений, обитает масса микроорганизмов, которые могут быть полезными или вредными для человека.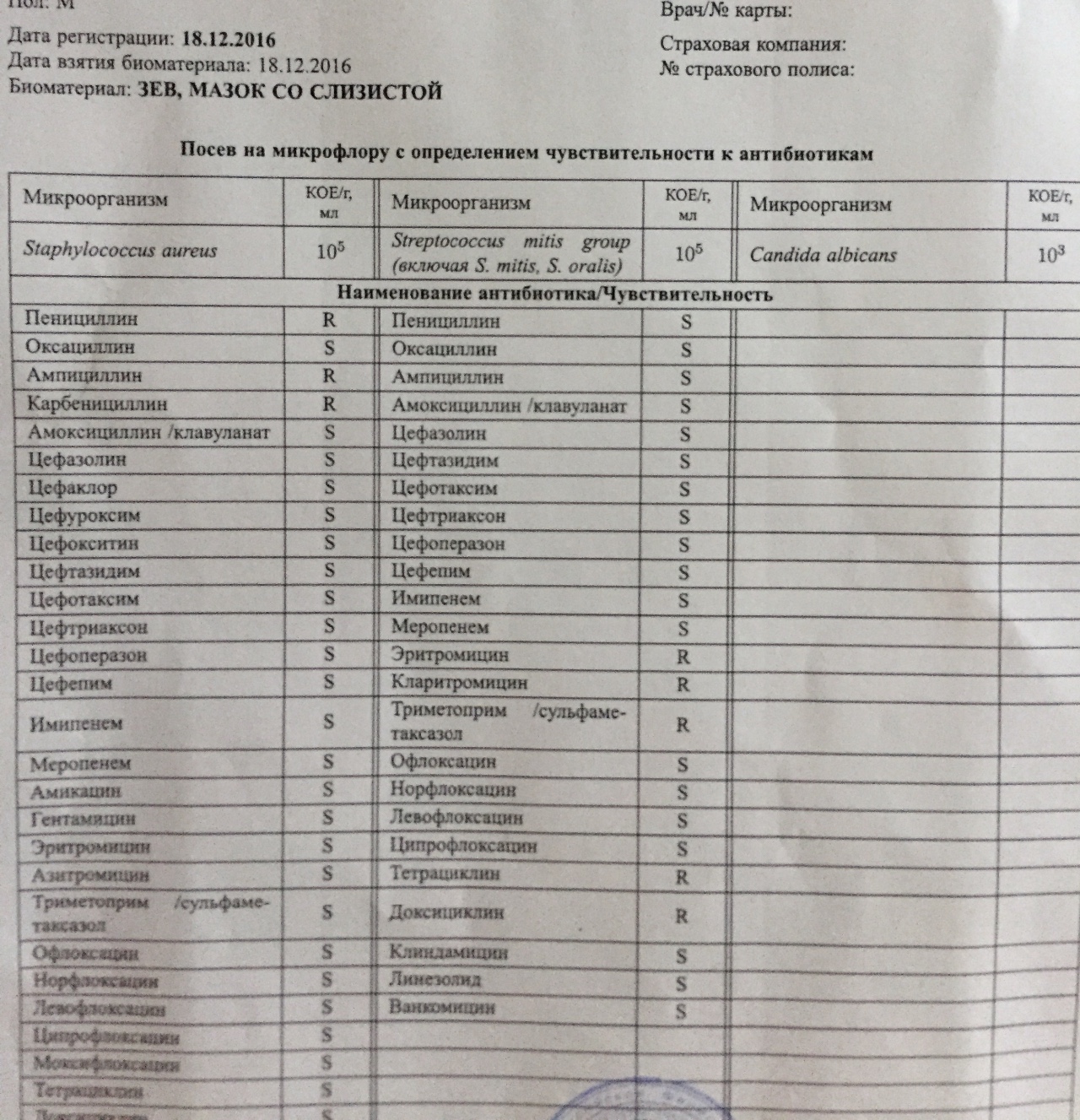 Это бактерии и вирусы. И если говорить об одном из наиболее сложных в лечении и, соответственно, опасном виде, то это золотистый стафилококк, по латыни – Staphylococcus aureus.
Это бактерии и вирусы. И если говорить об одном из наиболее сложных в лечении и, соответственно, опасном виде, то это золотистый стафилококк, по латыни – Staphylococcus aureus.
Общая информация о золотистом стафилококке
Что это? Бактерия, относящаяся к классу анаэробных, то есть, способных жить без воздуха, неподвижная, Грам-положительная. Существует немало типов стафилококка, но именно золотистый наиболее опасный. Назвали его так не из-за цвета. Ауреус – потому что при посеве в питательную среду колония бактерий дает желто-золотистое окрашивание.
Сразу можно подумать, что микроорганизм редко встречается, но на самом деле, его можно обнаружить везде. Бактерия живет на коже и слизистых человека, прекрасно себя чувствует в окружающей среде: на мебели, игрушках, посуде, деньгах. Это объясняется высокой устойчивостью микроорганизма к антисептикам, моющим средства, даже кипячению (гибнет только через 10 минут), замораживанию. Не боится стафилококк и спирта, перекиси водорода.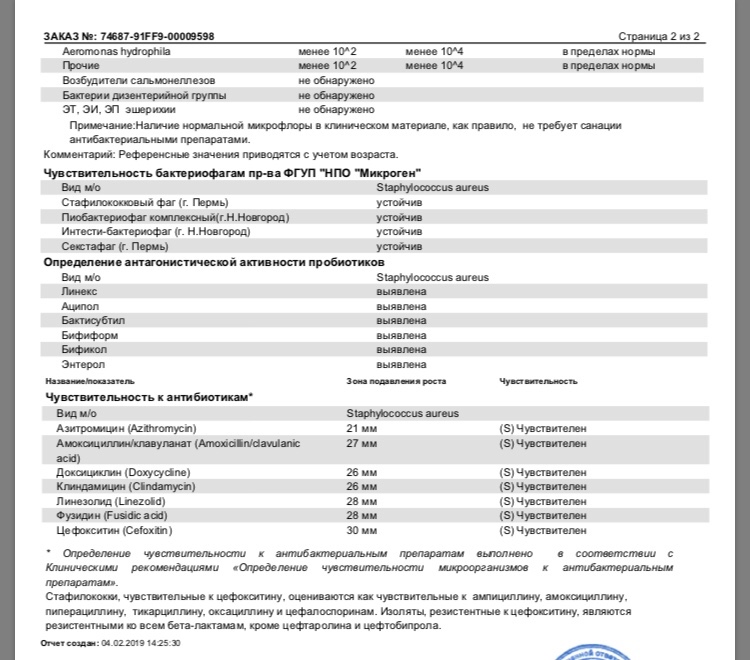 Единственное из доступных средств, которое может убить бактерию – обычная «Зеленка». Чаще всего обнаруживается золотистый стафилококк в носу.
Единственное из доступных средств, которое может убить бактерию – обычная «Зеленка». Чаще всего обнаруживается золотистый стафилококк в носу.
Впрочем, несмотря на распространенность, этот микроорганизм вызывает заболевания редко, даже живя на теле человека. Для того чтобы развилось воспаление, необходимо снижение иммунитета. Только в этом случае бактерии начнут активную деятельность и вызовут самые разные болезни кожи и слизистых.
Опасность золотистого стафилококка в том, что он устойчив к пенициллиновым антибиотикам за счет выработки лидазы и пенициллиназы – ферментов, разрушающих белки. Эти же вещества расплавляют кожу и слизистые, помогая бактериям проникнуть в организм.
Кроме того, стафилококк вырабатывает эндотоксин, вызывающий у человека интоксикацию, пищевое отравление и инфекционно-токсический шок – опасное состояние, которое крайне сложно поддается лечению.
Стоит прибавить к этому отсутствие постоянного иммунитета к таким бактериям. То есть, переболев инфекцией, человек все так же рискует заболеть вновь.
Норма показателей золотистого стафилококка
Как уже было сказано выше, бактерия есть везде. Но если был обнаружен стафилококк, это еще не повод для паники, есть определенные нормы содержания его на коже, слизистых, предметах. Многие начинают переживать, получив результаты анализа: стафилококк золотистый 10 в 4, или, к примеру, золотистый стафилококк 10 в 3. Чтобы разобраться, нужно понимать принципы определения количества микроорганизмов в биоматериале.
Существует 4 степени роста бактерий:
- – слабый рост;
- – рост до 10 колоний одного вида;
- – рост от 10 до 100 колоний;
- – рост больше 100 колоний;
Понятно, что чем больше степень, тем выше количество бактерий, соответственно, активнее патологический процесс. Первые две степени говорят о присутствии бактерии в биоматериале, третья – о том, что началась болезнь, стафилококк 4 степени – это уже выраженная патология.
Как расшифровать данные посева? Для каждого органа есть свои нормы. Так, золотистый стафилококк 10 в 6 степени – верхняя граница нормы. Обнаруживаемый микроорганизм в носу, зеве или горле, посевах кала пока еще не несет опасности. То есть, если анализы показывают золотистый стафилококк 10 в 5 степени или ниже, причин для особой паники нет. Возможно, потребуется лечение, но в каждом конкретном случае решает врач, учитывая многие нюансы. Конечно же, чем меньше цифра, тем лучше, но если обнаруживается стафилококк 10 в 3 степени, это вариант нормы.
Так, золотистый стафилококк 10 в 6 степени – верхняя граница нормы. Обнаруживаемый микроорганизм в носу, зеве или горле, посевах кала пока еще не несет опасности. То есть, если анализы показывают золотистый стафилококк 10 в 5 степени или ниже, причин для особой паники нет. Возможно, потребуется лечение, но в каждом конкретном случае решает врач, учитывая многие нюансы. Конечно же, чем меньше цифра, тем лучше, но если обнаруживается стафилококк 10 в 3 степени, это вариант нормы.
Факторы риска
Чтобы активизировался золотистый стафилококк, причины должны быть вескими, так как иммунитет сам по себе не снижается. Провоцирующими факторами являются такие состояния:
- гиповитаминоз, авитаминоз;
- нарушения в питании;
- другие инфекционные болезни;
- прием антибиотиков;
- прием гормональных препаратов;
- дисбактериоз.
Это причины, провоцирующие развитие инфекции у взрослых и у детей старше года. Но чаще всего обнаруживается стафилококк у грудничка. Более того, самый высокий риск заполучить стафилококка – у новорожденных, так как в больнице (и роддом не исключение) всегда выявляется большое количество золотистого стафилококка, что неудивительно, учитывая стойкость бактерии к антисептикам.
Более того, самый высокий риск заполучить стафилококка – у новорожденных, так как в больнице (и роддом не исключение) всегда выявляется большое количество золотистого стафилококка, что неудивительно, учитывая стойкость бактерии к антисептикам.
Если же новорожденный появился раньше срока или родился незрелым, то вероятность инфицирования еще больше повышается. Относительно эффективной профилактикой этого является раннее прикладывание к груди и отказ от искусственного вскармливания.
Какие заболевания могут возникнуть
Как у взрослых, так и у детей независимо от возраста золотистые стафилококки вызывают множество заболеваний. Инфекция поражает кожу и слизистые, но может попадать в ранку, внутренние органы.
Характерные для всех типов инфицирования симптомы золотистого стафилококка: повышенная температура и выраженная интоксикация, которая проявляется слабостью, плохим аппетитом, тошнотой. То есть, если возникло воспаление на коже, даже небольшое, но оно сопровождается высокой температурой и явным ухудшением самочувствия, можно заподозрить стафилококковую инфекцию.
Кожные болезни
Они наиболее часто встречаются, ведь бактерии живут на коже, и при снижении иммунитета именно покровы тела становятся главной мишенью, тем более, если имеется ранка, какие-либо высыпания и так далее. Бактерия может вызвать такие патологии:
- флегмону;
- абсцесс;
- фурункул;
- карбункул.
Флегмоной называют гнойный процесс, который развивается в жировой клетчатке, и чаще всего он запускается именно из-за золотистого стафилококка. Помимо общих симптомов, появляется припухлость и болезненность пораженной области. Флегмоны не имеют четких границ, и без лечения могут перейти на другие ткани: мышцы, кости и так далее. Кроме того, возможно развитие сепсиса.
Абсцесс – другое гнойное заболевание мышц или жировой клетчатки, но с четкими границами и инфильтративной капсулой, за счет чего несколько снижается опасность заболевания.
Фурункулы тоже признаки золотистого стафилококка. Так, гнойное воспаление волосяного фолликула чаще всего развивается из-за этой бактерии. Если же фурункулов много, и они сливаются, такое состояние называют карбункулом.
Если же фурункулов много, и они сливаются, такое состояние называют карбункулом.
Болезни суставов и костей
В этом случае золотистый стафилококк симптомы дает и общие, и местные. Среди последних боль в мышцах и суставах, которая обостряется и усиливается при движении. Над местом воспаления краснеет кожа, образуется припухлость.
Как правило, инфекция проникает в кость через рану при переломе, после оперативного вмешательства. Попав в ткани, бактерия расплавляет их, поэтому легко доходит до костного мозга, вызывая остеомиелит, возможно и развитие воспаления подкожной клетчатки с формированием тех же флегмоны или абсцесса.
Заболевания дыхательной системы
Тоже весьма распространённая группа. Это тот самый случай, когда смыв из зева или глотки, показывающий стафилококк 10 в 4 степени, говорит о необходимости специфического лечения, особенно если биоматериал брали у малыша, часто болеющего.
Так, если ребенок в четвертый раз подхватывает ангину, бронхит, и любая ОРВИ у него проходит с осложнениями, смыв нужно делать обязательно.
Если же ангина, бронхит появились впервые, но протекают тяжело, с высокой температурой, увеличением лимфоузлов, сильной интоксикацией, стоит подозревать стафилококковый воспалительный процесс.
Особенно опасна пневмония, вызванная этой бактерией, так как ее течение очень тяжелое, и лечить ее сложно за счет устойчивости стафилококка ко многим антибиотикам. Возникающий воспалительный процесс может даже спровоцировать появление гнойников в дыхательной системе.
Токсический шок
Причины возникновения такого состояния известны давно – и это золотистые стафилококки. Ни один другой микроорганизм не вызывает столь серьезной патологии, которая к тому же может появляться внезапно. Начинается синдром токсического шока резким повышением температуры, сильной интоксикацией: слабостью, резкой головной болью, тошнотой. Появляющийся гной из раны или каких-либо органов – один из симптомов токсического шока. Кроме того, образуется сыпь на теле, вероятно шелушение кожи.
Патологический процесс сложно поддается терапии, к тому же он развивается быстро, не всегда есть время для распознавания возбудителя. Поэтому, как правило, при такой симптоматике сразу назначают антистафилококковую терапию.
Лечение стафилококковой инфекции
Специфика терапии в том, что не всегда стоит назначать антибиотики. Так, если имеется локализованная форма или носительство (например, выявлен золотистый стафилококк 10 в 3 степени), то прием антибиотиков может даже усугубить процесс за счет уничтожения полезной микрофлоры. В такой ситуации помогает стимуляция иммунной системы, обработка покровов и слизистых зеленкой, хлорофиллиптом, прием антистафилококкового бактериофага. В зависимости от того, какие у больного симптомы, и лечение будет соответствующим. Играет важную роль и то, кто болеет: взрослый, подросток или младенец.
В тех случаях, когда процесс крайне выражен или имеет генерализированную форму, вполне оправдано назначение антибиотиков. Как правило, используются цефалоспорины, оксациллин, офлоксацин, другие препараты непенициллинового ряда.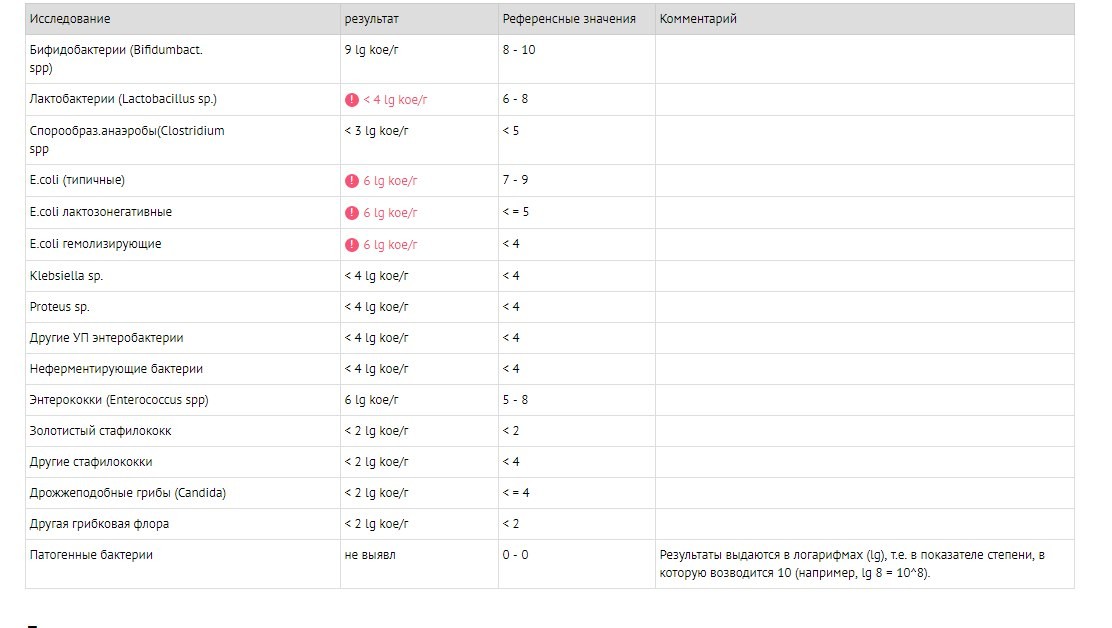 Обязательно назначается бактериофаг, иммуностимулирующие лекарства.
Обязательно назначается бактериофаг, иммуностимулирующие лекарства.
Что касается терапии оститов и кожных заболеваний, то она комбинированная. Чаще всего проводится хирургическая санация, после которой делают регулярную обработку полости. В то же время назначают антибиотики и иммуностимуляторы.
Таким образом, лечение болезней, вызванных золотистым стафилококком, сложное, но возможное при условии своевременного обращения за врачебной помощью.
Вопросы и ответы Клиника ИПМ
Ефимович Людмила Евгеньевна,
Оториноларинголог
Добрый день, Наталья!
Candida albicans — данный микроорганизм относится к условно-патогенным, т. е. в умеренных количествах является нормальной частью микрофлоры и вызывает заболевания только при избытке.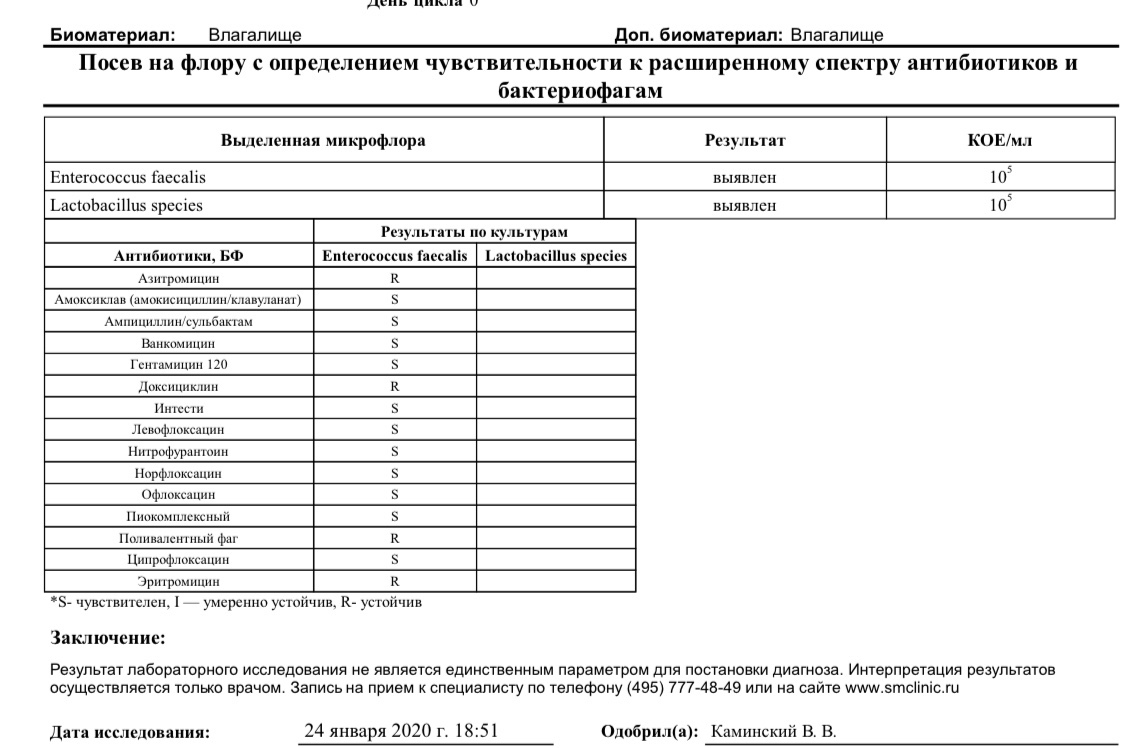 Чрезмерному росту этих микроскопических грибов препятствует нормальная бактериальная флора кожи и слизистых, а также защитные факторы организма. C. albicans присутствует у 80 % популяции людей, не вызывая болезней. Заболевание, вызванное грибами рода Candida, – кандидоз возникает при нарушениях иммунных механизмов защиты.Наличие в организме человека грибов кандида (C. Albicans) еще не означает развитие кандидоза. При приемлимом состоянии иммунитета развитие заболевания не происходит. Выделение Сandida spp. из нестерильных тканей (кожа, слизистые ротовой полости и половых путей) в количестве, не превышающем 104 КОЕ/мл, при отсутствии клинической картины кандидоинфекции расценивают как бессимптомное носительство. Следует отметить также, что кандида достаточно часто соседствует с патогенной бактериальной флорой, которая создает благоприятные условия для активного развития грибковой инфекции.
Чрезмерному росту этих микроскопических грибов препятствует нормальная бактериальная флора кожи и слизистых, а также защитные факторы организма. C. albicans присутствует у 80 % популяции людей, не вызывая болезней. Заболевание, вызванное грибами рода Candida, – кандидоз возникает при нарушениях иммунных механизмов защиты.Наличие в организме человека грибов кандида (C. Albicans) еще не означает развитие кандидоза. При приемлимом состоянии иммунитета развитие заболевания не происходит. Выделение Сandida spp. из нестерильных тканей (кожа, слизистые ротовой полости и половых путей) в количестве, не превышающем 104 КОЕ/мл, при отсутствии клинической картины кандидоинфекции расценивают как бессимптомное носительство. Следует отметить также, что кандида достаточно часто соседствует с патогенной бактериальной флорой, которая создает благоприятные условия для активного развития грибковой инфекции.
Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Около 20 % населения являются постоянными носителями этой бактерии, которая может сохраняться на кожных покровах и слизистых оболочках верхних дыхательных путей. Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям. Если бактериологический посев на стафилококк дал положительные результаты, то это значит следующее: — у пациента острая инфекция, вызванная стафилококком; — пациент – бессимптомный носитель стафилококка.
Около 20 % населения являются постоянными носителями этой бактерии, которая может сохраняться на кожных покровах и слизистых оболочках верхних дыхательных путей. Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям. Если бактериологический посев на стафилококк дал положительные результаты, то это значит следующее: — у пациента острая инфекция, вызванная стафилококком; — пациент – бессимптомный носитель стафилококка.
Результаты анализов могут соответствовать норме.
При наличии жалоб советую обратится к врачу.
Дисбактериоз (дисбиоз) — лечение, цены и запись на консультацию врача отделения гастроэнтерологии «ИАКИ» ЦАО
Дисбактериоз (дисбиоз) – состояние, вызываемое нарушением микробиота кишечника, связанное с изменением видового состава бактерий.
Микробиота кишечника (нормофлора, микрофлора) – это совокупность микроорганизмов, которая является обязательной составляющей нормальной жизнедеятельности человеческого организма. Состав кишечной флоры может изменяться и зависит от ряда факторов: генетика, иммунная система, использование антибиотиков и факторы окружающей среды (диета и т.д..).
Состав кишечной флоры может изменяться и зависит от ряда факторов: генетика, иммунная система, использование антибиотиков и факторы окружающей среды (диета и т.д..).
Дисбактериоз приводит к нарушению обмена веществ — жирового, углеводного, белкового, водно-солевого, обмена витаминов!
Симптомы
Дисбактериоз кишечника не имеет особых характерных симптомов. Его проявления идентичны клинической картине многих иных гастроэнтерологических заболеваний.
Основные клинические проявления дисбактериоза кишечника:
- Изменения со стороны стула: диарея, запор, неустойчивый стул (чередование состояний диареи и запора).
- Усиленное газообразование, вздутие живота разной интенсивности (может усугубляться после приема определенных продуктов питания.
- Нарушение общего состояния (интоксикация, обезвоживание, повышенная утомляемость, кожные высыпания, снижение массы тела).
- Нарушения пищеварения в различных отделах желудочно-кишечного тракта.

Классификация
Национальное руководство «Инфекционные болезни» (Москва, 2009) ( табл. 2).
|
Степень дисбиоза
|
Данные микробиологического исследования содержимого толстой кишки
|
Данные клинического обследования
|
|
I
|
Снижение общего количества основных представителей микрофлоры (бактеро иды, бифидо- и лактобактерии) до 107-108 КОЕ/г, уменьшение количества кишечной палочки с нормальной ферментативной активностью до 106 КОЕ/г, снижение количества условно патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida до 103 КОЕ/г
|
Измененный аппетит, метеоризм, неустойчивость стула, неравномерная окраска каловых масс
|
|
II
|
Снижение основных представителей кишечной микрофлоры до 105 КОЕ/г, увеличение количества лактозонегативной кишечной палочки до 104-105 КОЕ/г на фоне уменьшения количества их нормальных форм, повышение количества условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida до 104 КОЕ/г
|
Метеоризм.
|
|
III
|
Снижение до 103-104 КОЕ/г; отсутствие эшерихий с нормальной ферментативной активностью на фоне повышения числа их неполноценных штаммов, повышение уровня условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida до 104 КОЕ/г
|
Усиление симптомов желудочно-кишечной диспепсии. Появление трофических расстройств
|
|
IV
|
Отсутствие основных представителей анаэробной микрофлоры, отсутствие эшерихий с нормальной ферментативной активностью, подавляющее превосходство условно патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida и их ассоциаций (более 108 КОЕ/г
|
Симптомы общей интоксикации.
|
Причины
Состав кишечной микрофлоры может измениться под воздействия большого количества факторов, перечислим наиболее частые:
- Прием некоторых лекарств (антибиотиков, слабительных и т.д.).
- Инфекционные заболевания.
- Неправильное питание и вредные привычки.
- Заболевания органов пищеварения.
Диагностика
ИНСТИТУТ АЛЛЕРГОЛОГИИ И КЛИНИЧЕСКОЙ ИММУНОЛОГИИ располагает фундаментальной базой, позволяющей провести весь комплекс диагностических и лечебных мероприятий, соответствующих уровню международных стандартов. Многие из лечебно-диагностических методов разработаны сотрудниками нашего Института.
Диагноз устанавливается на основании клинической картины и анамнеза пациента, физикального исследования, лабораторной диагностики, эндоскопии (гастроскопия) и др. исследований.
исследований.
При необходимости консультативную помощь Вам могут оказать смежные специалисты, опытные врачи, разрабатывающие новые методы диагностики и лечения в этих направлениях медицины.
- Посев кала на дисбактериоз.
- Биохимический анализ кала.
- Копрограмма
- Определение бактериальных маркеров в крови и кале.
- Бактериологическое исследование.
Лечение
При выборе тактики лечения больного с дисбактериозом кишечника следует помнить, что нарушения микробиоценоза всегда носят вторичный характер!
Терапевтические мероприятия проводятся с учетом терапии основного заболевания, вызывающего дисбактериоз, с учетом состояния моторно-двигательной функции кишечника, процессов пищеварения и иммунной реактивности организма.
- Устранение экзогенных факторов риска (коррекция питания, употребление чистой питьевой воды и пр.).
- Достижение ремиссии хронических заболеваний.

- Подавление избыточной условно-патогенной микрофлоры.
- Прием препаратов, содержащих живые бактерии и пробиотиков.
Внимание!
Подбор лекарственной терапии должен производиться индивидуально с учетом тяжести течения заболевания, наличия сопутствующих заболеваний, возраста пациента и риска возможных побочных эффектов.
Просим Вас не заниматься самолечением на основании данных сети Интернет!
Телефон отделения: +7 (495) 695-56-95
Информационный блок для пациентов
Диета при дисбактериозе назначается с учетом сопутствующих симптомов и других хронический заболеваний, подбирается индивидуально врачом-гастроэнтерологом!
Ниже приведены общие рекомендации для больных с дисбактериозом!
Диета при дисбактериозе
1.Включите в Ваш рацион блюда и продукты «пребиотической направленности», стимулирующие рост постоянно присутствующей микрофлоры кишечника (ЕСЛИ НЕТ ПРОТИВОПОКАЗАНИЙ!).
2. Включите в Ваш рацион продукты, богатые пищевыми волокнами: изделия из пшеницы, гречихи, ржи, проса, кукурузы, чечевицы, ряд овощей — морковь, кабачки, капуста и т.д. (ЕСЛИ НЕТ ПРОТИВОПОКАЗАНИЙ!).
3. Включите в рацион нежирное мясо и рыбу, орехи, растительные жиры.
Старайтесь соблюдать режим питания.
Список запрещённых во время дисбактериоза продуктов:
- Легкоусвояемые углеводы, которые способствуют подавлению роста и размножения нормальной флоры кишечника и стимулируют рост аэробных микроорганизмов.
- Консервированные продукты.
- Макаронные изделия из муки нетвердых сортов.
- Жирные сорта мяса и рыбы.
- Любые копчености и солености.
- Крепкий чай и кофе
- Острые и пряные блюда.
- Майонез, горчица, кетчуп, острые соусы.
Влияние низкой температуры на рост и ультраструктуру Staphylococcus spp
Abstract
Влияние колебаний температуры является важным фактором роста бактерий, особенно таких патогенов, как стафилококки, которые должны оставаться жизнеспособными в потенциально жестких и длительных условиях переноса между хозяевами. Целью этого исследования было изучить реакцию S. aureus , S. epidermidis и S. lugdunensis на длительное воздействие низкой температуры (4 ° C) и то, как этот фактор повлиял на их последующее воздействие. рост, морфология колоний, клеточная ультраструктура и аминокислотный состав нецитоплазматической фракции гидролизата.Клинические изоляты выращивали в оптимальных условиях, а затем подвергали воздействию 4 ° C в течение 8 недель. Образцы, подвергнутые холодному стрессу, и контрольные образцы были оценены с помощью просвечивающей электронной микроскопии (ПЭМ) для выявления потенциальных ультраструктурных изменений. Чтобы определить изменения в аминокислотном составе, клетки разрушали для удаления липидных и цитоплазматических компонентов, а оставшиеся структурные компоненты гидролизовали. Затем профили аминокислот для гидролизной фракции анализировали на предмет изменений с помощью анализа главных компонентов (PCA).Воздействие трех стафилококков на длительный низкотемпературный стресс приводило к формированию увеличивающейся доли фенотипов вариантов малых колоний (SCV). ПЭМ показала, что клетки SCV имели значительно более толстые и более диффузные клеточные стенки, чем соответствующие образцы дикого типа для S. aureus и S. epidermidis , но изменения не были значительными для S. lugdunensis . Существенные видоспецифические изменения в аминокислотном составе фракции структурного гидролизата также наблюдались в обработанных холодом клетках.Данные показали, что стафилококки реагировали на длительные периоды лечения холодовым стрессом, превращаясь в популяции SCV. Было высказано предположение, что наблюдаемые ультраструктурные и аминокислотные изменения представляют собой механизмы ответа для выживания стафилококков в неблагоприятных условиях, таким образом поддерживая жизнеспособность видов до тех пор, пока благоприятные условия не возникнут снова.
Образец цитирования: Onyango LA, Dunstan RH, Gottfries J, von Eiff C, Roberts TK (2012) Влияние низкой температуры на рост и ультраструктуру Staphylococcus spp .PLoS ONE 7 (1):
e29031.
https://doi.org/10.1371/journal.pone.0029031
Редактор: Дипшиха Чакравортти, Индийский институт науки, Индия
Поступила: 12 октября 2011 г .; Одобрена: 19 ноября 2011 г .; Опубликован: 24 января 2012 г.
Авторские права: © 2012 Onyango et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана международной стипендией Университета Ньюкасла, стипендией Гидеона Ланга и исследовательским грантом Гарольда Стэннета Уильямса и Джудит Мейсон. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Хотя стафилококки принадлежат к общей флоре кожи и слизистых оболочек, они могут быстро стать условно-патогенными микроорганизмами, когда иммунная система хозяина нарушена, вызывая ряд заболеваний.Различные штаммы S. aureus стали известны своей устойчивостью к нескольким противомикробным агентам, и вместе с рядом коагулазонегативных стафилококков (ЦНС), включая S. epidermidis и S. lugdunensis , эти бактерии составляют: значительная доля внутрибольничных инфекций [1], [2], [3].
Было показано, что воздействие антибиотиков на стафилококки является одной из причин образования вариантов малых колоний (SCV). Эти варианты представляют собой субпопуляции бактерий, которые демонстрируют признаки атипичного роста по сравнению с таковыми у их аналогов дикого типа (WT).Как следует из названия, эти варианты характеризуются в основном негемолитическими и непигментированными крошечными колониями, примерно 1/10 размера их аналогов дикого типа [4]. Интерес к формам SCVs возник, когда они были связаны со стойкими клиническими инфекциями [5], [6]. У людей SCV связаны с хроническими стойкими инфекциями скелетной системы, сердца и легких, а также других органов, а также при использовании стационарных медицинских устройств [7]. Лечение таких инфекций стало проблемой, поскольку было показано, что SCV менее чувствительны к нескольким антибиотикам, и, кроме того, эти фенотипы лучше сохраняются внутриклеточно в клетках-хозяевах [8].Исследования, включающие модели на животных, показали, что многие вирулентные факторы, выраженные фенотипами WT и вызывающие заболевание, либо не экспрессируются, либо остаются минимальными в популяциях SCV [9], [10], [11]. Вместо этого SCV активируют механизмы, которые поддерживают их прикрепление и захват клетками-хозяевами, а также запускают метаболические стратегии, которые будут способствовать их выживанию после интернализации без необходимости использования цитотоксических мер [12]. Сообщения о множественном ауксотрофизме [5], [13], [14], [15] предполагают, что определенные метаболические пути были инактивированы в SCV.Дальнейшие молекулярные исследования предоставили доказательства того, что клинические SCVs имели разные фенотипы по сравнению с их родителями WT, но были способны возвращаться в форму WT [16], [17], предполагая, что фенотипические изменения включали значительные изменения метаболического гомеостаза в SCV.
Стафилококкам требуется способность выживать на неодушевленных предметах в процессе перехода от одного хозяина к другому. Они должны уметь адаптироваться к быстро меняющимся условиям окружающей среды и быть готовыми повторно активировать метаболизм и факторы вирулентности, когда появляются возможности.Для хранения пищевых продуктов, растворов и биологических материалов часто используются температуры 4 ° C, поскольку большинство патогенов считаются мезофильными и поэтому не могут хорошо расти при этой температуре [18]. Стафилококки способны расти в широком диапазоне температур (6,5–46 ° C), хотя их оптимальный диапазон составляет 30–37 ° C, и было высказано предположение, что они могут выжить при экстремальных температурах <6,5 ° C и> 46 ° C в течение ограниченного периода времени. периоды времени [18]. Способность стафилококков быстро адаптироваться к колебаниям низких и высоких температур особенно важна для патогенных штаммов стафилококков, поскольку в некоторых случаях эти бактерии должны оставаться жизнеспособными вне хозяина [19].
Клеточная стенка бактерий и связанные с ней белки представляют собой интерфейс между окружающей средой и цитоплазмой. Он действует как структурный барьер против токсичных химикатов, защищает клетку от колеблющихся условий окружающей среды и играет важную роль в развитии инфекции и патогенности [20]. В нескольких исследованиях изучали структуру клеточной стенки устойчивых к антибиотикам штаммов S. aureus , и результаты показали, что утолщение клеточной стенки было обычным признаком, возникающим только тогда, когда бактерия выращивалась в присутствии антибиотиков [21].В этих исследованиях предполагаемая функция утолщенной клеточной стенки заключалась в связывании и секвестрации ванкомицина на большем удалении от его целевого сайта. Таким образом, была выдвинута гипотеза о том, что бактериальные клетки, подверженные воздействию ряда стрессоров, могут адаптировать состав своей клеточной стенки и связанных белков для облегчения защиты от изменения условий окружающей среды. Чтобы потенциально измерить этот измененный состав, будет исследован анализ нецитоплазматической фракции и, в частности, аминокислотных изменений.
В настоящем исследовании цель исследования — определить, будет ли воздействие низкой температуры при 4 ° C в течение 8 недель стимулировать формирование фенотипов SCV в качестве механизма выживания клинических изолятов S. aureus , S. epidermidis . , и S. lugdunensis . Кроме того, скорость изменений числа SCV как пропорции жизнеспособных бактериальных популяций определялась в течение 8-недельного времени воздействия, а любые связанные изменения в морфологии и составе клеточной стенки оценивались с помощью ТЕМ и ГХ-МС соответственно.Было высказано предположение, что воздействие холодового стресса приведет к увеличению толщины клеточной стенки и изменению биохимического аминокислотного состава.
Материалы и методы
Бактериальные образцы
S. aureus , S. epidermidis и S. lugdunensis были изолятами, полученными в результате более раннего исследования [22] и поддерживаемыми в качестве культурального материала в лаборатории. Изоляты надлежащим образом хранили и регулярно субкультивировали для поддержания жизнеспособности.Проверки личности регулярно выполнялись с помощью ПЦР и стандартной биохимии API® Staph.
Рост бактерий
Ночные бульонные культуры S. aureus , S. epidermidis и S. lugdunensis использовали для создания свежих жидких культур (100 мл, выращенных в колбах на 250 мл), которые выращивали до средней экспоненциальной фазы при 37 °. C, 120 об / мин, а затем инкубировали при 4 ° C в течение 8 недель. Каждую неделю из этих жидких культур, подвергшихся холодному стрессу, получали n = 9 образцов, которые разбавляли 1 × 10 перед нанесением аликвот по 5 мкл каждого образца в трех экземплярах на колумбийский агар с лошадиной кровью (HBA, Oxoid).Засеянные планшеты инкубировали в течение 24 часов при 37 ° C, а затем исследовали. Регулярные проверки чистоты сохраняемых бульонных культур проводились с помощью анализов на основе ПЦР, чтобы гарантировать отсутствие перекрестного загрязнения во время отбора проб. Колонии, растущие из субкультивированных стрессовых бульонов, анализировали на чистоту культуры. Это было выполнено с использованием теста API® Staph (bioMérieux) и основанных на ПЦР анализах гена 16SrRNA с использованием метода Brown et al. , [23] и результаты проверены через базу данных NCBI BLAST (http: // www.ncbi.nlm.nih.gov/BLAST/).
Характеристика колонии
Колонии были физически оценены и разделены на две группы в зависимости от размера, гемолитической активности и пигментации. Колонии характеризовались как SCV, если они представляли собой точечные колонии (<1 мм в диаметре) со сниженной гемолитической активностью и пигментацией через 24–48 часов после инкубации, как описано в литературе [17], [24], [25]. Все остальные колонии были характеризуется как дикого типа (WT).
реверсия
SCV, полученных в результате обработки холодом, тестировали на реверсию путем субкультивирования отдельных колоний (n = 9) на чашках с HBA в течение ночи при оптимальных условиях, и скорость реверсии регистрировали как процент колоний WT в общей популяции.
Подготовка образца к ТЭМ
Используемая процедура подготовки образцов для ПЭМ была объединена с методами Глауэрта [26], Дикстры и Ройсса [27]. N = 9 колоний колоний WT и SCV, выращенных на HBA, фиксировали в 2,5% глутаровом альдегиде. Вторичную фиксацию проводили в 1% растворе четырехокиси осмия. Дегидратацию выполняли в градуированной серии вода-этанол (об. / Об.), Доведенной до следующих концентраций: 10%, 30%, 50%, 70%, 90% и 100%. Инфильтрацию проводили в белой смоле LR, приготовленной в этаноле до следующих концентраций: 10%, 30%, 50%, 70%, 90% и 100% (об. / Об.).Ультратонкие срезы вырезали, окрашивали и исследовали под просвечивающим электронным микроскопом, установленным на ускоряющее напряжение 80 кВ, и изображения получали при 40–100 000X.
Подготовка проб для исследования аминокислот
После 8-недельного периода воздействия клетки собирали и экстрагировали на компоненты клеточной стенки и мембран в соответствии с методами Hanaki et al. [28] и de Jonge et al. [29]. Клетки разрушали кипячением со стеклянными шариками в течение ½ часа.Суспензию центрифугировали при 3000 g в течение 5 мин и супернатант отбрасывали. Осадки клеток, содержащие фрагменты клеточной стенки и мембраны, затем лиофилизировали. Липидные компоненты мембран лиофилизированных образцов экстрагировали, добавляя хлороформ: метанол в соотношении 2–1 об. / Об. До конечного объема 3 мл. Образцы перемешивали, а затем центрифугировали 5–10 мин при 3500 об / мин и 4 ° C. Нижние фазы хлороформа аспирировали в пробирки для экстракции объемом 8 мл. Эту процедуру повторяли еще дважды с добавлением одного хлороформа и объединением образовавшихся фаз хлороформа.Остаточные суспензии метанола переносили в пробирки для дериватизации объемом 8 мл и центрифугировали в течение 5–10 мин. Эти гранулы лиофилизировали для удаления метанола перед гидролизом в кислоте. Осушенный осадок метанола гидролизовали, добавляя к образцу 200 мкл 6 М HCl, и суспензию инкубировали в течение 6 часов при 100 ° C. После этого образцы охлаждали и сушили вымораживанием.
Аминокислотный анализ гидролизованной клеточной стенки / белкового экстракта
Высушенные гидролизованные образцы были подготовлены для анализа с использованием набора Ez∶Faast ™ (Phenomenex® EZ∶faast ™) и разделены для анализа с помощью газовой хроматографии (ГХ), которая подходит для обнаружения более 40 аминокислот и родственных производных.Процедура включает твердофазную экстракцию с помощью ионообменной хроматографии, дериватизацию с образованием пропиловых эфиров аминокислот и заключительную стадию экстракции жидкость / жидкость перед анализом с помощью ГХ. Лиофилизированные гидролизованные образцы ресуспендировали в 500 мкл воды milliQ и экстрагировали, следуя 8-ступенчатой процедуре, как указано производителем, с использованием норвалина в качестве внутреннего стандарта. Анализ образцов, дериватизированных EZ∶Faast ™, проводили на системе ГХ Hewlett Packard HP 6890 series, снабженной пламенно-ионизационным детектором и колонкой ZB-PAAC-MS (10 м × 0.Внутренний диаметр 25 мм), поставляемый Phenomenex® Inc. Метод прибора включал раздельное впрыскивание (соотношение 15∶1) с температурой инжектора 250 ° C и скоростью потока через колонку 0,5 мл / мин. Объем инъекции для всех образцов был установлен на уровне 2,5 мкл.
Статистический анализ
Эксперименты проводили трижды (каждый в трех экземплярах, n = 9) для обеспечения воспроизводимости результатов. Анализ главных компонентов (PCA) проводили с использованием SIMCA-p + (12.0, Umetrics, Швеция), [30]. Все данные были предварительно обработаны логарифмическим преобразованием, центрированием среднего значения и масштабированием единичной дисперсии до генерации PCA.Оптимальная сложность модели PCA была определена в соответствии с процедурой перекрестной проверки (CV) [31]. CV включал семь раундов моделирования исключенных данных, в то же время все данные были исключены один раз, как это реализовано в SIMCA-P +. Сканирование резко отклоняющихся данных проводилось по критическому ортогональному расстоянию до модели и с помощью прибора Hotelling T 2 в пределах размеров модели. Ни один из методов не выявил ложных данных. Доверительные интервалы нагрузок оценивали методом складывания ножей с использованием результатов CV.
Результаты
Бульонные культуры S. aureus S. epidermidis и S. lugdunensis , подвергнутые длительному воздействию температур 4 ° C после начального роста при 37 ° C, дали ряд вариантов колоний при пересеве на чашки с HBA с вариации в размере, пигментации и гемолитической активности. Способность образовывать варианты небольших колоний (SCV) в ответ на стресс при 4 ° C наблюдалась у всех трех видов стафилококков, хотя их частота в популяциях различалась между видами, а их численность была связана с продолжительностью стресса.На начальных этапах стресса (1-2 недели) наиболее многочисленным типом колонии, наблюдаемым в культуре для каждого вида, была колония WT. SCV также присутствовали в это время, хотя они составляли <40% населения (Рисунок 1). Однако при длительной инкубации в условиях температурного стресса наблюдался сдвиг в динамике популяции: SCV-колонии представляли> 50% популяции через 3 недели для S. epidermidis (R 2 = 0,51, p <0,05) и через 7 недель. для S. lugdunensis (R 2 = 0.97, р <0,05). Культуры S. aureus не давали значимых значений SCV до истечения пяти недель инкубации (R 2 = 0,78, p <0,05).
Рисунок 1. Изменение процентного состава SCV-колоний популяций культур S. aureus S. epidermidis и S. lugdunensis , подвергшихся температурному стрессу при 4 ° C в течение 8 недель (n = 9) .
https://doi.org/10.1371/journal.pone.0029031.g001
SCV, вызванные температурой, имели размер колонии <1 мм и демонстрировали пониженную пигментацию с небольшим и переменным диапазоном гемолиза на HBA (рис. 2).Сравнения окрашенных по Граму клеток также суммированы на Фигуре 2, показывающей заметную разницу в интенсивности окрашивания между каждым типом колоний для всех 3 исследованных видов. Для определения интенсивности красителя использовалась упрощенная цветовая шкала и шкала от 1 до 5, где 5 - самая темная интенсивность, а 1 - самая светлая интенсивность. Клетки колонии WT постоянно окрашивались в темно-фиолетовый цвет и имели среднее значение ± SD 4,7 ± 1,0 (n = 20), в то время как клетки SCV всегда окрашивались значительно светлее со средним значением 2.1 ± 1,0 (n = 20).
Рисунок 2. Морфологические различия в размере, пигментации, гемолизе и окрашивании по Граму между WT и соответствующими SCV у S. aureus , S. epidermidis и S. lugdunensis .
Колонка (A) показывает различия в размере и пигментации между колониями WT (слева), которые больше и более пигментированы, чем их SCV (справа), которые являются маленькими с уменьшенной пигментацией (шкала представляет собой 1 мм). Столбец (B) показывает различия в ответе на окрашивание по Граму с окрашиванием клеток WT (слева) значительно темнее, чем их соответствующие SCV (справа).
https://doi.org/10.1371/journal.pone.0029031.g002
Идентификация вида
Чтобы убедиться, что наблюдаемая смешанная популяция колоний не являлась контаминантами, WT и предполагаемые SCV всех трех видов оценивали по показаниям API® Staph и с помощью ПЦР гена 16S рРНК. ПЦР всех протестированных колоний SCV подтвердила их идентичность как совместимые с исходным исходным материалом WT. Результаты API® Staph для колоний дикого типа оказались положительными для соответствующих им исходных видов, но результаты для SCV были неубедительными, что соответствовало предполагаемым изменениям метаболического гомеостаза, описанным в литературе.Для дальнейшей оценки идентичности SCV было показано, что эти колонии превращаются в колонии WT при субкультивировании на чашках с HBA и инкубировании при 37 ° C. SCV возвращались после 2 субкультур в условиях хранения клеток в течение 4 недель или меньше при 4 ° C, и до трех субкультур для восстановления, которые наблюдались для культур, хранящихся в течение 5-8 недель. Эти ревертанты, образованные таким образом из субкультуры, впоследствии были подтверждены как сходные с родительскими штаммами как API® Staph, так и ПЦР.
Электронная микроскопия
фиксированных колоний WT и SCV (n = 9 каждая) были разделены и исследованы с использованием ТЕМ.Результаты выявили нарушения внешнего вида цитоплазматических компонентов, перегородок, симметрии клеток и свойств клеточной стенки SCV-клеток по сравнению с их родительскими WT-клетками. Микрофотографии клеток WT каждого вида показали четко выраженное образование перегородок, происходящее в основном через середину клетки, разделяя клетку на две симметричные дочерние клетки (рис. 3). Напротив, клетки SCV показали более диффузные перегородки и преимущественно более «асимметричные» клеточные деления, при этом одна дочерняя клетка оказалась существенно меньше другой, как показано на рисунке 3 (a) для SCV S aureus .Оценка симметричных и асимметричных делений клеток в n = 100 клеток от каждого типа колонии от всех трех видов была проведена и суммирована в Таблице 1, которая подтвердила, что популяции SCV имели значительно большую долю своих клеток с очевидной «асимметричностью». деления клеток по сравнению с соответствующими клетками дикого типа (p <0,01).
Рисунок 3. ТЕМ-изображения (a) S. aureus , (b) S. epidermidis и (c) S. lugdunensis WT и SCV клеток, показывающие их соответствующие ультраструктурные характеристики.
Клетки WT имели четко очерченные клеточные стенки по сравнению с SCV, которые имели более толстые, более диффузные клеточные стенки после воздействия стресса (4 ° C).
https://doi.org/10.1371/journal.pone.0029031.g003
Таблица 1. Анализ частоты очевидных «симметричных» и «асимметричных» делений клеток в WT по сравнению с SCV-клетками из TEM клеточные препараты S. aureus , S. epidermidis и S. lugdunensis .
https://doi.org/10.1371/journal.pone.0029031.t001
Дальнейший анализ ТЕА показал, что клетки SCV имели более диффузные клеточные стенки, которые также оказались толще, чем их родительские штаммы. Чтобы установить, действительно ли были существенные различия, измерения толщины стенок были выполнены для n = 300 клеток на тип колонии для каждого вида. Для каждой ячейки измерения были взяты из трех отдельных областей, и среднее значение этих значений записали как толщину стенок этой конкретной ячейки.Для каждой подготовленной реплики было записано не менее десяти микрофотографий и изучались 10 полей зрения на каждую микрофотографию для записи различных данных (диффузные и утолщенные клеточные стенки и образование асимметричных перегородок) и подтверждения того, что ультраструктурные изменения не были артефактами. Анализ этих данных выявил значительные различия в толщине стенок между колониями WT и SCV S. aureus и S. epidermidis . Средняя (± стандартное отклонение) толщина клеточной стенки для S. aureus SCV (24 ± 7 нм) была значительно больше, чем их соответствующие клетки WT (17 ± 3 нм). S. epidermidis SCV-клетки также были значительно толще (33 ± 15 нм) по сравнению с их клетками WT (27 ± 5 нм). Не было существенной разницы в толщине клеточной стенки между клеток S. lugdunensis WT (24 ± 5 нм) и их соответствующими клетками SCV (24 ± 6 нм).
Анализ основных компонентов
Из-за изменений в морфологии, наблюдаемых на снимках ПЭМ SCV-клеток после воздействия 4 ° C, было высказано предположение, что будут сопутствующие изменения в составе белков, связанных с клеточной стенкой и клеточной стенкой.Таким образом, фракции клеточной стенки, полученные из клеток SCV и WT S. aureus , S. epidermidis и S. lugdunensis , расщепляли и гидролизовали для определения аминокислотного состава с помощью газовой хроматографии. Данные по аминокислотному составу были сопоставлены с 3 изолятами стафилококков, выращенных в качестве контрольных образцов в культурах при 37 ° C или подвергнутых длительному холодовому стрессу при 4 ° C (n = 9 для каждой комбинации). Полная матрица данных была подвергнута PCA визуализации решения 3 основных компонентов (PC) в соответствии с перекрестной проверкой (CV) с объясненными отклонениями 82% R 2 X и 72% по CV (Q 2 X).Однако вклад третьего ПК в совокупную CV составлял менее 5%, поэтому он не принимался во внимание.
Проверка оценок PCA выявила 3 кластера, в которых образцы стафилококков, независимо от штамма, выращенного при 37 ° C, были помещены в контрольную группу, смоделированную близко к ориджину (рис. 4). Образцы S. aureus , обработанные холодом, сформировали второй кластер, который моделировали с обычно высокими значениями t1 для всех аминокислот, но близкими к нулю баллами t2. Эта ориентация указывает на то, что всех аминокислот было больше во всех обработанных холодом S.aureus по сравнению с контрольными образцами. Напротив, обработанные холодом образцы S. epidermidis и S. lugdunensis , которые накладывались друг на друга, имели близкие к нулю баллы в первом ПК, но низкие t 2 баллов по сравнению с контрольными образцами. Данные показали, что все 3 вида имели сходные профили аминокислотного состава в клеточной стенке при выращивании в оптимальных условиях при 37 ° C, то есть в контрольных образцах. Однако, когда клетки подвергались длительному холодовому стрессу при 4 ° C, все 3 штамма ответили существенным изменением состава аминокислот в их клеточных стенках и связанных с ними белков.Однако S. aureus показал очень уникальный и характерный ответ, который явно отличался от реакции, вызванной S. epidermidis и S. lugdunensis .
Рис. 4. Разброс показателей анализа основных компонентов (PCA) (t1 по сравнению с t2), построенный на основе данных аминокислотного профиля стафилококковой клеточной стенки.
Культуры стафилококков выращивали в идеальных условиях при 37 ° C, представляющих контрольные образцы (Cont), или подвергали длительному воздействию 4 ° C в течение 8 недель (TE) перед взятием образцов и анализом аминокислот.Три разных штамма, S. aureus (SA), S. epidermidis (SE) и S. lugdunensis (SL), были исследованы в повторностях (n = 9) для каждого штамма на предмет реакции на температурные условия.
https://doi.org/10.1371/journal.pone.0029031.g004
Расположение всех обработанных холодом образцов S. aureus справа от диаграммы разброса PCA обусловлено высокими значениями t1 (как показано на рисунке). на рисунке 4), что является результатом повышения уровня аминокислот во всех S.aureus (см. PC1, то есть ось x на рисунке 4). Паттерны корреляции индивидуальных аминокислотных уровней с PC-компонентами были получены путем нагрузок. Они были определены как корреляция между отдельными ПК и содержанием отдельных аминокислот во включенных образцах. Для первого ПК в настоящем исследовании все корреляции были положительными для образцов S. aureus по сравнению с эталоном, что определяется в целом положительной корреляционной структурой при нагрузках p 1.Эта полная корреляционная картина между холодно обработанными S. aureus и контрольными образцами соответствовала нагрузкам, показанным на рисунке 5.
Рис. 5. Показатели p1 для аминокислот из экстрактов клеточной стенки S. aureus после длительного воздействия при 4 ° C в течение 8 недель по сравнению с соответствующими культурами, выращенными в идеальных условиях при 37 ° C, представляющими контрольные контрольные образцы.
S. aureus отреагировал на холодовой стресс в целом увеличением аминокислотного состава в этой фракции по сравнению с контролем, т.е.е. контрольные образцы от всех трех штаммов.
https://doi.org/10.1371/journal.pone.0029031.g005
Аминокислотные изменения, характеризующие реакции на холодовую терапию S. epidermidis и S. lugdunensis , были ортогональны ответу t 1. поскольку отдельные образцы варьировались в основном в направлении ПК2 (рис. 4). Кроме того, направление корреляции PCA было обратным по сравнению с PC1, на что указывает расположение обработанного холодом S.epidermidis и lugdunensis на более низкие баллы t 2 по сравнению с контрольными образцами. На практике это означало, что отрицательные нагрузки в PC2 указывали на повышенные уровни аминокислот в обработанных холодом образцах из S. epidermidis и lugdunensis по сравнению с контрольными образцами, например. APA и GLN обычно были выше, а SER и ASN были ниже в обработанных холодом образцах S. epidermidis и lugdunensis по сравнению с контрольными образцами.Эти ответы включали значительные изменения аминокислотных профилей по сравнению с соответствующими контрольными культурами, например, с повышением содержания аминокислот. SER, ASP и MET и снижение, например, THR, GLU и GLN (см. Все загрузки для ПК2 на рисунке 6).
Рисунок 6. Показатели p2 для аминокислот из экстрактов клеточной стенки S. epidermidis и S. lugdunensis после длительного воздействия при 4 ° C в течение 8 недель по сравнению с соответствующими культурами, выращенными в идеальных условиях при 37 ° C, представляющих эталонные контрольные образцы.
S. epidermidis и S. lugdunensis ответили на холодовой стресс существенным изменением аминокислотных профилей по сравнению с соответствующими контролями. Следует подчеркнуть, что PC2 обратно коррелировали с обработкой холодом, так что отрицательные нагрузки, например — 0,20 для GLN указывает на повышенный уровень аминокислот в обработанных холодом образцах S. epidermidis и S. lugdunensis , и наоборот.
https: // doi.org / 10.1371 / journal.pone.0029031.g006
Обсуждение
Когда культуры стафилококков подвергались воздействию температуры 4 ° C, культур S. epidermidis и S. lugdunensis генерировали SCV быстрее, чем культуры S. aureus . В конечном итоге все три вида образовали колонии SCV, но никогда не было 100% конверсии в течение 8-недельного периода воздействия 4 ° C. Зависимое от времени увеличение пропорций SCV в отобранных популяциях указывает на процесс адаптации, в котором возрастающее преобладание SCV представляет собой естественный отбор SCV с повышенной способностью к выживанию в неблагоприятных условиях [32].Фенотипическое переключение было отмечено у S. aureus как эффективная бактериальная стратегия против иммунного ответа хозяина и успешного установления хронической инфекции [33]. Это явление имеет эволюционное значение, поскольку оно дает избирательное преимущество для выживания бактерий в неблагоприятных условиях окружающей среды. В этом исследовании было предложено, что этот механизм будет полностью подходящим для периодов выживания между потенциальными хозяевами для этих комменсалов (условно-патогенных микроорганизмов) в отличие от спорообразующих бактерий, таких как бациллы, которым может потребоваться выживание в течение продолжительных периодов времени в более экстремальных условиях. условия водного лишения, воздействия УФ-излучения и токсичных химикатов.Хотя образование SCV произошло у S. aureus , S. epidermidis и S. lugdunensis после воздействия 4 ° C, было отмечено, что SCV учащались в культурах коагулазонегативных стафилококков (ЦНС) при температуре быстрее, чем в S. aureus . Изменчивость колоний ранее наблюдалась в ЦНС в ответ на лечение антибиотиками [34], но было высказано предположение, что, возможно, об этой особенности не сообщалось, поскольку измененные морфологические характеристики были неверно интерпретированы как контаминация, а не как представление фенотипического разнообразия [34].
Окрашивание по Граму применялось как рутинная процедура как часть процесса идентификации видов. Было быстро замечено, что SCV-клетки всегда окрашивались светлее, чем их соответствующие WT-клетки, что указывает на возможные несоответствия между структурами их клеточной стенки, что является основой этого метода окрашивания. Оценка нескольких образцов с использованием простой визуальной аналоговой шкалы выявила значительные различия в интенсивности окрашивания, что является дополнительным доказательством того, что изменения клеточной стенки и связанного с ней белкового состава могут быть связаны с образованием SCV-клеток в ответ на холодовой стресс.Исследование, проведенное Серадски и Томаш [21] с участием мутанта S. aureus , устойчивого к ванкомицину, показало, что этот мутант имел большое количество пептидогликана и внеклеточного мусора, который имел вид материала клеточной стенки. Считалось, что накопление материала клеточной стенки изолирует ванкомицин из среды, тем самым не позволяя ему достичь своей цели и повредить клетку. Вероятно, что утолщение клеточной стенки, наблюдаемое в образцах SCV в этом текущем исследовании, могло предотвратить проникновение некоторого количества кристаллического фиолетового красителя внутрь стенки, что привело к появлению более светлых пятен по Граму, наблюдаемых во многом так же, как Серадски и Томаш сообщили, что более толстые клеточные стенки изолируют и связывают антибиотик, тем самым предотвращая его проникновение в клетку.Была высказана гипотеза о том, что более толстые клеточные стенки SCV клеток S. aureus и S. epidermidis в сочетании с изменениями аминокислотного состава у всех трех видов ограничивают поглощение красителя по Граму.
Микрофотографии
TEM клеток S. aureus и S. epidermidis SCV показали диффузные клеточные стенки, которые были значительно толще у этих видов стафилококков, тогда как между клетками WT и SCV для S.lugdunensis . Утолщение клеточной стенки было отмечено как механизм устойчивости, используемый S. aureus против проникновения клинически важных антибиотиков [35], [36]. В нашем исследовании SCV были созданы в результате воздействия температурного стресса с аналогичными результатами, предполагающими, что утолщение клеточной стенки может быть общей реакцией бактериальных клеток, подвергшихся стрессу. Более толстая клеточная стенка может действовать как защитный механизм для клетки от внеклеточных проблем, которые в противном случае могут поставить под угрозу жизнеспособность бактерии.В устойчивой к антибиотикам ЦНС диффузная природа клеточной стенки была идентифицирована как слизь, связанная с клеточной стенкой, которая, как считалось, усиливает прилипание и колонизацию этими видами, что делает их очень успешными в возникновении патогенеза, связанного с устройством [37]. Аналогичные ответы S. aureus , S. epidermidis и S. lugdunensis , вызванные воздействием более холодных условий, также будут давать соответствующие преимущества для адгезии и выживания на фомитах для передачи между хозяевами.Ясно, что S. lugdunensis вызывал другой клеточный ответ на холодовую обработку по сравнению с S. aureus и S. epidermidis , поскольку не имел поддающихся измерению изменений толщины клеточной стенки. Ответы S. aureus и S. epidermidis соответствовали гипотезе о том, что воздействие холода может приводить к утолщению клеточных стенок, как это наблюдается у обработанных антибиотиками клеток [35], но это не обязательно так для все стафилококки.
Дальнейший анализ микрофотографий ПЭМ показал, что образцы SCV имели более диффузные перегородки в делящихся клетках. В этих образцах также была значительно более высокая доля очевидных «асимметричных» клеточных делений в S. aureus S. epidermidis и S. lugdunensis , при этом дочерние клетки меньшего размера наблюдались в 81, 65 и 72% образцов SCV по сравнению только с 38. , 29 и 33% наблюдаются в образцах WT, соответственно. Каль и соавторы также [15] задокументировали нарушение образования перегородок в своем исследовании клинического S.aureus SCV и предположил, что это могло привести к нарушению разделения клеток. Sianglum и др. [38] отметили тот же результат, когда S. aureus лечили новым антибиотиком, и пришли к выводу, что антибиотик прерывает процессы деления клеток. Саньял и Гринвуд [39] наблюдали эту характеристику у культур S. epidermidis , обработанных антибиотиком тейкопланином. ПЭМ-микрофотографии их образцов показали, что клетки подверглись делению на две дочерние клетки, но перегородки были сформированы ближе к одному полюсу клетки, а не прямо через середину клетки, подобно тому, что наблюдалось в этом текущем исследовании.Они не рассматривали возможные причины этой характеристики. Ультраструктурные изменения, наблюдаемые у S. aureus S. epidermidis и S. lugdunensis в ответ на длительное воздействие 4 ° C, согласуются с гипотезой о фенотипе выживания. продуцируется в популяции бактерий, подвергшихся стрессу, частота которых увеличивается при длительном воздействии. Было высказано предположение, что такой ответ будет совпадать с изменениями в биохимическом составе структуры клеточной стенки для оптимизации выживания клетки.Анализ экстрактов переваренных стенок и белков из клеток, собранных после роста в идеальных условиях (WT), по сравнению с таковыми из клеток, собранных после последующих 8 недель хранения при 4 ° C, выявил существенные изменения в аминокислотном составе.
Проверка оценок PCA показала ортогональную разницу в аминокислотном составе клеточной стенки и связанных белков между обработанными низкой температурой S. aureus с одной стороны, по сравнению с S. epidermidis и S.lugdunensis , напротив. Сравнение было проведено с использованием показателей аминокислот дикого типа для всех трех видов стафилококков, и применима прямая интерпретация, поскольку в пределах дикого штамма наблюдались незначительные вариации в уровнях аминокислот, не зависящие от штамма. Математическая интерпретация очевидной ортогональной кластеризации S. aureus по сравнению с S. epidermidis и S. lugdunensis в PC1 по сравнению с PC2, влечет за собой полное различие в физиологической реакции между двумя кластерами.Увеличение концентраций аминокислот, наблюдаемое в S. aureus , интерпретировалось как пропорциональное увеличение белков, связанных с клеточной стенкой, с соответствующими качественными различиями, поскольку все измеренные аминокислоты были повышены в разной степени. Напротив, S. epidermidis и lugdunensis , по-видимому, демонстрировали существенные качественные изменения в аминокислотном составе, которые соответствовали бы качественным изменениям включения белка. Далее был сделан вывод, что пропорции белков, ассоциированных с клеточной стенкой, у S.epidermidis и S. lugdunensis были подобны своим соответствующим контрольным WT.
Данные предполагают, что все три вида адаптируются путем изменения профилей аминокислотного состава клеточной стенки и связанных структурных белков, что подразумевает изменение состава белков. Дальнейшие выводы относительно возможной уникальной стратегии адаптации S. aureus в различных штаммах Staphylococcus при воздействии окружающей среды потребуют дополнительных эмпирических данных.Однако настоящие результаты соответствуют клиническим наблюдениям тяжелой патогенности, наблюдаемой у инфекций S. aureus по сравнению с другими видами стафилококков, что можно объяснить улучшением выживаемости за счет быстрой и радикальной адаптации [40]. Будущие исследования будут включать попытки идентифицировать изменения белков, которые могут произойти в ответ на стрессы окружающей среды. Более глубокое понимание белковых реакций, связанных с клеточной стенкой, на стимулы и стрессы окружающей среды может дать новое понимание для разработки противомикробных стратегий.
В заключение, результаты этого исследования достоверно показали, что воздействие низких температур на S. aureus , S. epidermidis и S. lugdunensis вызывает морфологические, ультраструктурные и биохимические изменения в составе клеточной стенки, которые определяют их фенотипические результаты. Изменения, связанные с фенотипом SCV, были временными, а не генетическими, о чем свидетельствует способность вернуться к фенотипу WT после субкультуры без стресса. Быстрое переключение между двумя фенотипами обеспечивает гибкость бактерий, что служит преимуществом, когда требуются быстрые реакции на колебания окружающей среды.
Благодарности
Мы благодарим Трейси Харрисон и Крейга Эванса за их помощь в проведении ПЦР изолятов. Демин Чжу и Син Дин Ван за помощь в работе с ТЕА.
Вклад авторов
Эксперимент задумал и спроектировал: ЛАО ТКР РХД. Проведены эксперименты: ЛАО. Проанализированы данные: ЛАО ТКР РЖС. Написал статью: ЛАО РХД ТКР Ю.Г. ЦвЭ.
Ссылки
- 1.
Франк К.Л., Патель Р. (2008) Staphylococcus lugdunensis — Не средний коагулазонегативный стафилококк.Вестник клинической микробиологии 30: 55–62. - 2.
Schaberg DR, Culver DH, Gaynes RP (1991) Основные тенденции микробной этиологии внутрибольничной инфекции. Американский медицинский журнал 91: приложение 3B72–75. - 3.
Носкин Г.А., Рубин Р.Дж., Шентаг Дж. Дж., Клюйтманс Дж., Хедблом ЕС и др. (2005) Бремя инфекций Staphylococcus aureus для больниц в США. Архивы внутренней медицины 165: 1756–1761. - 4.
Оньянго Л.А., Данстан Р.Х., Робертс Т.К. (2008) Варианты стафилококков в небольших колониях: патогенез и эволюционное значение в возникновении и поддержании проблемных человеческих инфекций.Журнал питания и экологической медицины 17: 56–75. - 5.
von Eiff C, Becker K (2003) Варианты небольших колоний: еще один механизм, с помощью которого Staphylococcus aureus может уклоняться от иммунного ответа и антимикробной терапии. В: Fluit AC, Schmitz FJ, редакторы. MRSA: текущие перспективы. Уаймондем, Великобритания: Caister Academic Press. С. 253–273. - 6.
Hoffstadt RE, Youmans GP (1932) Staphylococcus aureus : диссоциация и ее связь с инфекцией и иммунитетом.J Infect Dis 51: 216–242. - 7.
Seifert H, Wisplinghoff H, Schnabel P, von Eiff C (2003) Варианты небольших колоний Staphylococcus aureus и инфекция, связанная с кардиостимулятором. Emerg Infect Dis 9: 1316–1318. - 8.
Проктор Р.А., фон Эйфф С., Каль BC, Беккер К., Макнамара П. и др. (2006) Варианты небольших колоний: патогенная форма бактерий, способствующая хроническим и рецидивирующим инфекциям. Nat Rev Microbiol 4: 295–305. - 9.
Sifri CD, Baresch-Bernal A, Calderwood SB, von Eiff C (2006) Вирулентность вариантов небольших колоний Staphylococcus aureus в модели инфекции Caenorhabditis elegans .Заражение иммунной 74: 1091–1096. - 10.
Баддур Л. М., Симпсон В. А., Уимс Дж. Дж., Хилл М., Кристенсен Г. Д. (1988) Фенотипический отбор малых колоний вариантных форм Staphylococcus epidermidis в модели эндокардита на крысах. J Infect Dis 157: 757–763. - 11.
Йонссон И.М., фон Эйфф С., Проктор Р.А., Петерс Дж., Райден С. и др. (2003) Вирулентность мутанта hemB, проявляющего фенотип варианта маленькой колонии Staphylococcus aureus в мышиной модели септического артрита.Microbiol Patho 34: 73–79. - 12.
Vaudaux P, Francois P, Bisognano C, Kelley WL, Lew DP, et al. (2002) Повышенная экспрессия фактора слипания и фибронектин-связывающих белков мутантами hemB Staphylococcus aureus , экспрессирующими фенотипы небольших колоний. Infect Immun 70: 5428–5437. - 13.
Sherris JC (1952) Два небольших варианта колонии S. aureus , выделенные в чистой культуре из закрытых инфицированных поражений, и их потребности в диоксиде углерода.J Clin Pathol 5: 354–355. - 14.
Макнамара П.Дж., Проктор Р.А. (2000) Staphylococcus aureus вариантов малых колоний, перенос электронов и стойкие инфекции. Int J Antimicrob Agents 14: 117–122. - 15.
Каль BC, Беллинг Дж., Райхельт Р., Херрманн М., Проктор Р.А. и др. (2003) Тимидин-зависимые варианты небольших колоний Staphylococcus aureus обнаруживают грубые морфологические и ультраструктурные изменения, соответствующие нарушенному разделению клеток.J Clin Microbiol 41: 410–413. - 16.
Adler H, Widmer A, Frei R (2003) Появление устойчивого к тейкопланину варианта небольшой колонии Staphylococcus epidermidis во время терапии ванкомицином. Eur J Clin Microbiol Infect Dis 22: 746–748. - 17.
Seifert H, Oltmanns D, Becker K, Wisplinghoff H, von Eiff C (2005) Staphylococcus lugdunensis Инфекция, связанная с кардиостимулятором. Emerg Infect Dis 11: 1283–1286. - 18.
Прескотт Л. М., Харли Дж. П., Кляйн Д. А. (2002) Рост микробов — влияние факторов окружающей среды на рост.Микробиология. 5-е изд. Нью-Йорк: Макгроу-Хилл. - 19.
Сингх В.К., Хаттангади Д.С., Джотис Е.С., Сингх А.К., Чемберлен Н.Р. и др. (2008) Инсерционная инактивация дегидрогеназы альфа-кетокислот с разветвленной цепью в Staphylococcus aureus приводит к снижению содержания жирных кислот в мембране с разветвленной цепью и повышенной восприимчивости к определенным стрессам. Прикладная и экологическая микробиология 74: 5882–5890. - 20.
Дмитриев Б.А., Тукач Ф.В., Холст О., Ритчел Э.Т., Элерс С. (2004) Третичная структура муреина клеточной стенки Staphylococcus aureus .Журнал бактериологии 186: 7141–7148. - 21.
Серадски К., Томаш А. (1997) Ингибирование обновления клеточной стенки и автолиза ванкомицином у мутанта Staphylococcus aureus с высокой устойчивостью к ванкомицину. Журнал бактериологии 179: 2557–2566. - 22.
Батт Х.Л., Данстан Р.Х., МакГрегор Н.Р., Робертс Т.К., Зербес М. и др. (1998) Связь токсинов, повреждающих мембраны, от коагулазонегативных стафилококков и хронической боли в орофациальных мышцах.J Med Microbiol 47: 577–584. - 23.
Браун Г.К., Мартин А.Р., Робертс Т.К., Эйткен Р.Дж. (2001) Обнаружение Ehrlichia platys у собак в Австралии. Aust Vet J 79: 554–558. - 24.
von Eiff C, Peters G, Becker K (2006) Концепция варианта малых колоний (SCV) — роль стафилококковых SCV в хронических инфекциях. Травма, Int J Care Раненые 37: S26 – S33. - 25.
Kipp F, Becker K, Peters G, von Eiff C (2004) Оценка различных методов определения устойчивости к метициллину в вариантах небольших колоний Staphylococcus aureus .J Clin Microbiol 42: 1277–1279. - 26.
Глауэрт AM (1975) «Фиксация, обезвоживание и заделка биологических образцов». В: Глауэрт AM, редактор. Кембридж: Биомедицинская пресса Эльзевьера-Северной Голландии. 207 с. - 27.
Дикстра М.Дж., Ройсс Л.Е. (2003) Подготовка образцов для электронной микроскопии и методы. В: Дикстра М.Дж., Ройсс Л.Е., редакторы. Биологическая электронная микроскопия: теория, методы и устранение неисправностей. 2-е изд. NY: Kluwer Academic / Plenum publishers.534 с. - 28.
Ханаки Х., Лабищински Х., Инаба Й., Кондо Н., Мураками Х. и др. (1998) Увеличение количества муропептидов, не содержащих глутамин, в пептидогликане устойчивого к ванкомицину штамма Staphylococcus aureus Mu50. Журнал антимикробной химиотерапии 42: 315–320. - 29.
de Jonge BLM, Chang Y-S, Gage D, Tomasz A (1991) Пептидогликановая композиция высокоустойчивого к метициллину штамма Staphylococcus aureus . Журнал биологической химии 267: 11248–11254. - 30.
Джексон Дж. Э. (1991) Руководство пользователя по основным компонентам. Нью-Йорк: Вили. - 31.
Wold S (1978) Перекрестная проверка количества компонентов в факторных моделях и моделях главных компонентов. Технометрика 20: 397–405. - 32.
Woese CR (1987) Бактериальная эволюция. Microbiological Reviews 51: 221–271. - 33.
Tuchscherr L, Medina E, Hussain M, Volker W., Heitmann V, et al. (2011) Смена фенотипа Staphylococcus aureus : эффективная бактериальная стратегия, позволяющая избежать иммунного ответа хозяина и вызвать хроническую инфекцию.EMBO Mol Med 3: 129–141. - 34.
Леунг MJ, Nuttall N, Pryce TM, Coombs GW, Pearman JW (1998) Вариация колоний в Staphylococcus lugdunensis . J Clin Microbiol 36: 3096–3098. - 35.
Цуй Л., Ма Х, Сато К., Окума К., Теновер Ф.К. и др. (2003) Утолщение клеточной стенки является общим признаком устойчивости к ванкомицину у Staphylococcus aureus . J Clin Microbiol 41: 5–14. - 36.
Cui L, Murakami H, Kuwahara-Arai K, Hanaki H, Hiramatsu K (2000) Вклад утолщенной клеточной стенки и ее неамидированного компонента глутамина в устойчивость к ванкомицину, выражаемую Staphylococcus aureus Mu50.Противомикробные агенты и химиотерапия 44: 2276–2285. - 37.
Hogt AH, Dankert J, Feijen J (1983) Инкапсуляция, образование слизи и поверхностная гидрофобность коагулазонегативных стафилококков. FEMS Microbiol Lett 18: 211–215. - 38.
Sianglum W, Srimanote P, Wonglumsom W, Kittiniyom K, Voravuthikunchai SP (2011) Протеомные анализы клеточных белков в метициллин-устойчивом Staphylococcus aureus , обработанном родомиртоном, новым кандидатом в антибиотики.PLoS ONE 6: 1–10. - 39.
Саньял Д., Гринвуд Д. (1993) Исследование под электронным микроскопом устойчивых к гликопептидам антибиотиков штаммов Staphylococcus epidermidis . Журнал медицинской микробиологии 39: 204–210. - 40.
Abu-Qatouseh LF, Chinni SV, Seggewiss J, Proctor RA, Brosius J, et al. (2010) Идентификация дифференциально экспрессируемых малых небелковых РНК у Staphylococcus aureus , демонстрирующих как нормальный, так и вариантный фенотип с малыми колониями.Журнал молекулярной медицины 88: 565–575.
Ингибирование двухкомпонентной системы GraXRS с вертепорфином для борьбы с инфекциями Staphylococcus aureus
Kelly, R. & Davies, S.C. Борьба с устойчивостью к противомикробным препаратам во всем мире. Med. J. Aust. 207 , 371–373 (2017).
PubMed
Статья
Google ученый
Rasigade, J.-P., Dumitrescu, O.& Лина, Г. Новая эпидемиология Staphylococcus aureus инфекций. Clin. Microbiol. Заразить. 20 , 587–588 (2014).
PubMed
Статья
Google ученый
Wertheim, H. F. et al. Роль носительства в инфекциях, вызванных Staphylococcus aureus . Lancet Infect. Дис. 5 , 751–762 (2005).
PubMed
Статья
Google ученый
Баласубраманиан, Д., Харпер, Л., Шопсин, Б. и Торрес, В. Дж. Патогенез Staphylococcus aureus в различных средах хозяина. Pathog. Дис. 75 , ftx005 (2017).
PubMed Central
Статья
CAS
PubMed
Google ученый
Сток, А. М., Робинсон, В. Л. и Гудро, П. Н. Двухкомпонентное преобразование сигнала. Annu. Rev. Biochem. 69 , 183–215 (2000).
CAS
PubMed
Статья
Google ученый
Капра, Э. Дж. И Лауб, М. Т. Эволюция двухкомпонентных систем передачи сигналов. Annu. Rev. Microbiol. 66 , 325–347 (2012).
CAS
PubMed
PubMed Central
Статья
Google ученый
Кавада-Мацуо, М., Йошида, Ю., Накамура, Н. и Комацудзава, Х.Роль двухкомпонентных систем в устойчивости Staphylococcus aureus к антибактериальным средствам. Вирулентность 2 , 427–430 (2011).
PubMed
Статья
Google ученый
Бойл-Вавра, С., Инь, С., Джо, Д. С., Монтгомери, С. П. и Даум, Р. С. VraT / YvqF необходим для устойчивости к метициллину и активации регулона VraSR в Staphylococcus aureus . Agencia Eur.Med. 57 , 83–95 (2013).
CAS
Google ученый
Falord, M., Mäder, U., Hiron, A., Débarbouillé, M. & Msadek, T. Исследование регулона GraSR Staphylococcus aureus выявило новые связи с вирулентностью, реакцией на стресс и клеточной стенкой пути передачи сигналов. PLoS ONE 6 , e21323 (2011).
ADS
CAS
PubMed
PubMed Central
Статья
Google ученый
Haag, A. F. & Bagnoli, F. Роль двухкомпонентных систем передачи сигналов в регуляции вирулентности Staphylococcus aureus . Life Sci. J. 6 , 145–198 (2015).
Google ученый
Bem, A.E. et al. Бактериальные гистидинкиназы как новые мишени для антибактериальных препаратов. ACS Chem. Биол. 10 , 213–224 (2015).
CAS
PubMed
Статья
Google ученый
Okada, A. et al. Walkmycin B нацелен на WalK (YycG), гистидинкиназу, необходимую для роста бактериальных клеток. J. Antibiot. (Токио) 63 , 89–94 (2010).
CAS
Статья
Google ученый
Хиллиард, Дж. Дж., Гольдшмидт, Р. М., Ликата, Л., Баум, Э. З. и Буш, К. Множественные механизмы действия ингибиторов гистидиновых протеинкиназ из бактериальных двухкомпонентных систем. Антимикробный.Агенты Chemother. 43 , 1693–1699 (1999).
CAS
PubMed
PubMed Central
Статья
Google ученый
Gotoh, Y. et al. Двухкомпонентная сигнальная трансдукция как потенциальные мишени для лекарств в патогенных бактериях. Curr. Opin. Microbiol. 13 , 232–239 (2010).
CAS
PubMed
Статья
Google ученый
Villanueva, M. et al. Сенсорная депривация у Staphylococcus aureus . Нат. Commun. 9 , 523 (2018).
ADS
PubMed
PubMed Central
Статья
CAS
Google ученый
Kraus, D. et al. Регуляторная система GraRS контролирует восприимчивость Staphylococcus aureus к антимикробной защите хозяина. BMC Microbiol. 8 , 85 (2008).
ADS
PubMed
PubMed Central
Статья
CAS
Google ученый
Yang, S.-J. et al. Двухкомпонентная регуляторная система Staphylococcus aureus , GraRS, обнаруживает и придает устойчивость к выбранным катионным антимикробным пептидам. Заражение. Иммун. 80 , 74–81 (2012).
CAS
PubMed
PubMed Central
Статья
Google ученый
Cheung, A. L. et al. Сайт-специфическая мутация сенсорной киназы GraS в Staphylococcus aureus изменяет адаптивный ответ на отдельные катионные антимикробные пептиды. Заражение. Иммун. 82 , 5336–5345 (2014).
CAS
PubMed
PubMed Central
Статья
Google ученый
Chaili, S. et al. Сенсор GraS в Staphylococcus aureus обеспечивает устойчивость к защитным пептидам хозяина, различающимся по механизмам действия. Заражение. Иммун. 84 , 459–466 (2016).
CAS
PubMed
PubMed Central
Статья
Google ученый
Flannagan, R. S., Kuiack, R. C., McGavin, M. J. & Heinrichs, D. E. Staphylococcus aureus использует регуляторную систему GraXRS для восприятия и адаптации подкисленных фаголизосом в макрофагах. МБио 9 , 561 (2018).
Артикул
Google ученый
Muzamal, U., Gomez, D., Kapadia, F. & Golemi-Kotra, D. Разнообразие двухкомпонентных систем: понимание механизма передачи сигнала двухкомпонентной системой Staphylococcus aureus GraSR. F1000Res. 3 , 252 (2014).
PubMed
PubMed Central
Статья
Google ученый
Лю, К., Йео, В.-С. & Bae, T. Двухкомпонентная система SaeRS Staphylococcus aureus . Гены (Базель) 7 , 81 (2016).
Артикул
CAS
Google ученый
Илс, К. Л., Уилкинсон, Э. А., Крукшенк, Г., Такер, Дж. Х. Р. и Теннант, Д. А. Вертепорфин избирательно убивает гипоксические клетки глиомы за счет связывания железа и увеличения производства активных форм кислорода. Sci. Отчетность 8 , 14358 (2018).
ADS
PubMed
PubMed Central
Статья
CAS
Google ученый
Шимицу Т., Ленгалова А., Мартинек В. и Мартинкова М. Хем: новые роли гема в передаче сигналов, функциональной регуляции и в качестве каталитических центров. Chem. Soc. Ред. 48 , 5624–5657 (2019).
CAS
PubMed
Статья
Google ученый
van der Meer, J. W. M., Fears, R., Davies, D. S. C. & ter Meulen, V. Антимикробные инновации: сочетание приверженности, творчества и согласованности. Нат. Rev. Drug Discov. 13 , 709–710 (2014).
PubMed
Статья
CAS
Google ученый
Kong, C., Neoh, H. & Nathan, S. Нацеливание на Staphylococcus aureus токсины: потенциальная форма противовирулентной терапии. Токсины (Базель) 8 , 72 (2016).
Артикул
CAS
Google ученый
Thangamani, S., Mohammad, H., Abushahba, M. F. N., Sobreira, T. J. P. и Seleem, M. N. Использование ауранофина для лечения кожных стафилококковых инфекций. Внутр. J. Antimicrob. Агенты 47 , 195–201 (2016).
CAS
PubMed
PubMed Central
Статья
Google ученый
Yeo, W.-S. et al. Противораковые препараты, одобренные FDA, стрептозотоцин и флоксуридин, снижают вирулентность Staphylococcus aureus . Sci. Отчетность 8 , 2521 (2018).
ADS
PubMed
PubMed Central
Статья
CAS
Google ученый
Thangamani, S., Mohammad, H., Younis, W. & Seleem, M. Перепрофилирование лекарств для лечения стафилококковых инфекций. Curr. Pharm. Des. 21 , 2089–2100 (2015).
CAS
PubMed
Статья
Google ученый
Li, M. et al. Антимикробная система определения пептидов APS Staphylococcus aureus . Мол. Microbiol. 66 , 1136–1147 (2007).
CAS
PubMed
Статья
Google ученый
Золотистый стафилококк . Антимикробный. Агенты Chemother. 56 , 1047–1058 (2012).
CAS
PubMed
PubMed Central
Статья
Google ученый
Miró-Canturri, A., Ayerbe-Algaba, R. & Smani, Y. Перепрофилирование лекарств для лечения бактериальных и грибковых инфекций. Фронт. Microbiol. 10 , 41 (2019).
PubMed
PubMed Central
Статья
Google ученый
Gautret, P. et al. Гидроксихлорохин и азитромицин для лечения COVID-19: результаты открытого нерандомизированного клинического исследования. Внутр. J. Antimicrob. Агенты 56 , 105949 (2020).
CAS
PubMed
PubMed Central
Статья
Google ученый
Ходавердян В. и др. Открытие антивирулентных агентов против метициллин-резистентных Staphylococcus aureus . Антимикробный. Агенты Chemother. 57 , 3645–3652 (2013).
CAS
PubMed
PubMed Central
Статья
Google ученый
Hendrix, A. S. et al. Переназначение нестероидного противовоспалительного препарата дифлунизал в качестве остеопротекторной, противовирусной терапии для лечения остеомиелита Staphylococcus aureus . Антимикробный. Агенты Chemother. 60 , 5322–5330 (2016).
CAS
PubMed
PubMed Central
Статья
Google ученый
Loi, V. V. et al. Редокс-зондирование в условиях гипохлоритного стресса и инфекции репрессором семейства Rrf2 HypR в Staphylococcus aureus . Антиоксид. Редокс-сигнал. 29 , 615–636 (2018).
CAS
PubMed
PubMed Central
Статья
Google ученый
Loi, V. V. et al. Staphylococcus aureus отвечает на аллицин глобальным S-тиоаллилированием — роль пути Brx / BSH / YpdA и дисульфидредуктазы MerA в преодолении аллицинового стресса. Free Radic. Биол. Med. 139 , 55–69 (2019).
CAS
PubMed
Статья
Google ученый
Rapun-Araiz, B. et al. Систематическая реконструкция полной двухкомпонентной сенсорной сети Staphylococcus aureus . mСистемы 5 , e00511 – e00520. https://doi.org/10.1128/mSystems.00511-20 (2020).
Артикул
PubMed
PubMed Central
Google ученый
Мальпика, Р., Франко, Б., Родригес, К., Квон, О. и Джорджеллис, Д. Идентификация хинон-чувствительного окислительно-восстановительного переключателя в сенсорной киназе ArcB. Proc. Natl. Акад. Sci. 101 , 13318–13323 (2004).
ADS
CAS
PubMed
Статья
Google ученый
Фридман, М. и др. Перекрестные помехи двух уникальных управляемых фосфорилированием сигнальных путей в Staphylococcus aureus для модуляции заряда клеточной стенки: Stk1 / Stp1 встречает GraSR. Биохимия 52 , 7975–7986 (2013).
CAS
PubMed
Статья
Google ученый
AlAmri, M.A., Kadri, H., Alderwick, L.J., Jeeves, M. & Mehellou, Y. Фотосенсибилизирующий клинический агент вертепорфин является ингибитором киназ SPAK и OSR1. ChemBioChem 19 , 2072–2080 (2018).
CAS
PubMed
Статья
Google ученый
Elyasi, S., Khalili, H., Dashti-Khavidaki, S. & Mohammadpour, A. Нефротоксичность, вызванная ванкомицином: механизм, частота, факторы риска и особые группы населения. Обзор литературы. евро. J. Clin. Pharmacol. 68 , 1243–1255 (2012).
CAS
PubMed
Статья
Google ученый
Ли, Дж. С. Электротрансформация стафилококков. В протоколах электропорации для микроорганизмов (изд. Nickoloff, J. A.) 209–216 (Humana Press, Totowa, 1995). https://doi.org/10.1385/0-89603-310-4:209.
Глава
Google ученый
Schenk, S. & Laddaga, R.A. Улучшенный метод электропорации Staphylococcus aureus . FEMS Microbiol. Lett. 94 , 133–138 (1992).
CAS
Статья
Google ученый
Arnaud, M., Chastanet, A. & Debarbouille, M. Новый вектор для эффективного замещения аллелей у естественно нетрансформируемых грамположительных бактерий с низким содержанием GC. Прил. Environ. Microbiol. 70 , 6887–6891 (2004).
CAS
PubMed
PubMed Central
Статья
Google ученый
Valle, J. et al. SarA, а не σB важен для развития биопленок Staphylococcus aureus . Мол. Microbiol. 48 , 1075–1087 (2003).
CAS
PubMed
Статья
Google ученый
Peschel, A. et al. Staphylococcus aureus Устойчивость к человеческим дефенсинам и уклонение от уничтожения нейтрофилов с помощью нового фактора вирулентности Mprf основана на модификации мембранных липидов L-лизином. J. Exp. Med. 193 , 1067–1076 (2001).
CAS
PubMed
PubMed Central
Статья
Google ученый
Новик Р. П. Молекулярная биология стафилококков . ВЧ Опубл. 1–37 (1990).
Baba, T. et al. Геном и детерминанты вирулентности внебольничного MRSA с высокой вирулентностью. Ланцет 359 , 1819–1827 (2002).
CAS
PubMed
Статья
Google ученый
МакРипли Р. Дж. И Уитни Р. Р. Характеристика и количественное определение экспериментальных инфекций хирургической раны, используемых для оценки местных антибактериальных средств. Антимикробный. Агенты Chemother. 10 , 38–44 (1976).
CAS
PubMed
PubMed Central
Статья
Google ученый
Распад Staphylococcus aureus и метициллин-резистентного золотистого стафилококка от взрослых и детей, купающихся в морских водах | BMC Microbiology
Исследование было одобрено Внутренним контрольным советом Министерства здравоохранения Флориды (IRB 1491; DOH IRB Number, H07164) и Внутренним контрольным советом Университета Майами (IRB 20070306).Формы согласия подписывались каждым участником исследования (или родителем / опекуном), а личность участника не разглашалась. План полевых экспериментов соответствовал планам Эльмира и др. [17, 18], включая использование того же самого исследовательского участка (субтропический неточечный морской пляж для отдыха).
Полевые исследования в бассейне
Полевое исследование «Большой бассейн» использовалось для определения общего количества S. aureus и распределения S. aureus относительно MSSA и MRSA, выделенных из тел взрослых купающихся [17 , 18].Вкратце, после заполнения надувного бассейна 1400 л местной прибрежной морской воды (где во время сбора не наблюдали плавания людей) две группы из 10 взрослых участников подверглись серии из четырех непрерывных 15-минутных циклов купания. проводились в один день июля 2008 г., начало в 9:00 и 12:00 соответственно. Между циклами купания бассейн очищали и наполняли водой из того же источника. Участники не подвергались воздействию песка в течение первых двух циклов, но подвергались воздействию песка на пляже в течение последних двух циклов.Образцы исходной воды, воды из бассейна до контакта с участником (в трех экземплярах) и воды из бассейна после контакта с участником (в трех экземплярах) были собраны после каждого цикла. Образцы исходной воды, воды из бассейна и остаточного песка были проанализированы, как описано ниже. Демографические характеристики 20 взрослых участников «Большого пула» (10 мужчин и 10 женщин) включали возрастной диапазон от 19 до 51 года и массу тела от 50 до 100 кг [18].
Полевое исследование «Малый бассейн» было использовано для определения общей суммы S.aureus и распределение S. aureus среди MSSA и MRSA, высвобожденных из органов педиатрической популяции, включая оценку вклада песка, прилипшего к педиатрическому участнику [18]. Вкратце, в том же районе пляжа, где проводились исследования для взрослых, в течение двух дней в июле и августе 2008 г. 14 отдельных малышей в купальных костюмах поверх подгузников провели 15–30 минут на песчаном пляже (например, играя, сидя, лежа, гуляя, так далее). После воздействия песка малышей поместили в ванну объемом 190 литров, а местную прибрежную морскую воду (14 литров) осторожно вылили из продезинфицированных лейок на их головы и тела.При необходимости взрослые поддерживали малышей в бассейне в вертикальном положении либо руками в перчатках, либо руками, продезинфицированными спиртом. Санацию пула и сбор образцов (в трех экземплярах) выполняли, как описано [18]. Образцы исходной воды, воды из бассейна и остаточного песка были проанализированы, как описано ниже. Демографические характеристики 14 малышей из «Малого пула» (2 мужчин и 12 девочек) включали возраст от 5 до 47 месяцев и вес от 6,8 до 16,3 кг [18].
Перед началом исследования у всех участников были получены носовые культуры из передних носовых ходов с использованием искусственных мазков (мазок для культивирования BBL: Becton, Dickinson and Company) и S.aureus культивировали, как описано ниже.
Выделение и идентификация бактерий
S. aureus был выделен из проб воды с использованием метода стандартной мембранной фильтрации (MF) [19] с последующим выращиванием на селективных средах, агаре Baird Parker (Becton, Dickinson and Company, Sparks). , MD) с обогащением теллуритом яичного желтка (EY) (Becton, Dickinson and Company), BP и CHROMagar, CHR (Becton, Dickinson and Company) (технологический процесс см. На Рисунке 1). MSSA и MRSA, выделенные из чашек с ВР, подвергали генетическим тестам и сравнивали с организмами, выделенными из носовых культур.MSSA, выделенный из чашек CHR, использовали для прямого сравнения количества колоний, полученного в ходе предыдущих исследований. Помещения, используемые для обработки образцов, были расположены в нескольких минутах от места исследования, что позволяло обрабатывать образцы в течение одного часа после сбора. Объемы исходной воды, использованной для фильтрации, составляли 10 мл и 100 мл; объемы проб воды в бассейне, использованные для фильтрации до и после контакта со взрослыми участниками, составляли 10 мл и 50 мл соответственно; объемы воды, использованной для фильтрации после контакта с педиатрическими участниками, составляли 5 мл, 10 мл и 50 мл.Множественные объемы фильтровали для получения количественного подсчета колоний, поскольку уровни бактерий как в исходной воде, так и в экспериментальных образцах воды бассейна были неизвестны.
Рисунок 1
Процесс выделения и идентификации бактерий для S. aureus и MRSA .
Анализ S. aureus в песке был аналогичен анализу для воды, за исключением двух этапов предварительной обработки. На первом этапе измеряли содержание воды в песке (разница в весе песка до и после сушки при 110 ° C в течение 24 часов).На втором этапе бактерии извлекались из песчинок в заранее определенный объем стерильной воды. Для этого предварительно взвешенный невысушенный песок в асептических условиях извлекали из соответствующего контейнера для образца и помещали в стерильный предварительно взвешенный сосуд. В каждую емкость добавляли сто десять миллилитров стерильного фосфатно-солевого буфера (PBS), и банки энергично встряхивали в течение 30 секунд. Образцам давали осесть в течение 30 секунд, а затем супернатант использовали для мембранной фильтрации.Сто миллилитров образцов песчаного элюата использовали для фильтрации и определения количества бактерий.
После стандартного MF фильтрующие мембраны помещали в BP и CHR и инкубировали в аэробных условиях при 37 ° C в течение минимум 24 часов. После инкубации колонии, которые оказались черными, блестящими, выпуклыми, диаметром 2-5 мм и окруженными прозрачными зонами (BP) или лиловыми (CHR), считались предположительно S. aureus и подвергались подтверждающим тестам. Все предположительно положительные изоляты переносили в агар с маннитоловой солью (Becton, Dickinson and Company) для определения ферментации маннита и инкубировали в аэробных условиях при 37 ° C в течение 16-24 часов.Все изоляты, ферментирующие маннит, были обогащены [20] на триптиказо-соевом агаре с 5% овечьей крови (TSA II, Becton, Dickinson and Company) для определения морфологии колоний и общей пигментации, способности лизировать эритроциты и предоставлять бактериальные клетки. для тестов латексной агглютинации на фактор слипания и протеина A с использованием теста Remel BactiStaph Latex Agglutination Test (Thermo Fisher Scientific, Lenexa, KS).
Анализ культур мазков из носа был сосредоточен на обнаружении и генетической характеристике, а не на количественной оценке.Используемый метод был таким же, как и для проб воды, за исключением того, что этап мембранной фильтрации был пропущен. Используя стандартные асептические методы, мазки помещали в 0,5 мл триптиказо-соевого бульона TSB (Becton, Dickinson and Company) с добавлением 6,5% хлорида натрия и инкубировали в течение ночи при 37 ° C для обогащения. Сто микролитров ночного бульона переносили в агар с маннитоловой солью (Becton, Dickinson and Company), и организмы идентифицировали и подтверждали, как подробно описано выше.
Хромосомная ДНК была выделена из колоний, выделенных из воды, песка и носовых культур. Экстракты целых клеток получали из бактериальных изолятов, положительных по латексной агглютинации, с использованием набора для подготовки образцов мокроты Amplicor MTB (Roche Molecular Systems, Inc., Индианаполис, штат Индиана) в соответствии с рекомендациями производителя и использовались в качестве матрицы для подтверждения и характеристики полимеразных цепных реакций (ПЦР). ), как описано ниже. Эти экстракты ДНК (максимум 22 на фильтр) были подвергнуты ПЦР-анализу S.aureus специфический gyr Ген для подтверждения S. aureus и mec A ген для генетического подтверждения MRSA. Олигонуклеотидные праймеры и условия термоциклирования использовали, как описано ранее [21], с незначительной модификацией, заключающейся в том, что 5 мкл экстракта целых клеток использовались в качестве матрицы в начальных реакциях ПЦР вместо очищенной хромосомной ДНК.
Все организмы, которые были определены как генотипические MRSA (положительный результат теста на mecA ), были повторно выделены из чашек с агаром и выращены на агаровой среде для скрининга устойчивости к оксациллину ORSAB (Remel; Thermo Fisher Scientific), селективной среде для подтверждения фенотипа. MRSA.Все генотипические изоляты MRSA из этого исследования показали фенотипические характеристики MRSA. Все подтвержденные MRSA (n = 17) и MSSA (n = 162), собранные из образцов воды и песка, и все назальные культуры хранили как исходные штаммы при -80 ° C.
Сообщалось о количестве колоний с положительным результатом теста на gyr A ген (для S. aureus ) и mec A на ген (для MRSA). Затем счетчики доводили до колониеобразующих единиц на 100 мл воды (КОЕ / 100 мл) или на 100 г песка (КОЕ / 100 г) с использованием объема воды, подаваемой на фильтры, или веса песка, собранного из бассейна.Количество выделенных микробов на человека определяли путем умножения разницы в концентрациях микробов, измеренных до и после купания в бассейнах, на объемы воды, соответствующие каждому человеку.
Генетическая характеристика
Бактериальные изоляты, определенные как положительные для S. aureus , gyrA и MRSA mec A, были подвергнуты дополнительной ПЦР для тестирования генов токсинов для лейкоцидина Panton-Valentine, pvl , для оценки патогенного потенциала изолированных организмов, как описано ранее [21].Кассетная хромосома стафилококка метициллин, SCC mec , тип определяли для всех MRSA, как описано [22]; и белок A Staphylococcus, spa , тип был определен для всех MRSA и репрезентативной подгруппы MSSA, как описано [23], и с использованием сервера типа RIDOM spa для анализа последовательностей. Типы SCC mec и spa были определены для обеспечения конкретных генетических характеристик для сравнения между носовыми изолятами от колонизированных участников и образцами воды из бассейнов.Генетические характеристики были оценены для всех изолятов MRSA и всех изолятов MSSA из назальных мазков, а также из образцов воды и песка из небольшого бассейна. Из-за большого количества изолятов S. aureus из большого пула, генетическая характеристика была проведена на репрезентативном наборе изолятов MSSA из каждой коллекции воды большого бассейна и выбрана для включения подмножества всей морфологии колоний, общей пигментации и эритроцитов. тип гемолиза присутствует в каждом наборе. Были проанализированы все MSSA, собранные из проб воды небольшого бассейна от одного педиатрического участника, попавшего в колонию.
Статистический анализ
Анализ данных (включая корреляции Пирсона, T-тесты Стьюдента и тесты сумм рангов) был проведен с использованием Microsoft Excel 2003 и Sigmaplot 11.
Управление инфекциями Staphylococcus aureus
1. Морейллон П., Que YA, Глаузер М.П. Золотистый стафилококк (в том числе стафилококковый токсический шок). В: Man-dell GL, Bennett JE, Dolin R, eds. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета. 6-е изд. Филадельфия: Elsevier Churchill Livingstone, 2005: 2321–51….
2. Национальная система надзора за внутрибольничными инфекциями.
Отчет Национальной системы надзора за внутрибольничными инфекциями (NNIS), сводка данных с января 1992 г. по июнь 2004 г., выпущенный в октябре 2004 г. Am J Infect Control .
2004. 32: 470–85.
3. Носкин Г.А.,
Рубин Р.Ж.,
Шентаг JJ,
Клюйтманс Дж.,
Hedblom EC,
Смолдерс М,
и другие.
Бремя инфекций Staphylococcus aureus для больниц в Соединенных Штатах: анализ общенациональной базы данных образцов стационарных пациентов за 2000 и 2001 годы. Arch Intern Med .
2005; 165: 1756–61.
4. Камеры ВЧ.
Изменяющаяся эпидемиология Staphylococcus aureus? Emerg Infect Dis .
2001; 7: 178–82.
5. Наими Т.С.,
LeDell KH,
Комо-Сабетти К,
Борхардт С.М.,
Боксруд ди-джей,
Этьен Дж.,
и другие.
Сравнение инфекции, вызванной устойчивым к метициллину Staphylococcus aureus, связанной с местным населением и медицинским обслуживанием. ЯМА .
2003. 290: 2976–84.
6. Центры по контролю и профилактике заболеваний. Связанные с сообществами инфекции, вызванные устойчивостью к метициллину Staphylococcus aureus, у жителей островов Тихого океана — Гавайи, 2001–2003 гг. MMWR Morb Mortal Wkly Rep 2004; 53: 767–70. Доступ в Интернете 12 октября 2005 г. по адресу: http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5333a5.htm.
7. Фрэнсис Дж. С.,
Доэрти MC,
Лопатин У,
Джонстон CP,
Синха Джи,
Росс Т,
и другие.
Тяжелая внебольничная пневмония у здоровых взрослых, вызванная метициллин-резистентным золотистым стафилококком, несущим гены лейкоцидина Пантона-Валентайна. Clin Infect Dis .
2005; 40: 100–7.
8. Каплан SL.
Последствия метициллин-устойчивого золотистого стафилококка как внебольничного патогена у педиатрических пациентов. Инфекция Dis Clin North Am .
2005; 19: 747–57.
9. Адем П.В.,
Монтгомери CP,
Хусейн А.Н.,
Куглер Т.К.,
Аранджелович В,
Humilier M,
и другие.
Золотистый стафилококк, сепсис и синдром Уотерхауса-Фридериксена у детей. N Engl J Med .
2005; 353: 1245–51.
10. Левин Д.П.,
Фромм Б.С.,
Редди BR.
Медленный ответ на ванкомицин или ванкомицин плюс рифампин при метициллин-резистентном эндокардите, вызванном Staphylococcus aureus. Энн Интерн Мед. .
1991; 115: 674–80.
11. Лю Ц.,
Камеры ВЧ.
Золотистый стафилококк с гетерогенной устойчивостью к ванкомицину: эпидемиология, клиническое значение и критическая оценка методов диагностики. Противомикробные агенты Chemother .
2003; 47: 3040–5.
12. Моисе-Бродер П.А.,
Сакулас Г,
Элиопулос GM,
Шен-тег JJ,
Форрест А,
Moellering RC Jr.
Полиморфизм вспомогательного гена-регулятора группы II у метициллин-резистентного золотистого стафилококка является прогностическим признаком неэффективности терапии ванкомицином. Clin Infect Dis .
2004; 38: 1700–5.
13. Вундеринк Р.Г.,
Rello J,
Каммарата СК,
Croos-Dabrera RV,
Kollef MH.Линезолид против ванкомицина: анализ двух двойных слепых исследований пациентов с метициллин-резистентной нозокомиальной пневмонией Staphylococcus aureus. Сундук .
2003; 124: 1789–97.
14. Арбейт РД,
Маки Д,
Tally FP,
Capanaro E,
Эйзенштейн Б.И.
Безопасность и эффективность даптомицина для лечения осложненных инфекций кожи и кожных структур. Clin Infect Dis .
2004; 38: 1673–81.
15. Льюис Дж. С.,
Jorgensen JH.Индуцируемая устойчивость стафилококков к клиндамицину: следует ли беспокоиться клиницистам и микробиологам? Clin Infect Dis .
2005; 40: 280–5.
16. Фаулер В.Г. Младший,
Ольсен М.К.,
Кори Г.Р.,
Вудс CW,
Cabell CH,
Реллер Л.Б.,
и другие.
Клинические признаки осложненной бактериемии Staphylococcus aureus. Arch Intern Med .
2003. 163: 2066–72.
17. Фаулер В.Г. Младший,
Ли Дж,
Кори Г.Р.,
Боули Дж.,
Марр К.А.,
Гопал АК,
и другие.Роль эхокардиографии в оценке пациентов с бактериемией Staphylococcus aureus: опыт 103 пациентов. Джам Колл Кардиол .
1997; 30: 1072–8.
18. Розен А.Б.,
Фаулер В.Г. Младший,
Кори Г.Р.,
Даунс СМ,
Биддл АК,
Ли Дж,
и другие.
Экономическая эффективность чреспищеводной эхокардиографии для определения продолжительности терапии внутрисосудистой катетер-ассоциированной бактериемии Staphylococcus aureus. Энн Интерн Мед. .1999; 130: 810–20.
19. Фаулер В.Г. Младший,
Сандерс Л.Л.,
Секстон ди-джей,
Kong L,
Марр К.С.,
Гопал АК,
и другие.
Исход бактериемии Staphylococcus aureus с соблюдением рекомендаций инфекционистов: опыт 244 больных. Clin Infect Dis .
1998. 27: 478–86.
20. Мермель Л.А.,
Фарр Б.М.,
Шерерц Р.Дж.,
Раад II,
О’Грэйди Н,
Харрис Дж.С.,
и другие.Рекомендации по ведению инфекций, связанных с внутрисосудистым катетером. Clin Infect Dis .
2001; 32: 1249–72.
21. Лобати Ф,
Херндон Б,
Бамбергер Д.
Остеомиелит: этиология, диагностика, лечение и исход в государственном и частном учреждении. Инфекция .
2001; 29: 333–6.
22. Bamberger DM.
Диагностика и лечение остеомиелита. Comp Ther .
2000; 26: 89–95.
23.Le Saux N,
Говард А,
Барроумен, штат Нью-Джерси,
Габури I,
Самп-сын М,
Мохер Д.
Более короткие курсы парентеральной антибактериальной терапии, по-видимому, не влияют на частоту ответа у детей с острым гематогенным остеомиелитом: систематический обзор. BMC Infect Dis .
2002; 2: 16.
24. Бербари Э. Ф., Штекельберг Дж. М., Осмон ДР. Остеомиелит. В: Mandell GL, Bennet JE, Dolin R, eds. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета.6-е изд. Филадельфия: Эльзевьер Черчилль Ливингстон, 2005: 1322–1332.
25. Zimmerli W,
Видмер А.Ф.,
Блаттер М,
Фрай Р.,
Ochsner PE.
Роль рифампицина в лечении стафилококковых инфекций, связанных с ортопедическими имплантатами: рандомизированное контролируемое исследование. ЯМА .
1998. 279: 1537–41.
26. Colice GL,
Кертис А,
Deslauriers J,
Хеффнер Дж.
Свет R,
Литтенберг Б,
и другие.
Медикаментозное и хирургическое лечение парапневмонических выпотов: рекомендации, основанные на фактических данных [опубликованные поправки опубликованы в Chest 2001; 119: 319]. Сундук .
2000; 118: 1158–71.
27. Jensen AG,
Эсперсен Ф,
Скинхой П,
Росдаль ВТ,
Фримодт-Мёллер Н.
Менингит, вызванный золотистым стафилококком. Обзор 104 последовательных дел по всей стране. Arch Intern Med .
1993; 153: 1902-8.
28. Бамбергер DM.
Результат лечения бактериальных абсцессов без терапевтического дренирования: обзор случаев, описанных в литературе. Clin Infect Dis .1996; 23: 592–603.
29. Бойс Дж. М.,
Хэвилл Н.Л.,
Кохан С,
Думиган Д.Г.,
Ligi CE.
Работают ли меры инфекционного контроля в отношении метициллин-устойчивого золотистого стафилококка? Инфекционный контроль Hosp Epidemiol .
2004. 25: 395–401.
30. Купер Б.С.,
Камень SP,
Кибблер СС,
Куксон Б.Д.,
Робертс Дж. А.,
Medley GF, г.
и другие.
Меры изоляции в больничном ведении метициллин-устойчивого золотистого стафилококка (MRSA): систематический обзор литературы. BMJ .
2004; 329: 533.
31. Cepeda JA,
Белый дом Т,
Купер Б,
Привет J,
Джонс К.,
Кваку Ф,
и другие.
Изоляция пациентов в отдельных палатах или когортах для уменьшения распространения MRSA в отделениях интенсивной терапии: проспективное двухцентровое исследование. Ланцет .
2005; 365: 295–304.
32. Доббелинг Б.Н.,
Рейган Д.Р.,
Пфаллер М.А.,
Хьюстон AK,
Холлис Р.Дж.,
Венцель Р.П.
Долгосрочная эффективность интраназальной мази мупироцина.Проспективное когортное исследование носительства Staphylococcus aureus. Arch Intern Med .
1994; 154: 1505–8.
33. Perl TM,
Каллен Дж. Дж.,
Венцель Р.П.,
Циммерман М.Б.,
Пфаллер М.А.,
Шеппард Д,
и другие.
Мупироцин интраназально для профилактики послеоперационных инфекций, вызванных Staphylococcus aureus. N Engl J Med .
2002; 346: 1871–7.
34. Вертхайм HF,
Vos MC, г.
Отт А,
Восс А,
Клюйтманс Я.А.,
Vandenbroucke-Grauls CM,
и другие.Профилактика мупироцином против внутрибольничных инфекций Staphylococcus aureus у нехирургических пациентов: рандомизированное исследование. Энн Интерн Мед. .
2004. 140: 419–25.
35. Леб М,
Главный C,
Уокер-Дилкс С,
Иди А.
Противомикробные препараты для лечения колонизации устойчивым к метициллину Staphylococcus aureus. Кокрановская база данных Syst Rev .
2003; (4): CD003340.
Staphylococcus aureus адаптируется к условиям питания хозяина для преодоления тканеспецифической потребности в жирных кислотах с разветвленной цепью.
Значимость
Липоилирование — это посттрансляционная модификация, критическая для функции нескольких метаболических ферментов.У бактериального патогена Staphylococcus aureus недостаточность липоилирования препятствует росту и вызывает тканеспецифические дефекты вирулентности. Нарушение липоилирования вызывает ослабление, частично из-за нарушения ферментного комплекса, необходимого для синтеза жирных кислот с разветвленной цепью, важнейшего компонента мембраны S. aureus . S. aureus преодолевает ауксотрофию жирных кислот с разветвленной цепью в коже, приобретая ненасыщенные жирные кислоты хозяина. В этой работе подчеркивается адаптивность S.aureus , когда он сталкивается с нехваткой питательных веществ и актуальностью недостаточности липоевой кислоты во время инфекции. Наши результаты подтверждают мнение о том, что при разработке терапевтических средств необходимо учитывать универсальность мембранного биогенеза S. aureus .
Abstract
Во время инфекции патогенные микробы адаптируются к питательной среде хозяина посредством метаболического перепрограммирования и поглощения питательных веществ. Для бактериального патогена Staphylococcus aureus вирулентность в различных очагах инфекции определяется способностью поглощать мириады питательных веществ хозяина, включая липоевую кислоту, кофактор, необходимый для функционирования нескольких важнейших метаболических ферментных комплексов. S. aureus переносит липоевую кислоту между этими ферментными комплексами через амидотрансферазу LipL. Здесь мы обнаруживаем, что приобретение липоевой кислоты или ее присоединение через LipL к ферментным комплексам, необходимым для образования ацетил-КоА и жирных кислот с разветвленной цепью, является важным для бактериемии, но необязательным для кожной инфекции у мышей. Мутант lipL является ауксотрофным по отношению к предшественникам карбоновых кислот, необходимых для синтеза жирных кислот с разветвленной цепью, важного компонента липидов стафилококковых мембран и агента текучести мембран.Однако кожа лишена жирных кислот с разветвленной цепью. Мы показали, что S. aureus вместо этого удаляет полученные из организма ненасыщенные жирные кислоты из кожи с помощью секретируемой липазы, Geh, и белка, связывающего ненасыщенные жирные кислоты, FakB2. Более того, мышиные инфекции продемонстрировали значимость ассимиляции липидов хозяина для выживаемости стафилококков. В целом, эти исследования дают представление об адаптивных особенностях, которые обходят синтез липидов de novo, чтобы способствовать сохранению S. aureus во время поверхностной инфекции.Полученные данные также подтверждают неотъемлемые проблемы, связанные с нацеливанием бактериального липогенеза в качестве антибактериальной стратегии, и поддерживают одновременное ингибирование утилизации жирных кислот хозяина во время лечения.
Сноски
Вклад авторов: W.P.T., X.C. и F.A. разработали исследования; W.P.T., X.C., I.L. и F.A. проводили исследования; W.P.T. и F.A. проанализировали данные; и W.P.T. и F.A. написали статью.
Авторы заявляют об отсутствии конкурирующей заинтересованности.
Эта статья представляет собой прямое представление PNAS.
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.pnas.org/lookup/suppl/doi:10.1073/pnas.2022720118/-/DCSupplemental.
Доступность данных
Все данные исследования включены в статью и / или SI Приложение .
Стафилококковые инфекции: основы практики, история вопроса, патофизиология
Schramm GE, Johnson JA, Doherty JA, et al.Инфекция стерильного очага, вызванная метициллин-резистентным золотистым стафилококком: важность надлежащего начального лечения антимикробными препаратами. Crit Care Med . 2006 августа 34 (8): 2069-74. [Медлайн].
Мермель Л.А., Фарр Б.М., Шерерц Р.Дж. и др. Рекомендации по ведению инфекций, связанных с внутрисосудистым катетером. Clin Infect Dis . 2001 May 1. 32 (9): 1249-72. [Медлайн].
Simor AE, Phillips E, McGeer A, et al. Рандомизированное контролируемое испытание хлоргексидина глюконата для промывания, интраназального мупироцина, рифампицина и доксициклина в сравнении с отсутствием лечения для ликвидации колонизации метициллин-резистентного Staphylococcus aureus. Clin Infect Dis . 2007 15 января. 44 (2): 178-85. [Медлайн].
Комото А., Майгума Т., Тешима Д., Сугияма Т., Харуки Ю. Эффекты вмешательства фармацевта при лечении ванкомицином пациентов с бактериемией из-за метициллин-резистентного золотистого стафилококка. PLoS One . 2018.13 (9): e0203453. [Медлайн]. [Полный текст].
Yamasaki O, Kaneko J, Morizane S, et al. Связь между штаммами Staphylococcus aureus, несущими пантон-валентинские гены лейкоцидинов, и развитием глубоко укоренившейся фолликулярной инфекции. Clin Infect Dis . 2005 г. 1. 40 (3): 381-5. [Медлайн].
Labandeira-Rey M, Couzon F, Boisset S, Brown EL, Bes M, Benito Y. Staphylococcus aureus Panton-Valentine лейкоцидин вызывает некротическую пневмонию. Наука . 2007, 23 февраля. 315 (5815): 1130-3. [Медлайн].
Cremieux AC, Dumitrescu O, Lina G, Vallee C, et al. Пантон-валентин лейкоцидин усиливает тяжесть внебольничного метициллин-резистентного остеомиелита кроликов Staphylococcus aureus. PLoS One . 2009 25 сентября. 4 (9): e7204. [Медлайн]. [Полный текст].
Nienaber JJ, Sharma Kuinkel BK, Clarke-Pearson M, Lamlertthon S, Park L, Rude TH, et al. Чувствительные к метициллину изоляты эндокардита золотистого стафилококка связаны с генотипом клонального комплекса 30 и отличным репертуаром энтеротоксинов и адгезинов. J Заразить Dis . 2011 Сентябрь 204 (5): 704-713. [Медлайн]. [Полный текст].
де Йонг NWM, ван Кессель КПМ, ван Страйп ЯГ.Иммунное уклонение от золотистого стафилококка. Микробиол Спектр . 2019 7 марта (2): [Medline].
Kleiner E, Monk AB, Archer GL, Forbes BA. Клиническое значение Staphylococcus lugdunensis, выделенного из обычных культур. Clin Infect Dis . 2010 г. 1. 51 (7): 801-3. [Медлайн].
von Eiff C, Becker K, Machka K и др. Носовое носительство как источник бактериемии Staphylococcus aureus. Исследовательская группа. N Engl J Med .2001, 4 января. 344 (1): 11-6. [Медлайн].
Мертц Д., Фрей Р., Периат Н., Зиммерли М., Баттегай М., Флюкигер Ю. Эксклюзивное горло носительства Staphylococcus aureus: группы риска. Arch Intern Med . 2009 26 января. 169 (2): 172-8. [Медлайн].
Монтойя А., Шилдхаус Р., Гойал А., Манн Д. Д., Снайдер А., Чопра В. и др. Как часто руки медицинского персонала колонизируются организмами с множественной лекарственной устойчивостью? Систематический обзор и метаанализ. Am J Infect Control . 2019 июн. 47 (6): 693-703. [Медлайн].
Гафтер-Гвили А., Мансур Н., Бивас А. и др. Тромбоцитопения при бактериемии Staphylococcus aureus: факторы риска и прогностическое значение. Mayo Clin Proc . 2011 Май. 86 (5): 389-96. [Медлайн]. [Полный текст].
Yilmaz M, Elaldi N, Balkan İİ, Arslan F, Batırel AA, Bakıcı MZ, et al. Предикторы смертности от бактериемии Staphylococcus aureus: проспективное многоцентровое исследование. Антимикроб Энн Клин Микробиол . 2016 9 февраля. 15 (1): 7. [Медлайн].
McClelland RS, Fowler VG Jr, Sanders LL, et al. Бактериемия Staphylococcus aureus среди пожилых и молодых взрослых пациентов: сравнение клинических особенностей и смертности. Arch Intern Med . 1999, 14 июня. 159 (11): 1244-7. [Медлайн].
Kravitz GR, Dries DJ, Peterson ML, et al. Молниеносная пурпура, вызванная Staphylococcus aureus. Clin Infect Dis .2005 г. 1. 40 (7): 941-7. [Медлайн].
Bor DH, Woolhandler S, Nardin R, Brusch J, Himmelstein DU. Инфекционный эндокардит в США, 1998-2009 гг .: общенациональное исследование. PLoS One . 2013. 8 (3): e60033. [Медлайн].
Tande AJ, Palraj BR, Osmon DR, Berbari EF, Baddour LM, Lohse CM и др. Клиническая картина, факторы риска и исходы гематогенной инфекции протезирования суставов у пациентов с бактериемией Staphylococcus aureus. Am J Med . 2016 Февраль 129 (2): 221.e11-20. [Медлайн].
Robicsek A, Beaumont JL, Paule SM, et al. Универсальный эпиднадзор за метициллинрезистентным золотистым стафилококком в 3 дочерних больницах. Энн Интерн Мед. . 2008 г. 18 марта. 148 (6): 409-18. [Медлайн].
Bischoff WE, Wallis ML, Tucker BK и др. «Gesundheit!» чихание, простудные заболевания, аллергия и дисперсия золотистого стафилококка. J Заразить Dis .2006 15 октября. 194 (8): 1119-26. [Медлайн].
Diep BA, Chambers HF, Graber CJ, et al. Появление клона USA300 Staphylococcus aureus clone USA300 с множественной лекарственной устойчивостью, ассоциированным с населением, устойчивым к метициллину Staphylococcus aureus у мужчин, практикующих секс с мужчинами. Энн Интерн Мед. . 2008, 19 февраля. 148 (4): 249-57. [Медлайн].
Sing A, Tuschak C, Hörmansdorfer S. Метициллин-устойчивый золотистый стафилококк в семье и его домашняя кошка. N Engl J Med .2008 13 марта. 358 (11): 1200-1. [Медлайн].
Deck MK, Anderson ES, Buckner RJ, Colasante G, Coull JM, Crystal B и др. Многоцентровая оценка метода Staphylococcus QuickFISH для одновременной идентификации Staphylococcus aureus и коагулазонегативных стафилококков непосредственно из бутылочек для посева крови менее чем за тридцать минут. Дж. Клин Микробиол . 2012 г. 4 апреля [Medline].
Sarikonda KV, Micek ST, Doherty JA, et al.Колонизация носа, вызванного метициллин-резистентным золотистым стафилококком, является плохим предиктором инфекций, вызванных метициллин-резистентным золотистым стафилококком в отделениях интенсивной терапии, требующих лечения антибиотиками. Crit Care Med . 2010 окт. 38 (10): 1991-5. [Медлайн].
Голландия Т.Л., Арнольд С., Фаулер В.Г. Младший. Клиническое лечение бактериемии Staphylococcus aureus: обзор. JAMA . 2014 Октябрь 1. 312 (13): 1330-41. [Медлайн].
Kaasch AJ, Fowler VG Jr, Rieg S, Peyerl-Hoffmann G, Birkholz H, Hellmich M, et al.Использование простого набора критериев для ведения эхокардиографии при нозокомиальной бактериемии Staphylococcus aureus. Clin Infect Dis . 2011 г. 1. 53 (1): 1-9. [Медлайн].
Tubiana S, Duval X, Alla F, Selton-Suty C, Tattevin P, Delahaye F, et al. Шкала VIRSTA, прогнозирующая оценка для оценки риска инфекционного эндокардита и определения приоритета эхокардиографии у пациентов с бактериемией Staphylococcus aureus. J Заразить . 2016 22 февраля. [Medline].
Dumitrescu O, Boisset S, Badiou C, Bes M, Benito Y, Reverdy ME, et al. Влияние антибиотиков на золотистый стафилококк, продуцирующий лейкоцидин Пантона-Валентайна. Противомикробные агенты Chemother . 2007 апр. 51 (4): 1515-9. [Медлайн].
Лю С., Байер А., Косгроув С.Е., Даум Р.С., Фридкин С.К., Горвиц Р.Дж. и др. Руководство по клинической практике Американского общества инфекционистов по лечению метициллин-резистентных инфекций Staphylococcus aureus у взрослых и детей. Clin Infect Dis . 2011 Февраль 52 (3): e18-55. [Медлайн].
McNeil JC, Fritz SA. Стратегии профилактики рецидивов инфекций кожи и мягких тканей, связанных с сообществами Staphylococcus aureus. Curr Infect Dis Rep . 2019 11 марта. 21 (4): 12. [Медлайн].
Bai AD, Showler A, Burry L, Steinberg M, Ricciuto DR, Fernandes T и др. Влияние консультации по инфекционным заболеваниям на качество лечения, смертность и продолжительность пребывания при бактериемии Staphylococcus aureus: результаты большого многоцентрового когортного исследования. Clin Infect Dis . 2015 15 мая. 60 (10): 1451-61. [Медлайн].
Shi C, Xiao Y, Zhang Q, Li Q, Wang F, Wu J и др. Эффективность и безопасность цефазолина по сравнению с антистафилококковыми пенициллинами для лечения метициллин-чувствительной бактериемии Staphylococcus aureus: систематический обзор и метаанализ. BMC Infect Dis . 2018 11 октября. 18 (1): 508. [Медлайн].
Weis S, Kesselmeier M, Davis JS, Morris AM, Lee S, Scherag A и др.Цефазолин в сравнении с антистафилококковыми пенициллинами для лечения пациентов с бактериемией Staphylococcus aureus. Clin Microbiol Infect . 2019 27 марта. [Medline]. [Полный текст].
Аль-Хасан М.Н., Рак Х. Переход от внутривенной к пероральной антимикробной терапии у пациентов с неосложненными и осложненными инфекциями кровотока. Clin Microbiol Infect . 2019 22 мая. [Medline].
Iversen K, Ihlemann N, Gill SU, Madsen T., Elming H, Jensen KT, et al.Сравнение частичного перорального и внутривенного лечения эндокардита антибиотиками. N Engl J Med . 2019 31 января. 380 (5): 415-424. [Медлайн].
Проктор Р.А. Роль антагонистов фолиевой кислоты в лечении метициллин-резистентной инфекции Staphylococcus aureus. Clin Infect Dis . 15 февраля 2008 г. 46 (4): 584-93. [Медлайн].
Даум Р.С., Миллер Л.Г., Иммерглюк Л., Фриц С., Крич С.Б., Янг Д. и др. Плацебо-контролируемое исследование антибиотиков для небольших кожных абсцессов. N Engl J Med . 29 июня 2017 г. 376 (26): 2545-2555. [Медлайн].
Пиллаи С.К., Веннерстен С., Венкатараман Л., Элиопулос Г.М., Меллеринг Р.К., Карчмер А.В. Развитие пониженной чувствительности к ванкомицину у метициллин-чувствительного Staphylococcus aureus. Clin Infect Dis . 2009 15 октября. 49 (8): 1169-74. [Медлайн].
[Рекомендации] Рыбак М.Дж., Ломаэстро Б.М., Ротскахфер Дж.С., Моллеринг Р.С., Крейг В.А., Биллетер М. и др. Терапевтические рекомендации ванкомицина: краткое изложение согласованных рекомендаций Американского общества инфекционистов, Американского общества фармацевтов систем здравоохранения и Общества фармацевтов инфекционных заболеваний. Clin Infect Dis . 2009 г. 1. 49 (3): 325-7. [Медлайн].
Любин А.С., Снайдман Д.Р., Рутхазер Р., Биде П., Голан Ю. Прогнозирование высокой минимальной ингибирующей концентрации ванкомицина при инфекциях кровотока, вызванных устойчивым к метициллину Staphylococcus aureus. Clin Infect Dis . 2011 г. 15 апреля. 52 (8): 997-1002. [Медлайн]. [Полный текст].
Джайн Р., Кралович С.М., Эванс М.Э. и др. Инициатива по делам ветеранов по профилактике метициллин-резистентных инфекций Staphylococcus aureus. N Engl J Med . 2011 г., 14 апреля. 364 (15): 1419-30. [Медлайн].
Steed LL, Costello J, Lohia S, Jones T., Spannhake EW, Nguyen S. Уменьшение носительства Staphylococcus aureus у медицинских работников путем лечения неантибиотическим назальным антисептиком на спиртовой основе. Am J Infect Control . 2014 42 августа (8): 841-6. [Медлайн]. [Полный текст].
Арчер ГЛ. Золотистый стафилококк: хорошо вооруженный возбудитель. Clin Infect Dis .1998 Май. 26 (5): 1179-81. [Медлайн].
Баггетт Х.С., Хеннесси Т.В., Рудольф К. и др. Метициллин-резистентный золотистый стафилококк, возникший в сообществе, связанный с применением антибиотиков и цитотоксином Пантон-Валентайн лейкоцидином во время вспышки фурункулеза в сельской местности на Аляске. J Заразить Dis . 2004 г., 1. 189 (9): 1565-73. [Медлайн].
Begier EM, Frenette K, Barrett NL, et al. Вспышка метициллин-устойчивого золотистого стафилококка с высокой заболеваемостью среди игроков футбольной команды колледжа, чему способствовало косметическое бритье тела и ожоги дерна. Clin Infect Dis . 2004 15 ноября. 39 (10): 1446-53. [Медлайн].
Boggs W. Диклоксациллин от бактериемии MSSA связан с более низкой смертностью, чем цефуроксим. Информация о здоровье Reuters. 14 октября 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/81253. Доступ: 22 октября 2013 г.
Bouza E. Новые методы лечения инфекций, вызванных устойчивым к метициллину Staphylococcus aureus. Clin Microbiol Infect . 2009 г.15: 44-52.
Кэмпбелл К.М., Вон А.Ф., Рассел К.Л. и др. Факторы риска для ассоциированных с сообществом метициллин-устойчивых инфекций Staphylococcus aureus во время вспышки болезни среди военнослужащих в Сан-Диего, Калифорния, в 2002 году. J Clin Microbiol . 2004 Сентябрь 42 (9): 4050-3. [Медлайн].
Chang FY, MacDonald BB, Peacock JE, et al. Проспективное многоцентровое исследование бактериемии Staphylococcus aureus: частота эндокардита, факторы риска смертности и клиническое влияние резистентности к метициллину. Медицина (Балтимор) . 2003 Сентябрь 82 (5): 322-32. [Медлайн].
Charlebois ED, Perdreau-Remington F, Kreiswirth B, et al. Происхождение общественных штаммов метициллин-устойчивого золотистого стафилококка. Clin Infect Dis . 2004 г. 1. 39 (1): 47-54. [Медлайн].
Cosgrove SE, Sakoulas G, Perencevich EN, et al. Сравнение смертности, связанной с метициллин-устойчивой и метициллин-чувствительной бактериемией Staphylococcus aureus: метаанализ. Clin Infect Dis . 2003 г., 1 января. 36 (1): 53-9. [Медлайн].
Cunha BA. Антимикробная терапия Streptococcus pneumoniae с множественной лекарственной устойчивостью, энтерококков, устойчивых к ванкомицину, и устойчивых к метициллину Staphylococcus aureus. Med Clin North Am . 2006 ноябрь 90 (6): 1165-82. [Медлайн].
Cunha BA. Метициллин-резистентный золотистый стафилококк: клинические проявления и противомикробная терапия. Clin Microbiol Infect .2005 июл.11 Дополнение 4: 33-42. [Медлайн].
Cunha BA. Пероральная антибактериальная терапия серьезных системных инфекций. Med Clin North Am . 2006 ноябрь 90 (6): 1197-222. [Медлайн].
Cunha BA. Staphylococcus aureus Нозокомиальная пневмония: Клинические аспекты. Инфекция Dis Pract . 2007. 31: 557-60.
Cunha BA, Eisenstein LE, Hamid NS. Вызванный кардиостимулятором острый бактериальный эндокардит митрального клапана Staphylococcus aureus, осложненный стойкой бактериемией коронарного стента: лечение без токсичности пролонгированным / высокими дозами даптомицина. Сердце легкое . 2006 май-июнь. 35 (3): 207-11. [Медлайн].
Cunha BA, Hamid N, Kessler H, Parchuri S. Лечение даптомицином после неэффективности лечения цефазолином метициллин-чувствительного Staphylococcus aureus (MSSA) острого бактериального эндокардита трикуспидального клапана из периферически введенного центрального катетера (PICC). Сердце легкое . 2005 ноябрь-декабрь. 34 (6): 442-7. [Медлайн].
Cunha BA, Mikail N, Eisenstein L. Стойкая метициллин-резистентная бактериемия Staphylococcus aureus (MRSA) из-за «толерантного» штамма к линезолиду. Сердце легкое . 2008 сен-окт. 37 (5): 398-400. [Медлайн].
Cunha BA, Pherez FM. Устойчивость к даптомицину и неэффективность лечения после ванкомицина метициллин-резистентного золотистого стафилококка (MRSA) острого бактериального эндокардита митрального клапана (ABE) митрального клапана. евро J Clin Microbiol Infect Dis . 2009 июл.28 (7): 831-3. [Медлайн].
Czachor J, Herchline T. Синдром бактериального неменструального стафилококкового токсического шока, связанный с энтеротоксинами A и C. Clin Infect Dis . 2001 г., 1 февраля. 32 (3): E53-6. [Медлайн].
Даум Р.С., Ито Т., Хирамацу К. и др. Новая кассета устойчивости к метициллину в внебольничных изолятах устойчивых к метициллину Staphylococcus aureus различного генетического происхождения. J Заразить Dis . 2002 г. 1. 186 (9): 1344-7. [Медлайн].
Дерезински С. Метициллин-устойчивый золотистый стафилококк: эволюционная, эпидемиологическая и терапевтическая одиссея. Clin Infect Dis . 2005 15 февраля. 40 (4): 562-73. [Медлайн].
Фаулер В.Г. мл., Сандерс Л.Л., Конг Л.К. и др. Инфекционный эндокардит, вызванный Staphylococcus aureus: 59 проспективно выявленных случаев с последующим наблюдением. Clin Infect Dis . 1999, 28 января (1): 106-14. [Медлайн].
Фаулер В.Г. младший, Сандерс Л.Л., Секстон Д.Д. и др. Исход бактериемии Staphylococcus aureus с соблюдением рекомендаций инфекционистов: опыт 244 больных. Clin Infect Dis . 1998, 27 сентября (3): 478-86. [Медлайн].
Francis JS, Doherty MC, Lopatin U, et al. Тяжелая внебольничная пневмония у здоровых взрослых, вызванная метициллин-резистентным золотистым стафилококком, несущим гены лейкоцидина Пантона-Валентайна. Clin Infect Dis . 2005 г. 1. 40 (1): 100-7. [Медлайн].
Фридкин С.К., Хагеман Дж.С., Моррисон М. и др. Метициллин-устойчивый золотистый стафилококк в трех сообществах. N Engl J Med . 2005, 7 апреля. 352 (14): 1436-44. [Медлайн].
Grundmann H, Aires-de-Sousa M, Boyce J, Tiemersma E. Возникновение и возрождение метициллин-устойчивого золотистого стафилококка как угроза общественному здоровью. Ланцет . 2006 сентябрь 2. 368 (9538): 874-85. [Медлайн].
Harbarth S, Liassine N, Dharan S и др. Факторы риска стойкого носительства метициллин-устойчивого золотистого стафилококка. Clin Infect Dis .2000 Декабрь 31 (6): 1380-5. [Медлайн].
Herchline TE, Ayers LW. Встречаемость Staphylococcus lugdunensis в последовательных клинических культурах и связь изоляции с инфекцией. Дж. Клин Микробиол . 1991 29 марта (3): 419-21. [Медлайн].
Herchline TE, Barnishan J, Ayers LW и др. Продукция пенициллиназы и чувствительность Staphylococcus lugdunensis in vitro. Противомикробные агенты Chemother . 1990 декабрь 34 (12): 2434-5.[Медлайн].
Jensen AG, Wachmann CH, Espersen F, et al. Лечение и исход бактериемии Staphylococcus aureus: проспективное исследование 278 случаев. Arch Intern Med . 2002 14 января. 162 (1): 25-32. [Медлайн].
Казакова С.В., Хагеман Дж. С., Матава М. и др. Клон метициллин-устойчивого золотистого стафилококка среди профессиональных футболистов. N Engl J Med . 2005 г. 3 февраля. 352 (5): 468-75. [Медлайн].
Kloos WE, Bannerman TL.Обновленная информация о клиническом значении коагулазонегативных стафилококков. Clin Microbiol Ред. . 1994 7 января (1): 117-40. [Медлайн].
Mekontso-Dessap A, Kirsch M, Brun-Buisson C, et al. Постстернотомный медиастинит, вызванный Staphylococcus aureus: сравнение метициллин-резистентных и метициллин-чувствительных случаев. Clin Infect Dis . 2001 15 марта. 32 (6): 877-83. [Медлайн].
Миллер Л.Г., Дип Б.А. Клиническая практика: колонизация, фомиты и вирулентность: переосмысление патогенеза внебольничной метициллин-резистентной инфекции Staphylococcus aureus. Clin Infect Dis . 2008 г. 1. 46 (5): 752-60. [Медлайн].
Mohan SS, McDermott BP, Cunha BA. Метициллин-резистентный эндокардит протезного аортального клапана Staphylococcus aureus с параклапанным абсцессом, леченный даптомицином. Сердце легкое . 2005 янв-фев. 34 (1): 69-71. [Медлайн].
Naimi TS, LeDell KH, Como-Sabetti K, et al. Сравнение метициллин-резистентной инфекции Staphylococcus aureus, связанной с населением и медицинским обслуживанием. JAMA . 2003 декабрь 10. 290 (22): 2976-84. [Медлайн].
Nouwen JL, Ott A, Kluytmans-Vandenbergh MF, et al. Прогнозирование носового носительства золотистого стафилококка: вывод и проверка «правила культивирования». Clin Infect Dis . 2004 15 сентября. 39 (6): 806-11. [Медлайн].
Polenakovik H, Herchline T, Bacheller C, et al. Эндокардит, вызванный Staphylococcus lugdunensis, после ангиографии. Mayo Clin Proc . 2000 июн.75 (6): 656-7. [Медлайн].
Rasmussen JB, Knudsen JD, Arpi M, Schønheyder HC, Benfield T., Ostergaard C. Относительная эффективность цефуроксима по сравнению с диклоксациллином в качестве окончательной антимикробной терапии при чувствительном к метициллину Staphylococcus aureus, скорректированном на когерентную прогностическую оценку ретроспективного исследования бактериемии Staphylococcus aureus. J Antimicrob Chemother . 2013 г. 3 октября [Medline].
Сайман Л., О’Киф М., Грэм П.Л., 3-й и др. Госпитальная передача внебольничного метициллин-устойчивого золотистого стафилококка среди послеродовых женщин. Clin Infect Dis . 2003 15 ноября. 37 (10): 1313-9. [Медлайн].
Смит Т.Л., Пирсон М.Л., Уилкокс К.Р. и др. Возникновение устойчивости к ванкомицину у золотистого стафилококка. Рабочая группа по гликопептиду-промежуточному стафилококку. N Engl J Med . 1999 18 февраля. 340 (7): 493-501. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Сообщение FDA по безопасности лекарственных средств: при назначении линезолида (Зивокс®) пациентам, принимающим определенные психиатрические препараты, возможны серьезные реакции со стороны ЦНС.Доступно на http://www.fda.gov/Drugs/DrugSafety/ucm265305.htm. Доступ: 27 июля 2011 г.
Vandenesch F, Naimi T, Enright MC и др. Внебольничный устойчивый к метициллину Staphylococcus aureus, несущий гены лейкоцидина Пантона-Валентина: появление во всем мире. Emerg Infect Dis . 2003 августа, 9 (8): 978-84. [Медлайн].
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

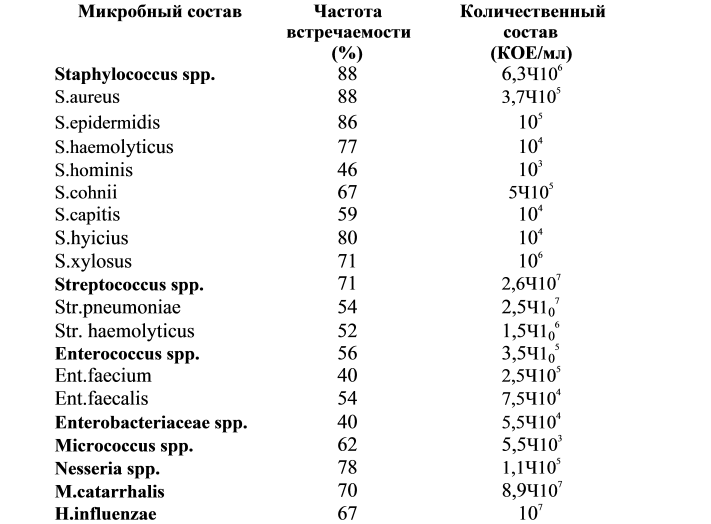
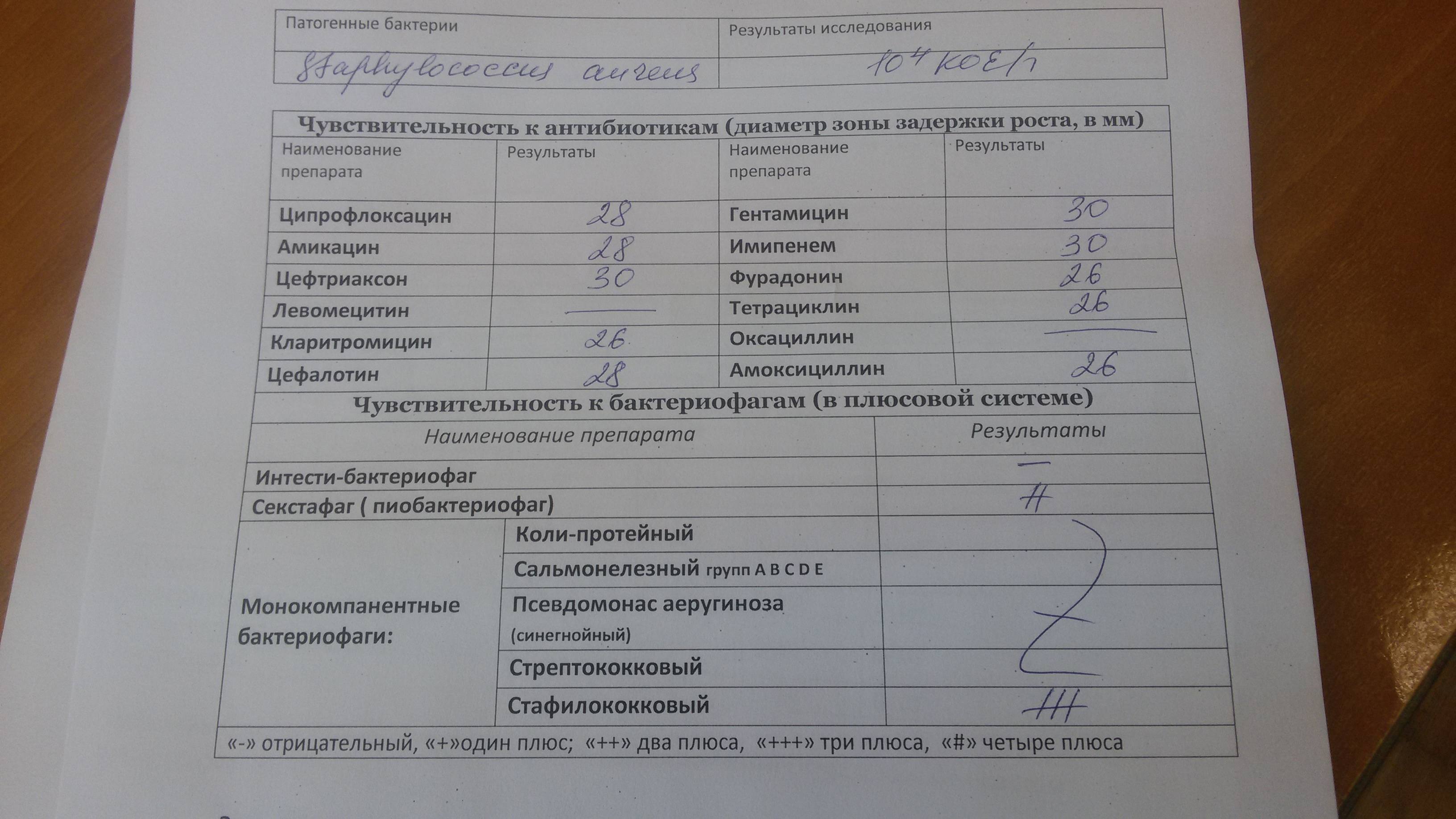 Требуется повторный забор мочи через 2-3 дня.
Требуется повторный забор мочи через 2-3 дня.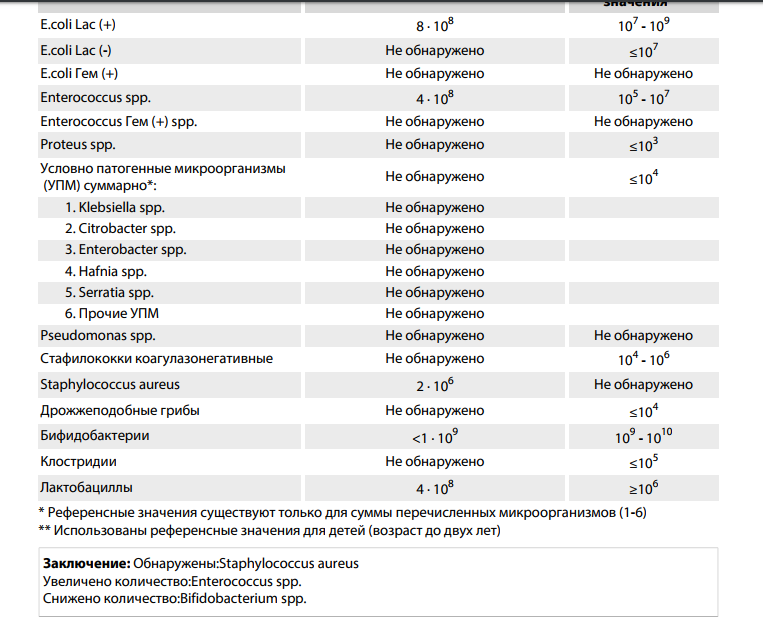
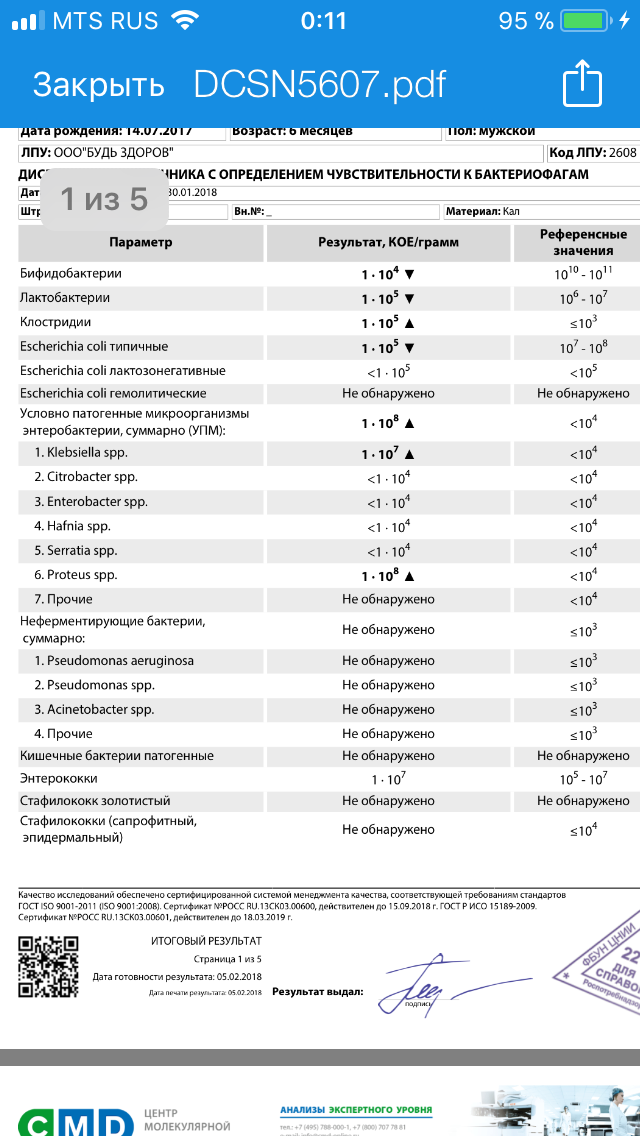 Brucellosis. Parasites. Ссылка
Brucellosis. Parasites. Ссылка

 Умеренно выраженные диарея и запоры, чувство распирания после приема пищи, мигрирующие, неопределенные боли в животе, симптомы гиповитаминоза. Отрыжка, изжога, кожные аллергические реакции
Умеренно выраженные диарея и запоры, чувство распирания после приема пищи, мигрирующие, неопределенные боли в животе, симптомы гиповитаминоза. Отрыжка, изжога, кожные аллергические реакции Патологические примеси в кале, нарушения общего статуса организма, генерализация процесса при крайнем ослаблении организма
Патологические примеси в кале, нарушения общего статуса организма, генерализация процесса при крайнем ослаблении организма