Стафилококк – симптомы, виды, причины возникновения и лечение заболевания
Возбудитель стафилококка — Staphylococcus aureus — это грамположительные неподвижные и не образующие спор анаэробные бактерии, которые имеют округлую форму (форму кокка) и растут гроздьями, поэтому фактически название микроорганизма означает “золотая гроздь винограда”.
О заболевании
При выращивании в чашке Петри с кровяным агаром колонии золотистого стафилококка имеют характерный золотисто-желтый цвет, отсюда и соответствующее название. Этот микроорганизм чрезвычайно распространен, им колонизировано около четверти населения планеты.
Обычно он распространяется в носовой полости, паховой области, подмышках и других частях кожи, но в большинстве случаев является нормальной частью кожной флоры человека и не вызывает никаких проблем.
Однако при увеличении количества бактерий на коже, они начинают проникать в глубокие слои кожи через микротрещины и могут привести к кожным инфекциям и абсцессам.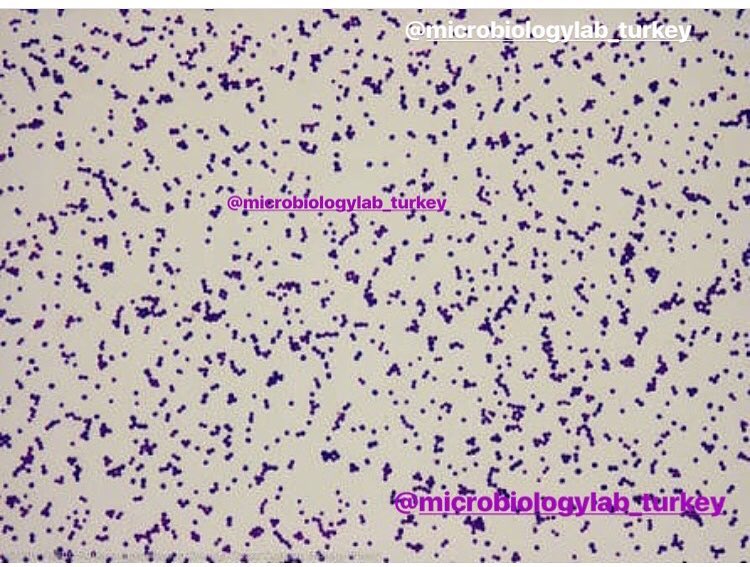
Патологические процессы могут затрагивать не только различные внутренние органы, такие как печень, почки, селезенка, головной мозг, но и мышцы, кости и суставы, что ведет к крайне плачевным последствиям, поэтому при подозрении на наличие инфекции, следует немедленно обратиться к доктору.
Виды стафилококковых инфекций
Выделяют несколько наиболее распространенных видов стафилококков:
● Гемолитический стафилококк.
Чаще всего эта инфекция поражает верхние дыхательные пути, вызывая гнойную ангину, фарингит, тонзиллит, бронхит и другие воспалительные заболевания. Данные бактерии очень устойчивы и трудно поддаются терапии.
● Золотистый.
Данный микроорганизм чрезвычайно устойчив почти ко всем видам антибиотиков пенициллинового ряда, антисептикам, высоким температурам, активным прямым солнечным лучам. Он вызывает различные поражения кожи, такие как экзема, абсцесс, фурункулы, поражения желудочно-кишечного тракта, верхних дыхательных путей, слизистых оболочек, в худшем случае приводит к токсическому шоку.
● Эпидермальный.
Этот микроорганизм обитает на поверхности кожи и слизистых любого здорового человека и не несет никакого вреда. Но, если эта бактерия попадает в кровь человека с ослабленным иммунитетом, что чаще всего происходит при хирургических операциях, использовании неправильно обработанных инструментов, катетеров, происходит заражение крови, что ведет к воспалению внутренней оболочки сердца.
● Сапрофитный.
Несмотря на то, что этот вид наименее опасный, при заражении он приводит к общей интоксикации организма, вследствие выделения опасных токсинов и ферментов в процессе своей жизнедеятельности. Данные микроорганизмы часто становятся возбудителями воспаления уретры и мочевого пузыря. Преимущественно это характерно для женщин в силу анатомических особенностей строения их мочеполовой системы. При отсутствии лечения цистит влечет за собой воспаление почек и проблемы с зачатием ребенка.
Симптомы и формы стафилококка у взрослых и детей
Симптомы, которые ощущает больной, сильно разнятся в зависимости от способа и места инфицирования и состояния иммунитета.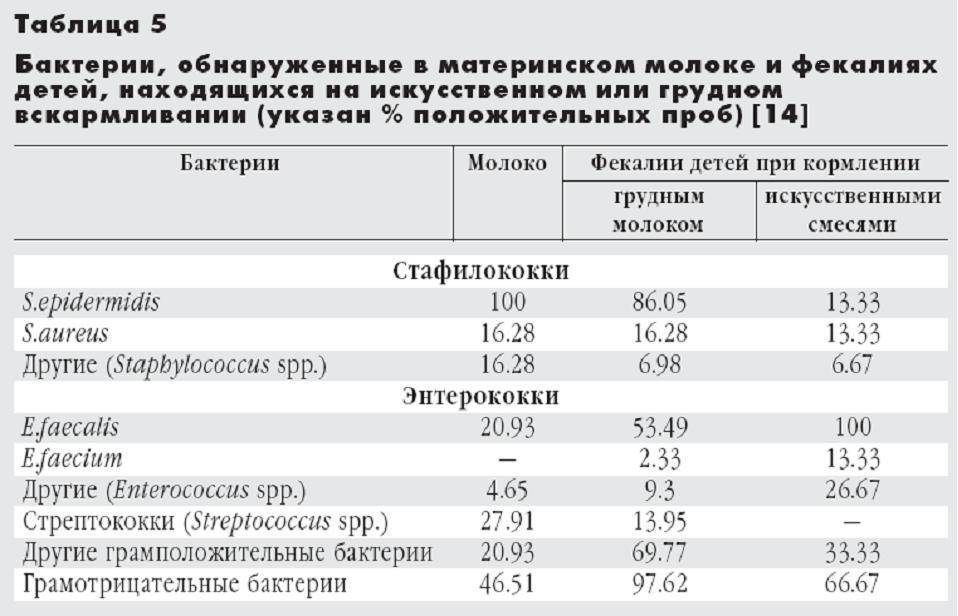 Но можно выделить ряд наиболее характерных признаков:
Но можно выделить ряд наиболее характерных признаков:
● повышенная температура;
● нагноение порезов, отечность, гнойные высыпания на коже и слизистых, зуд и покраснение глаз;
● отсутствие обоняния и носового дыхания;
● першение в горле, болезненность при глотании, сухой кашель;
● тошнота, рвота, общее ослабленное состояние;
● сильные головные боли, приступы эпилепсии, сильная одышка;
● болезненные ощущения в суставах.
Одной из самых распространенных форм стафилококков у взрослых людей является его бессимптомное носительство. Здоровый человек не ощущает каких-либо признаков заболевания до тех пор, пока не появится провоцирующий фактор, который даст толчок развитию болезни.
Для женщин наиболее опасен сапрофитная форма, способная привести к возникновению цистита. Это связано с тем, что уретра женщин располагается очень близко к влагалищу, из-за чего велика вероятность попадания патогенной микрофлоры, в том числе и палочки стафилококка, в уретральный канал, а затем и в мочевой пузырь, вызывая его воспаление.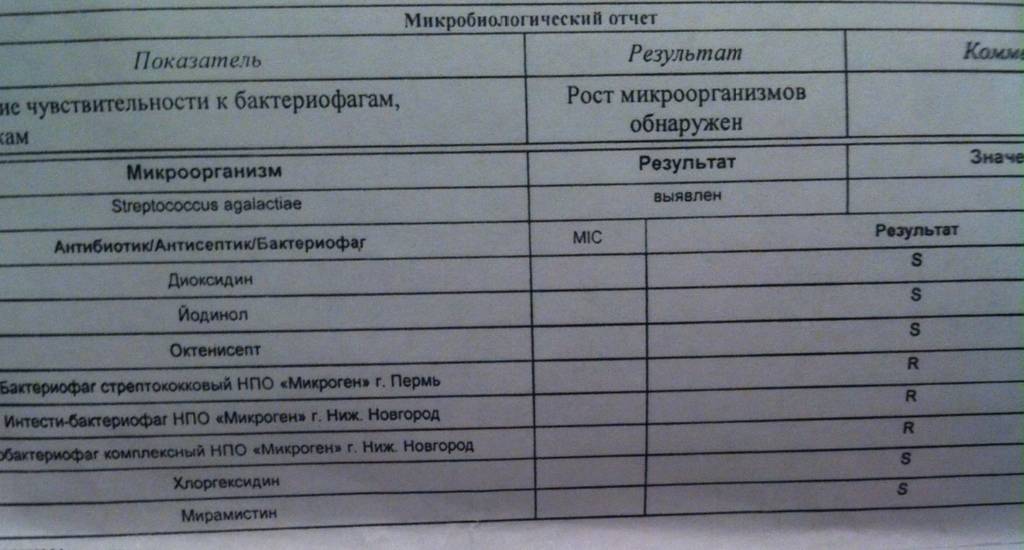
Так как маленькие дети не обладают окрепшей иммунной системой, риск развития инфекции у ребенка достаточно велик. Причем привести к серьезным осложнениям у детей могут даже те виды стафилококка, которые во взрослом возрасте практически не вызывают проблем. Особенную опасность представляет стафилококк у детей в возрасте до года, так как он с легкостью, в кратчайшие сроки способен распространиться по организму и привести к серьезным последствиям вплоть до летального исхода.
Причины возникновения
Наиболее часто бактерия попадает в организм человека через ранки и микротрещины на коже. Инфекция, проникнув через рану, начинает размножаться в крови, распространяясь по организму и поражая легкие, сердце, мозг, печень, почки, суставы.
При стафилококке заболевания могут быть самые различные такие, как пневмония, менингит, остеомиелит, эндокардит, сепсис и многие другие.
Заражение инфекцией стафилококк может произойти следующими способами:
● Контактно-бытовым путем при использовании личных предметов больного;
● Воздушно-капельным при близком общении с зараженным;
● Фекально-оральным на грязных фруктах, овощах и других продуктах питания, грязных посуде и руках;
● Вертикальным при прохождении ребенка через родовые пути зараженной матери при родах.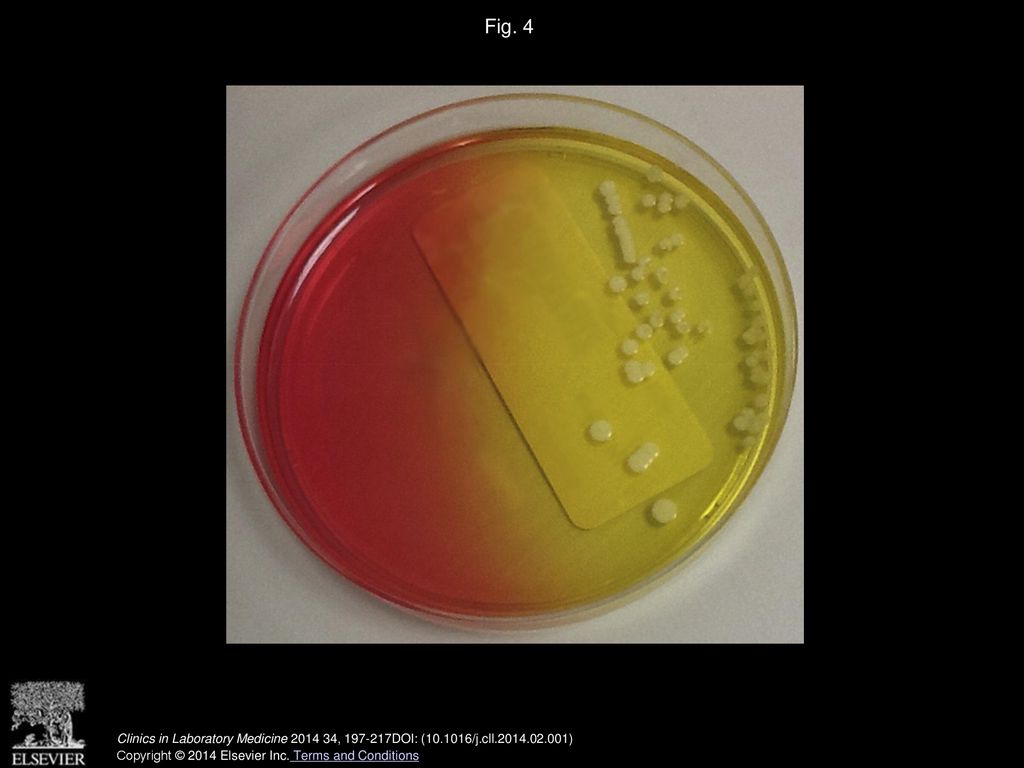
● Нередко инфицирование происходит во время хирургического вмешательства через медицинский инструментарий и во время проведения различных манипуляций.
Диагностика
Диагностировать наличие инфекции может только врач по результатам проведенного анализа на стафилококк.
Стоит помнить, что проведение анализа рекомендуется только, если присутствуют симптомы болезни. Наличие бактерии в биологическом материале может означать то, что человек является ее носителем, что само по себе является нормой.
Для анализа осуществляется забор материала из области, где предположительно развивается инфекция. Чтобы обнаружить патологический процесс проводятся несколько тестов, чтобы отследить динамику размножения бактерий. Если их число стремительно увеличивается, можно диагностировать наличие стафилококковой инфекции. Также дополнительный анализ позволит определить конкретный вид инфекции, чтобы доктор смог подобрать персональную схему лечения.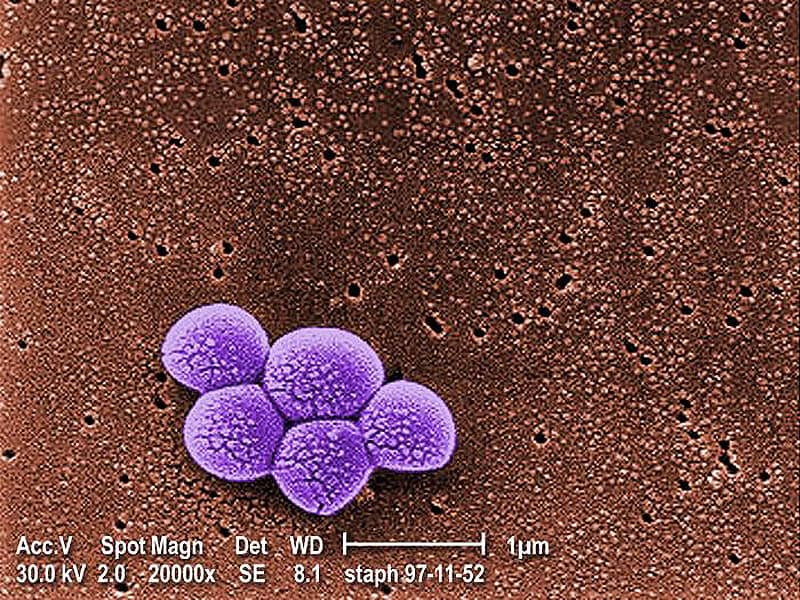
Лечение
Лечение стафилококка может проводиться хирургическим способом при наличии гнойного поражения в области заражения. Также может потребоваться удалить инфицированный имплант, катетер и пр.
В качестве консервативного лечения стафилококка применяют антибиотики, антибактериальные средства в сочетании с иммуномодулирующей терапией. Препараты подбираются с учетом устойчивости стафилококка к большому ряду медикаментов. Большую эффективность показало применение бриллиантового зеленого раствора для обработки зараженных ран.
Какие анализы необходимо сдать
В первую очередь, для определения наличия инфекции сдается анализ на стафилококк.
При заболеваниях дыхательных путей сдают мазок из носо- и-ротоглотки, при цистите — мочу, при расстройстве ЖКТ — кал, при кожных поражениях — соскоб с кожи, а, если есть подозрения на обширное заражение, сдают кровь.
Также перед тем как начать лечение с применением антибиотиков, требуется сдать анализ на резистентность к этим медикаментам.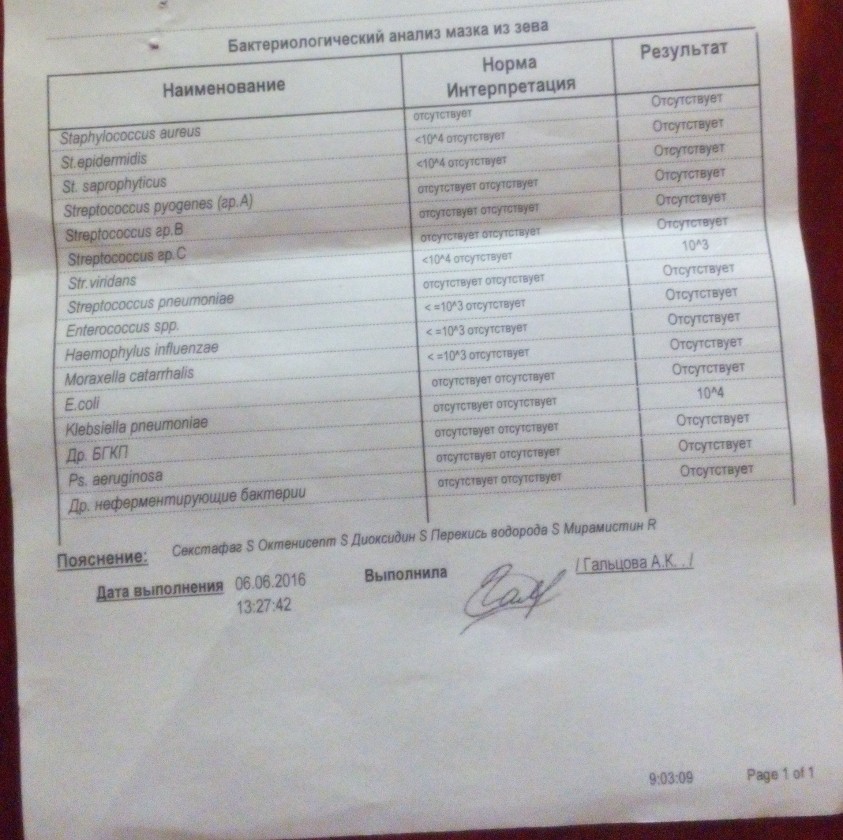
К какому врачу обращаться
Запущенными случаями заболевания занимается инфекционисту.
Но если у вас только появились подозрения и вы хотите получить точный диагноз, для начала вам следует обратиться к терапевту, с детьми – к педиатру. Доктор проведет диагностику и на основании полученных результатов выпишет вам направление к необходимому врачу.
Профилактика стафилококка
Главной мерой профилактики заражения стафилококком является постоянное соблюдение правил гигиены. После пребывания в общественных местах или контакта с предметами общественного пользования необходимо тщательно мыть руки с мылом. Также важно не контактировать с главным источником заражения стафилококком — больными людьми.
Как предотвратить заболевание
Чтобы предотвратить распространение стафилококка в организме и последующее развитие болезни, необходимо укреплять иммунитет. Для этого рекомендуется вести здоровый образ жизни, заниматься физической активностью, правильно питаться, соблюдая баланс витаминов и всех необходимых микроэлементов, потреблять достаточное количество воды./89/10.png)
Крепкий иммунитет сдержит активность патогенного микроорганизма в пределах безопасной нормы.
Будьте здоровы, дорогие пациенты!
Записаться на прием
Введите пожалуйста свои данные
Первая бактерия, которую получит новорожденный, зависит от способа родов
Дети, родившиеся в результате кесарева сечения, получают принципиально иную микрофлору, которая, возможно, обуславливает их меньшую устойчивость к ряду заболеваний. Более того, в отличие от рожденных обычным способом малышей, они могут «подцепить» микрофлору не мамы, а папы или врача-акушера.
Что обычный обыватель знает о родах, кроме общего механизма процесса? Наверное, то, что в отдельных более сложных случаях делают кесарево сечение, но оно уже стало вполне обычной процедурой, пожалуй, все. А вот московские клиники с радостью рассказывают беременным женщинам, что рожать, лежа на спине, как это было принято у наших мам и бабушек, – уже не модно. Рожать можно в воду (ну почти как дельфины), стоя, сидя на корточках или даже на четвереньках (вроде бы так рожали наши далекие предки). А чем на самом деле может помочь будущему малышу способ родов?
Рожать можно в воду (ну почти как дельфины), стоя, сидя на корточках или даже на четвереньках (вроде бы так рожали наши далекие предки). А чем на самом деле может помочь будущему малышу способ родов?
Исследование медиков из Университета Пуэрто-Рико показало, что
способ родов определяет микробиологическую среду, которая передается малышу в первые минуты жизни.
Их работу публикует Proceedings of the National Academy of Sciences.
Бактериальный фон ребенка во многом определяет его будущее здоровье, поэтому учет способа его формирования может дать положительный эффект при лечении растущих детей. Картина микрофлоры каждого человека индивидуальна: то, что будет аномалией и свидетельством болезни у одного, может оказаться в пределах нормы для другого. Поэтому данные об изначальном формировании микробиологического фона могут помочь в выборе лекарств для лечения и более точной диагностики.
Картина микрофлоры каждого человека индивидуальна: то, что будет аномалией и свидетельством болезни у одного, может оказаться в пределах нормы для другого. Поэтому данные об изначальном формировании микробиологического фона могут помочь в выборе лекарств для лечения и более точной диагностики.
Естественные роды более полезны для детей, чем кесарево сечение
Естественные роды гораздо полезнее для детей, чем кесарево сечение, утверждают сотрудники Университета Нового Южного Уэльса
Читать дальше
Какие же способы родов принципиально различаются по будущему бактериальному фону, а какие являются аналогичными? Согласно данным статьи, значение имеет лишь то, проходили ли роды вагинально или применялось кесарево сечение. Рожденные обычным способом дети наследуют в большей степени вагинальную микрофлору матери, а родившиеся в результате кесарева сечения – микрофлору кожных покровов.
Медики изучили 10 новорожденных, рожденных девятью женщинами в возрасте от 21 до 33 лет в одном из госпиталей Венесуэлы. В течение 24 часов после родов образцы для исследования на микрофлору отбирались из ртов детей, с их кожи и из желудочно-кишечного тракта.
Затем фрагменты микробной ДНК выделялись и подвергались так называемой процедуре амплификации. Ученые подчеркнули, что только использование современного оборудования для анализа ДНК позволило получить столь оперативные результаты в относительно небольших лабораториях в развивающихся странах (экспериментальная часть работы проводилась непосредственно в Венесуэле).
«В бактериальных сообществах детей, появившихся на свет с помощью кесарева сечения, доминируют бактерии ветви Staphylococcus. Большая часть из них безобидны, однако некоторые могут вызывать тяжелые инфекции. Возможно, более частые случаи некоторых заболеваний таких детей связаны именно с изначально иной микрофлорой», — считает Мария Домингес-Белло, первый автор работы.
Большая часть из них безобидны, однако некоторые могут вызывать тяжелые инфекции. Возможно, более частые случаи некоторых заболеваний таких детей связаны именно с изначально иной микрофлорой», — считает Мария Домингес-Белло, первый автор работы.
Действительно, медики уже отмечали, что
дети, родившиеся с помощью кесарева сечения, менее устойчивы к ряду патогенов, более склонны к аллергии и астме, чем родившиеся обычным способом малыши.
В частности, такие дети чаще «подхватывают» золотистый стафилококк, устойчивый к метициллину (methicillin-resistant Staphylococcus aureus, MRSA). Это сложно поддающееся лечению бактериальное заболевание, по данным сотрудников стационарных больниц, возникает все чаще в последние годы. Возможно, это результат «моды» на кесарево сечение.
Существует и другое объяснение наблюдаемого феномена. Возможно, причиной лучшего иммунитета у вагинально рожденных детей является изначальная «полезность» такой микрофлоры для новорожденного.
Природа устроила так, что получаемая малышом при родах микрофлора матери дает ему первый защитный барьер от патогенов.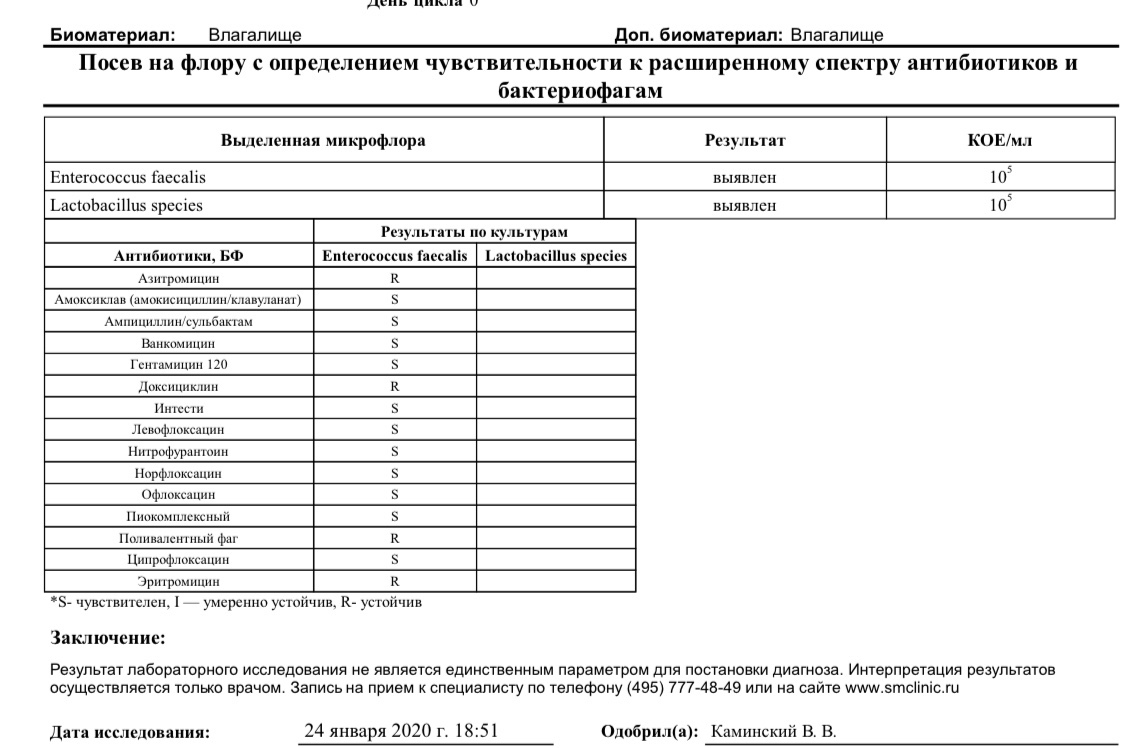 Дети, рожденные при кесаревом сечении, лишены его.
Дети, рожденные при кесаревом сечении, лишены его.
Другой важный результат: бактерии распределены по телу новорожденных малышей равномерно, в отличие от взрослых людей. В прошлом году та же группа Роберта Найта опубликовала работу, посвященную «картографированию» микрофлоры человека (о ней писала «Газета.Ru»). То, что распределение бактерий по телу меняется в течение жизни и «взрослая» микрофлора более дифференцирована по сравнению с младенческой, нуждается в дополнительной исследовании, считает Найт.
«Перспективы изучения того, как различаются индивидуальные микробные сообщества людей, действительно очень широки.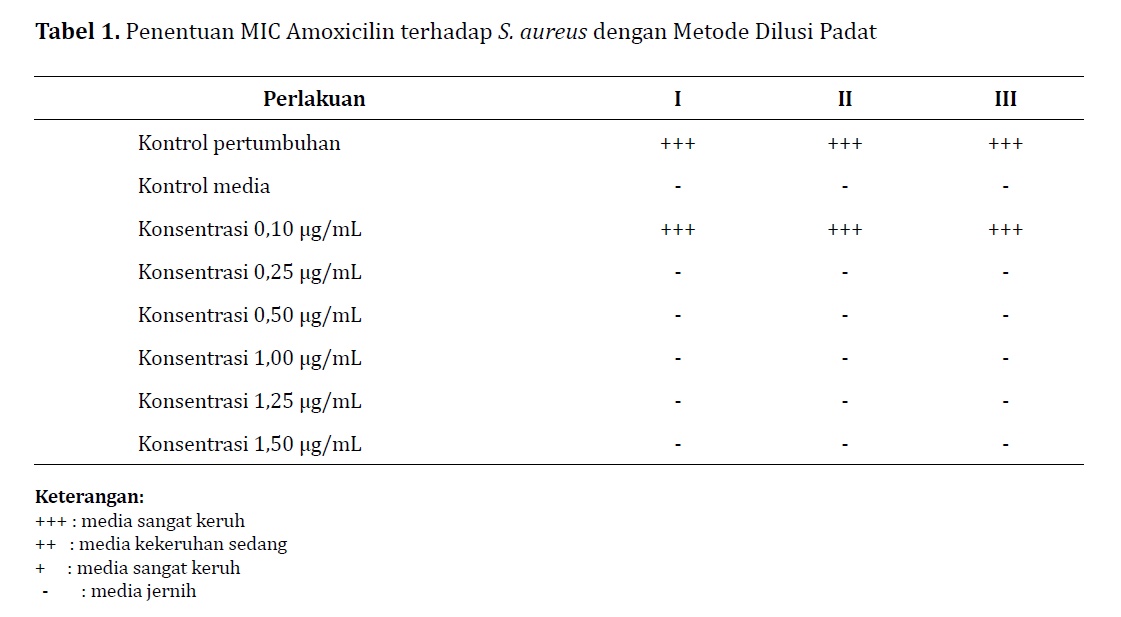 Мы можем использовать такие данные для биомедицинской диагностики. Картографирование микрофлоры взрослых стало первой точкой, а новое исследование микрофлоры младенцев – второй, теперь нам есть что сравнивать», — прокомментировал Найт.
Мы можем использовать такие данные для биомедицинской диагностики. Картографирование микрофлоры взрослых стало первой точкой, а новое исследование микрофлоры младенцев – второй, теперь нам есть что сравнивать», — прокомментировал Найт.
«Кожа новорожденного ребенка, фигурально выражаясь, является свежевспаханной почвой, ожидающей семян – в данном случае бактериальных сообществ. И то, какие семена первыми упадут в эту почву, во многом определяет ее будущее», — отметил Ноа Фирер, один из авторов работы.
Другой интересный результат – возможность наследования микрофлоры «постороннего» человека при кесаревом сечении. Возможно, первая передача бактерий ребенку в таком случае происходит от кожи человека, взявшего его на руки. А это уже необязательно мама, это может быть как врач-акушер, так и отец или бабушка ребенка.
Золотистый стафилококк в кале у ребенка | onwomen.ru
Золотистым стафилококком называют один из видов грамположительных бактерий шаровидной формы. Для детского организма он очень опасен, поскольку вызывает значительное количество заболеваний.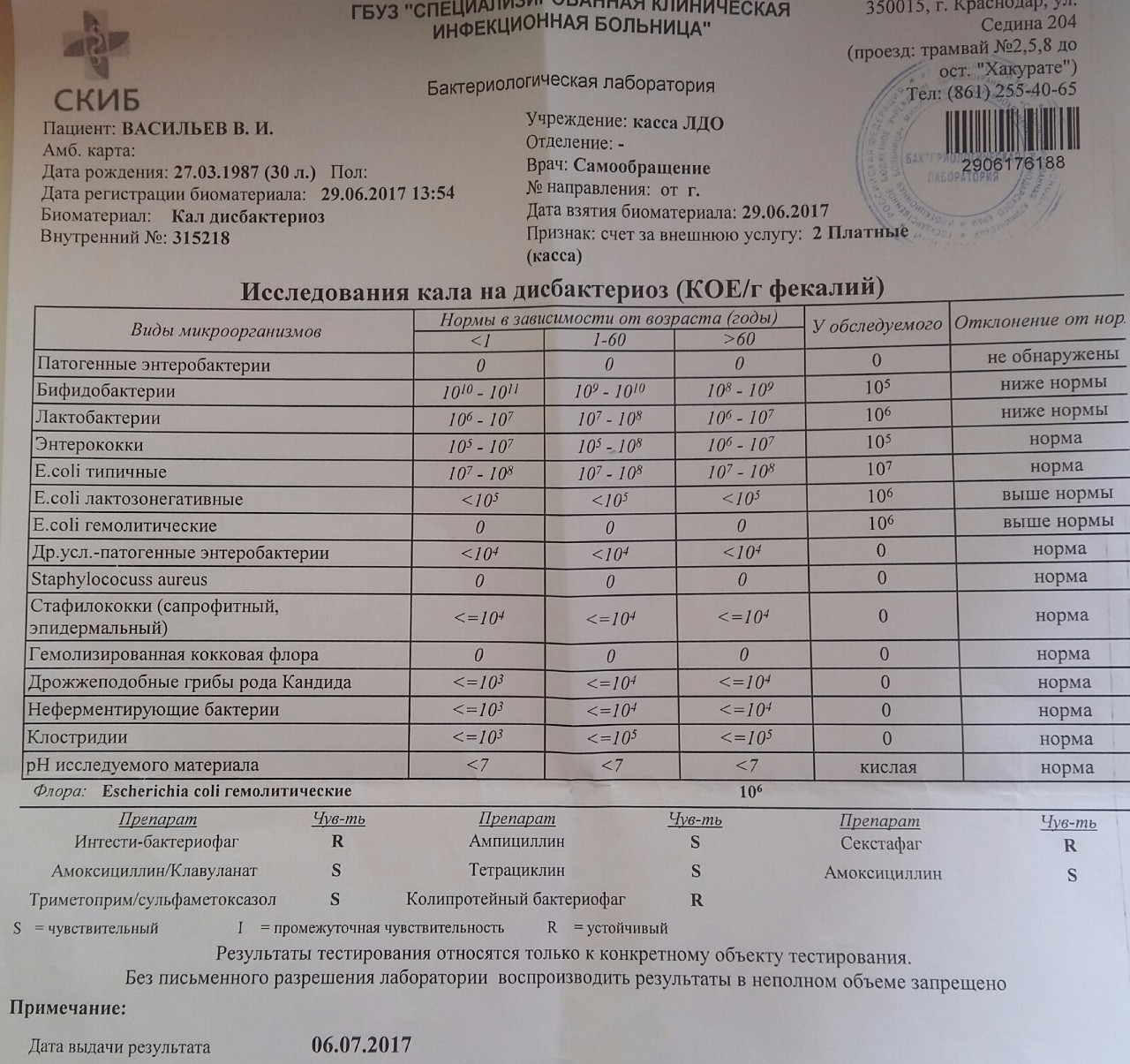 В их перечне присутствуют и легкие кожные инфекции, и смертельно опасные недуги.
В их перечне присутствуют и легкие кожные инфекции, и смертельно опасные недуги.
Бактерия может привести к развитию гнойно-воспалительных процессов уже в первый день жизни малыша. Дети наиболее подвергаются заражению, ведь иммунитет у них еще слабенький.
Трудности лечения состоят в том, что симптоматику инфицирования золотистым стафилококком легко перепутать с другими патологиями. Можно сразу не распознать, что виновником болезненного состояния малыша выступает именно эта бактерия.
Золотистый стафилококк: норма
Стафилококк локализуется в разных местах тела. Его золотистый вид любит поселяться в кишечнике, слизистой носа и горла.
Чтобы выявить присутствие в организме малыша золотистого стафилококка, необходимо исследовать кал на дисбактериоз. Такой тест проводится уже в родильном доме, когда появляется малейшее подозрение о проникновении бактерии в кишечник крохи.
Исследовать кал нужно минимум два раза с однодневным или двухдневным перерывом. Материал для теста (кал) желательно оперативно доставить в лабораторию (не позже, чем через три часа после испражнения). Это позволит получить корректные результаты.
Материал для теста (кал) желательно оперативно доставить в лабораторию (не позже, чем через три часа после испражнения). Это позволит получить корректные результаты.
Установленная норма золотистого стафилококка составляет 104. Это максимальное содержание бактерий в кале ребенка, которому исполнился год. Для грудных детей такой показатель считается высоким.
Важно наблюдать уровень золотистого стафилококка в динамике. Если происходит ускоренный рост бактерий, то это означает развитие инфекции, пришла пора начинать лечение.
Умеренное колебание количества золотистого стафилококка указывает, что состояние ребенка в норме.
Симптомы заражения золотистым стафилококком
Заражение золотистым стафилококком проявляется у каждого малыша по-разному.
При ранней форме инфицирования уже через несколько часов у ребенка происходит:
- повышение температуры;
- тошнота и рвотные позывы;
- нарушение стула;
- метеоризм.
Когда расстраивается работа ЖКТ, малыш начинает кряхтеть, натуживаться, иногда плакать. Стул у ребенка разжиженный, зеленоватого цвета, содержит белые комочки.
Стул у ребенка разжиженный, зеленоватого цвета, содержит белые комочки.
Запор, приходящий на смену поносу, сопровождается выраженным вздутием животика.
Если не облегчить неприятные симптомы, то ребенок может быстро ослабнуть.
Признаки поздней стадии заражения проявляются через три или пять дней после того, как золотистый стафилококк активизировался и удобно устроился в организме малыша. Бактерия выдает себя через:
- поражение внутренних органов и эпидермиса;
- заражение крови.
Бывает, хотя и редко, что золотистый стафилококк ничем не проявляется, и инфицирование протекает почти бессимптомно. Разве что возникают незначительные кожные патологии. Но анализ кала обязательно выявит бактерию, если она поселилась в организме малыша и размножилась выше допустимых пределов.
Причины инфицирования золотистым стафилококком
Причины заражения следующие:
- Ослабление иммунитета. Это – основной виновник инфицирования ребенка. Если защитные силы организма работают не в полную силу, то они не могут эффективно противостоять патогенным микроорганизмам.
 А болезнетворные бактерии встречаются на каждом шагу.
А болезнетворные бактерии встречаются на каждом шагу. - Недостаточное соблюдение гигиены. Малыши кладут в рот все подряд, иногда не моют руки перед тем, как сесть за стол (вина родителей). Порой за ними просто не уследишь, особенно во время прогулки или игры в песочнице. Микроорганизмы обожают грязь, поэтому риск заражения золотистым стафилококком возрастает, если уделять мало времени гигиене малыша и не приучать его к соблюдению личной чистоты.
- Прямое инфицирование ребенка от человека – носителя бактерий. Им может быть:
- сотрудник лечебного учреждения;
- работник пищеблока в детском саду или в школе.
Бактерии проникают сквозь поврежденные места на коже, слизистые оболочки и через пищу.
Золотистый стафилококк может принести и насекомое. Поэтому его укусы всегда следует обрабатывать антисептиком.
Золотистый стафилококк в кале – как помочь малышу в домашних условиях
У малышей уже со второй недели жизни и до полугода функциональные нарушение ЖКТ – явление частое.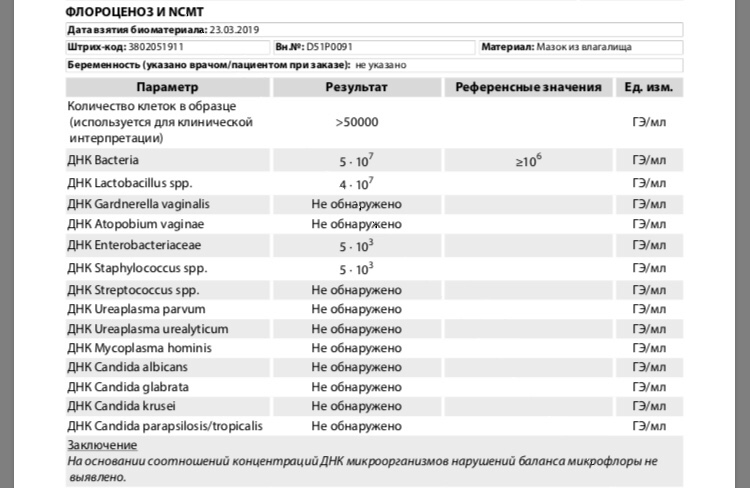 Кишечник заселяет множество бактерий различных видов. Он никогда не бывает стерильным.
Кишечник заселяет множество бактерий различных видов. Он никогда не бывает стерильным.
Лечение медикаментами целесообразно проводить только тогда, когда количество золотистого стафилококка в кале малыша в несколько раз превышает допустимое содержание.
В первую очередь, нужно нормализовать работу детского кишечника, не прибегая к фармакологии. Ведь часто лечим одно, но при этом наносим вред другой части организма.
Когда малыш начинает страдать от запоров, можно помочь ему так:
- Поить настоем семян льна, отваром ромашки аптечной и плодов фенхеля.
- Использовать готовую смесь растительных масел, например Бейби Калм или Плантекс. Первый препарат содержит масло анисовое, укропное и мятное, второй – эфирное, плодов фенхеля и лактозу. Они помогают пищеварению, ускоряют моторику кишечника и секрецию желудочного сока.
- Чаще выкладывать малыша на живот. Это поспособствует выходу излишних газов.
- Помогать крохе проделывать ножками «велосипед».
- Массажировать животик.
- Иногда не помешает сделать очистительную клизму или применить препарат Микролакс (слабительное средство, которое вводится через анальное отверстие). Можно поставить свечку (глицериновую).
Такие процедуры следует использовать редко, чтобы ЖКТ не отвык работать самостоятельно.
Если малыш на грудном вскармливании, то маме необходимо временно отказаться от потребления риса, бобовых, капусты, винограда и черники. Эти продукты скрепляют содержимое кишечника, способствуют метеоризму.
После нескольких месяцев стул у ребенка налаживается.
Лечение золотистого стафилококка
Лечить ребенка, инфицированного этим видом бактерии, непросто, поскольку она способна выделять фермент пенициллиназу. Тот наделяет золотистый стафилококк невосприимчивостью к антибиотикам.
Основные направления терапии:
- Укрепление иммунитета.
- Нормализация метаболизма.
Младенцы находятся на стационарном лечении в стерильных боксах. Важно не прерывать кормление грудным молоком, которое лучше любого лекарства способствует росту иммунитета. Поэтому мама постоянно должна быть возле малыша.
Когда появляются признаки воспаления тонкой кишки, повышается температура, кал превращается в слизистую зеленую массу, начинается лечение антибиотиками.
Вспомогательным способом терапии является применение отваров календулы, ромашки, настоя череды.
Наличие золотистого стафилококка в кале малыша – еще не повод, чтобы начинать пичкать его лекарствами. Необходимо четко отличать два понятия:
- стафилококк;
- стафилококковая инфекция.
Когда у ребенка присутствуют признаки заражения, то это и есть инфицирование золотистым стафилококком.
Когда же симптомы отсутствуют, но бактерия в кале обнаружена, родителям необходимо работать над укреплением иммунитета ребенка. Ослабление организма малыша – провоцирующий фактор инфицирования золотистым стафилококком.
Характеристика назофарингеального носительства бактериальных патогенов у детей и взрослых с рецидивирующими респираторными заболеваниями в Хабаровске (2015–2018 гг.) | Шмыленко
Введение
Часто болеющие дети — это группа детей, характеризующаяся более высоким, чем у их сверстников, уровнем заболеваемости острыми респираторными инфекциями [1].
В современной литературе часто болеющих детей относят к группе лиц с рецидивирующим или рекуррентным течением острых респираторных заболеваний. Частота встречаемости этой группы диспансерного наблюдения в детской популяции большинства стран мира находится на уровне 1550% [1, 2]. На долю заболеваний лор-органов у часто болеющих детей приходится 50-70% случаев [3-5].
Обсуждаются различные точки зрения на причины частых респираторных инфекций. Первая — дисфункция иммунной системы. Вторая — генетическая предрасположенность, наследственно обусловленный «поздний старт» иммунной системы [1, 6]. В последние годы эта проблема рассматривается также с позиций оценки микробиоты верхних дыхательных путей и реализации её патогенного влияния на организм человека. Внедрение современных технологий изучения микробиома человека (высокопродуктивное секвенирование), наличие открытых баз данных микроорганизмов (NCBI/BLAST) позволили расширить наши представления о формировании микробиоценоза верхних дыхательных путей, а также дисбиоза. Так, получена информация о чрезвычайной сложности микробных сообществ в этом локусе [3, 7, 8]. Микробиоценоз респираторного тракта начинает формироваться в перинатальный и неонатальный периоды, в том числе за счёт присоединения микрофлоры родовых путей матери. Наиболее близкий к материнской флоре носоглоточный микробиом был выявлен у детей в двухмесячном возрасте [9]. Он представляет собой сложную динамическую структуру, в состав которой входят резидентные (большая часть) и транзиторные микроорганизмы. Резидентная флора приспособлена к колонизации в этом биотопе, участвует в поддержании общего гомеостаза и защите организма от обсеменения болезнетворными микроорганизмами [3].
В период 1-го года жизни происходит прогрессивное изменение микробиома носоглотки в сторону заселения условно-патогенной флорой: Staphylococcus aureus, Streptococcus pneumoniae, Moraxella catarrhalis и др. [9]. При этом условно-патогенная флора, в частности S. aureus, имеет множество факторов патогенности, способность продуцировать агрессивные ферменты и высвобождать гистамин из клеток макроорганизма, что является основой для развития аллергического воспаления органов дыхания. Некоторые представители транзиторной микрофлоры носоглоточного локуса (родов Pseudomonas, Acinetobacter, Haemophilus, Streptococcus и др.) могут продуцировать гистамин самостоятельно, что служит пусковым механизмом для атопического воспаления и патологии носа, глотки, бронхов [10]. R.P. Dickson и соавт. [11] заостряют внимание на том, что воспаление при хронических заболеваниях респираторного тракта интенсивно поддерживается дисбиотическими нарушениями на слизистых оболочках дыхательных путей (dysbiosis — inflammation cycle). Отмечается при этом, что дисбиоз поддерживает воспаление, а воспаление — дисбиоз. Клинически это проявляется хроническим ринитом, синуситом, отитом, аденоидитом, тонзиллофарингитом и т.п. По мнению тех же авторов, dysbiosis — inflammation cycle — ключевое звено патогенеза рецидивирующих респираторных инфекций у детей, через которое может происходить переход рецидивирующих инфекций респираторного тракта в хронические.
Таким образом, изучение микробиома верхних дыхательных путей в норме и при патологии является сложной, многофакторной задачей, позволяет установить механизмы и закономерности формирования бактериальной флоры в различных биотопах этих путей [3]. Углублённый анализ носительства назофарингеальных патогенов позволит выявить факторы и группы риска заболеваний органов дыхания.
Необходимым условием для выполнения этой задачи является усовершенствование методических приёмов исследования микрофлоры и эпидемиологического анализа назофарингеального бактериального носительства и его последствий.
Цель исследований: по материалам четырёхлетних наблюдений (2015-2018 гг.) представить характеристику назофарингеального носительства бактериальных патогенов у детей и взрослых с рецидивирующими респираторными заболеваниями в г. Хабаровск.
Материалы и методы
Изучена микрофлора зева и носа 7043 детей и взрослых с респираторной патологией, находившихся на амбулаторном этапе наблюдения в 20152018 гг., в том числе 2820 детей в возрасте 0-6 лет, 702 детей возрастной группы 7-12 лет, 273 подростков 13-18 лет и 3248 взрослых пациентов.
Отбор проб для исследования проводился в соответствии с действующими нормативными документами [12]. Материалом для исследования явились мазки с задней стенки глотки и миндалин, а также из носа, взятые при глубоком введении стерильных тампонов в носовые ходы и помещённые в транспортную среду Стюарта. Время между забором материала и началом исследования не превышало 2 ч.
Посев материала проводили тампоном на оптимальный для выделения пневмотропных микроорганизмов набор питательных сред (кровяной агар (КА) с добавлением 3,5% лошадиной сыворотки и 5% эритроцитов барана, шоколадный агар, желточно-солевой агар (ЖСА), среда Эндо, среда Сабуро, сахарный бульон), позволяющий выявить основные патогены. При посеве на КА вначале посевным тампоном делали «площадку» на поверхности 1/3 чашки, затем с помощью бактериологической петли «растягивали» посевной материал с площадки, производя по 10-12 перпендикулярных к площадке штрихов на остальную поверхность чашки. Такой приём позволял получить разреженный рост изолированных колоний. Дополнительно мы применяли метод «подкормки» роста гемофильных бактерий на КА [13, 14]. Для этого по центру чашки Петри с посевом мазков из носа проводили подсев бульонной культуры гемолитического стафилококка. При росте стафилококка по обе стороны штриха образуется зона гемолиза, в которой содержатся продукты распада эритроцитов — ростовые факторы X и V, необходимые гемофильным бактериям.
Учёт результатов посевов проводили через 18-24 ч их инкубации в термостате (для КА — в СО2-инкубаторе). Второй учёт производили через 48 ч хранения чашек при комнатной температуре.
На чашках с КА рост гемофилов формировался вокруг пневмококков, стафилококков («сателлитный рост»). В случае гемофильной моноинфекции гемофилы вырастали в зоне гемолиза вдоль штриха подсеянного гемолитического стафилококка. Повторный просмотр чашек через 48 ч позволял более полно оценить состав выросшей флоры и количественные соотношения компонентов, растущих в условиях сложного взаимодействия микробных ассоциаций. При отсутствии роста в прямом посеве проводили высев на КА и ЖСА со среды обогащения (сахарного бульона).
Выросшие микроорганизмы идентифицировали с использованием наиболее рационального в каждом случае набора методов:
- классические тесты с оптохином, желчными кислотами, сапонином, бацитрацином;
- агглютинирующие сыворотки для идентификации стрептококков;
- тест-системы ПЦР для подтверждения Streptococcuspyogenes;
- хромогенные среды;
- пёстрые ряды.
Опорными признаками для идентификации моракселл выбраны:
- скольжение колоний по поверхности агара при сдвигании петлёй;
- положительный тест на оксидазу и каталазу;
- отсутствие ферментации глюкозы и лактозы.
Окончательную идентификацию осуществляли в бактериологическом анализаторе «Vitek 2 Compact».
Статистическая обработка полученных данных проводилась с помощью программы Statistica 6.0. Высчитывали среднее значение, ошибку средней величины, критерий χ2 Пирсона, в том числе с поправкой Йетса (χ2Йетса), и точный критерий Фишера (рFisher exact). Даты в знаменателе обозначения χ2 означают сравниваемые годы, например, сравнивались значения 2015 и 2018 гг. χ22015;2018). Средний темп прироста (Тпр ) вычисляли методом наименьших квадратов. Нулевая гипотеза отклонялась при уровне значимости p < 0,05.
Результаты и обсуждение
Перечень основных бактериальных патогенов и частота их выделения у лиц разных возрастных групп в Хабаровске представлены в табл. 1. В течение 4 лет на амбулаторном этапе были обследованы 7043 пациента с патологией верхних дыхательных путей.
Таблица 1. Частота выделения основных бактериальных патогенов у лиц разных возрастных групп в г. Хабаровск в 2015-2018 гг. (n = 7043)
Table 1. Frequency of isolation of the main bacterial pathogens in individuals of different age groups in Khabarovsk city in 2015-2018 (n = 7043)
Возбудители Pathogens | Возраст пациента Age of patients | Всего Total | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
0-6 | 7-12 | 13-18 | 19 и старше 19 and older | |||||||
абс. abs. | % | абс. abs. | % | абс. abs. | % | абс. abs. | % | абс. abs. | % | |
S. pneumoniae | 683 | 24,2 | 60 | 8,6 | 7 | 2,6 | 55 | 1,7 | 805 | 11,4 |
H. influenzae | 226 | 8,0 | 28 | 4,0 | 4 | 1,5 | 42 | 1,3 | 300 | 4,3 |
M. catarrhalis | 443 | 15,7 | 39 | 5,6 | 4 | 1,5 | 36 | 1,1 | 522 | 7,4 |
S. pyogenes | 42 | 1,5 | 22 | 3,1 | 3 | 1,1 | 22 | 0,7 | 89 | 1,3 |
S. agalactiae | 0 | 0 | 4 | 0,6 | 0 | 0 | 8 | 0,3 | 12 | 0,17 |
S. aureus | 1151 | 40,8 | 414 | 59 | 146 | 53,5 | 1037 | 32 | 2748 | 39,0 |
Энтеробактерии Enterobacteria | 167 | 5,9 | 32 | 4,6 | 23 | 8,4 | 444 | 13,7 | 666 | 9,5 |
Неферментирующие грамотрицательные бактерии Non-fermenting gram-negative bacteria | 130 | 4,6 | 15 | 2,1 | 5 | 1,8 | 69 | 2,1 | 219 | 3,1 |
Грибы рода Candida Fungi of the genus Candida | 498 | 17,7 | 112 | 16,0 | 51 | 18,7 | 508 | 15,6 | 1169 | 16,6 |
Число изолятов Number of isolates | 3340 |
| 726 |
| 243 |
| 2221 |
| 6530 |
|
Отрицательный результат Negative result | 439 | 15,6 | 83 | 11,8 | 49 | 18 | 963 | 29,7 | 1534 | 21,8 |
Всего обследовано лиц Total number of persons surveyed | 2820 | 84,4 | 702 | 88,2 | 273 | 82 | 3248 | 70,3 | 7043 | 100 |
Патогенная микрофлора выявлена у 5509 пациентов из 7043 обследованных (78,2 ± 0,49%). Частота обнаружения патогенов была высокой у детей всех возрастных групп (84,4 ± 0,43%; 88,2 ± 0,38%; 82,0 ± 0,46%) и ниже у взрослых (70,3 ± 0,54%; χ2 = 218,2; p < 0,00001). По суммарным данным наиболее часто в группе наблюдения отмечалось носительство S. aureus (39,0 ± 0,58%) и грибов рода Cаndida (16,6 ± 0,44%). Чаще всего эти два возбудителя выявлялись в ассоциациях с другими патогенами.
В последние годы в научной литературе появились данные о том, что штаммы S. aureus, изолируемые от назофарингеальных носителей, в том числе бессимптомных, могут обладать генетическими детерминантами патогенности, что указывает на потенциальную опасность этих микроорганизмов как возможных возбудителей эндогенных и экзогенных инфекционно-воспалительных процессов. Биотоп (слизистая полости носа) следует рассматривать как возможный источник штаммов с патогенным потенциалом, нуждающийся в санации [15]. Эта проблема продолжает оставаться актуальной и активно обсуждается врачебным сообществом.
Вместе с тем внимание клиницистов (педиатров, отоларингологов, терапевтов) по разным причинам направлено на выявление уровней носитель- ства четырёх патогенов: S. pneumoniae, Haemophilus influenzae, M. catarrhalis, S. pyogenes — как наиболее значимых в патологии респираторного тракта. Три из них (S. pneumoniae, H. influenzae, S. pyogenes) причастны к тяжёлым инвазивным формам. M. ca- tarrhalis в иностранной литературе, как правило, относится к значимым возбудителям. В отечественных немногочисленных публикациях идёт лишь накопление информации об участии M. catarrhalis в патологии респираторного тракта, практически отсутствуют сведения о частоте носительства этого патогена. Отсутствие опыта выделения моракселл культуральным методом, высокая стоимость готовых тест-систем и наборов для идентификации, отсутствие ПЦР-наборов для экспресс-диагностики затрудняют поиск и идентификацию данных микроорганизмов в клиническом материале для практических бактериологов и в некоторых случаях приводят к абсолютному их игнорированию. Эти обстоятельства не позволяют объективно оценить роль M. catarrhalis в патологии респираторных заболеваний [16].
Анализ состояния диагностики стрептококковых инфекций, проведённый нами при выездах на территории Дальневосточного федерального округа, а также при просмотре отчётов и лабораторных журналов бактериологических лабораторий в г. Хабаровске, демонстрирует полное отсутствие данных о выделении S. pyogenes или регистрацию единичных положительных случаев. Нами установлено, что на практике имеют место нарушения как на этапе забора и транспортировки материала для исследования, так и на этапе его посева. Эта информация также послужила мотивацией к изучению носительства S. pyogenes.
S. pneumoniae был выявлен у 805 человек из 7043 обследованных лиц (11,4 ± 0,38%), причём статистически значимо чаще в возрастной группе 0-6 лет (24,2 ± 0,51%), в сравнении с группой детей 7-12 лет (8,6 ± 0,33%; χ2 = 48,2; p < 0,0001) и группами подростков (2,6 ± 0,18%; χ2 = 48,6; p < 0,0001) и взрослых (1,7 ± 0,15%; χ2 = 548,7; p < 0,00001).
M. catarrhalis по уровню носительства занимает 2-е место после S. pneumoniae и выявлена у 522 (7,4 ± 0,31%) лиц из 7043 обследованных. Чаще она выделялась в возрастной группе 0-6 лет (15,7 ± 0,43%), в 2,8 раза реже — в средней возрастной группе (5,6 ± 0,27%; χ2 = 48,2; p < 0,00001) и редко — среди подростков (1,5 ± 0,14%; χ2 = 39,7; p < 0,00001) и взрослых (1,1 ± 0,12%; χ2 = 440,6; p < 0,00001).
H. influenzae выявлена у 300 из 7043 обследованных лиц (4,3 ± 0,24%), также чаще в возрастной группе 0-6 лет (8,0 ± 0,32%), вдвое реже — в группе детей 7-12 лет (4,0 ± 0,23%; χ2 = 12,7; p = 0,0004) и ещё реже — у подростков (1,5 ± 0,14%; χ2 = 14,4; p = 0,0001) и взрослых лиц (1,3 ± 0,13%; χ2 = 158,3; p < 0,00001).
S. pyogenes обнаружен у 89 лиц из 7043 обследованных (1,3 ± 0,13%). В отличие от пневмококков и гемофилов S. pyogenes чаще выявлялся в средней возрастной группе 7-12 лет (3,1 ± 0,21%), в других возрастных группах носительство отмечено в пределах 1,5 ± 0,14%; 1,1 ± 0,12%; 0,7 ± 0,09% соответственно. Причём если в средней детской группе отмечен статистически значимо более высокий процент выделения S. pyogenes по сравнению с детьми в возрасте 0-6 лет χ2Йетса = 7,6; p = 0,006) и взрослым населением χ2Йетса = 29,4; p < 0,00001), то между детьми 7-12 и подростками 13-18 лет эта разница оказалась несущественной χ2Йетса = 2,5; p = 0,1).
Таким образом, ранговое положение основных возбудителей, определяющих назофарингеальное носительство патогенов у лиц г. Хабаровска (п = 1716), представляется таковым: S. pneumoniae (47,0 ± 1,2%), M. catarrhalis (30,4 ± 1,11%), H. influenzae (17,5 ± 0,92%), S. pyogenes (5,2 ± 0,54%).
На следующем этапе анализа была установлена тенденция носительства четырёх основных патогенов в отдельные годы из наблюдаемых четырёх лет. Уровень носительства S. pneumoniae имеет тенденцию к росту в 2018 г. (11,9 ± 0,65%; 10,1 ± 0,66%; 11,0 ± 0,84%; 13,3 ± 0,99% соответственно в 2015-2018 гг.). Для H. influenzae отмечена противоположная тенденция (6,1 ± 0,48%; 4,2 ± 0,44%; 2,5 ± 0,42%; 2,6 ± 0,47%). Для catarrhalis поддерживается один и тот же уровень носительства — от 7,5 ± 0,53% в 2015 г. до 8,4 ± 0,81% в 2018 г. Наконец, для pyogenes, несмотря на низкие показатели носительства, отмечен рост выявления в 3,6-5,5 раза в период наблюдения в 2015-2018 гг.: 0,9 ± 0,19%; 0,6 ± 0,17%; 1,2 ± 0,29%; 3,2 ± 0,51%.
В последнем случае уровни выделения S. pyogenes выросли в 2017-2018 гг. вследствие оптимизации методических приёмов диагностики на этапе первичного посева (достижение роста изолированных колоний на плотных питательных средах, использование эритроцитов барана для выявления характерного β-гемолиза, дополнительное обогащение КА путём введения лошадиной сыворотки).
В основе ситуации с нарастанием показателей носительства S. pneumoniae лежат и другие причины. Статистически значимый рост отмечен за 2015–2018 гг. в младшей возрастной группе — 0–6 лет (Тпр = 3,9; χ22015;2018 = 4,8; p = 0,03), в средней — 7–12 лет (Тпр = 11,7; χ22015;2018 = 2,1; p = 0,08) и подростковой — 13–18 лет (Tпр = 19,62; pFisher exact = 0,3) (табл. 2). Несмотря на выявленный в указанных возрастных группах прирост значений, статистически значимого изменения показателей между 2015 и 2018 г. среди общего числа ежегодно обследуемых лиц не регистрировалось. Аналогично и в группе лиц 19 лет и старше значения остались практически на одном уровне (Tпр = 3,19; χ2Йетса,2015;2018 = 0,08; p = 0,8).
Таблица 2. Уровни назофарингеального носительства пневмококка у лиц разных возрастных групп в Хабаровске в 2015–2018 гг. (n = 7043)
Table 2. Levels of nasopharyngeal pneumococcal carriage in individuals of different age groups in Khabarovsk city in 2015–2018 (n = 7043)
В предыдущих исследованиях нами была показана статистически достоверная взаимосвязь между эпидемическим процессом внебольничной пневмонии и носительством пневмококков, отображающая проявления скрыто протекающего эпидемического процесса пневмококковой инфекции [17]. Такая же тенденция отмечена и в иностранной литературе [18].
По данным статистической формы № 2 «Сведения об инфекционных и паразитарных заболеваниях», в г. Хабаровске отмечен рост заболеваемости пневмококковой пневмонией в 7,3 раза в 2018 г. (12,01 на 100 тыс. населения) по сравнению с 2017 г. (1,64 на 100 тыс. населения). Вполне вероятна смена ведущих серотипов пневмококка, что может обусловить рост заболеваемости и уровней носительства.
Представленные материалы обосновывают необходимость продолжения мониторинга пневмококковой инфекции в г. Хабаровске.
На следующем этапе исследования определена возрастная структура носителей пневмококка. При таком анализе за 100% принято общее число выделителей (источников) пневмококковой инфекции (п = 805). Основная масса носителей инфекции (84,8 ± 1,27%) представлена детьми группы 0-6 лет. Дети 7-12 лет и взрослые лица 19 лет и старше составляют одинаковую долю в числе источников инфекции (7,5 ± 0,93 и 6,8 ± 0,89%). Совсем небольшую часть в числе носителей инфекции составляют подростки 13-18 лет (0,9 ± 0,33%).
Ранее выполненное нами исследование по анализу внутрисемейной циркуляции S. pneumoniae показало, что в группе часто болеющих детей — выделителей пневмококка — инфицированы 13,4% членов их семей, в основном не получивших специфическую профилактику. Наиболее часто инфицирование регистрируется среди братьев и сестёр (42,9%). Вместе с тем матери и отцы также могут быть носителями пневмококка в очагах (10,7%), а следовательно, источниками инфицирования и распространения инфекции [19]. Для ограничения внутрисемейной циркуляции возбудителя целесообразно держать под контролем и санировать всех членов семей (других детей и взрослых), имеющих тесный контакт с инфицированными детьми.
Анализ помесячной динамики назофарингеального носительства пневмококка, прослеженной при обследовании 1170 лиц в 2018 г., показал, что наиболее высокие показатели носительства регистрировали в феврале, мае и октябре, низкие — в августе (рисунок). Зимне-весенние пики носительства совпадают с повышением заболеваемости вирусными инфекциями. Как показано в исследованиях В.К. Таточенко [20], частота выделения и концентрация пневмококков в мокроте назофарингеальных носителей увеличивается во время острых респираторных вирусных инфекций, что считается одним из факторов, повышающих риск развития пневмонии или отита пневмококковой этиологии у больных. Известно также, что нейраминидаза гриппозных вирусов разрушает сиаловые кислоты тканей организма, способствуя адгезии пневмококков к клеткам эпителия бронхов [5, 10].
Рис. 1. Помесячная динамика назофарингеального носительства пневмококка (в %), прослеженная при обследовании 1170 лиц в 2018 г в Хабаровске.
Fig. 1. Monthly dynamics of nasopharyngeal pneumococcal carriage observed during the survey of 1,170 individuals in 2018 in Khabarovsk city.
Повышение уровня носительства пневмококков осенью (октябрь) может быть связано с действием факторов «перемешивания» детей (основная группа носителей) в период формирования организованных коллективов.
Таким образом, по материалам четырехлетних наблюдений (2015-2018 гг.) и бактериологического обследования 7043 детей трёх возрастных групп и взрослых с рецидивирующими респираторными заболеваниями в Хабаровске установлен значительный уровень назофарингеального носительства бактериальных патогенов (78,2%) с более высокими показателями у детей, чем у взрослых. Оптимизация методических приёмов бактериологической диагностики и эпидемиологического анализа материала позволили установить следующее ранговое положение основных возбудителей, определяющих назофарингеальное носительство патогенов среди обследованных лиц г. Хабаровска: S. pneumoniae (47%), M. catarrhalis (30,4%), H. influenzaе (17,5%), S. pyogenes (5,2%). Установлены две возрастные группы риска: дети 0-6 лет для S. pneumoniae, M. catarrhalis, H. influenzaе и дети 7-12 лет — для S. pyogenes. В течение 4 лет наблюдения отмечена тенденция к росту уровня носительства M. catarrhalis, а носительство H. influenzaе имело тенденцию к снижению. Для S. pyogenes при суммарном низком уровне носительства отмечена тенденция к росту в 3,4-5,3 раза. В то же время на фоне специфической противопневмококковой вакцинации выявлена тенденция к росту уровня носительства S. pneumoniae в 2018 г. по сравнению с 2015-2017 гг. в трёх возрастных группах детей (младшей, средней и подростковой), что сопровождалось повышением заболеваемости пневмококковой пневмонией в 7,3 раза в 2018 г. по сравнению с 2017 г. Носоглоточное носительство S. pneumoniae определяет риск развития пневмонии и других пневмококкассоциированных заболеваний у детей [4]. Растущий уровень носительства и заболеваемости обосновывают необходимость продолжения мониторинга с определением серотипового состава штаммов и характера анти- биотикорезистентности данного возбудителя.
1. Самсыгина Г.А., Выжлова Е.Н. Ещё раз о проблемах понятия «часто болеющие дети». Педиатрия. Журнал им. Г.Н. Сперанского. 2016; 95(4): 209-15.
2. Рамазанова Б.А., Ералиева Л.Т., Мустафина К.К., Колоскова Е.А. Мультицентровое исследование распространённости назофарингеального носительства Streptococcus pneumoniae на отдельных территориях Республики Казахстан до и после начала противопневмококковой вакцинации. Антибиотики и химиотерапия. 2017; 5-6(62): 35-42.
3. Борисова О.Ю., Гуров А.В., Гадуа Н.Т., Ефимов Б.А., Кафарская Л.И., Афанасьев С.С. и др. Микробиоценоз нёбных миндалин у практически здоровых лиц. Вестник оториноларингологии. 2018; 83(5): 31-5. DOI: http://doi.org/10.17116/otorino20188305131
4. Зарипова А.З., Баязитова Л.Т., Тюпкина О.Ф., Чазова Т.А., Тюрин Ю.А., Исаева Г.Ш. и др. Фенотипические и генотипические свойства Streptococcus pneumoniae при бактерионосительстве. Практическая медицина. 2018; 16(9): 106-12.
5. Тюркина С.И., Минасян В.С., Савенкова М.С., Китайгородский А.П., Овечкина Н.В., Кац Т.Г. и др. Лечение и профилактика аденоидитов бактериальными лизатами у часто болеющих детей. Детские инфекции. 2013; 12(1): 26-30.
6. Чеботарёва Т.А., Мазанкова Л.Н., Хоперскова А.П., Малиновская В.В., Кольцов В.Д., Брагина Г.С. Рекуррентные инфекции органов дыхания у детей и программы иммунореабилитации. Детские инфекции. 2014; (3): 61-4.
7. Наумкина Е.В., Матущенко Е.В., Калитина И.И., Абросимова О.А., Пядочкина Т.В., Матущенко А.И. Особенности микробиоты дыхательных путей при заболеваниях респираторного тракта. Бактериология. 2017; 2(3): 16-20. DOI: http://doi.org/10.20953/2500-1027-2017-3-16-20
8. Шабалдин А.В., Шабалдина Е.В., Симбирцев А.С. Особенности микробиома верхних отделов респираторного тракта у детей с рецидивирующими респираторными заболеваниями. Инфекция и иммунитет. 2017; 7(4): 341-9. DOI: http://doi.org/10.15789/2220-7619-2017-4-341-349
9. Peterson S.W., Knox N.C., Golding G.R., Tyler S.D., TylerA.D., Mabon P., еt al. A study of the infant nasal microbiome development over the first year of life and relation to their primary adult caregivers using cpn 60 universal target (UT) as a phylogenetic marker. PLoS One. 2016; 11(3): е0152493. DOI: http://doi.org/10.1371/journal.pone.0152493
10. Teo S.M., Mok D., Pham K., Kusel M., Serralha M., Troy N., et al. The infant nasopharyngeal microbiome impacts severity of lower respiratory infection and risk of asthma development. Cell Host Microbe. 2015; 17(5): 704-15. DOI: http://doi.org/10/1016/j.chom.2015.03.008
11. Dickson R.P., Martinez F.J., Huffnagle G.B. The role of the microbiome in exacerbations of chronic lung diseases. Lancet. 2014; 384(9944): 691-702. DOI: http://doi.org/10.1016/S0140-6736(14)61136-3
12. Методические указания МУ 4.2.2039-05. Методы контроля. Биологические и микробиологические факторы. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории. М.; 2001.
13. Богданович Т.М., Стецюк О.У., Кречикова О.И., Боронина Л.Г., Катосова Л.К., Фаустова М.Е. Выделение, идентификация, и определение чувствительности к антибиотикам Haemophilus influenzaе. Клиническая микробиология и антимикробная химиотерапия. 2000; 2(2): 93-9.
14. Боронина Л.Г. Лабораторные методы обнаружения, идентификации и определения резистентности к антибиотикам Haemophilus influenzaе. Екатеринбург; 2006.
15. Гриценко В.А., Мавзютов А.Р., Пашкова Т.М., Карташова О.Л., Тяпаева Я.В., Белозерцева Ю.П. Генетический профиль Staphylococcus aureus, выделенных от бактерионосителей и больных с инфекционно-воспалительной патологией. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018; (4): 56-62. DOI: http://doi.org/10.36233/0372-9311-2018-4-56-62
16. Шмыленко В.А., Бондаренко А.П., Троценко О.Е., Туркутюков В.Б. Частота обнаружения бактерий Moraxella catarrhalis у детей с рекуррентным течением респираторных заболеваний г. Хабаровска в 2016–2017 годах. Бюллетень физиологии и патологии дыхания. 2018; (68): 52-6. DOI: http://doi.org/10.12737/ article_5b18b82fc43524.59761242
17. Бондаренко А.П., Шмыленко В.А., Троценко О.Е., Зайцева Т.А., Каравянская Т.Н., Бутакова Л.В. и др. Внутригодовая динамика уровней носительства пневмококка и заболеваемости внебольничной пневмонией в г. Хабаровске в 2015 году. Бюллетень физиологии и патологии дыхания. 2016; (62): 16-21. DOI: http://doi.org/10.12737/23245
18. Simell B.I., Auranen K., Käyhty H., Goldblatt D., Dagan R., O’Brien K.L. Pneumococcal Carriage Group. The fundamental link between pneumococcal carriage and disease. Expert Rev. Vaccines. 2012; 11(7): 841-55. DOI: http://doi.org/10.1586/erv.12.53
19. Бондаренко А.П., Шмыленко В.А., Троценко О.Е. Эпидемиология назофарингеального носительства пневмококков в семейных очагах. Тихоокеанский медицинский журнал. 2018; (3): 54-7. DOI: http://doi.org/10.17238/PmJ1609-1175.2018.3.54-57
20. Таточенко В.К. Пневмококковая инфекция вошла в число управляемых. Журнал микробиологии, эпидемиологии и иммунобиологии. 2010; (3): 102-8.
Посев на золотистый стафилококк и чувствительность к антибиотикам
Микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и определить количество возбудителя.
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
-
кожи (карбункулам, импетиго, фолликулиту), -
молочных желез (маститу), -
дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, лариноготрахеиту, пневмонии), -
мочевыводящих путей (уретриту, циститу, пиелонефриту), -
пищеварительной системы (энтеритоколиту, аппендициту, перитониту, парапроктиту, холециститу), -
костно-суставной системы (остеомиелиту, артриту).
В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Для идентификации золотистого стафилококка проводится посев клинического материала на питательные среды, где при наличии S. aureus через 18-24 часа наблюдается рост колоний золотистого цвета.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка. При небольшом содержании микробов и отсутствии симптоматики лечение может вообще не понадобиться, т. к. и в норме на слизистой могут находиться эти микробы. Стафилококк в кишечнике обнаруживается постоянно, это не повод для лечения, но если его количество превышено, тогда нужны меры (бактерия может вызывать колики и расстройства). Стафилококк в мазке без симптомов вагинита также является нормой, в то время как большие количества стафилококка в мазке, наряду с повышением лейкоцитов, требуют лечения.
Наличие стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например при посеве мазков из носа и зева носительством считается количество бактерий до 103. Однако более высокие показатели говорят нам о золотистом стафилококке как о причине заболевания, и это уже далеко не бессимптомное носительство.
Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.
В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Отмечено также, что после пребывания больных в хирургической клинике стафилококк обнаруживался у них вдвое чаще, чем при поступлении. У больных, поступающих в стационары, наблюдается замена антибиотикочувствительных стафилококков на антибиотикоустойчивые.
Лечение больных стафилококковой болезнью препаратами пенициллина или другими давно применяемыми антибиотиками часто остаётся безрезультатным, поскольку такие препараты нередко только усугубляют тяжесть течения инфекции. Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.
Используется исследование:
-
Для определения целесообразности лечения. -
Для дифференциации бактерионосительства и опасного инфицирования. -
Для контроля за состоянием пациента после проведенного лечения. -
Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Что означают результаты?
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нор¬мальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и смертельно опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы. Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Исследование проводить до начала или через 2 недели после окончания антибактериальной, антимикотической терапии.
Собирается утром натощак до чистки зубов или через 2-3 часа после еды и питья. Перед взятием не надо полоскать рот. Забирается специалистом.
| Исследуемый материал | Допустимые м/о | Возбудители гнойно-воспалительных заболеваний | Степень роста |
| Отделяемое из носа |
Staphylococcus epidermidis
Streptococcus viridans
|
Staphylococcus aureus
Staphylococcus haemolyticus
Streptococcus pyogenes
Streptococcus pneumoniae
Pseudomonas aeruginosa
Escherichia coli
p. Enterobacetr
р. Klebsiella
р. Citrobacter
p. Proteus
p. Candida
p. Corynebacterium
p. Actinomyces
p. Neisseria
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I,II–контаминация или носительство
III, IV – этиологическая роль возбудителя
|
| Отделяемоеиззева |
Staphylococcus epidermidis
Streptococcus viridans
|
Staphylococcus aureus
Staphylococcus haemolyticus
Streptococcus pyogenes
Streptococcus pneumoniae
Pseudomonas aeruginosa
Escherichia coli
p. Enterobacter
р. Klebsiella
р. Citrobacter
p. Proteus
p. Candida
p. Corynebacterium
p. Neisseria
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I,II – контаминация или носительство
III, IV – этиологическая роль возбудителя
|
| Мокрота |
Staphylococcus epidermidis Streptococcus viridans
|
Staphylococcus aureus
Staphylococcus haemolyticus
Streptococcus pyogenes
Streptococcus pneumoniae
Escherichia coli
p. Enterobacter
Pseudomonas aeruginosa
р.Klebsiella
р. Citrobacter
p. Proteus
p. Candida
p. Corynebacterium
p. Actinomyces
p. Neisseria
|
I- 102КОЕ/мл
II – 103КОЕ/мл
III – 104 КОЕ/мл
IV- 105 — 106 КОЕ/мл
I –контаминация
II, III, IV – этиологическая роль возбудителя
|
| Отделяемое из глаз |
Staphylococcus epidermidis
Corynebacterium xerosis
Corynebacterium pseudodiphteriticum
(единичные колонии)
|
Staphylococcus aureus
Staphylococcus epidermidis
Neisseria gonorrhoeae
Corynebacteriumn diphteritiae
Streptococcus pyogenes
Streptococcus viridans
Staphylococcus haemolyticus
Pseudomonas aeruginosa
Escherichia coli
p. Enterobacter
р. Klebsiella
р. Citrobacter
p. Proteus
p. Candida
p. Aspergillus
Возбудители только воспалений коньюктивы
Haemophilusaegypticus
Moraxella lacunata
Branhamella catarrhalis
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I –контаминация
II, III, IV – этиологическая роль возбудителя
|
|
Отделяемое из ушей
Наружное ухо
|
Staphylococcus epidermidis
Corynebacterium pseudodiphteriticum
|
Staphylococcus aureus
Staphylococcus epidermidis
Streptococcus pyogenes
Streptococcus viridans
Staphylococcus haemolyticus
Escherichia coli
Прихроническойинфекции:
p. Enterobacter
р. Pseudomonas
р. Klebsiella
р. Citrobacter
p. Proteus
p. Candida
p. Corynebacterium
p. Actinomyces
p. Aspergillus
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I –контаминация
II, III, IV – этиологическая роль возбудителя
|
|
Отделяемое из ушей среднее и внутреннее ухо
| М/о отсутствуют |
Staphylococcus epidermidis
Corynebacterium pseudodiphteriticum
Staphylococcus aureus
Staphylococcus epidermidis
Streptococcus pyogenes
Streptococcus viridans
Staphylococcus haemolyticus
Escherichia coli
Прихроническойинфекции:
p. Enterobacter
р. Pseudomonas
р. Klebsiella
р. Citrobacter
p. Proteus
p. Candida
p. Corynebacterium
p. Actinomyces
p. Aspergillus
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
|
| Моча |
Стерильна
После прохождения через мочеиспускательній канал может обнаруживаться в норме :Staphylococcusepidermidis
p. Enterococcus
|
Escherichia coli
p. Enterobacter
p. Enterococcus
Pseudomonas aeruginosa
p. Proteus
р.Klebsiella
р. Citrobacter
Staphylococcus aureus
Staphylococcus epidermidis (> II ст.р.)
Streptococcus pyogenes
p. Mycoplasma
p. Ureaplasma
p. Candida
|
I- 103КОЕ/мл
II –3 . 103 —
5 . 103 КОЕ/мл
III – 104– 5 . 104КОЕ/мл
IV- 105 — 106КОЕ/мл
I –контаминация
II – исследование следует повторить
III, IV – этиологическая роль возбудителя
при низком удельном весе, рН< 5 ,
лейкоцитозе, плохом оттоке мочи
– может наблюдаться низкая степень бактеириурии, при имеющимся заболевании, необходимо определить вид микроорганизмов
Pseudomonas aeruginosa
p. Proteus
р.Klebsiella
р. Citrobacter
Escherichiacoli- чаще всего вызывают уроинфекции
Монокультура – острый воспалительный процесс
Ассоциации – при хронической (часто низкая степень бактериурии)
|
| Уретра |
Staphylococcusepidermidis
p. Enterococcus
сем. Enterobacteriaceae
Corynebacterium
|
Escherichia coli
p. Enterobacter
p. Enterococcus
Pseudomonas aeruginosa
p. Proteus
р.Klebsiella
р. Citrobacter
Staphylococcus aureus
Staphylococcus epidermidis (> II ст.р.)
Streptococcuspyogenes
p. Candida
На специальных элективных средах:
p. Mycoplasma
p. Ureaplasma
Патогенные м/о (в посеве не определяются):
Neisseria gonorrhoeae
Micobacterium tuberculosis
Treponema pallida
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I –контаминация
II – исследование следует повторить
III, IV – этиологическая роль возбудителя
|
| Кровь | Стерильна |
Сепсис и бактериимию могут вызвать все м/о патогенные и условно-патогенные:
Staphylococcus aureus
Staphylococcus epidermidis
Neisseria gonorrhoeae
Corynebacteriumn diphteritiae
Streptococcus pyogenes
Streptococcus viridans
Staphylococcus haemolyticus
Pseudomonas aeruginosa
Escherichia coli
p. Enterobacter
р.Klebsiella
р. Citrobacter
p. Proteus
p. Candida
| Степень не определяется |
| Желчь | Стерильна |
Escherichia coli
p. Enterobacter
р. Klebsiella
р. Citrobacter
p. Enterococcus
Clostridium perfringens
(Staphylococcusaureus– свидетельствует о печеночном или диафрагминальном абсцессе)
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I –контаминация
II – исследование следует повторить
III, IV – этиологическая роль возбудителя
|
| Сперма | Стерильна |
Escherichia coli
p. Enterobacter
р. Klebsiella
р. Citrobacter
p. Enterococcus
Clostridium perfringens
Staphylococcusaureus
p. Enterobacter
р. Klebsiella
р. Citrobacter
p. Proteus
p. Candida
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I –контаминация
II – исследование следует повторить
III, IV – этиологическая роль возбудителя
|
| Женские половые органы |
Влагалище: в норме
у новорожденных – молочнокислые бактерии, которые вытесняются Staphylococcusepidermidis до полового созревания
В менопаузеStaphylococcusepidermidis
В репродуктивном возрасте – Lactobacillus, Peptostreptococcus, Corynebacterium
( у многих здоровых женщин можно обнаружить Escherichiacoli
р.Streptococcus
Staphylococcusaureus
p. Mycoplasma
p. Ureaplasma
в низкой степени роста (I ст.р.) !!!!
Цервикальный канал: стерилен
Полость и придатки матки: стерильныВ слизисто-гнойной пробке влагалища в большом количестве присутсвуют молочнокислые бактерии ( в посеве не определяются)!!!!
|
Патогенные м/о (в посеве не определяются):
Neisseria gonorrhoeae
Micobacterium tuberculosis
Treponema pallida
Listeria monocytogenes
Trichomonasvaginalis
Условно-патогенныем/о (определяютсявпосеве):
Escherichia coli
p. Enterobacter
р. Klebsiella
р. Citrobacter
p. Enterococcus
p. Candida
р. Streptococcus
p. Staphylococcus
На специальных элективных средах:
p. Mycoplasma
p. Ureaplasma
Методом ПЦР, РИФ, ИФА
р. Chlamidia
Показатели баквагиноза:
(в посевах не определяются)
Gardnerellavaginalis
p. Leptothrix
|
I- 102КОЕ
II – 103КОЕ
III – 104 КОЕ
IV- 105 — 106 КОЕ
I, II – контаминация
III, IV – этиологическая роль возбудителя
|
Значение S.epidermidis для здоровой микробиоты полости носа
Симбиоз со
Staphylococcus epidermidis может иметь значение в созревании микробиоты полости носа в подростковом возрасте и в борьбе с патогенами: эта бактерия, защищенная биопленкой, может индуцировать выработку эпителием слизистой полости носа антимикробных пептидов.
Механизмы иммунной защиты слизистой оболочки влияют на микробиоту эпителия человека, и ее микробный состав значительно изменяется в раннем возрасте в процессе формирования иммунной системы. Существует корреляция между их недостаточным созреванием и развитием определенных заболеваний, хотя механизмы формирования здоровой микробиоты на данном этапе недостаточно хорошо изучены. Система полости носа остается одной из наименее изученных областей локализации эпителия, хотя даже в ноздрях могут присутствовать патогены, ответственные за развитие серьезных системных респираторных инфекций (например Staphylococcus aureus или Moraxella catarrhalis). Это объясняет важность данного исследования микробиоты полости носа у 467 здоровых добровольцев в 3 разных возрастных группах: 155 детей (средний возраст 5 лет), 171 юношей (средний возраст 19 лет) и 141 пожилой человек (средний возраст 82 года), соответственно; они были выбраны для представления возрастных групп, в которых иммунитет еще не сформирован, является зрелым или снижается.
Микробиота, характерная для каждой возрастной группы
В ходе анализа шести основных типов микроорганизмов было обнаружено, что состав микробиоты полости носа человека значительно меняется с возрастом, и по мере взросления разнообразие микробов уменьшается. Несмотря на преобладание Moraxella у детей, этот вид почти отсутствовал в двух других возрастных группах. Численность стафилококков по мере взросления увеличилась в 4,4 раза, таким образом, они стали преобладающим видом у молодых людей. Число оппортунистических патогенных микроорганизмов вида Dolosigranulum pigrum, которые могут вызывать инфекции верхних дыхательных путей, нозокомиальную пневмонию и септицемию, за период между детством и юношеством уменьшилось в 2,4 раза. Наконец, у пожилых людей была отмечена обратная по сравнению с молодыми людьми тенденция, т.е. снижение числа Staphylococcus и увеличение числа Dolosigranulum.
Защитный эффект
S. epidermidis
Основываясь на этих результатах, исследователи также выдвинули предположение о потенциальном механизме, при помощи которого один конкретный вид — Staphylococcus epidermidis — работая в тандеме с иммунной системой хозяина, может привести к элиминации назальных патогенов. S. epidermidis может стимулировать выработку кератиноцитами эпителия носовой полости антимикробных пептидов, уничтожающих патогенные бактерии, тогда как S. epidermidis, благодаря биопленке, устойчив к этим пептидам. Этот механизм симбиотического взаимодействия между бактериями микробиоты полости носа и системой врожденного иммунитета может способствовать элиминации патогенных микроорганизмов, стабилизации состава микробиоты и может помочь иммунной системе хозяина дифференцировать патогенные бактерии и комменсалы.
Источники:
Liu Q, Liu Q, Meng H, et al. Staphylococcus epidermidis Contributes to Healthy Maturation of the Nasal Microbiome by Stimulating Antimicrobial Peptide Production. Cell Host Microbe. 2020 Jan 8;27(1):68-78.e5.
Распространенность и факторы риска носительства Staphylococcus aureus через нос у детей, посещающих детские сады в Удджайне, Индия | Примечания к исследованию BMC
Баучер Х.В., Кори Г.Р.: Эпидемиология метициллин-устойчивого золотистого стафилококка. Clin Infect Dis. 2008, 46 (Приложение 5): S344-S349.
PubMed
Статья
Google Scholar
Lowy FD: Инфекции Staphylococcus aureus. N Engl J Med. 1998, 339 (8): 520-532.
PubMed
CAS
Статья
Google Scholar
Медиавилла Дж. Р., Чен Л., Матема Б., Крейсвирт Б. Н.: Глобальная эпидемиология связанного с сообществами метициллин-устойчивого золотистого стафилококка (CA-MRSA). Curr Opin Microbiol. 2012, 15 (5): 588-595.
PubMed
Статья
Google Scholar
Дэвид М.З., Даум Р.С.: Связанный с сообществом устойчивый к метициллину Staphylococcus aureus: эпидемиология и клинические последствия возникающей эпидемии.Clin Microbiol Rev.2010, 23 (3): 616-687.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Goossens H, Ferech M, Vander Stichele R, Elseviers M: Амбулаторное использование антибиотиков в Европе и связь с устойчивостью: исследование базы данных на международном уровне. Ланцет. 2005, 365 (9459): 579-587.
PubMed
Статья
Google Scholar
Патхак А., Махадик К., Данерия С.П., Шарма А., Эрикссон Б., Лундборг К.С.: Назначение антибиотиков амбулаторно: больница и сезонные колебания в Удджайне, Индия.Scand J Infect Dis. 2011, 43 (6–7): 479-488.
PubMed
Статья
Google Scholar
Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, Rice LB, Scheld M, Spellberg B, Bartlett J: Плохие ошибки, никаких лекарств: нет ESKAPE! Новости Общества инфекционных болезней Америки. Clin Infect Dis. 2009, 48 (1): 1-12.
PubMed
Статья
Google Scholar
Williams RE: Здоровое носительство Staphylococcus aureus: его распространенность и важность. Bacteriol Rev.1963, 27: 56-71.
PubMed
CAS
PubMed Central
Google Scholar
Wertheim HF, van Kleef M, Vos MC, Ott A, Verbrugh HA, Fokkens W. Выщипывание из носа и носительство Staphylococcus aureus через нос. Инфекционный контроль Hosp Epidemiol. 2006, 27 (8): 863-867.
PubMed
Статья
Google Scholar
Sherertz RJ, Bassetti S, Bassetti-Wyss B: «Облако» медработников. Emerg Infect Dis. 2001, 7 (2): 241-244.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Патак А., Мароти Й., Айер Р.В., Сингх Б., Шарма М., Эрикссон Б., Макаден Р., Лундборг К.С.: носительство в носу и чувствительность к антимикробным препаратам золотистого стафилококка у здоровых дошкольников в Удджайне, Индия. BMC Pediatr. 2010, 10: 100-
PubMed
PubMed Central
Статья
Google Scholar
Роу А.К., Лама М., Оникпо Ф., Деминг М.С.: Эффекты схемы и коэффициенты внутриклассовой корреляции из кластерного обследования медицинских учреждений в Бенине. Int J Qual Health Care. 2002, 14 (6): 521-523.
PubMed
Статья
Google Scholar
Бхатт SR: Питание: нормальное питание и недоедание. Учебник педиатрии Ахара. Отредактировал: Bhatt SR. 2009, Хайдарабад: Universities Press (India) Private Limited, 35-54. 9
Google Scholar
Murray PR, Baron EJ, Pfaller MA, Tenover FC, Yolken RH: Руководство по клинической микробиологии. 1999, Вашингтон, округ Колумбия: ASM Press, 7
Google Scholar
CLSI: Стандарты эффективности тестирования чувствительности к противомикробным препаратам M100-S20-U: 20-е информационное приложение. 2010, Пенсильвания: Уэйн: Институт CaLS
Google Scholar
Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, Harbarth S, Hindler JF, Kahlmeter G, Olsson-Liljequist B и др.: Множественная лекарственная устойчивость, широкая лекарственная устойчивость и бактерии, устойчивые к противовоспалительным препаратам: предложение международных экспертов по временным стандартным определениям приобретенной устойчивости.Clin Microbiol Infect. 2012, 18 (3): 268-281. 10.1111 / j.1469-0691.2011.03570.x.
PubMed
CAS
Статья
Google Scholar
Нагараджу У., Бхат Г., Курувила М., Пай Г.С., Джаялакшми, Бабу Р.П .: Метициллин-устойчивый золотистый стафилококк при внебольничной пиодермии. Int J Dermatol. 2004, 43 (6): 412-414.
PubMed
Статья
Google Scholar
Чаттерджи С.С., Рэй П., Аггарвал А., Дас А., Шарма М.: исследование носительства Staphylococcus aureus на уровне сообщества. Индийский J Med Res. 2009, 130 (6): 742-748.
PubMed
CAS
Google Scholar
Chen CJ, Hsu KH, Lin TY, Hwang KP, Chen PY, Huang YC: Факторы, связанные с носовой колонизацией устойчивых к метициллину Staphylococcus aureus среди здоровых детей на Тайване. J Clin Microbiol. 2011, 49 (1): 131-137.
PubMed
CAS
PubMed Central
Статья
Google Scholar
Бэ С., Ю Джи, Ли К., Ли С., Парк Б., Кан Й .: Колонизация носа четырьмя потенциальными респираторными бактериями у здоровых детей, посещающих детский сад или начальную школу в Сеуле, Корея. J Med Microbiol. 2012, 61 (Pt 5): 678-685.
PubMed
Статья
Google Scholar
Lo WT, Wang CC, Lin WJ, Wang SR, Teng CS, Huang CF, Chen SJ: Изменения в носовой колонизации метициллин-резистентным золотистым стафилококком у детей: 2004–2009.PLoS One. 2010, 5 (12): e15791-
PubMed
CAS
PubMed Central
Статья
Google Scholar
Халаблаб М.А., Хиджази С.М., Фавзи М.А., Арай Г.Ф .: Скорость носительства Staphylococcus aureus через нос и связанные факторы риска у отдельных лиц в сообществе. Epidemiol Infect. 2010, 138 (5): 702-706.
PubMed
CAS
Статья
Google Scholar
Kluytmans JA, Wertheim HF: Назальное носительство Staphylococcus aureus и профилактика внутрибольничных инфекций.Инфекция. 2005, 33 (1): 3-8.
PubMed
CAS
Статья
Google Scholar
Rafee Y, Abdel-Haq N, Asmar B, Salimnia T., Pharm CV, Rybak Pharm MJ, Amjad M: Повышенная распространенность метициллин-резистентной колонизации носа золотистого стафилококка у детей, контактировавших с детьми с внебольничными заболеваниями. BMC Infect Dis. 2012, 12: 45-
PubMed
PubMed Central
Статья
Google Scholar
Патхак А., Махадик К., Шарма Р., Мароти Й., Шарма М., Макаден Р., Лундборг К.С.: факторы, связанные с носительством мультирезистентной комменсальной кишечной палочки у женщин в постменопаузе в Удджайне, Индия. Scand J Infect Dis. 2012, 44 (12): 973-977.
PubMed
Статья
Google Scholar
Schaible UE, Kaufmann SH: Недоедание и инфекция: сложные механизмы и глобальные последствия. PLoS Med. 2007, 4 (5): e115-
PubMed
PubMed Central
Статья
Google Scholar
Савино В. Вилочковая железа является мишенью при недостаточности питания. Eur J Clin Nutr. 2002, 56 (Дополнение 3): S46-S49.
PubMed
CAS
Статья
Google Scholar
Чандра РК: Питание, иммунитет и инфекции: текущие знания и направления на будущее. Ланцет. 1983, 1 (8326 Pt 1): 688-691.
PubMed
CAS
Google Scholar
Чандра РК: Белково-энергетическая недостаточность и иммунологические реакции.J Nutr. 1992, 122 (3 доп.): 597-600.
PubMed
CAS
Google Scholar
Огузкая-Артан М., Байкан З., Артан Ц .: Носовое носительство Staphylococcus aureus у здоровых дошкольников. Jpn J Infect Dis. 2008, 61 (1): 70-72.
PubMed
Google Scholar
Патхак А., Махадик К., Данерия С.П., Шарма А., Эрикссон Б., Лундборг К.С.: Надзор за потреблением антибиотиков с использованием подхода «очаг инфекции» в 2 больницах в Удджайне, Индия.PLoS One. 2012, 7 (6): e38641-
PubMed
CAS
PubMed Central
Статья
Google Scholar
Инфекция, вызванная метициллинорезистентным золотистым стафилококком у детей
Этот материал нельзя использовать в коммерческих целях, в больницах или медицинских учреждениях. Несоблюдение может повлечь за собой судебный иск.
Что такое метициллин-устойчивый золотистый стафилококк?
- Метициллин-устойчивый золотистый стафилококк (MRSA) — это тип микробов, называемых бактериями.Бактерии MRSA могут вызывать инфекции в организме вашего ребенка. Антибиотики используются для уничтожения микробов. Когда микроб Staphylococcus aureus (Staph) становится устойчивым к определенным антибиотическим препаратам (не убивается ими), это называется MRSA. Зародыш стафилококка обычно находится на коже и в носу. Ваш ребенок может быть переносчиком стафилококка, но не заразиться или заболеть. Носитель MRSA может передать его другим людям и вызвать у них заболевание.
- Инфекция MRSA очень заразна. Это означает, что он легко передается от человека к человеку.Любой может заразиться MRSA-инфекцией. Ваш ребенок может заразиться MRSA в больнице или за ее пределами. MRSA может вызвать легкую, тяжелую (очень тяжелую) или смертельную инфекцию в организме вашего ребенка. Инфекция может попасть в кожу, кровь, легкие, сердце или мозг вашего ребенка.
Что увеличивает риск заражения моего ребенка MRSA-инфекцией?
- Использование антибиотиков: Если вы не будете следовать инструкциям воспитателя вашего ребенка по назначению антибиотиков, это может привести к тому, что микробы станут устойчивыми.Частое или длительное введение ребенку антибиотиков может вызвать резистентность. Если вы дадите своему ребенку антибиотики, когда они ему не нужны, это также может вызвать резистентность. Когда определенные микробы не могут быть уничтожены лекарством, ваш ребенок может заразиться MRSA-инфекцией.
- Пребывание в больнице: Сюда входит операция, пребывание в отделении интенсивной терапии (отделение интенсивной терапии) или на искусственной вентиляции легких (аппарате поддержки дыхания). Длительное пребывание в больнице или совместное проживание в палате с больным MRSA увеличивает риск заражения MRSA у вашего ребенка.
- Наличие трубок, проводов или металлических имплантатов в вашем теле: Медицинские трубки, помещенные в тело вашего ребенка, увеличивают риск заражения MRSA-инфекцией. Эти трубки могут включать внутривенные (IV) трубки и большие трубки, называемые центральными венозными линиями. Если вашему ребенку требуется диализ или другое лечение, можно использовать центральную венозную линию. К другим трубкам, повышающим риск заражения вашего ребенка MRSA, относятся трубки для кормления и катетеры. Мочевой катетер — это трубка, по которой сливается моча.MRSA также может жить на металлических имплантатах и вокруг них, таких как протезы (искусственные части тела).
- Наличие слабой иммунной системы: MRSA с большей вероятностью вызовет инфекцию, если у вашего ребенка слабая иммунная система. Иммунная система — это часть тела, которая борется с инфекцией. Диабет (высокий уровень сахара в крови) может ослабить иммунную систему вашего ребенка. Если ваш ребенок недавно прошел химиотерапию (лекарство от рака), у него может быть слабая иммунная система.
- Болеет гриппом или ветряной оспой: Если ваш ребенок болен гриппом (грипп) или ветряной оспой (ветряной оспой), он также может заразиться MRSA.Это может вызвать у вашего ребенка сильное заболевание.
- Передача MRSA младенцам: Если вы женщина, у которой есть MRSA, вы можете передать его своему ребенку, когда вы его родите. Поговорите со своим опекуном, если вы женщина, больная MRSA, и хотите кормить ребенка грудью.
Что еще увеличивает риск заражения моего ребенка MRSA?
- Несоблюдение чистоты: Это включает в себя то, что ребенок не мыл руки хорошо (с мылом и водой) или недостаточно долго.Смена подгузников и вытирание насморка также увеличивают риск передачи MRSA от одного человека к другому.
- Наличие члена семьи с инфекцией MRSA: Если кто-то из проживающих в вашем доме инфицирован MRSA, ваш ребенок подвергается более высокому риску заражения.
- Совместное использование личных вещей: MRSA может распространяться при совместном использовании таких предметов, как игрушки, одежда, постельное белье, мочалки и куски мыла.
- Совместное проживание с другими детьми: Дети в детских садах подвергаются более высокому риску заражения MRSA.
- Играет в спортивной команде: Ваш ребенок может заразиться MRSA во время занятий спортом. Это может произойти при контакте с телом (прикосновении) или при совместном использовании оборудования. В некоторых видах спорта, например, в футболе, во время игры на коже могут появиться царапины. Это открывает путь для проникновения микробов в организм.
- Злоупотребление внутривенными наркотиками: Дети более старшего возраста могут заразиться MRSA, если они будут вводить запрещенные (уличные) наркотики внутривенно.
Какие проблемы может вызвать инфекция MRSA?
MRSA может вызывать серьезные, а иногда и смертельные инфекции.Обратитесь к опекуну вашего ребенка за дополнительной информацией о любой из этих инфекций:
- Инфекции кожи, мягких тканей или ран: Эти инфекции могут быть небольшими или очень тяжелыми инфекциями кожи, мышц и других мягких тканей. Это может включать инфекцию культи пуповины вашего ребенка. Пуповина соединяет ребенка с матерью ребенка еще до его рождения. У вашего ребенка также могут быть инфекции ран, вызванных травмой, болезнью или порезом, сделанным во время операции.
- Инфекции мочевыводящих путей: Инфекция мочевыводящих путей (ИМП) — это инфекция почек, мочеточников или мочевого пузыря. Эти органы производят и хранят мочу в организме вашего ребенка.
- Остеомиелит или артрит: Остеомиелит — это инфекция костей вашего ребенка. Артрит — это заболевание, при котором у ребенка опухают суставы. Суставы — это места в теле, где встречаются две кости, например, колени и локти вашего ребенка. Наличие MRSA и остеомиелита может увеличить риск образования тромбов у вашего ребенка.Если это произойдет, у вашего ребенка может появиться покраснение, боль и припухлость в месте сгустка. Сгусток крови в легких вашего ребенка вызывает боль в груди и затрудненное дыхание.
- Инфекция органов брюшной полости: Органы в брюшной полости вашего ребенка, такие как печень и селезенка вашего ребенка, могут быть инфицированы.
- Менингит: Менингит — это отек мозга и позвоночника вашего ребенка.
- Пневмония: Пневмония возникает, когда в легких вашего ребенка появляется инфекция и опухоль.
- Бактериемия: Бактериемия возникает, когда микробы MRSA попадают в кровоток вашего ребенка и вызывают инфекцию крови.
- Инфекционный эндокардит: Эндокардит — это воспаление (отек) и инфекция внутренней оболочки сердца вашего ребенка.
Каковы признаки и симптомы инфекции MRSA?
Признаки и симптомы вашего ребенка зависят от того, в какой части его тела есть инфекция. Они могут включать:
- Лихорадка: Это высокая температура тела.
- Зараженная кожа: Кожа вашего ребенка может покраснеть и опухнуть, с ощущением тепла и боли. У него может быть темное пятно на коже, похожее на укус паука. У вашего ребенка могут быть фурункулы, омертвевшая кожа или гной на или под кожей. Кожные язвы могут появиться на любом участке тела вашего ребенка. У младенцев, которые носят подгузники, язвы чаще появляются в области подгузников.
- Суставной выпот: В одном из суставов вашего ребенка может скапливаться жидкость, вызывая отек, боль и скованность.
- Кашель: У вашего ребенка может быть кашель. Он может кашлять кровью.
- Проблемы с дыханием: Вашему ребенку может быть трудно дышать.
Как диагностируется инфекция MRSA?
Опекун вашего ребенка проверит его тело. Он может спросить вас, был ли ваш ребенок с кем-нибудь, кто болен MRSA. Вашему ребенку потребуются анализы крови и одно или несколько из следующего:
- Культуры: Опекун вашего ребенка может взять образцы мокроты (слизи) из горла или носа вашего ребенка.Он может взять образцы гноя из раны. Эти жидкости отправляются в лабораторию и проверяются на MRSA.
- Биопсия: Биопсия может быть сделана путем взятия образца кожи или другой инфицированной ткани вашего ребенка. Эта ткань будет отправлена в лабораторию для тестирования на MRSA.
- Рентген грудной клетки: Это снимок легких и сердца вашего ребенка. Воспитатели могут использовать рентгеновский снимок для поиска признаков инфекции (например, пневмонии) или коллапса легкого.
- Компьютерная томография: Это также называется компьютерной томографией.Это рентгеновский снимок участков тела. Он может показать места, где могла распространиться инфекция вашего ребенка.
- MRI: Этот тест называется магнитно-резонансной томографией. Во время МРТ делается снимок тела вашего ребенка.
- Эхо: Этот тест также называется эхокардиограммой. Звуковые волны используются для демонстрации изображений размера и формы сердца вашего ребенка. Эхо может сказать, насколько хорошо сердце качает кровь и насколько хорошо по нему течет кровь. Могут проявляться признаки инфекции, например наличие жидкости вокруг сердца.
- Сканирование костей: Воспитатель вашего ребенка может использовать этот тест, чтобы определить, распространилась ли инфекция на кости вашего ребенка.
Как лечится инфекция MRSA?
Лечение вашего ребенка будет зависеть от того, в какой части его тела находится инфекция. При лечении такие признаки и симптомы, как жар, кашель и боль, могут уменьшиться, а раны могут зажить. Лечение вашего ребенка может включать в себя любое из следующего:
- Антибиотики: Это лекарство от микробов, которое используется для лечения MRSA.Вашему ребенку может потребоваться одновременный прием нескольких антибиотиков.
- Разжижители крови: Это лекарства, которые могут помочь разрушить тромбы и предотвратить их образование.
- Изоляция: Если ваш ребенок находится в больнице, опекуны и посетители будут носить халат и перчатки, когда находятся в его палате. Воспитатели и другие лица, входящие в комнату вашего ребенка, также могут носить маску. Предметы, находящиеся в его палате, не будут переданы другим пациентам. Это сделано для предотвращения передачи его инфекции другим людям.Посетители также должны мыть руки перед отъездом, чтобы не допустить распространения микробов.
- Хирургия: Вашему ребенку может потребоваться операция по удалению инфицированной MRSA кожи или кости. Если вашему ребенку была сделана операция по установке искусственных имплантатов в его тело, возможно, их придется удалить.
- Разрез и дренаж: Если у вашего ребенка кожная инфекция MRSA, лица, осуществляющие уход, могут порезать инфицированный участок его кожи. Это поможет слить жидкость (гной), скопившуюся в этой области.
Каковы риски лечения от инфекции MRSA?
- Антибиотики, применяемые для лечения инфекции MRSA вашего ребенка, могут вызывать сыпь, тошноту, рвоту (рвоту) и диарею. Они могут повредить его почки, нервы или глаза. Он может чувствовать мышечную боль или слабость. Его зубы могут быть окрашены, а его кожа может стать чувствительной к свету. У вашего ребенка может быть нерегулярное сердцебиение. Его язык может опухать, и ему может быть трудно говорить. Антибиотики могут плохо сочетаться с другими лекарствами, которые он принимает.Лекарства для разжижения крови позволяют вашему ребенку легко начать кровотечение, даже не получив травмы. Некоторые антибиотики могут вызывать судороги или очень серьезные проблемы, которые могут быть опасными для жизни.
- Если не лечить инфекцию MRSA вашего ребенка, состояние может ухудшиться. Инфекция может распространиться на его кожу, суставы, почки, легкие, печень, селезенку, кости, мозг и сердце. Если у вашего ребенка инфекция позвоночника, ситуация может ухудшиться, и он потеряет способность пользоваться ногами. У вашего ребенка могут образоваться тромбы в легких и других частях тела.Эти проблемы могут быть опасными для жизни. Поговорите с опекуном вашего ребенка, если у вас есть вопросы или опасения по поводу инфекции или лечения вашего ребенка MRSA.
Что я могу сделать, чтобы предотвратить заражение моего ребенка или распространение MRSA?
- Давайте антибиотики в соответствии с инструкциями: Всегда давайте вашему ребенку антибиотики точно в соответствии с указаниями его опекуна. Убедитесь, что ваш ребенок допил все лекарства в соответствии с предписаниями, даже если он чувствует себя лучше. Если этого не сделать, будет труднее убить микроб.Никогда не давайте лекарства по рецепту без разрешения опекуна. Никогда не откладывайте антибиотики и не давайте остатки антибиотиков, которые были даны вашему ребенку от другой болезни.
- Мойте руки и руки вашего ребенка: Скажите всем в вашем доме мыть руки водой с мылом для уничтожения микробов после посещения туалета. Мойте руки после смены подгузников и перед приготовлением или приемом пищи. Все члены семьи должны мыть руки после кашля и чихания, а также всякий раз, когда они грязные.После посещения больного MRSA каждый должен вымыть руки. Следите за чистотой и короткой стрижкой ногтей на руках у вас и вашего ребенка.
- Купайтесь часто: Попросите ребенка регулярно купаться с мылом. Попросите его делать это, особенно после таких видов спорта, как футбол и борьба, когда есть физический контакт с другими людьми. Дети, использующие тренажеры, которые также используются другими, должны часто купаться.
- Вымойте всю одежду вашего ребенка: Мойте всю одежду водой с мылом после того, как ее наденет кто-то, кто, возможно, болен или болен инфекцией MRSA.Пусть ваш ребенок ежедневно меняет нижнее белье и одежду для сна.
- Держите раны закрытыми: Держите раны вашего ребенка чистыми и накрывайте их повязкой, пока они не заживут. Следуйте инструкциям опекуна вашего ребенка, чтобы рана была чистой и закрытой. Не позволяйте ребенку заниматься другими делами с другими, пока его язвы не заживут. Не отводите детей младшего возраста в детские сады до тех пор, пока не заживут все язвы.
- Не делитесь личными вещами: Не позволяйте ребенку делиться едой, напитками, вилками, ножами, ложками, тарелками или чашками с другими.Не позволяйте ему делиться кусками мыла или полотенцами, а также не позволяйте детям делиться игрушками. Не давайте разным младенцам одну и ту же соску.
- Хорошо очистите поверхности: Используйте средство на основе спирта или хлора, убивающее микробы, при чистке поверхностей, таких как столы, к которым часто дотрагиваются. Держите дверные ручки, ручки кранов и пол в чистоте. Игрушки, которыми играют дети, нужно хорошо чистить.
- Избавьтесь от микроба: Если кто-то в вашем доме заразился MRSA, ваш ребенок и другие члены семьи подвергаются большему риску заражения.Вам и вашей семье может потребоваться использовать крем с антибиотиком для носа или специальное мыло при мытье.
- Играйте безопасно: Убедитесь, что ваш ребенок использует надлежащие средства защиты и одежду при занятиях спортом. Это может предотвратить порезы или другие травмы, а также защитить его кожу от других детских микробов.
Где я могу найти поддержку и дополнительную информацию?
Инфекция MRSA может изменить жизнь вашего ребенка и вашей семьи. Вы и ваш ребенок можете чувствовать гнев, грусть или испуг.Эти чувства нормальные. Ваш ребенок должен поговорить о своих чувствах со своими опекунами, семьей или друзьями. Свяжитесь со следующим:
- Центры по контролю и профилактике заболеваний
1600 Clifton Rd.
Atlanta, GA 30333
Телефон: 1-800-232-4636
Интернет-адрес: http://www.cdc.gov
- Национальный институт аллергии и инфекционных заболеваний
NIAID Office of Communications & Government Relations
5601 Fishers Lane, MSC 9806
Бетесда, Мэриленд 20892-9806
Для доставки используйте Rockville, MD 20852
Телефон: 1-301-496-5717
Телефон: 1-866-284-4107
Веб-адрес: www3.niaid.nih.gov
Когда мне следует позвонить опекуну моего ребенка?
Позвоните опекуну вашего ребенка, если у него есть:
- Лихорадка (высокая температура тела).
- Сыпь, которая зудит или распространяется по всему телу.
- Покрасневшие, опухшие и теплые участки кожи. Эти области также могут быть болезненными.
- Рана или участок гноя под кожей, который не проходит.
- Тошнота (тошнота), рвота (рвота) или диарея.
- Мышечная боль или слабость.
- Кровь в моче или дефекации.
Когда мне следует немедленно обратиться за помощью?
Немедленно обратитесь за помощью или позвоните 911, если:
- Ваш ребенок кашляет кровью.
- У вашего ребенка внезапно возникли проблемы с речью.
- У вашего ребенка новые проблемы с дыханием.
- У вашего ребенка учащенное сердцебиение, он чувствует слабость или головокружение.
- Боль вашего ребенка становится очень сильной.
- У вашего ребенка опухает язык.
- У вашего ребенка припадок (судороги).
- У вашего ребенка болит голова, сковывает шея, он очень устал или сбит с толку.
- У вашего ребенка сильное кровотечение.
Соглашение об уходе
У вас есть право участвовать в планировании ухода за вашим ребенком. Узнайте о состоянии здоровья вашего ребенка и о том, как его можно лечить. Обсудите варианты лечения с опекунами вашего ребенка, чтобы решить, какой уход вы хотите для своего ребенка.
Приведенная выше информация является только учебным пособием.Он не предназначен для использования в качестве медицинского совета по поводу индивидуальных состояний или лечения. Поговорите со своим врачом, медсестрой или фармацевтом, прежде чем следовать какой-либо лечебной схеме, чтобы узнать, безопасно ли она для вас и эффективна.
Подробнее об инфекции, вызванной устойчивым к метициллину золотистым стафилококком у детей
Сопутствующие препараты
IBM Watson Micromedex
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
Авторские права © 2012. Thomson Reuters. Все права защищены. Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях.
Стойкие инфекции Staphylococcus aureus у детей с хроническими заболеваниями легких: многопрофильный анализ бактериальной адаптации для определения новых терапевтических подходов
Резюме
Пациенты, страдающие хроническими заболеваниями легких, аномально колонизированы многими комменсальными и патогенными видами бактерий, среди которых Staphylococcus aureus является наиболее часто определяемым патогеном (распространенность в легких пациентов с муковисцидозом (МВ) превышает 70%).Однако механизмы, лежащие в основе адаптации S. aureus к легким, изучены недостаточно.
Чтобы получить более полное представление о молекулярных механизмах адаптации S. aureus к хронической иммунодефицитной среде легких, мы выбрали четыре пары последовательных изолятов S. aureus от 3 пациентов с МВ и пациента с дефектной выработкой антител IgG, страдающего от хронических заболеваний легких. Мы использовали комбинацию геномного, протеомного и метаболомного подходов с функциональными анализами для углубленной характеристики S.aureus длительное сохранение при хронической легочной инфекции. Мы демонстрируем, что хроническая инфекция S. aureus связана с накоплением генетических модификаций, вызывающих измененные профили экспрессии белков и заметные метаболические изменения. Эти модификации согласуются как с индивидуальной адаптацией пациента, так и с конвергентной эволюцией изолятов S. aureus . Мы идентифицировали несколько метаболических путей (, например, , пантотенат и жирные кислоты) и регуляторы вирулентности (кодируемые локусами agr и sae ), которые могут быть терапевтическими мишенями.Важно отметить, что мы показываем, что длительная инфекция S. aureus приводит к повышенной способности образовывать биопленки и к длительному внутриклеточному выживанию. Важно отметить, что повышенная способность сохраняться внутриклеточно была подтверждена для изолятов S. aureus в собственных эпителиальных клетках пациента.
Наши результаты убедительно свидетельствуют о том, что внутриклеточная среда может составлять важную нишу устойчивости и рецидивов, требующих адаптированного лечения антибиотиками. Более того, многопрофильный подход, описанный в этом исследовании, прокладывает путь к персонализированной медицине для лечения хронических инфекций.
Краткое содержание автора Staphylococcus aureus — хорошо известный патоген для человека, вызывающий как доброкачественные, так и опасные для жизни инфекции. Удивительно, но S. aureus обладает способностью сохраняться в легких пациентов, страдающих хроническим респираторным заболеванием, в течение нескольких лет, несмотря на лечение антибиотиками. Такое долгосрочное постоянство зависит от постоянной адаптации внутри хозяина с течением времени, чтобы справиться с давлением окружающей среды, с которым сталкиваются легкие. В этом исследовании мы идентифицировали важные геномные, протеомные и метаболические изменения, происходящие во время внутрилегочной адаптации S.aureus. Пути и факторы вирулентности, идентифицированные в этом исследовании как возможно ведущие к персистенции, могут представлять собой новые терапевтические мишени.
Введение
Дыхательные пути — это порт входа для частиц внешней среды, таких как микроорганизмы. У здоровых людей инфекции редки, несмотря на частое вдыхание бактерий, из-за сложных врожденных механизмов защиты хозяина на слизистой оболочке легких. Хронические бактериальные инфекции являются отличительной чертой пациентов с муковисцидозом (МВ), хронической обструктивной болезнью легких (ХОБЛ) и расстройствами первичного иммунодефицита с легочными проявлениями [1-4].Эти инфекции связаны с повышенной заболеваемостью и способствуют быстрому снижению легочной функции.
Staphylococcus aureus и Pseudomonas aeruginosa являются наиболее частыми патогенами, поражающими легкие пациентов с хроническим заболеванием легких [3, 4]. Во время хронических инфекций патогены должны со временем адаптироваться, чтобы справиться с давлением окружающей среды в легких, таким как воспалительные реакции, гипоксия, дефицит питательных веществ, изменения осмолярности, низкий pH и терапия антибиотиками [5-7].Эволюция P. aeruginosa во время хронических легочных инфекций широко изучена и включает приобретение устойчивости к антибиотикам, увеличение продукции экзополисахаридов, потерю подвижности и образование вариантов малых колоний (SCV) [7-9]. Напротив, очень мало исследований изучали адаптации, которым подвергаются S. aureus у пациентов с хроническими заболеваниями легких, включая МВ [10, 11]. Более того, каждое из этих исследований касалось только генетических модификаций, происходящих в изолятах, полученных от одного пациента.
CF — одно из наиболее частых аутосомно-рецессивных заболеваний со смертельным исходом среди европейцев. МВ вызывается мутациями в гене регулятора трансмембранной проводимости муковисцидоза (CFTR). Дисфункция CFTR приводит к скоплению густой мокроты в дыхательных путях, что объясняет хронические бактериальные инфекции и последующую дыхательную недостаточность [2]. Согласно реестру пациентов с МВ Фонда кистозного фиброза США, распространенность S. aureus среди пациентов с МВ увеличилась примерно с 30% в 1990 г. до более 70% в 2016 г. с пиком распространенности в возрасте 11–17 лет.Более того, S. aureus — одна из первых бактерий, обнаруженных у младенцев с МВ.
Хотя в основном считается причиной острых инфекций внеклеточного образа жизни, S. aureus обладает способностью как образовывать биопленки [12-14], так и выживать в широком диапазоне эукариотических клеток-хозяев [15-24]. Эти способности, вероятно, способствуют сохранению S. aureus в дыхательных путях пациентов с хроническими заболеваниями легких в течение месяцев или лет, несмотря на соответствующее лечение противомикробными препаратами [25, 26].
Устойчивость S. aureus связана с резким снижением метаболизма (например, снижением активности цикла Кребса) [27] и обычно связана с уменьшением экспрессии факторов вирулентности и увеличением экспрессии бактериальные адгезины [28]. Такой профиль типичен для вариантов с малыми колониями (SCV), которые определяются их медленной скоростью роста, приводящей к образованию колоний небольшого размера [22, 29, 30]. Помимо SCV, штаммы с нормальной морфологией колоний могут демонстрировать аналогичные паттерны «низкой токсичности», что позволяет им сохраняться внутриклеточно, не устраняясь защитными механизмами клетки-хозяина [28].Паттерн «низкой токсичности» может быть достигнут либо временно, путем изменения экспрессии генов, кодирующих токсины и / или регуляторы, либо навсегда, путем мутаций в глобальных регуляторах [31-33]. Действительно, во время длительных инфекций бактериальная адаптация происходит посредством геномных модификаций, включая перестройки генома и точечные мутации, которые накапливаются со временем и приводят к серьезным изменениям в экспрессии белков [5]. Эти модификации приводят к появлению высокоадаптированных клонов, которые обладают способностью лучше выживать и сохраняться в дыхательных путях пациентов с хроническими заболеваниями легких, чем их предки.
Чтобы получить более полное представление о молекулярных механизмах адаптации S. aureus к хронической иммунодефицитной среде легких, мы выбрали четыре пары последовательных изолятов S. aureus от 3 пациентов с МВ и пациента с дефектной выработкой антител IgG, страдающего от хронических заболеваний легких. Мы использовали комбинацию подходов секвенирования следующего поколения и масс-спектрометрии для обнаружения протеогеномных вариаций, а также интегрированные метаболомные и фенотипические подходы для углубленной характеристики S.aureus длительное сохранение при хронической легочной инфекции.
В целом представленные данные показывают, что персистентность S. aureus связана как с индивидуальной адаптацией пациента, так и с конвергентной эволюцией, что объясняет повышенную способность образовывать биопленку, а также выживать в клетках-хозяевах. Эти наблюдения должны дать информацию о терапевтических решениях, направленных на искоренение хронических инфекций S. aureus путем выбора лекарств, нацеленных на внедренные в биопленку и внутриклеточные бактерии.
Результаты
Отбор пациентов с
хронической инфекцией легких S. aureus
Больница Necker-Enfants Malades (Париж, Франция) собирала клиническую и микробиологическую информацию о пациентах с CF и другими хроническими заболеваниями легких, начиная с 2008 г. назвали больных ХП для хронически инфицированных пациентов).
Пациент CP1 (мутация F508del + / + CFTR) неоднократно лечился комбинацией рифампицина и фузидовой кислоты для метициллин-резистентного S.aureus (MRSA) и ципрофлоксацин, цефтазидим и меропенем вместе с ингаляционным тобрамицином или колимицином для P. aeruginosa . Мы выбрали ранний изолят (CP1_early) из 2012 г. и поздний изолят (CP1_late) из 2015 г.
Пациент CP3 (мутация F508del / R347P CFTR) лечился комбинацией амоксициллин-клавуланата и триметоприм-сульфаметоксазола (SXT), а также получил иногда миноциклин и стрептограмины при обострениях бронхов. Мы выбрали ранний изолят (CP3_early) из 2009 г. и поздний изолят (CP3_late) из 2015 г.
Пациент CP4 (мутация F508del + / + CFTR) продемонстрировал коинфекцию с P. aeruginosa , что потребовало многократного внутривенного введения антибиотиков, включая цефтазидим, амикацин и ципрофлоксацин. Мы выбрали ранний изолят (CP4_early) из 2008 г. и поздний изолят (CP4_late) из 2017 г.
Пациент CP2 не имел мутации CFTR, но имел первичное гуморальное иммунодефицитное расстройство с легким дефицитом IgG2, вызывающим хронический бронхит. Бронхиальные обострения лечили с помощью SXT.Мы выбрали ранний изолят (CP4_early) из 2009 г. и поздний изолят (CP4_late) из 2013 г.
Клональные отношения между
последовательными изолятами S. aureus
Клональные отношения серийных изолятов CP исследовали с помощью полногеномного секвенирования и in silico мультилокусное типирование последовательностей (MLST). Мы подтвердили, что каждая пара изолятов каждого пациента имела один и тот же уникальный тип последовательности и, следовательно, принадлежала к одному и тому же клону.
Четыре пары изолятов принадлежали четырем отдельным клонам (ST8 для пациента CP1, ST15 для пациента CP3, ST5 для пациента CP4 и вариант с двумя локусами ST45 для пациента CP2), разделенных интервалами от 3 до 9 лет.Мы использовали четыре общедоступных эталонных штамма и создали дендрограмму, показывающую кластеризацию изолятов каждого пациента с выбранным эталонным штаммом (см. Методы) (, рис. 1, ).
Рис. 1. Выбор четырех пар изолятов S. aureus , принадлежащих к четырем различным ST, у четырех пациентов.
Дендрограмма, созданная wgsa.net из геномов восьми клинических изолятов, полученных из респираторных образцов четырех пациентов с хронической инфекцией легких, и четырех эталонных геномов из общедоступных баз данных.Длина ответвления пропорциональна количеству вариантов нуклеотидных сайтов в основных генах. Для каждого пациента (от CP1 до CP4) изолят, взятый первым, называется «ранним», а изолят, взятый позже, — «поздним». Указаны даты отбора проб и тип последовательности (ST) изолятов. «ТА» и «РА» означают, что изолят ауксотрофен по тимидину или пантотенату соответственно. Название изолята отображается красным цветом, если он устойчив к метициллину (MRSA). Включены контрольные штаммы PFESA1902 (ERR554197), st1307 (ERR158691), PFESA1195 (ERR554722).
Геномный анализ адаптации
S. aureus во время длительного инфицирования легких
Геномы всех клинических изолятов были собраны de novo и кодирующие последовательности ДНК (CDS) были аннотированы. Базовые метрики сборки доступны в S1 Table . Прогнозируемые белки были дополнительно классифицированы по функциональным категориям eggNOG. Геномная эволюция изучалась с помощью однонуклеотидных полиморфизмов (SNP), анализа коротких вставок и делеций (инделек) и поиска более крупных событий делеций / вставок.Общие характеристики обнаруженных мутаций приведены в Таблице 1 . Как и ожидалось, общее количество полиморфизмов увеличивалось с увеличением времени разделения ранних и поздних изолятов. Большинство SNP были миссенс-вариантами, встречающимися в CDS. Как часто наблюдается во время долгосрочной эволюции клонов внутри хозяина [11, 34, 35], уменьшение генома было доказано для 4 клонов с поздними изолятами, имеющими уменьшенный размер генома (с генетической потерей в диапазоне от 10 до 81 т.п.н.) по сравнению с к ранним изолятам ( S1 Table ).Большие делеции представляли собой плазмиды или области профага, потерянные во время хронической инфекции ( S2 Таблица ).
Следует отметить, что несинонимичные мутации, приобретенные поздними изолятами, были обнаружены в основном в генах, участвующих в метаболических процессах ( Рис. 2A ), а более конкретно в функциональных категориях «транспорт и метаболизм аминокислот» и «транспорт и метаболизм углеводов» ( S3 Таблица ) (, например, гены trpA и serA ). Несинонимичные мутации, приобретенные поздними изолятами, также часто встречаются в категории «хранение и обработка информации», которая включает белки, участвующие в процессах репликации, трансляции и репарации ( e.g., polC и holB гены ). Генетические вариации генов вирулентности включают миссенс-мутации в генах, кодирующих сильно вариабельные поверхностные белки, такие как белок A и SdrH. Изменение протеина А может привести к снижению способности S. aureus вызывать воспаление [36].
Рис. 2. Протеогеномный и метаболомный анализ четырех пар изолятов S. aureus .
( A ) Вертикальные гистограммы показывают функциональную классификацию белков, кодируемых генами с несинонимичными мутациями в геномах поздних изолятов S.aureus по сравнению с ранними изолятами. Варианты были обнаружены и аннотированы инструментом Snippy. Горизонтальные гистограммы показывают функциональную классификацию дифференциально экспрессируемых аннотированных белков на поздних стадиях по сравнению с ранними изолятами каждого пациента. Для каждой категории гистограммы представляют количество белков с пониженной и повышающей регуляцией по данным протеомного анализа с использованием пороговых значений <2 и> 2, соответственно. Функциональная классификация была проведена с использованием функциональных категорий eggNOG с последующим ручным курированием.Включены только гены и белки с функциональной аннотацией. Категория «клеточные процессы и передача сигналов» включает регуляторные белки и белки, участвующие в синтезе клеточной стенки и капсулы. Категория «хранение и обработка информации» включает белки, участвующие в процессах репликации, трансляции и восстановления. Категория «метаболизм» включает белки, участвующие в метаболизме и транспорте. Категория «вирулентность» включает экзотоксины, белки, участвующие в адгезии, формировании биопленок и иммуномодуляции.( B ) Классификация по 8 категориям измененного количества метаболитов в поздних изолятах по сравнению с ранними изолятами. Метаболиты были обнаружены путем проведения 2 независимых экспериментов в трех повторностях. TCA, цикл трикарбоновых кислот; PPP, пентозофосфатный путь; Nucl, нуклеотиды; КоА, коэнзим А; AA, аминокислоты.
Мы предположили, что первые изолятов S. aureus уже присутствовали в легких пациентов с МВ в течение нескольких месяцев или лет на момент отбора проб и, таким образом, вероятно, уже приобрели адаптивные мутации.Поэтому сначала мы провели поиск несинонимичных мутаций в этих ранних изолятах по сравнению с эталонными штаммами. Мы сосредоточились на мутациях, которые могут иметь наибольшее влияние (, т.е. , преждевременный стоп-кодон), и обнаружили, что CP1_early имеет преждевременные стоп-кодоны в генах hisD, rarD и ausA ; CP2_early в SDRC ; CP3_early в trpE; и CP4_early в сек A1 ( S4 Table) .Во время хронических инфекций конвергентная эволюция, скорее всего, происходит в ответ на общее давление отбора, наиболее распространенным из которых является лечение антибиотиками. Поэтому мы провели поиск в наших секвенированных геномах, локусы, которые были независимо изменены несинонимичными мутациями в нескольких изолятах, что могло быть признаком адаптивной параллельной эволюции. Примечательно, что мы обнаружили, что 12 генов имели несинонимичные мутации в изолятах S. aureus по крайней мере от трех из четырех пациентов с ХП (SAUSA300_0203, mtlR, sdrC, ebh, tagB, cvfC, gatA, agrC, lctP2, clpL, feoB , asp2 ) по сравнению с эталонными штаммами ( S5 таблица) .
Затем мы провели поиск несинонимичных мутаций в поздних изолятах по сравнению с родственными ранними изолятами и обнаружили четыре гена, мутировавшие в позднем изоляте, по крайней мере, у двух пациентов ( S4, таблица ). Эти четыре гена кодируют: i) SaeR, регулятор, участвующий в контроле экспрессии экзопротеинов, ii) киназу A жирных кислот FakA, участвующую в образовании биопленок [13] и экспрессию генов вирулентности [37], iii) тимидилатсинтазу ThyA, участвует в метаболизме пиримидина, инактивация которого придает фенотип SCV и устойчивость к SXT, и iv) очень большой связанный с клеточной стенкой фибронектин-связывающий белок Ebh.
Таблица 1.
Общие характеристики обнаруженных мутаций
Протеомный анализ целых клеток ранних и поздних
изолятов S. aureus
Четыре пары изолятов собирали для протеомного анализа на постэкспоненциальной фазе роста. Различия в экспрессии белков каждого позднего изолята анализировали и сравнивали с их родственным ранним изолятом (фиг. 3A, фиг. S1A) . Мы сосредоточились на белках с разницей обнаружения не менее 2 в log2 (интенсивность) после нормализации.
Рис. 3. Пациент CP4 выделяет S. aureus , эволюция внутри хозяина.
Визуализация тепловой карты и анализ иерархической кластеризации профилей белков ( A ) и метаболитов ( B ) ранних / поздних изолятов CP4 S. aureus . Изоляты культивировали до стационарной фазы в среде, имитирующей дыхательную жидкость пациентов с муковисцидозом (среда Cystic Fibrosis Sputum Medium или CFSM) с добавлением тимидина. (A) Визуализация тепловой карты протеомного профилирования.Был проведен один эксперимент с тремя биологическими повторностями. Ряды: белки; столбцы: образцы; Цветная клавиша указывает значение относительной концентрации белка (желтый: самый низкий; синий: самый высокий). Список белков находится в таблице S7 . (B) Визуализация тепловой карты профилирования метаболитов. Представлены 50 самых изменчивых соединений. Было проведено два независимых эксперимента с тремя биологическими повторностями. Строки: метаболиты; столбцы: образцы; Цветная клавиша указывает значение относительной концентрации метаболита (синий: самый низкий; красный: самый высокий).Список метаболитов находится в таблице S8 .
Все белки экстрагировали, расщепляли до пептидов и анализировали масс-спектрометрией LC-MS / MS. Обнаруженные пептиды были сопоставлены с пользовательской базой данных, содержащей белки USA300 (NC_007793.1) и все предсказанные белки из аннотации генома клинических изолятов.
Функциональные категории белков
Белки были отнесены к функциональным категориям eggNOG. Самая большая категория белков, которые должны дифференциально экспрессироваться для всех пар, включала белки, относящиеся к процессам метаболизма (и, более конкретно, к категории «транспорт и метаболизм аминокислот») ( Рис. 2A ; S7 Таблица ).Примечательно, что у трех пациентов экспрессия белков, участвующих в путях деградации мочевины и / или биосинтеза аргинина, была изменена в поздних изолятах по сравнению с ранними изолятами.
В целом функциональная категория «транспорт и метаболизм аминокислот» оказалась наиболее затронутой как с точки зрения генетических модификаций, так и с точки зрения уровней экспрессии белка, что предполагает центральную роль соответствующих путей во время адаптации внутри хозяина.
Категория «клеточные процессы и передача сигналов», включающая регуляторные белки, была второй по величине категорией белков, дифференциально экспрессируемых.Действительно, белки регуляторных сетей Agr, Rot, Sae, Sar или Fur по-разному экспрессировались во всех поздних изолятах. Кроме того, SdrD, который играет роль в адгезии, инвазии и уклонении от иммунитета [38], был активирован в поздних изолятах трех пациентов. Кроме того, белок SAUSA300_1236 (аннотированный как белок с неизвестной функцией, содержащий домен CAP) подавлялся в поздних изолятах трех пациентов.
Профили белков
У пациента с CP1 мутация гена agrC , обнаруженная в позднем изоляте, оказала плейотропный эффект на протеом.Действительно, дельта-гемолизин, PSMb1 и AgrA подавлялись в позднем изоляте, тогда как белки, кодируемые генами spa, sbi, fnbA, rot и coa , были активированы. Кроме того, адгезины, кодируемые sasG, efb, sdrD и ecb , подвергались повышенной регуляции. В целом, этот паттерн экспрессии предполагает, что поздний изолят CP1 развил низкую вирулентность и высокую адгезивность.
У пациента CP2 в изоляте CP2_late была обнаружена мутация в гене thyA .Поразительно, что продукты оперона pabBC (участвующие в пути биосинтеза фолиевой кислоты) были активированы, вероятно, для компенсации дисфункции тимидилатсинтазы [39]. В отличие от того, что обычно описывается для мутантов thyA [40], в изоляте CP2_late была повышена регуляция AgrA и AgrC, что приводило к сопутствующей повышающей регуляции продуктов генов hld и geh и к понижающей регуляции FnbA. . Этот паттерн экспрессии предполагает, что поздний изолят CP2 сохранил вирулентные свойства.
У пациента CP3 мутация гена thyA , обнаруженная в позднем изоляте, была связана с понижающей регуляцией регулона agr (что приводило к понижающей регуляции гена hld, saeP, lip и geh . продукты) [40]. Этот паттерн экспрессии предполагает, что, как и в случае позднего изолята CP1, поздний изолят CP3 эволюционировал в сторону низкой вирулентности и высокой адгезии. Кроме того, как и ожидалось, продукты генов dinG, и thiM , которые содержали сдвиг рамки считывания, и thyA , которые несли преждевременный стоп-кодон, не были обнаружены в изоляте CP3_late по сравнению с CP3_early изолятом.
У пациента CP4 сдвиги рамки считывания в генах fakA и panB были связаны с отсутствием экспрессии родственных белков в изоляте CP4_late. Следует отметить, что дефект в экспрессии fakA был связан с повышенной способностью к формированию биопленок [13] и подавлением регулона SaeR [37]. Кроме того, дефект в экспрессии panB ранее был связан с ауксотрофией и персистенцией пантотената [41]. Мы подтвердили как ауксотрофию пантотената (, рис. 4, ), так и повышенное образование биопленок в изоляте CP4_late (, рис. 5, ) (см. Ниже).Кроме того, адгезины, кодируемые sdrD и sasF , были активированы, что свидетельствует о гиперадгезивном фенотипе.
Рис. 4. Рост последних клинических изолятов S. aureus в CFSM.
Кривые роста получали в CFSM с добавлением тимидина или пантотената или без него. Показанные результаты соответствуют репрезентативному эксперименту для изолята CP1_late ( A ), изолятов CP2_late и CP3_late ( B ) и изолята CP4_late ( C ).Оранжевая и зеленая кривые соответствуют росту бактерий в среде с добавлением тимидина или пантотената; красная и синяя кривые — рост бактерий в среде без тимидина или пантотената. Вашингтон, США 300-LAC.
Рис. 5. Количественная оценка образования биопленок у клинических изолятов S. aureus . Количественную оценку образования биопленок
проводили с использованием микротитровального анализа кристаллическим фиолетовым в среде BHI с 1% глюкозы. Показанные результаты представляют собой среднее значение ± стандартное отклонение для трех независимых экспериментов, проведенных в трех повторностях.Статистическая значимость была измерена с использованием двухстороннего t-критерия Стьюдента, когда образование биопленки позднего изолята сравнивали с производством биопленки родственного раннего изолята от того же пациента. ** указывает значение p <0,001, тогда как ns указывает значение p> 0,05.
В целом протеогеномные данные позволяют предположить, что все поздние изоляты, кроме CP2_late, эволюционировали в направлении высокоадгезивных и низковирулентных свойств.
Метаболомный анализ целых клеток ранних и поздних
S.aureus , изоляты
Параллельно с протеомными анализами, описанными выше, четыре пары изолятов собирали для целевого метаболомного анализа в фазе постэкспоненциального роста. Этот анализ, выполненный с помощью масс-спектрометрии, позволил нам измерить относительные концентрации центральных и промежуточных метаболитов ряда метаболических путей, включая гликолиз / глюконеогенез, пентозофосфатный путь, цикл TCA, биосинтез нуклеотидов, свободные жирные кислоты, коферменты и аминокислоты.
Функциональные категории метаболитов
Обнаруженные метаболиты были разделены на 8 категорий ( Рис. 2B ). Поразительно, но наиболее измененной категорией в позднем изоляте всех четырех пациентов по сравнению с их родственными ранними изолятами была категория аминокислот. Эти данные согласуются с протеогеномными результатами и подтверждают центральную роль метаболизма аминокислот во время адаптации внутри хозяина.
Сравнение профилей метаболитов
Различие в профилях метаболизма между ранними и поздними изолятами пациентов с ХП подчеркивается тепловыми картами, показанными на рис. , S1B, и , рис. 3B, .Список метаболитов с измененным количеством в четырех парах изолятов приведен в таблице S8.
У пациента CP1 профиль метаболитов, который показывает заметное снижение цитрата и цис-аконитата, четко указывает на снижение активности цикла лимонной кислоты. Наблюдается резкое снижение содержания аргинино-сукцината, что соответствует увеличению белков ArgF, ArgG и ArgH, обнаруженному в протеомном анализе. У пациента с CP2 резкое снижение орнитина, вероятно, вызвано уменьшением белка ArcA (аргининдезиминазы), обнаруженным в протеомном анализе.Действительно, ферментация аргинина в орнитин зависит от оперона arc . Также было зарегистрировано сильное снижение количества треонина. В S. aureus треонин синтезируется из аспартата и служит предшественником для синтеза изолейцина аминокислоты с разветвленной цепью. Следует отметить, что путь биосинтеза треонина, как было показано, важен для вирулентности S. aureus у мышей и важен для стафилококковой инфекции кровотока [42].
У пациента CP3 снижение уровня фосфоенолпирувата коррелирует с уменьшением белка GapB (глицеральдегид-3-фосфатдегидрогеназа), тогда как снижение ADP коррелирует с отсутствием экспрессии ThiM (гидроксиэтилтиазолкиназы), обнаруженным в протеомном анализе (из-за сдвиг рамки считывания в гене thiM ).
У пациента с CP4 резкое уменьшение пантотената, кофермента A и дефосфокофермента A соответствует сдвигу рамки считывания в гене panB и последующему отсутствию экспрессии белков PanB и PanC. Действительно, пантотеновая кислота является предшественником кофермента А [43]. Кроме того, резко снизилось содержание цистина и цистатионина. У бактерий цистеин синтезируется из серина путем включения сульфида или тиосульфата. Цистеинсодержащие молекулы, такие как глутатион и тиоредоксин, играют важную роль в поддержании внутриклеточной восстанавливающей среды и защите от окислительного стресса.В S. aureus свободный цистеин, восстановленный кофермент А и другие тиолы могут помочь поддерживать окислительно-восстановительный баланс тиолов. Следовательно, дефект биосинтеза цистеина может повлиять на синтез белка и выживаемость S. aureus при голодании. Кроме того, что касается пациента CP3, снижение уровня фосфоенолпирувата коррелирует с уменьшением белка GapB, а у пациента CP1 наблюдается снижение активности цикла лимонной кислоты с заметным снижением цитрата и цис-аконитата.
Более того, в изолятах CP2_late и CP3_late, которые обнаруживают изменение гена thyA (связанное с фенотипом SCV, см. Ниже), мы обнаружили снижение содержания аспарагина, что согласуется с предыдущими данными, показывающими снижение содержания аспартата в SCV [27 ].Аспарагин напрямую связан с циклом лимонной кислоты через промежуточный оксалоацетат; следовательно, уменьшение аспарагина связано со сниженной активностью цикла лимонной кислоты.
В целом, метаболическое профилирование предполагает, что четыре поздних изолята развили пониженную активность цикла лимонной кислоты по сравнению с родственными ранними изолятами.
Функциональная характеристика изолятов
S. aureus
Сначала мы исследовали рост четырех пар изолятов в бульоне (на твердой среде и в жидкой культуре; Рис. 4, Рис. S2 и Рис. S3 ), определили их антибиотик. профили восприимчивости и их способность образовывать биопленку ( фиг. S4 и фиг. S5 ).
Ростовые свойства в бульоне
Морфология колоний на чашках с агаром для инфузии мозга и сердца (BHI) была аналогична таковой у USA300-LAC или немного меньше для всех изолятов, за исключением поздних изолятов пациентов CP2 и CP3, которые демонстрировали типичный фенотип SCV с очень маленькие колонии ( Fig S2 ). Изоляты CP2_late и CP3_late также не смогли вырасти на чашках Мюллера-Хинтона, что позволяет предположить, что они приобрели ауксотрофию по крайней мере для одного из соединений, отсутствующих в агаризованной среде Мюллера-Хинтона, таких как тимидин, гемин или менадион (которые присутствуют в агаровой среде Мюллера-Хинтона). BHI).Поскольку ранее было показано, что тимидин-зависимые SCV часто выделяются из дыхательных путей пациентов с МВ [44], мы сначала отслеживали рост двух SCV-подобных изолятов в определенной среде, имитирующей дыхательную жидкость пациентов с муковисцидозом (Cystic Fibrosis Sputum Medium или CFSM) [45] ( Рис. 4 ). Как и ожидалось, изоляты CP2_late и CP3_late демонстрировали серьезный дефект роста в отсутствие тимидина, тогда как добавление тимидина восстанавливало рост почти дикого типа ( i.е., аналогично тому, что было записано с USA300-LAC, Рис. 4B ). Как упоминалось ранее и в соответствии с этими наблюдениями, геномный анализ выявил мутацию в гене thyA для обоих изолятов. Кроме того, изолят CP4_late демонстрировал умеренно замедленный рост по сравнению с USA300-LAC, который не корректировался добавлением тимидина в среду (не показано). Как упоминалось ранее, геномный анализ изолята CP4_late показал «срыв рамки» в гене panB , который участвует в биосинтезе пантотеновой кислоты de novo .Действительно, рост изолята CP4_late в присутствии пантотената восстанавливает рост дикого типа (, фиг. 4C, ).
Чувствительность к антибиотикам
Анализы чувствительности к антибиотикам показали, что изоляты пациентов с СР1 и СР4 были устойчивы к метициллину, тогда как изоляты пациентов с СР2 и СР3 были чувствительны к метициллину. Кроме того, 2 изолята SCV (CP2_late и CP3_late) были устойчивы к SXT, что согласуется с тем фактом, что оба пациента получали этот антибиотик.Мутация P48R и преждевременный стоп-кодон (W88X) были обнаружены в гене thyA в геномах CP2_late и CP3_late, соответственно, что полностью поддерживает ауксотрофию тимидина и устойчивость к SXT этих изолятов.
Следует отметить, что поздний изолят пациента CP4 приобрел устойчивость к фторхинолонам, что соответствовало введению ципрофлоксацина этому пациенту. Мутация F226S, обнаруженная в гене gyrB в геноме CP4_late, может объяснить эту устойчивость к фторхинолонам.Последний изолят пациента CP3 приобрел устойчивость к циклинам, соответствующую введению миноциклина этому пациенту. Аминокислотная замена K57M в рибосомном гене S10 была обнаружена в геноме CP3_late. Примечательно, что недавно было показано, что два клинических изолята S. aureus с мутацией в этой же области белка S10 (делеция остатков 56-59; и двойной мутант K57M, Y58F) придают устойчивость к тигециклину [46].
Образование биопленок
Бактерии часто растут в организованных сообществах, известных как биопленки, что способствует их устойчивости.Предполагая, что изоляты, полученные от хронических инфекций, могут иметь более высокую способность к формированию биопленок, чем изоляты, полученные от острых инфекций, мы изучили способность к формированию биопленок четырех пар изолятов. Примечательно, что восемь клинических изолятов продемонстрировали большую способность к образованию биопленок по сравнению с эталонным штаммом USA300-LAC (значение p <0,001, , рис. S4, ). Кроме того, у трех пациентов поздние изоляты образовывали больше биопленок, чем ранние изоляты, что позволяет предположить, что долговременная адаптация улучшила их способность к образованию биопленок (значение p <0.001, , фиг. S5 ).
Изоляты S. aureus демонстрируют повышенную персистентность в эпителиальной клеточной линии CFBE-F508del
Многочисленные исследования показали, что внутриклеточная выживаемость, вероятно, играет важную роль в долговременной инфекции [16]. Более того, наши результаты свидетельствуют о том, что большинство изменений, обнаруженных в кодирующих последовательностях, экспрессии белков и метаболитов, влияют на метаболические пути и особенно на метаболизм аминокислот, что свидетельствует о пищевой адаптации к нише.Поэтому мы решили проверить, может ли такая адаптация к питанию способствовать внутриклеточной устойчивости.
Для оценки способности изолятов S. aureus сохраняться внутриклеточно, мы инфицировали как линию бронхиальных эпителиальных клеток CFBE 41o (гомозиготную по мутации F508del-CFTR), так и CFBE плазмидой, обеспечивающей экспрессию CFTR дикого типа. Мы протестировали 4 пары клинических изолятов, контрольный штамм USA300-LAC и стабильный мутант SCV, измененный в пути биосинтеза гемина (далее называемый Δ hem ).Инфекцию преследовали в течение 6 дней с использованием анализа защиты от гентамицина для предотвращения роста внеклеточных бактерий, как описано ранее [20]. Как и ожидалось, количество внутриклеточных бактерий дикого типа резко уменьшалось в ходе инфекции, тогда как мутант Δ hem был способен сохраняться внутриклеточно в течение всего периода эксперимента ( Fig. S5 ). Поразительно, что на 6-й день после инфицирования все клинические изоляты были способны сохраняться по крайней мере в 19 раз и до 452 раз больше, чем эталонный штамм USA300-LAC (, рис. 6, ).У 3 пациентов с муковисцидозом поздние изоляты продемонстрировали улучшенную способность сохраняться внутриклеточно в эпителиальных клетках CFBE-F508del по сравнению с родственными ранними изолятами на 6-й день после инфицирования ( фиг. 6, ). Следует отметить, что этого не наблюдалось для CP2, который не является пациентом с МВ. Интересно, что два поздних изолята с ауксотрофией по тимидину (, т.е. , поздние изоляты CP2 и CP3) имели пониженную способность персистировать в эпителиальных клетках CFTR дикого типа (CFBE-WT), экспрессирующих CFBE, тогда как на 6 день после инфицирования эти тимидиновые Изоляты ауксотрофов сохраняются лучше или одинаково хорошо, чем родственные ранние изоляты в эпителиальных клетках CFBE-F508del (, рис. 6, рис. S6, ).
Рис. 6. Внутриклеточная персистенция клинических изолятов S. aureus в эпителиальной клеточной линии CFBE-F508del.
Линия бронхиальных эпителиальных клеток CFBE (CFBE-F508del, гомозиготная по мутации F508del-CFTR) была инфицирована контрольным штаммом USA300-LAC и клиническими изолятами. Гентамицин присутствовал на протяжении всего эксперимента, чтобы предотвратить рост внеклеточных бактерий и новую инфекцию. Бактериальную нагрузку внутри клеток оценивали подсчетом КОЕ через 6 дней после заражения. Результаты нормализованы с использованием штамма USA300-LAC в качестве эталона и выражены как кратное изменение КОЕ.Показанные результаты представляют собой среднее значение ± стандартное отклонение для двух независимых экспериментов, выполненных в трех повторностях (результаты через 3 дня после заражения и в пределах CFBE_WT показаны на , рис. S6, ). Статистический анализ проводился с помощью непарного двустороннего критерия Стьюдента.
Последний изолят
S. aureus пациента CP4 демонстрирует повышенную устойчивость в первичных эпителиальных клетках пациента F508del.
Пациент CP4 обнаруживает мутацию F508del + / + CFTR. Чтобы подтвердить актуальность результатов, полученных с линией эпителиальных клеток бронхов CFBE, мы оценили устойчивость изолятов CP4 в первичных эпителиальных клетках, выделенных из носа пациента CP4 и от здорового донора.Этот эксперимент предоставляет уникальную возможность проверить специфичность S. aureus , выздоровевшего после длительной инфекции, в рамках адаптации пациента. Эксперимент (проведенный один раз в трех повторностях) подтвердил, что способность к сохранению позднего изолята улучшается по сравнению с ранним изолятом на 3 и 6 день как в первичных назальных эпителиальных клетках, полученных от здорового донора, так и от пациента CP4 (рис. 7) .
Рис. 7. Внутриклеточная персистенция клинических изолятов CP4 S. aureus в первичных эпителиальных клетках пациента F508del.
Первичные эпителиальные клетки носа, полученные от здорового донора (первичные клетки WT) и от пациента CP4 (первичные клетки CP4 с мутацией F508del + / + CFTR), инфицировали контрольным штаммом USA300-LAC и изолятами CP4. Гентамицин присутствовал на протяжении всего эксперимента, чтобы предотвратить рост внеклеточных бактерий и новую инфекцию. Бактериальную нагрузку внутри клеток оценивали подсчетом КОЕ через 3 и 6 дней после заражения. Результаты нормализованы с использованием штамма USA300-LAC (WT) в качестве эталона и выражены как кратное изменение КОЕ.Показанные результаты представляют собой среднее значение ± стандартное отклонение для одного эксперимента, проведенного в трех повторностях.
Методы
Пациенты и бактериальные изоляты
Клетки носового эпителия (клетки HNE) были взяты путем чистки носа обеих ноздрей после локальной визуализации слизистой оболочки носа у одного здорового добровольца и пациента CP4.
Эпидемический клон S. aureus USA300-LAC (обозначенный WT) был предоставлен Biodefense and Emerging Infections Research Resources (BEI). Производное USA300-LAC с делецией в пути гемина (мутант с тройной делецией ΔhemDBL ), участвующее в системе транспорта электронов, было ранее сконструировано для получения штамма со стабильным SCV-фенотипом [20].
Изоляты S. aureus выращивали на бульоне для инфузии сердца мозга (BHI) и чашках с агаром. Морфотипы колоний оценивали через 24 часа роста на чашках с агаром BHI или Мюллера-Хинтона.
По показаниям, изолята S. aureus культивировали в среде, имитирующей дыхательную жидкость пациентов с муковисцидозом (Cystic Fibrosis Sputum Medium или CFSM) [45] с добавлением или без добавления тимидина (100 мкг / мл) или пантотената ( 50 мкг / мл).
Секвенирование и анализ всего генома
Геномную ДНК экстрагировали с использованием набора DNeasy Blood and Tissue Kit с 10 мкг / мл лизостафина для облегчения лизиса клеток.Геномные библиотеки получали с использованием набора Nextera XT, мультиплексировали и секвенировали на приборе Illumina MiSeq (секвенирование парных концов 2 × 150).
Короткие чтения были обработаны с использованием программного обеспечения биоинформатического конвейера Nullarbor v1.20 (доступно по адресу: https://github.com/tseemann/nullarbor). Вкратце, необработанные чтения были обрезаны с помощью trimmomatic [47], de novo собраны с использованием SPAdes 3.9.0 [48] и аннотированы с помощью Prokka v1.11 [49]. Однонуклеотидный полиморфизм (SNP) и небольшие индели оценивали с помощью Snippy v3.1 (https://github.com/tseemann/snippy). Служба поиска похожих геномов онлайновой базы данных PATRIC 3.5.2 использовалась для определения наиболее сходного общедоступного генома для каждой пары клинических изолятов (https://www.patricbrc.org/app/GenomeDistance). Snippy использовался как для сопоставления считываний поздних изолятов с аннотированной сборкой раннего изолята, так и для сопоставления считываний ранних и поздних изолятов с общедоступным ближайшим эталонным геномом для четырех пар. Snippy классифицирует варианты по их предполагаемому функциональному эффекту на основе сопоставления с аннотированным эталонным геномом в синонимичных, несинонимичных или усеченных последовательностях, кодирующих белок.
Сборки, созданные Nullarbor, были загружены на сервер RAST [50], а также аннотированы через конвейер аннотаций RAST с использованием схемы аннотаций ClassicRAST. «Инструмент сравнения на основе последовательностей» сервера RAST, основанный на поиске сходства белков BLAST, использовался для идентификации больших вставок и делеций каждого позднего изолята по сравнению с ранним изолятом в качестве эталона.
Последовательности, представленные в этом документе, доступны в базе данных BioProject NCBI под регистрационным номером PRJNA446073 (http: // www.ncbi.nlm.nih.gov/bioproject/446073).
Количественная оценка образования биопленок
Для определения образования биопленок в статических условиях клинические изоляты, а также контрольные штаммы культивировали в среде Brain Heart Infusion (BHI) в присутствии 1% глюкозы. Эталонные штаммы включают USA300-LAC, который является слабым продуцентом биопленок, и его производное ΔagrC , которое является сильным продуцентом биопленок (получено из BEI Nebraska Transposon Mutant Library). Ночные культуры разбавляли до OD600 нм 0.05 в свежей среде BHI с добавлением 1% глюкозы. Всего 200 мкл каждой разведенной культуры высевали в два полистирольных 96-луночных планшета в трех экземплярах и инкубировали в течение 48 часов при 37 ° C без встряхивания. Через 24 ч роста среду обновляли. Через 48 часов один из 96-луночных планшетов использовали для оценки роста бактерий, принимая во внимание как бактерии в суспензии, так и прилипшие бактерии (ресуспендированные механически) и измеряя OD 600 нм. Другой 96-луночный планшет использовали для количественной оценки образования биопленок.Лунки трижды промывали дистиллированной H 2 O для удаления непривязанных бактерий, и биопленку, закрепленную на дне лунок, окрашивали 100 мкл 2% раствора кристаллического фиолетового в течение 15 мин. После окрашивания лунки трижды промывали дистиллированной H 2 О. Кристаллический фиолетовый солюбилизировали, используя 150 мкл 30% уксусной кислоты. 100 мкл солюбилизированного красителя переносили в новый 96-луночный планшет для определения оптической плотности при 540 нм.
Антимикробная чувствительность
Антимикробная чувствительность изолятов оценивалась методом дисковой диффузии.Тесты Etest использовали для определения минимальных ингибирующих концентраций гентамицина. Тесты на чувствительность проводили на чашках с агаром BHI, чтобы обеспечить рост ауксотрофных изолятов.
Эксперименты по культуре клеток
Клеточная линия муковисцидоза бронхиального эпителия CFBE41o-, которая представляет собой иммортализованную клеточную линию, гомозиготную по мутации delF508, и клеточная линия CFBE, дополненная для экспрессии WT CFTR, были щедро предоставлены Дитером Грюнертом (Университет Калифорнии, Сан-Франциско) [51].Их культивировали в минимальной необходимой среде (MEM) с добавлением 10% фетальной бычьей сыворотки (FBS) и содержащей 300 мкг / мл гигромицина B, 1% пенициллина / стрептомицина и 1% амфотерицина B.
Были получены первичные назальные эпителиальные клетки (HNE). как описано в [52] и культивировали в среде Игла, модифицированной Дульбекко, смешанной 1: 1 с Ham’s F-12 (DMEM: F12) с добавлением 10% FBS, 1% об. / об. незаменимых аминокислот, 90 мкг / 10 мкг / мл пиперациллина / тазобактама и 1% амфотерицина B.
В предыдущих анализах инфекции эпителиальные клетки высевали в лунки без покрытия для CFBE и лунки, покрытые коллагеном для HNE, и все антибиотики удаляли из культуральной среды.Эпителиальные клетки инфицировали с множественностью инфекции (MOI), равной 100, с использованием инокулята, взятого из культур S. aureus , выращенных в BHI до фазы экспоненциального роста. Через 1 ч 40 мин каждую лунку трижды промывали 1 мл фосфатно-солевого буфера (PBS), содержащего 300 мкг / мл гентамицина, для удаления внеклеточных бактерий. Промывание и добавление свежей среды, содержащей 50 мкг / мл гентамицина, повторяли на 3-й день. Гентамицин оказывает сильное бактерицидное действие на S. aureus USA300 (минимальные ингибирующие концентрации (МИК) = 2 мкг.мл -1 ) и очень плохое проникновение внутрь эукариотических клеток. Кроме того, измеренная МИК гентамицина всех клинических штаммов была ниже или равной 2 мкг / мл -1 . Инфицированные клетки содержались в увлажненной атмосфере с 5% CO2 при 37 ° C в течение 6 дней. Для подсчета жизнеспособных внутриклеточных персистирующих бактерий культуральную среду, содержащую гентамицин, удаляли из инфицированных клеток и лунки трижды промывали PBS, не содержащим антибиотиков. Эпителиальные клетки лизировали путем соскабливания 1 мл дистиллированной воды в течение 15 минут и серийные разведения клеточных лизатов высевали на агар BHI.Колониеобразующие единицы были пронумерованы через 48 ч при 37 ° C. Показанные результаты нормализованы со штаммом USA300-LAC039 в качестве эталона и выражены как кратное изменение КОЕ.
Протеомные анализы
Изоляты S. aureus выращивали в CFSM с добавлением тимидина (100 мкг / мл) в трех технических повторностях и собирали через 19 часов роста при 37 ° C при перемешивании (, т.е. , при постэкспоненциальном росте). фаза). Бактерии лизировали в PBS, содержащем 1 мМ CaCl2, 1 мМ MgCl2 и 10 мкг / мл лизостафина.
Белки переваривали и анализировали с помощью жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (наноЖХ-МС / МС). Для переваривания белков использовали метод подготовки образцов с помощью фильтра (FASP) [53, 54]. Затем белки восстанавливали в 100 мМ DTT в течение 30 минут при 60 ° C, смешивали с 8 М буфером мочевины, загружали на центробежные фильтры Microcon 30 кДа (Millipore) и алкилировали 50 мМ йодацетамидом. Фильтры дважды промывали 8 М мочевиной и дважды 50 мМ бикарбонатом аммония. После расщепления трипсином в течение ночи при 37 ° C образцы сушили в вакууме и хранили при -20 ° C до анализа масс-спектрометрии.
MS-анализ был выполнен, как было опубликовано ранее [54]. Высушенные пептиды ресуспендировали в 10% ACN, 0,1% TFA. Для каждого цикла 5 мкл (что соответствует приблизительно 1 мкг пептидов) вводили в МС nanoRSLC-Q Exactive PLUS (Dionex RSLC Ultimate 3000, Thermo Scientific, Waltham, MA). Пептиды разделяли на обращенно-фазовой жидкостной хроматографической колонке 50 см (Pepmap C18, Dionex). Растворителями для хроматографии были: (A) 0,1% муравьиная кислота в воде и (B) 80% ацетонитрил с 0,08% муравьиной кислоты.Пептиды элюировали из колонки со следующим градиентом: от 5% до 40% B в течение 120 минут, а затем от 40% до 80% B за 1 минуту. На 125 мин градиент был изменен на 5%, чтобы позволить повторно уравновесить колонку в течение 20 мин перед следующей инъекцией. Одну контрольную пробу с двумя 30-минутными линейными градиентами прогоняли между троекратными повторами для предотвращения переноса образца.
Пептиды, элюированные из колонки, анализировали с помощью зависимой от данных МС / МС с использованием метода сбора топ-10. Вкратце, настройки прибора были следующими: разрешение было установлено на 70 000 для сканирований MS и 17 500 для зависимых от данных сканирований MS / MS, чтобы увеличить скорость.Целевое значение MS AGC было установлено на 3,10 6 отсчетов, тогда как целевое значение AGC MS / MS было установлено на 5,10 4 . Диапазон сканирования МС составлял от 400 до 2000 m / z. Сканы МС и МС / МС были записаны в режиме профиля. Длительность динамического исключения составляла 20 с. Каждый образец был проанализирован в трех технических трех повторностях с помощью наноЖХ / МС / МС. Необработанные файлы MS обрабатывали с помощью программного обеспечения MaxQuant версии 1.5.8.3 и выполняли поиск с помощью поисковой системы Andromeda в пользовательской базе данных белков, содержащей 3 457 последовательностей белков.Для создания этой базы данных мы объединили белковые последовательности из аннотаций PROKKA и RAST всех клинических изолятов и аннотации MAGE USA300 (NC_007793.1) [55]. Избыточность набора последовательностей была уменьшена с помощью CD-HIT v4.6 [56] с порогом идентичности 80%. Для поиска исходной массы и фрагментных ионов мы установили отклонение массы на 4,5 и 20 частей на миллион соответственно. Минимальная длина пептида была установлена равной семи аминокислотам, и требовалась строгая специфичность расщепления трипсином, допускающая до двух пропущенных сайтов расщепления.Матч между запусками разрешен. Карбамидометилирование (Cys) было задано как фиксированная модификация, тогда как окисление (Met) и N-концевое ацетилирование белка были заданы как переменные модификации. Частота ложных открытий (FDR) на уровне белков и пептидов была установлена на 1%. Баллы рассчитывались в MaxQuant, как описано ранее [57]. Обратные и общие попадания загрязняющих веществ были удалены из выходных данных MaxQuant. Белки количественно определяли в соответствии с алгоритмом без метки MaxQuant, используя нормированные интенсивности количественного определения без метки (LFQ).Количественное определение белка проводили с использованием по меньшей мере двух пептидов на белок.
Статистический и биоинформатический анализ, включая тепловые карты и кластеризацию, был выполнен с помощью программного обеспечения Perseus (версия 1.6.0.7), которое свободно доступно на сайте www.perseus-framework.org [58]. Аннотации EggNOG для всех белков были получены с веб-сервера (последний доступ 2017-12-15) [59]. Имена генов были извлечены из AureoWiki [60] (последнее посещение — 15 декабря 2017 г.). Извлечение аннотаций GO, Keywords, EggNOG и Kegg pathway было выполнено с использованием Perseus.
Для точной количественной оценки мы проанализировали каждый изолят отдельно (3 образца из раннего и 3 образца из позднего сбора). Мы отфильтровали данные, чтобы сохранить только белки с как минимум 3 действительными значениями как минимум в одной группе (поздней или ранней). Затем данные были вменены для заполнения недостающих точек данных путем создания гауссовского распределения случайных чисел со стандартным отклонением 33% относительно стандартного отклонения измеренных значений и сдвигом среднего значения на 2,5 стандартного отклонения для моделирования распределения низких значений. значения сигнала.Чтобы различить дифференциальный белок между ранним и поздним для каждого изолята, мы выполнили t-тест, S0 = 0,1, и оставили только белки с FDR <0,05. Иерархическая кластеризация существенно разных белков была выполнена в Perseus по логарифмической интенсивности LFQ после нормализации данных по z-баллу с использованием евклидовых расстояний и параметров по умолчанию. Мы также выполнили T-тест, S0 = 0,1, FDR = 0,001, чтобы различать дифференциальные белки между поздними и ранними.
Метаболомический анализ
Профилирование метаболитов S.aureus проводили методом жидкостной хроматографии-масс-спектрометрии (ЖХ-МС), как описано [61]. Вкратце, изолята S. aureus выращивали в CFSM с добавлением тимидина в тех же условиях, что и для протеомных анализов. Метаболическая активность блокировалась погружением в жидкий азот на 10 сек. Метаболиты экстрагировали с использованием смеси растворителей метанол / ACN / h3O (50:30:20) при -20 ° C. Образцы встряхивали в течение 5 минут при 4 ° C, а затем центрифугировали при 16000 g в течение 15 минут при 4 ° C.Супернатанты собирали и анализировали с помощью ЖХ-МС с использованием колонки SeQuant ZIC-pHilic (Millipore) для разделения жидкостной хроматографией [61]. Растворителем водной подвижной фазы был 20 мМ карбонат аммония плюс 0,1% раствор гидроксида аммония, а подвижной органической фазой был ацетонитрил. Метаболиты разделяли линейным градиентом от 80% органической до 80% водной фазы в течение 15 мин. Температура колонки 48 ° C, скорость потока 200 мкл / мин. Метаболиты были обнаружены в диапазоне масс 75–1000 m / z с использованием масс-спектрометра Q-Exactive Plus (Thermo) с разрешением 35000 (при 200 m / z) с ионизацией электрораспылением и режимом переключения полярности.Замковые массы использовались для обеспечения точности определения массы ниже 5 ppm. Площади пиков различных метаболитов определяли с помощью программного обеспечения TraceFinder (Thermo), используя точную массу однозарядного иона и известное время удерживания на колонке для ВЭЖХ. Благодаря этому подходу мы смогли идентифицировать и измерить: глюкозу, глюкозу-6P (G6P), UDP-глюкозу (UDP-Glc), седогептулозу-7-P (SH-7P), рибозо-5-фосфат, глицеральдегид-3-фосфат, Лактат, пируват, фосфо-енолпируват (PEP), цитрат (Cit), цис-аконитат (цис-аконат), сукцинат (Suc), фумарат (Fum), малат (Mal), альфа-кетоглутарат (AKG), дигидроксиацетонфосфат (DHAP), N-карбамоил-L-аспартат, никотинамидадениндинуклеотид (NAD), NADH, никотинамидадениндинуклеотидфосфат (NADP), NADPH, аденин, аденозин, аденозинмоно, ди- и трифосфат (АТФ), АМФ , Цитидин, цитидин моно, ди и трифосфат (CMP, CDP, CTP), уридин моно, ди и трифосфат (UMP, UDP, UTP), гипоксантин, гуанин, гуанаозин, гуанидин моно и дифосфат (GMP, GDP), монофосфат инозина (IMP), пантотенат, дефосфо-кофермент A, кофермент A (CoA), флавинадениндинуклеотид (FAD), ниацин, никотинамид, 3-гидроксибутират, урат, 5-оксо-L-пролин, ацетил-аспартат , Ацетил-глутамин, Алани ne, аргинин, аргининосукцинат, аспарагин, аспартат, бетаин, цитруллин, цистатионин, цистин, глутамин, глутамат, глицин, гистидин, изолейцин, лейцин, саркозин, лизин, метионин, орнитин, аденилал, фенурилал L-метионин, треонин, триптофан, тирозин, валин, масляная кислота, карнитин, декановая кислота, лауриновая кислота, гексановая кислота, линолевая кислота, миристиновая кислота, октановая кислота, олеиновая кислота, пальмитиновая кислота.
Статистический анализ проводился с использованием программного обеспечения MetaboAnalyst 4.0 [62]. Алгоритм кластеризации тепловой карты был основан на измерении расстояния Пирсона для сходства и методе связи Уорда для кластеризации биотипов. Метаболиты с похожей структурой обилия располагались ближе друг к другу.
Статистический анализ
Данные анализировали с помощью программ Excel или GraphPad Prism. Результаты представлены либо с одним репрезентативным экспериментом, либо в виде среднего значения ± стандартное отклонение (SD).Количество биологических и технических повторов указано на рисунке.
Для двухвыборочных сравнений статистическую значимость измеряли с использованием непарного двуххвостого t-критерия Стьюдента. Для сравнений между более чем двумя группами статистическую значимость измеряли с использованием одностороннего дисперсионного анализа (ANOVA) с выполнением множественных сравнений (поправка Даннета), при этом каждое значение сравнивали со значением эталонного штамма.
Значения P <0,05 считались показателями статистической значимости.
Заявление об этике
Все эксперименты проводились в соответствии с руководящими принципами и правилами, описанными в Хельсинкской декларации и низком Huriet-Serusclat по этике исследований на людях, и было получено информированное согласие для всех участвующих субъектов. Серийные изоляты S. aureus были получены из секретов дыхательных путей четырех пациентов с хронической легочной инфекцией в университетской больнице Necker-Enfants Malades, Париж, Франция. Забор мокроты является частью стандартной стандартной процедуры.Процедура исследования утверждена Ile de France 2 IRB (ID-RCB / Eudract: 2016 A00309-42).
Обсуждение
Наше исследование выявило индивидуальную адаптацию пациента, проиллюстрированную приобретением мутаций, приводящих к устойчивости к антибиотикам, прямо коррелированной с лекарствами, вводимыми пациенту. Наше исследование также предоставило доказательства приобретения общих адаптивных признаков, таких как фенотип SCV, устойчивость к антибиотикам, ауксотрофии, снижение активности цикла лимонной кислоты, увеличение биопленки и способности внутриклеточной персистенции, которые имели место независимо от типа клона.
Особый интерес представляет то, что мы сообщаем о мутациях в двух основных регуляторных системах, Agr и Sae, которые могут влиять на экспрессию нескольких белков и количество метаболитов.
agr -дефектные мутанты, как было показано, возникают во время хронических инфекций и лучше приспособлены к сохранению внутри инфицированного хозяина [32, 63, 64]. Поздний изолят CP1 типичен для мутантов с дефектом agr и с повышающей регуляцией адгезинов и понижающей регуляцией токсинов, подтвержденной протеомным анализом.
Генетические изменения, прямо или косвенно направленные на регулон SaeR, были выявлены у 3 пациентов с МВ. Поскольку SaeR участвует в регуляции более 20 генов факторов вирулентности [65], а бактерии с дефицитом SaeRS менее заразны в моделях на животных [66], вполне вероятно, что длительная колонизация связана со снижением вирулентности.
В поздних изолятах CP1, CP3 и CP4 мы наблюдали увеличение экспрессии адгезина SdrD, принадлежащего регулону SaeR [67] ( S7, таблица ), указывая тем самым, что SdrD также важен для долговременной колонизации легких.Следует отметить, что SdrD участвует в адгезии к эпителиальным клеткам носа человека и кератиноцитам человека [68].
У пациентов с хроническими легочными инфекциями обнаружение SCV чаще всего является следствием длительного лечения SXT [69]. Эти стабильные клинические изоляты SCV больше не чувствительны к SXT и являются тимидин-ауксотрофными (TA-SCV) из-за мутаций в гене thyA , кодирующем тимидилатсинтазу [44, 69]. Примечательно, что в поздних изолятах CP1, CP2 и CP3 были обнаружены мутации tyA .Однако, вероятно, из-за компенсаторных механизмов в позднем изоляте CP1 только поздние изоляты CP2 и CP3 являются TA-SCV. Поскольку предполагается, что тимидин в изобилии в легких с продолжающимся хроническим воспалением, TA-SCV все еще могут расти в этой среде, сопротивляясь лечению SXT.
Помимо ауксотрофии по тимидину, мы наблюдали ауксотрофию по пантотенату в позднем изоляте CP4, которая ранее также была связана с персистентностью у Mycobacterium tuberculosis [41]. Приобретение ауксотрофии пантотената предполагает, что, как и тимидин, пантотенат также может присутствовать в легких пациентов с МВ.Приобретение ауксотрофов соответствует тому, что наблюдалось у изолятов P. aeruginosa CF [70]. Таким образом, это подтверждает, что метаболическая специализация — обычное явление среди долгожителей.
Другими яркими чертами фенотипической конвергентной эволюции S. aureus , идентифицированными в этой работе, были повышенная способность образовывать биопленку и сохраняться во внутриклеточной нише. У пациентов с CP3 и CP4 повышенная способность к биопленке поздних изолятов CP3 и CP4 может быть связана с мутацией в гене fakA , кодирующем киназу A жирных кислот (FakA).В самом деле, несколько исследований показали, что FakA-нулевые штаммы способны формировать биопленки [13] и испытывать дефицит в экспрессии факторов вирулентности, контролируемых системой SaeRS [37]. Сверхэкспрессия адгезинов, обнаруженная в протеомном анализе, также может в конечном итоге привести к увеличению образования биопленок в тестируемых клинических изолятах.
Хотя S. aureus обычно не считается внутриклеточным патогеном, многочисленные исследования продемонстрировали его способность сохраняться в клетках-хозяевах [15-24].Поразительно, что все клинические изоляты проявляли большую способность сохраняться в эпителиальных клетках CFBE-F508del по сравнению с эталонным штаммом USA300-LAC (, фиг. S6, ). Более того, для трех пациентов с МВ поздние изоляты S. aureus показали большую способность сохраняться в эпителиальных клетках CFBE-F508del по сравнению с ранними на 6-й день после инфицирования. Следует отметить, что поздний изолят CP2 не продемонстрировал улучшенной способности сохраняться внутриклеточно в эпителиальных клетках CFBE-F508del, возможно, из-за того, что он адаптировался к пациенту, не страдающему МВ.
Дополнительные файлы
Таблица S1: Основные параметры сборки. (.doc)
Таблица S2: Список генов, отсутствующих в поздних изолятах по сравнению с ранними изолятами. (.xls)
Таблица S3: Список несинонимичных мутаций, присутствующих в поздних изолятах по сравнению с ранними изолятами. (.xls)
Таблица S4: Стоп-кодонов в клонах CP по сравнению с контрольными штаммами. (.doc)
Таблица S5: Несинонимичные мутации в клонах по крайней мере 3 из 4 пациентов с ХП.(.doc)
Таблица S6: Конвергентная эволюция поздних изолятов. (.doc)
Таблица S7: Список белков с разницей обнаружения не менее 2 в log2 (интенсивность) после нормализации в поздних изолятах по сравнению с ранними изолятами. (.xls)
Таблица S8: Список метаболитов с измененным количеством в поздних изолятах по сравнению с ранними изолятами. (.xls)
Рисунок S1 : Тепловые карты, показывающие сравнение профилей белков и метаболитов ранних / поздних S.aureus .
Рисунок S2: Морфология колоний изолятов CP2_late и CP3_late. Бактерии выращивали на агаре BHI, инкубированном 12 ч при 37 ° C.
Рисунок S3: Кривые роста ранних клинических изолятов S. aureus в CFSM.
Рисунок S4: Количественная оценка образования биопленок у клинических изолятов S. aureus .
Фигура S5: Кривые внутриклеточного роста эталонных изолятов S. aureus в линии эпителиальных клеток CFBE.
Рисунок S6: Внутриклеточная персистенция клинических изолятов S. aureus в эпителиальной клеточной линии CFBE-F508del. (.pdf)
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
% PDF-1.7
%
284 0 объект
>
endobj xref
284 143
0000000044 00000 н.
0000003864 00000 н.
0000004129 00000 н.
0000004158 00000 п.
0000004219 00000 н.
0000004366 00000 н.
0000005318 00000 н.
0000013461 00000 п.
0000013550 00000 п.
0000013639 00000 п.
0000013728 00000 п.
0000013817 00000 п.
0000013906 00000 п.
0000013995 00000 п.
0000014084 00000 п.
0000014171 00000 п.
0000014258 00000 п.
0000014344 00000 п.
0000014432 00000 п.
0000014520 00000 н.
0000014607 00000 п.
0000014695 00000 п.
0000014784 00000 п.
0000014871 00000 п.
0000014959 00000 п.
0000015046 00000 п.
0000015135 00000 п.
0000015222 00000 п.
0000015310 00000 п.
0000015398 00000 п.
0000015487 00000 п.
0000015576 00000 п.
0000015666 00000 п.
0000015755 00000 п.
0000041978 00000 п.
0000049233 00000 п.
0000049272 00000 п.
0000051949 00000 п.
0000052301 00000 п.
0000052575 00000 п.
0000055405 00000 п.
0000055823 00000 п.
0000056155 00000 п.
0000060571 00000 п.
0000061055 00000 п.
0000061173 00000 п.
0000061427 00000 п.
0000062357 00000 п.
0000062679 00000 п.
0000062873 00000 п.
0000062951 00000 п.
0000063174 00000 п.
0000063759 00000 п.
0000064056 00000 п.
0000064518 00000 п.
0000064937 00000 п.
0000072266 00000 п.
0000072866 00000 п.
0000073406 00000 п.
0000082537 00000 п.
0000082603 00000 п.
0000082728 00000 н.
0000082854 00000 п.
0000082980 00000 п.
0000083105 00000 п.
0000083231 00000 п.
0000083357 00000 п.
0000083482 00000 п.
0000083608 00000 п.
0000083734 00000 п.
0000083860 00000 п.
0000083983 00000 п.
0000084108 00000 п.
0000084233 00000 п.
0000084357 00000 п.
0000084483 00000 п.
0000084609 00000 п.
0000084734 00000 п.
0000084860 00000 п.
0000084986 00000 п.
0000085111 00000 п.
0000085237 00000 п.
0000085363 00000 п.
0000085488 00000 п.
0000085612 00000 п.
0000085736 00000 п.
0000085862 00000 п.
0000085987 00000 п.
0000086112 00000 п.
0000086238 00000 п.
0000086364 00000 п.
0000086490 00000 н.
0000086616 00000 п.
0000086742 00000 п.
0000086868 00000 н.
0000086994 00000 п.
0000087120 00000 п.
0000087246 00000 п.
0000087372 00000 п.
0000087498 00000 п.
0000087624 00000 п.
0000087750 00000 п.
0000087876 00000 п.
0000088002 00000 п.
0000088128 00000 п.
0000088254 00000 п.
0000088380 00000 п.
0000088505 00000 п.
0000088631 00000 п.
0000088757 00000 п.
0000088883 00000 п.
0000089009 00000 п.
0000089132 00000 п.
0000089296 00000 п.
0000089469 00000 п.
0000089641 00000 п.
0000089817 00000 п.
0000089993 00000 н.
00000
00000 н.
00000 00000 п.
00000
00000 00000 п.
00000 00000 н.
00000 00000 п.
00000
00000 п.
00000
00000 п.
00000
00000 п.
00000
00000 п.
00000
00000 п.
0000091733 00000 п.
0000091852 00000 п.
0000092003 00000 п.
0000092220 00000 н.
0000092427 00000 н.
0000092648 00000 п.
0000092769 00000 н.
0000092920 00000 н.
0000093049 00000 п.
0000093218 00000 п.
0000093355 00000 п.
0000093488 00000 п.
0000093609 00000 п.
0000003216 00000 н.
трейлер
] / Назад 281871 / Размер 427 / Корень 285 0 R
>>
startxref
0
%% EOF
426 0 объект
>
ручей
xuKhQ; w & $; $ ѴF6
f! U
Дж.] «r7jUVpE» BЍ] ٍ nRl ܹ iM. ~ o
Информационный бюллетень о метициллин-резистентном золотистом стафилококке (MRSA)
Метициллин-резистентный Staphylococcus aureus (MRSA) — это бактерия (распространенная бактерия), которую нельзя лечить антибиотиками устойчивы к ним. MRSA может вызывать кожные инфекции, такие как абсцессы и фурункулы, а также инфицировать раны, вызывать пневмонию или инфекции крови или костей.
Некоторые штаммы MRSA могут встречаться в сообществе или у здоровых людей; они называются MRSA, приобретенными сообществом.Некоторые штаммы MRSA обнаруживаются у людей, проходивших лечение в больнице или других медицинских учреждениях. Дети могут иметь MRSA на теле или инфекции MRSA, даже не будучи в больнице.
Кто подвергается повышенному риску заражения MRSA-инфекцией?
Детей в больнице, кто:
- Есть другие заболевания, от которых они болеют.
- Ранее были в больнице или лечебном учреждении.
- Ранее лечились антибиотиками.
В общине дети, подвергающиеся наибольшему риску заражения MRSA, часто находятся в местах частого контакта с кожей, таких как школы, общежития, детские сады и спортивные сооружения.
Дети с другими заболеваниями, включая диабет, дерматит или с подавленным иммунитетом, также подвергаются повышенному риску.
Как можно заразиться MRSA?
Дети, у которых есть MRSA на коже или инфицированы MRSA, могут распространять бактерии.
MRSA может передаваться другим через руки медицинских работников, посетителей, опекунов, детей или через MRSA на такое оборудование, как перила для кроватей и детских кроваток, медицинское оборудование, дверные ручки и сантехника.
Как можно предотвратить распространение MRSA?
- Самое важное, что вы можете сделать для предотвращения распространения MRSA, — это часто мыть руки и руки вашего ребенка. Вы можете использовать спиртосодержащий раствор для рук или вымыть руки водой с мылом, а затем тщательно их высушить.
- Не прикасайтесь к той части тела ребенка, в которой может присутствовать MRSA.
- Следуйте инструкциям по обращению с ранами или устройствами.
- У вашего ребенка должны быть собственные полотенца, одежда и простыни.
- У вашего ребенка должны быть собственные принадлежности для ухода, например, ножницы для ногтей, пинцет и зубные щетки.
Не позволяйте им делиться этими элементами с другими. - Все столовые приборы, посуду, одежду и белье можно мыть в обычном режиме.
Когда нужно мыть руки?
Всегда чистые руки:
- , прежде чем брать что-либо, попавшее в рот или рот ребенка.
- перед приготовлением или употреблением еды или напитков.
- перед тем, как покинуть комнату ребенка.
- после посещения туалета или смены подгузников.
- после использования салфетки или носового платка.
- после обращения с мусором.
- после обращения с грязным бельем.
- после контакта с пораженным участком (по возможности избегайте прикосновений).
Что произойдет, если у вашего ребенка MRSA?
- Мазок из носа и / или любых ран или поражений на коже, или образцы мочи или мокроты будут отправлены в лабораторию для проверки на MRSA.
- Возможно, ваш ребенок не инфицирован MRSA. Бактерии могут жить в их теле или на нем, не причиняя никакого вреда. Это колонизация. В этом случае они не будут лечиться, если их врач не сочтет это необходимым.
- Дети, инфицированные MRSA, обычно не должны оставаться в больнице дольше.
- Детей можно лечить антибиотиками, убивающими MRSA, если у них есть местная инфекция, например инфицированная рана, или если у них серьезная инфекция. Возможно, им придется оставаться в больнице, пока не появятся признаки улучшения или не исчезнет.
- Вашему ребенку могут дать антисептический лосьон для тела и / или крем с антибиотиком, если у него есть MRSA на коже, волосах или носу. Это будет зависеть от того, используют ли они антибиотики, а также от наличия у них ран, кожных заболеваний или дренажей / устройств.
- Наши сотрудники будут принимать особые меры предосторожности, чтобы остановить распространение MRSA среди других пациентов. Ваш ребенок может находиться в отдельной комнате, и персонал будет использовать перчатки и халаты, ухаживая за ним. Ношение перчаток и халата помогает предотвратить распространение MRSA среди других детей в больнице.
- Вашему ребенку будет предложено оставаться в своей комнате, если он не пройдет анализы и не пройдет лечение.
Если у вашего ребенка MRSA, могут ли они принимать посетителей?
Да. Однако MRSA может поражать людей, у которых есть определенные долгосрочные проблемы со здоровьем. Пожалуйста, сообщите нашему медперсоналу, если кто-то, у кого есть долгосрочные проблемы со здоровьем, хочет навестить вашего ребенка. Посетителей попросят вымыть руки после посещения вашего ребенка, чтобы они не передавали MRSA другим.
Вам и вашим посетителям обычно не нужно надевать перчатки или халаты, если только вы или они не будете навещать других в больнице.
Ваш ребенок также может принимать посетителей из школы и развлекательных служб, если они не могут выйти из своей комнаты или посетить эти места лично. Возможно, вам и вашему ребенку будет удобно покинуть больницу, чтобы посетить участок Саут-Бэнк или другие районы.
Что происходит, когда вы посещаете амбулаторное отделение больницы или возвращаетесь в больницу после выписки?
Поскольку могут быть и другие дети, которые подвержены высокому риску заражения, меры предосторожности могут быть приняты, когда вы посещаете поликлиники или дневные отделения, приходите в отделение неотложной помощи или повторно госпитализируете.Это может включать использование одной комнаты или выделение временного интервала для встреч или процедур, когда пациентов меньше. Сообщите персоналу, что необходимы меры предосторожности в отношении MRSA. В системе информации о пациентах больницы (наша база данных пациентов) также должна быть запись о необходимости мер предосторожности в отношении MRSA.
Должен ли я сообщить об этом школе, дошкольному учреждению / детскому саду моего ребенка или другим родителям?
Нет. Риск для окружающих за пределами больницы очень низок. У других детей может быть MRSA, но они могут не знать об этом.Он может жить внутри или на теле, не причиняя никакого вреда. Хорошая очистка рук — самый важный фактор в предотвращении распространения инфекции.
Можно ли очистить MRSA?
Некоторые дети могут быть очищены от MRSA. Это зависит от использования антибиотиков, наличия у них дренажей / трубок или устройств, а также от текущих заболеваний. Ваш медицинский работник или медсестры по инфекционному контролю смогут дать вам совет.
Для получения дополнительной информации
Информационные справочники для пациентов по MRSA доступны по телефону:
Национальный совет здравоохранения и медицинских исследований (NHMRC)
Австралийская комиссия по безопасности и качеству здравоохранения
Свяжитесь с нами
I n f ec t i o n Служба управления и профилактики
Queensland Children’s Hospital
501 Stanley Street, South Brisbane 4101 36 t медсестры)
t: 07 3068 1558 (администрация)
t: 07 3068 1111 (общие запросы)
e: CHQ_IMPS @ health.qld.gov.au
(PDF) Носовое носительство Staphylococcus aureus у здоровых дошкольников
70
Краткое сообщение
Носовое носительство Staphylococcus aureus у здоровых дошкольников
Муге Огузкая-Артан *, Зейнеп
0003
2
Профессиональный колледж медицинских услуг Халил Байрактар и
1
Департамент медицинского образования, Медицинская школа,
Университет Эрджиес и
2
Больница по лечению заболеваний грудной клетки Нух Наци Язган, Кайсери, Турция (
августа
24, 2007.Принята 12 октября 2007 г.)
РЕЗЮМЕ: Для оценки распространенности носительства Staphylococcus aureus среди здоровых детей дошкольного возраста в
нашем регионе были взяты мазки из носа у здоровых детей в возрасте от 5 до 7 лет, посещавших детский сад
центр. Социально-демографические характеристики и данные о факторах риска были получены от родителей детей.
Из 200 детей S. aureus был изолирован у 36 (18%) испытуемых. Метициллин-устойчивый S.aureus был изолирован у
2 (5,6%) этих субъектов, ни у одного из которых не было выявленных факторов риска. Тест на чувствительность к противомикробным препаратам
показал, что все протестированные штаммы были чувствительны к гентамицину, ванкомицину, триметоприм-сульфаметоксазолу,
рифампицину и мупироцину. Устойчивость к эритромицину, клиндамицину, фузидовой кислоте и тетрациклину была определена
и составила 16,6, 8,3, 5,6 и 8,3% соответственно.
Jpn. J. Infect. Dis., 61, 70-72, 2008
* Автор, ответственный за переписку: Почтовый адрес: Университет Эрджиес, Халил
Профессиональный колледж медицинских услуг Байрактар, Кайсери, Турция.
Тел .: + 90-352-4374901 40010, Факс: + 90-352-4375936, Электронная почта:
Золотистый стафилококк уже давно признан
важным патогеном для человека. болезнь. Из-за увеличения на
числа инфекций, вызываемых метициллин-устойчивыми штаммами S. aureus
(MRSA), которые в настоящее время часто являются мультирезистентными, терапия
стала проблематичной. Таким образом, профилактика локальных инфекций стафилококка
стала более важной, чем когда-либо ранее.Носительство S. aureus
в носу играет ключевую роль в эпидемиологии и патогенезе инфекции
(1). Носительство S. aureus через нос было определено как фактор риска
для внебольничных и внутрибольничных инфекций,
затрагивающих около 20% населения (2).
Целью этого исследования было определение распространенности
носительства S. aureus и MRSA через нос у детей дошкольного возраста
и оценка паттернов чувствительности к антибиотикам изолятов
.
В Турции дети в возрасте 0-6 лет регулярно наблюдаются в
центрах первичной медико-санитарной помощи. В возрасте до 1 года они девять раз посещают
центров первичной медико-санитарной помощи, а затем посещают центр
один раз в год. Акушерки посещают на дому детей
, не доставленных в центры. Это исследование проводилось в
четырех центрах первичной медико-санитарной помощи в Кайсери, Турция, в мае — июне
2006 г. Всего за период исследования
эти центры посетили 200 детей.Письменные анкеты, касающиеся демографической ситуации —
и истории болезни (использование антибиотиков за последние 4 недели,
продолжительности использования антибиотика и название антибиотика,
наличие респираторной инфекции и наличие хронического заболевания
легкость ) были выполнены родителями детей. Подписано-
Получено
сформированного согласия от родителей. Образцы
для культивирования были получены с помощью ватного тампона, помещены в транспортную среду
, а затем транспортированы и обработаны в нашей микробиологической лаборатории
в течение 4 часов.Изоляты S. aureus
идентифицировали стандартными методами. Чувствительность к оксациллину
оценивали методом дисковой диффузии в соответствии с Институтом клинических лабораторных стандартов
(CLSI) (3).
Чувствительность изолятов к 10 антибиотикам (оксацил-
lin, эритромицин, клиндамицин, триметоприм-сульфаметоксазол
[SXT], ванкомицин, рипфампицин, гентамицин, тетрациклин
, дисковая кислота
, мупициклин
, мупициклин
). диффузный метод
.Для выявления индуцибельной устойчивости к клиндамицину был проведен тест двойной диффузии
(D-тест) путем размещения
дисков клиндамицина и эритромицина на расстоянии 15 мм друг от друга (4,5).
Статистический пакет для социальных наук (SPSS) для
Windows (версия 13.0; SPSS, Чикаго, Иллинойс, США) программное обеспечение
использовалось для статистического анализа данных. Частота
и процент были представлены для категориальных данных. Точный тест Фишера
был применен для определения потенциальных факторов, связанных с S.носовое носительство aureus. Уровень значимости
был установлен на 0,05 с использованием двустороннего метода.
В исследование были включены 200 детей (106 [53,0%] мальчиков и 94 [47,0%]
девочек). Общее носительство в
этой исследуемой популяции составляло 18,0% (36/200), а из 36 штаммов
5,6% (2/36; у 2 детей) были MRSA. Оба ребенка
посещали детский сад. Один использовал антибиотик
за последние 4 недели. Один из штаммов MRSA был также устойчив к клиндамицину
, а другой — к клиндамицину,
эритромицину, фузидовой кислоте и тетрациклину.В таблице 1 показан одномерный анализ
потенциальных факторов риска носительства S. aureus
.
Не было обнаружено никакой связи между носительством S. aureus
в носу и полом, посещением детского сада, использованием антибиотиков в
за последние 4 недели, респираторной инфекцией в ходе исследования
день, хроническим заболеванием и номер домашнего хозяйства. Всего было выделено
штаммов из 36. Картина чувствительности к антибиотикам
штаммов представлена в таблице 2.
Устойчивость к эритромицину присутствовала в 6 из 36 изолятов
(16,7%), а устойчивость к клиндамицину присутствовала в 3 из 36 изолятов
(8,3% общих, 6,2% конститутивных и 2,1% индуцибельных).

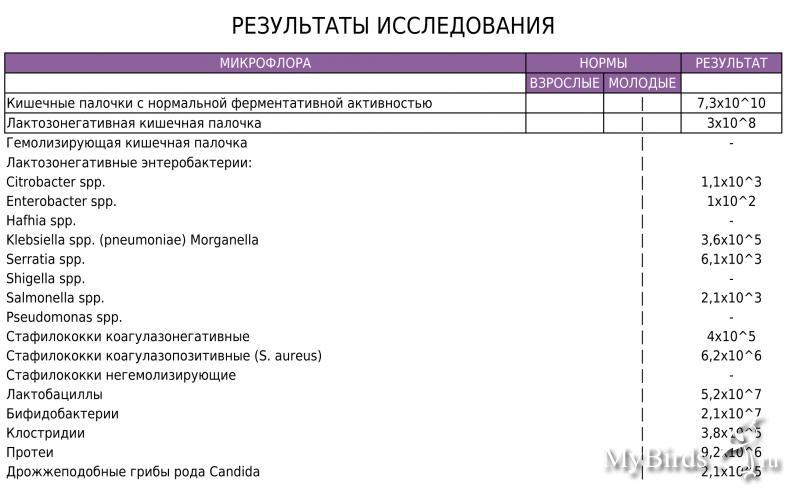 А болезнетворные бактерии встречаются на каждом шагу.
А болезнетворные бактерии встречаются на каждом шагу.