Памятка для родителей по «Острой кишечной инфекции у детей»
Уважаемые родители, если Ваш ребенок заболел острой кишечной инфекцией (по-научному, острым гастроэнтеритом), Вам необходимо спокойно проанализировать ситуацию и понять, как Ваш ребенок мог заболеть. Чаще всего это заболевание возникает при контактах с больными или носителями кишечных инфекций — ими чаще являются взрослые, окружающие ребенка (при несоблюдении правил личной гигиены).
Так же причиной заболевания является инфицированная вода (например, некипяченая вода или вода из открытых источников), пища (недоброкачественная, с истекшим сроком хранения продуктов либо хранившаяся без холодильника, плохо вымытые ягоды, овощи, фрукты, недостаточно термически обработанная –яйцо, курица, другие виды мяса). Острые кишечные инфекции бывают по происхождению вирусные (чаще всего), бактериальные либо смешанные вирусно-бактериальные. Существует множество вирусов, вызывающих инфекцию-это ротавирус, норовирус, астровирус, калицивирус, энтеровирус и т д. Среди бактериальных кишечных инфекций чаще встречается сальмонеллез. Реже -другие- например, иерсиниоз, дизентерия. Симптомы заболевания: повышение температуры тела, отказ от еды, боль в животе, питья, рвота, жидкий стул ,слабость, редкое мочеиспускание. В результате у ребенка часто развивается токсикоз и обезвоживание. Ребенок попадает в стационар и его необходимо наблюдать, обследовать и лечить. Очень важно соблюдать все рекомендации лечащего врача, но и участие мамы имеет большое значение в скорейшем выздоровлении ребенка.
Среди бактериальных кишечных инфекций чаще встречается сальмонеллез. Реже -другие- например, иерсиниоз, дизентерия. Симптомы заболевания: повышение температуры тела, отказ от еды, боль в животе, питья, рвота, жидкий стул ,слабость, редкое мочеиспускание. В результате у ребенка часто развивается токсикоз и обезвоживание. Ребенок попадает в стационар и его необходимо наблюдать, обследовать и лечить. Очень важно соблюдать все рекомендации лечащего врача, но и участие мамы имеет большое значение в скорейшем выздоровлении ребенка.
Прежде всего, мама должна быть спокойна и позитивна, особенно с маленькими детьми. Не надо забывать, что ребенок смотрит на мир мамиными глазами. Ваша уверенность психологически поможет малышу скорее выздоравливать. Своевременно начатое обследование и лечение ускорит выздоровление и поможет избежать осложнений. Часто ребенок отказывается от еды и питья-в таких случаях врач обычно назначает капельницу для коррекции обезвоживания, поддержания энергии и снятия токсикоза. На инфузионной терапии ребенка можно кормить и поить -но дробно (малыми порциями и чаще), жидкость предлагайте глоточками (либо поите из шприца по 5-10 мл через 10-15 минут). При бактериальных инфекциях врач назначит Вашему ребенку антибиотики. При кишечных инфекциях существует определенная диета- она соблюдается еще 14 дней после выздоровления. В первые 3-5 дней у детей старше года рекомендуется полное исключение цельномолочных продуктов, а также продуктов, усиливающих моторику и содержащие грубую клетчаткую.
На инфузионной терапии ребенка можно кормить и поить -но дробно (малыми порциями и чаще), жидкость предлагайте глоточками (либо поите из шприца по 5-10 мл через 10-15 минут). При бактериальных инфекциях врач назначит Вашему ребенку антибиотики. При кишечных инфекциях существует определенная диета- она соблюдается еще 14 дней после выздоровления. В первые 3-5 дней у детей старше года рекомендуется полное исключение цельномолочных продуктов, а также продуктов, усиливающих моторику и содержащие грубую клетчаткую.
Детям первого года жизни необходимо ограничить, а в тяжелых случаях исключить базовые адаптированные молочные смеси, цельное коровье молоко, соки. Детям, находящимся на искусственном вскармливании ,следует подбирать низко- или безлактозные смеси с таким количеством лактозы, которое перенесет больной, не допуская ухудшения клинической симптоматики .
Длительность диеты-до нормализации стула с постепенным расширением молочной составляющей. Сроки лечения индивидуальны — в среднем 7-10 дней (но особенностью течения кишечных инфекций является волнообразное течение—в 2 или 3 « волны», и это может удлинять срок лечения и госпитализации ребенка. Что такое волнообразное течение кишечной инфекции?
Что такое волнообразное течение кишечной инфекции?
Возбудители кишечных инфекций часто вызывают примерно через 3-4 дня от начала заболевания вторую « волну», т. е даже на фоне лечения снова может повыситься Т тела, появиться рвота, усилиться жидкий стул и ухудшиться самочувствие ребенка. И опять Вам могут назначить капельницу.… И снова – помните, мама — ни в коем случае не паниковать! Теперь Вы об этом знаете и продолжаете лечить своего малыша дальше, доверяя доктору и следуя его советам. Выздоровление непременно наступит ,не беспокойтесь. Все дети болеют по — разному — это надо понимать, есть и возрастные особенности-малыши до 3-х лет, особенно до 1 годика болеют тяжелее, и иммунитет у всех разный. Прогноз, конечно же, благоприятный, детки выздоравливают. Далее – после выписки из больницы надо соблюдать простые правила личной гигиены, диету до 14 дней. Желаем Вам скорейшего выздоровления!
Врач-педиатр отделения №6 Ковалько А.К.
Кишечная инфекция — симптомы и лечение острой кишечной инфекции
Острой кишечной инфекцией (ОКИ) каждый год заболевают более полумиллиарда людей в мире. Это группа заболеваний, объединенных на основе общего признака — локализации возбудителя в кишечнике. Наблюдается с одинаковой частотой у детей и взрослых.
Это группа заболеваний, объединенных на основе общего признака — локализации возбудителя в кишечнике. Наблюдается с одинаковой частотой у детей и взрослых.
Этиология ОКИ
Этиология кишечных инфекций связана с попаданием в организм возбудителя болезни. Выделяют 3 основных пути, по которым они поступают в организм:
- через пищу — обычно через продукты питания, которые не прошли достаточную гигиеническую и термическую обработку;
- через воду — симптомы и этиология кишечных заболеваний при заражении через воду возникают при употреблении некачественной воды;
- при бытовом контакте — через различные предметы или грязные руки.
Бактериальные ОКИ часто вызваны бактериями типа сальмонелл, кишечной палочки, а вирусные — попаданием в организм ротавирусов, энтеровирусов и т. п. Тяжелые клинические симптомы возникают при амебиазе и лямблиозе, которые относятся к сравнительно редким причинам.
Симптомы
Симптомы кишечной инфекции у взрослых и детей зависят от разновидности возбудителя. Однако есть общие признаки, указывающие на наличие заболевания: боли в животе, слабость, отсутствие аппетита, рвота, жидкий стул.
В остальном в зависимости от вида ОКИ клинический признак или несколько проявлений могут отличаться. Например, при холере лихорадки может не быть, тогда как шигеллез обязательно сопровождаются ею.
Действие болезнетворных микроорганизмов проявляется не сразу. Инкубационный период обычно составляет от 10 до 50 часов.
Острая кишечная инфекция у взрослых начинается, как правило, с незначительного недомогания, которое сменяют боли в животе и частый жидкий стул. Симптомы острой кишечной инфекции у детей как правило выражены более ярко.
Частый симптом заболеваний кишечника — острый понос. После заражения он может появиться, спустя несколько часов или дней. Вместе со рвотой диарея иногда приводит к обезвоживанию организма.
Вместе со рвотой диарея иногда приводит к обезвоживанию организма.
Диагностика и лечение
Специалисты клиники при подозрении ОКИ у обратившегося к ним пациента выясняют время возникновения первых симптомов и факторы риска, которые могли стать причиной болезни.
Симптоматика ОКИ присуща и многим другим недугам, поэтому для постановки точного диагноза необходимы дополнительные исследования: анализ мочи, крови, кала, бакпосев.
Лечение острой кишечной инфекции назначается врачом после осмотра и изучения анамнеза: диетотерапия, дезинтоксикационная терапия, регидратационная терапия, лечение антибактериальными препаратами, пробиотиками. Записаться на прием к врачу тут.
Профилактика — лучшее лечение острой инфекции. Профилактические меры сводятся к простым правилам: мыть руки перед едой, пить кипяченую или бутилированную воду, мыть фрукты и овощи перед употреблением, тщательно термически обрабатывать пищу. Полные рекомендации по профилактике ОКИ можно получить на приеме у врача-диетолога.
Полные рекомендации по профилактике ОКИ можно получить на приеме у врача-диетолога.
Дата публикации: 22.09.2017 |
Дата изменения: 07.08.2020
Кишечные инфекции и их профилактика — Городская Больница
К острым кишечным инфекциям огносят брюшной тиф, паратифы А и В, сальмонеллез, дизентерия, холера, инфекционный гепатит и др.
Кишечные инфекции характеризуются следующими основными признаками:
• фекально-оральным механизмом заражения, т. е. попадание возбудителя а организм происходит через рот, а возбудитель локализуется в кишечнике;
• пищевым, водным и контактно-бытовым путями передачи;
• поражением органов желудочно-кишечного тракта;
• осенне-летней сезонностью.
Источниками острых кишечных инфекций являются в основном больные люди и бактерионосители. Источниками сальмонеллеза могут быть больные животные или птица. Заражение кишечными инфекциями может происходить при контакте с больным или бактерионосителем, употреблении зараженной воды или инфицированных пищевых продуктов. Перенос возбудителей кишечных инфекций осуществляют мухи, тараканы и грызуны.
Источниками сальмонеллеза могут быть больные животные или птица. Заражение кишечными инфекциями может происходить при контакте с больным или бактерионосителем, употреблении зараженной воды или инфицированных пищевых продуктов. Перенос возбудителей кишечных инфекций осуществляют мухи, тараканы и грызуны.
Возбудители кишечных инфекций устойчивы к различным воздействиям и длительно сохраняются во внешней среде, например в водопроводной воде – до 3 месяцев, на овощах и фруктах — от 5 дней до 14 недель. Пищевые продукты, особенно молочные и мясные, а также кулинарные изделия и холодные блюда являются наиболее благоприятной средой для возбудителей кишечных инфекций. В них микробы, прежде всего сальмонеллы и дизентерийная палочка Зонне, могут размножаться при температуре от 20 до 40 оС.
Брюшной тиф и паратифы. Возбудитель брюшного тифа – подвижная палочка из рода сальмонелл. Источником инфекции является только человек — больной или бактерионоситель. Инкубационный период при брюшном тифе может продолжаться от 7 до 25 дней, при паратифах — от 2 до 14 дней. Брюшной тиф может протекать тяжело с характерным тифозным состоянием, бредом, сыпью и привести к смертельному исходу. Паратифы А и В сходны с брюшным тифом, но протекают без тяжелой интоксикации и прогноз благоприятный.
Инкубационный период при брюшном тифе может продолжаться от 7 до 25 дней, при паратифах — от 2 до 14 дней. Брюшной тиф может протекать тяжело с характерным тифозным состоянием, бредом, сыпью и привести к смертельному исходу. Паратифы А и В сходны с брюшным тифом, но протекают без тяжелой интоксикации и прогноз благоприятный.
Сальмонеллез. Сальмонеллез вызывается бактериями рода сальмонелл, широко распространенными в природе. Сальмонеллы являются возбудителями заболеваний у крупного рогато скота, свиней, домашней птицы и др. Основной источник инфекции — птица, особенно водоплавающая. Болеют также кошки, собаки, грызуны и др. Среди животных и птиц распространено носительство сальмонелл в кишечнике.
Всего известно около 2000 типов сальмонелл, более 100 из них патогенны не только для животных, но и для человека. Сальмонеллы устойчивы ко всем факторам среды, длительное время сохраняют жизнеспособность при замораживании и мариновании мяса. В пищевых продуктах они могут оставаться жизнеспособными многие дни и месяцы. В мясных, рыбных, молочных продуктах сальмонеллы хорошо размножаются, не изменяя при этом органолептических свойств продуктов. Оптимальной температурой для размножения сальмонелл является 30—37 °С. При температуре ниже 5 оС рост сальмонелл полностью прекращается. При температуре выше 50 °С размножение сальмонелл останавливается, при нагревании до 60 °С эти бактерии погибают через час, при 70 оС – через 30 мин, при 80 °С — через 10 мин, при кипячении — мгновенно.
В пищевых продуктах они могут оставаться жизнеспособными многие дни и месяцы. В мясных, рыбных, молочных продуктах сальмонеллы хорошо размножаются, не изменяя при этом органолептических свойств продуктов. Оптимальной температурой для размножения сальмонелл является 30—37 °С. При температуре ниже 5 оС рост сальмонелл полностью прекращается. При температуре выше 50 °С размножение сальмонелл останавливается, при нагревании до 60 °С эти бактерии погибают через час, при 70 оС – через 30 мин, при 80 °С — через 10 мин, при кипячении — мгновенно.
Дизентерия. Возбудители дизентерии – дизентерийные палочки из рода шигелл. Источником их могут быть больной человек и бактерионоситель. В последнее время частая причина дизентерии — молочные продукты. Это связано с тем, что палочка Зонне способна размножаться и накапливаться в заквасочных культурах и молочных продуктах. Она сохраняется в молоке более двух недель, в сметане — 11-86 дней, на овощах и фруктах 3—8 дней. Дизентерия Зонне часто имеет легкое, стертое течение, и у многих переболевших людей при самолечении формируется бактерионосительство.
Дизентерия Зонне часто имеет легкое, стертое течение, и у многих переболевших людей при самолечении формируется бактерионосительство.
Водный путь передачи инфекции свойственен главным образом дизентерии Флекснера, а контакто-бытовой — дизентерии Григорьева—Шига. Опасность представляет употребление продуктов, не проходящих тепловой обработки перед употреблением, — овощей, фруктов и ягод, инфицированных больными и бактерионосителями или зараженной почвой. При кипячении воды, молока, при тепловой обработке продуктов дизентерийные палочки быстро погибают.
Длительность инкубационного периода при дизентерии колеблется от 1 до 7 дней (чаще составляет 2—3 дня). Заболевание развивается остро, стул учащается до 10—12 раз в сутки, в испражнениях появляется слизь и кровь. Возможно развитие хронических форм дизентерии.
Холера относится к числу особо опасных инфекций. Возбудители холеры (вибрион азиатской холеры и вибрион Эль-Тор) длительно сохраняют жизнеспособность в окружающей среде, особенно в пресной и морской воде. Источник инфекции – только человек. Вибрионы холеры попадают в окружающую среду с выделениями больных типичными или стертыми формами холеры, а также от выздоравливающих и вибриононосителей. Ведущим фактором передачи холеры является водный.
Источник инфекции – только человек. Вибрионы холеры попадают в окружающую среду с выделениями больных типичными или стертыми формами холеры, а также от выздоравливающих и вибриононосителей. Ведущим фактором передачи холеры является водный.
Инкубационный период холеры колеблется от нескольких часов до 5 дней, чаще составляя 2—3 дня. Заболевание начинается внезапно. Характерными симптомами холеры являются понос в виде рисового отвара, судороги икроножных мыши, многократная обильная рвота, обезвоживание организма. При тяжелых и молниеносных формах заболевания летальность может быть высокой. При холере Эль-Тор часто наблюдаются стертые формы и бессимптомное вибриононосительство.
Вирусный гепатит А. Возбудитель относится к группе энтеровирусов. Источник инфекции — больной человек и вирусоноситель. Основным путем передачи вируса является фекально-оральный, но возможен парентеральный механизм передачи, предполагают возможность воздушно-капельной передачи. Наиболее восприимчивы к инфекции дети (после года) и молодежь. Инкубационный период гепатита А составляет в среднем 21—28 дней (от 7 до 50 дней). Симптомы болезни – слабость, тошнота, рвота, боли в правом подреберье, желтуха и др. Прогноз в основном благоприятный.
Наиболее восприимчивы к инфекции дети (после года) и молодежь. Инкубационный период гепатита А составляет в среднем 21—28 дней (от 7 до 50 дней). Симптомы болезни – слабость, тошнота, рвота, боли в правом подреберье, желтуха и др. Прогноз в основном благоприятный.
К острым кишечным инфекциям относят также другие вирусные диареи (вирусные гастроэнтериты): ротавирусная, паровирусная и пикорновирусная, способные передаваться от человека к человеку контактно-бытовым путем, а также с загрязненной водой или пищей. В пищевых продуктах размножение вирусов не происходит.
Принципы профилактики кишечных инфекций:
· высокий уровень благоустройства предприятия;
· строгое соблюдение санитарного режима уборки, дезинфекции, дезинсекции и дератизации;
· строгое соблюдение правил личной гигиены;
· своевременное выявление больных и носителей и их изоляция;
· соблюдение санитрно-гигиенических требований при производстве, хранении и реализации пищи и пищевых продуктов.
Профилактика острых кишечных инфекций
Острые кишечные инфекции широко распространены во всем мире, они поражают взрослых и детей.
Среди всех инфекционных патологий острые кишечные инфекции составляют 20%.
В 2018 году острыми кишечными инфекциями в России зафиксировано более 816 тысяч случаев заболеваний острыми кишечными инфекциями.
Профилактика инфекционных заболеваний особенно актуальна в период ухудшения паводковой ситуации.
Паводки — подъёмы уровня воды, возникающие в результате выпадения обильных осадков.
Благоприятные условия для размножения болезнетворных микроорганизмов в период паводков – угроза для здоровья большого количества людей. Подъем уровня воды – это всегда риск кишечных инфекций (бактериальных и вирусных) : дизентерии, ротавирусной, норовирусной инфекции, гепатита А и других заболеваний с фекально-оральным и водным путями распространения.
Острые кишечные инфекции — группа инфекционных заболеваний, вызванных различными микроорганизмами (бактериями, вирусами), проявляющаяся расстройствами пищеварения и симптомами обезвоживания.
Кишечные инфекции встречаются в любое время года: вирусные, чаще всего встречаются в холодное время года (с ростом заболеваемости гриппом и ОРВИ), бактериальные — в теплое время года.
В связи с благоприятным воздействием теплого климата на размножение микроорганизмов, особенно высок уровень заболеваемости острыми кишечными инфекциями в летний период времени. В этот период отмечается резкое повышение уровня инфицированности воды, почвы, продуктов питания возбудителями острых кишечных инфекций. Особенно подвержены в теплый период кишечным инфекциям дети. Это связано с низкой степенью активности защитных факторов, а так же с отсутствием сформированных гигиенических навыков у детей. Факторы иммунной защиты в желудочно-кишечном тракте у детей формируются к 5-летнему возрасту.
Практически все возбудители острой кишечной инфекции отличаются очень высокой устойчивостью. Например, возбудители паратифов и брюшного тифа продолжают свою жизнеспособность в молоке более 2 месяцев, в воде ещё дольше.
Микробы дизентерии в молоке могут жить и размножаться на протяжении 7 дней, а в речной воде — 35 дней. Свою жизнеспособность вирусы могут сохранять на различных предметах от 10 до 30 дней, а в фекалиях — более полугода.
Виды острых кишечных инфекций:
бактериальные: cальмонеллез, дизентерия, иерсиниоз, эшерихиоз, кампилобактериоз; острая кишечная инфекция, вызванная синегнойной палочкой, клостридиями, клебсиеллами, протеем; стафилококковое пищевое отравление, брюшной тиф, холера, ботулизм и прочие
ОКИ вирусной этиологи : ротавирусная, энтеровирусная, коронавирусная, аденовирусная, реовирусная инфекции
грибковые кишечные инфекции (чаще грибы рода Candida)
протозойные кишечные инфекции (лямблиоз, амебиаз) — отличаются крайне тяжелой клинической симптоматикой.
Кто является источником инфекции?
Основным источником инфекции является больной человек..gif) Опасным является здоровый бактерионоситель и тот, у кого заболевание протекает в стертой форме, при которой он даже этого не замечает.
Опасным является здоровый бактерионоситель и тот, у кого заболевание протекает в стертой форме, при которой он даже этого не замечает.
Как происходит заражение ?
Пути инфицирования:
В организм человека бактерии попадают через рот, вместе с пищей, водой или через грязные руки. Например, дизентерия может начаться при употреблении воды из-под крана, некипяченого молока; кишечная палочка может попасть в организм с просроченным кисломолочным продуктом; сальмонеллезом можно заразиться, употребив в пищу зараженные продукты, такие как куриное мясо и яйца, плохо промытые водой овощи и зелень.
Механизм заражения.
Основным механизмом попадания микроорганизмов в организм человека является алиментарный, но для вирусных инфекций характерен также и воздушно-капельный способ заражения.
Факторы передачи:
Пищевые продукты, предметы обихода, купание в открытых водоемах (в зависимости от инфекции).
 В передаче некоторых инфекций имеют значение насекомые (тараканы, мухи)
В передаче некоторых инфекций имеют значение насекомые (тараканы, мухи)Антисанитарные условия
Несоблюдение правил личной гигиены
* Наиболее опасны выделения больного.
Наиболее восприимчивы к кишечным инфекциям:
Дети до 5 лет
Люди преклонного возраста
Лица с заболеваниями желудочно-кишечного тракта
Люди, страдающие алкоголизмом
Люди с ослабленным иммунитетом.
Инкубационный период в среднем длится от 6 часов до 2 суток.
Клиническая картина.
Как правило, острые кишечные инфекции начинаются остро с повышения температуры тела, жидкого стула, болей в животе.
Общие симптомы острых кишечных инфекций:
Интоксикация. Повышение температуры тела, слабость, головокружение, ломота в теле
* Нарушения пищеварения: боли в области желудка, тошнота, многократная рвота, учащение стула (испражнения становятся водянистыми)
Клиническая картина и профилактика некоторых инфекций.
Инфекции, вызванные бактериями.
Холера.
Вызывает холеру бактерия вида Vibrio Cholerae.
Передается инфекция с сырой водой, пищевыми продуктами, при контакте с больными.
Инкубационный период длится от нескольких часов до 6 суток, чаще 1-2 дня.
Симптомы инфекции: заостренные черты лица, сиплый голос, мучительная жажда, постоянная рвота, сухость кожи, слабость, внезапный и частый понос, напоминающий рисовый отвар, боли в мышцах и судороги.
Лечение направлено на восстановление водно-солевого баланса, введение антибиотиков и витаминов.
Профилактика холеры заключается в предупреждении заноса инфекции, в соблюдении санитарно-гигиенических мер, таких как обеззараживание воды, мытье рук, термическая обработка пищи, обеззараживание помещений общего пользования. Специфическая профилактика состоит во введении холерной вакцины и холероген-анатоксина (действует 3-6 месяцев).
Сальмонеллез
Вызывается бактериями рода Salmonella, попадающих в организм с пищевыми продуктами животного происхождения.
Основные пути заражения:
Пищевой: мясо зараженных животных и птиц, недостаточно термически обработанные; питье загрязненной воды
При купании в загрязненной воде.
Инкубационный период длится от 2 часов до 3 суток, чаще 6-24 часа.
Симптомы: повышение температуры тела до 38-39оС, слабость, головная боль, тошнота, рвота, боли в животе, урчание, вздутие живота, многократный жидкий водянистый стул, боли в мышцах и суставах, судороги конечностей.
Лечение заключается в промывании желудка и кишечника, введении солевых растворов, спазмолитиков и антибиотиков. Необходимо обильное питье.
Профилактика: тщательная тепловая обработка мяса курицы и яиц, соблюдение правил личной гигиены, раздельные хранение и разделка сырой и готовой пищи.
Дизентерия (шигеллез).
Возбудители дизентерии принадлежат к роду Shigella.
Источником инфекции является больной или бактерионоситель.
Механизм передачи — фекально-оральный.
Основные пути передачи — контактно-бытовой, водный, алиментарный.
Факторы передачи: чаще молоко. Возможно овощи, фрукты, различные предметы, обсемененные шигеллами, мухи.
Инкубационный период длится от нескольких часов до 7 суток, чаще 2-3 суток.
Симптомы:
Заболевание начинается остро с появления болей в животе. Далее присоединяется расстройство стула. Частота стула колеблется от 10 до 20 раз в сутки. Стул сначала носит каловый характер, далее появляется слизь, кровь, уменьшается объем каловых масс, они могут приобретать вид плевка. Заболевание сопровождается повышением температуры тела, ознобом, слабостью, вялостью, снижением аппетита.
Лечение:
Больным дизентерией необходимо соблюдать постельный режим. Госпитализации подлежат больные со средне-тяжелым и тяжелым течением болезни. Назначается лечебное питание, антибактериальная терапия, компенсация потери жидкости, обильное питье. При болях в животе назначают спазмолитики.
Госпитализации подлежат больные со средне-тяжелым и тяжелым течением болезни. Назначается лечебное питание, антибактериальная терапия, компенсация потери жидкости, обильное питье. При болях в животе назначают спазмолитики.
Профилактика:
Для экстренной профилактики используют дизентерийный бактериофаг. Общая профилактика — санитарно-гигиенические мероприятия.
Ботулизм.
Возбудитель болезни — Clostridium botulinum
Заражение происходит при употреблении продуктов, в которых при анаэробных условиях размножаются бактерии и в большом количестве накапливается токсин.
Инкубационный период продолжается от 2 — 4 часов до 10 суток. В среднем — 2 суток.
Клиническая картина.
Болезнь начинается остро. Основные симптомы: головная боль, тошнота, рвота, боль в животе, нарушение зрения, глотания, изменение голоса. Смерть наступает от паралича дыхания.
Лечение.
При подозрении на ботулизм больные подлежат экстренной госпитализации в стационары, имеющие отделения реанимации. В первую очередь проводят очищение желудка и кишечника, вводят противоботулинистическую сыворотку. Наиболее эффективно её введение на первые сутки. Назначаются антибиотики. Больным с тяжелым течением болезни проводится искусственная вентиляция легких.
В первую очередь проводят очищение желудка и кишечника, вводят противоботулинистическую сыворотку. Наиболее эффективно её введение на первые сутки. Назначаются антибиотики. Больным с тяжелым течением болезни проводится искусственная вентиляция легких.
Профилактика:
Строгое соблюдение технологии производства консервированных продуктов.
Домашние заготовки хранить в холодильнике.
Лицам, употребившим подозрительный продукт, вводят половину лечебной дозы противоботулинистической сыворотки.
Инфекции, вызванные вирусами.
Ротавирусная инфекция.
Возбудителем инфекции является ротавирус.
Болеют в основном дети от 6 месяцев до 4 лет.
Механизм передачи возбудителя — фекально-оральный, чаще через воду.
Источник заболевания — больной, в меньшей степени вирусоноситель.
Инкубационный период длится от 15 часов до 7 суток.
Клиническая картина.
Болезнь начинается бурно, остро, появляются схваткообразные боли в животе, урчание, жидкий стул. У половины заболевших — рвота. Эти симптомы сочетаются с лихорадкой, головной болью, интоксикацией и катаральными явлениями. Отмечается снижение или отсутствие аппетита.
Лечение.
Госпитализации подлежат больные с выраженными признаками обезвоживания. Основная масса больных лечится на дому. Проводится регидратационная терапия. Восполнение жидкости в объемах, соответствующих потерям. Назначается щадящая диета до восстановления стула.
Профилактика:
Энтеровирусные инфекции.
Возбудитель — энтеровирусы групп Коксаки А, Коксаки В, ЕСНО.
Механизм передачи — фекально-оральный. Путь передачи — алиментарный. Факторы передачи чаще всего — овощи.
Источник инфекции — больной человек, который выделяет вирусы в окружающую среду с испражнениями и отделяемым дыхательных путей.
Инкубационный период составляет от 2 до 10 суток.
Клиническая картина.
Болезнь начинается остро с повышения температуры тела до 38-39оС, головной боли, боли в мышцах. Возможны тошнота и рвота, частый жидкий стул. Иногда присоединяются катаральные явления (ринит, фарингит, ларингит), а также герпетические высыпания на миндалинах. Проявления энтеровирусных инфекций многообразны, в особо тяжелых формах возможно развитие серозных менингитов и поражений сердца.
Лечение.
Госпитализация проводится по клиническим показаниям. В частности, при наличии менингеального синдрома и других поражениях нервной системы. Проводят противовоспалительную и дегидратационную терапию.
Профилактика:
Раннее выявление заболевших
Изоляция заболевших на 2 недели
В очаге инфекции — дезинфекция
Детям до 3 лет, имевшим контакт с больными, вводится нормальный человеческий иммуноглобулин, в нос закапывается лейкоцитарный интерферон в течение 7 дней.

Инфекции, вызванные простейшими.
Лямблиоз.
Возбудитель инфекции — Lamblia intestinalis, относится к простейшим.
Источник инфекции — больной человек или цистоноситель. Источником цист могут быть собаки и другие животные.
Механизм передачи — фекально-оральный (через воду, пищевые продукты, предметы обихода, посуду).
Инкубационный период составляет 10-15 дней.
Клиническая картина .
У больных отмечаются боли в верхней части живота или в области пупка, вздутие живота, урчание, тошнота, запоры, сменяющиеся поносами (испражнения жёлтые, с незначительной примесью слизи), дискинезии желчных путей, атопический дерматит, общая слабость, утомляемость, раздражительность, снижение аппетита, головные боли, головокружение, плохой сон.
Лечение.
Лечение направлено на ликвидацию токсикоза, противопаразитарная терапия, диета.
Профилактика:
Своевременное выявление больных и их лечение
Защита продуктов от загрязнения
Борьба с мухами
Не использовать воду из открытых источников без предварительного кипячения
Мытье фруктов, овощей
Соблюдение правил личной гигиены.
Диагностика острых кишечных инфекций.
Диагноз устанавливается на основании клинических признаков болезни, результатов лабораторного обследования, эпидемиологического анамнеза.
Лечение острых кишечных инфекций.
При подозрении на острую кишечную инфекцию необходимо обратиться к инфекционисту, терапевту или педиатру. При значительных болях в животе у детей необходимо вызвать скорую помощь для исключения хирургической патологии. Дети раннего возраста подлежат обязательной госпитализации.
Симптомы, с которыми необходимо обратиться к врачу незамедлительно:
Жидкий стул чаще 5 раз в сутки
Многократная рвота
Кровь в стуле
Схваткообразные боли в животе
Выраженная слабость и жажда
Наличие сопутствующих хронических инфекций.

Категорически запрещено
Применять болеутоляющие средства. В случае хирургической патологии это затруднит диагностику
Самостоятельно применять противодиарейные средства, так как при большинстве кишечных инфекций токсины скапливаются кишечнике, а применение таких препаратов приведет к их накоплению
Использовать грелку. Это только усилит воспалительный процесс.
Профилактика острых кишечных инфекций.
Профилактика острых кишечных инфекций включает общегигиенические и медицинские мероприятия, проводимые постоянно, вне зависимости от времени года и от уровня заболеваемости.
Необходимо выявить источник инфекции, изолировать его и начать лечение. В помещении, где находился больной, провести дезинфекцию.
Основные меры личной профилактики:
Соблюдать правила личной гигиены: тщательно мыть руки перед приемом и раздачей пищи, после посещения туалета, улицы
Следить за чистотой рук у детей, научить их соблюдать правила личной гигиены
Употреблять для питья кипяченую или бутилированную воду
Выбирать безопасные продукты
Следить за сроками годности продуктов
Тщательно мыть овощи и фрукты перед употреблением под проточной, а для детей — кипяченой водой
Проводить тщательную термическую обработку необходимых продуктов
Употреблять пищу желательно сразу после её приготовления
Готовые продукты хранить на холоде, оберегая их от мух.
 Не оставлять готовые продукты при комнатной температуре более чем на 2 часа
Не оставлять готовые продукты при комнатной температуре более чем на 2 часаПравильно хранить продукты в холодильнике: не допускать контакта между сырыми и готовыми продуктами (хранить в разной посуде)
Содержать кухню в чистоте
Не скапливать мусор
Выезжая на отдых, необходимо брать с собой запас чистой питьевой воды. Не употреблять воду из открытых источников
Купаться только в специально отведенных для этой цели местах. При купании в водоемах и бассейнах не допускать попадания воды в рот.
Меры общественной профилактики.
В целях профилактики острых кишечных инфекций осуществляется государственный санитарно-эпидемиологический надзор за соблюдением санитарных правил и норм на объектах производства, хранения, транспортировки и реализации (оптом и в розницу) пищевых продуктов, общественного питания, водоканала, независимо от форм собственности и ведомственной принадлежности; за соблюдением персоналом санитарных правил и норм в организованных коллективах детей и взрослых, в лечебно-профилактических учреждениях, санаториях, домах отдыха, домах престарелых и др.
Проводится обязательная гигиеническая подготовка работников отдельных профессий, производств и организаций, связанных непосредственно с процессом производства, приготовления, хранения, транспортировки и реализации пищевых продуктов, питьевой воды, обучением и воспитанием детей и подростков с выдачей им личных медицинских книжек.
Острые кишечные инфекции
По данным ВОЗ ежедневно в мире регистрируется 275 миллионов диарейных заболеваний у детей и взрослых. Болеют люди практически во всех странах мира независимо от социального положения, национальности, расы, пола и возраста. Чаще болеют дети 2-6 лет. Заболевания регистрируются повсеместно в течение всего года, но чаще в весенне-летний период.
Острые кишечные инфекции – это группа заразных заболеваний, которые повреждают кишечный тракт. Самое ,, безобидное,, — так называемое пищевое отравление, а самые опасные – холера, брюшной тиф, ботулизм, сальмонеллез, дизентерия, бруцеллез, иерсиниоз. Они остаются основной причиной заболеваемости и смертности во всем мире, в результате чего ежегодно умирает от 600 тысяч до 1,5 млн человек(2/3 из них составляют дети до 10 лет).
Лето – благодарное время не только для отдыха, но и , к сожалению, для размножения возбудителей различных болезней, в первую очередь острых кишечных инфекций. Их источником являются больные люди, бактерионосители, грызуны, гельминты, необработанные овощи и фрукты, неправильно хранящиеся и скоропортящиеся продукты.
Возбудителями кишечных инфекций могут быть: бактерии( холера, дизентерия, брюшной тиф), токсины (ботулизм), а так же вирусы( энтеровирус, ротавирус) и т.д.Больные и носители инфекции выделяют микробы во внешнюю среду с рвотными массами, мочой, испражнениями. Они устойчивы во внешней среде, живут, не боятся холода, однако, предпочитают тепло и влагу. Могут долго сохраняться на руках, посуде, игрушках, предметах обихода, в почве, воде. Многие из них могут размножаться в продуктах питания при комнатной температуре и даже низкой температуре.
При кипячении и обработке дезинфицирующими средствами микробы погибают.
Из-за нехватки времени взрослые и дети едят на ходу, не помыв руки. Многие мамы позволяют своим малышам есть только что приобретенные ягоды и фрукты. Заражающая доза для детей намного меньше, чем у взрослых, поэтому и течение болезни намного тяжелее: быстрее наступает обезвоживание, токсины попадают в головной мозг и жизненно важные органы ребенка. У детей, вскормленных грудью. Уровень иммуноглобулинов А и G, защищающих слизистую кишечника, настолько высок, что восприимчивость к токсинам и микробам минимальная.
Многие мамы позволяют своим малышам есть только что приобретенные ягоды и фрукты. Заражающая доза для детей намного меньше, чем у взрослых, поэтому и течение болезни намного тяжелее: быстрее наступает обезвоживание, токсины попадают в головной мозг и жизненно важные органы ребенка. У детей, вскормленных грудью. Уровень иммуноглобулинов А и G, защищающих слизистую кишечника, настолько высок, что восприимчивость к токсинам и микробам минимальная.
Дизентерия может начаться: если употребить некипяченое(парное) молоко, творог, сметану, приготовленные в домашних условиях. Кишечную палочку находят в некачественном кефире, йогурте. Стафилококк любит торты с кремом, глазированные сырки. А сальмонелла( их около 400 видов) попадает через яйца, куриное мясо, сосиски, плохо вымытые или вымытые грязной водой овощи и зелень. Доказано, что максимальное количество микробов обитает на денежных купюрах. На руках продуктовых колясок в гипермаркетах, куда усаживают маленьких детей во время ,,шопинга,,.
Диареи вирусной природы ( энтеровирус, ротавирус) начинаются остро, быстро распространяются. Возможно бессимптомное носительство и продолжающееся выделение вируса во внешнюю среду после клинического выздоровления. Поэтому могут одновременно болеть все члены семьи и организованные детские коллективы ( классы, детсады, пионерские лагеря).
От момента попадания микробов в организм проходит от 6 до 48 часов. Об острой кишечной инфекции может говорить тошнота, рвота, озноб. Лихорадка, схваткообразные боли в животе, жидкий стул, сниженный аппетит, жажда. Диагноз устанавливает врач, которого необходимо своевременно вызвать к заболевшему.
Если заражение все-таки произошло и в доме появился больной с расстройством кишечника, необходимо помнить следующее:
- Больного изолировать в отделенное помещение и вызвать врача
- Выделить отдельную посуду больному, мыть тщательно руки после ухода за ним; обеззараживать посуду и другие предметы кипячением
- Уход должен обеспечивать один человек
- Выпаивать больного кипяченой водой или раствором ,,регидрон,,
- Не заниматься самолечением; запрещено делать клизму, принимать аспирин, левомецитин, тетрациклин
- Ограничить посещение к больному
Основные правила предупреждения кишечных инфекций:
- Соблюдать правила личной гигиены, тщательно мыть руки перед едой и ее приготовлением; обучать детей правилам личной гигиены
- Содержать в чистоте кухню, жилище и прилегающие территории, обеззараживать нечистоты
- Использовать только свежие продукты, не закупать их впрок; соблюдать правила кулинарной обработки4 сырые и готовые продукты хранить раздельно
- Овощи и фрукты мыть, обдавать кипятком, экзотические фрукты и овощи из стран Азии, Африки можно употреблять только после термической обработки
- Воду из открытых водоемов необходимо кипятить перед использованием; исключить попадание воды в рот при купании.
 Пользоваться бутилированной водой
Пользоваться бутилированной водой - Приобретать продукты в магазинах или специально оборудованных рынках
- Не употреблять в пищу незнакомые грибы
- Молоко и творог. Купленные у частника, подлежат термической обработке, т.к. в них могут быть бациллы туберкулеза, бруцеллеза, или вирусы клещевого энцефалита
- Боритесь с мухами: садясь на продукты, они заражают их микробами; Продукты должны быть недоступны для насекомых, грызунов и домашних животных
- Яйца должны быть вымыты щеточкой перед употреблением. Варить не менее 30 минут( сальмонелла может находиться в желтке)
Профилактика кишечных инфекций
Наибольший подъем заболеваемости кишечными инфекциями наблюдается в летне-осенний период, что связано с массовыми выездами на дачи, употреблением овощей и фруктов, расширением уличной торговли скоропортящимися продуктами, купанием в открытых водоемах.
К кишечным инфекциям относятся дизентерия, сальмонеллез, брюшной тиф, паратифы А и Б, холера, гастроэнтерит, пищевые токсикоинфекции, вирусный гепатит А, вирусные кишечные инфекции (аденовирус, ротавирус, норовирус, астро вирус и т. д.). Основными проявлениями заболевания кишечными инфекциями, на которые следует обращать внимание, являются слабость, вялость, плохой аппетит, диарея, рвота, боли в животе, повышение температуры и появление озноба. При острых кишечных инфекциях вирусной этиологии наряду с поражениями кишечника отмечаются изменения со стороны верхних дыхательных путей: неба, дужек, язычка — при ротавирусной инфекции; трахеобронхит — при аденовирусной инфекции.
Для всех этих заболеваний характерным является проникновение возбудителей через рот и размножение их в кишечнике человека, откуда они с выделениями вновь попадают во внешнюю среду: почву, воду, на различные предметы и продукты питания.
Возбудители кишечных инфекций обладают высокой устойчивостью во внешней среде, сохраняя свои болезнетворные свойства в течение от нескольких дней до нескольких недель и даже месяцев. Еще более устойчивы во внешней среде патогенная кишечная палочка, возбудители брюшного тифа, вирусного гепатита, вирусы. В передаче возбудителей могут участвовать несколько основных факторов: вода, пищевые продукты, почва, предметы обихода, живые переносчики (например, насекомые) и т.д. В пищевых продуктах возбудители кишечных инфекций не только сохраняются, но и активно размножаются, не меняя при этом внешнего вида и вкуса продукта. Но при действии высокой температуры, например — при кипячении, возбудители кишечных инфекций погибают.
Источником заражения кишечными инфекциями является человек – больной или бактерионоситель (практически здоровый человек, в организме которого находятся возбудители кишечных инфекций).
Восприимчивость людей к кишечным инфекциям довольно высокая.
Опасность заражения кишечными инфекциями представляют продукты (блюда из них), употребляемые в холодном виде, без тепловой обработки, т.к. микробы в ней не только хорошо сохраняются, но и размножаются.
В этом плане большую опасность представляют собой кремово- кондитерские изделия, салаты, винегреты, молоко, масло, другие пищевые продукты (особенно те, которые не подлежат термической обработке).
Одним из факторов заражения и распространения кишечных инфекций является вода. Опасность заражения кишечными инфекциями представляет употребление для питья, мытья посуды, рук, овощей и фруктов воды открытых водоемов, талой воды. Заражение может произойти при купании в открытых водоемах. К заражению кишечными инфекциями может привести употребление воды из колодца, если колодец неправильно построен или неправильно используется.
Предметы домашнего обихода тоже могут содержать возбудителей различных заболеваний, особенно если в семье есть больной (или носитель) какого- либо заболевания. Это посуда, через которую могут передаваться кишечные инфекции, игрушки для детей, полотенца.
Профилактика кишечных инфекций включает простые правила гигиены:
Несвоевременное обращение за медицинской помощью может отрицательно сказаться на здоровье и привести к заражению окружающих.
Все мы обязаны заботиться о своем здоровье. При обнаружении у себя того, или иного инфекционного заболевания необходимо срочно обратиться к врачу. Не занимайтесь самолечением! Многие заболевания, например — дизентерия и сальмонеллез, в результате самолечения могут приобрести хронический характер.
По данным сайта www.rospotrebnadzor.ru |
Острые кишечные инфекции | Государственное бюджетное учреждение здравоохранения «Городская больница» г.Гая
Острые кишечные инфекции — это группа инфекционных болезней, при которых наблюдается преимущественное поражение кишечника. Возбудителями острых кишечных инфекций являются различные виды бактерий и вирусов. Основные симптомы острых кишечных инфекций это сильный понос, боли в животе, тошнота, рвота, повышение температуры. У детей острая кишечная инфекция может проявляться сильным беспокойством, поносом, отказом от пищи.
У детей острая кишечная инфекция может проявляться сильным беспокойством, поносом, отказом от пищи.
Более 60% всех случаев кишечной инфекций встречается у детей. Каждый год от кишечных инфекций в мире умирает около 1 млн. детей (большая часть в возрасте до 2 лет.) Причиной развития острых кишечных инфекций могут быть бактерий (сальмонелла, шигеллы, стафилококк, холера и др.), а также вирусы (энтеровирус, ротавирус).
Кишечные инфекции, передаются преимущественно, через пищу, воду, предметы обихода. Возбудители кишечных инфекций быстро развиваются в еде, в воде, на грязных руках.
Для кишечных инфекций характерно повышение температуры тела до 38-39 ° С, сопровождающееся ознобом, слабостью, головной болью. Однако столь выраженная интоксикация встречается не всегда – иногда температура повышается незначительно или остается нормальной.
Наиболее характерными проявлениями кишечной инфекции являются рвота и понос. Эти симптомы могут появляться отдельно друг от друга или одновременно. Рвота обычно сопровождается тошнотой и, как правило, приносит облегчение. Понос обильный водянистый – до 10-15 раз в сутки, сопровождается схваткообразными болями в околопупочной области.
Рвота обычно сопровождается тошнотой и, как правило, приносит облегчение. Понос обильный водянистый – до 10-15 раз в сутки, сопровождается схваткообразными болями в околопупочной области.
Затем к общей картине заболевания присоединяются признаки обезвоживания. Начальным признаком потери жидкости является сухость во рту; при более тяжелом течении заболевания учащается пульс, снижается артериальное давление, появляется осиплость голоса, судороги кистей и стоп.
Профилактика кишечной инфекции
Профилактика заключается в соблюдении правил личной гигиены: нельзя забывать о «золотом» правиле – мыть руки перед едой. Не рекомендуется употреблять в пищу продукты с истекшим сроком годности, даже хранившиеся в холодильнике, поскольку многие токсины способны сохраняться при низких температурах. Тщательно мыть овощи и фрукты. В поездках рекомендуется, есть только свежеприготовленные горячие блюда, избегать сырых овощей, салатов, неочищенных фруктов, пить только кипяченую или обеззараженную воду, не употреблять напитков со льдом.
Сальникова Л.В. – зав. инф. отд. ГБУЗ ГРБ.
Гастроэнтерит у детей — Harvard Health
Что это такое?
Гастроэнтерит — это воспаление желудка и кишечника, вызывающее диарею, рвоту, тошноту и другие симптомы расстройства пищеварения. В промышленно развитых странах наиболее частыми причинами гастроэнтерита у детей являются вирусы, бактерии (пищевое отравление) и кишечные паразиты.
- Вирусный гастроэнтерит — У здоровых детей вирусные инфекции пищеварительного тракта часто вызывают легкие эпизоды гастроэнтерита.В Соединенных Штатах наиболее частыми причинами вирусного гастроэнтерита у детей являются норволк-подобный вирус (норовирус), аденовирусы, энтеровирусы (в летние месяцы), астровирусы и ротавирусы. Все эти вирусы имеют тенденцию распространяться на руках, которые коснулись либо стула инфицированного человека, либо поверхностей, загрязненных инфицированным стулом. По этой причине маленькие дети, особенно те, кто только начинает приучать себя соблюдать правила гигиены, особенно уязвимы для вирусного гастроэнтерита. Они могут дотронуться до грязных подгузников (своих или товарищей по играм), забыть помыть руки после посещения туалета, засовывать грязные пальцы в рот, кусать ногти или жевать и сосать игрушки, к которым другие дети дотрагивались грязными руками. .Родители и детский персонал также могут передавать вирусный гастроэнтерит от ребенка к ребенку, особенно если они не моют руки с мылом после каждой смены грязных подгузников. Кроме того, взрослые, которые сами болеют вирусным гастроэнтеритом, иногда могут передавать свои вирусные инфекции детям, особенно если они готовят детскую еду, не вымыв предварительно руки с мылом. Иногда некоторые вирусы, вызывающие вирусный гастроэнтерит, также обнаруживаются в питьевой воде или продуктах питания, в основном в развивающихся странах и сельских районах, где санитарные условия плохие.
- Бактериальный гастроэнтерит (пищевое отравление) — Пища, которая не была приготовлена или хранилась должным образом, может размножать бактерии на своей поверхности, и эти бактерии иногда производят раздражающие химические вещества, называемые токсинами. Если ребенок ест пищу, наполненную микробами, симптомы гастроэнтерита вызываются либо самими бактериями, либо их побочными продуктами раздражения. Кроме того, некоторые типы агрессивных бактерий, такие как Campylobacter, Salmonella или E. coli 0157, могут вызывать более тяжелые формы пищевого отравления, вызывающие высокую температуру, тяжелые желудочно-кишечные симптомы и обезвоживание, даже у обычно сильных и здоровых детей.
- Кишечные паразиты — Кишечные паразиты могут передаваться детям через грязные руки, на загрязненные поверхности игрушек и сантехники, а также через загрязненную воду или пищу. Лямблии лямблии, паразиты, вызывающие лямблиоз, являются наиболее частой паразитарной причиной диареи среди детей в Соединенных Штатах, особенно в детских учреждениях.
Во всем мире гастроэнтерит является основной причиной детской смертности, особенно в развивающихся странах, где уровень санитарии и здравоохранения оставляет желать лучшего.Большинство этих детей умирают от крайнего обезвоживания (аномально низкого уровня жидкости в организме) в результате сочетания сильной диареи, рвоты и недостаточного потребления жидкости. Даже в промышленно развитых странах ежегодно случаются миллионы эпизодов гастроэнтерита, особенно у детей раннего возраста. В Соединенных Штатах ротавирусные инфекции были причиной более 3 миллионов случаев гастроэнтерита у детей каждый год, по крайней мере, 50 000 госпитализаций и 20-40 смертей. К счастью, ротавирусная вакцина, которую вводят младенцам, оказалась очень эффективной в снижении числа умеренных и тяжелых случаев ротавирусной болезни в Соединенных Штатах.
Чтобы продолжить чтение этой статьи, вы должны войти в .
Подпишитесь на Harvard Health Online, чтобы получать немедленный доступ к новостям здравоохранения и информации Гарвардской медицинской школы.
- Исследовать состояние здоровья
- Проверьте свои симптомы
- Подготовка к визиту к врачу или обследованию
- Найдите лучшие методы лечения и процедуры для вас
- Изучите возможности для лучшего питания и физических упражнений
Новые подписки на Harvard Health Online временно недоступны.Нажмите кнопку ниже, чтобы узнать о других наших предложениях по подписке.
Подробнее »
Гастроэнтерит у детей — проблемы здоровья детей
Детей следует поощрять пить жидкости, даже если они используются часто и небольшими порциями. Младенцы должны продолжать кормить грудью или пить смесь в дополнение к пероральному раствору электролита (раствор для пероральной регидратации — доступны в виде порошков и жидкостей в аптеках и некоторых продуктовых магазинах).Сок, газированные напитки, газированные напитки, чаи, спортивные напитки и напитки, содержащие кофеин, нельзя давать младенцам и детям младшего возраста. Эти напитки могут содержать слишком много сахара, что может усугубить диарею, и содержать слишком мало солей (электролитов), которые необходимы для восполнения тех, которые организм потерял. Для подростков спортивные напитки предпочтительнее сока и газировки из-за более низкого содержания в них сахара, но они все же содержат меньшее количество электролитов, чем оральные растворы электролитов. Обычная вода не идеальна для лечения обезвоживания у детей любого возраста, потому что в простой воде нет солей.
Детям, у которых рвота , следует часто давать небольшие количества жидкости, чтобы предотвратить обезвоживание. Родители должны предложить ребенку несколько глотков жидкости. Если жидкость не вырвана, глотки повторяют каждые 10 или 15 минут, увеличивая дозу до одной или двух унций через час или около того и увеличивая по мере переносимости. Эти большие количества можно давать реже, примерно каждый час. Жидкости всасываются очень быстро, поэтому, если у ребенка рвота более чем через 10 минут после питья, большая часть жидкости абсорбируется, и прием жидкости следует продолжить.Количество жидкости, которое нужно дать ребенку в течение 24 часов, зависит от возраста и веса ребенка, но обычно должно составлять от 1½ до 2½ унций жидкости на каждый фунт, который весит ребенок. Если у ребенка уменьшаются рвота или диарея, родители могут попробовать кормить ребенка более обычной диетой на следующий день. Растворы электролитов не следует принимать в одиночку более 24 часов из-за потенциальных проблем, связанных с недостаточным питанием.
Детям с диареей, но с небольшой рвотой следует получать дополнительную жидкость, чтобы восполнить потерю жидкости при диарее.Но, в отличие от детей, страдающих рвотой, им могут давать большее количество жидкости за один раз и они питаются своей обычной диетой. Однако, если у ребенка сильная диарея, вероятно, следует сократить потребление молочных продуктов (содержащих лактозу). Тяжелый гастроэнтерит может снизить способность ребенка усваивать лактозу, что приведет к еще большей диарее.
Дети, которые не могут пить даже глотками или у которых есть признаки сильного обезвоживания (такие как вялость, сухость во рту, отсутствие слез и отсутствие мочи в течение 6 часов и более), находятся в опасности, и им следует немедленно обратиться к врачу.Детям, у которых нет этих признаков, следует обратиться к врачу, если симптомы длятся более 1-2 дней. Если обезвоживание тяжелое, врач может дать ребенку жидкости через вену (внутривенно).
Желудочно-кишечные инфекции, борьба с желудочно-кишечными инфекциями
Желудочно-кишечные инфекции
- > 200 миллионов эпизодов инфекционного гастроэнтерита в год в США 1
- Во всем мире 3-6 миллионов детей ежегодно умирают от инфекционного гастроэнтерита 2
- Вспышки желудочно-кишечных инфекций вызывают серьезную озабоченность в больницах
Определение
Желудочно-кишечные инфекции — это вирусные, бактериальные или паразитарные инфекции, вызывающие гастроэнтерит, воспаление желудочно-кишечного тракта, затрагивающее как желудок, так и тонкий кишечник.Симптомы включают понос , рвоту и боль в животе . Обезвоживание — основная опасность желудочно-кишечных инфекций, поэтому регидратация важна, но большинство желудочно-кишечных инфекций проходят самостоятельно и проходят в течение нескольких дней. Однако в медицинских учреждениях и в определенных группах населения (новорожденные / младенцы, пациенты с ослабленным иммунитетом или пожилые люди) они потенциально опасны. Быстрая диагностика , соответствующее лечение и Инфекционный контроль Поэтому меры особенно важны в этих условиях.
Инфекции желудочно-кишечного тракта могут быть вызваны большим количеством микроорганизмов, в том числе:
Аденовирус
Аденовирус может вызывать диарею, лихорадку, конъюнктивит, инфекции мочевого пузыря и сыпь, но наиболее распространенным симптомом является респираторное заболевание. После ротавируса это самая частая причина детской диареи.
Campylobacter
Campylobacter является одной из наиболее частых бактериальных причин гастроэнтерита во всем мире и часто встречается у детей в возрасте до двух лет.Это может вызвать диарею (иногда с кровью), спазмы в животе, рвоту и жар. Обычно он передается с пищей через сырое или недоваренное мясо (особенно из домашней птицы ) или через зараженное молоко.
Clostridium difficile
Clostridium difficile Инфекция вызывает до 25% случаев антибиотико-ассоциированной диареи, наиболее часто возникающих в больницах или медицинских учреждениях 3 . Наибольшему риску подвержены пожилые люди и пациенты с ослабленным иммунитетом.Недавнее появление высокотоксигенных и устойчивых штаммов C. difficile привело к более частым и серьезным вспышкам, , увеличению заболеваемости на , и смертности.
Escherichia coli
Escherichia coli , часто называемая E. coli , является основной причиной диареи путешественников и основной причиной диарейных заболеваний в развивающихся странах, особенно среди детей.Люди обычно заражаются кишечной палочкой при проглатывании воды, загрязненной фекалиями человека или животных.
Escherichia coli O157: H7
Escherichia coli O157: H7 представляет собой продуцирующую токсин шига форму бактерии E. coli , которая вызывает желудочно-кишечные инфекции с такими симптомами, как кровавая диарея и рвота. Хотя обычно он проходит через несколько дней, иногда (5-10% 4 инфекций) может привести к гемолитико-уремическому синдрому (ГУС), который может привести к почечной недостаточности при отсутствии лечения.
Helicobacter pylori
Helicobacter pylori , называемый H. pylori , является причиной гастрита и связан с развитием желудочной и язвы двенадцатиперстной кишки . Это может вызвать боль в животе или тошноту, но во многих случаях симптомы отсутствуют. У инфицированных людей риск развития пептических язв в течение жизни составляет 10-20%, а риск рака желудка — 1-2%. 5 .
Ротавирус
Ротавирус является наиболее частой причиной диареи у детей младшего и младшего возраста и вызывает самые тяжелые случаи.Вакцина против ротавируса существует, но во всем мире она вызывает более чем ½ миллиона случаев смерти детей в возрасте до пяти лет в год. 6 Большинство из них находится в развивающихся странах.
Сальмонелла и шигелла
Salmonella и Shigella являются желудочно-кишечными заболеваниями пищевого происхождения. Сальмонелла широко распространена и содержится в сыром мясе, птице, морепродуктах и яйцах, а также в молоке и молочных продуктах. Острые симптомы включают тошноту, рвоту, спазмы в животе, диарею, лихорадку и головную боль.Шигелла часто встречается в воде, загрязненной фекалиями человека. Симптомы шигеллеза (бактериальной дизентерии) включают боль в животе, спазмы, диарею, лихорадку, рвоту и кровь, гной или слизь в стуле.
Золотистый стафилококк
Staphylococcus aureus — наиболее частая причина пищевой интоксикации, характеризующаяся резким / сильным началом, сильной тошнотой, судорогами, рвотой и диареей при продолжительности действия 1-2 дня. Этот условно-патогенный микроорганизм может быть обнаружен на людях (кожа, инфицированные порезы, носы и горло) и был связан с широким спектром пищевых продуктов, включая мясо и мясные продукты, птицу и яичные продукты, салаты, хлебобулочные и молочные продукты.
Yersinia enterocolitica
Yersinia enterocolitica , называемая Y. enterocolitica , является относительно нечастой причиной диареи и болей в животе. Инфекция чаще всего передается при употреблении в пищу зараженных продуктов, особенно сырых или недоваренных продуктов из свинины, а также мороженого и молока. Общие симптомы — лихорадка, боль в животе и диарея, часто с кровью.
Диагностика
Когда симптомы указывают на возможную желудочно-кишечную инфекцию , диагноз может быть подтвержден с помощью лабораторных тестов , используемых для посева или обнаружения антигена в образцах кала.В некоторых случаях (например, для E. coli , Salmonella, C. difficile …), при необходимости, для определения устойчивости микробов к терапии антибиотиками используется тестирование чувствительности к антибиотикам. Быстрая диагностика, особенно в больничных условиях, дает важную информацию для реализации мер инфекционного контроля .
Чтобы диагностировать причину диареи, полезно определить контекст: вспышка болезни пищевого происхождения или «диарея путешественников».
Пищевые очаги:
- Часто местные — группа людей, вместе принимающих пищу, страдает одной и той же болезнью.
- Проблема общественного здравоохранения, когда она широко распространена, затрагивает людей в разных местах и в течение более длительного периода времени.
- Важно распознать и эпидемиологически отслеживать, чтобы не допустить заражения большего числа людей.
- E. coli , Salmonella , Campylobacter и Staphylococcus являются одними из наиболее распространенных патогенов, вызывающих вспышки болезней пищевого происхождения.
Диарея путешественников :
- Наиболее распространенное заболевание, связанное с путешествиями.
- Заражены людьми, путешествующими в местах, где есть другие патогенные микроорганизмы, чем они привыкли, особенно в регионах, где более распространено заражение продуктов питания / воды.
- Чаще всего передается при приеме пищи или воды, загрязненной фекалиями.
- Большинство случаев вызвано бактериями, включая E. coli , Salmonella и Shigella .
Профилактика / Лечение
Лучшие способы предотвратить желудочно-кишечных инфекций включают:
- Правильная стирка рук
- Дезинфекция загрязненных поверхностей отбеливателем
- Стирка загрязненных предметов одежды
- Выявление инфицированных пациентов как можно скорее для внедрения расширенного инфекционного контроля
- Вакцины от большинства желудочно-кишечных инфекций отсутствуют.Исключения:
- Ротавирус
- Аденовирус (ограниченное количество)
- Для C. difficile : избегать без надобности назначения антибиотиков
Лечение Меры при желудочно-кишечных инфекциях включают:
- Регидратация — пероральная, иногда внутривенная
- Во многих случаях бактериального гастроэнтерита требуется только симптоматическое лечение (от лихорадки, диареи…).
- Антибиотики обычно не рекомендуются, поскольку они не влияют на вирусные инфекции, могут вызывать побочные эффекты, а чрезмерное употребление увеличивает риск развития устойчивых бактерий.
- Антибиотики могут быть рекомендованы в особо тяжелых случаях гастроэнтерита или если в качестве его причины были определены определенные бактерии.
Руководящие принципы
- Американское общество эпидемиологии здравоохранения (SHEA) / Американское общество инфекционных заболеваний (IDSA)
Клинические рекомендации по лечению инфекции Clostridium difficile у взрослых: обновление 2010 г., подготовленное SHEA / IDSA Infect. Control Hosp. Эпидемиол. 2010; 31 (5): 000-000
http: // www.jstor.org/stable/10.1086/651706
ССЫЛКИ
- Брайан CS. Инфекционные болезни в первичной медико-санитарной помощи. Издание: Сондерс. 2002
- Медицинская онлайн-библиотека Мерк — Заболевания желудочно-кишечного тракта www.merck.com
- Bartlett JG. Клиническая практика. Диарея, связанная с антибиотиками. N Engl J Med 2002; 346: 334-349
- Веб-сайт CDC: http://www.cdc.gov/ecoli/
- Clin Microbiol Rev.2006 июль; 19 (3): 449–490. doi: 10.1128 / CMR.00054-05
«Патогенез инфекции Helicobacter pylori», Йоханнес Г.Кустерс, Арно Х. М. ван Влит и Эрнст Дж. Кейперс http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1539101/ - Веб-сайт CDC: http://www.cdc.gov/rotavirus/index.html
Этот сайт не является источником медицинских консультаций
Медицинское содержание этого сайта представлено в краткой форме, носит общий характер и предоставляется только в информационных целях. Он не предназначен и не рекомендуется для использования в качестве замены профессиональной медицинской консультации. Вы не должны использовать Медицинское содержание этого Сайта для диагностики проблем или заболеваний, связанных со здоровьем или физической подготовкой.Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг относительно любого заболевания или лечения. Ничто, содержащееся на этом Сайте, не предназначено для медицинской диагностики или лечения. Он не должен использоваться врачами как единственный источник информации для принятия решений о назначении. Никогда не пренебрегайте медицинскими советами и не откладывайте их поиск из-за того, что вы прочитали на этом Сайте.
Инфекции кишечника | healthdirect
Основные факты
- Инфекции кишечника вызываются микроорганизмами («микробами») в кишечнике и иногда называются желудочно-кишечными инфекциями (гастроэнтеритом).
- Вы можете заразиться кишечной инфекцией, употребляя зараженную воду или пищу, или контактируя с другим инфицированным человеком.
- Инфекции кишечника могут быть вызваны вирусами (например, ротавирусом), бактериями (например, сальмонеллой) и паразитами (например, лямблиями).
- Вам следует обратиться к врачу, если симптомы серьезны, у вас жар, в стуле есть кровь или слизь, у вас есть признаки обезвоживания или если диарея длилась более 2 или 3 дней.
На этой странице
Что такое кишечная инфекция?
Инфекции кишечника вызываются микроорганизмами («жуками» или микробами), попавшими в ваш кишечник, который является частью вашей пищеварительной системы.
Инфекцию кишечника иногда называют желудочно-кишечной инфекцией или гастроэнтеритом.
Люди обычно заражаются от:
- употребление в пищу или питье зараженной воды или пищи (часто называемое пищевым отравлением)
- контактирует с инфицированными людьми или зараженными предметами, такими как столовые приборы, краны, игрушки или подгузники
Инфекции кишечника распространены в Австралии, но люди также часто заражаются, путешествуя за границу.Инфекции кишечника могут поразить кого угодно в любое время. Они могут причинить много дискомфорта и неудобств, а иногда и привести к более серьезным проблемам.
Каковы симптомы кишечной инфекции?
Некоторые общие симптомы кишечной инфекции включают:
У некоторых людей также выделяется кровь в стуле (фекалии), в том числе в случае инфекции, известной как дизентерия. Кровь в стуле может быть вызвана бактериями или паразитами, но это может быть что-то более серьезное, и вам всегда следует обращаться к врачу, если у вас есть этот симптом.
Когда мне следует обратиться к врачу?
Запишитесь на прием к врачу, если у вас есть:
Если вашему ребенку меньше 3 месяцев и у него диарея, немедленно обратитесь к врачу.
Детям следует обращаться в отделение неотложной помощи, если:
- признаки обезвоживания (отсутствие мочеиспускания, бледность, запавшие глаза, холодные руки или ноги или очень капризный)
- они не могут сдерживать жидкости
- У них очень сильная боль в животе
- они нездоровы, в том числе менее отзывчивы, плохо питаются или у них жар
Малыши и маленькие дети должны обратиться к врачу, если:
- у них не проходит диарея
- их кровь в помете
- худеют
ПРОВЕРЬТЕ СИМПТОМЫ — Воспользуйтесь нашей программой проверки симптомов и узнайте, нужна ли вам медицинская помощь.
Каковы наиболее частые причины кишечных инфекций?
Инфекции кишечника, вызываемые вирусами, включают:
- Ротавирус: часто встречается у детей раннего возраста; легко распространяется при контакте с зараженной рвотой или фекалиями (фекалиями).
- Норовирус: очень заразен и легко распространяется в детских учреждениях, домах престарелых и на круизных лайнерах.
Инфекции кишечника, вызываемые бактериями, включают:
- Campylobacter: часто связано с употреблением в пищу зараженной курицы; наибольшему риску подвержены молодые люди, пожилые люди, путешественники и люди, страдающие от недоедания.
- Сальмонелла: обычно передается через зараженное мясо, птицу или яйца.
- Shigella: наиболее часто встречается у путешественников в развивающиеся страны.
Инфекции кишечника, вызванные паразитами, включают:
- Лямблии: передаются с фекалиями инфицированных людей и животных; чаще всего встречается у маленьких детей, туристов и путешественников.
- Криптоспоридиоз: распространяется через зараженную пищу или воду.
- Амебиаз: поражает в основном молодых людей; обычно передается через зараженную воду или пищу.
Если у вас часто возникают симптомы кишечника, такие как диарея, это может быть признаком основного заболевания, такого как дивертикулит, болезнь Крона, синдром раздраженного кишечника или язвенный колит. Вам следует обратиться к врачу за советом.
Как диагностируются инфекции кишечника?
Чтобы диагностировать причину ваших симптомов, ваш врач может задать вам несколько вопросов и осмотреть вас. Они могут провести некоторые тесты, например:
В некоторых случаях вас могут направить в инфекционную службу.
НАЙТИ ЗДРАВООХРАНЕНИЕ — Наша поисковая система поможет вам найти врачей, аптеки, больницы и другие медицинские услуги.
Как лечат инфекции кишечника?
Большинство кишечных инфекций проходят через несколько дней. Но важно пить много жидкости, включая воду и напитки для пероральной регидратации, которые можно купить у фармацевта, чтобы избежать обезвоживания.
Диарея вызывает потерю большого количества жидкости из организма, поэтому будьте особенно осторожны с уязвимыми людьми, такими как очень молодые, очень старые и люди с плохим здоровьем.
Некоторым людям необходимы антибиотики при инфекциях кишечника, вызванных паразитами и бактериями. Если симптомы не исчезнут, обратитесь к врачу.
Можно ли предотвратить кишечные инфекции?
Многие инфекции кишечника можно предотвратить, заботясь о том, что вы едите и пьете, и соблюдая правила гигиены.
- Тщательно готовьте такие продукты, как мясо и яйца.
- Регулярно мойте руки, особенно перед тем, как прикасаться к еде.
- Путешествуя по развивающимся странам, используйте для питья и чистки зубов только воду в бутылках и избегайте льда и сырых продуктов.
- Избегайте тесного контакта с людьми с кишечной инфекцией
Ресурсы и поддержка
Если вам нужно узнать больше об инфекциях кишечника или получить совет о том, что делать дальше, позвоните в healthdirect по номеру 1800 022 222, чтобы поговорить с дипломированной медсестрой 24 часа 7 дней в неделю.
Другие языки
Health Translations имеет несколько переведенных информационных бюллетеней о состояниях, связанных с диареей.
Желудочно-кишечная микробиота и некоторые детские болезни: обзор
Бактериальная колонизация определяется сразу после рождения, через прямой контакт с материнской микробиотой, и на нее можно повлиять во время лактации.Появляются новые данные, указывающие на то, что количественные и качественные изменения микробиоты кишечника способствуют изменениям в активации иммунной системы слизистой оболочки, что приводит к внутри- или внекишечным заболеваниям. Баланс между патогенной и полезной микробиотой в детстве и подростковом возрасте важен для здоровья желудочно-кишечного тракта, включая защиту от патогенов, ингибирование патогенов, переработку питательных веществ (синтез витамина K), стимуляцию ангиогенеза и регулирование накопления жира в организме хозяина.Пробиотики могут способствовать преднамеренной модуляции кишечной микробиоты в пользу здоровья хозяина. Эта статья представляет собой обзор модуляции кишечной микробиоты при профилактике и адъювантном лечении детских желудочно-кишечных заболеваний.
1. Состав и функция желудочно-кишечной микробиоты
Микробиота желудочно-кишечного тракта человека обитает в сложной экосистеме [1]. Обычно он попадает к новорожденному после рождения и подвержен влиянию родов и загрязнению окружающей среды [2].При рождении желудочно-кишечный тракт незрелый, и их развитие продолжается в течение первых лет жизни [3]. В этот период на колонизацию бактерий в желудочно-кишечном тракте также могут влиять другие факторы, такие как тип кормления грудью (грудное вскармливание или «искусственное вскармливание») и, возможно, генетические характеристики (генотип) [3–5].
Факультативные анаэробные бактерии, такие как энтеробактерии, энтерококки и стрептококки, доминируют на первой стадии колонизации в течение недели после рождения.После этой ранней стадии эти пропорции меняются на противоположные, и количество строго анаэробных бактерий, таких как Bifidobacteria, Bacteroides и Clostridia, начинает превышать количество факультативных анаэробных бактерий [6]. Комменсальные бактерии играют важную роль в регуляции гомеостаза кишечника [7].
Адекватный процесс микробной колонизации кишечника способствует физиологическому развитию кишечника и созреванию иммунной системы, тем самым определяя риск развития заболевания в более позднем возрасте [6].Согласно Roberfroid et al. [1], несколько факторов могут влиять на количество и разнообразие бактерий, присутствующих в различных областях желудочно-кишечного тракта. Основными факторами, способствующими возникновению разнообразия бактерий, являются pH, перистальтика, доступность питательных веществ, окислительно-восстановительный потенциал в тканях, возраст хозяина, здоровье хозяина, бактериальная адгезия, взаимодействие бактерий, выделения слизи, содержащие иммуноглобулин, антагонизм бактерий и время прохождения [1 ].
Бактериальная нагрузка в желудке у здоровых людей низкая.Преобладающие выделенные организмы включают лактобациллы, стрептококки и дрожжи [8, 9]. В двенадцатиперстной кишке (тонком кишечнике) среда кислая (pH от 4 до 5), преобладают лактобациллы и стрептококки. У здоровых людей количество бактерий в двенадцатиперстной кишке выше, чем в желудке, примерно 10 2 –10 4 колониеобразующих единиц по сравнению с 10 2 КОЕ. Микробиота сильно изменяется от двенадцатиперстной кишки к подвздошной кишке по мере уменьшения скорости внутрипросветного содержимого и увеличения pH, увеличивая бактериальную нагрузку до 10 6 –10 8 КОЕ.Популяция микробиоты толстой кишки достигает 10 10 –10 12 КОЕ [8]; у взрослого человека может быть около 10 14 КОЕ, что превышает количество эукариотических клеток в организме человека [10].
В этом контексте есть два фактора, связанных с наибольшей физиологической колонизацией в толстой кишке: нейтральный pH и более длительное время прохождения. Исследования показали, что среднее время прохождения через толстую кишку у педиатрических пациентов без нарушений моторики составляет примерно 30 часов [11, 12], что выше, чем в тонком кишечнике, где транзит варьируется от 2 до 4 часов [1].
Основная функция кишечной микробиоты заключается в ограничении роста потенциальных патогенных микроорганизмов, предотвращении инвазии и внедрения этих микроорганизмов в экосистему. Кроме того, микробиота конкурирует за пространство и обладает способностью секретировать антимикробные вещества (бактериоцины), которые препятствуют размножению других бактерий. В этом процессе микробиота остается стабильной, метаболизируя вычитаемые и неперевариваемые продукты [1]. Ферментация неперевариваемых углеводов производит короткоцепочечные жирные кислоты (SCFA: ацетат, пропионат и бутират), которые играют важную роль в модуляции различных процессов в желудочно-кишечном тракте, включая электролиты (Ca, Mg и Fe) и воду. абсорбция, пролиферация и дифференцировка клеток, секреция гормонов и активация иммунной системы [8, 13].Более того, SCFA используются организмом в качестве источников энергии, включая колоноциты и небольшую часть печени и мышц [13]. Метаболические функции также приписываются микробиоте, так как производство витаминов (K, B12, биотин, фолиевая кислота и пантотеновая кислота) и синтез аминокислот из аммиака или мочевины [14].
В настоящее время ясно, что индукция и регуляция иммунной системы зависит от микробиоты. Исследования показывают, что на способность лейкоцитов мигрировать в очаг воспаления и уничтожать микробные патогены также могут влиять SCFAs.По данным Vinolo et al. [15] короткоцепочечные жирные кислоты могут регулировать функцию лейкоцитов посредством цитокинов (TNF- α , IL-2, IL-6 и IL-10), продукции эйкозаноидов и хемокинов.
В более широком контексте энтероциты играют важную роль в логистике иммунной системы, поскольку их положение в контакте с просветом кишечника имеет решающее значение для начального распознавания чужеродных молекул и генерации сигналов, которые передаются иммунокомпетентным клеткам. Участие энтероцитов в защитном механизме не ограничивается только врожденной защитой.Они могут действовать как антигенпрезентирующие клетки, вызывая приобретенный иммунный ответ, опосредованный Т-лимфоцитами [16, 17]. После активации антигенпрезентирующими клетками размножение клональных Т-клеток приводит к образованию хелперных лимфоцитов (Th-клеток) различных фенотипов: Th2, Th3 или регуляторных Т-клеток. Регуляторные Т-клетки играют ключевую роль в иммунной толерантности, поскольку они секретируют регуляторные цитокины, противовоспалительные элементы, такие как IL-10 и TGF- β , в ответ на антигены, которые распознаются как непатогены.Этот механизм объясняет, как ведет себя иммунотолерантность при воздействии безвредной антигенной нагрузки, такой как пищевые продукты. С другой стороны, нарушение активности этих клеток способствует развитию заболеваний из-за нарушения иммунной регуляции [17].
В этой статье был определен приоритет основных внутри- и внекишечных детских болезней, которые связаны с микробиотой желудочно-кишечного тракта. Среди желудочно-кишечных заболеваний были инфекция Helicobacter pylori, , некротический энтероколит, воспалительные заболевания кишечника, целиакия, запоры и диарея.К внекишечным заболеваниям относились ожирение и аллергические реакции, которые в настоящее время широко исследуются и обсуждаются.
2. Желудочно-кишечная микробиота и болезни
2.1.
Helicobacter pylori Инфекция
Хотя бактериальная нагрузка в желудке низкая, особое внимание было уделено видам Helicobacter из-за их связи с различными желудочными заболеваниями [1]. Helicobacter pylori — это грамотрицательные спиральные бактерии, вызывающие гастрит, язвы желудка и двенадцатиперстной кишки, рак желудка и лимфому лимфоидной ткани, ассоциированную со слизистой оболочкой [18], представляющую собой одну из самых распространенных бактериальных инфекций в мире [19].У педиатрических пациентов эта инфекция связана с болями в животе в детском возрасте, гастроэзофагеальной рефлюксной болезнью и задержкой роста [19]. Недавние исследования показали, что у взрослых он увеличивает риск ишемической болезни сердца [20]. В целом более 50% населения мира инфицировано Helicobacter pylori , 30–40% в развитых странах и более 80% в развивающихся странах [21]. Среди лиц моложе 20 лет распространенность инфекции составляет около 80% в развивающихся странах, что выше, чем в развитых странах.Различия в распространенности связаны с социально-демографическими факторами, такими как низкий социально-экономический статус, семья с низким доходом и плохие условия жизни [18].
2.2. Некротический энтероколит
Некротический энтероколит (НЭК) — это наиболее частая желудочно-кишечная неотложная медицинская помощь, которая возникает у новорожденных. Он представляет собой серьезную клиническую проблему у младенцев и поражает до 10% младенцев с массой тела менее 1500 г, особенно новорожденных с чрезвычайно низкой массой тела при рождении (<1000 г) и сроком гестации менее 28 недель [22].Распространенность смертности колеблется в пределах 20–30%. Распространенность заболеваемости также высока, в основном это долговременные нарушения развития нервной системы у новорожденных с чрезвычайно низкой массой тела при рождении [22, 23]. Несмотря на достижения в области интенсивной терапии новорожденных, НЭК продолжает оставаться потенциально опасным заболеванием для недоношенных новорожденных без значительных изменений в «заболеваемости» смертности и долгосрочной заболеваемости [23].
Патогенез неизвестен. Существует несколько факторов, включая недоношенность, гипоксию, кормление смесями, особенно избыток белкового субстрата в просвете кишечника, сепсис, кишечную ишемию и колонизацию кишечника патогенными бактериями [22, 23].В недавно опубликованном исследовании [24] сообщается о более высокой доле протеобактерий у новорожденных после постановки диагноза НЭК, что подтверждает другие результаты. Интересно, что в этом исследовании, проведенном на девяти новорожденных пациентах с НЭК и девяти в контрольной группе, за неделю до постановки диагноза была обнаружена более низкая доля этих бактерий у пациентов с НЭК по сравнению с контрольной группой [24]. Авторы отметили, что недоношенные дети без достаточной колонизации Proteobacteria в течение первой недели жизни могут быть не в состоянии модулировать адаптивный иммунологический ответ на последующее увеличение Proteobacteria [24].Следовательно, незрелость механизма толерантности под влиянием качества и количества микробиоты может быть связана с данной патологией.
2.3. Воспалительные заболевания кишечника
При воспалительных заболеваниях кишечника (болезнь Крона и язвенный колит) иммунная система оказывает аномальное действие на элементы микробиоты, которые присутствуют в слизистой оболочке кишечника и вызывают поражение кишечника [25]. У пациентов с воспалительным заболеванием кишечника в присутствии комменсальных бактерий наблюдается повышение уровня антител IgG, а Т-лимфоциты, представленные на слизистой оболочке, гиперактивны, что свидетельствует о подавлении местных механизмов толерантности [26].Фактически, существует несколько факторов, которые влияют на активацию и ремиссию воспалительной активности, например, выделение фекального потока, использование антибиотиков для лечения болезни Крона и антибиотиков широкого спектра действия при язвенном колите толстой кишки [27, 28]. Учитывая, что болезнь Крона у людей возникает в терминальном отделе подвздошной и толстой кишки, где концентрация бактерий выше [26], предполагается, что непереносимость, вызванная микробиотой, в сочетании с генетической предрасположенностью, способствует развитию этого воспаления [25].
Собственная пластинка — это участок ткани, где иммунные клетки первоначально распознают бактериальный антиген, прежде чем мигрировать в дистальную лимфоидную ткань, чтобы вызвать воспалительный ответ [29]. Эпителиальные клетки представляют рецепторы, называемые Toll-подобными рецепторами и рецепторами NOD2, которые важны для запуска иммунного ответа. После активации эти рецепторы могут генерировать внутриклеточный ответ, продуцируя провоспалительные цитокины [30]. Этот механизм способствует созреванию дендритных клеток слизистой оболочки, которое после контакта с антигеном переходит в локальные лимфоидные структуры, такие как пятна Пейера, и дренирует мезентериальные лимфатические узлы, чтобы инициировать или поддерживать Т- и В-клеточные иммунные ответы.Дендритные клетки инициируют иммунный ответ, контролируют воспаление кишечника и поддерживают толерантность. В этом контексте предполагается, что дендритные клетки слизистой оболочки играют ключевую роль в регулировании иммунных ответов в антигенной среде желудочно-кишечного тракта, поддержании гомеостаза кишечника и обеспечении мирного сосуществования с эндогенной микрофлорой [29]. У здоровых людей комменсальная флора не может пересечь эпителиальный барьер; однако, когда какая-либо из этих бактерий проходит через кишечный барьер, они быстро фагоцитируются макрофагами слизистой оболочки, избегая активации кишечного иммунного ответа; но, с другой стороны, когда патогенные микроорганизмы пересекают барьер, этот ответ активируется [31].
Язвенный колит и болезнь Крона обычно развиваются в районах с самой высокой концентрацией кишечной микробиоты, что позволяет предположить, что комменсальные бактерии, связанные с генетической предрасположенностью, могут вносить вклад в патогенез этих заболеваний [32]. Кроме того, несколько исследований, процитированных Фава и Данезе [33], предполагают, что микробиота, обнаруженная у пациентов с воспалительными заболеваниями кишечника, отличается от здоровых людей, предполагая, что дисбактериоз может привести к непереносимости. Эти пациенты имеют слабо диверсифицированную микробиоту с преобладанием Clostridia, Bactoroides и Bifidobacteria (комменсальная микробиота) и сопутствующим увеличением вредных бактерий, таких как Escherichia coli , что редко встречается у людей без воспалительных заболеваний кишечника [33].Доля вредных бактерий может составлять 30–40% от доминирующих бактерий, хотя и значительна, но причинно-следственная связь не установлена [34]. Интересно отметить, что низкое разнообразие видов связано с нестабильностью экосистемы, что подразумевает большую предрасположенность к изменению состава под влиянием окружающей среды. Таким образом, нестабильность экосистемы может способствовать риску воспаления.
2.4. Целиакия
Целиакия — это аутоиммунное заболевание тонкого кишечника, характеризующееся пожизненной непереносимостью глиадина и связанных с ним проламинов из пшеницы и других злаков, которая встречается у людей, генетически предрасположенных к непереносимости глютена [35].Через механизмы непереносимости глютена активируются оба иммунных ответа: (1) адаптивный иммунный ответ, в котором преобладают провоспалительные цитокины Th2, и (2) врожденный иммунный ответ, опосредованный интерлейкином-15, который приводит к эпителиальным изменениям с изменениями проницаемости и проницаемости. целостность слизистой оболочки кишечника, благоприятствующая активной фазе заболевания [36]. В ответ на активацию иммунной системы развивается атрофия ворсинок кишечника разной степени, вплоть до полной атрофии ворсинок, что связано с увеличением длины крипт и количества клеток [35].Эта аномалия в структуре слизистой оболочки может привести к нарушению всасывания питательных веществ, задержке развития, остеопении, остеопорозу, внекишечным аутоиммунным расстройствам, таким как герпетиформный дерматит, бесплодию и неопластическим процессам, которые можно предотвратить, исключив глютен из рациона. Таким образом, строгая безглютеновая диета является единственной терапией для ремиссии клинических симптомов и осложнений со здоровьем у этих пациентов [35, 37].
Роль микробиоты при глютеновой болезни до конца не изучена по сравнению со здоровыми людьми [38].Генетические факторы были связаны с колонизацией видов Bacteroides [39]. Исследования показали, что строгая безглютеновая диета у пациентов с целиакией способствует снижению количества полезных бактерий, особенно Bifidobacterium и Lactobacillus по сравнению с грамотрицательными бактериями ( Bacteroides и E . coli ) [36 ]. Это изменение микробиоты из-за исключения глютена может быть результатом исключения важных источников углеводов, основного источника энергии для комменсальной микробиоты [39].Диетическое лечение этих пациентов не способствует полностью гомеостазу кишечника; однако иммуносупрессивная реакция микробиоты может быть полезной для пациентов с глютеновой болезнью [40].
По оценкам, более 1 из каждых 100 новорожденных будет болеть этим заболеванием на протяжении всей жизни. Раньше считалось, что глютеновая болезнь редко появляется в детстве, в настоящее время она известна как относительно распространенное заболевание, которое можно диагностировать в любом возрасте. Это связано с тем, что распространенность типичных форм заболевания у детей выше, чем у взрослых, соответственно 67.0% против 14,3% случаев [41], но до 20% пациентов диагностируются после 60 лет. В настоящее время наблюдаются большие успехи в диагностике целиакии, которая принесет пользу пациентам и их семьям, а также лицам, не имеющим симптомов [37]. Параллельно с этим успехи в изучении микробиоты могут способствовать профилактике заболеваний.
2,5. Запор
Хронический запор — основная жалоба педиатров, обращающихся за консультациями в 25% гастроэнтерологических служб [42, 43].Это обычное состояние у педиатрических пациентов с многофакторной этиологией, которое в 90–95% случаев связано с функциональными причинами [44]. Критерии Рима III определяют хронический запор как наличие по крайней мере двух из следующих симптомов в течение двух или более месяцев: (1) два или меньше дефекаций в неделю; (2) не менее одного эпизода недержания кала в неделю; (3) в анамнезе сохраняющаяся поза или чрезмерная задержка стула по воле; (4) болезненные или твердые испражнения в анамнезе; (5) наличие большого количества каловых масс в прямой кишке; (6) наличие в анамнезе стула большого диаметра, который может мешать унитазу [43].
Zoppi et al. [45] с целью исследования состава кишечной экосистемы при хроническом функциональном запоре обнаружили дисбактериоз у детей с запором (средний возраст — годы). В этом исследовании наблюдалось большее количество клостридий и бифидобактерий в кале, чем у здоровых детей. При оценке младенцев Aguirre et al. [46] обнаружили, что искусственное вскармливание увеличивает в 4,5 раза риск запора по сравнению с преимущественно грудным вскармливанием. У младенцев, находящихся на грудном вскармливании, Bifidobacterium spp.Преобладают , что составляет до 90% от общей фекальной микробиоты, тогда как у младенцев, вскармливаемых смесью, микробиота более гетерогенная [47, 48]. Было показано, что грудное молоко является постоянным источником комменсальных бактерий для кишечника младенца, возможно, из-за состава пребиотиков, который стимулирует рост и поддержание Lactobacillus и Bifidobacterium [47, 48]. Добавление пребиотиков к искусственной детской смеси увеличивает количество бифидобактерий [49], частоту стула и снижает консистенцию стула, что аналогично характеристикам, наблюдаемым у младенцев, находящихся на грудном вскармливании [50, 51].
Присутствие комменсальных бактерий в толстой кишке способствует снижению pH, что стимулирует дальнейший рост, благодаря высокому процентному содержанию воды, что обеспечивает более влажный стул [52, 53] и более низкую консистенцию, что облегчает их выведение [54].
2.6. Диарея
Диарея — это симптом, определяемый как жидкий водянистый несформированный стул более трех раз в день или объем дефекации более 200 мл / день. Острая диарея — главный симптом острого гастроэнтерита.Согласно ESPGHAN (Европейское общество детской гастроэнтерологии, гепатологии и питания), острый гастроэнтерит определяется как снижение консистенции кала (мягкий или жидкий) и / или увеличение частоты стула (3 или более раз за 24 часа) с или без лихорадки или рвоты, обычно длится менее 7 дней и никогда не превышает 14 дней [55]. В некоторых случаях это сопровождается болями в животе и обезвоживанием [56].
В Европе частота диареи колеблется в пределах 0.5 и 1,9 эпизода в год у детей до 3 лет [55]. По оценкам недавнего систематического обзора, в котором участвовали 139 стран с низким и средним уровнем дохода, частота диареи снизилась с 3,4 эпизодов на ребенка в год в 1990 году до 2,9 эпизодов на ребенка в год в 2010 году, что является самым высоким показателем среди младенцев в возрасте 6–11 месяцев. возраст (4,5 эпизода на ребенка в год в 2010 г.) [57]. Несмотря на то, что с годами произошло снижение частоты эпизодов на одного ребенка, количество эпизодов все еще велико: в 2010 г. было зарегистрировано около 1,7 миллиарда случаев [57].
Наиболее распространенными этиологическими агентами являются ротавирусы, среди бактерий наиболее распространенным является Campylobacter , за которым следует Salmonella . Такие паразиты, как Giardia lamblia и Cryptosporidium , нечасто вызывают диарею у здоровых детей. Основные этиологические агенты могут меняться с возрастом ребенка: у детей до 1 года преобладают ротавирус, норовирус, аденовирус и сальмонелла . От 1 до 4 лет преобладают те же агенты, добавляя Campylobacter и Yersinia .У детей старше 5 лет — Campylobacter , Salmonella и ротавирус [55]. Диарея, связанная с приемом антибиотиков, также является частым явлением, достигая 30% случаев [58].
Основным патогенетическим механизмом гастроэнтерита, независимо от его причины, является изменение всасывания и секреции воды и электролитов через слизистую кишечника, это увеличивает, особенно у младенцев, риск развития острого обезвоживания, считающегося основным осложнением гастроэнтерита. [59].В этом смысле изменение кишечной микробиоты может помочь контролировать симптомы и осложнения диареи в рамках адъювантного лечения.
3. Кишечная микробиота и внекишечные заболевания
Кишечник — это первый барьер для питательных веществ и компонентов просвета, составляющий одну из первых линий защиты от инфекционных агентов и аллергенов [26]. Бактериальная транслокация вызывается увеличением кишечной проницаемости в результате нарушения кишечного барьера [60].Как упоминалось ранее, изменения кишечной микробиоты могут быть связаны с развитием внекишечных заболеваний, таких как ожирение и аллергические реакции.
3.1. Ожирение
В настоящее время ожирение становится серьезной проблемой общественного здравоохранения. Распространенность детского ожирения может достигать 20% в странах Европейского Союза и продолжает расти в развивающихся странах [61]. Нарушение баланса между потреблением энергии и расходом энергии является основным фактором риска чрезмерного набора веса у детей и подростков.
Недавние исследования указывают на различия в количестве и качестве микробиоты у тучных и худых детей, как указано Angelakis et al. [62]. В ходе проспективного наблюдения Kalliomäki et al. [63] наблюдали, что дети с нормальным весом в 7 лет имели более высокую распространенность видов Bifidobacterium в течение первого года жизни, чем дети с избыточной массой тела. На присутствие бактерий у новорожденного влияют материнские бактерии, а затем воздействие грудного молока или принятый тип вскармливания [62].
До беременности женщины с избыточным весом имеют большее количество Bacteroides, чем женщины с нормальным весом. Кроме того, увеличение числа Bacteroides во время беременности связано с чрезмерным набором веса [64]. В отношении уменьшения или увеличения количества Bacteroides у взрослых, страдающих ожирением, но не страдающих ожирением, исследования противоречивы, но многие из них делают вывод, что Bacteroides увеличивается у людей с ожирением, включая людей с диабетом [62].В экспериментальной модели на животных увеличение содержания Bacteroides в микробиоте кишечника было связано с предрасположенностью к накоплению энергии и ожирению [63]. У взрослых недавний метаанализ не обнаружил каких-либо различий в концентрации Bacteroides между людьми с ожирением и нормальным весом [62].
Среди детей высокий ИМТ Bacteroides fragilis и низкий уровень Staphylococcus у детей были связаны с более высоким ИМТ у детей дошкольного возраста [65].С другой стороны, у детей с избыточной массой тела в возрасте 7 лет не наблюдалось значительного увеличения количества Bacteroides по сравнению с детьми с нормальным весом в том же возрасте [63]. У подростков и взрослых значительное увеличение соотношения Bacteroides коррелировало с потерей веса после программы похудания [62].
До сих пор основная связь кишечной микробиоты с ожирением связана с присутствием бифидобактерий. Мета-анализ, проведенный с участием 159 субъектов с ожирением по сравнению с 189 контрольными субъектами из шести опубликованных исследований, продемонстрировал значительное истощение бифидобактерий в группе с ожирением [62].Другой метаанализ показал, что микробиота людей с ожирением представлена меньшими Firmicutes и Methanobrevibacter spp . концентрации, чем у лиц с нормальным весом [62]. Таким образом, исследования предполагают причинную связь между микробиотой и ожирением.
3.2. Аллергические реакции
В западных странах распространенность пищевой аллергии может поражать 6–8% детей в возрасте до 10 лет и 1–4% взрослого населения. Пищеварительные аллергические проявления могут возникать в любом месте тела, включая желудочно-кишечный тракт, кожу и дыхательную систему [66].Несколько исследований показывают повышенную кишечную проницаемость у пациентов с аллергией, что способствует прохождению протеиновых антигенов, поступающих с пищей [67]. Кроме того, эпидемиологические исследования показали, что у детей-аллергиков микробиота отличается от здоровых детей с более высоким уровнем клостридий и более низким уровнем бифидобактерий [68]. С другой стороны, у неаллергических детей в составе микробиоты чаще встречаются бифидобактерии и лактобациллы, что позволяет предположить, что модуляция микробиоты может способствовать предотвращению аллергических проявлений [68, 69].
Большинство публикаций о модуляции кишечной микробиоты у пациентов с аллергией сосредоточено на дерматологической патологии, особенно при атопическом дерматите. Это хроническое заболевание кожи, которым страдают от 10% до 25% западных детей [70]. Генетика — не единственный фактор риска. «Гигиеническая гипотеза» предполагает, что быстрое увеличение атопических проявлений может быть связано с меньшим воздействием инфекций на первом этапе жизни. Следуя этой теории, относительное отсутствие микробной стимуляции иммунной системы кишечника младенцев и чрезмерная гигиена, характерная для типичного западного образа жизни в раннем детстве, влияют на созревание иммунной системы [68].
Развитие детской иммунной системы имеет тенденцию быть направленным на фенотип Т-хелперов типа 2 (Th3) у младенцев, тогда как постнатальное созревание связано с постепенным ингибированием Th3 и увеличением сродства Th2. Согласно Prescott et al. [71], у детей с атопией в течение первого года жизни наблюдается быстрое подавление ответов Th3, в то время как реакция у детей с атопией стимулируется. Преобладающий ответ Th3 связан с повышенной выработкой антител IgE к антигенам окружающей среды и эозинофилии, лежащих в основе аллергических процессов.
Что касается микробиоты и атопических реакций, другие исследования также показали, что ранняя колонизация потенциально более патогенными бактериями, такими как Clostridium difficile и Staphylococcus aureus , чаще встречается у детей, у которых развивается аллергия [68].
4. Модуляция кишечной микробиоты
Научные достижения ежедневно приводят к все большему количеству знаний о микробиоте и ее связи с педиатрическими заболеваниями. В свете опубликованных исследований ведется поиск альтернатив для модуляции кишечной микробиоты с целью предотвращения и лечения широкого спектра заболеваний.В настоящее время использование пробиотиков рассматривается как терапевтическая стратегия из-за их способности подавлять чрезмерный рост патогенных бактерий и развитие воспалительных кишечных инфекций [72]. Пробиотики определяются как «живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина» [8]. Чтобы штамм микроорганизмов считался полезным для организма, или пробиотики должны соответствовать следующим критериям: (1) оставаться жизнеспособным в кишечнике, сопротивляясь перевариванию желудочной кислоты и желчных солей; (2) прилипает к эпителию желудочно-кишечного тракта; (3) быть метаболически активным; (4) снижает pH толстой кишки; (5) проявляет антибактериальную активность против патогенных бактерий [72]. Lactobacillus plantarum , L. rhamnosus , L. reuteri , L. casei , L. acidophilus , Bifidobacterium longum , штамм B. brevis и B. bifidum B. bifidum с доказанными пробиотическими эффектами. Преимущества пробиотического действия варьируются в зависимости от интервала времени, в течение которого бактерии остаются в кишечнике, и их количества [73].
Хотя количество и время приема важны для положительного эффекта, его рекомендация требует внимания.Самая серьезная проблема, связанная с использованием пробиотиков, — это риск сепсиса [72]. Пробиотики обладают определенным действием на конкретных пациентов. Таким образом, важно подчеркнуть, что пробиотики очень гетерогенны с различиями по составу и биологической активности [73].
Далее рассматриваются признаки модуляции пробиотической микробиоты кишечника для каждого заболевания, представленного в этой статье.
4.1.
Helicobacter pylori
Исследования in vitro показали, что L.acidophilus LB, связанный с терапией антибиотиками, оказывает агонистический эффект против бактерий, отрицательно влияя на рост бактерий, ингибируя гликолипиды рецепторов адгезии и снижая активность уреазы, необходимую для их выживания в кислой среде [74]. У людей пробиотический штамм может улучшить состояние инфекции, но недостаточно для ликвидации H. pylori , как показано в недавно опубликованном обзоре, посвященном инфекции Helicobacter pylori и детскому возрасту [19].Авторы заявляют, что среда, в которой живут дети, важна для предотвращения этой инфекции.
Использование добавки с ферментированным молоком, содержащей пробиотик L. casei DN-114 001 (Actimel) в течение 14 дней, способствовало эрадикации H. pylori у детей, получавших омепразол, амоксициллин и кларитромицин в течение 7 дней [ 75]. Этот результат предполагает, что пробиотик можно использовать в качестве адъювантной терапии для эрадикации HP у детей.
4.2. Некротический энтероколит
Оценка использования пробиотиков для снижения риска НЭК основана на двух недавних метаанализах. В первом упомянутом метаанализе было отобрано 11 испытаний с использованием модели фиксированного эффекта с участием недоношенных новорожденных с очень низкой массой тела (<34 недель беременности и массой тела при рождении <1500 г). Энтеральное введение любого пробиотика, начатое в течение первых 10 дней жизни и продолжающееся не менее 7 дней, позволило снизить частоту НЭК на 30%. Кроме того, было продемонстрировано, что у недоношенных новорожденных, получавших добавки, более низкий риск смерти [23].Во втором метаанализе добавление энтеральных пробиотиков также снизило частоту тяжелых НЭК (ОР 0,32; 95% ИК 0,17–0,6) и смертность (ОР 0,43; 95% ИК 0,25–0,75) у недоношенных новорожденных (<37 нед. беременность и / или вес при рождении <2500 г) [76]. В обоих исследованиях использование пробиотиков не снижает риск сепсиса.
Исследования выявили значительные различия в штаммах пробиотиков и протоколах лечения, данные свидетельствуют о необходимости дополнительных плацебо-контролируемых исследований.Согласно Deshpande et al. [23] если предлагается в качестве рутинной терапии для недоношенных новорожденных, должен быть сделан строгий выбор продукта, включая тщательный мониторинг целевой группы перед употреблением. Хотя результаты положительные, Комитет по питанию ESPGHAN по-прежнему не рекомендует рутинное использование пробиотиков для предотвращения НЭК [77].
4.3. Воспалительные заболевания кишечника
Пробиотики могут регулировать метаболическую активность кишечной флоры и ее компонентов, предотвращая бактериальный рост, поддерживая целостность кишечного барьера слизистой оболочки, улучшая их функцию, проницаемость, стабильность и индукцию апоптоза Т-клеток.Благодаря такому механизму действия пробиотики могут регулировать иммунный ответ и снижать секрецию провоспалительных факторов [4, 8].
При лечении язвенного колита в рандомизированном клиническом исследовании, контролируемом месалазином, было оценено использование Escherichia coli Nissle, 1917, непатогенного вещества, у 116 пациентов в возрасте 18–80 лет. Авторы обнаружили снижение ремиссии на 74,6% у пациентов, принимавших месалазин, по сравнению с 68,4% у пациентов, принимавших пробиотики (OR 1.35; 95% IC 0,6–3,04). В этом исследовании время до ремиссии было примерно одинаковым — 44 и 42 дня соответственно [78]. С другой стороны, метаанализ, опубликованный в 2010 г., в котором было отобрано 13 рандомизированных контролируемых исследований, предполагает, что использование пробиотиков не дало дополнительных преимуществ в индукционной ремиссии, хотя в поддержании симптомов ремиссии пробиотик 1,36 (95% ДИ 1,07) –1,73) был более эффективным, чем плацебо 0,69 (95% ДИ 2,47–1,01) [79]. Принимая во внимание контролируемые исследования, Escherichi coli, Nissle, 1917 (2.5 × 10 10 ) [78, 80], Bifidobacteria (ферментированное бифидобактериями молоко 100 мл / день) [81] и Lactobacilli GG (18 × 10 9 ) [82] были пробиотиками, которые напоминают эффект месалазина в поддерживающее лечение ремиссии.
При лечении активных и неактивных болезней Крона было проведено множество исследований с несколькими штаммами пробиотиков ( E. coli Nissle, LGG, L. johnsonii LA1, S. boulardii и VSL номер 3), но размер выборки был небольшим.Кроме того, результаты этих исследований, а также экспериментальных исследований на животных [83] не показали значительной разницы в уменьшении воспаления [84]. В ходе открытой пилотной оценки с использованием Lactobacillus GG (10 10 КОЕ) дважды в день в течение 6 месяцев, у 3 из 4 детей улучшились показатели индекса болезни Крона у детей (PCDAI). Но необходимы более рандомизированные контролируемые испытания для оценки эффективности Lactobacillus GG при болезни Крона у детей, а также для оценки других штаммов пробиотиков [85].
4.4. Целиакия
В настоящее время нет показаний к пробиотикам в качестве адъювантного лечения целиакии. Однако развитие знаний о микробиоте позволит проводить исследования в будущем, особенно в области микробиологии и генетической предрасположенности.
Основным генетическим фактором риска целиакии являются гены человеческого лейкоцитарного антигена (HLA) -DQ [35]. Недавно была изучена связь между типом кормления грудью и HLA-генотипом на состав кишечной микробиоты младенцев с семейной историей глютеновой болезни.Palma et al. [6] опубликовали первое исследование, которое обнаружило эту связь. По мнению авторов, у младенцев с высоким генетическим риском развития целиакии было больше B. fragilis и Staphylococcus spp. и меньшее количество Bifidobacterium spp . и B. longum . Грудное вскармливание уменьшило связанные с генотипом различия в составе микробиоты, что может частично объяснить защитную роль грудного молока при этом заболевании.Эпидемиологические исследования показывают, что грудное вскармливание оказывает защитное действие против риска развития целиакии, в основном, когда глютен вводится в рацион, когда младенцы еще находятся на грудном вскармливании [86]. Следовательно, защитный эффект грудного вскармливания также связан с его способностью регулировать кишечную микробиоту у младенцев, способствуя увеличению и поддержанию бифидобактерий.
4.5. Запор
Недавний систематический обзор нефармакологических методов лечения запоров у детей считает недостаточными доказательства действия пробиотиков [87].Обзор взрослых и детей показывает, что использование пробиотиков для лечения запоров следует рассматривать как исследовательское [88]. У взрослых исследования демонстрируют положительный пробиотический эффект по сравнению с плацебо, что можно увидеть в перекрестном исследовании с Lactobacillus casei Shirota (0,5–5 × 10 9 UCF) [89] и в рандомизированном контрольном исследовании с E. coli Nissle, 1917 (6.5 × 10 9 UCF) [90]. У педиатрических пациентов положительный пробиотический эффект при функциональном запоре наблюдался с различными штаммами пробиотиков.Йогурт с добавкой 10 9 КОЕ / мл Bifidobacterium longum по сравнению с плацебо продемонстрировал значительные различия в частоте дефекации, боли при дефекации и боли в животе в перекрестном двойном слепом контролируемом исследовании, в котором участвовали 59 детей и подростков в возрасте от 5 до 15 лет. лет [91]. Лечение Lactobacillus casei rhamnosus Lcr35 (8 × 10 8 КОЕ / день) не показало разницы в эффективности по сравнению с оксидом магния (50 мг / кг / день), поскольку боль в животе менее распространена в группе Lcr35. [92].В пилотном исследовании по оценке эффективности смеси пробиотиков (Ecologic Relief: Bifidobacteria B. bifidum, B. infantis, B. longum, Lactobacilli casei, L. plantarum и L. rhamnosus ) у педиатрических пациентов в возрасте от 4 до 16 лет. лет в течение 4 недель наблюдался значительный эффект этой смеси (4 × 10 9 КОЕ), увеличивая частоту стула и уменьшая количество недержания кала и болей в животе [93]. С другой стороны, Lactobacillus GG в качестве дополнения к лактулозе для лечения функционального запора у детей не оказал положительного эффекта [94], но в этом случае следует учитывать слабительный эффект лактулозы.В целом, использование пробиотиков, по-видимому, приносит пользу при функциональном запоре у педиатрических пациентов, но для того, чтобы сделать вывод, требуется большее количество случаев и более длительное наблюдение.
У нормальных здоровых младенцев (до 6 месяцев жизни) рандомизированное контролируемое исследование продемонстрировало значительное увеличение частоты стула и улучшение консистенции кала при использовании смеси с добавлением LGG [95]. Противоречиво, введение B. lactis , B. longum BL 999 и rhamnosus LPR не было связано с изменением частоты и консистенции стула, что привело к неясным пробиотическому эффекту у младенцев согласно комментарию ESPGHAN, опубликованному в 2012 году [77 ].
4.6. Диарея
Использование пробиотиков может способствовать уменьшению диарейных симптомов за счет множественных механизмов действия. Во-первых, он может сохранять функцию кишечного эпителия, избегая повышенной кишечной проницаемости [96] и вторжения патогенных микроорганизмов [97]. Во-вторых, за счет подкисления толстой кишки, производства бактерицидов, конкуренции за питательные вещества и выработки IgA он предотвращает рост патогенных штаммов [98]. Наконец, производство короткоцепочечных жирных кислот в толстой кишке стимулирует абсорбцию натрия колоноцитами [8].Штаммы Lactobacillus и тип дрожжей Saccharomyces boulardii являются наиболее изученными микроорганизмами.
Несколько метаанализов [58, 99–102] подтвердили положительные эффекты Lactobacillus GG и Saccharomyces boulardii при адъювантном лечении диареи. Хотя рандомизированные клинические испытания, проведенные с Saccharomyces boulardii , продемонстрировали высокую методологическую вариативность, они показали положительные результаты. В большом метаанализе было подтверждено, что эти дрожжи снижают риск диареи через 3 дня (RR 0.66; 95% IC 0,55–0,77) и в среднем снижение на 30,48 ч (95% IC 18,51–42,46 ч), что доказывает его эффективное действие при лечении регидратации [103].
В антибактериальной терапии вспомогательная добавка Saccharomyces boulardii снизила риск диареи с 17,2% до 6,7% (ОР 0,43; 95% IC 0,23–0,78) у детей и подростков в возрасте от 6 месяцев до 14 лет [58] . В другом пересмотре, включавшем педиатрических пациентов (1015 субъектов лечения и 971 контроль), авторы наблюдали значительное снижение частоты диареи, связанной с антибиотиками, при введении пробиотиков (RR 0.49; 95% IC 0,32–0,74) [104]. В более недавнем исследовании с участием 3432 детей и подростков в возрасте от 0 до 18 лет были получены положительные результаты для пробиотиков, но анализ подгрупп показал, что более высокие дозы (≥5 миллиардов КОЕ / день) более эффективны, чем более низкие дозы пробиотиков. дозы (<5 миллиардов КОЕ / день) () [105]. По данным Johnston et al. [105], частота диареи, связанной с антибиотиками, в исследованиях высоких доз в группах пробиотиков и плацебо составляла, соответственно, 8% и 22% (1474 участника; ОР 0.40; 95% ДИ 0,29–0,55). В то время как для исследований низких доз была обнаружена частота 8% в группе пробиотиков и 11% в контрольной группе (1382 участника; ОР 0,80; 95% ДИ 0,53–1,21) [105].
У детей с острой диареей добавление Lactobacillus GG связано со значительным сокращением продолжительности диареи, особенно вызванной ротавирусом и диареей, с более низким семидневным риском. Хотя перкуссии в объеме кала не наблюдалось, его применение было связано с умеренным преимуществом [100].
У госпитализированных детей потребление Lactobacillus GG по сравнению с плацебо имеет потенциальный эффект для снижения общей частоты диареи, связанной с оказанием медицинской помощи (ОР 0,37; 95% ДИ 0,23–0,59), включая симптоматический ротавирусный гастроэнтерит (ОР 0,49; 95% ДИ 0,28–0,86) [102]. Saccharomyces boulardii сокращал продолжительность диареи у госпитализированных пациентов с острой инфекционной диареей [106]. Dinleyici et al. [106] обнаружили сокращение продолжительности диареи примерно на 24 часа и сокращение госпитализации на 20 часов, что существенно повлияло на клиническую практику.
Имеются убедительные доказательства клинической пользы Lactobacillus и Saccharomyces boulardii [107] при лечении диареи. Что касается эффективности и безопасности других пробиотиков при лечении диареи у детей, делать выводы преждевременно. Требуются дальнейшие исследования для оценки эффектов дозы и ее безопасности [105].
4.7. Ожирение
При ожирении не рекомендуется дополнительное лечение пробиотиками. Ранее несколько краткосрочных рандомизированных контролируемых исследований показали положительное влияние пробиотиков на чувствительность к инсулину, воспалительные маркеры и толерантность к глюкозе [108].Учитывая, что истощение запасов бифидобактерий во время лактации является ассоциированным фактором развития ожирения в школьном возрасте [63], а первые годы жизни имеют решающее влияние на состав микробиоты кишечника человека, были разработаны исследования для оценки пробиотических добавок во время пренатального и послеродового периода. периоды [108].
Влияние перинатального пробиотического вмешательства на развитие избыточной массы тела в течение 10-летнего периода наблюдения оценивали Luoto et al. [109]. В этом исследовании потребление 10 10 КОЕ Lactobacillus GG за 4 недели до ожидаемых родов, продленных на 6 месяцев постнатально, казалось, сдерживало чрезмерную прибавку в весе, особенно среди детей до 24–48 месяцев.Применение Lactobacillus GG и Bifidobacterium lactis во время беременности снижало риск гестационного сахарного диабета и снижало риск рождения большего размера в пораженных случаях [110]. В настоящее время данные по педиатрии ограничены. Хотя исследования продемонстрировали связь между ожирением и диабетом 2 типа со специфическими изменениями в составе кишечной микробиоты, в основном на животных моделях [111], необходимы дальнейшие исследования для экстраполяции на человека.
4.8. Аллергическая реакция
Существует множество исследований, изучающих роль пробиотиков при атопическом дерматите у детей младше 2 лет. Предложение Lactobacillus GG по сравнению с плацебо снизило вдвое риск атопической экземы у генетически предрасположенных детей первого года жизни (ОР 0,51; 95% ДИ 0,32–0,84) [112]. В этом исследовании обе формы введения были эффективны: младенцем в течение 6 месяцев после родов или его матерью во время беременности.Другие исследования продемонстрировали значительное снижение индекса тяжести атопического дерматита с использованием Lactobacillus fermentum VRI-033 PCC 1 × 10 9 КОЕ два раза в день в течение 8 недель [113] и Lactobacillus GG у младенцев с подозрением на аллергию на коровье молоко IgE -сенсибилизированный [114]. У детей старше 2 лет также была обнаружена значительная разница в снижении степени тяжести индекса атопического дерматита с добавлением Lactobacillus GG [115] и Lactobacillus reuteri [116] по сравнению с плацебо.
Метаанализ, опубликованный в 2012 году на основе 14 исследований, предоставил доказательства в поддержку умеренной роли пробиотиков при атопическом дерматите. Прием пробиотиков снижал частоту атопического дерматита (ОР 0,79; 95% ДИ 0,71–0,88) и IgE-опосредованного атопического дерматита у младенцев (ОР 0,80; 95% ДИ 0,66–0,96) при использовании во время беременности или в начале жизни [117]. Кроме того, важно отметить, что грудное вскармливание может защитить от инфекции и атопии у младенцев, доставляя IgA и другие защитные молекулы TGF и IL-10 (с противовоспалительными свойствами) и способствуя увеличению количества лактобацилл и бифидобактерий [66].
Учитывая респираторные симптомы, Bifidobacterium lactis является наиболее распространенным пробиотиком, изучаемым у детей. Используемый у доношенного ребенка, у матери которого был поставлен диагноз ВИЧ, B. lactis CNCM I-3446 не продемонстрировал значительного влияния на частоту бронхопневмонии (ОР 0,75; 95% ДИ: 0,2–2,6) [118]. При испытании на младенцах в возрасте от 4 до 10 месяцев B. lactis , as L. reuteri также не оказали влияния на частоту и продолжительность респираторных заболеваний.В этом исследовании было замечено, что у младенцев, получавших контрольную смесь, было больше эпизодов диареи и эпизодов большей продолжительности [119].
Смесь для младенцев с добавлением Lactobacillus salivarius CECT5713 (2 × 10 6 КОЕ) обеспечила значительное снижение количества эпизодов респираторных инфекций по сравнению с контрольной смесью, соответственно, 53 против 36 после 6 месяцев потребления [120 ]. Использование формулы L. johnsonii с добавлением La1 не показало какого-либо положительного влияния на количество респираторных инфекций по сравнению с контрольной смесью [121].Согласно Комитету по питанию ESPGHAN, имеющихся данных недостаточно, чтобы сделать надежный вывод об использовании пробиотических добавок для профилактики респираторных инфекций у младенцев [77].
5. Заключение
Ключевая роль в здоровье человека может зависеть от баланса гомеостаза среди видов микробов, населяющих кишечник. Таким образом, микробиота кишечника рассматривается не только как потенциальный биомаркер, но и как важный фактор в адъювантной терапевтической мишени при внутри- и внекишечных заболеваниях.Хотя все люди генетически запрограммированы, эти изменения в микробиоте желудочно-кишечного тракта можно регулировать. Тем не менее, при назначении пробиотических добавок следует учитывать тип бактерий, режим дозирования, способ доставки и хозяина.
Конфликт интересов
Авторы заявили об отсутствии конфликта интересов.
Campylobacter Инфекция у детей
Campylobacter — это бактерия, которая может вызывать легкую или серьезную кишечную инфекцию, называемую кампилобактериозом.Симптомы часто включают спазмы, диарею, боль в животе и лихорадку.
Бактерии Campylobacter в основном поражают младенцев, подростков и молодых людей. По оценкам CDC, в США ежегодно регистрируется более 1,3 миллиона случаев инфекции Campylobacter . Однако это всего лишь оценка, потому что большинство случаев не диагностируются и не регистрируются.
Пациенты могут быть осмотрены детскими экспертами по инфекционным заболеваниям Техаса.
Причины и факторы риска
Campylobacter Инфекция чаще встречается летом, чем зимой.Человек обычно заражается, если ест или контактирует с сырым, недоваренным или недостаточно подогретым мясом, обычно с курицей. Его также можно подобрать, выпив зараженную воду или непастеризованные молочные продукты. Другой менее распространенный источник передачи — контакт с инфицированными фекалиями домашних животных, таких как кошки, щенки, птицы, хомяки и других.
Симптомы и типы
Признаки и симптомы кампилобактериоза обычно появляются через 2-5 дней после контакта с бактериями и могут включать:
- Диарея
- Судороги
- Боль в животе
- Лихорадка
- Кровь при поносе
- Тошнота
- Рвота
Болезнь обычно длится около недели, но может длиться дольше.У людей со слабой иммунной системой симптомы могут стать более серьезными и даже опасными для жизни.
Диагностика и тесты
Чтобы определить, что бактерии Campylobacter вызывают заболевание вашего ребенка, врач возьмет образец стула и посеет его. Поскольку заболевания этого типа вызываются множеством различных видов бактерий, это лучший способ точно определить, является ли причиной Campylobacter .
Лечение и уход
Болезнь, вызванная Campylobacter , обычно длится всего неделю, но может длиться дольше.Эта инфекция обычно требует лечения, чтобы быстрее разрешиться и уменьшить вероятность передачи другим людям. Врач часто назначает антибиотики, такие как азитромицин или кларитромицин, чтобы облегчить симптомы и помочь вашему ребенку быстрее почувствовать себя лучше. Если болезнь не проходит, немедленно обратитесь к врачу.
В домашних условиях мало что можно сделать, чтобы облегчить симптомы кампилобактериоза. Если у вас диарея, важно пить много воды, пока диарея длится.Противодиарейные лекарства не рекомендуются , особенно у детей, у которых они могут вызывать серьезные побочные эффекты.
Можно ли предотвратить заражение Campylobacter?
В большинстве случаев инфекция Campylobacter возникает в результате неправильного обращения или приготовления пищи. Даже капля зараженного сока из сырого цыпленка может вызвать инфекцию.
Вы можете предотвратить распространение бактерий, соблюдая меры предосторожности при приготовлении пищи. Нарежьте все мясо на разделочных досках, отличных от тех, которые используются для фруктов, овощей или других продуктов.Выбросьте весь маринад, использованный для сырого мяса. Перед подачей готовьте мясо, пока не перестанет быть розовым. Никогда не кладите приготовленное мясо на немытую посуду, содержащую сырое мясо.
Хорошие меры гигиены также могут помочь предотвратить распространение болезни. К ним относятся тщательное мытье рук с мылом и горячей водой после игры с домашним животным или прикосновения к нему, смены подгузника, работы с сырым мясом или посещения туалета. Если у кого-то из членов вашей семьи понос, всем (а не только больному) следует часто мыть руки.
Загрязненная вода и непастеризованные молочные продукты — два других распространенных источника бактерий Campylobacter . Лучше всего избегать и того, и другого.
Заболевания кишечных бактерий, распространенных среди детей — ScienceDaily
Тип бактерий, вызывающих диарею и подавляющих рост детей в развивающихся странах, был обнаружен у 14% выборки детей в промышленно развитой стране. Однако у детей были только легкие желудочно-кишечные симптомы или их вообще не было.Понимание почему — следующий шаг для этих исследователей.
Бактерия, называемая энтероагрегативной E. coli , может вызывать стойкую диарею и подавлять рост детей в развивающихся странах. Эти бактерии также связаны с диареей путешественников и являются причиной крупных вспышек диареи в нескольких промышленно развитых странах. Одна вспышка в Германии в 2011 году унесла жизни 54 человека, поскольку бактериальный штамм вырабатывал особенно сильный токсин. Однако бактерии также могут находиться в кишечнике некоторых носителей, не вызывая каких-либо симптомов, поэтому исследователи пытаются определить, какие штаммы энтероагрегативных E.coli и какие другие факторы, такие как питание и прием антибиотиков, приводят к диарейным заболеваниям.
Группа датских ученых исследовала распространенность бактерий в кишечнике детей в детских садах Дании. В исследовании, недавно опубликованном в журнале Frontiers in Cellular and Infection Microbiology , команда наблюдала за 179 детьми в возрасте от 0 до 6 лет в течение всего года. В то время они контролировали присутствие бактерий в кишечнике детей, используя образцы стула, а их родители отмечали любые желудочно-кишечные симптомы в анкете.
Команда обнаружила, что Enteroaggregative E. coli был широко распространен, с 14% детей, которые дали положительный результат на бактерии в какой-то момент в течение годового исследования. Из детей с положительным результатом теста 50% испытали некоторые желудочно-кишечные симптомы, но в основном они были легкими, и бактерии не влияли на рост детей. Многочисленные штаммы Enteroaggregative E. coli были изолированы от детей, из которых 35% были устойчивы к нескольким типам антибиотиков.
Итак, учитывая, что у детей с положительным результатом теста на энтероагрегант E. coli не было серьезных симптомов, нужно ли нам беспокоиться об этих бактериях, устойчивых к лекарствам или нет? В нормальных условиях микробы в кишечнике поддерживают равновесие друг с другом, конкурируя друг с другом. Однако, когда внешние факторы нарушают этот баланс, могут возникнуть диарейные заболевания. Профессор Карен А. Крогфельт, старший автор исследования, сказала Frontiers Blog, что результаты вызывают озабоченность. «У большинства здоровых детей бактерии не причинят вреда из-за естественной« устойчивости к колонизации », обеспечиваемой другими типами бактерий в кишечнике.Однако небольшой сдвиг в балансе микробов в кишечнике (из-за других методов лечения или изменений в диете), и тогда энтероагрегант E. coli может взять верх и вызвать серьезные симптомы ».
Поскольку 35% выделенных штаммов Enteroaggregative E. coli были устойчивы к нескольким антибиотикам, лечение детей этими антибиотиками могло иметь ограниченное воздействие на резистентные бактерии, убивая при этом многие другие типы бактерий в кишечнике. Это могло бы эффективно убить конкурентов, позволив энтероагреганту E.coli , чтобы взять верх.
Другие факторы, влияющие на способность бактерий вызывать заболевания, включают генетические особенности штамма и пищевое здоровье детей, что может объяснить, почему бактерии, по-видимому, вызывают больше диарейных заболеваний в развивающихся странах. Исследовательская группа надеется продолжить изучение этих факторов. Профессор Крогфельт выступает за использование пробиотических агентов и продуктов питания для обеспечения микробного баланса в кишечнике. Это особенно важно после курса антибиотиков.Команда надеется, что антибактериальные препараты в будущем будут более специфичными и менее разрушительными для наших кишечных микробов, что затруднит возможность потенциально опасных бактерий, таких как энтероагрегантная кишечная палочка , вызывать заболевание.

 В передаче некоторых инфекций имеют значение насекомые (тараканы, мухи)
В передаче некоторых инфекций имеют значение насекомые (тараканы, мухи).gif)

 Не оставлять готовые продукты при комнатной температуре более чем на 2 часа
Не оставлять готовые продукты при комнатной температуре более чем на 2 часа Пользоваться бутилированной водой
Пользоваться бутилированной водой Возбудители острых кишечных инфекций могут находиться на поверхностях различных предметов, овощах, ягодах, фруктах.
Возбудители острых кишечных инфекций могут находиться на поверхностях различных предметов, овощах, ягодах, фруктах.
 Особенно подвержены им дети. В условиях несоблюдения мер общественной и личной гигиены кишечные инфекции проявляют высокую контагиозность, могут быстро распространяться среди окружающих больного (бактерионосителя) лиц и вызывать массовые заболевания людей.
Особенно подвержены им дети. В условиях несоблюдения мер общественной и личной гигиены кишечные инфекции проявляют высокую контагиозность, могут быстро распространяться среди окружающих больного (бактерионосителя) лиц и вызывать массовые заболевания людей.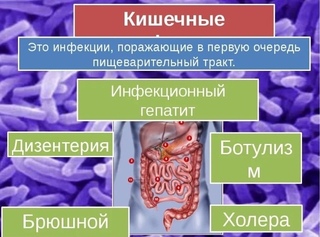 Через воду могут распространяться холера, брюшной тиф, дизентерия, сальмонеллезы, вирусный гепатит “А” (или болезнь Боткина) и др.
Через воду могут распространяться холера, брюшной тиф, дизентерия, сальмонеллезы, вирусный гепатит “А” (или болезнь Боткина) и др.