Внутриутробные инфекции новорожденных как маркер эпидемического неблагополучия в учреждениях родовспоможения | Смирнова
1. Врожденные инфекции: клиника, диагностика, лечение, профилактика: Учебное пособие для врачей. Издание 2-е, исправленное и дополненное. Под ред. Ю.В. Лобзина. Санкт-Петербург: Тактик-Студио. 2013. 104 с.
2. Шабалов Н.П. Неонатология: Учебное пособие: в 2 т.. – 3-е изд. исправ. и доп. – М.: МЕД пресс-информ, 2004. – 640 с.
3. Шакина И.А. Оптимизация диагностики и врачебной тактики при внутриутробных инфекциях: автореф. дис. … канд. мед.наук: 14.01.01 / Шакина Ирина Александровна; Омская государственная медицинская академия. Омск. –2010.
4. Ткаченко А.К., Романова О.Н., Марочкина Е.М. К понятию «внутриутробное инфицирование и внутриутробная инфекция» / Журнал Гродненского государственного медицинского университета. 2017. 1(57).с. 103–109.
Ткаченко А.К., Романова О.Н., Марочкина Е.М. К понятию «внутриутробное инфицирование и внутриутробная инфекция» / Журнал Гродненского государственного медицинского университета. 2017. 1(57).с. 103–109.
5. Catherine S. Peckham. Инфекции в период беременности. Врожденные и перинатальные инфекции: предупреждение, диагностика и лечение. Под ред. Мари-Луис Ньюэлл и Джаймса Мак-Интайра. Перевод с англ. проф. А.В. Михайлова. Санкт-Петербург. 2004. С. 12–26.
6. Иванова М. В., Миндлина А. Я., Серебрий А. Б. О необходимости изменения подходов к регистрации инфекций новорожденных, связанных с оказанием медицинской помощи, и внутриутробных инфекций // Эпидемиология и Вакцинопрофилактика. 2019; 18 (2): 104–112.
7. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2017 году» [электронный ресурс]. Режим доступа: http://rospotrebnadzor.ru/documents/ (дата обращения 29.04.2019).
Режим доступа: http://rospotrebnadzor.ru/documents/ (дата обращения 29.04.2019).
8. Дарьина М.Г., Техова И.Г., Мовчан К.Н. со автор. Нерешенные задачи статистического учета данных о внутриутробных инфекциях // Медицинский альманах.2015. 5(40).с. 71–74.
9. Приказ Министерства здравоохранения Российской Федерации от 26.11.1997 № 345 «О совершенствовании мероприятий по профилактике внутрибольничных инфекций в акушерских стационарах».
10. Постановление главного государственного санитарного врача Российской Федерации от 18.05.2010 № 58 «О введении в действие санитарно-эпидемиологических правил и нормативов СанПиН 2.1.3.2630-10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность». Доступо на: http://rospotrebnadzor. ru/documents/ (дата обращения 29.04.2019).
ru/documents/ (дата обращения 29.04.2019).
11. Захаров Н.И., Петрухина М.И., Малютина Л.В. и др. Инфекционный контроль и здоровье-сберегающие технологии в лечении и выхаживании новорожденных детей // Менеджер здравоохранения. 2012. № 9, с. 20–26.
12. Романенко В.В., Смирнова С.С. Голубкова А.А. и др. Оптимизация системы эпидемиологического надзора за внутрибольничными инфекциями новорожденных и родильниц в учреждениях родовспоможения // Сборник научно-практических работ «Актуальные аспекты вирусных инфекций в современный период» – Екатеринбург, 2008.
13. Флетчер Р., Флетчер С., Э. Вагнер. Клиническая эпидемиология. Основы доказательной медицины. – пер. с англ. – М. Медиа Сфера, 1998.– 352 с.
14. Смирнова С.С. Совершенствование эпидемиологического надзора и контроль за внутрибольничными инфекциями новорожденных в учреждениях родовспоможения: автореф. дис. … к.м.н. Пермский научный центр РАМН. Пермь. – 2006.
Смирнова С.С. Совершенствование эпидемиологического надзора и контроль за внутрибольничными инфекциями новорожденных в учреждениях родовспоможения: автореф. дис. … к.м.н. Пермский научный центр РАМН. Пермь. – 2006.
%PDF-1.6
%
1 0 obj
>
endobj
4 0 obj
/ModDate (D:20160622161821+03’00’)
/Subject
>>
endobj
2 0 obj
>
stream
application/pdf
Библиотека УО «ВГМУ»2016-06-22T16:18:21+03:002016-06-22T16:18:21+03:002016-06-22T16:18:21+03:00uuid:5ab243af-e647-4f69-b1f8-be6c5f6e4d81uuid:802a772c-f501-41aa-90fd-675158f99a29
endstream
endobj
3 0 obj
>
endobj
5 0 obj
>
/Font 18 0 R
/ProcSet [/PDF /Text]
/XObject >
>>
/Rotate 0
/Type /Page
/Annots [20 0 R]
>>
endobj
6 0 obj
>
/Rotate 0
/Type /Page
>>
endobj
7 0 obj
>
/Rotate 0
/Type /Page
>>
endobj
8 0 obj
>
/Rotate 0
/Type /Page
>>
endobj
9 0 obj
>
/Rotate 0
/Type /Page
>>
endobj
10 0 obj
>
/Rotate 0
/Type /Page
>>
endobj
11 0 obj
>
/Rotate 0
/Type /Page
>>
endobj
12 0 obj
>
/Font 36 0 R
/ProcSet [/PDF /Text]
>>
/Rotate 0
/Type /Page
>>
endobj
13 0 obj
>
stream
x}$u&Hqi%YnR]U}!lx,Y#Ȁ@18d2l3rsNdFĉYuR6źYYſ|?wLJ . 2%TNb?ryO@:8ya8’bO«_*V`[Ix.ݨ0(/
2%TNb?ryO@:8ya8’bO«_*V`[Ix.ݨ0(/
Внутриутробные инфекции — причина патологических состояний перинатального периода
PERINATOLOGIYA I PEDIATRIYA. 2016.2(66):65-69; doi 10.15574/PP.2016.66.65
Внутриутробные инфекции — причина патологических состояний перинатального периода
Щербина М. О., Выговская Л. А., Капустник Н. В.
Харьковский национальный медицинский университет, г. Харьков, Украина
В последние годы обращает на себя внимание рост внутриутробных инфекций, которые являются причиной всего спектра антенатальной патологии: инфекционных заболеваний плода, пороков его развития, мертворождений, недоношенности, развития фетоплацентарной недостаточности и задержки внутриутробного развития плода. Отмечена роль инфекций в патогенезе патологических состояний, формирующихся в перинатальном периоде, у новорожденных. В развитии инфекционных поражений плода, тяжести заболевания, локализации патологического процесса, темпах реализации и проявлениях возникшей патологии имеют значение вид возбудителя, его вирулентность, пути проникновения микроорганизмов от матери к плоду. В обзоре представлены данные влияния внутриутробных инфекций на эмбрион, плод, течение и исход беременности, а также состояние новорожденного.
В обзоре представлены данные влияния внутриутробных инфекций на эмбрион, плод, течение и исход беременности, а также состояние новорожденного.
Ключевые слова: внутриутробные инфекции, внутриутробное инфицирование, плод, беременность, течение.
Литература
1. Азимова Э.И. К вопросу профилактики рецидива генитального герпеса у беременных с антенатальной гибелью плода в анамнезе / Э.И. Азимова, С.Н. Султанов, Ф.П. Нишанова // Здоровье женщины. — 2011. — № 2. — С. 238—240.
2. Безнощенко Г.Б. Внутриутробные инфекции: (вопросы диагностики и врачебной тактики) / Г.Б. Безнощенко, Т.И. Долгих, Г.В. Кривчик. — Москва: Медкнига; Нижний Новгород: изд-во НГМА, 2013. — 88 с.
3. Боровкова Е.И. Взаимодействие возбудителей инфекции с организмом беременной как фактор риска внутриутробного инфицирования плода / Е.И. Боровкова // Здоровье женщины. — 2013. — № 2. — С. 95—98.
4. Булавенко О.В. Перинатальные последствия внутриутробного инфицирования / О.В. Булавенко // Світ медицини та біології. — 2012. — № 4. — С. 142—144.
— 2012. — № 4. — С. 142—144.
5. Влияние восходящего бактериального инфицирования на невынашивание беременности / Т.В. Ведощенко, О.И. Клычева, Г.А. Лазарева, А.Б. Хурасева // Человек и его здоровье. — 2014. — № 1. — С. 49—51.
6. Внутриутробная инфекция: современное состояние проблемы / Н.М. Подзолкова, М.Ю. Скворцова, Н.И. Мельникова, И.Ф. Острейков // Акушерство и гинекология. — 2009. — № 3. — С. 27—32.
7. Внутриутробное инфицирование плода: современный взгляд на проблему / У.Р. Хамадьянов, Л.А. Русакова, А.У. Хамадьянова [и др.] // Российский вестник акушера-гинеколога. — 2013. — № 5. — С. 16—20.
8. Внутриутробные инфекции: диагностика, лечение, профилактика / А.Л. Заплатников, Н.А. Коровина, М.Ю. Корнева [и др.] // Медицина неотложных состояний. — 2013. — № 1. — С. 14—20.
9. Внутрішньоутробні інфекції. Епідеміологія, клініка, діагностика та сучасні принципи терапії у вагітних жінок та дітей / Ю.П. Ткаченко, Г.О. Леженко, Ю.Г. Резніченко, Г.І. Резніченко. — Донецк: Заславский А. Ю., 2012. — 141 с.
Ю., 2012. — 141 с.
10. Врачебная тактика при внутриутробных инфекциях / Ю.И. Тирская, Т.Н. Белкова, Е.Б. Рудакова [и др.] // Акушерство и гинекология. — 2011. — № 8. — С. 42—47.
11. Врожденные, перинатальные и неонатальные инфекции: пер. с англ. / под ред. А. Гриноу, Дж. Осборна, Ш. Сазерленд. — Москва: Медицина, 2000. — 288 с.
12. Глазков І.С. Особливості акушерської і перінатальної патології у жінок з різними формами герпетичної інфекції / І.С. Глазков // Буковинський медичний вісник. — 2000. — №3. — С. 44—47.
13. Гомберг М.А. Репродуктивное здоровье и инфекции, вызванные Chlamidia trachomatis / М.А. Гомберг // Гинекология. — 2011. — № 1.— С. 13—16.
14. Давыдова Ю.В. Профилактика перинатальных инфекций и их последствий у беременных / Ю.В. Давыдова // Репродуктивная эндокринология. — 2013. — № 3. — С. 17—35.
15. Долгошапко О.Н. Роль и место анаэробной инфекции в развитии акушерско-гинекологических заболеваний, особенности ее лечения и профилактики / О.Н. Долгошапко // Здоровье женщины. — 2010. — № 10. — С. 41—43.
— 2010. — № 10. — С. 41—43.
16. Жабченко И.А. Особенности функционирования и факторы вирулентности уропатогенных штаммов Esherichia coli и их значение в клинической практике / И.А. Жабченко // Здоровье женщины. — 2013. — № 1. — С. 114—116.
17. Инфекции в акушерстве и гинекологии / под ред. О.В. Макарова, В.А. Алешкина, Т.Н. Савченко. — 2-е изд. — Москва: МЕДпресс-информ, 2009. — 464 с.
18. Квашнина Л.В. Дети первых пяти лет жизни: основные показатели в контексте достижения Целей Тысячилетия в Украине. Часть І / Л.В. Квашнина, Е.Е. Шунько, И.Н. Матвиенко // Перинатология и педиатрия. — 2015. — № 4. — С. 69—73.
19. Кузьмин В.Н. Вирусные инфекции и беременность / В.Н. Кузьмин, Л.В. Адамян. — Москва: Дипак, 2005. — 176 с.
20. Лехан В.М. Перинатальна смертність в Україні: досягнення та проблеми / В.М. Лехан, В.Г. Гінзбург // Україна. Здоров’я нації. — 2012. — № 1. — С. 15—25.
21. Лихачева А.С. Внутриутробные микст-ТОRСН-инфекции новорожденных, ассоциированные с острыми вирусными и передающимися половым путем инфекциями / А. С. Лихачева, И.И. Редько, Н.В. Лихачева // Таврический медико-биологический вестник. — 2013. — № 2. — С. 121—124.
С. Лихачева, И.И. Редько, Н.В. Лихачева // Таврический медико-биологический вестник. — 2013. — № 2. — С. 121—124.
22. Макацария А.Д. Герпетическая инфекция. Антифосфолипидный синдром и синдром потери плода / А.Д. Макацария, Н.В. Долгушина. — Москва: Триада-Х, 2002. — 80 с.
23. Невынашивание беременности, инфекция, врожденный иммунитет / О.В. Макаров, Л.В. Ковальчук, Л.В. Ганковская [и др.] — Москва: ГЭОТАР-Медиа, 2007. — 175 с.
24. Незгода І.І. Перинатальні та клініко-епідеміологічні аспекти цитомегаловірусної інфекції / І.І. Незгода, О.С. Онофрійчук, В.В. Щур // Перинатология и педиатрия. — 2011. — № 2. — С. 16—18.
25. Нерешенные задачи статистического учета данных о внутриутробных инфекциях / М.Г. Дарьина, И.Г. Техова, К.Н. Мовчан [и др.] // Медицинский альманах. — 2015. — № 5. — С. 71—74.
26. Особенности течения беременности и родов у больных с герпесвирусными инфекциями / Е.И. Барановская, С.В. Жаворонок, Л.Я. Супрун, А.Н. Воронецкий // Акушерство и гинекология. — 2004. — № 5. — С. 49—50.
— 2004. — № 5. — С. 49—50.
27. Павлов О.Г. Системный подход к анализу причин развития инфекций у новорожденных в раннем неонатальном периоде / О.Г. Павлов // Вестник новых медицинских технологий. — 2010. — № 3. — С. 74—75.
28. Перинатальные инфекции / Н.И. Жиляев, Н.А. Васильева, Н.Н. Жиляев [и др.]. — Тернополь, 2011. — 320 с.
29. Прилепская В.И. Микоплазменная инфекция и беременность / В.И. Прилепская, И.Ю. Фофанова // Акушерство и гинекология. — 2007. —№ 4. — С. 5—8.
30. Прокопюк В.Ю. Микоплазмоз в практике акушера-гинеколога / В.Ю. Прокопюк // Медицинские аспекты здоровья женщины. — 2008. — № 5. — С. 61—65.
31. Профілактика утробного інфікування та збереження вагітності у жінок з репродуктивними втратами в анамнезі / І.І. Воробйова, Н.Я. Скрипченко, Т.С. Черненко [та ін.] // Неонатологія, хірургія та перинатальна медицина. — 2014. — № 2. — С. 137—140.
32. Степаненко В.І. Сучасна терапевтична корекція вторинної імунної недостатності із залученням наномедичних технологій у комплексному лікуванні хворих на урогенітальні інфекції / В. І. Степаненко, С.В. Іванов // Здоровье женщины. — 2012. — № 8. — С. 171—177.
І. Степаненко, С.В. Іванов // Здоровье женщины. — 2012. — № 8. — С. 171—177.
33. Степанковская Г.К. Современный подход к лечению кандидозного вульвовагинита у беременных / Г.К. Степанковская, А.Б. Прилуцкая // Здоровье женщины. — 2010. — № 9. — С. 80—82.
34. Фофанова И.Ю. Особенности течения беременности при наличии урогенитальных микоплазм / И.Ю. Фофанова // Гинекология. — 2007. — № 2. — С. 67—70.
35. Хрянин А.А. Хламидийная инфекция в гинекологии и акушерстве / А.А. Хрянин, О.У. Стецюк, И.В. Андреева // Лечащий врач. — 2012. — № 3. — С. 30—37.
36. Чайка В.К. Инфекции в акушерстве и гинекологии: практическое руководство / В.К. Чайка. — Донецк: ООО «Альматео», 2006. — 640 с.
37. Юрьев С.Ю. Механизмы формирования осложнений беременности на фоне урогенитального хламидиоза: автореф. дис. … д.мед.н.: спец. 14.00.01 «Акушерство и гинекология» / С.Ю. Юрьев. — Томск, 2006. — 43 с.
38. Antimicrobials for preterm birth prevention: an overview / A. Subramaniam, A. Abramovici, W.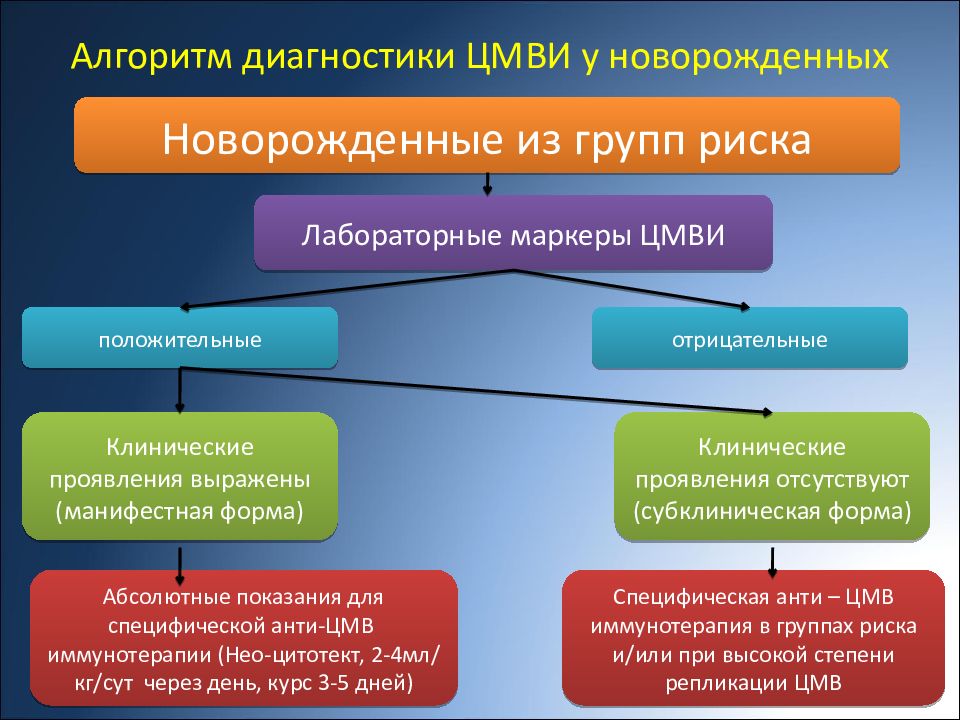 W. Andrews, A.T. Tita // Infect. Dis. Obstet. Gynecol. — 2012. — P. 157—159. http://dx.doi.org/10.1155/2012/157159
W. Andrews, A.T. Tita // Infect. Dis. Obstet. Gynecol. — 2012. — P. 157—159. http://dx.doi.org/10.1155/2012/157159
39. Eukaryote-Made Thermostable DNA Polymerase Enables Rapid PCR-Based Detection of Mycoplasma, Ureaplasma and Other Bacteria in the Amniotic Fluid of Preterm Labor Cases / T. Ueno, H. Niimi, N. Yoneda [et al.] // PLoS One. — 2015. — Vol. 10. — P. e0129032. http://dx.doi.org/10.1371/journal.pone.0129032; PMid:26042418 PMCid:PMC4456152
40. Genital herpes and its treatment in relation to preterm delivery / D.K. Li, M.A. Raebel, T.C. Cheetham [et al.] // Am. J. Epidemiol. — 2014. — Vol. 180 (11). — P. 1109—1117. http://dx.doi.org/10.1093/aje/kwu242; PMid:25392064
41. Guerra B. The genital herpes problem in pregnancy / B. Guerra, C. Puccetti, F. Cervi // G. Ital. Dermatol. Venereol. — 2012. — Vol. 147 (5). — P. 455—66. PMid:23007251
42. Howie S.E. Chlamydia trachomatis infection during pregnancy: known unknowns / S.E. Howie, P.J. Horner, A.W. Horne // Discov. Med. — 2011. — Vol. 12 (62). — Р. 57—64. PMid:21794209
Med. — 2011. — Vol. 12 (62). — Р. 57—64. PMid:21794209
43. Keegan M.B. Chlamydia trachomatis Infection: Screening and Management / M.B. Keegan, J.T. Diedrich, J.F. Peipert // J. Clin. Outcomes. Manag. — 2014. — Vol. 21 (1). — Р. 30—38. PMid:25554725 PMCid:PMC4279217
44. Lamont R.F. Rescreening for abnormal vaginal flora in pregnancy and re-treating with clindamycin vaginal cream significantly increases cure and improvement rates / R.F. Lamont, D. Taylor-Robinson, P. Bassett // Int. J. STD AIDS. — 2012. — Vol. 23 (8). — Р. 565—569. http://dx.doi.org/10.1258/ijsa.2011.011229; PMid:22930293
45. Molecular detection of Mycoplasma genitalium in men and pregnant women / H.W. Gubelin, T.M.A. Mart?nez, P.P. C?spedes [et al.] // Rev. Chilena. Infectol. — 2006. — Vol. 23, № 1. — Р. 15—19.
46. Qayum M. Prevalence of Chlamydia trachomatis among asymptomatic women / M. Qayum, M. Khalidbin-Saleem // J. Ayub. Med. Coll. Abbottabad. — 2013. — Vol. 25 (1—2). — P. 28—30. PMid:25098047
47. Sexually transmitted infections in pregnancy: prevalence, impact on pregnancy outcomes, and approach to treatment in developing countries / S. Mullick, D. Watson-Jones, M. Beksinska [et al.] // Sex. Trans. Infect. — 2005. — Vol. 81. — P. 294—302. http://dx.doi.org/10.1136/sti.2002.004077; PMid:16061534 PMCid:PMC1745010
Sexually transmitted infections in pregnancy: prevalence, impact on pregnancy outcomes, and approach to treatment in developing countries / S. Mullick, D. Watson-Jones, M. Beksinska [et al.] // Sex. Trans. Infect. — 2005. — Vol. 81. — P. 294—302. http://dx.doi.org/10.1136/sti.2002.004077; PMid:16061534 PMCid:PMC1745010
48. Suzuki Y. Evaluation levels of cytokines in amniotic fluid of women with intrauterine infection in the early second trimester / Y. Suzuki, T. Yamamoto, K. Kojima // Fetal Diagn Ther. — 2006. — Vol. 21, № 1. — P. 45—50. http://dx.doi.org/10.1159/000089047; PMid:1635497
49. Transmission of Staphylococcus aureus from mothers to newborns / E. Leshem, A. Maayan-Metzger, G. Rahav [et al.] // Pediatr. Infect. Dis. J. — 2012. — Vol. 31 (4). — P. 360—363. http://dx.doi.org/10.1097/INF.0b013e318244020e; PMid:22189535
50. Westhoff G.L. Herpes simplex virus and pregnancy: a review of the management of antenatal and peripartum herpes infections / G.L. Westhoff, S.E. Little, A.B. Caughey // Obstet. Gynecol. Surv. — 2011. — Vol. 66 (10). — P. 629—638. http://dx.doi.org/10.1097/OGX.0b013e31823983ec; PMid:22112524
Little, A.B. Caughey // Obstet. Gynecol. Surv. — 2011. — Vol. 66 (10). — P. 629—638. http://dx.doi.org/10.1097/OGX.0b013e31823983ec; PMid:22112524
51. Workowsky K.A. Centers for Diseases Control and Prevention (CDS). Sexually Transmitted Diseases Treatment Guidelines / K.A. Workowsky, S. Berman // MMWR Recomm Rep. — 2010. — Vol. 59 (RR—12). — P. 1—10.
Внутриутробные инфекции у новорожденных, факторы риска Текст научной статьи по специальности «Клиническая медицина»
ОБМЕН ОПЫТОМ
Внутриутробные инфекции у новорожденных, факторы риска
О.Б. Черняховский, И.В. Абрамова, О.Л. Полянчикова
Intrauterine infections in the newborn, risk factors
O.B. Chernyakhovsky, I.V. Abramova, O.L. Polyanchikova
Солнечногорская центральная районная больница, Московская область; родильный дом при городской клинической больнице №15 им. О.М. Филатова, Москва
О.М. Филатова, Москва
В последние годы в структуре репродуктивных потерь (перинатальная смертность, невынашивание беременности) значительно возросла роль внутриутробных инфекций. Инфекционная патология плода и новорожденного обусловливает до 27% случаев перинатальной смертности. Мертворождаемость при этой патологии достигает 41,4%, причем более 1/3 всех мертворожденных и умерших детей в раннем неонатальном периоде имеют основное или сопутствующее инфекцион-но-воспалительное заболевание. Внутриутробная инфекция является причиной всего спектра антенатальной патологии, включая пороки развития плода, формирование фетоплацентарной недостаточности и задержки внутриутробного развития.
Цель настоящего исследования заключалась в определении перинатальных инфекций у новорожденных, связанных с внутриутробным инфицированием и выявлением факторов риска у женщин во время беременности.
Проведено комплексное клинико-лабораторное исследование у 200 новорожденных детей (100 доношенных и 100 недоношенных), находившихся в детском реанимационном отделении. Все дети были обследованы на бактериальную, уреаплаз-менную и TORCH-инфекции, кандидоз, мико-плазмоз методом иммуноферментного анализа на приборе STAT FAX-2200 (США) с использованием тест-систем ЗАО «Вектор Бест» и полимераз-ной цепной реакции с применением технологий FLASH «НПФ ДНК-Технология». Забор материала для исследования проводился с разрешения матери перед лечебными процедурами.
Все дети были обследованы на бактериальную, уреаплаз-менную и TORCH-инфекции, кандидоз, мико-плазмоз методом иммуноферментного анализа на приборе STAT FAX-2200 (США) с использованием тест-систем ЗАО «Вектор Бест» и полимераз-ной цепной реакции с применением технологий FLASH «НПФ ДНК-Технология». Забор материала для исследования проводился с разрешения матери перед лечебными процедурами.
При комплексном клиническом обследовании новорожденных установлено, что внутриутробное инфицирование реализовалось во внутриутробную пневмонию у 30% доношенных детей и у 55% недоношенных, в конъюнктивит — у 18 и 15% соответственно, энтероколит — у 13 и 12%, пиелонефрит —
© Коллектив авторов, 2009
Ros Vestn Perinatal Pediat 2009; 1:88
Адрес для корреспонденции: 125412 Москва, ул. Талдомская, д. 2
2
у 22 и 6%, энцефалит — у 12 и 8,5%. Обследование детей позволило выявить ß-гемолитический стрептококк у 44% недоношенных и у 18% доношенных новорожденных, ß-гемолитический стрептококк в сочетании с одним из возбудителей инфекций (Toxoplasma gondii, цитомегаловирус, вирус простого герпеса, Candida spp.) — у 25 и 16% соответственно, возбудителей к одной или двум инфекциям (Chlamida trahomatis, T. gondii, цитомегаловирус, вирус простого герпеса, Candida spp.) — у 11% доношенных и 66% недоношенных детей.
Проанализированы данные анамнеза матерей, течения предыдущих, настоящей беременности и родов, соматическое и репродуктивное здоровье для выявления факторов риска внутриутробной инфекции. Установлено, что ведущими факторами риска явились: осложнение течения беременности сочетанным поздним гестозом (у 85% матерей доношенных детей и у 70% матерей недоношенных детей), обострение хронических воспалительных заболеваний (у 45 и 50% соответственно), в том числе пиелонефрит (у 28 и 18%) и анемия (у 52 и 36%), аномалия родовой деятельности (по 25%), ОРВИ (у 30 и 14%), хронические инфекционные воспалительные заболевания гениталий (у 13 и 25%).
Таким образом, сопоставление факторов риска внутриутробной инфекции плода с характером инфекций у новорожденных и структурой инфекционных заболеваний у обследованных нами детей свидетельствует о том, что между ними существует тесная взаимосвязь. Проблема внутриутробного инфицирования далека от разрешения и требует комплексного подхода, составной частью которого является обнаружение факторов высокого риска, определение их значимости у каждой беременной женщины, а также своевременное лечение хронических заболеваний и профилактика осложнений гестационного процесса. Это позволит существенно снизить перинатальную заболеваемость и смертность новорожденных и сохранить здоровье женщин.
РОССИЙСКИЙ ВЕСТНИК ПЕРИНАТОЛОГИИ И ПЕДИАТРИИ, 1, 2009
Врачебная тактика при внутриутробных инфекциях » Акушерство и Гинекология
ГОУ ВПО Омская государственная медицинская академия Минздравсоцразвития России, Омск ГУЗ Омской области Областная клиническая больница, Омск
Цель исследования. Выявление диагностических и прогностических критериев внутриутробной инфекции (ВУИ).
Выявление диагностических и прогностических критериев внутриутробной инфекции (ВУИ).
Материал и методы. Ретроспективный анализ историй родов 302 пациенток и новорожденных; проспективное исследование 49 пар мать-новорожденный группы риска ВУИ с целью разработки прогностической модели и 53 пар – для оценки эффективности разработанного алгоритма. Подтверждение/исключение диагноза ВУИ проводилось по результатам дополнительного обследования новорожденного в первые сутки после родов.
Результаты исследования. Выявлены клинико-анамнестические критерии развития ВУИ с учетом их диагностической информативности, составлена прогностическая таблица риска развития ВУИ, обладающая 92%-ной точностью. Предложена схема ведения беременных группы риска ВУИ в соответствии с разработанной прогностической таблицей.
Заключение. При ВУИ без четко установленного этиологического фактора бессистемное назначение этиотропных препаратов не является предпочтительным по сравнению с неспецифической терапией, направленной на улучшение функции маточно-плацентарного комплекса.
внутриутробная инфекция
прогноз
факторы риска
этиотропная терапия
1. Акушерство: Национальное руководство. – М.: ГЭОТАР-Мед, 2009. – С. 1125—1134.
2. Бубнова Н.И., Тютюнник В.Л., Михайлова О.И. Репродуктивные потери при декомпенсированной пла-
центарной недостаточности, вызванной инфекцией // Акуш. и гин. – 2010. – № 4. – С. 55–58.
3. Буданов П.В. Система обследования и лечения беременных с нарушением микроценоза родовых путей и внутриутробным инфицированием плода: Автореф. дис. …канд. мед. наук. – М., 2001.
аспекты тактики ведения беременных и рожениц высокого инфекционного риска: Автореф. дис. … канд. мед. наук. – Омск, 2008.
4. Буданов П.В., Малиновская В.В., Стрижаков А.Н., тика и лечение внутриутробной инфекции // Вопр.
практ. педиат. – 2007. – Т. 2, № 5. – С. 12.
5. Буданов П.В., Стрижаков А.Н. Этиология, патогенез, диагностика и лечение внутриутробной инфекции//Вопр. гин., акуш. и перинатол. – 2010. – Т. 9, № 3. – С. 61–71.
6. Голубцов П.С. Перинатальные аспекты внутриутробного инфицирования: Автореф. дис. … канд. мед. наук. – Омск, 1999.
7. Карапетян Т.Э., Антонов А.Г. Значение оппортунистических инфекций влагалища в развитии внутриутробной инфекции плода и новорожденного (ретроспективное исследование) // Акуш. и гин. – 2010. – № 4. – С. 59–63.
8. Крюкова А.Г., Камилов Ф.Ч., Ахмадеева Э.Н. К вопросу применения антибиотиков у новорожденных с риском внутриутробного инфицирования // Материалы Республиканской науч.-практ. конф. «Здоровый новорожденный». – Екатеринбург, 2000. – C. 125–127.
9. Кулаков В.И., Сухих Г.Т., Кан Н.Е. и др. Содержание цитокинов в амниотической жидкости, пуповинной крови и сыворотке крови женщин с внутриутробной инфекцией // Акуш. и гин. – 2005. – № 5. – С. 14–17.
10. Овчинникова Е.М. Клинико-эпидемиологические аспекты тактики ведения беременных и рожениц высокого инфекционного риска: Автореф. дис. … канд. мед. наук. – Омск, 2008.
11. Murth V., Kennea N.L. Antenatal infection inflammation and fetal tissue injury //Best Pract. Pres. Clin. Obstet. Gynaecol. – 2007. – Vol. 21, 3. – P. 479–489.
Antenatal infection inflammation and fetal tissue injury //Best Pract. Pres. Clin. Obstet. Gynaecol. – 2007. – Vol. 21, 3. – P. 479–489.
Тирская Юлия Игоревна, канд. мед. наук, ст. науч. сотр. ЦНИЛ, ассистент каф. акушерства и гинекологии № 2 ОмГМА
Адрес: 644001, Омск, ул. Б. Хмельницкого, д. 126–39.
Телефон: (8-913) 145-28-17
E-mail: [email protected]
ФАКТОРЫ РИСКА И ПРОГНОЗ РАЗВИТИЯ НЕКОТОРЫХ АКТУАЛЬНЫХ ВРОЖДЕННЫХ (ВНУТРИУТРОБНЫХ) ИНФЕКЦИЙ | Куюмчьян
1. Bialas, K.M. Perinatal cytomegalovirus and varicella zoster virus infections: epidemiology, prevention and treatment /Bialas K.M., Swamy G.K., Permar S.R. // Clin Perinatol. –2015. –Vol. 42, № 1. –Р. 61-75.
2. Bristow, B.N. Congenital Cytomegalovirus Mortality in the United States, 1990–2006 / Bristow B.N., O’Keefe K.A., Shafir S.C.,. Sorvillo F. J. // PLoS Negl Trop Dis. 2011 April; 5(4), доступ по адресу http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3082510/.
J. // PLoS Negl Trop Dis. 2011 April; 5(4), доступ по адресу http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3082510/.
3. Halonen, S.K. Toxoplasmosis / Halonen S.K., Weiss L.M. // Handb. Clin. Neurol. –2013. –Vol. 114. –P.125-145.
4. Заплатников, А.Л. Внутриутробные инфекции: диагностика, лечение, профилактика / А.Л. Заплатников, Л.А. Коровина, М.Ю. Корнеева, А.В. Чебуркин // Медицина неотложных состояний. – 2013. – Т. 1, № 48. – С. 25–33.
5. Васильев, В.В. Диагностика и прогнозирование некоторых врожденных инфекций в системе «беременная-плодребенок первого года жизни» / В.В. Васильев [и др.] // Росс. вестн. перинатол. и педиатр. – 2013. – Т. 58, № 3. – С. 92–97.
6. Внутриутробная инфекция. Ведение беременности, родов и послеродового периода : учебн. пособие / И.С. Сидорова, И.О. Макаров, Н.А. Матвиенко. – М.: МЕДпресс-информ, 2012. –160 с.
Ведение беременности, родов и послеродового периода : учебн. пособие / И.С. Сидорова, И.О. Макаров, Н.А. Матвиенко. – М.: МЕДпресс-информ, 2012. –160 с.
7. Sampedro M.A. Diagnosis of congenital infection / Sampedro M.A., Martinez L.A., Teatino P.M., Rodriguez-Granger J. // Enferm. Infecc. Microbiol. Clin. – 2011. –Vol. 29, Suppl 5. –P. 15-20.
8. Васильев, В.В. Диагностика и профилактика врожденных инфекций: современное состояние и перспективы / В.В. Васильев // Сб. трудов IV Санкт-Петербургского конгресса «Профессиональное образование, наука, инновации в XXI веке». – СПб, 18–19.11.2010. – С. 123–127.
9. Приказ Министерства здравоохранения РФ от 1 ноября 2012 г. N 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)»» [Электронный ресурс]. Доступ http://www.rosminzdrav.ru/documents/5828-prikazminzdrava-rossii-ot-12-noyabrya-2012g-572n.
Доступ http://www.rosminzdrav.ru/documents/5828-prikazminzdrava-rossii-ot-12-noyabrya-2012g-572n.
10. Лабораторная диагностика внутриутробных инфекций: методические рекомендации / А.В. Семенов, С.С. Вашукова. –СПб.: 2008. –79 с.
Этиологические и патогенетические перинатальные факторы развития внутриутробных инфекций у новорожденных (обзор) | Перепелица
1. Liu L., Johnson H.L., Cousens S., Perin J., Scott S., Lawn J.E., Rudan I., Campbell H., Cibulskis R., Li M., Mathers C., Black R.E.; Child Health Epidemiology Reference Group of WHO and UNICEF. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000. Lancet. 2012; 379 (9832): 2151– 2161. DOI: 10.1016/S0140-6736(12)60560-1. PMID: 22579125
2. World Health Statistics: 2010. Geneva: World Health Organization; 2010: 177.
World Health Statistics: 2010. Geneva: World Health Organization; 2010: 177.
3. Самсыгина Г.А. О предрасполагающих факторах и факторах риска развития неонатального сепсиса и о современных подходах его лечения. Педиатрия. Журн. им. Г.Н. Сперанского. 2012; 91 (3): 32-37.
4. Liu L., Oza S., Hogan D., Chu Y., Perin J., Zhu J., Lawn J.E., Cousens S., Mathers C., Black R.E. Global, regional, and national causes of under-5 mortality in 2000-15: an updated systematic analysis with implications for the Sustainable Development Goals. Lancet. 2016; 388 (10063): 3027-3035. DOI: 10.1016/S0140-6736(16)31593-8. PMID: 27839855
5. Lawn J.E., Blencowe H., Oza S., You D., Lee A.C., Waiswa P., Lalli M., Bhutta Z., Barros A.J., Christian P., Mathers C., Cousens S.N.; Lancet Every Newborn Study Group. Every newborn: progress, priorities, and potential beyond survival. Lancet. 2014; 384 (9938): 189-205. DOI: 10.1016/S0140-6736(14)60496-7. PMID: 24853593
Every newborn: progress, priorities, and potential beyond survival. Lancet. 2014; 384 (9938): 189-205. DOI: 10.1016/S0140-6736(14)60496-7. PMID: 24853593
6. Zaidi A.K., Ganatra H.A., Syed S., Cousens S., Lee A.C., Black R., Bhutta Z.A., Lawn J.E. Effect of case management on neonatal mortality due to sepsis and pneumonia. BMC Public Health. 2011; 11 (Suppl 3): S13. DOI: 10.1186/1471-2458-11-S3-S13. PMID: 21501430
7. Wynn J.L. Defining neonatal sepsis. Curr. Opin. Pediatr. 2016; 28 (2): 135–140. DOI: 10.1097/MOP.0000000000000315. PMID: 26766602
8. Самсыгина Г.А., Шабалов Н.П., Талалаев А.Г., Милованов А.П., Глуховец Н.Г., Глуховец Б.И. Сепсис новорожденных. Приложение к журналу «Архив патологии». М.: Медицина; 2004: 48.
9. Володин Н.Н. (ред.). Неонатология. Национальное руководство. М.: ГЭОТАР-Медиа; 2008: 749.
Володин Н.Н. (ред.). Неонатология. Национальное руководство. М.: ГЭОТАР-Медиа; 2008: 749.
10. Hornik C.P., Fort P., Clark R.H., Watt K., Benjamin D.K., Smith P.B., Manzoni P., Jacqz-Aigrain E., Kaguelidou F., Cohen-Wolkowiez M. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units. Early Hum. Dev. 2012; 88 (Suppl 2): S69–S74. DOI: 10.1016/S0378-3782(12)70019-1. PMID: 22633519
11. Edwards M.S., Gonik B. Preventing the broad spectrum of perinatal morbidity and mortality through group B streptococcal vaccination. Vaccine. 2013; 31 (Suppl 4): D66-D71. DOI: 10.1016/j.vaccine.2012.11.046. PMID: 23200934
12. Simonsen K.A., Anderson-Berry A.L., Delair S.F., Davies H.D. Early-onset neonatal sepsis. Clin. Microbiol. Rev. 2014; 27 (1): 21–47. DOI: 10.1128/CMR.00031-13. PMID: 24396135
Microbiol. Rev. 2014; 27 (1): 21–47. DOI: 10.1128/CMR.00031-13. PMID: 24396135
13. Gebremedhin D., Berhe H., Gebrekirstos К. Risk factors for neonatal sepsis in public hospitals of Mekelle City, North Ethiopia, 2015: Unmatched Case Control Study. PLoS One. 2016; 11 (5): e0154798. DOI: 10.1371/journal.pone.0154798. PMID: 27163290
14. Xiao T., Chen L., Liu H., Xie S., Luo Y, Wu D. The analysis of etiology and risk factors for 192 cases of neonatal sepsis. Biomed. Res. Int. 2017; 2017: 8617076. DOI: 10.1155/2017/8617076. PMID: 28758124
15. Alam M.M., Saleem A.F., Shaikh A.S., Munir O., Qadir M. Neonatal sepsis following prolonged rupture of membrane in a tertiary hospital in Karachi Pakistan. J. Infec. Dev. Ctries. 2014; 8 (1): 67–73. DOI: 10.3855/jidc. 3136. PMID: 24423714
3136. PMID: 24423714
16. Wynn J.L., Guthrie S.O., Wong H.R., Lahni P., Ungaro R., Lopez M.C., Baker H., Moldawer L.L. Postnatal age is a critical determinant of the neonatal host response to sepsis. Mol. Med. 2015; 21: 496-504. DOI: 10.2119/molmed.2015.00064. PMID: 26052715
17. Siakwa M., Kpikpitse Mupepi D., Mohamed S.S. Neonatal sepsis in rural Ghana: a case control study of risk factors in a birth cohort. IJRMHS & K.A.J. 2014; 4 (5): 77–88.
18. Милованов А.П., Савельева С.В. Внутриутробное развитие человека. М.: МДВ; 2006: 384.
19. Ванько Л.В., Матвеева Н.К., Ломова Н.А., Беляева А.С., Сафронова В.Г., Кан Н.Е., Сухих Г.Т. Функциональная активность гранулоцитов у беременных с высоким инфекционным риском и их новорожденных. Акуш. и гинекол. 2012; 7: 14-20.
Акуш. и гинекол. 2012; 7: 14-20.
20. Ломова Н.А., Кан Н.Е., Ванько Л.В., Донников А.Е., Матвеева Н.К., Беляева А.С., Тютюнник Н.В., Сухих Г.Т. Диагностическая значимость факторов врожденного иммунитета при плацентарной недостаточности. Акуш. и гинекол. 2014; 1: 29-35.
21. Перепелица С.А., Голубев А.М., Мороз В.В., Алексеева С.В., Мельниченко В.А. Воспалительные изменения в плаценте и бактериальная инфекция у недоношенных новорожденных c дыхательной недостаточностью. Общая реаниматология. 2012; 8 (3): 18-24. DOI: 10.15360/1813-9779-2012-3-18
22. Бубнова Н.И., Тютюнник В.Л., Михайлова О.И. Репродуктивные потери при декомпенсированной плацентарной недостаточности, вызванной инфекцией. Акуш. и гинекол. 2010; 4: 55-58.
23. Тирская Ю.И., Белкова Т.Н., Рудакова Е.Б., Долгих Т.И., Шакина И.А. Врачебная тактика при внутриутробных инфекциях. Акуш. и гинекол. 2011; 8: 42-47.
Тирская Ю.И., Белкова Т.Н., Рудакова Е.Б., Долгих Т.И., Шакина И.А. Врачебная тактика при внутриутробных инфекциях. Акуш. и гинекол. 2011; 8: 42-47.
24. Перетятко Л.П., Кулида Л.В., Проценко Е.В. Морфология плодов и новорожденных с экстремально низкой массой тела. Иваново; 2005: 384.
25. Kim C.J., Romero R., Chaemsaithong P., Chaiyasit N., Yoon B.H., Kim Y.M. Acute chorioamnionitis and funisitis: definition, pathologic features, and clinical significance. Am. J. Obstet. Gynecol. 2015; 213 (4 Suppl): S29– S52. DOI: 10.1016/j.ajog.2015.08.040. PMID: 26428501
26. Pacora P., Chaiworapongsa T., Maymon E., Kim Y.M., Gomez R., Yoon B.H., Ghezzi F., Berry S.M., Qureshi F., Jacques S.M., Kim J.C., Kadar N., Romero R. Funisitis and chorionic vasculitis: the histological counterpart of the fetal inflammatory response syndrome. J. Matern. Fetal. Neonatal. Med. 2002; 11 (1): 18-25. DOI: 10.1080/jmf.11.1.18.25. PMID: 12380603
J. Matern. Fetal. Neonatal. Med. 2002; 11 (1): 18-25. DOI: 10.1080/jmf.11.1.18.25. PMID: 12380603
27. Romero R., Miranda J., Chaemsaithong P., Chaiworapongsa T., Kusanovic J.P., Dong Z., Ahmed A.I., Shaman M., Lannaman K., Yoon B.H., Hassan S.S., Kim C.J., Korzeniewski S.J., Yeo L., Kim Y.M. Sterile and microbialassociated intra-amniotic inflammation in preterm prelabor rupture of membranes. J. Matern. Fetal. Neonatal. Med. 2015; 28 (12): 1394-1409. DOI: 10.3109/14767058.2014.958463. PMID: 25190175
28. Kacerovsky M., Musilova I., Andrys C., Hornychova H., Pliskova L., Kostal M., Jacobsson B. Prelabor rupture of membranes between 34 and 37 weeks: the intraamniotic inflammatory response and neonatal outcomes. Am. J. Obstet. Gynecol. 2014; 210 (4): 325.e1-325.e10. DOI: 10.1016/j.ajog.2013.10.882. PMID: 24184182
29. Bujold E., Morency A.M., Rallu F., Ferland S., Tétu A., Duperron L., Audibert F., Laferrière C. Bacteriology of amniotic fluid in women with suspected cervical insufficiency. J. Obstet. Gynaecol. Can. 2008; 30 (10): 882-887. DOI: 10.1016/S1701-2163(16)32967-X. PMID: 19038071
Bujold E., Morency A.M., Rallu F., Ferland S., Tétu A., Duperron L., Audibert F., Laferrière C. Bacteriology of amniotic fluid in women with suspected cervical insufficiency. J. Obstet. Gynaecol. Can. 2008; 30 (10): 882-887. DOI: 10.1016/S1701-2163(16)32967-X. PMID: 19038071
30. Madan I., Romero R., Kusanovic J.P., Mittal P., Chaiworapongsa T., Dong Z., Mazaki-Tovi S., Vaisbuch E., Alpay Savasan Z., Yeo L., Kim C.J., Hassan S.S. The frequency and clinical significance of intra-amniotic infection and/or inflammation in women with placenta previa and vaginal bleeding: an unexpected observation. J. Perinat. Med. 2010; 38 (3): 275-279. DOI: 10.1515/JPM.2010.001. PMID: 20146660
31. Romero R., Miranda J., Kusanovic J.P., Chaiworapongsa T., Chaemsaithong P., Martinez A., Gotsch F., Dong Z., Ahmed A.I., Shaman M., Lannaman K., Yoon B.H. , Hassan S.S., Kim C.J., Korzeniewski S.J., Yeo L., Kim Y.M. Clinical chorioamnionitis at term I: microbiology of the amniotic cavity using cultivation and molecular techniques. J. Perinat. Med. 2015; 43 (1): 19-36. DOI: 10.1515/jpm-2014-0249. PMID: 25720095
, Hassan S.S., Kim C.J., Korzeniewski S.J., Yeo L., Kim Y.M. Clinical chorioamnionitis at term I: microbiology of the amniotic cavity using cultivation and molecular techniques. J. Perinat. Med. 2015; 43 (1): 19-36. DOI: 10.1515/jpm-2014-0249. PMID: 25720095
32. Gravett M.G., Hummel D., Eschenbach D.A., Holmes K.K. Preterm labor associated with subclinical amniotic fluid infection and with bacterial vaginosis. Obstet. Gynecol. 1986; 67 (2): 229-237. DOI: 10.1097/00006250-198602000-00013. PMID: 3003634
33. Кан Н.Е., Тютюнник В.Л., Донников А.Е., Санникова М.В., Сухих Г.Т. Ассоциация полиморфизма гена ESR1 с преждевременным разрывом плодных оболочек. Бюл. эксперим. биологии и медицины. 2013; 156 (12): 811-814. DOI: 10.1007/s10517-014-2465-5. PMID: 24824712
34. Romero R., Garite T.J. Twenty percent of very preterm neonates (23-32 weeks of gestation) are born with bacteremia caused by genital Mycoplasmas. Am. J. Obstet. Gynecol. 2008; 198 (1): 1-3. DOI: 10.1016/j.ajog.2007.11.031. PMID: 18166295
Romero R., Garite T.J. Twenty percent of very preterm neonates (23-32 weeks of gestation) are born with bacteremia caused by genital Mycoplasmas. Am. J. Obstet. Gynecol. 2008; 198 (1): 1-3. DOI: 10.1016/j.ajog.2007.11.031. PMID: 18166295
35. Oh K.J., Lee S.E., Jung H., Kim G., Romero R., Yoon B.H. Detection of ureaplasmas by the polymerase chain reaction in the amniotic fluid of pati ents with cervical insufficiency. J. Perinat. Med. 2010; 38 (3): 261-268. DOI: 10.1515/JPM.2010.040. PMID: 20192887
36. Pararas M.V., Skevaki C.L., Kafetzis D.A. Preterm birth due to maternal infection: causative pathogens and modes of prevention. Eur. J. Clin. Microbiol. Infect. Dis. 2006; 25 (9): 562–569. DOI: 10.1007/s10096-0060190-3. PMID: 16953371
37. DiGiulio D.B., Romero R. , Kusanovic J.P., Gómez R., Kim C.J., Seok K.S., Gotsch F., Mazaki-Tovi S., Vaisbuch E., Sanders K., Bik E.M., Chaiworapongsa T., Oyarzún E., Relman D.A. Prevalence and diversity of microbes in the amniotic fluid, the fetal inflammatory response, and pregnancy outcome in women with preterm pre-labor rupture of membranes. Am. J. Reprod. Immunol. 2010; 64 (1): 38-57. DOI: 10.1111/j.16000897.2010.00830.x. PMID: 20331587
, Kusanovic J.P., Gómez R., Kim C.J., Seok K.S., Gotsch F., Mazaki-Tovi S., Vaisbuch E., Sanders K., Bik E.M., Chaiworapongsa T., Oyarzún E., Relman D.A. Prevalence and diversity of microbes in the amniotic fluid, the fetal inflammatory response, and pregnancy outcome in women with preterm pre-labor rupture of membranes. Am. J. Reprod. Immunol. 2010; 64 (1): 38-57. DOI: 10.1111/j.16000897.2010.00830.x. PMID: 20331587
38. DiGiulio D.B., Romero R., Amogan H.P., Kusanovic J.P., Bik E.M., Gotsch F., Kim C.J., Erez O., Edwin S., Relman D.A. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One. 2008; 3 (8): e3056. DOI: 10.1371/journal.pone.0003056. PMID: 18725970
39. Crawford J.T., Pereira L., Buckmaster J., Gravett M.G., Tolosa J.E. Amniocentesis results and novel proteomic analysis in a case of occult candidal chorioamnionitis. J. Matern. Fetal. Neonatal. Med. 2006; 19 (10): 667670. DOI: 10.1080/14767050600738289. PMID: 17118743
40. Cao B., Stout M.J., Lee I., Mysorekar I.U. Placental microbiome and its role in preterm birth. Neoreviews. 2014; 15 (12): e537–e545. DOI: 10.1542/neo.15-12-e537. PMID: 25635174
41. Jiménez E., Fernández L., Marín M.L., Martín R., Odriozola J.M., NuenoPalop C., Narbad A., Olivares M., Xaus J., Rodríguez J.M. Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section. Curr. Microbiol. 2005; 51 (4): 270–274. DOI: 10.1007/s00284-005-0020-3. PMID: 16187156
42. 42 Tambe P., Sammons H.M., Choonara I. Why do young children die in the UK? A comparison with Sweden. Arch. Dis. Child. 2015; 100 (10): 928– 931. DOI: 10.1136/archdischild-2014-308059. PMID: 26272911
43. Щеголев А.И., Туманова У.Н., Шувалова М.П., Фролова О.Г. Врожденная пневмония как причина перинатальной смертности в Российской Федерации. Неонатология: новости, мнения, обучение. 2016; 2: 61-66.
44. Nissen M.D. Congenital and neonatal pneumonia. Paediatr. Respir. Rev. 2007; 8 (3): 195–203. DOI: 10.1016/j.prrv.2007.07.001. PMID: 17868917
45. Карапетян Т.Э., Антонов А.Г. Значение оппортунистической инфекции влагалища в развитии внутриутробной инфекции плода и новорожденного (ретроспективное исследование). Акуш. и гинекол. 2010; 4: 59-63.
46. Shah B.A., Padbury J.F. Neonatal sepsis. An old problem with new insights. Virulence. 2014; 5 (1): 170–178. DOI: 10.4161/viru.26906. PMID: 24185532
47. Перепелица С.А., Голубев А.М., Мороз В.В. Особенности рентгенологических изменений в легких у недоношенных новорожденных с дыхательной недостаточностью. Общая реаниматология. 2011; 7 (1): 25-30. DOI: 10.15360/1813-9779-2011-1-25
48. Gallacher D.J., Hart K., Kotecha S. Common respiratory conditions of the newborn. Breathe. (Sheff.). 2016; 12 (1): 30–42. DOI: 10.1183/20734735.000716. PMID: 27064402
49. Милая О.В., Ионов О.В., Дегтярева А.В., Левадная А.В., Дегтярев Д.Н. Клинико-лабораторные проявления врожденных инфекционно– воспалительных заболеваний у детей с экстремально низкой и очень низкой массой тела при рождении. Акуш. и гинекол. 2014; 10: 66-71.
50. Hofer N., Zacharias E., Müller W., Resch B. An update on the use of C-reactive protein in early-onset neonatal sepsis: current insights and new tasks. Neonatology. 2012; 102 (1): 25-36. DOI: 10.1159/000336629. PMID: 22507868
51. Makkar M., Gupta C., Pathak R., Garg S., Mahajan N.C. Performance evaluation of hematologic scoring system in early diagnosis of neonatal sepsis. J. Clin. Neonatol. 2013; 2 (1): 25-29. DOI: 10.4103/2249-4847.109243. PMID: 24027741
52. Zea-Vera A., Ochoa T.J. Challenges in the diagnosis and management of neonatal sepsis. J. Trop. Pediatr. 2015; 61 (1): 1–13. DOI: 10.1093/tropej/fmu079. PMID: 25604489
53. Зубков В.В., Байбарина Е.Н., Рюмина И.И., Дегтярев Д.Н. Диагностическая значимость признаков пневмонии у новорожденных детей. Акуш. и гинекол. 2012; 7: 68-73.
54. Raymond S.L., Stortz J.A., Mira J.C., Larson S.D., Wynn J.L., Moldawer L.L. Immunological defects in neonatal sepsis and potential therapeutic approaches. Front. Pediatr. 2017; 5: 14. DOI: 10.3389/fped.2017.00014. PMID: 28224121
55. Yoshio H., Lagercrantz H., Gudmdundsson G.H., Ager Berth B. First line of defense in early human life. Semin. Perinatol. 2004; 28 (4): 304-311. DOI: 10.1053/j.semperi.2004.08.008. PMID: 15565791
56. Шилова Н.А., Чаша Т.В., Малышкина А.И., Родина М.А., Попова И.Г. Содержание антимикробного пептида кателицидина LL37 у глубоконедоношенных новорожденных с респираторным дистресс-синдромом и врожденной пневмонией. Педиатрия. Журн. им. Г.Н. Сперанского. 2014; 93 (1): 7-10.
57. Дмитриева И.Б., Белобородова Н.В., Черневская Е.А. Биомаркеры прокальцитонин и белок S100β в клинико-лабораторном мониторинге при критических состояниях новорожденных. Общая реаниматология. 2013; 9 (3): 58-65. DOI: 10.15360/1813-9779-2013-3-58
58. Fattah M.A., Omer А.F., Asaif S., Manlulu R., Karar T., Ahmed A., Aljada A., Saleh A.M., Qureshi S., Nasr A. Utility of cytokine, adhesion molecule and acute phase proteins in early diagnosis of neonatal sepsis. J. Nat. Sci. Biol. Med. 2017; 8 (1): 32–39. DOI: 10.4103/0976-9668.198362. PMID: 28250672
59. Machado J.R., Soave D.F., da Silva M.V., de Menezes L.B., Etchebehere R.M., Monteiro M., dos Reis A.,Corrêa R., Celes M. Neonatal sepsis and inflammatory mediators. Mediators Inflamm. 2014; 2014: 269681. DOI: 10.1155/2014/269681. PMID: 25614712
60. Verani J.R., McGee L., Schrag S.J.; Division of Bacterial Diseases, National Center for Immunization and Respiratory Diseases, Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease-revised guidelines from CDC, 2010. MMWR Recomm. Rep. 2010; 59 (RR-10): 1-36. PMID: 21088663
61. Randis T.M., Polin R.A. Early-onset group B Streptococcal sepsis: new recommendations from the Centres for Disease Control and Prevention. Arch. Dis. Child Fetal. Neonatal. Ed. 2012; 97 (4): F291-F294. DOI: 10.1136/archdischild-2011-300627. PMID: 22058178
62. Oh W. Early onset neonatal group B streptococcal sepsis. Am. J. Perinatol. 2013; 30 (2): 143-147. DOI: 10.1055/s-0032-1332804. PMID: 23322392
63. Reuter S., Moser C., Baack M. Respiratory distress in the newborn. Pediatr. Rev. 2014; 35 (10): 417–429. DOI: 10.1542/pir.35-10-417. PMID: 25274969
64. Stranieri I., Kanunfre K.A., Rodrigues J.C., Yamamoto L., Nadaf M., Palmeira P., Okay T. Usefulness of a 16S rDNA real-time PCR to monitor neonatal sepsis and to assist in medical decision to discontinue antibiotics. J. Matern. Fetal. Neonatal. Med. 2016; 29 (13): 2141–2144. DOI: 10.3109/14767058.2015.1077223. PMID: 26334172
65. Tarnow-Mordi W., Isaacs D., Dutta S. Adjunctive immunologic interventions in neonatal sepsis. Clin. Perinatol. 2010; 37 (2): 481-499. DOI: 10.1016/j.clp.2009.12.002. PMID: 20569818
66. Ohlsson A., Lacy J.B. Intravenous immunoglobulin for suspected or subsequently proven infection in neonates. Cochrane Database Syst Rev. 2010; 3: CD001239. DOI: 10.1002/14651858.CD001239.pub3. PMID: 20238315
67. Перепелица С.А. Комплексная оценка кислородного статуса и показателей липидного обмена у новорожденных с перинатальной гипоксией и гиповолемическим шоком. Общая реаниматология. 2017; 13 (3): 25-34. DOI: 10.15360/1813-9779-2017-3-25-34
68. Перепелица С.А., Алексеева С.В., Лучина А.А. Влияние перинатальных нарушений метаболизма на выбор режима искусственной вентиляции легких у новорожденных. Анестезиология и реаниматология. 2016; 4: 275-280. DOI: 10.18821/0201-7563-201661-4-275-280
69. Lahra M.M., Beeby P.J., Jeffery H.E. Intrauterine inflammation, neonatal sepsis, and chronic lung disease: a 13-year hospital cohort study. Pediatrics. 2009; 123 (5): 1314-1319. DOI: 10.1542/peds.2008-0656. PMID: 19403497
70. Jobe A. Effects of chorioamnionitis on the fetal lung. Clin. Perinatol. 2012; 39 (3): 441–457. DOI: 10.1016/j.clp.2012.06.010. PMID: 22954262
71. Розенберг О.А. Препараты легочного сурфактанта при острых и хронических заболеваниях легких (часть I). Общая реаниматология. 2014; 10 (4): 51-73. DOI: 10.15360/1813-9779-2014-4-51-73
72. Зубков В.В., Рюмина И.И., Евтеева Н.В., Юденков Д.И. Результаты проведения клинического аудита инфекционно-воспалительных заболеваний у новорожденных. Акуш. и гинекол. 2012; 7: 74-79.
Внутриутробные (врожденные) инфекции
Врожденные инфекции обычно передаются при трансплацентарном проникновении организма из кровотока матери в плод, хотя инфекция может также возникнуть при прохождении через родовые пути. Акроним TORCH обычно используется для перечисления инфекций, вызванных T оксоплазмозом, O тер (сифилис, ветряная оспа, парвовирус) R ubella, C ytomegalovirus и H erpes simplex.
Трансплацентарные инфекции могут привести к потере плода, задержке внутриутробного развития, недоношенности или послеродовым заболеваниям. После рождения врожденные инфекции могут проявляться в виде аномалий центральной нервной системы, таких как микроцефалия; гепатоспленомегалия с нарушением функциональных проб печени и тромбоцитопения. Каждый из возбудителей инфекции также имеет свои характерные клинические признаки:
Токсоплазмоз : хориоретинит, обструктивная гидроцефалия, умственная отсталость, внутричерепная кальцификация и судороги.Инфекция может быть не очевидна при рождении.
Сифилис: гепатоспленомегалия, выделения из носа или «насморк», анемия, тромбоцитопения, кожно-слизистая сыпь, периостит, остеохондрит, нефротический синдром и аномалии центральной нервной системы.
Сифилис с периоститом |
Краснуха: гепатоспленомегалия, задержка роста, тромбоцитопения, петехии, поражения «черничным маффином».Поздние признаки включают глухоту, катаракту и умственную отсталость.
Цитомегаловирус: аномалии ЦНС, гепатоспленомегалия и внутричерепные кальцификации. Глухота в более зрелом возрасте — важное осложнение и может быть единственным клиническим проявлением.
Простой герпес: пузырьков, энцефалит или диссеминированная инфекция с полиорганной недостаточностью. Врожденный простой герпес требует неотложной медицинской помощи. Большинство инфекций новорожденных, вызванных простым герпесом, не возникают при рождении.Скорее всего, болезнь передается при прямом контакте во время родов с инфицированной матерью. Инкубационный период составляет от 5 до 10 дней, и у ребенка появляются кожные поражения и / или системные признаки и симптомы, указывающие на сепсис.
Везикулы герпеса |
Вирус иммунодефицита человека : ВИЧ-инфекция может передаваться трансплацентарно, при контакте с кровью во время родов или через грудное молоко.Заражение происходит примерно у 25% детей, подвергшихся воздействию. Медикаментозное лечение и тщательное перинатальное ведение снижает уровень передачи инфекции в США примерно до 2%. Лечение матери, а затем и ребенка зидовудином значительно снижает риск заражения.
Парвовирус B19 Инфекция у плода может вызывать внутриутробную анемию, приводящую к застойной сердечной недостаточности и водянке плода. Инфекция Varicella zoster может привести к рубцеванию кожи, атрофии конечностей, микроцефалии, умственной отсталости, катаракте и нарушениям функции мочевого пузыря и кишечника.
Quickcheck: Внутриутробные (врожденные) инфекции
toc | вернуться наверх | предыдущая страница | следующая страница
Признаки внутриутробной инфекции (хориоамнионита)
Хориоамнионит — это инфекция беременности , которая поражает плаценту и оболочки, окружающие растущего ребенка. Беременная женщина может заболеть хориоамнионитом, когда бактерии перемещаются вверх через влагалище в матку. Хориоамнионит может вызвать преждевременные роды и нарушить обмен питательными веществами и газами между матерью и ребенком.Он также может передаваться ребенку через пуповину или во время родов через естественные родовые пути. В большинстве случаев хориоамнионит протекает доброкачественно и не причиняет вреда. В некоторых случаях, когда хориоамнионит плохо лечится, он может привести к развитию у ребенка пожизненной инвалидности, такой как гипоксически-ишемическая энцефалопатия (ГИЭ), церебральный паралич (ЦП) и перивентрикулярная лейкомаляция (ПВЛ). Врачи могут предотвратить необратимый вред, приняв меры предосторожности, такие как предоставление матери антибиотиками и своевременные роды через кесарево сечение (1).
Перейти к:
Признаки и симптомы хориоамнионита
Признаки и симптомы могут включать следующие (1):
- Повышение температуры тела матери (это важнейший клинический признак инфекции)
- Потоотделение (повышенное потоотделение)
- Гипотония (пониженное давление)
- Болезнь матки
- Значительная материнская тахикардия (частота сердечных сокращений> 120 уд / мин)
- Тахикардия плода (частота сердечных сокращений> 160 — 180 уд / мин.)
- Гнойные околоплодные воды или выделения из влагалища с неприятным запахом
- Материнский лейкоцитоз (высокое количество лейкоцитов)
Важно отметить, что некоторые женщины могут не проявлять явных признаков или симптомов инфекции.
Причины и факторы риска
Хориоамнионит или интраамниотическая инфекция обычно вызывается бактериями, попадающими в матку из влагалища или иногда из толстой кишки. Это более вероятно после преждевременного разрыва плодных оболочек (PROM), то есть разрыва амниотического мешка и хориона (также известного как «разрыв воды») до начала родов.Другие факторы риска хориоамнионита включают (1):
Диагностика
Хориоамнионит может быть диагностирован на основании таких признаков, как материнская лихорадка, микробиологические показания в культуре околоплодных вод или микроскопические аномалии пуповины и плаценты.
Диагноз хориоамнионита обычно основывается исключительно на клинических признаках, поскольку доступ к незагрязненным околоплодным водам или плаценте для посева является инвазивным и обычно избегается. Наличие лихорадки (температура> 100.4) плюс два других признака (болезненность матки, тахикардия матери или плода и гнойные / гнойные околоплодные воды), как правило, необходимы для диагностики. Кроме того, наличие факторов риска хориоамнионита, особенно разрыва мембраны, еще больше укрепляет диагноз (1).
Другие методы диагностики перечислены ниже:
Лабораторные тесты для матери без симптомов, у которой преждевременные роды или PROM, включают:
- Исследование околоплодных вод
- Скрининговый тест на GBS матери
- Исследования материнской крови
- Исследования мочи матери
Обследование матери с лихорадкой (лихорадкой) с подозрением на хориоамнионит включает:
- Количество лейкоцитов
- Уровни С-реактивного белка
- Измерение комплекса ингибиторов альфа-1-протеиназы
- Уровни интерлейкина-6 или ферритина в сыворотке
Исследования по оценке околоплодных вод и мочеполовых выделений включают:
- Бактериальные культуры
- Количество лейкоцитов
- Окрашивание по Граму
- pH
- Концентрация глюкозы
Ультрасонография может использоваться для определения благополучия ребенка в утробе матери.
Профилактика
Профилактика хориоамнионита имеет решающее значение. Преждевременный разрыв плодных оболочек (PROM) и преждевременный преждевременный разрыв плодных оболочек (PPROM) являются основными причинами хориоамнионита; до 70% женщин, у которых PROM развивается при схватках или родах, страдают хориоамнионитом. Хотя PROM может вызвать хориоамнионита, следует отметить, что вместе с преждевременными родами PROM может также быть вызван хориоамнионитом.
Стандарт лечения хориоамнионита включает назначение антибиотиков широкого спектра действия, обычно включающих эритромицин или азитромицин, и ампициллин в течение 7–10 дней внутривенно (2 дня) с последующим пероральным путем (1).Кроме того, индукция родов и родоразрешение связаны с уменьшением материнской инфекции и уменьшением потребности в неонатальной интенсивной терапии. При длительном разрыве мембраны (> 18 часов) во время родов профилактические антибиотики не показаны, если у матери нет колонии GBS. Однако Центры по контролю за заболеваниями (CDC) рекомендуют начать профилактику GBS, если статус GBS неизвестен (2).
Действительно, профилактические антибиотики оказались очень полезными в снижении частоты неонатальной смерти, хронических заболеваний легких или серьезных аномалий головного мозга у ребенка.Также было показано, что антибиотики снижают частоту хориоамнионита и неонатального сепсиса (инфицирование кровотока) и продлевают время до родов у матерей с преждевременным разрывом мембран, которым назначают выжидательную тактику (ожидание спонтанных родов).
Лечение
Лечение матери и ребенка с хориоамнионитом включает ранние роды, поддерживающую терапию и прием антибиотиков.
Своевременное назначение антибиотиков необходимо для предотвращения осложнений как у матери, так и у плода.Было показано, что время до родов после проведения антибактериальной терапии в некоторых случаях не влияет на заболеваемость. Таким образом, кесарево сечение для ускорения родов не показано при хориоамнионите, если нет других акушерских показаний. Внутривенное (IV) введение ампициллина каждые 6 часов и гентамицина каждые 8-24 часа до родов является стандартной схемой (1). Если выполняется кесарево сечение, для анаэробного покрытия обычно добавляют клиндамицин каждые 8 часов (или метронидазол). Лечение также должно включать введение дополнительной внутривенной дозы антибиотиков после родов (1).
Поддерживающие меры включают использование парацетамола (тайленола), что особенно важно во время родов для предотвращения неонатальной энцефалопатии (повреждения головного мозга) (1).
Возможные проблемы, вызванные лечением U ed Хориоамнионит
Хориоамнионит очень распространен и обычно не причиняет вреда маме или ребенку. Иногда это может повредить мембраны, а также вызвать выброс гормона простагландина и созревание шейки матки, что может привести к преждевременным родам.Кроме того, воспаление может распространиться на ворсинки хориона, которые покрывают плаценту и способствуют обмену питательных веществ и газов между матерью и ребенком. Это состояние, называемое виллитом, обычно доброкачественное, но может увеличить риск внутриутробной гибели плода.
Если хориоамнионит и / или виллит не лечить должным образом, это нечасто может привести к серьезным последствиям для ребенка, в том числе:
Что такое фунизит?
Фунисит — это воспаление пуповины в результате инфицирования пуповины.Фунисит часто возникает в результате хориоамнионита, когда инфекция распространяется от плацентарной мембраны на пуповину, вызывая синдром воспалительной реакции плода (FIRS). Фунисит обычно протекает доброкачественно, но иногда может нарушить приток кислорода и питательных веществ к ребенку, если роды не своевременны.
Юридическая помощь при хориоамнионите
Если у вашего ребенка был хориоамнионит и в настоящее время он страдает серьезным заболеванием, например, гипоксически-ишемической энцефалопатией или церебральным параличом, существует вероятность того, что ему была оказана неправильная медицинская помощь.Возможно, вы захотите подать иск о врачебной халатности.
В юридических центрах ABC (Reiter & Walsh, P.C.) мы занимаемся случаями родовых травм (включая инфекции и кислородное голодание). Наши отмеченные наградами поверенные разбираются в сложных юридических вопросах, связанных с инфекцией беременности, и помогут вам получить компенсацию, на которую вы имеете право. Чтобы начать бесплатное рассмотрение дела, обратитесь в юридические центры ABC любым из следующих способов:
Бесплатное рассмотрение случая | Доступно 24/7 | Никаких комиссий, пока мы не выиграем
Телефон (бесплатный): 888-419-2229
Нажмите кнопку Live Chat в своем браузере
Заполните нашу онлайн-форму для связи
Как вы произносите хориоамнионит?
Подробнее о нашей фирме
Подробнее о ведении дела о родовой травме
Источники:
- Тита, А.Т. (2018, август). Внутриамниотическая инфекция (клинический хориоамнионит или тройной I). Получено с https://www.uptodate.com/contents/intra-amniotic-infection-clinical-chorioamnionitis-or-triple-i?search=chorioamnionitis treatment & source = search_result & selectedTitle = 1 ~ 150 & usage_type = default & display_rank = 1 # h28.
- Хорсли, Э. (2011, 01 мая). CDC обновляет руководство по профилактике перинатального заболевания GBS. Получено с https://www.aafp.org/afp/2011/0501/p1106.html.
Какие физические признаки характерны для неонатального сепсиса, вызванного внутриутробной инфекцией?
Клингер Г., Леви И., Сирота Л. и др. Для Израильской сети новорожденных.Эпидемиология и факторы риска раннего начала сепсиса у младенцев с очень низкой массой тела при рождении. Am J Obstet Gynecol . 2009 Июль 201 (1): 38.e1-6. [Медлайн].
van den Hoogen A, Gerards LJ, Verboon-Maciolek MA, Fleer A, Krediet TG. Долгосрочные тенденции в эпидемиологии неонатального сепсиса и чувствительность возбудителей к антибиотикам. Неонатология . 2010. 97 (1): 22-8. [Медлайн].
[Рекомендации] Верани Дж. Р., Макги Л., Шраг С. Дж., Для отдела бактериальных заболеваний, Национальный центр иммунизации и респираторных заболеваний, Центры по контролю и профилактике заболеваний (CDC).Профилактика перинатального стрептококкового заболевания группы B — пересмотренное руководство CDC, 2010. MMWR Recomm Rep . 2010 19 ноября. 59 (RR-10): 1-36. [Медлайн]. [Полный текст].
Берарди А., Росси С., Спада С. и др. Для Рабочей группы по предотвращению СГБ в Эмилии-Романье. Стратегии предотвращения раннего сепсиса и ведения новорожденных в группе риска: широкий разброс в шести западных странах. J Matern Fetal Neonatal Med . 2019 Сентябрь 32 (18): 3102-8. [Медлайн].
Lin FY, Weisman LE, Azimi P и др. Оценка антибиотикопрофилактики во время родов для профилактики стрептококковой инфекции группы B с ранним началом. Pediatr Infect Dis J . 2011 30 сентября (9): 759-63. [Медлайн]. [Полный текст].
Weston EJ, Pondo T, Lewis MM, et al. Бремя инвазивного сепсиса новорожденных с ранним началом в США, 2005–2008 гг. Pediatr Infect Dis J . 2011 30 ноября (11): 937-41. [Медлайн].
Моралес В.Дж., Дики СС, Борник П., Лим Д.В.Изменение устойчивости стрептококков группы B к антибиотикам: влияние на ведение родов. Am J Obstet Gynecol . 1999 августа 181 (2): 310-4. [Медлайн].
Странк Т., Ричмонд П., Симмер К., Карри А., Леви О., Бургнер Д. Неонатальные иммунные ответы на коагулазонегативные стафилококки. Curr Opin Infect Dis . 2007 20 августа (4): 370-5. [Медлайн].
Power Coombs MR, Kronforst K, Levy O. Неонатальная защита хозяина от стафилококковых инфекций. Клин Дев Иммунол . 2013. 2013: 826303. [Медлайн].
Srinivasan L, Kirpalani H, Cotten CM. Выяснение роли геномики в неонатальном сепсисе. Семин Перинатол . 2015 декабрь 39 (8): 611-6. [Медлайн].
Groer MW, Gregory KE, Louis-Jacques A, Thibeau S, Walker WA. Микробиом младенцев с очень низкой массой тела при рождении и здоровье детей. Врожденные дефекты Res C Embryo Today . 2015 декабрь 105 (4): 252-64. [Медлайн].
Koenig JM, Yoder MC. Неонатальные нейтрофилы: хорошие, плохие и уродливые. Клин Перинатол . 2004 31 марта (1): 39-51. [Медлайн].
Weinberg AG, Rosenfeld CR, Manroe BL, Browne R. Подсчет неонатальных клеток крови в состоянии здоровья и болезни. II. Значения лимфоцитов, моноцитов и эозинофилов. Дж Педиатр . 1985 Март 106 (3): 462-6. [Медлайн].
Ландор М. Перенос иммуноглобулинов от матери к плоду. Ann Allergy Asthma Immunol . 1995 Apr. 74 (4): 279-83; викторина 284. [Medline].
Griffiths PD, Stagno S, Pass RF, Smith RJ, Alford CA Jr. Врожденная цитомегаловирусная инфекция: диагностическое и прогностическое значение обнаружения специфических антител иммуноглобулина M в сыворотке пуповины. Педиатрия . 1982 Май. 69 (5): 544-9. [Медлайн].
Колер П.Ф. Созревание системы человеческого комплемента. I. Время начала и участки синтеза C1q, C4, C3 и C5 у плода. Дж. Клин Инвест . 1973, март 52 (3): 671-7. [Медлайн].
Stocker J, Dehner L, ред. Детская патология. Том 2 . Филадельфия, Пенсильвания: Дж. Б. Липпинкотт; 1992.
Арнон С., Литмановиц И. Диагностические тесты при неонатальном сепсисе. Curr Opin Infect Dis . 2008 г., 21 (3): 223-7. [Медлайн].
Симонсен К.А., Андерсон-Берри А.Л., Делэр С.Ф., Дэвис HD. Ранний неонатальный сепсис. Clin Microbiol Ред. .2014 27 января (1): 21-47. [Медлайн].
Graham PL 3rd, Begg MD, Larson E, Della-Latta P, Allen A, Saiman L. Факторы риска позднего начала грамотрицательного сепсиса у младенцев с низкой массой тела при рождении, госпитализированных в отделение интенсивной терапии новорожденных. Pediatr Infect Dis J . 2006 25 февраля (2): 113-7. [Медлайн].
Столл Б.Дж., Хансен Н.И., Санчес П.Дж. и др., Для Сети неонатальных исследований Национального института здоровья детей и человеческого развития им. Юнис Кеннеди Шрайвер.Ранний неонатальный сепсис: бремя стрептококков группы B и кишечной палочки продолжается. Педиатрия . 2011 Май. 127 (5): 817-26. [Медлайн].
Американская академия педиатрии. Красная книга 2003: Отчет Комитета по инфекционным болезням . 26-е изд. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии; 2003. 117-123, 237-43, 561-73, 584-91.
Американская академия педиатрии. Красная книга 2018-2021: Отчет Комитета по инфекционным болезням .31-е изд. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии; 2018.
Комитет акушерства Американского колледжа акушеров и гинекологов. Заключение комитета ACOG № 485: Профилактика стрептококковой инфекции группы B с ранним началом у новорожденных (подтверждено в 2016 г.). Акушерский гинекол . 2011 апр. 117 (4): 1019-27. [Медлайн]. [Полный текст].
[Рекомендации] Schrag S, Gorwitz R, Fultz-Butts K, Schuchat A. Профилактика перинатального стрептококкового заболевания группы B.Пересмотренные рекомендации CDC. MMWR Recomm Rep . 2002 16 августа. 51 (RR-11): 1-22. [Медлайн].
Mukhopadhyay S, Lieberman ES, Puopolo KM, Riley LE, Johnson LC. Влияние оценки раннего сепсиса на практику грудного вскармливания в стационаре у бессимптомных доношенных новорожденных. Госпиталь Педиатр . 2015 Апрель 5 (4): 203-10. [Медлайн].
Kermorvant-Duchemin E, Laborie S, Rabilloud M, Lapillonne A, Claris O. Исход и прогностические факторы у новорожденных с септическим шоком. Pediatr Crit Care Med . 2008 марта, 9 (2): 186-91. [Медлайн].
Адамс-Чепмен И., Столл Б.Дж. Неонатальная инфекция и отдаленные исходы развития нервной системы у недоношенных детей. Curr Opin Infect Dis . 2006 июн.19 (3): 290-7. [Медлайн].
Volpe JJ. Послеродовой сепсис, некротический энтерколит и критическая роль системного воспаления в повреждении белого вещества у недоношенных детей. Дж Педиатр . 2008 Август.153 (2): 160-3. [Медлайн]. [Полный текст].
Столл Б.Дж., Хансен Н.И., Адамс-Чапман И. и др., Для Сети неонатальных исследований Национального института здоровья детей и развития человека. Нарушение нервного развития и роста у младенцев с крайне низкой массой тела при рождении с неонатальной инфекцией. JAMA . 2004 17 ноября. 292 (19): 2357-65. [Медлайн].
Seaward PG, Hannah ME, Myhr TL, et al. Международное многоцентровое исследование PROM: оценка предикторов неонатальной инфекции у новорожденных, родившихся у доношенных пациентов с преждевременным разрывом плодных оболочек.Преждевременный разрыв мембран. Am J Obstet Gynecol . 1998 сентябрь 179 (3, часть 1): 635-9. [Медлайн].
Комитет акушерской практики. Мнение комитета нет. 712: Внутриродовое ведение интраамниотической инфекции. Акушерский гинекол . 2017 Август 130 (2): e95-e101. [Медлайн]. [Полный текст].
Peng CC, Chang JH, Lin HY, Cheng PJ, Su BH. Внутриутробное воспаление, инфекция или и то, и другое (тройной I): новая концепция хориоамнионита. Педиатр неонатол . 2018 июн.59 (3): 231-7. [Медлайн].
Kuzniewicz MW, Walsh EM, Li S, Fischer A, Escobar GJ. Разработка и внедрение калькулятора раннего начала сепсиса для руководства антибиотикотерапией у недоношенных новорожденных и новорожденных на поздних сроках. Jt Comm J Qual Безопасность пациента . 2016 май. 42 (5): 232-9. [Медлайн].
Пуополо К.М., Дрейпер Д., Ви С. и др. Оценка вероятности неонатальной ранней инфекции на основе материнских факторов риска. Педиатрия . 2011 ноябрь 128 (5): e1155-63. [Медлайн].
Короткая МА. Руководство по систематическому физическому обследованию младенца с подозрением на инфекцию и / или сепсис. Adv Neonatal Care . 2004 июня, 4 (3): 141-53; викторина 154-7. [Медлайн].
Delanghe JR, Speeckaert MM. Трансляционные исследования и биомаркеры неонатального сепсиса. Клин Чим Акта . 2015 декабрь 7. 451 (pt A): 46-64. [Медлайн].
Чан К.Ю., Лам Х.С., Чунг Х.М. и др.Быстрая идентификация и дифференциация грамотрицательных и грамположительных бактериальных инфекций кровотока с помощью количественной полимеразной цепной реакции у недоношенных детей. Crit Care Med . 2009 августа 37 (8): 2441-7. [Медлайн].
Эномото М., Мориока И., Морисава Т., Йокояма Н., Мацуо М. Новый диагностический инструмент для обнаружения неонатальных инфекций с использованием мультиплексной полимеразной цепной реакции. Неонатология . 2009. 96 (2): 102-8. [Медлайн].
Mukhopadhyay S, Puopolo KM.Клинические и микробиологические характеристики раннего сепсиса у младенцев с очень низкой массой тела при рождении: возможности для управления антибиотиками. Pediatr Infect Dis J . 2017 май. 36 (5): 477-81. [Медлайн].
Carroll PD, Christensen RD. Новые и недостаточно используемые способы использования пуповинной крови в неонатальной помощи. Matern Health Neonatol Perinatol . 2015. 1:16. [Медлайн].
Хашу М., Осиович Х., Генри Д., Аль Хотани А., Солимано А., Спирт Д. П..Стойкая бактериемия и тяжелая тромбоцитопения, вызванные коагулазонегативным стафилококком в отделении интенсивной терапии новорожденных. Педиатрия . 2006 Февраль 117 (2): 340-8. [Медлайн].
Ньюман ТБ, Пуополо К.М., Wi S, Дрейпер Д., Эскобар Г.Дж. Интерпретация общего анализа крови вскоре после рождения у новорожденных с риском сепсиса. Педиатрия . 2010 ноябрь 126 (5): 903-9. [Медлайн].
Hawk M. C-реактивный белок при неонатальном сепсисе. Сеть для новорожденных . 2008 март-апрель. 27 (2): 117-20. [Медлайн].
Ng PC, Лам HS. Диагностические маркеры неонатального сепсиса. Curr Opin Pediatr . 2006 Апрель 18 (2): 125-31. [Медлайн].
Boskabadi H, Zakerihamidi M. Оцените диагноз неонатального сепсиса путем измерения интерлейкинов: систематический обзор. Педиатр неонатол . 2018 Август 59 (4): 329-38. [Медлайн]. [Полный текст].
Леал Ю.А., Альварес-Немегей Дж., Лавадорес-Мэй А.И., Хирон-Каррильо Дж. Л., Седильо-Ривера Р., Веласкес Дж. Р.Цитокиновый профиль как диагностический и прогностический фактор при неонатальном сепсисе. J Matern Fetal Neonatal Med . 2019 Сентябрь 32 (17): 2830-6. [Медлайн].
van Maldeghem I, Nusman CM, Visser DH. Растворимый подтип CD14 (sCD14-ST) как биомаркер неонатального сепсиса с ранним началом и сепсисом с поздним началом: систематический обзор и метаанализ. BMC Immunol . 2019 3 июня. 20 (1): 17. [Медлайн]. [Полный текст].
Meem M, Modak JK, Mortuza R, Morshed M, Islam MS, Saha SK.Биомаркеры для диагностики неонатальных инфекций: систематический анализ их потенциала в качестве диагностики в месте оказания медицинской помощи. Дж. Glob Health . 2011 декабрь 1 (2): 201-9. [Медлайн].
Алтунхан Х., Аннагур А., Орс Р., Мехметоглу И. Измерение прокальцитонина в 24-часовом возрасте может помочь в быстрой диагностике раннего неонатального сепсиса. Int J Заразить Dis . 2011 15 декабря (12): e854-8. [Медлайн].
Шарма Д., Фарахбахш Н, Шастри С., Шарма П.Биомаркеры для диагностики неонатального сепсиса: обзор литературы. J Matern Fetal Neonatal Med . 2018 31 июня (12): 1646-59. [Медлайн].
Ng PC, Li K, Leung TF и др. Раннее прогнозирование диссеминированного внутрисосудистого свертывания крови, вызванного сепсисом, с помощью интерлейкина-10, интерлейкина-6 и RANTES у недоношенных детей. Clin Chem . 2006 июн. 52 (6): 1181-9. [Медлайн].
Garges HP, Moody MA, Cotten CM и др. Неонатальный менингит: какова взаимосвязь между культурами спинномозговой жидкости, культурами крови и параметрами спинномозговой жидкости? Педиатрия . 2006 апр. 117 (4): 1094-100. [Медлайн].
Дэвис К.Л., Шах СС, Франк Г., Эппес СК. Почему младенцев проверяют на вирус простого герпеса ?. Скорая педиатрическая помощь . 2008 24 октября (10): 673-8. [Медлайн].
Ting JY, Synnes A, Roberts A, et al, для Исследователей Канадской сети новорожденных. Связь между использованием антибиотиков и неонатальной смертностью и заболеваемостью у младенцев с очень низкой массой тела при рождении без культурально-подтвержденного сепсиса или некротического энтероколита. JAMA Pediatr . 2016 декабрь 1. 170 (12): 1181-7. [Медлайн].
Циалла С., Боргези А., Поцци М., Стронати М. Инфекции новорожденных, вызванные мультирезистентными штаммами: эпидемиология, текущее лечение, новые терапевтические подходы и профилактика. Клин Чим Акта . 2015, 7 декабря. 451 (Pt A): 71-7. [Медлайн].
Shipp KD, Chiang T, Karasick S, Quick K, Nguyen ST, Cantey JB. Проблемы рационального использования антибиотиков в отделении интенсивной терапии новорожденных. Am J Perinatol . 2016 апр. 33 (5): 518-24. [Медлайн].
Clark RH, Bloom BT, Spitzer AR, Gerstmann DR. Эмпирическое применение ампициллина и цефотаксима по сравнению с ампициллином и гентамицином у новорожденных с риском сепсиса связано с повышенным риском неонатальной смерти. Педиатрия . 2006 Январь 117 (1): 67-74. [Медлайн].
Заиди А.К., Тикмани С.С., Варрайч Х.Дж. и др. Лечение серьезных бактериальных инфекций у новорожденных и детей грудного возраста на базе сообщества: рандомизированное контролируемое испытание, оценивающее три схемы антибиотикотерапии. Pediatr Infect Dis J . 2012 июля 31 (7): 667-72. [Медлайн].
Гарсия-Пратс JA, Cooper TR, Schneider VF, Stager CE, Hansen TN. Быстрое обнаружение микроорганизмов в культурах крови новорожденных с использованием автоматизированной системы посева крови. Педиатрия . 2000 марта 105 (3 п.1): 523-7. [Медлайн].
Броклхерст П., Фаррелл Б., Кинг А. и др. Для совместной группы ИНИС. Лечение неонатального сепсиса иммуноглобулином внутривенно. N Engl J Med . 2011 29 сентября. 365 (13): 1201-11. [Медлайн].
Центры по контролю и профилактике заболеваний. Профилактика перинатального стрептококкового заболевания группы B: перспективы общественного здравоохранения. Центры по контролю и профилактике заболеваний. MMWR Recomm Rep . 1996 31 мая. 45 (РР-7): 1-24. [Медлайн].
[Рекомендации] Американская академия педиатрии, Объединенный комитет по детскому слуху. Заявление о позиции на 2007 год: Принципы и рекомендации по раннему обнаружению слуха и программам вмешательства. Педиатрия . 2007 Октябрь 120 (4): 898-921. [Медлайн]. [Полный текст].
[Рекомендации] Американская академия аудиологии. Заявление о позиции и рекомендации по клинической практике Американской академии аудиологии: мониторинг ототоксичности. 2009, 1-25 октября. [Полный текст].
Sarkar S, Bhagat I, DeCristofaro JD, Wiswell TE, Spitzer AR. Изучение роли посевов крови из нескольких участков в оценке неонатального сепсиса. Дж Перинатол .2006 г., 1. 26 (1): 18-22. [Медлайн].
Гитанат Р.М., Ахмед I, Абу-Харб М., Онвунем С., МакГарри К., Хиншоу К. Антибиотики во время родов для длительного разрыва плодных оболочек в срок для предотвращения стрептококкового сепсиса группы B. J Obstet Gynaecol . 2019 июл.39 (5): 619-22. [Медлайн].
Сойер Т., Биллимория З., Хэндли С. и др. Терапевтический плазмообмен при неонатальном септическом шоке: ретроспективное когортное исследование. Am J Perinatol .2019 8 июня [Medline].
Отчет двух новорожденных
Стафилококковая инфекция у плода встречается редко и связана либо со стафилококковым сепсисом матери, либо с колонизацией, ведущей к вертикальной передаче. Дородовые инвазивные процедуры являются признанным фактором риска. У большинства новорожденных со стафилококковыми инфекциями, возникшими внутриутробно, исход был хуже. Мы сообщаем историю двух новорожденных, у которых при рождении были пустулезно-буллезные поражения кожи, и они успешно ответили на антистафилококковые антибиотики.Оба новорожденных полностью выздоровели. При наличии буллезных поражений кожи у новорожденного важно клинически заподозрить стафилококковые инфекции.
1. Введение
Staphylococcus aureus — это грамположительный бактериальный патоген, который обнаруживается на коже и имеет уровень колонизации влагалища 15% [1]. Однако хорошо известно, что он вызывает тяжелые инфекции мягких тканей, и появляется все больше доказательств того, что он также может вызывать хориоамнионит, ведущий к неонатальной заболеваемости и преждевременным родам [2].Материнский хориоамнионит и стафилококковая неонатальная септицемия связаны с худшими исходами и высокой неонатальной смертностью [3]. Авторы сообщают о двух новорожденных, у которых при рождении были пустулезно-буллезные поражения кожи без признаков клинического хориоамнионита и которые успешно ответили на антистафилококковые антибиотики. Оба новорожденных полностью выздоровели. Своевременное лечение соответствующими антистафилококковыми антибиотиками приводит к выздоровлению без прогрессирования бактериемии и ее осложнений, таких как септический шок, менингит и септический артрит.
2. Случай 1
Новорожденный ребенок поступил в больницу после выявления генерализованных пустулезно-буллезных поражений при рождении (рис. 1). Она родилась после экстренной LSCS (кесарево сечение нижнего сегмента) из-за отсутствия прогресса. Она была четвертым ребенком у матери, чья беременность протекала без осложнений. Перинатальный период протекал без осложнений, и только за три часа до родов после спонтанных родов произошел разрыв плодных оболочек. У матери также не было ни температуры, ни запаха спиртных напитков. При родоразрешении не использовались инструменты, и в остальном ребенок был здоров с удовлетворительными оценками по шкале APGAR.
У нее был септический скрининг при рождении, после которого было начато внутривенное (в / в) введение клоксациллина 50 мг / кг два раза в день, как при стафилококковом сепсисе. Исследования выявили FBC-WBC 35 × 10 3 , нейтрофилы 84%, лимфоциты 12%, моноциты 5% и CRP 12 мг · дл. Исследования CSF были нормальными. И мазок с поверхности, и посев крови выявили Staphylococcus aureus . Однако при внутривенном введении клоксациллина кожные поражения стали обширными, что дало слабый ответ. Поэтому антибиотики были заменены на меропен в / в 30 мг / кг каждые 8 часов.Тем не менее, после приема меропена у нее произошло постепенное выздоровление с исчезновением буллезных поражений, и лечение меропеном продолжалось 10 дней. Staphylococcus aureus был чувствителен к меропену, котримоксаолу и линезолиду. Хотя мать прошла скрининг на MSSA (метициллин-чувствительный Staphylococcus aureus ) и MRSA (метициллин-резистентный Staphylococcus aureus ), ее результаты исследования были нормальными.
3. Случай 2
Доношенный новорожденный, родившийся на дому акушеркой естественным путем, был доставлен в местную больницу для дальнейшего лечения буллезного поражения ягодиц, обнаруженного при рождении (рис. 2).Мать была одинока и не наблюдалась в женской консультации. У нее не было длительного разрыва мембраны, гипертермии или запаха ликвора. После госпитализации ребенок начал плохо сосать и стал менее активным. Ей было начато внутривенное введение клоксациллина в дозе 50 мг / кг два раза в день после обследования на сепсис. Исследования показали нормальное количество лейкоцитов и повышенный уровень СРБ (24 мг / дл). Исследования CSF были нормальными. Посев с поверхности буллезного очага выявил Staphylococcus aureus .Однако посев крови не выявил роста. Внутривенное введение клоксациллина продолжалось в течение семи дней, и на фоне приема антибиотиков у нее наступило постепенное выздоровление. Хотя мать прошла скрининг на MSSA (метициллин-чувствительный Staphylococcus aureus ) и MRSA (метициллин-резистентный Staphylococcus aureus ), ее результаты исследования были нормальными.
4. Обсуждение
Материнская стафилококковая колонизация связана с повышенным риском стафилококковой инфекции у новорожденных [4].Этот отчет уникален тем, что у обоих зарегистрированных новорожденных были выявлены стафилококковые инфекции кожи до рождения, что указывает на передачу инфекции от матери к плоду, вероятно, вторичной по отношению к колонизации влагалища матери. Исследования показали, что материнская колонизация связана с пятикратным повышением риска неонатальной колонизации в течение 2 часов после рождения [4]. Однако прямая передача инфекции от матери новорожденному встречается редко [5]. Кроме того, тот факт, что новорожденная, о которой сообщалось в случае 1, была доставлена с помощью LSCS, предполагает, что у нее были стафилококковые буллезные поражения внутриутробно.Доставка с помощью LSCS связана со значительным снижением колонизации новорожденных [6].
Ранее описанная серия случаев стафилококковой инфекции у матери и плода позволила выявить их факторы риска и осложнения у новорожденного [7]. Среди 11 сообщенных детей большинство были недоношенными, а дородовые инвазивные процедуры были фактором риска. Посев крови оказался положительным только у девяти детей. В их серии у всех детей было более тяжелое клиническое течение с дыхательной и гемодинамической недостаточностью; однако выборка была ограничена новорожденными, находившимися в отделении интенсивной терапии.
Патофизиология стафилококковых инфекций кожи и мягких тканей связана с секрецией бактериальных внеклеточных белков и компонентов бактериальной поверхности [8]. Эксфолиативные токсины А и В вызывают массивное увеличение Т-лимфоцитов, секретирующих лимфокины ИЛ-1, ИЛ-6 и ФНО-альфа [9]. Отшелушивающий токсин А также приводит к образованию волдырей. Оставленные без лечения волдыри приводят к бактериемии [10], и полное выздоровление обычно занимает 2-3 недели после начала приема соответствующих антибиотиков.
Дифференциальная диагностика пузырно-пузырчатых поражений у новорожденных многочисленна [11]. Инфекционная этиология включает буллезное импетиго и инфекции простого герпеса. Унаследованные причины включают наследственный буллезный эпидермолиз и буллезный ихтиоз, тогда как иммунобуллезные заболевания включают неонатальный буллезный пемфигоид и линейный дерматоз IgA. Тщательная клиническая оценка и микробиологическая демонстрация патогена помогают отличить неонатальные стафилококковые буллезные поражения от других этиологий.
Клинические признаки неонатальных стафилококковых инфекций зависят от локализации и тяжести инфекции. Осложнения неонатальных стафилококковых инфекций включают септический шок, пневмонию и абсцессы легких, септическую кишечную непроходимость и некротический энтероколит [12], церебральные абсцессы и менингит, остеомиелит, флегмона глазницы, септический артрит и эндокардит и связаны с высокой смертностью [13].
Лечение инвазивных стафилококковых инфекций включает внутривенное введение антибиотиков и лечение сопутствующих осложнений.Неосложненный Staphylococcus aureus бактерии нуждаются в внутривенном введении антибиотиков не менее 10–14 дней, в то время как длительный курс антибиотиков показан при таких осложнениях, как септический артрит, остеомиелит, менингит и абсцессы головного мозга.
5. Заключение
Важно клинически заподозрить стафилококковые инфекции при наличии буллезных поражений кожи у новорожденного. Однако посев крови может не выявить возбудителя во всех случаях, особенно у здорового новорожденного.Своевременное лечение соответствующими антистафилококковыми антибиотиками приводит к разрешению клинических проявлений и выздоровлению.
Доступность данных
Данные, связанные с этим отчетом, можно получить у соответствующего автора по разумному запросу.
Согласие
Письменное информированное согласие было получено от пациента на публикацию и сопроводительное изображение.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Все авторы одобрили окончательную версию рукописи.
Благодарности
Авторы хотели бы поблагодарить директора и доктора Р. Вайтеки, консультанта-микробиолога, и доктора С. А. К. Ирошини, консультанта-неонатолога, Т. Д. Баттикалоа, которые помогли управлять ребенком.
Авторские права
Авторские права © 2020 В. Тадчанамурти и Кавинда Даясири. Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Новая коронавирусная инфекция у новорожденных младше 28 дней в Китае
Резюме
В предыдущих исследованиях описывались клинические особенности Covid-19 у взрослых и младенцев в возрасте до 1 года. Мало что известно об особенностях, исходах и потенциале внутриутробной передачи у новорожденных в возрасте 28 дней и младше. Путем систематического поиска мы выявили 4 инфекции у новорожденных в Китае по состоянию на 13 марта. Возрастной диапазон составлял от 30 часов до 17 дней. Трое были мужчинами. У двух новорожденных была лихорадка, у одного была одышка, у одного был кашель и у одного не было синдромов.Поддерживающая терапия проводилась всем 4 новорожденным. Ни один не требовал интенсивной терапии или искусственной вентиляции легких. Ни у кого не было серьезных осложнений. К концу исследования трое новорожденных выздоровели и были выписаны за 16, 23 и 30 дней пребывания в больнице. Все 4 матери были инфицированы SARS-CoV-2, у 3 были симптомы до родов, а у 1 — после родов. Кесарево сечение было выполнено всем 4 матерям: 3 — в больницах уровня III и 1 — в больнице уровня II. Трое новорожденных были разлучены с матерями сразу после рождения и не находились на грудном вскармливании.Таким образом, новорожденные дети восприимчивы к инфекции SARS-CoV-2. Симптомы у новорожденных были более легкими, а исходы менее тяжелыми по сравнению со взрослыми. Возможна внутриутробная вертикальная передача, но прямых доказательств нет.
Введение
Вспышка коронавирусной болезни 2019 г. (Covid-19) быстро распространяется [1–8]. 31 января Всемирная организация здравоохранения объявила Covid-19 чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение. К 13 марта Covid-19 был подтвержден в 127 странах с 145 166 случаями и 5428 смертельными исходами по всему миру.
Сообщалось, что на более ранней стадии эпидемии пожилые люди были более подвержены инфицированию [1–8]. Впоследствии сообщалось об инфекциях у младенцев в возрасте до 1 года [8] и детей. На сегодняшний день мало что известно об инфекции у новорожденных. Кроме того, данные о внутриматочной передаче очень скудны [9]. Мы определили всех инфицированных новорожденных в Китае к 13 марта и описали клинические особенности, лечение, исходы и потенциал внутриутробной передачи.
Методы
Источники данных
Для этого ретроспективного исследования мы идентифицировали все неонатальные инфекции SARS-CoV-2 в период с 8 декабря 2019 г. по 13 марта 2020 г. в Китае. Сводное число новых инфекций ежедневно публикуется Национальной комиссией здравоохранения Китая [10]. Мы систематически исследовали все лабораторно подтвержденные 81 026 случаев заболевания к 13 марта, как описано ранее [8]. Короче говоря, мы получили сводные данные из центрального правительства и местных департаментов здравоохранения и провели скрининг новорожденных младше 28 дней.Были опрошены местные больницы, административные офисы и семьи пациентов с помощью средств связи по телефону или через Интернет. Это исследование было одобрено институциональным наблюдательным советом Школы медицинских наук Уханьского университета. Информированное согласие было отклонено в рамках расследования вспышки болезни.
Сбор данных
Данные о демографии, начале заболевания, диагнозе, лечении и исходах были собраны с использованием стандартных форм. Чтобы проанализировать потенциал внутриутробной передачи, начало болезни матери (симптомы, время появления симптомов относительно родов), диагноз, связь с Уханью (проживание или посещение Ухани или непосредственный контакт с посетителями из Ухани), родоразрешение (способы доставки, уровень больницы, защита уровень, гестационный возраст на момент родов), контакт матери и ребенка (разлучение, кормление грудью).
Определение инфекции SARS-CoV-2
Для выявления неонатальной инфекции во время госпитализации брали мазки из носоглотки или анналы. Количественная полимеразная цепная реакция в реальном времени использовалась в соответствии с рекомендованным протоколом [11].
Для матерей новорожденных использовали компьютерную томографию для предварительного обследования. Аномальные результаты включали непрозрачность матового стекла и двустороннее пятнистое затемнение. Подозрение на инфекцию определялось как отклонение от нормы результатов компьютерной томографии в сочетании с типичными клиническими симптомами, включая жар, кашель, головную боль, боль в горле, одышку, выделение мокроты.Были взяты мазки из носоглотки для обнаружения нуклеиновой кислоты SARS-CoV-2. Подтверждение наличия инфекции у матери было основано на тестах на нуклеиновую кислоту.
Результаты
На основании источников данных, которые мы использовали в этом ретроспективном исследовании, 4 подтвержденные нуклеиновыми кислотами неонатальные инфекции были идентифицированы посредством систематического и всестороннего поиска среди 81 026 подтвержденных случаев в Китае по состоянию на 13 марта (таблица 1). Все 4 пациента госпитализированы. Трое были мужчинами. Возрастной диапазон составлял от 30 часов до 17 дней.
ТАБЛИЦА 1
Характеристики 4 госпитализированных неонатальных инфекций, подтвержденных нуклеиновыми кислотами
У двух новорожденных была лихорадка, у 1 была одышка, у 1 был кашель и у 1 не было заметных синдромов. Заболевание возникло в больнице для 2 новорожденных и дома для 2 новорожденных. Два новорожденных ребенка были изолированы, а двое не изолированы на момент начала болезни.
Обнаружение нуклеиновых кислот проводилось с использованием мазков из носоглотки для 2 новорожденных и мазков из анальной жидкости для 2 новорожденных.Четверо новорожденных детей дали положительный результат при обнаружении нуклеиновых кислот. Компьютерная томография была проведена у 3 новорожденных. У всех наблюдалась повышенная маркировка легких. Время между датами поступления / появления симптомов и постановкой диагноза составляло 0–2 дня.
Всем 4 новорожденным было проведено поддерживающее лечение. Ни один не требовал интенсивной терапии или искусственной вентиляции легких. Ни у кого не было серьезных осложнений. Считалось, что трое новорожденных выздоровели после двух последовательных отрицательных тестов на нуклеиновую кислоту (с интервалом ≥24 ч). Пребывание в больнице составило 16, 23 и 30 дней соответственно.
У матери всех четырех новорожденных было диагностировано инфицирование. У трех матерей симптомы проявились до родов и у 1 — после родов. Наиболее частыми симптомами у матерей были лихорадка, за которой следовали кашель, снижение аппетита и непереносимость масел. Компьютерная томография была проведена всем 4 матерям, у 3 — до родов, а у 1 — после родов. У всех матерей были обнаружены отклонения от нормы. Обнаружение нуклеиновых кислот проводилось у всех 4 матерей, у 3 — после родов и 1 — до родов. Все 4 матери дали положительный результат на нуклеиновую кислоту.
Кесарево сечение было выполнено всем 4 матерям, 3 — в больницах уровня III и 1 — в больнице уровня II. Уровень защиты был III для 3 матерей и II для 1 матери. Трое новорожденных были разлучены с матерями сразу после рождения и не находились на грудном вскармливании; один новорожденный не был отделен от матери и находился на грудном вскармливании в течение 16 дней до появления симптомов.
Обсуждение
На основании источников данных, использованных в этом исследовании, у новорожденных были выявлены 4 подтвержденные нуклеиновой кислотой инфекции.
Симптомы неонатальной инфекции обычно слабо выражены по сравнению со взрослыми пациентами. О серьезных клинических осложнениях или летальных исходах не сообщалось, по сравнению с уровнем летальности 4–15% среди взрослых [1–4]. Обратите внимание, что у младенцев в возрасте до 1 года также наблюдались легкие симптомы или их отсутствие и редко — тяжелые осложнения [8]. Обнадеживает тот факт, что новорожденные и младенцы менее уязвимы для SARS-CoV-2. С другой стороны, легкие симптомы или их отсутствие у самых молодых затрудняют выявление и предотвращение дальнейшей передачи.
Число неонатальных инфекций составляет 4 по сравнению с 9 инфекциями у младенцев в возрасте от 28 дней до 1 года [8]. Пропорционально частота инфицирования у новорожденных может быть значительно выше, чем у младенцев. Различие в шансах заражения может объяснить разницу между темпами заражения, если таковая имеется, но пути передачи также могут быть разными. Возможно, что вертикальная передача является дополнительным путем неонатальных инфекций, хотя предыдущее исследование 6 беременных женщин не обнаружило каких-либо прямых доказательств [9].
Результаты настоящего исследования подтверждают потенциал внутриутробной передачи. Все 4 новорожденных были доставлены через кесарево сечение, и 3 новорожденных находились под защитой III уровня. Возможность передачи инфекции от матери ребенку во время родов через естественные родовые пути была исключена. За исключением пациента 2, контактировавшего с инфицированным посетителем, все остальные 3 новорожденных были изолированы, когда появились симптомы. У 3 новорожденных не было контакта матери и ребенка или кормления грудью. Время между рождением и постановкой диагноза было ограничено — от 30 часов до 5 дней.В совокупности вероятность заражения другими путями, кроме внутриутробной передачи, считается низкой. Однако есть и другие объяснения инфекций новорожденных. Во-первых, нельзя полностью исключить возможность внутрибольничного заражения. Во-вторых, мазки из носоглотки и анальной кишки не могут напрямую указывать на внутриутробную инфекцию, а вирусные частицы не были обнаружены в околоплодных водах или пуповинной крови у 6 пациентов [9]. В-третьих, количество неонатальных инфекций невелико, хотя возможна неполная идентификация.В-четвертых, SARS-CoV, другой коронавирус с аналогичной последовательностью генома [12], не передается вертикально [13, 14]. Требуются дальнейшие исследования.
Настоящее исследование имеет ограничения. Во-первых, хотя был проведен систематический и всесторонний поиск инфекции SARS-CoV-2 у новорожденных младше 28 дней, возможна неполная идентификация случаев. Во-вторых, настоящее исследование выявило в основном пациентов с симптомами. Однако существует бессимптомная инфекция Covid-19 [8, 15].В-третьих, у этих 5 новорожденных не были взяты образцы внутриматочной ткани. Прямое обнаружение SARS-CoV-2 в настоящем исследовании невозможно.
Таким образом, новорожденные дети восприимчивы к инфекции SARS-CoV-2. Симптомы у новорожденных были более легкими, а исходы менее тяжелыми по сравнению со взрослыми. Возможна внутриутробная вертикальная передача, но прямых доказательств нет.
Сноски
Вклад: Z.Z-J задумал исследование и подготовил рукопись; Z.Данные, собранные Z-J, Y.X-J, F.T., L.Y, J.Y., Y.B.X., B.Y. отредактировал рукопись.
Конфликт интересов: доктору Чжану нечего раскрывать.
Конфликт интересов: д-ру Ю нечего раскрывать.
Конфликт интересов: доктору Фу нечего раскрывать.
Конфликт интересов: доктору Лю нечего раскрывать.
Конфликт интересов: доктору Цзян нечего раскрывать.
Конфликт интересов: Dr.Ян нечего раскрывать.
Конфликт интересов: доктору Би нечего раскрывать.
- Получено 1 марта 2020 г.
- Принято 26 марта 2020 г.
Врожденные инфекции новорожденных — определение и лечение
Изображение: «Осмотр новорожденного». . Лицензия: CC BY 2.0
Определение
Это набор специфических врожденных инфекций, приобретенных внутриутробно или во время родов, вызывающих значительную внутриутробную и неонатальную заболеваемость и смертность.
Эпидемиология врожденных инфекций младенцев
Заболеваемость и распространение врожденных инфекций у младенцев изменились за последнее десятилетие. Заболеваемость врожденным токсоплазмозом и врожденным сифилисом снижается благодаря внедрению новых методов лечения и обязательного тестирования матерей на сифилис .
Избегание кошек и недоваренного мяса также связано с уменьшением заболеваемости врожденным токсоплазмозом.
Врожденная ветряная оспа и краснуха также становятся менее распространенными после введения вакцины против этих двух вирусов. Наиболее частой причиной врожденных инфекций в настоящее время является цитомегаловирус , но это может скоро измениться, поскольку было показано, что Ганцикловир является эффективным средством против вируса.
Использование противовирусной терапии и кесарева сечения снизило частоту врожденного герпеса и улучшило клинический исход младенцев.
Патофизиология врожденных инфекций у младенцев
Известно, что большинство вышеупомянутых инфекционных агентов проникают через плацентарный барьер и распространяются на плод внутриутробно, что может вызвать гибель плода , появление определенных врожденных пороков развития , недоношенных или хронических постнатальных инфекций . Заболевание матери обычно протекает в легкой форме, но последствия для плода обычно тяжелые.
Материнские инфекции на очень ранних сроках беременности могут вызвать потерю плода , что считается заниженным , потому что на этой стадии большинство женщин не знают, что они беременны.
Трансплацентарное распространение этих организмов у плода может быть связано с хронической инфекцией из-за незрелости иммунной системы плода. Эти организмы обычно не очень вирулентны, и иммунная система развивающегося плода может выработать к ним толерантность. Если это произойдет, иммунная система плода не сможет устранить инфекционные организмы, и может возникнуть хроническая инфекция.
Клинические проявления этих врожденных инфекций можно увидеть вскоре после рождения, в младенчестве, детстве или позже во взрослом возрасте.
Врожденный токсоплазмоз
Определение
Врожденный токсоплазмоз вызывается простейшими toxoplasma gondii , которые передаются от инфицированной матери к развивающемуся плоду трансплацентарно. Возбудитель болезни может быть передан при контакте с зараженными кошачьими фекалиями или при употреблении сырого мяса.
Микроскопические кисты, содержащие Toxoplasma gondii, развиваются в тканях многих позвоночных. Здесь, в ткани мозга мыши, тысячи покоящихся паразитов (окрашенных в красный цвет) окружены тонкой стенкой кисты паразита.
Врожденный токсоплазмоз обычно не распознается при рождении , и женщины в Соединенных Штатах обычно не проходят скрининг на токсоплазмоз. К сожалению, клинические последствия врожденного токсоплазмоза обычно проявляются у большинства больных в раннем взрослом возрасте.
Клинические особенности
Наиболее частыми проявлениями врожденного токсоплазмоза у младенцев являются хориоретинит , который может приводить к слепоте, обструктивной гидроцефалии и внутричерепной кальцификации.К сожалению, умственная отсталость часто наблюдается у младенцев, у которых развиваются внутричерепные кальцификации. Судороги и двигательная недостаточность также часто наблюдаются у пораженных младенцев.
Диагностика
Раннее выявление материнского токсоплазмоза необходимо для предотвращения распространения инфекции на плод. В Европе ежемесячный скрининг на токсоплазмоз стал стандартом лечения, поскольку он полезен для выявления ранней сероконверсии.
Тест полимеразной цепной реакции на токсоплазмоз в околоплодных водах также является вариантом и может помочь в установлении диагноза на ранней стадии.После подтверждения диагноза мать должна получать спирамицин по 1,5 грамма два раза в день для предотвращения инфицирования плода.
Если результат теста полимеразной цепной реакции окажется положительным, то вероятность инфицирования плода высока. В этом случае рекомендуется использовать пириметамин и сульфадиазин плюс фолиновая кислота .
Симптомы токсоплазмоза у матери неспецифичны и могут быть легко пропущены даже опытным врачом.Поэтому в случае сомнений рекомендуется заказать серологический тест или тест полимеразной цепной реакции для подтверждения диагноза.
Пренатальные ультразвуковые признаки ограничения внутриутробного развития, гидроцефалии плода, внутричерепных кальцификатов и асцита указывают на токсоплазмоз плода. И снова следует начать комбинированную терапию пириметамином , сульфадиазином и фолиевой кислотой .
Профилактика токсоплазмоза
- Беременные женщины должны пройти обследование, если есть опасения по поводу риска.
- Беременным женщинам следует избегать сырого мяса.
- Беременным женщинам следует менять наполнитель для кошачьего туалета ежедневно или попросить кого-нибудь сделать это.
Врожденный сифилис
Этапы
Все матери, больные сифилисом, передают возбудитель, Treponema pallidum , развивающемуся плоду трансплацентарным путем. Сифилис можно разделить на три стадии.
- первичная стадия характеризуется наличием сифилитического шанкра и лимфаденита.
- вторичная стадия характеризуется распространением гематогонов микроорганизмов и является стадией, наблюдаемой у младенцев с врожденным сифилисом. Затем эти младенцы могут перейти в латентную бессимптомную стадию или симптоматическую третичную стадию.
- Симптоматическая третичная стадия врожденного сифилиса характеризуется неврологическими и сердечно-сосудистыми заболеваниями, помимо гранулематозной болезни кожи.
Изображение: «Микрофотография, показывающая Treponema pallidum, спирохет, вызывающую сифилис.Пятно Дитерле »Нефрона — Собственная работа. Лицензия: CC BY-SA 3.0
.
Эпидемиология
Заболеваемость врожденным сифилисом снизилась с момента введения обязательного серологического скрининга во время беременности . Инфекция плода чаще встречается у матерей с первичной или вторичной стадией сифилиса.
Клинические особенности
Врожденный сифилис может проявляться симптомами в возрасте до двух лет, т. Е. Заболевание на ранней стадии или симптомы могут появиться через два года, т.е.е., позднее заболевание. Без эффективного лечения случаев перинатальной смерти наступает в одной трети случаев. Остальные две трети обычно рождаются бессимптомно, но если их не лечить, симптомы появятся в течение первых нескольких месяцев жизни.
Ранние проявления врожденного сифилиса включают кровянистые выделения из носа, гепатоспленомегалию, желтуху, повышение уровня печеночных ферментов, лимфаденопатию, гемолитическую анемию, остеохондрит и тромбоцитопению. Кожно-слизистая сыпь, нарушение роста, нефрит, слепота из-за хориоретинита и аномалии центральной нервной системы также часто наблюдаются на ранних стадиях заболевания.Поздние признаки врожденного сифилиса включают хроническое воспаление костей, зубов и центральной нервной системы.
Диагноз
Диагноз врожденного сифилиса может быть подтвержден с помощью темнопольной микроскопии на образцах, полученных из плаценты или пупка, или с помощью серологического исследования . Наиболее часто используемыми серологическими тестами являются тест Лаборатории исследования венерических заболеваний и тест Rapid Plasma Reagin .Эти два теста выявляют антитела против кардиолипина, и они не специфичны для сифилиса, но полезны для прогнозирования активности и тяжести заболевания.
Тест иммобилизации T. pallidum , тест абсорбции флуоресцентных трепонемных антител и тесты микрогемагглютинации для T. pallidum специфичны для сифилиса. Тестирование полимеразной цепной реакции для T. pallidum до сих пор недоступно для клинической практики.
Лечение
Младенцы с симптомами, у которых сифилис подтвержден одним из неспецифических количественных тестов или специальных тестов, должны получить лечение.Кроме того, следует обследовать бессимптомных младенцев от матерей с положительным серологическим тестом, а в случае выявления врожденного сифилиса — лечить.
Если документально подтвержденная история лечения матери недоступна, лечение матери против сифилиса проводилось менее чем за месяц до родов или мать не получала пенициллин, необходимо обследовать и лечить ребенка.
Наиболее эффективная терапия для врожденного сифилиса — это 10-дневный курс водного пенициллина G от 100 000 до 150 000 единиц / кг / 24 каждые двенадцать часов в течение первой недели и каждые восемь часов после этого или прокаин пенициллин G 50 000 единиц / кг в / м. один раз в день в течение десяти дней.Успех лечения подтверждается возвращением к отрицательному результату серологического теста одного из неспецифических тестов, упомянутых выше.
| Первые выводы | Позже выводы |
| Гепатоспленомегалия | Зубья Хатчинсона (зубчатые) |
| Аденопатия | Потеря слуха |
| Сыпь | Седловидный нос |
| Ринит (насморк) | Сабля голени |
| Метафизарные просветы при рентгенографии | Задержка развития |
Инфекция ветряной оспы
Определение
Первичная инфекция ветряной оспы у матери может вызвать синдром врожденной ветряной оспы или ветряную оспу новорожденных в зависимости от времени начала материнской инфекции.Синдром врожденной ветряной оспы возникает, когда трансплацентарное распространение происходит во время раннего развития плода, тогда как неонатальная ветряная оспа возникает, если трансплацентарная инфекция возникает во время родов.
Эпидемиология
Примерно 25% плодов инфицированных матерей заразятся инфекцией, но только 2% будут поражены клинически. Если инфицирование происходит в период с шестой по 12-ю -ю неделю беременности, это может повлиять на развитие конечностей. Инфекция плода на сроке от 16 до 20 недель беременности связана с заболеваниями глаз и головного мозга.Считается, что инфицирование плода в третьем триместре приводит к менее тяжелому заболеванию.
Клинические особенности
Наиболее частыми проявлениями синдрома врожденной ветряной оспы являются рубцовые рубцы на коже, атрофия конечностей, наличие нейрогенного мочевого пузыря и гидронефроз. Наличие этих последних трех признаков указывает на поражение вегетативной нервной системы . Микроцефалия, корковая атрофия, судороги и умственная отсталость также наблюдаются при синдроме врожденной ветряной оспы.Заболевания глаз характеризуются микрофтальмией, катарактой и хориоретинитом.
Диагноз
Диагноз инфицирования плода вирусом ветряной оспы может быть подтвержден задокументированным анамнезом ветряной оспы во время беременности матери, а также типичной клинической картиной синдрома врожденной ветряной оспы у новорожденных.
Тестирование с помощью полимеразной цепной реакции на вирусную ДНК доступно и также может помочь в установлении диагноза. Тестирование полимеразной цепной реакции может быть подтверждено на основе образцов пуповинной крови, ворсинок хориона или крови плода.Иммуноглобулин-М и иммуноглобулин-G вируса ветряной оспы являются положительными при синдроме врожденной ветряной оспы.
Лечение
Женщины, которые подверглись воздействию вируса ветряной оспы, но еще не заболели этой инфекцией, могут получить пользу от введения иммуноглобулина против ветряной оспы.
Беременным женщинам с тяжелой формой ветряной оспы может помочь введение ацикловира , но неизвестно, влияет ли это на риск инфицирования плода.Противовирусное лечение синдрома врожденной ветряной оспы не показано, поскольку вирус не реплицируется у новорожденного.
Если мать заболеет ветряной оспой в течение последних нескольких дней беременности, риск неонатальной ветряной оспы очень высок. Смертность от этого состояния может достигать 30%, и было показано, что использование иммуноглобулина против ветряной оспы у новорожденных спасает жизнь.
Парвовирус B19
Определение
Парвовирус B19 у взрослых обычно протекает бессимптомно или не выявляется.Инфекция парвовирусом B19 во втором триместре может быть связана с водянкой плода или потерей плода . Если у плода не развиваются какие-либо из этих острых осложнений или если внутриутробное переливание крови успешно спасает плод, риск хронической инфекции парвовируса B19 у плода незначителен.
Вирус иммунодефицита человека
Патофизиология
Было показано, что вирус иммунодефицита человека (ВИЧ) может передаваться через плацентарный путь к развивающемуся плоду.Беременные женщины, у которых подтверждено наличие ВИЧ, могут передать вирус своему плоду почти в 40% случаев.
Рисунок: «ВИЧ» Брюса Блауса. Лицензия: CC BY-SA 4.0
.
Почти у всех новорожденных от ВИЧ-инфицированных матерей ВИЧ-специфические антитела являются положительными при рождении. Это, однако, не означает, что эти младенцы были инфицированы, поскольку серологическая реверсия, как сообщается, происходит у значительного числа детей в возрасте до 18 месяцев. Грудное вскармливание также связано с повышенным риском послеродовой передачи ВИЧ младенцу.
Клинические особенности
Врожденная инфекция ВИЧ обычно не вызывает никаких симптомов при рождении. Ранними проявлениями врожденной ВИЧ-инфекции являются лимфаденопатия, гепатоспленомегалия, кандидоз полости рта и инвазивные бактериальные инфекции. Также можно увидеть рецидивирующую пневмонию и нарушение нормального развития.
Диагноз
Диагноз «врожденная ВИЧ-инфекция» может быть подтвержден положительным результатом теста на полимеразную цепную реакцию . Отрицательный результат теста на полимеразную цепную реакцию при рождении, в возрасте одного и четырех месяцев достаточно для исключения врожденной ВИЧ-инфекции.
Использование зидовудина (ZDV) ВИЧ-инфицированной матерью во время беременности и во время родов, а также введение ZDV новорожденному значительно снизили риск вертикальной передачи ВИЧ младенцу. Использование ZDV во время родов в сочетании с невирапином также снизило риск заражения младенцев.
Ведение ВИЧ-инфекции у матерей и новорожденных
- ВААРТ терапия для подтвержденных инфицированных младенцев
- AZT во время родов для матери
- Кесарево сечение, если у матери> 1000 копий / куб.
- Открытый младенец получает:
- АЗТ перорально в течение 6 недель после родов
- Профилактика TMP / SMX до выявления ВИЧ-отрицательного результата.
Врожденная краснуха
Эпидемиология
В настоящее время оцениваемая заболеваемость врожденной краснухой составляет от 30 до 60 случаев в год, что является огромным падением по сравнению с ранее сообщенным числом 57 686 случаев в 1969 году. Основной причиной такого значительного снижения заболеваемости врожденной краснухой является введение иммунизация против возбудителя.
Просвечивающая электронная микрофотография вируса краснухи.
Тяжесть поражения плода зависит от времени инфицирования матери.Инфекция матери в течение первых восьми недель беременности обычно связана с выкидышем , самопроизвольным абортом или потерей плода. Плоды, инфицированные до 11 недель беременности, обычно имеют несколько пораженных органов, тогда как у инфицированных после 12 недель беременности наблюдаются только глухота или ретинопатия.
Клинические особенности
Новорожденные с врожденной краснухой обычно не имеют симптомов при рождении. Ранние клинические признаки врожденной краснухи включают генерализованную лимфаденопатию, гепатоспленомегалию, гепатит, желтуху и тромбоцитопению.Эти особенности обычно проходят в течение нескольких недель.
Осложнения
долгосрочные осложнения врожденной краснухи — нейросенсорная глухота, катаракта, умственная отсталость и сахарный диабет 1 типа. Заболевшие младенцы считаются инфицированными до достижения возраста 1 года.
Диагноз
Выделение вируса краснухи успешно в течение одного года после рождения. Образцы из носоглотки, спинномозговой жидкости или мочи могут помочь в выделении вируса и постановке диагноза.Наличие специфического для краснухи подавления гемагглютинации после девяти месяцев является специфическим и диагностическим признаком врожденной краснухи.
Лечение
Лечение врожденной краснухи недоступно, и следует сосредоточить внимание на иммунизации детей и взрослых для предотвращения заражения инфекцией во время беременности.
Первичная инфекция представлена как:
Если мать заразится во время беременности, ребенок может родиться мертвым или иметь «триаду»:
- I — Катаракта
- II — Глухота
- II — пороки сердца
Врожденная цитомегаловирусная инфекция
Определение
Врожденная цитомегаловирусная инфекция — наиболее частая причина врожденных инфекций в США.До 20% инфицированных младенцев развивают нейросенсорную тугоухость, повреждение глаз и когнитивную или двигательную дисфункцию. Молодые, одинокие небелые матери подвергаются наибольшему риску заражения цитомегаловирусом во время беременности.
Птофизиология
Цитомегаловирус может передаваться к плоду трансплацентарным путем , во время родов или при грудном вскармливании . Примерно 40% материнских первичных инфекций вызывают врожденную цитомегаловирусную инфекцию плода.Первичная материнская инфекция в первом триместре обычно вызывает более тяжелую картину врожденного цитомегаловируса у новорожденного при рождении.
Клинические особенности
Клинические проявления врожденной цитомегаловирусной инфекции могут возникать в раннем неонатальном периоде или в позднем детстве. Раннее проявление обычно включает задержку внутриутробного развития, микроцефалию, летаргию, оптическую невропатию и внутричерепные кальцификации. Смертность высока и может достигать 12% в течение первых шести месяцев жизни.Умственная отсталость и потеря слуха могут возникать в детстве и обычно прогрессируют.
Диагностика
Выделение и культивирование вируса из выделений из ротовой полости или мочи новорожденного может помочь в установлении диагноза. Кроме того, обнаружение вирусной ДНК с помощью теста с помощью полимеразной цепной реакции может быть очень полезным для раннего распознавания болезни.
Лечение
Тяжелая врожденная цитомегаловирусная инфекция в настоящее время лечится в рамках экспериментальных исследований с помощью внутривенного ганцикловира . Валганцикловир доступен в форме для перорального применения и может быть эффективным в случаях умеренной и тяжелой врожденной цитомегаловирусной инфекции. Вакцина против цитомегаловируса находится в стадии разработки.
| Симптомы при рождении (10%) | Поздние симптомы (50%) |
| Преждевременные | Слух |
| Гепатоспленомегалия | Потеря зрения |
| Маленький для гестационного возраста | Задержка развития |
| Микроцефалия | Судорожное расстройство |
| Изъятие |
Врожденный простой герпес
Эпидемиология
В отличие от ранее обсуждавшихся врожденных инфекций, врожденный простой герпес обычно приобретается во время родов .По оценкам, распространенность врожденного простого герпеса в США составляет 30 случаев на 100 000 живорождений. Уровень младенческих атак при первичном материнском герпесе может достигать 50%, тогда как уровень инфицирования младенцев у женщин с реактивацией болезни обычно составляет от 15 до 20%.
Изображение: «Микрофотография, показывающая изменения вируса простого герпеса (ВПГ). Мазок из шейки матки. Пап-пятно »Нефрона — Собственная работа. Лицензия: CC BY-SA 3.0
.
Клинические особенности
Симптомы врожденного простого герпеса обычно проявляются в течение первого дня жизни, но могут проявляться через неделю после рождения.Врожденный простой герпес может вызывать локальные заболевания кожи, глаз и рта, энцефалит с кожными заболеваниями или без них, заболевания глаз и рта или диссеминированную инфекцию у новорожденных.
Энцефалит обычно возникает между 8 и 12 днями послеродового периода. Тяжелая диссеминированная инфекция может вызвать раздражительность, судороги, респираторный дистресс-синдром, желтуху, нарушения кровотечения и шок.
Клиническая картина диссеминированного врожденного простого герпеса напоминает бактериальный сепсис и может быть трудно распознать .Хотя локализованное кожное заболевание кажется доброкачественным, лечение все же следует начинать как можно раньше, чтобы предотвратить прогрессирование в более тяжелое заболевание с поражением центральной нервной системы.
Распространенный
- Энцефалит тяжелой степени
- Хориоретинит
- Поражения кожи
- Гепатит
- Коагулопатия / DIC
- Пневмонит
Диагностика
Вирусные культуры и обнаружение вирусной ДНК с помощью тестирования полимеразной цепной реакции являются основными инструментами для подтверждения диагноза врожденного простого герпеса.Серологические анализы бесполезны при диагностике врожденного простого герпеса.
| ПЦР крови | CSF PCR | Глаз / рот / ректальный вирусный посев |
| Лучший тест на диссеминированное заболевание | Лучший тест на менингит | Лучший тест на заболевание кожи / глаз / рта |
| Консультация офтальмолога для комплексного обследования зрения | ||
Лечение
Лечение врожденного простого герпеса включает внутривенное введение ацикловира 20 мг / кг / дозу три раза в день в течение двух-трех недель. Нейтропения обычно наблюдается у пролеченных младенцев, и необходимо выполнить повторных общих анализов крови .
Новорожденных с врожденным простым герпесом следует поместить в отделение интенсивной терапии . Первичный или рецидивирующий активный генитальный герпес у беременной во время родов является показанием для кесарева сечения .
Подтверждение вертикального инфицирования плода коронавирусной болезнью 2019: критерии неонатальности и патологии для раннего начала и трансплацентарной передачи тяжелого острого респираторного синдрома Коронавирус 2 от инфицированных беременных матерей
Плацента — уникальный гетерогенный орган: он состоит из клеток двух генетически разных особей.Он также отличается двойным кровоснабжением от 2 человек: материнское кровообращение входит в плаценту через многочисленные спиральные артериолы матки и циркулирует в межворсинчатом пространстве, а кровообращение плода попадает в плаценту через пупочные артерии и циркулирует на всех уровнях матки. хорионическое дерево ворсинок. Эти 2 кровообращения находятся в тесном контакте друг с другом, но остаются разделенными узкоспециализированным трофобластическим барьером. Кроме того, на границе раздела матери и плода присутствуют как материнские, так и плодные клетки.В результате образец плацентарной ткани, взятой с помощью тампона, иглы или эксцизионной биопсии, содержит как материнские, так и фетальные клетки, включая материнские красные и белые кровяные тельца в межворсинчатом пространстве. После гомогенизации ткани перед экстракцией нуклеиновой кислоты клетки матери и плода смешиваются. Положительный результат ПЦР-теста на инфекционный агент в гомогенизированном образце плацентарной ткани или мазке из ее содержимого устанавливает, что агент присутствует в образце, но не может точно определить местонахождение агента в материнском компоненте, компоненте плода или в обоих компонентах. .Это проиллюстрировано в недавнем сообщении 47 , в котором мазки и биопсии были взяты из плаценты мертворожденного ребенка, доставленного матери с COVID-19. Эти образцы были диагностированы с помощью ОТ-ПЦР как положительные на SARS-CoV-2; однако, поскольку образцы включали клетки как материнского, так и эмбрионального происхождения, было невозможно подтвердить, был ли коронавирус в клетках матери или плода. Интересно, что, несмотря на положительный результат теста на COVID-19 в образцах плаценты, амниотическая жидкость, мазки из влагалища матери и все образцы аутопсии плода, включая мазки изо рта, подмышечных впадин, мекония и фетальную кровь, полученные в течение нескольких минут после рождения, были отрицательными. SARS-CoV-2 с помощью ОТ-ПЦР.В другом отчете 48 с амнионной поверхности плаценты был взят мазок и обнаружен положительный результат на SARS-CoV-2 после родов от бессимптомной матери с COVID-19. Новорожденный протекал бессимптомно и не инфицирован. Таким образом, эту форму отбора проб из плаценты и ПЦР-анализа нельзя надежно использовать для подтверждения трансплацентарной передачи вируса.
.
