» Врожденный стридор у детей
Врожденный стридор — это достаточно неприятное детское заболевание, которое выражается во врождённой аномалии трахеи, дыхательных путей, гортани. В результате такой аномалии появляется шумное дыхание у младенца. Необходимо сказать, что по статистике сегодня врожденный стридор отмечается у 60% детей. В большинстве случаев легкая форма такой аномалии проходит по прошествии нескольких часов после рождения малыша.
Корни возникновения болезни
При врожденном стридоре отмечаются патологические процессы в верхних дыхательных путях. Все это приводит к шумному дыханию, непроходимости и сужению трахеи в гортани. Может возникать отек слизистых горла и обструкция. Следует сказать, что стридор могут спровоцировать как различные сложные болезни, так и преждевременные роды.
Разновидности данного заболевания
В настоящее время принято выделять 4 стадии тяжести этого заболевания. Поговорим о таких разновидностях более подробно..jpg)
Первая стадия заболевания характеризуется минимальными аномалиями и проходит через несколько часов после рождения ребенка. В данном случае какое-либо лечение не требуется.
Вторая стадия заболевания требует соответствующего обследования, а в случае обнаружения каких-либо серьезных аномалий проводится соответствующее лечение.
Третья стадия детского врожденного стридора характеризуется громким шумом на вдохе. В данном случае требуется соответствующее лечение.
Четвертая стадия заболевания наиболее сложная и требующая своевременной медицинской помощи. В случаях не оказания такого лечения ребенок может погибнуть. Ребенок при наличии у него 4 стадии стридора сразу же после рождения переводится в реанимационное отделение.
Диагностирование врожденного стридора
Врожденный детский стридор достаточно часто проходит самостоятельно с ростом организма и укреплением хрящевой ткани. В данном случае какого-либо лечения проводить не требуется. Проводится осмотр ребенка отоларингологом, который может определить как наличие слабости хрящей гортани, так и различные другие сопутствующие причины стридора. Так, например, может быть определена киста в гортани, врожденный стеноз трахеи, паралич голосовых связок, свищ между пищеводом и трахеей и расщелина гортани. Такое заболевание может усиливаться при замерзании и инфекционных болезнях малыша. Дети, у которых отмечается стридор, требуют особо тщательного ухода и эффективной профилактики от простудных заболеваний.
Так, например, может быть определена киста в гортани, врожденный стеноз трахеи, паралич голосовых связок, свищ между пищеводом и трахеей и расщелина гортани. Такое заболевание может усиливаться при замерзании и инфекционных болезнях малыша. Дети, у которых отмечается стридор, требуют особо тщательного ухода и эффективной профилактики от простудных заболеваний.
Симптоматика стридора и лечение болезни
Симптомы врожденного стридора проявляются сразу же после рождения малыша. Это может быть свистящее хрипящее дыхание, а имеющиеся шумы могут полностью проходить в тёплом помещении. Обследование ребенка должен проводить отоларинголог или пульмонолог. Детей с подобной патологией необходимо наблюдать у соответствующего врача и полностью следовать рекомендациям по лечению ребенка. В последующем дети со стридором растут полностью нормальной жизнью, а заболевание с возрастом проходит.
Лечение данного заболевания подразумевает прием гормональных препаратов, ингаляции, прием бронхолитиков и выполнение различных физиотерапевтических процедур. Последнее отличается эффективностью и при использовании специального оборудования позволяет быстро нормализовать дыхание и устраняет имеющиеся аномалии гортани и трахеи.
Последнее отличается эффективностью и при использовании специального оборудования позволяет быстро нормализовать дыхание и устраняет имеющиеся аномалии гортани и трахеи.
Врожденный стридор — причины, симптомы, диагностика и лечение
Врожденный стридор – патологическое шумное (свистящее или шипящее) дыхание, обусловленное врожденной аномалией строения гортани или трахеи. Врожденный стридор проявляется громким затрудненным дыханием, которое увеличивается при плаче, кашле. Диагностика врожденного стридора проводится педиатром, отоларингологом и пульмонологом с учетом данных анамнеза, ларингоскопии, трахеобронхоскопии, эзофагоскопии. Лечения врожденного стридора, обусловленного функциональными причинами, не требуется: по мере роста хрящей гортани (к 2-3 годам) стридорозное дыхание исчезает. Если патология связана с органическими причинами, может потребоваться хирургическое вмешательство.
Общие сведения
Врожденный стридор является заболеванием детей раннего возраста, с которым приходится сталкиваться специалистам в области педиатрии, отоларингологии и пульмонологии. Врожденный стридор обычно проявляется с рождения, реже дебютирует на первом месяце жизни ребенка или несколько позже. Характерным признаком стридора служит патологически шумное дыхание, связанное с преодолением сопротивления, которое встречается на пути воздушных масс при прохождении через суженный участок гортани. Врожденный стридор не является самостоятельной нозологической формой, а указывает на дыхательную обструкцию, обусловленную различными патологическими состояниями гортани и трахеи.
Врожденный стридор обычно проявляется с рождения, реже дебютирует на первом месяце жизни ребенка или несколько позже. Характерным признаком стридора служит патологически шумное дыхание, связанное с преодолением сопротивления, которое встречается на пути воздушных масс при прохождении через суженный участок гортани. Врожденный стридор не является самостоятельной нозологической формой, а указывает на дыхательную обструкцию, обусловленную различными патологическими состояниями гортани и трахеи.
Причины врожденного стридора
От 60 до 70% случаев врожденного стридора у детей обусловлены аномалиями развития гортани и верхних дыхательных путей. Чаще всего стридорозное дыхание обусловлено врожденной слабостью наружного кольца гортани (ларингомаляцией). В этом случае во время вдоха надгортанник и черпалонадгортанные складки пролабируют в полость гортани, что сопровождается ее обструкцией и стридорозным звуком на вдохе. Ларингомаляция часто наблюдается у детей, рожденных от преждевременных родов, страдающих гипотрофией, рахитом, спазмофилией.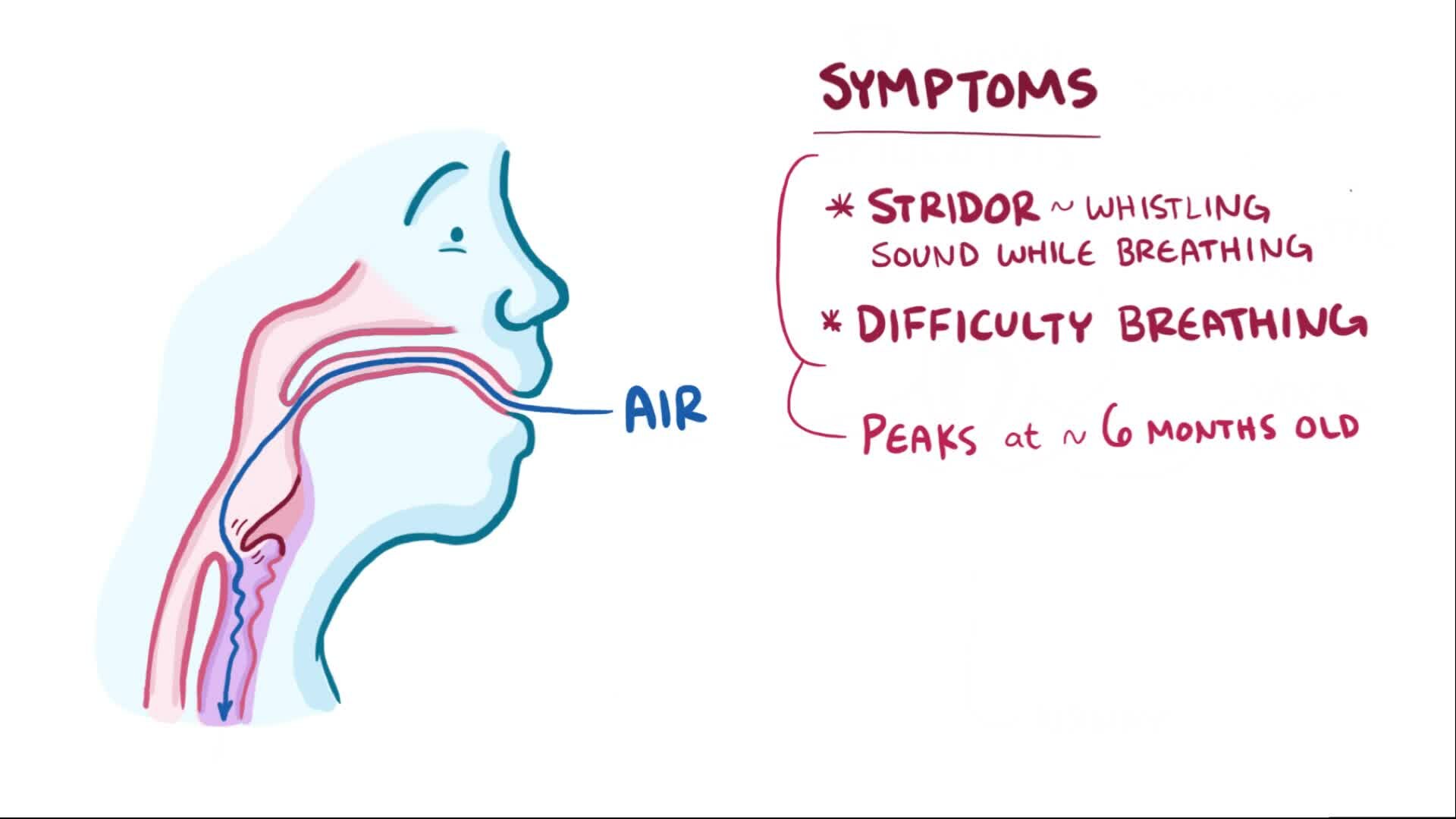 В ряде случаев врожденная слабость гортани может сочетаться с другими пороками дыхательных путей – например, трахеомаляцией и трахеобронхомаляцией.
В ряде случаев врожденная слабость гортани может сочетаться с другими пороками дыхательных путей – например, трахеомаляцией и трахеобронхомаляцией.
Данные нарушения связывают с локальной формой мышечной гипотонии, обусловленной задержкой развития нервно-мышечного аппарата. У детей с врожденным стридором нервно-мышечная недостаточность также может проявляться гастроэзофагеальным рефлюксом, ахалазией кардии, апноэ сна, птозом век.
Значительно реже среди причин врожденного стридора выявляются доброкачественные опухоли гортани (гемангиомы, лимфангиомы, папилломатоз гортани), злокачественные новообразования, атрезия хоан, парезы и параличи голосовых складок, рубцовый ларинготрахеальный стеноз, врожденный зоб и др. Если врожденный стридор возникает во время кормления, необходимо думать о пищеводно-трахеальном свище или расщелине гортани.
Врожденный стридор может встречаться как изолированно, так и входить в структуру генетических синдромов (Дауна, Марфана, Пьер–Робена и др. ). Нередко врожденному стридору сопутствует другая врожденная патология — гипертензионно-гидроцефальный или судорожный синдром, пороки сердца (открытое овальное окно, дополнительная хорда желудочка), легочная гипертензия и др.
). Нередко врожденному стридору сопутствует другая врожденная патология — гипертензионно-гидроцефальный или судорожный синдром, пороки сердца (открытое овальное окно, дополнительная хорда желудочка), легочная гипертензия и др.
Приобретенный стридор может являться признаком опухолей трахеи и бронхов, обтурации трахеобронхиального дерева инородными телами, бронхиальной астмы, аллергического отека дыхательных путей, инфекций (эпиглоттита, заглоточного абсцесса, крупа), подсвязочного стеноза, обусловленного длительной интубацией, раком гортани или пищевода, тиреоидита.
Классификация врожденного стридора
По степени нарушения дыхания врожденный стридор классифицируют следующим образом:
- I степень (компенсированная) — врожденный стридор не требует лечения;
- II степень (погранично-компенсированная) — врожденный стридор требует динамического наблюдения и, возможно, лечения;
- III степень (декомпенсированная) – врожденный стридор, требующий лечения;
- VI степень – врожденный стридор, несовместимый с жизнью, требующий немедленных реанимационных мероприятий и хирургического лечения.

Различают три типа врожденного стридора: инспираторный, экспираторный и двухфазный. Инспираторный стридор развивается на вдохе; при этом образуется стридорозный шум низкого звучания, обусловленный локализацией поражения выше голосовых складок (в области гортаноглотки или верхнего отдела гортани). При двухфазном стридоре имеет место обструкция дыхательных путей на уровне голосовых складок; при этом возникает шумное дыхание высокого звучания. Врожденный стридор экспираторного типа, развивающийся на выдохе, обусловлен обструкцией ниже голосовых складок и характеризуется средней высотой стридорозного звука.
Симптомы врожденного стридора
Врожденный стридор проявляется уже вскоре после рождения ребенка и усиливается в первые недели жизни. При этом обращает внимание характерное слышимое на расстоянии громкое звучание, возникающее при прорыве воздушной струи через суженную гортань. Шум может быть свистящим, звонким или шипящим, глухим; напоминать воркование голубей, мурлыканье кошки, петушиный крик или кудахтанье курицы. Во время сна, нахождения в теплом помещении, в состоянии покоя интенсивность шума снижается; при сосании, плаче, кашле – напротив, увеличивается.
Во время сна, нахождения в теплом помещении, в состоянии покоя интенсивность шума снижается; при сосании, плаче, кашле – напротив, увеличивается.
В большинстве случаев врожденный стридор протекает в легкой, компенсированной степени, позволяя ребенку расти и развиваться нормально. При компенсированном врожденном стридоре физическое состояние ребенка, как правило, не страдает, акт сосания не нарушен, голос сохранен. Однако в некоторых случаях, стридорозное дыхание может сочетаться с явлениями дисфонии и дисфагии.
При возникновении ОРВИ, сопровождающихся катаральными изменениями верхних дыхательных путей, возникает острый приступ стридора. Это проявляется одышкой, ларингоспазмом, цианозом кожных покровов, втяжением межреберных промежутков грудной клетки, яремной ямки и эпигастральной области при вдохе. При тяжелой форме врожденного стридора может развиться асфиксия и острая дыхательная недостаточность.
Наличие у ребенка врожденного стридора может способствовать развитию ларингита, трахеита, бронхита, тяжелой пневмонии, бронхиальной астмы.
Диагностика
Для выяснения причин врожденного стридора необходим осмотр ребенка педиатром, отоларингологом, пульмонологом, неврологом, гастроэнтерологом. При осмотре оценивается общее состояние ребенка, ЧД и ЧСС, окраска кожных покровов, участие вспомогательной мускулатуры в акте дыхания, втяжение уступчивых участков грудной клетки при дыхании и т. д.
- Для визуальной оценки состояния гортани проводится микроларингоскопия.
- При необходимости выполняется рентгенография гортани и мягких тканей шеи, УЗИ гортани, КТ и МРТ, рентгенография грудной клетки, трахеобронхоскопия, бронхография.
- При сочетании симптомов врожденного стридора с дисфагией обследование дополняется рентгеноскопией пищевода, эзофагогастродуоденоскопией, УЗИ брюшной полости.
- При дисфонии и афонии целесообразно проведение нейросонографии, ЭЭГ, КТ головного мозга.
- При подозрении на врожденный зоб необходима консультация эндокринолога с проведением УЗИ щитовидной железы, определением уровня ТТГ, Т3, Т4.

Дифференциальную диагностику врожденного стридора следует проводить с ларингитом, истинным и ложным крупом, заглоточным абсцессом, инородными телами гортани, трахеи и бронхов, бронхоаденитом при туберкулезе, лимфогранулематозом.
Лечение врожденного стридора
В большинстве случаев явления компенсированного и погранично-компенсированного врожденного стридора, уменьшаются к 6 месяца жизни ребенка и исчезают полностью к 2-3 годам. Рекомендуется регулярное наблюдение отоларинголога; специального лечения при этом обычно не проводится.
В ряде случаев при ларингомаляции прибегают к нанесению лазером надрезов на надгортанник, рассечению черпалонадгортанных складок либо удалению части черпаловидных хрящей. При острых приступах врожденного стридора, развившихся на фоне ОРВИ, требуется немедленная госпитализация. В стационаре могут назначаться гормональные препараты, ингаляции, бронхолитики. При развитии критического состояния показана трахеотомия или интубация с ИВЛ.
При врожденном стридоре, обусловленном опухолевыми процессами, необходимо эндоскопическое удаление доброкачественных новообразований гортани. При стридоре, вызванном врожденный гипотиреозом, проводится гормонозаместительной терапия.
Прогноз и профилактика осложнений при врожденном стридоре
По мере роста ребенка, хрящи гортани становятся тверже, просвет гортани — шире, поэтому явления врожденного стридора могут спонтанно регрессировать к 2-3 годам. В этот период необходимо заботиться о профилактике простудных заболеваний, полноценном питании, проведении закаливающих мероприятий, создании благоприятной психологической обстановки. При наличии органических причин врожденного стридора и сопутствующей патологии необходимо их своевременное устранение.
В случае присоединения респираторной инфекции, декомпенсации врожденного стридора и развитии дыхательной недостаточности, прогноз может вызывать опасения.
Педиатрические и хирургические аспекты врожденного стридора гортани.
4851830
ПЕТРУНИЧЕВ Алексей Юрьевич
ПЕДИАТРИЧЕСКИЕ И ХИРУРГИЧЕСКИЕ АСПЕКТЫ ВРОЖДЁННОГО СТРИДОРА ГОРТАНИ
14.01.08 — педиатрия 14.01.03 — болезни уха, горла и носа
Автореферат диссертации на соискание ученой степени доктора медицинских наук
2 8 ИЮЛ 2011
Санкт-Петербург 2011 г
4851830
Работа выполнена на кафедре педиатрии им. проф. И.М. Воронцова ФПК и ПП и кафедре оториноларингологии Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургская государственная педиатрическая медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научные консультанты:
Доктор медицинских наук Доктор медицинских наук, профессор
Официальные оппоненты:
Доктор медицинских наук, профессор
Доктор медицинских наук, профессор
Доктор медицинских наук, профессор
Ведущая организация:
Федеральное государственное военное образовательное учреждение высшего профессионального образования Военно-медицинская Академия имени С. М. Кирова Министерства обороны Российской Федерации
М. Кирова Министерства обороны Российской Федерации
Защита состоится 14 ноября 2011 года в _ часов на заседании
Диссертационного Совета (Д 208.087.03) при ГОУ ВПО СПбГПМА Минздравсоцразвития России по адресу 194100, Санкт-Петербург, ул. Литовская, д. 2
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО СПбГПМА Минздравсоцразвития России по адресу 194100, Санкт-Петербург, ул. Литовская, д. 2
Автореферат разослан «_»_2011 г.
Учёный секретарь Диссертационного совета Д 208.087.03
доктор медицинских наук, профессор М.Л. Чухловина
Новик Геннадий Айзикович Цветков Эдуард Анатольевич
Эрман Лев Владимирович Ромашок Фёдор Петрович Карпищенко Сергей Анатольевич
СПИСОК СОКРАЩЕНИИ
БА — бронхиальная астма
ВПР — врожденный порок развития
ИКП — инспираторный коллапс преддверия гортани
КЩР — кислотно-щелочное равновесие крови
ЛМ — ларингомаляция
ВСГ — врождённый стридор гортани
ЭФЛС — эндофиброларингоскопия
Актуальность исследования.
Стридор, даже проявляющийся вскоре после рождения (т.е. врождённый), означает лишь шумное дыхание, непостоянный симптом множества различных поражений дыхательных путей: врождённых пороков развития (ВПР), воспалительных заболеваний, повреждений, нейрогенных расстройств, опухолей и пр. Разумеется, при острых заболеваниях стридор носит транзиторный характер.
Болезнь, обозначенная в МКБ-10 под названием «врождённый стридор гортани» (ВСГ) (код Q 31.4), имеет более чем полуторавековую историю. Это широко распространённое заболевание, манифестный период которого приходится на первые месяцы и годы жизни. Его наиболее заметным симптомом является стойкий шум при дыхании в отсутствие пороков развития или заболеваний дыхательных путей. Причина была обнаружена в конце XIX века (Sutherland and Lack, 1897) и заключалась в коллапсе преддверия гортани при каждом вдохе (далее — инспираторный коллапс преддверия гортани (ИКП)) на спонтанном дыхании. В настоящее время большинством авторов признаётся, что ИКП — самая частая причина врождённого стридора (Солдатский Ю. Л., 2004; Roger et al., 1995, Daniel, 2006; Zoumalan et al., 2007).
Л., 2004; Roger et al., 1995, Daniel, 2006; Zoumalan et al., 2007).
В России за отсутствием до конца XX века эндоскопической диагностики (Цветков Э.А., 1999; Солдатский Ю.Л., 2000) лёгкие случаи не обследовались, а тяжёлые расценивались как другие заболевания. Серьёзную проблему внёс прижившийся в других развитых странах термин «ларингомаляция» (JIM), предложенный в 1940-х годах Jackson и Jackson как клинический синоним ИКП. Ведь существует также целый ряд врождённых и приобретённых неврологических расстройств, сопровождающихся ИКП в любом возрасте. Для их комплексного обозначения предложен термин «нейрогенная ЛМ».
Эндофиброларингоскопия (ЭФЛС) давно всеми используется как основной диагностический метод вне зависимости от клинических находок
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Г\
(O’Sullivan et al., 2004; Moumoulidis et al., 2005; Bent, 2006; Sivan et al„ 2006). Современные исследования показывают, что при JIM у детей нередко имеется сопутствующая патология со стороны дыхательной и других систем (Солдатский Ю. Л., 2009; Bibi et al., 2001; Masters et al, 2002; Midulla et al., 2004; Goldberg, 2005; Stavroulaki, 2006; Unal et al., 2006). При этом единой и теоретически обоснованной системы их взаимоотношений с ИКП до сих пор не выстроено.
Л., 2009; Bibi et al., 2001; Masters et al, 2002; Midulla et al., 2004; Goldberg, 2005; Stavroulaki, 2006; Unal et al., 2006). При этом единой и теоретически обоснованной системы их взаимоотношений с ИКП до сих пор не выстроено.
Современным методом лечения тяжёлых случаев ИКП является т.н. «супраглотгопластика» — эндоскопическая хирургическая коррекция преддверия гортани в многочисленных вариантах (Loke et al., 2001; Reddy and Vatt, 2001; Werner et al., 2002; Zalzal and Collins, 2005). Однако, показания к операции сильно варьируют у разных авторов ввиду около 5 % уровня неэффективности и осложнений (Denoyelle et al., 2003; Lee et al., 2007; Richter and Thompson, 2008; Schroeder et al., 2009). Это повышает сложность и стоимость дополнительного обследования (Yellon and Goldberg, 2001; Berg et al., 2008; Zafereo et al., 2008; O’Connor et al., 2009).
Разнообразие клинической картины при JIM и её течения (Gessler et al, 2002; Mandell and Arjmand, 2003; Smith et al., 2005; Ritcher et al, 2008), a также непредсказуемый эффект хирургической коррекции, не позволяют использовать ИКП в качестве финального диагностического критерия отдельного заболевания. Ряд авторов даже предлагает проводить дифференциальную диагностику JIM с бронхиальной астмой (БА) (Агога R. et al, 2005; Weinberger М. and Abu-Hasan M, 2007). Врождённый характер гортанного стридора, наличие семейных случаев (Shohat et al, 1992; Baxter, 1994; Chen et al, 2007) и отдельного синдрома «Ларингомаляция» в каталоге Online Mendelian Inheritance in Man (OMIM 150280) так и не привели к разработке лабораторных генетических методов диагностики ВСГ.
Ряд авторов даже предлагает проводить дифференциальную диагностику JIM с бронхиальной астмой (БА) (Агога R. et al, 2005; Weinberger М. and Abu-Hasan M, 2007). Врождённый характер гортанного стридора, наличие семейных случаев (Shohat et al, 1992; Baxter, 1994; Chen et al, 2007) и отдельного синдрома «Ларингомаляция» в каталоге Online Mendelian Inheritance in Man (OMIM 150280) так и не привели к разработке лабораторных генетических методов диагностики ВСГ.
Цель исследования: Повысить качество оказания медицинской помощи пациентам с врождённым стридором гортани путём изучения его распространённости в популяции, оптимизации диагностических и лечебных подходов, а также методов профилактики.
Задачи исследования:
1. Определить этиологическую структуру врождённого стридора и распространённость врождённого стридора гортани в популяции.
2. Определить факторы риска при инспираторном коллапсе преддверия гортани.
3. Разработать дифференциально-диагностические критерии врождённого стридора гортани и нейрогенной ларингомаляции.
4. Определить влияние врождённого стридора гортани на течение бронхиальной астмы.
5. Оценить возможности рентгенологической диагностики инспираторного коллапса преддверия гортани.
6. Оценить возможности гистологической диагностики врожденного стридора гортани.
7. Оптимизировать хирургическое лечение врождённого стридора гортани.
8. Определить роль медико-генетического консультирования в профилактике врождённого стридора гортани.
Научная новизна.
— Впервые установлена популяционная частота врождённого стридора гортани.
— Получены новые данные о тяжести состояния детей с инспираторным коллапсом преддверия гортани, в частности о распространённости гипоксии, дыхательных расстройств, нарушения кормления и развития. Полностью систематизирована картина как гортанных, так и внегортанных симптомов и осложнений врождённого стридора гортани.
— Впервые установлены дифференциально-диагностические критерии врождённого стридора гортани и нейрогенной ларингомаляции.
— Получены новые сведения о взаимном влиянии врождённого стридора гортани и бронхиальной астмы.
Обнаружены новые точные рентгенологические признаки инспираторного коллапса преддверия гортани.
— Впервые установлены гистологические признаки врождённого стридора гортани.
— Впервые в России опробованы, классифицированы и оценены методы эндоскопической ларингопластики при врождённом стридоре гортани.
— Получены новые данные о преобладании роли генетических факторов в этиологии врождённого стридора гортани.
Практическая ценность.
— Обоснована необходимость широкого внедрения алгоритма диагностики, лечения и профилактики врождённого стридора гортани.
— Улучшена клиническая и лабораторная диагностика при врождённом стридоре гортани. Обнаружены новые группы риска: пациенты с дыхательными расстройствами, упорным срыгиванием, задержкой развития, аспирациями Разработана удобная в практической работе карта обследования.
— Предложен комплексный практический метод дифференциальной диагностики врождённого стридора гортани и нейрогенной ларингомаляции.
— Обоснована необходимость и предложены способы выявления врождённого стридора гортани у детей с бронхиальной астмой.
— Предложен новый эффективный метод рентгенологической диагностики инспираторного коллапса преддверия гортани.
— Разработан способ гистологической диагностики врождённого стридора гортани.
— На основе полученных данных создан единый список абсолютных показаний к супраглоттопластике и классификация хирургических методов.
— Разработаны подходы к медико-генетическому консультированию и эффективной профилактике врождённого стридора гортани.
Положения, выносимые на защиту:
1. Дети с инспираторным коллапсом преддверия гортани достоверно чаще здоровых детей в первые месяцы жизни страдают хронической гипоксией, упорным срыгиванием, задержкой развития, дыхательными расстройствами, аспирациями. Сочетание этого состояния с бронхиальной астмой ведёт к утяжелению обоих заболеваний.
Сочетание этого состояния с бронхиальной астмой ведёт к утяжелению обоих заболеваний.
2. Врождённый стридор гортани является самостоятельным заболеванием с генетической предрасположенностью и устойчивым комплексом клинических, эндоскопических и гистологических признаков.
3. В алгоритм диагностики, лечения и профилактики врождённого стридора гортани следует ввести рентгенографию шеи в боковой проекции, определение парциального давления газов крови, гистологическое исследование биоптата гортани, супраглоттопластику и медико-генетическое консультирование.
Реализация работы и её апробация.
Результаты работы внедрены в практику амбулаторно-поликлинического отделения, консультативно-диагностического центра и ЛОР-клиники Санкт-Петербургской государственной педиатрической медицинской академии, материалы используются в учебном процессе кафедр педиатрии и оториноларингологии СПбГПМА и кафедры оториноларингологии Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова.
И.И. Мечникова.
Основные положения диссертационного исследования доложены и обсуждены на различных конференциях, среди них:
(1) Всероссийская научно-практическая конференция с международным участием «Современные аспекты и перспективы развития оториноларингологии» (сентябрь 2005г., Москва) (2) VII съезд оториноларингологов России (май 2006 г., Нижний Новгород) (3) II Российский форум «Здоровье детей: профилактика социально-значимых заболеваний» (март 2008 г., Санкт-Петербург) (4) Съезд Европейского общества генетиков (май 2009 г., Вена) (5) Всероссийская научно-практическая конференция с международным участием «100-летие
российского общества патологоанатомов», (октябрь 2009, Санкт-Петербург) (6) Региональная научно-практическая конференция «Совершенствование подготовки педиатрических кадров в вузах Санкт-Петербурга» (ноябрь 2009, Санкт-Петербург) (7) Заседание Санкт-Петербургского филиала Российского общества аллергологов (февраль 2010 г., Санкт-Петербург) (8) Совместное заседание Санкт-Петербургских обществ медицинских генетиков и неврологов (март 2010 г. , Санкт-Петербург) (9) Научно-практическая конференция молодых учёных «Актуальные вопросы клинической и экспериментальной медицины» (май 2010 г., Санкт-Петербург), (10) IV региональная научно-практическая конференция «Воронцовские чтения» (март 2011 г., Санкт-Петербург)
, Санкт-Петербург) (9) Научно-практическая конференция молодых учёных «Актуальные вопросы клинической и экспериментальной медицины» (май 2010 г., Санкт-Петербург), (10) IV региональная научно-практическая конференция «Воронцовские чтения» (март 2011 г., Санкт-Петербург)
По теме диссертации опубликовано 38 научных работ, одно учебное пособие. Получен один патент на изобретение.
Объём и структура диссертации.
Диссертация состоит из введения, обзора литературы, главы материалов и методов, четырёх глав собственных наблюдений, главы обсуждения полученных результатов, заключения, восьми выводов, практических рекомендаций и списка литературы. Последний включает в себя 246 научных источников (9 — отечественных и 237 — зарубежных авторов). Работа изложена на 218 страницах машинописного текста, иллюстрирована 54 рисунками и 23 таблицами.
Работа выполнена на кафедре педиатрии им. проф. И.М. Воронцова ФПК И ПП и кафедре оториноларингологии ГОУ ВПО СПбГПМА Минздравсоцразвития России
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Учитывая многообразие касающихся ВСГ спорных вопросов, в работе было создано несколько различных групп исследования. Их взаимоотношения представлены на рис. 1. Итого в работе — 1367 объектов исследования.
Их взаимоотношения представлены на рис. 1. Итого в работе — 1367 объектов исследования.
Пациенты (400 детей от 2 мес. до 5 лет, средний возраст 11 мес.), направленные на обследование по поводу стридора с 2004 по 2010 гг., исследовались клинически, также оценивалась медицинская документация. Дети с очевидно транзиторным стридором за счёт катаральных явлений со стороны дыхательных путей формировали группу сравнения и в дальнейшем исключались из исследования. Кислотно-щелочное равновесие (КЩР) крови исследовалось на биохимическом анализаторе Nova Biomedical Stat Profile pHOx Plus.
Рис. 1. Взаимоотношения групп исследования в работе. Жирным шрифтом обозначены основные и дополнительные группы, их взаимодействие, обычным — результирующие подгруппы, пунктиром -пациенты, исключённые из исследования.
Эндофиброларингоскопия (ЭФЛС) — основной метод диагностики ИКП. Выполнялась с помощью фиброларингоскопа Olympus ENF РЗ с наружным диаметром дистального конца 3,5 мм, источник света Olympus CLE-10. У детей первых месяцев жизни использовался более тонкий ларингофиброскоп 11101 SP с дистальным наружным диаметром 2,5 мм, ксеноновый источник холодного света XENON NOVA (KARL STORZ). Данные фиксировались с помощью видеокамеры для эндоскопа/микроскопа Азимут Эндокам-450 и цифрового накопителя.
У детей первых месяцев жизни использовался более тонкий ларингофиброскоп 11101 SP с дистальным наружным диаметром 2,5 мм, ксеноновый источник холодного света XENON NOVA (KARL STORZ). Данные фиксировались с помощью видеокамеры для эндоскопа/микроскопа Азимут Эндокам-450 и цифрового накопителя.
К 2004 году под постоянным наблюдением в СПбГПМА уже находилось 15 детей с ИКП по данным ЭФЛС, не подвергнутых супраглотгопластике в связи с отсутствием такой практики в России. В ходе настоящего исследования оценивались структура и подвижность преддверия гортани каждые 6-12 месяцев с использованием ЭФЛС, а с 5 лет — зеркальной ларингоскопии. Наблюдение продолжалось до исчезновения ИКП, после чего оценивалась остаточная деформация гортани.
Новые данные были использованы для коррекции предложенных нами ранее теоретических моделей остаточных деформаций гортани при ЛМ (Э.А. Цветков и А.Ю. Петруничев, 2003) и популяционного исследования.
Был выполнен поиск аналогичных изменений преддверия гортани у 300 взрослых (18-64 лет), анамнез которых не включал хронических или тяжёлых острых заболеваний гортани.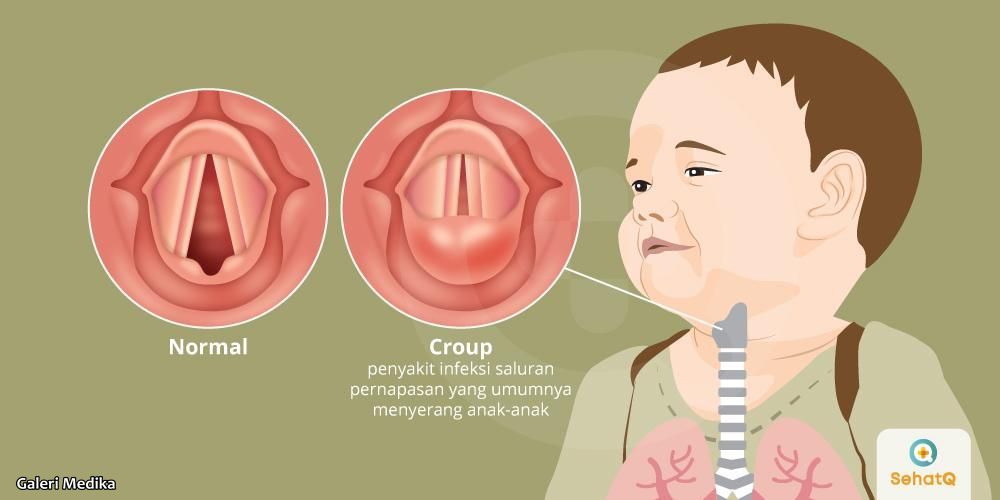 Исследование выполнялось на базе СПбГМА им. И.И. Мечникова. С той же целью в 50 детских городских поликлиниках Санкт-Петербурга участковым врачам-педиатрам предлагалось заполнить анкету по частоте встречаемости явных случаев врождённого стридора у детей до 2 лет на участках.
Исследование выполнялось на базе СПбГМА им. И.И. Мечникова. С той же целью в 50 детских городских поликлиниках Санкт-Петербурга участковым врачам-педиатрам предлагалось заполнить анкету по частоте встречаемости явных случаев врождённого стридора у детей до 2 лет на участках.
На базе районных аллергологических кабинетов г. Санкт-Петербурга отбирались дети с частично контролируемым или неконтролируемым вариантами БА. Определено две группы исследования, в первую из которых вошло 50 детей от 6 месяцев до 5 лет. Средний возраст составил 3 года 10 месяцев. Диагноз ставился на основании клинических критериев (GINA 2010). Двадцать два ребёнка с БА от 6 до 15 лет (средний возраст 9 лет) составили вторую группу исследования. Диагноз подтверждён данными спирометрии, для её проведения использовался аппарат «Microspiro Ш-601» производства CHEST. M.I. Inc. Для уточнения спектра сенсибилизации проводились кожные пробы с бытовыми, эпидермальными и пыльцевыми аллергенами. Уровень общего и специфических IgE определялся методом иммуноферментного анализа.
Для оценки состояния преддверия гортани проводилась ЭФЛС для детей до 5 лет и зеркальная ларингоскопия для более старших. В последнем случае исследование выполнялось дважды: в состоянии покоя, а затем после серии приседаний до появления клинически заметной одышки («нагрузочный» тест).
Рентгенография шеи в боковой проекции (мягкотканный режим) тестировалась в качестве альтернативного эндоскопическому метода диагностики ИКП. Выполнялась на аппарате Dira-RG.
Во всех случаях наличия показаний супраглоттотастику выполнял профессор Э.А. Цветков на базе JIOP-клиники СПбГПМА при участии автора с совместным обсуждением и коррекцией хода вмешательства. Операция (23 случая) выполнялась под назофарингеальным наркозом. Визуализация гортани осуществлялась при прямой ларингоскопии. Применялись опорная система по RIECKER-KLEINSASSER в сочетании с раздвижным ларингоскопом и фарингоскопом конструкции Э.А.Цветкова (1989). Использовался операционный микроскоп Olympus MDB — 322.
Манипуляции с тканями выполнялись с помощью гортанного инструментария Karl Storz, в 18 случаях использовался хирургический С02 лазер Atcus 15. При выполнении методик, сопровождающихся удалением участков преддверия гортани, полученный материал отправлялся на гистологическое исследование (15 образцов). Оценка выполнялась автором совместно с доцентом кафедры патологической анатомии доц. B.C. Зайцевым Выполнялись немедленный и отсроченный контроль эффекта операции.
Материалом для исследования в группе сравнения гистологического исследования стали целые гортани (30 образцов), взятые после летального исхода до 1 года, когда в анамнезе не было заболевания гортани или продлённой интубации. Окраска в обеих группах — гематоксилин-эозин, а также по Ван Гизону. Использовались микроскопы ЛОМО микмед-2 и Leica DM-2000.
Генетические методы. Разработка цитогенетических и молекулярно-генетических маркёров ВСГ требует проведения отдельной научно-исследовательской работы. В связи с этим, в настоящем исследовании были использованы методы клинической генетики: клинико-генеалогический, близнецовый. Также методами анкетирования и оценки медицинской документации проводился анализ действия тератогенов и мутагенов. Доступным родственникам I-II степени родства пробандов старше 6 лет выполнялась непрямая зеркальная ларингоскопия.
В связи с этим, в настоящем исследовании были использованы методы клинической генетики: клинико-генеалогический, близнецовый. Также методами анкетирования и оценки медицинской документации проводился анализ действия тератогенов и мутагенов. Доступным родственникам I-II степени родства пробандов старше 6 лет выполнялась непрямая зеркальная ларингоскопия.
Статистическая обработка материала проводилась с помощью программ Microsoft Exel 2003 и StatSoft Statistica 6,0 с использованием расчётов:
— случайной ошибки репрезентативности (т) для относительных показателей и средней арифметической (М) вариационного ряда,
— среднего квадратического отклонения (о) для М,
— непараметрического показателя х2 для качественных признаков,
корелляционного анализа методом Спирмена (рху) для предположительно зависимых рядов,
— доверительного коэффициента (t) с критерием Стьюдента, в т.ч. для малых выборок.
Критерием статистической достоверности полученных результатов считали величину р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Распространённость врождённого стридора гортани
Этиологическая структура врождённого стридора
По результатам только клинического обследования из 400 детей с врождённым стридором у 78 (19 %) причина шумного дыхания была очевидно транзиторной (катаральные явления: выделения из носа, влажный кашель и пр.), а других патологических симптомов практически не было. Оставшимся 322 пациентам (81 %) — была рекомендована ЭФЛС.
Эндоскопическое исследование показалось многим родителям слишком инвазивной процедурой и было выполнена лишь в 173 случаях. Побочными эффектами ЭФЛС у детей первых месяцев и лет жизни в нашей выборке были беспокойство и плач, срыгивание пищи, апноэ (быстро купированное на месте), отёк слизистой оболочки носа с нарушением носового дыхания и др.
Объективные находки присутствовали в 146 (84 %) случаях. Из них ИКП — 118 (68 %) случаев, ВПР гортани без ИКП — 28 (16 %) слетев и нормальная ларингоскопическая картина — 27 (16 %) случаев.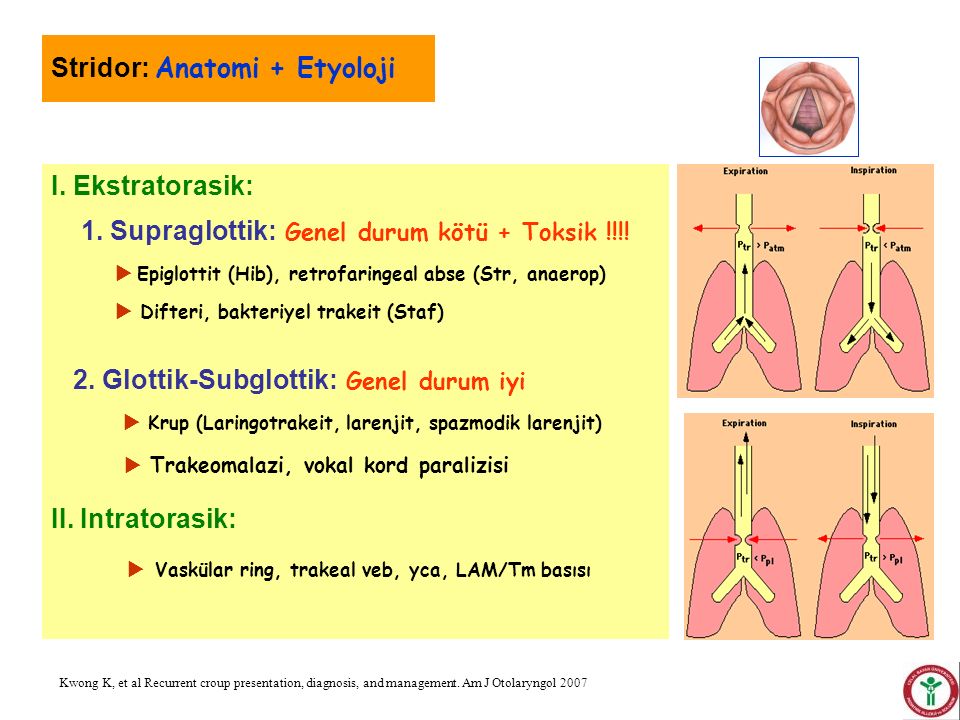 Кроме того, в ряде случаев дополнительные ВПР обнаруживались как сопутствующие при ИКП: 4 случая гемангиомы гортани, 4 случая кисты преддверия гортани, 2 случая врождённого подголосового стеноза.
Кроме того, в ряде случаев дополнительные ВПР обнаруживались как сопутствующие при ИКП: 4 случая гемангиомы гортани, 4 случая кисты преддверия гортани, 2 случая врождённого подголосового стеноза.
Из 108 случаев эндоскопически подтверждённого изолированного ИКП у 62 (57 %) пациентов были замечены анатомические особенности (одна или более), способствующие его развитию: избыток слизистой оболочки задних отделов входа в гортань, укорочение черпалонадгортанных складок, значимое увеличение клиновидных хрящей, свёрнутый у основания надгортанник, поперечное складывание надгортанника. Во всех случаях данные находки были субъективны и дискутабельны.
Группу для дальнейшего исследования составили 108 детей с изолированным ИКП. 78 пациентов со стридором вследствие катаральных явлений послужили группой сравнения.
Таким образом, экстраполируя эндоскопические находки на всю группу детей, которым была рекомендована ЭФЛС, получаем следующую структуру этиологии врождённого стридора: 55 % — ИКП, 19 % -воспаление дыхательных путей, 13 % — ВПР гортани без ИКП и 13 % -внегортанные особенности.
Распространённость врождённого стридора гортани по результатам эндоскопического исследования
В группе из 15 неоперированных детей, находящихся под многолетним наблюдением, на момент исчезновения стридора при ЭФЛС под местной анестезией сохранялся заметный ИКП. У 3 пациентов, у которых изначально помимо ИКП не было найдено аномалий преддверия гортани, при повторном исследовании через 6 месяцев после окончания манифестного периода гортань выглядела соответственно возрастной норме. Очевидно, в данном случае мы имели дело с нейрогенной ЛМ. Результаты прочих наблюдений представлены в таблице 1.
Для повышения объективности поиск (по уточнённым схемам) остаточных при ВСГ деформаций гортани у здоровых взрослых проводили независимо два исследователя в группах по 150 человек. Результаты (табл. 2) статистически не отличались (t = 0,3), что позволило их объединить. Итоговый результат 4,3 ± 1,2 %. Данная цифра отражает минимальную популяционную частоту ВСГ.
Таким образом, маркёрами ВСГ у детей старшего возраста и даже взрослых достоверно могут считаться увеличение клиновидных хрящей, избыток мягких тканей черпаловидных областей, растяжение черпалонадгортанных складок, укорочение черпалонадгортанных складок
с продольным сворачиванием надгортанника. Популяционная частота ВСГ по результатам эндоскопического исследования составляет 4,3 ± 1,2 %.
Популяционная частота ВСГ по результатам эндоскопического исследования составляет 4,3 ± 1,2 %.
Таблица 1
Возрастная динамика эндоскопической картины в группе долговременного наблюдения детей с ИКП_
№ Пол Первичная ЭФЛС ЭФЛС в возрасте 7-10 лет
1 м Коллапс преддверия гортани, избыток ткани в черпаловидных областях Избыток ткани в черпаловидных областях
2 м то же Избыток ткани в черпаловидных областях
3 м то же Близко к возрастной норме
4 м Коллапс преддверия гортани, укорочение черпалонадгортанных складок Черпаловидные складки нормальной длины, заметно истончены
5 м то же Укорочение черпалонадгортанных складок, надгортанник свёрнут у основания
6 ж Коллапс преддверия гортани, избыток ткани в черпаловидных областях Избыток ткани в черпаловидных областях
7 ж то же Увеличение клиновидных хрящей
8 ж Коллапс преддверия гортани, увеличение клиновидных хрящей Близко к возрастной норме
9 ж то же Увеличение клиновидных хрящей
10 ж Коллапс преддверия гортани, укорочение черпалонадгортанных складок, западание надгортанника Черпаловидные складки нормальной длины, заметно истончены, отклонение надгортанника кпереди
11 ж Коллапс преддверия гортани, избыток ткани в черпаловидных областях Избыток ткани в черпаловидных областях
12 ж Коллапс преддверия гортани, укорочение черпалонадгортанных складок Растяжение чепралонадгортанных складок в длину и ширину
Таблица 2
Встречаемость эндоскопических маркёров ВСГ в популяции
Обнаруженные аномалии I группа п = 150 II группа п= 150 Всего
увеличение клиновидных 3 3 6
хрящей
избыток мягких тканей 1 0 1
черпаловидных областей
растяжение 2 1 3
черпалонадгортанных складок
укорочение черпалонадгор-
танных складок с продольным 1 2 3
сворачиванием надгортанника
Итого 7 6 13
Распространённость инспираторного коллапса преддверия гортани по результатам клинического исследования
Всего было собрано 250 адекватно заполненных анкет.
Педиатры указали наличие минимум 0 и максимум 8 детей до 2 лет с врождённым стридором на своих участках. Средняя арифметическая показателя составила 2,8 на участок.
В соответствии с приказом Минздрава РФ № 371 (с изменениями) на одном участке детской городской поликлиники находится около 800 детей, соответственно, дети до 2 лет — около 100 человек.
Следовательно, популяционная частота рождённого стридора составляет около 2,8 %.
Доля ИКП среди детей с врождённым стридором по нашим данным составляет около 0,55.
Следовательно, популяционная частота ИКП по результатам клинического исследования 2,8 % х 0,55 = 1,54 %. Это высокий показатель для отдельного заболевания, но он значительно ниже частоты, определённой по результатам эндоскопического исследования (более 4 %).
Таким образом, врождённый стридор как ведущий симптом позволяет выявлять ИКП с популяционной частотой лишь около 1,5 %, что свидетельствует о высокой распространённости атипичных или малосимптомных форм.
Обследование пациентов с инспираторным коллапсом преддверия гортани
Сравнительный анализ клинико-анамнестических данных в группах детей с изолированным инспираторньш коллапсом преддверия гортани и с траюиторным стридором
Основные характеристики детей с изолированным ИКП и транзиторным стридором (вследствие катаральных явлений) на момент рождения статистически не отличались (табл. 3). Цифры в таблице указаны с округлением до 0,5 недель (срок гестации), до 0,5 см (длина тела) и до 50 г (масса тела).
Таблица 3
Сравнительная характеристика сроков гестации и антропометрических показателей на момент родов в группах детей с изолированным ИКП и
Показатель изолированный ИКП п = 108 транзиторный стридор п = 78 г
тш тах М т тш тах М ш
срок гестации на момент родов (нед) 36 42,5 40,5 ±1 38 41 39,5 ±1,5 < 0,375
длина тела при рождении (см) 43 57 48,5 ±3 48 52 47,5 ±2,5 < 0,375
масса тела при рождении (г) 1750 4300 3650 ±350 2700 3750 3550 ±250 < 0,375
Другие анамнестические данные, а также результаты клинического исследования сравниваются в таблице 4. Для быстрой, удобной и эффективной фиксации данных была разработана специальная карта первичного приёма пациента со стридором.
Для быстрой, удобной и эффективной фиксации данных была разработана специальная карта первичного приёма пациента со стридором.
Для оценки обструктивного апноэ во сне родители пациентов были обучены отмечать эпизоды внезапного обрыва и восстановления стридора во время сна ребёнка, фиксируя длительность и частоту. Случаи цианоза фиксировались все, кроме цианоза носогубного треугольника, т.к. он может отмечаться и у здоровых детей первых месяцев жизни.
Таким образом, дети с изолированным ИКП не отличаются от пациентов со стридором вследствии выраженных катаральных явлений по течению беременности ими, доношенности, антропометрическим данным на момент родов и частоте цианоза.
Вместе с тем у таких детей достоверно чаще в анамнезе встречаются осложнения родов (17 %, р < 0,05). Достоверно чаще и дольше используется естественное вскармливание (60 %, р < 0,01).
В первые месяцы жизни достоверно чаще отмечается упорное срыгивание (80 %, р < 0,001), задержка физического развития (14 %, р < 0,05), задержка психомоторного развития (6 %, р < 0,05), попёрхивание (11 %, р < 0,05), стенозы дыхательных путей (7 %, р < 0,05) и эпизоды апноэ (12 %, р < 0,01).
Таблица 4
Сравнительная характеристика амнестических данных и клинических находок в группах детей изолированным ИКГ1 и трацзиторным стридором
Показатель изолированный ИКП п = 108 транзитор-ный стридор п = 78 х2 Р
выполнение мер по планированию беременности 24 (22 %) 19(24%) 0,12 0,73
возраст матери на начало беременности старше 35 лет 4 (4 %) 6 (8 %) 1,42 0,23
осложнения беременности (токсикозы, угрозы прерывания, заболевания) 37 (34 %) 28 (36 %) 0,05 0,81
кесарево сечение 12(11%) 10(13%) 0,13 0,72
осложнения родов 18 (17 %) 5 (6 %) 4,4 <0,05
естественное вскармливание минимум до 3 месяцев 64 (60 %) 29 (37 %) 8,83 <0,01
число детей, с длиной тела в 3 месяца < 10-го центиля 14 (13 %) 2 (3 %) 6,23 <0,05
число детей, с массой тела в 3 месяца < 10-го центиля 15 (14 %) 3 (4 %) 5,23 <0,05
упорное срыгивание 86 (80 %) 24 (31 %) 44,74 < 0,001
попёрхивание 11 (10%) 2 (3 %) 4,05 <0,05
одышка, стенозы дыхательных путей 8 (7 %) 0 6,04 <0,05
цианоз 6 (5 %) 3(4%) 0,29 0,59
случаи апноэ 13 (12%) 1 (1 %) 7,53 <0,01
отставание в психомоторном развитии в возрасте 3-6 мес. 7 (6 %) 0 5,25 <0,05
7 (6 %) 0 5,25 <0,05
Исследование парциального давления газов крови в группе детей с инспираторшш коллапсом преддверия гортани
В техническом паспорте для аппарата, использованного в исследовании максимальная норма для рС02 была указана 45 мм рт.ст., а минимальная для р02 — 85 мм рт.ст. Распределение результатов исследования у 50 пациентов первого года жизни с ИКП в зависимости от возраста представлены в таблице 5.
Таблица 5
Результаты анализа парциального давления газов крови в группе детей _с ИКП в зависимости от возраста_
возраст (мес.) п р02 (мм рт.ст.) рС02 (мм рт.ст.)
шш тах М тш тах
2 10 46,8 70,5 59,3 34,0 45,3
3 10 47,7 77,8 66,7 28,2 39,5
4-5 10 46,2 Г8М 62,6 28,9 39,1
6-8 10 51,3 80,0 65,9 27,7 36,1
9-12 10 47,4 79,2 61,6 28,3 ■)
В целом, на первом году жизни гипоксия установлена у 49 (98 %) из 50 пациентов. Её выраженность не зависит от возраста (рху = -0,1) . Средний уровень р02 на первом году жизни составляет 63,3 ± 1,1 мм рт.ст. (а = 7,9). У более старших детей с ИКП в нашей выборке также наблюдалась гипоксия.
Средний уровень р02 на первом году жизни составляет 63,3 ± 1,1 мм рт.ст. (а = 7,9). У более старших детей с ИКП в нашей выборке также наблюдалась гипоксия.
Гиперкапния, напротив, не характерна для пациентов с ИКП, единственный случай, а также результаты, приближающиеся к верхней границе нормы, приходятся на первые месяцы жизни.
Таким образом, почти все пациенты с ИКП (98 %) независимо от клинической формы заболевания находятся в состоянии хронической гипоксии (среднее р02 крови на первом году жизни 63,3 ± 1,1 мм рт.ст., а = 7,9), что исключает «доброкачественный» характер этой патологии.
Патогенез врождённого стридора гортани
Стридор не относится к начальным или промежуточным звеньям в патогенезе ВСГ. Он является скорее чрезвычайно полезным симптомом. Исходя из этого мы логически связали находки у пациентов с ИКП, создав собственную концепцию (рис. 2).
Единственным пунктом, указанным в схеме, но не встреченная в нашей выборке, является лёгочная гипертензия, подробно описанная Ша1 е! а1. отсроченная ир«нхи-:н\-<>чная патология и
отсроченная ир«нхи-:н\-<>чная патология и
ншчо.ю.’ия сердечнососудистой системы
смерти детей
Рис 2. Патогенез ВСГ. Собственная концепция «Айсберг». Верхний уровень — стридор, средний уровень — непосредственные эффекты ИКП, нижний уровень — опосредованные эффекты ИКП.
Дифференциалыю-диагностические критерии врождённого стридора гортани и нейрогенной ларингомаляции.
Для отделения ВСГ от нейрогенной ЛМ пациентов с ИКП распределяли в две рабочие группы «диспластическая» (принадлежность к ВСГ) и «нейрогенная».
Первичным дифференциальным симптомом в пользу ВСГ явилось наличие анатомических особенностей, способствующих ИКП. Но из-за условно-описательного характера этого критерия, он был первично установлен лишь у 62 (57 %) пациентов с ИКП, а после многократных пересмотров число возросло до 81 (74 %). Вторым этапом в группах сравнивались остальные характеристики пациентов и симптомы заболевания. Обнаруженные различия представлены в таблице 6.
Таблица 6
Сравнительная характеристика пациентов с ИКП в «диспластической» и
признак диспласти- нейроген- х1
ческая ная Р
п = 83 11 = 25
изменённая анатомия преддверия гортани 80 (96 %) 1 (4 %) 89 < 0,001
гипоксия в родах 4 (5 %) 14 (56 %) 36 <0,001
неврологические заболевания нетили лёгкие тяжёлые — -
упорное срыгивание 81 (98 %) 5 (20 %) 71 <0,001
задержка физического развития 14 (17 %) 1 (4 %) 2,7 0,1
попёрхивание 3 (4 %) 8 (28 %) 13,6 <0,001
эпизоды апноэ 3 (4 %) 10 (40 %) 24 < 0,001
показания к хирургическому лечению 51 (61 %) 1 (4 %) 25 < 0,001
семейные случаи 23 (28 %) 1 (4 %) 6,25 <0,05
По совпадению большинства пунктов 83 случая (77 %) было отнесено к «диспластической» группе (ВСГ), а остальные 23 % случаев — к «нейрогенной». Третьим этапом сравнили характеристики и течение стридора в двух группах. Найденные различия (р < 0,001) представлены в таблице 7.
Найденные различия (р < 0,001) представлены в таблице 7.
Таблица 7
Сравнительная характеристика стридора в «диспластической» и
условие диспластическая нейрогенная
начало с рождения 2-3 месяца
во сне ослабление усиление
при физической нагрузке усиление без изменения
плач без изменения усиление
в положении на животе ослабление без изменения
на фоне ОРВИ усиление без изменения
В результате были сформулированы дифференциально-диагностические критерии ВСГ. Они представлены в таблице 8.
Таблица 8
Дифференциально-диагностические критерии ВСГ и нейрогенной ЛМ
№ признак ВСГ нейрогенная ЛМ
1 характер стридора во сне ослабление усиление
2 условия усиления стридора физическая нагрузка эмоциональная нагрузка
3 анатомические аномалии преддверия гортани по данным ЭФЛС да нет
4 неврологические синдромы нет да
5 дополнительные симптомы упорное срыгивание, задержка физического развития попёрхивание, эпизоды апноэ во сне
6 показания к хирургическому лечению да нет
7 семейный характер да нет
Определение частоты ВСГ среди всех случаев ИКП как 0,77 позволяет уточнить распространённость этого заболевания в популяции. Расчётная доля ВСГ в этиологии всех форм врождённого стридора составит 0,55 (доля ИКП) х 0,77 = 42 %. Частота встречаемости ВСГ в популяции по результатам клинической диагностики составит 1,54 % (частота ИКП) х 0,77 = 1,2%.
Расчётная доля ВСГ в этиологии всех форм врождённого стридора составит 0,55 (доля ИКП) х 0,77 = 42 %. Частота встречаемости ВСГ в популяции по результатам клинической диагностики составит 1,54 % (частота ИКП) х 0,77 = 1,2%.
Таким образом. Дифференциально-диагностическими критериями ВСГ в манифестный период являются: (а) заметный с рождения характерный стридор, усиливающийся при нагрузке и ослабляющийся во сне, (б) инспираторный коллапс преддверия гортани в сочетании с его изменённой анатомией, (в) наличие срыгивания, вплоть до задержки физического развития, (г) семейный характер, (д) отсутствие поражения нервной системы, (е) наличие тяжёлых форм с необходимостью хирургической коррекции.
Доля ВСГ в этиологии врождённого стридора составляет 42 %, а популяционная частота по результатам клинической диагностики — 1,2 %.
Врождённый стридор гортани и бронхиальная астма
Из 50 детей в первой группе исследования (младший возраст) клинически ИКП можно было заподозрить у 38. Выявлялись прямые и косвенные свидетельства наличия инспираторного стридора в анамнезе (включая кратковременный, эпизодический, тихий). Учитывались не
Выявлялись прямые и косвенные свидетельства наличия инспираторного стридора в анамнезе (включая кратковременный, эпизодический, тихий). Учитывались не
характерные для БА симптомы, такие как инспираторная или смешанная одышка, упорное срыгивание, отставание в физическом или психомоторном развитии, эпизоды апноэ, попёрхивание.
Таблица 9
Частота наблюдения клинических симптомов в группе детей с ИКП изолированным и группе детей младше 5 лет с сочетанием ИКП и БА
Показатель БА + ИКП п = 34 изолированный ИКП и =108 х2 Р
инспираторный стридор (в анамнезе) 10(29%) 108 (100 %) 91,7 < 0,001
число детей, с длиной тела в 3 месяца < 10-го центиля ■ 4 (12 %) 14 (13 %) 0,03 0,85
число детей, с массой тела в 3 месяца < 10-го центиля 4 (12 %) 15 (14 %) 0,1 0,75
упорное срыгивание в первые 6 месяцев жизни 26 (76 %) 86 (80 %) 0,15 0,69
попёрхивание в первые 6 месяцев жизни 5 (15 %) 11 (10%) 0,53 0,47
одышка с инспираторным компонентом 9 (29 %) 8 (7 %) 8,92 <0,01
цианоз 12 (35 %) 6 (5 %) 20,7 < 0,001
случаи апноэ 3 (9 %) 13 (12 %) 0,27 0,61
отставание в психомоторном развитии в возрасте 3-6 мес. 6 (18 %) 7 (6 %) 3,88 <0,05
6 (18 %) 7 (6 %) 3,88 <0,05
частота встречаемости ИКП 68 % в группе неконтролируемой БА 4 % в популяции — -
Диагноз подтверждён рентгенологически и эндоскопически в 34 случаях, что составило 68 % всей группы. Клинические симптомы у пациентов с сочетанием БА и ИКП сравниваются в таблице 9 по частоте с симптомами изолированного ИКП (основная выборка в нашем исследовании).
Наглядно продемонстрировано, что типичный стридор является непременным симптомом ИКП только в нашей выборке, где этот признак использовался как критерий отбора. Когда критерием служат эндоскопические находки, его встречаемость снижается в несколько раз.
Заметно, что га всех клинических признаков ИКП сочетание с БА достоверно повышает частоту выявления одышки, цианоза, а также
задержки психомоторного развития. Среднее значение рОг (п — 23) по данным КЩР крови составило 68,3 ± 4,6 мм рт.ст., что статистически не отличается от среднего для изолированного ИКП (р < 0,375). Показания к супраглоттопластике имелись у 23 детей, что составило 65 % установленных диагнозов.
Показания к супраглоттопластике имелись у 23 детей, что составило 65 % установленных диагнозов.
Во второй группе (22 ребёнка старше 5 лет) ввиду более старшего возраста сбор анамнеза о состоянии пациентов на первом году жизни был существенно затруднён. Находками в анамнезе в пользу ВСГ явились: упорное срыгивание в первые месяцы жизни (29 %), инспираторный стридор в первые месяцы жизни (21 %), двухфазная одышка (14 %), задержка физического развития в первые месяцы жизни (14 %), эпизоды апноэ (7 %). Т.к. зеркальная ларингоскопия значительно проще и доступнее ЭФЛС, она была проведена всем пациентам. У 14 (64 %) детей ВСГ был диагностирован по остаточной деформации преддверия гортани без ИКП.
В дети с БА Ш ВСГ эндоскопически а ВСГ клинически ■ «+» нагрузочный тест О «+» данные спирографии □ «+» Р{д-диагностика
Рис. 3. Диагностика ВСГ у детей старше 5 лет с БА.
Нагрузочный тест выявил ИКП у 6 (43 %) детей. У 2 детей (14 %) данные спирометрии отражали затруднение вдоха вне обострения БА.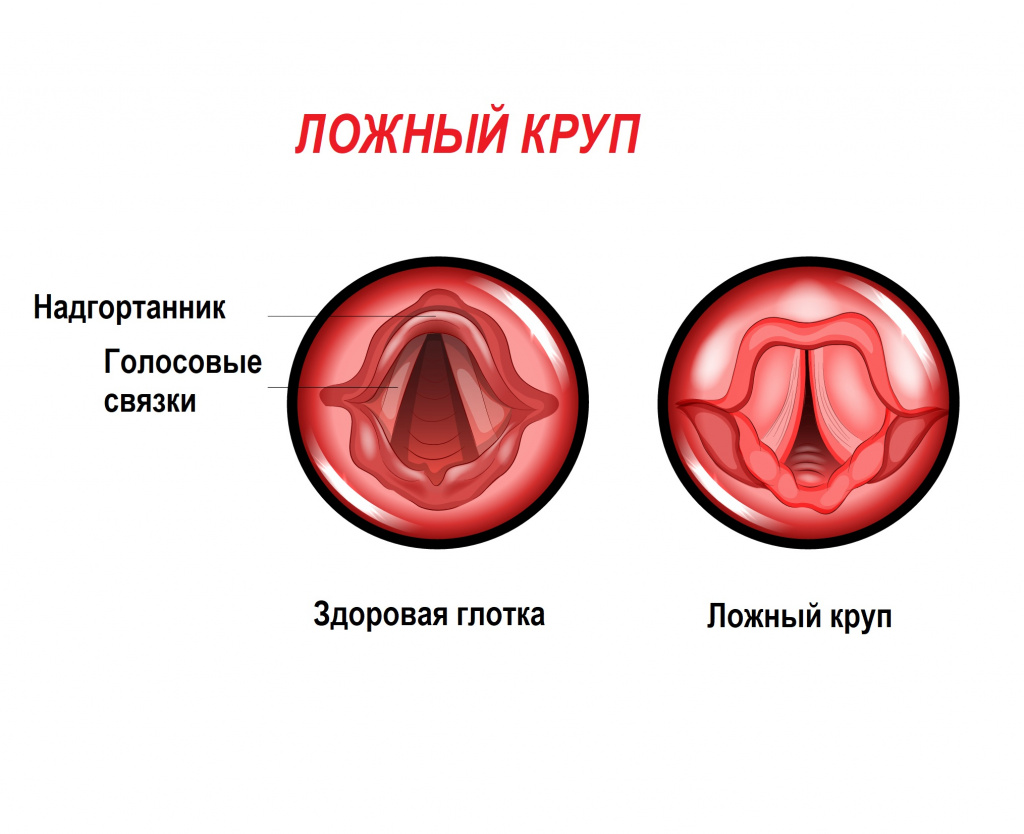 Рентгенологическая диагностика ИКП оказалась эффективной у этих же двух детей (рис. 3).
Рентгенологическая диагностика ИКП оказалась эффективной у этих же двух детей (рис. 3).
Таким образом. Дети с частично контролируемой или неконтролируемой БА нуждаются в дифференциальной диагностике ВСГ. В нашей выборке более чем у 60 % таких пациентов диагноз этого заболевания подтвердился. У больных младше 5 лет диагностику следует начинать с клинических данных, а у более старших детей — с эндоскопических.
При одновременном наличии БА и ВСГ у ребёнка, оба заболевания протекают тяжелее, чем изолированные.
Рентгенологическое исследование
Были систематизированы находки на 60 рентгенограммах с правильно выдержанной проекцией. В норме у ребёнка первых лет жизни просвет глотки, гортани и трахеи имеет на рентгенограмме одинаковый передне-
задний размер и плавные контуры. В случае JIM было обнаружено, что просвет глотки более чем в два раза превышает хорошо различимый просвет трахеи. Кроме того, на рис 4. заметно, что воздух образует дополнительный треугольный контур между задней стенкой гортани и задней стенкой глотки. Это коррелирует с эндоскопическими находками расширения грушевидных синусов. Также можно отметить направленный кпереди дополнительный полукруглый контур на уровне надгортанника.
Это коррелирует с эндоскопическими находками расширения грушевидных синусов. Также можно отметить направленный кпереди дополнительный полукруглый контур на уровне надгортанника.
Рис. 4. Рентгенограмма шеи в боковой проекции у ребёнка Д. 7 месяцев с ИКП. 1 — просвет гортаноглотки, 2 — «передний карман» глотки, 3 -«воздушный треугольник» глотки, 4 — голосовой отдел гортани, 5 -просвет трахеи.
Таблица 10
Варианты нарушения условий рентгенографии шеи в боковой проекции в
группе детей с ИКП
Вариант Результат
Голова согнута вперёд Нет просвета гортаноглотки
Снимок сделан в момент глотка То же
Поднято плечо ребёнка Наложение на контуры воздушного столба шеи
В проекцию шеи попадают пальцы родителя То же
Снимок сделан в момент движения Смазанные контуры воздушного столба шеи
Жёсткий снимок Не заметны границы воздушного столба шеи
Нечётко выдержана боковая проекция Накладываются контуры грушевидных синусов, валлекул, гортани
Снимок сделан в прямой проекции с повёрнутой в сторону головой Контуры воздушного столба шеи закрыты позвоночником
Симптом «воздушного треугольника глотки» был обнаружен у 58 (98 ± 2 %) пациентов и в настоящее время запатентован как способ диагностики JIM. Симптом «переднего кармана» глотки был констатирован только у 28 (46 ± 7 %) пациентов. Мы предполагаем, что данный симптом определяется лишь в том случае, если момент снимка совпадает с фазой вдоха у ребёнка. Трижды при проведении рентгенографии шеи был выявлен сопутствующий врождённый стеноз или деформация трахеи.
Симптом «переднего кармана» глотки был констатирован только у 28 (46 ± 7 %) пациентов. Мы предполагаем, что данный симптом определяется лишь в том случае, если момент снимка совпадает с фазой вдоха у ребёнка. Трижды при проведении рентгенографии шеи был выявлен сопутствующий врождённый стеноз или деформация трахеи.
Беспокойство ребёнка во время процедуры отмечено лишь у 19 детей (32 %). Варианты нарушения методики рентгенографии нами систематизированы и представлены в таблице 10.
Таким образом, рентгенография шеи в боковой проекции является высокоэффективным (98 ± 2 %), доступным и простым методом предварительной диагностики ИКП. Дополнительным преимуществом метода является возможность неинвазивной диагностики ВПР трахеи.
Гистологические исследования
Группа сравнения (аутопсия неизменённой гортани)
Найденные среди 30 образцов особенности гистологического строения гортани детей первого года жизни систематизированы в таблице 11.
По природе особенностей все находки были расценены как признаки незрелости тканей, нарушение соотношения тканей и феномены неустановленной природы.
Таблица 11
Гистологические особенности гортани на первом году жизни,
Вид аномалии Число Доля %
гиперклеточность черпаловидных хрящей 16 53
липоциты в хряще 16 53
широкая зона волокнистого хряща 14 47
незрелость рожковидных и клиновидных хрящей 14 47
сосуды в толще хряща 12 40
дольки желёз между пучками миоцитов 12 40
беспорядочная смесь тканей 10 33
отдельные поперечнополосатые миоциты 8 27
гетерохромия основного вещества хряща 7 23
расширение протоков желёз 3 10
лимфангиэктазия 2 7
гиперваскуляризация 2 7
эмбриональная ткань 2 7
Основная выборка (биопсия при врождённом стридоре гортани) Гистологическое исследование 15 образцов биопсийного материала выявило ряд отличий от находок в группе сравнения (табл. 12).
Единичными находками явились: большое число нервных волокон, скопление клеток, напоминающих перициты. Особенности визуализируются на увеличении 200-400х.
Особенности визуализируются на увеличении 200-400х.
Таблица 12
Результаты гистологического исследования биоптатов гортани при ВСГ и _в группе сравнения__
аномалия БСГ п = 15 аутопсия п = 30 -,1 Р
число доля m % число ДОЛЯ
вакуолизация эпителиоцитов 14 93% ±7 0 0 — -
разрыхление соединит.ткани 14 93% ±7 0 0 — -
безъядерные участки 13 87% ±9 0 0 — -
лимфангиэктазия 12 80% ± И 2 7% 25,1 < 0,001
очаговая гипер-васкуляризация 3 20% ± 11 2 7% 1,8 0,18
Таким образом, гистологическими признаками ВСГ являются вакуолизация эпителиоцитов слизистой оболочки (93 ± 7 %), выраженное разрыхление соединительной ткани (93 ± 7 %), безъядерные участки (87 ± 9 %), а также лимфангиэктазия (80 ± 11 %).
Хирургическое лечение
Показания и противопоказания
Ни один из случаев «нейрогенной» JIM не потребовал хирургического вмешательства. Отбор пациентов с ВСГ для проведения операции осуществлялся среди детей, поступавших на отделение в экстренном порядке ввиду стеноза гортани (3 случая) или в плановом порядке по направлениям JIOP-врачей поликлиник (20 случаев). Показаниями для вмешательства в случае его выполнения в плановом порядке явились:
Показаниями для вмешательства в случае его выполнения в плановом порядке явились:
— хроническая гипоксия по данным оценки парциального давления газов крови (в структуре оценки КЩР) — 22 случая,
— частое и обильное срыгивание — 18 случаев,
— выявленное клинически обструктивное апноэ — 9 случаев
— задержка физического развития — 7 случаев
— попёрхивание — 5 случаев
— задержка психомоторного развития — 4 случая
— гиперкапния — 2 случая.
Учитывая также разные степени тяжести перечисленных выше состояний, создать единую схему для определения необходимости супраглоттопластики не представляется возможным. Впрочем, следующие ситуации представляются абсолютными показаниями к операции:
— Тяжёлая гипоксия. За граничный уровень предлагается брать среднее значение рС>2 при ИКП на первом году жизни: 63 мм рт.ст.
— Гиперкапния.
— Частые продолжительные (более 15 секунд) эпизоды апноэ.
— Рецидивирующие стенозы гортани II и более степени.
— Попёрхивание каждый приём пищи.
— Повторные случаи аспирационной пневмонии.
— Ежедневное обильное срыгивание с задержкой физического развития.
Прочие показания можно расценивать как относительные.
Таким образом, дети с ВСГ нуждаются во всестороннем обследовании с целью определения индивидуальных показаний к хирургическому лечению. При этом результаты ЭФЛС имеют значение лишь для постановки основного диагноза и определения наиболее адекватного способа хирургической коррекции.
Хирургические вмешательства и результаты
При прямой ларингоскопии под наркозом вид гортани в 20 из 23 случаев был обычный для возраста пациента (что было ожидаемо ввиду отсутствия спонтанного дыхания). Это подчёркивает важность предварительной ЭФЛС с видеозаписью.
Рис 5. Собственная модификация классификации операций при ВСГ. А. Супраглоттопластика. Б. Поперечная диссекция. В. Эпиглоттопластика. Г. Эпиглоттопексия.
В. Эпиглоттопластика. Г. Эпиглоттопексия.
Отсутствие ранее выполненных операций супраглоттопластики в России и противоречивость существующих англоязычных классификаций вынудило предложить собственную классификацию вмешательств при
ВСГ. Варианты представлены на рис. 5: супраглоттопластика (без уточнений) — удаление избытка слизистой оболочки в задних отделах преддверия гортани; поперечная диссекция — рассечение черпалонадгортанных складок; эпиглоттопластика — иссечение боковых поверхностей надгортанника; эпиглоттопексия — подшивание или приклеивание надгортанника к корню языка.
Число выполнения отдельных хирургических приёмов в нашей выборке представлено в таблице 13.
Таблица 13
вид операции односторонняя двусторонняя Всего
супраглоттопластика 6 10 16
поперечная диссекция 3 2 5
эпиглоттопластика 5 3 8
эпиглоттопексия 1 1 1
Исходы операции были следующими. Полная эффективность заключалась в немедленном исчезновении стридора, одышки, попёрхивания и апноэ. Срыгивание исчезало или значительно уменьшалось. Постепенно нормализовалось насыщение крови кислородом (в среднем + 20 % через месяц), значительно ускорялось физическое развитие. Данный результат достигнут в 17 (74 %) из 23 случаев. Неполная эффективность с сохранением части симптомов констатирована в 5 (22 %) случаях.
Срыгивание исчезало или значительно уменьшалось. Постепенно нормализовалось насыщение крови кислородом (в среднем + 20 % через месяц), значительно ускорялось физическое развитие. Данный результат достигнут в 17 (74 %) из 23 случаев. Неполная эффективность с сохранением части симптомов констатирована в 5 (22 %) случаях.
Двусторонняя поперечная диссекция оказалась неэффективна у единственного (4 % случаев) пациента с Робено-подобным синдромом. Развившаяся в области вмешательства стойкая инфильтрация не позволила избежать трахеотомии. Деканюляция оказалась возможной только через 9 месяцев. По данным мировой литературы дети с набором ВПР и аномалий действительно несут повышенный риск неблагоприятного исхода вмешательства.
Итоговая доля успешных операций составляет 96 ± 4 %.
В ходе операций с использованием микроножниц возникала нетяжёлая кратковременная сангвинация; в раннем послеоперационном периоде -лёгкая кратковременная (до суток) дисфагия. Других осложнений не было.
Таким образом, эндоскопические способы коррекции ВСГ следует подразделить на супраглоттопластику, поперечную диссекцию, эпиглоттопластику и эпиглоттопексию. При отсутствии противопоказаний (сопутствующие аномалии и ВПР) они являются безопасными и эффективными (96 ± 4 %).
Генетические исследования.
Клинико-генеалогический метод
Попытка обнаружить комплекс внешних фенотипических маркеров ВСГ или устойчиво связать какую-то часть случаев с известным генетическим заболеванием не принесла результатов.
Среди 83 пациентов с изолированным ИКП лишь в нескольких случаях были установлены генетические синдромы:
• Синдром Дауна (подтверждён цитогенетически ранее) — 2 пациента
• Синдром Пьера-Робена — I ребёнок
• Робено-подобный синдром — 2 ребёнка
• Множественные ВПР без нарушения интеллекта — 3 ребёнка.
Единственный случай неэффективной супраглоттопластики
констатирован именно у ребёнка с Робено-подобным синдромом.
С подтверждением эндоскопических маркёров врождённого стридора гортани у старших детей и взрослых выявление семейных случаев заболевания стало значительно более простым и достоверным.
В результате из 108 случаев изолированного ИКП (по данным ЭФЛС), в 24 (22 %) семьях у больного пробанда оказались от 1 до 3 больных родственников I и II степени родства. Одна из показательных родословных представлена на рис. 6. «Пропуск» заболевания II-1 может оказаться ложным.
Рис 6. Родословная пациента С 6 мес. с ВСГ.
1-2,11-2, Ш-1,3-ВСГ.
Во всех выявленных семейных случаях наиболее вероятным типом наследования является аутосомно-доминантный: болеют мужчины и женщины, «вертикальный» тип передачи признака. Вполне вероятна неполная пенетрантность.
Двадцать три семейных случая пришлись на группу из 83 детей с ВСГ (28 ± 5 %). Единственная семейная ситуация в группе из 25 детей с «нейрогенной» JIM (4 %) представляется случайной (рис 7).
Таким образом: Семейный характер ВСГ наблюдается в 28 ± 5 % случаев. Наиболее вероятный тип наследования — аутосомно-
доминантный. С учётом высокой популяционной частоты ВСГ, медико-генетическое консультирование представляется эффективным в профилактике этого заболевания. Основные направления профилактики: раннее выявление ВСГ у родственников пробанда, а также определение противопоказаний к хирургическому лечению.
I Р !ЩЮ !□ □ Я ~¡¡! !<1 &
Рис. 7. Родословная пациента К 5 мес. с «нейрогенной» формой JIM.
1-4 — ВСГ. Ш-1,2 — нейрогенная JIM.
Сравнение роли средовых и генетических факторов в этиологии врождённого стридора гортани
Из 108 пациентов с изолированным ИКП сибсы-близнецы были обнаружены у шестерых. К сожалению, в двух случаях они погибли при рождении или вскоре после него, так что сведений о них нет. В остальных случаях на консультацию присылали либо единственного больного ребёнка, либо ребёнка с более тяжёлым течением заболевания. Основные сведения представлены в таблице 14.
Таблица 14
Наличие и характер ИКП у сибсов-близнецов пробандов из группы
детей с ИКП
I близнец II близнец конкор-
JVo Зигота (пробанд) дантность
пол ИКП пол ИКП
I 1 муж ВСГ муж ВСГ да
2 1 муж ВСГ муж ВСГ да
3 2 жен ВСГ муж. нейрогенная JIM нет
4 2 жен ВСГ муж нет нет
Материала для статистической обработки не достаточно, но, в целом, результаты использования близнецового метода свидетельствуют о большей роли генетических, нежели средовых факторов в развитии ИКП.
Анализ действия средовых факторов в этиологии ИКП дал следующие результаты: из 98 адекватным образом анкетированных семей курение одного или обоих родителей отмечалось в 13 (13 %), эндокринная патология — в 11 (11 %), проф. вредности — 10 (10 %), проживание в ремонтируемой квартире — 6 (6 %), проживание в потенциально загрязнённых районах — 5 (5 %). Как можно заметить, находки не отличаются ни однообразием, ни высокой частотой.
Патологическое течение беременности наблюдалось в 37 случаях (38%), но было очень разнообразно: токсикозы разных сроков, угрозы прерывания, поражения плаценты, дебют тиреоидита, сахарного диабета, острые инфекционные заболевания, приём лекарственных препаратов, травмы и пр. Срок гестации на момент родов колебался от 37 до 42 недель, в среднем составил 40,5 недель. Т.е. теория о влиянии недоношенности на развитие ИКП после рождения не является состоятельной. Дети в группе исследования чаще доношенные или переношенные.
В 18 (18 %) случаях наблюдалось патологическое течение родов, приведшее к гипоксии новорождённого: аномальные типы предлежания, обвитие пуповиной, длительный безводный период и пр. Данные находки, как уже указывалось, почти все встречались при нейрогенной ЛМ.
Таким образом. ВСГ является генетическим, вероятнее всего мультифакторным заболеванием.
ВЫВОДЫ
1. Распространённость типичной формы врождённого стридора гортани (с шумным дыханием в качестве ведущего симптома) в популяции 1,2 %. С учётом атипичных случаев — более 4 %. Среди детей первого года жизни с шумным дыханием это заболевание выявляется в 42 % случаев
2. У детей с инспираторным коллапсом преддверия гортани в первые месяцы жизни достоверно чаще, чем у здоровых отмечается упорное срыгивание (80 %, р < 0,001), задержка физического развития (14 %, р < 0,05), задержка психомоторного развития (б %, р < 0,05), попёрхивание (11%, р < 0,05), стенозы дыхательных путей (7 %, р < 0,05) и эпизоды апноэ (12 %, р < 0,01). Исследование парциального давления газов крови демонстрирует среднее р02 крови на первом году жизни 63,3 ± 1,1 мм рт.ст. (а = 7,9) в 98 % диагностированных случаев.
3. Дифференциально-диагностическими критериями врождённого стридора гортани в манифестный период являются: (а) заметный с рождения характерный стридор, усиливающийся при нагрузке и ослабляющийся во сне, (б) инспираторный коллапс преддверия гортани в сочетании с его изменённой анатомией, (в) наличие срыгивания, вплоть до
задержки физического развития, (г) семейный характер, (д) отсутствие поражения нервной системы, (е) наличие тяжёлых форм с необходимостью хирургической коррекции.
4. Дети с частично контролируемой или неконтролируемой бронхиальной астмой нуждаются в дифференциальной диагностике врождённого стридора гортани (эффективность более 60 %). Наличие этого заболевания в любом возрасте может быть дополнительной причиной неполного контроля течения бронхиальной астмы.
5. Эффективность рентгенографии шеи в боковой проекции в диагностике инспираторного коллапса преддверия гортани составляет 98 ± 2 % при оценке симптома «воздушного треугольника» гортаноглотки.
6. Гистологическими признаками врождённого стридора гортани являются вакуолизация эпителиоцитов слизистой оболочки (93 ± 7 %), выраженное разрыхление соединительной ткани (93 ± 7 %), безъядерные участки (87 ± 9 %), а также лимфапгиэктазия (80 ± 11 %).
7. Эндоскопические операции по поводу врождённого стридора гортани следует подразделять на супраглоттопластику, поперечную диссекцию, эпиглоттопластику и эпиглоттопексию. Эффективность составляет 96 ± 4%. Показания к операции определяются индивидуально. Основное противопоказание — наличие множественных врождённых пороков развития, других генетических синдромов.
8. Врождённый стридор гортани имеет генетическую предрасположенность с аутосомно-доминантным типом наследования и частотой семейных форм 28 ± 5 %. Профилактика осуществляется с помощью медико-генетического консультирования и заключается в ранней диагностике новых случаев заболевания в семье, а также снижении риска хирургических осложнений.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Для педиатров и детских ЛОР-врачей амбулаторного звена
1) Учитывать возможность скрытых осложнений при врождённом стридоре неясной этиологии.
2) Подозревать ИКП или сходный по механизму действия ВПР гортани не только при врождённом стридоре, но и в случаях:
— рецидивирующих (несколько раз в год) острых стенозов гортани
— эпизодов апноэ без известной причины (например, центральное апноэ при соответствующем неврологическом расстройстве),
— задержки физического и(или) психомоторного развития неясной этиологии
— упорного срыгивания
— признаков инспираторной одышки при отрицательном результате диагностики методом прямой ларингоскопии
— попёрхивания и(или) аспирации, если причина не установлена
3) Для уточнения показаний к эндоскопической диагностике ИКП предварительно использовать:
— Рентгенографию верхних дыхательных путей в боковой проекции. Основным признаком ИКП служит симптом «воздушного треугольника глотки», дополнительной треугольной области воздушного столба гортаноглотки, расположенной между задней стенкой гортани и задней стенкой гортаноглотки. Вспомогательным признаком может быть дополнительная полукруглая область воздушного столба гортаноглотки, расположенная кпереди от надгортанника и направленная вперёд. Также следует оценивать просвет трахеи.
— Исследование КЩР крови. Наиболее информативные показатели -парциальное давление кислорода крови (индикация гипоксии) и углекислого газа крови (индикация гиперкапнии).
— Клиническую диагностику обструктивного апноэ во сне на основании внезапных кратковременных эпизодов отсутствия шума.
Расширенный анамнез для определения дополнительных патологических состояний у ребёнка.
Данные полезно фиксировать в разработанной специальной карте.
4) Детей с подтверждённым ИКП направлять на медико-генетическое консультирование. При невозможности — самостоятельно проводить дифференциальную диагностику ВСГ с использованием клинико-анамнестического и генеалогического методов. Исходить из аутосомно-доминантного типа наследования.
5) Использовать наличие семейного характера ВСГ как дополнительное показание к медико-генетическому консультированию. Проводить раннюю диагностику данного заболевания у новорождённых в таких семьях.
6) В направлении на консультацию к ЛОР-врачу детей с ВСГ для решения вопроса о супраглоттопластике указывать наличие внегортанных симптомов заболевания, других заболеваний (особенно генетических).
7) Определять показания и противопоказания к супраглоттопластике индивидуально. Преимущество отдавать не эндоскопическим находкам, но данным о состоянии здоровья ребёнка.
8) При отрицательном решении вопроса об операции ребёнка следует взять на учёт с целью:
— выполнения консервативного лечения и профилактики осложнений (общеукрепляющая, антирефлюксная и симптоматическая терапия)
— отслеживания роста и развития ребёнка, а также появления (или выявления) новых заболеваний и патологических состояний для возможного пересмотра показаний к супраглоттопластике.
9) У пациентов с частично контролируемой или неконтролируемой БА выявлять ВСГ в качестве сопутствующего заболевания.
— Для детей до 5 лет использовать клиническую диагностику, а затем -рентгенографию шеи и эндофиброларингоскопию.
— У пациентов старше 5 лет первым этапом целесообразно выполнять эндоскопическое исследование с последующим подтверждением другими методами (клинико-анамнестический, спирометрия, рентгенография шеи).
Для оперирующих оториноларингологов.
1) В качестве метода выбора окончательной диагностики ИКП использовать ЭФЛС под местной анестезией на спонтанном дыхании. Кроме ИКП важно отмечать имеющиеся анатомические особенности преддверия гортани, все аномалии и ВПР верхних дыхательных путей Полезно выполнять видеозапись на цифровой носитель.
2) Считать абсолютными показаниями к хирургическому лечению ВСГ:
— Гипоксию С рС>2 < 63 мм рт.ст.
— Гиперкапнию с рССЬ > 40 мм рт.ст.
— Частые продолжительные (более 15 секунд) эпизоды апноэ.
— Рецидивирующие (более 3 раз за год) тяжёлые стенозы гортани (II и более степени).
— Попёрхивание с тяжёлым кашлем каждый приём пищи.
— Более 1 случая аспирационной пневмонии.
— Ежедневное обильное срыгивание с задержкой физического развития.
3) В качестве метода выбора хирургического лечения ВСГ использовать супраглоттопластику по одному из четырёх вариантов или в комбинации: супраглотгопластика, поперечная диссекция, эпиглоттопластика и эпиглоттопексия. По жизненным показаниям в экстренном порядке операцию выполнять после проведения интубации трахеи или трахеотомии, В остальных случаях — в плановом порядке под назофарингеальным наркозом Удалённые ткани отправлять на гистологическое исследование
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1) Петруничев А.Ю. Некоторые вопросы этиологии ларингомаляции. // Рос. оториноларингология. 2003. №1. С.116-118. (рецензия ВАК РФ)
2) Цветков Э.А., Петруничев А.Ю. Ларингомаляция (показания для хирургического лечения).//Рос. оториноларингология. 2003. №4. С.112-114. (рецензия ВАК РФ)
3) Петруничев А.Ю. Дифференциальная диагностика ларингомаляции. Научн.-практ. конф. молодых учёных «Актуальные вопросы клинической и экспериментальной медицины»: Тез. докл. СПб.: Изд.дом СПбМАПО, 2004. С. 94-95.
4) Цветков Э.А., Савин А.Н., Петруничев А.Ю. Влияние ларингомаляции на здоровье взрослого человека: Сб.тр. Мариинской больницы «Актуальные проблемы диагностики, лечения и профилактики заболеваний». Вып. III. СПб.: Изд. СПбГПМА, 2004. С. 251-254.
5) Zaitsev V.S, Petrunichev A.Ju, Mkheidze M.O. Autopsy larynx findings of a patient with Down syndrome (DS, case report). // Eur. J. Hum. Genet. 2004. Vol.12, N6, Suppl.l. P. 107.
6) Зайцев B.C., Петруничев А.Ю., Колобов A.B. Особенности гистологического строения гортани у детей первого года жизни. // Рос. оториноларингология. 2005. №2. С.17-20. (рецензия ВАК РФ)
7) Петруничев А.Ю. Методические подходы к изучению гистологии гортани. Всероссийск. научн.-практ. конф. с межд. участием «Современные аспекты и перспективы развития оториноларингологии»: Тез.докл. М.,2005. С. 56.
8) Цветков Э.А., Петруничев А.Ю. Клинические проявления и перспективы вторичной профилактики ларингомаляции. Всероссийск. научн.-практ. конф. с межд. участием «Современные аспекты и перспективы развития оториноларингологии»: Тез.докл. М.,2005. С.59-60.
9) Петруничев А.Ю. Совершенствование исследования аутопсийной гортани при ларингомаляции. Научн.-практ. конф. молодых учёных «Актуальные вопросы клинической и экспериментальной медицины»: Тез. докл. СПб.: Изд.дом СПбМАПО, 2006. С. 215-216.
10) Цветков Э.А., Петруничев А.Ю. Эффективность выявления и динамического наблюдения детей с ларингомаляцией врачами амбулаторного звена. VII съезд оториноларингологов России: Тез.докл. СПб., 2006. С. 466-467.
11) Петруничев А.Ю., Семёнова О.Н. Популяризация знаний по ларингомаляции. Актуальные проблемы современной оториноларингологии. Всеармейская научн.-практ. конференции: Тез,докл. СПб, 2006. С. 84-85.
12) Петруничев А.Ю. Подготовка препаратов гортани для гистологического исследования в ходе аутопсии. // Рос. оториноларингология. 2006. №1. С. 143-146. (рецензия ВАК РФ)
13) Цветков Э.А., Петруничев А.Ю. Место ларингомаляции в работе педиатра и детского ЛОР-врача. // Рос. оториноларингология. 2006. №3. С. 81-84 (рецензия ВАК РФ)
14) Цветков Э.А, Петруничев А.Ю. Предпосылки стандартизации диагностической тактики в случае врождённого стридора. // Рос. оториноларингология. 2007. Прил.1. С. 222-226.
15) Петруничев А.Ю, Цветков Э.А. Доброкачественный врождённый стридор (ларингомаляция) как медико-социальная проблема. II Российск. форум «Здоровье детей: профилактика социально-значимых заболеваний»: Тез.докл. СПб, 2008. С. 55-62.
16) Петруничев А.Ю. Социальная значимость доброкачественного врождённого стридора (ларингомаляции). II Российск. форум «Здоровье детей: профилактика социально-значимых заболеваний»: Тез.докл. СПб,
2008. С. 180.
17) Цветков Э.А, Петруничев А.Ю. Состояние функции дыхания у детей в манифестный период ларингомаляции. // Рос. оториноларингология. 2008. №3. С.101-106. (рецензия ВАК РФ)
18) Petrunitchev A.Ju. Laryngomalacia (OMIM 150280) and congenital stridor in infants. // Eur. J. Hum. Genet. 2009. Vol.17, Suppl.2. P.67.
19) Петруничев А.Ю, Бикузарова JI.B. Оценка существующей схемы организации медицинской помощи детям с врождённым стридором. Научн.-практ. конф. молодых учёных «Актуальные вопросы клинической и экспериментальной медицины»: Тез.докл. СПб.: Изд.дом СПбМАПО,
2009. С. 207-209.
20) Петруничев А.Ю. Патогенез ларингомаляции у детей первых лет жизни. // Рос. оториноларингология. 2009. Прил. 1. С. 96-99.
21) Петруничев А.Ю. Ларингомаляция (OMIM 150280): перспективы медико-генетического консультирования: Сб.тр. «Современные технологии профилактики наследственных болезней и детской инвалидности» / под ред. B.C. Баранова, О.П. Романенко. СПб.: «Феникс», 2009. С. 168-173.
22) Петруничев А.Ю, Цветков Э.А. Объективные методы диагностики ларингомаляции. // Рос. оториноларингология. № 6. 2009. С. 87-93. (рецензия ВАК РФ)
23) Зайцев B.C., Цветков Э.А, Петруничев А.Ю. Гистология преддверия гортани в норме и при ларингомаляции. 100-летие российского общества патологоанатомов: Тез.докл. СПб.: «Береста», 2009. С. 127-129.
24) Цветков Э.А, Петруничев А.Ю. Опыт хирургического лечения ларингомаляции в Санкт-Петербурге. III научн.-практ. конференция оториноларингологов центрального федерального округа РФ «Актуальное в оториноларингологии»: Тез.докл. М,2009. С. 65-67.
25) Петруничев А.Ю, Бикузарова Л.В. Улучшение регистрации данных при первичном приёме больных с врождённым стридором. III научн.-практ. конференция оториноларингологов центрального федерального округа РФ «Актуальное в оториноларингологии»: Тез.докл. М.,2009. С. 271-273.
26) Петруничев А.Ю., Безбородова М.А. Адекватное лечение врождённого стридора. Научн.-практ. конф. молодых учёных «Актуальные вопросы клинической и экспериментальной медицины»: Тез.докл. СПб.: Изд.дом СПбМАПО, 2010. С. 308-309.
27) Безбородова М.А., Петруничев А.Ю. Использование генеалогического метода при ларингомаляции (OMIM 150280). // Мед. генетика. 2010. №5. С. 20.
28) Долговременное наблюдение детей с ларингомаляцисй. Популяционная частота синдрома. / А.Ю. Петруничев [и др.]. // Рос. оториноларингология. № 2. 2010. С. 109-114. (рецензия ВАК РФ)
29) Цветков Э.А., Петруничев А.Ю., Зайцев B.C. Хирургическое лечение ларингомаляции. // Рос. оториноларингология. 2010. Прил. 1. С.230-235.
30) Петруничев А.Ю. Ларингомаляция: изолированный генетический синдром, комплексное заболевание или симптом?: Сб.тр. «Актуальш проблемы акушерства i гшекологп, клпич1кн ¡мунологи та медично1 генетию». Киев, 2010. Т. 19. С. 358-365.
31) Петруничев А.Ю., Воронов В.А. Роль средовых и генетических факторов в этиологии доброкачественного врождённого стридора (ларингомаляции): Сб.тр. «Актуальные проблемы медицины и биологии» / под ред. A.B. Шаброва, В.Г. Маймулова. СПб: СПбГМА им. И.И. Мечникова, 2010. С. 37-38.
32) Петруничев А.Ю., Цветков Э.А. Генетические методы исследования и медико-генетическое консультирование при ларингомаляции: в помощь оперирующему оториноларингологу. // Рос. оториноларингология. № 4. 2010. С. 80-86 (рецензия ВАК РФ)
33) Петруничев А.Ю., Макарова И.В., Цветков Э.А. Ларингомаляция и бронхиальная астма у детей. // Рос. оториноларингология. № 4. 2010. С. 7079 (рецензия ВАК РФ)
34) Петруничев А.Ю, Пащинин А.Н., Цветков Э.А. Значимость эндоскопической коррекции преддверия гортани при ларингомаляции. // Вестн. Рос. воен. мед. акад. № 3., Прил. 1. 2010. С. 57.
35) Петруничев А.Ю., Новик Г.А., Цветков Э.А. Врождённый стридор гортани: диагностика и лечение. // Педиатрич. фармакол. № 1. 2011. С. 7882 (рецензия ВАК РФ)
36) Новик Г.А., Петруничев А.Ю., Макарова И.В. Бронхиальная астма и врождённый стридор гортани у детей. / Лечащий врач. № 2. 2011. С. 7981 (рецензия ВАК РФ)
37) Цветков Э.А., Петруничев А.Ю., Новик Г.А. Прогресс в супраглоттопластике. Материалы XVIII съезда оториноларингологов России. Т. 1. СПб. 2011. С. 406-410.
38) Petrunitchev A.Ju. Laryngomalacia (OMIM 150280): unexpectedly high frequency in population. // Eur. J. Hum. Genet. 2011. Vol.19, Suppl.2. P.97.
Учебное пособие: Э.А. Цветков, А.Ю. Петруничев. Ларингомаляция. Диагностическая и лечебная тактика при врождённом стридоре. СПб: Издательство СП6ГПМА.2007. 22с.
ИЗОБРЕТЕНИЯ
Пат. 2410029 С1 Российская Федерация, МПК А61В 6/00 (2006.01) Способ диагностики ларингомаляции / Цветков Э.А., Петруничев А.Ю.; заявитель и патентообладатель ГОУ ДПО Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию — № 2009128811/14; заявл./16. Бумага офсетная. Гарнитура Тайме. Объем 2,0 п. л. Тираж 100 экз. Зак. № 43
Отпечатано в ЦМТ СПбГПМА. 194100, Санкт-Петербург, Литовская ул., д. 2.
Стридор врожденный: особенности заболевания и лечение
Стридор врожденный – болезнь детей раннего возраста, которая характеризуется шумами инспираторной формы в процессе дыхательной функции.
Причины возникновения
Врожденный стридор у детей начинает развиваться сразу после рождения, немного утихает после полугода и самостоятельно исчезает ближе к 2-3 годам. По мнению многих медиков, причиной возникновения данного заболевания является аномальное развитие наружного отдела гортани и хрящевых тканевых соединений черпаловидного вида. Надгортанник отличается мягкостью, он скручен в трубочку. Связки черпалонадгортанной формы располагаются близко друг к другу и образуют форму парусов, которые натянуты. При вдохе связки колышутся, таким образом возникает шумовой эффект.
Симптомы
Врожденный стридор у новорожденных характеризуется такой симптоматикой:
- звонкий шум со свистящим эффектом, который напоминает голубиное воркование, в некоторых случаях кошачье мурлыканье;
- уменьшение интенсивности шумовых звуков во время сна, при перемещении малыша из холодной в более теплую комнату, при пребывании ребенка в состоянии абсолютного покоя;
- увеличение шумовой интенсивности при кашле, плаче или при возбуждении.
Состояние малыша при данной болезни практически не изменяется, дыхание не нарушено, сосательные рефлексы без изменений, сохраняется голос.
Диагностирование
Стридор врожденной формы может диагностироваться двух типов:
- инспираторный;
- экспираторный.
При тяжелой степени стридора необходимо провести ларингоскопию для того, чтобы выяснить, не провоцируется ли данное заболевание полипом или наличием мембранного соединения голосовых связок врожденной формы. Причиной появления дыхания стридорозного типа может стать также абсцесс ретротонзиллярной или ретрофарингеальной формы.
Лечение
Стридор врожденной формы к полугоду жизни уменьшается и к двухлетнему, в некоторых случаях, к трехлетнему возрасту полностью исчезает. Таким образом, нет необходимости проводить какое-либо лечение.
Профилактика
Первичные профилактические меры данной болезни отсутствуют, так как первые признаки появляются сразу после рождения малыша. Основные методы профилактики должны быть направлены на улучшение общего состояния ребенка:
- регулярные профилактические осмотры у педиатра;
- соблюдение правильного питания с высоким содержанием продуктов, в состав которых входит большое количество клетчатки;
- отказ от острой и горячей пищи;
- предотвращение переохлаждения ребенка;
- профилактические меры по предотвращению простуд;
- массаж.
Лечение врожденного стридора в Краснодаре
Оплата приема происходит в клинике. Запись к врачу без комиссий и переплат.
Детский ЛОР,
ЛОР
Стаж 4 года
В клинике
от 1 350₽
Запись на приём:
(861) 205-07-26
Клиника «ЛАЙФ»
Запись на приём
Как клиника работает в условиях эпидемии COVID-19?
Детский хирург,
педиатр
Стаж 25 лет
Высшая категория
В клинике
от 1 500₽
Запись на приём:
(861) 206-03-46
«Клиника Екатерининская» на Одесской
Запись на приём
Как клиника работает в условиях эпидемии COVID-19?
Запись к врачу недоступна
Врожденный стридор « Новости Татарстана и Казани
Врождённый стридор — это заболевание, которое проявляется исключительно у детей. Характеризуется оно шумным свистящим дыханием, которое обусловлено врождёнными аномалиями строения трахеи и гортани.
Врожденный стридор развивается у детей к 2 неделям жизни. Однако если вы найдёте симптомы, похожие на врождённый стридор у вашего новорождённого ребёнка, то не стоит сразу паниковать. От 40 до 50 процентов новорождённых малышей в первые часы жизни страдают стридорным дыханием, при этом спустя несколько часов этот симптом проходит.
Стридорное дыхание зачастую усиливается во время передвижения или высокой эмоциональной напряжённости. Если в спокойной обстановке стридорное дыхание может фактически пропадать, то в стрессовой ситуации оно может усиливаться, сильно пугая родителей малыша. В случае ОРВИ врождённый стридор может давать осложнения, ухудшая состояние малыша, а в единичных случаях даже приводя к асфиксии и острой дыхательной недостаточности.
Для диагностики заболевания нужно обратиться к педиатру. Педиатр, исходя из общего состояния ребёнка, может дополнительно направить вас к отоларингологу, неврологу или пульмонологу. Ребёнку в обязательном порядке сделают микроларингоскопию. Возможны также и другие процедуры, однако всё мы перечислять не будем, дабы не пугать родителей непонятными им терминами.
В большинстве случаев врождённый стридор не требует дополнительного лечения. Если ребёнку стридорное дыхание не мешает, то поводов для серьёзных волнений нет. К 2–3 годам заболевание обычно проходит само по себе, что связано с развитием дыхательной системы ребёнка. Поэтому больным этим недугом обычно показано лишь наблюдение у местного педиатра и отоларинголога. Однако при острой фазе болезни понадобится немедленная госпитализация. Как мы помним, на фоне ОРВИ врождённый стридор может приводить к асфиксии, а с этим медлить нельзя. В больнице вашему ребёнку могут назначить ингаляции, бронхолитики и (или) гормональные препараты. Лечение назначается индивидуально.
Больным врождённым стридором следует следить за своим образом жизни. Вашему малышу нужно избегать ОРВИ и сильных эмоциональных стрессов, которые могут приводить к осложнениям. Также позаботиться о закаливании и о полноценном питании. У вашего малыша должно быть всё для полноценного роста и развития. Если вы будете внимательно относиться к вашему ребёнку, то врождённый стридор не скажется на жизни и здоровье малыша.
Новости по теме
Оценка состояния новорожденного при первом патронаже: что должен знать педиатр | Рюмина
1. Неонатология – Национальное руководство. Под ред. акад. Н.Н. Володина М.: «ГЭОТАР-Медиа», 2009. 848 с.
2. Шабалов Н.П. Неонатология: Уч. пособие в 2-х томах. 6-е изд. М.: МЕДпресс-информ, 2016, 1504 с.
3. Shakib J, Buchi K, Smith E, Korgenski K, Young PC. Timing of initial well-child visit and readmissions of newborns. Pediatrics, 2015 Mar, 135(3): 469-74.
4. Сухих Г.Т., Байбарина Е.Н., Рюмина И.И. Базовая помощь новорожденному – международный опыт (под ред. Н.Н. Володина). М: ГЭОТАР-Медиа, 2008. 308 с.
5. Избранные клинические рекомендации по неонатологии. Под редакцией Е.Н. Байбариной, Д.Н. Дегтярева. М.: ГЭОТАР-Медиа. 2016. 240 с.
6. McKee-Garrett TM. Overview of the routine management of the healthy newborn infant. UpToDate.
7. Зубков В.В., Рюмина И.И. Уход за пуповинным остатком, профилактика и лечение омфалита. Неонатология, 2014, 1: 176-180.
8. Гомелла Т.Л. и др. Неонатология: в 2-х томах. Пер. с англ. М.: Медицина, 2015. 708 с., 864 с.
9. Fox L. Newborn assessment. Arizona State Univercity Project. College of Nursing and health.
10. World Health Organization, United Nations Children’s Fund. WHO child growth standards and the identification of severe acute malnutrition in infants and children. A Joint Statement. Acta Paediatrica, 2006, 95: 5-101.
11. www.who.int/making_pregnancy_safer.
Клиническая картина врожденного стридора: анамнез, физикальный, причины
Автор
Тимоти Д. Мерфи, доктор медицины Консультирующий и обслуживающий персонал, педиатрическая медицина легких и сна, Детская больница Мэри Бридж
Тимоти Д. Мерфи, доктор медицины, является членом следующих медицинских обществ: Американское торакальное общество, Американская академия медицины сна
Раскрытие информации: нечего раскрывать.
Соавтор (ы)
Клемент Л. Рен, доктор медицины Заведующий отделением детской пульмонологии отделения педиатрии, доцент детской больницы Голизано в Стронге, Рочестерский университет, Нью-Йорк
Клемент Л. Рен, доктор медицины, является членом следующих медицинских обществ: Американская академия аллергии, астмы и иммунологии, Американская академия педиатрии, Американский колледж грудных врачей, Американское торакальное общество
Раскрытие: Ничего не разглашать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Чарльз Каллахан, DO Профессор, заведующий кафедрой педиатрии и детской пульмонологии, Медицинский центр Tripler Army
Чарльз Каллахан, DO является членом следующих медицинских обществ: Американская академия педиатрии, Американский колледж грудных врачей, Американский колледж педиатров-остеопатов, Американского торакального общества, Ассоциации военных хирургов США, Христианских медицинских и стоматологических ассоциаций
Раскрытие: Ничего не разглашать.
Главный редактор
Дениз Серебриски, доктор медицины Доцент кафедры педиатрии Медицинского колледжа Альберта Эйнштейна; Директор отделения легочной медицины, отделение педиатрии им. Льюиса М. Фрада, Медицинский центр Якоби / Северный центральный госпиталь Бронкса; Директор Детского центра астмы и аллергии Якоби, Медицинский центр Якоби
Дениз Серебриски, доктор медицины, является членом следующих медицинских обществ: Американское торакальное общество
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Томас Скэнлин, доктор медицины Руководитель отделения легочной медицины и центра кистозного фиброза, отделение педиатрии, Медицинская школа Рутгерса Роберта Вуда Джонсона
Томас Скэнлин, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации содействия развитию науки , Общество педиатрических исследований, Американское общество биохимии и молекулярной биологии, Американское торакальное общество, Общество педиатрических исследований
Раскрытие: нечего раскрывать.
Врожденный гортанный стридор | Отделение отоларингологии хирургии головы и шеи
Что такое врожденный стридор гортани?
Врожденный стридор гортани возникает в результате врожденной (присутствующей при рождении) аномалии гортани (голосового аппарата). Стридор — это высокий звук, который лучше всего слышен, когда ребенок вдыхает. Это указывает на частичную закупорку верхних дыхательных путей.
Что вызывает врожденный стридор гортани?
Врожденный стридор гортани возникает из-за различных дефектов, присутствующих при рождении.Например, при ларингомаляции слабость структур гортани заставляет их разрушаться во время дыхания. У детей ларингомаляция — наиболее частая причина стридора. Эта проблема решается через 12–18 месяцев, как правило, сама по себе.
Каковы симптомы врожденного стридора гортани?
Основным симптомом этого заболевания является стридор, который слышен при дыхании младенца. Стридор обычно слышен, когда младенец вдыхает, но также может быть слышен, когда младенец выдыхает.Другие характеристики стридора могут включать:
Стридор меняется в зависимости от активности.
Стридор присутствует во время различных фаз бодрствования — еды, сна или возбуждения.
Стридор обычно менее шумный, когда ребенок лежит на животе.
Стридор ухудшается, если у ребенка инфекция верхних дыхательных путей.
Симптомы врожденного стридора гортани могут быть похожи на другие заболевания или проблемы со здоровьем.Всегда консультируйтесь с лечащим врачом вашего ребенка для постановки диагноза.
Как диагностируется врожденный стридор гортани?
В дополнение к полному анамнезу и физическому осмотру диагностические процедуры по поводу врожденного стридора гортани могут включать ларингоскопию или бронхоскопию дыхательных путей. Это процедура, при которой в дыхательные пути вводят трубку, чтобы врач вашего ребенка мог наблюдать за дыхательными путями во время дыхания.
Лечение врожденного стридора гортани
В большинстве случаев врожденный стридор гортани — это безвредное заболевание, которое проходит само по себе, без каких-либо медицинских действий.Случай каждого ребенка уникален. У небольшого процента развиваются серьезные респираторные проблемы, требующие медицинского и хирургического вмешательства.
Врожденный гортанный стридор (ларингомаляция) | Cooper University Health Care
Стридор в гортани — это шумный или высокий звук, который возникает при дыхании. Это вызвано неправильным формированием голосового аппарата (гортани).
Это состояние присутствует при рождении и называется врожденным стридором гортани (ларингомаляция), и это наиболее частая причина шумного дыхания (стридор) у младенцев.Во время развития ребенка гортань может развиваться не полностью. В результате часть гортани ослабевает, из-за чего мягкие ткани гортани опускаются над отверстием дыхательных путей и частично блокируют его во время дыхания.
Хотя в большинстве случаев врожденный стридор гортани — это безвредное заболевание, которое проходит само по себе к 20-месячному возрасту. Однако у некоторых младенцев возникают серьезные проблемы с дыханием, которые требуют лечения. Вот почему, если у вашего ребенка появляются признаки стридора, важно, чтобы его или ее осмотрел педиатр, который может направить вас к отоларингологу (специалисту по ушам, носу и горлу).
Важно отметить, что если у вашего ребенка проблемы с дыханием, немедленно позвоните в службу 9-1-1 или на местный номер службы экстренной помощи.
Почему стоит выбрать Cooper для лечения врожденного гортанного стридора
Обладая повышенным уровнем подготовки и опытом, команда отоларингологов Купера — специалисты по лечению ушей, носа и горла — обладают уникальной квалификацией для лечения детей с этим заболеванием и имеют подтвержденный послужной список успешных результатов.
Кроме того, наши ЛОР-специалисты владеют самыми современными минимально инвазивными хирургическими методами, включая трансоральную роботизированную хирургию (TORS) и трансоральную лазерную микрохирургию (TOLM).
Симптомы врожденного гортанного стридора
Основным признаком врожденного стридора гортани является высокий звук, который вы слышите, когда ваш ребенок дышит. Его лучше всего слышно, когда ребенок вдыхает (вдыхает), но также его можно услышать, когда ребенок делает выдох (выдох).
Дополнительно стридор может:
- Изменение с действием
- Присутствовать во время еды, сна или возбуждения
- Становитесь менее шумными, когда ребенок лежит на животе
- Хуже, если у вашего ребенка инфекция верхних дыхательных путей, например, кашель или простуда
Другие симптомы более тяжелого врожденного стридора гортани могут включать:
- Затруднение при кормлении
- Плохая прибавка в весе
- Удушье при кормлении
- Апноэ (паузы на дыхании)
- Втягивание в шею и грудь при каждом вдохе
- Цианоз (синюшный оттенок кожи, обычно вызванный низким уровнем кислорода)
- Гастроэзофагеальный рефлюкс (срыгивание, рвота и срыгивание)
- Вдыхание пищи в легкие (аспирация)
Как диагностируется врожденный стридор гортани
Ваш педиатр спросит о симптомах и истории здоровья вашего ребенка, а также проведет его физический осмотр.Затем вас могут направить к специалисту по ушей, носу и горлу (отоларингологу) для дальнейшего диагностического обследования. Это может включать:
- Назофаринголарингоскопия (NPL), офисный тест, в котором крошечная камера, напоминающая пучок спагетти со светом на конце, вводится через ноздрю вашего ребенка в нижнюю часть горла, где находится гортань, что позволяет Ваш доктор, чтобы увидеть голосовой ящик
- Рентген шеи
- Рентгеноскопия дыхательных путей (движущееся изображение)
- Ларингоскопия , осмотр гортани под наркозом в операционной
- Бронхоскопия , исследование внутренней части трахеи и бронхов (дыхательные пути в легкие), ниже гортани; это обследование проводится через рот с помощью небольшой камеры.
Как лечить врожденный стридор гортани
Лечение будет зависеть от симптомов, возраста, общего состояния здоровья и тяжести состояния вашего ребенка. Лечение может включать:
- Наблюдение : показано пациентам с незначительной обструкцией и отсутствием проблем с дыханием
- Лекарства : лекарства от рефлюкса и / или стероиды для уменьшения отека дыхательных путей
- Хирургия : При тяжелом состоянии рекомендуется процедура, называемая супраглоттопластикой.Эта операция проводится через рот (трансорально), и можно использовать лазер или хирургические инструменты для удаления ткани в верхней части гортани, которая препятствует прохождению дыхательных путей. Эта процедура занимает около часа.
Свяжитесь с нами
Чтобы узнать больше об услугах, доступных в Отделении отоларингологии — хирургии головы и шеи, или записаться на прием, позвоните по телефону 856.342.3113.
Ларингомаляция (гортанный стридор): симптомы, диагностика и лечение
Ларингомаляция (LAYR inn go mah LAY shah) также называется гортанным стридором.Это происходит из-за слабости частей голосового аппарата (гортани), которая присутствует при рождении. Это состояние может вызвать высокий звук, называемый стридором (STRI der). Вы можете услышать этот звук, когда ваш ребенок вдыхает.
Причина ларингомаляции
Ларингомаляция означает «мягкая гортань». Это вызвано вялостью тканей над голосовыми связками (так называемая надгортанная гортань). Когда человек вдыхает (вдох), эти ткани попадают в дыхательные пути и вызывают частичную блокировку дыхательных путей.Эта закупорка в области голосового аппарата создает шумное дыхание (называемое стридором).
Ларингомаляция — наиболее частая причина шумного дыхания у младенцев. Более чем у половины младенцев в течение первой недели жизни наблюдается шумное дыхание. У большинства других младенцев он возникает в течение 2–4 недель после рождения. Это редко, но ларингомаляция может возникнуть у детей старшего возраста или взрослых, обычно у детей с другими медицинскими проблемами.
Признаки и симптомы
Основной симптом ларингомаляции — шумное дыхание при вдохе ребенка.Это называется инспираторным стридором . Стридор май:
Изменение с активностью. Звук может быть громче, когда ребенок расстроен, плачет или взволнован.
Говорите громче, когда ваш ребенок простужен.
Обычно звук будет громче, когда ребенок лежит на спине, и тише, когда он лежит на животе.
В более тяжелых случаях ларингомаляции может быть:
Рвота или срыгивание пищи (рефлюкс)
Плохая прибавка в весе
Проблемы с питанием
Задыхаясь от еды
Паузы в дыхании (апноэ) или посинение (цианоз)
Опускание груди или шеи при дыхании (втягивание)
Диагностика
После медицинского осмотра врач вашего ребенка может подумать, что у вашего ребенка ларингомаляция.Некоторые анализы могут быть сделаны в кабинете врача бодрствующему ребенку. Ларингоскопия (Lay rinn GOSS koh pee) и Назофарингоскопия (nay zoh fayr inn GOSS koh pee) — это тесты, которые позволяют врачу точно увидеть, как работает голосовой аппарат. Если эти анализы в офисе не объясняют симптомы вашего ребенка, его или ее врач может назначить дополнительные анализы.
Лечение
В большинстве случаев это безвредное заболевание, которое проходит само по себе без лечения. Обычно оно улучшается к тому времени, когда ребенок достигает 18-месячного возраста.Долгосрочных осложнений нет, но у небольшого числа детей могут развиться серьезные проблемы с дыханием, которые могут потребовать хирургического вмешательства или другого медицинского лечения. Иногда детей с ларингомаляцией также лечат лекарствами от рефлюкса.
Когда звонить врачу
Если вы заметили что-либо из следующего, позвоните врачу вашего ребенка.
Ваш ребенок выглядит так, будто ему труднее дышать. Вы можете заметить, что он дышит быстрее или медленнее, чем обычно, делает поверхностный вдох, раздувает или втягивает ноздри.
Кожа вашего ребенка вокруг губ становится синей.
Ваш ребенок не набирает вес.
Если у вас есть вопросы или опасения, обязательно спросите врача или медсестру вашего ребенка.
Ларингомаляция (PDF)
HH-I-332 Редакция 15 марта 2011 г., Национальная детская больница, 2011 г.
Стридор новорожденного
Стридор новорожденного
важное условие, во многих случаях подразумевающее
надвигающаяся катастрофа с очень скомпрометированной
дыхательные пути.Это знак, который нужно учитывать
с остальным анамнезом и осмотром
выводы и соответствующие расследования должны
затем предпринять меры для подтверждения источника
шум. Новорожденных со стридором следует лечить
в мультидисциплинарной среде клиницистами
знакомы со сложной физиологией этих
детей, и с доступом к множеству
медико-хирургические исследовательские и
терапевтические возможности, необходимые для оказания первоклассной помощи.
1. Введение
Неонатальная жизнь предполагает реадаптацию газообмена из внутриматочной среды во внематочную. Стридор в этот период отражает критическую обструкцию дыхательных путей, которая могла быть ожидаемой или совершенно неожиданной. С появлением более совершенных исследований в матке, более широким распространением устоявшихся терапевтических практик в неонатальных условиях и технологическими достижениями, которые позволяют видеть больше детей, приходящих в этот мир в более раннем гестационном возрасте, возникает проблема — лучше осознавать потребности новорожденных. и знать, когда вмешаться.В современных отделениях интенсивной терапии новорожденных (ОИТН) младенцы с массой тела более 1000 граммов и рожденные после 27 недель беременности имеют примерно 90% шанс на выживание, и у большинства из них нормальное неврологическое развитие [1].
Стридор можно определить как резкий скрипящий звук в результате частичной обструкции ларинготрахеальных дыхательных путей. На латыни, первоначально в 17 веке, это означало «скрипеть». Стридор у новорожденного потенциально означает надвигающуюся катастрофу с очень сильно нарушенными дыхательными путями.Стридор, наблюдаемый при значительном надгрудинном толчке и межреберной рецессии, указывает на то, что дыхательные пути могут находиться на расстоянии менее миллиметра от полной непроходимости. Тем не менее, стридор является признаком, который необходимо учитывать вместе с остальной историей и результатами обследования, после чего следует провести соответствующие исследования для подтверждения источника шума. Его тяжесть, а также тяжесть сопутствующего респираторного дистресс-синдрома определяют срочность, с которой необходимо продолжить обследование, начиная от хорошо новорожденного с легким стридором, отсутствием респираторного дистресса и полноценным кормлением, и заканчивая тяжелым нарушением дыхательных путей, требующим немедленного вмешательства. вмешательство.
2. Анатомо-физиологические аспекты
У новорожденного намного более узкие дыхательные пути по сравнению с младенцем, ребенком или взрослым. Средний диаметр надгортанника составляет около 4,0 мм, и влияние любой формы отека на дыхательные пути такого размера часто повторяется, цитируя обратную зависимость сопротивления потока от радиуса в трубчатой структуре (сопротивление) [2] .
Неонатальная респираторная физиология и ее влияние на размер дыхательных путей подчеркивают адаптивные потребности плода в отношении жизни вне матки.Их легочный кровоток в матке относительно ограничен относительной гипоксией плода, но это радикально меняется, когда установление дыхания вызывает повышение содержания кислорода и улучшение легочного кровотока. Это может вызвать развитие необычных кровеносных сосудов, которые внешне вдавливают дыхательные пути, как это наблюдается у пациентов с сосудистыми кольцами.
Грудная стенка новорожденного стабилизирует очень эластичную грудную клетку, в то время как легкое новорожденного, особенно у недоношенного ребенка, составляет только 10–15% от общей емкости легких.Для увеличения функциональной остаточной емкости легкого новорожденного ребенок использует (1) торможение выдоха — использование активного сужения голосовой щели во время выдоха, (2) постоянное активное использование инспираторных мышц во время выдоха и (3) высокую частоту дыхания [3] ]. Отсутствие этих рефлексов, особенно у ребенка с двусторонним поражением голосовых связок, вызывает двухфазный стридор и быструю декомпенсацию, отсюда необходимость немедленной интубации или возможного постоянного положительного давления в дыхательных путях (CPAP) для поддержания проходимости дыхательных путей.Однако в неврологически функционирующих дыхательных путях эта физиология также допускает бесконтактную анестезию со спонтанным дыханием, что является обычной практикой, когда большинство отделений проводят микроларингоскопию и бронхоскопию.
3. Обследование новорожденного
Стридор — это всего лишь симптом болезни, который требует полного анамнеза и обследования. В анамнезе должны быть описаны антенатальные и перинатальные события, затрудненное дыхание, кормление и рост, а также предыдущая интубация или интенсивная терапия. Это должно быть дополнено поиском тахипноэ, хрюканья, втягивания грудной стенки внутрь, расширения носа и центрального цианоза.
Гибкая ларингоскопия в настоящее время широко используется при оценке стридора новорожденных. Процедура переносится хорошо и может проводиться как через нос, так и через рот. Он дает хороший обзор надгортанника и голосовых связок, позволяя оценить динамику дыхательных путей у бодрствующего ребенка. Однако гибкая ларингоскопия не позволяет ни пальпировать, ни визуализировать подсвязочный канал и трахею. Таким образом, большинству детей со стридором, отличным от простой легкой ларингомаляции, по-прежнему требуется жесткая ларинготрахеобронхоскопия.
Дополнительным исследованием, полезным при оценке новорожденных с обструкцией дыхательных путей, является полисомнография. Многие дети с обструкцией дыхательных путей страдают апноэ во сне, поскольку мускулатура верхних дыхательных путей расслабляется во время сна. Следовательно, полисомнография может быть полезным инструментом при обследовании этих новорожденных и принятии решения об оперативном лечении. Он позволяет рассчитывать некоторые переменные, такие как индекс респираторного дистресс-синдрома (RDI), частоту и серьезность десатурации кислородом (pO 2 ) и задержку диоксида углерода (pCO 2 ).Если у новорожденного такие значения, как RDI> 20 / час, частые десатурации pO 2 ниже 90% или уровни pCO 2 выше 50 мм рт. Ст., У этого ребенка может быть надвигающаяся дыхательная недостаточность.
Этиология стридора у новорожденных обычно врожденная. В исследовании, посвященном стридору у 219 пациентов, Холингер подтвердил это, также отметив, что более половины детей в возрасте до 2,5 лет имели аномалии гортани [4]. Он также обнаружил, что у 45,2% детей со стридором была другая ассоциированная патология, связанная с дыхательными путями, что побудило к утверждению, что при оценке стридора не делают заключение ларингоскопией, а проводят эндоскопическое исследование всего трахеобронхиального дерева [4].
В значительной части неонатальных заболеваний стридор возникает в результате лежащей в основе врожденной аномалии, вероятно, усугубленной воспалительным компонентом. Также важно оценить реакцию стридора на более консервативные варианты лечения. К ним относятся реакция на адреналин / адреналин при крупе или стенозе подсвязочного пространства, использование положительного давления в конце выдоха (PEEP) или постоянного положительного давления в дыхательных путях (CPAP) при трахеомаляции, использование ингаляционных и системных стероидов при воспалении или изменении организма позиционирование как при ретрогнатии нижней челюсти.
Сужение ларинготрахеального пути может происходить на уровне надгортанника, голосовой щели, подсвязочного пространства, шейной или грудной трахеи. Это может быть состояние, присущее этим областям, внутреннее состояние структур, несущих потоки воздуха в легкие и из легких, или вызванное наличием материала внутри самого просвета. Стридор означает обструкцию ларинготрахеальных дыхательных путей, и его следует отличать от других шумов в дыхательных путях; Стертор — это шум, вызываемый глоткой, который часто усиливается, когда ребенок спит (типичным примером является храп), в то время как хрипы являются результатом сужения бронхов.Стридор, как правило, ухудшается, когда ребенок бодрствует, ест или расстроен.
Было много способов описать слышимый шум, включая качество звука, место препятствия и патологический диагноз. Однако классическое описание его отношения к дыханию остается в силе. Стридор может быть инспираторным, выдыхательным или и тем, и другим. Длина компонента выдоха часто позволяет предположить, где происходит максимальное сужение или где давление закрытия является наиболее критическим.Если звук является чисто инспираторным, большинство отоларингологов предполагают, что непроходимость, скорее всего, надгортанная, и дифференциальный диагноз, вероятно, будет включать ларингомаляцию или что-то, вызывающее втягивание надгортанных структур во время вдоха ребенка. Стридор из-за обструкции на уровне голосовых связок или подсвязочного канала часто бывает двухфазным. Обструкция трахеи вызывает преимущественно экспираторный стридор, при фиксированных обструкции (в отличие от динамических) стридор будет двухфазным.
4. Обструкция надгортанных дыхательных путей
Ларингомаляция — наиболее частая причина стридора новорожденных. Типичным является стридор на вдохе, который ухудшается при кормлении, возбуждении и положении на спине. Прямая визуализация гортани обычно демонстрирует коллапс надгортанника, плотные черноногие складки, омега-образный надгортанник, ретрофлексированный надгортанник и выпадение надгортанника. Считается, что это состояние является результатом нервно-мышечного изменения тонуса гортани с последующим коллапсом надгортанных структур [5].Многие дети с ларингомаляцией испытывают рефлюкс [6]; Хотя это может быть результатом очень отрицательного внутригрудного давления, рефлюкс сам по себе может способствовать отеку и, следовательно, нарушению дыхательных путей.
Ларингомаляция также связана с другими врожденными аномалиями, такими как неврологические проблемы или синдром Дауна, и до двух третей могут иметь ассоциированное поражение вторых дыхательных путей.
У большинства детей ларингомаляция протекает в легкой форме и проходит самостоятельно [7], диагноз подтвержден при гибкой ларингоскопии.Однако у детей с тяжелыми или атипичными особенностями эндоскопия жестких дыхательных путей оправдана, а хирургическая супраглотопластика используется для облегчения симптомов с хорошими результатами в подавляющем большинстве случаев.
В неонатальной практике другой частой причиной надгортанной непроходимости является удерживающая слизь киста в валлекуле. Наше подразделение наблюдало многие из этих случаев, и состояние хорошо описано в литературе [8]. Они часто смещают надгортанник кзади, вызывая стридор и очевидные опасные для жизни эпизоды, которые легко исправить с помощью процедуры марсупиализации кистозного поражения.
5. Обструкция голосовых путей
Обструкция голосовых связок, вызванная нарушением движения голосовых связок (VCMI), является второй по частоте причиной стридора у новорожденных. В то время как двусторонний VCMI имеет тенденцию проявляться стридором и обструкцией дыхательных путей, пациенты с односторонним VCMI также могут иметь стридор, но дополнительно проявляются слабым плачем или затруднениями при кормлении из-за аспирации. Важно исключить поддающиеся коррекции нейронные аномалии, возникающие в результате ствола мозга, такие как мальформация Арнольда Киари, поскольку коррекция давления на миндалины мозжечка часто устраняет в анамнезе колеблющийся стридор и обструкцию дыхательных путей.На практике многие случаи одностороннего VCMI являются ятрогенными, приобретенными после спасающих жизнь внутригрудных процедур, таких как восстановление трахеопищеводного свища или кардиоторакальные процедуры при сердечных аномалиях у новорожденного. Поврежденный возвратный гортанный нерв, часто затрагивающий левую голосовую связку, позволяет связке находиться в парамедианном положении, которое втягивается при вдохе. Иногда черствый член может вращаться кнутри, и голосовая связка может располагаться по средней линии, и слышен стридор при напряжении.При одностороннем VCMI используются различные методы лечения, включая речевую и языковую терапию, медиализацию голосовых связок и реиннервацию гортани [9].
Управление двусторонней VCMI направлено на обеспечение безопасности проходимости дыхательных путей. Традиционно это достигалось с помощью трахеостомии, которая может потребоваться примерно у половины пациентов. Однако в последнее время использовались различные открытые и эндоскопические процедуры, чтобы попытаться избежать трахеостомии [9]. Ботулинический токсин в перстневидную мышцу, иссечение перстневидной мышцы, латерализация голосовых связок и эндоскопическое расщепление заднего перстневидного хряща с использованием трансплантата реберного хряща были предложены в неонатальном или раннем младенческом периоде, в то время как другие методы, включая аритеноидэктомию голосовых связок, хордотомию или рецидивирующую ларингеальную Повторная иннервация нерва предназначена для детей старшего возраста с установленной трахеотомией, требующей деканюляции.Вероятно, что у двух третей детей движение по крайней мере в одной голосовой связке со временем восстановится, поэтому любые агрессивные ранние хирургические вмешательства должны быть сбалансированы с тем фактом, что дыхательные пути могут улучшиться спонтанно, тем более что любое хирургическое расширение дыхательных путей может быть достигнутым за счет хорошего голоса в будущем.
Важным диагнозом при VCMI является дифференциация паралича / паралича и фиксации голосовых связок из-за стеноза задней голосовой щели. Последнее — приобретенная проблема, которая стала более частой в нашей практике с увеличением числа крайне недоношенных детей, нуждающихся в ЛОР-воздействии.Эти дети нуждаются в интенсивной терапии новорожденных, часто страдают респираторной недостаточностью после аспирации мекония и могут потребовать эндотрахеальной интубации в течение длительного периода времени. К сожалению, эндотрахеальная трубка может вызвать значительное раздражение голосовой щели, что, в свою очередь, вызывает грануляцию задней голосовой щели. Приобретенный стеноз подсвязочного канала встречается редко в результате лучшего понимания патофизиологии этого состояния, но в некоторой степени он был заменен стенозом задней голосовой щели.Известно, что дети, родившиеся на 24–26 неделе беременности, с массой тела менее 1000 г, страдают хроническими заболеваниями легких, и небольшой процент этих новорожденных, по-видимому, значительно реагирует на наличие эндотрахеальной трубки. Диагноз гранулем гортани ставится только при пробной экстубации, и у этих новорожденных могут развиться межчелюстные спайки и, к сожалению, стеноз задней голосовой щели.
Неврологическая дисфункция дыхательных путей гортани также может проявляться в виде воспаления в голосовой щели.В классическом описании гастроэзофагеальной рефлюксной болезни (ГЭРБ) с вовлечением гортани считается, что она возникает, когда гортань омывается рефлюксатом, и чувствительность гортани изменяется [5]. Это может проявляться аномальным сужением гортани под воздействием раздражителей, вызывающих периодическое спазматическое сужение гортани новорожденного, или отсутствием сужения, позволяющим значительно аспирать содержимое желудка, что приводит к симптомам нижних дыхательных путей, имитирующим бронхиолит или реактивное заболевание дыхательных путей.Аспирация бронхов, подтверждающая наличие макрофагов, содержащих липиды, наряду с признаками вымощенной булыжником слизистой оболочки трахеи может помочь педиатру рассмотреть возможность длительной антирефлюксной терапии или, в некоторых случаях, фундопликации, если максимальная терапия не помогает предотвратить текущие респираторные проблемы.
Другой необычной причиной обструкции голосовой щели является расщелина гортани [10]. Этого можно не заметить при стандартной фиброоптической назендоскопии и даже при ларингоскопии под наркозом. Золотым стандартом было бы выполнить микроларингоскопию с бинокулярным зрением и раздвинуть задние структуры гортани в сторону и исследовать глубину межчелюстных тканей.Избыточные или обильные ткани в этой области могут предупредить о возможности. Однако помимо аспирации у детей с расщелиной гортани наблюдается стридор, когда ткани прилегают больше, чем обычно, а вдох приводит к легкому втягиванию голосовых складок и неприятному шуму. Некоторые предполагают, что частота расщелины гортани увеличивается, хотя это может просто отражать большую осведомленность врачей. Небольшие щели можно исправить эндоскопически, но более длинные со значительной щелью между гортани / трахеей и пищеводом требуют внешнего доступа.
Врожденные перепонки голосовой щели могут проявляться как афония или пронзительный кошачий крик вместе со стридором. Сети могут быть связаны с генетическим изменением, как при велокардиофациальном синдроме [11]. В редких случаях перепонка бывает тонкой и ограничивается только гортани, при этом перепонка может быть разорвана во время интубации или ее можно разрезать серповидным ножом. Чаще перепонка толстая с подсвязочным отделом, которое на боковой рентгенограмме выглядит как парус. Их нельзя лечить простым разделением, но может потребоваться трахеостомия, открытая пластика, установка киля (или использование надхрящницы для предотвращения повторного формирования паутины) и лечение связанного с ней стеноза подсвязочного канала.Раньше считалось возможным хирургическое вмешательство, когда ребенок старше, но улучшение неонатальной анестезии и микроскопических методов позволило проводить эту форму операции в более раннем возрасте, что позволило избежать трахеотомии [11].
Рецидивирующий респираторный папилломатоз редко является причиной неонатального стридора, но он может проявляться нормальным дыханием при рождении, а затем прогрессирующим двухфазным стридором и потерей голоса либо в младенчестве, либо в младенчестве. Есть надежда, что недавнее внедрение вакцин против вируса папилломы человека (типы 6 и 11) снизит заболеваемость этим заболеванием [12].В настоящее время это состояние чаще всего лечат с помощью повторного удаления массы с использованием микродебридера, холодного оружия или лазера CO 2 .
6. Подсвязочная обструкция дыхательных путей
Подсвязочный стеноз (SGS) в настоящее время наблюдается относительно нечасто. Если стеноз ранний и мягкий, можно использовать период покоя гортани (2-недельная интубация без нарушений), в то время как любая грануляционная ткань может быть удалена, а любые подсвязочные кисты, образующиеся из-за закупорки слизистых желез, могут быть сняты или удалены ( использование холодного оружия для минимизации повреждения тканей).Если возникают проблемы с повторяющимися грануляциями, можно использовать митомицин С. Баллонная дилатация также полезна, но если отек серьезный или кажется, что он прогрессирует, можно использовать расщепление перстневидного хряща (эндоскопическое или открытое). Как только стеноз устойчив и установлен, может потребоваться трахеостомия с хирургическими вариантами ларинготрахеальной реконструкции (LTR) или крикотрахеальной резекции (CTR).
Чтобы избежать трахеостомии, недавно было рекомендовано раннее хирургическое вмешательство для SGS; исследование пациентов в возрасте до 12 месяцев, перенесших одноэтапную LTR, показало, что трахеостомии удалось избежать у 9 из 10 новорожденных и младенцев [13].Интересно, что более раннее радикальное хирургическое вмешательство, чтобы избежать трахеостомии, также было предложено в последовательности Робина, где дистракционный остеогенез и глоссопексия позволили избежать трахеостомии у 6 младенцев, у которых не удалось CPAP [14]. Точно так же ранняя послеродовая хирургия рекомендуется детям с опухолями, вызывающими обструкцию дыхательных путей. Несмотря на то, что недавние тенденции к раннему хирургическому вмешательству могут быть заманчивым способом избежать трахеостомии, это технически сложнее, с повышенными физиологическими рисками, в том числе связанными с потерей крови.
Неудачная экстубация все еще является распространенным сценарием, требующим вмешательства ЛОР в неонатальном или педиатрическом отделении интенсивной терапии. Обычно экстубацию следует предпринимать, когда ребенок относительно здоров и имеет утечку вокруг трубки. Хотя важно убедиться, что нет респираторной причины неудачной экстубации, с точки зрения ЛОР следует искать как связанные с интубацией, так и другие причины ЛОР. Требуется тесное сотрудничество между различными специальностями.
Подсвязочная гемангиома — еще одно заболевание, лечение которого за последние три года изменилось.У ребенка двухфазный стридор, и в 50% случаев возможно поражение кожи. На простом рентгеновском снимке столба трахеи виден классический асимметричный столб воздуха в подсвязке, и они фантастически реагируют на пропранолол, так что операция трахеотомии при этом состоянии осталась в прошлом. По-прежнему существуют разногласия относительно продолжительности лечения, необходимости хирургического вмешательства в некоторых случаях и необходимости одновременного лечения системными стероидами.Однако существует консенсус в отношении того, что после эндоскопического подтверждения этого диагноза недоношенные новорожденные или новорожденные с низкой массой тела должны находиться под тщательным наблюдением на предмет эпизодов гипогликемии на фоне лечения пропранололом [15].
7. Обструкция трахеи
Трахеомаляция вызывается либо слабостью стенки трахеи из-за изменений соотношения хряща и мышцы, либо из-за гипотонии трахеальной мышцы, вызывающей выпадение переднего отдела [16]. Он может быть первичным или вторичным по отношению к другому поражению (например, трахеопищеводному свищу или сосудистой мальформации).Трахеомаляция, сопровождающая трахеально-пищеводный свищ у новорожденного, обычно профессионально лечится общим детским хирургом в нашем учреждении. Однако дети с другими ассоциированными аномалиями средней линии расщелины, такими как синдром VATER, нуждаются в более тщательном обследовании. За прошедшие годы было много сообщений о случаях, когда у этих детей развился дивертикул трахеи, который продолжает вызывать значительную обструкцию, несмотря на квалифицированную хирургическую помощь [17]. Хирургическое лечение трахеомаляции варьируется в зависимости от локализации, поскольку верхняя трахеомаляция более подвержена трахеопексии с вовлечением грудины, тогда как нижняя трахеомаляция включает прикрепление к магистральным сосудам или, возможно, даже скользящую трахеопластику с первичным анастомозом.
Врожденный стеноз трахеи с полными кольцами трахеи часто связан с наличием легочного слинга. Эта перевязка является результатом развития левой легочной артерии, отходящей от правой легочной артерии, обвивая себя вокруг трахеи на стадии развития плода. Отсутствие развития трахеи или С-образного трахеального кольца при рождении приводит к заболеванию, и если оно затрагивает значительный сегмент трахеи, у новорожденного развивается стридор типа стиральной машины, характерный для этих случаев. .Хирургическое лечение этих случаев часто включает перемещение левой легочной артерии в легочный ствол подальше от области сужения, в то время как коррекция сужения трахеи может выполняться либо с помощью скользящей трахеопластики, как рекомендует Grillo [18], либо с помощью множество других альтернатив, таких как трахеопластика аутотрансплантатом, трахеопластика перикардиальной заплатой или хирургия стента.
Трахея также может быть закупорена сосудистыми аномалиями [19]. Было описано множество причин.Общие сосудистые кольца, полностью окружающие трахею, включают двойную дугу аорты и правую дугу аорты с аберрантной левой подключичной артерией. Обычные сосудистые слинги, оказывающие неокружное давление, представляют собой аберрантную безымянную артерию и слинг легочной артерии, образованные аномальной левой легочной артерией. Часто требуется хирургическая коррекция основной патологии, но вторичная трахеомаляция также является частым осложнением.
8. ХАОС и ВЫХОД
Клиническая практика сильно изменилась за последние несколько десятилетий, поскольку достижения в области ультразвуковой диагностики облегчили точную антенатальную диагностику проблем с дыхательными путями и, следовательно, надлежащее перинатальное ведение.Типичные пренатальные ультразвуковые признаки при врожденном синдроме обструкции верхних дыхательных путей (ХАОС) включают многоводие, расширенную трахею и повышенную эхогенность легких, плоскую или перевернутую диафрагму и асцит [20]. Также можно увидеть истинную причину обструкции дыхательных путей. In utero MRI — полезный метод визуализации в дополнение к ультразвуку.
Когда обструкция дыхательных путей во время родов вызывает беспокойство, в последние несколько лет использовалась процедура ex utero intrapartum (EXIT) для спасения жизней этих детей, которые могли бы умереть ранее.В дополнение к EXIT, также была рекомендована фетоскопическая хирургия [21]: создание перфорации в закупоренной гортани позволяет выделять жидкость из закупоренных легких, чтобы способствовать развитию легких, и хотя EXIT все еще требуется, есть надежда, что долгосрочное респираторное функция будет лучше.
9. Заключение
Стридор у новорожденного означает очень серьезную обструкцию дыхательных путей, требующую неотложной помощи. Подход к лечению должен осуществляться клиницистами, знакомыми со сложной физиологией этих детей, которые могут быть еще очень незрелыми в своем развитии.В исследовательском арсенале есть медицинские и хирургические варианты, и использование этих новейших технологических достижений может быть необходимо для временного ограничения их состояния до тех пор, пока они не вырастут из своего состояния. Важно отметить, что это междисциплинарное состояние, и хорошее общение между профессионалами и лицами, осуществляющими уход, может привести к долгосрочным успешным результатам для этих очень уязвимых членов нашего общества.
Врожденный стридор: необычное проявление коарктации аорты
Backer CL, Ilbawi MN, Idriss FS, DeLeon SY (1989) Сосудистые аномалии, вызывающие сдавление трахеи и пищевода. J Thorac Cardiovasc Surg 97: 725–731
CAS
PubMed
Google Scholar
Chen L-C, Huang J, Wang C (1999) Диагностика синдрома аномальной безымянной артерии с помощью спиральной компьютерной томографии с трехмерной реконструкцией дыхательных путей: отчет об одном случае. Acta Paediatr Sin 40: 124–127
CAS
Google Scholar
Fearon B, Shortreed R (1963) Трахеобронхиальная компрессия врожденными сердечно-сосудистыми аномалиями у детей: синдром апноэ. Энн Отол Ринол Лайнгол 72: 949–969
CAS
Статья
Google Scholar
Fyler DC, Buckley LP, Hellenbrand WE и др. (1980) Отчет о региональной программе кардиологии новорожденных в Новой Англии. Педиатрия 65: 432–436
Google Scholar
Хокинс Дж. А., Бейли У. В., Кларк С. М., Айви Т. Д. (1992) Необычная компрессия трахеи артерии: лечение путем реимплантации безымянной артерии. J Thorac Cadiovasc Surg 103: 678–682
CAS
Google Scholar
Kussman BD, Geva T, McGowan FX (2004) Сердечно-сосудистые причины компрессии дыхательных путей. Педиатр Анаест 14: 60–74
Статья
PubMed
Google Scholar
McLaughlin RBJ, Wetmore RF, Tavill MA, Gaynor JW, Spray TL (1999) Сосудистые аномалии, вызывающие симптоматическое трахеобронхиальное сжатие. Ларингоскоп 109: 312–319
Артикул
PubMed
Google Scholar
Moes CAF, Izukawa T, Trusler GA (1975) Неопределенное сжатие трахеи артерии. Арка Отоларингол 101: 733–738
CAS
Статья
PubMed
Google Scholar
Mustard WT, Bayliss CE, Fearon B, Pelton D, Trusler GA (1969) Сдавление трахеи безымянной артерией у детей. Ann Thorac Surg 8: 312–319
CAS
Статья
PubMed
Google Scholar
Rothman A (1998) Коарктация аорты: обновленная информация. Curr Probl Pediatr 28: 37–60
Статья
Google Scholar
Саманек М., Славик З., Зборилова Б. и др.(1989) Распространенность, лечение и выявление сердечных заболеваний у живорожденных детей: проспективный анализ 91 823 живорожденных детей. Педиатр Кардиол 10: 205–211
CAS
Статья
PubMed
Google Scholar
Schneeweiss A, Blieden LC, Shem-Tov A, et al. (1982) Коарктация аорты с врожденной немангиомой лица и шеи и аневризма дилатации подключичной или безымянной артерии. Сундук 82: 186–187
CAS
Статья
PubMed
Google Scholar
Strife JL, Baumel AS, Dunbar JS (1981) Сдавление трахеи безымянной артерией в младенчестве и детстве. Радиология 139: 73–75
CAS
Статья
PubMed
Google Scholar
Свищук Л.Е. (1971) Переднее вдавливание трахеи в младенчестве и раннем детстве: нормально или ненормально? Am J Roentgenol 112: 12–17
CAS
Статья
Google Scholar
Vanderbilt Children’s Hospital, Нашвилл, TN
Ларингомаляция является наиболее частой причиной шумного дыхания (стридора) у младенцев и детей.Это наиболее частая врожденная аномалия (врожденный порок) голосового аппарата (гортани).
Ларингомаляция лучше всего описывается как гибкая ткань над голосовыми связками, которая попадает в дыхательные пути при вдохе младенца. Причина ларингомаляции и причина гибкости ткани неизвестны. Скорее всего, недоразвита та часть нервной системы, которая придает тонус дыхательным путям.
Симптомы ларингомаляции
У младенцев с ларингомаляцией наблюдается прерывистое шумное дыхание при вдохе, также называемое инспираторным стридором.Этот шум может уменьшаться или ухудшаться в зависимости от положения ребенка во сне или лежа.
Стридор на вдохе очень часто усиливается при возбуждении, плаче, возбуждении, кормлении или положении / сне на спине. Эти симптомы часто присутствуют при рождении и обычно возникают в течение первых 10 дней жизни. Однако шумное дыхание при ларингомаляции может начаться в любой момент в течение первого года.
Симптомы часто усиливаются или ухудшаются в течение первых нескольких месяцев после постановки диагноза, обычно в возрасте от четырех до восьми месяцев.Большинство младенцев с ларингомаляцией перерастают шумное дыхание в возрасте от 12 до 18 месяцев.
Другие симптомы, которые могут быть связаны с ларингомаляцией, включают:
- Проблемы с кормлением
- Плохая прибавка в весе (нарушение роста)
- Срыгивание пищей (рвота или срыгивание)
- Давиться пищей
- Гастроэзофагеальный рефлюкс (срыгивание кислоты из желудка)
- Втягивание груди и / или шеи (втягивание груди и / или шеи при дыхании)
- Цианоз (синеет)
- Апноэ (паузы на дыхании)
Степень ларингомаляции
Ларингомаляция может быть легкой, средней или тяжелой.Около 99 процентов младенцев с ларингомаляцией имеют легкую или умеренную ларингомаляцию.
Легкая ларингомаляция : У младенцев с легкой ларингомаляцией шумное дыхание (инспираторный стридор). Нет значительной обструкции дыхательных путей, проблем с кормлением или других симптомов, связанных с ларингомаляцией. Шумное дыхание раздражает лиц, осуществляющих уход, но не вызывает других проблем со здоровьем.
Младенцы с легкой ларингомаляцией обычно перерастают стридор в возрасте от 12 до 18 месяцев.Даже если у вашего ребенка может быть легкая ларингомаляция, все же важно следить за признаками и симптомами ухудшения ларингомаляции.
Умеренная ларингомаляция : Младенцы с умеренной ларингомаляцией имеют шумное дыхание или стридор на вдохе. Еще у них может быть:
- Проблемы с кормлением без плохой прибавки в весе (нарушение роста)
- Срыгивание пищей (рвота или срыгивание)
- Давиться пищей
- Гастроэзофагеальный рефлюкс (срыгивание кислоты из желудка)
- Легкое или умеренное втягивание грудной клетки и / или шеи (грудная клетка и / или шея втягиваются при дыхании), но без тяжелого дистресса
Младенцы с умеренной ларингомаляцией обычно перерастают стридор в возрасте от 12 до 18 месяцев, но им может потребоваться лечение гастроэзофагеального рефлюкса.Желудочная кислота, если она достигает верхней части пищевода и голосового аппарата, может вызвать отек гибкой ткани над голосовыми связками. Очень часто младенцам с ларингомаляцией средней или тяжелой степени требуются пероральные препараты для лечения гастроэзофагеального рефлюкса.
Даже если у вашего ребенка может быть умеренная ларингомаляция, все равно важно следить за признаками и симптомами ухудшения ларингомаляции.
Тяжелая ларингомаляция : Младенцы с тяжелой ларингомаляцией имеют шумное дыхание или стридор на вдохе.Еще у них может быть:
- Трудности с кормлением из-за плохой прибавки в весе (нарушение роста)
- Значительное втягивание груди и / или шеи (втягивание груди и / или шеи при дыхании)
- Значительный цианоз (синеет)
- Опасное для жизни апноэ (паузы при дыхании)
- Проблемы с сердцем или легкими, вызванные хронической кислородной недостаточностью (низкий уровень кислорода)
- Симптомы со стороны дыхательных путей, достаточно серьезные, чтобы вызвать несколько визитов в отделение неотложной помощи или больницу
Лишь один процент младенческой ларингомаляции — тяжелые случаи, которые обычно требуют хирургического вмешательства.
Диагностические тесты для младенцев с ларингомаляцией
Гибкая ларингоскопия : Этот метод необходим для подтверждения диагноза ларингомаляция. Освещенный эндоскоп или ларингоскоп вводят через нос или рот. Врач осматривает ткань над голосовыми связками, чтобы определить, является ли она гибкой. Верхние дыхательные пути также проверяются на наличие других проблем, которые могут способствовать шумному дыханию.
Рентгенография шеи и грудной клетки : У некоторых младенцев с ларингомаляцией также есть дополнительные проблемы с дыхательными путями, которые могут способствовать шумному дыханию.Рентгенография шеи и грудной клетки позволяет выявить другие проблемы в верхних дыхательных путях, трахее или трахее, груди и легких. Если рентгеновские снимки не соответствуют норме, могут быть рекомендованы дополнительные обследования.
Микроларингоскопия и бронхоскопия (ML&B) : ML&B выполняется в операционной под общим наркозом. Врач осматривает голосовой аппарат и трахею с помощью прицела с подсветкой. Область проверяют на наличие проблем с дыхательными путями, которые могут способствовать шумному дыханию. ML&B может быть рекомендован, если рентгеновские снимки показывают отклонения от нормы или есть подозрение на другие проблемы с дыхательными путями в дополнение к ларингомаляции.
Датчик импеданса : Существует высокая частота гастроэзофагеального рефлюкса у младенцев с умеренной или тяжелой ларингомаляцией. Могут быть назначены пероральные препараты или рекомендован импедансный зонд для проверки степени гастроэзофагеального рефлюкса. Зонд импеданса — это небольшая трубка, вводимая через нос в пищевод. Трубка подключена к измерительному устройству, которое регистрирует, сколько раз кислота покидает желудок и достигает пищевода. Этот тест измеряет кислотность в верхнем пищеводе возле горла и в нижнем пищеводе непосредственно перед желудком.Зонд импеданса помещается во время рентгеновского снимка.


