Токсокароз: враг из детской песочницы
Малыш, с сосредоточенным видом копающийся в песке, вызывает умиление у своих родителей и дарит уставшим мамам минуты покоя. Однако врачи предупреждают: за свое спокойствие родители могут заплатить здоровьем собственного ребенка. У маленьких детей совсем нет санитарной культуры, а родителям не всегда легко уследить за чистотой рук своего малыша. Личинки глистов — основной фактор риска для здоровья маленького любителя песочных куличей.
Детские песочницы, расположенные в неогороженных дворах, — рассадники токсокары или собачьих (реже кошачьих) глистов. В Европе, если хозяин ведет свою собаку на прогулку, то обязательно берет с собой пакетик с совком. Когда собака опорожнила свой кишечник, хозяин тут же убирает за ней. У нас ничего подобного нет, поэтому возникает опасность инфицирования детей. По статистике 80% песочниц в России заражены яйцами токсокар.
Основным источником заражения для человека являются собаки, особенно щенки.Инфицированнось собак токсокарами по данным в среднем составляет 15 – 20%. Инвазионные яйца обнаруживаются на шерсти как домашних, так и бездомных кошек и собак. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5-36 суток, становясь заразными. А заразность яиц сохраняется в почве длительное время, в компосте — несколько лет. Человек заражается при проглатывании заразных яиц. Не исключено заражение при употреблении термически недостаточно обработанных тканей резервуарных хозяев — свиней, ягнят, цыплят и др.
Наиболее уязвимы для заражения токсокарозом дети в возрасте от одного до шести лет. Словом, те, кто способен часами самозабвенно строить песочные замки, пока взрослые, «выгуливающие» их, спокойно сидят на лавочке. Более старшие дети и даже молодые взрослые, тоже могут болеть этим видом гельминтоза.Есть некоторые категории взрослых людей, которые по роду своей профессиональной деятельности, тоже могут заразиться токсокарами. Это ветеринары, рабочие коммунального хозяйства, дворники, садоводы – любители. Немалую роль в распространении (растаскивании) яиц токсокар играют насекомые, чаще тараканы. Японские ученые даже доказали, что тараканы питаются яйцами токсокар, причем до 25% они потом их выделяют в жизнеспособном состоянии.
Это ветеринары, рабочие коммунального хозяйства, дворники, садоводы – любители. Немалую роль в распространении (растаскивании) яиц токсокар играют насекомые, чаще тараканы. Японские ученые даже доказали, что тараканы питаются яйцами токсокар, причем до 25% они потом их выделяют в жизнеспособном состоянии.
Хотя заразиться можно в течение года, на летне-осенний период приходится наибольшее количество случаев по той простой причине, что в это время число яиц паразитов в почве и контакт с ней максимальны.
Поговорим более подробно: что же такое токсокароз и как его избежать?
Токсокароз – это заболевание до нынешнего времени еще недостаточно изученное, даже несмотря на тот факт, что по степени распространенности он в наших широтах удерживает третье место после болезни энтеробиоза (это поражения острицами) и аскаридоза. Необходимо отметить, что человек финальным «пунктом назначения» токсокары не является (окончательный хозяин данного паразита — собака), и, проникнув в организм человека, гельминт не развивается в дальнейшем. Человек для токсакар является промежуточным или случайным хозяином. Сразу отмечу, что для людей этот вид гельминтоза не заразен, то есть от человека к человеку он не передается. Но, тем не менее, наличие этой инвазии в организме человека имеет неприятные последствия, и вред от миграции, а также жизнедеятельности токсокары в организме человека может быть довольно велик.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и далее с током крови — мигрируют. В зависимости от того, куда с кровью разнеслись и где осели личинки, будет соответствующая клиническая картина заболевания. Личинки токсокар могут локализоваться в самых различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. Но чаще всего страдают печень, легкие, глаза. Если поражены легкие, то возможны образования гранулем с картиной бронхопневмоний и вплоть до бронхиальной астмы. Если личинки осели в головном мозге, то будут проявляться неврологические симптомы, если это кожа – то это будут зудящие высыпания.Глазной токсокароз связывают с заражением человека минимальным количеством личинок. Течение болезни — от нескольких месяцев до нескольких лет. Практически всегда токсокарозом поражается только один глаз. Личинки токсокар сохраняют жизнеспособность в течение длительного времени (месяцы, годы). Личинки, осевшие в тканях, пребывают в «дремлющем» состоянии, а затем под влиянием благоприятных факторов активизируются и продолжают миграцию. С течением времени часть личинок инкапсулируется и постепенно разрушается внутри капсулы. Личинка в организме человека может выживать до 10 лет.
Если поражены легкие, то возможны образования гранулем с картиной бронхопневмоний и вплоть до бронхиальной астмы. Если личинки осели в головном мозге, то будут проявляться неврологические симптомы, если это кожа – то это будут зудящие высыпания.Глазной токсокароз связывают с заражением человека минимальным количеством личинок. Течение болезни — от нескольких месяцев до нескольких лет. Практически всегда токсокарозом поражается только один глаз. Личинки токсокар сохраняют жизнеспособность в течение длительного времени (месяцы, годы). Личинки, осевшие в тканях, пребывают в «дремлющем» состоянии, а затем под влиянием благоприятных факторов активизируются и продолжают миграцию. С течением времени часть личинок инкапсулируется и постепенно разрушается внутри капсулы. Личинка в организме человека может выживать до 10 лет.
Длительные хронические гельминтозы чреваты многим. Они могут даже задерживать физическое и умственное развитие ребенка.
Острые формы приносят также массу проблем. Ребенок становится вялым, слабым, по ночам скрипит зубами, ворочается, нередко худеет, плохо ест или, напротив, демонстрирует неумеренный аппетит. Его может мучить тошнота, зуд в заднем проходе, боли в животе. Могут наблюдаться кожные высыпания в виде крапивницы, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Токсокароз характеризуется тяжелым, длительным и рецидивирующим течением (от нескольких месяцев до нескольких лет), что связано с периодическим возобновлением миграции личинок токсокар. Клинические проявления в дальнейшем (как уже упоминалось выше) зависят от интенсивности заражения, распространения личинок в тех или иных органах. Самое страшное, что если ребенок маленький, он даже не сможет рассказать об этом. А болезнь будет прогрессировать. И связать ухудшающееся состояние малыша с его постоянными визитами в детскую песочницу неспециалист вряд ли сможет. Заметив эти симптомы, родители должны непременно обратиться к врачу.
Заметив эти симптомы, родители должны непременно обратиться к врачу.
Методы диагностики
Заболевание токсокароз, как было сказано выше, достаточно трудно выявить. Эозинофиллия — один из наиболее постоянных признаков для всех гельминтозов, в т.ч. и токсокароза, часто сопровождается лейкоцитозом и повышеием СОЭ. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70-80% и более. При биохимическом исследовании крови, нередко отмечается умеренное увеличение содержания билирубина и небольшое повышение активности печеночных ферментов. Но все это не специфичные для данного конкретного заболевания признаки. Еще можно сделать биопсию тканей, однако поскольку личинки постоянно мигрируют, в любом случае их непросто идентифицировать, поэтому подтвердить диагноз «токсокароз» — могут лишь лабораторные исследования.Поэтому единственный способ диагностики болезни — это анализ крови на присутствие специфических антител к токсокаре, ведь антитела к токсокаре могут определяться и при личиночной стадии их паразитирования.
Что нужно делать, чтобы избежать заражения?
Профилактика токсокароза включает общесанитарные мероприятия по охране от загрязнения окружающей среды фекалиями собак и кошек, дегельминтизацию их, создание в городах специальных мест для выгула собак и кошек. Необходима защита игровых детских площадок, парков, скверов от посещений животных; использование естественных факторов санации почвы (открытые солнечные лучи).
Но, как ни банально звучит, основная профилактика токсокароза включает соблюдение личной гигиены, обучение детей санитарным навыкам. А именно:
- Не пускать ребенка самостоятельно играть в открытых (не огороженных) песочницах в городских дворах.
- Следить, чтобы дети, играя в песочнице или с домашними животными, не тянули в рот грязные руки.
- Не забывайте приучать ребенка мыть руки, когда он приходит с улицы, перед едой (малышам тщательно мойте сами).

- Нельзя в пищу использовать немытые продукты. Зелень, ягоды, овощи и фрукты, которые могут содержать частицы почвы, старательно нужно промывать проточной водой.
- А мясо, промежуточных хозяев паразита (это свиньи, дикие, домашние птицы), нужно подвергать тщательной термической обработке.
- Регулярно давать домашним животным для профилактики противоглистные препараты.
Лечение токсокароза
Лечение токсокарозадолжно проводиться исключительно по рекомендациям и под контролем врача. Применяют противонематодозные препараты: тиабендазол (минтезол), мебендазол (вермокс), медамин, немозол, диэтилкарбамазин (дитразина цитрат). Лечение глазного токсокароза проводят инъекциями депомедрола, с использованием фото- и лазерокоагуляции для разрушения токсокарных гранулем. В некоторых случаях лечение глазного и других форм токсокароза осуществляется хирургическими методами.
Проблема гельминтозов в педиатрии. Токсокароз. Что делать? Текст научной статьи по специальности «Клиническая медицина»
медицинским совет 2015 | № 14
Т.М. ЧЕРНОВА, к.м.н., Санкт-Петербургский государственный педиатрический медицинский университет Минздрава России
ПРОБЛЕМА ГЕЛЬМИНТОЗОВ В ПЕДИАТРИИ
ТОКСОКАРОЗ. ЧТО ДЕЛАТЬ?
Воздействие гельминтов на состояние здоровья детей очень разнообразно. Однако отрицательные результаты копроовоскопического анализа кала не исключают у ребенка глистную инвазию, в частности внекишечную локализацию паразитов. Основной причиной тканевых гельминтозов являются нематоды рода Тохосага, личинки которых мигрируют в организме, вызывая поражение внутренних органов, нервной системы, глаз, кожи. Наибольшую эффективность в лечении токсокароза демонстрирует албендазол, который способен проникать в ткани и вызывать гибель паразитов.
Ключевые слова:
глистные инвазии
токсокароз
дети
лечение
албендазол
К проблеме глистных инвазий в нашей стране относятся как к деликатной, и говорить о ней широко не принято. Поэтому врачи забывают, что гельминты способны вызвать самые серьезные заболевания у человека.
Наиболее часто гельминтозы встречаются в педиатрической практике. По статистике, ежегодно глистную инвазию переносят 200-300 тыс. детей, хотя специалисты уверены, что уровень зараженности гораздо выше. Воздействие гельминтов на состояние здоровья детей может быть разнообразным. Они вызывают дисфункцию желудочно-кишечного тракта (боли в животе, неустойчивый стул, метеоризм, тошноту), хроническую интоксикацию (длительный субфебрилитет, головную боль, снижение аппетита, раздражительность, быструю утомляемость, нарушение сна). Глисты способны подавлять работу иммунной системы — зараженные дети значительно чаще болеют острыми респираторными и кишечными инфекциями. Сенсибилизация продуктами обмена и распада гельминтов может являться причиной аллергодерматозов, характеризующихся клиническим полиморфизмом (крапивница, экземоподобные дерматиты, пруриго) и резистентностью к традиционной терапии, ухудшать течение других аллергических заболеваний (бронхиальной астмы, поллинозов). На фоне глистной инвазии формируется дисбактериоз кишечника, развиваются анемия и гипови-таминозы [1, 2].
Знание разнообразной клинической симптоматики гельминтозов позволяет педиатру заподозрить заболевание и провести лабораторную диагностику. При исследовании копрофильтрата можно обнаружить фрагменты паразитов, яйца и личинки, в крови — лейкоцитоз, эозино-филию, анемию, ускоренную СОЭ, значительный рост уровня общего 1дЕ, в копрограмме — признаки воспале-
ния, дисбиоза. Отрицательные результаты копроовоскопического анализа кала не исключают у ребенка глистную инвазию, поскольку, с одной стороны, время сбора материала не всегда совпадает с кладкой яиц паразитами, а с другой стороны, возможна внекишечная (тканевая) локализация паразитов.
Отрицательные результаты копроовоскопического анализа кала не исключают у ребенка глистную инвазию, поскольку, с одной стороны, время сбора материала не всегда совпадает с кладкой яиц паразитами, а с другой стороны, возможна внекишечная (тканевая) локализация паразитов.
Основной причиной тканевых гельминтозов являются нематоды рода Тоxocara, паразитирующие в половозрелом состоянии у плотоядных млекопитающих в основном семейств псовых — T. canis и кошачьих — T. mystax. Для человека основным источником являются собаки (преимущественно щенки, инфицирующиеся трансплацентар-но), у которых взрослые гельминты паразитируют в желудке и тонком кишечнике. Самки токсокар откладывают более 200 тыс. яиц в сутки, после чего они выделяются с фекалиями собак в окружающую среду, а также загрязняют шерсть животного. В почве через 2-3 нед. в яйцах созревают личинки, которые сохраняют жизнеспособность в течение длительного времени (рис. 1).
Наиболее часто гельминтозы встречаются в педиатрической практике. По статистике, ежегодно глистную инвазию переносят 200-300 тыс. детей,хотя специалисты уверены, что уровень зараженности гораздо выше
Человек инфицируется при заглатывании яиц гельминтов с землей, водой, немытыми овощами и фруктами, через грязные руки и т. п., загрязненные личинками токсокар. Чаще заражаются дети, т. к. они более тесно контактируют с домашними животными, землей, песком и обладают слабыми гигиеническими навыками. Среди взрослых в группу риска входят ветеринары, работники питомников и приютов для собак, рабочие коммунального хозяйства, огородники, продавцы овощной продукции. Существует мнение, что при непосредственном контакте с животными заразиться невозможно, поскольку для созревания яиц требуется как минимум 2 нед.Установлено, что важную роль в распространении токсокар играют тараканы, которые поедают большое количество яиц
медицинским совет 2015 | № 14
гельминтов и до 25% из них выделяют в жизнеспособном состоянии [4].
Высокий процент лиц с антитоксокарозными антителами в крови свидетельствует о большой интенсивности эпидемического процесса. Причем серологические признаки инвазированности во много раз превышают уровень регистрируемой заболеваемости. Так, по данным различных авторов, частота встречаемости токсокароза у населения в различных регионах России составляет от 3,3 до 9,2%, при этом количество инфицированных детей достигает 40-50% [5, 6].
Больной человек не опасен для других людей, поскольку является биологическим тупиком. В тонкой кишке из яиц токсокар высвобождаются личинки, проникают через слизистую оболочку кишки в кровоток и разносятся в различные органы, прежде всего в печень (где задерживается большая их часть) и в легкие (где проходят определенные стадии развития). Также личинки могут внедряться в глаза, скелетные мышцы, головной мозг, поджелудочную железу, миокард, лимфатические узлы. Мигрируя в организме человека, личинка повреждает ткани, оставляя по ходу движения кровоизлияния, воспалительные изменения и некрозы. В тканях образуются многочисленные эозино-фильные инфильтраты и гранулемы, в которых личинки в «дремлющем» состоянии сохраняются до 10 лет. В любой момент миграция личинок может возобновиться, поэтому токсокароз часто принимает длительное рецидивирующее течение. В центре гранулемы в дальнейшем появляется зона некроза, что со временем приводит к разрушению органа. Аллергизация организма инфицированного ребенка продуктами жизнедеятельности и распада токсокар запускает каскад иммунопатологических реакций -избыточное образование иммунных комплексов и развитие системных васкулитов [7].
Симптомы токсокароза очень разнообразны и зависят главным образом от локализации паразитов в организме человека, интенсивности заражения и степени иммунного ответа хозяина. Поэтому больные могут обратиться к врачам самых различных специальностей: педиатру, гастроэнтерологу, аллергологу, дерматологу, окулисту, неврологу и др.
В большинстве случаев инфицированность токсокара-ми длительное время протекает бессимптомно и выявляется случайно.
При наличии клинических проявлений в зависимости от преобладающих симптомов выделяют кожную, висцеральную, глазную и неврологическую формы.
Кожная форма токсокароза проявляется зудящими высыпаниями на коже в виде покраснения и локального отека (вплоть до экземы), особенно по ходу миграции личинок. Процесс может быть ограниченным или распространенным и иметь различную выраженность. Такие дети зачастую наблюдаются с диагнозами: пруриго (почесуха), атопический дерматит, рецидивирующая крапивница, себорейный дерматит, эритрокератодермия, розовый лишай и др. По разным данным, при специфическом обследовании у 10-25% больных диагностируется токсокароз [8, 9].
Висцеральный токсокароз — наиболее частая форма заболевания (до 95,5%), возникающая при массивном заражении, часто у детей с геофагией. Заболевание характеризуется длительной рецидивирующей субфебрильной лихорадкой, реже — фебрильной. Температура повышается обычно в полдень или вечером, сопровождаясь познабливанием. В 62% случаев температурная реакция наблюдается в период легочных проявлений. У ребенка наблюдаются недомогание, потеря аппетита, боли и вздутие живота, тошнота, иногда рвота, диарея (частый жидкий стул), снижение массы тела. Кроме того, отмечаются лим-фаденопатия (до 67%), в 70-80% случаев — гепатомегалия, реже — спленомегалия (около 20%). У трети пациентов заболевание сопровождается рецидивирующими высыпаниями на коже. Поражения бронхолегочной системы встречаются у 50-65% больных висцеральным токсокаро-зом и проявляются в виде бронхита (длительный сухой кашель, чаще в ночное время), приступов удушья с развитием дыхательной недостаточности, тяжелых пневмоний (могут протекать с осложнениями и заканчиваться смертельным исходом). совет 2015 | № 14
совет 2015 | № 14
вания, как правило, отсутствует. Обычно поражается один глаз (90,9%). Заболевание может проявляться в виде косоглазия, одностороннего снижения остроты зрения, выпадения части поля зрения, лейкокории, помутнения роговицы. При осмотре могут выявляться эозинофильные гранулемы в заднем отделе глаза (в стекловидном теле, сетчатке), увеит, папиллит, хориоретинит. Паразитарные гранулемы в тканях глаза нередко принимают за ретино-бластомы. При длительном процессе развиваются признаки хронического эндофтальмита. Течение болезни -от нескольких месяцев до нескольких лет. Поражение зрительного нерва личинкой токсокары может привести к односторонней слепоте [14, 15].
Симптомы токсокароза очень разнообразны и зависят главным образом от локализации паразитов в организме человека, интенсивности заражения и степени иммунного ответа хозяина. Поэтому больные могут обратиться к врачам самых различных специальностей: педиатру, гастроэнтерологу, аллергологу, дерматологу, окулисту, неврологу и др.
При поражении головного мозга личинками токсокар у детей очень часто изменяется поведение: ребенок становится гиперактивным, начинает хуже читать, нарушается внимание, отстает от здоровых детей по результатам нейропсихологических тестов, по моторной и познавательной функциям. Кроме того, могут наблюдаться судороги, эпилептиформные припадки. В тяжелых случаях возможно развитие менингита, энцефалита с остаточными явлениями в виде парезов, параличей [10].
Диагностика токсокароза достаточно сложна. Заподозрить глистную инвазию позволяет обычный клинический анализ крови, в котором отмечается лейкоцитоз с эозинофилией. Так как в организме человека токсокары, в отличие от других гельминтов, не достигают половозрелого состояния, выявить взрослых особей или их яйца в кале нельзя. ), титр которых зависит от интенсивности инвазии, локализации возбудителя и иммунного статуса инфицированного. В настоящее время используют иммунофер-ментный анализ (ИФА), обладающий достаточно высокой чувствительностью и специфичностью при висцеральной локализации гельминта (93,7 и 89,3% соответственно). Титры 1:800 и выше свидетельствуют о заболевании, а титры 1:200-1:400 — о носительстве [16, 17]. Кроме того, мигрирующие личинки можно выявить при гистологическом исследовании биоптатов пораженных тканей. При глазном токсокарозе уровень эозинофилов обычно в пределах нормы или незначительно повышен (до 6-9%). Серологические реакции обычно отрицательны, или
), титр которых зависит от интенсивности инвазии, локализации возбудителя и иммунного статуса инфицированного. В настоящее время используют иммунофер-ментный анализ (ИФА), обладающий достаточно высокой чувствительностью и специфичностью при висцеральной локализации гельминта (93,7 и 89,3% соответственно). Титры 1:800 и выше свидетельствуют о заболевании, а титры 1:200-1:400 — о носительстве [16, 17]. Кроме того, мигрирующие личинки можно выявить при гистологическом исследовании биоптатов пораженных тканей. При глазном токсокарозе уровень эозинофилов обычно в пределах нормы или незначительно повышен (до 6-9%). Серологические реакции обычно отрицательны, или
антитела выявляются в низком титре. В этих случаях помогает обнаружение личинки при офтальмологическом исследовании.
Дифференциальный диагноз токсокароза проводят с ранней стадией других гельминтозов (описторхоза, аскаридоза), стронгилоидозом, а также эозинофильной гранулемой, бронхиальной астмой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, протекающими с повышенным содержанием эозинофилов в периферической крови.
Лечение токсокароза проводится в амбулаторных условиях (тяжелые и осложненные формы — в стационаре). Специальная диета и прием слабительных не требуются. Препараты для лечения тканевых гельминтозов должны обладать высокой абсорбцией из ЖКТ, низкой токсичностью и поливалентным действием (взрослые особи и личинки). Кроме того, необходим широкий спектр проти-вопаразитарной активности, поскольку у детей достаточно часто встречаются полиинвазии: наиболее характерны двухсимбиотные (энтеробиоз + лямблиоз, энтеробиоз + аскаридоз, аскаридоз + трихоцефалез), из трехсимбиот-ных чаще выявляется сочетание энтеробиоз + лямблиоз + токсакароз [12, 18]. Спектр эффективных антигельминт-ных средств чрезвычайно узок, при этом для лечения тканевых гельминтозов у детей применяются только албендазол и мебендазол. к токсо-карам до 1:800 и более проводят повторные курсы лечения албендазолом [11].
к токсо-карам до 1:800 и более проводят повторные курсы лечения албендазолом [11].
На фоне терапии возможны тошнота, головокружение, повышение температуры тела, крапивница, связанные с токсическим действием продуктов разрушения токсокар.
Эти явления кратковременны и уменьшаются при приеме энтеросорбентов. Кроме того, в комплексе с противопа-разитарными препаратами, в особенности с албендазо-лом, применяются желчегонные средства. Учитывая возможное преходящее увеличение содержания печеночных ферментов, во время лечения или в качестве подготовки перед проведением дегельминтизации целесообразно назначать гепатопротекторы.
Лечение глазного токсокароза проводят субконъюн-ктивальными инъекциями Депо-Медрола, с использованием фото- и лазерокоагуляции для разрушения токсо-карных гранулем. В некоторых случаях используются хирургические методы.
Прогноз при своевременном выявлении и лечении токсокароза, как правило, благоприятный. Однако массивное поражение жизненно важных органов (миокард, центральная нервная система) может привести к летальному исходу.
К мерам профилактики токсокароза прежде всего относится соблюдение правил личной гигиены: ногти на руках ребенка должны быть коротко пострижены, тщательное мытье рук (после контакта с землей, песком, домашними животными), зелени, овощей и других пищевых продуктов, которые могут содержать частицы загрязненной почвы. Яйца возбудителей токсокароза покрыты липучим веществом, поэтому удалить их с рук, предметов обихода и обуви можно лишь при помощи моющих средств.
Домашним собакам периодически должны проводиться профилактические курсы лечения противоглистными препаратами. Наиболее эффективно лечение щенков в возрасте 4-5 нед. , а также беременных сук. И конечно же, необходима защита детских игровых площадок, территорий детских садов, парков, скверов от выгула животных.
, а также беременных сук. И конечно же, необходима защита детских игровых площадок, территорий детских садов, парков, скверов от выгула животных.
ЛИТЕРАТУРА
1. Копанев Ю.А. Глистные инвазии у детей. Практика педиатра, 2006: http://medi.ru/doc/ j01061016.htm.
2. Шрайнер Е.В. Гельминтозы в клинической практике педиатра: вопросы диагностики, терапии, профилактики. Русский медицинский журнал, 2013, 14: 773-777.
3. Pitetti RD. Visceral Larva Migrans (Updated; May 22, 2009)- http://emedicine.medscape. com/article/1000527-overview.
4. Overgaauw PA. Aspects of Toxocara Epidemiology: Human Toxocarosis. Critical Reviews in Microbiology, 1997, (23)3: 215-231.
5. Лебедева О.В. Эпидемиология токсокароза в Санкт-Петербурге. Автореф. дис…. канд. мед. наук, СПб., 2006: 23.
6. Хубирьянц В.В., Сергиенко А.А., Татарчук О.П. Терапевтические аспекты токсокароза человека и животных. http://vetfac.nsau.edu.ru/ new/text/confer/t03/33.htm.
7. Pawtowska-Kamieniak A, Mroczkowska-Juchkiewicz A, Papierkowski A. Henoch-Schoenlein purpura and toxocarosis. Pol. Merkur. Lekarski, 1998, 4 (22): 217-218.
8 Плотникова И.А., Медведева С.Ю. Клинико-морфологические особенности течения ато-пического дерматита и некоторых других форм дерматозов у детей, страдающих токсо-карозом. Аллергология, 1998, 4, http://www. mmm.spb.ru/Allergology/1998/4/Art5.php.
9. Humberta Ph, Niezboralab M, Salembierb R at al. Skin Manifestations Associated with Toxocariasis: A Case-Control Study. Dermatology, 2000, 201(3): 230-234.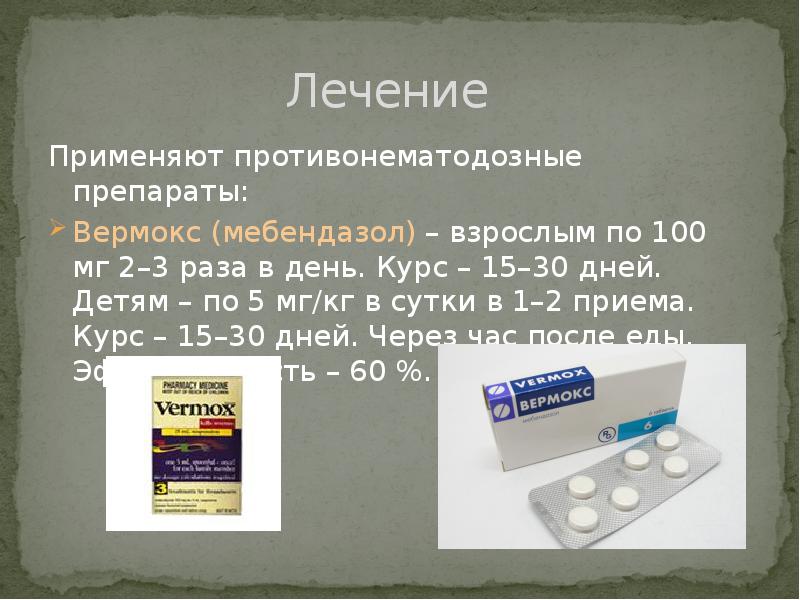
10. Германенко И.Г, Сергиенко Н.Е., Зайцева Л.И., Лисицкая Т.И. Токсокароз у детей: клинико-лабораторные особенности. Медицинская панорама, 2009, 7: 61-64.
11. Холодняк ПЕ. Клинико-эпидемиологические особенности, диагностика и новые подходы к терапии токсокароза у детей. Автореф. дис. … канд. мед. наук, М., 2009: 25.
12. Мерзлова Н.Б., Шепелева А.А., Батурин В.И., Самойлова Н.И. Токсокароз в сочетании с другими паразитозами у детей с соматической патологией. Детские инфекции, 2007, 6: 29-33.
13. Bede O, Szenasi Zs, Gyurkovits K, Nagy D. Toxocarosis in the background of chronic cough in childhood: a longitudinal study in Hungary. Abstracts of the XX World Allergy
Congress(TM), December 2-6, 2007, Bangkok, Thailand: POSTERS-GROUP 1-MONDAY: PEDIATRIC ALLERGY & ASTHMA: 387.
14. Sabrosa NA, de Souza EC. Nematode infections of the eye: toxocariasis and diffuse unilateral subacute neuroretinitis. Current Opinion in Ophthalmology, 2001, 12(6): 450-454.
15. Stewart JM, Cubillan LD, Cunningham ET. Prevalence, clinical features, and causes of vision loss among patients with ocular toxoca-riasis. Retina, 2005, 25(8): 1005-1013.
16. Бекиш О-Я.Л., Бекиш Л.Э. Токсокароз: эпидемиологические, диагностические, клинические и терапевтические аспекты. Медицинские новости, 2003, 3, http://www. mednovosti.by/journal.aspx?article=2294.
17. Методические указания МУ 3.2.1043-01 «Профилактика токсокароза» (утв. Главным государственным санитарным врачом РФ 28 мая 2001 г.) (по состоянию на 25 сентября 2006 года). http://jurbase.ru/texts/sector081/tes81860.htm.
http://jurbase.ru/texts/sector081/tes81860.htm.
18. Кучеря Т.В. Диагностика и лечение наиболее часто встречающихся паразитарных полиинвазий у детей в амбулаторно-поликлиниче-ских условиях. CONSILLIUM MEDICUM-Педиатрия, 2013, 3: 21-24.
ТОКСОКАРОЗ: современный подход | #03/98
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
- Биология возбудителя
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Основным источником инвазии для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с инвазированным животным, шерсть которого загрязнена инвазионными яйцами, или при попадании в рот земли, в которой были яйца токсокар. Особенно подвержены заражению дети во время игры в песке или с собакой. Наибольший риск заражения у детей, страдающих геофагией. Взрослые заражаются при бытовом контакте с инвазированными животными или в процессе профессиональной деятельности (ветеринары, собаководы, работники коммунальной службы, шоферы, землекопы и др.). У человека возможно заражение также при поедании сырого или плохо обработанного термически мяса паратенических хозяев. Описаны случаи заражения токсокарозом при употреблении в пищу печени ягненка. Не исключается возможность трансплацентарной и трансмаммарной передачи инвазии и у человека.
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
- Клиническая картина токсокароза
Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T. canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
- Лечение токсокароза
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Обратите внимание!
- Основным источником инвазии для человека являются собаки
- Особенно подвержены заражению дети во время игры в песке или с собакой
Ларвальные гельминтозы. Токсокароз в педиатрической практике | #06/16
Все живое на земном шаре
попало в цепкую «гельминтологическую паутину»,
которая сплеталась миллионами лет.
К. И. Скрябин
Распространенность гельминтозов среди жителей различных континентов Земли огромна: на каждого жителя Африки приходится более двух видов гельминтов, в Азии и Латинской Америке более одного вида, в Европе поражен каждый третий житель. В России практически каждый человек в течение жизни переносит паразитарное заболевание, причем чаще страдают дети [1]. По величине ущерба, наносимого здоровью людей, гельминтозы занимают 4-е место после диареи, туберкулеза и ишемической болезни сердца. Ежегодно в мире от гельминтозов погибают 135 тыс. человек, причем число это неуклонно растет [2].
Гельминты оказывают выраженное негативное влияние на здоровье человека, способствуют более частому возникновению инфекционной и соматической патологии, провоцируют или поддерживают течение аллергической патологии, оказывают негативное влияние на формирование специфического поствакцинального иммунитета. Паразитарные заболевания продолжают не только стойко сохранять свою распространенность, но и увеличиваются абсолютно во всех странах мира, особенно развивающихся, расположенных в зоне тропиков и субтропиков. Подобные тенденции наблюдаются также и в России, где в последние годы зарегистрировано повышение заболеваемости гельминтозами: за 5 лет токсокароз вырос на 64% в год, эхинококкоз — в 3 раза. С 2004 г. Постановлением Правительства РФ № 715 гельминтозы включены в перечень заболеваний, представляющих опасность для окружающих. Среди известных причин роста заболеваемости гельминтозами можно выделить:
- санитарно-гигиенические — высокий уровень контаминации окружающей среды яйцами гельминтов в результате сброса необезвреженных сточных вод и стоков животноводческих комплексов; недостаточные гигиенические навыки населения, привычка удобрять почву экскрементами;
- миграционными — усилением миграции населения и завозом паразитарных болезней из эндемических стран, вторжением городского населения в сельскую местность (работа на садовых участках, дачах, личных фермах), рост числа бродячих животных;
- информационными — малая информированность населения, а порой и врачей о гельминтозах и путях их заражения, профилактика гельминтозов ограничена лишь лечением вновь выявленных случаев заболевания;
- этническими — особенности питания населения, а именно употребление сырой или слабообработанной продукции;
- экономическими — обеднение населения, удорожание лекарственных препаратов;
- экологическими — снижение общей иммунной реактивности.
В настоящее время известно около 270 видов гельминтов, паразитирующих в организме человека, из которых 30 широко распространены на территории России. Гельминты, паразитирующие у человека, относятся к типу плоских червей, среди которых различают два класса: Cestoidea — ленточные черви и Trematoda — сосальщики, и типу круглых червей (класс Nematoda — собственно круглые черви). В зависимости от места паразитирования в организме человека, гельминты подразделяются на просветные, к которым относится большинство патогенных для человека гельминтов, и тканевые. В тканях в свою очередь могут обитать как взрослые особи, так и личинки.
Гельминтозы, при которых основным патогеном являются личинки, мигрирующие или покоящиеся, называют личиночными или ларвальными [3]. Особенностью ларвальных гельминтозов является то, что человек в данной ситуации является промежуточным или случайным хозяином, а жизненный цикл паразита не завершается, личинка не превращается в половозрелую особь и не может дать потомство [4]. Следовательно, такой вид паразитирования является биологическим тупиком. К числу таких гельминтозов относят многие филяриозы, трихинеллез, гнатостомоз, капилляриоз, спарганоз, эхинококкозы, токсокароз и др.
В отсутствие этиологического диагноза, который поставить удается не всегда, этот вид гельминтозов обозначают обобщенным термином Larva migrans, под которым понимают симптомокомплекс, обусловленный паразитированием личинок гельминтов, для которых человек не является естественным хозяином [5–7]. В зависимости от пути проникновения и места паразитирования условно выделяют перкутанные, или кожные, и висцеральные формы. Возбудителями кожной формы являются шистосомы, анкилостомы, некоторые виды филярий. При этом личинки гельминтов проникают в неповрежденную кожу при контакте с водой или почвой, паразитируют в эпидермисе, дерме или гиподерме, а после самопроизвольной гибели личинки, через 1–6 месяцев, наступает полное выздоровление [8]. Это условно доброкачественные гельминтозы. Висцеральная форма, возбудителями которой являются эхинококки, токсокары, цистицерки и др., возникает при проглатывании человеком яиц гельминтов с водой, продуктами питания, частичками почвы и протекает зачастую тяжело, длительно, порой годами и, как правило, не заканчивается спонтанным выздоровлением. Прогноз у данной группы гельминтозов серьезный, вплоть до летального исхода [9].
Наиболее тяжело протекают ларвальные (личиночные) гельминтозы вследствие множественного поражения печени, легких, сердца, почек, головного мозга, органа зрения и др. (токсокароз, однокамерный эхинококкоз, цистицеркоз) или агрессивного роста и метастазов зародышей или яиц паразита (многокамерный эхинококкоз, парагонимоз). Кроме этого, обладая значительной антигенной чужеродностью, мигрирующие личинки вызывают тяжелую общую и местную аллергическую реакцию, вплоть до формирования в тканях эозинофильных гранулем, оказывают механическое и токсическое повреждение [10].
Для гельминтозов характерен широкий диапазон клинических симптомов: от слабовыраженных до генерализованных реакций с множественными поражениями. Именно такая неспецифичность, малоинформативность стандартных методик гельминтологического исследования на яйца глистов, в совокупности с традиционным отсутствием настороженности у городских практических врачей, побудили нас еще раз обратить внимание на эту проблему. Часто правильный диагноз скрывается за самыми разнообразными масками и распознается поздно (рис. 1).
Токсокароз является самым распространенным из ларвальных гельминтозов у детей, пораженность токсокарозом в странах умеренного пояса составляет от 2% до 37%, достигая 92,8% в тропических странах [11–14]. Токсокароз — это зоогельминтоз, имеющий тяжелое хроническое течение с выраженным иммуносупрессирующим эффектом и полиорганными поражениями. Возбудителем токсокароза является нематода из рода Toksokara. Наиболее известны Toksokara catis, паразитирующая в организме кошек, и Toksokara canis, паразитирующая в организме собак, волков, лисиц, песцов и других представителей семейства псовых [15, 16]. Самка Toksokara canis имеет длину 9–18 см, самец — 5–10 см. Взрослые паразиты локализуются в желудке и тонкой кишке окончательных хозяев. Средняя продолжительность жизни половозрелых особей составляет 4–6 мес, и каждая самка Toksokara canis откладывает более 200 тыс. яиц в сутки. Яйца выделяются незрелыми и через 5–8 дней инкубации в почве становятся инвазионными, сохраняя жизнеспособность и инвазивность до 10 лет. Кроме этого, широкому распространению токсокароза среди животных способствует совершенный механизм передачи возбудителя, при котором сочетаются прямой (заражение яйцами из окружающей среды), внутриутробный (заражение плода личинками через плаценту), трансмаммарный (передача личинок с молоком) пути передачи и заражение через резервуарных (паратенических) хозяев.
Основной источник опасности для человека — это домашние и бродячие собаки разного возраста. В настоящее время в Москве численность собак превышает 1 млн особей, которые ежедневно оставляют на ее территории около 270 тонн экскрементов, содержащих более 40 тысяч яиц токсокар в каждом грамме! Поэтому каждая вторая проба почвы детских площадок, скверов, парков и территорий вокруг жилых домов содержит яйца этих паразитов [17–20]. У детей заражению может способствовать геофагия, именно поэтому токсокарозом чаще болеют дети дошкольного возраста. Прямой контакт с собакой также может привести к заражению через шерсть, загрязненную почвой, содержащей зрелые яйца токсокар. Ребенок может заражаться круглогодично через загрязненные яйцами почву, продукты питания, воду, руки. Установлена роль тараканов в распространении токсокароза: они поедают значительное количество яиц токсокар и до 25% их выделяют в жизнеспособном состоянии в окружающую среду [21]. Группу риска составляют люди, по роду деятельности контактирующие с животными и почвой.
Человек служит паратеническим (резервуарным) хозяином, являясь для паразита биологическим тупиком, так как токсокары паразитируют у него только в личиночной стадии, не выделяясь в окружающую среду. После проглатывания человеком зрелых яиц, в проксимальном отделе тонкого кишечника из них выходят личинки, которые через слизистую оболочку проникают в кровоток, затем заносятся в печень и правую половину сердца. Попав в легочную артерию, личинки продолжают миграцию и переходят из капилляров в легочную вену, достигают левой половины сердца и затем разносятся кровью по разным органам и тканям. Мигрируя, они достигают места, где диаметр сосуда меньше размера самой личинки, и покидают кровяное русло. Личинки токсокар могут оседать абсолютно во всех органах и тканях, сохраняя жизнеспособность в течение длительного времени, периодически активизируясь и возобновляя миграцию. С течением времени часть личинок инкапсулируется и постепенно разрушается внутри капсулы.
Токсокароз имеет длительное, рецидивирующее течение [22]. Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека [23, 24]. В зависимости от преимущественной локализации личинок выделяют висцеральную и глазную формы токсокароза.
Висцеральный токсокароз встречается чаще как у детей, так и у взрослых и возникает в результате заражения большим числом личинок [25]. Клинические проявления острого токсокароза разнообразны (рис. 2).
Для больных токсокарозом наиболее характерна субфебрильная, реже — фебрильная лихорадка с пиком во второй половине дня, сопровождающаяся недомоганием и ознобом. Как правило, одновременно с лихорадкой выявляется синдром поражения легких, варьирующий в широких пределах: от катаральных явлений до тяжелых астмоидных состояний. Могут наблюдаться рецидивирующие бронхиты, бронхопневмонии вплоть до летального исхода. При рентгенологическом исследовании в этот период выявляются множественные или единичные эозинофильные инфильтраты, так называемый синдром Леффлера. Наряду с синдромом поражения легких часто отмечается увеличение размеров печени, а иногда и селезенки, сопровождающееся болями в животе, тошнотой, рвотой и диарей. Практически у всех больных выявляется лимфаденопатия. В отдельных случаях токсокароз сопровождается развитием аллергического миокардита, панкреатита, поражением почек [26]. Поражение кожи при токсокарозе встречается реже и отличается полиморфностью высыпаний: от эритем до пятнисто-папулезных и уртикарных элементов. Все чаще стали выявлять и поражение центральной нервной системы, которое может протекать в виде эписиндрома, гиперактивности, аффективной неустойчивости, трудностей в учебе. В тяжелых случаях регистрируется менингоэнцефалит, парезы, параличи, нарушения психики. Увязать такие явления непосредственно с токсокарозом весьма проблематично, однако в одном из сероэпидемиологических исследований, проведенном в 1984 г., показана связь затруднений при чтении, невозможности сосредоточиться и низкого уровня интеллекта с заболеванием дошкольников токсокарозом.
Развитие глазного токсокароза связано с заражением человека небольшим количеством личинок (рис. 3) [27]. При низкой интенсивности инвазии, антигенное воздействие паразита на организм недостаточно, чтобы вызвать сенсибилизацию с развитием выраженных аллергических реакций, гранулематозного процесса и эозинофилии. Поэтому личинки, не попадая в «ловушку» иммунной и воспалительной реакций, свободно мигрируют по органам и тканям и попадают в глаза. Глазной токсокароз больше характерен для детей и подростков и редко сочетается с висцеральными поражениями. Токсокарозом всегда поражается один глаз в виде солитарных гранулем или хронических эндофтальмитов с экссудацией. Считается, что до 10% хронического увеита связано с токсокарозом глаза. Наблюдается также поражение личинками параорбитальной клетчатки, что проявляется периодическими отеками, иногда с развитием экзофтальма (рис. 3). Поражение зрительного нерва может привести к односторонней слепоте. Основными клиническими проявлениями глазного токсокароза являются косоглазие, лейкокория и одностороннее снижение зрения [28].
Золотым стандартом диагностики любого гельминтоза является паразитологический метод. Однако прижизненный паразитологический диагноз токсокароза практически невозможен, поскольку обнаружить мигрирующие личинки трудно, а идентифицировать их по гистологическим срезам весьма непросто [29].
Клиническо-анамнестическая диагностика токсокароза также затруднительна ввиду полиморфизма и неопределенности клинических проявлений. В повседневной клинической практике своевременная постановка диагноза и назначение специфической терапии — скорее исключение, чем правило. Для облегчения задачи в 1978 г. был предложен диагностический алгоритм (табл.).
При сочетании симптомов и признаков на сумму более 12 баллов целесообразно назначение иммунологической диагностики. В диагностике глазного токсокароза может помочь офтальмологическое обследование с обнаружением личинки в области диска зрительного нерва или в макулярной части.
Диагностика токсокароза на сегодняшний день основывается на лабораторных методах исследования [30]. Одним из постоянных проявлений висцеральной формы токсокароза является лейкоцитоз и стойкая длительная эозинофилия до 30–90%. Наблюдается также умеренная анемия, гиперпротеинемия, гипергаммаглобулинемия, высокий уровень IgE. При поражении печени отмечаются нарушения ее функции.
Наиболее информативными в диагностике токсокароза являются иммунологические методы, а именно определение титра специфических IgG-антител к Toksokara canis методом иммуноферментного анализа (ИФА), обладающим высокой чувствительностью и достаточной специфичностью при висцеральной локализации гельминта — 93,7% и 89,3% соответственно [31]. Установлена корреляция между клиническими проявлениями, тяжестью процесса и титpами антител. Титp специфических антител 1:800 и выше с большой степенью вероятности свидетельствует о заболевании, а титpы 1:200–1:400 — о носительстве токсокаp при висцеральном токсокаpозе и патологическом процессе пpи токсокаpозе глаза. За лицами с низкими титрами противотоксокарозных антител устанавливается диспансерное наблюдение и пpи появлении клинических признаков болезни рекомендуется проведение специфической терапии. Однако необходимо помнить, что не всегда имеется прямая корреляция между титром антител и тяжестью заболевания, так как токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного. Кроме того, возможны и ложные результаты исследования: ложноположительные могут наблюдаться у больных эхинококкозами, описторхозом (в острой фазе заболевания), миграционной фазой аскаридоза; ложноотрицательные — при токсокарозе глаз, первичном иммунодефиците, длительном течении гельминтоза.
До настоящего времени нет единой схемы специфической терапии токсокароза, базирующейся на научных данных. Обычно применяют противонематодозные препараты, действующие на личиночную стадию гельминтов — альбендазол и мебендазол; ивермектин и диэтилкарбамазин [32]. Все препараты активны в отношении мигрирующих личинок и недостаточно активны в отношении тканевых форм, находящихся в гранулемах. Самым часто используемым является мебендазол, назначаемый в дозе 200–300 мг/сут в 2–3 приема, внутрь, в течение 10–14 дней. Повторный курс проводят через 2 недели. Диэтилкарбамазин назначают в дозе 3–4 мг/кг/сут в 2 приема, внутрь, в течение 21 дня. Однако наиболее широким спектром действия обладает альбендазол, эффективный в отношении большинства кишечных нематодозов и ларвальных цестодозов. Механизм действия альбендазола связан с избирательным подавлением полимеризации бета-тубулина, что ведет к деструкции цитоплазматических микроканальцев клеток кишечного тракта гельминтов. Назначается альбендазол в дозе 10 мг/кг/сут в два приема, внутрь, после еды в течение 10–14 дней. Необходимость повторного курса устанавливается после клинико-лабораторного обследования больного. Побочные явления, возникающие при применении вышеуказанных препаратов, могут быть связаны не только с токсическим действием антигельминтных препаратов, но и с реакцией организма на массовую гибель личинок токсокар. Поэтому в процессе лечения целесообразно назначать антигистаминные препараты, а в ряде случаев и кортикостероиды.
При глазном токсокарозе гранулемы удаляют микрохирургическими методами, для разрушения личинок в средах глаза применяют лазерокоагуляцию [33]. При бессимптомном течении с низкими титрами специфических антител лечение не проводится, а за больными устанавливается динамическое наблюдение.
Критериями эффективности лечения считают постепенное снижение и ликвидацию клинических проявлений токсокароза, уменьшение уровня эозинофилов и специфических антител. Вместе с тем исследования показывают, что в результате лечения процесс снижения уровня специфических антител идет медленно и не охватывает всех пациентов. Клинический эффект от лечения опережает гематологический и иммунологический. При рецидивах симптоматики, сохранении стойкой эозинофилии или повышении титра специфических антител проводят повторные курсы, иногда до 4–5.
Диспансерное наблюдение за переболевшими проводит врач-инфекционист или педиатр на протяжении не менее 6 месяцев. Больные подлежат осмотру 1 раз в 2 месяца и снимаются с учета после 2-кратного отрицательного результата на антитела методом ИФА с интервалом в 3–4 месяца. Прогноз в большинстве случаев благоприятный.
Основную роль в контроле заболеваемости токсокарозом играет традиционная профилактика, которая включает в себя соблюдение правил личной гигиены, обязательное обучение детей санитарным навыкам, своевременную дегельминтизацию собак, оборудование мест выгула собак, повышение культурного уровня владельцев собак [34].
Литература
- Онищенко Г. Г. Мед. паразитология и параз. болезни. 2000. № 1. С. 3–7.
- Горохов В. В., Скира В. Н., Кленова И. Ф. и др. Современная эпизоотологическая ситуация по основным гельминтозам в РФ (2005 г.) / Материалы докл. науч. конф. «Теория и практика борьбы с паразитарными болезнями». М., 2007. Вып. 8. С. 78–79.
- Никулин Ю. Т. Тканевые гельминтозы. Тр. науч.-практ. конф. Витебск, 2000. С. 57–59.
- Гузеева М. В., Иванова Т. М., Тимошенко Н. И. Ларвальные гельминтозы в Москве / Материалы докл. Всерос. конф. «Актуальные аспекты паразитарных заболеваний в современный период», Тюмень, 17–18 сент. 2008 г. Тюмень, 2008. С. 59–60.
- Лысенко А. Я., Владимова М. Г., Кондрашин А. В., Майори Дж. Клиническая паразитология. Женева: ВОЗ, 2002. 734 с.
- Лысенко А. Я. Общие и особенные черты ларвальных гельминтозов человека. Медицинская паразитология и паразитарные болезни, 1998. № 2. С. 27–31.
- Beaver P. C. Larva migrans // Exep. Parasitologu. 1956. V. 5. P. 587–621.
- Гузеева М. В. Роль и место редких гельминтозов в паразитарной патологии в России. Автореф. дисс. … канд. мед. наук. М., 2009. 26 с.
- Barra L. A., dos Santos W. F., Chieffi P. P. Visceral larva migrans: a mixed from of presentation in an adult. The clinical and laboratory aspects // Rev. Soc. Bras. Med. Trop. 1996. V. 29 (4). P. 373–6.
- Hartleb M., Januszwski K. Sever hepatic invovement in visceral larva migrans // Eur. J. Gastroenter. Hepatol. 2001. V. 13 (10). P. 1245–1259.
- Magnaval J. F., Glickman L. T., Dorchies Ph. La toxocarose, une zoonoze helminthique majeure // Rev. Med. Vet. 1994. 145. P. 611–627.
- Magnaval J. F., Michault A., Calon N., Charlet J. P. Epidemiology of human toxocariasis in La Reunion // Trans. Roy. Soc. Trop. Med. Hyg. 1994. 88. P. 531–533.
- Старостина О. Ю. Описторхоз и токсокароз в Омской области. Природно-очаговые инфекции в России современная эпидемиология, диагностика, тактика защиты населения. Тез. докл. научн. конф. Омск, 1998. С. 180–181.
- Мерзлова Н. Б., Лагвилава Э. А., Горбань Л. Я. Особенности течения токсокароза у детей Пермского региона. Актуальные проблемы инфектологии и паразитологии. Материалы 1-й межд. юбил. конф. Томск, 2001. С. 105–106.
- Jia Chen, Dong-Hui Zhou, Alasdair J. Nisbet, Min-Jun Xu, Si-Yang Huang, Ming-Wei Li, Chun-Ren Wang, Xing-Quan Zhu. Advances in molecular identification, taxonomy, genetic variation and diagnosis of Toxocara spp. // Journal Infection, Genetics and Evolution. 2012. № 12. Р. 1344–1348.
- Leonid M Irenge1, Renata Fogt-Wyrwas, Catherine Dumont, Jean-Pierre Doucet, Bernard Mignon, Bertrand Losson, Jean-Luc Gala. Duplex quantitative real-time PCR assay for the detection and discrimination of the eggs of Toxocara canis and Toxocara cati (Nematoda, Ascaridoidea) in soil and fecal samples // Parasites & Vectors. 2012. № 5. Р. 288. ISSN 1756–3305.
- Верета Л. Е., Мамыкова О. И. Обсемененность почвы яйцами токсокар в детских дошкольных учреждениях г. Москвы и ее источники // Медицинская паразитология. 1984. № 3. С. 19–22.
- Субботин А. М. Гельминтозы собак Беларуси и меры борьбы с ними: Автореф. дис…. канд. ветерин. наук. Минск, 2002.
- Ястреб В. Б., Белоусов М. Н. Паразитарное загрязнение мегаполиса Москвы. М., 1994. С. 53–54.
- Гламаздин И. Г., Петрушина С. В., Хисамов И. Р. Токсокароз собак, диагностика и методы эпизоотического надзора // Ветеринарный врач. 2007. № 3. С. 28–31.
- Бекиш О. Я. Л., Бекиш Л. Э. Токсокароз: эпидемиологические, диагностические, клинические и терапевтические аспекты // Медицинские новости. 2003. № 3. С. 6–10.
- Алексеева М. И. Токсокароз: клиника, диагностика, лечение // Медицинская паразитология. 1984. № 6. С. 66–72
- Поляков В. Е., Лысенко А. Я., Авдюхина Т. И., Константинова Г. Н. Токсокароз у детей и подростков // Эпидемиология и инфекционные болезни. 2004. № 6. С. 43–46.
- Горохов В. В., Успенский А. В., Пешков Р. А., Горохова Е. В. Токсокароз в современных условиях // Медицинская паразитология и паразитарные болезни. 2011. № 2. С. 3–6.
- Замазий Т. Н., Здор О. А. Особенности эпидемиологии и клиническоготечения токсокароза в современных условиях // Международный медицинский журнал. 2005. № 1. С. 133–135.
- Thomas K., Nidxdoff N., Manger B. et. al. Hypereosinophilia with myocardial involvement due to toxocariasis. Diagnosis of regional myocardia perfusion abnormalities by pulsed tissue Doppler echocardiography // Med. Klin. 2000. V. 95 (3). P. 163–167.
- Ратникова Л. И., Козочкина К. К., Лаврентьева Н. Н. Клинические и лабораторные проявления токсокароза // Российский медицинский журнал. 2012. № 1. С. 29–30.
- Balmer A., Munier F. Leukokoria in child- emergency and challenge // Klin. Monatsbl. Augenheiekd. 1999, May. V. 214 (5). P. 332–335.
- Шишканова Л. В. Токсокароз на юге России; эпизизоотологическая, санитарнопаразитологическая и сероэпидемиологическая характеристика. Автореф. дисс. … канд. биол. наук. М., 2010. 26 с.
- Лысенко А. Я., Красильников А. А. Лабораторные методы диагностики паразитарных болезней. М., 1999. 58 с.
- Нечаева А. С., Старкова Т. В., Черникова Е. А. Оптимизация метода учета результатов ИФА при токсокарозе // Медицинская паразитология и паразитарные болезни, 2013. № 2. С. 39–41.
- Белоусов Ю. Б., Гуревич К. Г. Клиническая фармакокинетика. М.: Литтера, 2005. 288 с.
- Barisani-Asenbauer T., Maca S. M., Hauff W. Treatment of ocular toxocariasis with albendazol // Ocul. Pharmacol. Ther. 2001. V. 17 (3). P. 278–94.
- Малышева Н. С., Самофалова Н. А., Григорьев Д. Г., Вагин Н. А., Елизаров А. С., Гладких К. А., Шуйкина Э. Е. Проблема токсокароза в современных условиях и совершенствование подходов к его профилактике // Ученые записки: электронный научный журнал Курского государственного университета. 2013. № 1 (25).
А. С. Боткина1, кандидат медицинских наук
М. И. Дубровская, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
1 Контактная информация: [email protected]
Особенности лечения паразитарных заболеваний | Кочергина Е.А., Корюкина И.П., Зубов Е.В.
Для цитирования: Кочергина Е.А., Корюкина И.П., Зубов Е.В. Особенности лечения паразитарных заболеваний. РМЖ. 2004;13:815.
На современном этапе паразитарные заболевания признаны общегосударственной проблемой. Это связано с их повсеместным распространением и отрицательным воздействиям на здоровье населения, приводящим к значительным экономическим потерям [1]. Особенно это касается детского населения, так как среди заболевших они составляют более 80%. Цифры заболеваемости гельминтозами сопоставимы с показателями заболеваемости ОРВИ и гриппом вместе взятыми. Сегодня, когда известны механизмы основных патогенетических реакций при паразитарных заболеваниях, можно сказать, что они являются причиной тяжелых аллергических проявлений, вызывают патологию органов пищеварения и органов дыхания, оказывают сенсибилизирующее и иммунодепрессивное влияние, чем обеспечивают благоприятный фон для возникновения соматической и инфекционной патологии [2]. Наиболее общее патологическое воздействие всех гельминтов – аллергизация организма и подавление иммунного ответа. Гельминты, их части, продукты их жизнедеятельности являются аллергенами, вызывают воспалительные изменения, оказывают иммуносупрессивное действие и всегда индуцируют интенсивную продукцию Ig E–антител. Все это поддерживает или инициирует хронические аллергические заболевания, такие как крапивница, атопический дерматит, бронхиальная астма. Конечно, гельминтозы нельзя отнести к истинно аллергическим заболеваниям, но надо помнить, что это болезни, в патогенезе которых аллергия участвует, как обязательный компонент основного патологического процесса [2]. Наличие паразитарного заболевания у ребенка приводит к подавлению неспецифической резистентности организма, что ведет к учащению острых респираторных и инфекционных заболеваний, удлинению и утяжелению их течения. Достоверно доказано снижение выработки защитных антител при вакцинации дифтерии у инвазированных. Ухудшается формирование иммунитета при ревакцинации кори и столбняка у больных с паразитарным заболеванием. Также у детей с гельминтозом чаще регистрируется ложный вираж туберкулиновых проб. Иммунная система всегда реагирует на действие паразитарного антигена, и длительное хроническое течение инвазии вызывает ее истощение. Снижение Т–лимфоцитов у больного приводит к развитию таких осложнений, как бактериально–вирусные и аллергические. Поэтому в докладе ВОЗ (1977) среди причин, способных вызвать вторичное иммунодефицитное состояние (ВИД), на первое место были вынесены протозойные и глистные болезни. Хроническое течение гельминтоза всегда сопровождается обменными нарушениями в виде снижения содержания белка в печени, обмена жиров и углеводов, гипоксии в органах, уменьшения концентрации витаминов, микроэлементов, фолиевой кислоты, что может вызвать необратимые изменения в органах. Поэтому очень важным при установлении окончательного диагноза паразитарного заболевания является выбор тактики ведения больного и адекватного лечения. Лечение паразитарных заболеваний на современном этапе остается нерешенной проблемой, особенно это касается тканевых гельминтозов, таких как токсокароз, эхинококкоз, стронгилоидоз и др. Применение существующих сегодня антигельминтных препаратов (в основном это производные мебендазола) не всегда эффективно. Это связано с их низкой кишечной абсорбцией – до10%, быстрым развитием резистентности при повторных и длительных курсах терапии, формированием при реинвазиях более тяжелых форм, которые ведут к значительным иммунологическим сдвигам [4]. Сегодня в России появился новый антигельминтный препарат широкого спектра действия – Немозол ( а л ьбе н д а зол ). Системное действие Немозола связано с его активным метаболитом – сульфоксидом альбендазола, который образуется в печени. Немозол активен в отношении разных видов паразитов. Препарат ингибирует полимеризацию бета–глобулина, что приводит к нарушению образования цитоплазматических микротубул клеток гельминта. Экспериментальные данные свидетельствуют о том, что Немозол действует не только на взрослых кишечных особей, а также на их яйца и личинки [5]. Высокая терапевтическая активность Немозола обусловлена тем, что он имеет наибольшую среди антигельминтных препаратов биодоступность – до 30%. Широко использовать препарат в детском городскомгельминтологическом центре города Перми мы начали с сентября 2003 года. Эффективность Немозола оценивали по степени излечения больных детей и степени снижения яиц в кале – эти методы считаются стандартами ВОЗ (WHO, 1999). Хорошая эффективность Немозола выявлена при лечении токсокароза. В Перми регистрируется высокий уровень заболеваемости токсокарозом – 47,68 на 100 тыс. детского населения, Пермская область занимает восьмое место в Российской Федерации по данной нозологии. Это инвазия часто встречается у детей до 5 лет и характеризуется полиморфной клинической картиной, с развитием тяжелых осложнений со стороны легких, кожи, печени. Легочные поражения встречаются у 50% больных в виде бронхитов с бронхообструктивным синдромом, пневмоний, атопической бронхиальной астмы. В клинике превалирует сухой приступообразный кашель, чаще ночью, лихорадка, слабость, потливость, инспираторная одышка. Известны случаи тяжелых токсокарозных эозинофильных пневмоний с летальным исходом. Изменения со стороны сердечно–сосудистой системы при токсокарозе имеют, как правило, аллергическую этиологию. Миграция личинок способствует также манифестации вирусной инфекции с развитием тяжелых миокардитов. Описаны случаи обнаружения на аутопсии личинок Toxocara canis в миокарде и некротических гранулематозных очагов с эозинофильной инфильтрацией. К классическим признакам сердечного заболевания присоединяются гиперэозинофилия, острая лихорадка и симптомы поражения соединительной ткани. Абдоминальный синдром встречается у 80% больных токсокарозом детей и проявляется вздутием, болями в животе, тошнотой, иногда рвотой, диареей. Гепатомегалия регистрируется у 65% больных. Развитие глазного токсокароза возникает при низкой степени инвазии и низком иммунном ответе, что и позволяет личинкам беспрепятственно проникать к глазному яблоку. Часто заболевание регистрируется у детей старше 12 лет, чаще поражаются лица мужского пола. Практически всегда идет изолированное поражение только одного глаза, чаще левого. Больные жалуются на снижение остроты зрения до полной слепоты. В процесс могут вовлекаться сетчатка, хрусталик, стекловидное тело. Заболевание имитирует ретинобластому, болезнь Коатса, дегенерацию макулярного пятна. Может поражаться параорбитальная клетчатка, с отеком и гиперемией век, отеком щеки и лимфоаденитом; также имеет место диплопия и экзофтальм, процесс носит рецидивирующий характер. По нашим данным, почти у 40% больных токсокарозом детей после лечения отмечаются рецидивы. Даже в период ремиссии у таких больных сохраняется лимфоаденопатия, увеличение печени, кожный синдром. Идущие процессы сенсибилизации вызывают нарушение функции органов и тканей, что ведет к снижению физического и умственного развития ребенка. В течение нескольких лет мы применяли возможные схемы и различные препараты для лечения токсокароза, оценивая их эффективность. Анализ историй болезни 224 детей с токсокарозом показал высокую терапевтическую активность Немозола по отношению к личинкам токсокары. Терапевтическую эффективность препаратов оценивали по регрессу клинических проявлений,прогрессивному снижению уровня эозинофилии, снижению титру специфических антител до уровня 1:400 и ниже. Больные токсокарозом получали Немозол в дозировке 15 мг/кг в сутки в течение 10–14 дней. Существенным положительным моментом было отсутствие побочных эффектов и хорошая переносимость Немозола при длительных курсах терапии. Значительный терапевтический эффект мы получили при лечении стронгилоидоза – инвазии, которая в последнее время стала часто регистрироваться в Пермской области. В клинике у наших больных чаще преобладал кишечный вариант течения инвазии. Больные жаловались на изжогу, вздутие живота, боли в животе после еды, похудание, тошноту, рвоту, понос. Интенсивная инвазия стронгилоиодоза может протекать по типу язвенной болезни, язвенного колита, энтерита, острого живота. С января по май 2004 года в детском городском гельминтологическом центре мы пролечили 8 больных со стронгилоидозом (4 больных из семейного очага, 3 поступили повторно после безуспешного лечения мебендазолом). Больные получали Немозол по 400 мг ежедневно в течение 3–х дней. Контрольные анализы через 1 и 3 месяца показали эффективность препарата в 100% случаях. Учитывая спектр существующих сегодня в России антигельминтных препаратов, альтернативы Немозолу при лечении стронгилоидоза нет. Высокая паразитоцидная активность Немозола отмечена нами и при лечении других нематодозов: аскаридоз – 100% (n=14), энтеробиоз – 96,4% (n=82), трихинеллез – 100% (n=9), где n – количество пролеченных. Причем при аскаридозе и энтеробиозе эффект достигался после однократного приема препарата. Анализируя полученные нами данные, считаем, что наиболее перспективным Немозол показал себя при mixt–инвазиях, когда у больного выявляется сочетанная инвазия из 2 и более паразитов. Немозол давал положительные результаты и в случаях, когда у больных с гельминтозом выявлялся лямблиоз. В настоящее время имеется достаточное количество препаратов для специфического лечения лямблиоза. При выборе препарата для лечения лямблиоза необходимо помнить, что в последние годы появилось большое количество штаммов паразитов, устойчивых к длительно применявшимся ранее метронидазолу и фуразолидону. Сегодня широкое распространение в лечении лямблиоза у людей пробрели ингибиторы тубулина бензимедазольного ряда (албендазол). Эти препараты значительно безопаснее и удобны для массового применения [6]. Стандартная дозировка Немозола, применяемая нами в лечении лямблиоза (400 мг в сутки в течение 5 дней) приводила к 86% излечению от сочетанного паразитарного заболевания. При стойкой эозинофилии, длящейся несколько месяцев, при невозможности по тем или иным причинам идентифицировать возбудителя и установить диагноз, многие авторы предлагают проводить эмпирическую терапию антигельминтиками широкого спектра действия. В этих случаях быстрый терапевтический эффект является косвенным подтверждением диагноза. Учитывая возможности Немозола, считаем его идеальным препаратом для проведения терапии ex juvantibus [3]. З а к люч е н и е. Опыт применения Немозола в детском городском гельминтологическом центре г. Перми составил более 300 больных с различными видами паразитарных заболеваний. Полученные нами данные свидетельствуют о том, что Немозол – высокоэффективный препарат широкого спектра действия и может использоваться в педиатрии для лечения паразитарных заболеваний. Немозол является препаратом выбора при таких тяжелых тканевых гельминтозах, как эхинококкоз, токсокароз, нейроцистицеркоз, высоко эффективен при лечении сочетанных паразитозов и протозоозов. Не имеет возрастных ограничений, выпускается в удобной лекарственной форме в виде таблеток и суспензии. Существенным преимуществом применения Немозола, особенно у детей, является не только высокая противопаразитарная активность, но и практически полное отсутствие побочных эффектов и хорошая переносимость.
Литература 1. Онищенко Г.Г. Заболеваемость паразитарными болезнями в Российской федерации и основные направления деятельности по ее стабилизации // Медицинская паразитология. – 2002. № 4. С 3–10. 2. Астафьев Б.А. Иммунологические проявления и осложнения гельминтозов. – М., 1987. – 124с. 3. Лысенко А.Я., Владимова М.Г., Кондрашин А.В. // Клиническая паразитология. Женева, 2002, с 65 – 66. 4. Озерецковская Н.Н. Подходы отечественной школы паразитологов – иммунологов к терапии паразитарных болезней // Медицинская паразитология. – 1998. – № 2. – С. 12–15. 5. J. Horton Treatment of parasitic diseases // Parasitology 2000, Cambridge University Press. – S 113–132. 6. Авдюхина Т.И., Константинова Т.Н., Кучеря Т.В. Лямблиоз // учебное пособие. – Москва, 2003, с 16 –17.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Предыдущая статья
Следующая статья
Токсокароз у людей. Симптомы, диагностика, лечение и профилактика
Дата публикации: .
Врач лабораторной диагностики
Централизованной иммуно-токсикологической
лаборатории Семкова З.А.
Токсокароз – гельминтное заболевание, вызываемое несвойственным человеку паразитом – токсокарой, очень схожей с аскаридой человеческой – нематодой семейства Anisaridae рода Toxocara. Диаметр ее личинки составляет 0,02 мм.
Toxocara Canis – гельминт, поражающий представителей семейства псовых (собак, волков, лисиц, песцов).
Toxocara Mystax (cati) – гельминт семейства кошачьих. Тем не менее, токсокарозом, вызванным Toxocara Canis, заражаются и люди. Попадание личинок токсокар в организм человека – это «ошибка адресом», для паразита это гибель.
По данным отдельных авторов, в России количество детей, зараженных токсокарозом, составляет 40-50%, в США Центром по борьбе с болезнями ежегодно регистрируется 700-1000 случаев токсокароза.
Источником инвазии для людей являются собаки, выделяющие яйца токсокар с фекалиями, а также загрязненная яйцами шерсть животного. В США 20% взрослых собак и 95% щенков заражено этими гельминтами, а яйца токсокар обнаруживаются в 10-30% проб почв и дворов.
Инвазированные токсокарозом люди не являются источником заражения, так как человек для токсокары несвойственный хозяин, и возбудители в организме человека не достигают половозрелого состояния.
Для людей основными предпосылками передачи возбудителя токсокароза является загрязненность почвы яйцами токсокар и контакт с ней.
Клинические проявления токсокароза. Это гельминтоз из группы нематодозов, характеризующийся лихорадкой, бронхитом, пневмонией, гепатоспленомегалией и эозинофилией (в крови). Личиночный токсокароз регистрируется во многих странах мира.
У человека различают личиночный (висцеральный, глазной) и имагинальный (кишечный) токсокароз.
Люди заражаются токсокарозом при проглатывании яиц токсокар с пищей и водой, загрязненными испражнениями животных, а также при контакте с инвазированными животными. Вышедшие из яиц личинки мигрируют из кишечника через стенку кишки и по кровеносным сосудам попадают в различные органы и ткани, где инкапсулируются и, сохранив длительное время биологическую активность, вызывают личиночную форму заболевания. Личинки токсокар кошек после миграции вновь попадают в кишечник в половозрелой стадии развития (имаго) и вызывают имагинальную форму заболевания.
Чаще болеют дети 1-4 лет. Заболевание протекает с ярко выраженными аллергическими симптомами: зудящими высыпаниями, лихорадкой, гепатоспленомегалией, бронхопневмонией с приступами мучительного кашля и удушья, одутловатостью лица, образованием в различных органах специфических гранулём, содержащих личинки токсокар. Возможны токсокарозный офтальмит с поражением заднего сегмента глаза (хориоретинит), кератит. При глазном токсокарозе возможны необратимые повреждения глаз, вплоть до потери зрения.
Длительность болезни от нескольких месяцев до нескольких лет. Имагинальный токсокароз встречается редко. Клинически проявляется тошнотой, болями в животе, обильной саливацией, понижением аппетита, головокружением.
Диагноз токсокароза основывается на клинической картине, данных эпидемиологического анамнеза и результатах лабораторных исследований. Проводят серологические реакции с токсокарозным антигеном. В крови стойкая длительная эозинофилия (до 70-90%) и СОЭ до 50 мм/ч, гиперглобулинемия. Диагноз имагинального токсокароза ставят при обнаружении яиц токсокар в испражнениях.
Лечение заболевания проводят тиабендазолом в суточной дозе 25-50 мг/кг в течение 5-7 дней или мебендазолом в дозе 3-5 мг/кг в течение 5-7 дней. Применяют десенсибилизирующие средства.
Прогноз чаще благоприятный. Для лечения имагинального токсокароза используют пирантел и левамизол. Лечение глазной формы токсокароза альбендазол 15 мг/кг в сутки 20 дней.
Профилактика личиночного и имагинального токсокароза включает общесанитарные мероприятия по охране от загрязнения окружающей среды фекалиями собак и кошек, дегельминтизация их, создание в городах социальных мест для выгула собак и кошек, соблюдение правил личной гигиены, мытье рук после контакта с животными!
БУДЬТЕ ЗДОРОВЫ! БЕРЕГИТЕ СЕБЯ И СВОИХ БЛИЗКИХ!
Клинико-эпидемиологические особенности, диагностика и новые подходы к терапии токсокароза у детей
1. Авдюхина Т. И., Лысенко А. Я., Федоренко Т. Н. и др. Сероэпидемиология токсокароза и токсоплазмоза в смешанных очагах. Пикациз и серопораженность детей. // Медицинская паразитология.-1987. № 3.- С 39-41.
2. Авдюхина Т. И., Лысенко А. Я., Сколько больных висцеральным токсокарозом в России ? // Медицинская паразитология.- 1994. № 1.- С. 12-16.
3. Алексеева М. И. Токсокароз: клиника, диагностика, лечение. // Медицинская паразитология.-1984. № 6.- С. 66-72.
4. Алексеева М. И., Лысенко А. Я., Гораш В. Р. Токсокароз. // Учебное пособие. М. ЦОЛИУВД992, С. 39.
5. Алексеева М. И., Константинова Т. Н., Цуцкиридзе Н. П. Общие и специфические Е при токсокарозе // Гельминтология сегодня: проблемы и перспективы. Тез. докл. науч. конф.- Москва, 1989,-т 1.-С 13.
6. Алексеева М. И, Куприянова Н. Ю., Селинский И. Ж. Изучение трёх химиопрепаратов при экспериментальном токсокарозе // Гельминтология сегодня: проблемы и перспективы. Тез. докл. научн. конф.- Москва, 1989.-Т2.-С 11.
7. Алиева П. М. Эпидемиология атопического дерматита, иммуногенетические механизмы предрасположенности и иммунокоррегирующая терапия: Автореф. Дис. . д-ра мед. наук. М. 1992; 21-22.
8. Анджалов В. О., Хватова А. В., Кричевская Г. И., и др. Диагностика токсокароза при увеитах у детей // Вестник офтальмологии.-1991.-№1.-С 26-28.
9. Антоньев А. А., Прохоренко В. И. Об общепатологических закономерностях патогенеза аллергических дерматозов. // Вест. Дермат. Венерол. -1996.-№1.- С 20-21.
10. Арутюнов А. Т., Иваников И. О, Сюткин В. Е. Диагностика и лечение хронических заболеваний печени.- М. Принт-Ателье. 2005.-303с.
11. Астафьев Б. А. Иммунологические проявления и осложнения гельминтозов.-М., 1987.-124с.
12. Бабаченко И. В., Тимченко. А. И., Стебулова Т. К., и др. Токсокароз в практике инфекциониста // Педиатрия.-2002.-№2.- С 41-43.
13. Байориненс Д. В. Ларвальный токсокароз. Автореф. дисс. . канд. мед. наук.-Москва, 1983.-26с.
14. Беляев В. С., Кравчичинина В. В., Душин Н. В. Случай токсокароза глаз // Вестник офтальмологии. 1996. -№ 2. -С 51-52.
15. Березенцев Ю. А. Преодоление тканевыми личинками гельминтов антигенной несовместимости с хозяином / Материалы заседания, посвященного 100-летию со дня рождения К.И. Скрябина. -Москва, 1981. -С 47-58.
16. Беэр С. А., Новосильцев Г. И., Мельникова Л. И. Роль водного фактора в рассеивании яиц Toxocara и распространение токсокароза в условиях мегаполиса // Паразитология. 1999. -№ 2. — С 129-135.
17. Благов Н. А., Барышев М. Д., Фирсов В. Н. Иммунологические показатели у больных с кишечными нематодозами / Гельминтология сегодня: проблемы и перспективы. Тез. Док. науч. конф.- Москва, 1989.1. Т 1. — С 53.
18. Блюгер А. Ф., Новицкий И. Н. Практическая гепатология. — Рига: Звайгзне, 1984. С 255-267.
19. Болезни печени и желчевыводящих путей / Под ред. В.Т. Ивашкина. -М: ООО « Изд. Дом « М-Вести», 2005. 432с.
20. Бронштейн А. М., Токмалев А. К. Паразитарные болезни человека. Протозоозы и гельминтозы . М. издательство РУДН, 2002. — 207с.
21. Буеверов А. О. Лекарственный гепатит: если препарат нельзя отменить //Клин, перспективы гастроэнтнрол., гепатол. 2007. — № 5. — С 13-19.
22. Булатов В. Н., Петрова Г. П., Чередова И. Н и др. Клиника и диагностика токсокароза у детей // Казанский медицинский журнал. — 2000. -№3.-С 234-236.
23. Вагнер Е. А., Журавлев В. А, Корепанов В. И. Инструментальная диагностика очаговых поражений печени. — Пермь, 1981.
24. Вазир Шад Мухомед. Атопический дерматит у детей. Совершенствование патогенетического лечения на основании комплексного изучения показателей иммунитета : Дисс. .канд. мед. наук.-Москва, 1995. 154с.
25. Верета Л. Е., Мамыкова О. И. Обсеменённость почвы яйцами токсокар в детских дошкольных учреждениях г. Москвы и её источники / Медицинская паразитология. 1984. — № 3. — С 19-22.
26. ВОЗ. Профилактика кишечных и паразитарных инвазий и борьба с ними. Серия тех. док. № 749. Женева, 1988.
27. Волкова Н. С. Изменения в тканях плотоядных грызунов при многократной инвазии токсокарозом // Гельминтология сегодня: проблемы и перспективы. Тез. докл. науч. конф. Москва, 1998.- Т.1 — С 73.
28. Волкова Н. С., Соляник Ф. Г. Паразиты и паразитозы животных и человека. -Киев, 1975.-С 115-122.
29. Гастроэнтерология и гепатология: диагностика и лечение / Под. Ред. A.B. Калинина и А. И. Хазанова. Москва: Миклош, 2007. — 602с.
30. Голованова Н. Ю., Тумольская Н. И., Лыскина Г. А., Ревматические маски паразитарных заболеваний у детей. Тезисы докладов на конгрессе
31. Человек и лекарство», Москва, апрель 2004 г.
32. Гораш В. Р., Алексеева М. И. Результаты 3- летней работы по изучению обсеменённости почвы яйцами токсокар в Кишинёве // Медицинская паразитология. Е // Современные проблемы аллергологии, клинической иммунологии и иммунологической фармакологии : Сб. тр. 2-го Нац. Конгр. Росс. Ассоц. Аллергологов и клинических иммунологов. Москва, 1998. — С 81-103.
40. Давидянц В. А. Санитарно-гельминтологическая характеристика токсокароза и разработка комплексных мероприятий по профилактике иборьбе с ним ( на примере Армянской ССР)// Дисс. . канд. мед.наук. -Ереван, 1984.-113с.
41. Давидянц В. А., Чобанов А. Г. Некоторые вопросы медицинской эпизоотологии и эпидемиоолгии токсокароза // Актуальные вопросы медицинской паразитологии и тропической медицины : Сб. науч. тр. — Баку, 1981.-Т 1.-С 83-84.
42. Дмитриев С. Н., Данилова Г. А., Горбачевский Г. И. Случай токсокароза у детей // Педиатрия. 1990. — № 7. — С 80-82.
43. Дубовская Л. Л., Тумольская Н. И., Сидоренко Е.И. Особенности клинического течения изолированного ларвального поражения орбиты у детей // Вестник офтальмологии. 2000. — № 3. — С 37-38.
44. Дюбкова Т. П. Гастродуоденальная патология у детей с атопическим дерматитом // Вест. Дерм. Вернер. 1997. -№ 3. — С 12-16.
45. Ещанов М. Т., Кулаков А. В., Черноусов А. Д. и др. Клиническая и иммуностимулирующая эффективность полиоксидония в комплексном лечении эхинокококкоза // Аллергология, астма и клиническая иммунология. 1997. -№ 4. — С 66-68.
46. Жарова В. В. Результаты санитарно-гельминтологических исследований детских песочниц на яйца гельминтов в г. Москве // Медицинская паразитология. 1974. — № 3. — С 278.
47. Желева Р. Ц. Изыскания метода иммунологической диагностики ларвального токсокароза человека : Автореф. Дисс. . канд. мед. наук. -Москва, 1975.-16 с.
48. Запруднов А. М., Мазурин А. В., Филин В. А. Критерии диагностики билиарной и гастродуоденальной патологии в детском возрасте // Вопр. охр. мат. и дет. 1997. — № 9. — С 41-48.
49. Запруднов А. М., Салькова С. И., Мазанкова Л. Н. Гельминтозы у детей: Практическое руководство для врачей. -М.: ГЭОТАР-МЕД, 2002,. Е-антитела у больных токсокарозом // Медицинская паразитол.- 1998. — № 2. С 32-34.
60. Константинова Т. Н. Паразитарные поражения печени : Учебное пособие.- М., 1993.-31с.
61. Константинова Т. Н. Паразитарные поражения кишечника: учебное пособие. М., 1993. — 23с.
62. Константинова Т. Н., Авдюхина Т. И, Горбунова Ю. П. Заражение токсокарозом при употреблении сырой утиной печени // Актуальные вопросы эпидемиологии инфекционных заболеваний 6 Сб. науч. тр. -Москва, 1997. С 330-332.
63. Константинова Т. Н., Конаныхина С. Ю. Сравнительная эффективность мебендазола и медамина в лечении токсокароза у детей , актуальные вопросы эпидемиологии инфекционных болезней : Сб. науч. тр. Москва, 1997.-С 335-337.
64. Коровина Н. А., Лыков М. И., Прокопьева В. И. Случай токсокароза у ребенка 3.5 лет // Дет. доктор. 2000. — № 6. — С 60-61.
65. Костин М. П. Иммунокоррекция в педиатрии / Практическое рукаводство для врачей / под. Ред М.П. Костинова Изд. 2-е. доп. М.: Медицина для всех, 2001. — 240с.
66. Кочергина Е. А. Особенности рецидивирующего течения токсокароза у детей и усовершенствование методов терапии // Дисс. . канд. мед. наук.- Пермь, 2002. 144с.
67. Кривенкова В. Н. Сероэпидемиологическое обследование детей Ленинграда на токсокароз с применением РЭМА / Проблемы тканевого паразитизма: Сб. науч. тр. -Ленинград, 1985. — С 36-38.
68. Кузнецова В. Д., Азеева Л. Н., Хренов С. Г. и др. О случаях заболевания токсокарозом на Свердловской железной дороге // Медицинская паразитология. 2002. -№ 1. — С 52-53.
69. Куприянова Н. Ю. Ареал Toxocara canis и эпидемиолгия токсокароза в Восточной Сибири // Дисс. . канд. мед. наук. — Москва, 1988.
70. Куприянова Н. Ю. Эпидемиолгические подходы к изучению роли собак и кошек, как резервуаров возбудителей Токсокароза / Гельминтозы человека: Респ. сб. науч. тр. — Ленинград, 1987. С 43-45.
71. Ладовская М. В. Паразитарные заболевания легких // Медицинская паразитология. 1993. № 2. — С 43-49.
72. Лавров В. Ф., Русаков Е.В., Шапошников А. А. и др. Основы иммунологии, эпидемиологии и профилактики инфекционных болезней.-Учебное пособие для врачей. М.: ЗАО « МП Гигиена», 2007. — 311с.
73. Лагвилава Э. А. Клиническая характеристика и лечение токсокароза у детей. Дисс. .канн. мед. наук. Пермь, 2000.
74. Лебедев К.А., Понякина И. Д. Иммунограмма в клинической практике. М. Наука, 1990.-224с.
75. Лебедева М. Н., Михальцин Ф. С., Фролова А. А и др. Социально-экономическая эффективность профилактики массовых гельминтозов // Медицинская паразитология. 1998. — № 3.- С 23-26.
76. Лейкина Е. С. Заболевания человека, вызванные миграцией личинок-нематод животных (обзор зарубежной литературы) // Медицинская паразитология. 1962. № 1. — С 100-104.
77. Лейкина Е. С. Иммунитет при гельминтозах // Основы общей гельминтологии. М. наука, 1976. — Т 3. — С 89-168.
78. Лейкина Е. С. Стимуляция и супрессия гельминтами иммунных реакций хозяина на гетерологические антигены. Сообщение 2. Иммуно-супрессивное действие гельминтов // Медицинская паразитология. — 1978. №6.-С 16-22.
79. Лейкина Е. С., Плотников Н. Н., Прокопенко Л. И. Основные методы борьбы с гельминтозами. Их усовершенствование и развитие // Медицинская паразитология. 1974. — № 3. — С 259-265.
80. Ленкаускайте Г. Л., Циронкайте Э. А., Мейрате А. И. и др. К вопросу эпидемиологии и диагностики токсокарза в г. Вильнюсе // Актуальные проблемы паразитологии в Прибалтике : материалы к IX научнр-кординационной конференции,- 1982.-С 145-148.
81. Лысенко А. Я. Общие и особенные черты ларвальных гельминтозов человека // Медицинская паразитолгия. 1998. — № 2. — С 27-31.
82. Лысенко А. Я., Авдюхина Т. И, Федоренко Т. Н. Сероэпидемиология токсокароза и токсоплазмоза в смешанных очагах. Сообщение 1. иммунологическая структура населения в городском и сельских очагах // Медицинская паразитология.- 1987. № 3.- С 34-38.
83. Лысенко А. Я., Владимова М. Г., Кондрашин А. В., Майори Дж. Клиническая паразитология.- Женева: ВОЗ, 2002. 734с.
84. Лысенко А. Я., Красильников А. А. Лабораторные методы диагностики паразитарных болезней. Москва, 1999. — 58с.
85. Лысенко. А. Я., Константинова Т. И, Авдюхина Т. И. Токсокароз //Учебное пособие. Москва, 1996. -37с.
86. Лысенко А. Я.,Фельдман Э. В., Рыбык Е. А. Влияние инвазированности детей на иммунитет // Медицинская паразитология. -1991 № 5 — С 3436.
87. Лурье А. А., Щербаков А. М. Фармококинетика мебендазола у человека //
88. Медицинская паразитолгия. 1998. — № 5. — С 68-72.
89. Магдиев С. Р., Зиганшина Н. X., Фузайлов Ю. М. Сравнительная эффективность и переносимость вермокса, комбатрина и медамина при лечении нематодозов // Актуальные вопросы медицинской паразитологии: Сб. науч. тр.- Ташкент, 1988. С 68-71.
90. Мазманян М. В. Антиген к Toxocara canis как фактор сенсибилизации больных неинфекционно-аллергической формой бронхиальной астмы. Дис. .кан. мед. наук.- Москва, 1998.
91. Мазманян М. В., Тумольская Н. И. Взаимосвязь токсокарной инвазии с бронхиальной астмой // Медицинская паразитология. 1998. № 2. — С 54-59.
92. Майборода А. А., Куприянова Н. Ю., Селинский И. Н. Морфология воспалительной реакции в паренхиматозных органах мышей, инвазированных токсокарами // Медицинская паразитолгия. — 1991. №1. -С 47-49
93. Майер К.-П. Гепатит и последствия гепатита: Практич. Рук.: Пер. с нем. / Под. Ред. A.A. Шептулина. -М.: Гэотар-Медицина, 1999. 431с.
94. Медуницин Н. В. Цитокины и аллергия, опосредованная Ig Е // Иммунология. 1993. № 5. — С 11-13.
95. Актуальные проблемы инфектологии и паразитолгии : Материалы 1-ймежд. юбил. конф. Томск, 2001. — С 101-102.
96. Мельникова Л. И. Геогельминтозы в патологии человека // Медицинская паразитология.- 1999. № 5. — С 51-53.
97. Мерзлова Н. Б., Лагвилава Э. А., Горбань Л. Я. Особенности течения токсокароза у детей Пермского региона / Актуальные проблемы инфектологии и паразитолгии : материалы 1-ой межд. юбил. конф. 3 Томск, 2001.-С 105-106.
98. Мерзлова Н. Б., Лагвилава Э. А., Пчельников М. Г. Раннее выявление паразитарной инвазии детского населения : материалы 5-го конгр. педиатров, Москва, 16-18 февр. -М., 1999. С. 283-284.
99. Михайлов В. Б., Мотырева А. И., Соколова и др. Токсокароз в Удмуртии / Актуальные проблемы инфектологии и паразитолгии: Материалы 1-ой межд. Юбил. конф. Томск, 2001. -С 133.
100. Михайловская Н. И., Атяшева Л. Н., Московская И. А. Использование количественных критериев эхографии печени в дифференциальной диагностике хронических гепатитов у детей. // Опыт деятельности диагностических центров. Москва. 1998.- С 106-107.
101. Митков В. В. Клиническое руководство по ультразвуковой диагностике. -М.: Видарт, 1996-1998. Т. 1-5.
102. Московская И. А. Болезни печени у детей. Руководство. Под. ред. Студеникина М. Я. Тула,: Гриф и К, 2007.- 512с.
103. Назаренко С. И., Мозгова Л. А., Назаренко Л. В. Выявленный случай врождненного токсокароза // Информационный бюллютень « Новости Вектор-Бест». 2000. — № 2. — С 5-6.
104. Найт Р. Паразитарные болезни : Пер. с анг.- М.: Медицина, 1985,- 416 с.
105. Насонов Е. Л., Соловьев С. К., Шайков А. В., Богданов М. В. // Клин, фармакол. и терапия.- 1995,- № 4- с. 44- 49.
106. Новикова В. И. Иммунореабилитация часто болеющих детей. Афтореф. дис. . д.м.н., Москва, 199. 23с.
107. Овчинникова В. А., Соловьева В.А., Приклонский А. В. Лечениенепаразитарных кист печени и их осложнений // Рос. журн. гастроэнтерол., гепатол., колопроктол.-1996.- Т.6. № 2.- С. 34-37.
108. Основные методы лабораторной диагностики паразитарных болезней. -ВОЗ, Женева, 1994.
109. Озерецковская Н. Н. Органная патология в хронической стадии тканевых гельминтов: роль эозинофилов крови и тканей, иммуноглобулины G, Е и факторов индуцирующих иммунный ответ // Медицинская паразитология. -2000. № 4. — С. 9-14.
110. Озерецковская Н. Н. Подходы отечественных паразитологов -иммунологов к терапии паразитарных болезней // Медицинская паразитология. 1998. № 2. — С. 12-15.
111. Озерецковская Н. И. Клинико-иммунологические подходы к построению тактики лечения гельминтозов, оценке и прогнозу его эффективности / Гельминтология сегодня: перспективы и проблемы. : Сб. науч. тр.-Москва, 1989. Т 2.- С. 36.
112. Озецковская Н. Н. Эозинофилия крови и иммуноглобулин Е; Особенности регуляции при гельминтозах и аналогичных болезнях // Медицинская паразитология.- 1997. № 2. — С. 3-9.
113. Озерецковская Н. Н. Иммуносупрессия при паразитарных болезнях, её значение в патогенезе и клинике // Медицинская паразитология. 1979. №5.-С. 3-11.
114. Озерецковская Н. Н., Тумольская Н. И., Зальнова Н. И. Клиника и лечение гельминтозов. — JI: Медицина, 1989. С. 8-16, 169-173.
115. Ошевская 3. А., Гелыптейн В. С., Боровков Г.Е. Сравнительная эффективность медамина и вермокса при энтеробиозе // Медицинская паразитология. 1992. — № 2. — С. 34-35.
116. Павлов А. В., Романенко Н. А., Хизняк Н. И. Биологическое загрязнение окружающей среды и здоровье человека. Киев, 1992. — 324 с.
117. Педиатрия: Руководство. Инфекционные заболевания. Пер. с англ. / Под ред. Р. Е. Бергмана, В. К. Вогана. 2-е изд., перераб. И доп. — М.:1. Медицина, 1992. 640 с.
118. Петров Р. В., Степина М. А., Лебедев К. А. Особенности оценки количества Т-лимфоцитов и других розеткообразующих клеток в крови здоровых и больных людей // Бюллетень экспериментальной биологии и медицины. 1976. -Т 81. — № 2.- С. 197-199.
119. Петров Р. В. // Иммунология. М., Медицина, 1982.
120. Петров Р. В., Хаитов Р. М., Пинегин Б. В. Оценка иммунологического статуса человека при массовых обследованиях; методические рекомендации для научных работников и врачей практического зравоохранения // Иммунология. 1992. — № 6. — С. 51-62.
121. Пискунова Е. А., Безгодов В. Н., Горячкина В. Н. и др. К вопросу о распространённости токсокароза и оценке уровня загрязненности почвы яйцами токсокар в Кировском районе г. Перми // Материалы 1-й межд. юбил. конф. Томск, 2001. — С. 138.
122. Плотникова И. А. Влияние токсокароза на течение атопического дерматита у детей // Дисс. Канд. мед. наук. Екаренберг, 1998.
123. Плотникова И. А., Медведева С. Ю. Клинико-морфологические особенности течения атопического дерматита и некоторых других форм дерматозов у детей, страдающих токсокарозом. Аллергология 1998. — № 4. — С. 15-20.
124. Плэйфэр Д. Наглядная иммунология. Пер. с англ. М., 1999.
125. Поляков В. Е., Клайшевич Г. И., Лялина В. Н. Токсокарозы у детей // Медицинская консультация. 1996. — № 4. — С. 11-14.
126. Поляков В. Е., Клайшевич Г. И., Поляков Н. В., Общая характеристика гельминтозов ( глистных инвазий) и нематодозов у детей. Энтеробиоз. // Мед. помощь. 1996.- № 3. — С. 29-32.
127. Поляков В.Е., Клайшевич Г. И., Поляков Н. В. Глистные заболевания // Школа здоровья. 1997. — № 1. — С. 29-32.
128. Поляков В. Е., Лысенко А. Я. Гельминтозы у детей и подростков. М.:1. Медицина, 2003.- 256 с.
129. Поставит В. А. Руководство по инфекционным болезням. Спб, 1997. -501 с.
130. Привалова Н. К. Клиника, диагностика и лечение токсокароза // Материалы региональной научно-практической конференции. -Биробиджан, 1999. С. 97-98.
131. Райт А. Основы иммунологии: Пер. с анг. М.: Мир, 1991. — 328 с.
132. Раманаускайте М. Б., Байоринец Д. В., Пташкес Р. С. Клиника токсокароза у детей // Педиатрия. 1978. — № 1.- С. 54-60.
133. Романенко H. JI. Санитарное законодательство по профилактике Паразитарных болезней // Медицинская паразитология. — 1993. № 2. — С. 36.
134. Романенко Н. А., Падченко И. К., Чебышев Н. В. Санитарная Паразитология. М: Медицина, 2000. — С. 9-1.
135. Самсыгина Г. А. Железодефицитные анемии у детей: профилактика и лечение // Лечащий врач. 2001. — № 5-6. — С. 62-65.
136. Сергиев В. П. Значение паразитарных болезней в патологии человека // Медицинская паразитология. 1991. — № 5. — С. 3-6.
137. Сергиев В. П., Лебедева M. Н., Фролова А. А. Паразитарные болезни человека, их профилактика и лечение // Эпидемиология и инфкционные болезни. 1997. — № 2. С. 8-11.
138. Сергиев В. П., Лебедева M. Н. Распрастранённость паразитарных болезней и их профилактика в России // Медицинская паразитология. -1997. № 3. — С. 5-9.
139. Сметанников В. М., Калугин И. А. Токсокароз у детей//« Новое, прогрессивное в практику здравоохранения»: Тезисы науч-прак. конф.-Ульяновск, 1990.- С. 75-76.
140. Соринсон С. Н., Мирзаев К. М. Комплексная фармакотерапия при инфекционных заболеваниях. Изд. 2-е. — Тащкент : Медицина, 1990.
141. Соринсон С. Н. Гельминтозы. Клиническая лекция. Н. Новгород: НГМИ, 1993.-С. 27.
142. Соринсон С. Н. Инфекционные болезни в поликлинической практике : Рукаводство для врачей. Спб. : Гиппократ, 1993. — 320 с.
143. Сосипатрова А. А. Изучение патоморфологических изменений в паренхиме органов овец при заражении их неспецифическими гельминтами (Ascaris suum, Toxocara canis) // Материалы научной конференции ВОГ 1969- 1970. выпуск 23.- М, 1971. С. 253-255.
144. Суворова К. Н., Антоньев А. А., Доважанский С. И., Писаренко М. Ф. Атопический дерматит. Саратов: Издательство Саратовского университета, 1989 ; 168 с.
145. Суханова Г. И., Каминский Ю. В., Шитер С. В. Диагностика и адаптационные сдвиги у больных ларвальным парагониазом // ‘ материалы Международ. Сим. Фонда мед. обмена Японии и России. -Токио, 1995.-С. 7-12.
146. Тест- система иммуноферментная для выявления антител к антигенам гельминтов // Инструкция по применению. — Новосибирск, 2000.-16 с.
147. Тихомирова Э. П. Сравнительная эффективность медамина и ментизола в лечении стронгилоидоза // Медицинская паразитология. — 1991.-С. 24-26.
148. Тихомирова Э. П., Доценко В. JI. Эффективность лечения больных нематодозами медамином // Гельминтозы человека: Респ. сб. науч. тр. Ленинград, 1989.-С. 34-39.
149. Токмалев А. К. Гельминтозы человека: клинико-патогенетические особенности, современное состояние диагностики и лечения // Лечащий Врач.- 2007. № 9.- С. 41-45.
150. Тотолян А. А. Иммуноглобулин Е: структура, продукция, биологические эффекты и диагностическое использование // Аллергология. 1998- № 2.- С. 4-7.
151. Тузанкина И.А., Синявская О. А., Шершнев В. Иммунопатологические состояния в педиатрической практике. — Екатеренбург, 1998. — 135 с.
152. Тумольская Н. И. Токсокароз человека: современный подход // Врач.1997.-№9.-С. 11-13.
153. Тумольская Н. И., Мазманян М. В. Опыт лечения больных висцеральной формой токсокароза // Актуальные проблемы инфектологии и паразитолгии: Мат. Межд. конф. Томск, 2001.- С. 101.
154. Тумольская Н. И. Клинические аспекты проблемы токсокароза. В кн:
155. VI Российский съезд врачей инфекционистов, 29-31 октября 2003 г. Спб., 2003.-С. 385-386.
156. Усов И. Н., Фурсевич В. М., Кевра М. К. Фармакорецептурныйсправочник педиатра. — 2-е изд.- Минск, 1994.
157. Учайкин В. Ф. Руководствотпо инфекционным болезням у детей. М.: ГЭОТАР- МЕД, 2001. — 824 с.
158. Федотова Г. П. Энтеробиоз в дошкольных учреждениях // Медицинская паразитология.- 1999.- № 1. С. 61-62.
159. Фролова С. Б., Волков Г. Н., Боготов Н. И. Сероэпидемиология токсокароза в очаге описторхоза Западно- Сибирского региона // Медицинская паразитология.- 1997. № 4. — С. 21-24.
160. Хазанов А. И. Фукциональная диагностика заболеваний печени. М.: Медицина, 1998.-301 с.
161. Хендерсон Дж. М. Патофизиология органов пищеварения : Пер. с англ.- М. Спб.: Бином- Невский диалект, 1997. 278 с.
162. Ходасевич Л. С., Леонтьев В. Я., Ладыгина А. С. И др Висцеральный токсокароз // Архив патологии. 1998. — № 5.- С. 54-55.
163. Чагин К. П., Шуйкина Э. Е., Лейкина Е. С. И др. Состояние и перспективы научных исследований по иммунологии паразитарныхболезней // Медицинская паразитология. — 1978. № 6.- С. 10-16.
164. Чебышев Н. В., Богоявлинский Ю. К., Гришина Е. А. Гельминтозы : органно- системные процессы в их патогенезе и лечении.- М: Медицина, 1999.- 155 с.
165. Чередниченко В. М. Поражение глаз при токсокарозе // Офтальмология. 1985. — № 4.- С. 236- 243.
166. Черкасский Б. А. Инфекционные и паразитарные болезни человека. М: Медицина, 1997. — С. 494-495.
167. Чистенко Г. Н., Василевко И. В., Павлюченко В. Б. и др. Токсокароз: распространенность, источники инвазии, факторы передачи // Здравоохранение ( МЗ Беларусь).- 1996. № 5.- С. 58-59.
168. Чобанов Р. Э. Гулиева Р. О., Нифтулаев Н. 3. Серологическое обследование на токсокароз населения агломерации Баку // Медицинская паразитология. 1990. — № 3.- С. 35-38.
169. Шептулин А. А. Новые данные о применении урсодезоксихолевой кислоты при лечении заболеваний печени // Gastroenterol, Hepatol. — 2000. № 4.- P. 24-25.
170. Шувалова Е. А. Инфекционные болезни.- М: Медицина, 2001.- С.’ 283285.
171. Шуйкина Э. В. Значение иммунитета в паразито- хозяинных отношениях // Актуальные проблемы гельминтологии: Сб. науч. тр. — Москва, 1989. С. 260-285.
172. Шуйкина Э. В. Аспекты клинической и эпидемиологической иммунологии при паразитарных болезнях // Медицинская парпзитология.- 1989. № 5. с. 89-93.
173. Щегловская Г. А., Струкова И. А., Мошенская С. П. и др. Некоторые клинико-эпидемиологические особенности токсокароза // Актуальные вопросы неотложной медицины : Сб. тр. науч. конф. Липецк, 1999. — Т 2.- С. 200-201.
174. Щенников Э. Л., Отцова А. Г. Паразитарные заболевания ибронхолегочной синдром // Клиническая медицина. 1996.- № 7. — С. 48-49.
175. Щербаков А. М., Пантелеева Е. Я., Фирсова Р. А. Лечение мебендазолом больных альвеолярным эхинококкозом // Медицинская паразитология. — 1993.-№2.-С. 14-16.
176. Эмужите Р., Байориненс Д. Я., Янулявичуте Н. Токсокароз и токсоплазмоз у больных с повторными респираторными и аллергическими болезнями // Гельмитология сегодня: проблемы и перспективы : Тезисы докл. науч. конф. Москва, 1989. — Т 2. — С. 190.
177. Ющук Н. Д., Венгеров Ю. Я. Лекции по инфекционным болезням. В Двух томах. -М.: ВУНМЦ, 1999.
178. Ющук Н. Д. и др. Гельминтозы: Мето. Указания. М., 1995.
179. Ямпольская О. В. Разработка метода иммунодиагностики и сероэпидимиологическое исследование токсокароза человека // Дисс. . кандит. Мед. наук. Москва, 1987.
180. Ямпольская О. В., Игнашенкова Г. В. Опыт сероэпидемиологического обследования детей на токсокароз с помощью реакции энзим меченных антител ( РЭМА) // Медицинская паразитология.- 1978. № 4. С. 52-54.
181. Янович В. А., Брюнеткина Н. М. исследования почвы на наличие яиц Токсокар в Еврейской Автономной области // Медицинская паразитология. 1999. — № 3. — С. 29-36.
182. Abe N., Yasurfwa A. Pervalence of toxocara spp eggs in sandpis of pare in Osaka city Japan with notes on the prevention of egg contamination у fence construction // J Vet. Me. Sci.- 1997, Jan.- 59 (1). P. 79-80.
183. Agazamova G. S. Experience in treatment of chronic toxic hepatitis by ursodeoxicholic acid // Med. Tr. Prob. Ekol. 2001.- V. 1. — P. 39-42.
184. Ajayi О. O., Duhlinka D. D., Agwale S. M. Frequence of human toxocara in Plateau state, Nigeria // Mem-Just- Oswaldo-Cruz.- 2000, Mar-Apr/- 95(2).-P. 147-9.
185. Akadgi K. Enterobius vermicularis and Enterobiasi. // Progr. Me. Parasit.
186. Japany. -1973. -V. 5. P. 233-379.
187. Akao N. Takayanagi N. N., Zuzuki R. Ocular larva migrans caused y toxocara cati in Mongolian gerbils and a comparison of ophthalmologic findings with those productd bu T. canis // Parasitol. 2000.- V. 86(5).- P/ 1133-5.
188. Alba- Hurtago F.,Tertora P.G., Tsutsum V. Histopatothological investigation of experimental ocular toxocariasis in gerbils // Parasitol. 2000.- V. 30(20). — P. 143-7.
189. Amin H. I., Donald H. R., Han D. P. Vitrectomy update for macular traction in ocular toxocariasis // Retina, 2000. V. 20( 1)/- P. 80-5.
190. Amon U., Menz U., Wolff H. H. Investigation in plazma ievels jf mast cell mediators in acute atopic dermatitis. J. Dermatol Sci 7: 63, 1994.
191. Baldisserofto M., Conchin C. F., Soares M. D. Ultrasound findings in children with toxocariasis: report of 18 cases // Pediatr. Radial. 1999, May, 29(5).- P. 316-9.
192. Ballek D., Takla M., Ising- Volmer S. et ai. The helminth of the red fox in Nordhessen and Oxtvestfalen // DTM. Dtsch. Tierar. Ztl. Wocheushr. -1992. -V. 99 (4). P. 435-37.
193. Balmer A., Munier F. Leukokoria in child- emergency and challenge // Klin. Monatsbl. Augenheiekd. 1999, May. — V. 214 (5). — P. 332-5.
194. Bardon R., Cuellar C., Guillen J. I. Larval distribution of toxocara canis in BALB c mince at nine weks and one year post-inoculation // Htlminthol. -1994, Dec. 68 (4). P. 359-60.
195. Barisani-Asenbauer T., Maca S. M., Hauff W. Treatment of ocular toxocariasis with albendazol // Ocul. Pharmacol. Ther. — 2001. -V. 17(3). P. 278-94.
196. Barra L. A., dos- Santos W. F., Chieffi P. P. Visceral larva migrans: a mixed from of presentation in an adult. The clinical and laboratory aspects // Rev/ Soc. Bras. Med. Trop. 1996. — V. 29 (4). — P. 373-6.
197. Beaver P. C. Larva migrans // Exep. Parasitologu. 1956. V. 5. — P. 587-621.
198. Beaver P. C., Snyder c., Can-era G. Chronic eosinophilia to visceral Larva
199. Migranis // Pediatries. 1952. — V. 9. — P. 7-19.
200. Beerlandt N., Draland L., De-Keersmaecher L. et al. Ocular toxocariasis in a 36 year-old patient: a case report // Bull. Soc. Beige Ophtalmol. 1995. -259.-P. 177-81.
201. Bench Adis for the diagnosis of intestinal parasites. WHO, Geneva, 1994.
202. Bench Adis for the diagnosis filiarial infection. WHO, Genrva, 1997.
203. Bercoft D. M. O. Infection by the dogs roundworm and fatal myocarditis // // New Zeal. Med. J. 1964/ — V. 63. — P. 729.
204. Biglan A., Glickman L., Lobes L. Serum and toxocara antibody in nematode endophtalmitis // Am. J. Ophtalm. 1997. — V. 88. — P. 898-901.
205. Blanchard J. A. 2nd, Barve S., Joshi- Barve S. et. Al. Cytokine production by CAP AN -1 and CAPAN-2 cell liens // Dig. Dis. Sei. 2000.— — V. 45. N 5.-P. 927-932.
206. Bouchard O., Arbib F., Paramelle. et al. Acute euosinofilic pneumonia and larva migranis sindrome a propos of a case in an adult // Rev. Mai. Respir. — 1994.-V. 11 (6).-P. 593-595.
207. Bouree P., Grimault E., Fromention J., et. Al. Visceral larva migrans in adults with severe pulmonary manifestations // Press. Med. 1997.- 26(2). -P. 70-72.
208. Buijs j. Toxocara infection and airway function: an experimental and epidemiological stady. Utrecht.- 1993.- 190 p.
209. Buijis J., Borsboom G., van Gtmund J. J., et. al. Toxocara seroprevalence in 5- year- old schoolchildren: relation with allergic astma // Am. J. Epidemiol. 1994. — V. 140 (9).- P. 839-47.
210. Bujis J., van Knapen F. Toxocara infection in children and relation with allergic manifestations // Vet. O. -1994. -V. 16.- P. 138-143.
211. Buijs J., Lokhorst W. H., Robinson J., et. Al. Toxocara canis inducedmurine pulmonary inflammation: analysis of cells and proteins in lung tissue and bronchoalveolar lavege fluid // Parasite-Immunol. 1994- V. 16(1)/ — P. 1-9.
212. Burke T. m., Edwards L. R. Prenatal and lactacional transmission of Toxocara canis and Ancylostoma canis: experimental infection of this biet at pregnancy and parturition // Int. J. Parasitol.- 1985.- V. 15(5). P. 485-90.
213. Caldwell-Blatz S., Chu J. How to stop the spread to toxocariasis // Nursing.-2000.-V. 30(1). P. 17.
214. Cameron F. J., Sohai S. A., Scheimberg I. The significance of hepatic lesion associated with small adrenocortical tumors in childhood // Br. J. Radiol.1997.- V. 70(836).- P. 852-5.
215. Chandhuri R. N., Saha T. K. Topical eosinophilia. Experiments wich Toxocara canis // Lancet. 1959. — V. 2.- P. 493.
216. Chalasani N., Wilcox D. M. Etiology, evaluaton and outcjme of jaundice in patients with acquired immunodeficiency sundrome // Hepatology.- 1996.23,- P.728-733.
217. Charlotee F., Bachir D., Nenert M., et. al. Vascular lesion of the liver in sckle cell disease. A clinicopathological stady in 26 living patients. // Arch. Pathol. Lab. Med.-1995.-V. 119.-P. 46-52.
218. Cilia G., Perez-Trallero E., Gutierres C., et. al. Seroprevalence of toxocara infection in middl-class and disadvantaged children northern Spain // Eur. J. Epidemiol. 1996. — V. 12(5). — P. 541-3.
219. Cook G. C. Parasitic disease in clinical practice. Springier-Verlag; London; 1990.
220. Costa-Cruz J. M., Nunes R. S., Buso A. G. Presence of Toxocara sppeggs in public squares of Uerlandia city, Minas Gerais, Brazil II Rev. Just. Med. Trop. Sao. Paulo. -1994. V. 36(1). — P. 39-42.
221. Cullar C., Fenoy S., Aguila C., et. al. Isotype specific immune responses in murine experimental toxocariasis // Men. Just. Oswaldo cruz.- 2001.- V. 96(4).-P. 549-53.
222. Davids P. H. P., Tanka A. K. F., Rauws E. A. G. et. al. Benign biliary structures: surgery or endoscopy ? // Ann. Surg. — 1993. V. 217. — P. 237243.
223. Dmoch A., Matulinski R. Toxocariasis syndrome as of hypereosinophilia // Przegl. Lek. 1995. -V. 52 (12).- P. 610-1.
224. Duprez T. P., Bigaignon G., Delgrange F. et. al. M RI of cervical cordlesion and treir resolution in Toxocara canis myelopatathy // Neuroradiology. —1996. Nov, 38 (8). P. 792-5.
225. Eberhard M. L., Alfano E. Adult Toxocara cati infection in U. S. chirdren: report of four cases // Am. J. Trop. Med. Hyd. 1998, Sep, 59 (3). — P. 404-6.
226. Epe C., Menwissen M., Stoye M. Transmission trals ITS2-PCR and RAPD-PCR show identity of Toxocara canis isolates red fox and dog // Vet. Parasitol. 1999, 84 (1-2). — P. 101-12.
227. Epe C., Sabel T., Sclinierder T/ The behavior and pathogeniciti of Toxocara canis in mice of different strains // Parasitol. Res. — 1994, 80(8)/ P. 691-5.
228. Espana A., Serna M. J., Rubio et. al. Secondary urticaria due to toxocariasis: possibly caused by ingesting raw cattle meat ?// J. Invest Allergol. Clin. Immunol. 1993. — V. 3. -Nl.- P. 51-52.
229. Fendric A. M., Baldwin J. Allergrn-infduced inflammation and the role of immunoglobulin E (Ig E) // Am J Ther. 2001 Jul-Aug. — V. 8 (4). P. 291-7.
230. Fenoy S., Curllar C., Guillen J. L. Serological evidence of Toxocariasis:in patients from Spain with a clinical suspicion of larva migrans // J. Hemithol. —1997, Mar, 71(1).-P. 9-1.
231. Fok E., Rozgomyi F. Epidemiology and public htalth consequence of human toxocariasis as frequently occurring urban zoonosis // Ory. Hetill/ 1999. — V. 140(27).-P. 1513-8.
232. Gan Y., Wu Q., Ou F., Li G. et. al. Studies on the efficacy of albendazol candy for treatment or intestinal nematode infections // Zhongguo Ji Sheng Chong Xue. 1994. — V. 12 (2). — P. 147-9.
233. Glickman L. T., Schantz P. M., Epidemiology and pathogenic of zoonotic toxocariasis // Epidemiol. Revue. 1981. — V. 3. — P. 230/
234. Gillespie S. Toxocara: dogwalking and playing fields // B. J. Sports Med. — 2001, Feb, V. 35(1).-P. 6-7.
235. Goffette S., Jeajean A. D., Duprez N. F. Eozinophilic and myelitis related to toxocara canis infection // Eur. J. neurol. 2000, Nov. — 7(6). — P. 703-6.
236. Guerglio B., de-Gentile L., Uguyen J. M. et. al. Epidemiologic approach to human toxocariasis in western France // Parasitol. Res. -1994. V. 80(6). -P. 531-6.
237. Guerra A., Navarro C., de-Guevana C. L. Seropre valence of toxocariasis in children and case of VLM // Eur. J. Epidemiol.- 1995, Dec, 11)6).- P. 701-2.
238. Habner J., Unlakov M., Leissova M. Diagnosis of the early phase of toxocariasis using Jg G avidity // Epidemiol. Microbiol. Ivvunol. -2000, Apr.-50(2).- P. 67-70.
239. Hakim S. L., Thadasavanth M., Shamilah R. H. et. al. Prevaience of toxocara canis antibody among children with bronchial astma in Klang Hospital, Malaysia // Trans. R. Soc. Trop. Med. Hyg. 1997,- V. 91(5). P. 528.
240. Hartleb M., Januszwski K. Sever hepatic invovement in visceral larva migrans // Eur. J. Gastroenter. Hepatol. 2001,- V. 13(10). P. 1245-9.
241. Hassan A. T., el-Manawaty N. H. Experimental murine toxocariasis histopathological study of chronic renal infection, transplacental transmission end ultrastruchural study of egg shell // J. Egypt. Soc. -Parasitol. 1994, Aug,24 (2). — P. 333-9.
242. Hassan M. M., Farghaly A. M., GaberN. S. et al. Parasitic causes of hepatomegaly in cgildren // J. Egypt. Soc. Parasitol. — 1996, Apr. -26(1).- P. 177-89.
243. Havasiova K., Dubinsky P., Stefansikova A. A seroepidemiologiacal stadu of human Toxocara infection in the Slovak Republic // J. Helmintol. -1993, Dec.-67(4). P. 291-6.
244. Herry J., Philippe B., Hennequin C. Acute life-treatining toxocaral tamponade // Chest.- 1997, Dec. -112(6). -P.1693-3.
245. Hoffen R. J., Kilaghbian T., Esekogwi V. I., Henderson S. O. Cjmmjn presentation of amoebic liver abscess // Ann. Emerg. Med.- 1999. № 34. P. 351-355.
246. Horton J. Albendazol: a review of anthehelmintic efficacy and safety in humans//Parasitology.- 2000.-V. 121.-P 8113-32.
247. Hrckova G., Veiebny S. Treatment of toxocara canis infections in mice with Lipo some-incorporated benzim-idazol carbamates and immunomodulatio glucan // J/ Helmintol. 2001, Jun.- V. 75(2). P. 141-6.
248. Humbert P., Bardde T., Buchet S. Toxocariasis. A cosmopolitan parasitic zoonosis // Alleg. Immmunol. Paris. 1995.-27(8). — P. 284-91/
249. Humbert P., Niezborala M., Salimbier R. et. al. Skin manifestation associated wich toxocariasis: a case control study// Dermatol.- 2000. V. 201(3). — P. 230-238.
250. Jacob C. M., Pastorino A. S., Peres B. A. Clinicala and laboratorial ftatures of visceral toxocariasis in infancy // Rev. Just. Med. Trop. De Sao Paolo-1994, Jan-Feb, 36(1). P. 19-26.
251. Jain-Noureddine V., Baral T. Toxocara sp. In the playgrounds and sand pits in Besanson // Ann. Pharm. Fr.- 1997.- 55(5). P. 224-7.
252. Jeanfaivre T., Cimon B., Toistuchow N et. al. Pleurai effusion and toxocariasis // Thorax.- 1996, Jan.- 51(1). P. 106-7.
253. Jeffrey H. S., leach R. V. Atlas of Medical Helminthology and Protozooiogy. Second ed. // Churchill Livingstone. Edinburg London and N-Y.- 1975. P. 4.
254. Juszko J., Marczynska M., Zarnowska H. Diagnosis and treatment of eye in infections caused by the canine ascaris Larva Toxocara canis // Klin. Oczna/1994, Aug-Sep. 96(8-9).- P. 275-80.
255. Jimenz J. E.,Valladares B., Fernandes-Palacion J. M. et.al. A serologic study of human toxocariasis in Canary Islands (Spain), environmental influence // Am. J. Trop. Med. Hyg.- 1997, Jan, 56(1).- P. 113-5.
256. Kincekova J., Dubinsky P., Filka J. et. al. Toxocara infections in childhood in Relation to reactive arthritis // Epidemiol-Microbiol. Immunol.- 1997, Mar, 46(1).-P. 39-41.
257. Kincekova J., Reiterova K., Dubinsky P.Larval toxocarosis and it clinical manifestation on childhood in the Slovak Republic // J. Helmentol. -1999,1. Dec, 73(4).-P. 322-328.
258. Krukar-Baster K., Zygulska-Mach H., Sajak-Hydzik К/ Long-term observations of ocular toxocariasis in children and youth // Klin-Oczna.-1996.- 98 (6).-P. 445-8.
259. Kumar J., Kimm J. MR in Toxocara canis myelopathy // Am. J. Neuroradiol.-1994, Nov, 15(10).-P. 1918-20.
260. Lani S. Гельминтозы-одна из основных причин недоствточности питания: Программа по международным вопросам питания, отдел наук по питанию.- Нью-Йорк: Университет Cornell, 1993.- Р. 58-61.
261. Lopes- Veles R., Saures De Figuerra M., Gimeno I. et. al. Ocular toxocariasis or retinoblastoma ? // Enferm. Infec. Micribioo. Clin. -1995/- V. 13.N 4- P. 242-245.
262. Lopes- Veles R., Turrientes M. C., Malo O. 2 case of Toxocariasis (visceral larva migrans) // Euferm. Infec. Microb. Clin. -1996, Nov, 14(9). P. 548-550.
263. Loukas A., Doedeus A., ‘Hitz M. Indentification of new C-type lection TES-70, secreted by infectiv larva of toxocariasis, which bins to host ligands // Parasitology 2000, Nov, 121(5). -P. 545-554/
264. Laud-Tonnesen S. Vecceral larva migrans. A cause of eosinophilia in adults // Tidesskr. Nor. Laegeform. -1996, Sep 20/ 116(22). — P. 2660-1.
265. Luo Z. J., Wang G. X., Y ang С J. et. al. Detection of circulating antigen antibodies in toxocara canis infection among children Cheungdu China // J. Parasitol.- 1999, Apr, V. 85(2).- Р/ 2520261.
266. Magnaval J. F., Bery A., Farbe R. Eosinophil cationic protein as a possible maker of active human Toxocara infection // allergy. 2001, 56.- P. 1096-99.
267. Magnaval J. F., Galindo V., Glickman L. T. et. al. Human Toxocara infection of the central nervous system and neurological disordes: a case- control stadu
268. Parasitol. -1997, Nov, 115(5).- P. 537-43.
269. Magnaval J. F., Glickman L. T., Dorchies P. et. al. Highlights of human toxocariasis // Korean J. Parasitol.- 2001.-V. 39(1). P. 1-11.
270. Magnaval J. F.Comparativ efficacy of diethilcarbamazine end mebendazole for the treatment of human toxocariasis // Parasitol.-1995.- V. 110(5). —1. P.529-533.
271. Martinez-Barbadosa I., Ruiz-Gonzalis L. M., Gutierrez-Quiros M. Frequecy of Toxocara Cati eggs in domestic cats in Mexico City and state of Mexico // Bol. Chil. Parasitol.-1997, Jan-Jun, 52 (1-2).- P. 12-17.
272. Maruama S., Nino T., Yamamoto K. Parasitism of Toxocara canis larva in chickens inoculated with the ascarid eggs // J. Vet. Vet. Med. Sci.- 1994, Feb, 56(1).-P. 139-141.
273. Mochamed N. H., Soffar s., sabry N. V. et al. Effect of immunomoduiation on the course of experimental toxocariasis in mice // J. Egypt. Soc. Parasitol.- 1994, Dec, 24(3). P. 671-683.
274. Moreira-Silva S. F., Pereria F.F. Intestinal nematodes Toxocara infection and pyogenic liver abscess in children a possible association // J. Trop. Peditr. -2000, Jun. V. 46(3).- P. 167-172.
275. Nada S. M., Azza B. E., Mahmoud L. A., et al. Toxocariasis as a cause of renal disease in children Sharkia Governorate Egypt // J. Egypt. Soc. Parasitil. 1996. Dec. — v. 26(3).- P. 709-717.
276. Nelson S., Greene T., Ernhart C.B. Tosocara canis infection preschool age children: risk factors and the cognitive development or preschool children // Neurotoxicol. Teratol.- 1996.-V. 18(2).-P. 167-174.
277. Noemi I., Rugiera E., Viovi A. Familial seroepidemiology of toxocariasis // Bol. Chil. Parasitil.- 1994, Jul-Dec. V. 49 (3-4). — P. 52-59.
278. Nunes C. V., Fudisi R. N., Heinemam M. B. et. al. Toxocariasis: serological diagnosis y indirect antibody competition ELISA // Rev. Just. Med. Trop. Sao. Paulo.- 1994, Mar-Apr. V. 42(2). — P. 95-100.
279. Nunes C. M., Sinhorini I. L., Ogassawara S. Influence of soil texture inrecovery of Toxocara canis ages y flotation method // vet. Parasitol. 1994, Jim.- V. 53(3-4).- P. 269-274.
280. Obwaller A., Jesen-Jarolini E., Auer H., et. all. Toxocara infections in humans: symptomatic course of Toxocariasis correlates significantly with levels of Ig E, Anti- Ig E immune complexs // Parasitol. Immunol.- 1998, Jun.—V. 20(7).- P. 311 -317.
281. Oqe S., Oge H. Prevalence of Toxocara spp. Eggs in soil of public pare in Ancara, Nurkey // Dtsch. Tieraraztl. Wochenschr.- 2000, Feb.- V. 107(2). P. 72-75.
282. Ota S., Komiyama A., Johkua K., et. al. Eosinophilic meningoencephaio-myrlitis due to Toxocara canis // Rinsho. Shinkeigaku.-1994.- V.34(l 1).- P. 1148-52.
283. Oteifa N. M., Moustafa M. F., el-Gozamy B.R. Experimental congenital toxocariasis: effut on foetal future immune response // J. Egypt. Soc. Parasitol. -1996.- V. 26(3).- P. 629-638.
284. Panaitescu D., Capram T., Bugarin V. Study of the incidence of intestinal and systemic parasitoses in group of children with handicaps // Roum-Arch. Micribiol. Immunol.- 1995.-V. 54(1-2). P. 65-67.
285. Pent J. Carrera G. M. Eosinophilia in children caused by visceral larva migrans // J. Lousiana State Med. Soc. 1953. V. 105. — P. 275-279.
286. Petithory J. C., Beddok A., Quedos M. Ascaridiasis Zoonoses: visceral larva mygrans syndromes // Bull. Acad. Natl. Med.- 1994, Apr.- V. 172(4).- P. 635647.
287. Prunier F., Delpine S., Victor J. et. al. Loffler,s fibroblastic endocarditis. A eport of case complicationg toxocariasis // Arch. Mal Coeur. Vaiss.- 2001.- V. 94(3).- P. 226-30.
288. Radman N. E., Achelli S. V., Tonrouge R. D. Human Toxocariasis. Its seroprevalence in the citi of La Planto // Men. Inst. Oswaido. Cruz.- 2000, May- Jun.- V. 95(3).- P. 281-5.
289. Rai S. K., Uga S., Ono K. et al. Seroepidemiological study of Toxocarainfection in Nepal // Southlast. Asian. J. Trop. Med. Public. Health.- 1996, Jun.-V. 27(2).-P. 286-90.
290. Rayes A. A., Lamertucci J. R. Human toxocariasis as a possible cause of Eosinophilic arthritis // Rheumatology (Oxford). 2000, Jan. — V.40(l).- P. 109-110.
291. Rayes A. A., Lamertucci J. R. The association between human toxocariasis and pyogenic abscesses // Rev. Soc. Bras. Med. Trop. 199, Jul-Aug.-V.32(4). — P. 425-438.
292. Rayes A. A., Texeira D. M. Tropical piomyositis and human toxocariasis: a clinical and experimental study // Am. J. Med. 2000, Oct.- P. 422-425.
293. Rayes A. A., Texeira D. M., Serufo J. C. et. al. Human toxocariasis and piogenic liver abscess: a possible association // Am. J. gastroenterol.- 2001, Feb. V.96(2). — P. 563-566.
294. Sadjjadi S. M., Khosravi M., Mehrabani D. et. al. Seroprevalence of toxocara infection in school children in Shiraz, southern Iran // J. Trop. Pediatr.-2000, Dec.-V.46(6). P. 327-330.
295. Saint-Blancat P., Morand I., Cladant F.X. Toxocara canis infection. 2 cases of peripheral granuloma in adults // J. Fr. Ophalm.- 1997, V. 20(4). P. 252257.
296. Sane A. C., Barber B. Pulmonary nodules due to toxocara canis infections in an immunocompetent adult // South. Med. J. 1997, Jun.-V.90(l).- P. 78-79.
297. Sellai F., Picard F., Mutschier V. et. al. Myelitis due a Toxocara canis ( larva migrans) // Rev. Neurol., Paris.- 1992.- V.148.-N1.- P. 53-55.
298. Sharghi N., Schantz P. M., Caramico L. et. al. Enviromental exposure to Toxocara as a possible risk factor for asthma: a clinic based casecontrol study //Clin. Inf. Dis. -2001. V. 32.-P. 111-116.
299. Soltys J., Boroskova Z., Duinsky P. et. al. Effect of glucan immunomodulator on the immune response and larval burdens in mice with experimental toxocariasis // Appl. Parasitol. -1996. 37(3).- P. 161-167.
300. Spent J. F. A. Observation on the development of toxocara canis the dogs //
301. Parasitol.- 1958. V. 48.- P. 184-209.
302. Sugane K., Kusama Y., Takamoto M., et. al. Eosinophilia, IL-5 level and recovery of larva in IL-5 transgenic mice infected with Toxocara canis //J. Helminthol.-1986, Jun.- V.70(2). P. 153-158.
303. Taanto N. J., Passamote L., Marinconz R. Zoonotic parasitosis transmitted y Dogs in The Chaco Saltero Argentina // Medicina (B. Aires).-2000.- V.60(2). P. 217-20.
304. Taylor M. R., O Connor P., Hinson A. R., et. al. Toxocara titres in maternal and cord Blood // J. Infect.- 1996.-V.32(3).- P. 231-233.
305. Thomas K., Nidxdoff N., Manger B., et. al. Hypereosinophilia with myocardial involvement due to toxocariasis. Diagnosis of regional myocardia perfusion abnormalities by pulsed tissue Doppler echocardiography // Med. Klin.- 2000.-V.95(3). P. 163-167.
306. Tran V. F., Lumbroso L., Le Hoang P., et. al. Ultrasound biomicroscopy in peripheral retinovitreal toxocariasis // Am. J. Ophtal.- 199.- V. 127(5).- P. 607- 609.
307. Uhlikova M., Hubner J., Kolarova L., et. al. Immunological studies on human larva toxocariasis // Cent. Eur. J. Publ. Health.-1996. V.4(4).- P. 242-5.
308. Vasques-Tsuji O., Ruiz-Hermandez A., Martinez-Barbadosa I. Soil contamination with toxocara sp eggs in public parks and home garden from Mexico Citi // Bol. Chil. Paras.- 1996,- V.51(3-4). P. 54-58.
309. Villano M., Cerillo A., Narciso N. et. al. A rare case of Toxocara canis arachnoiditis //J. Neurosurg. Sei.- 1992.-V.36. N1. P. 67-69.
310. Wang M. Q. Jiang H. J., Inone H. et. al. B cell mitogenic activity of Toxocara canis adult worm antigen // Perasit. Innunol.- 1995, Dec.-V.17(2).-P. 609615.
311. Wilder H. Ocular toxocariasis // Trans. Amer. Acad. Ophalmol. Otolaring.-1950.-V. 88.-P. 898-90.
312. Wolach B., Sinureich Z., Uziel J., Gotesman G., Pomerantz A. Toxocariasis: a diagnostic dilemma // Israel Journal of Med. Sciences. -1995.-V.31.-N 11. P.
313. Woodruff A. W. Toxocariasis //Brit. Med. J. -1970.-5724.-P. 663-89.
314. Yamasaki H., Akaki K., Kim Chooll Lim P. et. al. Development of highly specific Recombinant Toxocara canis Second-Stage larva excretory-secretiry antigen for immuno diagnosis of human toxocariasis // J. Clin. Micribiol. -2000, Apr.-P. 1409-1413.
315. Zacharasiewicz A., Auer H., Brath H. Toxocara and bronchial hyperreactivity-results of seraprevalens stady // Wien. Klin. Wocheuschr.-2000, Nov 10.- V. 112(21). -P. 922-926.
316. Zugulska-Mach H., Krukar-Baster K., Zibrowski S. Ocular toxocariasis in children and youth // Doc. Ophthalmol.- 1993.- V.84.-N 2. P. 145-154.
CDC — Токсокароз — Ресурсы для медицинских работников
Диагностика висцерального токсокароза или глазного токсокароза основывается на наличии признаков VT или OT и истории контакта с потенциальным источником инфекционных яиц или личинок Toxocara (например, в недоваренном инфицированном мясе или субпродуктах). Диагноз висцерального токсокароза ставится на основании сопоставимого заболевания и анамнеза с положительными результатами серологического тестирования.В настоящее время рекомендуемый тест — это иммуноферментный анализ (ELISA) с антигенами личиночной стадии, обычно экскреторные / секреторные антигены высвобождаются при культивировании инфекционных личинок Toxocara . Специфичность этого анализа хорошая, хотя возможна перекрестная реактивность с антителом против круглого червя человека, Ascaris lumbricoides ; однако анализы с использованием экскреторных / секреторных антигенов Toxocara сводят к минимуму эту проблему. Положительные серологические результаты следует интерпретировать с учетом клинического статуса пациента.Обнаруживаемые антитела могут быть результатом инфекции в прошлом. Также серопозитивность может присутствовать при бессимптомной инфекции Toxocara . Парные образцы сыворотки, демонстрирующие значительное повышение уровня антител с течением времени, могут быть полезны для подтверждения активной инфекции.
При глазном токсокарозе уровни антител Toxocara в сыворотке могут быть низкими или отсутствовать, несмотря на клиническое заболевание. В некоторых случаях антитело Toxocara может быть обнаружено в образцах водной или стекловидной жидкости из пораженного глаза и может быть связано с местным образованием антител или утечкой антител из кровотока.Образец глазной жидкости можно тестировать при более низком разведении, чем сыворотка, для повышения чувствительности ELISA.
Признаки и симптомы VT или ОТ могут быть вызваны мигрирующими личинками других гельминтов, включая Baylisascaris procyonis (как VT, так и ОТ), Strongyloides spp. (VT) и Paragonimus spp. (VT). Для дифференциальной диагностики может быть полезно пристальное внимание к течению заболевания, истории воздействия и серологическому анализу. Для ОТ, если личинка визуализируется в глазу, измерение размера может помочь отличить более крупные личинки Baylisascaris от Toxocara или других личинок.
Проявления токсокароза отражают количество мигрирующих личинок, когда личинки мигрировали в организме, а также степень иммунного ответа и воспаления, развившегося в ответ на присутствие личинок. Многие инфекции протекают бессимптомно. При тяжелых инфекциях большое количество личинок может мигрировать через печень, легкие или другие внутренние органы, вызывая воспаление и симптоматическое заболевание (ЖТ). В редких случаях личинки могут мигрировать в центральную нервную систему (ЦНС), вызывая эозинофильный менингоэнцефалит или образование гранулем в ЦНС.Признаки ЖТ включают жар, кашель, хрипы, боли в животе и гепатомегалию. Часто присутствует эозинофилия. Висцеральный токсокароз был предложен как причина астмы; однако могут быть многофакторные причины астмы, и необходимы дальнейшие исследования для установления причинной связи между токсокарозом и астмой.
Обычно ОТ представляет собой одностороннее заболевание, когда личинка проникает в единственный глаз. Общие признаки связаны с гранулематозным воспалением, особенно сетчаткой, увеитом и / или хориоретинитом.Пациенты могут иметь лейкокорию и снижение зрения в пораженном глазу, что можно принять за ретинобластому. Может развиться диффузный односторонний подострый нейроретинит или связки стекловидного тела.
Лечение альбендазолом или мебендазолом показано при висцеральном токсокарозе, хотя оптимальная продолжительность лечения не определена. Оба препарата метаболизируются в печени; Длительное применение альбендазола (от недель до месяцев) привело к развитию панцитопении у некоторых пациентов с нарушением функции печени.Пациенты, находящиеся на длительном лечении, должны контролироваться серийным подсчетом клеток крови. Однако альбендазол использовался для лечения миллионов пациентов во всем мире и в кампаниях массового введения лекарств, и он считается безопасным лекарством с низкой токсичностью. В дополнение к противопаразитарной терапии может быть показана симптоматическая терапия, включая лечение стероидами для контроля воспаления.
| Лекарство | Доза и продолжительность |
|---|---|
| Альбендазол | 400 мг внутрь два раза в день в течение пяти дней (доза для взрослых и детей) |
| Мебендазол | 100-200 мг внутрь два раза в день в течение пяти дней (доза для взрослых и детей) |
Альбендазол для перорального применения доступен для использования людьми в США.
Мебендазол для перорального применения доступен для использования людьми в США.
При глазном токсокарозе цель лечения — минимизировать повреждение глаза. Системное противопаразитарное лечение альбендазолом или мебендазолом в тех же дозах, что и при висцеральном заболевании, может быть полезным при активном заболевании. Попытки удалить личинку хирургическим путем могут оказаться безуспешными. Может быть показан контроль воспаления в глазу с помощью местных или системных стероидов. Для пациентов с нездоровой болезнью улучшение результатов может быть результатом хирургического вмешательства для предотвращения дальнейшего повреждения из-за хронического воспаления.
Детский токсокароз: история вопроса, патофизиология, эпидемиология
Мазур-Мелевска К., Мания А., Фиглерович М., Кемниц П., Служевский В., Михалак М. Влияние возраста на клинические проявления Toxocara spp. инфекция у детей. Энн Агрик Энвирон Мед . 2012. 19 (2): 233-6. [Медлайн].
Кнопп С., Стейнманн П., Кейзер Дж., Утцингер Дж. Нематодные инфекции: гельминты и трихинеллы, передающиеся через почву. Инфекция Dis Clin North Am .2012 июн. 26 (2): 341-58. [Медлайн].
Maruyama H, Nawa Y, Noda S, et al. Вспышка висцеральной мигрирующей личинки, вызванной Ascaris suum, на острове Кюсю, Япония. Ланцет . 1996, 22 июня. 347 (9017): 1766-7. [Медлайн].
Конгдон П., Ллойд П. Инфекция токсокарой в Соединенных Штатах: значимость бедности, географии и демографии как факторов риска и значение для оценки распространенности в округах. Int J Public Health . 2011 фев.56 (1): 15-24. [Медлайн].
Красная книга. Токсокароз. 2009 Отчет Комитета по инфекционным болезням. 28 изд. Американская академия педиатрии . 2009. 666-67.
Turrientes MC, Perez de Ayala A, Norman F, Navarro M, Perez-Molina JA, Rodriquez-Ferrer M, et al. Висцеральная личинка мигрирует у выходцев из Латинской Америки. Emerg Infect Dis . 2011 июл.17 (7): 1263-5. [Медлайн].
Нкуава А., Сако Ю., Ито С. и др.Серологические исследования неврологических глистных инфекций в сельских районах юго-западного Камеруна: токсокароз, цистицеркоз и парагонимоз. PLoS Negl Trop Dis . 6 июля 2010 г., 4 (7): e732. [Медлайн]. [Полный текст].
Colli CM, Rubinsky-Elefant G, Paludo ML и др. Серологическая, клиническая и эпидемиологическая оценка токсокароза в городских районах на юге Бразилии. Rev Inst Med Trop Сан-Паулу . 2010 апр. 52 (2): 69-74. [Медлайн].
Эспиноза Ю.А., Huapaya PE, Roldan WH, et al.Распространенность токсокароза человека в андских сообществах на северо-востоке Лимы, Перу. Rev Inst Med Trop Сан-Паулу . 2010 Февраль 52 (1): 31-6. [Медлайн].
Ляо CW, Сукати Х., Д’Ламини П. и др. Распространенность инфекции Toxocara canis среди детей в Свазиленде, на юге Африки. Энн Троп Мед Паразитол . 2010 январь 104 (1): 73-80. [Медлайн].
Akdemir C. Мигрирующие висцеральные личинки среди детей в Кютахья (Турция) и оценка игровых площадок для T.canis яйца. Тюрк Дж. Педиатр . 2010 март-апрель. 52 (2): 158-62. [Медлайн].
Эльшазли AM, Аттиа G, Эль-Гариб AS, Белал США. Клинические разновидности Toxocariasis canis в Детской больнице Университета Мансура: это недооцененная проблема ?. J Egypt Soc Parasitol . 2011 Август 41 (2): 263-74. [Медлайн].
Канобана К., Вереекен К., Джунко Диас Р., Сариего И., Рохас Л., Бонет Горбеа М. и др. Серопозитивность на токсокары, атопия и астма: исследование на кубинских школьниках. Trop Med Int Health . 2013 8 февраля [Medline].
Sariego I, Kanobana K, Junco R, Vereecken K, Núñez FA, Polman K и др. Частота антител к токсокарам у кубинских школьников. Trop Med Int Health . 2012 июн.17 (6): 711-4. [Медлайн].
Пинелли Э, Херреманс Т, Хармс М.Г., Хук Д., Кортбек Л.М. Серопозитивность к токсокарам и аскаридам среди пациентов с подозрением на висцеральную и глазную миграцию личинок в Нидерландах: тенденции с 1998 по 2009 год. Eur J Clin Microbiol Infect Dis . 2011 июл.30 (7): 873-9. [Медлайн].
Ростами А., Риахи С.М., Голландия CV и др. Оценки серологической распространенности токсокароза у людей во всем мире: систематический обзор и метаанализ. PLoS Negl Trop Dis . 13 (12) декабря 2019 г .: e0007809. [Медлайн].
Линч Н.Р., Эдди К., Ходген А.Н. и др. Распространенность инфекции Toxocara canis в тропической Венесуэле. Trans R Soc Trop Med Hyg .1988. 82 (2): 275-81. [Медлайн].
Cassenote AJ, Lima AR, Pinto Neto JM, Rubinsky-Elefant G. Распространенность серотипов и изменяемые факторы риска Toxocara spp. у бразильских школьников. PLoS Negl Trop Dis . 2014 май. 8 (5): e2830. [Медлайн]. [Полный текст].
Оски Ф.А. и др. Простейшие паразиты. Токсокароз. Принципы и практика педиатрии . 2-е издание. Филадельфия, Пенсильвания: Дж. Б. Липпинкотт; 1994. 1405-08.
Hurni MA, Gerbig AW, Braathen LR, Hunziker T.Токсокароз и синдром Уэллса: причинно-следственная связь ?. Дерматология . 1997. 195 (4): 325-8. [Медлайн].
Вольфром Э., Чен Г., Лежоли-Буассо Х., Бейло С., Женио М., Тайеб А. [Хроническая крапивница и инфекция токсокара canis. Исследование случай-контроль. Энн Дерматол Венереол . 1996. 123 (4): 240-6. [Медлайн].
Bachmeyer C, Lamarque G, Morariu R и др. Висцеральная мигрирующая личинка, имитирующая лимфому. Сундук .2003 Апрель 123 (4): 1296-7. [Медлайн].
Амир Дж., Харел Л., Эйдлитц-Маркус Т., Варсано И. Лимфедема как предвестник токсокароза. Инфекция . 1995 ноябрь-декабрь. 23 (6): 389-90. [Медлайн].
Cruz AT, Франклин GY, Kaplan SL. Токсокароз, вызывающий эозинофильный асцит. Pediatr Infect Dis J . 2008 г. 23 апреля. 27 (6): 563-4. [Медлайн].
Hamidou MA, Gueglio B, Cassagneau E, et al. Пурпура Геноха-Шонлейна, связанная с инфекцией Toxocara canis. Дж Ревматол . 1999 26 февраля (2): 443-5. [Медлайн].
Де Кок С., Леметр Дж., Деуверт Ф. Э. Эндомиокардит Леффлера: клиническая картина как опухоль правого желудочка. J Сердечный клапан Dis . 1998, 7 ноября (6): 668-71. [Медлайн].
Herry I, Philippe B, Hennequin C и др. Острая опасная для жизни токсокаральная тампонада. Сундук . 1997 декабрь 112 (6): 1692-3. [Медлайн]. [Полный текст].
Тобин Э. Х., Чжан Дж., Матон Б.Менингоэнцефалит и миграция висцеральной личинки у женщины при интенсивном контакте с кошками. Инфекция Dis Clin Pract . Май 2011. 19 (3): 221-2.
Salvador S, Ribeiro R, Winckler MI, Ohlweiler L, Riesgo R. Детский нейротоксокароз с сопутствующим поражением церебральной, мозжечковой и периферической нервной системы: отчет о болезни и обзор литературы. Дж. Педиатр (Рио Дж.) . 2010 ноябрь-декабрь. 86 (6): 531-4. [Медлайн].
Центры по контролю и профилактике заболеваний.Глазной токсокароз — США, 2009-2010 гг. MMWR Morb Mortal Wkly Rep . 2011, 10 июня. 60 (22): 734-6. [Медлайн].
Глазной токсокароз — США, 2009-2010 гг. MMWR Morb Mortal Wkly Rep . 2011, 10 июня. 60 (22): 734-6. [Медлайн].
Оски Ф.А. и др. Амбулаторная педиатрия. Эндофтальмит. Принципы и практика педиатрии . 2-е издание. Филадельфия, Пенсильвания: Дж. Б. Липпинкотт; 1994. 888.
Стюарт Дж. М., Кубиллан Л. Д., Каннингем Э.Распространенность, клинические особенности и причины потери зрения у пациентов с токсокарозом глаз. Сетчатка . 2005 25 декабря (8): 1005-13. [Медлайн].
Вудхолл Д. Забытые паразитарные инфекции: токсокароз. Центры по контролю и профилактике заболеваний. Доступно на http://www2c.cdc.gov/podcasts/media/pdf/COCA_Toxocariasis.pdf. Доступ: 4 февраля 2015 г.
Або-Шехада М.Н., Шариф Л., Эль-Сухон С.Н. и др. Распространенность антител Toxocara canis у людей в северной Иордании. Дж Гельминтол . 1992 марта 66 (1): 75-8. [Медлайн].
Агудело C, Вильяреал E, Касерес E и др. Заражение человека и собак Toxocara canis в бедном районе Боготы. Mem Inst Oswaldo Cruz . 1990 январь-март. 85 (1): 75-8. [Медлайн].
Акао Н., Охта Н. Токсокароз в Японии. Паразитол Инт . 2007 июн. 56 (2): 87-93. [Медлайн].
Альтчех Дж., Наллар М., Конка М. и др. [Токсокароз: клинико-лабораторные особенности у 54 больных]. Педиатр (Barc) . 2003 май. 58 (5): 425-31. [Медлайн].
Американская академия педиатрии. Токсокароз (Visceral Larva Migrans, Глазная мигрантная личинка). Красная книга: Отчет Комитета по инфекционным болезням за 2009 год . 28-го. Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии; 2009. 666-7.
Аранго CA. Висцеральная мигрирующая личинка и синдром гиперэозинофилии. Южный Мед J . 1998 сентябрь 91 (9): 882-3.[Медлайн].
Arpino C, Gattinara GC, Piergili D, Curatolo P. Инфекция токсокарами и эпилепсия у детей: исследование случай-контроль. Эпилепсия . 1990 Янв-Фев. 31 (1): 33-6. [Медлайн].
Ашват М.Л., Робинсон Д.Р., Катнер ХП. Предположительный случай токсокароза, связанный с эозинофильным плевральным выпотом: отчет о болезни и обзор литературы. Am J Trop Med Hyg . 2004 декабрь 71 (6): 764. [Медлайн]. [Полный текст].
Токсокароз.Спектор Дж. М., Гибсон Т. Е.. Атлас педиатрии в тропиках и странах с ограниченными ресурсами . Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии; 2009. 249-251.
Baldisserotto M, Conchin CF, Soares Mda G и др. Результаты УЗИ у детей с токсокарозом: сообщение о 18 случаях. Педиатр Радиол . 1999 Май. 29 (5): 316-9. [Медлайн].
Bass JL, Mehta KA, Glickman LT и др. Бессимптомный токсокароз у детей.Проспективное исследование и испытание лечения. Clin Pediatr (Phila) . 1987 Сентябрь 26 (9): 441-6. [Медлайн].
Bede O, Szénási Z, Danka J, Gyurkovits K, Nagy D. Токсокароз, связанный с хроническим кашлем в детстве: продольное исследование в Венгрии. Дж Гельминтол . 2008 декабрь 82 (4): 357-63. [Медлайн].
Бейран И., Кочави О., Миллер Б. «Тихий» глазной токсокароз. Eur J Ophthalmol . 1998 июл-сен. 8 (3): 195-6.[Медлайн].
Buijs J, Borsboom G, van Gemund JJ и др. Распространенность токсокар у 5-летних младших школьников: связь с аллергической астмой. Am J Epidemiol . 1994, 1. 140 (9): 839-47. [Медлайн].
Carvalho EA, Rocha RL. Токсокароз: мигрирующая висцеральная личинка у детей. Дж. Педиатр (Рио Дж.) . 2011 март-апрель. 87 (2): 100-10. [Медлайн].
Чанг С., Лим Дж. Х., Чой Д. и др.Мигрирующая висцеральная личинка печени Toxocara canis: результаты компьютерной томографии и сонографии. AJR Am J Roentgenol . 2006 декабрь 187 (6): W622-9. [Медлайн].
Чианферони А., Шнайдер Л., Шанц П.М. и др. Мигрирующие висцеральные личинки, связанные с проглатыванием дождевых червей: клиническая эволюция у пациента подросткового возраста. Педиатрия . 2006, февраль, 117 (2): e336-9. [Медлайн].
Силла Г., Перес-Траллеро Е., Гутьеррес С. и др. Распространенность инфекции Toxocara среди детей из среднего класса и из неблагополучных семей на севере Испании (Гипускоа, Страна Басков). Eur J Epidemiol . 1996, 12 октября (5): 541-3. [Медлайн].
Dauriac-Le Masson V, Chochon F, Demeret S, Pierrot-Deseilligny C. Менингомиелит Toxocara canis. Дж Neurol . 2005 Октябрь 252 (10): 1267-8. [Медлайн].
Despommier D. Токсокароз: клинические аспекты, эпидемиология, медицинская экология и молекулярные аспекты. Clin Microbiol Ред. . 2003 г., 16 (2): 265-72. [Медлайн].
Эберхард М.Л., Альфано Э.Инфекции Toxocara cati у взрослых у детей в США: отчет о четырех случаях. Am J Trop Med Hyg . 1998 Сентябрь 59 (3): 404-6. [Медлайн]. [Полный текст].
Эберхардт О., Биалек Р., Нагеле Т., Дичганс Дж. Эозинофильный менингомиелит при токсокарозе: клинический случай и обзор литературы. Clin Neurol Neurosurg . 2005 августа 107 (5): 432-8. [Медлайн].
Elefant GR, Shimizu SH, Sanchez MC и др. Серологическое наблюдение за больными токсокарозом после химиотерапии, основанное на обнаружении антител IgG, IgA и IgE с помощью иммуноферментного анализа. J Clin Lab Анал . 20 (4): 164-72. [Медлайн].
Fenoy S, Cuellar C, Guillen JL. Серологические доказательства токсокароза у пациентов из Испании с клиническим подозрением на висцеральную мигрирующую личинку. Дж Гельминтол . 1997 Mar.71 (1): 9-12. [Медлайн].
Fenoy S, Cuellar C, Guillen JL. Распространенность токсокароза у детей и взрослых в Мадриде и Тенерифе, Испания. Дж Гельминтол . 1996 июн. 70 (2): 109-13.[Медлайн].
Фортенберри Дж. Д., Кенни Р. Д., Младший Дж. Мигрирующая висцеральная личинка, вызывающая статическую энцефалопатию у младенца. Pediatr Infect Dis J . 1991 Май. 10 (5): 403-6. [Медлайн].
Frazier M, Anderson ML, Sophocleous S. Лечение глазного токсокароза альбендезолом: отчет о болезни. Оптометрия . 2009 Апрель 80 (4): 175-80. [Медлайн].
Gavignet B, Piarroux R, Aubin F, Millon L, Humbert P.Кожные проявления токсокароза человека. J Am Acad Dermatol . 2008 декабрь 59 (6): 1031-42. [Медлайн].
Glickman LT, Шанц PM. Эпидемиология и патогенез зоонозного токсокароза. Epidemiol Rev . 1981. 3: 230-50. [Медлайн].
Good B, Holland CV, Taylor MR, et al. Глазной токсокароз у школьников. Clin Infect Dis . 2004 15 июля. 39 (2): 173-8. [Медлайн].
Gotistein B, Piarroux R.Современные тенденции в области тканевых гельминтов. Паразит . 2008 Сентябрь 15 (3): 291-8. [Медлайн].
Гулд И.М., Ньюэлл С., Грин Ш., Джордж Р. Х. Токсокароз и эозинофильный менингит. Br Med J (Clin Res Ed) . 2 ноября 1985 г. 291 (6504): 1239-40. [Медлайн].
Graeff-Teixeira C, da Silva AC, Yoshimura K. Обновленная информация об эозинофильном менингоэнцефалите и его клинической значимости. Clin Microbiol Ред. . 2009 Apr, 22 (2): 322-48, Содержание.[Медлайн].
Guneratne R, Mendis D, Bandara T, Fernando SD. Коинфекция токсоплазмы, токсокары и туберкулеза у четырехлетнего ребенка. BMC Педиатр . 2011 26 мая. 11:44. [Медлайн]. [Полный текст].
Хавасева К., Дубинский П., Стефанчикова А. Сероэпидемиологическое исследование инфекции человека токсокарой в Словацкой Республике. Дж Гельминтол . 1993 декабрь 67 (4): 291-6. [Медлайн].
Хаяши К., Тахара Х., Ямасита К. и др.Визуальные исследования печени у пациентов с мигрирующими висцеральными личинками из-за вероятной инфекции Ascaris suum. Визуализация брюшной полости . 1999 сентябрь-октябрь. 24 (5): 465-9. [Медлайн].
Хелдрих Ф.Дж., Гарг П.П. Эозинофильный менингит. Md Med J . 1988 Февраль 37 (2): 138-40. [Медлайн].
Hill IR, Denham DA, Scholtz CL. Личинки Toxocara canis в мозгу британского ребенка. Trans R Soc Trop Med Hyg . 1985. 79 (3): 351-4. [Медлайн].
Humbert P, Niezborala M, Salembier R, et al. Кожные проявления, связанные с токсокарозом: исследование случай-контроль. Дерматология . 2000. 201 (3): 230-4. [Медлайн].
Иддавела Р.Д., Раджапаксе Р.П., Перера Н.А., Агацума Т. Характеристика видоспецифичного экскреторно-секреторного антигена Toxocara canis (TcES-57) и разработка двойного сэндвич-ELISA для диагностики мигрирующих висцеральных личинок. Корейский J Parasitol .2007 Март 45 (1): 19-26. [Медлайн].
Инан М., Сакру Н., Ватансевер У., Билги С. Мигрирующая висцеральная личинка, проявляющаяся как острый живот у ребенка. J Педиатр Хирург . 41 (3): e7-9. [Медлайн].
Инатоми Ю., Мураками Т., Токунага М. и др. Энцефалопатия, вызванная мигрирующей висцеральной личинкой, вызванной Ascaris suum. J Neurol Sci . 1999 г., 1. 164 (2): 195-9. [Медлайн].
Джайн Р., Сони С., Бхаргава Д.К. и др.Гранулемы печени, вызванные мигрирующими висцеральными личинками у взрослых: внешний вид на УЗИ и МРТ. Визуализация брюшной полости . 1994 май-июнь. 19 (3): 253-6. [Медлайн].
Jeanfaivre T, Cimon B, Tolstuchow N, et al. Плевральный выпот и токсокароз. Грудь . 1996, январь, 51 (1): 106-7. [Медлайн].
Kaushik SP, Hurwitz M, McDonald C, Pavli P. Инфекция Toxocara canis и гранулематозный гепатит. Ам Дж. Гастроэнтерол . 1997 июл.92 (7): 1223-5. [Медлайн].
Кайес С.Г. Токсокароз человека и синдром мигрирующей висцеральной личинки: коррелятивная иммунопатология. Хим Иммунол . 1997. 66: 99-124. [Медлайн].
Kraus A, Valencia X, Cabral AR, de la Vega G. Висцеральные мигрирующие личинки, имитирующие ревматические заболевания. Дж Ревматол . 1995 22 марта (3): 497-500. [Медлайн].
Крцмери В. Младший, Гулд И., Собота К., Спаник С. Два случая диссеминированного токсокароза у пораженных носителей, успешно пролеченных мебендазолом. Химиотерапия . 1992. 38 (5): 367-8. [Медлайн].
Кумар Дж., Кимм Дж. М.Р. в миелопатии Toxocara canis. AJNR Am J Neuroradiol . 1994 15 ноября (10): 1918-20. [Медлайн].
Лассманн Б., Цигрелис С., Вирк А. 33-летняя женщина с выраженной эозинофилией. Mayo Clin Proc . 2007 январь 82 (1): 103-6. [Медлайн].
Li MW, Lin RQ, Song HQ, Wu XY, Zhu XQ. Полные митохондриальные геномы трех видов токсокар, важных для здоровья человека и животных. BMC Genomics . 2008 16 мая, 9: 224. [Медлайн].
Лим JH. Токсокароз печени: мигрирующая висцеральная личинка. Визуализация брюшной полости . 2008 март-апрель. 33 (2): 151-6. [Медлайн].
Ljungstrom I. Toxocara canis. Акуффо Х., Линдер Э., Юнгстрем И., Вальгрен М. Паразиты более холодного климата . Лондон и Нью-Йорк: Тейлор и Фрэнсис; 2003. 187–194.
Magnaval JF, Galindo V, Glickman LT, Clanet M.Инфекция человека Toxocara центральной нервной системы и неврологические расстройства: исследование случай-контроль. Паразитология . 1997, ноябрь 115 (Pt 5): 537-43. [Медлайн].
Матос М. де Ф, Милитао Д. Н., Брум М. А. и др. Наличие антител к токсокарам у детей, отобранных в Hospital Universitario, Campo Grande, MS, Brazil. Rev Inst Med Trop Сан-Паулу . 1997 Янв-Фев. 39 (1): 49-50. [Медлайн].
Мацуки Ю., Фудзи Т., Накамура-Учияма Ф. и др.Токсокароз проявляется множественными излияниями в перикардиальное пространство, грудную полость и сумку Моррисона. Intern Med . 2007. 46 (12): 913-4. [Медлайн].
Михаэль Н.З., Монпетит В.Дж., Оризага М. и др. Заражение Toxocara canis энцефалитом. Can J Neurol Sci . 1974 Май. 1 (2): 114-20. [Медлайн].
Mimoso MG, Pereira MC, Estevao MH, et al. Эозинофильный менингоэнцефалит, вызванный Toxocara canis. Eur J Pediatr .1993 сентябрь 152 (9): 783-4. [Медлайн].
Мойяди А., Махадеван А., Ананд Б. и др. Мигрирующая висцеральная личинка проявляется в виде множественных внутричерепных и внутриспинальных абсцессов. Невропатология . 2007 августа 27 (4): 371-4. [Медлайн].
Monsel G, Caumes E. Последние разработки дерматологических синдромов у возвращающихся путешественников. Curr Opin Infect Dis . 2008 21 октября (5): 495-9. [Медлайн].
Montalvo AM, Espino AM, Escalante G, Finlay CM.[Изучение серологической распространенности токсокароза в детской популяции в городе Гавана]. Rev Cubana Med Trop . 1994. 46 (3): 156-8. [Медлайн].
Морейра-Силва SF, Leao ME, Mendonca HF, Pereira FE. Распространенность антител к токсокарам в случайной выборке стационарных пациентов в детской больнице в Витории, Эспириту-Санто, Бразилия. Rev Inst Med Trop Сан-Паулу . 1998 июл-авг. 40 (4): 259-61. [Медлайн].
Мюррей MG, Bahna SL.Консультации по аллергии на эозинофилию у грудного ребенка. Allergy Asthma Proc . 2012 июл-авг. 33 (4): 370-3. [Медлайн].
Натвани Д., Лейнг РБ, Карри П.Ф. Скрытый токсокароз — причина повторяющихся болей в животе в детском возрасте. Br J Clin Pract . 1992 Зима. 46 (4): 271. [Медлайн].
Нельсон С, Грин Т, Эрнхарт CB. Инфекция Toxocara canis у детей дошкольного возраста: факторы риска и когнитивное развитие детей дошкольного возраста. Нейротоксикол Тератол . 1996 март-апрель. 18 (2): 167-74. [Медлайн].
Ота К.В., Димарас Х., Хеон Э., Бабин П.С., Яу Ю.С., Рид С. и др. Токсокароз, имитирующий метастазы ретинобластомы в печень, легкие и спинной мозг. Pediatr Infect Dis J . 2009 28 марта (3): 252-4. [Медлайн].
Отейфа Н.М., Мустафа М.А., Элгозамы Б.М. Токсокароз как возможная причина аллергических заболеваний у детей. J Egypt Soc Parasitol .1998 28 августа (2): 365-72. [Медлайн].
Патель Х, Гольдштейн Д. Детский увеит. Детская клиника North Am . 2003 Февраль 50 (1): 125-36. [Медлайн].
Petithory JC. Иммунологическая диагностика синдрома мигрирующей глазной личинки. Офтальмология . 1990 май-июнь. 4 (3): 298-300. [Медлайн].
Рай С.К., Уга С., Оно К. и др. Сероэпидемиологическое исследование инфекции Toxocara в Непале. Юго-Восточная Азия J Trop Med Public Health .1996, 27 июня (2): 286-90. [Медлайн].
Райес А.А., Ламбертуччи-младший. Мигрирующая висцеральная личинка и гнойный абсцесс печени. Ам Дж. Гастроэнтерол . 1999 г., апрель 94 (4): 1116. [Медлайн].
Рейли А., Беккер Дж, Мейер Дж, Ракофф В. Гиперозинофилия [клиническая конференция]. Med Pediatr Oncol . 1992. 20 (3): 232-9. [Медлайн].
Roig J, Romeu J, Riera C и др. Острая эозинофильная пневмония, вызванная токсокарозом с результатами бронхоальвеолярного лаважа. Сундук . 1992 июл.102 (1): 294-6. [Медлайн].
Roldán WH, Espinoza YA. Оценка иммуноэлектропереносного иммуноферментного блоттинга для подтверждающей серодиагностики токсокароза человека. Mem Inst Oswaldo Cruz . 2009 Май. 104 (3): 411-8. [Медлайн].
Ромеу Дж., Роиг Дж., Бада Дж. Л. и др. Токсокароз взрослого человека приобретается в результате употребления в пищу сырых улиток. J Заразить Dis . 1991 Август 164 (2): 438. [Медлайн].
Sabrosa NA, de Souza EC.Нематодные инфекции глаз: токсокароз и диффузный односторонний подострый нейроретинит. Curr Opin Ophthalmol . 2001 12 декабря (6): 450-4. [Медлайн].
Sabrosa NA, Zajdenweber M. Инфекции глаз нематодами: токсокароз, онхоцеркоз, диффузный односторонний подострый нейроретинит и цистицеркоз. Офтальмол Clin North Am . 2002 Сентябрь 15 (3): 351-6. [Медлайн].
Сакаи С., Шида Ю., Такахаши Н. и др. Поражения легких, связанные с висцеральной мигрирующей личинкой, вызванной Ascaris suum или Toxocara canis: визуализация шести случаев. AJR Am J Roentgenol . 186 (6): 1697-702. [Медлайн].
Sane AC, Barber BA. Легочные узелки из-за инфекции Toxocara canis у иммунокомпетентного взрослого человека. Южный Мед J . 1997, январь 90 (1): 78-9. [Медлайн].
Сапорито Л., Скарлата Ф, Коломба С., Инфурнари Л., Джордано С., Титоне Л. Токсокароз человека: отчет о девяти случаях. Acta Paediatr . 2008 сентябрь 97 (9): 1301-2. [Медлайн].
Шарки Дж. А., Маккей П. С..Глазной токсокароз у пациента с неоднократно отрицательным титром по ИФА на Toxocara canis. Br J Офтальмол . 1993 апр. 77 (4): 253-4. [Медлайн].
Small KW, McCuen BW 2d, de Juan E. Jr, Machemer R. Хирургическое лечение тракции сетчатки, вызванной токсокарозом. Am J Ophthalmol . 1989 г. 15 июля. 108 (1): 10-4. [Медлайн].
Sturchler D, Schubarth P, Gualzata M, et al. Тиабендазол против альбендазола в лечении токсокароза: клиническое испытание. Энн Троп Мед Паразитол . 1989 Октябрь 83 (5): 473-8. [Медлайн].
Szczepanski T, Sonta-Jakimczyk D, Janik-Moszant A, Olejnik I. Общая лимфаденопатия как начальное проявление токсокароза у семилетнего мальчика. Pediatr Infect Dis J . 1996 15 августа (8): 717-8. [Медлайн].
Тейлор М.Р., Кин СТ, О’Коннор П., Малвихилл Е., Голландия С. Расширенный спектр токсокаральной болезни. Ланцет . 1988 26 марта.1 (8587): 692-5. [Медлайн].
Тейлор М.Р., О’Коннор П., Хинсон А.Р., Смит HV. Титры токсокар в материнской и пуповинной крови. J Заразить . 1996 май. 32 (3): 231-3. [Медлайн].
Торгерсон П.Р., Розенхайм К., Таннер И., Зядинов И., Гримм Ф., Бруннер М. и др. Скрининг на эхинококкоз, токсокароз и токсоплазмоз в сельской местности на востоке Казахстана. Trop Med Int Health . 2009 14 марта (3): 341-8. [Медлайн].
Уликова М., Хубнер Дж.Распространенность инфекции Toxocara canis в Чешской Республике. Cent Eur J Public Health . 1998 6 августа (3): 195-8. [Медлайн].
Видал Дж. Э., Штайнбок Дж, Сегуро АС. Эозинофильный менингоэнцефалит, вызванный Toxocara canis: отчет о болезни и обзор литературы. Am J Trop Med Hyg . 2003 сентябрь 69 (3): 341-3. [Медлайн].
Villano M, Cerillo A, Narciso N, et al. Редкий случай Toxocara canis arachnoidea. J Neurosurg Sci .1992 янв-март. 36 (1): 67-9. [Медлайн].
Уокер MD, Zunt JR. Нейропаразитарные инфекции: нематоды. Семин Нейрол . 2005 Сентябрь 25 (3): 252-61. [Медлайн].
Уолш СС, Робсон, штат Висконсин, Харт, Калифорния. Острый преходящий миозит, вызванный токсокарой. Арч Дис Детский . 1988 Сентябрь 63 (9): 1087-8. [Медлайн].
Уэллс DL. Общественное понимание токсокароза. Общественное здравоохранение . 2007 Март 121 (3): 187-8.[Медлайн].
Wisniewska-Ligier M, Wozniakowska-Gesicka T, Sobolewska-Dryjanska J, Markiewicz-Józwiak A, Wieczorek M. Анализ течения и лечения токсокароза у детей — длительное наблюдение. Parasitol Res . 2012 июн. 110 (6): 2363-71. [Медлайн]. [Полный текст].
Wolfrom E, Chene G, Boisseau H, et al. Хроническая крапивница и Toxocara canis. Ланцет . 1995 21 января. 345 (8943): 196. [Медлайн].
Xinou E, Lefkopoulos A, Gelagoti M, et al.Результаты КТ и МРТ при церебральной токсокаральной болезни. AJNR Am J Neuroradiol . 2003 24 апреля (4): 714-8. [Медлайн].
Захария С.Б., Захария Б., Варгезе Р. Нейровизуализационные исследования церебрального синдрома «висцеральной мигрирующей личинки». Дж. Нейровизуализация . 1994, 4 января (1): 39-40. [Медлайн].
Zygulska-Mach H, Krukar-Baster K, Ziobrowski S. Глазной токсокароз у детей и юношества. Док офтальмол . 1993. 84 (2): 145-54.[Медлайн].
Токсокароз: история болезни, виды, диагностика, лечение
Токсокароз — это заражение личинками аскариды собак ( Toxocara canis ) и кошек ( Toxocara cati ). Яйца круглых червей из фекалий собак и кошек часто встречаются в почве и песке в парках, общественных пляжах и других местах на открытом воздухе.
В нормальном жизненном цикле яйца аскариды попадают в организм другой собаки или кошки, а личинка мигрирует через стенку кишечника.Взрослые черви развиваются в тонком кишечнике и откладывают яйца, которые выводятся с калом, где они снова становятся заразными в почве.
Люди не являются естественными хозяевами, но могут заразиться, случайно проглотив яйца из почвы. Личинки вылупляются и проникают через стенку кишечника, путешествуя по другим частям тела, таким как печень, сердце и мозг. У человека личинки не развиваются в зрелых червей и не откладывают новые яйца. Однако они вызывают болезнь. Есть три общепризнанных синдрома.
Личинки Toxocara canis второй стадии вылупляются из яиц — Авторское право изображения: olgaru79 / Shutterstock
Типы токсокароза
Скрытый токсокароз встречается у детей. Это вызывает легкое заболевание с лихорадкой. Другие возможные симптомы включают кашель, плохой сон, головные боли и боли в животе. У детей могут появиться признаки инфицированных лимфатических узлов, опухшей печени или хрипов. Считается, что скрытый токсокароз вызывается длительным воздействием мигрирующих молодых червей.
Visceral larva migrans (VLM) — воспалительная реакция, вызванная гибелью личинок, мигрирующих через внутренние органы. В первую очередь он поражает детей в возрасте до пяти лет. С VLM:
связан ряд симптомов.
- усталость
- потеря веса
- анорексия
- лихорадка
- кашель
- пневмония
- Бронхоспазм
- Боль в животе
- головная боль
- сыпь
- изъятия (редко)
Также могут присутствовать опухшая печень, инфицированные лимфатические узлы и хрипы.Могут развиться серьезные осложнения, такие как плевральный выпот, хроническая крапивница (крапивница), миокардит и дыхательная недостаточность.
Когда личинки мигрируют в глаза ( глазных мигрирующих личинок ), они могут вызвать проблемы со зрением, покраснение глаз или появление белого зрачка (лейкокории). Хориоретинит — воспаление сосудистой оболочки и сетчатки — и гранулемы — типичные наблюдения при осмотре. OLM может вызвать потерю зрения, фиброз сетчатки, ретинобластому и отслоение сетчатки.
OLM чаще всего встречается у детей в возрасте от пяти до десяти лет.
Диагностика токсокароза
VLM следует заподозрить у любого ребенка с необъяснимым фебрильным заболеванием и эозинофилией (увеличение определенного типа лейкоцитов). Мультисистемное заболевание, опухшая печень и употребление грязи в анамнезе — это другие признаки того, что у ребенка может быть ВЛМ. Ключевыми симптомами OLM являются односторонняя потеря зрения и косоглазие (смещение глаз).
Окончательный диагноз VLM может быть поставлен путем анализа на общие антигены круглых червей и вещество группы крови А.Однако эти иммунологические тесты не являются надежными для OLM, потому что пациенты, как правило, имеют более низкие уровни антигена аскариды в крови. ОЛМ диагностируется при офтальмологическом обследовании.
Лечение
Стандартное лечение токсокароза — пятидневный курс альбендазола. Иногда к нему добавляют кортикостероиды, чтобы подавить аллергическую реакцию на круглых червей. Для OLM предпочтительными методами лечения являются хирургическое вмешательство, стероиды и противоглистная (противопаразитарная) химиотерапия.
Дополнительная литература
Выявление и лечение глазного токсокароза
Аджай Сингх, доктор медицины, E.T. Каннингем-младший, доктор медицины, доктор философии, магистр здравоохранения, и Джей М. Стюарт, доктор медицины, Сан-Франциско
Диагностика глазного токсокароза может быть сложной задачей как из-за того, что это состояние относительно необычно, так и из-за того, что его проявления обычно варьируются от пациента к пациенту. В недавнем исследовании распространенности, клинических особенностей и причин потери зрения у пациентов с глазным токсокарозом, проведенном в больнице Фрэнсиса I.Proctor Foundation, Калифорнийский университет, Сан-Франциско, общая распространенность инфекции глаза Toxocara была относительно низкой и составляла 1 процент от общей популяции увеита.1 Тем не менее, глазной токсокароз остается важной причиной увеита, особенно у детей и подростков. Взрослые.
Заражение человека нематодами Toxocara canis или Toxocara cati может вызывать как системный, так и глазной токсокароз. Окончательными хозяевами для этих видов нематод являются собаки и кошки соответственно.Люди заражаются этим заболеванием при проглатывании яиц с зародышем, обычно из зараженных сырых овощей или инфицированного сырого мяса (курица, кролик и баранина), 2 из загрязненных источников воды или через геофагию. Большинство повреждений глаз возникает в результате воспалительной реакции, которая возникает после смерти личинки. По причинам, которые до конца не изучены, глазной и системный токсокароз обычно диагностируют у пациентов разного возраста. В частности, было замечено, что системный токсокароз, также называемый мигрирующей висцеральной личинкой, как правило, поражает детей в возрасте до 3 лет, возможно, из-за повышенного уровня пика среди этой группы3, тогда как глазной токсокароз обычно проявляется у детей старшего возраста и молодого возраста. Взрослые.
Клиническая презентация
Глазной токсоксокароз является односторонним у 90 процентов пациентов.1,4,5 Традиционно считается, что это заболевание поражает в первую очередь младенцев и детей младшего возраста, но недавние исследования выявили случаев заражения токсокарой у ряда подростков и молодых людей. . Неизвестно, вызван ли этот сдвиг в демографии более глубоким пониманием эпидемиологии глазного токсокароза, изменением схемы направления к специалистам или истинным изменением групп риска.1,5 Контакт с домашними собаками и кошками, особенно с щенками и котятами, которые с большей вероятностью переносят инфекцию, считается важным фактором риска для детей. Общие симптомы, которые приводят пациентов в клинику, включают нечеткое зрение и плавающие помутнения. Также могут присутствовать боль и светобоязнь, но обычно они незначительны6. У молодых пациентов глазная инфекция может быть незаметна до тех пор, пока они не пройдут проверку зрения в школе или не разовьются косоглазие или лейкокория.
Рисунок 1.Два отдельных пациента (A и B) с излеченными гранулемами заднего полюса вследствие токсокароза глаза. Обратите внимание на заметные складки сетчатки и образование эпиретинальной мембраны. |
Глазной токсокароз проявляется в виде гранулемы заднего полюса (см. Рисунок 1) у 25-50 процентов пациентов.1,4,5,6 Причина такой очевидной склонности к заднему полюсу неясна. , хотя было высказано предположение, что гематогенно распространяющиеся нематоды могут с большей вероятностью поселиться в небольших перифовеальных концевых артериях.И наоборот, возможно, что поражения желтого пятна, скорее всего, будут симптоматичными и, следовательно, побудить пациентов обратиться за медицинской помощью. Острый Toxocara retinochoroiditis выглядит как туманное, плохо очерченное белое пятно с покрывающим его витритом. Когда воспаление проходит, поражение становится отчетливым, хорошо разграниченным, приподнятым белым образованием размером от половины до четырех диаметров диска. Нарушение пигментного эпителия сетчатки часто окружает поражение, и складки сетчатки, отходящие от очага поражения, встречаются довольно часто.При внимательном осмотре может быть обнаружен темно-серый центр, который, как предполагалось, является остатками личинки 6,7, а также кровеносные сосуды сетчатки, входящие в гранулему. Toxocara Гранулемы также могут развиваться на диске зрительного нерва, и в этом случае потеря зрения может быть значительной; может присутствовать афферентный зрачковый дефект, и обследование глазного дна может выявить перипапиллярную отслойку и / или экссудаты сетчатки по типу макулярной звезды (нейроретинит).
Около 50 процентов всех глаз с токсокарозом проявляются в виде периферической гранулемы (см. Рисунок 2) .1,4,5,6 В острой форме поражение выглядит как мутная белая масса на периферическом дне глазного дна, которая может имитировать сугроб, наблюдаемый у пациентов с парспланитом. Со временем консолидация и сокращение поражения приводит к появлению периферической приподнятой массы, часто с расширяющимися кзади складками сетчатки (см. Рис. 3) . В некоторых случаях экссудаты сетчатки могут быть обширными.
| Рис. 2. Два отдельных пациента с периферическими гранулемами из-за глазного токсокароза.Обратите внимание на заметные, расширяющиеся кзади складки сетчатки и, в случае А, обширный экссудат. |
Менее 25 процентов глаз с токсокарозом имеют плотное воспаление стекловидного тела, имитирующее эндофтальмит (см. Рис. 3) .1,4,6 В отличие от многих других форм увеита, признаки эндофтальмита Toxocara часто более выражены. выражен, чем симптомы. Фактически, как уже отмечалось, боль и светобоязнь обычно минимальны или отсутствуют. При обследовании с помощью щелевой лампы обычно выявляется легкая или умеренная вторичная реакция передней камеры с разбросанными небольшими кератическими осадками на эндотелии роговицы.Задние синехии могут развиваться время от времени, но нечасто. Образование гипопиона, хотя и сообщается, встречается редко8. Визуализация глазного дна через воспаление стекловидного тела обычно затруднена. В тяжелых случаях может развиться экссудативная отслойка сетчатки. Когда воспаление спадает, стекловидные оболочки могут образовывать ретролентальную массу, которая в тяжелых случаях может вызвать отслоение цилиарного тела, гипотонию и туберкулез.
Основные причины потери зрения у пациентов с глазным токсокарозом в значительной степени зависят от локализации и тяжести воспаления.Зрение обычно ухудшается у пациентов с эндофтальмитом Toxocara из-за помутнения воспалительной среды, кистозного макулярного отека и / или образования катаракты. Гранулемы заднего полюса, напротив, обычно вызывают потерю зрения из-за прямого поражения желтого пятна или диска зрительного нерва, вторичного образования сетчатых складок или эпиретинальных мембран или, в редких случаях, развития хориоидальной неоваскуляризации. Снижение зрения у пациентов с токсокарозом периферических глаз обычно является следствием поражения желтого пятна в виде простирающихся кзади серповидных складок или экссудата.Кроме того, амблиопия может развиться у молодых пациентов с помутнением срединного слоя и / или поражением желтого пятна.
Рисунок 3. Эндофтальмит Toxocara. Обширный витрит скрывает детали глазного дна, так что диск зрительного нерва (стрелка) едва виден. |
Диагноз
Несмотря на то, что анамнез, обзор систем и полное обследование глаз при расширении являются наиболее важными, несколько дополнительных тестов также могут быть полезны при диагностике токсокароза глаз.Эозинофилия сыворотки указывает на инфекцию, но обычно присутствует только в условиях активной системной инфекции. Эозинофилы, обнаруженные в водной или стекловидной жидкости, являются более прямым индикатором глазной инфекции, но такие жидкости редко доступны для тестирования. Анализы для обнаружения антител против Toxocara в сыворотке используются наиболее часто и могут быть полезны для подтверждения клинического диагноза, но, как известно, они мало чувствительны. Повышенная чувствительность может быть достигнута с помощью анализа внутриглазных жидкостей с помощью ELISA 9,10, но такое тестирование доступно только в нескольких изолированных исследовательских центрах.Таким образом, во всех смыслах и целях глазной токсокароз часто является клиническим диагнозом.
Методы визуализации могут предоставить дополнительную информацию многим пациентам. Оптическая когерентная томография гранулем заднего полюса обычно демонстрирует высоко отражающую массу, расположенную над RPE11, а также может показать факторы, потенциально способствующие потере зрения, такие как наличие интраретинальной или субретинальной жидкости. В-сканирование УЗИ особенно полезно, когда витрит или другие помутнения не позволяют увидеть глазное дно.
Редко диагноз глазного токсокароза ставится гистопатологически после идентификации мертвой личинки в центре эозинофильной гранулемы (см. Рисунок 4) .
Лечение
Решение о начале терапии зависит от стадии инфекции. Клинические проявления в состоянии покоя без активного воспаления не требуют противовоспалительного или противоглистного лечения. Для тех редких пациентов, которые обращаются с поражением глаз на фоне висцеральной мигрирующей личинки, наиболее эффективным является системное лечение одним из производных бензимидазола (альбендазолом, тиабендазолом и мебендазолом) в сочетании с местными и / или системными кортикостероидами по показаниям.12,13 Хотя сравнительных исследований нет, лучшая переносимость альбендазола и его общедоступность в большинстве стран делают его предпочтительным противоглистным препаратом в большинстве случаев.
Кортикостероиды можно вводить местно, периокулярно, внутриглазно или системно, в зависимости от локализации и тяжести воспаления. Циклоплегия / мидриатика часто показана при наличии воспаления передней камеры, чтобы минимизировать риск образования задних синехий, и ее следует выбирать и дозировать в зависимости от тяжести воспаления.У отобранных пациентов следует рассмотреть возможность витрэктомии Pars plana для удаления воспалительных тканей, снятия тракции витреомакулярного тракта и устранения отслоения сетчатки (см. Рисунок 5) .14 Также были предприняты попытки хирургического удаления живой личинки из субретинального пространства15. подвижную личинку можно уничтожить с помощью лазерной фотокоагуляции.
Профилактика
Надлежащая утилизация наполнителя для туалета, дегельминтизация инфицированных домашних животных, полное приготовление мяса, тщательное ополаскивание фруктов и овощей и надлежащая практика мытья рук являются важными мерами предотвращения заражения человека.16 Накрытие песочниц на общих игровых площадках и открытых огородах также полезно, поскольку помогает предотвратить заражение, а повышение температуры, вызванное независимым укрытием, способствует уничтожению существующих яиц.17
Рис. 4. Окрашенный H&E срез периферической сетчатки, показывающий мертвую личинку Toxocara canis в центре эозинофильной гранулемы. Этот срез был вырезан из исходного гистопатологического блока, который был впервые изучен и опубликован в 1965 году.19 |
Хотя в настоящее время молекулярные вакцины не доступны, они могут когда-нибудь оказаться полезными для борьбы с заражением собак и кошек. К настоящему времени миозины Toxocara были идентифицированы как потенциальные кандидаты в антигены для такой вакцины18.
Для диагностики глазного токсокароза требуется высокий индекс подозрительности. Чаще всего страдают дети и молодые люди. Воспаление обычно одностороннее с одним из трех проявлений: гранулема заднего полюса, периферическая гранулема или эндофтальмит Toxocara .Анализ сыворотки на антитела против Toxocara может быть полезным, но, как известно, он нечувствителен, поэтому к отрицательным результатам следует относиться с осторожностью. Часто бывает полезным визуализация, особенно ОКТ и В-сканирование. Большинству пациентов с глазным токсокарозом полезно лечение кортикостероидами, но не антигельминтными средствами, поскольку воспаление возникает в результате реакции организма на мертвого червя. Однако следует рассмотреть возможность применения противоглистного агента при активной системной инфекции или при офтальмоскопическом наблюдении живой подвижной личинки.Витрэктомия Pars plana показана избранным пациентам с длительно существующими обломками стекловидного тела, тракцией или регматогенной отслойкой сетчатки14
Рис. 5. Гранулема заднего полюса у 10-летней девочки с домашним скунсом и двухмесячным анамнезом ухудшения зрения и плавающими помутнениями, поражающими ее левый глаз (A). Зрение на презентации было 20/100. Сывороточный IgG к токсокарам был положительным при разведении 1:16.Для иссечения гранулемы и удаления эпиретинальных мембран была выполнена витрэктомия pars plana (B). Окончательный послеоперационный обзор был 20/25. |
Д-р Сингх — научный сотрудник, а д-р Стюарт — преподаватель кафедры офтальмологии Медицинской школы UCSF. Свяжитесь с ними в отделении офтальмологии Медицинской школы UCSF, 10 Koret Way, K301, Сан-Франциско, Калифорния 94143-0730, телефон: (415) 476-0496, факс: (415) 476-0336, электронная почта: stewartj @ Vision.ucsf.edu.
Доктор Каннингем — директор службы увеитов Калифорнийского Тихоокеанского медицинского центра и клинический профессор офтальмологии Медицинской школы Стэнфордского университета. Свяжитесь с ним в West Coast Retina Medical Group, Inc., 185 Berry St., Lobby 5, Suite 130, San Francisco, CA 94107-1739. Телефон: (415) 972 4600, факс: (415) 975 0999, электронная почта: [email protected]
1. Стюарт JM, Cubillan LD, Cunningham ET Jr. Распространенность, клинические особенности и причины потери зрения среди пациентов с глазным токсокарозом.Retina 2005; 25: 1005-13.
2. Нагакура К., Татибана Х., Канеда Й., Като Ю. Токсокароз, возможно, вызванный употреблением в пищу сырого цыпленка. Журнал Infect Dis 1989; 160: 735-6.
3. Шанц PM, Weis PE, Pollard ZF, et al. Факторы риска токсокаральной мигрирующей глазной личинки: исследование случай-контроль. Am J Public Health 1980; 70: 1269.
4. Wilkinson CP, Welch RB. Внутриглазные токсокары. Am J Ophthalmol 1971; 71: 921-30.
5. Йокои К., Гото Х., Сакаи Дж., Усуи М.Клинические особенности глазного токсокароза в Японии. Ocul Immunol Inflamm 2003; 11: 269-75.
6. Щиты JA. Глазной токсокароз. Обзор. Surv Ophthalmol 1984; 28: 361-81
7. Foster CS. Глазной токсокароз. В: Фостер и Витале. Диагностика и лечение увеита. Филадельфия: W.B. Сондерс, 2002: 428-436.
8. Аппельманс М., Михильс Дж., Рокет П. Увеит с эозинофильным гипопионом, вызванный личинками нематод. Bull Soc Belge Ophtalmol 1965; 140: 505-12
9.Магнавал Дж. Ф., Малард Л., Морассин Б., Фабр Р. Иммунодиагностика глазного токсокароза с использованием вестерн-блоттинга для обнаружения специфических антител к Toxocara IgG и CAP для измерения специфических антител к Toxocara IgE. Дж. Гельминтол 2002; 76: 335-9.
10.Benitez del Castillo JM, Herreros G, Guillen JL. Двусторонний глазной токсокароз, продемонстрированный иммуноферментным анализом водянистой влаги. Am J Ophthalmol 1995; 119: 514-6.
11. Хигашидэ Т., Акао Н., Сирао Э., Сирао Ю.Результаты оптической когерентной томографии и ангиографии пациента с субретинальной гранулемой токсокар. Am J Ophthalmol 2003; 136: 188-90.
12. Sturchler D, Schubarth P, Gualzata M, Gottstein B, Oettli A. Тиабендазол против альбендазола в лечении токсокароза: клиническое испытание. Энн Троп Мед Паразитол 1989; 83: 473-8.
13. Sabrosa NA, de Souza EC. Нематодные инфекции глаз: токсокароз и диффузный односторонний подострый нейроретинит. Curr Opin Ophthalmol 2001; 12: 450–454.
14. Amin HI, McDonald HR, Han DP, Jaffe GJ, et al. Обновление витрэктомии для тракции желтого пятна при глазном токсокарозе. Сетчатка 2000; 20: 80-5.
15. de Souza EC, Nakashima Y. Диффузный односторонний подострый нейроретинит. Отчет о трансвитреальном хирургическом удалении субретинальной нематоды. Офтальмология 1995; 102: 1183-6.
16. Харви Дж. Б., Робертс Дж. М., Шанц П. М.. Обзор рекомендаций ветеринаров по лечению кишечных паразитов у собак и борьбе с ними: значение для общественного здравоохранения.J Am Vet Med Assoc 1991; 199: 702-7.
17. Уга С., Катаока Н. Меры по контролю заражения яиц токсокарами в песочницах общественных парков. Am J Trop Med Hyg 1995; 52: 21-4.
18. Обваллер А., Дюшен М., Брюн Н., Штайпе В, Трипп С., Крафт Д., Видерманн Г., Ауэр Н., Аспок Н. Рекомбинантное рассечение тяжелой цепи миозина Toxocara canis показывает сильную кластеризацию антигенных областей. Parasitol Res 2001; 87: 383-9.
19. Хоган MJ, Кимура SJ, Спенсер WH.Мигрирующая висцеральная личинка и периферический ретинит. JAMA 1965; 194: 1345-7.
Токсокароз — NHS
Токсокароз — редкая инфекция, вызываемая паразитами аскариды. Люди могут заразиться им при обращении с почвой или песком, загрязненными фекалиями инфицированных животных.
Паразиты аскариды чаще всего встречаются у кошек, собак и лисиц и обычно поражают маленьких детей.
Это связано с тем, что дети с большей вероятностью соприкоснутся с зараженной почвой, когда они играют и засовывают руки в рот.
Однако случаи заболевания зарегистрированы у людей всех возрастов.
Признаки и симптомы
У большинства людей заражение этими личинками аскариды не вызывает никаких симптомов, и паразиты умирают в течение нескольких месяцев.
Однако у некоторых людей наблюдаются легкие симптомы, например:
В редких случаях личинки аскариды поражают такие органы, как печень, легкие, глаза или мозг, и вызывают серьезные симптомы, например:
- усталость
- потеря аппетита или потеря веса
- кожные высыпания
- хрипы или затрудненное дыхание
- изъятия (припадки)
- нечеткое или нечеткое зрение, обычно поражающее только один глаз
- очень красный и болезненный глаз
Когда обращаться к вашему GP
Обратитесь к терапевту как можно скорее, если вы считаете, что у вас или вашего ребенка есть симптомы, которые могут быть вызваны токсокарозом.
Если один из ваших глаз поражен токсокарозом, существует риск необратимой потери зрения. Однако своевременное лечение может снизить вероятность этого.
Обычно токсокароз можно обнаружить с помощью анализа крови, хотя при поражении глаз может потребоваться проверка зрения на наличие паразитов.
Почему это происходит
Паразиты аскариды, вызывающие токсокароз (называемые токсокарами), обитают в пищеварительной системе собак, кошек и лисиц.Черви производят яйца, которые выделяются с фекалиями инфицированных животных и загрязняют почву.
Яйца становятся заразными только через 10–21 день, поэтому свежие фекалии животных не представляют непосредственной опасности. Однако после того, как яйца попадут в песок или почву, они могут выжить в течение многих месяцев.
Люди могут заразиться, если зараженная почва попадет им в рот. Как только яйца попадают в человеческое тело, они попадают в кишечник, прежде чем вылупятся и выпустят личинки (самая ранняя стадия развития).Эти личинки могут путешествовать по большинству частей тела.
Однако, поскольку люди не являются нормальным хозяином для этих личинок, они не могут развиваться дальше этой стадии и производить яйца. Это означает, что инфекция не может передаваться между людьми.
Снижение риска
Лучший способ снизить вероятность развития токсокароза — соблюдать гигиену.
Например, мытье рук теплой водой с мылом после контакта с домашними животными или контакта с песком или почвой.
Если у вас есть домашняя кошка или собака, их следует регулярно очищать от глистов, а их фекалии следует немедленно утилизировать.
Подробнее о профилактике токсокароза.
Как лечится
Если у вас нет симптомов или симптомы легкие, лечение обычно не требуется.
Однако вам понадобятся лекарства, если у вас серьезная инфекция, поражающая ваши органы. Для уничтожения личинок паразита используется лекарство, называемое глистогонным.
Чаще всего используется альбендазол, альтернативой является мебендазол.
Эти лекарства обычно не вызывают побочных эффектов, хотя у некоторых людей могут возникать головные боли или боли в животе.
Помимо глистогонных средств, часто назначают стероидные препараты (кортикостероиды), чтобы уменьшить воспаление, вызванное тяжелой инфекцией.
Если токсокароз поражает глаз, вместо глистогонных средств используются стероидные препараты. Также может потребоваться операция — например, при отслоении сетчатки.
Большинство людей полностью выздоравливают и не испытывают никаких долгосрочных осложнений. Однако существует риск необратимой потери зрения при поражении одного из глаз.
Подробнее о лечении токсокароза.
Насколько распространен токсокароз?
Токсокароз редко встречается в Великобритании, хотя трудно точно определить, сколько случаев возникает каждый год, поскольку заболевание часто диагностируется неправильно или недиагностируется. Многие люди, вероятно, подверглись воздействию паразитов, даже не подозревая об этом.
В целом токсокароз чаще встречается у детей и молодых людей.
Последняя проверка страницы: 13 июня 2018 г.
Срок следующей проверки: 13 июня 2021 г.
Токсокароз: скрытая угроза с прогрессирующими последствиями для общественного здравоохранения | Инфекционные болезни бедности
Деспомье Д. Токсокароз: клинические аспекты, эпидемиология, медицинская экология и молекулярные аспекты. Clin Microbiol Rev.2003; 16: 265–72.
PubMed
PubMed Central
Статья
Google Scholar
Overgaauw PA, van Knapen F. Ветеринарные аспекты и аспекты общественного здравоохранения Toxocara spp. Vet Parasitol. 2013; 193: 398–403.
PubMed
Статья
Google Scholar
Голландия CV. Пробелы в знаниях в эпидемиологии Toxocara : загадка остается. Паразитология. 2017; 144: 81–94.
PubMed
Статья
CAS
Google Scholar
Macpherson CN. Эпидемиология и значение токсокароза для общественного здравоохранения: зооноз мирового значения. Int J Parasitol. 2013; 43: 999–1008.
PubMed
Статья
Google Scholar
Zibaei M. Гельминтозные и сердечно-сосудистые заболевания: Toxocara вида вызывают заболевание. Curr Cardiol Rev.2017; 13: 56–62.
PubMed
PubMed Central
Статья
Google Scholar
Strube C, Heuer L, Janecek E. Toxocara spp. инфекции у паратенических хозяев. Vet Parasitol. 2013; 193: 375–89.
PubMed
Статья
Google Scholar
Fan CK, Holland CV, Loxton K, Barghouth U. Церебральный токсокароз: немое прогрессирование до нейродегенеративных расстройств? Clin Micobiol Rev.2015; 28: 663–86.
Артикул
Google Scholar
Fan CK, Liao CW, Cheng YC. Факторы, влияющие на проявление токсокароза у человека: генетика и окружающая среда. Vet Parasitol. 2013; 193: 342–52.
PubMed
Статья
CAS
Google Scholar
Чен Дж., Чжоу Д.Х., Нисбет А.Дж., Сюй М.Дж., Хуанг С.Ю., Ли М.В., Ван Ч.Р., Чжу XQ. Достижения в области молекулярной идентификации, систематики, генетической изменчивости и диагностики Toxocara spp. Заразить Genet Evol. 2012; 12: 1344–8.
PubMed
Статья
Google Scholar
Nicoletti A. Токсокароз. Handb Clin Neurol. 2013; 114: 217–28.
PubMed
Статья
Google Scholar
Чен Дж., Сюй М.Дж., Чжоу Д.Х., штаб-квартира Сун, Ван Ч.Р., Чжу XQ. Паразитарные зоонозы собак и кошек в Китае. Векторы паразитов. 2012; 5: 152.
PubMed
PubMed Central
Статья
Google Scholar
Rubinsky-Elefant G, Hirata CE, Yamamoto JH, Ferreira MU. Токсокароз человека: диагностика, распространенность серотипов в мире и клинические проявления системных и глазных форм. Ann Trop Med Parasitol. 2010; 104: 3–23.
PubMed
Статья
CAS
Google Scholar
Hotez PJ, Wilkins PP. Токсокароз: самая распространенная в Америке запущенная инфекция бедности и гельминтоз мирового значения? PLoS Negl Trop Dis. 2009; 3: е400.
PubMed
PubMed Central
Статья
Google Scholar
Fillaux J, Magnaval JF. Лабораторная диагностика токсокароза человека. Vet Parasitol. 2013; 193: 327–36.
PubMed
Статья
CAS
Google Scholar
Морейра GM, TelmoPde L, Mendonça M, Moreira AN, McBride AJ, Scaini CJ, Conceição FR. Токсокароз человека: современные достижения в диагностике, лечении и вмешательстве.Trends Parasitol. 2014; 30: 456–64.
PubMed
Статья
Google Scholar
Wilder HC. Эндофтальмит нематод. Trans Am Acad Ophthalmol Otolaryngol. 1950; 55: 99–104.
PubMed
CAS
Google Scholar
Париз М.Э., Хотез П.Дж., Слуцкер Л. Забытые паразитарные инфекции в США: потребности и возможности. Am J Trop Med Hyg. 2014; 90: 783–5.
PubMed
PubMed Central
Статья
Google Scholar
Zhu XQ, Korhonen PK, Cai H, Young ND, Nejsum P, von Samson-Himmelstjerna G, et al. Генетический план возбудителя зоонозов Toxocara canis . Nat Commun. 2015; 6: 6145.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Гассер РБ, Корхонен П.К., Чжу XQ, Янг Н.Д.Использование генома Toxocara для поддержки исследований токсокароза и новых вмешательств. Adv Parasitol. 2016; 91: 87–110.
PubMed
Статья
Google Scholar
Li MW, Lin RQ, Song HQ, Wu XY, Zhu XQ. Полные митохондриальные геномы трех видов Toxocara, видов, имеющих значение для здоровья человека и животных. BMC Genomics. 2008; 9: 224.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Гассер РБ. Идеальное время, чтобы использовать передовые молекулярные технологии для изучения фундаментальной биологии видов токсокар . Vet Parasitol. 2013; 193: 353–64.
PubMed
Статья
Google Scholar
Mizgajska-Wiktor H, Jarosz W. Сравнение загрязнения почвы яйцами Toxocara cani s и Toxocara cati в сельских и городских районах Великопольского района в 2000-2005 гг. Wiad Parazytol.2007; 53: 219–25. (на польском языке)
PubMed
Google Scholar
Гавор Дж., Борецка А. Загрязнение окружающей среды яйцами токсокар в Мазовецком воеводстве как риск токсокароза у детей. Wiad Parazytol. 2004; 50: 237–41.
PubMed
Google Scholar
Борецка А., Гавор Дж., Недворок М., Сордил Б. Встречаемость Toxocara spp.яйца в бытовой среде детей с диагностированным токсокарозом в Лодзинском воеводстве. Wiad Parazytol. 2010; 56: 141–4.
PubMed
Google Scholar
Викрамасинге С., Ятавара Л., Раджапакс Р.П., Агацума Т. Toxocara canis и Toxocara vitulorum : молекулярная характеристика, дискриминация и филогенетический анализ на основе митохондрий (АТФ-синтаза субъединицы 6 и 12S) (ITS-2 и 28S) гены.Parasitol Res. 2009; 104: 1425–30.
PubMed
Статья
Google Scholar
Wickramasinghe S, Yatawara L, Rajapakse RP, Agatsuma T. Toxocara vitulorum (Ascaridida: Nematoda): содержание, расположение и состав митохондриальных генов по сравнению с другими видами Toxocara . Мол Биохим Паразитол. 2009; 166: 89–92.
PubMed
Статья
CAS
Google Scholar
Le TH, Anh NT, Nguyen KT, Nguyen NT, do TT T, Gasser RB. Toxocara malaysiensis Инфекция домашних кошек во Вьетнаме — новая зоонозная проблема? Заразить Genet Evol. 2016; 37: 94–8.
PubMed
Статья
Google Scholar
Zhu XQ, Jacobs DE, Chilton NB, Sani RA, Cheng NABY, Gasser RB. Молекулярная характеристика варианта Toxocara от кошек в Куала-Лумпуре, Малайзия. Паразитология. 1998. 117: 155–64.
PubMed
Статья
CAS
Google Scholar
Гиббонс Л.М., Джейкобс Д.Е., Сани РА. Toxocara malaysiensis n. Sp. (Nematoda: Ascaridoidea) от домашней кошки ( Feliscatus Linnaeus , 1758). J Parasitol. 2001; 87: 660–5.
PubMed
Статья
CAS
Google Scholar
Fogt-Wyrwas R, Mizgajska-Wiktor H, Pacoń J, Jarosz W.Внутривидовые вариации между ITS-последовательностями Toxocara canis , Toxocara cati и Toxascaris leonine от разных видов хозяев в Юго-Западной Польше. J Helminthol. 2013; 87: 432–42.
PubMed
Статья
CAS
Google Scholar
Zhu XQ, Gasser RB, Jacobs DE, Hung GC, Chilton NB. Взаимоотношения между некоторыми аскаридоидными нематодами на основе данных о последовательности рибосомной ДНК. Parasitol Res.2000; 86: 738–44.
PubMed
Статья
CAS
Google Scholar
Li MW, Lin RQ, Song HQ, Sani RA, Wu XY, Zhu XQ. Электрофоретический анализ изменчивости последовательностей в трех участках митохондриальной ДНК для аскаридоидных паразитов, имеющих значение для здоровья человека и животных. Электрофорез. 2008; 29: 2912–7.
PubMed
CAS
Google Scholar
Smith H, Holland C, Taylor M, Magnaval JF, Schantz P, Maizels R.Насколько распространен токсокароз у человека? К стандартизации наших знаний. Trends Parasitol. 2009. 25: 182–8.
PubMed
Статья
Google Scholar
Саид И., Тайра К., Капел СМ. Toxocara canis у экспериментально зараженных серебристых и песцов. Parasitol Res. 2005; 97: 160–6.
PubMed
Статья
Google Scholar
Guimarães AM, Alves EG, de Rezendede GF, Rodrigues MC. Toxocara sp. яйца и Ancylostoma sp. личинки в общественных парках, Бразилия. Rev Saude Publica. 2005; 39: 293–5. (на португальском)
PubMed
Статья
Google Scholar
Tiyo R, Guedes TA, Falavigna DL, Falavigna-Guilherme AL. Сезонное заражение площадей и газонов паразитами с зоонозным потенциалом в южной части Бразилии. J Helminthol. 2008; 82: 1–6.
PubMed
Статья
CAS
Google Scholar
Дада Б.Дж., Линдквист В.Д. Распространенность Toxocara spp. яйца в некоторых общественных местах и в местах отдыха на шоссе в Канзасе. J Helminthol. 1979; 53: 145–6.
PubMed
Статья
CAS
Google Scholar
Chorazy ML, Ричардсон DJ. Исследование загрязнения окружающей среды яйцеклетками аскарид, Уоллингфорд, Коннектикут. Vector Borne Zoonotic Dis. 2005; 5: 33–9.
PubMed
Статья
Google Scholar
Düwel D. Распространенность яиц Toxocara яиц в песке детских игровых площадок во Франкфурте / М. Ann Trop Med Parasitol. 1984; 78: 633–6.
PubMed
Статья
Google Scholar
Рокицкий Ю., Кухарска А.П., Дзидо Дж., Карчевска Д. Заражение детских площадок в городе Гданьск яйцами паразитов. Wiad Parazytol. 2007; 53: 227–30. (на польском языке)
PubMed
Google Scholar
Emehelu CO, Fakae BB. Распространенность яиц Toxocara canis на игровых площадках детских садов в Нсукке, Нигерия. В J Zoonoses. 1986; 13: 158–61.
CAS
Google Scholar
Отейфа Н.М., Мустафа М.А. Потенциальный риск заражения токсокарозом в районе Гелиополис, Каир, Египет. J Egypt Soc Parasitol. 1997. 27: 197–203.
PubMed
CAS
Google Scholar
Gunaseelan L, Ganesan PI, Ramadass P, Basheer MA, Raghavan N. Частота яиц токсокар в окружающей среде. J Indian Vet. 1992; 69: 308–9.
Google Scholar
Симидзу Т. Распространенность яиц токсокар яиц в песчаных карьерах в городе Токусима и его окрестностях. J Vet Med Sci. 1993; 55: 807–11.
PubMed
Статья
CAS
Google Scholar
Киган Дж. Д., Голландия CV. Сравнение эмбрионов Toxocara canis в контролируемых условиях в почве и волосах. J Helminthol. 2013; 87: 78–84.
PubMed
Статья
Google Scholar
Родди Г., Холланд С., Стаффорд П., Вулф А. Загрязнение шерсти лисицы яйцами Toxocara canis . J Helminthol. 2008. 82: 293–6.
PubMed
Статья
CAS
Google Scholar
Roddie G, Stafford P, Holland CV, Wolfe A. Загрязнение шерсти собак яйцами Toxocara canis . Vet Parasitol. 2008; 152: 85–93.
PubMed
Статья
Google Scholar
Ли А.С., Шанц П.М., Казакос КР, Монтгомери С.П., Боуман Д.Д. Эпидемиологические и зоонозные аспекты аскаридных инфекций у собак и кошек. Trends Parasitol. 2010. 26: 155–61.
PubMed
Статья
Google Scholar
Дубинский П., Хавасиова-Рейтерова К., Петко Б., Ховорка И., Томасовикова О. Роль мелких млекопитающих в эпидемиологии токсокароза. Паразитология. 1995; 110: 187–93.
PubMed
Статья
Google Scholar
Антолова Д., Рейтерова К., Митерпакова М., Станко М., Дубинский П. Циркуляция Toxocara spp. в пригородных и сельских экосистемах Словацкой Республики. Vet Parasitol. 2004; 126: 317–24.
PubMed
Статья
CAS
Google Scholar
Reperant LA, Hegglin D, Tanner I., Fischer C, Deplazes P. Грызуны как общие индикаторы зоонозных паразитов плотоядных животных в городской среде. Паразитология. 2009. 136: 329–37.
PubMed
Статья
CAS
Google Scholar
Magnaval JF, Glickman LT, Dorchies P, Morassin B. Основные моменты токсокароза человека. Корейский J Parasitol. 2001; 39: 1–11.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Акао Н., Охта Н. Токсокароз в Японии. Parasitol Int. 2007; 56: 87–93.
PubMed
Статья
Google Scholar
Йошикава М., Нишиофуку М., Мория К., Одзи Ю., Ишизака С., Касахара К. и др. Семейный случай висцерального токсокароза, вызванного употреблением сырой бычьей печени. Parasitol Int. 2008; 57: 525–9.
PubMed
Статья
Google Scholar
Stoicescu RM, Mihai CM, Giannakopoulou AD.Выраженная гиперэозинофилия у малыша: отчет о болезни. J Med Life. 2011; 4: 105–8.
PubMed
PubMed Central
CAS
Google Scholar
Musso C, Castelo JS, Tsanaclis AM, Pereira FE. Распространенность гранулем печени, индуцированных Toxocara , выявленных с помощью иммуногистохимии, при серии аутопсий в Детской клинической больнице в Витории, ES, Бразилия. Арка Вирхова. 2007; 450: 411–47.
PubMed
Статья
Google Scholar
Хартлеб М., Янушевский К. Тяжелое поражение печени при мигрирующих висцеральных личинках. Eur J Gastroenterol Hepatol. 2001; 13: 1245–9.
PubMed
Статья
CAS
Google Scholar
Kuenzli E, Neumayr A, Chaney M, Blum J. Сердечные заболевания, связанные с токсокарозом — систематический обзор литературы. Acta Trop. 2016; 154: 107–20.
PubMed
Статья
Google Scholar
Kayes SG, Oaks JA. Развитие гранулематозного ответа при токсокарозе мышей. Начальные события Am J Pathol. 1978; 93: 277–94.
PubMed
CAS
Google Scholar
Дромер С, Константин А., Амар Дж., Колье М., Билли Т., Шамонтин Б. и др. Ревматологические аспекты токсокароза (висцеральная мигрирующая личинка), по поводу 2 случаев. Преподобный Рум Эд Фр. 1993; 60: 621–4.
PubMed
CAS
Google Scholar
Шетти AK, Авилес DH. Нефротический синдром, связанный с инфекцией Toxocara canis . Ann Trop Paediatr. 1999; 19: 297–300.
PubMed
Статья
CAS
Google Scholar
Prunier F, Delepine S, Victor J, de Gentile L, Moreau C, Laporte J, et al. Фибробластный эндокардит Лоффлера. Отчет о случае, осложнившем токсокароз. Arch Mal Coeur Vaiss. 2001; 94: 226–30. (на французском языке)
PubMed
CAS
Google Scholar
Исмаил М.А., Халафаллах О. Toxocara canis и хроническая крапивница у пациентов из Египта. J Egypt Soc Parasitol. 2005; 35: 833–40.
PubMed
Google Scholar
Стюарт JM, Cubillan LD, Cunningham ET Jr. Распространенность, клинические особенности и причины потери зрения среди пациентов с глазным токсокарозом. Сетчатка. 2005. 25: 1005–13.
PubMed
Статья
Google Scholar
Центры по контролю и профилактике заболеваний. Глазной токсокароз — США, 2009–2010 гг. MMWR Morb Mortal Wkly Rep. 2011; 60: 734–6.
Google Scholar
Quinnell RJ. Генетика предрасположенности к гельминтозной инфекции. Int J Parasitol. 2003. 33: 1219–31.
PubMed
Статья
CAS
Google Scholar
Norhaida A, Suharni M, Liza Sharmini AT, Tuda J, Rahmah N.rTES-30USM: клонирование с помощью сборочной ПЦР, экспрессии и оценки полезности при обнаружении токсокароза S228. Ann Trop Med Parasitol. 2008; 102: 151–60.
PubMed
Статья
CAS
Google Scholar
Xinou E, Lefkopoulos A, Gelagoti M, Drevelegas A, Diakou A, Milonas I, Dimitriadis AS. Результаты КТ и МРТ при церебральной токсокаральной болезни. AJNR Am J Neuroradiol. 2003; 24: 714–8.
PubMed
CAS
Google Scholar
Watthanakulpanich D, Smith HV, Hobbs G, Whalley AJ, Billington D. Применение экскреторно-секреторных антигенов Toxocara canis и антител подкласса IgG (IgG1-4) в серодиагностических анализах токсокароза человека. Acta Trop. 2008; 106: 90–5.
PubMed
Статья
CAS
Google Scholar
Нордин Р., Смит Х.В., Мохамад С., Майзелс Р.М., Фонг М.И. Сравнение IgG-ELISA и IgG4-ELISA для серодиагностики Toxocara .Acta Trop. 2005; 93: 57–62.
PubMed
Статья
CAS
Google Scholar
Jin Y, Shen C, Huh S, Sohn WM, Choi MH, Hong ST. Серодиагностика токсокароза методом ИФА с использованием неочищенного антигена личинок Toxocara canis . Корейский J Parasitol. 2013; 51: 433–9.
PubMed
PubMed Central
Статья
Google Scholar
Jacobs DE, Zhu XQ, Gasser RB, Chilton NB.Методы на основе ПЦР для идентификации потенциально зоонозных аскаридоидных паразитов собак, лисиц и кошек. Acta Trop. 1997; 68: 191–200.
PubMed
Статья
CAS
Google Scholar
Li MW, Lin RQ, Chen HH, Sani RA, Song H, Zhu XQ. Инструменты ПЦР для проверки специфической идентичности аскаридных нематод собак и кошек. Зонды Mol Cell. 2007; 21: 349–54.
PubMed
Статья
CAS
Google Scholar
Рай С.К., Уга С., Ву З., Такахаши Ю., Мацумура Т. Использование полимеразной цепной реакции в диагностике токсокароза: экспериментальное исследование. Юго-Восточная Азия J Trop Med Public Health. 1997; 28: 541–4.
PubMed
CAS
Google Scholar
Van De N, Trung NV, le Duyet V, Chai JY. Молекулярная диагностика больного глазным токсокарозом во Вьетнаме. Корейский J Parasitol. 2013; 51: 563–7.
PubMed
PubMed Central
Статья
Google Scholar
Lim SJ, Lee SE, Kim SH, Hong SH, You YS, Kwon OW и др. Распространенность Toxoplasma gondii и Toxocara canis среди больных увеитом. Ocul Immunol Inflamm. 2014; 22: 360–6.
PubMed
Статья
CAS
Google Scholar
Macuhova K, Kumagai T., Akao N, Ohta N. Петлевой изотермический анализ амплификации для обнаружения и различения яиц Toxocara canis и Toxocara cati непосредственно из образцов песка.J Parasitol. 2010; 96: 1224–7.
PubMed
Статья
CAS
Google Scholar
Tomita N, Mori Y, Kanda H, Notomi T. Петлевая изотермическая амплификация (LAMP) генных последовательностей и простое визуальное обнаружение продуктов. Nat Protoc. 2008; 3: 877–82.
PubMed
Статья
CAS
Google Scholar
Аревало Дж. Ф., СП Эспиноза, Ф. Аревало. Глазной токсокароз.J Pediatr Ophthalmol Strabismus. 2012; 50: 76–86.
PubMed
Статья
Google Scholar
Campbell JP, Wilkinson CP. Визуализация в диагностике и лечении глазного токсокароза. Int Ophthalmol Clin. 2012; 52: 145–53.
PubMed
Статья
Google Scholar
Morais FB, MacielAL ATE, Muccioli C, Al-lemann N. Результаты ультразвукового исследования при глазном токсокарозе.Arq Bras Ophthalmol. 2012; 75: 43–7.
Артикул
Google Scholar
Hashida N, Nakai K, Nishida K. Диагностическая оценка глазного токсокароза с использованием оптической когерентной томографии с высоким проникновением. Case Rep Ophthalmol. 2014; 5: 16–21.
PubMed
PubMed Central
Статья
Google Scholar
Ахмед А.С., Бисвас Дж. Увейтис: поиск причины.Тайвань J Ophthalmol. 2013; 3: 134–40.
Артикул
Google Scholar
Ким Й.Дж., Мун СН, Чанг Дж. Х. Токсокароз диска зрительного нерва. J Neuroophthalmol. 2013; 33: 151–2.
PubMed
Статья
Google Scholar
Tran VT, Lumbroso L, LeHoang P, Herbort CP. Ультразвуковая биомикроскопия при периферическом ретиновитреальном токсокарозе. Am J Ophthal. 1999; 127: 607–9.
PubMed
Статья
CAS
Google Scholar
Родман Дж., Пиццименти Дж. Диагностическая визуализация глазного токсокароза in vivo. Clin Exp Optom. 2009. 92: 146–14.
PubMed
Статья
Google Scholar
Чен К., Гу Дж., Цзян Р., Чжоу М., Чанг К. Роль ультразвуковой биомикроскопии в диагностике глазного токсокароза. Br J Ophthalmol. 2018 Май; 102 (5): 642–6.
PubMed
Статья
Google Scholar
Sánchez SS, García HH, Nicoletti A. Результаты клинической и магнитно-резонансной томографии нейротоксокароза. Фронт Neurol. 2018; 9: 53.
PubMed
PubMed Central
Статья
Google Scholar
Рохилла С., Джайн Н., Ядав Р., Дхаулаканди ДБ. Мигрирующая висцеральная личинка печени. BMJ Case Rep.2013; 13: 2013.
Google Scholar
Раджеш С., Патидар Ю., Растоги А., Бихари С. Изображение месяца: мигрирующая висцеральная личинка печени. Am J Gastroenterol. 2015; 110: 497.
PubMed
Статья
CAS
Google Scholar
Ким Ю.К., Ким С.С., Мун В.С., Чо БХ, Ли Си, Ли Дж. Результаты МРТ очаговых эозинофильных заболеваний печени. AJR Am J Roentgenol. 2005; 184: 1541–8.
PubMed
Статья
Google Scholar
Magnaval JF, Шарле JP. Сравнительная эффективность тиабендазола и мебендазола при лечении токсокароза. Терапия. 1987; 42: 541–4. (на французском языке)
PubMed
CAS
Google Scholar
Stürchler D, Schubarth P, Gualzata M, Gottstein B, Oettli A. Тиабендазол против альбендазола в лечении токсокароза: клиническое испытание. Ann Trop Med Parasitol. 1989; 83: 473–8.
PubMed
Статья
Google Scholar
Павловски З. Токсокароз у человека: клиническое проявление и дилемма лечения. J Helminthol. 2001; 75: 299–305.
PubMed
Статья
CAS
Google Scholar
Woodhall DM, Fiore AE. Токсокароз: обзор для педиатров. J Pediatric Infect Dis Soc. 2014; 3: 154–9.
PubMed
Статья
Google Scholar
Ранасурия Г., Миан А., Бужауд З., Цигрелис К.Легочный токсокароз: клинический случай и обзор литературы. Инфекционное заболевание. 2014; 42: 575–8.
PubMed
Статья
CAS
Google Scholar
Грючкова Г. Новые подходы к иммунопрофилактике при токсокарозе. В: Holland CV, Smith HV, редакторы. Toxocara : загадочный паразит. Оксфордшир: CAB International; 2006. с. 174–94.
Google Scholar
Мартинес-Пульгарин Д.Ф., Муньос-Урбано М., Гомес-Сута Л.Д., Дельгадо О.М., Родригес-Моралес AJ. Глазной токсокароз: новые диагностические и терапевтические перспективы. Последние сообщения Pat Antiinfect Drug Discov. 2015; 10: 35–41.
PubMed
Статья
Google Scholar
Frazier M, Anderson ML, Sophocleous S. Лечение глазного токсокароза альбендезолом: описание случая. Оптометрия. 2009. 80: 175–80.
PubMed
Статья
Google Scholar
Satou T, Horiuchi A, Akao N, Koike K, Fujita K, Nikaido T. Toxocara canis : поиск потенциального лекарства среди алкалоидов бета-карболина — исследования in vitro и на мышах. Exp Parasitol. 2005; 110: 134–9.
PubMed
Статья
CAS
Google Scholar
Осман А.А. Лечебная битва с личиночным токсокарозом: мы все еще далеко позади? Acta Trop. 2012; 124: 171–8.
PubMed
Статья
Google Scholar
Wiśniewska-Ligier M, Woniakowska-Gęsicka T, Sobolewska-Dryjańska J, Markiewicz-Jówiak A, Wieczorek M. Анализ течения и лечения токсокароза у детей: многолетнее наблюдение. Parasitol Res. 2012; 110: 2363–71.
PubMed
Статья
Google Scholar
Вудхолл Д., Старр М.К., Монтгомери С.П., Джонс Дж. Л., Лам Ф., Рид Р. У. и др. Глазной токсокароз: эпидемиологические, анатомические и терапевтические варианты на основе опроса узких офтальмологов.Офтальмология. 2012; 119: 1211–7.
PubMed
Статья
Google Scholar
Чой К.Д., Чой Дж. Х., Чой С. Ю., Юнг Дж. Х. Токсокарная оптическая нейропатия: клинические особенности и офтальмологические данные. Int J Ophthalmol. 2018; 11: 520–3.
PubMed
PubMed Central
Google Scholar
Эберхардт О., Биалек Р., Нагеле Т., Дичганс Дж. Эозинофильный менингомиелит при токсокарозе: клинический случай и обзор литературы.Clin Neurol Neurosurg. 2005; 107: 432–8.
PubMed
Статья
CAS
Google Scholar
Graeff-Teixeira C, da Silva AC, Yoshimura K. Обновленная информация об эозинофильном менингоэнцефалите и его клинической значимости. Clin Microbiol Rev.2009; 22: 322–48.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Гоффетт С., Жанжан А.П., Дюпре Т.П., Бигайнон Дж., Синдик С.Дж.Эозинофильный плеоцитоз и миелит, связанные с инфекцией Toxocara canis . Eur J Neurol. 2000. 7: 703–6.
PubMed
Статья
CAS
Google Scholar
Хомбу А., Йошида А., Кикучи Т., Нагаясу Е., Куроки М., Маруяма Х. Лечение синдрома мигрирующей личинки с помощью длительного приема альбендазола. J Microbiol Immunol Infect. 2017; S1684-1182 (17): 30142–1.
Google Scholar
Deplazes P, van Knapen F, Schweiger A, Overgaauw PA. Роль домашних собак и кошек в передаче гельминтозов зоонозов в Европе с особым вниманием к эхинококкозу и токсокарозу. Vet Parasitol. 2011; 24: 41–53.
Артикул
Google Scholar
Parsons JC. Аскаридные инфекции кошек и собак. Ветеринарная клиника North Am Small Anim Pract. 1987; 17: 1303–7.
Артикул
Google Scholar
ВОЗ. Действия по снижению опасности для здоровья человека, исходящей от животных. ВОЗ Хрон. 1978; 32: 307–10.
Google Scholar
Мальейро А., Анибал Ф. Ф., Мартинс-Филью О. А., Тейшейра-Карвалью А., Перини А., Мартинс М. А., Медейруш А. И., Турато В. М., Асенсио М. П., Брандао ИТ, Номизо А., Силва С. Л., Фаччиоли Л. Х. Вакцинация pcDNA-IL-12 блокирует эозинофильное воспаление, но не гиперчувствительность дыхательных путей после инфицирования мыши Toxocara canis .Вакцина. 2008; 26: 305–15.
PubMed
Статья
CAS
Google Scholar
Basualdo J, Sparo M, Chiodo P, Ciarmela M, Minvielle M. Пероральное введение потенциального пробиотика ( Enterococcus faecalis CECT 7121), по-видимому, снижает количество паразитов у мышей, инфицированных Toxocara canis . Ann Trop Med Parasitol. 2007. 101: 559–62.
PubMed
Статья
CAS
Google Scholar
Chiodo PG, Sparo MD, Pezzani BC, Minvielle MC, Basualdo JA. In vitro и in vivo эффекты Enterococcus faecalis CECT7121 на Toxocara canis . Mem Inst Oswaldo Cruz. 2010; 105: 615–20.
PubMed
Статья
CAS
Google Scholar
де Авила Л.Ф., Консейсао, Франция, Telmo Pde L, Dutra GF, de los Santos DG, Martins LH, Berne ME, da Silva PE, Scaini CJ. Saccharomyces boulardii снижает интенсивность инфицирования мышей с токсокарозом.Vet Parasitol. 2012; 187: 337–40.
PubMed
Статья
Google Scholar
Kudtarkar A, Shinde UP, Bharkad G, Singh K. Твердые липидные наночастицы альбендазола для лечения инфекции Toxocara canis : исследования эффективности in vivo. Nanosci Nanotechnol-Asia. 2017; 7: 80–91.
CAS
Google Scholar
Wilkinson CP, Welch RB. Внутриглазный Toxocara .Am J Ophthalmol. 1971; 71: 921–30.
PubMed
Статья
CAS
Google Scholar
Йокои К., Гото Х., Сакаи Дж., Усуи М. Клинические особенности глазного токсокароза в Японии. Ocul Immunol Inflamm. 2003; 11: 269–75.
PubMed
Статья
Google Scholar
до Лаго А., Андраде Р., Муччиоли С., Белфорт Р. мл. Оптическая когерентная томография предполагаемой субретинальной гранулемы Toxocara : клинический случай.Arq Bras Oftalmol. 2006; 69: 403–5.
PubMed
Статья
Google Scholar
Gass JD, Gilbert WR, Guerry RK, Scelfo R. Диффузный односторонний подострый нейроретинит. Офтальмология. 1978; 85: 521–45.
PubMed
Статья
CAS
Google Scholar
de Souza EC, Nakashima Y. Диффузный односторонний подострый нейроретинит. Отчет о трансвитреальном хирургическом удалении субретинальной нематоды.Офтальмология. 1995; 102: 1183–6.
PubMed
Статья
CAS
Google Scholar
Коричневый DH. Глаз Toxocara canis . I Экспериментальная иммунология. Энн Офтальмол. 1971; 3: 907–10.
PubMed
CAS
Google Scholar
Гиллеспи С.Х., Диннинг В.Дж., Воллер А., Кроукрофт Н.С. Спектр глазного токсокароза. Глаз (Лонд). 1993; 7: 415–8.
Артикул
Google Scholar
Ahn SJ, Ryoo NK, Woo SJ. Глазной токсокароз: клиника, диагностика, лечение и профилактика. Asia Pac Allergy. 2014; 4: 134–41.
PubMed
PubMed Central
Статья
Google Scholar
Ahn SJ, Woo SJ, Jin Y, Chang YS, Kim TW, Ahn J, et al. Клиника и течение глазного токсокароза у взрослых.PLoS Negl Trop Dis. 2014; 8: e2938.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Glickman LT, Magnaval JF, Domanski LM, Shofer FS, Lauria SS, Gottstein B, et al. Висцеральная мигрирующая личинка у взрослых французов: синдром новой болезни? Am J Epidemiol. 1987; 125: 1019–34.
PubMed
Статья
CAS
Google Scholar
Финстерер Дж., Ауэр Х.Нейротоксокароз. Rev Inst Med Trop Сан-Паулу. 2007. 49: 279–87.
PubMed
Статья
Google Scholar
Richartz E, Buchkremer G. Церебральный токсокароз: редкая причина когнитивных расстройств. Вклад в дифференциальную диагностику деменции. Nervenarzt. 2002. 73: 458–62. (на немецком языке)
PubMed
Статья
CAS
Google Scholar
Bachli H, Minet JC, Gratzl O.Церебральный токсокароз: возможная причина эпилептических припадков у детей. Чайлдс NervSyst. 2004. 20: 468–72.
Google Scholar
Морейра-Силва С.Ф., Родригес М.Г., Пимента Дж.Л., Гомеш С.П., Фрейре Л.Х., Перейра ИП. Токсокароз центральной нервной системы: сообщалось о двух случаях. Rev Soc Bras Med Trop. 2004; 37: 169–74.
PubMed
Статья
Google Scholar
Фортенберри Дж. Д., Кенни Р. Д., Младший Дж. Мигрирующая висцеральная личинка, вызывающая статическую энцефалопатию у младенца. Pediatr Infect Dis J. 1991; 10: 403–6.
PubMed
Статья
CAS
Google Scholar
Caldera F, Burlone ME, Genchi C, Pirisi M, Bartoli E. Toxocara энцефалит с поражением автономной нервной системы. Инфекционное заболевание. 2013; 41: 691–4.
PubMed
Статья
CAS
Google Scholar
Gasser RB, Zhu XQ, Jacobs DE, Hu M, Chilton NB. Молекулярно-генетическая характеристика представителей рода Toxocara — таксономические, популяционно-генетические и эпидемиологические соображения. В: Holland CV, Smith HV, редакторы. Toxocara : загадочный паразит. Соединенное Королевство: Уоллингфорд; 2006. с. 18–31.
Google Scholar
Magnaval JF, Faufingue JH, Morassin B, Fabre R. Катионный белок эозинофилов, специфические IgE и IgG4 при токсокарозе человека.J Helminthol. 2006; 80: 417–23.
PubMed
Статья
CAS
Google Scholar
Магнавал Дж. Ф., Берри А., Фабр Р., Морассин Б. Катионный белок эозинофилов как возможный маркер активной инфекции человека Toxocara . Аллергия. 2001; 56: 1096–9.
PubMed
Статья
CAS
Google Scholar
Mohamad S, Azmi NC, Noordin R. Разработка и оценка чувствительного и специфического теста для диагностики токсокароза человека с использованием трех рекомбинантных антигенов (TES-26, TES-30USM и TES-120).J Clin Microbiol. 2009; 47: 1712–7.
PubMed
PubMed Central
Статья
CAS
Google Scholar
Peixoto PL, Nascimento E, Cançado GG, Miranda RR, Rocha RL, Araújo RN, et al. Идентификация антигенов-кандидатов от взрослых стадий Toxocara canis для серодиагностики токсокароза человека. Mem Inst Oswaldo Cruz. 2011; 106: 200–6.
PubMed
Статья
Google Scholar
Magnaval JF, Fabre R, Maurières P, Charlet JP, de Larrard B. Применение процедуры вестерн-блоттинга для иммунодиагностики токсокароза человека. Parasitol Res. 1991; 77: 697–702.
PubMed
Статья
CAS
Google Scholar
Yamasaki H, Araki K, Lim PK, Zasmy N, Mak JW, Taib R, Aoki T. Разработка высокоспецифичного рекомбинантного Toxocara canis второй стадии экскреторно-секреторного антигена личинки для иммунодиагностики токсокароза человека .J Clin Microbiol. 2000; 38: 1409–13.
PubMed
PubMed Central
CAS
Google Scholar
Magnaval JF. Сравнительная эффективность диэтилкарбамазина и мебендазола для лечения токсокароза человека. Паразитология. 1995; 110: 529–33.
PubMed
Статья
Google Scholar
Баррера М.Г., Леонарди Д., Болмаро Р.Э., Эченике К.Г., Оливьери А.С., Саломон С.Дж. и др.Оценка in vivo микросфер альбендазола для лечения личинок Toxocara canis migrans. Eur J Pharm Biopharm. 2010; 75: 451–4.
PubMed
Статья
CAS
Google Scholar
Леонарди Д., Эченик К., Ламас М.С., Саломон С.Дж. Высокая эффективность альбендазола-ПЭГ 6000 в лечении инфекции личинки Toxocara canis migrans. J Antimicrob Chemother. 2009. 64: 375–8.
PubMed
Статья
CAS
Google Scholar
Хориучи А., Сато Т., Акао Н., Койке К., Фудзита К., Никайдо Т. Влияние свободного альбендазола и альбендазола, заключенного в полиэтиленгликоль-липосомы, на подвижность и количество личинок у мышей, инфицированных Toxocara canis . Vet Parasitol. 2005; 129: 83–7.
PubMed
Статья
CAS
Google Scholar
Грцкова Г., Велебный С. Лечение инфекций Toxocara canis у мышей с помощью включенных в липосомы карбаматов бензимидазола и иммуномодулятора глюкана.J Helminthol. 2001; 75: 141–146.
PubMed
CAS
Google Scholar
Хруцкова Г., Велебный С., Обваллер А., Ауэр Х., Коган Г. Оценка последующей терапии фенбендазолом, включенным в стабилизированные липосомы, и иммуномодулятор глюкана у мышей, инфицированных личинками Toxocara canis . Acta Trop. 2007. 104: 122–32.
Артикул
CAS
Google Scholar
Руководство по глазному токсокарозу (лечение в 2020 г.)
Глазной токсокароз встречается редко, но может привести к слепоте и другим изнурительным проблемам со зрением.Это результат паразитарной инфекции аскариды.
Существуют хирургические и медицинские методы лечения, в зависимости от тяжести состояния. Врачи могут назначить кортикостероиды, глистогонные препараты или хирургическое вмешательство при таких осложнениях, как отслоение сетчатки.
Токсокароз — это тип инфекции, которую животные могут передавать человеку. Считается, что в США этой инфекции заразились десятки миллионов человек. Однако многие люди, подвергшиеся воздействию паразита Toxocara , никогда не заболевают. (Подробнее)
Два основных синдрома, связанных с этой инфекцией, включают глазной токсокароз и системный токсокароз. Глазной тип возникает, когда личинки Toxocara мигрируют в глаз, поражая зрительный нерв или глаз.
Из-за потенциально разрушительных последствий, которые это состояние может иметь для пораженного глаза, крайне важно, чтобы все подозреваемые случаи были быстро диагностированы. Обычно это делается с помощью теста ELISA, чтобы гарантировать окончательный диагноз. (Подробнее)
Есть варианты лечения, которые врачи могут назначить, при этом кортикостероиды часто рассматриваются в первую очередь при наличии активного внутриглазного воспаления. (Подробнее)
Поскольку первичная инфекция токсокароза не редкость, каждый должен принять надлежащие профилактические меры. Предотвращая первичную инфекцию, люди могут остановить развитие глазного токсокароза. (Подробнее)
Что такое токсокароз?
В U.S., по оценкам, около 14 процентов населения перенесли эту инфекцию. Люди, у которых есть собаки, имеют более высокий риск заразиться им. Тем не менее, кошачьи фекалии также могут передавать инфекцию.
Эта инфекция чаще встречается у людей в жарких и влажных регионах, а также у тех, кто живет в бедности.
Инфекция токсокароза может развиться, если кто-то случайно проглотит яиц токсокары . Яйца вылупляются после того, как попадают в тело.
Через кровоток личинки аскариды попадают в разные участки тела. Глаза — это одна из структур, в которую они могут попасть, а также печень, легкие, мышцы, сердце и мозг.
В большинстве случаев люди не испытывают никаких симптомов. Однако, если личинки вызывают повреждение органов или тканей, симптомы могут включать жар, воспаление печени, кашель и проблемы с глазами.
Что такое глазной токсокароз?
Если инфекция токсокароза поражает глаза, может развиться глазной токсокароз.
Примерно у 90 процентов людей поражен только один глаз. Традиционно эксперты полагали, что этой инфекцией в первую очередь заразились маленькие дети и младенцы, но недавние исследования показали, что она также наблюдалась у молодых людей и подростков.
Основные симптомы включают плавающие помутнения и нечеткое зрение. Также возможна чувствительность к свету и боли, но обычно они легкие.
Согласно Review of Ophthalmology, у маленьких детей эту глазную инфекцию можно не заметить, пока у них не разовьется лейкокория или косоглазие или они не пройдут проверку зрения в школе.
Leukocoria описывает аномальное белое отражение, исходящее от сетчатки глаза.
Косоглазие — это перекос глаз. Это может быть наружу или внутрь.
Диагностическое тестирование
При подозрении на токсокароз глаз врач обычно начинает офтальмологическое обследование. Врач ищет признаки этого состояния, такие как гранулема сетчатки. Эта гранулема представляет собой воспалительную массу от беловатого до желтоватого цвета.Обычно он обнаруживается в периферической сетчатке или заднем полюсе.
Врач также может искать сопутствующие заболевания, которые могут присутствовать при гранулеме, например:
- Эпиретинальная мембрана. Это состояние характеризуется образованием тонкого слоя рубцовой ткани на поверхности сетчатки.
- Отслоение сетчатки. Сетчатка отделяется от точек прикрепления.
- Отек желтого пятна. Это состояние возникает, когда жидкость накапливается в желтом компоненте сетчатки.
Эти сопутствующие заболевания могут вызвать необратимую потерю зрения в глазах, где присутствует глазной токсокароз.
Для подтверждения диагноза врач обычно проводит серологическое исследование, которое обычно состоит из иммуноферментного анализа (ИФА). С помощью этого теста они ищут сывороточные антитела, связанные с личинками Toxocara .
Варианты лечения
- Кортикостероиды: При внутриглазном воспалении обычно назначают кортикостероиды.Их обычно принимают внутрь для облегчения воспаления. Важно принимать лекарство точно по назначению. Врач также может дать рекомендации по диете, например, следить за потреблением сахара. Это потому, что кортикостероиды могут повышать уровень сахара в крови.
- Противогельминтные препараты : При глазном токсокарозе использование противогельминтных препаратов для лечения инфекции остается спорным вопросом. Тем не менее, это все еще может рассматриваться для некоторых людей. Эти препараты обычно используются при системной форме этой инфекции.Когда врачи назначают этот тип лекарства, его обычно назначают вместе с кортикостероидным препаратом.
- Фотокоагуляция: В одном отчете исследовалось использование фотокоагуляции для лечения этой инфекции. В отчете говорится, что это лечение уничтожило подвижную субретинальную личинку. Фотокоагуляция считается хирургической процедурой. Он работает, чтобы разрушить или уменьшить аномальные структуры сетчатки. Это также может привести к образованию рубцов, специально предназначенному для лечения проблемы с сетчаткой.
Врач использует для этой процедуры лазер.Это вызывает микроскопический ожог. Это лечение, как правило, наиболее эффективно, когда оно используется на ранних стадиях заболевания. Если человек уже потерял зрение в результате этой инфекции, это лечение не может вернуть его. Однако это может помочь снизить риск дальнейшей или необратимой потери зрения.
- Ранибизумаб : В некоторых случаях у людей развивается хориоидальная неоваскуляризация в результате глазного токсокароза. Неоваскуляризация сосудистой оболочки глаза характеризуется развитием новых кровеносных сосудов в слое сосудистой оболочки глаза.Один отчет показал, что лекарство ранибизумаб было эффективным для лечения этой проблемы при интравитреальном введении.
Ранибизумаб — это лекарство, которое чаще всего используется для лечения влажной формы возрастной дегенерации желтого пятна. Поскольку это может помочь уменьшить отек желтого пятна, который возникает в результате окклюзии вены сетчатки, он может быть полезен при этой проблеме.
Этот препарат классифицируется как агонист фактора роста эндотелия сосудов. Его механизм действия — остановить рост аномальных кровеносных сосудов.Он также помогает остановить утечку жидкости из глаз, которая может привести к потере зрения.
Этот препарат выпускается в жидкой форме. Когда врач назначает его для лечения токсокароза глаз, он вводится непосредственно в пораженный глаз.
В среднем это лекарство вводится примерно раз в месяц и только в пораженный глаз. Уколы можно сделать в кабинете врача.
- Операция: Если у кого-то наблюдается эпиретинальная мембрана, отслоение сетчатки или стойкое помутнение стекловидного тела, часто показано хирургическое вмешательство.Точная выполняемая процедура зависит от состояния, в котором находится человек, и его общей степени тяжести.
Предотвращение инфекции
Есть методы, которые люди могут использовать, чтобы снизить риск заражения этой инфекцией. Каждому, у кого есть кошки или собаки, следует регулярно проверять своих питомцев на наличие глистов, особенно если они проводят время на улице.
Не реже одного раза в неделю очищайте жилую зону питомца, а также миски для еды и воды. После обработки фекалий питомца немедленно вымойте руки водой с мылом.При работе с фекалиями домашних животных также рекомендуется надевать перчатки для утилизации.
Так как яйца могут быть обнаружены в почве, после работы в саду или другого контакта с грязью или почвой, мойте руки. Учите детей никогда не есть землю или грязь, поскольку это подвергает их риску проглатывания яиц.
Также убедитесь, что все песочницы закрыты, когда они не используются, чтобы животные не использовали их в качестве туалетного лотка.
Яйца Toxocara устойчивы к внешним воздействиям и могут жить годами при соблюдении надлежащих условий благодаря их прочному защитному слою.Эти яйца не уничтожаются большинством обычных дезинфицирующих средств. Поэтому соблюдение осторожности при обращении с фекалиями животных и их немедленное удаление являются важными мерами.
После того, как яйца выходят из животного, они не заразны в течение двух-четырех недель, поэтому необходима тщательная очистка для удаления всего, что может включать яйца.
Любой, у кого развивается инфекция токсокароза, должен знать о возможности глазного токсокароза. Немедленное лечение важно независимо от того, начинает ли заболевание влиять на глаза.
Список литературы
Глазной токсокароз — США, 2009-2010 гг. Центры по контролю и профилактике заболеваний.
Эпидемиология и факторы риска. Центры по контролю и профилактике заболеваний.
Распространенность, клинические особенности и причины потери зрения у пациентов с глазным токсокарозом. Сетчатка .
Выявление и лечение глазного токсокароза. Обзор офтальмологии.
Глазной токсокароз: обзор. Обзор офтальмологии .
Профилактика и контроль. Центры по контролю и профилактике заболеваний.
Какая связь между преднизоном и диабетом? Медицинские новости сегодня.
Случай глазного токсокароза, вылеченный с помощью ксеноновой фотокоагуляции. Клиника Oczna .
Интравитреальный ранибизумаб в лечении хориоидальной неоваскуляризации, вторичной по отношению к глазному токсокарозу, у 13-летнего мальчика. Глаз .
Глазной токсокароз: клинические особенности, диагностика, лечение и профилактика. Аллергия в Азиатско-Тихоокеанском регионе .
.

