Инфекционный эндокардит у детей. Что изменилось за последние 40 лет?
Цель. Ученые оценили 106 случаев инфекционного эндокардита (ИЭ) у детей в Китае и выяснили клинические проявления и вид патогенного микроорганизма, вызвавшего ИЭ.
Методы. Клинические признаки, осложнения, патогенные микроорганизмы, диагностика и лечение детского ИЭ были рассмотрены в двух группах пациентов с ИЭ в разные периоды времени (группа А, 34 случая, произошедшие в период с 2000 по 2011 года и группа В, 72 случая, произошедшие в период с 1964 по 1999 год).
Результаты. В общей сложности 106 педиатрических больных с достоверным диагнозом ИЭ на основе модифицированных критериев Duke были зачислены в исследование и оценены. Сравнивая две группы пациентов из разных периодов времени, ученые обнаружили, что заболеваемость ревматической болезнью сердца значительно сократилась (с 19,4 до 5,9%), в то время как врожденное заболевание сердца, связанное с ИЭ, имело тенденцию к увеличению (с 55,6 до 79,4%). Золотистый стафилококк был наиболее распространенным патогенным микроорганизмом, и его участие в патологическом процессе имело тенденцию к увеличению (от 32,0 до 58,5%), в то время как процент инфекций, вызванных Streptococcus Viridans (8,0%), не изменился. Интересно отметить, что частота вегетаций увеличилась с 50,0 до 67,6 %, также увеличилась заболеваемость правосторонним ИЭ (с 35,0 до 60,9 %). В последнее время наиболее поражаемым был трехстворчатый клапан (увеличение с 30,0 до 47,8%), в то время как частота поражения митрального клапан сократилась (с 60,0 до 39,1%). Наиболее часто используемым антибиотиком для лечения ИЭ был пенициллин; в последнее время все больше рекомендуют сочетать пенициллин с цефалоспоринами.
Золотистый стафилококк был наиболее распространенным патогенным микроорганизмом, и его участие в патологическом процессе имело тенденцию к увеличению (от 32,0 до 58,5%), в то время как процент инфекций, вызванных Streptococcus Viridans (8,0%), не изменился. Интересно отметить, что частота вегетаций увеличилась с 50,0 до 67,6 %, также увеличилась заболеваемость правосторонним ИЭ (с 35,0 до 60,9 %). В последнее время наиболее поражаемым был трехстворчатый клапан (увеличение с 30,0 до 47,8%), в то время как частота поражения митрального клапан сократилась (с 60,0 до 39,1%). Наиболее часто используемым антибиотиком для лечения ИЭ был пенициллин; в последнее время все больше рекомендуют сочетать пенициллин с цефалоспоринами.
Выводы. Сравнив педиатрических пациентов с ИЭ за последние 40 лет, ученые обнаружили, что роль ревматической болезни сердца, как предрасполагающего фактора, уменьшилась. Детский ИЭ по-прежнему преимущественно связан со стафилококковой инфекцией. Наиболее часто поражается трикуспидальный клапан вместо митрального клапана. Грамположительные бактерии показали повышенную устойчивость к пенициллину, использование комбинированной терапии со временем увеличивается.
Грамположительные бактерии показали повышенную устойчивость к пенициллину, использование комбинированной терапии со временем увеличивается.
Источник: www.karger.com
Первичный инфекционный эндокардит у детей и подростков Текст научной статьи по специальности «Клиническая медицина»
© Коллектив авторов, 2005
М.К. Соболева, Е.Г. Соболева, М.Е. Скоблякова ПЕРВИЧНЫЙ ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ У ДЕТЕЙ И ПОДРОСТКОВ
Кафедра педиатрии лечебного факультета (зав. проф. М.К. Соболева) Новосибирской государственной медицинской академии, Детский кардиоревматологический центр г. Новосибирск, РФ
Представлены результаты наблюдения 62 детей и подростков (возраст от 3 мес до 14 лет) с первичным инфекционным эндокардитом (ПИЭ). Инъекционные наркоманы исключены из исследования. Установлено, что особенностями современного ПИЭ являются поликлапанное поражение, более частое, чем у взрослых, вовлечение митрального клапана в воспалительный процесс, слабая выраженность лабораторных признаков иммунопатологической фазы воспаления, переход острой его формы в подострую под влиянием антибактериальной терапии, быстрота (в течение 1—3 недель) формирования пороков. Общая и госпитальная летальность при ПИЭ составила 10%, у излеченных клапанная недостаточность развилась в 80% случаев, среди которой преобладала недостаточность I степени. Количество пороков с клапанной недостаточностью II и III степени в последние годы снизилось в 2 раза в связи с применением длительной (до 6 недель) комбинированной антибактериальной терапии.
Общая и госпитальная летальность при ПИЭ составила 10%, у излеченных клапанная недостаточность развилась в 80% случаев, среди которой преобладала недостаточность I степени. Количество пороков с клапанной недостаточностью II и III степени в последние годы снизилось в 2 раза в связи с применением длительной (до 6 недель) комбинированной антибактериальной терапии.
Article presents the results of examination of 62 children and adolescents at the age of 3—14 years old with native infectious endocarditis (NIE). Drug-adduct patients were excluded from examination. Authors showed next current peculiarities of NIE: multivalvular lesion, more frequent mitral valve involvement in comparison with grown-up patients, low intensity of immune inflammation laboratory signs, transformation of acute from in subacute one under the influence of antibiotic therapy, quickness of valvular insufficiency forming (within 1—3 weeks). Total and intrahospital lethality in NIE patients was 10%; survived patients developed valvular insufficiency in 80% of cases, and I degree of insufficiency dominated among them. Number of cases with II—III degree of valvular insufficiency reduced last decade thanks to prolonged (up to 6 weeks) and combined antibiotic therapy.
Number of cases with II—III degree of valvular insufficiency reduced last decade thanks to prolonged (up to 6 weeks) and combined antibiotic therapy.
Первичный инфекционный эндокардит (ПИЭ) — тяжелое инфекционное, чаще бактериальное, системное заболевание с первоначальным поражением неизмененных до болезни клапанов сердца и пристеночного эндокарда. Болезнь сопровождается бактериемией, деструкцией клапанов, эмболическим, тромбогеморрагическим, иммунокомплексным поражением внутренних органов и без лечения приводит к смерти [1]. Первые описания ПИЭ принадлежат основоположнику учения о данном заболевании — Уильяму Ослеру (W. Osler), который в 1885 г., приведя систематизированное аналитическое описание 232 случаев инфекционного эндокардита (ИЭ), обратил внимание на то, что ИЭ чаще всего поражает предварительно измененный эндокард, в то же время (существенно реже) развитие болезни возможно и на предварительно неизмененных клапанах. В качестве иллюстрации им были приведены 3 случая ПИЭ. Удивительно, но годом раньше, в 1884 г. русский клиницист А.П. Ланговой подробно описал 4 пациентов с ИЭ, причем только у одной пациентки заболевание развилось на фоне врожденного порока сердца, у остальных трех — ИЭ был первичным. В России для познания ПИЭ исключительна роль В.А. Черногубова, который в 1940 г., в период господствующего мнения о том, что ИЭ является ко-
Удивительно, но годом раньше, в 1884 г. русский клиницист А.П. Ланговой подробно описал 4 пациентов с ИЭ, причем только у одной пациентки заболевание развилось на фоне врожденного порока сердца, у остальных трех — ИЭ был первичным. В России для познания ПИЭ исключительна роль В.А. Черногубова, который в 1940 г., в период господствующего мнения о том, что ИЭ является ко-
нечной стадией ревматизма, ярко описал и выделил ПИЭ, указав, что в структуре всех больных ИЭ у 20% пациентов болезнь развилась на предварительно неизменных клапанах. В настоящее время доля больных ПИЭ увеличилась до 30% среди всех заболевших ИЭ [2, 3], что связывают с экспансией факторов риска болезни. К последним относят ситуации, провоцирующие развитие транзиторной бактериемии,— манипуляции на сосудах, оперативные вмешательства, зондовое питание, эндоскопические исследования, интубация трахеи и искусственная вентиляция легких , стоматологические вмешательства, а также заболевания, течение или терапия которых сопровождается иммуносупрессией (лейкозы, солидные опухоли, сахарный диабет, бронхиальная астма и др. ) [4—7] . Особое место среди факторов риска ПИЭ занимает инъекционная наркомания, роль которой в последние годы становится все более весомой для подростков и детей [8].
) [4—7] . Особое место среди факторов риска ПИЭ занимает инъекционная наркомания, роль которой в последние годы становится все более весомой для подростков и детей [8].
В последние годы, благодаря внедрению эхокар-диоскопии для визуализации повреждения эндокарда, успехам антибактериальной терапии и инвазив-ной кардиохирургии (оперативного лечения ИЭ в период его активности), результаты лечения болезни, считавшейся ранее фатальной, существенно улучшились. Тем не менее ИЭ остается тяжелой, ива-
лидизирующей болезнью и, согласно прогнозам, число таких пациентов будет неуклонно возрастать [2, 4, 9].
Цель исследования — изучение частоты, особенностей клинической картины, лабораторных феноменов и исходов ПИЭ у детей и подростков в регистре их непрерывного наблюдения в течение 12 лет.
Материалы и методы исследования
Наблюдали 62 пациента в возрасте от 3 мес до 17 лет с ПИЭ, диагноз которого был установлен в период 1992—2004 гг. Наши 10 пациентов с ПИЭ — инъекционные наркоманы — были исключены из исследования, так как результаты изучения особенностей ПИЭ у пациентов этой группы были нами недавно опубликованы [8]. Контрольную группу составили 37 здоровых детей и 26 подростков.
Наши 10 пациентов с ПИЭ — инъекционные наркоманы — были исключены из исследования, так как результаты изучения особенностей ПИЭ у пациентов этой группы были нами недавно опубликованы [8]. Контрольную группу составили 37 здоровых детей и 26 подростков.
Для верификации ИЭ использовали критерии DUKE [10, 11], детально прокомментированные В.П. Тюриным [2], общеклиническое, лабораторно-инструментальное обследование, трансторакальная и чреспищеводная ЭХОКГ, бактериологическое исследование крови (3-кратное бактериологическое исследование образцов крови на стерильность с определением чувствительности микробов к антибиотикам). Всем больным в динамике проводили рентгенографическое исследование органов грудной клетки, ультразвуковое исследование внутренних органов, в 16 случаях — компьютерную, в 12 случаях ЯМР-диагнос-тику головного мозга, осмотр глазного дна, бульбарную микроскопию конъюнктивы, у 6 пациентов была исследована спинно-мозговая жидкость. Всем больным определяли маркеры вирусов гепатита B и С в сыворотке методом иммуноферментного анализа ELISA II с применением тест-систем производства «Вектор-Бест».
Всем больным определяли маркеры вирусов гепатита B и С в сыворотке методом иммуноферментного анализа ELISA II с применением тест-систем производства «Вектор-Бест».
Полученные результаты статистически обработаны с применением пакетов прикладных программ «Microcal Origin» и «Мicrosoft Excel», при сравнении признаков был использован критерий Стьюдента, достоверными считали различия при р<0,05, для изучения степени взаимосвязи между параметрами использовали коэффициент корреляции r, вычисленный по формуле Пирсона.
Результаты и их обсуждение
Согласно нашим наблюдениям, ПИЭ у не наркоманов в популяции детей и подростков встречается с частотой 0,15:10000 в год, 1,1% на 100 госпитализаций в специализированное отделение. Число грудных детей и детей раннего возраста в структуре ПИЭ составило всего 2 ребенка (3,2%), что несколько расходится с мнением некоторых авторов [12], которые считают, что ПИЭ в детской популяции поражает преимущественно младенцев. Полученные нами данные свидетельствуют о том, что ПИЭ остается редким, а у грудных детей — редчайшим заболеванием.
Полученные нами данные свидетельствуют о том, что ПИЭ остается редким, а у грудных детей — редчайшим заболеванием.
Пик заболеваемости ПИЭ у наблюдавшихся в регистре приходился на возраст 12,4±1,6 лет, среди больных явно доминировали лица мужского пола (соотношение 2,8:1 в пользу лиц мужского пола), аналогичная тенденция отмечается и во взрослых клиниках [2]. У 3 юношей, больных ПИЭ, заболевание носило «семейный характер»: все трое имели
родственников первой линии родства: отцов — в двух случаях, мать — в одном, перенесших ИЭ. В одном случае отец ребенка погиб от ПИЭ, в другом — ПИЭ привел к формированию тяжелой недостаточности аортального клапана, потребовавшей его протезирования через 6 мес от верификации ПИЭ. В третьем случае, когда в родословной пробанда была выявлена мать, страдающая ИЭ, можно было судить о низкой активности заболевания у нее на фоне ревматического порока сердца, в то же время операция по протезированию митрального клапана из-за недостаточности последнего вследствие ИЭ (в данном случае вторичного) все-таки потребовалась и была проведена через 3,5 года от верификации вторичного ИЭ.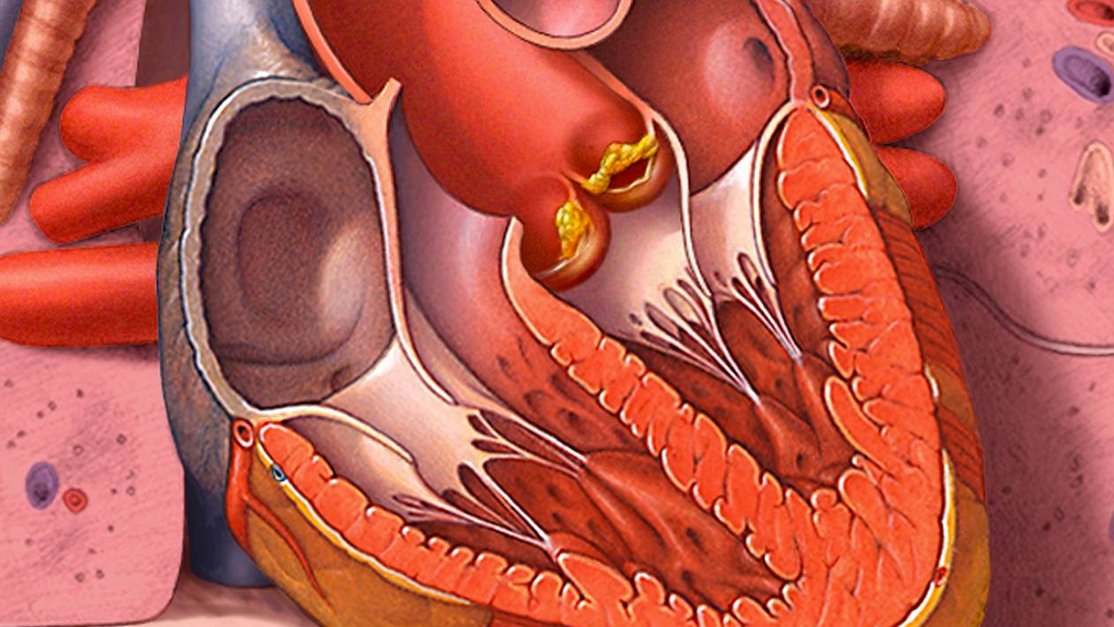 Наше описание «семейных случаев ПИЭ» является первым в литературе.
Наше описание «семейных случаев ПИЭ» является первым в литературе.
Течение болезни у обследованных можно было квалифицировать как «острое» в 26% (16) случаев, у остальных — заболевание протекало подостро, при этом I степень активности отмечена у 26 больных (58%), II степень активности — у 14 пациентов (22%), c максимальной (III) степенью активности ПИЭ протекал у 12 (20%) пациентов. Острое течение ПИЭ было, как правило, ассоциировано с высокой степенью активности: у всех 12 больных с III степенью ПИЭ протекал остро, у остальных 4 пациентов с острым течением ПИЭ активность заболевания была II степени. У пациентов с так называемым «семейным ИЭ» болезнь протекала подостро, с III степенью активности. Важной особенностью современного ПИЭ является его способность к трансформации острого, иногда «острейшего» течения в подострое с невысокой степенью активности под влиянием антибактериальной терапии, что мы наблюдали у 9 пациентов (14,5%).
Транзиторная бактериемия могла возникнуть вследствие предшествующих оперативных вмешательств у 9 больных (14,5%), стояния интравеноз-ного катетера у 6 больных (9,6%), нагноительных заболеваний кожи и подкожно-жировой клетчатки (фурункулез, абсцессы) у 7 больных (11,2%), стоматологических манипуляций (экстракция зуба, вскрытие каналов, ношение брекетов) у 12 больных (19,4%). У 31 (50%) пациента при самом тщательном сборе анамнеза и анализе амбулаторной карты пусковой фактор, провоцирующий бактериемию, не был выявлен. В то же время у подавляющего большинства заболевших (56 больных — 90,3%) был документирован хронический суб- или декомпенсиро-ванный тонзиллит, который у 8 пациентов (12,9%) сочетался с впервые выявленным хроническим гайморитом, у 9 (14,5%) в качестве сопутствующего заболевания фигурировал вторичный хронический пиелонефрит, у 3 (4,8%) был обнаружен описторхоз и сопровождающий его хронический холецистит с выделением из желчи Str. viridans.
У 31 (50%) пациента при самом тщательном сборе анамнеза и анализе амбулаторной карты пусковой фактор, провоцирующий бактериемию, не был выявлен. В то же время у подавляющего большинства заболевших (56 больных — 90,3%) был документирован хронический суб- или декомпенсиро-ванный тонзиллит, который у 8 пациентов (12,9%) сочетался с впервые выявленным хроническим гайморитом, у 9 (14,5%) в качестве сопутствующего заболевания фигурировал вторичный хронический пиелонефрит, у 3 (4,8%) был обнаружен описторхоз и сопровождающий его хронический холецистит с выделением из желчи Str. viridans.
Этиологию ПИЭ удалось документировать 3-кратными бактериологическими исследованиями гемокультуры при жизни только у 24 пациентов
(38,7%), причем, как правило, у больных с Ш и, существенно реже, со II степенью активности. Всего с учетом бактериологического исследования ауто-псийного материала этиология ПИЭ была выявлена у 29 (46,8%) пациентов. У больных «ПИЭ с установленным возбудителем» в подавляющем большинстве случаев развитие болезни было связано с грам-позитивной флорой: Str. viridans (38,2%), Str. haemoliticus (13,8%), Str. intermedius (6,9%), S. aureus (34,1%), S. epidermidis (3,4%), Citrobacter diversus (3,4%). У 5 погибших пациентов возбудителем ИЭ был S. aureus (80%) и Str. viridans (20%).
У больных «ПИЭ с установленным возбудителем» в подавляющем большинстве случаев развитие болезни было связано с грам-позитивной флорой: Str. viridans (38,2%), Str. haemoliticus (13,8%), Str. intermedius (6,9%), S. aureus (34,1%), S. epidermidis (3,4%), Citrobacter diversus (3,4%). У 5 погибших пациентов возбудителем ИЭ был S. aureus (80%) и Str. viridans (20%).
Клиническая картина при ПИЭ острого течения высокой степени активности складывалась из лихорадки, ознобов, профузных потов, снижения массы тела, головных болей, носовых кровотечений, резкой слабости, одышки, кашля, сердцебиений. При подостром течении отмечался длительный (в течение нескольких недель и даже месяцев) субфебрилитет с эпизодами познабливания, слабостью, снижением толерантности к физическим нагрузкам, похуданием. Жалобы на боли в сердце (колющего характера, без иррадиации) были весьма редкими и встречались только у 9 пациентов (14,5%) с ПИЭ, в то же время при более активном сборе анамнеза и выявлении жалоб чувство дискомфорта в грудной клетке и тяжесть в области сердца отмечали 31 пациент (50%). Большинство больных (54—87%) жаловались на головокружения и головные боли разной интенсивности. Бледность кожных покровов с сероватым колоритом и выраженным периорби-тальным цианозом присутствовала у 47 больных и была максимально выражена при подостром ПИЭ высокой степени активности, а при остром ПИЭ с III степенью активности присутствовали легкий желтушный колорит кожи и иктеричность склер. 36 больных (58%), как при остром, так и при по-достром ПИЭ, одинаково часто жаловались на боли в суставах и мышцах различной интенсивности, у 2 подростков отмечались весьма интенсивные боли в грудном и поясничном отделах позвоночника.
Большинство больных (54—87%) жаловались на головокружения и головные боли разной интенсивности. Бледность кожных покровов с сероватым колоритом и выраженным периорби-тальным цианозом присутствовала у 47 больных и была максимально выражена при подостром ПИЭ высокой степени активности, а при остром ПИЭ с III степенью активности присутствовали легкий желтушный колорит кожи и иктеричность склер. 36 больных (58%), как при остром, так и при по-достром ПИЭ, одинаково часто жаловались на боли в суставах и мышцах различной интенсивности, у 2 подростков отмечались весьма интенсивные боли в грудном и поясничном отделах позвоночника.
Поражение неизмененного до болезни клапанного и пристеночного эндокарда является основным признаком ПИЭ [10,11]. У подавляющего числа пациентов при остром ПИЭ с высокой степенью активности стертая, малоспецифичная клиническая картина, экстракардиальные поражения в виде гло-мерулонефрита, пневмонии приводили к поздней постановке диагноза, пациенты поступали в специализированное отделение уже с признаками клапанной недостаточности I или II степени. У 9 детей и подростков с ПИЭ вначале исключали лейкоз, системный васкулит, псевдотуберкулез. Как оказалось, при по-достром течении ПИЭ с низкой степенью активности формирование порока и появление аускультативной картины клапанной недостаточности может затягиваться до 4,5—6 месяцев, что весьма затрудняет дифференциацию ПИЭ с острой ревматической лихорадкой. В то же время при остром ИЭ, особенно при его
У 9 детей и подростков с ПИЭ вначале исключали лейкоз, системный васкулит, псевдотуберкулез. Как оказалось, при по-достром течении ПИЭ с низкой степенью активности формирование порока и появление аускультативной картины клапанной недостаточности может затягиваться до 4,5—6 месяцев, что весьма затрудняет дифференциацию ПИЭ с острой ревматической лихорадкой. В то же время при остром ИЭ, особенно при его
стафилококковой этиологии, клапанная недостаточность может формироваться очень быстро — в течение 1—3 недель. Сердечные шумы отсутствовали при поступлении в стационар у 58% больных, у 14,5% больных с изолированным поражением аортального клапана в начальной стадии выслушивался систолический шум над аортой и в V точке. В дальнейшем, по мере формирования порока в виде недостаточности аортального клапана, появлялись диастолический шум разной интенсивности и продолжительности, ослабление II тона над аортой и снижение показателей диастолического давления. Последний признак мы считаем важным и неоправданно забытым аускультативным феноменом несостоятельности аортального клапана: у 4 пациентов мы наблюдали диастолическое АД на уровне 15—30 мм рт.ст. При проведении трансторакальной и чреспи-щеводной ЭХОКГ выяснено, что особенностью современного ПИЭ у детей и подростков как при остром, так и при подостром течении болезни, является поликлапанность поражения эндокарда — вовлечение в воспалительный процесс нескольких клапанов с преимущественным поражением одного, и более частое, чем у взрослых [2], вовлечение в воспалительный процесс митрального клапана (табл. 1). Размеры вегетаций варьировали от 5,4±0,6 до 18,8±0,2 мм, что отчетливо корреливало с активностью болезни (г=0,83). Вегетации выглядели как «отдельные конгломераты», «пакеты», «флоттирующие по ходу кровотока округлые образования» (табл. 2).
Последний признак мы считаем важным и неоправданно забытым аускультативным феноменом несостоятельности аортального клапана: у 4 пациентов мы наблюдали диастолическое АД на уровне 15—30 мм рт.ст. При проведении трансторакальной и чреспи-щеводной ЭХОКГ выяснено, что особенностью современного ПИЭ у детей и подростков как при остром, так и при подостром течении болезни, является поликлапанность поражения эндокарда — вовлечение в воспалительный процесс нескольких клапанов с преимущественным поражением одного, и более частое, чем у взрослых [2], вовлечение в воспалительный процесс митрального клапана (табл. 1). Размеры вегетаций варьировали от 5,4±0,6 до 18,8±0,2 мм, что отчетливо корреливало с активностью болезни (г=0,83). Вегетации выглядели как «отдельные конгломераты», «пакеты», «флоттирующие по ходу кровотока округлые образования» (табл. 2).
Кроме типичных для ИЭ изменений на клапанах, признаки легочной гипертензии отмечались у 7 (11,2%) больных, надрыв хорд аортального клапана — у 6 (9,6%) больных, вегетации на эндокарде правого желудочка — у 5 (8%) больных, подклапан-
Таблица 1
Частота формирования недостаточности сердечных клапанов различной локализации в результате перенесенного ПИЭ
Локализация поражения Абс. число больных (n=50) Частота, %
число больных (n=50) Частота, %
Аортальный клапан 8 16
Митральный клапан 8 16
Аортальный и митральный клапаны 24 48
Митральный и трикуспи-дальный клапаны 2 4
Аортальный и трикуспи-дальный клапаны 1 2
Аортальный, митральный и трикуспидальный клапаны 4 8
Митральный клапан, клапан легочной артерии и трикуспидальный клапан 3 6
Таблица 2
Локализация вететаций у детей и подростков с первичным инфекционным эндокардитом в процессе его диагностики
ный абсцесс с локализацией последнего под аортальным клапаном — у 2 (3,2%) пациентов. Во всех случаях, когда проводилась одновременная трансторакальная и чреспищеводная ЭХОКГ отмечалась более высокая информативность последней, особенно в первые недели развития болезни. Именно этот метод позволяет не только зафиксировать факт поражения эндокарда, но и более точно определить размеры, плотность и подвижность вегетаций. В то же время только у 4 пациентов при остром течении ПИЭ вегетации, не обнаруженные на трансторакальной ЭХОКГ, были обнаружены при проведении чреспи-щеводного исследования, что подтверждает сохраняющуюся важность проведения трансторакальной ЭХОКГ для диагностики эндокардита.
Во всех случаях, когда проводилась одновременная трансторакальная и чреспищеводная ЭХОКГ отмечалась более высокая информативность последней, особенно в первые недели развития болезни. Именно этот метод позволяет не только зафиксировать факт поражения эндокарда, но и более точно определить размеры, плотность и подвижность вегетаций. В то же время только у 4 пациентов при остром течении ПИЭ вегетации, не обнаруженные на трансторакальной ЭХОКГ, были обнаружены при проведении чреспи-щеводного исследования, что подтверждает сохраняющуюся важность проведения трансторакальной ЭХОКГ для диагностики эндокардита.
Поражение миокарда при ИЭ, как известно, обусловлено дистрофией, ишемией, развивающейся вследствие токсических и тромбоэмболических изменений в сердечной мышце, у части больных могут наблюдаться воспалительные изменения непосредственно в сердечной мышце, реже (при особенно тяжелом течении ПИЭ) возможно формирование микроабсцессов в сердечной мышце [2]. У 23 пациентов с миокардитом (37% от всех пациентов с ПИЭ) пер-куторно, по данным рентгенографии и ЭХОКГ отмечались дилатация сердечных полостей, снижение глобальной сократительной способности миокарда до 43,1±3,8% (в норме 50—70%) и фракции укорочения до 23,1±2,1% (нормальные параметры 29—41%) при одновременном увеличении активности АЛТ, КФК, ЛДГ в среднем в 2,2 раза (табл. 3). У пациентов с миокардитом отмечались стойкая тахикардия, глухость сердечных тонов, самые разнообразные нарушения ритма и проводимости — блокады ножек пучка Гиса (64%), желудочковая экстрасистолия (у 39%), атриовентрикулярные бло-
У 23 пациентов с миокардитом (37% от всех пациентов с ПИЭ) пер-куторно, по данным рентгенографии и ЭХОКГ отмечались дилатация сердечных полостей, снижение глобальной сократительной способности миокарда до 43,1±3,8% (в норме 50—70%) и фракции укорочения до 23,1±2,1% (нормальные параметры 29—41%) при одновременном увеличении активности АЛТ, КФК, ЛДГ в среднем в 2,2 раза (табл. 3). У пациентов с миокардитом отмечались стойкая тахикардия, глухость сердечных тонов, самые разнообразные нарушения ритма и проводимости — блокады ножек пучка Гиса (64%), желудочковая экстрасистолия (у 39%), атриовентрикулярные бло-
кады I и II степени в 30% и 22 % случаев соответственно. Перикардит встречался существенно реже (только у 6,5% от всех обследованных с ПИЭ), при этом максимальное количество жидкости в перикарде по данным ЭХОКГ не превышало 40 мл и только у 3 пациентов (4,8%) требовалось ее удаление, пе-рикадит во всех случаях можно было квалифицировать как серозно-гнойный.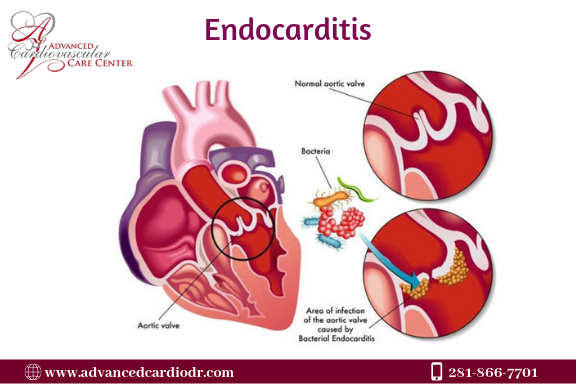 На аутопсии гнойный перикардит был обнаружен у всех 5 погибших, объем жидкости в перикарде при этом колебался от 65 до 120 мл.
На аутопсии гнойный перикардит был обнаружен у всех 5 погибших, объем жидкости в перикарде при этом колебался от 65 до 120 мл.
Сердечная недостаточность (СН) считается серьезным осложнением ИЭ и ее прогрессирование является веским аргументом в пользу хирургического лечения ИЭ [4, 9], признаки СН при поражении левых камер сердца выявляются гораздо раньше, чем при ИЭ с преимущественным поражением правых отделов сердца. Последняя особенность в большей степени характерна для ПИЭ наркоманов [8]. Согласно последним рекомендациям пользоваться при определении степени СН по классификации Н.А. Белоконь, предложенной в 1979 г., признаки СН I степени имели 70% пациентов, II А и II Б левожелудочковой — 17% и 8 % соответственно, III — 5%.
Тромбоэмболические/тромбогеморрагические (ТЭ/ТГ) осложнения и проявления ПИЭ при жизни диагностируются у 22—60% пациентов и у 90— 100% умерших [2, 3]. По нашим данным, при жизни ТЭ/ТГ встречаются у 65% пациентов при жизни, на аутопсии выявляются у 100% умерших [13]. Во всех случаях именно ТЭ/ТГ синдром в виде мозговых катастроф являлся непосредственной причиной смерти у детей и подростков, что согласуется с мнением терапевтов-специалистов по ИЭ [2, 4]. Более детальная информация о ТЭ/ТГ синдроме при ИЭ была недавно предметом нашего подробного описания [13], причем нами обращалось внимание на то, что число, выраженность и тяжесть ТЭ/ТГ тесно коррелировали со степенью активности болезни, их развитие было зафиксировано на 2—3-й неделе от начала антибактериальной терапии. Расположение вегетаций на передней створке митрального клапана ассоциировано с самыми тяжелыми и фатальными ТЭ/ТГ осложнениями болезни, в то же время локализация тромботических масс на правой коронарной створке аортального клапана сопровождается обилием тромбоэмболий, но риск серьезных, представляющих угрозу жизни ТЭ/ТГ осложнений, все же ниже, чем у больных с вегетациями, расположенными на митральном клапане. При размерах вегетаций 11,5 мм и более, по нашим данным, возможно ожидать развитие тяжелых, иногда фатальных осложнений ИЭ [9, 13].
Во всех случаях именно ТЭ/ТГ синдром в виде мозговых катастроф являлся непосредственной причиной смерти у детей и подростков, что согласуется с мнением терапевтов-специалистов по ИЭ [2, 4]. Более детальная информация о ТЭ/ТГ синдроме при ИЭ была недавно предметом нашего подробного описания [13], причем нами обращалось внимание на то, что число, выраженность и тяжесть ТЭ/ТГ тесно коррелировали со степенью активности болезни, их развитие было зафиксировано на 2—3-й неделе от начала антибактериальной терапии. Расположение вегетаций на передней створке митрального клапана ассоциировано с самыми тяжелыми и фатальными ТЭ/ТГ осложнениями болезни, в то же время локализация тромботических масс на правой коронарной створке аортального клапана сопровождается обилием тромбоэмболий, но риск серьезных, представляющих угрозу жизни ТЭ/ТГ осложнений, все же ниже, чем у больных с вегетациями, расположенными на митральном клапане. При размерах вегетаций 11,5 мм и более, по нашим данным, возможно ожидать развитие тяжелых, иногда фатальных осложнений ИЭ [9, 13]. Стафилококковая этиология ИЭ является самой неблагоприятной и опасной как в плане общего прогноза, так и риска фатальных ТЭ/ТГ осложнений.
Стафилококковая этиология ИЭ является самой неблагоприятной и опасной как в плане общего прогноза, так и риска фатальных ТЭ/ТГ осложнений.
Экстракардиальные поражения при ПИЭ. ТЭ/ТГ проявления ИЭ вносят свою лепту в поражение внутренних органов и мозга при ИЭ, кроме того, длитель-
Локализация вегетаций Абс. число больных (п=61) Частота, %
Аортальный клапан 9 14,4
Митральный клапан 10 16,1
Аортальный и митральный клапаны 29 46,4
Митральный и трикуспи-дальный клапаны 2 3,2
Аортальный и трикуспи-дальный клапаны 1 1,6
Аортальный, митральный и трикуспидальный клапаны 6 9,6
Митральный клапан, клапан легочной артерии и трикуспидальный клапан 5 8
Таблица 3
Некоторые лабораторные показатели у пациентов с первичным инфекционным эндокардитом различной степени активности до начала
антибактериальной терапии
Показатели Контрольная группа Степень активности ПИЭ
I II III
Число обследованных 27 39 28 16
Эритроциты, -1012 /л 4,7±0,5 3,9±0,41 3,8±0,4 3,6±0,3*
Гемоглобин, г/л 136,6±2,1 119,1±1,2 104,6±1,3* 106,6±1,7*
Лейкоциты, -109 /л 6,8±0,7 11,2±0,7 13,9±1,5 17,1±0,8*
Тромбоциты, -109 /л 226,8±6,9 226,4±14,2 180,4±11,2* 168,1±4,2*
СОЭ, мм/ч 6,2±1,2 26,9±1,1 32,4±3,2 46,7±1,9*
АЛТ, мкм/л 0,58±0,04 0,52±0,03 0,78±0,05 1,2±0,04*
АСТ, мкм/л 0,36±0,03 0,65±0,02 0,98±0,06 1,4±0,02*
Билирубин, мкмоль/л: общий прямой непрямой 9,8±1,1 2,3±0,6 7,5±0,4 11,2±2,0 2,9±0,4 8,9±0,7 18,2±1,4 6,2±0,6 11,9±0,8 28,1±2,4 8,4±0,7 19,2±1,2
КФК, МЕ/л 85,8±14,8 88,2±11,2 121,3±7,6 148,3±11,4*
ЛДГ, МЕ/л 178,8±22,3 176,4±10,1 202,3±6,2 241,4±6,2*
Мочевина, ммоль/л 5,4±0,5 5,6±0,4 8,9±0,6 11,9±0,4*
Креатинин, мг/дл 0,68±0,03 0,8±0,1* 0,73±0,1* 0,93±0,1*
* p<0,05 при сравнении показателей с контрольной группой.
ная бактериемия приводит к формированию имму-ноопосредованного их поражения.
Проявления ТГ/ТЭ на коже и слизистых оболочках встречаются реже, чем у взрослых и еще реже, чем в группе наркоманов [8]. Так, пятна Рота, узелки Ослера, пятна Джейнуэя мы не встречали, пятна Либ-мена—Лукина были обнаружены только у 15% пациентов. В то же время вышеперечисленные феномены сохраняют диагностическую значимость в силу своей высокой специфичности и по праву входят в состав малых диагностических критериев ИЭ [1, 2, 10] .
Артриты (преимущественно крупных суставов) с незначительным количеством выпота наблюдали у 40% больных с подострым течением ПИЭ. Именно артриты в сочетании с миалгиями, слабостью и феб-рилитетом были причиной госпитализации больных в стационар.
Вовлечение в патологический процесс почек в виде инфаркта почки, гломерулонефрита, тубулоин-терстициального нефрита отмечалось у каждого третьего пациента с ПИЭ. Ведущим синдромом у всех пациентов была гематурия, при гломерулонефри-те максимальный уровень протеинурии достигал 1,2±0,15 г/л, признаки острой почечной недостаточности (ОПН) встречались при ПИЭ крайне редко — у одного пациента с инфарктом почки при остром течении ИЭ с III степенью активности и еще у одного больного с гломерулонефритом. В после-
Ведущим синдромом у всех пациентов была гематурия, при гломерулонефри-те максимальный уровень протеинурии достигал 1,2±0,15 г/л, признаки острой почечной недостаточности (ОПН) встречались при ПИЭ крайне редко — у одного пациента с инфарктом почки при остром течении ИЭ с III степенью активности и еще у одного больного с гломерулонефритом. В после-
днем случае ПИЭ протекал подостро, отмечалась его активность II степени, диагностика болезни была крайне поздней (на момент диагностики были частично разрушены аортальный и митральный клапаны). У пациентов с ОПН максимальный уровень креатинина и мочевины не превышали 0,148 мг/дл и 15,2 ммоль/л соответственно. Нормализация параметров азотистого обмена наступала через 10—12 дней под влиянием эффективной антибактериальной терапии.
У 11 больных ПИЭ был обнаружен пиелонефрит, весьма часто этот процесс протекал на фоне пузыр-но-мочеточникового рефлюкса II степени или дистопии одной из почек (8 пациентов).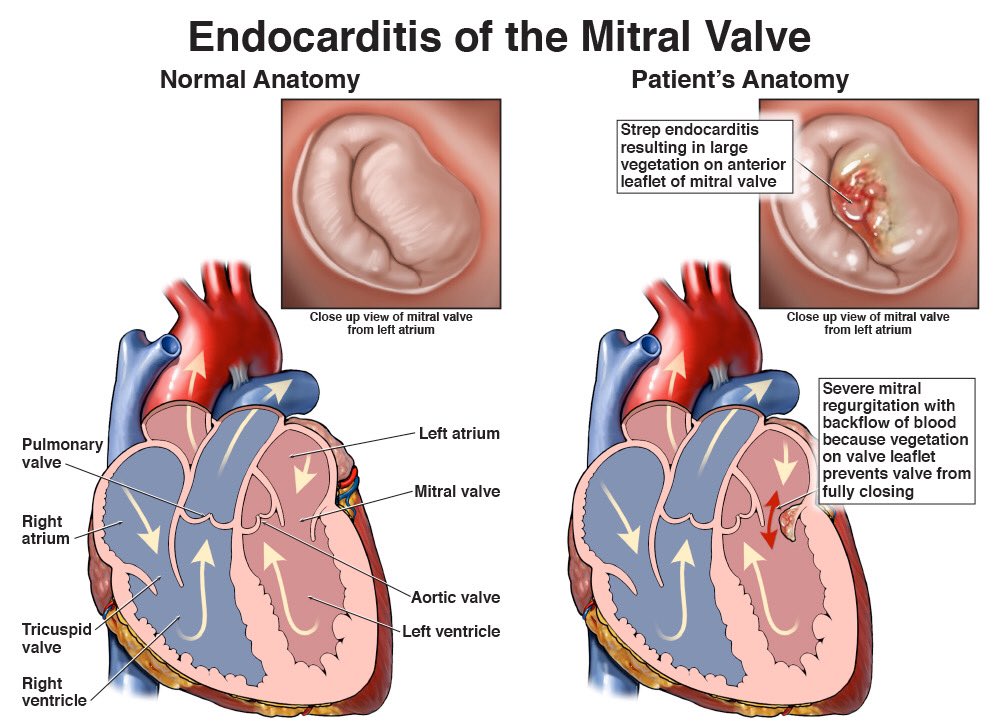 Мы расценили клиническую ситуацию у этих 8 детей и подростков как «обострение вторичного хронического пиелонефрита», выраженность лейкоцитурии (оцениваямая в пробе Нечипоренко) была невысокой (26 400± ±1054 кл/мл). У остальных 3 пациентов пиелонефрит «присоединился» к ПИЭ в период летальных мозговых тромбоэмболических осложнений, на стадии полиорганной недостаточности и был подтвержден результатами аутопсии. Возбудителями воспалительного процесса у 2 умерших был S. aureus (то же, что и самого ПИЭ). У одного погибшего пациента (очевидно, из-за длительной катетеризации мочевых путей) возбудителем пиелонефрита был госпитальный штамм Ps. aeruginosa.
Мы расценили клиническую ситуацию у этих 8 детей и подростков как «обострение вторичного хронического пиелонефрита», выраженность лейкоцитурии (оцениваямая в пробе Нечипоренко) была невысокой (26 400± ±1054 кл/мл). У остальных 3 пациентов пиелонефрит «присоединился» к ПИЭ в период летальных мозговых тромбоэмболических осложнений, на стадии полиорганной недостаточности и был подтвержден результатами аутопсии. Возбудителями воспалительного процесса у 2 умерших был S. aureus (то же, что и самого ПИЭ). У одного погибшего пациента (очевидно, из-за длительной катетеризации мочевых путей) возбудителем пиелонефрита был госпитальный штамм Ps. aeruginosa.
Гепатит был документирован у каждого третьего пациента с ПИЭ, независимо от характера течения и активности эндокардита. В отличие от ПИЭ у инъекционнных наркоманов [8], у которых в 90% случаев природа гепатита (гепатит В, гепатит В+С) была вирусной, у пациентов с ПИЭ, у которых фактор наркомании был исключен, ни в одном случае не были обнаружены маркеры гепатитов В и С.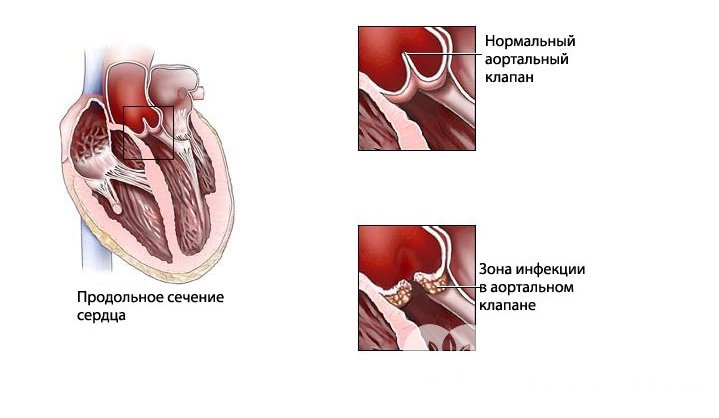 В то же время увеличение печени, болезненность ее края, повышение активности аминотрансфераз (табл. 3), гипербилирубинемия (максимальный уровень общего билирубина 28,6 мкмоль/л) позволили нам расценить эту ситуацию как «токсический» гепатит, что согласуется с точкой зрения терапевтов, занимающихся проблемами ИЭ [2].
В то же время увеличение печени, болезненность ее края, повышение активности аминотрансфераз (табл. 3), гипербилирубинемия (максимальный уровень общего билирубина 28,6 мкмоль/л) позволили нам расценить эту ситуацию как «токсический» гепатит, что согласуется с точкой зрения терапевтов, занимающихся проблемами ИЭ [2].
Как уже упоминалось, поражение ЦНС — основная причина смерти пациентов с ИЭ. Жалобы на головные боли, преходящие явления нарушений мозгового кровообращения при жизни сопровождали ПИЭ у наших пациентов в большинстве (75%) случаев. Явления острого нарушения мозгового кровообращения (ОНМК) в системе средней мозговой артерии, геморрагические инсульты с очаговой симптоматикой различной степени выраженности как проявления ТЭ/ТГ синдрома наблюдались у 25% пациентов, как правило, при высокой активности ИЭ и его стафилококковой этиологии. Результаты аутоп-сийных исследований свидетельствуют о том, насколько серьезно и многогранно страдание ЦНС при ПИЭ: помимо субарахноидальных и субдуральных кровоизлияний с очагами нагноения, выявлялось диффузное поражение сосудов — на фоне их полнокровия были выявлены явления пролиферативного и деструктивного васкулита, инфильтрация стенок сосудов лимфоцитами и нейтрофилами.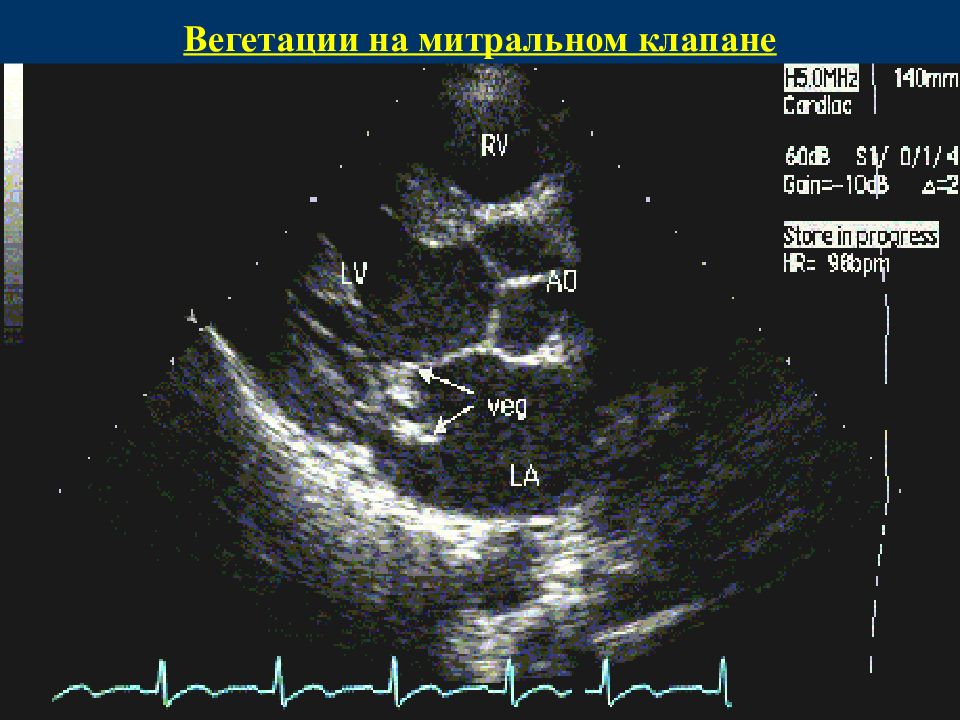
Спленомегалия, как характерный для ИЭ синдром у взрослых [2], у наших детей и подростков, больных ПИЭ, выявлялся только в 15% случаев (у 9 больных), причем исключительно у пациентов с острым течением ПИЭ высокой степени ( II—III) активности.
Основные параметры лабораторной активности ПИЭ у детей и подростков весьма сходны с таковыми у взрослых [1, 2]. Картина периферической крови у наблюдаемых нами пациентов характеризовалась нейтрофильным лейкоцитозом, ускорением СОЭ, реже тромбоцитопенией. Выраженность указанных изменений отчетливо коррелировала с активностью процесса. У 6 больных ПИЭ можно было говорить о наличии лейкемоидной реакции нейтро-фильного типа: количество лейкоцитов у них превышало 31,6±1,02-109/л, нейтрофилов — 78,6±2,8%, у 3 пациентов СОЭ превышала 75 мм/ч. Обычно у больных со II—III степенью активности ПИЭ уровень СРБ, ЛДГ были существенно повышены (табл. 3).
Маркеры иммунопатологической фазы воспаления при ПИЭ. В отличие от взрослых, при подо-стром течении ИЭ у которых маркеры иммунопатологической фазы воспаления выражены существенно
В отличие от взрослых, при подо-стром течении ИЭ у которых маркеры иммунопатологической фазы воспаления выражены существенно
[2], криоглобулины и антитела к кардиолипинам у обследованных нами больных не определялись. Повышение уровня циркулирующих иммунных комплексов до 240,8±11,2 у.е. определено лишь у 15% пациентов, ревматоидный фактор — у 2% больных, гипергаммаглобулинемия — в 18% случаев.
Терапия ПИЭ проводилась в соответствии с существующими рекомендациями [1, 2, 4], в ходе лечения ПИЭ использовали антибиотики с бактерицидным действием против потенциальных и установленных возбудителей сроком 6—8 недель. Как оказалось, именно такая длительная и массивная антибактериальная терапия может обеспечить стерилизацию бактериальных вегетаций [4,5]. Внедрение в терапию «ПИЭ с неустановленным возбудителем» комбинации цефтриаксона с гентамицином, и в терапию ИЭ, обусловленного 5. viridans, ЕМегоеоеа, ванкомицина с гентамицином, следование постулатам лечения ИЭ, внедренных во взрослых клиниках [1, 2], привело к заметным положительным результатам.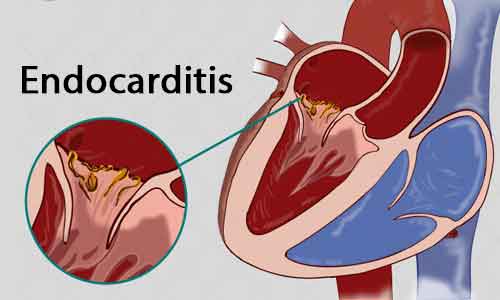 Формирование тяжелой (II—III степени) клапанной недостаточности снизилось в 3,2 раза. Улучшение (купирование лихорадки, улучшение самочувствия) наступало на 7—10-е сутки у 75% больных, у остальных — требовалась смена антибактериальной терапии, в 10% она оказалась неэффективной.
Формирование тяжелой (II—III степени) клапанной недостаточности снизилось в 3,2 раза. Улучшение (купирование лихорадки, улучшение самочувствия) наступало на 7—10-е сутки у 75% больных, у остальных — требовалась смена антибактериальной терапии, в 10% она оказалась неэффективной.
Исходы ПИЭ. Общая и госпитальная летальность при ПИЭ составила 10%, во всех случаях она была обусловлена тромбоэмболическими осложнениями — разрывом микотических аневризм сосудов мозга с развитием массивных субдуральных и суб-арахноидальных кровоизлияний. Выздоровление зафиксировано у 90%. Пороки сердца в виде недостаточности клапанов в различных комбинациях, несмотря на направленную антибактериальную терапию, сформировались в 80% случаев (табл. 1). У подавляющего числа пациентов (65%) с клапанной недостаточностью она проявляла себя регурги-тацией I степени, I—II степени — у 25%, у 20% (в основном это были пациенты со стафилококковой этиологией болезни и высокой активностью ИЭ) сформировалась недостаточность II—III степени. 4 пациентам спустя 1 —1,5 года после диагностики ИЭ и выздоровления потребовалось протезирование аортального клапана. Следует отметить, что только в одном случае (1,6%) была выполнена операция у больного с активным ИЭ.
4 пациентам спустя 1 —1,5 года после диагностики ИЭ и выздоровления потребовалось протезирование аортального клапана. Следует отметить, что только в одном случае (1,6%) была выполнена операция у больного с активным ИЭ.
Таким образом, ПИЭ остается редким, но весьма опасным заболеванием с высокими показателями инвалидизации и летальности. Особенностями ПИЭ у детей и подростков является мультиклапан-ное поражение с более частым, чем у взрослых, поражением митрального клапана. Особенностью ПИЭ, в отличие от острой ревматической лихорадки, является быстрое (иногда в течение 1—3 недель от начала лихорадки) формирование клапанных пороков, возможность трансформации остро протекающего ПИЭ в подострый, слабая (в срав-
нении со взрослыми) выраженность лабораторных маркеров иммунопатологической фазы воспаления. Основной причиной летальности при ПИЭ являются тромбоэмболические мозговые катастрофы. Уровень оперативной активности (инвазив-
Уровень оперативной активности (инвазив-
ного хирургического лечения ПИЭ в период активности болезни) при оказании медицинской помощи больным ПИЭ остается чрезвычайно низким в сопоставлении с таковой в клиниках США и Европы [4].
ЛИТЕРАТУРА
См. online-версию журнала http://www.pediatriajournal.ru № 2/2006, приложение № 2.
© Коллектив авторов, 2005
Ю.В. Шматкова, Т.В. Бершова, Е.Н. Басаргина, М.И. Баканов
ОСОБЕННОСТИ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА КЛЕТКИ И ЦИТОКИНОВОГО СТАТУСА У ДЕТЕЙ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
ГУ Научный Центр здоровья детей РАМН, Москва
В работе представлены результаты комплексного клинико-лабораторного обследования 22 пациентов в возрасте от 4 до 16 лет с хронической сердечной недостаточностью. Проведено клини-ко-биохимическое сравнительное исследование влияния комплексной терапии на тяжесть состояния, течение хронической сердечной недостаточности и прогноз, а также содержания цитокинов, молочной кислоты и активности креатинфосфокиназы и креатинфосфокиназы МВ. Обсуждаются клеточно-молекулярные механизмы участия цитокинов в процессе формирования и развития сердечной недостаточности у детей.
Проведено клини-ко-биохимическое сравнительное исследование влияния комплексной терапии на тяжесть состояния, течение хронической сердечной недостаточности и прогноз, а также содержания цитокинов, молочной кислоты и активности креатинфосфокиназы и креатинфосфокиназы МВ. Обсуждаются клеточно-молекулярные механизмы участия цитокинов в процессе формирования и развития сердечной недостаточности у детей.
Article presents the results of complex clinical and laboratory examination of 22 patients aged 4—16 years old with chronic heart failure. Authors performed clinical and biochemical comparative study, estimating influence of complex treatment upon severity of clinical state, on currency of chronic heart failure and on prognosis, and also investigated level of cytokines, of lactic acid and activity of creatine phosphokinase and creatine phosphokinase MB. Authors discuss molecular mechanisms of cytokines participation in forming and development of chronic heart failure.
Исходя из механизмов развития сердечной недостаточности (СН), можно полагать, что активация системы цитокинов играет существенную роль в возникновении и формировании хронической сердечной недостаточности (ХСН) [1, 2] (см. рисунок). Считается доказанным участие фактора некроза опухоли а (ФНОа) и интерлейкина 6 (ИЛ6) в прогрессирующем ослаблении сократительной функции сердечной мышцы, их способности индуцировать гипертрофию миокарда, оказывать отрицательное инотропное действие, вызывая ремоделирование левого желудочка [3] .
В настоящее время продолжается активный поиск лекарственных средств и методов лечения ХСН, обладающих принципиально новыми терапевтическими свойствами и действующих на различные механизмы патогенеза этого синдрома. Если раньше основным арсеналом в лечении этого грозного состояния были сердечные гликозиды (СГ) и диуретики, то сегодня одно из видных мест отводится ингибиторам ангиотензинпревращающего фермента (ИАПФ), Р-адреноблокаторам и антагонистам альдостерона.
Практика лечения пациентов с ХСН показывает, что комплексная терапия вместо ожидаемого полного снижения риска смерти снижает его лишь на треть [4]. Это подтверждает то, что, наряду с ренин-ангио-тензин-альдостероновой, симпатико-адреналовой системами и эндотелиальной дисфункцией, существенную роль в патогенезе ХСН играют провоспа-лительные цитокины.
Молекулярные механизмы, лежащие в основе ци-токин-индуцируемого нарушения сократительной способности миокарда и развития ремоделирования сердца, многофункциональны и изучены недостаточно. В связи с этим, данные об участии цитокинов в развитии ХСН, могут иметь важное практическое значение для разработки новых подходов к лечению этой патологии и выяснению механизмов действия применяемых препаратов.
Цель работы: изучить динамику содержания ФНОа, ИЛ6 и показателей энергетического обмена клетки в сыворотке крови у детей с ХСН на фоне комплексной терапии.
1. Демин А.А., Скопин И.И., Соболева М.К. и др. // Клин. мед. — 2003. — № 6. — C. 68 —71.
2. Тюрин В.П. Инфекционные эндокардиты. — М., 2002. — 224 с.
3. Cabell C.H., Jollis J.G., Peterson G.E. // Arch. Intern. Med. — 2002. — Vol. 162, № 1. — P. 90 —94.
4. Ferrieri P., Gewitz M.H., Gerber M.A. // Circulation. — 2002. — Vol. 105, № 24. — P. 2115 —2126.
5. Hoen B., Alla F., Selton — Suty C. et al. // JAMA. — 2002. — Vol. 228, № 1. — P. 75 — 81.
6. William C.R. // ACC Scientific Session 2000. — Vol. 15. —Р. 39 —71.
7. Asperberro F., Begnette M., Oberhansli I. et al. // Eur. J. Pediatr. — 1999. — Vol. 158, № 1. —
158, № 1. —
P. 275—280.
8. Соболева М.К., Соболева Е.Г., Веселова Е.А., Скоблякова М.Е. // Педиатрия. — 2003. — № 6.
— C. 43—51.
9. Соболева М.К. // Кардиология и ревматология детского возраста. Практическое руководство по детским болезням. — М., 2004. — Т. 3. — С. 264 —278.
10. Durack D.T., Lukes A.S., Bright D.K. // Am. J. Med. — 1994. — Vol. 96, № 3. — P. 200—209.
11. Li J.S., Sexton D.J., Mick N. et al. // Clin. Infect. Dis. — 2000. — Vol. 30, № 4. — P. 633—638.
12. Bitar F.F., Jawdi R.A., Dbaibo G.S. et al. // Acta Pediatr. — 2000. — Vol. 89, № 4. — P. 427—430.
13. Соболева Е.Г., Чупрова А.В., Соболева М.К. // Педиатрия. — 2004. — № 2. — C. 24—30.
Соболева Е.Г., Чупрова А.В., Соболева М.К. // Педиатрия. — 2004. — № 2. — C. 24—30.
Профилактика инфекционного эндокардита
Инфекционный эндокардит (ИЭ) является значимым фактором риска высокой заболеваемости и смертности, поэтому до проведения медицинских процедур и манипуляций необходимо рассмотрение вопроса о проведении антибактериальной профилактики данной патологии.
Американский колледж кардиологии (American College of Cardiology — ACC) и Американская кардиологическая ассоциация (American Heart Association — AHA) выпустили обновленную версию рекомендаций по профилактике инфекционного эндокардита у пациентов с клапанными пороками сердца.
Пациенты группы высокого риска в отношении развития инфекционного эндокардита определяются как лица, имеющие сопутствующую сердечную патологию, связанную с наибольшим риском развития неблагоприятного исхода ИЭ. К ним относятся:
1. Пациенты с протезами клапанов, а также пациенты после пластики клапанов с использованием любых протезных материалов.
2. Пациенты, перенесшие инфекционный эндокардит (ИЭ)
3. Пациенты с врожденными пороками сердца:
а. Цианотические врожденные пороки сердца без хирургической
коррекции или с остаточными дефектами, паллиативными шунтами,
кондуитами.
b. Врожденные пороки сердца после полной коррекции (хирургической
либо эндоваскулярной) с использованием протезных материалов в
течение 6 месяцев после коррекции
с. Наличие остаточных дефектов в области протезных материалов или
устройств, имплатированных хирургически либо эндоваскулярно.
АНТИБИОТИКОПРОФИЛАКТИКА НЕ РЕКОМЕНДУЕТСЯ
При проведении местной анестезии на неинфицированных тканях, снятии швов, рентгенографии зуба, установке скобок и брекетов, при выпадении молочных зубов или травме губ и слизистой рта.
При бронхоскопии, ларингоскопии, трансназальной или эндотрахеальной интубации, при гастроскопии, колоноскопии, цистоскопии или трансэзофагеальной эхокардиографии.
При проведении любого вмешательства на коже и мягких тканях.
ВНИМАНИЕ При этих и во всех остальных ситуациях — антибиотик назначается, если этого требует собственно заболевание или процедура (операция), но при этом учитывается активность антибиотика против возможных возбудителей ИЭ у лиц с высоким риском его развития
АНТИБИОТИКОПРОФИЛАКТИКА НАЗНАЧАЕТСЯ ПАЦИЕНТАМ С ВЫСОКИМ РИСКОМ ЭНДОКАРДИТА ПРИ СЛЕДУЩИХ ВМЕШАТЕЛЬСТВАХ
А. Стоматологические процедуры:
Антибиотическая профилактика может обсуждаться только для стоматологических процедур, требующих манипуляций на деснах или периапикальной области зубов или перфорации слизистой оболочки рта.
Антибиотикопрофилактика потребуется, если вам предстоит какая-либо из следующих процедур:
— разрез слизистой полости рта
— удаление зуба
— лечение корневых каналов
— инъекция в связку зуба (интралигаментарная анестезия)
— удаление зубных отложений
— операция на пародонте
— любая другая манипуляция, при которой травмируется зубодесневое соединение
Рекомендуемая профилактика при риске стоматологической процедуры
- I.
 Нет аллергии к пенициллину или ампициллину
Нет аллергии к пенициллину или ампициллину
Амоксициллин или ампициллин*
Единственная доза за 30-60 минут до процедуры
Взрослые
2 г перорально или в/в
Дети
50 мг/кг перорально или в/в - II. Аллергия к пенициллину или ампициллину
Клиндамицин
Единственная доза за 30-60 минут до процедуры
Взрослые
600 мг перорально или в/в
Дети
20 мг/кг перорально или в/в
Цефалоспорины не должны использоваться у пациентов с анафилаксией, ангионевротическим отеком или крапивницей после приема пенициллина или ампициллина.
*Альтернативно цефалексин 2 г в/в или 50 мг/кг в/в для детей, цефазолин или цефтриаксон 1 г в/в для взрослых или 50 мг/кг в/в для детей.
В.. Манипуляции на дыхательных путях.
При проведении инвазивных вмешательств на респираторном тракте для лечения установленной инфекции (например, дренирование абсцесса) пациентам из группы высокого риска ИЭ, в схему антибиотикотерапии должны быть включены пенициллины или цефалоспорины, активные в отношении стафилококков.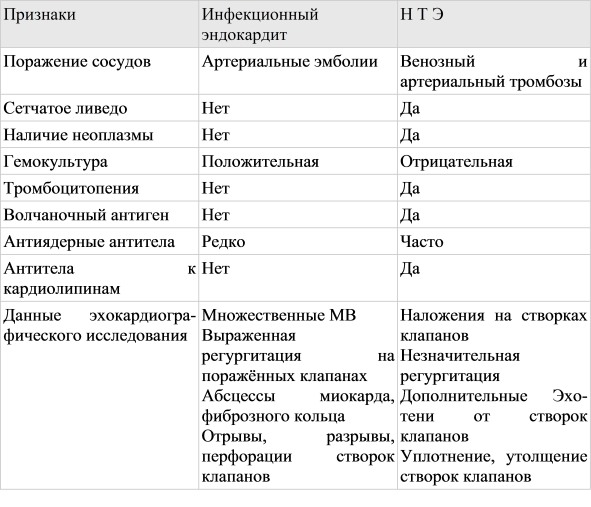 При непереносимости последних назначается ванкомицин. Если доказано либо предполагается, что инфекция вызвана метициллин-резистентным штаммом золотистого стафилококка, то назначается ванкомицин или иной антибиотик, активный в отношении МРЗС (MRSA).
При непереносимости последних назначается ванкомицин. Если доказано либо предполагается, что инфекция вызвана метициллин-резистентным штаммом золотистого стафилококка, то назначается ванкомицин или иной антибиотик, активный в отношении МРЗС (MRSA).
Бактериальный эндокардит — медицинский центр «ВАШ ДОКТОР» Шахты
Это заболевание сердца, когда начинается воспалительный процесс во внутренней оболочке сердца. Вызывают эти процессы микроорганизмы, в большинстве случаев это стрептококк. Это заболевание может проявляться у людей любого возраста, поэтому он возможен и у детей, но стоит заметить, что у мужчин чаще проявляется это заболевание, чем у женщин.
Факторы, которые могут располагать проникновение в организм стрептококка, реже кишечной палочки, является врожденный порок сердца у детей, либо поражение сердечных клапанов. Сопутствующие этому заболеванию может быть коарктация аорты, или заболевания межжелудочной перегородки.
Симптомы
Люди сначала могут и не знать про это заболевание, потому что поначалу оно может идти бессимптомно. Так бывает у людей со сниженным иммунитетом, или у пожилых людей. Но в основном у человека повышается температура, не хочется кушать, в результате чего снижается вес человека. Протекание болезни зависит еще от формы заболевания, при острой форме у человека начинается озноб, лихорадка, подкожные кровоизлияния, сердечная недостаточность. Если бактериальный эндокардит протекает в обычной форме, тогда он проявляется повышением потливости, ногтевые пластины начинают расслаиваться, в организме начинается мышечная боль и человек быстро теряет вес. Также при обследовании можно заметить увеличение печени и селезенки.
Осложнения
Бактериальный эндокардит является очень серьезной болезнью, и если не начать вовремя лечение, он приводит к необратимым реакциям. При игнорировании болезни бактериальные клетки начинают скапливаться в организме, и образуют коросты. Именно эти образования и приводят к осложнениям, коросты имеют свойства отрываться и перебрасываться в другие органы. В результате возникает сердечная или почечная недостаточность, инсульт, также могут нарушаться клапаны в сердце, и быть плохое кровообращение в мозге.
Диагностика
Как говорилось ранее, это заболевание относиться к тяжелым, поэтому, как только человек заметил первые его симптомы, нужно срочно обращаться к врачу. В больнице человеку назначат большое количество анализов, а перед этим врач осматривает пациента и изучает историю его болезни, чтобы установить предполагающие факторы болезни.
Инфекционный эндокардит у детей с врожденными пороками сердца (клинико-эхокардиографические иморфологические сопоставления)
Г: Т
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
российской федерации
МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ имени И. М. СЕЧЕНОВА
На правах рукописи
УДК: 616.125.216:616-0532
АЛЕКСЕЕВА Ольга Петровна
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ У ДЕТЕЙ С ВРОЖДЕННЫМИ ПОРОКАМИ СЕРДЦА (клинико-эхокардиографические и морфологические сопоставления)
14.Иаппа, 1985). В силу этого
обстоятельства диагноз инфекционного эндокардита устанавливается на поздних этапах его развития, что является одной из причин неблагоприятного течения и исхода.
В настоящее время в клинической практике широко применяются ультразвуковые методы диагностики инфекционного эндокардита. Несмотря на имеющиеся данные о высокой информативности эхокардиографии при инфекционном эндокардите (Г.И.Сторожаковидр., 1985;В.М.Деля-гинидр., 1938; ТЛеуа, 1988) сведения касающиеся ранней эхо-диагностики заболевания, эволюции выявленных вегетации и прогностического значения метода противоречивы.
Требуют дальнейшего изучения механизмы развития сердечной недостаточности при инфекционном эндокардите , которая является одной из основных причин летального исхода.
В педиатрической практике комплексные работы по исследованию сердечно-сосудистой системы с применением современных инструментальных методов, патоморфологии с учетом форм и особенностей течения инфекционного эндо-кгрдита единичны и носят фрагментарный характер.
Перечисленные обстоятельства послужили основанием для проведения настоящего исследования.
ТТель ттсслеттпвпниуг. Изучить клинико-диагностические критерии инфекционного эндокардита (ИЭ) при врожденных пороках сердца на основании клинико-эхокардиогра-фи ;еских и морфологических сопоставлений и провести •дифференциальную диагностику с первичным ИЭ.
Згптячи Т1Г гттрпгтя гтня:
1. Изучить клинические проявления ИЭ с учетом современного течения и формы: заболевания.
2. Определить эхокардиографические изменения внут-рисердечных структур и гемодинамики при ИЭ у детей с врожденными пороками сердца.
3. Провести сравнительную оценку выявленных клини-ко-эхокардиографичееких и морфологических изменений у больных с врожденными пороками сердца и контрольной группы детей с первичным ИЭ.
Нпучнпянпвизна, В настоящей работе на основании комплексного (клинико-эхокардиографического и морфологического) исследования оценено состояние сердечно-сосудистой системы у детей, страдающих инфекционным эндокардитом на фоне ВПС. Новизна данного исследования заключается в том, что в группу больных с ВПС входят дети, у которых инфекционный эндокардит развился до операции и после проведенных коррегирующих операций, что позволяет выявить особенности его течения. Установлены по данным эхокардиографии характер поражения внутрисердечных структур у больных при ВПС и у больны.:, перенесших коррегирующие операции!
Впервые у детей описаны результаты длительного наблюдения (на протяжении 4 лет) за выявленными при эхо-кардиографическом исследовании вегетациямк на клапанах сердца при ИЭ.
Выявлена высокая корреляция между данными эхокардиографии «л морфологическими исследованиями.
По морфологическим исследованиям установлена частота поражения миокарда и перикарда при ИЭ у детей. Оценено влияние миокардита на исход заболевания.
Практическая ттенногтъ. Описаны клинические особенности современного течения инфекционного эндокардита у детей с ВПС, имеющие диагностическое значение.
Дифференцированные эхокардиографические признаки поражения внутрисердечных структур при различных формах ИЭ у детей могут использоваться для диагностики заболевания.
Знание особенностей современного течения ИЭ у дет* ей, применение ультразвуковых методов исследования сердца
позволяют уменьшить сроки от начала заболевания до установления диагноза эндокардита и достигнуть лучших результатов при своевременно начатой комплексной терапии.
Основные положения-, вьтносимьтс ня зптттиту
1. Кльяическгте проявления ИЭ у детей находятся в за. висимости от формы заболевания. 2. Эхокардиографиче-ское исследование позволяет значительно сократить сроки установления диагноза ИЭ от его начала. 3. Частота поражения миокарда при вторичном ИЭ у детей с врожденными пороками сердца, выявляемая при морфологическом исследовании, выше регистрируемой клинически.
Аттробапист работы. Основные положения работы доложены на научно-практической конференции «Неревматические поражения сердца у детей» в Детской клинической больнице N 1 (Москва, 1Р88 г.) , на научно-практической конференции в поликлинике N 121 Гагаринского района (Москва, 1989 г.) , на заседании кардиологической секции (Москва, 1990 г.). Фрагмент работы был представлен в форме стендового доклада на XIX Международном съезде детских врачей (Париж, 1989 г.).
Пуб щткяттии. По теме диссертации опубликованы 4 работы.
Объем и структура пиггрртяиии. Диссертация изложена на 172 листах машинописного текста и состоит из введения, обзора литературы, глав с изложением материалов и методов, результатов собственных исследований, обсуждения полученных результатов, выводов и практических рекомендаций. Работа иллюстрирована 13 таблицами, 39 рисунками, 3 клиническими примерами. Библиография включает 134 отечественных и 93 иностранных научных работ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В течение 10 лет с 1980 по 1990 гг. обследовано 57 .;етей в возрасте от 1,5 до 15 лет, страдающих ИЭ (табл.1), находившихся на стационарном обследовании и лечешг.: в Детской клинической больнице N 1 г.Москвы.
Таблица 1
Структурный состав больных инфекционным эндокардитом
Форма ИЭ Количество Пол Возраст в годах больных
Абс.ет, от 8 до 15 лет.
При постанов1 г диагноза ИЭ использовались клинические и инструментально-лабораторные критерии заболевание (лихорадка, озноб, потливость, появление или изменение характеристики шумов над областью сердца, спленомегалия, тромбоэмболия,’анемия, лейкоцитоз, увеличение СОЗ, обнаружение вегетаций на клапанах сердца при эхокардиографическом исследовании и т.д.).
У всех больных был тщательно изучен анамнез заболевания,проведено полное клинико-лабораторное обследование, включавшее исследование анализов крови, мочи, биохимического анализа I рови, общего белка и белковых фракций, С-реактнЕлого протеина, уровня серомукоида.
V 56 больных проводились посевы венозной крови на микрофлору. Забор крови проводился до назначения или на фоне отмены антибактерчалышх препаратов 1 раз в сутки в -течение 3 дней. Результат исследования гемокультуры на бактериальную флору считали положительным при выделении одного и того же возбудителя хотя бы из двух порций крови. При отсутствии роста на 10-й день результат расценивали как отрицательный.
В качестве инструментальных методов использовали электрокардиографию (56 больных), фонокардиографию (56), рентгенографию сердца в 3 проекциях (55) , по показаниям преходили экскреторную урографию (5).
Зхокардиографическое (ЭхоКГ) исследование у 37 больных проводилось на аппаратах МАРК-500,600 фирмы АТЛ, БопоЬуег Б8Н-40А фирмы Тошиба и Алока-870, работающих ь режимах эхокардиографии, импульсного и непрерывной волны допплера с частотой излучения 2,5, 3,5 и 5 мГц. При эхокардиографическом исследовании, наряду с
топической диагностикой ВПС, оценивались наличие, форма и размер вегетаций, наличие регургитации на к.:апанах или сброса крови слева направо на уровне межжелуд чко-вой перегородки вследствие решунтирования дефектов после выполненных радикальных вмешательств.
Гистологическое исследование проводилось на материале, полученном во время операции протезирование клапанов у 2 больных и при 20 аутопсиях. Материал фиксировалсяв 10% растворе формалина, затем подвергался общепринятой воск-парафиновой проводке. Парафиновые срезы окрашивались гематоксилином и эозином.
Статистическая обработка полученного материала проводилась в институте сердечно-сосудистой хирургии им.А.Н.Бакулева АМН России на персональной ЭВМ по программе «Микростат П» (США). Оценивалась такие параметр:: как средние величины (М), среднее квадратичное отклонение <$), средняя квадратичная ошибка С± м), достоверность различия частоты встречаемости признакоз (Р) с помощью критерия Стьюдента (Т).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ НАБЛЮДЕНИЙ.
У всех больных с вторичным ИЭ наблюдалось подострое течение заболевания. Среди ВПС наиболее часто эндокардит отмечался у больных с тетрадой Фалло и дефектом межжелудочковой перегородки (19 и 9 больных соответственно). Преобладали дети перенесшие паллиативные (12) и радикальные (15) операции по поводу различных ВПС.
У 11 больных с тетрадой Фалло, которым был наложен артериовенозный анастомоз, ИЭ развился через 10 месяцев -13,8 лет (в среднем 6,8 лет) после проведенных операций. Среди больных, перенесших радикальные операции по изводу различных ВПС, у 6 ИЭ присоединился в ранке« ло-слеоперационном периоде (в tpeднeм через 9,6 днехаюсяе
операции), у 9 — в.позднем послеоперационном периоде (в среднем через 1,8 лет после операции).
При анализе анамнеза болезни установлено, что у 13 детей ИЭ предшествовали следующие заболевания: в 4 случаях ашины, в 2 — гнойный отит, в 2 — фурункулез, в 1 -. экстракция зуба, в 1 — парапроктит, в 1 — абсцесс мягких тканей, в 2 — катетеризация полостей сердца, предпринятая с целью уточнения топики ВПС. У б больных установлена четкая связь начала ИЭ с проведенными радикальными операциями ло поводу ВПС.
У 28 больных не удалось выявить провоцирующие факторы в развитии ИЭ. Очаги хронической инфекции (множественный кариес зубов, патология ЛОР-органов) выявлены у 37 (78,8%) из 47 больных; большинство составляли дети с ВПС, сопровождающиеся хронической шпоксемией — 25 (67,6%) из 37.
Среди обследованных с вторичным ИЭ у 16 (31,1%) больных диагноз заболевания был заподозрен с момента появления первых клинчческих признаков. У 31 (65,9%) , больного имела место поздняя диагностика ИЭ. Большинство из этих детей наблюдались длительное время с диагнозом ОРВИ (11) и «лихорадка неясного генеза» (10). В связи с этим сроки установления диагноза ИЭ колебались от 2 до ‘8 месяцев от качала болезни (в среднем 2.5 мес).
Изучение клинической картины у 47 больных с вторичном ИЭ позволило определить, что первым симптомом у 46 была лихорадка (91,1%). Безлихорадочное течение ИЭ наблюдалось у одной больной.
Острое начало заболевания, сопровождающееся постоянной или гектической лихорадкой наблюдалось у б больных с ИЭ, осложнившим течение раннего послеоперационного периода после проведенных радикальных операций по поводу ВПС. С первых дней заболевания
у этих больных ухудшалось общее состояние, нарастали признаки сердечной недостаточности.
У 40 (86,9%) больных наблюдалось постепенное кгчало ИЭ с субфебрильной или интермитирующей лихорадки. У этих больных в течение 1-1,5 месяцев от начала по^ьемов температуры появлялись жалобы на повышенную утомляемость, слабость, снижение аппетита. У 10 больных лихорадка сопровождалась ознобом и потливостью. У больных с ВПС, сопровождающихся хронической гипоксемией, наблюдалось усиление цианоза кожных покровов и слизистых оболочек, усиление одышки (3), появление одышечно-ци-анотических приступов (2) или их учащение (3). У 1 больного с вторичным ИЭ, развившимся на фоне ревматического порока сердца, появились признаки недостаточности кровообращения ПА-ПБ ст.
У 19 (40,4%) больных с первых недель заболевания отмечалось тахикардия, которая не исчезала при снижении температуры тела. У 23 (48,9%) больных наблюдалось появление новых шумов или изменение выраженности и продолжительности ранее существующих шумов над областью сердца. У 5 больных с некоррегировашшми ВПС отмечалось снижение интенсивности систолического шума, у 2 -снижение интенсивности систолодиастолическоги шума ар-териовенозного анастомоза, у 10 — после перенесенных ра-.дикальных операций усилился систолический шум. У б больных был выслушан диастолический шум в точке проекции аортального клапана, который на определялся до заболевания. Исследования показали, что у больных с вторичным ИЭ спределить изменения характеристики имеющихся шумов над областью сердца представляет большие трудности. Так, уменьшение интенсивности систолического шума стеноза легочной артерии (1 больной) исистолоди-астолического шума артериовенозного анастомоза (2), обусловленные закрытием вегетациями просвета этих сосу-
дов, наблюдалось в. течение длительного Бремени (от б месяце» до 4 лет).
У 24 (51,1%) больны* изменения характеристики шумов над областью сердца не удалось определить из-за наличия грубых шумов, непосредственно связанных с ВПС или фун-. кциойирующими анастомозами. .
У всех больных с вторичным ИЭ отмечались приглушение тонов и расширение границ сердца, обусловленные наличием ВПС. У 15 (31,9%) больных наблюдалось значительней перкуторное расширение границ сердца, что ‘ невозможно было объяснить только наличием ВПС. Полученные данные мы расценили как проявления миокардита у этьх детей, что нашло подтверждение на аутопсии у 7.
Среди 39 обследовании- больных появление признаков недостаточности крезообращений отмечено на 3-6 месяце откачала заболевания у 18 из них. У 8 больных она соответствовала ПА ст., у 7 — ПА-ПБ ст. У 3 больных с некорреш-рованными ВПС наблюдалась недостаточность кровообращения Ш ст. У 21 больного признаков недостаточности кровообращения выявлено не.было.
Клинически экссудативный перикардит установлен у одного больного с вторичным ИЭ, развившимся на фоне ревматического порока сердца.
Из экстракардиальных признаков ИЭ у 11 больных отмечались петехии на коже спины, нижних конечностей, у 4 -пятна Лухапа-Либмана. Спленомегагия определялась у 23 (48,9%) бо. :ьных. У 7 — она стала пальпироваться с первых 2-3 недель от начала заболевания, у 16 — в ходе прогресси-рования ИЭ. Тромбоэмболический синдром встретился у 9 (19,1%) больных.
На ЭКГ и ФКГ у всех больных отмечались изменения, свойственные соответствующим ВПС. У З больных на ЭКГ зарегистрирована предсердная экстрасистолия, у 4 — атрио-
вентрикулярные блокады I — П степени в сочетании с внут-рижелудочковыми блокадами.
Морфологические исследования крови показалг, что имеют место различия лабораторных показателей в зависимости от типа ВПС. У больных с вторичным ИЭ, развившимся на фоне бледных пороков сердца и у больных ИЭ, перенесших коррегирующие операции по поводу ВПС, сопровождающихся хронической гипоксемией, уровень гемоглобина составлял 116,5 + 4,97 г/л и 140,5 + 10,62 г/л соответственно. Наблюдался нейтрофильный лейкоцитоз до 12,5409 /ли 11,7-Ю9 /л (8,5 + 0,73 и7,8±0,79) соответ-. ственно. СОЭ была увеличена в пределах от 1 б до 70 мм/час (23,0+ 4,57 и16,0 ±3,65) соответственно.
У больных ИЭ, развившимся на фоне неоперированных ВПС, сопровождающихся хронической гипоксемией, отмечался высокий уровень гемоглобина 211,1 +24.75 г/л, нормальное количество лейкоцитов 5,4+0,46*10 /л, низкие показатели СОЭ 1,08 + 0,2 мм/час.
Увеличение С- реактивного белка отмечалось у 23 детей, уровня серомукоида у 18, что отражало активность ИЗ. Положительные результаты посевов крози на бактериальную флору получены у 8 (17%) больных. У 4 больных выделен зеленящий стрептококк, у 1 — золотисть-й стафилококк, у 2 — эпидермальный стафилококк, у 1 — недифференцированная грамотрицательная палочка.
Вторую группу составили 10 детей с первичны.* ИЭ. В этой группе большинство составляли мальчики. Начало ИЭ чаще было отмечено в возрастной период 4-6’лет. Острый ИЭ наблюдался у одного больного, подострый — у 9.
В случае острого ИЭ заболевание протекало по типу сепсиса и отсутствие признаков поражения клапанного аппарата сердца не позволило установить диагноз прижизнгино, бдительность ИЭ у этого больного составила 3 недели»
Среди детей с подострым ИЭ у 2 больных не удалось выявить каких-либо провоцирующих факторов в развитии заболевания. У 5 больных ИЭ развился после перенесенной ангины, у 1 — на фоне обширного абсцесса мягких тканей, у 1 — на фоне тяжелого течения скарлатины. В этой группе ни у одного больного диагноз ИЭ не установлен на догоспитальном этапе. Чаще всего дети направлялись в стационар с диагнозов ревматизм (3) и «лихорадка неясного генеза» (3). Анализ анамнеза болезни показал, что диагноз ИЭ установлен в среднем через 1,8 месяцев с момента появления лихорадки (от 14 дней до б месяцев). Изучение клинической картины у 9 больных позволило определить, что и при этой форме ИЭ одним из ранних симптомов была лихорадка, которая имела постоянный или гектический характер. У 4 детей лихорадка сопровождалась выраженным ознобом и потливостью. У всех больных отмечалась тахикардия, которая сохранялась при снижении температуры тела. В первые 3-4 недели от начала заболевания у 5 больных определялось расширение границ сердца влево. П4Л1 этом у двух больных расширение границ сердца наблюдалось до прослушивания диастолического шума в точке проекции ао ггального клапана. У 4 больных расширение границ сердца выявлено при поступлении.
У 4 больных при поступлении выслушивались шумы в «ердце: у 1 — прослушивался систолический шум на верхушке, у 2 — дгастолический шум в точке проекции аортального клапана, у г — систолический шум на верхушке и диастоли-ческий шум в точке проекции аортального клапана. У 5 больных шумы над областью сердца, обусловленные поражением клапанного аппарата, начинали выслушиваться на 3-6-8 неделе от начала заболевания: у 4 — выслушивался диастолический шум в точке проекции аортального клапана и у 1 • систолический шум на верхушке. В ходе развития болезни у одного больного дополнительно к систолическому
шуму стал выслушиваться диастолический шум в точке проекции аортального клапана, что свидетельствовало о поражении аортального клапана.
Аускультативные изменения со стороны сердца, которые имели большое диагностическое значение, достоверно чаще выявлялись у детей с первичным, чем с вторичным ИЗ. Разница в частоте этих признаков в сравниваемых группах была достоверна (Р<0,01).
Из экСтракардиальных симптомов ИЭ мы наблюдали пе-техии у 4 больных, пятна Лукина-Либмана у 1. Сплено! :е-галия выявлена у всех больных с первичным ИЭ. Частота спленомегалии у больных с первичным ИЭ достоверно выше, чем у больных с вторичным ИЭ (100 и 48,9% соответственно, Р<0,05).офилышй-лейкоцитоз до 18,б*109 /л (10,3 ± 1,54) , ¿уомбоцнтопення до 140,0’Ю9 /л (193,8 + 16,49), увеличение СОЭ от 25 до 70 мм/час (30,1 +4,7). Повышение С-ре-акт’лшюго белка и уровня серомукоида отмечено у всех Сильных. Положительные результаты посевов чрови на бактериальную флору получены у 2 больных: у 1 — выделена (лшегноиная палочка, у 1 — золотистый стафилококк.
Недостаточность кровообращения, которая наблюдалась у 3 больных, развивалась на поздних этапах от начала заболевания.
Указанные выше клинико-лабораторные изменения у всех 9 больных с первичным ИЭ свидетельствовали о поражение ке только клапанного аппарата сердца, но и миокарда. Мы имели значимую разницу и в оценке частоты миокардита, который существенно преобладал у детей с первичным ИЭ (100%), в отличие от вторичного ИЭ (31,9%, Р<0,05). Клинически перикардит диагностирован у одного больного.
Таким образом, у большинства больных с вторичным ИЭ клинические проявления в начале заболевания были достаточно скудными. Не во всех случаях были информативны лабораторное показатели. В то же время у больных с первичным ИЭ, как правило, отмечалась большая четкость в характеристике основных клинических проявлений и выраженности лабораторных исследований.
Наряду с общепринятыми методами исследования было лров едено комплексное изучение эхокардиографических изменений и морфологических данных у детей с ИЭ. Полученные результаты сопоставлены с данными клинико-ла-бораторных исследований.
По данным эхокардиографии при вторичном ИЭ (I группа) признаки поражения внутрисердечных структур выявлены у 15из28 (53,6%) больных.Вегетацииобнаруженыв 5 случаях на створках аортальных, в 4 — на створках трехстворчатых клапанов, в 5 — на створках клапана легочной артерии, в 1 — на створках митрального, аортального и трехстворчатого клапанов.
Во второй группе (первичный ИЭ) вегетанкк оби-г-у1?:«- -ны у 9 (100%) больных: в 1 случае на створках митрально; ;, клапана, с 5 — на створках аортальных клапана, о -
створках митрального и аортального клапанов, в 1 — на створках митрального и трехстворчатого клапанов.
Эхокардиографическая картина вегетации была разнообразной — от плоских мелких неравномерных уплотнени на ствсрках клапанов, до массивных крупных образований, выступающих за пределы створок. Сопоставление эхокар-диографических данных с результатами операций (А) и аутопсий (8) показало, что плоские мелкие неравно? ‘ерные уплотнения соответствуют вегетациям от 2 до 5 мм в диаметре, крупные массивные вегетации достигают 10-15 мм.
Выявлены различия в размерах вегетаций у больных с вторичным и первичным ИЭ. При вторичном ИЭ у 5 больных размеры вегетаций составляли 3-5 мм и только у 1 — они достигали 10 мм в диаметре. При перви чном ИЭ у Я больных размеры вегетаций составляли 5-7 мм и у 3 — от 10 до ‘5 мм ? диаметре. Сопоставление результатов эхокардиографии, л!опо:олопш с клиническими проявлениями ИЭ выявило иряную зависимость размеров вегетаций от тяжести заболевания. Наиболее выраженные изменения обнаружены у больных с пер:зкчтшм ИЭ.
Осоо’ый интерес представляло то обстоятельство, что вегетации обнаружены при малосимптомных вариантах вторичного ИЭ V;/ 10 из 15).окардиографию при ранней диагностике ИЭ, коща обчч-да.е лаоораторные показатели не отражают активность воспалительного процесса, что особенно важно для детей с ВПС.
Сопоставление результатов эхокардиографии, операций, аутопсий с аускультативными изменениями со стороны сердца показало, что обнаружение вегетаций на ЭхоКТ явилось более достоверным диагностическим критерием ИЭ у 5 из б больных с ВПС, чем появление нового шума или качественное изменение имеющихся шумов лад областью сердца. Полученные данные подтвердили мнение .Г.Р.Уап
Hare (1984) о том, что в критерии диагностики ИЭ у детей с ВПС могут быть включены выявленные на ЭхоКГ вегетации.
Минимальный срок регистрации вегетаций от начала появления первых признаков ИЭ был 6 недель при вторичном и 4 недели при первичном ИЭ. Это позволило у 12 больных (8 с вторичным и 4 с первичным ИЭ) установить диагноз ИЭ на более ранних этапах его развития.
Сравнительная оценка результатов ЭхоКГ-исследова-ния с клиническими проявлениями показало, что эхокарди-ографическая картина вегетаций не имела четких отличий в зависимости от характера течения заболевания и его активности. Это заключение подтверждено при морфологическом исследовании операционного и секционного материала (2 и 8 соответственно), что выражалось в отсутствии воспалительных изменений в ткани створок пораженное клапанов (у 5 из 10).
Изучение влияния антибактериальной терапии на морфологию вегетаций в процессе лечения у 10 больных не выявило изменений формы и размеров вегетаций. Это по-зволгет нам считать, что ЭхоКГ-проявления не могут служить критерием определения длительности антибактериальной терапии. Подобные данные согласуются с результатами исследования L.C Ju et al (1986).
Нами впервые проведено динамическое наблюдение за морфологией выявленных на ЭхоКГ вегетаций в течение 4-х лет у 9 больных. У 8 из 9 больных, у которых была получена ремиссия, не отмечено отчетливых изменений вегетаций. У одного больного с вялотекущим ИЭ, несмотря на проводимую антибактериальную терапию, мы наблюдали увеличение размеров вегетаций на створках клапана легочной артерии, которые полностью закрыли ее просвет.слапанах была обусловлена формированием их недостаточности в результате присоединения НС. Вегетации на хлашшзх были менее 2 мм в диаметре, что ¿г груд-ншто на визуализацию при ЭхоКГ. Сброс крови па уровне желудочков слева направо после адекватно выполненных операций связан с реканализацией дефекта межжелудочковой перегородки. Выявленные вегетации на заплате де- ‘ фекта в межжелуАочковой перегородке также были менее 2 мм в дламетре.
Сопоставление результатов ЭхоКГ-исследования с клиническими данными показало, что застойная сердечгая недостаточность (ЗСН) чаще наблюдалась у больны/ с выявленными на ЭхоКГ вегетациями (у 8 из 24), в то время как в группе без вегетаций из 13 обследованных она отмечалась у 2.
Сравнительный анализ результатов ЭхоКГ с данными операций (4) и аутопсий (11) позволил отметить более выраженную деструкцию пораженных клапанов у больных с выявленными на ЭхоКГ вегетациями (у 5 из 12), что нашло отражение в развитии у гих ЗСН.
Не установлено четкой связи между частотой тромбоэм-болических осложнений и характером ЭхоКГ-данных. Так,
б группе больных с выявленными на ЭхоКГ вегетациями тромбоэмболии наблюдались у б из 24, а в группе без веге-тацийу 2 из 13.
Не выявлено существенных различий показателей летальности в этих группах. В группе больных с выявленными на ЭхокГ вегетациями отмечена летальность 9 из 24 детей, а в группе без вегетации 4 из 13.
Та::им образом, мы наблюдали два типа эхокардиогра-фическихизмененийприИЭ:прямые (вегетации) икосвен-ные эхо-признаки (регургитация на клапанах и сброс крови на уровне желудочков в связи с решунтировгнием дефекта межжелудочковой перегородки), что имеет важное диагностическое значение.
Из 57 наблюдавшихся нами больных погибло 25. Основной причиной смерти больных была сердечная недостаточность, от которой погибло 15 детей (68%) и значительно реж» тромбоэмболические осложнения — 6. детей (24%). 2 больных (8%) с некоррелированными пороками сердца, сопровождающиеся хронической гипоксемией, погибли во ¿рема одышечно-цианотических приступов.
Мсрфологическое изучение операционного (2) и секционного (20) материала выявило некоторые отличия в сравниваемых группах больных ИЭ: деструктивный процесс клапанного аппарата в виде перфораций створок, образования аневризм створок и в редких случаях предсердно-желу-дочковых фистул был более значительно выражен в группе больны к с первичным ИЭ (у 4 из 6), чем в группе вторичного ИЭ (у 2 из’16). Выявленные изменения мы связываем с тем, что при вторичном ИЭ воспалительный процесс развивается на фоне гемодинамически измененных клапанах, замедляющих деструктивные процессы.
Наши исследования показали, что независимо от формы ИЭ чаще фиксировалось изолированное поражение клапанов сердца (у 14 лз 22). У половины больных с вторичным
ИЭ отмечалось изолированное поражение правых отделов сердца. В группе первичного ЙЭ преобладало поражение левых отделов сердца (у 4 из б).
Гистологическое исследование эндокарда ¿юраженны;: :слапанов выявило соответствие между клиническими ь. морфологическими изменениями. Так, у 15 больных (10 с вторичным и 5 с первичным ИЭ) с манифестными признаками эндокардита имелась картина очагового и диффузного деструктивного вальвулита. У 7 больных (б с вторичным и 1 с первичным ИЭ) при отсутствии выраженных симптомов эндокардита преобладали склеротические изменения.
Гистологическое исследование мис харда у 14 больных (10 с вторичным и 4 с первичным ИЭ) в активной стадии заболевания позволило выявить признаки миокардита. У 4 больных с вторичным и у 1 — с первичным ИЭ, которые погибли в неактивной стадии болезни, отмечались признаки иостмиокардичического кардиосклероза. У одного больного с вторичным ИЭ выявлена жировая дистрофия миокарда. Сопсл-авление результатов морфологического исследования с кгмническими данными показало, что ИЭ сопровождается поражением миокарда. Миокардит ус клинически у больных с вторичным ИЭ был установлен в два раза реже, чемнг аутопсии (31,9 и бб,б% соответственно).
Морфологическое исследование показало наличие прямой связи между выраженностью клинических проявлений заболевания и развитием перикардита. Так, при вторичном ИЭ признаки перикардита были выявлены у одного больного, в то время как первичный ИЭ у 3 из 5 больных сопровождался перикардитом. Клинически перикардит был диагностирован только у больного с вторичным ИЭ. У болг-ных с первичным ИЭ перикардит-не был диагностирован прижизненно.
Описанные изменения свидетельствуют о том, что появление или нарастание имеющихся изменений со стороны
сердца при ИЭ связано в большей степени с поражением клапанного аппарата сердца, наряду с этим одной из причин расстройства кровообращения является миокардит.
Проведенные исследования позволили выявить характерные признаки инфекционного эндокардита в зависимости ,ох формы заболевания, оценить значение эхокардиографических изменений в диагностике болезни, установить причины расстройства кровообращения. Раннее использование эхокардиографии способствует уменьшению сроков установления диагноза ИЭ.
ВЫВОДЫ
1. Инфекционный эндокардит (ИЭ) у детей в настоящее время встречается в виде вторичной формы на фоне врожденных пороков сердца- 80,7%, в единичных случаях им заболевают дети ~с ревматическими пороками сердца -1,8%. Первичная форма ИЭ развивается на неповрежденных клапанах в 17,5%. Причем заболевание, как правило, имеет подострое течение.
2. Вторичный ИЭ на ранних стадиях развития характеризуется субфебрильной или интёрмитирующей лихорадкой с кратковременными снижениями до нормальных показателей, нарастанием общей интоксикации (усиление бледности или цианоза кожных покровов, тахикардией) на фоне отсутствия выраженных изменений периферической крови.
Для первичного ЦЭ типичны фебрильная лихорадка, общие симптомы интоксикации (бледность кожных покровов, тахикардия), спленомегалия, нейтрофиль.:ый лейкоцитоз, увеличение СОЭ; клинические проявления поражений клапанов сердца обнаруживаются на 3-8 неделе от начала заболевания.
а
3. Метод эхокардиографии при ИЭ имеет большое диагностическое значение, так как позволяет выявлять вегетации с 4-6 недели от начала заболевания, их размер и локализацию. Вместе с тем эхокардиографическая картинг вегетаций не зависит от активности воспалительного процесса и длительности проводимой терапии
4. Морфологические (макроскопические) изменения характеризуются наличием вегетаций на клапанах и париетальном эндокарде, перфорациями створок, в редких случаях образованием аневризм створок и предсердко-же-лудочковых фистул. Микроскопические изменения характеризуются наличием очагового и диффузного деструктивного вальвулита. При вторичном ИЭ в 66,6% случаев заболевание сопровождается миокардитом.
5. Клинико-эхокардиографические и морфологические сопоставления показали, что при ИЭ у больных с врожденными пороками сердца наиболее часто поражаются правые отделы сердца (трехстворчатый и легочный клапаны).
6. Расстройство кровообращения у больных ИЭ обусловлено не только поражением клапанного аппарата сердца, но и миокардитом, что необходимо учитывать при назначении комплексной терапии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Необъяснимые подъемы температуры наряду с ухудшением общего самочувствия позволяет с высокой долей вероятности заподозрить у детей с В ПС наличие инфекционного эндокардита.
2. Своевременная диагностика ИЭ у детей состоит в комплексном клинико-лабораторном обследовании с обязательным использованием эхокардиографии.
3. После выписки из стационара больные должны находиться под наблюдением педиатра и кардиолога. При раз-
личных интеркурентных заболеваниях и хирургических манипуляциях с целью профилактики рецидивов ИЭ необходимо назначать антибактериальные препараты. Предупредить развитие ИЭ у детей с врожденными пороками сердца возможно при своевременной санации хронических очагов инфекции.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Ультразвуковые методы исследования в диагностике инфекционного эндокардита у детей / Соавт.: И.Н.Митина, Н.А.Тюрин, В.И.Сербин, А.Я.Нежлукто// Педиатрия.-1989.- N 9.- С.66-68.
2. Ультразвуковые методы исследования в диагностике инф 2кционного эндокардита у детей /Соавт.: И.Н.Митина, Н.А.Тюрин, В.Н.Сербин, А.Я.Нежлукто// Тез.докл. XIX Международного съезда детских врачей. — Париж.- 1989. -С.9.
3. Особенности современного течения инфекционного эндокардита у детей с врожденными пороками сердца /Соавт.: Ю.Н.Захарова// Механизмы компенсации и восстановления нарушенных функций. Сб.научных трудов. -Изд.УДН. — М., — 1990. — С.55-56.
4. Клинико-морфологические сопоставления при инфекционном эндокардите у детей /Соавт.: Н.А.Тюрин, Ю.Н.Яоошинский, В.И.Сербин, Т.С.Парсегова, Л.Н.Каск, И.Н.Митина //Педиатрия. -1991.- N 5. — С.71-76.
Современные аспекты диагностики инфекционного эндокардита у детей
В современной клинической практике проблема инфекционного эндокардитастоит достаточно остро. Это обусловлено довольно высокой заболеваемостью, выраженным клиническим полиморфизмом, нарастанием числа атипичных форм, повышением удельного веса возбудителей, резистентных к антибактериальной терапии [2, 4].
По данным литературы заболеваемость ИЭ у взрослых составляет 1,7–6,5:100.000 населения в год [1], у подростков — более низкая, и составляет 3,0–4,3:1 млн. населения в год [3]. В то же время по данным, поступающим из крупных медицинских центров Европы и США, удельный вес ИЭ среди детей и подростков в специализированных стационарах постепенно нарастает, что связывают с увеличением числа операций на сердце при врожденных пороках, постоянным расширением спектра инвазивных диагностических и лечебных медицинских манипуляций, а также распространением внутривенной наркомании [4]. При этом мальчики заболевают эндокардитом в 2–3 раза чаще, чем девочки. Среди всех случаев эндокардита инфекционный генез составляет 25–40 % [3].
Недостаточная изученность патогенетических механизмов и клинических проявлений ИЭ у детей в зависимости от вариантов течения являются причиной поздней диагностики и заболевания [1].
Целью исследования явилось изучениеклинических, лабораторных и инструментальных методов исследования, инфекционного эндокардита у детей в современных условиях.
Материалы иметоды исследования.
Исследование проводилось при кафедре Госпитальной педиатрии № 2 на базе клиники ТашПМИ. В исследование были включены 8 детей с установленным диагнозом Инфекционный эндокардит, находившихся на лечении с 2013 по 2016гг, и проведён ретроспективный анализ 12 историй болезни детей с диагнозом Инфекционный эндокардит за период с 2010 по 2016гг. Всем детям проводился комплекс клинико-лабораторных исследований включающий в себя посев крови на стерильность, при анализе результатов которого определились нижеследующие результаты.
Результаты иих обсуждение. Наиболее опасным возбудителем ИЭ является S. Aureus. В последние годы его роль как лидирующего возбудителя ИЭ в отдельных регионах возрастает: этот микроорганизм является возбудителем ИЭ не менее чем в 40 % случаев. S. epidermidis встречается реже в 5 раз, чем S. Aureus (табл. 1).
Таблица 1
Частота основных возбудителей больных детей ИЭ
Возбудители | Частота,% |
Streptococcispp.: S. viridans S. faecalis (энтерококк) S. pneumoniae (пневмококк) B — гемолитические S. spp. Прочие | 40 4 3 4 2 |
Staphylococci spp.: S. aureus S. epidermidis Грамнегативные грибы Грибы Другие или смешанные | 12 5 4 3 8 |
Различные виды бета — гемолитических стрептококков идентифицированы как возбудители ИЭ, наиболее частым является зеленящий стрептококк. Факторы, способствующие его инвазии: манипуляции в полости рта, хирургические вмешательства, тонзиллиты, фарингиты, синуситы. При энтерококковом эндокардите очаги инфекции чаще всего локализуются в гастроинтестинальном, гинекоуринальном трактах, а также в полости рта — парадонтоз. ИЭ, вызываемый Strep. Bovis, развивается на фоне патологии кишечника, нередко осложняет опухолевые процессы в кишечнике. Анаэробные стрептококки чаще всего вызывают ИЭ, связанный с хирургическими операциями, в том числе и с протезированием клапанов.
Развитию грибковых эндокардитов могут предшествовать длительное лечение антибиотиками, глюкокортикоидами, сахарный диабет, внутривенное введение глюкозы, кардиохирургические вмешательства.
Из грамположительных микроорганизмов заслуживают внимания факультативные анаэробы — листерия, дифтероиды, лактобациллы, стрептобациллы, актинобациллы и др. эта группа вызывает эндокардиты протезов клапанов.
Таким образом,положительная гемокультура у больных с инфекционным эндокардитом выявлена в 40 %, из них: грам (+) флора в 69,6 %, грам (-) флора в 26,8 %, грибы рода Кандида в 3 %. Клинико-лабораторные септические и иммунокомплексные проявления при ИЭ, вызванные золотистым стафилококком и зеленящим стрептококком, предопределяют прогноз заболевания и ассоциируются с острым и подострым вариантами ИЭ. При ИЭ, вызванном грам (-) флорой, наблюдается высокий процент тромбоэмболических осложнений (33,3 %) и иммунокомплексных изменений (нефрит, полиартрит, геморрагический васкулит), которые ассоциируются с затяжным вариантом заболевания.
При анализе предрасполагающих факторов развития инфекционного эндокардита у детей определилось, что при ВПС риск развития ИЭ во многом зависит от характера анатомического дефекта сердца и максимален у пациентов с синими пороками Фалло, дефектом межжелудочковой перегородки, при атрио–вентрикулярной коммуникации, аортальном стенозе.
В нашем исследовании у 12 детей инфекционный эндокардит развился на фоне ВПС, при этом у 50 % отмечалисьпороками Фалло, ДМЖП у 25 %, аотральный стеноз отмечался у 8 % исследуемых. Наименьший риск ИЭ имеют пациенты с дефектом межпредсердной перегородки, открытым артериальным протоком.
Выявлены клинико-лабораторные особенности вторичного ИЭ: на фоне ВПС отмечался в 60 %, при врожденных пороках сердца: у половины больных ИЭ проявлялся гломерулонефритом, у трети — миокардитом, у четверти больных- суставным синдромом, на фоне ревматизма ИЭ определился в 33 % случаях и проявлялся наличием в 50 % постоянной формы фибрилляции предсердий, в 30 %- тромбоэмболических осложнений, в основном за счет ЗСН. При ИЭ на фоне дисплазии соединительной ткани при ПМК проявлялся в основном иммунокомплексными поражениями, а при двустворчатом аортальном клапане- умеренным септическим синдромом. Факторами риска неблагоприятного прогноза развития вторичного ИЭ являются: при ревматизме- митрально-аортальные пороки сердца, фибрилляция предсердий; врожденных пороках сердца- пороки сердца синего типа, возникновение ИЭ после перенесенных реконструктивных операций.
Клиническая симптоматика ИЭ появляется в основном через 2 недели с момента возникновения бактериемии. Наиболее ранний и частый симптом заболевания — лихорадка (в большинстве случаев — неправильного типа) с ознобом различной выраженности 100 % и последующим профузным потоотделением 80 % случаях. Характерны быстрая утомляемость, нарастающая слабость, анорексия и потеря веса в 60 %. Нередки распространенные артралгии и миалгии, головные боли, боли в сердце 50 %, носовые кровотечения 20 % (рис. 1).
Рис.1. Клиническая симптоматика ИЭ
Так называемые «периферические» симптомы ИЭ у детей и подростков, в отличие от взрослых, встречаются значительно реже (5 %). Тем не менее такие феномены, как симптом Лукина–Либмена (геморрагические высыпания на коже, слизистых и переходной складке конъюнктивы), у 1 больного, 5 % узелки Ослера (плотные болезненные гиперемированные образования в подкожной клетчатке пальцев кистей или на тенаре ладоней), в 5 % повреждения Джейнуэя (мелкие эритематозные высыпания на ладонях и подошвах),10 % пятна Рота (овальные с бледным центром геморрагические высыпания на глазном дне)в 5 % сохраняют свою диагностическую значимость в силу их высокой специфичности и входят в состав малых диагностических критериев.
Основным клиническим синдромом заболевания является эндокардит с быстрым развитием клапанной регургитации (преимущественно — аортальной) при локализации процесса на нативных (естественных) клапанах. При современном ИЭ у детей и подростков наблюдается тенденция к учащению поражения митрального и трикуспидального клапанов, а также клапанов легочной артерии как в отдельности, так и в виде поливальвулярной патологии.
При клиническом исследовании особое внимание уделяется не только однократно фиксируемой аускультативной картине, но и ее динамике. В частности, в дебюте поражения первоначально не измененного аортального клапана может быть выслушан систолический шум по левому краю грудины, вероятно, обусловленный стенозированием устья аорты за счет вегетаций на полулунных клапанах. В дальнейшем появляется нежный протодиастолический шум в V точке с усилением при наклоне тела больного вперед; по мере усугубления клапанной деструкции интенсивность и продолжительность шума нарастает, отмечается ослабление II тона на аорте и снижение диастолического артериального давления.
Заключение. Таким образом,проведена углубленная оценка инфекционного эндокардита с клинико-лабораторных позиций на фоне ревматизма, врожденных пороков сердца, ИБС, дисплазии соединительной ткани сердца и выявлены факторы риска неблагоприятного прогноза. Оценены новые формы инфекционного эндокардита: нозокомиальные и правосердечные. Показана значимость иммунокомплексных и аутоиммунных реакций в развитии и прогрессировании инфекционного эндокардита. Определена прогностическая значимость вспомогательных лабораторных и инструментальных методов исследования в диагностике вариантов инфекционного эндокардита.
Литература:
- Самсыгина Г. А., Щербакова М. Ю. Кардиология и ревматология детского возраста. М. 2004.
- Мелехов А. В., Гендлин Г. Е., Сторожаков Г. И. Эндокардит внутривенных наркоманов. // Росс. мед. журн. — 2007: выпуск: 42–45. 3.
- Соболева М. К., Белов Б. С. Инфекционный эндокардит у детей. РМЖ. 2006. — том 14. — № 8. — С. 630–636.
- Bitar F. F., Jawdi R. A., Dbaibo G. S. et al. Paediatric infective endocarditis: 19– years experience at a tertiare care hospital in a developing country // Acta Pediatr. — 2000.– V.89.– N.4.– P. 427–430.
Основные термины (генерируются автоматически): инфекционный эндокардит, врожденный порок сердца, ребенок, зеленящий стрептококк, клиническая симптоматика, полость рта, фон ВПС, фон ревматизма.
Антибиотикотерапия для лечения инфекционного эндокардита
Вопрос обзора
Мы стремились оценить имеющиеся данные о клинической пользе и вреде различных режимов применения антибиотиков, используемых для лечения пациентов с инфекционным эндокардитом.
Актуальность
Инфекционный эндокардит — это инфекция внутренней оболочки сердца. Это серьезная инфекция, которая часто приводит к летальному исходу, и часто требует проведения операции на сердце. Антибиотики — это лекарства, которые лечат инфекции и являются краеугольным камнем лечения инфекционного эндокардита. Лечение пациентов с инфекционным эндокардитом является внутрибольничным (проводится в стационаре). Несмотря на это, имеются существенные различия между руководствами в их рекомендациях по антибиотикотерапии. Более того, по причине их дозы и длительности периода времени, в течение которого антибиотики должны быть применены, они могут иметь серьезные побочные эффекты, такие как повреждение почек и внутреннего уха, и вызывать аллергические реакции.
Характеристика исследований
Мы определили только шесть рандомизированных контролируемых испытаний (исследования, в которых участники были отнесены к одной из двух или более групп лечения с использованием случайного метода), в которых сравнивали различные режимы применения антибиотиков, в которые входило ограниченное число участников. В каждом испытании исследовали разные виды и дозы антибиотиков. Включенные исследования были опубликованы в период между 1998 и 2019 и были проведены в США, Испании, Финляндии и Дании. Доказательства актуальны по состоянию на 6 января 2020 года.
Основные результаты
Это первое обновление подтверждает выводы оригинальной версии обзора. Ограниченные доказательства низкого или очень низкого качества свидетельствуют о том, что сравнительные эффекты различных режимов применения антибиотиков с точки зрения скорости излечения или других важных клинических исходов являются неопределенными. Выводы этого обновленного Кокрейновского обзора были основаны на нескольких рандомизированных контролируемых испытаниях с высоким риском смещения. Соответственно, имеющиеся данные не подтверждают и не отвергают какие-либо режимы антибактериальной терапии для лечения инфекционного эндокардита.
Качество доказательств
Уверенность в результатах этого обзора от низкой до очень низкой. Включенные исследования имели ограничения связанные с их дизайном и выполнением, и три исследования были спонсированы производителем лекарства, которое в них оценивали. Более того, к неопределенности привело и то, что в исследования было включено ограниченное число людей. Для получения большей информации о том, какие антибиотики являются лучшими для лечения людей с инфекционным эндокардитом, требуются более обширные исследования.
Бактериальный эндокардит | Бостонская детская больница
Что такое бактериальный эндокардит?
Бактериальный эндокардит — это инфекция внутренней оболочки сердца. Это происходит, когда бактерии (микробы) попадают в кровоток и оседают в сердце, где они размножаются и вызывают инфекцию.
Хотя любой может заболеть бактериальным эндокардитом, люди с врожденным пороком сердца могут иметь более высокий риск. Это связано с тем, что у людей с врожденным пороком сердца может быть шероховатая область на внутренней поверхности сердца, вызванная негерметичным или узким клапаном, аномальными соединениями внутри сердца или предыдущей операцией.Эти грубые участки или материалы, помещенные после предыдущей операции или катетеризации, являются потенциальными местами для размножения бактерий.
Бактериальный эндокардит возникает не очень часто, но когда он возникает, он может вызвать серьезное повреждение сердца и потенциально опасен для жизни.
Каковы симптомы бактериального эндокардита?
Самым частым признаком бактериального эндокардита у детей с врожденным пороком сердца является лихорадка. Другие симптомы могут включать:
- плохой аппетит
- усталость
- учащенное дыхание
- боль в суставах
- сыпь
- потеря веса
Каковы причины бактериального эндокардита?
Бактериальный эндокардит может возникнуть, когда бактерии проникают в организм и растут на внутренней поверхности сердца.У детей и взрослых с врожденным пороком сердца это может произойти после одной из следующих процедур:
- стоматологические процедуры (включая чистку зубов)
- Операция по удалению миндалин или аденоидов (тонзиллэктомия или аденоидэктомия)
- Операция на дыхательных путях, желудочно-кишечном тракте или мочевыводящих путях
- Инфекции кожи или ногтей на ногах
Иногда причина неизвестна или это может быть другой тип инфекции.
Как мы лечим бактериальный эндокардит
Здесь, в кардиологическом центре Бостонской детской больницы, наша команда специалистов оказывает стационарную и амбулаторную помощь пациентам с врожденными пороками сердца. Лечение бактериального эндокардита является как медикаментозным, так и хирургическим и требует скоординированной команды врачей различных специальностей для обеспечения наиболее успешного результата. Когда требуется операция по поводу инфекции клапана, наши хирурги специализируются на восстановлении клапана и избегают замены, когда это возможно.Ремонтируем клапаны, которые традиционно ремонтируют в других центрах.
Эндокардит | Американская академия педиатрии
- Leigh Bragg, MD *
- Ana Alvarez, MD *
- * Отделение инфекционных заболеваний и иммунологии, отделение педиатрии, Медицинский колледж Университета Флориды, Джексонвилл, Джексонвилл, Флорида.
- AACEK:
- Aggregatibacter parainfluenzae , Aggregatibacter actinomycetemcomitans , Cardiobacterium hominis , Eikenella corrodens, и Eikenella corrodens, и Kingella разновидностей
- врожденный порок сердца
- CVC:
- центральный венозный катетер
- IE:
- инфекционный эндокардит
- ECHO:
- эхокардиография
Пробелы в образовании
Из-за связанной с ним смертности (20% -25 %), врачи должны признать, что инфекционный эндокардит может поражать детей без сердечных аномалий в анамнезе.(1)
Педиатры должны знать недавно пересмотренные рекомендации Американской кардиологической ассоциации по антимикробной профилактике инфекционного эндокардита у детей. (2)
Цели
После прочтения этой статьи читатели должны уметь:
Перечислить факторы риска инфекционного эндокардита (ИЭ).
Распознавайте признаки, симптомы и критерии Дюка, которые помогают в диагностике ИЭ.
Определите соответствующие лабораторные тесты и изображения, необходимые для диагностики ИЭ.
Обсудите медикаментозное и хирургическое лечение, используемое при лечении ИЭ.
Определите популяцию и процедуры, в которых профилактические антибиотики используются для предотвращения ИЭ.
Случай 1
У ранее здорового 3-летнего мальчика в течение 5 дней наблюдается лихорадка, озноб, недомогание и рвота. При осмотре температура 102.4 ° F (39,1 ° C). Он вялый, имеет петехии на слизистой оболочке щек и конечностей. Он госпитализирован для обследования и лечения сепсиса неизвестного происхождения. Три посева крови, выполненные в разных случаях, выявили грамположительные кокки при окраске по Граму. Эхокардиография (ЭХО) выполняется из-за подозрения на эндокардит.
Случай 2
У 14-летней девочки с врожденным пороком сердца (ВПС) 3 года назад была проведена замена аортального клапана биопротезом.Сегодня она поступает в отделение неотложной помощи с одышкой и периферическими отеками. При осмотре у нее нет лихорадки, но новый резкий диастолический шум и гепатомегалия. ECHO выявляет 1,5-сантиметровую растительность на аортальном клапане. Она госпитализирована в отделение интенсивной терапии, ей вводят антибиотики широкого спектра действия. Через 24 часа ее клиническое состояние продолжает ухудшаться, и ее принимают до…
Инфекционный эндокардит у детей с нормальным сердцем: показания к хирургическому вмешательству
Резюме
Хотя инфекционный эндокардит является редким заболеванием, он может быть смертельным, если его не лечить.Новая эра инфекционного эндокардита у детей со структурно нормальным сердцем стала очевидной. Критерии Дьюка были установлены в течение длительного времени и дают четкие рекомендации по диагностике; однако показания к хирургическому вмешательству в педиатрической популяции должны быть адаптированы к индивидуальным пациентам.
Ключевые слова: Эндокардит, инфекционный, педиатрический, хирургическое лечение
1. Введение
Инфекционный эндокардит (ИЭ) остается необычным опасным для жизни состоянием с ежегодным уровнем заболеваемости от 0.05 и 0,12 случая на 1000 госпитализаций [1]. До 1970-х годов у большинства детей с ИЭ был ревматический порок сердца. В последнее время, за последние два десятилетия, врожденные пороки сердца (ВПС) стали преобладающим основным заболеванием ИЭ в развитых странах [1]. Кроме того, увеличилось количество случаев ИЭ, связанных с ИБС, из-за увеличения числа выживших детей с восстановленной или паллиативной ИБС [1].
Хотя ИЭ редко встречается у детей с нормально структурированным сердцем, его все чаще диагностируют при отсутствии ИБС [1].Инфекция эндокарда в этих условиях часто связана с установкой центральных венозных катетеров рядом с сердцем или с иммуносупрессивным состоянием. В настоящее время считается, что 8–10% случаев ИЭ у детей развиваются в сердце с нормальной структурой [1]. Ведение ИЭ зависит главным образом от длительного лечения антибиотиками, как рекомендовано недавно опубликованными руководящими принципами [1]. Роль хирургического вмешательства в лечении ограничена определенными случаями и показаниями [2].
В то время как диагностические критерии и лечение ИЭ хорошо известны, роль и показания к хирургическому вмешательству четко не определены.Из-за ограниченного числа спорадических случаев вряд ли будут какие-либо рандомизированные контролируемые испытания лечения ИЭ в педиатрической популяции, что поставило группу авторов перед трудностями при составлении рекомендаций. Таким образом, многие из текущих показаний основаны на единодушном мнении [1]. В этом отчете мы представляем серию случаев ИЭ у детей со структурно нормальным сердцем, которым потребовалось хирургическое лечение ИЭ. Мы обсуждаем показания и рекомендации по хирургическому лечению ИЭ у детей.
2. История болезни
2.1. Случай 1
В отделение неотложной помощи поступила 1-летняя девочка с длительной лихорадкой и плохим кормлением в анамнезе. Ребенок госпитализирован в педиатрическое лечебное отделение для обследования. Ее история болезни была значимой для двух рецидивирующих инфекций; первым был целлюлит лица, а вторым — сепсис. При ее недавнем поступлении в посев крови выросло Pseudomonas aeruginosa , которые лечили меропенемом и гентамицином в соответствии с чувствительностью посева и антибиотикограммой.Из-за необычного анамнеза рецидива серьезной инфекции была проведена скрининговая эхокардиограмма (ECHO), которая показала нормальную анатомию сердца с двумя внутрисердечными массами, соответствующими диагнозу эндокардита. Первая масса размером 11 мм прикреплена к передней створке трехстворчатого клапана (TV;). Вторая масса размером 4,5 мм прикреплена к задней створке TV с легкой регургитацией трикуспидального клапана (TR) и градиентом TR 25 мм рт. В течение предшествующих 2 недель после начала противомикробного лечения эндокардита у пациента отмечалось усиление гипоксии, а повторная ЭХО демонстрировала отслоение большого фрагмента растительности и миграцию одной массы в левую легочную артерию (LPA) с турбулентностью потока из-за значительной обструкция кровотока, несмотря на адекватную терапию антибиотиками и антикоагулянтами.Таким образом, пациент был направлен на хирургическую вегетэктомию для устранения обструкции легочного кровотока. Растительность была удалена хирургическим путем из TV и LPA. Тканевые культуры из растительности подтвердили P. aeruginosa IE. Пациент выздоровел после операции со стерилизацией крови и нормальной анатомией сердца при выписке домой.
Эхогенная масса, проходящая через трехстворчатый клапан.
2.2. Случай 2
Трехмесячный младенец мужского пола родился доношенным путем нормальных естественных родов от матери с гестационным диабетом.После рождения у ребенка была выраженная гипогликемия, и ему потребовалась госпитализация в отделение интенсивной терапии для новорожденных (ОИТ) для мониторинга уровня сахара в крови и внутривенного введения глюкозы. Ребенку требовалась высокая концентрация декстрозы для поддержания нормального уровня сахара в крови; для этого был вставлен пупочный венозный катетер. Первоначально был проведен кардиологический скрининг, который выявил гипертрофированную межжелудочковую перегородку без обструкции и нормальные структуры сердца. Ребенок выздоровел и выписан в хорошем состоянии.Через 1 месяц его повторно положили в больницу с плохим питанием и лихорадкой на 10 дней. Общий анализ крови показал лейкоцитоз с количеством лейкоцитов 23 × 10 3 / мл и тромбоцитопению с количеством тромбоцитов 24 × 10 3 / мл. Были собраны посевы крови и мочи, и было начато лечение антибиотиками широкого спектра действия. В посеве крови выросли не -albicans Candida , что потребовало начала внутривенной терапии амфотерицином B. Повторные посевы крови оставались положительными даже после 1 недели противогрибкового лечения; Между тем, эхокардиография показала большие внутрипредсердные образования, прикрепленные к телевизору без каких-либо препятствий.Из-за большого размера грибковой массы со стойкой фунгемией, которая не улучшилась при системном введении противогрибковых средств, ребенок был направлен на хирургическую вегетэктомию. Хорошо сформированное образование (6 × 4 × 3 см) было удалено из правого предсердия (). Пациент выздоровел после операции с полной стерилизацией крови без остаточного поражения сердца и выписан в хорошем состоянии.
Из правого предсердия иссечено образование хорошо сформированной формы. Тканевые культуры подтвердили вегетацию, отличную от -albicans Candida .
2.3. Случай 3
Двухмесячный младенец мужского пола родился недоношенным на 34 неделе беременности, с массой тела при рождении 2,1 кг. У него не было серьезных осложнений, и ему не потребовалась искусственная вентиляция легких или постоянный центральный венозный катетер после рождения. Через несколько дней в яслях ребенок был выписан домой. Через неделю после выписки у него началась лихорадка дома из-за плохого питания, и он был повторно госпитализирован в периферическую больницу, где его лечили от сепсиса новорожденных. В культуре крови выросло Candida albicans , для которых было начато внутривенное введение амфотерицина B.У него продолжала подниматься температура, несмотря на адекватную противогрибковую терапию; поэтому была проведена эхокардиография, которая показала большую массу на стыке нижней полой вены и правого предсердия, распространяющуюся на правый желудочек через ТВ. Масса была размером 10–20 мм (). ECHO не продемонстрировал основного заболевания сердца.
Грибковое образование в правом предсердии двухмесячного младенца.
Затем он был переведен в третичную больницу, где повторные серийные эхокардиографические исследования продолжали показывать массу правого предсердия (), связанную со стойкой фунгемией, несмотря на 30 дней комбинированного противогрибкового лечения амфотерицином B и флуконазолом.В культурах крови стабильно росло C. albicans , и повторная эхокардиография не показала уменьшения размера массы с обструкцией правого предсердно-желудочкового притока. Затем пациента отправили на операцию, и правое предсердие было удалено хирургическим путем. Гистопатология массы показала C. albicans . Послеоперационная эхокардиография не показала остаточной массы, пациентка получала амфотерицин В в течение 6 недель с полной стерилизацией крови после вегетэктомии.На контрольных эхокардиографах не было обнаружено рецидивов новообразования и не наблюдалось остаточного поражения сердца.
3. Обсуждение
ИЭ — необычное заболевание у педиатрических пациентов с потенциально серьезными последствиями. Сложный характер этого заболевания требует точной диагностики и способствует лечению [3]. В то время как существующее ранее заболевание сердца является основным предрасполагающим фактором для развития ИЭ у детей, все чаще сообщается о случаях ИЭ без основного заболевания сердца [4].
Данные по ИЭ у детей со структурно нормальным сердцем и отсутствием предрасполагающих факторов ограничены.Russell et al. [3], за 21 год изучения результатов хирургического лечения ИЭ, обнаружили, что в 35 случаях эндокардита потребовалось хирургическое вмешательство; из них 14 (40%) не имели врожденного порока сердца. Помимо растущего числа детей, выживших после кардиохирургических операций, существуют и другие факторы риска, которые считаются предрасполагающими условиями для ИЭ. В одном исследовании авторы подчеркнули, что улучшение методов реанимации, новые технологии и более инвазивные устройства, используемые у неонатальных и педиатрических критических пациентов, создали новую группу пациентов с повышенным риском эндокардита [5].В настоящее время примерно 8–10% случаев ИЭ у детей развиваются без аномального строения сердца, хотя могут быть идентифицированы другие основные факторы риска, такие как иммунодефицит, хроническое парентеральное питание и наличие центральных венозных катетеров рядом с сердцем или туннельных центральных венозных катетеров [1] . Carceller et al. [5] в своем исследовании тенденции развития ИЭ у детей обнаружили, что 15 из 56 (26%) пациентов с эндокардитом имели серьезное системное заболевание без врожденных проблем с сердцем, а шесть из этих 56 (7%) были полностью здоровыми детьми. .
Есть некоторые различия в характеристиках ИЭ у детей с нормальным сердцем и детей с сердечными нарушениями. Микроорганизмы, вызывающие эндокардит у детей с нормальным сердцем, могут отличаться от тех, которые вызывают ИЭ у детей с сердечными нарушениями. В своем недавнем отчете, опубликованном в 2015 году, европейская кардиологическая группа выделила две новые подгруппы пациентов с ИЭ: первая подгруппа включает пациентов в отделении интенсивной терапии, а другая — пациентов с ИЭ, поражающим правую часть сердца.Обе подгруппы не имели основной ИБС, но у них могли быть другие факторы риска и другой спектр возбудителей. В отделениях интенсивной терапии обычно возбудителями ИЭ являются Staphylococci , Streptococci и грибы, тогда как грамотрицательные бациллы также часто встречаются в детских отделениях интенсивной терапии [1], [2]. Правосторонний эндокардит может возникнуть при наличии внутривенных катетеров; следовательно, микроорганизмы, переносимые кровотоком, попадают в правую часть сердца, потенциально вызывая ИЭ при ранее существовавшем небактериальном тромботическом эндокардите, который вызывается центральным катетером и служит отличным очагом для последующей бактериальной или грибковой колонизации у пациента с бактериемией или фунгемией. [1].В двух из трех наших случаев были обнаружены оппортунистические организмы, связанные с окружающей средой здравоохранения во время их поступления в ОИТ
Признаки и симптомы ИЭ могут быть расплывчатыми, особенно у новорожденных и маленьких детей, которые не демонстрируют типичную картину критериев Дьюка [6]. Это делает диагностику ИЭ у этой группы пациентов сложной задачей, требующей высокого индекса подозрительности. Еще одна дилемма, касающаяся лечения, — это назначение антибиотиков широкого спектра действия на ранней стадии после постановки диагноза, а затем корректировка и сужение выбора антибиотиков на основе результатов посева и антибиотикограммы.Известно, что лечение бактериального ИЭ требует 4–6 недель приема антибиотиков. Необходимая продолжительность может быть даже больше в случае грибкового эндокардита. Хирургические показания и сроки хирургического вмешательства при ИЭ являются предметом обсуждения [7]. Важно рассмотреть возможность раннего вмешательства при активном ИЭ, чтобы избежать прогрессирования до острой трудноизлечимой сердечной недостаточности, необратимых структурных повреждений, постоянного источника бактериемии и системных инфекционных тромбоэмболических явлений [7].
В 2015 году Европейское общество кардиологов опубликовало рекомендации по профилактике и лечению ИЭ [2].Показания к операции в этих рекомендациях очень похожи на рекомендации Американского колледжа кардиологов / Американской кардиологической ассоциации от 2015 года [1]. Совсем недавно, в 2016 году, Американская ассоциация торакальной хирургии опубликовала краткое изложение хирургических показаний к ИЭ, которые включают дисфункцию клапана, приводящую к симптомам сердечной недостаточности, левосторонний ИЭ, вызванный Staphylococcus aureus , грибковыми или другими высокоустойчивыми микроорганизмами. ИЭ, осложненный блокадой сердца, абсцессом кольца или аорты или деструктивными проникающими поражениями, свидетельствует о стойкой инфекции через 5-7 дней после начала соответствующей антибактериальной терапии [8].
В двух наших случаях были разные организмы, оба из которых были зарегистрированы как общие организмы ИЭ в естественном сердце. Грибковый эндокардит у детей обычно вызывается видами Candida . С увеличением использования центрального венозного катетера у младенцев и детей, а также инфузий с высокой концентрацией глюкозы и гиперпитания, иногда обнаруживались инфекции Candida настенного или клапанного эндокарда. Грибковый эндокардит часто связан с крупной рыхлой растительностью.Фрагментация растительности и осыпание системных инфицированных тромбов из растений может вызвать серьезные местные или экстракардиальные осложнения, такие как прогрессирующая клапанная дисфункция, дисфункция миокарда и перианнулярное распространение инфекции с образованием местного абсцесса. Также могут возникать экстракардиальные осложнения, такие как неврологический визг, инсульт и эмболизация. Европейские руководящие принципы рекомендуют амфотерицин B с флуцитозином или без него или эхинокандин в высоких дозах; тем не менее, они не указали продолжительность лечения, рекомендованного для длительной супрессивной терапии пероральным флуконазолом, тогда как в американских руководствах длительная супрессивная терапия упоминалась только в тех случаях, когда не проводилось кардиохирургическое вмешательство [1].За исключением новорожденных с настенным эндокардитом и иногда детей более старшего возраста, медикаментозное лечение грибкового ИЭ обычно безуспешно, и требуется хирургическое вмешательство в сочетании с противогрибковыми препаратами [1].
Наш первый случай был осложнен обструкцией LPA после начального регресса TV-массы при введении антибиотиков. Однако большой фрагмент был отделен и эмболизирован в LPA, что привело к значительной обструкции. Эмболические осложнения могут возникать в 30% случаев [1]. Многочисленные исследования на взрослых показали повышенный риск эмболизации, когда растительность превышает 10 мм, что указывает на роль раннего хирургического вмешательства в тех случаях, когда растительность настолько велика.Недавно это открытие было подтверждено педиатрическим исследованием [1]. Показания к хирургическому удалению, основанные на размере опухоли, остаются предметом споров у недоношенных детей с низкой массой тела. Расположение растительности также может быть фактором риска. Левосторонние поражения считаются риском системной эмболизации. Определенные организмы, а именно Staphylococci , Pneumococci и грибы, также несут более высокий риск эмболизации [1].
Тромбоэмболия легочной артерии — серьезное осложнение ИЭ правого желудочка.Hejna et al. [9] сообщили о взрослом случае внезапной смерти наркомана, вводившего внутривенные наркотики, и патологоанатомическое исследование показало полное разрушение передней и перегородочной створок ТВ и желтое образование со слегка зернистой поверхностью, вклинившейся в обе ветви легочной артерии. вызывая полную обструкцию, похожую на седловидную тромбоэмболию легочной артерии.
Многочисленные инфаркты легких, вызванные небольшими эмболами, могут быть связаны с правосторонним бактериальным эндокардитом. Mansour et al.[10] сообщили о 11-летнем ребенке, у которого был ИЭ, осложненный небольшими септическими легочными эмболами, происходящими из трехстворчатой вегетации. Легочная эмболия была диагностирована с помощью компьютерной томографии через 25 дней после начала приема антибиотика и не нуждалась в хирургическом лечении. Тем не менее, в другом исследовании сообщалось о 4-летней девочке с дефектом межжелудочковой перегородки, которая получала кортикостероиды для лечения аутоиммунной гемолитической анемии; она также продемонстрировала признаки ЭИ с растительностью, простирающейся от ТВ к легочному клапану, вызывая стеноз и регургитацию легочного клапана.Ей была сделана хирургическая резекция, но у нее был послеоперационный рецидив, приведший к массивной тромбоэмболии легочной артерии и смерти [11].
И европейские, и американские руководства не включали риск эмболизации в показания к хирургическому вмешательству, а европейская группа отметила, что точная роль раннего хирургического вмешательства в предотвращении эмболических событий остается спорной [2]. Некоторые показания к неотложной операции по предотвращению эмболизации включают левостороннее поражение с тяжелым стенозом или регургитацией, трудноизлечимой сердечной недостаточностью или очень большой вегетацией> 30 мм.
Хотя в нашем первом случае была большая растительность (> 10 мм), мы изначально решили подождать операции и дать больше времени для лечения, поскольку мы отметили некоторое раннее уменьшение размеров с началом приема антибиотиков. Однако эмболизация в легочную артерию произошла во время регресса в размере, и у пациента была десатурация со значительной обструкцией LPA большой растительностью, что потребовало немедленного хирургического удаления.
В настоящее время из-за отсутствия педиатрических данных, свидетельствующих в пользу профилактического хирургического вмешательства для предотвращения первичных тромбоэмболических событий, решение медицинских работников является трудным и индивидуальным.Прогнозирование риска эмболизации отдельного пациента остается сложной задачей из-за противоречивых данных, опубликованных в отношении конкретной ценности эхокардиографического определения размера растительности или конкретного местоположения в качестве предикторов [1], [2].
Во втором случае решение было принято раньше, чем через две недели после поступления пациента, принимая во внимание естественную историю грибкового эндокардита и сложность его лечения только медикаментозным лечением. Кроме того, в третьем случае для проведения хирургического вмешательства потребовалось больше времени, в основном из-за размера пациента и лечения, проводимого в периферийной больнице.В конце концов, хирургическое вмешательство было решено, когда начали проявляться гемодинамические эффекты с признаками обструкции притока и отсутствия регресса в размере при наличии стойкой кандидемии.
Хотя Shamszad et al. [12] упомянули, что поражения, расположенные в левом сердце, больше всего нуждались в хирургическом вмешательстве, во всех наших трех случаях пораженным местом было правое сердце.
ИЭ — болезнь, требующая совместного подхода. Европейские руководящие принципы устанавливают критерии для перевода пациента в «бригаду по лечению эндокардита» [2].Этим пациентам рекомендуются ранние консультации в инфекционных, кардиологических и кардиохирургических службах. Также важно определить группы пациентов, которые подвержены более высокому риску ИЭ или его осложнений. Несколько факторов предрасполагают детей с ИЭ к потенциально опасным для жизни осложнениям, которые могут потребовать раннего хирургического вмешательства [1].
Опубликованные в настоящее время рекомендации по хирургическому лечению ИЭ у детей в основном экстраполируются из опыта взрослых. Показания к сердечно-сосудистой хирургии при детской ИЭ иногда ясны.Однако во многих случаях показания следует оценивать индивидуально в каждом конкретном случае.
Детский инфекционный эндокардит EMRA
Детский инфекционный эндокардит (ИЭ) — это сложная с диагностической точки зрения инфекция у детей, поскольку она часто проявляется расплывчатыми или едва различимыми признаками и симптомами. При подозрении необходимы значительные ресурсы больницы и специализированная поддержка. Хотя заболеваемость редка, если ее не заметить, болезнь связана со значительной заболеваемостью и смертностью.Поэтому крайне важно, чтобы врачи неотложной помощи понимали уникальные особенности ИЭ в педиатрической популяции, а также соответствующие диагностические инструменты и самые современные рекомендации по лечению.
Эпидемиология
В целом ИЭ у детей встречается реже, чем у взрослых. Удивительно, но заболеваемость педиатрическим ИЭ в последние годы действительно увеличилась, в основном из-за улучшения выживаемости среди детей с врожденными пороками сердца (ВПС) в развитых странах, несмотря на значительное снижение ревматической болезни сердца. 1 Исследования показали, что от 50% до 90% педиатрических пациентов с эндокардитом в анамнезе имели ИБС и / или восстановление сердца. 2,3,4
Кроме того, более сложное ведение пациентов в отделениях неонатальной и педиатрической интенсивной терапии увеличило количество педиатрических пациентов, у которых развивается катетерный ИЭ с или без сопутствующей ИБС. 1 Состояния с ослабленным иммунитетом с сопутствующими онкологическими, иммунологическими или инфекционными заболеваниями подвергают детей старшего возраста риску, в то время как факторы образа жизни, такие как злоупотребление внутривенными наркотиками, играют все более важную роль в подростках. 5
Патофизиология
Инфекционный эндокардит возникает, когда поврежденный эндотелий или ткань клапана создает среду, в которой откладываются тромбоциты и фибрин, образуя очаг, в котором организмы могут прилипать и образовывать инфицированную растительность. 1
Как и взрослые, грамположительные бактерии составляют большинство организмов, ответственных за ИЭ у детей. Сюда входят стрептококки группы viridans, стафилококки (наиболее опасно устойчивые к метициллину S.aureus ) и enteroccoci.
Реже грамотрицательные виды, такие как группа HACEK (виды Hemophilus, Aggregatibacter, Cardiobacterium, Eikenella и Kingella ), участвуют в патогенезе ИЭ. Грибковый эндокардит обычно вызывается видами Candida и менее вероятно Aspergillus . 6-7
Культурально-отрицательный ИЭ может встречаться у 5-10% детей. Этот диагноз ставится, когда у пациента есть клинические признаки ИЭ, но постоянно отрицательные посевы крови. 1 Это происходит чаще, когда HACEK и грибковые организмы являются причинной этиологией, поскольку их трудно выращивать на стандартной питательной среде. Это также может произойти в условиях предыдущего использования антибиотиков или когда организмы остаются изолированными внутри растительности. 7
Диагностика
Эндокардит можно разделить на молниеносные (острые) и подострые процессы. Эти классификации относятся как к скорости, так и к тяжести прогрессирования заболевания.Фульминантный эндокардит, например, может развиваться от нескольких дней до недель и часто усугубляется распределительным и кардиогенным шоком. Немедленно показаны быстрая оценка, стабилизация и интенсивная терапия.
Однако в большинстве случаев детский эндокардит протекает подостро. Признаки и симптомы часто расплывчаты и неспецифичны и включают субфебрильную лихорадку, недомогание, миалгии, артралгии и головные боли. 6,7 При осмотре может выслушиваться новый или изменяющийся шум в сердце. Конечно, наличие в анамнезе ИБС, предшествующих кардиохирургических операций, предшествующего постоянного катетера, протезного материала и / или предшествующего повреждения клапана должно усилить подозрение.
Несколько исследований подтвердили, что критерии Дьюка по-прежнему превосходят другие критерии диагностики ИЭ у детей. Напоминаем, что в этих критериях используются клинические, микробиологические и эхокардиографические компоненты, и для постановки диагноза требуется сочетание основных и / или второстепенных критериев. Важные отличия включают тот факт, что экстракардиальные проявления ИЭ (например, поражения Джейнвея, узлы Ослера) менее распространены у детей, чем у взрослых. Как правило, рекомендуется брать 3 культуры крови с интервалом не менее часа в первый день, а затем еще 2 культуры на второй день, если роста нет. 1
Эндокардит по-прежнему сложно диагностировать, особенно в отделении неотложной помощи. Ограниченные диагностические критерии на момент предъявления и отсутствие эхокардиографических данных вносят вклад в диагностическую дилемму. Кроме того, лабораторное обследование в отделении неотложной помощи часто бывает безрезультатным и неспецифическим. 1,5,7 В результате многим пациентам изначально ставится неправильный диагноз, прежде чем они будут правильно идентифицированы при повторном посещении. 8 Ультразвук в месте оказания медицинской помощи может ускорить диагностику и лечение.Комфорт и уровень квалификации врача-ультразвукового врача, а также определение вегетации или нового повреждения клапана — все это факторы, которые способствуют ранней и точной диагностике. 9
Лечение и осложнения
В целом принципы лечения ИЭ у детей аналогичны принципам лечения ИЭ у взрослых. При подозрении на эндокардит необходим мультидисциплинарный подход. Может потребоваться помощь кардиолога, инфекциониста или отделения интенсивной терапии.Эмпирические антибиотики следует начинать после получения культур. По мере того, как посевы видоизменяются, переход к таргетной терапии, основанной на чувствительности, будет уместен. Прием антибиотиков обычно продолжается в течение 4-6 недель.
Факторы, предрасполагающие к развитию осложнений, включают тип организма, расположение и размер растительности, а также наличие других сопутствующих заболеваний, особенно сердечных заболеваний. Тяжелая сердечная недостаточность, неконтролируемая инфекция, эндокардит протеза клапана или шунта, а также эмболические события могут потребовать хирургического вмешательства. 6 Кроме того, могут возникать тяжелые неврологические проявления с распространением бактерий в мозг. Из-за этих типов осложнений эндокардит вызывает значительную смертность от 6 до 14%. 2,5,7
Заключение
Детский ИЭ — редкое, но опасное заболевание, диагностика которого требует высокого уровня подозрений. Поскольку он часто проявляется подострыми формами и у ребенка с недифференцированной лихорадкой, необходимо обязательно узнать о предшествующем анамнезе ИБС, кардиохирургических операциях или анамнезе установки постоянного катетера у ранее тяжелобольного ребенка.Хотя диагноз не всегда ставится в отделении неотложной помощи, соответствующий уровень беспокойства является ключом к предотвращению заболеваемости и смертности.
Список литературы
- Ferrieri P, Gewitz MH, Gerber MA et al. Особенности инфекционного эндокардита в детском возрасте. Педиатрия . 109 (5): 931-943. 2002.
- Day MD, Говро К., Шульман С. и др.: Характеристики детей, госпитализированных с инфекционным эндокардитом. Тираж . 119: 865-870.2009.
- Мартин JM, Neches WH, Wald ER. Инфекционный эндокардит: 35 лет опыта в детской больнице. Clin Infect Dis. 24: 669–675. 1997.
- Ценг В., Чиу С., Шао П. и др.: Изменение спектра инфекционного эндокардита у детей: 30-летний опыт работы в центре третичной медицинской помощи на Тайване. Педиатр Инфекция Дис. J . 33: 467-71. 2014.
- Tsai WT. «Воспалительные и инфекционные болезни сердца». В Strange and Scahfermeyer Pediatric Emergency Medicine, 4 th Edition .p274-277. Макгроу Хилл. Нью-Йорк. 2015.
- Брэгг Л., Альварес А. Эндокардит. Обзор педиатрии . 2014; 35 (4): 162-167.
- Хойер А и Силбербак М: Инфекционный эндокардит. Обзор педиатрии 26 (11): 394-400. 2005.
- Левена, С. Инфекционный эндокардит: опыт педиатрического отделения неотложной помощи. J Детский педиатр . 41: 269-272. 2005.
- Cheng AB, Levine DA, Tsung JW, Phoon CK. Диагностика детского инфекционного эндокардита врачом неотложной помощи с помощью эхокардиографии в месте оказания медицинской помощи. Am J Emerg Med. 2012; 30 (2): 386e1-386e3.
Инфекционный эндокардит у детей: сохранение естественного клапана часто возможно, несмотря на запущенное клиническое заболевание | Европейский журнал кардио-торакальной хирургии
Аннотация
Предыстория: Недавние сообщения, описывающие хирургический опыт при ИЭ в детстве, немногочисленны. Мы стремились определить индивидуальные особенности пациента и их влияние на исход для детей с инфекционным эндокардитом (ИЭ), перенесших хирургическое вмешательство.Поэтому мы рассмотрели все случаи ИЭ с подтвержденным посевом, направленных на хирургическое вмешательство в нашем учреждении за последние три десятилетия. Методы: Из 15 124 сердечно-сосудистых хирургических вмешательств, проведенных в период с 1978 по 2007 год в нашем учреждении детям в возрасте до 18 лет, только 30 (0,2%) были выполнены для первичного диагноза ИЭ. Все 30 детей прошли обзор карт и ретроспективный анализ риска и риска. Результаты: Средний возраст пациентов составлял 9,8 года (от 10 до 17 недель).5 лет). Основные врожденные пороки сердца присутствовали у 22 (77%), а предшествующее внутрисердечное восстановление — у 9 (30%). Септическая эмболия возникла у 13 (46%), а необратимые инсульты — у 4 (14%). Streptococcus viridans и Staphylococcus aureus были преобладающими организмами. S. viridans был связан с лежащими в основе врожденными поражениями ( p ≪ 0,01). S. aureus был связан с образованием абсцесса ( p ≪ 0,03), клиническим сепсисом ( p 0.04), острое ухудшение ( p 0,01), длительная госпитализация ( p 0,01) и смерть ( p 0,01). Аортальный, митральный и трикуспидальный клапаны вовлекались с одинаковой частотой, чаще, чем выводной тракт правого желудочка. Два клапана были задействованы на 30%. Родной клапан сохранился при эксплуатации в 22 (73% случаев). Однофакторные предикторы замены клапана включали увеличенное утолщение створки ( p 0,01) и возникновение септической эмболизации ( p = 0.02), тогда как умеренная / тяжелая клапанная регургитация не была значительной. Пятилетняя свобода от связанной с ИЭ смерти и повторного вмешательства составила 84% и 80% соответственно. При последнем обследовании 96% пациентов относятся к NHYA I. Выводы: У детей, перенесших операцию по поводу инфекционного эндокардита, часто наблюдается запущенное заболевание с эмболическими осложнениями и поражением двойного клапана. Однако часто возможно сохранение родного клапана. О необходимости замены клапана говорят утолщение створки и эмболизация.Несмотря на запущенную патологию, выживаемость и функциональные результаты благоприятны.
1 Введение
Улучшения в диагностике и лечении инфекционного эндокардита (ИЭ) были нивелированы сдвигами как во взрослых, так и в педиатрических группах риска и возбудителях [1]. Детский ИЭ раньше был лишь редким осложнением ревматической болезни сердца. Однако растущее число пациентов, живущих с хирургическим лечением врожденных поражений, в настоящее время составляет большинство пациентов, у которых развился ИЭ в детстве [2].Стафилококки также становятся все более распространенными из-за их связи с инвазивными процедурами и пристрастием к протезному материалу [1]. Таким образом, инфекционный эндокардит в детском возрасте может стать все более распространенной и сложной хирургической проблемой в сердечно-сосудистых отделениях.
Недавние сообщения, описывающие хирургический опыт при ИЭ в детстве, немногочисленны [3–6]. Поэтому мы решили рассмотреть все случаи ИЭ с подтвержденным посевом, направленных на хирургическое вмешательство в нашем учреждении за последние три десятилетия.В частности, мы стремились охарактеризовать современный профиль ИЭ, требующего хирургического вмешательства, и определить особенности пациента, которые влияют на хирургическое лечение, необходимость замены клапана и последующий результат.
2 Пациенты и методы
Все 30 детей (в возрасте до 18 лет), которые были направлены на хирургическое вмешательство с подтвержденным посевом ИЭ в период с 1978 по 2006 гг. В нашем учреждении, были проанализированы с помощью ретроспективного обзора карт.Эти случаи составляют 0,2% от общего числа 15 124 сердечно-сосудистых хирургических вмешательств, выполненных в нашем учреждении за этот период. Было запрошено одобрение институционального совета по этике, но индивидуальное согласие пациента не было получено из-за исторического характера, и с пациентами не связывались напрямую, поэтому был получен отказ от согласия. Срок наблюдения составил в среднем 5,1 года после операции, что составляет 130 пациенто-лет.
Данные были получены из медицинских карт учреждения с подробным описанием демографических данных пациентов, предоперационной эхокардиографии и ангиографии, оперативных процедур, последующих посещений клиники и отчетов о вскрытии трупа при наступлении смерти.Данные были введены и проанализированы с использованием статистического программного обеспечения SAS, версия 9.1 (Институт SAS, Кэри, Северная Каролина). Данные описываются как частоты, медианы с диапазонами, средние значения со стандартными отклонениями или отношения шансов / рисков с 95% доверительным интервалом (ДИ), в зависимости от ситуации. Актуарные исходы, зависящие от времени, были рассчитаны с использованием принципов Каплана – Мейера. Для определения предикторов исхода был проведен одномерный анализ риска и опасности. В случае отсутствия данных рассчитывались средние значения и указывалась частота пропущенных данных.Значимость считалась p 0,05.
3 Результаты
3.1 Клиническая патология
Средний возраст на момент операции составлял 9,8 года (от 10 недель до 17,5 лет). Сопутствующие врожденные пороки сердца присутствовали в большинстве случаев (таблица 1), хотя в семи из них (23%) врожденные пороки сердца были случайной находкой, выявленной во время исследования ИЭ. Еще один ребенок со структурно нормальным сердцем имел иммуносупрессию после недавней трансплантации костного мозга.Таким образом, у шести детей (20%) не было известных предрасполагающих факторов.
Таблица 1
Частота ассоциированных сердечно-сосудистых и несердечно-сосудистых аномалий
Таблица 1
Частота связанных сердечно-сосудистых и несердечно-сосудистых аномалий
Предыдущая стернотомия была выполнена у девяти (30%), еще у трех был проведен открытый проток лигирование или восстановление коарктации с помощью торакотомии (таблица 2). Протезный материал (кроме швов) присутствовал у восьми (27%) на момент постановки диагноза.
Таблица 2
Распространенность и характер предыдущих хирургических процедур
Таблица 2
Распространенность и характер предыдущих хирургических процедур
Преобладающими клиническими признаками при обращении были конституциональные (летаргия, 80%; недомогание, 79%) и неспецифические особенности системного сепсиса (лихорадка 90%). Физические признаки, связанные с ИЭ у взрослых, были необычными (осколочные кровоизлияния, 20%; удары ногтями, 4%; ни у одного ребенка не было узлов Ослера или поражений Джейнвей).Более 90% имели повышенные маркеры воспаления или лейкоцитоз, анемия присутствовала у 79%. Что особенно важно для хирургического вмешательства с использованием искусственного кровообращения, у 19% пациентов наблюдалась воспалительная тромбоцитопения.
Возбудителем неизменно являлся Streptococcus viridans (37%), Staphylococcus aureus (40%) или Staphylococcus epidermidis (17%). S. viridans был особенно связан с наличием основных врожденных пороков сердца (отношение шансов 12.8 (1,1–139,5), p 0,01) и более короткой общей госпитализации (отношение шансов 0,87 (95% ДИ 0,78–0,98), p 0,01). Напротив, S. aureus был предиктором более агрессивного клинико-патологического заболевания, более частых послеоперационных осложнений, замедленного выздоровления и смерти (Таблица 3). Однако ни один из организмов не мог предсказать тип хирургической процедуры, предпринятой впоследствии, включая необходимость замены клапана или корня.
Таблица 3
Связь с Staphylococcus aureus инфекционным эндокардитом
Таблица 3
Связь с Staphylococcus aureus инфекционным эндокардитом
Примерно у половины (46%) пациентов в этой серии клиническая эмболизация произошла до операции.Эмболизация головного мозга произошла до операции у четырех (14%) детей, все из которых страдали стойким неврологическим дефицитом. Дополнительные места системной эмболизации включали подколенную артерию, двустороннюю поверхностную бедренную артерию, печень селезенки и двусторонние инфаркты почек. Четверо (14%) пострадали от тромбоэмболии легочной артерии. Двум пациентам была выполнена формальная хирургическая эмболэктомия. У первого из них была устойчивая двусторонняя эмболизация поверхностной бедренной артерии. Хотя тромб был восстановлен, пульс не мог быть восстановлен, и пациент в конечном итоге умер от полиорганной недостаточности.У второго пациента произошла значительная тромбоэмболия легочной артерии из-за разрастания большого трехстворчатого клапана, и ему была выполнена неосложненная эмболэктомия легочной артерии в качестве единственной хирургической процедуры.
Аортальный, митральный и трикуспидальный клапаны были первичным очагом инфекции с одинаковой частотой (Таблица 4). Легочный клапан или канал оттока правого желудочка поражались реже. Два или более клапана были задействованы у трети пациентов, а предоперационная чувствительность эхокардиографии для выявления этих случаев составила 90% (9 из 10 случаев).В единичном случае был инфицирован материал пластыря для дефекта межжелудочковой перегородки (ДМЖП) (Dacron ® ) и клапанный аппарат. Чувствительность и специфичность трансторакальной эхокардиографии для оценки образования абсцесса была низкой: было диагностировано пять, из которых два были ложноположительными. Еще два абсцесса были обнаружены при операции у детей, перенесших предоперационную трансторакальную эхокардиографию.
Таблица 4
Предоперационная оценка поражения сердца с эндокардитом
Таблица 4
Предоперационная оценка поражения сердца с эндокардитом
Функция желудочков неизменно сохранялась, хотя значительная (умеренная или тяжелая) клапанная недостаточность была обычным явлением.Следовательно, тяжелая клапанная недостаточность с острым кардиогенным шоком или без него была наиболее частым показанием к хирургическому вмешательству (таблица 5). Интересно, что наличие дефекта перегородки защищает от острого гемодинамического коллапса ( p ≪ 0,01), возможно, за счет разгрузки желудочка перед лицом тяжелой клапанной регургитации.
Таблица 5
Таблица 5
3.2 Хирургия
Один пациент с S.При IE трикуспидального клапана aureus развился большой гнойный (положительный по культуре) перикардиальный выпот, и был проведен открытый дренаж в качестве изолированной процедуры, которая прошла без осложнений. Всем остальным пациентам была проведена внутрисердечная операция (таблица 6).
Таблица 6
Операции, выполняемые во время операции
Таблица 6
Операции, проводимые во время операции
У четырех детей, перенесших предоперационные нарушения мозгового кровообращения (CVA), решение об операции было вызвано продолжающейся системной эмболизацией.Средний интервал от CVA до хирургического вмешательства с использованием искусственного кровообращения составил 6 дней (от 2 дней до 2 недель). Всем была сделана предоперационная компьютерная томография для подтверждения инфаркта мозга. У одного ребенка был подтвержденный геморрагический инфаркт достаточно большого размера, чтобы предотвратить предоперационную антикоагулянтную терапию. Еще один пятый ребенок перенес операцию по поводу эндокардита через 6 недель после субарахноидального кровоизлияния, предшествовавшего восстановлению грибковой базилярной аневризмы. Ни у одного из этих пяти детей не наблюдалось прогрессирования церебрального повреждения, связанного с искусственным кровообращением, но у всех наблюдались стойкие неврологические последствия при последнем наблюдении.
Родной клапан сохранился у трех четвертей детей и всех детей в возрасте до 11 лет. Из семи пациентов, которым была необходима замена клапана (средний возраст 14 лет), механическое устройство было имплантировано четырем. Предоперационные особенности, которые были связаны с необходимостью замены клапана, включали увеличенное утолщение створки (отношение шансов 7,1 (1,1–45,9), p 0,01) и возникновение эмболизации (отношение шансов 12,7 (1,8–91,1), p = 0,02).Серьезность клапанной регургитации сама по себе не была значимым предиктором в этой серии.
3.3 Восстановление и выживание
3.3.1 Ранняя смертность
Всем пациентам был назначен послеоперационный курс антибиотиков на срок от 2 до 24 недель. Среднее время пребывания в отделении интенсивной терапии составляло 4 дня (диапазон 1–88), а среднее время госпитализации после интенсивной терапии — 6 дней (диапазон 2–36). Серьезные послеоперационные осложнения возникли у 13 (43%) детей, особенно у S.aureus (таблица 3). Осложнения включали нарушение ритма (3), кровотечение (2), абсцесс легкого (1), клапанную регургитацию (2) и полиорганную недостаточность (5).
Было три (10%) случаев ранней смерти, связанных с эпизодом ИЭ. Первым пациентом был 13-летний мальчик с длительной историей миелодисплазии, которому в прошлом году была проведена трансплантация костного мозга, вследствие чего у него был ослаблен иммунитет. У нее развился стафилококковый ИЭ клапана аорты с абсцессом корня, по поводу которого было выполнено композитное протезирование корня аорты.После длительного пребывания в реанимации ее выздоровление осложнилось грибковой инфекцией протеза, в результате чего она умерла.
Во втором случае у 17-летнего мальчика с задержкой в развитии, но структурно нормальным сердцем развился S. aureus IE митрального клапана. Несмотря на замену митрального клапана, у него сохранялся системный сепсис, и у него появились признаки вегетации трехстворчатого клапана, пневмонии и периферической септической эмболии. Его состояние продолжало ухудшаться, и он умер от полиорганной недостаточности.
Третья ранняя смерть произошла от 9-летней девочки с синдромом Дауна, у которой ранее был произведен ремонт дефекта межжелудочковой перегородки. Она повторно обратилась с жалобами на сепсис и септическую тромбоэмболию легочной артерии. При операции требовалась пластика перегородки трехстворчатого клапана с перикардом крупного рогатого скота. К сожалению, у нее развилась тяжелая послеоперационная регургитация трикуспидального клапана, и через 3 дня потребовалась повторная операция по замене трикуспидального клапана. Она не оправилась от установленной полиорганной недостаточности.
3.3.2 Поздняя смертность
Впоследствии умерли еще четыре пациента (рис. 1а).
), ни одна из которых напрямую не связана с эпизодом ИЭ (отсутствие смерти от эндокардита 84% ± 6 через 5 лет). Однофакторные факторы риска смерти от всех причин включали установленный предоперационный гемодинамический шок, поражение митрального клапана и ИЭ двойного клапана (таблица 7). Известно, что из выживших 22 (96%) физически активны, не имеют сердечных симптомов и относятся к субъективной функциональной классификации NYHA I.
Рис. 1
(a) Выживаемость после хирургического вмешательства ( n = 30) по поводу инфекционного эндокардита, стратифицированная в зависимости от того, подвергся ли ребенок замене клапана или нет. Пятилетняя выживаемость составила 82% ± 8 или 41% ± 19 в зависимости от того, был заменен клапан или нет соответственно ( p = 0,05). Сплошная линия представляет параметрическое определение непрерывных точечных оценок, а пунктирная линия охватывает 70% доверительные интервалы.(б) Отсутствие повторной операции (в процентах) после хирургического вмешательства по поводу инфекционного эндокардита. Сплошная линия представляет оценки Каплана – Мейера, а пунктирная линия охватывает 70% доверительные интервалы.
Рис. 1
(a) Выживаемость после хирургического вмешательства ( n = 30) по поводу инфекционного эндокардита, стратифицированная в зависимости от того, подвергся ли ребенок замене клапана или нет. Пятилетняя выживаемость составила 82% ± 8 или 41% ± 19 в зависимости от того, был заменен клапан или нет соответственно ( p = 0.05). Сплошная линия представляет параметрическое определение непрерывных точечных оценок, а пунктирная линия охватывает 70% доверительные интервалы. (б) Отсутствие повторной операции (в процентах) после хирургического вмешательства по поводу инфекционного эндокардита. Сплошная линия представляет оценки Каплана – Мейера, а пунктирная линия охватывает 70% доверительные интервалы.
Таблица 7
Одномерные предикторы смертности от всех причин
Таблица 7
Одномерные предикторы смертности от всех причин
Впоследствии пятерым детям была проведена повторная операция, и у четырех ( Инжир.1б). Три повторные операции заключались в замене отремонтированного клапана с регургитацией, а одна заключалась в имплантации протеза после ранее проведенной операции на трикуспидальном клапане.
4 Обсуждение
В целом, результаты после ИЭ не отразили улучшений в хирургической, антимикробной и интенсивной терапии за последние 50 лет [7]. Причины этого проистекают из постепенных изменений в уязвимых популяциях пациентов и возбудителей болезней. У взрослых бремя ревматической болезни сердца сменилось старением населения с ростом числа имплантатов протезных клапанов и трансвенозных кардиостимуляторов.Кроме того, успехи в антимикробной терапии были нивелированы увеличением распространенности стафилококковых инфекций, осложняющих интервенционные процедуры. Виды стрептококков исторически составляли 60–80% всех случаев, в которых современные антибиотики, как ожидается, излечивают более чем в 90% случаев [1]. Однако к 1990-м годам S. aureus был зарегистрирован как единственный наиболее распространенный патоген, вызывающий ИЭ во всех возрастных группах [1].
Популяция детей из группы риска также претерпела важные изменения [6,8].Немногим более 50 лет назад паллиативный системно-легочный шунт был единственным вариантом лечения большинства врожденных пороков сердца. Напротив, почти всем детям теперь могут быть предложены варианты долгосрочного корректирующего или паллиативного хирургического лечения. Часто эти стратегии включают реконструкцию с использованием протезного материала и повторные вмешательства. Хотя в настоящее время сообщаемая частота ИЭ у пациентов с врожденным пороком сердца составляет всего 1% [2], общая частота, вероятно, будет расти параллельно с ростом детской и взрослой популяции с восстановленными врожденными пороками сердца.В этой серии 77% случаев были связаны с основным врожденным пороком сердца, тогда как этот показатель может достигать 90% [4].
Как и у взрослых, этиологические организмы также могут сместиться в сторону тех, у кого есть склонность к протезному материалу ( S. epidermidis ) и повторным вмешательствам ( S. aureus ). По крайней мере, 40% случаев ИЭ, возникающего при восстановленном врожденном пороке сердца, в настоящее время вызваны видами стафилококков [2]. Однако примечательно, что до 20% наших серий произошли у детей без известных предрасполагающих факторов, и что у пяти из этих шести детей количество микроорганизмов составляло S.aureus . Это подчеркивает потенциальную угрозу этого организма даже для пациентов с нормальным строением сердца.
Риск ИЭ при врожденных пороках сердца тесно связан с аномальными внутрисердечными шунтами и ускорением кровотока. До хирургического вмешательства по поводу врожденного порока сердца ИЭ чаще всего встречается у пациентов с дефектами межжелудочковой перегородки [2]. После вмешательства врожденный стеноз аорты, атрезия легочной артерии или тетралогия Фалло с шунтом системно-легочной артерии связаны с самым высоким зарегистрированным риском развития ИЭ.Каналы правого желудочка и легочной артерии также связаны с умеренно высоким риском. Напротив, анатомически исправленные поражения, успешно вылеченная транспозиция магистральных артерий, дефекты межпредсердной перегородки, дефекты межжелудочковой перегородки (без остаточного дефекта) и открытый артериальный проток связаны с низким риском. Сообщается, что инфекционный эндокардит, возникающий после восстановления дефекта межжелудочковой перегородки, всегда связан с остаточной утечкой. Это был наш опыт с одним ребенком с инфицированным материалом пластыря дефекта межжелудочковой перегородки.
Наш опыт включает высокую частоту поражения двойного клапана, эмболизацию, клинические признаки тяжелого системного сепсиса и тяжелую клапанную недостаточность. Эти особенности предполагают запущенную болезнь. Невозможно определить, связано ли это преимущественно с вирулентностью организмов в уязвимой популяции или иным образом с поздним обращением в хирургические службы. Также трудно делать выводы о методах лечения, не понимая численного знаменателя всех детей с диагнозом ИЭ за тот же период.Учитывая, что в этой хирургической серии повторно представлены 0,2% от общего числа пациентов нашей службы, в 3–4 раза больше детей могло лечиться с медицинской точки зрения [2,6,9], если показатели ИЭ у детей, о которых сообщают другие, являются точными. Распространенное болезненное состояние во время операции может быть результатом коварного проявления и отсутствия определяющих признаков ИЭ у детей. Например, клинические проявления были преимущественно расплывчатыми и конституциональными, а не признаками, которые могли быть конкретно связаны с ИЭ.Особую тревогу вызывает очень высокий уровень системной эмболизации по сравнению с другими сериями [3–5], чего можно было бы избежать, если проявить большее клиническое подозрение или более раннее вмешательство.
Немногие другие центры сообщили о своем недавнем хирургическом опыте лечения инфекционного ИЭ у детей. За 27-летний период стаж группы Монро составил всего 16 детей [3]. Они сообщили о несколько более высоком уровне ИЭ протезных тканей (19%), аналогичном анатомическом распределении инфицированных клапанов, аналогичном уровне этиологических микроорганизмов и связанных врожденных пороках сердца в 69%.Интересно, что они описали несколько более высокую частоту перфорации створок, образования абсцесса или разрыва хорд, что может объяснить их потребность в замене клапана в 63% случаев [3].
Группа из Уругвая вместо этого сообщила о серии из 26 младенцев и детей, у которых нативный клапан сохранился у 72% [5], что более точно отражает наш опыт в данном документе. Хотя их госпитальная летальность была выше (19%), большинство смертей было связано с системным сепсисом, а не с хирургической стратегией лечения.Наконец, Horvath и его коллеги в 1989 году сообщили о небольшой группе из 11 детей, у 45% которых был заменен нативный клапан [4]. Они зарезервировали операцию только при неизлечимой застойной сердечной недостаточности, системной эмболии или стойком сепсисе и испытали раннюю смертность, аналогичную (9%) указанной здесь.
Ключевым выводом из нашего опыта является то, что родной клапан может быть сохранен при нескольких неблагоприятных клинических и патологических особенностях. Преимущества предотвращения замены клапана при ИЭ у взрослых были четко продемонстрированы [10], но сохранение собственного клапана особенно важно у детей.В частности, замена митрального клапана связана с высоким риском повторной замены (> 70% в 15 лет [11]) и повышенной смертностью [12], особенно у детей младшего возраста [13]. Ранее мы продемонстрировали, что возраст менее 2 лет и митральный протез менее 20 мм являются независимыми предикторами для более ранней повторной замены клапана [13], и риски еще выше для детей младшего возраста с кольцевыми размерами ≪16 мм [14] . В отличие от этого, санация и восстановление митрального клапана с использованием методов Карпентье обеспечивает отличную выживаемость на позднем этапе, отсутствие повторной операции и позднее функциональное состояние [15].Если необходима замена митрального клапана, это в некоторой степени обнадеживает, что поздняя функция, как сообщается, благоприятна и что соматический рост продолжается, так что протезы большего размера обычно могут быть имплантированы при повторной операции [13]. Результаты также приемлемы для механических клапанов, имплантированных в других положениях [16,17].
Вероятно, что более крупные исследуемые группы могут идентифицировать перфорацию створки и образование абсцесса как независимые факторы риска замены клапана. Однако, по нашему опыту, ни предоперационные эхокардиографические данные, ни обнаружение абсцесса во время операции не были сильно связаны с необходимостью замены клапана.Отчасти это связано с тем, что несколько замен клапанов потребовалось по причинам, не связанным с абсцессом. Кроме того, в одном подтвержденном абсцессе корня аорты нативный клапан был сохранен посредством хирургической обработки и ирригации. Корневые абсцессы у детей ранее были связаны со смертностью до 27% [18]. Напротив, все наши пациенты с подтвержденными абсцессами пережили ранний период, хотя один умер поздно, а одному потребовалась поздняя повторная операция.
В ранее опубликованных обзорах корневые абсцессы у детей неизменно связывались со стафилококковыми инфекциями [18].Тот факт, что три из пяти подтвержденных абсцессов в нашей серии были вторичными по отношению к S. viridans , подчеркивает агрессивный характер нестафилококковых инфекций. Тем не менее, S. aureus был связан с более агрессивным клиническим заболеванием, большей заболеваемостью и смертностью. Ни у одного из этих пациентов не было первичного грибкового ИЭ, хотя у одного ребенка в послеоперационном периоде развился грибковый сепсис, и он умер. Сообщаемая выживаемость после грибкового ИЭ остается низкой (немногим более 40% по сравнению с ± 20% в предыдущие эпохи) с высокой частотой рецидивов [19].
Сроки операции у детей с подтвержденной сердечно-сосудистой патологией вызывают серьезное беспокойство. Интуитивно рекомендуется более длительный интервал, особенно в контексте подтвержденного внутрипаренхиматозного кровоизлияния. Однако продолжающаяся системная эмболия обычно требует раннего вмешательства. Обнадеживает тот факт, что ни у одного из пациентов в этой серии не было прогрессирования церебрального повреждения во время операционного окна.
Этот отчет ограничен небольшим количеством субъектов и неизвестным популяционным знаменателем детей с диагнозом ИЭ в нашем учреждении в течение периода исследования.Тем не менее, он служит для того, чтобы подчеркнуть редкую природу этого состояния и тот факт, что его распространенность, вероятно, будет увеличиваться с ростом популяции детей и молодых людей, живущих с вылеченными или паллиативными врожденными пороками сердца. Повышенная клиническая подозрительность и улучшенные методы визуализации должны быть направлены на выполнение хирургического вмешательства до начала системной эмболизации и непоправимого повреждения клапанного аппарата. Замены клапана можно избежать в большинстве случаев, иногда даже при наличии кольцевого абсцесса.Сохранение собственного клапана должно привести к увеличению выживаемости на поздних сроках, отсутствию повторных операций и функциональным результатам.
Список литературы
[1],,,,,,,,,.
Изменение характеристик пациента и влияние на смертность при эндокардите
,
Arch Intern Med
,
2002
, vol.
162
(стр.
90
—
94
) [2],,.
Тридцатилетняя заболеваемость инфекционным эндокардитом после операций по поводу врожденного порока сердца
,
JAMA
,
1998
, vol.
279
(стр.
599
—
603
) [3],,.
Хирургия инфекционного клапанного эндокардита у детей
,
Eur J Cardiothorac Surg
,
1999
, vol.
16
(стр.
653
—
659
) [4],,,,,,.
Оперативное лечение инфекционного эндокардита у детей
,
Eur J Cardiothorac Surg
,
1989
, vol.
3
(стр.
26
—
32
) [5],,,,,,,.
Активный инфекционный эндокардит у младенцев и детского возраста: десятилетний обзор хирургической терапии
,
J Card Surg
,
1997
, vol.
12
(стр.
406
—
411
) [6],,.
Инфекционный эндокардит. 35 лет опыта в детской больнице
,
Clin Infect Dis
,
1997
, vol.
24
(стр.
669
—
675
) [7].
Оценка и оптимизация результатов хирургического лечения эндокардита
,
JAMA
,
2003
, vol.
290
(стр.
3250
—
3251
) [8].
Инфекционный эндокардит у детей
,
Pediatr Infect Dis J
,
1992
, vol.
11
(стр.
907
—
912
) [9],,,,.
Хирургическое вмешательство при инфекционном эндокардите в младенчестве и детстве
,
Ann Thorac Surg
,
1995
, vol.
60
(стр.
90
—
95
) [10],,,,,,.
Есть ли преимущества в восстановлении инфицированных митральных клапанов?
,
Ann Thorac Surg
,
1997
, т.
63
(стр.
1718
—
1724
) [11],,,,,,,,.
Результаты замены митрального клапана у детей: анализ конкурирующих рисков
,
J Thorac Cardiovasc Surg
,
2004
, vol.
128
(стр.
703
—
709
) [12],,,,,,.
Долгосрочная выживаемость после замены митрального клапана у детей в возрасте ≥5 лет: мультиинституциональное исследование
,
Circulation
,
2001
, vol.
104
(стр.
I143
—
147
) [13],,,,,.
Предикторы выживаемости, роста и функционального статуса протеза после механической замены митрального клапана у детей в возрасте ≥5 лет, мультиинституциональное исследование
,
Circulation
,
2003
, vol.
108
Доп. 1
(стр.
II174
—
II179
) [14],,.
Замена митрального клапана у детей: дополнительные факторы риска, влияющие на выживаемость и повторное вмешательство
,
J Heart Valve Dis
,
2005
, vol.
14
(стр.
158
—
165
) [15],,,,,,,,,.
Отдаленные результаты пластики митрального клапана при активном эндокардите
,
Circulation
,
2005
, vol.
111
(стр.
2532
—
2536
) [16],,,,,.
Среднесрочное наблюдение после установки механических клапанов у детей
,
Cardiol Young
,
2006
, vol.
16
(стр.
579
—
585
) [17],,.
Механическое протезирование аортального клапана: отдаленные результаты у детей
,
J Heart Valve Dis
,
2005
, vol.
14
(стр.
166
—
171
) [18],,,,.
Эндокардиальные абсцессы у детей: клинический случай и обзор литературы
,
Clin Infect Dis
,
1999
, vol.
29
(стр.
1478
—
1482
) [19],,,,.
Грибковый эндокардит: данные в мировой литературе, 1965–1995
,
Clin Infect Dis
,
2001
, vol.
32
(стр.
50
—
62
)
© 2008 Европейская ассоциация кардио-торакальной хирургии. Опубликовано Elsevier B.V.Все права защищены.
Европейская ассоциация кардио-торакальной хирургии
Случай инфекционного эндокардита у 3-летнего мужчины
Инфекционный эндокардит (ИЭ) возникает в результате бактериальной или грибковой инфекции и связан со значительной заболеваемостью и смертностью. Существует несколько известных факторов риска эндокардита, и 90% педиатрических случаев имеют основной структурный или врожденный порок сердца или протез клапана сердца.Литература по ИЭ у ранее здоровых детей относительно немногочисленна, а патогенез и основные факторы риска остаются в основном неизвестными. Нашим пациентом был трехлетний мужчина с уникальным проявлением ИЭ. Отсутствие у него структурных и врожденных факторов риска эндокардита потребовало дальнейшего обследования, а лабораторные исследования подтвердили недостаточность иммуноглобулина, что свидетельствует о первичном иммунодефиците (PAD). ЗПА проявляется повышенной восприимчивостью к инфекциям, обычно проявляющимся как рецидивирующая пневмония, менингит, септический артрит и средний отит.Педиатрические пациенты обычно имеют инфекции, но у 1 из 2000 пациентов есть ЗПА. Наш случай подчеркивает потенциальную необходимость дальнейшего исследования ЗПА у молодого пациента без известных факторов риска, у которого развивается необычная инфекция, такая как ИЭ.
1. Введение
ИЭ возникает в результате бактериальной или грибковой инфекции и ассоциируется со значительной заболеваемостью и смертностью. К факторам риска ИЭ относятся врожденные аномалии сердца и протезных клапанов [1, 2]. У пациентов с естественными клапанами и нормальной структурой сердца ИЭ был связан с кардиохирургическим вмешательством вследствие травмы и внутривенного введения наркотиков [3].Эндокардит редко встречается у людей со здоровым сердцем, примерно 8–10% случаев ИЭ у педиатрических пациентов возникают при отсутствии ранее существовавшего сердечного заболевания [4]. Имеется ограниченная литература по ИЭ у ранее здоровых детей, а патогенез и основные факторы риска в значительной степени неизвестны [5].
PAD — это широкая категория иммунодефицитов, которые могут возникать в результате дефектов в нескольких компонентах иммунной системы, включая дефекты B- и / или T-клеток, неадекватные или отсутствующие антитела.Выявлены различные расстройства в этой категории, включая Х-сцепленную агаммаглобулинемию (XLA), общий вариабельный иммунодефицит (CVID), дефицит IgA и аутосомно-рецессивную агаммаглобулинемию (ARA). Хотя каждое из этих расстройств имеет свой собственный уникальный генетический профиль и клиническую картину, пациенты с ЗПА часто обращаются с рецидивирующими и / или аномально тяжелыми инфекциями. Диагноз ставится на основании уровней иммуноглобулинов, проточной цитометрии и, в конечном итоге, подтверждающего генетического тестирования.Пациенты с ЗПА также имеют повышенный риск как аутоиммунных заболеваний [6], так и злокачественных новообразований [7].
Возраст появления диапазонов ЗПА, но они могут появиться уже в трехмесячном возрасте после потери материнской защиты антител. Из-за того, что у маленьких детей часто развиваются инфекции по мере развития их иммунной системы, многие врачи могут упускать частые или патологические инфекции как нормальный незрелый педиатрический иммунитет или другие доброкачественные причины, тем не менее, у 1 из 2000 детей есть ЗПА [8].Однако отсроченная диагностика ЗПА вредит здоровью и развитию. В нашем случае у 3-летнего мужчины был обнаружен ИЭ, несмотря на отсутствие известных факторов риска. Наш пациент показывает, что ЗПА следует учитывать при дифференциальной диагностике пациента без основных факторов риска, у которого развивается серьезная необычная инфекция, такая как эндокардит.
2. История болезни
3-летний ранее здоровый мужчина поступил в отделение неотложной помощи с лихорадкой неизвестного происхождения продолжительностью примерно четыре недели.В качестве амбулаторного пациента он прошел несколько обследований за последний год, у него был диагностирован фарингит с последующим средним отитом, и он прошел полные курсы амоксициллина и азитромицина. Несмотря на прием антибиотиков, он продолжал ежедневно поднимать температуру до 102,5 F. У него также были жалобы на потерю веса (7 фунтов), усталость, непродуктивный кашель и запоры. Жизненно важные признаки при поступлении включали лихорадку 101,7 F, частоту сердечных сокращений 135 и частоту дыхания 20.
Физический осмотр выявил сухость слизистых оболочек, эритему задней части глотки без экссудата миндалин, заднюю шейную лимфаденопатию, нормальное сердечно-сосудистое и респираторное обследование, легкая форма вздутие живота без органегалии или значительной болезненности и задержка наполнения капилляров на четыре секунды.Остальные результаты обследования были в пределах нормы.
Посев крови был положительным на Enterococcus faecalis , что привело к трансторакальной эхокардиограмме, которая была положительной для вегетации 3 × 5 мм на передней створке митрального клапана, подтверждающей эндокардит (рис. 1). Пациенту было начато внутривенное введение ампициллина, которое было прекращено через 14 дней терапии из-за подозрения на нейтропению, индуцированную ампициллином (ANC 100 клеток / мм 3 ). Затем его перевели на ванкомицин и гентамицин в течение четырех недель.
После завершения четырехнедельного курса антибиотиков у пациента продолжали развиваться рецидивирующие лихорадки, а дальнейшее инфекционное заболевание показало положительный результат ПЦР на Clostridium difficile , который лечили метронидазолом. Учитывая, что в анамнезе он болел эндокардитом без выявленных факторов риска, было проведено иммунологическое обследование. Обследование соответствовало низким уровням IgG, IgA и IgM (Таблица 1).
| ||||||||||||||||||
Пациенты после иммунологического исследования ген был секвенирован для оценки XLA.Идентифицированный ген был c. 1178-3T> G, вариант с неопределенным значением в гене Btk, предположительно являющийся причиной его агаммаглобулинемии. Дальнейшая иммунная оценка субпопуляций B-клеток, как показано в таблице 2, показала отсутствие CD19 + B-клеток. Внутриклеточная экспрессия белка Btk была снижена в моноцитах (MFI = 2,06) по сравнению с экспериментальным контролем (MFI = 7,99). Этот результат наводит на мысль о диагнозе XLA.
| |||||||||||||||
С момента постановки диагноза он регулярно получал плановые внутривенные инфузии иммуноглобулина (ВВИГ). бесплатно последние четыре месяца.
3. Обсуждение
ИЭ редко встречается в педиатрической популяции и несет высокий риск заболеваемости и смертности. Сообщается о заболеваемости от 0,34 до 0,64 случая на 100 000 в год [5]. Большинство случаев является результатом структурного дефекта или врожденного порока сердца [2]. Примерно в 10% случаев нет основного заболевания сердца, и причина этого в значительной степени неизвестна [4]. Наш случай относится к 3-летнему ребенку, у которого был эндокардит без каких-либо определяемых факторов риска, у которого при дальнейшем обследовании было обнаружено ЗПА.Поскольку педиатрические пациенты часто болеют инфекциями, часто забывают о ЗПА. В случаях аномальных инфекций необходимо определить причину, и ЗПА должна быть на вершине этого дифференциала.
У большинства пациентов с ЗПА диагностируется тяжелая инфекция, вызванная недостатком защитного иммуноглобина [9]. Часто регистрируемые инфекции включают рецидивирующую пневмонию, эмпиему, синусит, рецидивирующий отит, сепсис, рецидивирующий менингит или септический артрит [10–12].У тех, у кого нет защитных В-клеток, бактериальные инфекции обычно начинаются через три месяца после рождения, когда материнский IgG снижается ниже защитного уровня, и у большинства пациентов диагноз ставится в возрасте до пяти лет [12]. Многие из этих инфекций не являются тяжелыми и также часто наблюдаются у иммунокомпетентных детей. Однако возникновение серьезных инфекций, таких как IE, редко и является важным ключом к дальнейшим исследованиям для выявления любых основных ЗПА.
Есть несколько типов PAD. Одним из примеров является агаммаглобулинемия Брутона, или агаммаглобулинемия Брутона, которая представляет собой редкое генетическое заболевание с распространенностью 1 на каждые 19 000 новорожденных мальчиков в Соединенных Штатах [13].Образование В-клеток ослабляется из-за мутации в гене Btk , которая изменяет белок Btk, участвующий в дифференцировке В-клеток [14, 15]. Ген Btk был идентифицирован в 1993 году, и с тех пор были идентифицированы многочисленные сайты мутаций гена [7]. У нашего пациента есть вариант мутации Btk, о котором ранее не сообщалось в литературе. Клиническая картина нашего пациента согласуется с отсутствием дифференцировки В-клеток, что вызывает недостаток иммуноглобулина и, как следствие, приводит к рецидивам и серьезным инфекциям; следовательно, вероятно, что мутация может быть причинной.Однако важно отметить, что значение этой вариантной мутации гена неизвестно, и дальнейшие исследования ее значимости для агаммаглобулинемии продолжаются.
В заключение, эндокардит — это серьезная инфекция, которая редко встречается в здоровой педиатрической популяции без известных факторов риска. ЗПА часто упускают из виду, поскольку у иммунокомпетентных детей часто возникают общие инфекции, такие как средний отит и пневмония. Наш случай подчеркивает, что педиатрические пациенты с более серьезными и необычными инфекциями, такими как эндокардит, должны быть тщательно обследованы на предмет их первопричины.В нашем случае подчеркивается, что ЗПА должна быть на первом месте среди таких пациентов, поскольку промедление с диагностикой и лечением может привести к увеличению заболеваемости и смертности.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Изменение факторов риска детского инфекционного эндокардита
Брук MM: Лечение и профилактика бактериального эндокардита у детей . Pediatr Clin North Am 1999, 46 : 275–287.Отличный обзор эпидемиологии, патогенеза, микробиологии, диагностики, лечения и профилактики бактериального эндокардита у детей.
PubMed
CAS
Статья
Google Scholar
DelPont JM, DeCicco LT, Vartalitis C, et al. : Инфекционный эндокардит у детей: клинические анализы и оценка двух диагностических критериев . Pediatr Infect Dis J 1995, 14 : 1079–1086.
CAS
Статья
Google Scholar
Normand J, Bozio A, Etienne J, et al. : Изменение характера и прогноза инфекционного эндокардита в детском возрасте . Eur Heart J 1995, 16 ( доп. B ): 28–31.
PubMed
Google Scholar
Данилович D: Инфекционный эндокардит . Педиатр Ред. 1995, 16 : 148–154.
PubMed
CAS
Google Scholar
Ашкенази С., Леви О, Блиден L: Тенденции детского инфекционного эндокардита в Израиле с акцентом на детей в возрасте до 2 лет . Pediatr Cardiol 1997, 18 : 419–424.
PubMed
CAS
Статья
Google Scholar
Битар Ф.Ф., Джавди Р.А., Дбаибо Г.С., и др.: Детский инфекционный эндокардит: 19-летний опыт работы в больнице третичного уровня в развивающейся стране . Acta Paediatr 2000, 89 : 427–430.
PubMed
CAS
Статья
Google Scholar
Alexiou C, Langley SM, Monro JL: Хирургия инфекционного клапанного эндокардита у детей . евро J Cardiothorac Surg 1999, 16 : 653–659.
PubMed
CAS
Статья
Google Scholar
Picarelli D, Leone R, Duhagon P, et al. : Активный инфекционный эндокардит у младенцев и детей: десятилетний обзор хирургической терапии . J Card Surg 1997, 12 : 406–411.
PubMed
CAS
Статья
Google Scholar
Martin JM, Neches WH, Wald ER: Инфекционный эндокардит: 35 лет опыта в детской больнице . Clin Infect Dis 1997, 24 : 669–675.
PubMed
CAS
Google Scholar
Morris CS, Reller MD, Menashe VD: Тридцатилетняя заболеваемость инфекционным эндокардитом после операции по поводу врожденного порока сердца . JAMA 1998, 279 : 599–603. В штате Орегон все жители, перенесшие хирургическое вмешательство по поводу серьезных врожденных дефектов, были зарегистрированы в регистре с 1982 года. Это позволило авторам определить долгосрочную заболеваемость эндокардитом в когорте из 3860 пациентов.После 25-летнего наблюдения частота эндокардита составила 13,3% для клапанного стеноза аорты, 3,5% для коарктации аорты, 2,8% для первичного дефекта межпредсердной перегородки, 2,7% для изолированного вентрикулосептального дефекта и 1,3% для тетралогии Фалло. . Случаев эндокардита у детей с вторичным дефектом межпредсердной перегородки, открытым артериальным протоком или стенозом легочной артерии не было. Это хорошо проведенное исследование с очень долгосрочным наблюдением за большим количеством пациентов.
PubMed
CAS
Статья
Google Scholar
Kalra GS, Verma PK, Dhall A, et al. : Транскатетерное закрытие дефектов межжелудочковой перегородки: немедленные результаты и промежуточное наблюдение . Am Heart J 1999, 138 : 339–344.
PubMed
CAS
Статья
Google Scholar
Робертс GJ: Стоматологи невиновны! Настоящим виновником является «повседневная» бактериемия: обзор и оценка доказательств того, что стоматологические хирургические процедуры являются основной причиной бактериального эндокардита у детей . Pediatr Cardiol 1999, 20 : 317–325. В этой легко читаемой статье доктор Робертс рассматривает всю информацию и приходит к факту, о котором мы давно подозревали: дантисты невиновны. Повседневная бактериемия — это злодейство; дантисты — герои.
PubMed
CAS
Статья
Google Scholar
Даджани А.С., Тауберт К.А., Уилсон В., и др. : Профилактика бактериального эндокардита. Рекомендации Американской кардиологической ассоциации . JAMA 1997, 277 : 1794–1801.
PubMed
CAS
Статья
Google Scholar
Strom BL, Abrutyn E, Berlin JA, et al. : Стоматологические и кардиологические факторы риска инфекционного эндокардита: популяционное исследование случай-контроль . Ann Intern Med 1998, 129 : 761–769. Авторы вели активное наблюдение в 54 больницах в районе Филадельфии.Они сравнили случаи эндокардита с общественным контролем. Стоматологическое лечение не было фактором риска развития эндокардита даже у пациентов с пороками клапанов сердца. Авторы предлагают пересмотреть текущую политику профилактики.
PubMed
CAS
Google Scholar
Лукас В., Робертс Г.Дж.: Одонтогенная бактериемия после процедур чистки зубов у детей . Pediatr Dent 2000, 22 : 96–100.В этом исследовании приняли участие сто пятьдесят пять детей, проходящих стоматологическое лечение под наркозом. Оценивали зубной налет и гингивит. Количественные посевы крови были выполнены у детей, которым подвергали чистку зубов, чистку зубов или удаление зубного камня. Удивительно, но не было различий в частоте или интенсивности бактериемии в трех группах. Авторы приходят к выводу, что у пациентов с такой же вероятностью может развиться бактериемия из-за чистки зубов в домашних условиях, как и из-за профессиональной уборки.
PubMed
CAS
Google Scholar
Lamas CC, Eykyn SJ: В больнице был приобретен эндокардит нативного клапана: анализ 22 случаев за 11 лет . Сердце 1998, 79 : 442–447.
PubMed
CAS
Google Scholar
Raymond J, Aujard Y, Европейская исследовательская группа: Нозокомиальные инфекции у педиатрических пациентов: европейское многоцентровое проспективное исследование . Инфекционный контроль Hosp Epidemiol 2000, 21 : 260–263.В ходе этого 6-месячного проспективного исследования с активным эпиднадзором была определена частота внутрибольничных инфекций в 20 педиатрических отделениях в восьми странах: пяти педиатрических отделениях интенсивной терапии, семи отделениях для новорожденных, двух отделениях гематологии и онкологии и восьми общих педиатрических отделениях. Частота внутрибольничной инфекции варьировала от 1% в отделениях общего профиля до 23,6% в отделениях детской интенсивной терапии. Инфекции кровотока были наиболее распространены в отделениях новорожденных и в большинстве случаев были связаны с центральными венозными катетерами.Ценность этого исследования — проспективный характер с активным наблюдением в самых разных условиях стационара.
PubMed
CAS
Статья
Google Scholar
Гаррисон П.К., Фридман LR: Экспериментальный эндокардит I. Стафилококковый эндокардит у кроликов, возникший в результате размещения полиэтиленового катетера в правой части сердца . Йель Дж. Биол Мед 1970, 42 : 394.
PubMed
CAS
Google Scholar
Фаулер В.Г. Младший, Макинтайр Л.М., Йеман М.Р., и др. : Устойчивость in vitro к тромбин-индуцированному микробицидному белку тромбоцитов в изолятах Staphylococcus aureus от пациентов с эндокардитом коррелирует с источником внутрисосудистого устройства. J Infect Dis 2000, 182 : 1251–1254.
PubMed
CAS
Статья
Google Scholar
Raad II, Sabbagh MF: Оптимальная продолжительность терапии катетерной бактериемии Staphylococcus aureus: исследование 55 случаев и обзор . Clin Infect Dis 1992, 14 : 75–82.
PubMed
CAS
Google Scholar
Карлович М.Г., Хашимото Л.Н., Келли Р.Э. младший, Бюшер ES: Следует ли удалять центральные венозные катетеры, как только у новорожденных обнаружена кандидемия ? Педиатрия 2000, 106 : e63.
PubMed
CAS
Статья
Google Scholar
Pearson ML, Консультативный комитет по практике инфекционного контроля в больницах: Руководство по профилактике внутрисосудистых инфекций, связанных с устройствами . Infect Control Hosp Epidemiol 1996, 17 : 438–469.
PubMed
CAS
Статья
Google Scholar
Beck C, Dubois J, Grignon A, et al. : Заболеваемость и факторы риска катетерного тромбоза глубоких вен в педиатрическом отделении интенсивной терапии: проспективное исследование . J Pediatr 1998, 133 : 237–241.
PubMed
CAS
Статья
Google Scholar
Oelberg DG, Fisher DJ, Gross DM, et al. : Эндокардит у новорожденных из группы высокого риска . Педиатрия 1983, 71 : 392–397.
PubMed
CAS
Google Scholar
Ноэль Г.Дж., О’Лафлин Дж.Э., Эдельсон П.Дж.: Правосторонний эндокардит новорожденного Staphylococcus epidermidis: описание пяти катетеризованных младенцев . Педиатрия 1988, 82 : 234–239.
PubMed
CAS
Google Scholar
Symchych PS, Krauss AN, Winchester P: Эндокардит после внутрисердечной установки катетеров пупочной вены у новорожденных . J Pediatr 1977, 90 : 287–289.
PubMed
CAS
Статья
Google Scholar
Опи Г.Ф., Фрейзер С.Х., Дрю Дж. Х., Дрю S: Бактериальный эндокардит в отделении интенсивной терапии новорожденных . J Paediatr Child Health 1999, 35 : 545–548.
PubMed
CAS
Статья
Google Scholar
Daher AH, Berkowitz FE: Инфекционный эндокардит у новорожденных . Clin Pediatr 1995, 34 : 198–206.
CAS
Google Scholar
Mohan UR, Walters S, Kroll JS: Эндокардит, вызванный бета-гемолитическим стрептококком группы A, у детей с потенциально летальными последствиями: 2 случая и обзор . Clin Infect Dis 2000, 30 : 624–625.
PubMed
CAS
Статья
Google Scholar
Ласки А.Л., Джонсон Т.Р., Дагарцикас М.И., Тобиас JD: Эндокардит, относимый к бета-гемолитическим стрептококкам группы А после неосложненной ветряной оспы у вакцинированного ребенка . Педиатрия 2000, 106 : e40.
PubMed
CAS
Статья
Google Scholar
Conway DSG, Taylor AD, Burrell CJ: Атопическая экзема и стафилококковый эндокардит: пора распознать связь ? Hosp Med 2000, 61 : 356–357.
PubMed
CAS
Google Scholar
Sherertz RJ, Ely EW, Westbrook DM, et al. : Обучение врачей может снизить риск инфицирования сосудистых катетеров . Ann Intern Med 2000, 132 : 641–648.
PubMed
CAS
Google Scholar
Мермель Л.А.: Профилактика внутрисосудистых катетерных инфекций . Ann Intern Med 2000, 132 : 391–402.

 Нет аллергии к пенициллину или ампициллину
Нет аллергии к пенициллину или ампициллину