Повышенные эозинофилы в крови у грудничка
Все элементы нашего организма выполняют свою определенную роль. Если что-то в их структуре или количестве нарушается, появляются серьезные проблемы.
Даже такие небольшие клетки как эозинофилы могут нанести существенный вред организму грудничка в большом количестве.
Увеличение количества эозинофилов в крови является достаточно распространенной проблемой. Они очищают организм грудничка от чужеродных белков. Подсчитав их количество в крови можно охарактеризовать общее состояние ребенка.
Диагностика
Для проверки уровня эозинофилов педиатр может назначить несколько анализов, таких как биохимический анализ, анализ крови, кала и мочи. Некоторые врачи считают необходимым брать слизь из носовой полости.
Если после всех проведенных анализов устанавливается определенная патология, назначается бронхоскопия или рентгенография.
Причины
Существует несколько причин повышения уровня эозинофилов в крови. Это может быт следствием аллергии. Если у грудничка есть тяжелая непереносимость, сопровождающаяся затруднениями в дыхании, количество эозинофилов увеличивается.
[important]Пораженные паразитарным описторхозом желудок, печень или поджелудочная железа тоже могут быть причиной эозинофилии.[/important] Она также может быть вызвана любым кожным заболеванием, которое появилась в результате воздействия раздражителя, что распространено при экземе, лишае или дерматите.
Количество эозинофилов в крови увеличивается в результате попадания стафилококков. Этот вирус поражает организм, поэтому мозг активно вырабатывает вещества, которые могут ему противостоять.
Эозинофилия у грудничка часто является следствием дефицитов таких веществ, как ионы магния. Это также может свидетельствовать о недостатке витаминов.
Для грудничков характерно увеличение количества эозинофилов при негативной реакции на определенные препараты, коровье молоко или по наследственной предрасположенности.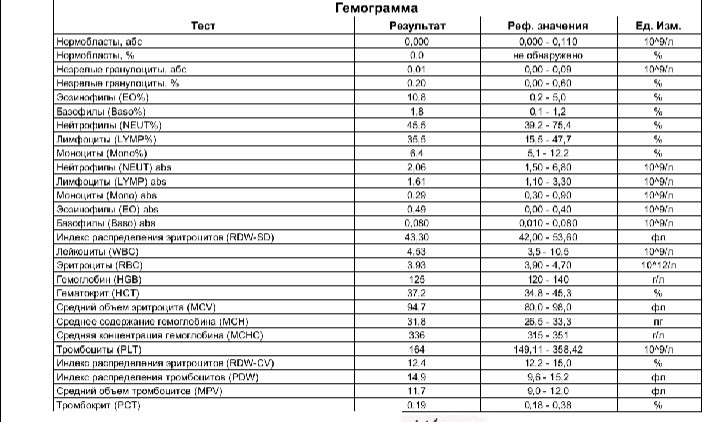 Если у родителей наблюдался повышенный уровень эозинофилов, у ребенка это может повториться.
Если у родителей наблюдался повышенный уровень эозинофилов, у ребенка это может повториться.
Лечение
На данный момент не существует определенного метода лечения эозинофилии. Главная задача для доктора и родителей — установить причины ее появления. [note]Поэтому после всех анализов педиатр обычно назначает дополнительные обследования, целью которых является установить причину такого явления.[/note]
Если у грудничка нет больших отклонений от нормы, у него хорошее самочувствие, он не проявляет беспокойства и отличается хорошим развитием, рекомендуется еще раз сдать анализ. Может была допущена ошибка, поэтому паниковать сразу не стоит.
Как только врач определили причину повышенного уровня эозинофилов, нужно начинать лечение этого заболевания. Будь это инфекция, аллергия или глисты — нужно помочь ребенку справиться с этой проблемой.
Важно помнить, что при должном лечении организм грудничка быстро восстановится. Если родители и врачи не будут медлить, все придет в норму и уровень эозинофилов в крови тоже стабилизируется. Необходимо лишь следовать рекомендациям доктора.
Необходимо лишь следовать рекомендациям доктора.
Если после обследования не удалось определить конкретное заболевание, обратите внимание на общее состояние ребенка. Когда грудничок часто подвержен вирусным инфекциям, вполне возможно сильное ослабление иммунитета.
Такие сбои появляются в результате воздействия аллергии или паразитов. В данном случае врач может назначить препараты для укрепления иммунитета, а также закаливание организма.[tip]Что означает повышение моноцитов в крови ребенка — узнайте из нашей публикации.
Практические сведения для мам — как берут кровь из вены у грудничка.
Рекомендуем материал о нормах нейтрофилов в крови у детей.[/tip]
Заключение
Для лечения повышенного уровня эозинофилов необходимо пройти комплексное обследование. Доктор установит первопричину и путем лечения данного заболевания можно привести все в норму.
Похожие статьи
«Почему в крови эозинофилы повышены, о чем это говорит?» – Яндекс.Кью
Эозинофилы — одна из групп лейкоцитов (белоснежных кровяных клеток). Они относятся к нейтрофильному ряду, но отличаются от нейтрофилов некими особенностями. Они немного крупнее. Ядра у их содержат наименьшее число частей (обычно 2-3).
Под микроскопом в цитоплазме этих клеток видна соответствующая обильная зернистость оранжево-розового цвета. Она состоит из огромного количества однородных гранул. Когда делают анализ крови, эозинофилы подсчитывают в мазке под микроскопом либо определяют на гематологическом анализаторе.
Повышенный уровень эозинофилов в крови у взрослого говорит о наличие ряда проблем в организме, с которыми столкнулся человек. Высокое содержание может говорить об аллергической реакции, не всегда острого типа, о разнообразных бактериальных инфекциях или о жизнедеятельности паразитов-глистов.
Это связано с тем, что эозинофилы, являются клетками, которые моментально реагируют на вышеперечисленные проблемы, и вместе с базофилами, их можно отнести к прямым маркерам на реакции гиперчувствительности в организме
Роль эозинофилов в организме
Функции эозинофилов разнообразны, некоторые из них очень похожи на функции других белых кровяных телец. Они участвуют в многочисленных воспалительных процессах, особенно связанных с аллергическими реакциями. Кроме того, у эозинофилов есть определенные физиологические роли в формировании органов (например, в развитии молочной железы после родов).
Они участвуют в многочисленных воспалительных процессах, особенно связанных с аллергическими реакциями. Кроме того, у эозинофилов есть определенные физиологические роли в формировании органов (например, в развитии молочной железы после родов).
Различают следующие функции представленных клеток:
- нахождение в том месте, где имеют место воспалительные процессы;
- предотвращение негативного влияния потенциально опасных веществ;
- уничтожение клеток;
- противопаразитарная и бактерицидная активность.
Эозинофилы в крови могут оказывать не только положительное влияние, но и отрицательное. Они не дают потенциально опасным микроорганизмам попасть в организм человека, но бывают случаи, когда они связаны с патологическими изменениями. Ярким примером может стать болезнь Леффлера.
Норма
У взрослых норма эозинофилов в крови составляет 0,4х109/л, норма у детей несколько больше (до 0,7х109/л). Впрочем, относительно содержания других иммунных клеток нормальное количество эозинофилов у взрослых и детей колеблется в пределах 1–5%.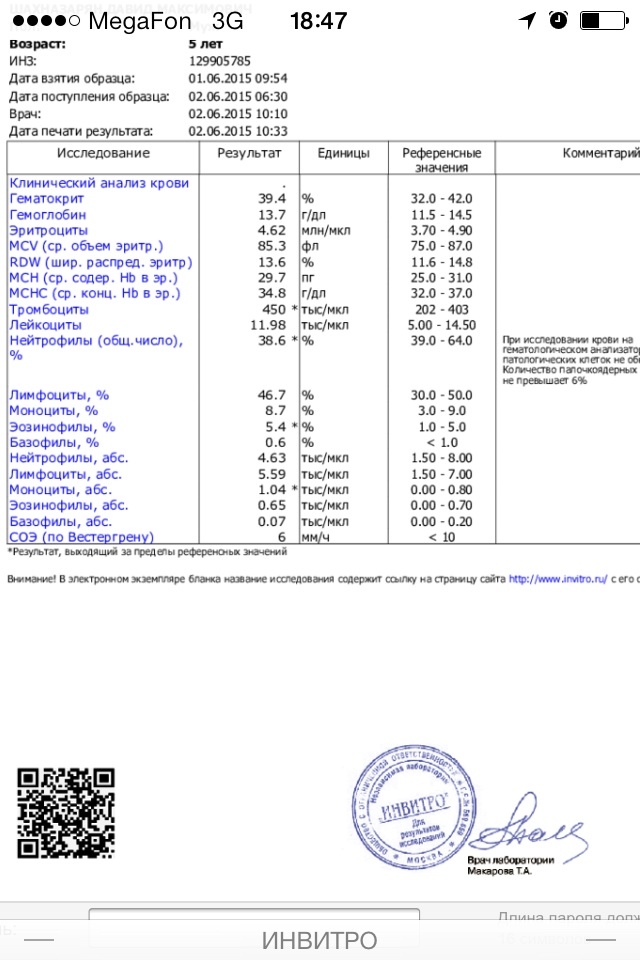
Повышенные эозинофилы в крови и других жидкостях организма могут быть обусловлены множеством факторов.
Причины повышения эозинофилов в крови
Почему эозинофилы повышены у взрослого, о чем это говорит? Эозинофилы выше нормы вызывают особое состояние организма, которое называют эозинофилией. Существуют различные степени этого недуга:
- Легкая – показатель клеток достигает 10%
- Средняя – от 10 до 15% эозинофилов
- Тяжелая форма – более 15 процентов. Данная степень заболевания может выражаться кислородным голоданием на клеточном или тканевом уровне.
В медицинской практике существует наиболее распространенная и легко запоминающаяся аббревиатура, которая помогает довольно легко запомнить наиболее известные причины развития эозинофилии.
ПОКАА – паразиты (лямблиоз, аскаридоз, описторхоз), опухоли, коллагенозы, аллергии, астма. Это топ 5 самых распространенных причин из-за которых происходит увеличение эозинофилов в крови.
В более редких случаях причиной повышения эозинофилов становятся другие болезни:
- Острый лейкоз.
- Туберкулез.
- Наследственная эозинофилия.
- Ревматическая лихорадка (ревматизм).
- Экссудативные реакции различного происхождения.
- Ваготония (раздражение блуждающего нерва), вегето-сосудистая дистония.
- Снижение функциональных способностей щитовидной железы (
гипотиреоз
).
Необходимо знать, что не всегда данные клетки приносят организму пользу. Борясь с инфекцией, они могут провоцировать аллергию сами. Когда число эозинофилов превышает 5% от общего количества лейкоцитов, формируется не только эозинофилия. В месте скопления данных клеток формируются воспалительные изменения тканей. По такому принципу часто у детей возникает ринит и отек гортани.
Физиологические причины
Содержание эозинофилов изменяется в зависимости от действия различных факторов:
- Самые высокие показатели данный клеток могут наблюдаться исключительно ночью, когда человек спит, а днем соответственно – самые низкие.

- Анализ выявляет вариации количества клеток у женщин на протяжении менструального цикла: в начальные этапы их число увеличивается, после овуляции постепенно снижается;
- Лечение некоторыми лекарственными средствами может повлиять на показатель: медикаменты от туберкулёза, пенициллины, аспирин, димедрол, препараты сульфаниламида и золота, комплексы с витамином В, химотрипсин, имипрамин, мисклерон, папаверин, эуфиллин, бета-блокаторы, хлорпропамид, гормональные лекарства и т.д;
- Пищевой режим: сладости или алкоголь увеличивают вероятность того, что анализ будет некорректный.
Впервые обнаруженные повышенные эозинофилы в анализе крови требуют проведения повторного исследования и изучения изменения их количества в динамике (нескольких последовательно проведённых анализов).
Повышенные эозинофилы у ребенка
В зависимости от возраста ребенка, причиной превышения нормы содержания клеток могут быть следующие факторы:
- У новорожденных детей высокая норма эозинофилов может быть вызвана резус-конфликтом, стафилококком, гемолитической болезнью, дерматитами и аллергическими реакциями на медикаменты или еду.

- В возрасте от полутора до трех лет высокие показатели эозинофилов могут быть вызваны атопическим дерматитом, аллергией на лекарства и отеком Квинке.
- У детей старше трех лет эозинофилы повышаются при наличии бронхиальной астмы или аллергического ринита, во время обострения кожной аллергии, ветрянки,
скарлатины
и при гельминтозе. Также повышение эозинофилов у ребенка могут вызывать злокачественные опухоли.
Повышенные эозинофилы в крови – это не самостоятельное заболевание, все усилия должны быть направлены на то, чтобы найти основную причину их повышения и, по возможности, ее ликвидировать.
Что делать?
Если общий анализ крови показал, что эозинофилы повысились, нужно обязательно дополнительно сдать биохимический анализ крови, так можно узнать о заболевании, которое привело к повышению. Обязательно нужно обратить внимание на белковый уровень ферментов, которые размещены в печени и т. д. Дополнительно нужно сдать анализ мочи, кала, чтобы узнать есть глисты или их отложения яиц.
д. Дополнительно нужно сдать анализ мочи, кала, чтобы узнать есть глисты или их отложения яиц.
Лечить эозинофилию гематолог, но помните, это не самостоятельно заболевание, а только один с симптомов какого-то заболевания. Нужно обязательно определить заболевание, из-за которого увеличились эозинофилы, затем будет назначена эффективная схема лечения, нужные медикаментозные препараты и физиотерапевтические процедуры.
Материал предоставлен
simptomy-lechenie.net
причины, почему высокий уровень, увеличение количества
Когда хотя бы один из показателей в анализе крови ребенка повышен, это всегда настораживает родителей. Особенно, если речь идет об одном из видов лейкоцитов, ведь многим мамам известно, что эти клетки стоят на страже иммунитета ребенка. А это значит, что их повышенное количество может сигнализировать, что у сына или дочки появилась какая-то проблема со здоровьем. Почему же у ребенка может наблюдаться увеличение количества эозинофилов и какие действия родителей будут правильными при таких изменениях анализа крови?
Особенно, если речь идет об одном из видов лейкоцитов, ведь многим мамам известно, что эти клетки стоят на страже иммунитета ребенка. А это значит, что их повышенное количество может сигнализировать, что у сына или дочки появилась какая-то проблема со здоровьем. Почему же у ребенка может наблюдаться увеличение количества эозинофилов и какие действия родителей будут правильными при таких изменениях анализа крови?
Зачем нужны эозинофилы
Эозинофилами называют один из видов лейкоцитов, представляющих собой клетки крови. Из-за присутствия внутри таких клеток гранул их вместе с другими видами лейкоцитов (базофилами и нейтрофилами) относят к гранулоцитам. Главной функцией этих лейкоцитов выступает защита организма ребенка от воздействия на них различных аллергенов и токсинов, а также возбудителей паразитарных, стафилококковых и других инфекций. Кроме того, эти клетки регулируют воспалительный процесс.
Эозинофилы образуются в костном мозге, как и другие клетки крови, а после выхода в кровоток пребывают либо в капиллярах, либо в разных тканях тела (в дыхательных путях, коже, клетках кишечника и других местах). В периферической крови они определяются в относительно небольшом количестве. Интересной особенностью таких клеток является то, что эозинофилы могут активно перемещаться, используя для этого амебиоидный способ. Так они «подходят» к нужному инфекционному агенту или токсину, который требуется обезвредить.
При этом данные лейкоциты способны поглощать как сами чужеродные частицы, так и образовавшиеся в организме ребенка иммунные комплексы или гистамин. При воздействии на паразитов эозинофилы выделяют ферменты, которые разрушают их оболочку. Кроме того, эозинофильные лейкоциты выделяют простагландины и прочие биологически активные соединения.
Какой уровень эозинофилов является повышенным
Норма эозинофилов определяется в анализе крови посредством подсчета лейкоцитарной формулы. Уровень таких клеток выражают в процентах от всего количества белых телец.
Уровень таких клеток выражают в процентах от всего количества белых телец.
Верхней границей нормы для детей считают:
- Не больше 5% эозинофилов в возрасте до года (у новорожденных до 10-го дня жизни верхней границей будет 4%).
- Не больше 4% эозинофилов у детей, которым уже исполнился 1 год.
Если повышены эозинофилы в крови у ребенка, такое состояние называется эозинофилией. Она бывает реактивной (небольшой), когда уровень этих лейкоцитов повышается максимум до 15%. Также выделяют умеренную эозинофилию, если такой вид лейкоцитов составляет 15-20% от всех белых клеток крови. При показателе более 20% говорят о высокой эозинофилии. У некоторых детей при активном патологическом процессе эозинофилы представляют 50% от всех лейкоцитов или даже больше.
Причины эозинофилии
Наиболее частые причины превышения нормального процента эозинофилов в детском возрасте представлены аллергическими реакциями и глистными инвазиями. При их наличии у ребенка выявляется преимущественно реактивная эозинофилия, то есть показатель редко превышает 10-15%.
При их наличии у ребенка выявляется преимущественно реактивная эозинофилия, то есть показатель редко превышает 10-15%.
Аллергии в наши дни являются весьма распространенными патологиями у детей. Они могут провоцироваться веществами-аллергенами из пищи, бытовой химии, шерсти животных, пыльцы растений и прочего. При отеке Квинке, крапивнице, экссудативном диатезе, бронхиальной астме и нейродермите уровень эозинофилов всегда повышается.
Глисты являются тоже весьма частой проблемой у детей, поскольку многие малыши не соблюдают гигиенические правила в полной мере – не моют руки или моют их недостаточно тщательно, едят немытые овощи, общаются с животными. Все эти факторы повышают риск заражения гельминтами, среди которых самыми распространенными у детей называют аскариды и острицы.
Высокий уровень эозинофильных лейкоцитов также выявляется при:
- Нехватке магния.

- Лейкозе и других доброкачественных либо злокачественных опухолях.
- Полицитемии.
- Ревматизме и системных заболеваниях.
- Инфекциях, вызванных простейшими.
- Инфекционном мононуклеозе.
- Малярии.
- Скарлатине и других острых инфекциях, вызываемых бактериями.
- Дерматите, псориазе и других кожных болезнях.
- Васкулитах.
- Туберкулезе.
- Иммунодефицитах.
- Ожогах, занимающих большую площадь тела.
- Заболеваниях легких.
- Сниженной функции щитовидной железы.
- Циррозе печени.
- Врожденных сердечных пороках.
- Удалении селезенки.
- Приеме некоторых лекарств, например, сульфаниламидов, нитрофуранов, гормональных средств или антибиотиков.
- Повышении тонуса блуждающего нерва.
Отдельно выделяется эозинофилия, которая обусловлена генетическим фактором.
Кроме того, повышенное число эозинофилов может выявляться у детей, которые недавно перенесли пневмонию или гепатит. После таких болезней, как и в послеоперационный период и после травм, эозинофильные лейкоциты могут определяться выше нормы довольно длительное время.
Симптомы
Если у ребенка эозинофилия, такое состояние не проявляется специфическими симптомами, а будет иметь клиническую картину основной болезни, спровоцировавшей изменение лейкограммы. У ребенка могут отмечать высокую температуру, анемию, увеличение печени, сердечную недостаточность, болезненность суставов, уменьшение веса, боли в мышцах, сыпь на коже и другие симптомы.
При аллергических заболеваниях будут жалобы на зуд кожи, сухой кашель, дерматит, насморк и прочие признаки аллергических реакций. Если причиной эозинофилии выступают аскариды либо острицы, у ребенка нарушится сон, появится зуд в области заднего прохода и половых органов, изменится аппетит и масса тела.
Что делать
Обнаружив в анализе ребенка повышенные эозинофилы, следует обратиться к лечащему врачу. Педиатр осмотрит ребенка и направит на повторный анализ, чтобы исключить возможность ошибочного результата. Также при необходимости будут назначены другие исследования – анализ мочи, копрограмма, биохимический анализ крови, проверка кала на яйца гельминтов, серологические тесты и так далее.
Лечение при эозинофилии должно быть направлено на причину такого изменения крови.
Врач учтет основную болезнь и назначит нужный курс лечения:
- При заражении острицами, аскаридами или другими паразитами терапия будет направлена на уничтожение таких возбудителей и выведение их из детского организма.
- Выявив у ребенка аллергическую болезнь, в первую очередь устанавливают аллергены, которые стали ее причиной и вызывают обострения.
 Также ребенку назначаются антигистаминные средства, облегчающие зуд и воспалительный процесс.
Также ребенку назначаются антигистаминные средства, облегчающие зуд и воспалительный процесс. - Если высокие эозинофилы спровоцированы назначенными ранее лекарствами, их отменяют.
Как только общее состояние ребенка улучшается, а симптомы вызвавшего высокие эозинофилы заболевания пропадут, лейкоцитарная формула также нормализуется.
Подробнее об эозинофилах вы можете узнать, посмотрев следующее видео.
Повышенные эозинофилы у ребенка… — Детская поликлиника 143
🤪КАНИКУЛЫ – ОТДЫХ НА ЗДОРОВЬЕ (часть 4)
⠀
«Давайте же мыться, плескаться, ⠀
Купаться, нырять, кувыркаться ⠀
В ушате, в корыте, в лохани, ⠀
В реке, в ручейке, в океане, ⠀
— И в ванне, и в бане, ⠀
Всегда и везде ⠀
— Вечная слава воде!»⠀
📚(К. Чуковский «Мойдодыр»)
⠀
☀️Погода нас этим летом радует и мы спешим на реку, пруд, озеро или море. Плаваем в бассейне или плещемся в любой подходящей емкости🌊 Дети могут резвиться в воде целый день. Купание, плаванье — это не только ежедневная водная процедура💦 Это полезный навык. А уж сколько водных видов спорта.
Мы вам сегодня напомним о необходимости соблюдения правил поведения, которые позволят избежать неприятностей при отдыхе на воде, а купание доставит вам истинное удовольствие.
⠀
✅Для купания детей выбирайте место, где: ⠀
— чистая вода, ⠀
— ровное песчаное (лучше) дно (без свай, коряг, острых камней, стекла, водорослей),⠀
— небольшая глубина (до 2 м),
— нет сильного течения (до 0.5 м/с),⠀
— обязательно проверьте состояние воды.
⠀
🏊🏼♀️Приятнее всего плавать в естественных водных бассейнах, на берегах которых оборудованы хорошие пляжи🏖 Прежде чем войти в воду, обязательно убедитесь в том, что она чистая.
⠀
✅ЗАПОМНИТЕ:⠀
— Не купайтесь в грязной воде❗️ ⠀
— Купание детей проводится только под присмотром взрослых❗️ ⠀
— Пользоваться надувным матрасом (кругом) надо с особой осторожностью: матрас может неожиданно сдуться или уплыть по течению далеко от берега. ⠀
— Особое внимание обращают на себя морские обитатели (смотри в карусели).
⠀
🌊Отправляясь купаться в море, спросите у местных жителей о том, какие рыбы водятся в тех местах, где вы собираетесь купаться. Старайтесь смотреть под ноги и не наступать на морских обитателей🦑
Конечно, все они быстры и юрки, но может оказаться, что за камнем, на который вы наступили, прячется морской ёж🐡
⠀
При виде медуз не пугайтесь и не зовите на помощь. ⠀
Маленькие медузы, как правило, не опасны, их ожоги редко бывают чувствительными. Тем не менее никогда 🙅🏻♀️не трите глаза, после того как брали в руки медузу. К тем медузам, которые имеют очень длинные щупальца и на теле которых есть фиолетовые пятна, следует относиться с опаской и отплывать от них подальше.
⠀
📌Если вы почувствовали, что у вас сводит судорогой бедро, согните ногу в колене🦵🏼 рукой сильно потяните назад. Если свело икроножную мышцу, согните ногу и прижмите стопу к груди.
⠀
📌Во время игр в воде будьте внимательны и аккуратны: избегайте захватов и погружений, так как в пылу игры кто-нибудь из вас может наглотаться воды.
⠀
📌Не стесняйтесь звать на помощь в опасной ситуации, но никогда не давайте ложных сигналов.
⠀
❗️ПОМНИТЕ❗️ ⠀
В воде ежегодно тонут тысячи людей, среди них даже профессиональные пловцы. Быстрое оказание первой помощи утопающему – единственный шанс спасти ему жизнь❗️ Ведь на берегу не всегда есть спасатели, а помощи ждать может быть слишком долго. (первая помощь при утоплении – смотри в карусели📲)
⠀
#дгп143 #вода #купание #лето
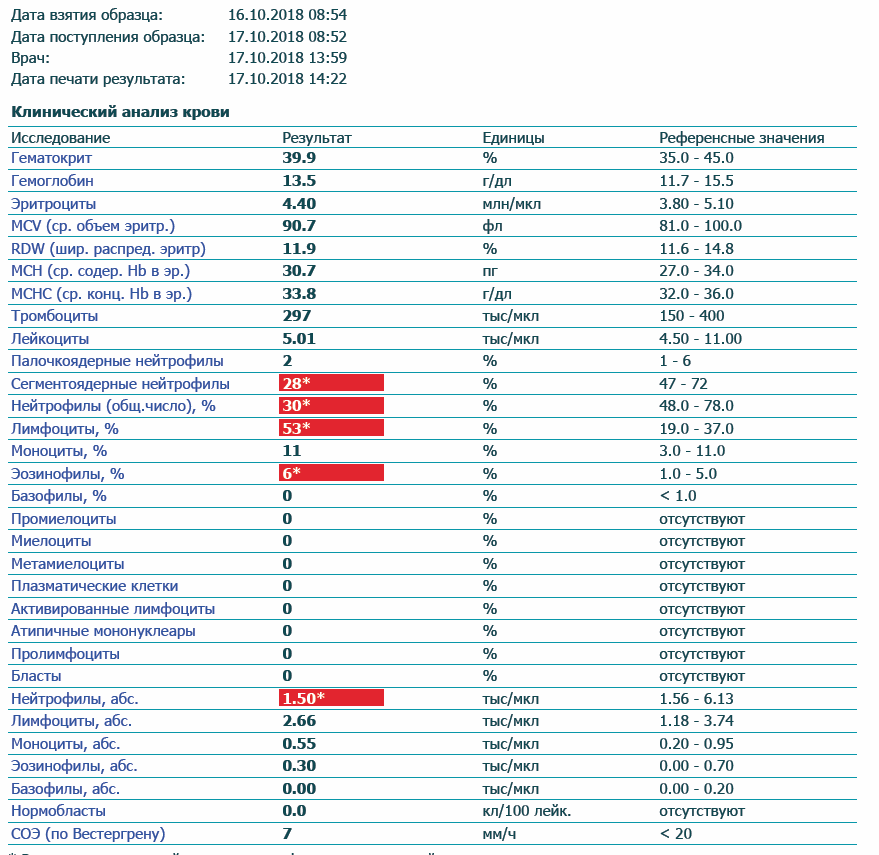
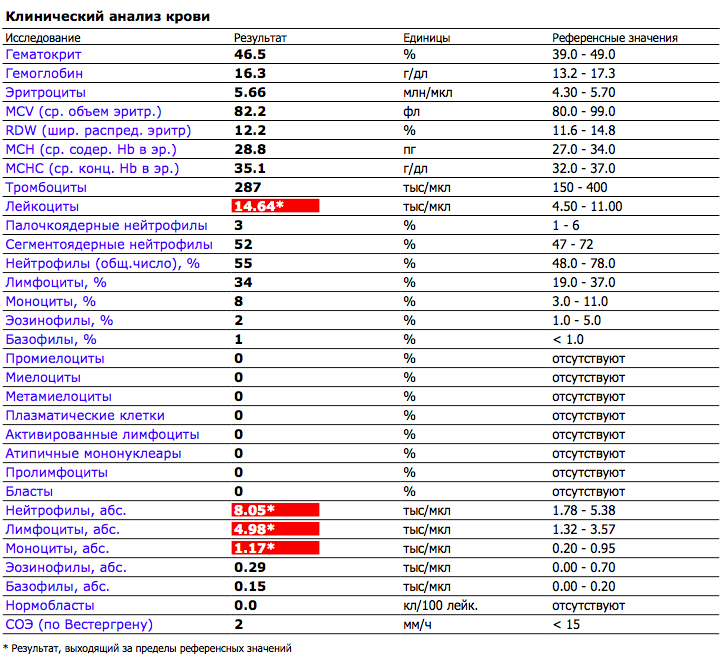
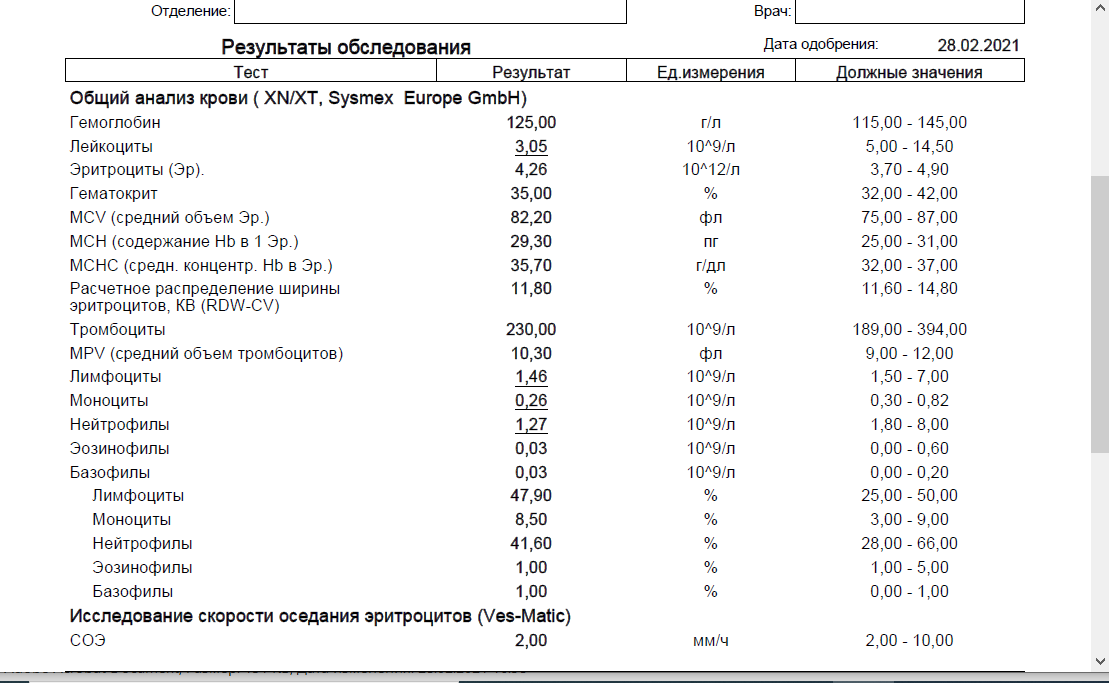
Повышены эозинофилы и понижены моноциты в крови у ребенка — Вопрос педиатру
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 70 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.15% вопросов.
Оставайтесь с нами и будьте здоровы!
Бактериальная инфекция по анализу крови
27.11.2019
Общий анализ крови (ОАК) — это лабораторный метод, позволяющий объективно оценить качественный и количественный состав клеток крови для диагностики различных заболеваний. Подсчет количества лейкоцитов (WBC), процентное соотношение лейкоцитов (лейкоцитарная формула) и СОЭ (скорость оседания эритроцитов) — основные параметры, отражающие активность вирусных и бактериальных инфекций.
Лейкоциты WBC – «белые рыцари» иммунной системы. Лейкопоэз (образование лейкоцитов) происходит в красном костном мозге. В зависимости от морфологических особенностей (размер клетки, форма ядра, наличие специфических гранул) и функции, которую они выполняют, лейкоциты разделяют на две группы: гранулоциты (нейтрофильные, базофильные и эозинофильные лейкоциты), агранулоциты (моноциты, лимфоциты).
· Нейтрофилы (NE) В сосудистом русле в норме циркулируют два типа NE: палочкоядерные (молодые) и сегментоядерные (зрелые). Более юные элементы гранулоцитарного ряда выходят в кровь из красного костного мозга только при патологии. Основная функция NE- уничтожение микроорганизмов, путем распознавания, активного захвата, и переваривания микробного агента (фагоцитоз). Нейтрофилы участвуют во всех этапах воспалительного процесса.
· Эозинофилы (EO)- ведущие форменные элементы в борьбе с паразитами (простейшие, гельминты), принимают участие в аллергических реакциях.
· Базофилы (BA)- принимают участие в аллергических реакциях, а также в регуляции кровообращения посредством секреции гормоноподобных веществ: гистамин, серотонин и гепарин.
· Лимфоциты (LYM)- играют центральную роль во всех иммунологических реакциях организма. Благодаря рецепторам на поверхности клеток, они способны различать «свое» и «чужое». Основная функция LYM- синтез защитных антител и обеспечение иммунной памяти.
· Моноциты (MON)- агранулоцитарные клетки, которые находятся в крови несколько суток, затем покидают кровоток перемещаясь в ткани, где выполняют свою функцию как макрофаги, фагоцитируя частицы более крупных размеров, чем нейтрофилы, а иногда и целые микробные агенты.
· Плазматические клетки (Плазмоциты)- клетки лимфоидной ткани, развивающиеся из клеток – предшественниц В-лимфоцитов, ответственные за выработку антител, в ответ на стимуляцию чужеродными антигенами. В норме в крови плазмоциты не циркулируют.
· СОЭ- определяется интенсивностью и скоростью склеивания эритроцитов в кровеносном русле. Этот параметр косвенно указывает на наличие патологического процесса, например, воспаления, в организме.
Для расшифровки анализа все перечисленные показатели важно оценивать в комплексе, а не по-одному. К тому же, для правильной интерпретации изменений в ОАК необходимо учитывать возрастные особенности лейкоцитарной формулы.
Рис.1
При рождении ребенка количество нейтрофилов(NE) преобладает над содержанием лимфоцитов (LYM). На 4-5 дни величина NE и LYM находится приблизительно на одном уровне (Первый перекрест). Далее, начиная со 2-го месяца жизни ребенка, число NE снова уменьшается, а LYM — возрастает, следом показатель NE нарастает, а LYM снижается. Затем, в 4 года количество клеток примерно одинаково (Второй перекрест). Наконец, к четырнадцатилетнему возрасту, процентное соотношении лейкоцитов (WBC) соответствует показателям взрослого человека.
В таблице представлены показатели процентного соотношения WBC.
|
|
|
|
|
|
| ||
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
Признаки бактериальной инфекции по анализу крови.
Человеческий организм постоянно сталкивается с внешними угрозами в виде патогенных микроорганизмов. При подготовке к возможному повреждению в крови быстро образуется мобильный пул циркулирующих нейтрофилов, в результате ускоренного выхода гранулоцитов из красного костного мозга, прекращения выхода нейтрофилов в ткани и мобилизацией пристеночного пула элементов.
При острых бактериальных инфекциях количество этих элементов в крови резко увеличивается, могут появляться менее зрелые клетки. (Сдвиг влево). Интенсивное разрушение зрелых нейтрофилов в тканях приводит к активной продукции костным мозгом более юных клеток. В крови увеличивается количество как самих лейкоцитов, так и отдельной фракции – нейтрофилов.
Чем выше количество этих клеток, тем более активен воспалительный процесс в организме. Нередко эти изменения помогают выявить признаки бактериальной инфекции по анализу крови у взрослых. При воспалительном процессе бактериальной этиологии, характерно повышение в плазме крови некоторых воспалительных белков (фибриногена, церулоплазмина, иммуноглобулинов). Некоторые из этих белков присоединяются к эритроцитам, следовательно, СОЭ увеличивается в разы.
Анализ крови при вирусной инфекции.
Вирусу для репликации необходима полноценная клетка организма, которую он использует как полигон для производства собственного генома, поэтому вирус находит и поражает определенные клетки, содержащие на своей поверхности специфические рецепторы. Для того, чтобы клетки иммунной системы могли отличать инфицированную клетку от здоровой и уничтожить ее, в качестве «метки зараженности» выступают белки главного комплекса гистосовместимости класса I (MHC I). Так активируются Т-лимфоциты, имеющие на своей поверхности определенные рецепторы, с помощью которых они распознают меченные, а значит инфицированные клетки.
В связи с этим, при острых вирусных заболеваниях в ОАК увеличиваться количество лимфоцитов и/или моноцитов. Общее количество лейкоцитов обычно снижено или в пределах возрастной нормы.
Однако при патологическом процессе вирусной этиологии анализ крови может соответствовать и нормальным показателям здорового человека, а при течении бактериального процесса количество лейкоцитов и абсолютное число нейтрофилов не всегда являются надежным маркером. Именно поэтому для назначения эффективного и адекватного лечения каждый случай должен оцениваться врачом индивидуально.
Кроме того, в настоящее время можно защитить себя и своих родных от многих вирусных и бактериальных инфекций с помощью эффективной и безопасной вакцинации.
Автор: врач-ординатор Университетской клиники H-Clinic Пушик Елена Павловна
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич
Возврат к списку
Эозинофилы понижены в крови у ребенка, что это значит
Эозинофилы – это малочисленная популяция белых клеток крови, показатели которой понижены почти до 0 у ребенка при инфекционных заболеваниях, и повышаются при аллергии или заражении гельминтами.
Причины эозинопении
Количество эозинофилов (EO, EOS) в крови у детей от года до 12 лет составляет в норме 0,02- 0,6 *109/л. После 12 лет число эозинофильных гранулоцитов у подростков такое же, как и у взрослого человека. Это значит, что результаты анализа находится в диапазоне 0,02 – 0,44*109/л.
Доля EO от общего количества белых кровяных клеток у детей до 12 лет в норме не должна выходить за рамки значений 0,5 – 7%. При значениях ниже 0,5% говорят об относительной эозинопении.
Если результат анализа на содержание EOS менее 0,02*109/л, то это значит, что у ребенка развивается абсолютная эозинопения. К 0 стремятся показатели эозинофильных гранулоцитов при острых состояниях, вызванных инфекционными болезнями, болевым шоком, физическим перенапряжением.
Эозинофилы 0 у детей
Для подсчета доли эозинофилов в мазке крови лаборант просматривает 100 лейкоцитов (WBC в бланке анализа крови). Большая часть белых клеток представлена нейтрофилами и лимфоцитами. Базофилов и эозинофилов в мазке крови очень немного. Так, показатель EO 4% значит, что из 100 лейкоцитов всего лишь 4 являются эозинофильными гранулоцитами.
Значение EO 1%, в анализе говорит о том, что на 100 лейкоцитарных клеток приходится только 1 эозинофил. Если относительные эозинофилы понижены до 0%, то это значит, что количество этих клеток у ребенка настольно уменьшилось, что из 100 лейкоцитов нет ни одного EO.
Тем не менее, это не значит, что при EO 0 данные гранулоциты исчезли совершенно. При исследовании других 100 WBC обнаруживается 1 эозинофил. Результаты же анализа покажут в первом случае 0%, а во втором – 1%.
Относительное количество EO уменьшается из-за повышения нейтрофилов – популяции лейкоцитов, отвечающей за уничтожение бактерий. Резко повышены нейтрофилы у детей при бактериальных инфекциях, что в детском возрасте случается достаточно часто и является особенностью становления иммунной системы.
Причины эозинопении у детей
Эозинофилы понижены у ребенка при таких заболеваниях, как:
- синдром Кушинга — гиперсекреция надпочечниками гормонов, особенно кортизола;
- гнойных бактериальных инфекциях;
- ОРВИ, грипп, острые инфекции в первые дни болезни;
- анемия, вызванная нехваткой витамина В12;
- отравление мышьяком, таллием, свинцом, ртутью;
- травмы, хирургическая операция, ожог;
- прием препаратов с гормонами щитовидной железы, кортикостероидами, лечение пенициллином;
- стресс.
В12-дефицитная анемия
Распространенной причиной понижения эозинофильной популяции служит анемия, которую провоцирует недостаток витамина В12. При этой форме заболевания уменьшается до 0% количество эозинофилов, появляются гигантские нейтрофилы, понижены базофилы и общие WBC.
Причинами нехватки витамина В12 в организме у ребенка служат:
- отсутствие или нехватка животного белка в рационе;
- заражение широким лентецом – паразитическим червем, конкурентно поглощающим витамин В12 из кишечника;
- наследственным нарушением всасывания витамина В12.
Признаки анемии проявляются головокружением, слабостью, отсутствием аппетита. Нехватка витамина В12 отрицательно сказывается на функциях нервной системы. У ребенка нарушается кожная чувствительность, появляются опоясывающие боли, изменяется походка.
Понижение эозинофилов при инфекциях
Причиной понижения EO до 0% служат инфекционные вирусные, бактериальные заболевания в остром периоде, а также воспалительные бактериальные процессы, сопровождающиеся образованием гноя.
Изменяется лейкоцитарная формула у ребенка при заражении вирусом гриппа:
- в первый день – понижены эозинофилы, лимфоциты, повышены общие WBC;
- в последующие дни – понижены WBC, повышены лимфоциты.
Повышение содержания лимфоцитов при гриппе значит, что иммунитет адекватно отвечает на вторжение вируса, а пониженные показатели лейкоцитов говорят об активной миграции этих клеток в очаг инфекции.
Относительные EO могут снижаться до 0 при гнойных инфекциях, тяжелом протекании пневмонии, дизентерии, дифтерии. Понижение эозинофильных гранулоцитов и 0% в бланке анализа отмечается при остром аппендиците.
Повышение нейтрофилов и общих лейкоцитов в сочетании с пониженными эозинофилами значит, что организм борется с воспалением, и служит показателем нормальной физиологической реактивности иммунной системы.
Диагностическое значение эозинопении
При диагностике величина EO обязательно учитывается при гнойных инфекциях, брюшном, возвратном тифе, осложнениях, вызванных действием адреналина, приемом глюкокортикоидов, никотиновой кислоты.
Пониженные EOS служат неблагоприятным признаком, ухудшающим прогноз болезни, у детей с синдромом Дауна, недоношенных новорожденных при сепсисе.
Неблагоприятным признаком протекания болезни считается анэозинофилия или полное отсутствие эозинофилов в сочетании с пониженными лимфоцитами. Состояние анэозинофилии значит, что не только относительная величина EO соответствует 0%, но и абсолютное количество этой популяции в крови падает до 0.
Пониженные эозинофильные гранулоциты при увеличении веса, повышенном уровне кортизола и высоком артериальном давлении указывают на синдром Кушинга. Подробнее о том, почему в анализе крови понижены EO, прочтите в статье «Пониженные эозинофилы у взрослых».
Что такое EoE? — Детское здравоохранение округа Ориндж,
Эозинофильный эзофагит, также известный как EoE, является относительно недавно признанным заболеванием, которое характеризуется накоплением эозинофилов (клеток аллергии) в слизистой оболочке пищевода.
Эозинофилы вызывают воспаление пищевода, которое может вызывать следующие симптомы:
- Затруднение при кормлении, в том числе отказ от кормления и непереносимость кормления
- Плохая прибавка в весе
- Снижение аппетита
- Боль в груди
- Боль в животе
- Рефлюкс-подобные симптомы
- Рвота
- Проблемы с глотанием
- Пищевое застревание (когда пища застревает в горле)
Причины, по которым у некоторых людей есть EoE, до конца не изучены.Исследования показали тесную связь между пищевой аллергией и EoE. Экологические аллергены также могут играть роль в этом заболевании, но необходимы дополнительные исследования. Что мы действительно знаем, так это то, что EoE — это хроническое заболевание, с которым можно справиться с помощью диеты и / или лечения. EoE не опасен для жизни; однако, если его не лечить, это может привести к необратимому повреждению пищевода.
Многие пациенты с EoE также страдают гастроэзофагеальной рефлюксной болезнью (ГЭРБ), хроническим расстройством пищеварения, которое вызвано аномальным потоком желудочной кислоты из желудка в пищевод.Нередко пациенты получают лечение от ГЭРБ, одновременно проходя лечение от EoE. Узнайте больше о ГЭРБ.
В CHOC наши мультидисциплинарные команды гастроэнтерологов и аллергологов работают вместе, чтобы диагностировать и лечить EoE, чтобы наши пациенты могли уменьшить или устранить свои симптомы, предотвратить будущие осложнения и жить счастливой жизнью. Мы также понимаем, что с диагнозом EoE приходит много вопросов о заболевании, лечении и долгосрочном здоровье. Мы собрали наиболее часто задаваемые вопросы, которые мы получали от наших пациентов и их семей.Эти ответы не должны заменять информацию или конкретные инструкции, предоставляемые поставщиками медицинских услуг для пациентов.
Общие сведения об эозинофильном эзофагите
Что такое верхний отдел желудочно-кишечного тракта?
Верхний отдел желудочно-кишечного тракта включает части тела, которые расщепляют и переваривают пищу, которую мы едим. Волнообразным движением, называемым перистальтикой, мышцы проталкивают пищу и жидкость по пищеварительному тракту. Поражение верхних отделов желудочно-кишечного тракта включает следующее:
- Первое крупное движение мышц — это глотание пищи или жидкости.Начало глотания является произвольным, но как только оно начинается, процесс становится непроизвольным и продолжается под контролем нервов.
- Пищевод — мышечная трубка, по которой пища проходит из горла в желудок.
- В месте соединения пищевода и желудка имеется кольцевой клапан, закрывающий проход между двумя органами. Когда пища приближается к клапану, окружающие мышцы расслабляются и позволяют пище пройти в желудок. Затем клапан закрывается.
- Затем пища попадает в желудок, который выполняет три механических задачи: хранение и смешивание пищи с последующим опорожнением ее в тонкий кишечник.
- Пища переваривается в тонком кишечнике и растворяется соками поджелудочной железы, печени и кишечника, а содержимое кишечника перемешивается и продвигается вперед, чтобы обеспечить дальнейшее пищеварение.
Что такое эозинофил?
Эозинофил — это один из нескольких типов лейкоцитов, обычно обнаруживаемых в крови и некоторых тканях. Эозинофилы помогают поглощать и уничтожать бактерии и микроорганизмы, такие как паразиты. Они также участвуют в контроле аллергических реакций и заболеваний.Эозинофилы обычно защищают организм.
Что такое расстройство, связанное с эозинофилами?
Расстройство, связанное с эозинофилами, — это болезненное состояние, при котором слишком много эозинофилов в определенном органе или органах, часто в желудочно-кишечном тракте. Слишком большое количество эозинофилов часто связано с аномальными симптомами. Долгосрочные эффекты слишком большого количества эозинофилов в данной области тела неизвестны.
Насколько распространен эозинофильный эзофагит (ЭоЭ)?
По оценкам, около 55 пациентов на 100 000 человек в Соединенных Штатах имеют EoE.Это может отличаться в зависимости от региона.
Был ли мой ребенок рожден с EoE?
Дети, вероятно, не рождаются с EoE, но со временем они развиваются. Они могут родиться с предрасположенностью к заболеванию.
Получают ли взрослые EoE?
Взрослые получают EoE. Он может развиваться в детстве и сохраняться в зрелом возрасте. Некоторые люди впервые испытывают EoE во взрослом возрасте или получают диагноз только один раз в зрелом возрасте. Общее повышение осведомленности о заболевании улучшило распознавание болезни и необходимость в эндоскопической биопсии.
Вредно ли, если в пищеводе человека всего несколько эозинофилов?
Присутствие эозинофилов свидетельствует о воспалении пищевода. Воспаление всегда следует лечить, и его нельзя игнорировать. Однако, сколько эозинофилов «слишком много» и сколько «слишком долго», еще предстоит определить.
У некоторых людей больше шансов получить EoE?
Хотя любой может получить EoE, мальчики, как правило, развивают его чаще, чем девочки — примерно три к одному.
Каковы симптомы EoE у младенцев?
Младенцы с EoE обычно имеют симптомы, похожие на рефлюкс, включая рвоту, раздражительность, рвоту и отказ от кормления. Некоторые дети также могут испытывать проблемы с ростом.
Каковы симптомы EoE у детей ясельного возраста?
Симптомы EoE у детей ясельного возраста аналогичны таковым у младенцев, но они также могут жаловаться на боль в животе или испытывать проблемы с переходом на твердую пищу.
Каковы симптомы EoE у детей школьного возраста?
Дети школьного возраста могут иметь симптомы рефлюкса, а также могут периодически рвать.У них могут быть трудности с глотанием, но им трудно это объяснить.
Каковы симптомы EoE у детей старшего возраста и подростков?
Симптомы у детей старшего возраста и подростков аналогичны симптомам всех других возрастных групп, но могут также включать жалобы на затруднения при глотании или застревание пищи в пищеводе.
Кого следует тестировать на EoE?
Пациенты с симптомами, перечисленными в верхней части этой страницы, которые не реагируют на лечение, могут быть проверены на EoE.Это особенно актуально для тех, кто испытывает значительные трудности с проглатыванием твердой пищи.
Является ли EoE наследственным?
EoE может быть более распространенным в семьях. Членов семьи следует обследовать, если у них есть симптомы.
Дети перерастают EoE?
Имеются ограниченные данные о долгосрочных результатах EoE.
Может ли воспаление пищевода быть злокачественным?
Ограниченные данные для взрослых позволяют предположить, что воспаление не приводит к раку, но еще слишком рано говорить об этом наверняка.Любой воспалительный процесс, сохраняющийся с детства до взрослого возраста, должен вызывать беспокойство.
Что произойдет, если кто-то с эозинофильным расстройством подвергнется воздействию «небезопасной» пищи?
EoE-реакция может произойти не сразу. Обычно, если ребенок употребляет «небезопасную» пищу, у него могут обостриться симптомы в течение нескольких дней.
Одинаковы ли симптомы EoE у взрослых и детей?
Симптомы схожи, но взрослые обычно испытывают затруднения при глотании или застревает в пищеводе пища.У взрослых чаще возникают стриктуры, которые необходимо расширять.
Что такое стриктура?
EoE может вызывать изменения в тканях, выстилающих пищевод, что может привести к стриктуре или сужению пищевода. Считается, что это происходит в результате воспаления у некоторых детей и взрослых с EoE. При образовании стриктуры пища может не пройти изо рта в желудок.
Как лечат стриктуры?
Стриктуры пищевода обычно лечат путем расширения или растяжения пищевода.Для этого вводят длинную цилиндрическую резиновую трубку в рот и пищевод или вводят надувной баллон через эндоскоп в пищевод. Эти процедуры могут вызвать боль и разрывы пищевода. Пациенты и их семьи должны обсудить эти процедуры и понять риски.
Вопросы о диагностике EoE
Как диагностируется EoE?
EoE диагностируется путем оценки симптомов каждого ребенка, улучшения симптомов во время прохождения лечения EoE и признаков EoE, обнаруженных во время эндоскопии.У детей с EoE обычно наблюдается высокое количество эозинофилов в ткани пищевода. Более 15 эозинофилов на поле высокого увеличения обычно считается признаком EoE. Эндоскопист может упомянуть, что видит трахеализацию или бороздки (кольца) в пищеводе, что также указывает на EoE.
EoE может напоминать другие заболевания. У пациентов с ГЭРБ эозинофилы могут быть обнаружены в пищеводе в меньшем количестве. Пациенты с ГЭРБ и EoE могут реагировать на терапию блокаторами кислоты ингибиторами протонной помпы.Узнайте больше о ГЭРБ.
Что такое эндоскопия?
Эндоскопия, также известная как верхняя эндоскопия, эзофагогастродуоденоскопия и EGD, представляет собой тест с использованием специальной камеры для изучения слизистой оболочки пищевода, желудка и двенадцатиперстной кишки. Небольшие образцы тканей, называемые биопсиями, берутся для оценки под микроскопом. Для выполнения процедуры обычно требуется седация. Узнайте больше об эндоскопии.
Что такое биопсия?
В случае диагностики EoE биопсия — это небольшой образец ткани, взятый из слизистой оболочки желудочно-кишечного тракта, который можно исследовать под микроскопом, чтобы помочь диагностировать EoE и другие расстройства.
Сколько биопсий необходимо сделать для диагностики EoE?
EoE — это очаговое заболевание, поэтому обычно берут от четырех до шести образцов, чтобы повысить вероятность обнаружения заболевания, если оно присутствует.
Есть ли способ диагностировать EoE без инвазивных тестов или с помощью простого анализа крови?
К сожалению, эндоскопия — единственный способ поставить точный диагноз EoE. Для исключения других заболеваний могут потребоваться анализы крови и стула, но для диагностики первичного эозинофильного расстройства анализа крови не существует.
Придется ли пациентам проходить дополнительную эндоскопию и биопсию после постановки первоначального диагноза?
Пациентам, вероятно, со временем потребуется несколько эндоскопий, чтобы контролировать реакцию ребенка на лечение.
Как врачи выясняют, какие продукты могут вызывать симптомы EoE?
Наши специалисты используют комбинацию истории болезни пациентов и всех доступных тестов, включая укол кожи, пластырь и пищевые проблемы, чтобы определить продукты, вызывающие EoE.
Что такое кожный укол?
Это простая процедура, которая быстро определяет, есть ли у человека антитела к аллергену, пищевому или экологическому аллергену. Используя разбавленные растворы специфических аллергенов на пластиковых шпильках, один из наших врачей-аллергологов и иммунологов прокалывает поверхность кожи ребенка. Реакция на кожную пробу не всегда означает, что у вашего ребенка аллергия на аллерген, вызвавший реакцию. Кожные пробы дают быстрые результаты, обычно занимают 15 минут, и они более чувствительны, чем анализы крови.Кожные прик-тесты обычно сопровождаются пластырем.
Что такое патч-тестирование?
Это тест, который используется для выявления отсроченных аллергических реакций. Настоящая еда используется для проверки того, как детский организм реагирует на ее присутствие. Продукты, вызывающие реакцию, также могут вызывать симптомы EoE, однако это можно определить только после наблюдения за ребенком, когда еда ограничена, а затем снова введена. Узнайте больше о тестировании исправлений.
Информация о лечении EoE
Как лечится EoE?
Для детей с EoE основной целью лечения является обеспечение нормального роста и развития.Стероиды и / или диетические модификации являются наиболее распространенными методами лечения. Схемы лечения часто трудно поддерживать, и их необходимо подбирать индивидуально в соответствии с проблемами и образом жизни каждой семьи. Узнайте больше о лечении EoE в CHOC.
Правда ли, что некоторые дети с EoE не могут есть пищу?
Большинство детей могут есть немного еды, но каждый пациент с EoE немного отличается. Некоторые пациенты должны полагаться на специально разработанную формулу для своего питания. Эти диеты называются элементарными диетами.Узнайте больше о различных типах диет, используемых для устранения симптомов EoE.
Какие лекарства помогают EoE?
Некоторые пациенты с EoE принимают «проглоченные стероиды» для разрушения эозинофилов, борьбы с воспалением и обеспечения заживления. Продукты, которые используются для лечения EoE, изначально изучались у астматиков и одобрены для использования у детей. Фактически, некоторые из стероидов одобрены для детей в возрасте от 12 месяцев.
Некоторые пациенты с EoE могут также иметь симптомы аллергии, требующие ежедневного приема лекарств.Не каждому пациенту с EoE понадобится лекарство от аллергии.
Новые методы лечения под названием «биопрепараты» были изучены на пациентах с EoE. Неизвестно, насколько полезны эти искусственные антитела в будущем.
Где я могу получить дополнительную информацию о лечении эозинофильных расстройств?
Для получения дополнительных сетевых ресурсов по эозинофильному эзофагиту, пожалуйста, обратитесь к нашему списку онлайн-ресурсов.
Где я могу получить дополнительную информацию об экспериментальных методах лечения?
Дополнительная информация об экспериментальных ресурсах доступна через Американское партнерство по эозинофильным заболеваниям и Национальные институты здравоохранения.
Есть ли побочные эффекты от местных стероидов, таких как флутиказон и будесонид?
Во рту и горле человека содержится множество организмов, включая бактерии и дрожжи. Иногда при приеме подобных лекарств на поверхности рта и горла остается небольшое количество остатков. Это изменение может привести к размножению дрожжевых организмов и вызвать болезненность и проблемы с глотанием. Этот побочный эффект можно устранить полосканием горла водой и сплевыванием после каждого использования.
Нужна ли аллергия пациентам с EoE на шо ts?
Прививки от аллергии на аллергены окружающей среды и их влияние на EoE не изучалось.
Более высокая чувствительность младенцев по сравнению с материнскими предшественниками эозинофилов / базофилов к химическому воздействию в помещении
Цель . Известно, что повышенные уровни клеток-предшественников эозинофилов / базофилов (Eo / B) связаны с аллергическим воспалением и риском атопии. Целью настоящего исследования было изучить влияние различных воздействий в помещении на набор и дифференциацию предшественников Eo / B в парах мать-ребенок. Методы . В 68 парах мать-ребенок в исследовании LINA мононуклеарные клетки периферической крови были использованы для оценки колониеобразующих единиц (КОЕ) Eo / B.Информация об исходах заболевания и воздействиях в помещениях была получена из анкет. Концентрации летучих органических соединений (ЛОС) в помещениях измерялись пассивным отбором проб. Результатов . КОЕ младенцев Eo / B были положительно связаны с воздействием табачного дыма, дезинфицирующих средств или ЛОС. Напротив, для материнских КОЕ Eo / B было обнаружено только несколько ассоциаций. Более высокое количество младенческих КОЕ Eo / B наблюдалось у детей с симптомами свистящего дыхания в течение второго года жизни. Выводы .Мы демонстрируем, что кроветворные клетки младенца, по-видимому, более чувствительны к воздействию окружающей среды по сравнению с материнскими клетками. По крайней мере, у младенцев активация этих кроветворных клеток под воздействием окружающей среды может способствовать повышенному риску развития респираторных заболеваний.
1. Введение
Эозинофилы и базофилы являются типичными эффекторами аллергического воспаления [1]. У пациентов с астмой было обнаружено увеличение количества эозинофилов и базофилов в тканях, крови и костном мозге, а также корреляция с тяжестью заболевания [1–3].Кроме того, несколько исследований показали, что количество клеток-предшественников эозинофилов / базофилов, которые развиваются из клеток CD34 + костного мозга под влиянием специфических хемокинов и цитокинов [4], увеличивается в периферической крови пациентов с атопией и астмой [5, 6] , аллергический ринит [6–8], полипоз носа [8] или атопические кожные проявления [7], которые также рассматривались в Denburg и Keith [9] и Gauvreau и Denburg [10]. У детей предшественники Eo / B пуповинной крови различаются по фенотипу и функциям среди младенцев с риском атопии [11].Кроме того, было обнаружено, что предшественники пуповинной крови позволяют прогнозировать частоту и характеристики острых респираторных заболеваний у младенцев в течение первого года жизни [12]. Наряду с этими количественными отношениями к исходам болезней Denburg et al. продемонстрировали, что питание матери во время беременности может влиять на количество и функцию клеток-предшественников и, следовательно, на исходы заболеваний, такие как атопический дерматит и хрипы в возрасте одного года [13]. В согласии с этим наша собственная группа предоставила данные, показывающие, что количество клеток-предшественников Eo / B у годовалых детей с колыбелькой увеличивалось в связи с загрязнением окружающей среды [14].До сих пор данные, показывающие чувствительность предшественников Eo / B к образу жизни и факторам окружающей среды, ограничиваются кроветворной системой младенца. В рамках исследования LINA («Образ жизни и факторы окружающей среды и их влияние на риск аллергии у новорожденных») мы уже продемонстрировали, что уровни цитокинов Th2 / Th3 в пуповинной крови, но не материнские, зависят от химического воздействия во время беременности [15]. Этот результат может указывать на повышенную уязвимость младенцев по сравнению со взрослыми Т-клетками к воздействию окружающей среды. Целью настоящего исследования было выяснить, реагируют ли релевантные для аллергии эозинофильные / базофильные клетки-предшественники от младенцев с большей чувствительностью к загрязнителям окружающей среды по сравнению с клетками-предшественниками от их матерей, живущих в той же среде.
2. Материалы и методы
2.1. Дизайн исследования
Исследование матери и ребенка LINA было разработано для изучения того, как факторы окружающей среды в пре- и постнатальном периоде влияют на иммунную систему и являются ли они детерминантами повышенного риска аллергии в более позднем возрасте. Для этого исследования в период с мая 2006 г. по декабрь 2008 г. в Лейпциге, Германия, было отобрано 629 пар мать-ребенок (включая 7 близнецов). Матери, страдающие иммунными или инфекционными заболеваниями во время беременности, были исключены из исследования.Шестьсот шесть пар мать-ребенок участвовали в однолетнем обследовании, а 546 пар — в двухлетнем наблюдении (одно плановое посещение в год около дня рождения ребенка). Образцы крови 397 матерей и 340 детей были взяты у детей двухлетнего возраста (средний возраст: 2 года и 26 дней, мин – макс: 1 год и 343 дня – 2 года и 161 день) в рамках запланированного визита. Достаточное количество мононуклеарных клеток периферической крови (PBMC) для культур метилцеллюлозы было доступно для подгруппы из 68 соответствующих пар мать-ребенок (66 матерей, 68 детей; 2 пары близнецов).Все соответствующие числа показаны на рисунке A.1 в дополнительных данных, доступных в Интернете по адресу http://dx.doi.org/10.1155/2016/5293932. Участие в исследовании LINA было добровольным, и от всех участников было получено письменное информированное согласие. Исследование было одобрено этическим комитетом Лейпцигского университета (исх. № 046-2006, 160-2008).
2.2. Данные анкеты
Информация, касающаяся общих аспектов жизни и условий окружающей среды во время беременности, была собрана с помощью подробных анкет на 36-й неделе беременности.Кроме того, ежегодно собиралась информация о респираторных исходах у ребенка за последние 12 месяцев, а также информация о жилищных условиях и условиях окружающей среды (например, о воздействии табачного дыма в окружающей среде (ETS) и использовании чистящих средств). Все анкеты были заполнены родителями самостоятельно. Для получения более подробной информации, пожалуйста, обратитесь к разделу «Методы» дополнительных данных.
2.3. Приготовление образцов периферической крови
PBMC выделяли в течение шести часов после сбора от примерно 3 мл (ребенок) до 5 мл (мать) свежей гепаринизированной периферической крови с помощью центрифугирования плотности Ficoll Paque.PBMC замораживали в аликвотах по 1 мл 90% фетальной бычьей сыворотки и 10% диметилсульфоксида с 10–30 × 10 6 клеток. Протокол размораживания клеток и выделение неприлипающих мононуклеарных клеток (NAMNCs) выполняли согласно Reece et al. [16]. Жизнеспособность PBMC после оттаивания и NAMNC после 2 ч инкубации в среднем составила 93,4%.
2.4. Метилцеллюлозные культуры
В настоящей статье для оценки КОЕ Eo / B был использован хорошо зарекомендовавший себя и апробированный метод функционального анализа метилцеллюлозы [12, 14, 16].Для оценки дифференциации клеток-предшественников эозинофилов / базофилов путем образования колоний 5 × 10 5 NAMNC инкубировали в двух экземплярах в присутствии рекомбинантного человеческого цитокина IL-3 (1 нг / мл), IL-5 (1 нг / мл) или GM-CSF (10 нг / мл) (R&D Systems Europe Ltd., Абингдон, Оксон, Великобритания) в течение 14 дней. Колониеобразующие единицы (КОЕ) эозинофилов / базофилов были обнаружены и подсчитаны по их характерной морфологии с помощью светового инвертированного микроскопа. Подробности описаны ранее [12, 14, 16]. Исследователь, который проводил анализы и анализы предшественников, был не осведомлен о личности субъектов и других собранных данных.Из-за недостаточного количества клеток после оттаивания анализы метилцеллюлозы не могли быть выполнены для всех трех цитокинов в некоторых образцах. Количество случаев для культур, стимулированных IL-3, IL-5 и GM-CSF, дало в общей сложности 67, 66 и 56 анализируемых образцов для детей и 63, 36 и 11 образцов для матерей, соответственно. .
2.5. Измерение концентраций ЛОС и котинина
Для измерения индивидуального воздействия летучих органических соединений (ЛОС) в домашних условиях пассивные пробоотборники (мониторы 3M, тип OVM 3500; 3M GmbH, Нойс, Германия) были помещены в спальню ребенка (или альтернативно в комнате, где ребенок предпочтительно проводил большую часть своего времени) около первого дня рождения ребенка.Концентрации ЛОС были проанализированы, как описано ранее [17], и скорректированы с учетом сезонных колебаний, как описано в Schlink et al. [18]. Для анализа котинина см. Раздел «Методы» дополнительных данных.
2.6. Статистический анализ
Статистические тесты были выполнены с использованием STATISTICA для Windows версии 10.0 (StatSoft Inc. Europe, Гамбург, Германия). Критерий хи-квадрат был проведен для сравнения параметров анализируемой подгруппы с остальной когортой LINA (:).
Анализы, относящиеся к КОЕ Eo / B, рассчитываются в рамках описанной подгруппы (пары мать-ребенок, включая две группы близнецов). Расчеты для общих ассоциаций, независимых от анализов Eo / B CFU (например, воздействие ETS по сравнению с концентрациями ЛОС), были выполнены для всей когорты LINA (). Когда статистический анализ требовал разделения на подгруппы (например, воздействие ETS: да или нет), данные не были представлены для чисел <5.
Было проверено, может ли доступный размер выборки для анализа Eo / B выявить ожидаемое воздействие загрязнителей внутри помещений (в частности, ЛОС).При коэффициенте ошибок первого типа (альфа) 0,05, целевой мощности 0,9 и ожидаемой корреляции популяции 0,460 (согласно нашей более ранней статье [14] КОЕ Eo / B и общая сумма всех ЛОС коррелировали с), требуемый размер выборки для таких анализов составлял 45.
Поскольку большинство параметров не имели нормального распределения, анализы в целом проводились с использованием непараметрических тестов. Чтобы определить взаимосвязь между количеством КОЕ Eo / B и атопическими исходами или воздействием ETS или дезинфицирующих средств в помещении, медианы сравнивались с использованием теста Манна-Уитни.Чтобы проверить эти результаты, были использованы модели множественной логистической регрессии для определения скорректированного отношения шансов (OR) с 95% доверительным интервалом. Были использованы следующие искажающие факторы: месяц рождения (для сезонных изменений), пол ребенка (для потенциальных различий между мальчиками и девочками), школьное образование родителей (как маркер социального статуса) и семейный анамнез атопии (для рассмотрения индивидуальный генетический фон), а также воздействие ETS в помещении во время беременности, уровень котинина у матери в первый день рождения ребенка, сумма всех измеренных ЛОС в первый день рождения ребенка (как котинин, так и ЛОС в качестве маркера воздействия ETS во второй день рождения ребенка). год жизни), сырость в жилище на втором году жизни (как маркер раннего контакта с аллергеном дыхательных путей) и дети с инфекциями дыхательных путей на втором году жизни (для рассмотрения потенциального неаллергического происхождения хрипов).Тест ранговой корреляции Спирмена применялся для анализа связи между количеством КОЕ Eo / B у матери и ребенка и между количеством выкуриваемых сигарет и КОЕ Eo / B, а также между концентрациями ЛОС и количеством КОЕ Eo / B. Все значения <0,05 считались значимыми. Корректировки из-за многократного тестирования не проводились, так как наш анализ был основан на гипотезе a priori [19].
3. Результаты
3.1. Характеристики исследуемой популяции
Характеристики исследуемой популяции показаны в таблице 1 (A).Не было различий в распределении рассматриваемых параметров в анализируемой подкогорте () по сравнению с остальной когортой LINA ().
В целом, была обнаружена положительная корреляция между соответствующими материнскими и младенческими IL-3- (,,), а также GM-CSF- (,,) стимулированными Eo / B КОЕ (таблица 2). Все показанные значимые связи между КОЕ Eo / B, воздействием окружающей среды и клиническими исходами суммированы на Рисунке 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



 Кроме того, повышенное число эозинофилов может выявляться у детей, которые недавно перенесли пневмонию или гепатит. После таких болезней, как и в послеоперационный период и после травм, эозинофильные лейкоциты могут определяться выше нормы довольно длительное время.
Кроме того, повышенное число эозинофилов может выявляться у детей, которые недавно перенесли пневмонию или гепатит. После таких болезней, как и в послеоперационный период и после травм, эозинофильные лейкоциты могут определяться выше нормы довольно длительное время.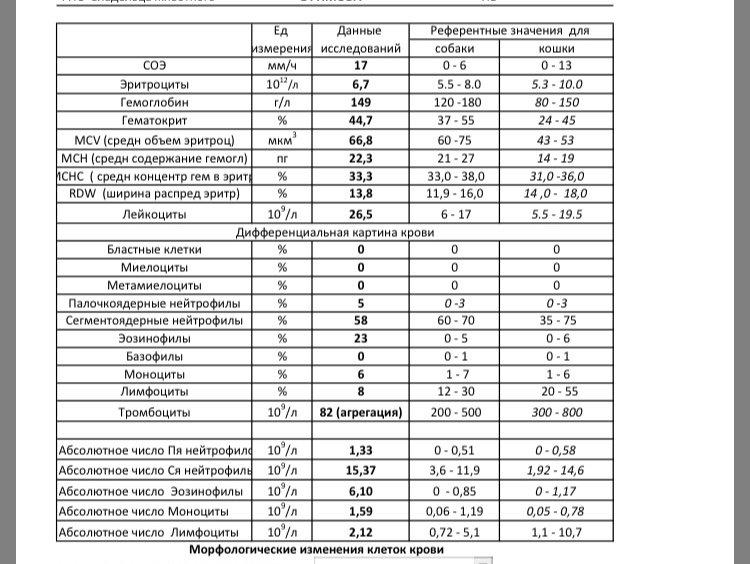 Также ребенку назначаются антигистаминные средства, облегчающие зуд и воспалительный процесс.
Также ребенку назначаются антигистаминные средства, облегчающие зуд и воспалительный процесс.