Гипотрофия у детей раннего возраста — причины гипотрофии, диагностика и лечение, степени
Гипотрофия у детей – дефицит массы, связанный с недостатком либо нарушением усвоения в организме питательных веществ. Ежегодно диагностируется от 2 до 30 % случаев патологии.
Классификация и клинические симптомы
По времени развития гипотрофию классифицируют на внутриутробную и внеутробную. По выраженности различают три степени патологии:
-
гипотрофия 1 степени у детей – недостаток веса до 10-20 % от нормы. Малыши развиваются по возрасту, снижение аппетита незначительное. Кожа бледная, жировой слой истончен; -
гипотрофия 2 степени у детей – снижение веса на 20-30 % и отставание роста на 2-3 см. Нарушена активность, аппетит плохой. Тургор кожи и тонус мышц резко снижены, жировой слой отсутствует на теле и конечностях; -
3 степень гипотрофии у детей — недобор веса на 30 % и более, резко выраженное отставание в развитии и росте. Отмечается адинамичность, заостренность черт лица, сухость, серость кожи и слизистых, атрофичность мышц и тканей, расстройство работы внутренних органов. Подкожный жир отсутствует. Развиваются осложнения: конъюнктивиты, пневмонии, анемии. Состояние тяжелое.
Отмечается адинамичность, заостренность черт лица, сухость, серость кожи и слизистых, атрофичность мышц и тканей, расстройство работы внутренних органов. Подкожный жир отсутствует. Развиваются осложнения: конъюнктивиты, пневмонии, анемии. Состояние тяжелое.
Причины гипотрофии у детей
Гипотрофия у детей раннего возраста возникает под действием внешних и внутренних причин.
Внутренние причины – это различные заболевания: ферментопатии, пороки развития, иммунодефициты.
Внешние причины связаны с тремя факторами:
-
алиментарный: при несбалансированном/недостаточном питании -дефиците грудного молока, частом срыгивании, болезнях (родовые травмы, заячья губа, ДЦП и др.), голодании; -
инфекционный, связанный с ОРВИ и другими инфекциями; -
социальный — плохие условия проживания.
Диагностика и лечение гипотрофии у детей
Врожденная патология обнаруживается при УЗИ-диагностике. Приобретенная гипоторофия у детей до года и старше диагностируется при осмотре, изменении антропометрических показателей, подтверждается при углубленном обследовании.
Подход к лечению зависит от причин. Алиментарный фактор корректируется диетой: оптимизацией питания по качеству, нутриентному и витаминно-минеральному составу, калорийности. Медикаментозное лечение – только по рекомендации врача.
Обязателен контроль динамики роста и массы тела. Лучший помощник для мамы — высокоточные смарт-весы AGU Wally с мониторингом веса и роста ребенка в мобильном приложении, помогающие избежать и гипотрофии, и паратрофии.
Профилактика гипотрофии у детей включает качественное питание и лечение сопутствующих болезней.
Гипотрофия — Медкор
Гипотрофия первой степени
Первоначально недостаток питательных элементов организм пытается компенсировать накопленным подкожно-жировым слоем. Жиры из депо мигрируют в кровь, проходят через печень и превращаются в энергию для поддержания нормальной физиологической активности органов и систем. Первоначально жировые запасы исчезают в области живота, затем в других местах. Оценка степени истощения подкожно-жирового слоя производится разными методиками. Наиболее практичным, и вместе с тем информативным методом, считается индекс Чулицкой. В основе данного метода лежит измерение окружности плеча в двух разных местах, затем бедра и голени, а от получившейся суммы отнимают рост ребенка. Норма для ребенка до года равна 20-25 см. Другой способ представляет собой измерение кожной складки в четырех разных местах: на животе слева от пупка, на плече, в области лопаток, и наконец, на бедре с внешней стороны. При нормальном росте и развитии ребенка кожная складка равна приблизительно 2-2.5 см. При первой степени гипотрофии индекс Чулицкой равен 10-15 сантиметрам, а кожная складка незначительно уменьшается.
Жиры из депо мигрируют в кровь, проходят через печень и превращаются в энергию для поддержания нормальной физиологической активности органов и систем. Первоначально жировые запасы исчезают в области живота, затем в других местах. Оценка степени истощения подкожно-жирового слоя производится разными методиками. Наиболее практичным, и вместе с тем информативным методом, считается индекс Чулицкой. В основе данного метода лежит измерение окружности плеча в двух разных местах, затем бедра и голени, а от получившейся суммы отнимают рост ребенка. Норма для ребенка до года равна 20-25 см. Другой способ представляет собой измерение кожной складки в четырех разных местах: на животе слева от пупка, на плече, в области лопаток, и наконец, на бедре с внешней стороны. При нормальном росте и развитии ребенка кожная складка равна приблизительно 2-2.5 см. При первой степени гипотрофии индекс Чулицкой равен 10-15 сантиметрам, а кожная складка незначительно уменьшается.
Симптомы гипотрофии первой степени:
•Жировые складки дряблые, тонус мышц снижен, теряется эластичность и упругость кожи.
•Рост ребенка первоначально соответствует возрастным нормам.
•Масса тела снижена приблизительно от 11% до 20% от первоначальной.
•Общее самочувствие нормальное. Отмечается быстрое утомление.
•Нарушений со стороны центральной нервной системы нет. Сон тревожный, прерывистый.
•Ребенок немного раздражителен, может срыгивать съеденную пищу.
Гипотрофия второй степени
Изменения те же что, при первой степени, но отличие состоит в том, что они немного углубляются, а также появляются другие характерные симптомы:
Признаки гипотрофии второй степени:
•Подкожный жировой слой сильно истончается на ногах, руках, и может отсутствовать на животе или груди.
•Индекс Чулицкой снижается, и варьирует в пределах от одного до десяти сантиметров.
•Кожные покровы бледные, сухие.
•Кожа дряблая, легко сдвигается в складки.
•Волосы и ногти становятся ломкими.
•Снижается мышечная масса на конечностях, масса тела убывает приблизительно на двадцать – тридцать процентов, также отмечается отставание в росте.
•Нарушается терморегуляция, такие дети быстро замерзают, или также быстро перегреваются.
•Высок риск обострения хронических инфекций (пиелонефрит, отит, пневмония).
•Нарушение устойчивости по отношению к принимаемой пище.
В связи с трофическими нарушениями ворсинок и слизистой оболочки кишечника нарушается пищеварение, в частности всасывание питательных веществ. Появляется дисбактериоз, то есть преобладает патогенная бактериальная флора. У детей появляются: усиленное газообразование, вздутие и дискомфорт в области живота. Нередки запоры или поносы, часто сменяющиеся друг за другом.
•Снижается мышечный тонус. Из-за значительно сниженного тонуса мышц живот выпячивается наружу, и создается впечатление лягушачьего живота.
Из-за значительно сниженного тонуса мышц живот выпячивается наружу, и создается впечатление лягушачьего живота.
•Недостаток витамина Д и кальция в организме приводит к дополнительному развитию слабости мышц, развитию симптомов остеопороза (вымывание кальция из костей). При этом кости черепа становятся мягкими, большой и малый роднички остаются открытыми довольно длительное время.
•Со стороны центральной нервной системы также выявляется ряд патологических нарушений, сходных с таковыми при первой степени гипотрофии. Дети беспокойны, не могут уснуть, часто капризничают. Затем характерные симптомы перевозбуждения центральной нервной системы постепенно сменяются вялостью и апатией к окружающему миру.
Гипотрофия третьей степени Отражает всю полноту клинической картины заболевания. При данной степени максимально выражены нарушения работы всех органов и систем. Первичная причина заболевания обуславливает наиболее тяжелое состояние ребенка, малоэффективность предпринимаемых мер по выведению ребёнка из данного состояния, и его дальнейшее выздоровление. Третья степень гипотрофии характеризуется сильным истощением организма, снижением всех видов обмена веществ.
Третья степень гипотрофии характеризуется сильным истощением организма, снижением всех видов обмена веществ.
Характерные признаки и симптомы гипотрофии третьей степени:
•По внешнему виду можно сразу определить, что существует хронический недостаток питания. Подкожно-жировой слой отсутствует практически во всех местах, включая лицо. Кожные покровы сухие, бледные и настолько истончены, что ребенок выглядит, будто мумия.
•При попытке образовать пальцами кожную складку практически отсутствует сопротивление здоровой кожи. Эластичность кожи настолько снижена, что складка не расправляется в течение длительного времени после отпускания пальцев. По всему телу образуются глубокие морщины.
•Мышечная масса и масса тела в целом настолько малы, что индекс упитанности по Чулицкой не определяется, либо отрицательный. Общее снижение массы тела составляет 30% и более от нормальных показателей.
•На лице видно западение щек, скулы выпячиваются вперед, выражено заострение подбородка.
•Четко выражены проявления нехватки жизненно важных микроэлементов и витаминов.
•Нехватка железа сказывается на появлении трещин в углах рта (заеды), а также анемии.
•Недостаток витаминов А и С проявляется в виде появления на слизистых оболочках: кровоточивости и атрофии (отмирание, уменьшение в размерах) десен, стоматита в виде мелких белесоватых высыпаний.
•Живот сильно растянут за счет слабости мышц, поддерживающих его.
•Температура тела часто скачет вверх вниз за счет того, что не работает центр терморегуляции в головном мозге.
•Резко снижен иммунитет. Можно обнаружить признаки вялотекущих хронических инфекций. Воспаление среднего уха – отит, воспаление почек – пиелонефрит, воспаление легких – пневмония.
•У ребенка рост отстает от среднестатистических показателей.
Варианты течения гипотрофии
Отставание в росте и развитии ребенка может присутствовать на каждом этапе его развития, начиная преимущественно со второй половины беременности, и заканчивая периодом младшего школьного возраста.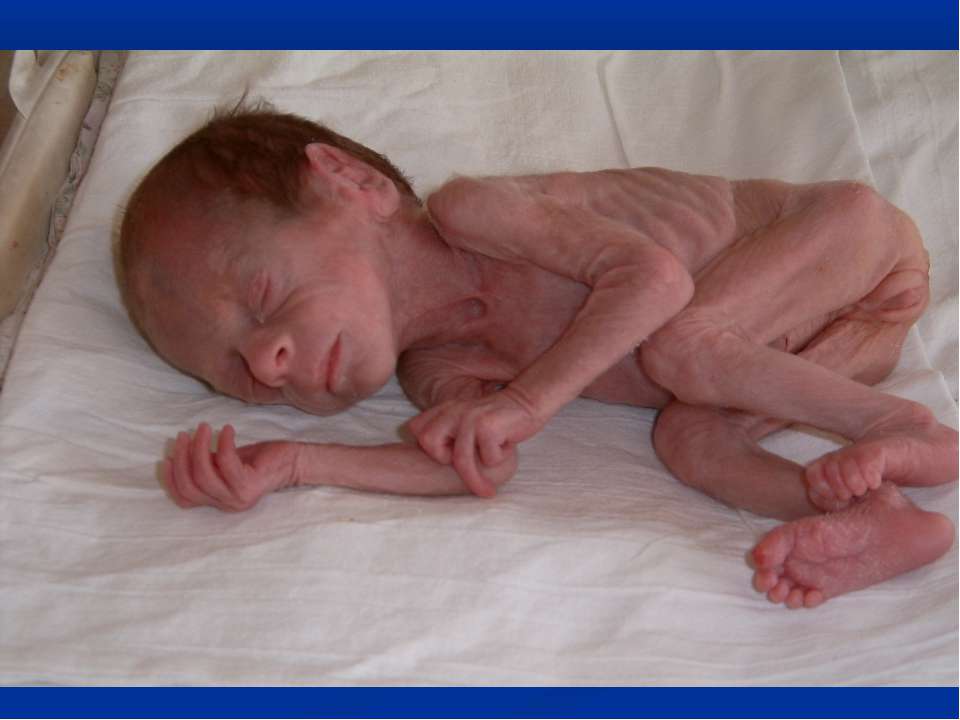 При этом проявления заболевания характеризуются своими особенностями. В зависимости от периода развития гипотрофических проявлений, различают четыре варианта течения гипотрофии:
При этом проявления заболевания характеризуются своими особенностями. В зависимости от периода развития гипотрофических проявлений, различают четыре варианта течения гипотрофии:
•внутриутробная гипотрофия;
•гипостатура;
•квашиоркор;
•алиментарный маразм.
Внутриутробная гипотрофия
Внутриутробная гипотрофия берет свое начало еще во внутриутробном периоде. Некоторые авторы называют данную патологию внутриутробной задержкой развития плода. Существует несколько вариантов развития внутриутробной гипотрофии:
1. Гипотрофический – когда нарушается питание всех органов и систем, плод развивается очень медленно, и не соответствует сроку беременности.
2. Гипопластический – этот вариант развития означает, что наряду с недостаточным общим развитием организма плода, существует и некоторое отставание в созревании и развитии всех органов. Здесь идет речь о том, что органы и ткани при рождении недостаточно сформированы, и не полностью выполняют свои функции.
Здесь идет речь о том, что органы и ткани при рождении недостаточно сформированы, и не полностью выполняют свои функции.
3. Диспластический вариант течения гипотрофии характеризуется неравномерным развитием отдельных органов. Одни, например сердце, печень – развиваются нормально, соответствуя сроку беременности, а другие – наоборот, отстают в своем развитии, или развиваются несимметрично.
Гипостатура Гипостатура – термин берет свое начало из греческого языка, и означает hypo – ниже, или под, statura – рост, или величина. При этом варианте развития гипотрофии существует равномерное отставание как в росте ребенка, так и в его массе тела. Единственное отличие от истинной гипотрофии заключается в том, что кожные покровы и подкожно-жировой слой не подвергаются сильным изменениям. Гипостатура, как один из вариантов течения гипотрофии, возникает вторично при хронических заболеваниях некоторых внутренних органов. Развитие гипостатуры обычно связано с переходными периодами роста и развития ребенка. Один из таких периодов приходится на первое полугодие жизни ребенка. При этом к материнскому молоку начинают понемногу добавлять продукты питания, молочные смеси – другими словами, докармливать ребенка. Появление данной патологии на втором году жизни связано, прежде всего, с врожденными хроническими заболеваниями. Вот часто встречающиеся из них:
Один из таких периодов приходится на первое полугодие жизни ребенка. При этом к материнскому молоку начинают понемногу добавлять продукты питания, молочные смеси – другими словами, докармливать ребенка. Появление данной патологии на втором году жизни связано, прежде всего, с врожденными хроническими заболеваниями. Вот часто встречающиеся из них:
•Врожденные пороки сердечнососудистой системы. Нарушение кровообращения ведет к недостаточному притоку кислорода и питательных веществ к органам и тканям.
•Энцефалопатии в сочетании с эндокринными расстройствами также крайне неблагоприятно влияют на обмен веществ в организме, задерживая развитие и рост.
•Бронхолегочная дисплазия – это нарушенное развитие легочной ткани еще в период внутриутробного развития плода. При этом возникают серьезные осложнения, связанные с дыханием и доставкой кислорода в кровь.
Как уже было сказано выше, дети с гипостатурой преимущественно отстают в росте. Было доказано, что устранение причины, вызвавшей данную патологию, постепенно приводит к нормализации роста таких детей. Квашиоркор Термином квашиоркор принято называть такой вариант течения гипотрофии, который встречается в странах с тропическим климатом, и где в питании преобладает растительная пища. Кроме того существуют специфические нарушения, при которых организм недополучает, не синтезирует или вовсе не усваивает белковую пищу. К нарушениям, способствующим развитию квашиоркора, относятся:
Было доказано, что устранение причины, вызвавшей данную патологию, постепенно приводит к нормализации роста таких детей. Квашиоркор Термином квашиоркор принято называть такой вариант течения гипотрофии, который встречается в странах с тропическим климатом, и где в питании преобладает растительная пища. Кроме того существуют специфические нарушения, при которых организм недополучает, не синтезирует или вовсе не усваивает белковую пищу. К нарушениям, способствующим развитию квашиоркора, относятся:
•Длительное нарушение пищеварения, проявляющееся постоянным неустойчивым стулом – другими словами, у ребенка хроническая диарея.
•При заболеваниях печени нарушается ее белковообразовательная функция.
•Заболевания почек, сопровождающиеся повышенной потерей белка вместе с мочой.
•Ожоги, чрезмерные кровопотери, инфекционные заболевания.
Недостаточное потребление белковых продуктов (мясо, яйца, молочные) приводит к своеобразному течению данной патологии, выражающемуся в четырех основных и постоянных симптомах:
1. Нервно-психические расстройства – ребенок апатичен, вял, у него наблюдается повышенная сонливость, отсутствие аппетита. При обследовании таких детей часто можно выявить отставание в психомоторном развитии (поздно начинает держать головку, сидеть, ходить, речь формируется с большим опозданием).
Нервно-психические расстройства – ребенок апатичен, вял, у него наблюдается повышенная сонливость, отсутствие аппетита. При обследовании таких детей часто можно выявить отставание в психомоторном развитии (поздно начинает держать головку, сидеть, ходить, речь формируется с большим опозданием).
2. Отёки обусловлены недостатком белковых молекул в крови (альбуминов, глобулинов и др.). Альбумины поддерживают онкотическое давление в крови, привязывая к себе молекулы воды. Как только возникает белковая недостаточность, вода сразу покидает сосудистое русло и проникает в межтканевое пространство – образуется местная отечность тканей. В начальных стадиях болезни отекают преимущественно внутренние органы, но этот факт ускользает от внимания родителей. В развернутых (манифестных) стадиях болезни отекают периферические ткани. Отеки появляются на лице, стопах, конечностях. Создается ошибочное представление, что ребенок здоров и упитан.
3. Cнижение мышечной массы. Мышечная масса, а вместе с ней сила, значительно уменьшаются. Белковое голодание приводит к тому, что организм заимствует собственные белки из мышц. Происходит так называемая атрофия мышечных волокон. Мышцы становятся дряблыми, вялыми. Вместе с мышцами нарушается питание подлежащих тканей и подкожно-жировой клетчатки.
Мышечная масса, а вместе с ней сила, значительно уменьшаются. Белковое голодание приводит к тому, что организм заимствует собственные белки из мышц. Происходит так называемая атрофия мышечных волокон. Мышцы становятся дряблыми, вялыми. Вместе с мышцами нарушается питание подлежащих тканей и подкожно-жировой клетчатки.
4. Опоздание в физическом развитии детей. Сопровождается недостаточностью ростового показателя, в то время как масса тела снижена намного меньше. Дети при квашиоркоре низкого роста, приземисты, двигательная активность находится ниже нормы. Кроме постоянных симптомов, у детей, страдающих квашиоркором, присутствуют другие признаки заболевания, встречающиеся с различной частотой. Частыми симптомами считаются:
1. Изменение цвета, смягчение истончение и, в конце концов, выпадение волос на голове. Волосы становятся светлее, а в более поздних проявлениях болезни, или у детей старшего возраста, обнаруживаются обесцвеченные, или вовсе седые пряди волос.
2. Дерматит – воспаление поверхностных слоев кожных покровов. На коже проявляются покраснение, зуд, трещины. В последующем кожа на пораженных участках отшелушивается, и на этом месте остаются следы в виде светлых пятен. К редким симптомам относят:
1. Дерматоз – красно-коричневые пятна округлой формы.
2. Гепатомегалия – патологическое увеличение печени. Печеночная ткань замещается жировой и соединительной тканью. Печень не способна образовывать ферменты и другие активные вещества, необходимые для нормальной функции всего организма.
3. Нарушения функции почек. Снижается фильтрационная способность. В крови накапливаются вредные продукты обмена веществ.
4. Нарушения стула носит постоянный характер. У ребенка присутствует постоянный понос. Каловые массы блестят и неприятно пахнут.
Подытоживая изложенный материал, с уверенностью можно сказать, что квашиоркор – это заболевание, исключительно редко встречающееся в странах с умеренным климатом. Страны, расположенные в данной географической широте, имеют развитый социальный статус и уровень жизни, поэтому практически исключается возможность недоедания и дефицита в питании белков и калорий.
Страны, расположенные в данной географической широте, имеют развитый социальный статус и уровень жизни, поэтому практически исключается возможность недоедания и дефицита в питании белков и калорий.
Алиментарный маразм
Алиментарный маразм (истощение) встречается у детей младшего и старшего школьного возраста. При маразме присутствует недостаток как белков, так и калорий. Чтобы установить причину и поставить точный диагноз, выясняют: •Из истории начала заболевания узнают, какова была масса тела ребенка еще до того, как появились первые признаки гипотрофии.
•Социально-экономическое положение, в котором находится семья ребенка.
•По возможности выяснить суточный рацион.
•Есть ли рвота или хроническая диарея, и насколько часто возникает.
•Принимает ли данный ребенок какие-либо лекарственные средства. Например, анорексигенные, которые подавляют аппетит, или мочегонные средства, выводящие из организма много полезных питательных веществ, в том числе белок. •Есть ли нарушения со стороны центральной нервной системы: стрессовые ситуации, алкогольная или наркотическая зависимость.
•Есть ли нарушения со стороны центральной нервной системы: стрессовые ситуации, алкогольная или наркотическая зависимость.
•В подростковом возрасте, в частности у девочек, начиная с 12 лет, выясняют наличие и оценивают регулярность, периодичность и длительность менструального цикла. Все вышеперечисленные факторы прямым или косвенным путем отражаются на состоянии организма, влияют на все органы и системы, угнетая их функциональную работоспособность. Тем самым предрасполагают к развитию алиментарного маразма. Среди всех симптомов, появляющихся при алиментарном маразме, выделяют постоянные и редкие симптомы.
К постоянным симптомам относят:
•потеря массы тела достигает до 60% от нормальной, соответствующей возрасту;
•уменьшение толщины подкожно-жирового слоя;
•уменьшение массы мышечных волокон;
•конечности больного становятся очень тонкими;
•на лице появляются множество морщин, кожа обтягивает все лицевые кости и, кажется, будто это лицо старика. Редкими симптомами считаются:
Редкими симптомами считаются:
•Диарея, носит хронический характер. Стул жидкий, блестит, с неприятным запахом.
•Истончение и просветление волос, которые со временем начинают выпадать.
•Обострение хронических инфекций – очень частый спутник ослабленного недоеданием организма.
•Молочница – грибковое заболевание, при котором поражаются слизистые оболочки полости рта, влагалища и мочеиспускательного канала. Проявляются выделениями белесоватого цвета, зудом и дискомфортом в указанных местах. •Симптомы поливитаминной недостаточности, в зависимости от нехватки определенных витаминов и минералов. При объективном обследовании у таких детей обнаруживается множество патологических изменений среди всех органов и систем:
•Глазные изменения проявляются воспалением век, образованием новых мелких сосудов на роговой оболочке. Во внутренних углах глаз появляются бляшки сероватого цвета (недостаток витамина А).
•В ротовой полости наблюдаются воспалительные изменения слизистой оболочки и десен. Язык увеличивается в размерах (из-за нехватки витамина В12).
•Сердце увеличивается в размерах. Недостаточная сила сердечных толчков приводит к застаиванию крови в венах, появляется отечность нижних конечностей.
•Слабость мышц передней брюшной стенки обуславливает отвислый, выступающий живот. Печень выступает за нижний край правого подреберья.
•Явные неврологические нарушения проявляются в нервозности, повышенной раздражительности, мышечной слабости, в снижении сухожильных рефлексов. Функциональные изменения отражают степень патологических нарушений, связанных с белково-калорийной недостаточностью:
•Ухудшается память, снижаются умственно-познавательные способности, в том числе работоспособность. •Падает острота зрения. Недостаток витамина А обуславливает снижение зрения в сумеречное время.
•Острота вкусовых ощущений также снижена.
•Недостаток витамина С приводит к повышенной ломкости капилляров. На коже можно заметить мелкоточечные кровоизлияния после легкого щипка. Нехватка незаменимых жирных кислот Если присутствует дефицит незаменимых жирных кислот (линолевая и линоленовая кислоты), незамедлительно появляются специфические симптомы, характерные при недостаточном их потреблении. Линоленовая и линолевые кислоты в большом количестве содержатся в растительных маслах (оливковое, подсолнечное, соевое). В большинстве случаев данный вариант гипотрофии появляется у детей грудного возраста, которым недостает в питании материнского молока. Коровье молоко и другие молочные смеси не содержат незаменимые жирные кислоты количестве, необходимом для энергетических и пластических затрат молодого организма. В зависимости от недостаточности той или иной жирной кислоты, симптомы заболевания будут немного отличаться друг от друга. При недостатке линолевой кислоты появляются следующие симптомы:
•Сухость кожных покровов с отшелушиванием поверхностного рогового слоя.
•Алопеция (облысение).
•Заживление ран продолжается длительный период.
•Тромбоцитопения – пониженное количество тромбоцитов (клетки крови, отвечающие за ее свертываемость) в крови. Недостаток тромбоцитов приводит к повышенной ломкости мелких сосудов, при случайных мелких бытовых повреждениях кожных покровов кровотечение удлиняется. Незначительные щипки вызывают появление множества мелкоточечных кровоизлияний.
•Длительный неустойчивый стул (диарея).
•Периодические обострения инфекционных заболеваний (к примеру, кожи или легких).
Недостаток линоленовой кислоты приводит к: •онемению и парестезии (чувство покалывания) нижних и верхних конечностей;
•общей мышечной слабости;
•нарушению четкости зрения.
В целом, тяжесть патологических изменений и отставание массы тела от роста зависят от множества причин, в том числе от длительности белкового и калорийного голодания юношей и девушек. Поэтому своевременное выяснение причин приводящих к развитию алиментарного маразма может предотвратить все патологические последствия. Диагностика гипотрофии Основные положения Подходя к этапу диагностирования гипотрофии, вариантов течения, возможных осложнений со стороны других органов – необходимо учитывать несколько моментов. Обнаружение важных клинических признаков по всем основным системам, вовлеченным в патологический процесс. Сюда включают следующие нарушения: •нарушения упитанности – проявляются в виде истончения подкожно-жирового слоя и трофических изменений; •нарушения пищеварительной функции – включают изменение устойчивости к пище;
Поэтому своевременное выяснение причин приводящих к развитию алиментарного маразма может предотвратить все патологические последствия. Диагностика гипотрофии Основные положения Подходя к этапу диагностирования гипотрофии, вариантов течения, возможных осложнений со стороны других органов – необходимо учитывать несколько моментов. Обнаружение важных клинических признаков по всем основным системам, вовлеченным в патологический процесс. Сюда включают следующие нарушения: •нарушения упитанности – проявляются в виде истончения подкожно-жирового слоя и трофических изменений; •нарушения пищеварительной функции – включают изменение устойчивости к пище;
•нарушения обмена веществ: белкового, жирового, углеводного, минерального, витаминного;
•функциональные нарушения со стороны центральной нервной системы.
Важным, и основным критерием для диагностирования данной патологии, является размер подкожного жирового слоя. Чем тоньше этот слой, тем более выражено нарушение общего состояния организма. Вторым моментом, который не должен ускользать от внимания врачей, является дифференцировка патологических изменений, происходящих при гипотрофии, с другими похожими заболеваниями, со снижением роста, массы тела, и общего физического развития детей. Симптомы детей с гипостатурой очень схожи с таким заболеванием, как нанизм. Это патология центральных эндокринных органов (гипоталамуса и гипофиза), при которой не вырабатывается гормон роста – соматотропин. При данном заболевании, в отличие от гипостатуры, нет патологических изменений в виде истончения подкожного жирового слоя и других трофических нарушений. Все органы развиваются равномерно, хотя и уменьшены в размере. Оценка состояния ребенка и определение степени патологических изменений определяется также по характеру каловых масс. Первоначально при гипотрофии стул скудный, без цвета, с характерным зловонным запахом. В дальнейшем нарушения функциональной способности перерабатывать пищу желудочно-кишечным трактом приводят к тому, что стул становится обильным, блестит, в нем присутствуют остатки непереваренной пищи, мышечных волокон.
Вторым моментом, который не должен ускользать от внимания врачей, является дифференцировка патологических изменений, происходящих при гипотрофии, с другими похожими заболеваниями, со снижением роста, массы тела, и общего физического развития детей. Симптомы детей с гипостатурой очень схожи с таким заболеванием, как нанизм. Это патология центральных эндокринных органов (гипоталамуса и гипофиза), при которой не вырабатывается гормон роста – соматотропин. При данном заболевании, в отличие от гипостатуры, нет патологических изменений в виде истончения подкожного жирового слоя и других трофических нарушений. Все органы развиваются равномерно, хотя и уменьшены в размере. Оценка состояния ребенка и определение степени патологических изменений определяется также по характеру каловых масс. Первоначально при гипотрофии стул скудный, без цвета, с характерным зловонным запахом. В дальнейшем нарушения функциональной способности перерабатывать пищу желудочно-кишечным трактом приводят к тому, что стул становится обильным, блестит, в нем присутствуют остатки непереваренной пищи, мышечных волокон. Инфицирование патогенными бактериями слизистой оболочки кишечника влечет за собой явления дисбактериоза (диарея, вздутие и дискомфорт в области живота). Вследствие недостаточного поступления белка, организм использует внутренние резервы (из мышц, жировой ткани), продукты обмена которых в виде аммиака выводятся почками. Моча таких больных имеет запах аммиака. Лабораторные исследования Ввиду того, что при гипотрофии присутствует многообразие патологических изменений, лабораторные анализы будут вариабельны, в зависимости от преимущественного поражения того или иного органа. К примеру, при анемии будет снижение числа эритроцитов и гемоглобина в кровяном русле. В биохимических анализах можно обнаружить признаки нарушения работы печени, недостаток витаминов и микроэлементов.
Инфицирование патогенными бактериями слизистой оболочки кишечника влечет за собой явления дисбактериоза (диарея, вздутие и дискомфорт в области живота). Вследствие недостаточного поступления белка, организм использует внутренние резервы (из мышц, жировой ткани), продукты обмена которых в виде аммиака выводятся почками. Моча таких больных имеет запах аммиака. Лабораторные исследования Ввиду того, что при гипотрофии присутствует многообразие патологических изменений, лабораторные анализы будут вариабельны, в зависимости от преимущественного поражения того или иного органа. К примеру, при анемии будет снижение числа эритроцитов и гемоглобина в кровяном русле. В биохимических анализах можно обнаружить признаки нарушения работы печени, недостаток витаминов и микроэлементов.
Гипотрофия
курение, употребление алкоголя и наркотических веществ матерью, а также неблагоприятные социальные условия и стрессы.
Недостаточное или несбалансированное питание, неблагоприятные условия окружающей среды, частые инфекционные заболевания у ребенка после рождения могут приводить к приобретенной гипотрофии. Кроме того, риск гипотрофии повышается при наличии тяжелых хронических заболеваний и пороков развития у ребенка, особенно при иммунодефицитных состояниях. Если попытаться разобраться в механизмах развития данного состояния становится понятно что гипотрофия развивается по типу порочного круга. Нарушение процессов пищеварения, приводящее к дефициту питательных веществ опосредует снижение продукции витаминов, гормонов и некоторых пищеварительных веществ, в результате чего нарушение пищеварения усугубляется, может возникать снижение защитных сил организма, сопровождающееся легкой восприимчивостью к инфекциям. Развитие инфекционных заболеваний обуславливает еще больший дефицит питательных веществ.
Кроме того, риск гипотрофии повышается при наличии тяжелых хронических заболеваний и пороков развития у ребенка, особенно при иммунодефицитных состояниях. Если попытаться разобраться в механизмах развития данного состояния становится понятно что гипотрофия развивается по типу порочного круга. Нарушение процессов пищеварения, приводящее к дефициту питательных веществ опосредует снижение продукции витаминов, гормонов и некоторых пищеварительных веществ, в результате чего нарушение пищеварения усугубляется, может возникать снижение защитных сил организма, сопровождающееся легкой восприимчивостью к инфекциям. Развитие инфекционных заболеваний обуславливает еще больший дефицит питательных веществ.
Различают 3 степени гипотрофии. Легкую степень гипотрофии, как правило, пропускают. Дети могут становиться немного более плаксивы, капризны. Возможно легкое снижение аппетита. При осмотре можно отметить легкую бледность, уменьшение количества подкожной жировой клетчатки в большей степени на животе. Дефицит массы тела достигает 10-20% от средних значений.
Дефицит массы тела достигает 10-20% от средних значений.
При среднетяжелой степени гипотрофии, ребенок становится менее активным, мало интересуется окружающим, игрушками, быстро устает, легко раздражается. Могут возникать задержка развития речи, эмоциональная сфера скуднеет. Аппетит снижен. Кожа ребенка бледная, сухая, дряблая. Возможно нарушение терморегуляции в виде снижения температуры тела, похолодания конечностей. Подкожная жировая клетчатка сохранена на лице, но значительно истощена на животе и конечностях. Дефицит массы по отношению к росту достигает 20-30%, дефицит роста – 2-4 см по сравнению со средними значениями. Ребенок начинает чаще и тяжелее болеть. Отмечается повышение частоты дыханий и сердечных сокращений, при попытке насильственного кормления возникает рвота, нередки запоры. Стул как правило скудный.
При крайней степени гипотрофии ребенок сонлив, безучастен к окружающему, при попытке контакта – раздражителен, негативен. Отмечается выраженное отставание в психическом развитии, утрата приобретенных навыков. Подкожная жировая клетчатка резко истощена на всем теле. Ребенок напоминает скелет обтянутый кожей. Мышцы истощены, тонкие, тонус их резко снижен. Дефицит массы тела составляет более 30%, дефицит роста – 7-10 см. У ребенка выявляются симптомы недостаточного поступления жидкости – сухие слизистые, морщинистые губы, трещины в углах рта. Конечности постоянно холодные, в целом температура тела обычно снижена. Дыхание поверхностное, ритм его неправильный. Пульс слабый, частота сердечных сокращений снижена. Отмечаются частые срыгивания, рвота. Стул жидкий частый, мочеиспускание редкое, малыми порциями.
Подкожная жировая клетчатка резко истощена на всем теле. Ребенок напоминает скелет обтянутый кожей. Мышцы истощены, тонкие, тонус их резко снижен. Дефицит массы тела составляет более 30%, дефицит роста – 7-10 см. У ребенка выявляются симптомы недостаточного поступления жидкости – сухие слизистые, морщинистые губы, трещины в углах рта. Конечности постоянно холодные, в целом температура тела обычно снижена. Дыхание поверхностное, ритм его неправильный. Пульс слабый, частота сердечных сокращений снижена. Отмечаются частые срыгивания, рвота. Стул жидкий частый, мочеиспускание редкое, малыми порциями.
Не следует недооценивать состояние ребенка. Помимо внешних изменений, могут возникать нарушения со стороны внутренних органов, которые могут длительно, и возможно пожизненно препятствовать нормальному развитию организма и приводить к инвалидизации и даже смерти. Прогноз зависит от степени гипотрофии а также потенциальной возможности устранения провоцирующих факторов.
Лечение данного состояния всегда комплексное и требует участия команды квалифицированных врачей, имеющих опыт в диетологии, педиатрии, неврологии, а также других специалистов. Одним из основополагающих направлений при этом является исключение провоцирующих факторов, нормализация бытовых условий, санация очагов хронической инфекции, борьба с гиподинамией и диетотерапия.
Одним из основополагающих направлений при этом является исключение провоцирующих факторов, нормализация бытовых условий, санация очагов хронической инфекции, борьба с гиподинамией и диетотерапия.
Лечение гипотрофии легкой степени, как правило, проводится в домашних условиях под тщательным наблюдением педиатра. При более тяжелых нарушениях необходима госпитализация.
Диетотерапия складывается из двух основных периодов – в первом, который может занимать до 5-7 дней, необходимо выяснить какие продукты переносятся ребенком. При этом не следует обогащать питание сложными блюдами. Лучше если пища будет простой, при этом, обычно применяется принцип «омоложения» диеты, т.е. применяются те продукты, которые рассчитаны на детей более младшего возраста. На втором этапе, который будет длиться до выздоровления, но, минимально 2-3 недели, необходимо постепенно увеличивать объем потребляемой пищи до возрастной нормы с коррекцией ее качества. Питание должно быть дробным. Кроме того, обязательным условием является эффективный контроль диетотерапии с ведением пищевого дневника, контролем массы тела, включающим все необходимые лабораторные и другие методы обследования. При легкой степени гипотрофии расчет питания производится на долженствующую массу тела (т.е. ту, которую должен иметь здоровый ребенок в этом возрасте) с обязательным соблюдением принципа адекватности (ребенок должен получать все необходимые ему вещества). Несмотря на то что сейчас существует достаточное количество материалов по организации питания и физиологическим потребностям ребенка, зачастую составление диеты вызывает значительные трудности у родителей. Поэтому мы рекомендуем Вам обратиться к педиатру, имеющему опыт в ведении детей с гипотрофией.
При легкой степени гипотрофии расчет питания производится на долженствующую массу тела (т.е. ту, которую должен иметь здоровый ребенок в этом возрасте) с обязательным соблюдением принципа адекватности (ребенок должен получать все необходимые ему вещества). Несмотря на то что сейчас существует достаточное количество материалов по организации питания и физиологическим потребностям ребенка, зачастую составление диеты вызывает значительные трудности у родителей. Поэтому мы рекомендуем Вам обратиться к педиатру, имеющему опыт в ведении детей с гипотрофией.
Гипотрофия это состояние нарушенного питания ребенка, сопровождающееся дефицитом массы тела. Гипотрофия может быть внутриутробной и приобретенной. При первом варианте отмечается замедление набора массы плодом. Тому может быть масса причин. Наиболее часто правильное развитие плода нарушается при наличии инфекционных и хронических заболеваний у матери, патологии плаценты, гестозах на любых сроках. Кроме того, влияние могут оказывать юный (до 20 лет) или старший (более 40 лет) возраст беременной, профессиональные вредности, недостаточное питание, курение, употребление алкоголя и наркотических веществ матерью, а также неблагоприятные социальные условия и стрессы. Недостаточное или несбалансированное питание, неблагоприятные условия окружающей среды, частые инфекционные заболевания у ребенка после рождения могут приводить к приобретенной гипотрофии. Кроме того, риск гипотрофии повышается при наличии тяжелых хронических заболеваний и пороков развития у ребенка, особенно при иммунодефицитных состояниях. Если попытаться разобраться в механизмах развития данного состояния становится понятно что гипотрофия развивается по типу порочного круга. Нарушение процессов пищеварения, приводящее к дефициту питательных веществ опосредует снижение продукции витаминов, гормонов и некоторых пищеварительных веществ, в результате чего нарушение пищеварения усугубляется, может возникать снижение защитных сил организма, сопровождающееся легкой восприимчивостью к инфекциям. Развитие инфекционных заболеваний обуславливает еще больший дефицит питательных веществ.
Недостаточное или несбалансированное питание, неблагоприятные условия окружающей среды, частые инфекционные заболевания у ребенка после рождения могут приводить к приобретенной гипотрофии. Кроме того, риск гипотрофии повышается при наличии тяжелых хронических заболеваний и пороков развития у ребенка, особенно при иммунодефицитных состояниях. Если попытаться разобраться в механизмах развития данного состояния становится понятно что гипотрофия развивается по типу порочного круга. Нарушение процессов пищеварения, приводящее к дефициту питательных веществ опосредует снижение продукции витаминов, гормонов и некоторых пищеварительных веществ, в результате чего нарушение пищеварения усугубляется, может возникать снижение защитных сил организма, сопровождающееся легкой восприимчивостью к инфекциям. Развитие инфекционных заболеваний обуславливает еще больший дефицит питательных веществ.
Различают 3 степени гипотрофии. Легкую степень гипотрофии, как правило, пропускают. Дети могут становиться немного более плаксивы, капризны. Возможно легкое снижение аппетита. При осмотре можно отметить легкую бледность, уменьшение количества подкожной жировой клетчатки в большей степени на животе. Дефицит массы тела достигает 10-20% от средних значений.
Возможно легкое снижение аппетита. При осмотре можно отметить легкую бледность, уменьшение количества подкожной жировой клетчатки в большей степени на животе. Дефицит массы тела достигает 10-20% от средних значений.
При среднетяжелой степени гипотрофии, ребенок становится менее активным, мало интересуется окружающим, игрушками, быстро устает, легко раздражается. Могут возникать задержка развития речи, эмоциональная сфера скуднеет. Аппетит снижен. Кожа ребенка бледная, сухая, дряблая. Возможно нарушение терморегуляции в виде снижения температуры тела, похолодания конечностей. Подкожная жировая клетчатка сохранена на лице, но значительно истощена на животе и конечностях. Дефицит массы по отношению к росту достигает 20-30%, дефицит роста – 2-4 см по сравнению со средними значениями. Ребенок начинает чаще и тяжелее болеть. Отмечается повышение частоты дыханий и сердечных сокращений, при попытке насильственного кормления возникает рвота, нередки запоры. Стул как правило скудный.
При крайней степени гипотрофии ребенок сонлив, безучастен к окружающему, при попытке контакта – раздражителен, негативен. Отмечается выраженное отставание в психическом развитии, утрата приобретенных навыков. Подкожная жировая клетчатка резко истощена на всем теле. Ребенок напоминает скелет обтянутый кожей. Мышцы истощены, тонкие, тонус их резко снижен. Дефицит массы тела составляет более 30%, дефицит роста – 7-10 см. У ребенка выявляются симптомы недостаточного поступления жидкости – сухие слизистые, морщинистые губы, трещины в углах рта. Конечности постоянно холодные, в целом температура тела обычно снижена. Дыхание поверхностное, ритм его неправильный. Пульс слабый, частота сердечных сокращений снижена. Отмечаются частые срыгивания, рвота. Стул жидкий частый, мочеиспускание редкое, малыми порциями.
Отмечается выраженное отставание в психическом развитии, утрата приобретенных навыков. Подкожная жировая клетчатка резко истощена на всем теле. Ребенок напоминает скелет обтянутый кожей. Мышцы истощены, тонкие, тонус их резко снижен. Дефицит массы тела составляет более 30%, дефицит роста – 7-10 см. У ребенка выявляются симптомы недостаточного поступления жидкости – сухие слизистые, морщинистые губы, трещины в углах рта. Конечности постоянно холодные, в целом температура тела обычно снижена. Дыхание поверхностное, ритм его неправильный. Пульс слабый, частота сердечных сокращений снижена. Отмечаются частые срыгивания, рвота. Стул жидкий частый, мочеиспускание редкое, малыми порциями.
Не следует недооценивать состояние ребенка. Помимо внешних изменений, могут возникать нарушения со стороны внутренних органов, которые могут длительно, и возможно пожизненно препятствовать нормальному развитию организма и приводить к инвалидизации и даже смерти. Прогноз зависит от степени гипотрофии а также потенциальной возможности устранения провоцирующих факторов.
Лечение данного состояния всегда комплексное и требует участия команды квалифицированных врачей, имеющих опыт в диетологии, педиатрии, неврологии, а также других специалистов. Одним из основополагающих направлений при этом является исключение провоцирующих факторов, нормализация бытовых условий, санация очагов хронической инфекции, борьба с гиподинамией и диетотерапия.
Лечение гипотрофии легкой степени, как правило, проводится в домашних условиях под тщательным наблюдением педиатра. При более тяжелых нарушениях необходима госпитализация.
Диетотерапия складывается из двух основных периодов – в первом, который может занимать до 5-7 дней, необходимо выяснить какие продукты переносятся ребенком. При этом не следует обогащать питание сложными блюдами. Лучше если пища будет простой, при этом, обычно применяется принцип «омоложения» диеты, т.е. применяются те продукты, которые рассчитаны на детей более младшего возраста. На втором этапе, который будет длиться до выздоровления, но, минимально 2-3 недели, необходимо постепенно увеличивать объем потребляемой пищи до возрастной нормы с коррекцией ее качества. Питание должно быть дробным. Кроме того, обязательным условием является эффективный контроль диетотерапии с ведением пищевого дневника, контролем массы тела, включающим все необходимые лабораторные и другие методы обследования. При легкой степени гипотрофии расчет питания производится на долженствующую массу тела (т.е. ту, которую должен иметь здоровый ребенок в этом возрасте) с обязательным соблюдением принципа адекватности (ребенок должен получать все необходимые ему вещества). Несмотря на то что сейчас существует достаточное количество материалов по организации питания и физиологическим потребностям ребенка, зачастую составление диеты вызывает значительные трудности у родителей. Поэтому мы рекомендуем Вам обратиться к педиатру, имеющему опыт в ведении детей с гипотрофией.
Питание должно быть дробным. Кроме того, обязательным условием является эффективный контроль диетотерапии с ведением пищевого дневника, контролем массы тела, включающим все необходимые лабораторные и другие методы обследования. При легкой степени гипотрофии расчет питания производится на долженствующую массу тела (т.е. ту, которую должен иметь здоровый ребенок в этом возрасте) с обязательным соблюдением принципа адекватности (ребенок должен получать все необходимые ему вещества). Несмотря на то что сейчас существует достаточное количество материалов по организации питания и физиологическим потребностям ребенка, зачастую составление диеты вызывает значительные трудности у родителей. Поэтому мы рекомендуем Вам обратиться к педиатру, имеющему опыт в ведении детей с гипотрофией.
Автор: врач-педиатр ДМЦ «Тигренок» Жарков П. А.
причины, симптомы, диагностика, лечение, профилактика
Паталогическое состояние, обусловленное хроническим нарушением питания, что сопровождается недостаточным приростом массы тела ребенка по отношению к его росту и возрасту.
Причины
Хроническое нарушение питания может возникать на фоне различных факторов, которые воздействуют в пренатальном или постнатальном периоде.
Внутриутробная гипотрофия у плода возникает в результате воздействия неблагоприятных условий, нарушающих нормальное развитие плода. В пренатальном периоде развитие гипотрофии плода и новорожденного могут вызывать патология беременности, соматические заболевания женщины, стрессы, вредные привычки, нарушение питания женщины, производственные и экологические вредности, внутриутробное инфицирование и гипоксия плода.
Развитие внеутробной гипотрофии у детей раннего возраста может возникать на фоне эндогенных и экзогенных факторов. К эндогенным причинам относят хромосомные аномалии и врожденные пороки развития, ферментопатии, снижение защитных сил организма, аномалии конституции.
Все экзогенные факторы, приводящие к гипотрофии у детей, делятся на алиментарные, инфекционные и социальные. Алиментарные факторы обусловлены развитием белково-энергетических дефицитов, возникающих на фоне недостаточного или несбалансированного питания. Возникновение гипотрофии у ребенка может возникать на фоне систематического недокармливания, связанного с затруднением сосания при неправильной форме сосков у матери, гипогалактией, недостаточным количеством молочной смеси, частыми и обильными срыгиваниями, несбалансированным питанием ребенка и кормящей женщины. К этой же группе причин также относятся заболевания самого новорожденного, не позволяющие ему активно сосать и получать необходимое количество пищи, такие как расщелина губы и неба, врожденные пороки сердца, родовые травмы, перинатальные энцефалопатии, пилоростеноз, детский церебральный паралич и алкогольный синдром плода.
Возникновение гипотрофии у ребенка может возникать на фоне систематического недокармливания, связанного с затруднением сосания при неправильной форме сосков у матери, гипогалактией, недостаточным количеством молочной смеси, частыми и обильными срыгиваниями, несбалансированным питанием ребенка и кормящей женщины. К этой же группе причин также относятся заболевания самого новорожденного, не позволяющие ему активно сосать и получать необходимое количество пищи, такие как расщелина губы и неба, врожденные пороки сердца, родовые травмы, перинатальные энцефалопатии, пилоростеноз, детский церебральный паралич и алкогольный синдром плода.
К развитию приобретенной гипотрофии предрасположены дети, часто болеющие острыми респираторными инфекциями, кишечными инфекциями, воспалительным поражение легочной ткани или туберкулезом. Развитию гипотрофии у детей также способствуют неблагоприятные санитарно-гигиенические условия, обусловленные некачественным уходом за ребенком.
Симптомы
При гипотрофии первой степени состояние детей практически не нарушено, нервно-психическое развитие находится в пределах нормы, иногда у ребенка может определяться незначительное снижение аппетита. При физикальном осмотре выявляется бледность кожных покровов, снижение тургора тканей, уменьшение толщины подкожно-жирового слоя в области живота.
При физикальном осмотре выявляется бледность кожных покровов, снижение тургора тканей, уменьшение толщины подкожно-жирового слоя в области живота.
Для гипотрофии II степени характерно нарушение активности ребенка и выраженное снижение аппетита. У ребенка выявляется бледность кожных покровов, а также их усиленное шелушение и дряблость. Определяется снижение мышечного тонуса, эластичности и упругости тканей. Кожа у малыша легко собирается в складки, которые плохо расправляются. На животе, конечностях и туловище исчезает подкожно-жировой слой, но при этом он сохраняется на лице. У ребенка может обнаруживается одышка, артериальная гипотония и тахикардия.
При гипотрофии III степени у ребенка выявляется резкое истощение, отмечается атрофия подкожно-жирового слоя на всем туловище и на лице. Ребенок адинамичен и фактически не реагирует на раздражители. Такие малыши резко отстают в росте и нервно-психическом развитии. Кожные покровы у ребенка имеют бледно-серый окрас, слизистые оболочки сухие и бледные, отмечается атрофия и отсутствие тургора мышц. В терминальной стадии гипотрофии у ребенка возникает гипотермия, урежение сердечного ритма и гипогликемия.
В терминальной стадии гипотрофии у ребенка возникает гипотермия, урежение сердечного ритма и гипогликемия.
Диагностика
Чаще всего выявление внутриутробной гипотрофии плода, происходит при проведении ультразвукового исследования беременной. В процессе акушерского ультразвукового обследования может определяться размеры головки, длина и предполагаемая масса плода. При задержке внутриутробного развития плода акушер-гинеколог направляет беременную в стационар для выявления причин нарушения.
У новорожденных детей гипотрофии может определяться сразу после рождения. Для выявления нарушения применяют антропометрию, основанную на определении параметров физического развития: длины, массы, окружности головы, груди, плеча, живота, бедра, толщины кожно-жировых складок.
Лечение
Лечение постнатальной гипотрофии основано на мероприятиях, которые включают устранение причин нарушения питания, диетотерапию, организацию правильного ухода, устранение метаболических нарушений.
Медикаментозная терапия основана на назначении ферментов, витаминов, адаптогенов, анаболических гормонов. При тяжелой степени гипотрофии может потребоваться внутривенное введение белковых гидролизатов, глюкозы, солевых растворов, витаминов.
Профилактика
Профилактика развития пренатальной гипотрофии плода включает соблюдение режима дня и питания беременной и исключении влияния на плод различных неблагоприятных факторов.
Дальнозоркость у детей: причины, симптомы, степени
Дальнозоркость или по-научному гиперметропия – это дефект зрительного восприятия, во время которого снижается видимость предметов, расположенных и вблизи, и вдали. Дальнозоркость присутствует у всех новорожденных детей, что обусловлено физиологическими особенностями оптической системы глаз и является вариантом нормы.
Но в некоторых случаях патология сохраняется и в дальнейшем, возникают дополнительные симптомы в виде жжения и быстрого утомления глаз, головных болей, снижения зрения, косоглазия.
Гиперметропия достаточно опасное заболевание, ведь заметить скрытые симптомы могут только очень внимательные родители, а поставить окончательный диагноз исключительно врач-офтальмолог. Своевременно начатое лечение у детей позволяет в дальнейшем навсегда избавиться от патологии.
Норма и патология при гиперметропии
Гиперметропия в норме присутствует у детей раннего возраста (1-3 года), не вызывает беспокойства и не требует лечения. В период развития между младенчеством и школьным возрастом (до 6-7 лет) идет активный рост, увеличивается масса тела ребенка, развиваются внутренние органы и системы. Особенно активное развитие происходит в зрительной системе – вырабатывается точное соотношение функциональности разных частей глазного яблока.
У детей к четырем годам данный дефект зрительного восприятия проходит. Специалисты считают, что обнаружить заболевание и отличить его от нормы можно уже с первых месяцев жизни. При выявлении дальнозоркости у детей больше возрастных нормальных значение требует проведения лечения.
Очень важно начать терапию сразу после постановки диагноза, так как дети школьного возраста подвергаются усиленной нагрузке на глаза. В дальнейшем, при отсутствии коррекции глаз, симптомы гиперметропии усиливаются.
Особенности гиперметропии
При детской дальнозоркости расстройство зрительного анализатора характеризуется фокусировкой изображения не на зрительной части сетчатки, а за ее пределами. Симптомы проявляются невозможностью различать объекты, находящиеся вблизи, но которые ребенок отлично различает на далеком расстоянии. Так, малыши с данным дефектом не могут сосредоточиться на игрушке, которая находится рядом возле них.
Четкость зрения, видимость предметов вдали и вблизи обеспечивает аккомодационный аппарат. Фокусировка изображения на сетчатке происходит благодаря изменению кривизны хрусталика, за которую отвечает ресничная мышца (цилиарная). Чтобы хорошо видеть объекты на близком расстоянии цилиарная мышца напрягается, а хрусталик становится более выпуклым и преломление света происходит сильнее. Для дальнего зрения хрусталик становится плоским благодаря расслаблению цилиарной мышцы. Таким образом, для хорошего рассмотрения предметов на разном расстоянии кривизна хрусталика постоянно изменяется. Показатель преломления хрусталика измеряют в диоптриях.
У детей с рождения глаз характеризуется гиперметропией, которая постепенно уменьшается с ростом глаза и исчезает полностью к 7 годам. Данное состояние у младенцев считается нормой и характеризуется не полностью сформировавшимся зрительным анализатором.
Классификация дальнозоркости
Степени тяжести гиперметропии у детей:
- Слабая стадия дальнозоркости характеризуется показателями до 2 дптр включительно – у детей отсутствуют симптомы за счет компенсации аккомодационных способностей зрительного органа. Первая стадия болезни обнаруживается при профилактических осмотрах, хорошо поддается коррекции с помощью специальных упражнений для глаз.
- Средняя степень патологии (от 2.25 до 5 дптр) – ребенок плохо видит вблизи, но может хорошо различать дальние объекты.
- Высокая степень нарушений (5.25 дптр и выше) – зрение значительно снижается, как вблизи, так и вдали.
Этиологические факторы развития детской дальнозоркости
Причинами развития дальнозоркости в детском возрасте являются:
- генетические факторы;пороки развития зрительной системы, неправильная закладка структур глаза;
- нарушение внутриутробного роста плода;
- травматическое повреждение глаз химическими соединениями или физическими факторами;
- состояния после инфекционных процессов;
- операции на зрительном органе;
- повышенное перенапряжение, утомляемость глаз;
- неправильно подобранные очки или контактные линзы.
Клиническая картина гиперметропии
При слабой степени дальнозоркости симптомы со стороны нарушения зрительной функции отсутствуют. Поэтому в данном периоде важно наблюдение родителей за изменившимся поведением ребенка. Признаки гиперметропии на ранних стадиях болезни, проявляются:
- учащенным морганием;
- капризностью и раздражительностью;
- постоянно возникающими головными болями, головокружением;
- невозможностью сконцентрироваться на игрушках и любых других предметах, расположенных близко или находящихся в руках;
- повышенная усталость глаз без видимых причин;
- нарушение сна;
- воспаление глазного яблока, гиперемия, сухость;
- повышенное слезотечение.
Средняя стадия болезни чаще диагностируется у детей при профилактических осмотрах офтальмолога в школьном возрасте. Выше описанная картина может проявляться более яркими симптомами. Основными проявлениями средней степени дальнозоркости являются плохая видимость предметов на близком расстоянии, их расплывчатость. Ребенок испытывает затрудения при чтении, письме. Таким пациентам ошибочно ставят диагнозы дисграфия, дислексия, задержка развития.
При высокой степени гиперметропии ребенок жалуется на плохую видимость ближних предметов и дальних объектов.
При гиперметропии часто развивается сходящееся косоглазие, имеются нарушения бинокулярного зрения.
Диагностические мероприятия
Пройдите полное обследование зрения
в глазной клинике «Леге Артис»
Пора исправить зрение!
Запись на прием по телефону:
Диагностика гиперметропии у детей проводится врачом-офтальмологом. Проверка остроты зрения проводится разными методами, в зависимости от возраста ребенка. Также перед началом исследования в глаз закапывают капли для расширения зрачка. Это приводит к расслаблению цилиарной мышцы и позволяет правильно измерить светопреломляющую способность глаза. Для своевременного выявления дальнозоркости рекомендуется посещать детского офтальмолога не реже 1 раз в год.
Диагностика состоит из сбора анамнеза, родители дают полную информацию о поведении ребенка и присутствующих жалобах: ребенок с проблемами зрительного восприятия быстро утомляется, становится замкнутым, у него преобладает плохое настроение, для детей школьного возраста характерно медленное чтение, но яркие картинки на расстоянии (билборды, плакаты) они рассматривают с высоким интересом.
Для выявления дальнозоркости используются разные методы диагностики:
- визометрия – для малышей применяют таблицы с картинками, для детей среднего школьного возраста таблицы с буквами;
- определение нарушений преломляющей способности глаза проводится с помощью авторефрактометрии, обязательно в условиях циклоплегии: медикаментозного расширения зрачка и выключения аккомодации;
- скиаскопия и ретиноскопия.
Методы лечения гиперметропии у детей
Лечение дальнозоркости проводится консервативным путем у детей до 18 лет. При отсутствии положительного эффекта после совершеннолетия применяется микрохирургическая операция или лазерная коррекция зрения.
Начиная с самого раннего возраста — с нескольких месяцев жизни, применяются оптические средства для коррекции зрения – очки или контактные линзы. Очковая коррекция наиболее распространенная, в связи с ее доступностью и дешевизной. Применяется плеоптическое аппаратное лечение для развития остроты зрения. Получить высокие положительные результаты и в будущем снять очки можно только при условии правильно подобранных линз. Для этого проводится диагностика, после чего врач выписывает рецепт на необходимые очки. Родители могут самостоятельно выбрать оправу, желательно отдавать предпочтение таким материалам, как карбон или пластмасса. Такие оправы обладают прочностью, надежностью и легкостью, не вызывают дискомфорта. Чтобы ребенок носил очки без капризов лучше выбирать оправу любимой цветовой гаммы малыша.
Некоторые родители подбирают с врачом для коррекции дальнозоркости контактные линзы, так как они имеют свои преимущества – в первую очередь, линзы не сползают и не пачкаются, не мешают ребенку заниматься активными видами спорта.
Аппаратное лечение гиперметропии
Методы аппаратного лечения применяются у детей с 3-х летнего возраста, такие методы весьма эффективны и нравятся малышам. Аппаратное лечение улучшает микроциркуляцию в тканевых структурах глаз, нормализует обменные процессы, улучшает трофику, стимулирует развитие зрительного анализатора, повышение остроты зрения, развитие бинокулярных функций.
Аппаратное лечение проводится в игровой форме по специальной программе, разработанной врачом.
Оперативное лечение
Лазерная коррекция остроты зрения проводится у пациентов с 18 лет. Применяются методы в ходе которых производится искусственное формирование роговичной поверхности с нужной преломляющей силой. Хирургическое вмешательство проводится и в тяжелых случаях и заключается в замене хрусталика.
Осложнения
Отсутствие лечения дальнозоркости может стать причиной развития амблиопии («ленивого глаза», не поддающегося коррекции с помощью оптики), косоглазия.
Гипотрофия — Справочник заболеваний
Гипотрофия — хроническое расстройство питания, в результате недостатка питательных веществ или нарушения их усвоения, характеризующееся снижением массы тела.
Общая информация
Преимущественно наблюдается у детей на первом году жизни, иногда до двух лет. По времени возникновения делится на врожденную и приобретенную.
Врожденная гипотрофия может быть вызвана несколькими причинами:
- Патологическим течением беременности, во время которой кровообращение в плаценте было нарушено;
- Внутриутробным инфицированием плода;
- Заболеваниями самой беременной, неправильным ее питанием, курением и употреблением алкоголя;
- Возрастом моложе 18, либо старше 30 лет;
- Воздействием вредного производства.
Приобретенная гипотрофия также может быть вызвана рядом причин: недокармливанием, затруднением сосания, неполноценным питанием; недоношенностью, частыми болезнями ребенка, пороками развития, родовой травмой, нарушением кишечного всасывания при массе заболеваниях обмена веществ и патологий эндокринной системы.
Симптомы
Гипотрофия 1 степени характеризуется потерей массы тела до 20% от возрастной нормы. При этом истончается подкожный жировой слой на животе.
При гипотрофии 2 степени потеря массы тела составляет 25-30% от возрастной нормы.
- Подкожный слой истончен на животе и конечностях, сохранен только на лице;
- Кожа сухая, дряблая;
- Наблюдается отставание в росте, снижение аппетита, нарушения стула;
- Ребенок становится раздражительным, утрачивает приобретенные ранее навыки;
- Нарушается терморегуляция тела.
При гипотрофии 3 степени потеря массы тела составляет более 30% от нормы. Прибавление массы тела отсутствует, ребенок сильно отстает в росте. По внешним признакам это крайняя степень истощения, при которой
- Кожные покровы бледно-серого цвета;
- Полностью отсутствует подкожный жировой слой;
- Все слизистые бледные и сухие;
- Во рту присутствуют элементы кандидозного стоматита ;
- Дыхание при этом поверхностное;
- Тоны сердца приглушены;
- Артериальное давление снижено;
- Низкая температура тела.
Профилактика
Обеспечение естественного вскармливания, достаточного рационального питания матери, лечение гипогалактии, ранее определение заболевания у новорожденных и детей грудного возраста.
Лечение
Лечение 1 степени амбулаторное, 2 и 3 степени — стационарное. Необходимо правильное питание, лечение сопутствующих заболеваний нарушения обмена веществ и инфекционных осложнений.
При недостатке молока у матери ребенка докармливают донорским или искусственными смесями. В случае недостатка в материнском молоке нужных веществ их назначают дополнительно в виде продуктов (творог, кефир, сливки, сахарный сироп). В тяжелых случаях питательные вещества вводят внутривенно через капельницу.
Независимо от причин заболевания, всем больным детям назначают витамины, ферменты (пепсин, абомин, панзинорм, фестал, панкреатин и др.), в тяжелых случаях — гормональная терапия, лечебная физкултура, массаж, ультрафиолетовое облучение. Немаловажен правильный уход за ребенком — это регулярные прогулки на свежем воздухе, предупреждение застоев в легких — чаще брать ребенка на руки и переворачивать, при охлаждении класть грелку к ножкам, тщательно ухаживать за полостью рта.
Третья степень гипотрофии угрожает летальным исходом с вероятностью в 30-50%
Особенности гипотрофии у детей — воспитанников дома ребенка
Известно, что дефицитные состояния (ДС) — это группа заболеваний, причиной которых является недостаточное поступление в желудочно-кишечный тракт (ЖКТ) и/или всасывание из него в кровь различных веществ: воды, белков, жиров, углеводов, витаминов и др. Одним из видов ДС является гипотрофия. Гипотрофия — это хроническое расстройство питания с дефицитом массы тела. Основным наиболее частым вариантом недостаточного питания является белково-энергетическая недостаточность. Однако, как правило, у таких детей есть и дефицит поступления витаминов, микроэлементов. Эпидемиологические исследования по распространенности гипотрофии у детей в Украине не проводились. Однако в течение последних лет отмечен рост числа детей с гипотрофиями. По данным ВОЗ, в развивающихся странах 20–30 % детей раннего возраста имеют белково-энергетическую и другие виды недостаточности питания [1, 12].
В настоящее время выделяют разнообразные причины и/или факторы риска развития ДС у детей. Прежде всего, это грудной и ранний возраст, на который приходится максимальная частота ДС. Именно в этот возрастной период наиболее активен рост организма и потребности в основных пищевых ингредиентах на единицу массы тела максимальны. Кроме того, дети, рожденные недоношенными, с задержкой внутриутробного развития, имеют исходно низкие запасы питательных веществ. В дальнейшем у этих детей на фоне увеличения потребности в питательных веществах снижается способность к их утилизации [2, 9, 10].
Другим не менее важным фактором риска развития ДС является искусственное вскармливание. Несмотря на то, что современные адаптированные для детского питания смеси скорригированы по многим ингредиентам (в лучших смесях их число доходит до 30), у детей, рано переведенных на искусственное вскармливание, достоверно чаще развиваются желудочно-кишечные, аллергические, инфекционные заболевания, анемия, рахит, различные гиповитаминозы [3, 11].
Следующим фактором риска развития ДС является недостаточное поступление различных питательных веществ в организм вследствие особенностей диеты ребенка из-за традиций питания в семье. В некоторых случаях одностороннее питание ребенка может быть обусловлено низкой общей и медицинской грамотностью, психическими заболеваниями, низким уровнем материального благосостояния семьи [4, 5].
К наиболее значимым факторам риска развития ДС относится нарушение переваривания и всасывания пищевых веществ за счет первичного или вторичного синдрома мальабсорбции, а также дисбиоза кишечника [6, 7].
В этиологической структуре ДС, и в частности гипотрофий, выделяют экзогенные, эндогенные и смешанные варианты. К экзогенным причинам относят алиментарный, инфекционный, токсический факторы, анорексию как следствие психогенной и другой депривации и др. К эндогенным причинам относятся: перинатальные энцефалопатии, бронхолегочная дисплазия, врожденные пороки развития ЖКТ с полной или частичной его непроходимостью, врожденные пороки развития сердечно-сосудистой системы, первичные и вторичные иммунодефициты, первичный и вторичный синдром мальдигестии и мальабсорбции, наследственные аномалии обмена веществ, эндокринные заболевания [8, 10].
В клинической картине гипотрофий различают ряд синдромов. Это синдром трофических расстройств, который характеризуется истончением подкожно-жирового слоя, снижением тургора тканей, дефицитом массы тела, нарушением пропорциональности телосложения, признаками полигиповитаминоза (А, В1, В2, В6, Д, Р, РР).
Синдром пищеварительных нарушений проявляется снижением аппетита вплоть до анорексии, нарушением толерантности к пище, неустойчивым стулом, дисбиозом кишечника, признаками мальдигестии в копроцитограмме.
Синдром дисфункции центральной нервной системы (ЦНС) характеризуется нарушением эмоционального тонуса и поведения ребенка, малой активностью, нарушением сна, терморегуляции, отставанием психомоторного развития, мышечной гипо-, дистонией.
Синдром нарушений гемопоэза и снижения иммунобиологической реактивности проявляется анемией, вторичными иммунодефицитными состояниями, склонностью к стертому, атипичному течению частых инфекционно-воспалительных заболеваний.
Целью настоящей работы явилось изучение этиологии и клинического течения гипотрофии у детей раннего возраста из социально неблагополучных семей.
Материалы и методы исследования
Под нашим наблюдением находились 72 ребенка — воспитанника городского специализированного дома ребенка «Наши дети» г. Донецка в возрасте от 3 месяцев до 1 года. Из них мальчиков — 37 (51,4 %), девочек — 35 (48,6 %). Исследование основывалось на анализе медицинской документации, клиническом наблюдении за детьми в динамике, оценке нарастания массы тела и роста, изучении индекса Чулицкой, проведении лабораторных (клинический анализ крови, протеинограмма, сахар, электролиты крови, сывороточное железо, общий анализ мочи, копроцитограмма, посев кала на микрофлору) и инструментальных (нейросонограмма, ЭКГ, ЭхоКГ, УЗИ внутренних органов) обследований.
Полученные результаты обрабатывались классическими математическими методами вариационной статистики с применением пакета прикладных программ Statistica for Windows.
Результаты исследований и их обсуждение
Особенностями перинатального анамнеза явилось то, что половина детей рождены от 3-й и следующих беременностей. Практически все матери (86,1 %) не наблюдались и не обследовались во время беременности. У 32 (44,4 %) матерей имели место в анамнезе сифилис и другие венерические заболевания, у 5 (6,9 %) — туберкулез. У 18 (25,0 %) детей имелись указания на патологию данной беременности у матери, 51 (70,8 %) ребенок родился в асфиксии различной степени. Следует подчеркнуть, что 15 (20,8 %) детей родились недоношенными, 17 (23,6 %) — с задержкой внутриутробного развития (ЗВУР). Из них у 7 (41,2 %) человек имел место гипотрофический вариант ЗВУР, у 4 (23,5 %) детей — гипопластический, у 6 (35,3 %) пациентов — диспластический. Типичными проявлениями диспластического варианта ЗВУР являлись множественные пороки развития, в том числе — пороки развития головного мозга, нарушения телосложения, дизэмбриогенетические стигмы. В рождении данной категории детей недоношенными либо с задержкой внутриутробного развития представляется значимым низкий социальный и образовательный уровень матерей, сопровождающийся нездоровым образом жизни, нерациональным питанием. Большинство матерей (68,1 %) во время беременности курили, употребляли алкоголь и наркотики.
Все дети с момента рождения находились на искусственном вскармливании. В доме ребенка использовались адаптированные молочные смеси, соответствующие возрасту, вовремя вводились прикормы. Суточный рацион детей был обогащен животными белками, жирами, витаминами, железом, микроэлементами.
Проведенные исследования выявили у 53 (73,6 %) детей гипотрофию. При этом гипотрофия I степени имела место у 31 (58,5 %) пациента, гипотрофия II степени — у 20 (37,7 %), гипотрофия III степени – у 2 (3,8 %) детей. Анализируя этиологическую структуру гипотрофии, следует отметить, что у детей — воспитанников дома ребенка имели место как экзогенные, так и эндогенные ее причины (табл. 1).
Из экзогенных причин у 30 (56,6 %) пациентов выявлен алиментарный фактор. Последний характеризовался затруднениями при вскармливании ребенка. Так, срыгивание и рвота от 1 до 6 раз в течение суток отмечались у 27 (50,9 %) детей, короткая уздечка языка — у 5 (9,4 %) детей, незаращение верхней губы и твердого неба — у 3 (5,7 %) человек.
Инфекционный причинный фактор имел место у 26 (49,1 %) пациентов с гипотрофией. При этом у 19 (35,8 %) детей диагностированы пневмонии, у 10 (18,9 %) детей — острые кишечные инфекции, у 7 (13,2 %) пациентов — инфекции мочевой системы, у 4 (7,5 %) — внутриутробные инфекции, у 1 (1,9 %) ребенка — токсико-септическое состояние. Следует отметить, что острые кишечные инфекции в генезе гипотрофии имеют особую значимость. Последние вызывают морфологические изменения слизистой оболочки кишечника (вплоть до атрофии ворсин), иммунопатологические повреждения кишечной стенки, приводя к развитию синдрома мальдигестии и мальабсорбции, дисбиоза кишечника [3].
Анализируя эндогенные причины гипотрофий, необходимо отметить наличие у каждого обследованного ребенка патологии ЦНС: последствий перинатального гипоксически-ишемического поражения — у 49 (92,5 %) детей, гидроцефалии — у 8 (15,1 %) пациентов, микроцефалии — у 4 (7,5 %) человек, врожденных пороков развития головного мозга — у 2 (3,8 %) детей, детского церебрального паралича — у 1 (1,9 %) ребенка.
Отличительной особенностью дома ребенка является то, что в нем пребывает большое количество детей с наследственными синдромами и врожденными пороками развития. Так, синдром недифференцированной дисплазии соединительной ткани отмечался у 18 (34,0 %) детей, синдром Дауна (трисомия 21-й хромосомы) — у 4 (7,5 %), фетальный алкогольный синдром — у 2 (3,8 %), синдром Гольденхара (окулоаурикуловертебральная дисплазия) — у 1 (1,9 %) ребенка.
Синдром иммунного дисбаланса диагностирован у 12 (22,6 %) детей, врожденные пороки сердца — у 3 (5,7 %) человек, дилатационная кардиомиопатия — у 1 (1,9 %) ребенка, бронхолегочная дисплазия — у 1 (1,9 %) ребенка, врожденный порок развития желудочно-кишечного тракта — у 1 (1,9 %) человека. Следует подчеркнуть, что у всех пациентов имел место смешанный генез гипотрофии.
Анализ анамнеза обследованных детей показал, что сопутствующие заболевания были представлены рахитом у 36 (67,9 %) пациентов, железодефицитной анемией легкой степени — у 30 (56,6 %), средней степени — у 4 (7,5 %) обследованных. Дисбиоз кишечника констатирован у 33 (62,3 %) детей. Атопическим дерматитом страдали 10 (18,9 %) обследованных.
В клинической картине у детей с гипотрофией I степени наблюдались истончение подкожно-жирового слоя на всех участках тела, и прежде всего на животе, снижение эластичности кожи, тургора мягких тканей, мышечного тонуса, бледность кожных покровов и слизистых оболочек, снижение массы тела на 15,73 ± 1,21 % ниже средних возрастных показателей. Рост детей не отставал от средних возрастных показателей. Индекс упитанности Чулицкой в среднем составил 12,42 ± 1,74. Психомоторное развитие детей соответствовало возрасту. Однако у трети пациентов выявлялись нарушение сна, беспокойство, быстрая утомляемость.
При гипотрофии II степени у всех детей подкожно-жировой слой отсутствовал на животе, груди, резко истончался на конечностях, сохранялся на лице. Кожа бледная, сухая, легко собиралась в складки. Тургор тканей снижен. Отмечались признаки полигиповитаминоза: мраморность, шелушение и гиперпигментация в складках, ломкость ногтей и волос, яркость слизистых. Выявлялись стигмы рахита: размягчение краев большого родничка, краниотабес, гаррисонова борозда, сколиоз, мышечная гипотония, отставание в прорезывании зубов. Наблюдались снижение массы тела на 24,03 ± 2,32 %, отставание в росте на 1,91 ± 0,72 см по сравнению со средними возрастными показателями. Индекс упитанности Чулицкой в среднем составил 5,73 ± 0,93. Кроме того, у 14 (70,0 %) детей отмечались слабость, раздражительность, беспокойный сон. У 9 (45,0 %) пациентов был снижен аппетит, наблюдался неустойчивый стул, выявлялись признаки мальдигестии в копроцитограмме.
Гипотрофия III степени диагностирована у 2 пациентов. У обоих детей имел место синдром Дауна. Внешний вид этих больных характеризовался крайней степенью истощения. Подкожно-жировой слой отсутствовал на животе, туловище, конечностях, резко истончался или отсутствовал на лице. Кожа бледно-серого цвета, конечности холодные. Кожная складка не расправлялась. На коже и слизистых оболочках имелись проявления полигиповитаминоза. Наблюдались гипопластические и остеомаляционные признаки рахита. Живот вздут. Стул неустойчивый: запор, чередующийся с кашицеобразным стулом. Отмечались гипопротеинемия, гипогликемия. Масса тела пациентов была снижена на 32,42 ± 1,13 % по сравнению со средними возрастными показателями. Дети резко отставали в росте (на 5,62 ± 1,44 см ниже средних возрастных показателей). Индекс упитанности Чулицкой составлял 0. Обращало внимание, что у детей были утеряны ранее приобретенные навыки нервно-психического развития.
Выводы
1. У детей раннего возраста из социально неблагополучных семей гипотрофия является частой патологией, составляя 73,6 %. При этом I степень гипотрофии имела место у 58,5 % пациентов, II и III степени — у 41,5 % больных.
2. Наиболее значимыми экзогенными причинами гипотрофии у детей — воспитанников дома ребенка являлись алиментарные (56,6 % детей) и инфекционные (49,1 % больных). Из эндогенных причин доминировали патология ЦНС (100,0 % больных) и наследственные синдромы (47,2 %). В большинстве случаев гипотрофия имела смешанный генез.
3. Для детей раннего возраста с наследственными синдромами и врожденными пороками развития характерна гипотрофия тяжелой степени.
Гипотрофия — обзор | Темы ScienceDirect
Эпигенетические изменения при синдроме Дауна
Синдром Дауна (СД) считается наиболее частой причиной умственной отсталости. Невропатологические исходы СД включают дефекты нейрогенеза, дифференцировки нейронов и гипотрофию мозга (Lepagnol-Bestel et al., 2009). DS в основном вызывается полной трисомией HSA21, хотя дополнительной копии критической области синдрома Дауна (DSCR) достаточно, чтобы вызвать DS.
HSA21 содержит 225 генов и 59 псевдогенов, и около 100 из них расположены в DSCR (Hattori et al., 2000). Хотя сам по себе DSCR не может воспроизвести полные особенности DS, его достаточно, чтобы вызвать большинство признаков DS. Одногенные мышиные модели, исследующие конкретные гены DSCR, во многом способствовали нашему знанию этого заболевания. Интересно, что некоторые из них имеют важные эпигенетические последствия.
DYRK1A считается одним из основных эффекторов в патологии DS, и его сверхэкспрессия вызывает ухудшение обучения и памяти, а также способствует патологии болезни Альцгеймера за счет фосфорилирования белков APP и TAU (Park et al., 2009). Интересно, что в отношении своей эпигенетики DYRK1A взаимодействует с комплексом SWI / SNIF. Как упоминалось выше, комплекс SWI / SNIF представляет собой ремоделирующий хроматин комплекс, который участвует в устройстве структуры хроматина. Обычно это связано с экспрессией генов и влияет на явные подмножества генов в соответствии с его взаимодействующими элементами. Комплекс SWI / SNF индуцирует экспрессию нижестоящих генов, таких как JARID1D (HDMT), L3MBTL2 (HMT) и NCOR (интерактор HDAC) (Lepagnol-Bestel et al., 2009). DYRK1A также фосфорилирует HDAC SIRT1 и CREB, регулируя транскрипцию многих генов посредством ацетилирования гистонов (Guo et al., 2010; Park et al., 2009). Таким образом, DYRK1A полностью участвует в эпигенетическом аппарате, что указывает на эпигенетическое опосредование эффекта DYRK1A на дерегуляцию гена DS. Интересно, что DYRK1A — не единственный белок DSCR, который взаимодействует с комплексом SWI / SNF. Бромодомен и повторяющийся домен WD, содержащий 1 (BRWD1) и связанный с Runt фактор транскрипции 1 (RUNX1), также связаны с комплексом SWI / SNF (Bakshi et al., 2010; Хуанг и др., 2003). Точно так же три белка DSCR взаимодействуют с SWI / SNF, усиливая возможное значение этого комплекса в этиопатологии DS. В самом деле, BRG1, содержащий комплекс SWI / SNF, является критическим во время развития нервной системы. BRG1 сильно экспрессируется в конечном мозге, мозжечке и областях заднего мозга и вызывает аномалии мозга, когда он не регулируется (Dorfman et al., 2003). Ингибирование BRG1 также вызывает нарушение нейрогенеза и дифференцировки нейронов (Eroglu et al., 2006), тем самым демонстрируя четкие параллели между его дерегулированием и особенностями DS. Более того, BRG1 положительно регулирует фактор транскрипции Т-клеток, который участвует в несолидных опухолях и может вносить вклад в повышенную заболеваемость лейкемией при DS (Dorfman et al., 2003). Примечательно, что синдром ATRX вызывается мутациями комплекса SWI / SNF, что подтверждает существование некоторых аналогий между этими двумя заболеваниями. К сожалению, участие SWI / SNF в DS не исследовано, и неизвестно, значимы ли эти сходства.DSCR также включает некоторые конститутивные гены хроматина. Фактор сборки хроматина 1, субъединица B (CHAF1B), является конститутивным белком хроматина, который участвует в сборке нуклеосом. CHAF1B взаимодействует с MBD1 и HP1 и участвует в репрессии транскрипции через DNAm и h4K9me3 (Reese et al., 2003). Связывающийся с нуклеосомами домен 1 группы с высокой подвижностью (HMGN1) также является конститутивным белком хроматина и регулирует ацетилирование h4K14 посредством активности CBP / P300 HAT (Ueda et al., 2006). Опять же, существует конвергенция эпигенетических эффекторов.Другой белок DSCR, гомолог 2 онкогена E26 вируса эритробластоза (ETS2), также регулирует активность CBP / P300 (Sun et al., 2006). Как уже упоминалось, мутация CBP / P300 вызывает RTS, а ацетилирование гистонов имеет решающее значение для обучения и формирования памяти. Таким образом, кажется, что дисфункция CBP / P300 может быть, по крайней мере, частично ответственна за когнитивные нарушения, наблюдаемые при DS.
В целом, данные свидетельствуют о том, что гены DSCR могут вызывать глобальные эпигенетические изменения, которые влияют на экспрессию генов, расположенных внутри и вне HSA21.В самом деле, исследования профилей экспрессии мРНК показали, что многие гены вне HSA21 нарушены и что некоторые гены на HSA21 обнаруживают дозозависимую экспрессию (Mao et al., 2005). Несмотря на то, что было опубликовано только одно высокопроизводительное исследование паттернов метилирования ДНК, первые дифференциально метилированные гены в DS уже идентифицированы. Интересно, что большинство из них расположены вне HSA21 (Kerkel et al., 2010). К сожалению, на сегодняшний день не опубликовано никаких отчетов об исследовании профилей гистонов при СД, и их участие в этиопатологии СД остается неопределенным.
Важно отметить, что miR-99a, let-7c, miR-125b-2, miR-155 и miR-802 расположены в HSA21 и, следовательно, сверхэкспрессируются в DS. Интересно, что mir-155 и miR-802 нацелены на MECP2 (Kuhn et al., 2010), который подавляется в DS (Nagarajan et al., 2006). Как мы уже говорили, мутация MeCP2 вызывает RTT, что также связано с умственной отсталостью. Примечательно, что miR-802 находится в области DSCR, и это предполагает независимую связь между генами DSCR и эпигенетическими эффекторами.Более того, член семейства гистонов h3A Z псевдоген 1 (h3AFZP) расположен на HSA21. Неизвестно, является ли этот псевдоген функциональным, но его гомолог h3AZ участвует в регуляции гена (Barski et al., 2007). Примечательно, что ДНК 5mC-метилтрансфераза 3-подобная (DNMT3L), некаталитический член семейства DNMT, также находится в HSA21. DNMT3L связывает нуклеосомы, когда они не нацелены на метилирование h4K4, и стимулирует активность метилирования DNMT3A и DNMT3B (Ooi et al., 2007). Это еще раз указывает на то, что эпигенетические факторы играют важную роль в этиопатогенезе СД.
В последние годы эпигенетика стала рассматриваться как новая парадигма для многих болезней. Он имеет кардинальное значение в регуляции экспрессии генов и, следовательно, участвует во всех процессах, участвующих в регуляции экспрессии генов. Изменение эпигенетического аппарата, по-видимому, является обычным процессом при многих неврологических заболеваниях, которые периодически затрагивают одни и те же пути. DS не является исключением, и несколько линий доказательств предполагают, что эпигенетика в значительной степени способствует DS.Изучение эпигенетического ландшафта СД предлагает новые возможности для лучшего понимания этиопатологии СД.
% PDF-1.7
%
155 0 объект
>
эндобдж
xref
155 97
0000000016 00000 н.
0000002710 00000 н.
0000002900 00000 н.
0000002936 00000 н.
0000003552 00000 н.
0000003619 00000 н.
0000003758 00000 н.
0000003897 00000 н.
0000004036 00000 н.
0000004175 00000 п.
0000004314 00000 н.
0000004453 00000 п.
0000004592 00000 н.
0000004998 00000 н.
0000005420 00000 н.
0000005643 00000 п.
0000005680 00000 н.
0000005794 00000 н.
0000005906 00000 н.
0000006493 00000 н.
0000006907 00000 н.
0000007162 00000 н.
0000007592 00000 н.
0000008078 00000 н.
0000008210 00000 п.
0000008753 00000 н.
0000009002 00000 н.
0000009607 00000 п.
0000010276 00000 п.
0000010831 00000 п.
0000010932 00000 п.
0000011470 00000 п.
0000012104 00000 п.
0000012803 00000 п.
0000013190 00000 п.
0000013275 00000 п.
0000013597 00000 п.
0000014007 00000 п.
0000014659 00000 п.
0000015319 00000 п.
0000016054 00000 п.
0000016469 00000 п.
0000019119 00000 п.
0000026818 00000 п.
0000029616 00000 п.
0000063915 00000 п.
0000089413 00000 п.
0000089483 00000 п.
0000089582 00000 п.
0000108735 00000 п.
0000109006 00000 п.
0000109414 00000 н.
0000109441 00000 п.
0000109951 00000 н.
0000110021 00000 н.
0000110113 00000 п.
0000127502 00000 н.
0000127765 00000 н.
0000128026 00000 н.
0000128053 00000 н.
0000128443 00000 н.
0000148242 00000 н.
0000148500 00000 н.
0000148912 00000 н.
0000170551 00000 п.
0000170814 00000 н.
0000171246 00000 н.
0000183530 00000 н.
0000183786 00000 н.
0000184095 00000 н.
0000220228 00000 н.
0000220267 00000 н.
0000220650 00000 н.
0000221044 00000 н.
0000221509 00000 н.
0000221939 00000 н.
0000226939 00000 н.
0000227191 00000 н.
0000227529 00000 н.
0000227805 00000 н.
0000235377 00000 н.
0000235630 00000 н.
0000235990 00000 н.
0000236372 00000 н.
0000236899 00000 н.
0000237448 00000 н.
0000243613 00000 н.
0000243652 00000 н.
0000256174 00000 н.
0000257562 00000 н.
0000375399 00000 н.
0000375456 00000 н.
0000375512 00000 н.
0000375568 00000 н.
0000375624 00000 н.
0000375680 00000 н.
0000002236 00000 н.
трейлер
] / Назад 500269 >>
startxref
0
%% EOF
251 0 объект
> поток
hb«c`b`e` \ k ̀
Спинальная мышечная атрофия — NHS
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое ослабляет мышцы и вызывает проблемы с движением.
Это серьезное заболевание, которое со временем ухудшается, но существуют методы лечения, которые помогают справиться с симптомами.
Симптомы SMA
Симптомы SMA и время их появления зависят от типа вашего SMA.
Типичные симптомы включают:
- неустойчивые или слабые руки и ноги
- проблемы с движением, такие как затруднение при сидении, ползании или ходьбе
- подергивание или тряска мышц (тремор)
- проблемы с костями и суставами, такие как необычно изогнутые позвоночник (сколиоз)
- Проблемы с глотанием
- Проблемы с дыханием
СМА не влияет на интеллект и не вызывает трудностей в обучении.
Типы SMA
Есть несколько типов SMA, которые начинаются в разном возрасте. Некоторые типы вызывают более серьезные проблемы, чем другие.
Основными типами являются:
- тип 1 — развивается у детей младше 6 месяцев и является наиболее тяжелым типом
- Тип 2 — появляется у детей в возрасте 7-18 месяцев и менее тяжел, чем тип 1
- тип 3 — развивается после 18 месяцев и является наименее тяжелым типом, поражающим детей.
- тип 4 — поражает взрослых и обычно вызывает только легкие проблемы.
Младенцы с типом 1 редко выживают после первых нескольких лет жизни.Большинство детей с типом 2 доживают до взрослого возраста и могут прожить долгую полноценную жизнь. Типы 3 и 4 обычно не влияют на продолжительность жизни.
Подробнее о типах SMA.
Лечение SMA
В настоящее время вылечить SMA невозможно, но исследования по поиску возможных новых методов лечения продолжаются.
Доступны лечение и поддержка для купирования симптомов и помощи людям с СМА в достижении наилучшего качества жизни.
Лечение может включать:
- упражнения и оборудование для улучшения движения и дыхания
- зонды для кормления и рекомендации по диете
- скобки или хирургическое вмешательство для лечения проблем с позвоночником или суставами
В лечении могут быть задействованы различные медицинские работники. ваше медицинское обслуживание, включая врачей-специалистов, физиотерапевтов, эрготерапевтов, логопедов и лингвистов.
Подробнее о лечении СМА.
Тесты на SMA
Генетическая проблема, вызывающая SMA, передается ребенку его родителями.
Поговорите с терапевтом, если вы планируете беременность и:
- у вас был ребенок с СМА до
- у вас есть история болезни в вашей семье
- у вашего партнера есть история болезни в их семья
Врач общей практики может направить вас к консультанту по генетическим вопросам, чтобы обсудить риск заболевания, влияющего на будущую беременность, и любые возможные СПС.
Если вы беременны и есть вероятность, что у вашего ребенка может быть СМА, можно провести тесты, чтобы проверить, родится ли он с этим заболеванием.
Анализы также можно проводить после рождения для диагностики СМА у детей и взрослых.
Подробнее о тестах на SMA.
Как передается по наследству СМА
В большинстве случаев ребенок может родиться с СМА только в том случае, если у обоих родителей есть дефектный ген, вызывающий это состояние.
У родителей обычно не бывает SMA, которая известна как носитель. Примерно 1 из 40-60 человек является носителем основного дефектного гена, вызывающего СМА.
Если у 2 родителей, которые являются носителями, есть ребенок, существует:
- 1 из 4 (25%) шансов, что их ребенок будет иметь SMA
- 1 из 2 (50%) шанс, что их ребенок будет носителем дефектного ген, но не будет иметь SMA
- 1 из 4 (25%) шанс, что их ребенок не будет иметь SMA и не будет носителем
Некоторые более редкие типы SMA наследуются немного по-другому или могут не передаваться на всех. Спинальная мышечная атрофия В Великобритании есть дополнительная информация о том, как передается СМА.
Поговорите с врачом или терапевтом, если у вас или вашего партнера есть семейный анамнез СМА, и вы беспокоитесь, что ваши дети могут заболеть этим.
Информация о вас или вашем ребенке
Если у вас или вашего ребенка есть спинальная мышечная атрофия, ваша клиническая бригада передаст информацию о вас или вашем ребенке в Национальную службу регистрации врожденных аномалий и редких заболеваний (NCARDRS).
Это помогает ученым искать более эффективные способы профилактики и лечения этого состояния.Вы можете отказаться от регистрации в любое время.
Подробнее о реестре.
Последняя проверка страницы: 4 мая 2020 г.
Срок следующего рассмотрения: 4 мая 2023 г.
Спинальная мышечная атрофия — Типы
Существует несколько различных типов спинальной мышечной атрофии (СМА), которые начинаются в разном возрасте.
Все они могут вызывать слабость и затруднения при передвижении, но степень тяжести этих проблем варьируется.
На интеллект и обучаемость не влияют какие-либо типы SMA.
СМА типа 1 (младенцы)
У детей со СМА типа 1 симптомы проявляются в первые 6 месяцев жизни.
Младенцы с заболеванием:
- имеют очень слабые и гибкие руки и ноги (гипотония)
- имеют проблемы с движением, едой, дыханием и глотанием
- не могут поднять голову или сидеть без поддержки
Большинство младенцев со СМА типа 1 умирают в течение первых нескольких лет жизни, обычно в результате серьезных затруднений с дыханием.
Спинальная мышечная атрофия В Великобритании есть дополнительная информация о СМА 1 типа.
СМА 2 типа (младенцы старшего и ясельного возраста)
Дети со СМА 2 типа обычно проявляют симптомы в возрасте от 7 до 18 месяцев. Симптомы менее серьезны, чем у типа 1.
Дети с этим заболеванием могут:
- сидеть без посторонней помощи, но не стоять и ходить
- иметь слабые руки или ноги
- испытывать дрожь (тремор) в пальцах. и руки
- позже развиваются проблемы с суставами, такие как необычно искривленный позвоночник (сколиоз).
- слабые дыхательные мышцы и затрудненный кашель — это может подвергнуть их риску инфекций грудной клетки.
СМА 2 типа может сократить продолжительность жизни, но большинство детей с этим заболеванием доживают до взрослой жизни и могут прожить долгую полноценную жизнь.
Спинальная мышечная атрофия В Великобритании есть дополнительная информация о СМА 2 типа.
СМА 3 типа (дети и молодые люди)
Симптомы СМА 3 типа обычно развиваются после 18 месяцев, но они очень разные и иногда могут не проявляться до позднего детства или раннего взросления.
Люди с состоянием:
- могут стоять и ходить без посторонней помощи, хотя им может быть трудно ходить или вставать из положения сидя
- могут быть проблемы с равновесием, трудности при беге или подъеме по ступенькам, а также легкая тряска их пальцы
- могут обнаружить, что со временем ходить становится все труднее, и они могут со временем потерять способность ходить, когда станут старше.
СМА типа 3 обычно не влияет на продолжительность жизни.
Спинальная мышечная атрофия В Великобритании есть дополнительная информация о СМА 3 типа.
СМА типа 4 (взрослые)
СМА типа 4, также называемая СМА с началом у взрослых, обычно начинается в раннем взрослом возрасте.
У кого-то с этим заболеванием могут быть:
- слабость в руках и ногах
- трудности при ходьбе
- дрожание и подергивание мышц
СМА типа 4 со временем ухудшается, но обычно не вызывает проблем с дыханием или глотанием .Это не влияет на продолжительность жизни.
Спинальная мышечная атрофия В Великобритании есть дополнительная информация о СМА 4 типа.
Другие типы SMA
Есть несколько других типов SMA, в том числе:
Последняя проверка страницы: 4 мая 2020 г.
Срок следующего рассмотрения: 4 мая 2023 г.
Спинальная мышечная атрофия (СМА): виды, диагностика и лечение
Обзор
Что такое спинальная мышечная атрофия (СМА)?
Спинальная мышечная атрофия (СМА) — это группа генетических заболеваний, вызывающих слабость и истощение произвольных мышц у младенцев и детей и, реже, у взрослых.Это одно из наиболее распространенных генетических заболеваний, поражающих детей. По оценкам, каждый 6000–10 000 младенцев во всем мире рождается со СМА.
В более чем 95 процентах случаев СМА вызвана неадекватной выработкой белка, называемого белком двигательного нейрона выживания (SMN), который необходим для двигательных нейронов. SMN производится SMN1 и в меньшей степени SMN2 . Эти гены находятся на хромосоме 5. Как правило, у людей есть две копии гена SMN1 и до двух копий гена SMN2 в каждой из клеток мотонейрона.У людей со спинальной мышечной атрофией обе копии гена SMN1 изменены или отсутствуют. Наличие дополнительных копий (трех или более) гена SMN2 связано с более легким заболеванием, частично компенсируя отсутствующие SMN1 . Редко SMA вызывается мутациями в генах, отличных от SMN (не хромосома 5).
Моторные нейроны лежат в переднем роге спинного мозга и непосредственно контролируют скелетные мышцы тела. Без адекватного белка SMN мотонейроны спинного мозга начинают сокращаться и умирать.Когда это происходит, мозг ребенка не может управлять произвольными мышцами тела, особенно в руках и ногах, а также в голове и шее. Мышцы начинают ослабевать и истощаться. Это влияет на такие движения, как ходьба, ползание, контроль головы и шеи, глотание и дыхание.
Какие бывают типы мышечной атрофии позвоночника?
Существует четыре различных типа мышечной атрофии позвоночника. Классификация определяется этапами развития, которые ребенок достигает к моменту начала заболевания.Типы I и II являются наиболее распространенными.
Типы спинальной мышечной атрофии (СМА):
- Тип 1 (тяжелая форма) SMA : Этот тип также называется болезнью Верднига-Гофмана. Это самый тяжелый и самый распространенный тип СМА. Обычно это проявляется при рождении или в первые несколько месяцев после него (0-6 месяцев). Симптомы включают гибкость конечностей и слабое движение туловища. Дети с этим типом обычно имеют очень ограниченную способность двигаться. Им также будет трудно кормить и глотать, поднимать голову и дышать.СМА типа 1 быстро прогрессирует с ослаблением мышц, что приводит к частым респираторным инфекциям и, как правило, к смерти к 2 годам. Младенцы со СМА типа 1 никогда не могут сидеть.
- Тип 2 (средний уровень) SMA : Симптомы обычно появляются в возрасте от 7 до 18 месяцев. Скорость прогрессирования может сильно различаться. Болезнь поражает скорее ноги ребенка, чем его или ее руки. Дети с СМА типа 2 никогда не выдерживают. Респираторные инфекции также распространены при этом типе СМА.Ожидаемая продолжительность жизни может варьироваться от раннего детства до взрослого возраста, в зависимости от тяжести состояния пациента.
- Тип 3 (легкий) SMA : Этот тип SMA также называется Кугельберг-Веландером или ювенильной спинальной мышечной атрофией. Симптомы могут впервые появиться в течение многих лет, от 18 месяцев до раннего взросления. Пациенты с СМА 3 типа могут стоять и ходить, но могут испытывать затруднения при вставании из положения сидя. У них также может наблюдаться легкая мышечная слабость и повышенный риск респираторных инфекций.У большинства пациентов со СМА 3-го типа продолжительность жизни близка к нормальной.
- Тип 4 (взрослый) SMA : Симптомы этого редкого типа SMA обычно не проявляются до второго или третьего десятилетия жизни. Пациенты со СМА 4 типа могут ходить в зрелом возрасте, но обычно у них наблюдается медленно прогрессирующая мышечная слабость и другие типичные симптомы СМА.
Если вы заметили какой-либо из этих симптомов у своего ребенка или у себя, немедленно обратитесь к врачу.
У кого возникает мышечная атрофия позвоночника?
Спинальная мышечная атрофия может поражать людей любой расы и пола.Дополнительно
- Каждый 40 человек несет ген, вызывающий СМА.
- Ребенок от двух генных носителей имеет 25-процентный шанс родиться со спинальной мышечной атрофией.
- По оценкам, семьдесят пять миллионов американцев являются носителями гена мышечной атрофии позвоночника.
- Считается, что более 25 000 американцев страдают от мышечной атрофии позвоночника.
Диагностика и тесты
Как диагностируется спинальная мышечная атрофия (СМА)?
Спинальная мышечная атрофия обычно диагностируется с помощью анализа крови на наличие гена SMN1 (генетическое тестирование).Этот ген будет отсутствовать примерно у 95 процентов людей с SMN-зависимой SMA. В остальных 5 процентах ген окажется видоизмененным. Ваш врач назначит этот тест, если он или она подозревают, что у вашего ребенка может быть СМА, на основании его или ее симптомов и других диагностических исследований. Ваш врач может назначить электрическое исследование, называемое ЭМГ (электромиография), или выполнить биопсию мышц, чтобы подтвердить диагноз СМА.
Ведение и лечение
Как лечится спинальная мышечная атрофия (СМА)?
В настоящее время нет лекарства от мышечной атрофии позвоночника.Лечение детей, страдающих СМА, направлено на устранение их симптомов, предотвращение осложнений и улучшение качества их жизни. Ваш врач сможет определить лучшее лечение для вашего ребенка в зависимости от типа SMA, тяжести состояния и его возраста.
Для пациентов с СМА типа 1 лечение может включать питание через зонд и аппараты ИВЛ, а также другие формы респираторной помощи. Физическая терапия также может принести пользу пациентам со СМА 1 типа. Многие пациенты с этим типом мышечной атрофии позвоночника проводят большую часть своей жизни в больнице.В какой-то момент родителей могут попросить принять очень трудное решение об использовании устройств жизнеобеспечения для своего ребенка.
Ваш врач или отдел социальных служб больницы должен иметь возможность связать вас с группами поддержки, такими как Cure SMA, за помощью в принятии этих чрезвычайно трудных решений.
Для пациентов с СМА 2 и 3 типа лечение может включать ортопедические скобы, инвалидные коляски, а также физиотерапию и профессиональную терапию.
Важно помнить, что мозг людей со спинальной мышечной атрофией развивается нормально.Многие пациенты со СМА очень умны и общительны. Разговоры с ними, игры и другие формы умственной стимуляции могут помочь эмоциональной и физической жизни этих детей.
Перспективы / Прогноз
Проводятся ли какие-либо новые исследования спинальной мышечной атрофии (СМА)?
Многие ученые и клиницисты прилагают все усилия, чтобы улучшить наше понимание этого заболевания и улучшить выживаемость и качество жизни пациентов с СМА.Недавние открытия генов, участвующих в SMA, и роли (ей) этих генов в поддержании здоровья мотонейронов, а также новые разработки в молекулярной медицине дают надежду на лучшие стратегии лечения этой группы заболеваний. В настоящее время исследования сосредоточены на стратегиях увеличения производства белка SMN с помощью различных подходов.
Ресурсы
Что мне делать, если у меня есть ген спинальной мышечной атрофии, но у меня нет СМА?
Если вам поставили диагноз как носитель гена SMA, но это заболевание не влияет, вам все равно следует обратиться за советом к генетическому консультанту или своему врачу.Это очень важно, если вы планируете завести ребенка. Он или она сможет помочь вам оценить ваши риски и шансы иметь ребенка со спинальной мышечной атрофией. Если у вас уже был ребенок с СМА, ваш консультант должен посоветовать вам варианты будущих беременностей.
Ресурсы
Лечение SMA
925 Busse Road
Elk Grove Village, IL 60007
800.886.1762
Факс: 847.367.7623
info @ fsma.org www.curesma.org
Ассоциация мышечной дистрофии
Национальный офис — 222 S. Riverside Plaza Suite 1500
Чикаго, Иллинойс 60606
800.572.1717
Факс: 520.529.5300
[email protected] www.mda.org
Бой SMA
1321 Duke Street Suite 304
Александрия, VA 22134
703.299.1144
[email protected] www.fightsma.org
Фонд спинальной мышечной атрофии
888 Седьмая авеню, офис 400
Нью-Йорк, Нью-Йорк 10019
877.ФОНД.SMA (877.386.3762), 646.253.7100
Факс: 212-247-3079
www.smafoundation.org
Спинальная мышечная атрофия — НОРД (Национальная организация редких заболеваний)
УЧЕБНИКИ
Руссман Б.С. Спинальная мышечная атрофия. В: The NORD Guide to Rare Disorders, Philadelphia, PA: Lippincott, Williams and Wilkins, 2003: 637.
СТАТЬИ ИЗ ЖУРНАЛА
Wu JS, Darras BT, Rutkove SB.Оценка спинальной мышечной атрофии с помощью количественного УЗИ // Неврология. 2010; 75 (6): 526-31.
Руткове С.Б., Шефнер Дж. М., Грегас М. и др. Характеристика спинальной мышечной атрофии с помощью электроимпедансной миографии. Мышечный нерв. 2010; 42 (6): 915-21.
Lewelt A, Krosschell KJ, Scott C и др. Потенциал действия сложных мышц и двигательная функция у детей со спинальной мышечной атрофией. Мышечный нерв. 2010; 42 (5): 703-8.
Ренбаум П., Келлерман Э., Джарон Р. и др. Спинальная мышечная атрофия с понтоцеребеллярной гипоплазией вызвана мутацией в гене VRK1.Am J Hum Genet. 2009; 85 (2): 281-9.
Бах-младший. Использование искусственной вентиляции легких уместно у детей с генетически подтвержденной мышечной атрофией позвоночника 1 типа: движение для. Педиатр Респир Ред. 2008; 9 (1): 45-50.
Brichta L, et al. Активация SMN in vivo у носителей спинальной мышечной атрофии и пациентов с вальпроатом. Энн Нейрол. 2006; 59: 970-5.
Кауфманн П., Мунтони Ф .; Международный координационный комитет подкомитета SMA по дизайну клинических испытаний SMA. Проблемы дизайна клинических исследований СМА.Международный координационный комитет (ICC) Подкомитета SMA по дизайну клинических испытаний SMA. Нервно-мышечное расстройство. 2007; 17 (6): 499-505.
Swoboda KJ, Prior TW, Scott CB и др. Естественное течение денервации при СМА: отношение к возрасту, количеству копий SMN2 и функции. Энн Нейрол. 2005; 57 (5): 704-12.
Mellies U, Dohna-Schwake C, Stehling F, Voit T. Нарушение дыхания во сне при спинальной мышечной атрофии. Нервно-мышечное расстройство. 2004; 14 (12): 797-803.
Puruckherr M, Mehta JB, Girish MR, Byrd RP Jr, Roy TM.Тяжелое обструктивное апноэ во сне у пациента с атрофией спинных мышц. Грудь. 2004; 126 (5): 1705-7.
Brichta L, et al. Вальпроевая кислота увеличивает уровень белка SMN2: препарат, хорошо известный как потенциальное средство для лечения спинальной мышечной атрофии. Hum Mol Genet. 2003; 12: 2481-9.
Руссман Б.С. и др. Испытание фазы 1 рилузола при спинальной мышечной атрофии. Арка Neurol. 2003; 60: 1601-03.
Бах Дж., Вега Дж., Майорс Дж., Фридман А. Спинальная мышечная атрофия 1 типа качество жизни. Am J Phys Med Rehabil.2003; 82 (2): 137-42.
Sporer SM, Смит Б.Г. Вывих бедра у пациентов со спинальной мышечной атрофией. J Pediatr Orthop. 2003; 23 (1): 10-4.
Laufersweiler-Plass C, Rudnik-Schöneborn S, Zerres K, Backes M, Lehmkuhl G, von Gontard A. Поведенческие проблемы у детей и подростков со спинальной мышечной атрофией и у их братьев и сестер. Dev Med Child Neurol. 2003; 45 (1): 44-9.
Bromberg MB, Swoboda KJ. Оценка количества двигательных единиц у младенцев и детей со спинальной мышечной атрофией.Мышечный нерв. 2002; 25 (3): 445-7.
Courtens W, Johansson AB, Dachy B, Avni F, Telerman-Toppet N, Scheffer H. Вариант инфантильной мышечной атрофии позвоночника с врожденными переломами у новорожденного женского пола: доказательства аутосомно-рецессивного наследования. J Med Genet. 2002; 39 (1): 74-7.
Бах Дж. Р., Бэрд Дж. С., Плоски Д., Навадо Дж., Уивер Б. Спинальная мышечная атрофия 1 типа: лечение и результаты. Педиатр Пульмонол. 2002; 34 (1): 16-22.
Миллер Р., Мур Д.Х., Дронски В. и др. Плацебо-контролируемое исследование габапентина при спинальной мышечной атрофии.J Neurol Sci. 2001; 15; 191 (1-2): 127-31.
Гозал Д., Легочные проявления нервно-мышечной болезни с особым упором на мышечную дистрофию Дюшенна и спинальную мышечную атрофию. Педиатр Пульмонол. 2000; 29: 141-50.
Strober JB и др., Прогрессирующие мышечные атрофии позвоночника. J Child Neurol. 1999; 14: 691-95.
Андерссон П.Б. и др. Нервно-мышечные расстройства у детей. Curr Opin Pediatr. 1999; 11: 497-503.
Лю Ю.Б. и др., Остановка предсердий в случае синдрома Кугельберга-Веландера с поражением сердца: электрофизиологическое исследование.Int J Cardiol. 1999; 70: 207-10.
Zerres K, Rudnick-Schoneborn S, Forrest E, et al. Совместное исследование естественного течения проксимальной СМА с дебютом у детей и подростков (СМА типа II и III): 569 пациентов. J Neurol Sci. 1997; 146: 67-72.
Cunha MC и др., Спинальная мышечная атрофия II типа (промежуточный) и III (Кугельберг-Веландер). Эволюция 50 пациентов с физиотерапией и гидротерапией в бассейне. Arq Neuropsiquiatr. 1996; 54: 402-06.
Исодзуми К., Делонг Р., Каплан Дж. И др.Связь спинальной мышечной атрофии лопатки и надкостницы с хромосомой 12q24.1-q24.31. Hum Mol Genet. 1996; 5 (9): 1377-82.
Thomas NH, Dubowitz V. Естественное течение СМА типа I (тяжелой). Нервно-мышечное расстройство. 1994; 4: 497-502.
Brzustowicz LM, et al., Оценка неаллельной генетической гетерогенности хронической (тип II и III) спинальной мышечной атрофии. Hum Hered. 1993; 43: 380-87.
Miles JM, et al., Патологический случай месяца. Спинальная мышечная атрофия 3 типа (болезнь Кугельберга-Веландера).Am J Dis Child. 1993; 147: 793-94.
Iannaccone ST, Browne RH, Samaha FL, et al. Группа DCN / SMA: проспективное исследование SMA в возрасте до шести лет. Pediatr Neurol. 1993; 9: 187-193.
Russman BS, Iannaccone ST, Buncher CR, et al. Новые наблюдения за естественной историей
SMA. J Child Neurol. 1992; 7: 347-353.
Fischbeck KH, Souders D, La Spada A. Ген-кандидат на Х-сцепленную мышечную атрофию позвоночника. Adv Neurol. 1991; 56: 209-13.
Goutières F, Bogicevic D, Aicardi J.Преимущественно шейная форма мышечной атрофии позвоночника. J Neurol Neurosurg Psychiatry. 1991; 54 (3): 223-5.
Йоханнан М., Патель П., Колаволе Т., Малабарей Т., Махди А. Атрофия мозга при болезни Верднига-Гофмана. Acta Neurol Scand. 1991; 84 (5): 426-8.
Brzustowicz LM, et al., Генетическое картирование хронической мышечной атрофии позвоночника в детском возрасте по хромосоме 5q11.2-13.3. Природа. 1990; 344: 540-41.
Чоу С.М., Гилберт Э.Ф., Чун Р.В. и др. Детская оливопонтоцеребеллярная атрофия со спинальной мышечной атрофией (инфантильная OPCA + SMA).Clin Neuropathol. 1990; 9 (1): 21-32.
Урбанек К. и др., АКТГ и стероиды при болезни Кугельберга-Веландера. Acta Univ Palacki Olomuc Fac Med. 1990; 126: 147-50.
Браун Дж. С., Целлер Дж. Л., Суонк С. М., Фурумасу Дж., Варат С.Л. Хирургические и функциональные результаты спондилодеза при спинальной мышечной атрофии. Позвоночник (Phila Pa 1976). 1989; 14 (7): 763-70.
Merlini L, Granata C, Bonfiglioli S, Marini ML, Cervellati S, Savini R. Сколиоз при спинальной мышечной атрофии: естественная история и лечение.Dev Med Child Neurol. 1989; 31 (4): 501-8.
Карни А., Навон Р., Садех М. Дефицит гексозаминидазы А, проявляющийся в виде спинальной мышечной атрофии с поздним началом. Энн Нейрол. 1988; 24 (3): 451-3.
Johnson WG, Wigger HJ, Karp HR, Glaubiger LM, Rowland LP. Ювенильная спинальная мышечная атрофия: новый фенотип дефицита гексозаминидазы. Энн Нейрол. 1982; 11 (1): 11-6.
Эванс Г.А., Дреннан Дж.С., Руссман Б.С. Функциональная классификация и ортопедическое лечение мышечной атрофии позвоночника. J Bone Joint Surg Br.1981; 63B (4): 516-22.
ИНТЕРНЕТ
Приор Т.В., Руссман Б.С. (Обновлено 27 января 2011 г.). Спинальная мышечная атрофия. В: GeneReviews at GeneTests: Medical Genetics Information Resource (онлайн-база данных). Авторские права, Вашингтонский университет, Сиэтл. 1993-2012 гг. Доступно на http://www.genetests.org. По состоянию на 9 февраля 2012 г.
Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Спинальная мышечная атрофия, тип III; SMA3. Запись №: 253400. Последнее редактирование 15 ноября 2011 г.Доступно по адресу: http://www.ncbi.nlm.nih.gov/omim/. По состоянию на 9 февраля 2012 г.
Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Спинальная мышечная атрофия I типа; SMA3. Запись №: 253300. Последняя редакция 5 декабря 2011 г. Доступно по адресу: http://www.ncbi.nlm.nih.gov/omim/. По состоянию на 9 февраля 2012 г.
Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Спинальная мышечная атрофия II типа; SMA2. Запись №: 253550. Последнее изменение: 26 июля 2011 г. Доступно по адресу: http: // www.ncbi.nlm.nih.gov/omim/. По состоянию на 9 февраля 2012 г.
Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Спинальная мышечная атрофия IV типа; SMA4. Запись №: 271150. Последняя редакция 21 августа 2007 г. Доступно по адресу: http://www.ncbi.nlm.nih.gov/omim/. По состоянию на 9 февраля 2012 г.
Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Спинальная мышечная атрофия, проксимальная, взрослая, аутосомно-доминантная. Запись №: 182980. Последнее обновление 25 октября 2004 г. Доступно по адресу: http: // www.ncbi.nlm.nih.gov/omim/. По состоянию на 9 февраля 2012 г.
Детский ботулизм — Американский семейный врач
НАДИН КОКС, доктор медицинских наук, и РЭНДИ ХИНКЛ, доктор медицинских наук, Медицинский центр Маунт-Кармель, Колумбус, Огайо
Am Fam Physician. , 1 апреля 2002; 65 (7): 1388-1393.
Хотя заболеваемость младенческим ботулизмом во всем мире редка, большинство случаев диагностируется в Соединенных Штатах. Младенец может заразиться ботулизмом, проглотив споры Clostridium botulinum, которые содержатся в почве или медовых продуктах.Споры прорастают в бактерии, которые колонизируют кишечник и синтезируют токсины. По мере абсорбции токсин необратимо связывается с рецепторами ацетилхолина на окончаниях двигательных нервов в нервно-мышечных соединениях. Младенец с ботулизмом становится все более слабым, гипотоническим и гипорефлексическим, проявляя аномалии бульбарных и спинномозговых нервов. Симптомы включают запор, вялость, слабый крик, плохое питание и обезвоживание. Высокий показатель подозрительности важен для диагностики и своевременного лечения детского ботулизма, поскольку это заболевание может быстро прогрессировать до дыхательной недостаточности.Диагноз подтверждается путем выделения микроорганизма или токсина в стуле и определения классической картины электромиограммы. Лечение состоит из нутритивной и респираторной поддержки до тех пор, пока не будут восстановлены новые замыкательные пластинки двигателя, что приводит к спонтанному выздоровлению. Неврологические последствия наблюдаются редко. Некоторым детям требуется амбулаторное зондовое питание, и у них может быть стойкая гипотония.
Детский ботулизм вызывается нейротоксином, вырабатываемым спорообразующими анаэробными грамположительными бациллами Clostridium botulinum, которые повсеместно встречаются в почве.Проглатывание спор приводит к синтезу токсина и всасыванию из кишечного тракта младенца. Детский ботулизм вызывается токсинами типов A и B.1. Последующее нейропаралитическое заболевание протекает в подострой форме, сначала вызывая запор, за которым следует прогрессирующая слабость. Осведомленность врачей о младенческом ботулизме имеет первостепенное значение для раннего распознавания и вмешательства, потому что более 70 процентам этих младенцев в конечном итоге потребуется механическая вентиляция.2
Патофизиология
Детский ботулизм возникает, когда проглоченные споры прорастают и колонизируют желудочно-кишечный тракт младенца.Считается, что слепая кишка является начальным местом активности, и паралич илеоцекального клапана может позволить колонизирующим бактериям распространиться в терминальную часть подвздошной кишки. 3 После колонизации бактерий токсин вырабатывается и всасывается в кишечном тракте. Механизм, с помощью которого токсин транспортируется в нервную ткань, неизвестен. 4 Токсин необратимо связывается с пресинаптическими холинергическими рецепторами на окончаниях двигательных нервов и впоследствии интернализуется. Попав внутрь цитозоля, токсин действует как протеаза, повреждая интегральный мембранный белок ацетилхолинсодержащих везикул, нарушая экзоцитоз и подавляя высвобождение ацетилхолина, необходимого для возбуждения мышц.4,5
Эпидемиология
Девяносто процентов случаев младенческого ботулизма в мире диагностируется в Соединенных Штатах, в основном из-за осведомленности врачей.5,6 По состоянию на 1996 год Центры по контролю и профилактике заболеваний (CDC) задокументировали больше более 1400 случаев1. Распространенность младенческого ботулизма превзошла распространенность пищевого и раневого ботулизма1. По оценкам, ежегодно в Соединенных Штатах регистрируется более 250 случаев младенческого ботулизма, но многие остаются нераспознанными7. Калифорния, Юта. и Пенсильвания имеют самый высокий уровень заболеваемости; почти 50 процентов всех случаев зарегистрировано в Калифорнии.2,8
Загрязнение почвы и меда — два признанных источника спор ботулина. Были проведены обширные исследования для выявления других источников. В конце 1970-х годов в Калифорнии исследователи9 проанализировали 555 образцов почвы, домашней пыли, злаков, детского питания, консервов, сахара, кукурузного сиропа, меда и коммерческих смесей. За исключением образцов меда и почвы, спор не было обнаружено.9 В исследовании10, проведенном в Нью-Йорке, споры не были обнаружены ни в одном из 236 протестированных продуктов.Согласно микробиологическим исследованиям, до 25 процентов продуктов из меда содержат споры.11 История употребления меда наблюдается в 15 процентах случаев ботулизма, о которых сообщается в CDC.5,12 В результате мед нельзя употреблять в пищу. для младенцев младше одного года.
Проспективное исследование методом случай-контроль12 было проведено для определения факторов риска детского ботулизма. Результаты показали, что снижение частоты испражнений (менее одного в день) и кормление грудью были факторами риска развития заболевания у младенцев старше двух месяцев.Для младенцев младше двух месяцев проживание в сельской сельскохозяйственной местности было единственным значительным фактором риска, о котором сообщили 40 процентов исследованных семей. Предположительно, эти дети будут с большей вероятностью подвергаются аэрозольные спорам из одежды, загрязненной почвой или из нарушенного soil.12
Роли грудного вскармливания в детской ботулизме остается спорными. Согласно различным исследованиям, грудное вскармливание происходит у 70–90 процентов младенцев с ботулизмом.13 Грудное вскармливание может отсрочить клиническую тяжесть этого состояния, позволяя таким младенцам получить медицинскую помощь до того, как ботулизм станет смертельным.14 Нет доказательств того, что младенцы, находящиеся на грудном вскармливании, имеют более тяжелую болезнь по сравнению с младенцами, находящимися на искусственном вскармливании.12
Исторически считалось, что детский ботулизм способствует развитию синдрома внезапной детской смерти (СВДС). Если болезнь не распознать, паралич дыхательной мускулатуры может привести к быстрой гипоксемии и остановке дыхания. Два исследования выявили посмертную колонизацию C. botulinum от 4 до 15 процентов смертей, вызванных СВДС15. Однако недавнее 10-летнее проспективное исследование не показало, что оккультный ботулизм является значительным фактором СВДС.16
Клиническая презентация
Младенцы, заболевшие ботулизмом, находятся в возрасте от шести недель до девяти месяцев, причем пик заболеваемости приходится на два-три месяца. Около 90 процентов младенцев с ботулизмом моложе шести месяцев4. Детский ботулизм бывает трудно распознать из-за его скрытого начала. Классические клинические признаки включают запор, аномалии черепных нервов, гипотонию, гипорефлексию и затрудненное дыхание. Признаки и симптомы, обычно присутствующие при поступлении в больницу, перечислены в таблице 1.2
Посмотреть / распечатать таблицу
ТАБЛИЦА 1
Признаки и симптомы младенческого ботулизма при поступлении в больницу
| Признаки и симптомы | Частота (%) | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Слабость или гибкость | |||||||||||||||||||||||||||||||
Плохое питание | 79 | ||||||||||||||||||||||||||||||
Запор | 65 | ||||||||||||||||||||||||||||||
18 | |||||||||||||||||||||||||||||||
Раздражительность | 18 | ||||||||||||||||||||||||||||||
Проблемы с дыханием | 11 | ||||||||||||||||||||||||||||||
9055 9055 9055 9055 9055 9055 9055 9055 9055 9055 младенческого ботулизма в больнице Адм. ission
У пораженных младенцев запор может наблюдаться в течение различного времени и может предшествовать слабости на несколько недель.14 Гипотония, нейрогенный мочевой пузырь и другие признаки вегетативной дисфункции могут возникать на ранних стадиях заболевания. Признаки слабости у младенца с ботулизмом начинаются с поражения черепных нервов и потери контроля над головой. У младенца может развиться слабый плач, плохая сосательная способность, нарушение рвотного рефлекса, скопление секрета и снижение перорального приема. Также может наблюдаться потеря моторики глаз, птоз, мидриаз и слабость лица.14,15 Слабость прогрессирует по нисходящей в течение нескольких дней.Больные младенцы становятся раздражительными и вялыми. В тяжелых случаях младенческого ботулизма затрудненное дыхание начинается как поздний признак заболевания, быстро приводящее к остановке дыхания.14 Дифференциальный диагнозДифференциальный диагноз детской гипотонии обширен (таблица 2) .14 Младенцы с ботулизмом часто болеют. диагностирован сепсис или менингоэнцефалит из-за симптомов вялости и раздражительности при поступлении. Однако у этих младенцев обычно нет лихорадки, и обследование на эти состояния будет отрицательным.17 Обезвоживание и другие метаболические причины должны быть тщательно исследованы. Синдром Рея можно эффективно исключить, определив уровень аммиака в сыворотке крови14. Также необходимо учитывать отравление. Полиомиелит часто связан с асимметричными клиническими проявлениями и плеоцитозом спинномозговой жидкости, который не наблюдается при младенческом ботулизме.14,17 Детская спинальная мышечная атрофия редко вызывает дисфункцию зрачков или глаз.14 Врожденная миастения встречается редко и может быть исключена у матери и новорожденного. история.Синдром Гийена-Барре проявляется как восходящий паралич и обычно не наблюдается у детей младше одного года.14,17 Наконец, следует учитывать острую обструкцию верхних дыхательных путей у младенцев с плохим кормлением, неспособностью справляться с выделениями и респираторным дистресс-синдромом. Просмотреть / распечатать таблицу ТАБЛИЦА 2 Дифференциальная диагностика гипотонии у младенцев
ТАБЛИЦА 2 946 946 946 Дифференциальный диагнозСепсис | |||||||||||||||||||||||||||||||
Менингит | |||||||||||||||||||||||||||||||
Энцефалит | |||||||||||||||||||||||||||||||
Метаболический | |||||||||||||||||||||||||||||||
51 Электролитные аномалии | |||||||||||||||||||||||||||||||
синдром Рейе | |||||||||||||||||||||||||||||||
Печеночная энцефалопатия | |||||||||||||||||||||||||||||||
гипотиреоз | |||||||||||||||||||||||||||||||
Органические acidurias | |||||||||||||||||||||||||||||||
Подострый некротический энцефаломиелит | |||||||||||||||||||||||||||||||
Токсины | |||||||||||||||||||||||||||||||
Тяжелые металлы | |||||||||||||||||||||||||||||||
Спирты | |||||||||||||||||||||||||||||||
органофосфатам | |||||||||||||||||||||||||||||||
Антихолинэргики | |||||||||||||||||||||||||||||||
наркотиками | |||||||||||||||||||||||||||||||
Нервно | |||||||||||||||||||||||||||||||
полиомиелит | |||||||||||||||||||||||||||||||
Детская спинальная мышечная атрофия | |||||||||||||||||||||||||||||||
Острая полинейропатия (синдром Гийена-Барре) | |||||||||||||||||||||||||||||||
Врожденная миастения гравис | |||||||||||||||||||||||||||||||
Мышечная дистрофия и врожденная миопатия | |||||||||||||||||||||||||||||||
Клещевой паралич |
Диагноз
Окончательный диагноз может быть поставлен с помощью обнаружения ботулотоксина и выделения C.botulinum из образцов стула. Кроме того, электромиограммы (ЭМГ) могут подтвердить ранний диагноз.
Выделенный стул является предпочтительным образцом для посева и исследования токсинов. У младенца, страдающего запором, может потребоваться промывание толстой кишки ограниченным количеством стерильного физиологического раствора. Образец стула массой 25 г или 25 мл сточных вод следует собрать в стерильный контейнер и поставить в холодильник.5 Образец сыворотки должен быть получен для анализа на токсины. Для исследования также должны быть собраны пробы других потенциальных источников, такие как пыль, почва с одежды, мед, кукурузный сироп или продукты питания.
Тестирование обычно проводится государственными департаментами здравоохранения или CDC. Идентификация организмов проводится с использованием обычных микробиологических методов. Идентификация ботулинического токсина завершается с помощью биотеста нейтрализации мышей. Полимеразная цепная реакция и иммуноферментные анализы были разработаны для тестирования детского ботулизма. Однако из-за недоступности реагентов и отсутствия стандартизации в лабораториях эти тесты не заменили биоанализ на мышах в качестве предпочтительного метода тестирования.5,8,18
Исследователи предложили проводить стандартизированное электродиагностическое тестирование у младенцев с подозрением на ботулизм, ища триаду ЭМГ, чтобы помочь в раннем подтверждении диагноза (Таблица 3). все три диагностические функции.19 Поскольку результаты ЭМГ могут быть нормальными на ранней стадии заболевания, может потребоваться серийное тестирование, начиная с одной недели до 10 дней с момента появления симптомов.2,15 Кроме того, разрешение результатов ЭМГ не коррелирует с выздоровлением. спонтанной вентиляции.20
Просмотр / печать таблицы
ТАБЛИЦА 3
Оценка ЭМГ подозрительных случаев младенческого ботулизма
Стандартная батарея ЭМГ |
Скорость проведения моторных и сенсорных нервов в одной руке и одной ноге |
Стимуляция двухгц нервов двух дистальных мышц |
Супрамаксимальная стимуляция одиночного нерва с последующей тетанизацией 50 Гц в течение 10 секунд и сразу после этого одиночными нервными стимулами с 30-секундными интервалами до достижения амплитуды сложных мышечных потенциалов возврат к исходному уровню |
Диагностическая триада детского ботулизма |
Составные мышечные потенциалы действия пониженной амплитуды по крайней мере в двух группах мышц |
Тетаническое и посттетаническое облегчение более 120 процентов от исходного уровня |
Длительная посттетаническая фасилитация более 120 секунд и отсутствие посттетанического истощения |
ТАБЛИЦА 3
Оценка с помощью ЭМГ подозреваемых случаев младенческого ботулизма
Стандартная батарея ЭМГ |
Стимуляция двухгц нервов двух дистальных мышц |
Супрамаксимальная стимуляция одиночного нерва с последующей тетанизацией 50 Гц в течение 10 секунд и сразу после этого одиночными нервными стимулами с 30-секундными интервалами до тех пор, пока амплитуда сложных мышечных потенциалов не вернется к исходному уровню |
Диагностическая триада младенческого ботулизма |
Составные мышечные потенциалы действия уменьшенной амплитуды по крайней мере в двух группах мышц |
Тетаник и пост-тет анальное облегчение, определяемое амплитудой более 120 процентов от исходного уровня |
Длительное посттетаническое облегчение более 120 секунд и отсутствие посттетанического истощения |
Клиническое лечение
Поддерживающая терапия является основой терапии.Младенцы с ботулизмом должны оставаться в отделении интенсивной терапии, поскольку им часто требуется обеспечение проходимости дыхательных путей, кормление через назогастральный зонд, а также физиотерапия и трудотерапия. Родителям обычно разрешается круглосуточное посещение, и их следует поощрять к участию в уходе за своим младенцем.
У этих младенцев могут возникнуть различные осложнения во время госпитализации (Таблица 4) .2 Следует избегать применения аминогликозидов, поскольку их использование может лизировать бактерии, высвобождая дополнительный внутриклеточный токсин в кишечник младенца.5,17 Не было обнаружено, что катартические средства сокращают течение болезни 1,17
Посмотреть / распечатать таблицу
ТАБЛИЦА 4
Общие осложнения у пациентов, госпитализированных с младенческим ботулизмом
| Осложнения | Частота (% ) | ||||
|---|---|---|---|---|---|
Синдром неадекватной секреции антидиуретического гормона | 16 | ||||
Вегетативная нестабильность | 12 | 04 | 04 | Инфекция мочевыводящих путей | 11 |
Пневмония | 7 | ||||
Сепсис | 5 | 000 9055 | 4 | ||
Остановка дыхания | 4 |
ТАБЛИЦА 4
Общие осложнения у пациентов, госпитализированных с младенческим ботулизмом
| 9055 905 905 905 905 905 905 905 905 904 905 несоответствующей секреции антидиуретического гормона | 16 | |
|---|---|---|
Вегетативная нестабильность | 12 | |
Апноэ | ||
Пневмония | 7 | |
Сепсис | 5 | |
Deizure0005 | 4 | |
Остановка дыхания | 4 |
Исторически сложилось так, что для введения антитоксина использовался продукт лошадиного происхождения.Побочные эффекты, в том числе анафилаксия, наблюдались у 20 процентов пациентов, и антитоксин больше не считается полезным, учитывая самоограничивающееся течение младенческого ботулизма.11 Недавно Департамент здравоохранения Калифорнии провел пятилетнее клиническое исследование ботулинического иммунитета. глобулин, антитоксин человеческого происхождения для лечения детского ботулизма. Использование ботулинического иммуноглобулина у младенцев позволило сократить время, проведенное в больнице, и потребность в искусственной вентиляции легких и зондовом питании.21
Прогноз отличный, летальность составляет менее 2 процентов.17 Восстановление происходит в результате регенерации нервных окончаний и моторных замыкательных пластинок. Диафрагмальная функция восстанавливается до восстановления периферических мышц.
Для младенцев, которым требуется искусственная вентиляция легких, средняя продолжительность составляет 23 дня. В среднем младенцы могли кормить ребенка перорально через 51 день после поступления.

 Отмечается адинамичность, заостренность черт лица, сухость, серость кожи и слизистых, атрофичность мышц и тканей, расстройство работы внутренних органов. Подкожный жир отсутствует. Развиваются осложнения: конъюнктивиты, пневмонии, анемии. Состояние тяжелое.
Отмечается адинамичность, заостренность черт лица, сухость, серость кожи и слизистых, атрофичность мышц и тканей, расстройство работы внутренних органов. Подкожный жир отсутствует. Развиваются осложнения: конъюнктивиты, пневмонии, анемии. Состояние тяжелое.
