Острый постстрептококковый (постинфекционный) гломерулонефрит | #01/17
Острый иммунокомплексный диффузный пролиферативный гломерулонефрит, часто связанный с инфекционными заболеваниями, называют острым постинфекционным гломерулонефритом. Ведущая роль в развитии острого гломерулонефрита принадлежит стрептококку, что определяет еще одно название этого заболевания — острый постстрептококковый гломерулонефрит. Эта наиболее изученная и распространенная форма острого гломерулонефрита, чаще поражающая детей, является темой данного обзора.
Этиология и эпидемиология острого гломерулонефрита
Острый постстрептококковый гломерулонефрит развивается вследствие перенесенной или на фоне персистирующей стрептококковой инфекции и имеет типичные серологические и морфологические признаки. Его возбудителем чаще является β-гемолитический стрептококк группы А, к наиболее известным нефритогенным штаммам которого относятся М-типы 1, 2, 4, 12, 18, 49, 55, 57 и 60 [1–3].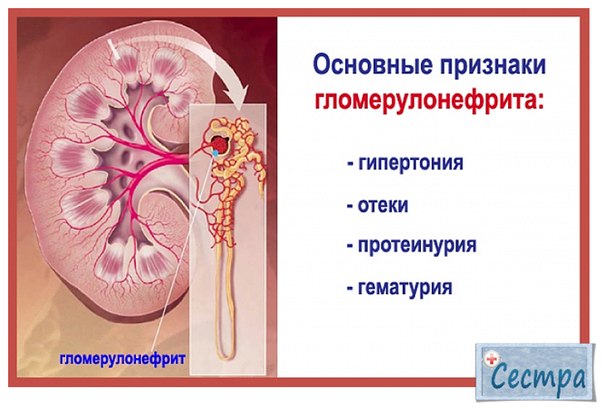
Типичен очаг стрептококковой инфекции в лимфоидных тканях ротоглотки (небные и глоточные миндалины), нередка первичная локализация стрептококка в коже при импетиго или роже, возможно развитие заболевания после отита, остеомиелита. Риск развития острого постстрептококкового гломерулонефрита после инфицирования стрептококком зависит как от конкретного штамма стрептококка, так и от локализации очага. Так, при инфицировании стрептококком серотипа 49 риск развития гломерулонефрита при кожной инфекции в 5 раз выше, чем при фарингите [4, 5].
В развитых странах Северной Америки и Центральной Европы отмечается снижение частоты острого постстрептококкового гломерулонефрита, где заболевание встречается в основном в виде спорадических случаев. В развивающихся странах Южной Америки, Африки, в Китае и Юго-Восточной Азии наблюдаются случаи групповых заболеваний в бедных районах и эпидемические вспышки в плотно населенных областях. Причиной эпидемий стрептококковой инфекции, приводящей к вспышкам острого гломерулонефрита, все чаще бывают атипичные (мутантные) штаммы β-гемолитического стрептококка группы А, резистентные к пенициллинам, макролидам и тетрациклинам, а также другие стрептококки (возбудитель коровьего мастита Streptococcus zooepidemicus и нефритогенный штамм пиогенного стрептококка — Streptococcus pyogenes M49), способные «ускользать» от иммунного ответа. Острый гломерулонефрит, возникший вследствие инфицирования подобными штаммами, как правило, протекает более тяжело и отличается высоким процентом хронизации [6, 7]. Одной из самых известных была эпидемия острого гломерулонефрита, связанная с инфекцией Streptococcus zooepidermicus, отмеченная с декабря 1997 г. по июль 1998 г. в штате Nova Serrana в Бразилии, когда суммарное число заболевших составило 253 человека (от 4,5 до 18,1 на 1000 населения), а источником инфекции стал сыр, приготовленный из молока коров [6].
Острый гломерулонефрит, возникший вследствие инфицирования подобными штаммами, как правило, протекает более тяжело и отличается высоким процентом хронизации [6, 7]. Одной из самых известных была эпидемия острого гломерулонефрита, связанная с инфекцией Streptococcus zooepidermicus, отмеченная с декабря 1997 г. по июль 1998 г. в штате Nova Serrana в Бразилии, когда суммарное число заболевших составило 253 человека (от 4,5 до 18,1 на 1000 населения), а источником инфекции стал сыр, приготовленный из молока коров [6].
Острый постстрептококковый гломерулонефрит значительно чаще встречается у детей, чем у взрослых. Пик заболеваемости приходится на возраст от 2 до 6 лет. Около 5% случаев приходится на возраст младше 2 лет, до 10% — на взрослых старше 40–50 лет, преимущественно мужчин. Мальчики болеют чаще девочек [1, 2, 8]. Острый постстрептококковый гломерулонефрит чаще развивается в зимние месяцы спустя 10–12 дней после перенесенной стрептококковой инфекции (фарингит, ангина, скарлатина), острой инфекции дыхательных путей.
Развитие острого постстрептококкового гломерулонефрита более вероятно при наличии предрасполагающих факторов, таких как отягощенная наследственность в отношении инфекционно-аллергических заболеваний, повышенная семейная восприимчивость к стрептококковой инфекции, наличие у ребенка хронических очагов инфекции, гиповитаминоза, гельминтозов [3, 8]. Провоцирующими факторами развития острого постстрептококкового гломерулонефрита у детей-носителей гемолитического стрептококка могут стать переохлаждение и респираторные вирусные инфекции.
Помимо стрептококка, острый гломерулонефрит может развиваться вследствие других инфекций (бактериальных, вирусных, паразитарных). Среди вирусов наибольшую роль играют вирусы гриппа, кори, краснухи, гепатита А и В. Так, острый гломерулонефрит регистрируется во время эпидемий гриппа и гепатита А. В странах Африки и Азии причиной развития острого гломерулонефрита часто будут паразитарные инфекции (тропическая малярия, шистосомоз) [1, 3, 8].
Провоцировать развитие острого гломерулонефрита могут и неинфекционные факторы, что связано с высокой аллергизацией населения. К таким сенсибилизирующим агентам относятся прежде всего лекарственные препараты (антибиотики, сульфаниламиды), вакцины и сыворотки, пыльца растений, яды насекомых и других животных, пищевые продукты при индивидуальной непереносимости и другие аллергены (табл. 1).
К таким сенсибилизирующим агентам относятся прежде всего лекарственные препараты (антибиотики, сульфаниламиды), вакцины и сыворотки, пыльца растений, яды насекомых и других животных, пищевые продукты при индивидуальной непереносимости и другие аллергены (табл. 1).
Патогенез и патоморфология
В развитии острого постстрептококкового гломерулонефрита ведущее значение принадлежит образованию в крови растворимых иммунных комплексов. При остром постстрептококковом гломерулонефрите или другом постинфекционном нефрите нет непосредственного поражения почек инфекционным агентом, а заболевание обусловлено иммунопатологической реакцией на возбудитель и его антигены. Именно поэтому при «классическом» течении острого постстрептококкового гломерулонефрита первые признаки заболевания возникают через 1–3 нед после перенесенной ангины, в течение которых происходит сенсибилизация организма к антигенам стрептококка.
Большое значение в развитии острого постстрептококкового гломерулонефрита имеет «нефритогенность» определенных штаммов стрептококка. Нефритогенные штаммы стрептококков вырабатывают белки — эндострептолизины, имеющие выраженное сродство к структурам почечных клубочков. При попадании в циркуляцию эти белки, связываясь с участками клубочков, активируют комплемент и формируют иммунные комплексы, что приводит к повреждению эндотелия капилляров клубочков с развитием экссудативных и пролиферативных процессов, провоцирует активацию системы гемостаза и развитие локального внутрисосудистого свертывания с микротромбозами капилляров клубочков.
Нефритогенные штаммы стрептококков вырабатывают белки — эндострептолизины, имеющие выраженное сродство к структурам почечных клубочков. При попадании в циркуляцию эти белки, связываясь с участками клубочков, активируют комплемент и формируют иммунные комплексы, что приводит к повреждению эндотелия капилляров клубочков с развитием экссудативных и пролиферативных процессов, провоцирует активацию системы гемостаза и развитие локального внутрисосудистого свертывания с микротромбозами капилляров клубочков.
Другой механизм реализуется повреждением нейраминидазой стрептококков нормальных молекул IgG, которые, откладываясь в неповрежденных клубочках и связываясь с анти-IgG-антигенами, формируют иммунные комплексы, повреждающие почку [1, 3, 8].
Роль других антигенов и токсинов β-гемолитического стрептококка, таких как мембранные антигены М-типа, эндотоксин D, нефрит-ассоциированный плазминовый рецептор, эритрогенный экзотоксин В, сводится к запуску механизмов пролиферации в почечных клубочках, активации С3-фракции комплемента и ренин-ангиотензин-альдостероновой системы (РААС), что приводит в свою очередь к задержке натрия и воды и почечной вазоконстрикции [1, 2, 9–12].
Острый постстрептококковый гломерулонефрит характеризуется преимущественно субэпителиальным отложением иммунных комплексов с формированием диффузного эндокапиллярного пролиферативного гломерулонефрита, который в своем развитии может проходить несколько стадий: экссудативную, экссудативно-пролиферативную, пролиферативную и фазу остаточных явлений, сменяющих друг друга.
При иммуногистохимическом исследовании в ранние сроки заболевания обнаруживают IgG и С3, которые распределяются диффузно вдоль стенок капилляров в виде мелких гранул.
Патогномоничным признаком острого постстрептококкового гломерулонефрита, выявляемым при электронной микроскопии, будут отложения IgG- и С3-депозитов в виде «горбов» на эпителиальной стороне базальной мембраны капилляров.
Первоначально изменения носят экссудативный характер с набуханием эндотелиальных и мезангиальных клеток и инфильтрацией полиморфноядерными лейкоцитами, выраженность которой зависит от степени иммунокомплексных отложений. В дальнейшем начинают преобладать процессы пролиферации мезангиоцитов и эндотелиоцитов, тогда как количество инфильтрирующих клеток постепенно снижается. Морфологические изменения после перенесенного острого гломерулонефрита могут сохраняться в виде увеличения мезангиального матрикса, неравномерной плотности и неправильного контура гломерулярной базальной мембраны, синехий.
В дальнейшем начинают преобладать процессы пролиферации мезангиоцитов и эндотелиоцитов, тогда как количество инфильтрирующих клеток постепенно снижается. Морфологические изменения после перенесенного острого гломерулонефрита могут сохраняться в виде увеличения мезангиального матрикса, неравномерной плотности и неправильного контура гломерулярной базальной мембраны, синехий.
Поражение капилляров клубочков в дебюте острого гломерулонефрита приводит к их полнокровию, стазу, повышению проницаемости и повреждению стенок. Эритроциты проникают в полость капсулы клубочка и канальцев, что обусловливает развитие гематурии различной степени выраженности. При значительном нарушении микроциркуляции может существенно снижаться скорость клубочковой фильтрации (СКФ), что клинически будет проявляться олигурией.
Нарушения почечной гемодинамики и ишемия почек приводят к активации РААС с обратным всасыванием натрия в канальцах нефронов. Этому же способствуют активация тубулогломерулярной обратной связи и нарушение СКФ.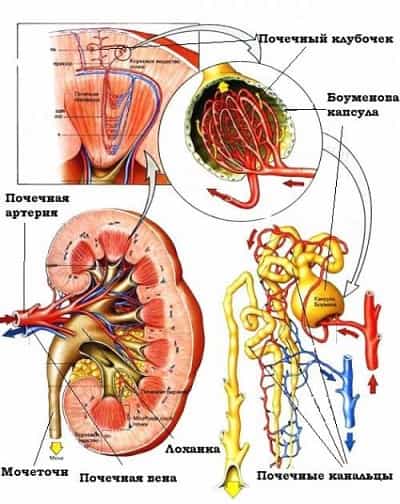 Указанные патогенетические механизмы приводят к гипернатриемии, острой гиперволемии и объем-натрий-зависимой гипертензии с перегрузкой объемом левого желудочка миокарда.
Указанные патогенетические механизмы приводят к гипернатриемии, острой гиперволемии и объем-натрий-зависимой гипертензии с перегрузкой объемом левого желудочка миокарда.
В редких случаях развивается выраженная пролиферация париетального эпителия и накопление моноцитов экстракапиллярно. Экстракапиллярная пролиферация (пролиферативные экстракапиллярные полулуния) более чем в 30% клубочков ведет к быстропрогрессирующему острому нефриту с быстрым исходом в нефросклероз с терминальной уремией.
Ренальная острая почечная недостаточность (ОПН) осложняет другие редкие варианты тяжелого острого гломерулонефрита:
- с фибриноидным некрозом почечных артерий при неконтролируемой гипертензии;
- с миоренальным синдромом с рабдомиолизом при рецидивах почечной эклампсии.
Клиническая картина и течение заболевания
Острый постстрептококковый гломерулонефрит обычно манифестирует через 1–3 нед после перенесенной ангины или фарингита либо через 3–6 нед после кожной инфекции. Клинические проявления острого гломерулонефрита могут варьировать от скудных изменений в моче до яркой манифестации в виде остронефритического синдрома с классической триадой симптомов: гематурией, отеками, гипертензией, а также олигурией (табл. 2). При целенаправленном расспросе можно выявить симптомы в виде жажды, слабости, уменьшения количества мочи. По мере развития заболевания присоединяются одышка, сердцебиение, головная боль, тошнота, во многом обусловленные острой гипертензией. Боли в пояснице ощущают 5–10% больных. Боли тупые, симметричные, обусловлены растяжением капсулы почек в результате отека почечной паренхимы.
Клинические проявления острого гломерулонефрита могут варьировать от скудных изменений в моче до яркой манифестации в виде остронефритического синдрома с классической триадой симптомов: гематурией, отеками, гипертензией, а также олигурией (табл. 2). При целенаправленном расспросе можно выявить симптомы в виде жажды, слабости, уменьшения количества мочи. По мере развития заболевания присоединяются одышка, сердцебиение, головная боль, тошнота, во многом обусловленные острой гипертензией. Боли в пояснице ощущают 5–10% больных. Боли тупые, симметричные, обусловлены растяжением капсулы почек в результате отека почечной паренхимы.
Гематурия — обязательный признак острого гломерулонефрита. У 2/3 больных обнаруживается микрогематурия, у остальных — макрогематурия. После увеличения диуреза макрогематурия, как правило, исчезает, в то время как микрогематурия может сохраняться в течение многих месяцев после острого периода. Отеки, вследствие задержки натрия и воды при манифестном течении, определяются у 80–90% больных. Преимущественная локализация отеков — лицо. Отеки наиболее выражены утром, днем могут спадать, сменяясь отеком лодыжек. У некоторых больных формируется facies nephritica: отеки лица, бледность кожного покрова, набухание шейных вен. Олигурия развивается в первые дни заболевания, сохраняется обычно в течение 2–3 дней. Анурия не характерна. Длительно сохраняющаяся олигурия может рассматриваться как неблагоприятный прогностический признак.
Преимущественная локализация отеков — лицо. Отеки наиболее выражены утром, днем могут спадать, сменяясь отеком лодыжек. У некоторых больных формируется facies nephritica: отеки лица, бледность кожного покрова, набухание шейных вен. Олигурия развивается в первые дни заболевания, сохраняется обычно в течение 2–3 дней. Анурия не характерна. Длительно сохраняющаяся олигурия может рассматриваться как неблагоприятный прогностический признак.
Артериальная гипертензия развивается более чем у 80% больных, чаще умеренная. В основе ее патогенеза — увеличение объема циркулирующей крови, увеличение ударного объема сердца, повышение сердечного выброса и периферического сосудистого сопротивления. Длительное и стойкое повышение артериального давления (АД) рассматривается как неблагоприятный прогностический признак и может свидетельствовать о развитии застойной сердечной недостаточности или формировании почечной эклампсии.
Протеинурия, отмечающаяся почти всегда, как правило, не достигает высоких цифр и сохраняется в среднем не более 7–10 дней. Умеренная и следовая протеинурия может выявляться дольше.
Умеренная и следовая протеинурия может выявляться дольше.
В общем анализе мочи выявляются цилиндры (гиалиновые, зернистые и эритроцитарные цилиндры), в первые дни заболевания можно обнаружить лейкоциты, представленные в основном сегментоядерными нейтрофилами, эозинофилами и лимфоцитами, отражающими иммунный воспалительный процесс в клубочках.
В общем анализе крови выявляют нейтрофильный лейкоцитоз, возможны эозинофилия, увеличение скорости оседания эритроцитов (СОЭ), анемия. Наблюдается умеренное снижение СКФ при нормальном или повышенном почечном кровотоке. Азотовыделительная функция почек чаще не нарушена либо отмечается небольшое увеличение содержания азотистых продуктов. Характерны диспротеинемия (гипер-α-2- и гипер-γ-глобулинемия), гипокомплементемия.
При серологическом исследовании крови у большинства больных обнаруживают повышенные титры антистрептолизина О, антистрептогиалуронидазы, антистрептокиназы. На первой неделе болезни выявляют циркулирующие иммунные комплексы и снижение концентрации С3-фракции комплемента. В сыворотке крови повышается концентрация IgG, IgM, редко IgA.
В сыворотке крови повышается концентрация IgG, IgM, редко IgA.
Нарушения в системе свертывания крови проявляются сокращением протромбинового времени, повышением протромбинового индекса, угнетением фибринолитической активности, появлением продуктов деградации фибрина и фибриногена в сыворотке крови и моче.
Остро развившаяся гиперволемия приводит к гипертензии с расширением полостей сердца. При этом расширяются границы относительной тупости сердца, часто обнаруживают тахикардию, реже — брадикардию, ослабление I тона, акцент II тона на аорте. В тяжелых случаях возможно появление ритма галопа. На электрокардиограмме отмечаются низкий вольтаж, удлинение зубца P–Q, двухфазность и уплощение зубца T, иногда смещение интервала ST. Появляется спазм сосудов глазного дна, возможны геморрагии и отек диска зрительного нерва.
В период обратного развития острого нефрита появляется полиурия, исчезают отеки и макрогематурия, нормализуется АД. Примерно через 1,5–2 мес нормализуются показатели мочи и наступает полная клинико-лабораторная ремиссия. Однако полное выздоровление с обратным развитием морфологических изменений в почках наступает через 1–2 года.
Однако полное выздоровление с обратным развитием морфологических изменений в почках наступает через 1–2 года.
Если отдельные клинические симптомы сохраняются более 6 мес, это указывает на затяжное течение острого гломерулонефрита; длительность симптоматики более 1 года расценивают как переход в хронический нефрит. Однако у детей изолированная микрогематурия может сохраняться и более 1 года после перенесенного острого гломерулонефрита без хронизации заболевания [3, 8].
Отличительной особенностью течения современного острого гломерулонефрита является преобладание малосимптомных вариантов, которые встречаются в десятки раз чаще, чем манифестные. Такое атипичное субклиническое течение острого гломерулонефрита характеризуется изолированным мочевым синдромом (в виде гематурии) и отсутствием экстраренальных проявлений, либо они столь незначительны и кратковременны, что проходят незамеченными. «Классический» остронефритический синдром встречается редко.
Как правило, субклинические формы острого гломерулонефрита выявляются случайно при лабораторном исследовании либо констатируются постфактум при тщательном изучении анамнеза.
Осложнения острого гломерулонефрита
При тяжелом течении острого нефрита в начальный период возможны угрожающие жизни осложнения:
- почечная эклампсия с отеком мозга;
- острая сердечная недостаточность;
- отек легких;
- острая почечная недостаточность.
Наиболее тяжелое осложнение — эклампсия (ангиоспастическая энцефалопатия), всегда сопровождается повышением АД, обусловлена спазмом сосудов головного мозга и последующим его отеком. Эклампсия проявляется тонико-клоническими судорогами, возникающими после короткого периода предвестников — головной боли, тошноты, рвоты, нарушения зрения. Во время припадка сознание отсутствует, кожный покров и слизистые оболочки становятся цианотичными, дыхание — неровным, хрипящим, появляется пена изо рта, происходит непроизвольное мочеиспускание. Приступ длится несколько минут, иногда наблюдается серия приступов. При отсутствии ургентной адекватной терапии возможен летальный исход от кровоизлияния в головной мозг.
Типичной причиной ОПН являются рентгеноконтрастная нефропатия. Риск этого осложнения при выполнении внутривенной урографии или ангиографии при остром нефрите резко повышен. При остром нефрите высок риск ятрогенных нефропатий — при применении НПВС, нефротоксичных антибиотиков, циклоспорина. При наличии профузной макрогематурии, вызывающей обструкцию мочеточников, описаны случаи развития постренальной ОПН.
Острая сердечно-сосудистая недостаточность у детей возникает редко, характеризуется резким увеличением размеров печени, нарастанием периферических отеков и клинической картиной острой левожелудочковой недостаточности, прогрессирующей в кардиогенный отек легких.
Диагностика и дифференциальный диагноз
Отеки, гематурия и артериальная гипертензия составляют триаду клинических симптомов, служащую основным критерием клинической диагностики острого гломерулонефрита. Трудности в распознавании заболевания возникают при атипичном или стертом течении, когда у ребенка выявляют только микрогематурию и незначительную протеинурию. В этих случаях поставить диагноз помогают данные о недавно перенесенной стрептококковой инфекции, наблюдение за динамикой АД и почечного процесса и результаты дополнительных исследований, включающие определение титра антистрептококковых антител и концентрации компонентов комплемента в сыворотке крови.
В этих случаях поставить диагноз помогают данные о недавно перенесенной стрептококковой инфекции, наблюдение за динамикой АД и почечного процесса и результаты дополнительных исследований, включающие определение титра антистрептококковых антител и концентрации компонентов комплемента в сыворотке крови.
Дифференциальную диагностику следует проводить с урологическими заболеваниями с гематурией (мочекаменная болезнь, нефроптоз, опухоли и туберкулез почек, тромбоз почечных вен), обострением хронического гломерулонефрита, острым пиелонефритом, острым тубулоинтерстициальным нефритом (инфекционным, лекарственным), IgA-нефритом (первичным и вторичным), синдромом Альпорта, болезнью тонких базальных мембран, гемолитико-уремическим синдромом [1, 3, 8].
Для проведения дифференциальной диагностики важно тщательно собрать анамнез, выяснить, не было ли ранее отеков, изменений в анализах мочи, повышенного артериального давления. В пользу обострения хронического нефрита свидетельствуют также снижение концентрационной способности почек, изменения на глазном дне.
Иногда вопрос дифференциальной диагностики решается путем длительного наблюдения за ребенком, а в некоторых случаях при длительно сохраняющейся симптоматике необходимо морфологическое исследование — биопсия почки. Развитие нефротического синдрома или быстропрогрессирующее течение требует исключить другую форму гломерулонефрита, манифестировавшую под маской «острого» [13–15].
Лечение
Лечение больных острым гломерулонефритом проводят в стационаре. В острый период необходимы постельный режим, покой, тепло, способствующие улучшению кровообращения в почках. Расширение режима проводят по мере исчезновения отеков, коррекции гипертензии.
Учитывая связь острого постстрептококкового гломерулонефрита со стрептококковой инфекцией, в дебюте заболевания целесообразно назначать антибиотики из группы пенициллинов (например, защищенные пенициллины), цефалоспорины в течение 10 сут. Антибактериальная терапия показана при развитии острого гломерулонефрита при фарингите, тонзиллите, поражениях кожи, особенно при положительных результатах посевов с зева или при высоких титрах антистрептококковых антител в крови.
Диета
В острый период болезни, особенно при бурном начале с отеками, олигурией и артериальной гипертензией, необходимо резко ограничить потребление хлорида натрия и воды. В период развития олигурии суточное количество потребляемой жидкости рассчитывается по формуле: диурез за предыдущие сутки + потери на перспирацию (15 мл/(кг × сут) или 400 мл/(м2 × сут)). В дальнейшем количество потребляемой жидкости увеличивается соответственно увеличению диуреза. Бессолевой стол назначается в первую неделю заболевания, а при сохранении олигурии и/или артериальной гипертензии и на более длительный срок. Снижение повышенной концентрации натрия крови — основа патогенетической терапии нефритических отеков и артериальной гипертензии. У большинства больных с нефритическим синдромом понижение концентрации натрия крови, даже при отсутствии другой терапии, приводит к быстрому купированию отечного и гипертензионного синдромов.
После стойкой нормализации АД и диуреза разрешено добавление соли в пищу из расчета 0,5–1,0 г/сут. При благоприятном течении заболевания потребление соли восстанавливается с 4–5 недели из расчета 50 мг/(кг × сут).
При благоприятном течении заболевания потребление соли восстанавливается с 4–5 недели из расчета 50 мг/(кг × сут).
Убедительных доказательств положительного влияния малобелковой диеты на течение острого гломерулонефрита не получено. Традиционно принято ограничивать потребление белка из расчета около 1,0 г/кг в сутки. Расширение рациона производится преимущественно за счет растительного белка, потребление белков животного происхождения ограничивается в течение 2–3 нед. Противопоказаны острые блюда и продукты, содержащие экстрактивные вещества и аллергены; следует избегать продуктов, богатых калием. Общая энергетическая ценность пищи должна соответствовать потребностям ребенка.
Лечение отечного синдрома
Диуретическая терапия назначается при выраженных отеках, способствует снижению гиперволемии и угрозы развития осложнений. Назначение гидрохлоротиазида эффективно только при нормальной скорости СКФ. Спиронолактон не применяется из-за риска развития гиперкалиемии. Наиболее часто назначается фуросемид, который эффективен даже при сниженной СКФ. Препарат используется в дозе 1,0–2,0 мг/кг в сутки парентерально в 1–2 приема; при необходимости доза препарата может быть увеличена. Через несколько дней пациент может быть переведен на пероральный прием препарата. При выраженных отеках, признаках левожелудочковой недостаточности с артериальной гипертензией фуросемид назначается в дозе до 4 мг/кг в сутки и более.
Антигипертензивная терапия
Антигипертензивная терапия необходима при гипертензии, не корригируемой режимом и салуретиками. Для лечения используют антагонисты кальция дигидропиридинового ряда: нифедипин (0,25–1 мг/кг в сутки), амлодипин (6–17 лет: 2,5–5 мг/сут), исрадипин, 0,15–0,8 мг/кг в сутки (до 20 мг/сут) и др.; центральные симпатолитики: метилдопа (10 мг/кг в сутки), моксонидин; кардиоселективные β-адреноблокаторы. Ингибиторы ангиотензин-превращающего фермента — эналаприл (0,1–0,5 мг/кг в сутки), каптоприл (0,3–1,5 мг/кг в сутки), лизиноприл (0,07–0,6 мг/кг в сутки) рамиприл, фозиноприл — применяют под контролем за уровнем СКФ и калия крови в сочетании с фуросемидом.
При появлении предвестников почечной эклампсии или отека легких необходим переход на интенсивную инфузионную терапию фуросемидом (до 480 мг в сут) с периферическими вазодилататорами (внутривенно капельно: нитроглицерин или нитропрусид натрия, диазоксид) и альфа-блокаторами (дигидролазин). При отсутствии эффекта с нарастанием гипертензии с энцефалопатией показан перевод в отделение интенсивной терапии с проведением сеансов изолированной ультрафильтрации, гемодиализа или интермиттирующей гемофильтрации. Экстракорпоральное удаление жидкости показано также при развитии критической гипергидратации с угрозой острой левожелудочковой недостаточности.
Иммуносупрессивная терапия
Иммуносупрессивная терапия показана больным с присоединившимся нефротическим синдромом (сохраняющимся более 2 нед), при снижении СКФ без тенденции к возвращению к норме. Для выбора схемы иммуносупрессии обязательно проведение биопсии почки. При нефротическом синдроме с экстракапиллярной пролиферацией в отдельных клубочках применяется преднизолон внутрь в дозе 1–2 мг/кг в сутки. При быстропрогрессирующем остром нефрите с выявлением экстракапиллярных пролиферативных полулуний более чем в 30% клубочков почечного биоптата применяются внутривенные метилпреднизолоновые «пульсы».
Основные принципы лечения острого постстрептококкового гломерулонефрита представлены в табл. 3.
Профилактика и прогноз
Для предупреждения острого гломерулонефрита необходимы своевременная диагностика и адекватная терапия стрептококковых заболеваний, санация очагов хронической инфекции, рациональное проведение профилактических прививок. При наличии хронического тонзиллита и/или аденоидита необходимы консультация оториноларинголога и решение вопроса о необходимости тонзилло- или аденоэктомии [8].
Диспансерное наблюдение за детьми, перенесшими острый постстрептококковый гломерулонефрит, осуществляется в течение 5 лет, а при сохранении малейших изменений в анализах мочи — до перевода во взрослую сеть.
Прогноз острого постстрептококкового гломерулонефрита у детей достаточно благоприятный. В среднем около 90% детей выздоравливают, у остальных остаточные изменения в моче могут сохраняться длительное время [3, 8]. Прогрессирование острого гломерулонефрита в терминальную хроническую почечную недостаточность у детей отмечается не более чем в 1–2% случаев. Летальный исход регистрируют крайне редко. У ребенка, у которого в течение 1 года после манифестации острого гломерулонефрита сохраняются гипертензия или отеки либо протеинурия выше 1 г/сут, следует исключить хронизацию с помощью стационарного обследования.
У взрослых риск хронизации острого гломерулонефрита с исходом в терминальную хроническую почечную недостаточность почти в 10 раз чаще, чем у детей [2–4, 8].
В настоящее время недостаточно данных о возможности трансформации острого гломерулонефрита в хронический нефрит. Поскольку биопсия почки проводится только при затяжном течении острого гломерулонефрита или развитии нефротического синдрома, в большинстве случаев невозможно судить об эволюции морфологических изменений в клубочках.
Случаи хронизации острого гломерулонефрита регистрируются при инфицировании атипичными штаммами β-гемолитического стрептококка или его другими видами, а также при развитии острого гломерулонефрита вследствие паразитарных инфекций (например, тропической малярии). Эти наблюдения касаются в основном взрослых мужчин, перенесших острый гломерулонефрит в результате эпидемических вспышек. [16, 17].
Литература
- Нефрология. Учебное пособие для послевузовского образования под ред. Е. М. Шилова. М.: ГЭОТАР-Медиа, 2007.
- Острый гломерулонефрит — все ли вопросы решены? От редакции // Клиническая нефрология. 2009. Т. 2. С. 4–9.
- Хасабов Н. Н., Малкоч А. В. Современные представления о гломерулонефритах. В кн.: Нефрология детского возраста (под ред. В. А. Таболина и др.). М.: ИД Медпрактика-М, 2005. С. 306–390.
- Jankauskiene A., Pundziene B., Vitkevic R. Postinfectious glomerulonephritis in children in Lithuania during 1995–2004: prevalence and clinical features //Medicina (Kaunas). 2007. Vol. 43. Suppl 1. P. 16–22.
- Nasr S. H., Markowitz G. S., Stokes M. B. et al. Acute postinfectious glomerulonephritis in the modern era: experience with 86 adults and review of the literature // Medicine (Baltimore). 2008. Vol. 87. № 1. P. 21–32.
- Balter S., Benin A., Pinto S. W. et al. Epidemic nephritis in Nova Serrana, Brazil // Lancet. 2000. Vol. 355. № 9217. P. 1776–1780.
- Francis A. J., Nimmo G. R., Efstratiou A. et al. Investigation of milk-borne Streptococcus zooepidemicus infection associated with glomerulonephritis in Australia // J. Infect. 1993. Vol. 27. № 3. P. 317–23.
- Папаян А. В., Савенкова Н. Д. Клиническая нефрология. СПб: Сотис, 1997. 712 с.
- Yoshizawa N., Oshima S., Sagel I. et al. Role of a streptococcal antigen in the pathogenesis of acute poststreptococcal glomerulonephritis. Characterization of the antigen and a proposed mechanism for the disease // J. Immunol. 1992. Vol. 148. № 10. P. 3110–3116.
- Viera N., Pedreanez A., Rincon J., Mosquera J. Streptococcal exotoxin B increases interleukin-6, tumor necrosis factor alpha, interleukin-8 and transforming growth factor beta-1 in leukocytes // Pediatr. Nephrol. 2007. Vol. 22. № 9. P. 1273–1281.
- Viera N., Pedreanez A., Rincon J., Mosquera J. Streptococcal zymogen type B induces angiotensin II in mesangial cells and leukocytes //Pediatr. Nephrol. 2009. Vol. 24. № 5. P. 1005–1011.
- Gadau J., Peters H., Kastner C. et al. Mechanisms of tubular volume retention in immune-mediated glomerulonephritis // Kidney Int. 2009. Vol. 75. № 7. P. 699–710.
- Wong W., Morris M. C., Zwi J. Outcome of severe acute post-streptococcal glomerulonephritis in New Zealand children // Pediatr. Nephrol. 2009. Vol. 24. № 5. P. 1021–1026.
- Raff A., Hebert T., Pullman J., Coco M. Crescentic post-streptococcal glomerulonephritis with nephrotic syndrome in the adult: is aggressive therapy warranted? // Clin. Nephrol. 2005. Vol. 63. № 5. P. 375–380.
- El-Husseini A. A., Sheashaa H. A., Sabry A. A. et al. Acute postinfectious crescentic glomerulonephritis: clinicopathologic presentation and risk factors // Int. Urol. Nephrol. 2005. Vol. 37. № 3. P. 603–609.
- Pinto S. W., Sesso R., Vasconcelos E. et al. Follow-up of patients with epidemic poststreptococcal glomerulonephritis // Am. J. Kidney Dis. 2001. Vol. 38. № 2. P. 249–255.
- Sesso R., Pinto S. W. Five-year follow-up of patients with epidemic glomerulonephritis due to Streptococcus zooepidemicus // Nephrol. Dial Transplant. 2005. Vol. 20. № 9. P. 1808–1812.
А. В. Малкоч1, кандидат медицинских наук
А. Ю. Николаев, доктор медицинских наук, профессор
Н. Н. Филатова, кандидат медицинских наук
ФГБОУ ДПО РМАНПО МЗ РФ, Москва
1 Контактная информация: [email protected]
Гломерулонефрит — причины, симптомы и лечение — Медкомпас
Гломерулонефрит представляет собой иммуно-воспалительную реакцию, которая поражает почечные клубочки, при этом имеются клинические проявления как со стороны почек, так и со стороны остальных органов и систем.
Гломерулонефрит может классифицироваться по различным признакам. Так, по характеру течения выделяют:
- Острый
- Хронический
- Латентный (выявляются только характерные изменения мочи и незначительное повышение артериального давления
- Быстропрогрессирующий.
Патологический процесс может быть в зависимости от причинных факторов:
- Первичным – поражение почек является первоначальным
- Вторичным – имеются системные иммуно-воспалительные заболевания, например, системная красная волчанка, ревматизм и другие.
Клинические формы гломерулонефрита представлены следующим образом:
- Гематурическая, при которой в моче выявляется очень большое количество эритроцитов
- Нефротическая
- Смешанная
- Выделяют также активную и неактивную фазы заболевания.
Симптомы болезни
Первые симптомы начинают появляться примерно через 2-3 недели после эпизода стрептококковой инфекции. Они различны и зависят от клинического варианта гломерулонефрита. Однако все симптомы делятся на две основные группы:
- Почечные
- Внепочечные.
Начало заболевания может иметь классическую клиническую картину или проявляться только одним симптомом из трех классических:
- Повышение артериального давления
- Появление отеков
- Изменения в моче (наиболее типичный признак – это наличие эритроцитов в моче выше нормы).
Причины болезни
Основным причинным фактором является бета-гемолитический стрептококк, но могут быть и другие микроорганизмы.
Иммунная система при развитии гломерулонефрита изначально работает неправильно, что и приводит к повреждению собственных тканей организма. В данном случае это почечные клубочки. Таким образом, это заболевание представляет собой сенсибилизацию организма к тем или иным микроорганизмам. При вторичных гломерулонефритах имеются системные нарушения в иммунной системе. Это преимущественно диффузные заболевания соединительной ткани.
Принято выделят предрасполагающие факторы, которые повышают вероятность развития аутоиммунного воспаления. К ним относятся:
- Воздействие низких температур на организм
- Прием алкоголя в больших количествах
- Введение иммунных препаратов – это вакцины, сыворотки, иммуноглобулинов
- Предшествующие стрептококковые инфекции – ангина, ревматизм, поражения мягких тканей и т.д.
Диагностика
Диагностический поиск при подозрении на гломерулонефрит включает в себя следующие дополнительные методы исследования:
- Общеклинический анализ мочи и анализ мочи по Нечипоренко (снижение или увеличение объема мочи, появление в моче белка (протеинурия), микрогематурия (эритроциты в моче))
- Общеклинический анализ крови (может быть повышена СОЭ, отмечается лейкоцитоз, эозинофилия)
- УЗИ почек
- Ревмопробы.
Осложнения
Отсутствие своевременного лечения острого гломерулонефрита приводит к следующим осложнениям:
- Острая недостаточность функции почек
- Поражение головного мозга (энцефалопатия), которое проявляется судорожным синдромом, потерей сознания, непроизвольно происходящими актами мочеиспускания и дефекации
- Острая недостаточность функции сердца по левожелудочковому типу (очень высок риск смертельного исхода).
Хронический гломерулонефрит может осложниться:
- Злокачественным повышением артериального давления (эклампсией)
- Хронической недостаточностью сердца, печени и почек
- Обострением хронических инфекционно-воспалительных заболеваний
- Уремическим плевритом, перикардитом, перитонитом.
Лечение болезни
Лечение гломерулонефрита основано на следующих принципах:
- Иммуносупрессия (назначаются глюкокортикостероиды)
- Коррекция имеющихся патологических изменений (снижение артериального давления, повышение белка в крови и т.д.)
- Назначение антибиотиков, активных в отношении стрептококков, если они выявлены в организме.
ГЛОМЕРУЛОНЕФРИТ У ДЕТЕЙ | Энциклопедия KM.RU
Гломерулонефрит — инфекционно-аллергическое заболевание, характеризующееся нарушением функции почек. Различают острый и хронический гломерулонефрит. Заболевание развивается через 2—3 недели после перенесенной скарлатины, ангины, хронического тонзиллита, вирусных инфекций верхних дыхательных путей. У таких больных в носоглотке и на коже часто обнаруживаются стрептококки. Провоцирует заболевание переохлаждение организма.
Развитие. Предполагается несколько вариантов механизма развития гломерулонефрита: 1) непосредственное повреждение стрептококками или его компонентами почек; 2) фиксация стрептококка на клетках почек с последующим образованием к этим комплексам аутоантител, которые повреждают почку.
Симптомы. Через 10-21 день после перенесенной инфекции у ребенка появляется слабость, повышенная утомляемость, жажда, уменьшение выделения мочи. Больной и окружающие его замечают отеки на лице, затем на ногах, пояснице, которые чаще появляются постепенно и являются наиболее ранним и частым признаком гломерулонефрита. Моча принимает цвет мясных помоев, но может окрашиваться в бурый или цвет черного кофе. Ведущим симптомом заболевания является гипертония. Происходит повышение артериального давления — как максимального, так и минимального. Оно имеет стойкий и длительный характер (более 3-х месяцев) и указывает на переход заболевания в хроническую форму. В связи с этим ухудшается зрение, появляются головные боли, сонливость, тошнота. При тяжелом течении гломерулонефрита возможны осложнения: острая почечная недостаточность, отек мозга, острая сердечная недостаточность.
Диагноз. Ставится при пасточности или отеках лица, поясницы, при малом выделении мочи (меньше 300 мл), головных болях, повышении артериального давления, бурой моче. Заболевание следует дифференцировать с пиелонефритом.
Лечение. Больные должны лечиться в стационаре. Ограничивается потребление жидкости. Пища не должна содержать соли. Назначаются антибиотики в течение 2—3 недель, мочегонные средства. Лечение в стационаре продолжается не менее 1,5—2 месяцев.
Профилактика. Больные должны находиться под наблюдением нефролога 5 лет. Следует ежемесячно исследовать мочу. Детей необходимо оберегать от инфекций, желательно освободить от занятий физкультурой.
КЛИНИЧЕСКИЙ СЛУЧАЙ ОСТРОГО ПОСТИНФЕКЦИОННОГО ГЛОМЕРУЛОНЕФРИТА У РЕБЕНКА Текст научной статьи по специальности «Клиническая медицина»
ISSN 2410-6070 ИННОВАЦИОННАЯ НАУКА №12 / 2020
УДК 616.61-002.1
Имаева Л.Р.,
доцент кафедры педиатрии с курсом ИДПО,
к.м.н., ГБОУ ВО БГМУ Минздрава России, г. Уфа, РФ врач-нефролог нефрологического отделения, ГБУЗ РДКБ, г. Уфа, РФ Ахметшин Р.З.,
заведующий кафедрой педиатрии с курсом ИДПО, доцент, к.м.н., ГБОУ ВО БГМУ Минздрава России, г. Уфа, РФ главный врач ГБУЗ РДКБ, г. Уфа, РФ Шагарова С.В., профессор кафедры педиатрии с курсом ИДПО, д.м.н., ГБОУ ВО БГМУ Минздрава России, г. Уфа, РФ
Ширяева Г.П.,
профессор кафедры педиатрии с курсом ИДПО, д.м.н., ГБОУ ВО БГМУ Минздрава России, г. Уфа, РФ
КЛИНИЧЕСКИЙ СЛУЧАЙ ОСТРОГО ПОСТИНФЕКЦИОННОГО ГЛОМЕРУЛОНЕФРИТА У РЕБЕНКА
Аннотация
В статье представлено клиническое наблюдение ребенка с острым постинфекционным гломерулонефритом, осложненным развитием полиорганной недостаточности. Описывается клиническая картина заболевания, приводятся результаты комплексного обследования пациента, динамика клинико-лабораторных данных на фоне лечения.
Ключевые слова:
острый постинфекционный гломерулонефрит, осложнения, дети.
Актуальность. Гломерулонефрит является одним из наиболее тяжелых поражений почек, протекающий с нарушением функции ряда систем и всех видов обмена, обуславливающего раннюю инвалидизацию детей и подростков [2, 3]. Гломерулонефрит занимает второе место среди заболеваний почек по частоте развития хронической почечной недостаточности [1, 4].
Приводим клиническое наблюдение больного с острым постинфекционным гломерулонефритом с нефритическим синдромом высокой степени активности.
Мальчик, 9 лет, заболел остро: боль в горле, на второй день на фоне многократной рвоты, разжиженного стула, у ребенка появились чувство нехватки воздуха, отеки, одышка, выраженная слабость, снижение диуреза, макрогематурия. Состояние очень тяжелое, сознание оглушенное, кожные покровы бледные с мраморным рисунком, влажные, холодные на ощупь. На нижних конечностях многочисленные ссадины, осложненные стрептодермией. Цианоз губ. Видимые слизистые сухие. В легких дыхание жесткое с обеих сторон, по всем полям выслушиваются крепитирующие мелкопузырчатые влажные хрипы. Тахипноэ до 64 в минуту, тахикардия до 132 в минуту. Артериальная гипертензия до 140/100 мм рт.ст. Живот умеренно вздут. Моча цвета «мясных помоев». При интубации трахеи обильное пенистое отделяемое из дыхательных путей. Остановка сердечной деятельности во время интубации. Клиническая смерть. Дефибрилляция, непрямой массаж сердца. Сердечная деятельность восстановлена через 3 минуты. Состояние ребенка крайне тяжелым, обусловленное полиорганной недостаточностью (дыхательная недостаточность III, сердечно-сосудистая недостаточность, отек головного мозга, печеночная, почечная недостаточность), без сознания — кома II-III. На ИВЛ. При санации трахеобронхиального дерева (ТБД) слизисто-гнойное отделяемое. По катетеру моча цвета «мясных помоев». Общий анализ мочи: цвет
~ 140 ~
«мясных помоев», протеинурия до 3 г/л, эритроциты в большом количестве. Биохимический анализ крови: гиперазотемия (уровень мочевины 41,19 ммоль/л, уровень креатинина 159 мкмоль/л). Клиническом анализ крови: лейкоцитоз 42,3х10/л, увеличение СОЭ — 38 мм/ч, тромбоцитоз 570х10/л, анемия (уровень гемоглобина 95 г/л, эритроциты 3,27х1012/л). Иммунологическое исследование: повышение уровня иммуноглобулина А — 2,78 г/л, G — 15,3 г/л, уровня ЦИК — 48 у.е., С-реактивного белка — 20, титра АСЛО — 625 МЕ/мл; гипокомплементемия 1:2. УЗ-исследование: в плевральных полостях и брюшной полости незначительное количество свободной жидкости; печень несколько увеличена в размерах; вокруг желчного пузыря асцитический ободок; почки увеличены в размерах: правая — 95х40х44мм, левая -97х35х38мм, топика обычная, паренхима утолщена до 18мм, гиперэхогенная. Эхокардиография: все полости сердца расширены, митральная регургитация +, сократительная способность миокарда снижена, жидкость в полости перикарда на максимальной границе нормы. Рентгенография органов грудной клетки: данные рентген-семиотики обусловлены отечным синдромом. Электроэнцефалографическое исследование: легкие диффузные изменения биопотенциалов головного мозга с патологической активностью (острые тета-волны, комплексы «острая волна — медленная») в задне-височных, теменно-затылочных отведениях. УЗ-допплерография сосудов головного мозга: экстракраниальные сегменты артерий головы проходимы. Интракраниальные сегменты магистральных артерий каротидного бассейна проходимы. Повышено сопротивление кровотоку с обеих сторон. Позвоночные артерии проходимы. Венозные дисциркуляции умеренные. Данные компьютерной томографии головного мозга: атрофические изменения вещества мозга.
Мальчик находился в течение 5 дней на ИВЛ, получал оксигенотерапию, антибактериальную, гормональную, гипотензивную, инфузионную терапию, диуретики, ноотропы, гепатопротекторы, кардиотрофики, с учетом печеночной и почечной недостаточности, местное лечение ран на ногах. На фоне проводимой терапии восстановилось сознание, диурез, отеки исчезли, по данным биохимического анализа крови снизились показатели мочевины и креатинина. Но сохранялись артериальная гипертензия до 130/80 мм рт.ст., макрогематурия. На 21 день от начала заболевания моча посветлела, уровень АД нормализовался.
Через 1,5 месяца в анализах мочи сохранялась значительная микрогематурия, в клиническом анализе крови анемия легкой степени (гемоглобин 109 г/л, эритроциты 3,93*1012/л). Биохимические показатели крови в пределах нормы. При УЗ-исследовании размеры почек в пределах нормы, паренхима нормальной толщины и эхогенности. При эхокардиографическом исследовании: полости сердца на максимальной границе нормы.
На момент катамнеза (через 6 месяцев от начала заболевания): отеков нет, макрогематурия не повторялась. В анализах мочи удельный вес в пределах 1025, следы белка (25 мг/дл), сохраняется значительная микрогематурия. Показатели клинического, биохимического анализов крови в пределах возрастной нормы. Небольшая гиперфильтрация (по Шварцу) 147 мл/мин. При иммунологическом исследовании: IgA — 1,59 г/л, IgM — 0,86 г/л, IgG — 10,4 г/л, повышение ЦИК до 42 у.е., повышение уровня АСЛО до 376 МЕ/мл. При УЗ-исследовании: почки — размеры в норме, топика обычная, структурные. В режиме ЭД сосудистый рисунок почек не изменен, кровоток определяется вплоть до капсулы. Эхокардиографическое исследование: без особенностей.
Из анамнеза жизни: мальчик от I беременности, протекавшей на фоне угрозы прерывания, маловодия, I срочных родов. С первого месяца жизни частые ОРИ, рецидивирующие бронхиты. В течение года стрептодермии. Социальный анамнез неблагополучный: оба родителя периодически злоупотребляют алкоголем.
Заключение. Таким образом, в данном клиническом случае острый постинфекционный гломерулонефрит с нефритическим синдромом протекал с высокой степенью активностью и проявлялся в дебюте осложнениями: острое почечное повреждение, острая дыхательная недостаточность III, острая сердечная недостаточность, острая печеночная недостаточность, отек головного мозга, кома II-III степени. Учитывая вышеизложенное, ребенок нуждается в дальнейшем динамическом наблюдении врача-
нефролога с регулярным контролем анализов крови, мочи, оценкой почечных функций. Список использованной литературы:
1. Детская нефрология: Практическое руководство /под ред. Э. Лойманна, А.Н. Цыгина, А.А. Саркисяна. — М.: Литтерра, 2010.- 400 с. — С. 98-105.
2. Детская нефрология: руководство для врачей / Под ред. М.С. Игнатовой. — 3-е изд., перераб. и доп. -М.: ООО «Медицинское информационное агенство», 2011. — 696 с.
3. Г.А. Маковецкая, О.В. Борисова, Л.И. Мазур, Е.С. Гасилина. Прогнозирование развития заболеваний почек, ассоциированных в дебюте с инфекцией // Педиатрия. — 2012. — № 6. — С. 12-17.
4. Eison T.M. Poststreptococcal acute glomerulonephritis in children: clinical features and pathogenesis /T.M.Eison, B.H. Ault, D P. Jones, R.W. Cheshey // Pediatr. Nephrol. — 2011. — v. 26.- P.165-180.
© Имаева Л.Р., Ахметшин Р.З., Шагарова С.В., Ширяева Г.П., 2020
УДК 616-08-035
Лепехина О.А.
канд. мед. наук, доцент ВГМУ г.Воронеж, РФ Лепехина Л.И. канд. мед. наук, ассистент ВГМУ г.Воронеж, РФ Азарова О.А. канд. мед. наук, доцент ВГМУ г.Воронеж, РФ Чуанба С.В. ординатор ВГМУ г.Воронеж, РФ
ПСИХО-ЭМОЦИОНАЛЬНОЕ СОСТОЯНИЕ ПАЦИЕНТОВ С ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ НА ПРИЕМЕ ВРАЧА СТОМАТОЛОГА-ТЕРАПЕВТА
Аннотация
Риск возникновения осложнений на приёме врача стоматолога зачастую связан с наличием у пациента соматической патологии. В статье рассмотрены изменения психо-эмоционального состояния, вследствие этого ухудшение общего состояния больного с артериальной гипертензией во время лечения у стоматолога. Рассмотрены возможные способы предотвращения неотложных состояний у этой группы больных.
Ключевые слова
Стоматологический стресс, артериальная гипертензия, тактика стоматолога, профилактика неотложных состояний
Гипертоническая болезнь возникает чаще всего в высокоразвитых странах и у людей с повышенной психо-эмоциональной нагрузкой, что является прямым доказательством ведущей роли ЦНС в развитии гипертонической болезни. Длительное психо-эмоциональное напряжение и отрицательные эмоции -ведущий предрасполагающий фактор гипертонической болезни.
В нашей стране артериальная гипертензия (АГ) встречается у 40% населения и занимает 1 -е место по смертности от сердечно-сосудистых заболеваний [1]. Повышение риска осложнений на
~ 142 ~
Острый пострептококковый гломерулонефрит — НЦЗД
ТОНЗИЛЛИТ (АНГИНА) И ЧЕМ ОН ОПАСЕН ДЛЯ ПОЧЕК?!
Острый тонзиллит (в повседневной жизни ангина) — инфекционное заболевание с местными проявлениями в виде острого воспаления нёбных миндалин, вызываемое чаще всего стрептококками или стафилококками, реже другими микроорганизмами. Ангиной также называют обострение хронического тонзиллита.
ЧТО ТАКОЕ СТРЕПТОКОКК?
Бета-гемолитический стрептококк из группы А (лат. Streptococcus pyogenes) это весьма распространенный микроб (бактерия), который может быть выявлен в организме многих здоровых людей, однако при неблагоприятных условиях он может провоцировать боли в горле, ангину (острый тонзиллит), скарлатину, инфекции кожи, образование нарывов, заражение крови и осложнения в виде острого ревматизма и ОСТРОГО ГЛОМЕРУЛОНЕФРИТА.
КАК ПРОИСХОДИТ ЗАРАЖЕНИЕ СТРЕПТОКОККАМИ?
В ходе эпидемиологических исследований было установлено, что бета-гемолитический стрептококком заражено до 20% здоровых детей, которые являются носителями этого микроба.
Чаще всего бета-гемолитический стрептококк передается через частички слизи, которые выделяются из горла и носа заболевшего человека (или носителя) во время кашля или чихания.
СТРЕПТОКОКК ПРИЧИНА МНОГИХ ЗАБОЛЕВАНИЙ:
В наши дни стрептококки вызывают интерес преимущественно из-за редких случаев быстро прогрессирующей болезни, а также риска серьезных осложнений при не вылеченных инфекциях.
Острая инфекция стрептококка может проявиться в виде фарингита (острый фарингит), скарлатины (сыпь), импетиго (инфекция поверхностных слоев кожи) или целлюлит (инфекция глубоких слоев кожи). Агрессивная, токсигенная инфекция может привести к некротизирующему фасцииту, миозиту и синдрому стрептококкового токсина шока. У пациентов после острой стрептококковой инфекции могут также развиться иммунно-обусловленные постстрептококковые осложнения, такие как острый ревматизм и острый гломерулонефрит.
ПОЗДНИЕ ОСЛОЖНЕНИЯ СТРЕПТОКОКОККОВОЙ ИНФЕКЦИИ (ИММУННО-ОБУСЛОВЛЕННЫЕ)
В частности, почти у 1% детей в возрасте от 3 до 15 лет, недавно заразившихся бета-гемолитическим стрептококком, иммунная система начинает вырабатывать антитела (иммунные клетки защиты), которые атакуют не только саму инфекцию, но и нормальные ткани тела, включая ткани суставов, ПОЧЕК и сердца. Потому что некоторые белки стрептококка по структуре очень похожи на белки клеток сердца, почек и суставов, т.е. иммунная система не может распознать чужеродный белок от своего собственного и таким образом организм сам начинает себя атаковать. По этой причине спустя 1-2 недели после начала ангины (или скарлатины), вызванной бета-гемолитическим стрептококком у таких детей может развиться так называемая «острая ревматическая лихорадка» при которой происходит воспаление суставов и сердца и/или «ОСТРЫЙ ПОСТРЕПТОКОККОВЫЙ ГЛОМЕРУЛОНЕФРИТ».
РАССМОТРИМ КАК МОЖНО ЗАПОДОЗРИТЬ ОСТРЫЙ ГЛОМЕРУЛОНЕФРИТ:
Если заметите, что через несколько недель после перенесенной ангины (скарлатины, фарингита) у него появились следующие симптомы:
- Появились отеки лица, пастозность век или в другой области тела или ребенок стал редко мочится.
- Моча приобрела темно-красную (бордовую) окраску (цвет мочи мясных помоев)
Другими симптомами могут быть повышение температуры, слабость, озноб, сильная головная боль.
ЕСЛИ ВЫ ЗАМЕТИТЕ ТАКИЕ СИМПТОМЫ, НЕМЕДЛЕННО ОБРАТИТЕСЬ К ВРАЧУ!
В любом случае всем детям и взрослым, заболевшие ангиной, фарингитом или скарлатиной у которых анализы выявили бета-гемолитического стрептококка из группы А должно проводится лечение антибиотиками.
Лечение должно быть начато как можно скорее (это необходимо для предотвращения образования нарывов в горле или распространения инфекции на соседние органы), а также развития поздних осложнения на сердце, почек и суставов.
Если у вас возникли вопросы по данной теме, мы постараемся на них ответить.
Поражение небных миндалин при остром тонзиллите (гипертрофия (увеличение размера) небных миндалины, налеты)
Бета-гемолитический стрептококк из группы А (лат. Streptococcus pyogenes) это весьма распространенный микроб (бактерия), который может быть выявлен в организме многих здоровых людей
Скарлатина — острое инфекционное заболевание, характеризующееся лихорадкой, интоксикацией, ангиной и обильной точечной сыпью. Болеют чаще всего дети 2-10 лет. Возбудителем скарлатины является стрептококк группы А.
Макрогематурия (гематурия видимая на глаз, моча в виде «мясных помоев»)
ФАКТОРЫ РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ ОСТРОГО ПОСТИНФЕКЦИОННОГО ГЛОМЕРУЛОНЕФРИТА В ДЕБЮТЕ У ДЕТЕЙ | Опубликовать статью ВАК, elibrary (НЭБ)
ФАКТОРЫ РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ ОСТРОГО ПОСТИНФЕКЦИОННОГО ГЛОМЕРУЛОНЕФРИТА В ДЕБЮТЕ У ДЕТЕЙ
Научная статья
Имаева Л.Р.1, *, Ахметшин Р.З.2, Ширяева Г.П.3, Шагарова С.В.4, Хазиева Н.Е.5
1 ORCID: 0000-0002-6735-4896;
1, 2, 3, 4 Башкирский государственный медицинский университет Минздрава России, Уфа, Россия;
5 Республиканская детская клиническая больница, Уфа, Россия
* Корреспондирующий автор (liliyaraz[at]mail.ru)
Аннотация
У 100 детей с острым постинфекционным гломерулонефритом (ОПИГН) проведена оценка роли различных факторов в манифестации болезни. В статье описаны особенности клинической картины начального периода острого гломерулонефрита в зависимости от степени активности почечного процесса, развития осложнений заболевания, приведены анамнестические данные, результаты комплексного обследования пациентов, освещены перинатальные и постнатальные, а также социальные факторы риска. Целью данного исследования явилось установление значимости сочетанных факторов риска, влияющих на степень активности клинических проявлений в дебюте острого постинфекционного гломерулонефрита у детей, развитие осложнений заболевания.
Ключевые слова: острый гломерулонефрит, осложнения, дети.
RISK FACTORS FOR THE DEVELOPMENT OF COMPLICATIONS IN THE ONSET
OF ACUTE POSTINFECTIOUS GLOMERULONEPHRITIS IN CHILDREN
Research article
Imaeva L.R.1, *, Akhmetshin R.Z.2, Shiryaeva G.P.3, Shagarova S.V.4, Khazieva N.E.5
1 ORCID: 0000-0002-6735-4896;
1, 2, 3, 4 Bashkir State Medical University of the Ministry of Health of the Russian Federation, Ufa, Russia;
5 National Children’s Clinical Hospital, Ufa, Russia
* Corresponding author (liliyaraz[at]mail.ru)
Abstract
The current study assesses the role of various factors in the manifestation of acute post-infectious glomerulonephritis in 100 children. The article describes the clinical features of the initial period of the disease based on the degree of activity of renal process and the development of complications as well as provides anamnestic data and the results of a complex examination of patients. The authors also highlight perinatal, postnatal and social risk factors. The aim of this study is to establish the significance of combined risk factors affecting the degree of activity of clinical manifestations in the onset of acute post-infectious glomerulonephritis in children and the development of complications of the disease.
Keywords: acute glomerulonephritis, complications, children.
Введение
Острый гломерулонефрит (ОГН), несмотря на общеизвестные четкость клинических проявлений и кажущуюся редкость хронизации болезни, остается проблемой, многие аспекты которой далеки от решения [7]. Острый постинфекционный гломерулонефрит значительно чаще встречается у детей, чем у взрослых [5]. Тяжелое течение острого гломерулонефрита может привести к развитию угрожающих для жизни осложнений.
Материалы и методы исследования
В основу настоящей работы положены результаты комплексного обследования 100 детей с острым постинфекционным гломерулонефритом с нефритическим синдромом в возрасте 2 – 17 лет, из них девочек 56 (37,3%), мальчиков 94 (62,7%). Острый нефритический синдром проявлялся классической триадой симптомов: отеки, артериальная гипертензия, гематурия. Группу сравнения составили 30 здоровых детей и подростков в возрасте 3 – 17 лет, не имевших заболеваний почек, сердца.
Методы исследования включали анкетирование родителей, анализы мочи, клинический и биохимический анализы крови, исследование функционального состояния почек, гемостазиограмму, иммунограмму (иммуноглобулины трех классов, циркулирующие иммунные комплексы – ЦИК, комплемент), титр антистрептолизина О (АСЛО), мазок из зева и с кожи (при стрептодермии), инструментальные методы: ультразвуковое исследование органов брюшной полости и почек, ЭКГ, по показаниям: эхокардиография (ЭХОКГ), электроэнцефалография (ЭЭГ), ультразвуковая допплерография сосудов головного мозга. Для анкетирования детей и их родителей использовали специально разработанную анкету, которая содержала 37 вопросов и отражала перинатальные и постнатальные факторы риска, социальные факторы. Все дополнительные исследования, анкетирование, включение результатов исследования в настоящую работу проведены с согласия родителей и детей.
Результаты исследования были обработаны с применением стандартных пакетов программы STATISTICA version 6,0 (США). Определяли основные вероятностные показатели: среднее квадратическое отклонение, доверительный интервал по критерию Стьюдента, коэффициенты корреляции между основными параметрами, а также коэффициенты множественной корреляции.
Основные результаты
Для оценки характера клинических проявлений острого гломерулонефрита в дебюте дети были подразделены на 3 группы: с минимальной (21%), среднетяжелой (39%) и высокой (40%) степенью активности почечного процесса. Критерием оценки степени тяжести являлись выраженность, длительность сохранения отечного синдрома, артериальной гипертензии, мочевого синдрома (макрогематурия, протеинурия) и наличие осложнений (острое почечное повреждение, острая сердечная недостаточность, ангиоспастическая энцефалопатия).
Основные клинические проявления у больных с минимальной активностью ОГН – небольшие отеки (пастозность лица в течение 2-5 дней) в 95,2% случаев; периодические боли в животе и в поясничной области (в течение 2-3 дней) в 57,1% случаев; у 4 (19%) пациентов наблюдалось небольшое повышение уровня АД в течение 2-3 дней. Отличительной особенностью данной группы являлась непродолжительность проявлений нефритического синдрома.
Больные с умеренной активностью ОГН занимали по тяжести промежуточное место между детьми с минимальной и высокой активностью заболевания. ОГН у детей этой группы (n=39) протекал с выраженным нефритическим синдромом: отеки наблюдались в 100% случаев, у 6 больных (15,4%) на УЗИ выявлялось небольшое количество свободной жидкости в брюшной полости. Артериальная гипертензия у детей с умеренной активностью ОГН выявлялась статистически достоверно чаще, чем при минимальной активности и реже, чем при высокой активности ГН. Повышение АД в 43,6% случаев в отличие от высокой степени активности было умеренным (130/85 – 145/90 мм рт. ст.), а в 28,2% наблюдений достигало 150/110 мм рт. ст. и сохранялось в течение 7-10 дней. Макрогематурия в этой группе наблюдалась у 35 (89,7%) детей, сохранялась в течение 2-5 дней, из них у 9 (23%) макрогематурия продолжалась более одной недели. Почечная недостаточность острого периода отмечалась у 10 (25,6%) детей, проявлялась повышением уровня мочевины в 20,5% случаев, повышение уровня креатинина – в 25,6% и снижением суточного диуреза.
Следующую группу (n=40) составили дети с высокой активностью ОГН. Дебют заболевания у этих больных характеризовался отеками и макрогематурией в 100% случаев, распространенные отеки (на лице, туловище, конечностях) наблюдались также в 100% случаев, при УЗИ выявлялось умеренное количество свободной жидкости в брюшной полости. Макрогематурия была более продолжительной, чем у детей с минимальной и умеренной активностью ОГН и составляла (10,5±1,5 суток), а у 4 (19,6%) продолжалась в течение 16-23 суток. Средние показатели систолического АД составляли 160±20 мм рт. ст., диастолического – 95,5±10 мм рт. ст. У отдельных больных наблюдались подъемы АД до 190/120 мм рт.ст. Длительное сохранение артериальной гипертензии составляло 10-15 дней. У значительной части детей (95%) были жалобы на головные боли, уменьшение количества выделяемой мочи; периодические боли в животе и в поясничной области отмечались в 100% случаев. Повышение уровня мочевины наблюдалось у 25 (62,5%) больных, повышение уровня креатинина – у 21 (52,5%). У 8 (20%) пациентов определялось повышение аланинтрансферазы (АЛТ). У детей с высокой степенью активности на фоне выраженных проявлений нефритического синдрома течение заболевания характеризовалось развитием ренальных и экстраренальных осложнений.
Средний уровень мочевины и креатинина сыворотки крови был статистически достоверно выше их показателей у детей как контрольной группы, так и у больных с минимальной и умеренной активностью ОГН (табл. 1). Средний уровень общего белка, холестерина, общего билирубина, АЛТ в сыворотке крови у больных с ОГН не отличался от показателей контрольной группы.
Таблица 1 – Средние показатели (M±m) биохимического анализа крови у больных ОГН
различной степени активности в дебюте заболевания
| Показатели | ОГН минимальной активности, n=21 | ОГН умеренной активности, n= 39 | ОГН максимальной активности, n=40 | Контроль n=30 |
| Общий белок, г/л | 72,29±0,84 | 68,96±0,87 | 63,47±1,02 | 73,39±1,18 |
| Мочевина, ммоль/л | 5,46±0,21* | 6,01±0,34* | 11,37±0,61 | 3,95±0,20* |
| Креатинин, мкмоль/л | 70,98±1,75* | 76,03±2,85* | 102,79±3,07 | 65,84±2,86* |
| Холестерин, ммоль/л | 4,34±0,83 | 4,06±1,18 | 4,06±1,3 | 4,27±0,16 |
| Общий билирубин, мкмоль/л | 9,08±3,13 | 9,02±2,78 | 8,68±5,47 | 10,48±0,86 |
| АЛТ, Е/л | 13,01±0,65 | 16,46±0,9 | 23,64±2,09 | 12,47±1,19 |
Примечание: * p<0,001 в сравнении с показателями при максимальной активности ОГН.
Снижение клубочковой фильтрации было выявлено у 32 (32%) из 100 больных ОГН. Снижение концентрационной функции почек у 43 (43%). В дебюте у детей с высокой активностью ОГН снижение фильтрационной и концентрационной функций почек наблюдалось достоверно чаще, чем при умеренной и минимальной активности заболевания (рис. 1).
Рис. 1 – Нарушения функционального состояния почек у детей при ОГН различной степени активности
в дебюте заболевания
При ОГН с нефритическим синдромом различной степени активности по сравнению с группой контроля достоверно чаще наблюдались ЛОР-патология, множественный кариес, болезни кожи, железодефицитная анемия. Гидроторакс (6%), гидроперикард (4%) выявлялись в дебюте ОГН у детей с высокой степенью активности болезни на фоне распространенных отеков и снижения диуреза.
Частым осложнением ОГН в дебюте являлось острое повреждение почек, которая наблюдалось в 31% случаев: у 6 детей с умеренной и у 21 – с высокой степенью активности и ни в одном случае с минимальной активностью почечного процесса. Острое повреждение почек среди детей с высокой активностью ОГН встречалась достоверно чаще, чем при умеренной и минимальной активности заболевания и с более высокими показателями мочевины и креатинина. У 1 (2,5%) из 40 детей с высокой степенью активности течение ОГН осложнилось развитием полиорганной недостаточности (острая сердечная недостаточность, острая печеночная недостаточность, отек головного мозга, кома II-III степени).
Острая сердечная недостаточность развивалась в 6% случаев у детей с ОГН на высоте отечного синдрома, артериальной гипертензии и снижения диуреза. У всех 6 детей имелась максимальная степень активности почечного процесса. У 2 из 6 детей сердечная недостаточность проявлялась острой левожелудочковой недостаточностью (одышка, пена изо рта, крепитирующие мелкопузырчатые влажные хрипы по всем полям легких, тахикардия). У 4 детей наблюдалась правожелудочковая недостаточность (увеличение печени на 5-6 см из-под края реберной дуги, цианоз, отеки, нарушение сердечного ритма, увеличение размеров сердца). При УЗИ у детей с сердечной недостаточностью выявлялся гидроперикард, на эхокардиограмме – снижение сократительной способности сердечной мышцы.
Ангиоспастическая энцефалопатия наблюдалась у 2 (2%) детей с ОГН, проявлялась сильными головными болями, тошнотой, рвотой, потерей сознания, судорогами тонического и клонического характера, брадикардией. У 8 (8%) детей с ОГН отмечалось нарушение функционального состояния печени с повышением уровня АЛТ (150±10,5 ЕД).
Развитию ОГН различной степени активности предшествовала чаще всего острая респираторная инфекция (ОРИ) – 43 (43%) случая, несколько реже стрептодермия и ангина, острый лимфаденит и причина осталась невыясненной (рис. 2). У 34 (79,1%) детей, перенесших ОРИ, было обнаружено повышение титра АСЛО, что согласуется с данными M. Ilyas и соавт. [9, P. 1101]: 84%. В 37% случаев стрептококковая этиология заболевания была подтверждена высевом гемолитического стрептококка со слизистой зева или с кожи.
Рис. 2 – Заболевания, предшествовавшие развитию ОГН
Для выяснения сенсибилизации к стрептококку исследовали титр АСЛО в крови. Во всех группах детей с различной степенью активности ОГН выявлялись повышенные значения АСЛО, но наиболее высокий уровень АСЛО был выявлен при высокой степени активности гломерулонефрита, по сравнению с минимальной и умеренной активностью заболевания, данные различия статистически достоверны (табл. 2).
Таблица 2 – Уровень АСЛО (M±m) у детей при ОГН в дебюте заболевания
| Показатели | ОГН | Контроль, n=30 | ||
| минимальной активности, n=21 | умеренной активности, n= 39 | высокой активности, n=40 | ||
| Титр АСЛО | 294,51±25,67 | 596,51±30,33 | 872,53±42,82* | 125,7±30,55 |
Примечание: * p<0,005 в сравнении с показателями при минимальной, умеренной активности ОГН и показателями контрольной группы.
Выявлялась положительная достоверная корреляция между степенью активности острого гломерулонефрита (минимальная, умеренная, высокая активность) и титром АСЛО в дебюте заболевания (коэффициент корреляции по Спирмену=0,515; P<0,001). Наблюдалась положительная достоверная корреляция между наличием осложнений в дебюте острого гломерулонефрита и титром АСЛО в дебюте заболевания (коэффициент корреляции по Спирмену=0,25; P=0,013). Была установлена положительная достоверная корреляционная связь между уровнем артериального давления в дебюте ОГН и титром АСЛО в первые дни заболевания и титром АСЛО через 1 месяц от начала заболевания (коэффициент корреляции по Спирмену=-0,34, P=0,0005 и коэффициент корреляции по Спирмену=-0,40; P=0,034, соответственно). Между выраженностью отечного синдрома в дебюте острого гломерулонефрита и титром АСЛО в начале заболевания была обнаружена положительная достоверная корреляция (коэффициент корреляции по Спирмену=0,39; P=0,0055). Отмечалась положительная достоверная корреляция между уровнем мочевины, креатинина в начале заболевания и титром АСЛО в дебюте ОГН (коэффициент корреляции по Спирмену=0,25, P=0,012 и коэффициент корреляции по Спирмену=0,23, P=0,019; соответственно).
При обследовании 20 детей с ОГН в дебюте заболевания на цитомегаловирусную инфекцию (ЦМВИ), вирус Эпштейн-Барр (ВЭБ), хламидиоз, у 4 (4%) детей обнаружена активная хламидийная инфекция, у 2 (2%) – активная ВЭБ, у 1 (1%) – активная ЦМВИ. Хламидийная инфекция была у 2 больных с высокой активностью ОГН и у 2 с минимальной активностью заболевания; ВЭБ в обоих случаях обнаружена при высокой активности ОГН; ЦМВИ – при минимальной активности заболевания.
Наиболее часто ОГН начинался в возрасте 7-11 лет (44%) из всех 100 больных, что совпадает с данными других авторов [1], [2], [4]. Но есть и другое мнение [8] о том, что пик заболеваемости острым гломерулонефритом в детстве приходится на возраст от 2 до 6 лет. При этом чаще всего развивался ОПИГН умеренной или высокой степени активности (38,6% и 43,2% случаев из 44). В литературе не встречается указаний на риск развития ОГН различной степени активности в зависимости от возраста у детей.
Среди больных ОГН с нефритическим синдромом чаще в 1,8 раз встречаются мальчики, чем девочки, что совпадает с исследованиями различных авторов [4], [10]. Преобладание мальчиков среди больных ОГН можно объяснить тем, что мальчики чаще подвергаются переохлаждению (что способствует заболеванию ангиной и ОРИ) и получают микротравмы кожи (что является необходимым условием для развития пиодермий).
Большинство детей с ОГН проживали в сельской местности. Достоверных различий в развитии ОГН различной степени активности у детей, проживающих в городской и сельской местности, не было выявлено. Что, возможно, связано с повышением социально-экономического уровня страны, урбанизацией села.
У большей части детей с ОГН имели место неблагополучные социальные факторы: курение одного из родителей в 51% случаев, неудовлетворительные жилищно-бытовые условия и низкий уровень образования родителей в 34%, профессиональные вредности родителей в 25%, злоупотребление алкоголем в 9% случаев. При высокой активности ОГН у детей неудовлетворительные жилищно-бытовые условия и низкий уровень образования родителей встречались достоверно чаще, чем при умеренной и минимальной активности заболевания.
Дебют ОГН, независимо от степени активности процесса, достоверно чаще (51 % случаев) приходился на осенний период времени, по сравнению с другими сезонами года. В летнее время наблюдалась редкая заболеваемость у детей с высокой и умеренной активностью ОГН, и не было ни одного случая заболевания с минимальной активностью. Некоторое увеличение частоты заболеваемости отмечалось в августе и резкое увеличение частоты в сентябре, что, видимо, связано со сменой погодно-климатических условий. Ряд авторов также указывает на важную роль погодно-климатической нагрузки в возникновении ОГН у детей [3], [6].
Частота встречаемости часто болеющих детей среди больных ОГН достоверно была выше по сравнению с группой контроля. Среди больных с высокой активностью ГН часто болеющие дети встречались достоверно чаще, по сравнению с группой детей с минимальной активностью ОГН.
У 60 (60%) детей с ОГН имелись в анамнезе указания патологические состояния при рождении: раннее излитие околоплодных вод в 21% случаев, обвитие плода пуповиной и асфиксия новорожденного в 22% случаев. 18% детей родились путем кесарева сечения. Эти данные указывают на возможную гипоксию почек в период родов, что согласуется с исследованиями других авторов [4]. Дети с высокой степенью ОГН достоверно чаще, чем дети с минимальной активностью ОГН родились путем кесарева сечения. У матерей детей с высокой активностью ОГН достоверно чаще по сравнению с матерями больных с минимальной и умеренной активностью ОГН наблюдались угроза прерывания во второй половине беременности, гестозы и нефропатия беременных. Достоверно чаще недоношенными рождались дети с высокой активностью ОГН, по сравнению с пациентами из групп с умеренной и минимальной активностью заболевания. Частота риска развития внутриутробной инфекции и задержки внутриутробного развития наблюдались также достоверно чаще у детей с высокой степенью активности ОГН.
Заключение
В результате проведенного нами корреляционного анализа установлено, что в развитии ОГН чаще выявлялось сочетание 5-6 факторов риска (частые интеркуррентные заболевания в анамнезе, хронические очаги инфекции, стрептодермия, отягощенная наследственность по патологии органов желудочно-кишечного тракта и органов мочевыделительной системы, энцефалопатия в анамнезе). Сочетание 5-6 факторов риска находилось в достоверно положительной корреляции с показателями уровня мочевины, креатинина и с суточным диурезом в дебюте ОГН с нефритическим синдромом (коэффициент корреляции по Спирмену=0,25; P=0,013).
Выводы
- Факторами риска развития острого гломерулонефрита являются анте- и перинатальные факторы, отягощенная по почечной патологии наследственность, частые интеркуррентные заболевания, хронические очаги инфекции, социально неблагополучные факторы в семье. Сочетание факторов риска определяет степень активности почечного процесса в дебюте болезни.
- Развитию осложнений (острое повреждение почек, острая сердечная недостаточность и ангиоспастическая энцефалопатия) при остром гломерулонефрите способствует сочетание ряда факторов риска (частые интеркуррентные заболевания в анамнезе, хронические очаги инфекции, стрептодермия, энцефалопатия в анамнезе, степень выраженности отечного синдрома, артериальной гипертензии, макрогематурии в дебюте болезни).
- Детей с сочетанными факторами риска следует отнести в группу риска по развитию острого гломерулонефрита с проведением профилактических мероприятий.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Горчакова Л.Н. Малиновская. Герпесвирусная инфекция у детей с остропротекающим гломерулонефритом / Л.Н. Горчакова, В.В. Длин, Н.В. Шабалина, В.В. // Педиатрия. 2000г. №1. С. 14-16.
- Детская нефрология: Практическое руководство /под ред. Э. Лойманна, А.Н. Цыгина, А.А. Саркисяна. – М.: Литтерра, 2010.- 400 с. – С. 98-105.
- Ковальчук В.К. Популяционное исследование факторов риска возникновения гломерулонефрита у детей в промышленных центрах Приморского края / В.К. Ковальчук, А.Н. Ни, В.М. Колдаев и соавт. // Здоровье населения и среда обитания. 2007. № 12. С. 20-23.
- Лоскутова С.А. Заболеваемость и клиническая характеристика ОГН у детей в Новосибирской области / С.А. Лоскутова, А. В. Чупрова, Е. А.Мовчан, О. В. Дуничева // Нефрология и диализ, т. 5, 2003г., №1. С.152-156.
- Малкоч А.В. Острый постстрептококковый (постинфекционный) гломерулонефрит. / А.В. Малкоч, А.Ю. Николаев, Н.Н. Филатова. // Лечащий врач. 2017г. №1.
- Ни А. Роль сезонных факторов в развитии болезней мочевой системы у детей / А. Ни, В.Н. Лучанинова. // Российский Вестник перинатологии и педиатрии. 2011. № 1. С. 41-46.
- Острый гломерулонефрит – все ли вопросы решены? От редакции. Клиническая нефрология. №2 – 2009. – 80 с., с.4-8.
- Шилов Е.М. Нефрология / Е.М. Шилов.. 2007. – 688с., с. 204-206.
- Ilyas M. Changing epidemiology of acute post- streptococcal glomerulonephritis in Northeast Florida: a comparative study / M. Ilyas, A. Tolayamat. // Pediatr. Nephrol. (2008) 23: 1101-1106.
- Rodrigues-Itube B. Pathogenesis of poststreptococcal glomerulonephritis a centure after Clemens von Pirquet / B. Rodrigues-Itube, S. Batsford. // Kidney Int. – 2007. – Vol.71. – P.1094-1104.
Список литературы на английском языке / References in English
- Gorchakova L.N. Gerpesvirusnaja infekcija u detejj s ostroprotekajushhim glomerulonefritom [Herpes Virus Infection in Children With Acute Glomerulonephritis] / L.N. Gorchakova, V.V. Dlin, N.V. Shabalina et al. // Pediatrija [Pediatrics]. 2000. №1. pp. 14-16. [in Russian]
- Detskaja nefrologija: Prakticheskoe rukovodstvo [Children’s Nephrology: A Practical Guide] / Edited by Eh. Lojjmanna, A.N. Cygina, A.A. Sarkisjana. – M.: Litterra, – 400 p. – pp. 98-105. [in Russian]
- Koval’chuk V.K. Populjacionnoe issledovanie faktorov riska vozniknovenija glomerulonefrita u detejj v promyshlennykh centrakh Primorskogo kraja [Population-Based Study of Risk Factors for Glomerulonephritis in Children in Industrial Centers of Primorsky Krai] / V.K. Koval’chuk, A.N. Ni, V.M. Koldaev et al. // Zdorov’e naselenija i sreda obitanija [Population Health and Habitat]. 2007. № 12. pp. 20-23. [in Russian]
- Loskutova S. A. Zabolevaemost’ i klinicheskaja kharakteristika OGN u detejj v Novosibirskojj oblasti [Morbidity and Clinical Characteristics of Ogn in Children in the Novosibirsk Region]. / S. A. Loskutova, A. V. Chuprova, E. A.Movchan et al. // zh. Nefrologija i dializ [Nephrology and Dialysis magazine], Vol. 5, 2003, №1. pp. 152-156. [in Russian]
- Malkoch A.V. Ostryjj poststreptokokkovyjj (postinfekcionnyjj) glomerulonefrit [Acute Post-Streptococcal (Post-Infectious) Glomerulonephritis]. / A.V. Malkoch, A.Ju. Nikolaev, N.N. Filatova // Lechashhijj vrach [The Attending Physician]. 2017. №1. [in Russian]
- Ni A. Rol’ sezonnykh faktorov v razvitii boleznejj mochevojj sistemy u detejj [The Role of Seasonal Factors in the Development of Diseases of the Urinary System in Children] / A. Ni, V.N. Luchaninova // Rossijjskijj Vestnik perinatologii i pediatrii [Russian Bulletin of Perinatology and Pediatrics]. 2011. № 1. pp. 41-46. [in Russian]
- Ostryjj glomerulonefrit – vse li voprosy resheny? Ot redakcii. [Acute Glomerulonephritis – Are All the Issues Resolved? From the Editorial Board.] Klinicheskaja nefrologija [Clinical Nephrology]. №2 – 2009. – 80 p., pp. 4-8. [in Russian]
- Shilov E.M. Nefrologija [Nephrology] / E.M. Shilov. 2007. – 688p., pp. 204-206. [in Russian]
- Ilyas M. Changing epidemiology of acute post- streptococcal glomerulonephritis in Northeast Florida: a comparative study / M. Ilyas, A. Tolayamat // Pediatr. Nephrol. (2008) 23: 1101-1106.
- Rodrigues-Itube B. Pathogenesis of poststreptococcal glomerulonephritis a centure after Clemens von Pirquet. / B. Rodrigues-Itube, S. Batsford // Kidney Int. – 2007. – Vol.71. – pp. 1094-1104.
Клиническое значение нарушений плазменного звена гемостаза и методы их коррекции у больных хроническим гломерулонефритом c нефротическим синдромом | Чеботарева
Введение
Тромбозы и тромбоэмболии являются одними из наиболее серьезных осложнений нефротического синдрома (НС). Связь тромбозов почечных вен с НС была установлена еще в 1840 г. [1]. До появления иммуносупрессивной терапии, в условиях персистирования НС, тромбоэмболия являлась одной из частых причин смерти больных. Однако и после начала применения антикоагулянтных препаратов тромбозы и эмболии остаются частыми осложнениями НС и возникают в 20–52 % случаев [1][2][3][4][5][6]. В связи с этим вопросы терапии и профилактики тромботических осложнений, способы оценки риска тромбозов и кровотечений у больных с НС сохраняют актуальность до настоящего времени.
Цель обзора — представить данные литературы о частоте и локализации тромбоэмболических осложнений у больных хроническим гломерулонефритом (ХГН) с НС, а также рассмотреть подходы к оценке риска и профилактике этих осложнений.
Проявления, локализация тромбозов
Наиболее часто при НС развиваются тромбоэмболия легочной артерии (ТЭЛА) (у 38 %), тромбозы глубоких вен нижних конечностей (у 34 %) и тромбозы почечных вен (25–30 %). Реже тромбозы локализуются в системе вен портальной системы, венозных синусах головного мозга, внутренней яремной вене и нижней полой вене [7]. По данным L. J. Zhang и соавт. [8], частота венозных тромбозов при НС недооценена из-за отсутствия у части больных каких-либо клинических проявлений. Среди 512 больных с НС, обследованных с применением контрастной мультиспиральной компьютерной томографии легких и брюшной полости, у 180 (35 %) выявлены венозные тромбозы различной локализации, у 85 % из них диагностированы тромбозы ветвей легочной артерии in situ, у 38 % — тромбозы почечных вен, ассоциированные с тромбозами легочной артерии, и у 44 % — изолированные тромбозы почечных вен, при этом у 84 % они протекали бессимптомно.
Факторы риска развития венозных тромбозов при НС
У больных ХГН с НС риск развития венозных тромбозов напрямую зависит от формы ХГН. Среди морфологических форм ХГН наиболее высокий риск тромботических осложнений наблюдалась у больных мембранозной нефропатией (МН), частота венозных тромбозов при этой форме варьировала от 29 до 48 %, составляя в среднем 38 % [9][10][11][12]. Частота венозных тромбоэмболических осложнений была значительно выше при МН, чем при нефропатии IgA [13, 14]. В 26 % случаев отмечены тромбозы у больных мембранопролиферативным / мезангиокапиллярным ХГН и болезнью минимальных изменений (у 24 %), реже тромбозы выявлялись у больных фокально-сегментарным гломерулосклерозом (ФСГС) и болезнью минимальных изменений — у 10 и 9 % соответственно [15][16]. Причины такого распределения риска тромбоза между формами ХГН до сих пор не установлены.
Факторы риска развития тромбозов при НС изучены в ретроспективном когортном исследовании на основании анализа базы данных о 7037 больных медицинских центров для ветеранов в городах Мемфис и Лонг-Бич (США). Показано, что абсолютный и относительный риск тромбоза при НС зависел от сывороточной концентрации альбумина. Среди обследованных больных установлено 158 случаев венозных тромбозов за 8,1 года наблюдения при концентрации сывороточного альбумина < 2,5 г/дл [17]. Обнаружена корреляция между риском тромботических осложнений и уменьшением концентрации сывороточного альбумина менее 2,5 г/дл. Однако это исследование имело некоторые ограничения, так как основную группу составляли лица мужского пола, только у 26 % обследованных больных были диагностированы первичные гломерулопатии, у 50 % — диабетическая нефропатия и у 22 % — нефротический синдром неуточненного генеза [17].
Дополнительным фактором риска развития тромбозов является длительность НС. Показано, что тромбозы чаще всего развиваются в первые 6 месяцев существования НС [7]. L. J. Zhang и соавт. показали, что возраст старше 60 лет является независимым фактором риска развития венозных тромбозов у больных с НС. Неблагоприятное прогностическое значение имели также выраженность протеинурии, катетеризация центральных вен и наличие злокачественных образований [12][18][19].
Риск тромботических осложнений прослежен в ретроспективном анализе тромбоэмболических осложнений в когорте, состоящей из 898 больных МН. В исследовании оценивали все протекавшие с клиническими проявлениями венозные тромбозы и тромбоэмболии, в том числе ТЭЛА, тромбоз глубоких вен нижних конечностей и тромбоз почечных вен. Было проанализировано влияние различных факторов — лекарств, в том числе гормональных препаратов, наличия злокачественных новообразований, курения, повторных тромбозов, иммобилизации в течение 6 недель или беременности в течение 3 месяцев до развития венозных тромбозов. Изучены лабораторные параметры, которые могли влиять на риск развития тромбозов, — сывороточные концентрации креатинина, холестерина и триглицеридов, альбумина, скорость клубочковой фильтрации [9]. Пороговая концентрация альбумина сыворотки, при которой риск тромбозов увеличивается в 2,5 раза, составила 2,8 г/дл. Кроме того, показано, что уменьшение концентрации альбумина сыворотки на каждый 1,0 г/дл повышало риск тромбозов в 2,13 раза. Из других параметров только мужской пол являлся независимым фактором риска венозных тромбозов [15]. В некоторых исследованиях показано, что концентрация альбумина сыворотки менее 2,0 г/дл являлась суррогатным маркером тромбофилии при НС, и при уменьшении концентрации альбумина ниже этого значения необходимо назначать антикоагулянтную терапию для профилактики тромботических осложнений [20][21][22].
Другой формой, протекающей с тяжелым НС, часто резистентным к проводимой иммуносупрессивной терапии, является ФСГС. В исследовании S.-J. Li и соавт. [23] венозные тромбозы были выявлены у 12 (10 %) из 120 больных ФСГС, при этом у 3 больных — во время первого эпизода НС, у 9 тромбоз развился во время очередного рецидива НС. Самыми частыми локализациями были ТЭЛА, тромбоз почечных вен и глубоких вен нижних конечностей. Зарегистрированы один случай тромбоза венозных синусов головного мозга и один случай тромбоза воротной вены [19][24]. Положительная прогностическая значимость повышения концентрации D-димера в плазме в отношении риска развития тромбозов установлена у 22,4 % больных ФСГС.
Склонность к образованию тромбов в почечных венах при нефротическом синдроме может быть обусловлена гемоконцентрацией, которая усугубляется вследствие диуретической терапии и способствует формированию тромба в почечных венах у больных с НС [6]. На основании многофакторного регрессионного анализа S-J. Li и соавт. [23] заключили, что гемоконцентрация, оцениваемая по гематокриту, наряду с рецидивирующим течением НС и повышением концентрации D-димера, является предиктором венозного тромбоза у больных ФСГС с НС.
Артериальные тромбозы при НС
Риск возникновения артериальных тромбозов повышен у больных с НС. B. K. Mahmoodi и соавт. [7] диагностировали тромбозы артериальных сосудов у 42 (14 %) из 298 больных ХГН и диабетической нефропатией с НС. Инфаркт миокарда развился у 44 % больных с НС, с меньшей частотой (у 11–14 %) отмечались нестабильная стенокардия, тромбозы периферических артерий и острое нарушение мозгового кровообращения. Описаны тромбозы брыжеечной, подмышечной, бедренной, сонной, церебральной и почечных артерий [25]. В отличие от венозного тромбообразования предикторами артериальных тромбозов, помимо НС, являются общепопуляционные факторы — возраст, пол, курение, сахарный диабет, артериальная гипертензия и снижение скорости клубочковой фильтрации. Риск артериальных тромбозов при НС, по-видимому, обусловлен другими патогенетическими механизмами, в первую очередь активацией тромбоцитов. Некоторые авторы предполагают возможность назначения аспирина для предотвращения тромбозов при МН, особенно у больных с высоким риском артериальных тромбозов [26]. Поэтому при отсутствии строгих показаний к назначению антикоагулянтов у больных с НС с риском артериальных тромбозов целесообразно применение малых доз аспирина. Кроме того, наличие антифосфолипидного синдрома и выявление полиморфизмов генов тромбофилий (мутация фактора V Leiden, мутации генов протромбина, α-, β- и γ-цепей фибриногена, гена PAI-1, дефициты AT, протеинов С, S, метилентетрагидрофолат-редуктазы) являются дополнительными факторами риска тромботических осложнений и ухудшения функции почек у больных ХГН [27][28][29].
Механизмы гиперкоагуляции при НС
Среди механизмов гиперкоагуляции и развития тромбозов при НС обсуждаются выведение с мочой низкомолекулярных антикоагулянтных факторов, в первую очередь антитромбина III и плазминогена, активация плазменного звена гемостаза и подавление фибринолиза [6][30]. Массивная неселективная протеинурия может привести также к потере фибринолитических белков, протеина S и плазмина, что усугубляет прокоагулянтное состояние. К дополнительным механизмам тромбообразования относят повышение концентраций в плазме прокоагулянтных молекул — фибриногена и высокомолекулярных факторов V и VIII [9]. Концентрация фибриногена плазмы, который усиливает активность тромбоцитов и агрегацию эритроцитов, увеличивается у больных с НС. Кроме того, в этой группе больных выявляется более высокая активность фактора VII и концентрация α-2-макроглобулина, которые способствуют тромбообразованию [31].
У больных с НС в рамках МН отмечено 6-кратное увеличение ингибитора активатора плазминогена, что сопровождалось подавлением фибринолитической активности плазмы [32].
Может увеличиваться содержание в крови других факторов коагуляционного каскада и одновременно компенсаторно повышаться синтез белков в печени. Например, концентрация D-димера в сыворотке крови умеренно повышается при НС даже при отсутствии клинических проявлений тромбоза [33][34]. Кроме того, показано, что при НС с мочой может теряться активная свободная форма протеина S по сравнению с неактивной формой. Поэтому даже при нормальной концентрации протеина S в крови может развиваться гиперкоагуляция за счет уменьшения содержания в крови активной формы.
У больных с НС отмечается активация тромбоцитарного звена гемостаза, в частности адгезии тромбоцитов способствует повышение синтеза тромбоксана А2. Дополнительные механизмы активации тромбоцитов включают гиперхолестеринемию и повышение активности фактора Виллебранда [31][35].
Таким образом, уменьшение сывороточной концентрации альбумина и увеличение содержания высокомолекулярных белков приводят к дисбалансу прокоагулянтного и антикоагулянтного звеньев свертывания крови, способствуя высокому риску тромбообразования у больных с НС [6][36].
Лабораторные маркеры гиперкоагуляции при НС
У больных с НС показатели протромбинового времени, активированного частичного тромбопластинового времени, плазменная активность протеина С и количество тромбоцитов, как правило, остаются в пределах нормы [37]. В то же время отмечается уменьшение плазменной активности протеина S, антитромбина III, и сывороточной концентрации альбумина вследствие потери их с мочой. Концентрация фибриногена плазмы у больных с НС значительно повышена. Однако ни один из вышеперечисленных факторов не являлся предиктором тромботических осложнений [38]. T.-Y. Chen и соавт. [39] регистрировали при НС увеличение концентраций фибринопептида A, фрагментов протромбина F1+2 и тромбин-антитромбинового комплекса, но изменения этих показателей не ассоциировались с возникновением тромбозов. Концентрация D-димера плазмы повышается при НС при отсутствии тромбозов и коррелирует с величиной протеинурии и концентрацией сывороточного альбумина. В исследовании D. J. Sexton и соавт. [33] повышенная концентрация D-димера в плазме не являлась предиктором тромбозов у больных с НС в течение 2 лет наблюдения, в то время как в другом исследовании [23] у больных ФСГС с тяжелым НС повышенная концентрация D-димера была ассоциирована с риском возникновения тромботических осложнений.
Лечение
Согласно рекомендациям KDIGO (Kidney Disease Improving Global Outcomes) [40], всем больным МН и уменьшением сывороточной концентрации альбумина менее 2,5 г/дл следует назначить профилактическую антикоагулянтную терапию варфарином, целью которой является достижение международного нормализованного отношения (МНО) от 2,0 до 3,0. Перед приемом варфарина рекомендован короткий курс гепаринотерапии нефракционированным гепарином или низкомолекулярными гепаринами (НМГ).
В случае возникновения венозных тромбозов при НС лечение проводят согласно рекомендациям по ведению венозных тромбозов соответствующей локализации, при этом предлагается использовать полную дозу антикоагулянтов. Дозы корригируют в зависимости от скорости клубочковой фильтрации [40]. В настоящее время отсутствуют крупные многоцентровые исследования, посвященные сравнению антикоагулянтов и антиагрегантов для профилактики тромботических осложнений НС. В проспективном пилотном исследовании больных с НС терапия НМГ (эноксапарином) в дозе 40 мг/сут была безопасна и эффективна для предотвращения тромбозов у 55 больных с НС [41]. В ретроспективном анализе больные с концентрацией альбумина менее 2,0 г/дл получали профилактическую терапию эноксапарином 20 мг/сут, при длительности гипоальбуминемии более 3 месяцев их переводили на терапию малыми дозами варфарина с целью поддержания МНО в интервале от 1,5 до 2,5, а больные с концентрацией альбумина сыворотки 2,0–3,0 г/дл получали аспирин в дозе 75 мг/сут. Не было отмечено тромботических осложнений в первые недели терапии, в связи с чем авторы сделали заключение об эффективности антикоагулянтной и антиагрегантной терапии для профилактики тромботических осложнений у больных НС [42].
Проблема антикоагулянтной терапии при НС решена не до конца [15]. Обсуждается возможность развития резистентности к терапии гепаринами вследствие потери с мочой антитромбина III у больных с НС. В этом случае прямые пероральные антикоагулянты могут иметь преимущества у этой категории больных. Однако вопрос о возможности назначения прямых пероральных антикоагулянтов — ингибиторов тромбина и фактора Ха — остается открытым [34]. Эффективность применения этих препаратов для лечения тромбоза при НС, в основном у больных МН, была продемонстрирована лишь в единичных клинических наблюдениях [43–45]. Предполагается, что применение прямых пероральных антикоагулянтов, ингибиторов фактора Ха или ингибиторов тромбина, может оказаться более эффективным, чем назначение НМГ у больных с НС с низкой плазменной активностью антитромбина III. Однако эффективность и безопасность применения этих препаратов у больных с НС остается непредсказуемой. Содержание фактора Xа в крови больных с НС может варьировать от нормального до повышенного или даже уменьшаться у больных с НС [19]. Плазменная активность антитромбина III у больных с НС также не всегда снижена. Кроме того, потеря с мочой некоторых регуляторных компонентов гемостаза может сопровождаться риском кровотечений [34].
Опубликовано лишь одно рандомизированное пилотное исследование [46], в котором сравнили эффективность ривароксабана в дозе 30 мг/сут и дальтепарина по 5000 МЕ 2 раза в день подкожно для лечения венозных тромбозов у больных с НС и уменьшением плазменной активности антитромбина III менее 70 %. При наблюдении в течение 4 недель объем и степень реканализации тромбов были сопоставимыми в обеих группах. Увеличение плазменной активности антитромбина III в обеих группах в динамике, по-видимому, было связано с достижением ремиссии ХГН и уменьшением выраженности протеинурии в результате патогенетической терапии. Среди побочных эффектов отмечен только один случай кровоизлияния в подслизистый слой кишечной стенки в группе ривароксабана, серьезных кровотечений не было ни в одной из групп. Однако малое число обследованных больных (8 больных с НС и 8 человек в группе контроля) не позволяет сделать выводы и рекомендовать прямые пероральные антикоагулянтные препараты для широкого применения у больных с НС.
Более того, применение антикоагулянтов может сопровождаться риском острого почечного повреждения или прогрессии хронической болезни почек (ХБП), что обусловлено возникновением кровоизлияний в клубочки почек и обструкции канальцев эритроцитарными цилиндрами [47]. В исследовании S. Brodsky и соавт. [48] при увеличении МНО более 3,0 частота нефропатии, ассоциированной с варфарином, составила 33,0 % у больных с ХБП и 16,5 % — у больных без ХБП.
Назначение антикоагулянтных препаратов для профилактики тромбозов у больных с НС должно рассматриваться с учетом риска кровотечений (шкалы ATRIA или HAS-BLED) [49][50]. Подходы к профилактическому назначению антикоагулянтов представлены на рис. 1. Они определяются морфологическим вариантом нефрита и концентрацией альбумина сыворотки крови. К дополнительным факторам риска развития тромбозов относятся длительный постельный режим, ожирение, семейный анамнез тромбозов (генетическая тромбофилия, антифосфолипидный синдром), оперативные вмешательства в недавнем прошлом (гинекологические, на брюшной полости, ортопедические), дегидратация, лечение высокими дозами глюкокортикостероидов, беременность.
Рисунок 1. Алгоритм назначения профилактической антикоагулянтной терапии у больных НС.
Figure 1. Prescription algorithm for preventive anticoagulant therapy in NS patients.
Примечание. НМГ — низкомолекулярный гепарин.
Note. LMWH — low-molecular-weight heparin.
Продолжительность антикоагулянтной терапии, в том числе для профилактики тромботических осложнений НС, в крупных многоцентровых рандомизированных исследованиях точно не определена. Однако, по мнению экспертов, лечение тромбозов, а также профилактику тромботических осложнений у больных НС следует проводить до купирования НС или до достижения концентрации альбумина сыворотки 3,0 г/дл и более [31]. Назначение антикоагулянтных препаратов с прямым действием (апиксабан, ривароксабан) при НС можно обсуждать, если больной отказывается от длительных инъекций НМГ, не удается достигнуть целевого МНО при назначении варфарина, либо прямой антикоагулянтный препарат был назначен больному ранее.
Таким образом, НС сопровождается высоким риском тромботических осложнений, главным образом венозных. Основными факторами риска венозных тромбозов являются морфологический вариант нефропатии и концентрация альбумина сыворотки крови, в то время как риск артериальных тромбозов определяется также и общепопуляционными факторами — возрастом, полом, курением, наличием сахарного диабета, артериальной гипертензии и распространенного атеросклероза. Антикоагулянтная терапия у больных с НС проводится на основании оценки риска тромботических осложнений и кровотечений.
1. Zumberg M., Kitchens C.S. Consultative hemostasis and thrombosis. Philadelphia, Saunders Elsevier, 2007.
2. Bellomo R., Atkins R.C. Membranous nephropathy and thromboembolism: Is prophylactic anticoagulation warranted? Nephron. 1993; 63: 249–54. DOI: 10.1159/000187205.
3. Orth S.R., Ritz E. The nephrotic syndrome. N Engl J Med. 1998; 338: 1202–11. DOI: 10.1056/NEJM199804233381707.
4. Schlegel N. Thromboembolic risks and complications in nephrotic children. Semin Thromb Hemost. 1997; 23: 271–80. DOI: 10.1055/s-2007-996100.
5. Llach F., Koffler A., Finck E., Massry S.G. On the incidence of renal vein thrombosis in the nephrotic syndrome. Arch Intern Med. 1977; 137: 333–6.
6. Singhal R., Brimble K.S. Thromboembolic complications in the nephrotic syndrome: Pathophysiology and clinical management. Thromb Res. 2006; 118: 397–407. DOI: 10.1016/j.thromres.2005.03.030.
7. Mahmoodi B.K., Kate M.K., Waanders F. et al. High absolute risks and predictors of venous and arterial thromboembolic events in patients with nephrotic syndrome: Results from a large retrospective cohort study. Circulation. 2008; 117(2): 224–30. DOI: 10.1161/CIRCULATIONAHA.107.716951.
8. Zhang L.J., Zang Z., Li S.J. et al. Pulmonary embolism and renal vein thrombosis in patients with nephrotic syndrome: Prospective evaluation of prevalence and risk factors with CT. Radiology. 2014; 273(3): 897–906. DOI: 10.1148/radiol.14140121.
9. Lionaki S., Derebail V.K., Susan L., Hogan S.L. et al. Venous thromboembolism in patients with membranous nephropathy. Clin J Am Soc Nephrol. 2012; 7: 43–51. DOI: 10.2215/CJN.04250511.
10. Forero F.V., Prugue N.G., Morales N.R. Idiopathic nephrotic syndrome of the adult with asymptomatic thrombosis of the renal vein. Am J Nephrol. 1988; 8(6): 457–62. DOI: 10.1159/000167654.
11. Изотова А.В., Арьев А.Л., Ракитянсткая И.А. Тромбоз почечных вен как осложнение нефротического синдрома (клинико-морфологический анализ 24 пациентов с мембранозной нефропатией). Нефрология. 2000; 4(2): 110.
12. Wagoner R.D., Stanson A.W., Holley K.E., Winter C.S. Renal vein thrombosis in idiopathic membranous nephropathy and nephrotic syndrome: Incidence and significance. Kidney Int. 1983; 23: 368–74. DOI: 10.1038/ki.1983.28.
13. Rankin A.J., McQuarrie E.P., Fox J.G. et al. Venous thromboembolism in primary nephrotic syndrome–is the risk high enough to justify prophylactic anticoagulation? Nephron. 2017; 135: 39–45. DOI: 10.1159/000448628.
14. Barbour S.J., Greenwald A., Djurdjev O. et al. Disease-specific risk of venous thromboembolic events is increased in idiopathic glomerulonephritis. Kidney Int. 2012; 81: 190–5. DOI: 10.1038/ki.2011.312.
15. Glassock R.G. Prophylactic anticoagulation in nephrotic syndrome: A clinical conundrum. J Am Soc Nephrol. 2007; 18: 2221–5. DOI: 10.1681/ASN.2006111300.
16. Maas R.J., Deegens J.K., Beukhof J.R. et al. The clinical course of minimal change nephrotic syndrome with onset in adulthood or late adolescence: A case series. Am J Kidney Dis. 2017; 69(5): 637. DOI: 10.1053/j.ajkd.2016.10.032.
17. Gyamlani G., Miklos Z., Molnar M.Z. et al. Association of serum albumin level and venous thromboembolic events in a large cohort of patients with nephrotic syndrome. Nephrol Dial Transplant. 2017; 32(1): 157–64. DOI: 10.1093/ndt/gfw227.
18. Kerlin B.A., Haworth K., Smoyer W.E. Venous thromboembolism in pediatric nephrotic syndrome. Pediatr Nephrol. 2014; 29: 989–97. DOI: 10.1007/s00467-013-2525-5.
19. Kerlin B.A., Ayoob R., Smoyer W.E. Epidemiology and pathophysiology of nephrotic syndrome-associated thromboembolic disease. Clin J Am Soc Nephrol. 2012; 7: 513–20. DOI: 10.2215/CJN.10131011.
20. Cherng S.C., Huang W.S., Wang Y.F. et al. The role of lung scintigraphy in the diagnosis of nephrotic syndrome with pulmonary embolism. Clin Nucl Med. 2000; 25(3): 167. DOI: 10.1097/00003072-200003000-00001.
21. Kuhlmann U., Steurer J., Bollinger A. et al. Incidence and clinical significance of thromboses and thrombo-embolic complications in nephrotic syndrome patients. Schweiz Med Wochenschr. 1981; 111: 1034.
22. Waldman M., Crew R.J., Valeri A. et al. Adult minimal-change disease: clinical characteristics, treatment, and outcomes. Clin J Am Soc Nephrol. 2007; 2: 445. DOI: 10.2215/CJN.03531006.
23. Li S-J., Tu Y.-M., Zhou C.-S. et al. Risk factors of venous thromboembolism in focal segmental glomerulosclerosis with nephrotic syndrome. Clin Exp Nephrol. 2016; 20(2): 212–7. DOI: 10.1007/s10157-015-1149-4.
24. Loscalzo J. Venous thrombosis in the nephrotic syndrome. N Engl J Med. 2013; 368: 956–8. DOI: 10.1056/NEJMcibr1209459.
25. Fahal I.H., McClelland P., Hay C.R. et al. Arterial thrombosis in the nephrotic syndrome. Postgrad Med J. 1994; 70(830): 905–9. DOI: 10.1136/pgmj.70.830.905.
26. Hofstra J.M., Wetzels J.F.M. Should aspirin be used for primary prevention of thrombotic events in patients with membranous nephropathy? Kidney Int. 2016; 89(5): 981–3. DOI: 10.1016/j.kint.2016.01.019.
27. Козловская Н.Л., Шилов Е.М., Метелева Н.А. и др. Клиникоморфологические особенности нефропатии при первичном и вторичном антифосфолипидном синдроме. Терапевтический архив. 2007; 79(6): 16–25.
28. Козловская Н.Л., Боброва Л.А. Генетическая тромбофилия и почки. Клиническая нефрология. 2009; 3: 23–35.
29. Боброва Л.А., Козловская Н.Л., Шкарупо В.В. и др. Влияние генетической формы тромбофилии на клинико-морфологические проявления и характер течения хронического гломерулонефрита. Нефрология и диализ. 2010; 12(1): 25–33.
30. Roy C.D.Y., Sabbagh R., Roy D. et al. Ischemic stroke of possible embolic etiology associated with nephritic syndrome. Kidney Int Rep. 2017; 2: 988–94.
31. Mirrakhimov A.E., Ali A.M., Barbaryan A. et al. Primary nephrotic syndrome in adults as a risk factor for pulmonary embolism: An up-to-date review of the literature. Int J Nephrol. 2014; 916760. DOI: 10.1155/2014/916760.
32. Hamano K., Iwano M., Akai Y. et al. Expression of glomerular plasminogen activator inhibitor type 1 in glomerulonephritis. Am J Kidney Dis. 2002; 39: 695–705. DOI: 10.1053/ajkd.2002.31986.
33. Sexton D.J., Clarkson M.R., Mazur M.J. et al. Serum D-dimer concentrations in nephrotic syndrome track with albuminuria, not estimated glomerular filtration rate. Am J Nephrol. 2012; 36: 554–60. DOI: 10.1159/000345475.
34. Sexton D.J., de Freitas D.G., Little M.A. et al. Direct-acting oral anticoagulants as prophylaxis against thromboembolism in the nephrotic syndrome. Kidney Int Rep. 2018; 3:784–93. DOI: 10.1016/j.ekir.2018.02.010.
35. Sirolli V., Ballone E., Garofalo D. et al. Platelet activation markers in patients with nephrotic syndrome. A comparative study of different platelet function tests. Nephron. 2002; 91: 424–30. DOI: 10.1159/000064282.
36. Barbano B., Gigante A., Amoroso A. et al. Thrombosis in nephrotic syndrome. Semin Thromb Hemost. 2013; 39: 469–76.
37. Yalсinkaya F., Tomer N., Gorgani A.N. et al. Haemostatic parameters in childhood nephrotic syndrome. Int Urol Nephrol. 1995; 27(5): 643–7.
38. Mortazavi F., Majidi J. Evaluation of hemostatic factors in children with nephrotic syndrome. Pak J Med Sci. 2008; 24(3): 356–9.
39. Chen T.-J., Huang C.-C., Tsao C.-J. Hemostatic molecular markers in nephrotic syndrome. Am J Hematol. 1993; 44: 276–9.
40. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney International. 2012; 2(Suppl 2).
41. Rostoker G., Durand-Zaleski I., Petit-Phar M. et al. Prevention of thrombotic complications of the nephrotic syndrome by the low-molecular-weight heparin enoxaparin. Nephron. 1995; 69: 20. DOI: 10.1159/000188355.
42. Medjeral-Thomas N., Ziaj S., Condon M. et al. Retrospective analysis of a novel regimen for the prevention of venous thromboembolism in nephrotic syndrome. Clin J Am Soc Nephrol. 2014; 9: 478–83. DOI: 10.2215/CJN.07190713.
43. Sasaki Y., Raita Y., Uehara G. et al. Carotid thromboembolism associated with nephrotic syndrome treated with dabigatran. Case Rep Nephrol Urol. 2014; 4: 42–52. DOI: 10.1159/000362162.
44. Shimada Y., Nagaba Y., Nagaba H. et al. Edoxaban was effective for treating renal vein thrombosis in a patient with nephrotic syndrome. Intern Med. 2017; 56: 2307–10. DOI: 10.2169/internalmedicine.8742-16.
45. Dupree L.H., Reddy P. Use of rivaroxaban in a patient with history of nephrotic syndrome and hypercoagulability. Ann Pharmacother. 2014; 48: 1655–8. DOI: 10.1177/1060028014549349.
46. Zhang L., Zhang H., Zhang J. et al. Rivaroxaban for the treatment of venous thromboembolism in patients with nephrotic syndrome and low AT-III: a pilot study. Exp Ther Med. 2018; 15: 739–44. DOI: 10.3892/etm.2017.5471.
47. Brodsky S.V., Satoskar A., Chen J. et al. Acute kidney injury during warfarin therapy associated with obstructive tubular red blood cell casts: a report of 9 cases. Am J Kidney Dis. 2009; 54: 1121–6. DOI: 10.1053/j.ajkd.2009.04.024.
48. Brodsky S.V., Nadasdy T., Rovin B.H. et al. Warfarin-related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney Int. 2011; 80(2): 181–9. DOI: 10.1038/ki.2011.44.
49. National Institute for Health and Care Excellence. Atrial fibrillation: the management of atrial fibrillation. (Clinical guideline 180). 2014. http://guidance.nice.org.uk/CG180.
50. Fang M.C., Go A.S., Chang Y. et al. A new risk scheme to predict warfarin-associated hemorrhage: the ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation) Study. J Am Coll Cardiol. 2011; 58: 395–401.
Гломерулонефрит у детей | Детская больница Филадельфии
Гломерулонефрит — это заболевание почек, поражающее клубочки. Клубочки — это очень маленькие, важные структуры в почках, которые снабжают кровоток небольшими единицами в почках, которые фильтруют мочу, называемыми нефронами. Во время гломерулонефрита клубочки воспаляются и ухудшают способность почек фильтровать мочу.
Гломерулонефрит вызывается несколькими различными болезненными состояниями, включая следующие:
Системное иммунное заболевание, такое как системная красная волчанка (СКВ или волчанка)
К другим системным заболеваниям могут относиться:
Группа узелкового полиартериита. Воспалительное заболевание артерий.
васкулит Вегенера. Прогрессирующее заболевание, которое приводит к широко распространенному воспалению всех органов тела.
пурпура Геноха-Шенлейна. Заболевание, обычно наблюдаемое у детей, которое связано с пурпурой (маленькие или большие пурпурные поражения на коже и внутри органов) и затрагивает несколько систем органов.
Форма наследственного гломерулонефрита, называемая синдромом Альпорта, поражающая как мужчин, так и женщин; у мужчин чаще возникают проблемы с почками.Лечение направлено на предотвращение и лечение высокого кровяного давления и предотвращение повреждения почек.
У детей частая причина гломерулонефрита — стрептококковая инфекция, такая как ангина или инфекция верхних дыхательных путей. Гломерулонефрит обычно возникает более чем через неделю после заражения. Это часто называют острым постстрептококковым гломерулонефритом или APSGN.
Ниже приведены наиболее частые симптомы гломерулонефрита.Однако каждый ребенок может испытывать симптомы по-разному. Симптомы могут включать:
Моча темно-коричневого цвета (кровь и белок)
Боль в горле
Уменьшение диуреза
Усталость
Летаргия
Повышенное дыхательное усилие
Головная боль
Высокое кровяное давление
Судороги (могут возникнуть в результате высокого кровяного давления)
Сыпь, особенно над ягодицами и ногами
Похудание
Боль в суставах
Бледный цвет кожи
Накопление жидкости в тканях (отек)
Симптомы гломерулонефрита могут напоминать другие состояния и проблемы со здоровьем.Всегда консультируйтесь с врачом вашего ребенка для постановки диагноза.
В дополнение к тщательному медицинскому осмотру и полной истории болезни врач вашего ребенка может порекомендовать следующие диагностические тесты:
Посев из горла
Анализы мочи
Анализы крови
Электрокардиограмма (ЭКГ или ЭКГ). Тест, который регистрирует электрическую активность сердца, выявляет аномальные ритмы (аритмии или аритмии) и обнаруживает повреждение сердечной мышцы.
УЗИ почек (также называемое сонографией). Неинвазивный тест, при котором датчик пропускают через почку, производя звуковые волны, которые отражаются от почки, передавая изображение органа на видеоэкран. Тест используется для определения размера и формы почки, а также для обнаружения новообразований, камней в почках, кисты или других препятствий или аномалий.
Рентген грудной клетки. Диагностический тест, который использует невидимые лучи электромагнитной энергии для создания изображений внутренних тканей, костей и органов на пленке.
Биопсия почек. Процедура, во время которой через иглу из почки берется небольшой образец ткани. Ткань отправляется на специальное исследование, чтобы определить конкретное заболевание.
Специфическое лечение гломерулонефрита определит врач вашего ребенка на основании:
Возраст вашего ребенка, общее состояние здоровья и история болезни
Степень заболевания
Толерантность вашего ребенка к определенным лекарствам, процедурам или методам лечения
Ожидания по течению болезни
Ваше мнение или предпочтение
Если гломерулонефрит вызван стрептококковой инфекцией, лечение будет направлено на излечение инфекции и лечение симптомов, связанных с инфекцией.Лечение будет зависеть от основной причины. Таким образом, лечение направлено на замедление прогрессирования заболевания и предотвращение осложнений.
Лечение гломерулонефрита может включать:
Ограничение жидкости
Диета с пониженным содержанием белка
Сниженная солевая и калиевая диета
Лекарства, например:
Диализ. Лечение для удаления шлаков и дополнительной жидкости из крови после того, как почки перестали функционировать.Диализ может потребоваться для краткосрочной или долгосрочной терапии.
Если гломерулонефрит не исчезнет, возможно, потребуется лечение длительной почечной недостаточности.
Постстрептококковый гломерулонефрит (ПСГН) | CDC
ПСГН — редкое осложнение перенесенной стрептококковой инфекции группы А.
PSGN — это заболевание почек, которое может развиться после инфекций, вызванных бактериями, называемыми стрептококками группы A (стрептококки группы A). Эти инфекции включают инфекции горла и кожи, такие как ангина, скарлатина и импетиго.ПСГН не является стрептококковой инфекцией почек группы А. Вместо этого ПСГН возникает в результате того, что иммунная система организма борется с инфекцией горла или кожной инфекцией группы А.
Обычно для развития ПСГН требуется около 10 дней после появления симптомов ангины или скарлатины. Для развития ПСГН требуется около 3 недель после появления симптомов стрептококковой инфекции кожи группы А.
Вы не можете поймать PSGN от кого-то еще
Люди не могут заразиться PSGN от кого-то другого, потому что это иммунный ответ, а не инфекция.Однако люди с стрептококковой инфекцией группы А могут передавать бактерии другим людям, в основном через респираторные капли.
Предупреждающие знаки обычно указывают на проблемы с почками
Симптомы PSGN могут включать:
- Темная, красновато-коричневая моча
- Припухлость (отек), особенно на лице, вокруг глаз, а также на руках и ногах
- Снижение потребности в мочеиспускании или уменьшение количества мочи
- Чувство усталости из-за низкого уровня железа в крови (утомляемость из-за легкой анемии)
Кроме того, у кого-то с PSGN обычно есть:
- Белок в моче
- Высокое артериальное давление (гипертония)
У некоторых людей могут отсутствовать симптомы или симптомы настолько легкие, что они не обращаются за медицинской помощью.
Наиболее частые дети
Любой человек может получить ПСГН после лечения ангины, скарлатины или импетиго. Люди с повышенным риском этих инфекций также подвергаются повышенному риску получения ПСГН.
ПСГН чаще встречается у детей, чем у взрослых. Развитие ПСГН после ангины или скарлатины чаще всего встречается у детей школьного возраста. Развитие ПСГН после импетиго чаще всего встречается у детей дошкольного возраста.
Доктора смотрят, насколько хорошо работают почки
Врачи ставят диагноз ПСГН, изучая историю болезни пациента и заказывая лабораторные анализы.Врачи могут проанализировать образцы мочи на наличие белка и крови. Врачи также могут сделать анализ крови, чтобы увидеть, насколько хорошо работают почки. Они также могут определить, переболел ли пациент недавно стрептококковой инфекцией группы А.
Лечение направлено на снятие отека и артериального давления
Лечение ПСГН направлено на устранение симптомов по мере необходимости:
- Уменьшение отека (отека) путем ограничения потребления соли и воды или назначения лекарства, увеличивающего отток мочи (мочегонное средство)
- Управление высоким кровяным давлением (гипертонией) с помощью лекарств от кровяного давления
Людям с ПСГН, у которых может оставаться стрептококковая инфекция группы А в горле, часто назначают антибиотики, предпочтительно пенициллин.
Серьезные осложнения, включая длительное повреждение почек
Большинство людей, у которых развивается ПСГН, выздоравливают в течение нескольких недель без каких-либо осложнений. В редких случаях может наблюдаться долговременное повреждение почек, включая почечную недостаточность. Эти редкие осложнения чаще встречаются у взрослых, чем у детей.
Защитите себя и других
Основным способом предотвращения ПСГН является предотвращение стрептококковых инфекций группы А, таких как стрептококковая ангина, скарлатина и импетиго. Заражение стрептококком группы A не защищает человека от повторного заражения в будущем.Вакцины для предотвращения стрептококка группы А. Однако есть вещи, которые люди могут сделать, чтобы защитить себя и других.
Соблюдение правил гигиены помогает предотвратить инфекцию, вызванную стрептококками группы А
Лучший способ предотвратить заражение или распространение стрептококковой инфекции группы А — это часто мыть руки. Это особенно важно после кашля или чихания, а также перед приготовлением пищи или приемом пищи. Чтобы соблюдать правила гигиены, вам необходимо:
- Прикрывайте рот и нос салфеткой, когда кашляете или чихаете
- Положите использованные салфетки в корзину для мусора
- Кашель или чихание в верхнюю часть рукава или локоть, а не в руки, если у вас нет бумажной салфетки.
- Часто мойте руки водой с мылом не менее 20 секунд
- Используйте средство для чистки рук на спиртовой основе, если мыло и вода недоступны.
Вам также следует мыть стаканы, посуду и тарелки после того, как ими воспользуется больной.После стирки эти вещи можно использовать для других.
Антибиотики помогают предотвратить распространение инфекции среди других людей
Предотвратить распространение стрептококковой инфекции группы А другим людям. Людям с стрептококковой инфекцией группы А следует оставаться дома, не ходить на работу, в школу или в детский сад, пока они:
- Больше нет лихорадки
И - Принимали антибиотики не менее 12 часов
Возьмите рецепт точно так, как говорит врач. Не прекращайте принимать лекарство, даже если вы или ваш ребенок чувствуете себя лучше, если только врач не скажет прекратить.
Начало страницы
Детский нефротический синдром | NIDDK
На этой странице:
Что такое детский нефротический синдром?
Детский нефротический синдром не является заболеванием сам по себе; скорее, это группа симптомов, которые
- указывают на повреждение почек — особенно повреждение клубочков, крошечных единиц в почках, через которые фильтруется кровь.
- приводит к выбросу слишком большого количества белка из организма в мочу
Когда почки повреждены, протеиновый альбумин, обычно содержащийся в крови, просачивается в мочу.Белки — это большие сложные молекулы, которые выполняют в организме ряд важных функций.
Два типа детского нефротического синдрома:
- первичный — наиболее распространенный тип детского нефротического синдрома, который начинается в почках и поражает только почки.
- вторичный — синдром вызван другими заболеваниями
Медицинский работник может направить ребенка с нефротическим синдромом к нефрологу — врачу, который специализируется на лечении заболеваний почек.По возможности, ребенок должен обратиться к детскому нефрологу, который имеет специальную подготовку для лечения проблем с почками у детей. Однако во многих частях страны детских нефрологов не хватает, поэтому ребенку, возможно, придется путешествовать. Если путешествие невозможно, некоторые нефрологи, занимающиеся лечением взрослых, также могут лечить детей.
Что такое почки и что они делают?
Почки — это два органа в форме бобов, каждый размером с кулак. Они расположены чуть ниже грудной клетки, по одной с каждой стороны позвоночника.Каждый день почки фильтруют от 120 до 150 литров крови, чтобы произвести от 1 до 2 литров мочи, состоящей из отходов и лишней жидкости. Дети производят меньше мочи, чем взрослые, и количество мочи зависит от их возраста. Моча течет из почек в мочевой пузырь по трубкам, называемым мочеточниками. Мочевой пузырь хранит мочу. Когда мочевой пузырь опорожняется, моча выходит из организма через трубку, называемую уретрой, расположенную в нижней части мочевого пузыря.
Моча течет из почек в мочевой пузырь по трубкам, называемым мочеточниками.
Почки работают на микроскопическом уровне. Почки — это не один большой фильтр. Каждая почка состоит примерно из миллиона фильтрующих единиц, называемых нефронами. Каждый нефрон фильтрует небольшое количество крови. Нефрон состоит из фильтра, называемого клубочком, и канальца. Нефроны работают в два этапа. Клубочки пропускают жидкость и продукты жизнедеятельности; однако он предотвращает прохождение клеток крови и крупных молекул, в основном белков. Отфильтрованная жидкость затем проходит через канальцы, которые отправляют необходимые минералы обратно в кровоток и удаляют отходы.
Каждая почка состоит примерно из миллиона фильтрующих единиц, называемых нефронами. Каждый нефрон фильтрует небольшое количество крови. Нефрон состоит из фильтра, называемого клубочком, и канальца.
Что вызывает детский нефротический синдром?
Хотя идиопатические или неизвестные заболевания являются наиболее частой причиной первичного детского нефротического синдрома, исследователи связали определенные заболевания и некоторые специфические генетические изменения, повреждающие почки, с первичным детским нефротическим синдромом.
Причина вторичного детского нефротического синдрома — основное заболевание или инфекция. Это основное заболевание или инфекция, которые называются первичным заболеванием, вызывают изменения в функции почек, которые могут привести к вторичному нефротическому синдрому у детей.
Врожденные болезни — болезни, которые присутствуют при рождении — также могут вызывать детский нефротический синдром.
Нефротический синдром первичного детского возраста
К различным типам идиопатического детского нефротического синдрома относятся следующие заболевания:
- Болезнь минимальных изменений включает повреждение клубочков, которое можно увидеть только в электронный микроскоп.Этот тип микроскопа показывает крошечные детали лучше, чем любой другой микроскоп. Ученые не знают точной причины болезни минимальных изменений.
Болезнь минимальных изменений является наиболее частой причиной идиопатического детского нефротического синдрома. 1 - Фокальный сегментарный гломерулосклероз рубцевание в отдельных участках почки:
- «Очаговая» означает, что только некоторые клубочки покрываются рубцами.
- «Сегментарный» означает, что повреждение затрагивает только часть отдельного клубочка.
- Мембранопролиферативный гломерулонефрит — это группа заболеваний, связанных с отложениями антител, которые накапливаются в клубочках, вызывая утолщение и повреждение. Антитела — это белки, вырабатываемые иммунной системой для защиты организма от чужеродных веществ, таких как бактерии или вирусы.
Нефротический синдром вторичного детского возраста
Некоторые общие заболевания, которые могут вызывать вторичный нефротический синдром у детей, включают
- диабет, состояние, которое возникает, когда организм не может использовать глюкозу (тип сахара) обычно
- IgA-васкулит, заболевание, при котором мелкие кровеносные сосуды в организме воспаляются и протекают.
- гепатит, воспаление печени, вызванное вирусом
- Вирус иммунодефицита человека (ВИЧ), вирус, изменяющий иммунную систему
- волчанка, аутоиммунное заболевание, которое возникает, когда организм атакует собственную иммунную систему
- малярия, болезнь крови, распространяемая комарами
- стрептококковая инфекция, инфекция, которая возникает, когда бактерии, вызывающие фарингит или кожную инфекцию, остаются без лечения
Другие причины вторичного нефротического синдрома у детей могут включать определенные лекарства, такие как аспирин, ибупрофен или другие нестероидные противовоспалительные препараты, а также воздействие химических веществ, таких как ртуть и литий.
Врожденные болезни и детский нефротический синдром
Врожденный нефротический синдром встречается редко и поражает младенцев в первые 3 месяца жизни. 2 Этот тип нефротического синдрома, иногда называемый инфантильным нефротическим синдромом, может быть вызван
- наследственных генетических дефектов, которые передаются от родителей к ребенку через гены
- инфекций на момент рождения
Дополнительная информация об основных заболеваниях или инфекциях, вызывающих изменения функции почек, представлена в разделе здоровья NIDDK «Гломерулярные заболевания».
У каких детей чаще развивается детский нефротический синдром?
В случаях первичного детского нефротического синдрома, причина которого является идиопатической, исследователи не могут точно определить, у каких детей этот синдром более высок. Однако по мере того, как исследователи продолжают изучать связь между генетикой и детским нефротическим синдромом, возможно, удастся предсказать синдром для некоторых детей.
Дети с большей вероятностью разовьются вторичным детским нефротическим синдромом, если они
- страдают заболеваниями, которые могут повредить почки
- принимать определенные лекарства
- развивают определенные виды инфекций
Каковы признаки и симптомы детского нефротического синдрома?
Признаки и симптомы детского нефротического синдрома могут включать
- отек — опухоль, чаще всего на ногах, ступнях или лодыжках и реже на руках или лице
- альбуминурия — когда в моче ребенка высокий уровень альбумина
- гипоальбуминемия — когда в крови ребенка низкий уровень альбумина
- гиперлипидемия — когда уровень холестерина и жира в крови ребенка выше нормы
Кроме того, у некоторых детей с нефротическим синдромом может быть
- кровь в моче
- симптомы инфекции, такие как лихорадка, вялость, раздражительность или боль в животе
- потеря аппетита
- понос
- высокое кровяное давление
Каковы осложнения детского нефротического синдрома?
Осложнения детского нефротического синдрома могут включать
- инфекция. Когда почки повреждены, у ребенка больше шансов заболеть инфекцией, потому что организм теряет белки, которые обычно защищают от инфекции. Медицинские работники пропишут лекарства для лечения инфекций. Дети с детским нефротическим синдромом должны получать пневмококковую вакцину и ежегодные прививки от гриппа для предотвращения этих инфекций. Детям также следует сделать соответствующие возрасту прививки, хотя поставщик медицинских услуг может отложить введение некоторых живых вакцин, пока ребенок принимает определенные лекарства.
- тромбов. Сгустки крови могут блокировать поток крови и кислорода через кровеносный сосуд в любом месте тела. У ребенка повышается вероятность образования тромбов, когда он или она теряет белки с мочой. Врач будет лечить тромбы с помощью разжижающих кровь препаратов.
- высокий холестерин в крови. Когда альбумин попадает в мочу, уровень альбумина в крови падает. Печень производит больше альбумина, чтобы восполнить низкий уровень в крови.В то же время печень производит больше холестерина. Иногда детям может потребоваться лечение лекарствами для снижения уровня холестерина в крови.
Как диагностируется детский нефротический синдром?
Медицинский работник диагностирует детский нефротический синдром с помощью
- медицинский и семейный анамнез
- медосмотр
- анализы мочи
- анализ крови
- УЗИ почек
- Биопсия почки
Медицинский и семейный анамнез
Изучение медицинского и семейного анамнеза — одна из первых вещей, которые медицинский работник может сделать для диагностики детского нефротического синдрома.
Физический осмотр
Медицинский осмотр может помочь диагностировать детский нефротический синдром. Во время медицинского осмотра чаще всего врач
- осматривает тело ребенка
- ударов по определенным участкам тела ребенка
Анализы мочи
Медицинский работник может назначить следующие анализы мочи, чтобы определить, есть ли у ребенка повреждение почек в результате детского нефротического синдрома.
Тест полосками на альбумин. Тест с помощью индикаторной полоски, выполняемый на образце мочи, может определить присутствие альбумина в моче, что может означать повреждение почек. Ребенок или воспитатель собирает образец мочи в специальную емкость. Для проведения теста медсестра или техник помещает полоску химически обработанной бумаги, называемую щупом, в образец мочи ребенка. Пятна на щупе меняют цвет, когда в моче присутствует альбумин.
Отношение альбумина к креатинину в моче. Медицинский работник использует это измерение для оценки количества альбумина, попавшего в мочу за 24-часовой период.Ребенок сдает образец мочи на приеме к врачу. Креатинин — это продукт жизнедеятельности, который фильтруется в почках и выводится с мочой. Высокое соотношение альбумина к креатинину в моче указывает на то, что почки выделяют большое количество альбумина с мочой.
Анализ крови
Анализ крови включает забор крови в офисе поставщика медицинских услуг или в коммерческом учреждении и отправку образца в лабораторию для анализа. Лаборатория тестирует образец, чтобы оценить, сколько крови фильтруют почки каждую минуту, это называется оценочной скоростью клубочковой фильтрации или рСКФ.Результаты теста помогают врачу определить степень повреждения почек. Медицинские работники могут также назначить другие анализы крови, чтобы помочь определить основное заболевание, которое может вызывать нефротический синдром у детей.
УЗИ почек
Ультразвук использует устройство, называемое преобразователем, которое безопасно и безболезненно отражает звуковые волны от органов, чтобы создать изображение их структуры. Специально обученный техник выполняет процедуру в офисе поставщика медицинских услуг, амбулаторном центре или больнице.Радиолог — врач, специализирующийся на медицинской визуализации — интерпретирует изображения, чтобы увидеть, нормально ли выглядят почки; ребенку обезболивание не требуется.
Биопсия почки
Биопсия почки — это процедура, при которой берется небольшой кусочек почечной ткани для исследования под микроскопом. Медицинский работник выполняет биопсию в амбулаторном центре или больнице. Лечащий врач назначит ребенку легкую седацию и местную анестезию; однако в некоторых случаях ребенку потребуется общая анестезия.Патолог — врач, специализирующийся на диагностике заболеваний — исследует ткани в лаборатории. Тест может помочь диагностировать детский нефротический синдром.
Когда врач подозревает, что у ребенка болезнь минимальных изменений, он или она часто начинает лечение с помощью лекарств, не выполняя биопсию. Если лекарство подействует, ребенку биопсия не требуется. В большинстве случаев поставщик медицинских услуг не выполняет биопсию детям младше 12 лет, если он или она не считает, что причиной является другое заболевание.
Как лечится детский нефротический синдром?
Медицинские работники решают, как лечить детский нефротический синдром, в зависимости от типа:
- первичный детский нефротический синдром: лекарственные препараты
- Вторичный детский нефротический синдром: лечение основного заболевания
- врожденный нефротический синдром: лекарства, операция по удалению одной или обеих почек и трансплантация
Первичный детский нефротический синдром
Медицинские работники лечат идиопатический детский нефротический синдром с помощью нескольких типов лекарств, которые контролируют иммунную систему, удаляют лишнюю жидкость и снижают кровяное давление.
- Управляйте иммунной системой. Кортикостероиды — это группа лекарств, которые снижают активность иммунной системы, уменьшают количество альбумина, теряемого с мочой, и уменьшают отек. Медицинские работники обычно используют преднизон или родственные кортикостероиды для лечения идиопатического детского нефротического синдрома. Около 90 процентов детей достигают ремиссии при ежедневном приеме кортикостероидов в течение 6 недель, а затем немного меньшей дозе через день в течение 6 недель. 2 Ремиссия — это период, когда у ребенка отсутствуют симптомы.
У многих детей наблюдается рецидив после начальной терапии, и медицинские работники лечат их более коротким курсом кортикостероидов до тех пор, пока болезнь снова не перейдет в ремиссию. У детей могут быть множественные рецидивы; однако чаще всего они выздоравливают без длительного повреждения почек.
Если у ребенка частые рецидивы или он не реагирует на лечение, врач может прописать другие лекарства, снижающие активность иммунной системы. Эти лекарства препятствуют выработке организмом антител, которые могут повредить ткани почек.Они включают
- циклофосфамид
- микофенолят (CellCept, Myfortic)
- циклоспорин
- такролимус (Гекория, Програф)
Врач может использовать эти другие лекарства для иммунной системы с кортикостероидами или вместо кортикостероидов.
- Удалите лишнюю жидкость. Врач может прописать мочегонное средство — лекарство, которое помогает почкам удалять лишнюю жидкость из крови.Удаление лишней жидкости часто помогает снизить кровяное давление.
- Пониженное артериальное давление. У некоторых детей с детским нефротическим синдромом развивается высокое кровяное давление, и им может потребоваться прием дополнительных лекарств для снижения кровяного давления. Два типа препаратов, снижающих артериальное давление, ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина, имеют дополнительное преимущество в замедлении прогрессирования заболевания почек. Многим детям с нефротическим синдромом требуется два или более лекарств для контроля артериального давления.
Нефротический синдром вторичного детского возраста
Медицинские работники лечат вторичный детский нефротический синдром путем лечения основной причины первичного заболевания. Например, поставщик медицинских услуг может вылечить детей до
.
- Назначение антибиотиков при инфекции
- корректирующие лекарства для лечения волчанки, ВИЧ или диабета
- смена или прекращение приема лекарств, которые, как известно, вызывают вторичный детский нефротический синдром
При лечении основной причины врач также будет лечить ребенка для улучшения или восстановления функции почек с помощью тех же лекарств, которые используются для лечения первичного детского нефротического синдрома.
Смотрители должны следить за тем, чтобы дети принимали все прописанные лекарства и следовали плану лечения, рекомендованному их лечащим врачом.
Врожденный нефротический синдром
Исследователи обнаружили, что лекарства неэффективны при лечении врожденного нефротического синдрома и что большинству детей потребуется пересадка почки к 2–3 годам. Трансплантация почки — это операция по помещению здоровой почки только что умершего человека или живого донора, чаще всего члена семьи, в тело человека, чтобы взять на себя работу поврежденной почки.Чтобы сохранить здоровье ребенка до трансплантации, врач может порекомендовать следующее:
- инъекций альбумина для восполнения потери альбумина с мочой
- диуретики для удаления лишней жидкости, вызывающей отеки
- антибиотиков для лечения первых признаков инфекции
- гормонов роста для стимуляции роста и созревания костей
- Удаление одной или обеих почек для уменьшения потери альбумина с мочой
- диализ для искусственной фильтрации шлаков из крови при отказе почек
Как можно предотвратить детский нефротический синдром?
Исследователи не нашли способа предотвратить детский нефротический синдром, если причина идиопатическая или врожденная.
Питание, диета и питание
Детям с нефротическим синдромом может потребоваться внести изменения в свой рацион, например,
- ограничение количества натрия, часто из соли, которое они принимают каждый день
- уменьшение количества жидкости, которую они пьют каждый день
- соблюдение диеты с низким содержанием насыщенных жиров и холестерина для контроля повышенного уровня холестерина
Родители или опекуны должны поговорить с лечащим врачом ребенка, прежде чем вносить какие-либо изменения в рацион ребенка.
ресурса
Национальный фонд почек
Дети с хроническим заболеванием почек: советы родителям
Справочник работодателя
Nemours KidsHealth Website
Когда у вашего ребенка хроническое заболевание почек
Что делать с диализом?
Nephkids
Группа киберподдержки
Объединенная сеть обмена органами
Трансплантация органов: что нужно знать каждому ребенку (PDF, 1.67 МБ)
Министерство здравоохранения и социальных служб США, Центры услуг Medicare и Medicaid
Покрытие Medicare услуг диализа и трансплантации почек (PDF, 1080 КБ)
Управление социального обеспечения США
Пособия для детей с ограниченными возможностями (PDF, 413 КБ)
Клинические испытания
Национальный институт диабета, болезней органов пищеварения и почек (NIDDK) и другие подразделения Национального института здоровья (NIH) проводят и поддерживают исследования многих заболеваний и состояний.
Что такое клинические испытания и какую роль в исследованиях играют дети?
Клинические испытания — это исследования с участием людей всех возрастов. Клинические испытания ищут новые способы предотвращения, обнаружения или лечения заболеваний. Исследователи также используют клинические испытания для изучения других аспектов лечения, таких как улучшение качества жизни. Исследования с участием детей помогают ученым
- определить уход, который лучше всего подходит для ребенка
- найди лучшую дозу лекарств
- найти средства для лечения заболеваний, от которых страдают только дети
- лечат состояния, которые ведут себя по-разному у детей
- понять, как лечение влияет на организм растущего ребенка
Узнайте больше о клинических испытаниях и детях.
Какие клинические испытания открыты?
Клинические испытания
, которые в настоящее время открыты и набираются, можно просмотреть на сайте www.ClinicalTrials.gov.
Список литературы
[1] Нефротический синдром. Медицинская онлайн-библиотека руководств Merck. www.merckmanuals.com. Обновлено в июле 2013 г. Проверено 7 июля 2014 г.
[2] Баккалоглу С.А., Шефер Ф. Заболевания почек и мочевыводящих путей у детей. В: Taal MW, Chertow GM, Marsden PA, et al., Eds. Бреннер и Ректор Почка .9 изд. Филадельфия: Сондерс; 2011: 2622–2643.
Гломерулонефрит у детей | Медицинская онлайн-библиотека Lecturio
Изображение: «Микрофотография биопсии почек, показывающая заметное фиброцеллюлярное серповидное образование и умеренную мезангиальную пролиферацию в клубочках. Окраска гематоксилином и эозином ». Авторы: Аруначалам Рамасвами, Тиравиам Кандасвами, Толаппан Раджендран, Кижак Пишарам Джеякришнан, Хла Аунг, Мохаммаед Икбал, Чакко К Джейкоб, Хаджи Шаукат Зинна и Газала Кафил.Лицензия: CC BY 2.0
.
Определение
Острый гломерулонефрит (ОГ) — , определяемый как повреждение клубочков, которое сопровождается воспалением клубочков. Это клиническая комбинация внезапного начала гематурии и протеинурии, отеков и гипертонии с или без эритроцитов. Педиатрический хронический GN включает как первичный GN (например, нефропатия IgA), так и вторичный GN (например, нефрит системной красной волчанки).
«Патология гломерулонефрита» Изображение создано Lecturio
Эпидемиология и этиология
GN возникает, когда иммунные комплексы задерживаются в паренхиме почек. Педиатрический GN можно разделить на четыре типа на основании клинических проявлений:
- Острый GN
- Быстро прогрессивный GN
- Рецидивирующая макроскопическая гематурия
- Хронический GN
| Острый (слепки эритроцитов) | Хроническая токсичность (без слепков) | ||
| Первичный | Вторичная | Первичный | Вторичная |
|
|
| То же, что и при острой вторичной причине:
|
Классификация
Его также можно классифицировать по этиологии.
Первичный гломерулонефрит включает:
- Острый постстрептококковый ГН обычно встречается у детей старше двух лет. Заболеваемость в развивающихся странах примерно в четыре раза выше, чем в развитых странах
- IgA-нефропатия обычно не развивается до подросткового возраста (в основном у мужчин). Это наиболее частая причина острого гломерулонефрита у детей
- Мембранопролиферативный ГН (МПГН) встречается у детей старше восьми лет
Вторичный гломерулонефрит возникает из:
- Пурпура Геноха – Шенлейна встречается у детей в возрасте восьми лет и старше. Пурпура Геноха – Шенлейна является наиболее частой причиной вторичного гломерулонефрита
- Гранулематоз с полиангиитом
- Микроскопический полиангиит
- Системная красная волчанка
Острый постстрептококковый ГН обычно возникает у детей старше двух лет. Заболеваемость в развивающихся странах примерно в четыре раза выше, чем в развитых странах (). IgA-нефропатия обычно не развивается до подросткового возраста (в основном у мужчин).Это наиболее частая причина острого гломерулонефрита у детей.
Аналогичным образом, мембранопролиферативный ГН (MPGN) и пурпура Геноха – Шенлейна встречаются у детей в возрасте восьми лет и старше. Пурпура Геноха – Шенлейна — наиболее частая причина вторичного гломерулонефрита. . Кажется, что расовых различий нет.
Патофизиология
Патогенез GN остается несколько неясным, несмотря на достижения медицины . Патофизиология включает иммунный ответ, связанный с инфекциями или некоторыми неинфекционными состояниями, которые, в свою очередь, активируют ряд биологических процессов (активация комплемента, набор лейкоцитов, высвобождение цитокинов и т. Д.), которые приводят к повреждению клубочков и увеличивают проницаемость базальной мембраны клубочка.
Циркулирующие иммунные комплексы (комплексы антиген-антитело или другие механизмы) захватываются почечной тканью и откладываются в базальной мембране клубочков. Воспаление и разрастание эндотелиальных, мезангиальных и эпителиальных клеток приводит к повреждению нормальной почечной ткани.
Воспалительный процесс может быть самовоспламеняющимся и привести к продолжающимся дополнительным травмам .Например, высвобождение цитокинов приводит к привлечению фагоцитов и образованию комплекса атаки на мембрану (MAC), который вызывает дальнейшее повреждение. Если воспалительный процесс купирован, как это происходит при остром постстрептококковом ГН, почечная ткань восстанавливается. В противном случае происходит прогрессирующая потеря клубочков и нефронов (например, мембранопролиферативный ГН).
Острый постстрептококковый GN : здесь этиологический агент очевиден — стрептококки, особенно бета-гемолитические стрептококки группы А.Однако некоторые исследования указывают на наличие нефритогенных штаммов бета-гемолитических стрептококков группы А, которые отличаются от ревматогенных штаммов.
Это объясняет разные реакции на иммунные комплексы, которые приводят к двум разным заболеваниям (постстрептококковый ГН и ревматическая лихорадка соответственно). М-белки, М-подобные белки и другие факторы на стрептококки были идентифицированы как триггеры для инициирования более нефритогенного процесса. Антигенная мимикрия между белками патогена и белками сердца и почек приводит к образованию иммунных комплексов, поскольку организм вырабатывает иммунный ответ против собственных белков.
Клинические особенности
Самый частый симптом — это изменение цвета мочи, обычно связанное с гематурией. Моча обычно красновато-коричневого цвета (цвета «чай» или «кола»), состояние, называемое макрогематурией. (Когда кровь присутствует в моче, но не влияет на цвет и вместо этого обнаруживается при микроскопическом анализе мочи, это называется микроскопической гематурией). Если цвет ярко-красный, это означает дополнительные структурные проблемы, например образование камней.
Мочеиспускание часто безболезненно. Боль при мочеиспускании при макрогематурии должна вызывать подозрение на острый геморрагический цистит . Осложнения, связанные с ГН, могут вызывать симптомы и признаки, варьирующиеся от одышки до изменения психического статуса.
При физикальном обследовании могут быть обнаружены различные признаки, такие как высокое кровяное давление (в зависимости от возраста и пола ребенка), изменение психического статуса, тахипноэ, одышка, тахикардия и шейная лимфаденопатия. Обследование брюшной полости может выявить другие симптомы, включая асцит (нефротическое заболевание), гепатомегалию или спленомегалию, боль в животе и отек мошонки.
Задержка жидкости может привести к некоторому периферическому отеку, но это не может быть точечная коррозия. При остром ГН на коже может проявляться характерная сыпь, характерная для HSP, которая изначально может быть не явной. . Это может быть ограничено ступнями или ягодицами. Поражение суставов возникает при некоторых мультисистемных заболеваниях с острым ГН.
Гломерулонефрит проявляется следующим спектром симптомов:
- Гематурия (макроскопическая или микроскопическая)
- Дисморфические эритроциты и цилиндры эритроцитов в моче
- Протеинурия, которая может достигать нефротического диапазона (> 3 г за 24 ч)
- Гипертония
- Отек
- Почечная недостаточность
К различным клиническим проявлениям относятся следующие:
Острый GN : типичное проявление включает внезапное начало гематурии с протеинурией или без нее, снижение скорости клубочковой фильтрации и задержку соленой воды.Часто возникают отеки и повышенное артериальное давление.
Быстро прогрессирующее GN : острое, быстрое и прогрессирующее ухудшение функции почек, иногда даже в течение нескольких дней или недель. Морфологически характеризуется обширным серповидным образованием.
Рецидивирующая макроскопическая гематурия : IgA-нефропатия, а иногда и синдром Альпорта, проявляющийся как преходящие эпизоды макроскопической гематурии, обычно возникающие через 1-2 дня после инфекции верхних дыхательных путей.
Хронический GN : при хроническом GN признаки и симптомы могут быть небольшими, но не явными. Анализ мочи может выявить только микроскопическую гематурию или протеинурию.
В некоторых случаях пациенты обращаются на более позднюю стадию заболевания с симптомами и признаками повышенного артериального давления, ухудшения функции почек, протеинурии и / или гематурии. Биопсия почек показывает только неспецифические признаки, такие как гломерулярный склероз, фиброз и атрофия канальцев.
Диагноз
Ранняя диагностика важна для начала правильного лечения и остановки течения болезни , которая в конечном итоге может привести к терминальной стадии почечной недостаточности.Клинические проявления заболевания важны (например, нормальная или сниженная СКФ, наличие или отсутствие системных симптомов, семейный анамнез и т. Д.), Поскольку они позволяют понять основную причину.
Клинический диагноз
В дополнение к симптомам и признакам, упомянутым выше, необходимо собрать в анамнезе предыдущих эпизодов (стрептококковой) инфекции горла, чтобы определить хронический GN или постстрептококковый GN, соответственно. Также важно выяснить семейный анамнез, который может быть положительным у пациентов с СКВ и мембранопролиферативным ГН.
При сборе анамнеза пациента необходимо исключить участие других систем (из-за осложнений или с точки зрения дифференциальной диагностики). Обследование сердечно-легочной системы должно быть сосредоточено на оценке последствий перегрузки жидкостью .
Лабораторная диагностика
Моча : гематурия (макроскопическая или микроскопическая), протеинурия (обычно от 500 мг / сут до 3 г / сут) и цилиндры эритроцитов в моче. Хотя последнее является диагностическим признаком клубочкового кровотечения, обычно его не обнаруживают.Кроме того, для оценки функции почек необходим 24-часовой показатель экскреции белка с мочой или соотношение белок: креатинин в моче.
Сыворотка : Если уровни комплемента в сыворотке ненормальные, проверьте отдельные компоненты (например, C3, C4). Низкий C3 и нормальный C4 наблюдается при постстрептококковом гломерулонефрите. Однако низкий C3 и низкий C4 наблюдается при волчанке, шунтирующем нефрите и бактериальном эндокардите. Уровень креатинина в сыворотке крови проверяется для контроля функции почек.
Культура для мазков из горла и кожи может быть положительной у пациентов с инфекционной этиологией.
Визуализация
Ультразвуковое исследование почек должно быть выполнено, чтобы исключить другие почечные нарушения , такие как кисты и камни. Также полезно определить степень фиброза.
Гистопатология
Биопсия почек почти всегда требуется для установления окончательного диагноза . Однако постстрептококковый гломерулонефрит, гемолитико-уремический синдром и пурпура Геноха-Шенлейна не требуют биопсии у пациентов.
Световая микроскопия : световая микроскопия не чувствительна и не специфична для GN.Существует множество вариаций, а также совпадений в выводах, что не позволяет поставить окончательный диагноз. Тем не менее, световая микроскопия имеет клиническое значение для корреляции с клиническими данными и прогнозом пациента. Результаты светового микроскопа можно разделить на диффузный пролиферативный ЗН (с поражением в большинстве клубочков) или очаговый ЗН (с поражением менее 50% клубочков).
Иммунофлуоресцентная микроскопия : иммунофлуоресцентная микроскопия может показать отложения IgG, IgA и IgM с комплементами в клубочках.Характер отложений может быть достаточно характерным, чтобы позволить идентифицировать конкретное заболевание.
| Форма осаждения | Состояние |
| Зернистые отложения | Заболевания иммунного комплекса |
| Линейное отложение IgG вдоль базальной мембраны клубочка | Болезнь, вызванная антителами к базальной мембране клубочков |
| Мезангиальный IgA> IgG | IgA нефропатия, пурпурный нефрит Геноха – Шенлейна |
| Отсутствие депозита иммуноглобулина (указывает на слабый иммунный ответ) | Системный васкулит |
Электронная микроскопия : электронная микроскопия полезна для подтверждения диагноза, поскольку она показывает, находятся ли отложения в мезангиуме или субэндотелиальных / субэпителиальных тканях или их комбинации.Следовательно, это может помочь установить очень конкретный диагноз, например болезнь минимальных изменений, очаговый сегментарный гломерулосклероз, болезнь тонкой базальной мембраны и т. д.
Клиническая картина конкретных заболеваний гломерулонефрита у детей
Острый постстрептококковый GN : внезапно возникший острый нефрит через 1-2 недели после стрептококковой инфекции горла и через 3-6 недель после кожной инфекции. Однако в анамнезе инфекция горла или кожи может отсутствовать. Обнаружение антигена ДНКазы B — лучший метод выявления перенесенной стрептококковой инфекции.
Острый постстрептококковый ГН — одна из наиболее частых клубочковых причин макрогематурии у детей. и важная причина острой почечной недостаточности и госпитализации детей. Биопсия почек не показана при наличии типичных особенностей. Специфические изменения при биопсии почек включают:
- Неровные бугристые отложения иммуноглобулина и комплемента на базальной мембране клубочков и мезангиуме
- Электронно-плотные отложения или «горбы» на субэпителиальной стороне.
Уровень C3 в сыворотке может резко и заметно снизиться, что часто является диагностическим и возвращается к норме примерно через 6 недель после болезни.
Синдром Альпорта : наследственный нефрит обычно является Х-сцепленным доминантным заболеванием (хотя редко может быть аутосомно-доминантным или рецессивным). Это может проявляться в виде бессимптомной (микроскопической) гематурии, а иногда наблюдается макрогематурия после респираторной инфекции.
Биопсия почек показывает склероз клубочков, толстую базальную мембрану, фиброз, пенистые клетки и атрофию канальцев. Может быть потеря слуха и глазные аномалии , такие как передний лентиконус, который является патогномоничным.
Дифференциальная диагностика
- Болезнь антител к базальной мембране клубочков
- Антинейтрофильные цитоплазматические аутоантитела (ANCA) GN
- Нефропатия C1q
- IgA нефропатии
- (Идиопатический) Мембранопролиферативный ГН (остается важной причиной гломерулярных заболеваний у детей)
- Паучиммунный ANCA-негативный GN
- Системная красная волчанка (антиядерные антитела могут помочь исключить это)
- Обструкция лоханочно-мочеточникового перехода
- Болезнь Вильсона
Лечение
Лечение GN включает поддерживающую терапию, а также лечение основной патологии.
Поддерживающая терапия
При ГН или большинстве почечных заболеваний поддерживающая терапия включает регулирование водно-электролитного баланса и гипертонии, а также мониторинг функции почек. При перегрузке жидкостью обычно помогают диуретики, ограничение жидкости и ограничение соли. . Петлевые диуретики полезны при перегрузке жидкостью, а также при гипертонии, хотя могут потребоваться другие гипотензивные средства, такие как ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II.
Электролитные нарушения включают гипокальциемию и гипонатриемию, и, если они легкие, могут быть устранены путем контроля перегрузки жидкостью. Иногда может потребоваться добавка кальция. Следует избегать тяжелых физических упражнений . Если почечная функция слишком плохая, например, При острой почечной недостаточности потребуется диализ.
Лечение основной патологии
Лечение должно быть направлено на борьбу с воспалением и подавление фиброза .Первое может быть достигнуто путем введения противовоспалительных или иммунодепрессивных агентов, таких как кортикостероиды (пероральные или системные), циклофосфамид, азатиоприн и мофетил микофенолят.
Для подавления фиброза терапия направлена на снижение протеинурии и повреждения канальцев . Лекарства, которые помогают достичь этого, включают ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина 2.
Примечание : Любая персистирующая стрептококковая инфекция у пациентов с постстрептококковым ГН должна лечиться с помощью пенициллина.
Острый постстрептококковый нефрит
Следует назначать антибиотики для предотвращения распространения или лечения любой существующей инфекции, если таковая имеется. Ограничение потребления соли и петлевые диуретики часто являются терапией первой линии против гипертонии. При необходимости могут быть добавлены специфические гипотензивные препараты.
Синдром Альпорта
Нет специфической терапии, и прогноз плохой . Ингибиторы ангиотензинпревращающего фермента могут замедлить прогрессирование заболевания.Обычно это требует диализа и трансплантации почек, поскольку существует предрасположенность к терминальной стадии почечной недостаточности.
Прогресс и прогноз
В целом, прогноз для детей с ГН в целом хороший, так как почти во всех случаях эпидемического постинфекционного ГН часто наблюдается полное выздоровление. Пациенты с очаговым ГН имеют лучший прогноз, чем пациенты с диффузным пролиферативным ГН, которые, как правило, имеют более серьезное заболевание. Однако у некоторых детей может развиться терминальная стадия почечной недостаточности.Летальность от острого гломерулонефрита колеблется в пределах 0-7%. Спорадические случаи связаны с более высокой частотой хронических заболеваний и развитием терминальной стадии почечной недостаточности.
Гломерулонефрит (гломерулярная болезнь) — Симптомы, причины и лечение
Почки удаляют отходы и жидкость из крови с помощью крошечных фильтров, называемых клубочками (glow-MER-you-lye). Гломерулонефрит, иногда называемый гломерулярной болезнью, представляет собой тип заболевания почек, при котором клубочки повреждены и не могут удалять отходы и жидкость должным образом.Гломерулонефрит может начаться внезапно или медленно, с течением времени. Если он начинается внезапно, это называется острым гломерулонефритом. Если он развивается медленно, это называется хроническим гломерулонефритом. Каждый четвертый человек с гломерулонефритом никогда не болел почек.
Каковы симптомы гломерулонефрита?
Симптомы гломерулонефрита часто проявляются медленно. Вы можете не заметить, что что-то не так. Признаки гломерулонефрита часто обнаруживаются при обычных посещениях врача.Ваш лечащий врач может попросить вас пройти дополнительные тесты для проверки на гломерулонефрит или другое заболевание почек, если ваши тесты покажут любую из следующих проблем:
Обратитесь к своему врачу, если вы заметили какие-либо из следующих симптомов, поскольку они могут быть признаками гломерулонефрита или другой проблемы с почками:
- Моча розового или коричневого цвета
- Пенистая или пузырьковая моча
- Отек лица, глаз, лодыжек, ступней, ног или живота
- Чувство усталости больше обычного
Если вы заметили какие-либо симптомы или если ваши тесты показывают, что ваши почки могут работать не так хорошо, как должны, ваш лечащий врач может попросить вас пройти один или несколько из следующих тестов:
- Анализ мочи: Ваш лечащий врач возьмет образец мочи для проверки крови, белка, лейкоцитов и эритроцитов.
- Анализ крови: Ваш лечащий врач возьмет образец крови, чтобы проверить уровень отходов в вашей крови.
- Визуализирующие тесты: Ваш лечащий врач может попросить вас сделать рентген, УЗИ или компьютерную томографию, чтобы он или она могли увидеть ваши почки.
- Биопсия почки: Ваш лечащий врач или хирург с помощью специальной иглы извлекут крошечный кусочек ткани внутри вашей почки. Образец ткани будет изучен под микроскопом для проверки на гломерулонефрит.
Если ваш лечащий врач подозревает, что у вас гломерулонефрит, вам, скорее всего, потребуется биопсия почки. Биопсия почки почти всегда необходима, чтобы выяснить, есть ли у вас гломерулонефрит.
Вернуться к началу
Что вызывает гломерулонефрит?
Не всегда можно узнать, что вызывает гломерулонефрит. Многие заболевания и состояния могут привести к повреждению клубочков, но у кого-то может быть гломерулонефрит, никогда не болевший ни одним из этих заболеваний или состояний.Некоторые из проблем, которые могут привести к гломерулонефриту, включают:
- Высокое кровяное давление
- Диабет
- Рак
- Стрептококковая ангина
- Регулярный прием нестероидных противовоспалительных препаратов (НПВП), превышающих рекомендованную, таких как ибупрофен, аспирин или напроксен
- Бактериальная инфекция сердца
- Вирусные инфекции, такие как ВИЧ, гепатит В и гепатит С
- Иммунные заболевания, такие как волчанка, синдром Гудпасчера и IgA-нефропатия
- Васкулит (состояние, вызывающее раздражение кровеносных сосудов)
Вернуться к началу
Каковы возможные осложнения гломерулонефрита?
Иногда гломерулонефрит носит временный характер, и ваши почки могут восстановить нормальное функционирование.Если это необратимо и продолжает ухудшаться, это может привести к серьезным проблемам с почками, таким как острое повреждение почек, хроническое заболевание почек, высокое кровяное давление или нефротический синдром. Некоторые другие возможные осложнения включают:
Вернуться к началу
Как лечить гломерулонефрит?
Лечение гломерулонефрита зависит от его причины. Например, если высокое кровяное давление вызвало повреждение клубочков, лечение, скорее всего, будет сосредоточено на контроле вашего кровяного давления.Некоторые лекарства, называемые ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов ангиотензина (БРА), могут помочь контролировать ваше кровяное давление.
В некоторых случаях гломерулонефрит может вылечиться самостоятельно. Если у вас была ангина, которая привела к гломерулонефриту, ваши клубочки могут восстановиться самостоятельно после того, как вы примете антибиотик для лечения стрептококковой инфекции.
Знание причины повреждения клубочков поможет вашему врачу выбрать правильное лечение для вас.
Вернуться к началу
Как предотвратить гломерулонефрит?
Профилактика гломерулонефрита не всегда возможна. Вы можете попытаться снизить риск повреждения клубочков, контролируя кровяное давление и поддерживая здоровый уровень сахара в крови. Другие способы снизить ваши шансы заболеть гломерулонефритом включают:
- Как можно скорее обратиться к врачу, если вы подозреваете, что у вас ангина
- Практикуйте безопасный секс и избегайте употребления наркотиков
- Не принимайте больше рекомендованной дозы безрецептурных обезболивающих, таких как ибупрофен, аспирин или напроксен.
Вернуться к началу
Подход к ребенку с острым гломерулонефритом
Острый гломерулонефрит (AGN) — частое заболевание в детском возрасте.Многих детей с AGN можно лечить в условиях первичной медико-санитарной помощи. Диагноз обычно ставится на основании результатов исследования мочи, особенно на основании цилиндров эритроцитов. Одно из наиболее важных начальных исследований — определение уровня C3 комплемента; Гипокомплементемия наиболее характерна для постстрептококковой АГН, в то время как нормокомплементемия чаще всего наблюдается при IgA-нефропатии. Детей, у которых АГН сопровождается значительной артериальной гипертензией или почечной недостаточностью, следует немедленно обследовать специалиста.Наличие серьезных внепочечных признаков или симптомов также требует срочного направления. В противном случае целесообразно серийное наблюдение в отделении первичной медико-санитарной помощи.
1. Введение
Многие дети с острым гломерулонефритом (АГН) впервые попадают в приемные врача. Этот первоначальный контакт может иметь решающее значение для определения наиболее подходящего расположения ребенка, а также для выявления любых непосредственных угроз для жизни.
В этой статье будет рассмотрен офисный подход к AGN у детей на основе прочных знаний в области патофизиологии.Он начнется с обзора патологии и патофизиологии гломерулонефрита, а затем представит практическое описание важных аспектов анамнеза и физического обследования, имеющих отношение к ребенку с подозрением на AGN. Затем он предоставит руководство по выбору и интерпретации соответствующих лабораторных исследований для первоначальной оценки. Наконец, будут даны некоторые рекомендации по направлению детей с AGN, включая обсуждение некоторых ситуаций, в которых может оказаться целесообразным лечение со стороны лица, осуществляющего первичный уход.
2. Обзор AGN
AGN представляет собой комплекс результатов, гистологически отмеченных генерализованным гломерулярным воспалением. Часто биопсия почек недоступна, но AGN обычно можно распознать по клинической картине гематурии, перегрузке жидкостью (отек и гипертензия) и некоторым признакам почечной недостаточности (повышение АМК и креатинина).
В большинстве случаев воспаление клубочков начинается с реакции антиген-антитело, либо прямого связывания антитела с антигеном, экспрессированного или захваченного в клубочках, либо локализации циркулирующего комплекса в почках.Это вызывает травму, активируя одну или несколько систем медиаторов воспаления: каскад комплемента, факторы свертывания крови, цитокины, факторы роста и другие. Воспаление характеризуется пролиферацией резидентных клубочковых клеток и инфильтрацией лимфоцитами или нейтрофилами.
Воспаление и расширение клубочков нарушает микроциркуляцию, снижая скорость клубочковой фильтрации (СКФ) и обычно приводя к увеличению уровня азота мочевины и креатинина. Это снижение СКФ, в свою очередь, приводит к задержке соли и воды, вызывая перегрузку жидкостью.Степень перегрузки жидкостью в AGN может значительно различаться. В тяжелых ситуациях это может проявляться опасной для жизни гипертонией и отеком легких. Действительно, гипертоническая энцефалопатия может быть основной жалобой у некоторых детей с AGN [1].
В некоторых ситуациях AGN является первичным процессом, и практически все клинические данные являются следствием поражения почек. Постстрептококковое AGN является лучшим примером этого [2]. В других случаях AGN является лишь одним из проявлений системного заболевания, поражающего несколько органов, каждый из которых может быть поврежден независимо.У детей прототипом для этого является AGN, связанный с пурпурой Шенлейна Геноха [3].
К счастью, большинство случаев AGN у детей либо купируются самостоятельно, либо поддаются лечению, хотя в острой фазе болезни могут быть разрушительные осложнения. Реже то, что начинается как очевидное AGN, может предвещать развитие хронического процесса, который в конечном итоге может перерасти в необратимую терминальную стадию почечной недостаточности (ESRD).
3. Анамнез и физикальное обследование
Чаще всего ребенка с AGN осматривают из-за внезапного изменения цвета мочи.Однако иногда предъявляемая жалоба может относиться к осложнению заболевания: гипертоническим припадкам, отекам и т. Д.
История начинается с получения более подробной информации об изменении мочи. Гематурия у детей с AGN обычно описывается как «кокаиновая», «чайная» или «дымчатая». Настоящая ярко-красная кровь в моче скорее является следствием анатомических проблем, таких как мочекаменная болезнь [4], чем гломерулонефрита. Цвет мочи в AGN однороден по всей струе.Макрогематурия AGN практически всегда безболезненна; дизурия, сопровождающая макрогематурию, указывает на острый геморрагический цистит [5], а не на заболевание почек. История предыдущих таких эпизодов может указывать на обострение хронического процесса, такого как IgA-нефропатия [6]. Хотя история недавно задокументированной стрептококковой инфекции согласуется с постстрептококковой AGN, такая история часто недоступна.
Следующим важным моментом является выяснение любых симптомов, указывающих на осложнения AGN.Они могут включать одышку или непереносимость физических упражнений из-за перегрузки жидкостью или головных болей, нарушения зрения или изменение психического статуса из-за гипертонии.
Так как AGN может быть источником жалобы на мультисистемное заболевание, полный анализ систем имеет жизненно важное значение. Особое внимание следует уделять сыпи, дискомфорту в суставах, недавнему изменению веса, утомляемости, изменениям аппетита, респираторным заболеваниям и недавнему воздействию лекарств. В семейном анамнезе следует учитывать наличие каких-либо членов семьи с аутоиммунными расстройствами, поскольку у детей с СКВ и мембранопролиферативным гломерулонефритом (МПГН) могут быть такие родственники.Семейный анамнез почечной недостаточности (особенно вопросы о диализе и трансплантации почки) может быть первым ключом к разгадке такого процесса, как синдром Альпорта, который изначально может проявляться картиной AGN.
Медицинский осмотр начинается с тщательной оценки основных показателей жизнедеятельности, особенно артериального давления. Артериальное давление на 5 мм выше 99-го процентиля для возраста, пола и роста ребенка, особенно если оно сопровождается каким-либо изменением психического статуса, требует немедленного внимания. Тахикардия и тахипноэ указывают на симптоматическую перегрузку жидкостью.Тщательное обследование носа и горла может предоставить доказательства кровотечения, предполагая возможность наличия одного из ANCA-положительных васкулитов, таких как гранулематоз Вегнера [7]. Шейная лимфаденопатия может быть следствием недавнего стрептококкового фарингита. Кардиопульмональное обследование предоставит доказательства перегрузки жидкостью или легочного поражения, характерных для редких почечно-легочных синдромов. Особенно важно обследование брюшной полости. Асцит может присутствовать, если есть нефротический компонент AGN.Гепато- или спленомегалия могут указывать на системное заболевание. Сильная боль в животе может сопровождать HSP. Отек мошонки также может возникать при нефротическом синдроме, а орхит — редкая находка при HSP.
При AGN важно очень тщательное обследование кожи. Сыпь, вызванная HSP, хотя и характерна при ярком цвете, вначале может быть едва заметной и ограничиваться ягодицами или тыльной стороной стопы. Некоторый периферический отек из-за задержки соли и воды наблюдается при AGN, но это, как правило, более тонкий «мускулистый» отек, чем точечный отек, характерный для нефротического синдрома.
Вовлечение суставов возникает при некоторых мультисистемных нарушениях с AGN. Маленький сустав (например, пальцы) более типичен для СКВ, тогда как поражение коленного сустава наблюдается при HSP.
4. Лабораторная оценка
Очевидно, что хороший анализ мочи — это первая задача при оценке ребенка с подозрением на AGN. Наличие слепков красных кровяных телец, хотя и не всегда, является диагностическим признаком гломерулонефрита, если они есть [8]. AGN — это воспалительный процесс, поэтому нет ничего необычного в том, чтобы увидеть лейкоциты в почечной моче.К сожалению, это иногда приводит к неправильному диагнозу инфекции мочевыводящих путей.
Протеинурия также почти неизменна для AGN, хотя любая причина макрогематурии может привести к определенному количеству белка в моче. Однако, если моча не сильно кровоточит, сочетание гематурии и протеинурии практически всегда означает гломерулонефрит.
Первичный анализ крови, необходимый при подозрении на AGN, фактически ограничен; например, более сложные иммунологические исследования на самом деле являются исследованиями «второго уровня» после того, как известны первоначальные результаты.Очевидно, что оценка функции почек и электролитов является важным первым шагом, как и получение гемограммы. Легкая степень анемии часто наблюдается при AGN и, вероятно, является разжижающей; более серьезная анемия может свидетельствовать о том, что этот процесс может быть более хроническим. Как правило, при большинстве причин AGN нет важных изменений в количестве лейкоцитов или тромбоцитов. Нормальное количество тромбоцитов при наличии петехий и пурпуры — обычная находка при HSP.
Помимо этих основных тестов, только некоторые другие полезны при первоначальной оценке.Обычно в состав входит сывороточный альбумин; небольшая степень гипоальбуминемии типична для многих воспалительных процессов, таких как HSP, но значения <2,0 г / дл довольно необычны для простого AGN и указывают на процесс с компонентом нефротического синдрома. Безусловно, самый важный (и часто забываемый) тест, который нужно пройти изначально, - это оценка системы комплемента. Обычно это означает получение сыворотки C3 и C4; общий гемолитический комплемент («CH50») обычно представляет только исторический интерес.Постстрептококковое AGN характеризуется очень низким C3, иногда с минимальным снижением C4 [9]. Последнее очень преходяще и, вероятно, связано с активацией криоглобулинами III типа.
Невозможно переоценить важность своевременного измерения C3. Гипокомплементемия постстрептококкового AGN быстро проходит, обычно нормализуется через шесть-восемь недель. С другой стороны, нарушения мочеиспускания могут сохраняться намного дольше. Таким образом, если у ребенка с отклонениями от нормы в моче в течение нескольких недель ранее не проводилось измерение C3, без биопсии почки с уверенностью поставить диагноз постстрептококкового AGN может быть невозможно.
Все эти тесты должны быть легко получены в учреждении первичной медико-санитарной помощи и обычно позволяют идентифицировать ребенка, которому необходимо направление.
5. Офис-менеджмент
Некоторым детям с AGN требуется немедленное направление к детскому нефрологу. Ребенок с тяжелой гипертензией (более чем на 5 мм выше 99-го процентиля), особенно если он сопровождается какими-либо неврологическими жалобами, должен быть немедленно направлен. Аналогичным образом, дети со значительной почечной недостаточностью должны пройти обследование у специалиста.Когда AGN сопровождается нефротическим синдромом, дополнительные диагностические и терапевтические вмешательства также выходят за рамки типичной практики первичной медико-санитарной помощи.
Однако, помимо этих ситуаций, со многими такими детьми можно разумно обращаться в учреждениях первичной медико-санитарной помощи. Ребенок с AGN в условиях HSP, например, с нормальным давлением, с нормальной функцией почек и не нефротическим, требует немногого, кроме тщательного серийного наблюдения. Хотя нарушения мочеиспускания могут сохраняться в течение некоторого времени после того, как остальная часть болезни разрешится, у таких детей практически нет риска необратимого повреждения почек.
Многие дети с постстрептококковой АЯГ также могут наблюдаться в условиях первичной медико-санитарной помощи, но это потребует проведения серийных обследований. Основной угрозой для таких детей является гипертония и ее осложнения, которые могут развиваться в течение нескольких дней. При типичном постстрептококковом АГН с минимальной гипертензией (например, артериальное давление между 95-м и 99-м процентилями) и без почечной недостаточности целесообразна терапия петлевым диуретиком с ежедневной перепроверкой артериального давления.
Нарушения мочевыделения при постстрептококковой АГН могут сохраняться в течение длительного времени, даже года. Лучший показатель излечения болезни — возвращение уровня С3 в норму. Обычно это происходит в течение 6-8 недель. Устойчивое снижение C3 к этому времени заслуживает обращения, поскольку это может быть индикатором того, что AGN на самом деле было первоначальным проявлением более хронического процесса, такого как MPGN [10].
Гломерулонефрит — Заболевания почек и мочевыводящих путей
Врачи исследуют возможность острого гломерулонефрита у людей, у которых развиваются симптомы, указывающие на это заболевание.Они также исследуют возможность у людей, результаты лабораторных анализов (которые могут быть выполнены для оценки неспецифических симптомов или как часть обычного медицинского обследования) указывают на дисфункцию почек или наличие крови в моче. Лабораторные тесты показывают различное количество белка и клеток крови в моче и часто нарушение функции почек, о чем свидетельствует высокая концентрация мочевины и креатинина (продуктов жизнедеятельности) в крови.
У людей с быстро прогрессирующим гломерулонефритом цилиндры (скопления эритроцитов или лейкоцитов) часто видны в образце мочи, который исследуют под микроскопом.Анализы крови обычно выявляют анемию.
Когда врачи подозревают гломерулонефрит, обычно проводится биопсия почки, чтобы подтвердить диагноз, помочь определить причину и определить количество рубцов и вероятность обратимости. Биопсия почки проводится путем введения иглы в одну из почек под контролем УЗИ или компьютерной томографии (КТ) для получения небольшого количества почечной ткани. Хотя биопсия почки является инвазивной процедурой и иногда может вызывать осложнения, обычно она безопасна.
Хронический гломерулонефрит развивается постепенно, поэтому врач не может точно сказать, когда он начался. Это может быть обнаружено, когда анализ мочи, сделанный в рамках медицинского обследования, выявляет присутствие белка и клеток крови в моче у человека, который чувствует себя хорошо, имеет нормальную функцию почек и не имеет симптомов. Врачи обычно проводят визуализацию почек, такую как УЗИ или КТ.
Биопсия почки — самый надежный способ отличить хронический гломерулонефрит от других заболеваний почек.Однако биопсия редко проводится на поздних стадиях. В этих случаях почки сморщиваются и покрываются рубцами, и шанс получить конкретную информацию о причине невелик. Врачи подозревают, что почки сморщены и покрыты рубцами, если функция почек была плохой в течение длительного времени, а при визуализации почки выглядят аномально маленькими.
Иногда могут помочь дополнительные тесты для определения причины. Например, при диагностике постинфекционного гломерулонефрита посев из горла может предоставить доказательства стрептококковой инфекции.Уровни антител к стрептококкам в крови могут быть выше нормы или постепенно увеличиваться в течение нескольких недель. Острый гломерулонефрит, который следует за инфекцией, отличной от ангины, обычно легче диагностировать, потому что его симптомы часто начинаются, когда инфекция еще очевидна.
