Церебральная ишемия у новорожденных детей
ЦЕРЕБРАЛЬНАЯ ИШЕМИЯ — диагноз, который могут поставить врачи новорожденным малышам в роддоме. Возникает она из-за недостаточного снабжения клеток головного мозга кислородом. Причина, способствующая этой нехватке, может появиться как во время беременности мамы, так и во время рождения ребенка.
Одним из первых тестов, которыми пользуются врачи сразу после рождения малыша — является всем известная оценка ребенка по шкале Апгар. По количеству баллов судят о состоянии малыша. Чем ниже балл, тем тяжелее состояние ребенка, тем больше вероятность данного диагноза. Диагноз церебральная ишемия новорожденных используют врачи в первый месяц жизни ребенка и делят патологию по тяжести на три степени. От степени тяжести зависит лечение ребенка.
Самая легкая – это 1 степень, как правило, отмечается легкая неврологическая симптоматика, например, в виде повышенной возбудимости ребенка и малыш не нуждается в стационарном лечении. А вот при второй, особенно третей степени решается вопрос о госпитализации малыша в специализированное отделение стационара.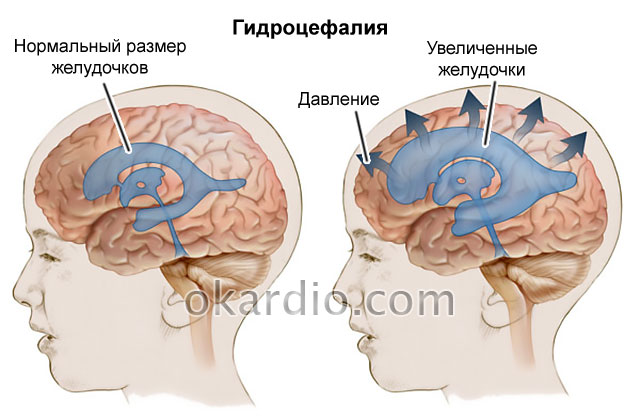 Первый месяц — это острое состояние. Со второго месяца жизни до достижения 1 года идет период восстановления пострадавшей от ишемии нервной системы, и невролог в диагнозе гипоксически-ишемическое поражение цнс выделяет ведущие синдромы и лечение подбирает в соответствии с этим. Одно из тяжелых последствие церебральной ишемии – это детский церебральный паралич, делающий ребенка инвалидом детства.
Первый месяц — это острое состояние. Со второго месяца жизни до достижения 1 года идет период восстановления пострадавшей от ишемии нервной системы, и невролог в диагнозе гипоксически-ишемическое поражение цнс выделяет ведущие синдромы и лечение подбирает в соответствии с этим. Одно из тяжелых последствие церебральной ишемии – это детский церебральный паралич, делающий ребенка инвалидом детства.
В этом втором промежутке времени будет очень важно участие родителей в процессе восстановительного лечения. Необходимо наблюдение невролога, обязательны дополнительные ультразвуковые исследования головного мозга. По результатам осмотра и исследований невролог может направить вас с ребёнком на прием к остеопату, так же может назначит курс лекарственных препаратов. Чаще всего препараты эти из группы сосудистых, ноотропных препаратов, а также из группы витаминов или мочегонных. В некоторых сложных случаях малыши нуждается в повторной госпитализации в стационар для назначения противосудорожной терапии, внутримышечных инъекций и капельниц.
Что же требуется от родителей?
Во-первых -это внимательное отношение к своему малышу. Наблюдение за ребенком в течение дня, за его сном и бодрствованием, за его психическим и двигательным развитием, за реакцией на окружающее воздействие. Не пренебрегайте назначениями лечащего врача. При плановом посещении невролога рассказывайте о своих наблюдениях за ребенком, это поможет скорректировать назначения.
Такая информация может потребоваться и остеопату. После первичной консультации у остеопата, где отводится время на сбор всех имеющихся данных и непосредственную остеопатическую диагностику, определяется тактика ведения ребенка. Чаще одной процедуры коррекции найденных дисфункций бывает недостаточно, и тогда остеопат назначит повторный прием, который может быть спустя 1 -3 недели.
Какие изменения после лечения у остеопата наблюдают родители у ребенка? Чаще всего это улучшение сна, уменьшение немотивированного плача, срыгиваний, положительные сдвиги в предречевом и моторном развитии. Невролог наблюдает положительную динамику при неврологическом осмотре, у него появляется возможность уменьшить лекарственную нагрузку на ребенка.
Невролог наблюдает положительную динамику при неврологическом осмотре, у него появляется возможность уменьшить лекарственную нагрузку на ребенка.
Автор публикации: Гореликова Елена Аркадьевна
Врач-остеопат, детский невролог.
Специалист Центра детского коррекционного развития и нейропсихологии
ЭЭГ новорожденных с церебральной ишемией после терапевтической гипотермии
ЭЭГ новорожденных с церебральной ишемией после терапевтической гипотермии
Одной из актуальных проблем неонатологии и педиатрии является гипоксически-ишемическая энцефалопатия, развивающаяся вследствие перенесенной интранатальной асфиксии. В настоящий момент основным способом нейропротекторной защиты головного мозга считается терапевтическая гипотермия — наиболее эффективная и безопасная методика, позволяющая снизить неблагоприятные последствия поражения центральной нервной системы.
Специалисты ФГБОУ ВО «Курский государственный медицинский университет» МЗ РФ провели исследование результатов 30 электроэнцефалограмм новорожденных со сроком гестации более 36 недель, перенесших умеренную или тяжелую интранатальную асфиксию с диагнозом церебральная ишемия 2–3-й степени.
В течение первых двух часов после рождения новорожденные с интранатальной асфиксией и с выявленными показаниями к проведению процедуры начинали получать в качестве лечения контролируемое индуцируемое снижение центральной температуры тела до 33,5 °С в течение 72 ч. Терапия проводилась неинвазивным методом с помощью аппарата, состоящего из блока системы охлаждения-согревания на водной основе и теплообменного одеяла, которым покрывалось не менее 70 % площади поверхности тела для снижения температуры с оптимальной скоростью.
По окончании терапевтической гипотермии пациентам проводилось согревание с повышением центральной температуры не более 0,5 °С в час, до ректальной температуры 37 °С. При удовлетворительном состоянии ребенка длительность фазы согревания составляла в среднем 7–9 часов.
Авторами выявлено, что в 87 % случаев гипоксически-ишемического поражения мозга после проведения терапевтической гипотермии общее состояние новорожденных улучшилось, картина ЭЭГ имеет положительную динамику: сохранена синхронность разрядов вспышек, четко прослеживается чередование циклов сонбодрствование, эпилептиформной активности не зарегистрировано.
Достаточно высокую эффективность проводимого лечения можно оценить и на фоне неврологического статуса новорожденных. У всех детей с церебральной ишемией 2–3-й стадии наблюдалась типичная картина: на момент рождения до проведения терапевтической гипотермии общее состояние тяжелое. Спонтанная двигательная активность снижена. Мышечный тонус дистоничен с преобладанием диффузной гипотонии конечностей. Мышечная сила снижена. Рефлексы конечностей вызываются, снижены, симметричны. Рефлексы новорожденных все отрицательные. На болевой раздражитель реакция движением (сгибание стопы).
При осмотре на 7-е сутки после рождения во всех исследуемых случаях наблюдалась следующая клиническая картина: общее состояние средней степени тяжести, с положительной динамикой, спонтанная двигательная активность достаточная. Мышечный тонус дистоничен с преобладанием умеренного флексорного гипертонуса конечностей. Мышечная сила сохранена, все рефлексы новорожденных положительны. То есть клинически проявляется положительная динамика неврологического состояния новорожденных с гипоксически-ишемическими поражениями после проведения лечебной гипотермии.
Достоверным подтверждением результатов исследования являются результаты ЭЭГ, позволяющей оценить динамику функционального состояния мозга новорожденного на протяжении всего периода болезни вне зависимости от активности ребенка. Несмотря на положительную клиническую картину, необходимо более информативное и доказательное подтверждение эффективности проводимого лечения, в чем и состоит особенность и важность ЭЭГ как метода исследования. ЭЭГ позволяет оценить не только эффективность терапевтической гипотермии, но и особенности электрогенеза развивающегося мозга. аЭЭГ позволяет в ранние сроки выявить судорожную активность, в первую очередь, субклиническую, не сопровождающуюся клиническими проявлениями. Известно, что судорожная активность ухудшает неврологический прогноз детей, перенесших гипоксически-ишемическую энцефалопатию. аЭЭГ обладает рогностической ценностью эффективности лечебной гипотермии которая выражается в восстановлении тренда до прерывистого паттерна.
Таким образом, авторами установлено, что понижение температуры мозга способно ограничить развитие всех основных патогенетических механизмов повреждения нейронов головного мозга, то есть системная лечебная гипотермия вызывает регресс неврологических нарушений, способствуя довольно быстрому восстановлению структур ЦНС и значительно меньшему их повреждению в результате перенесенной интранатальной асфиксии.
Источник: «Особенности ЭЭГ новорожденных с церебральной ишемией после терапевтической гипотермии» И.Г. Хмелевская, Н.С. Разинькова, О.Г. Бец, А.В. Серёжкина, Т.А. Миненкова, С.Г. Боева
http://vestnik.volgmed.ru/ru/issue/322/ №3 2019 (71)
https://www.volgmed.ru/uploads/journals/articles/1570428099-vestnik-2019-3-3419.pdf (статья)
Метки: научные исследования, неонатология
06.04.2020
Церебральная гемодинамика у детей группы высокого риска в неонатальном периоде | Тумаева
1. Стародубов В.И., Цыбульская И.С., Суханова Л.П. Охрана здоровья матери и ребенка как приоритетная проблема современной России. Современные медицинские технологии 2009; 2: 11–16. (Starodubov V.I., Tsybul’skaya I.S., Sukhanova L.P. Maternal and child health as a priority problem of modern Russia. Sovremennye meditsinskie tekhnologii 2009; 2: 11–16.)
2. Суханова Л.П., Кузнецова Т.В. Перинатальные проблемы воспроизводства населения России (по данным анализа статистических форм №№13,32). Социальные аспекты здоровья населения 2010; 4: 16. http://vestnik.mednet.ru/component/option,com_weblinks/Itemid,23/lang,ru/ (Sukhanova L.P., Kuznetsova T.V. Perinatal problems of reproduction of the population of Russia (according to the analysis of statistical forms №№13,32). Sotsial’nye aspekty zdorov’ya naseleniya 2010; 4: 16. http://vestnik.mednet.ru/component/option,com_weblinks/Itemid,23/lang,ru/)
Суханова Л.П., Кузнецова Т.В. Перинатальные проблемы воспроизводства населения России (по данным анализа статистических форм №№13,32). Социальные аспекты здоровья населения 2010; 4: 16. http://vestnik.mednet.ru/component/option,com_weblinks/Itemid,23/lang,ru/ (Sukhanova L.P., Kuznetsova T.V. Perinatal problems of reproduction of the population of Russia (according to the analysis of statistical forms №№13,32). Sotsial’nye aspekty zdorov’ya naseleniya 2010; 4: 16. http://vestnik.mednet.ru/component/option,com_weblinks/Itemid,23/lang,ru/)
3. Raju Tonse N.K., Ariagno R.L, Higgins R. et al. Research in Neonatology for the 21st Century. Pediatrics 2005; 115: 468–474.
4. Савельева Г.М., Шалина Р.И., Сичинава Л.Г. и др. Акушерство. М.: ГЭОТАР-Медиа, 2010; 656. (Savel’eva G.M., Shalina R.I., Sichinava L.G. et al. Obstetrics. M.: GEHOTАRMedia, 2010; 656. )
)
5. Степаненко Т.А., Павлова Т.В., Петрухин В.А. и др. Проблемы перинатальных потерь при операции кесарева сечения. Системный анализ и управление в биомедицинских системах 2009; 8: 1: 41–44. (Stepanenko T.А., Pavlova T.V., Petrukhin V.А. et al. Problems of perinatal loss at caesarean section. Sistemnyj analiz i upravlenie v biomeditsinskikh sistemakh 2009; 8: 1: 41–44.)
6. Signore C., Klebanoff M. Neonatal morbidity and mortality after elective cesarean delivery. Clin Perinatol 2008; 35: 2: 361–371.
7. Bodner K., Wierrani F., Grunberger W. et al. Influence of the mode of delivery on maternal and neonatal outcomes: a comparison between elective cesarean section and planned vaginal delivery in a low-risk obstetric population. Arch Gynecol Obstet 2011; 283:1193–1198.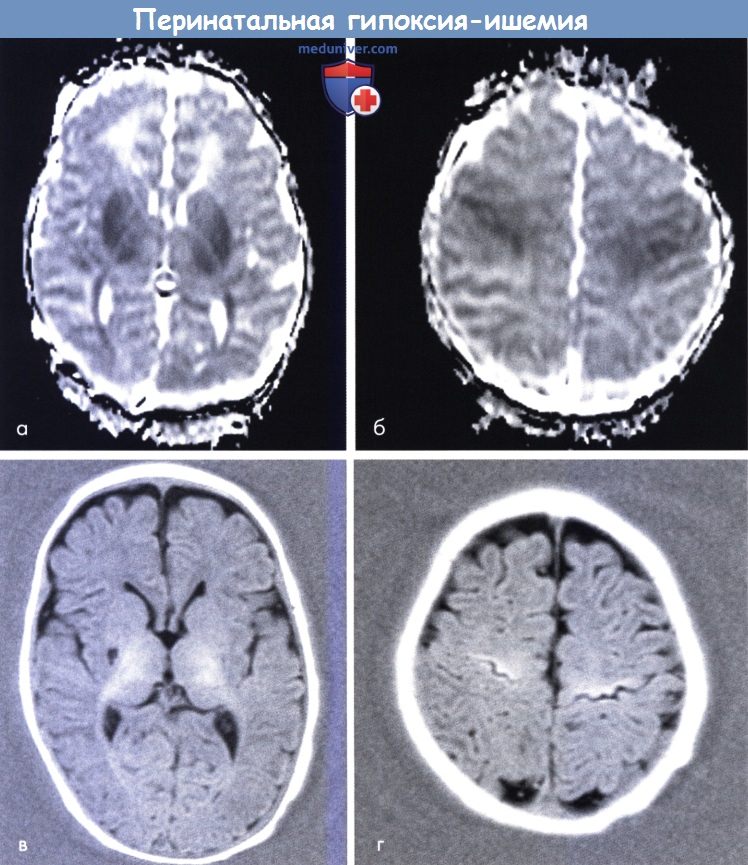
8. Кулаков В.И., Барашнев В.И. Новорожденные высокого риска. М.: ГЭОТАР-Медиа 2006: 528. (Kulakov V.I., Barashnev V.I. Newborns at high risk. M.: GEHOTАRMedia 2006: 528.)
9. Суханова Л.П. Здоровье новорожденных детей России. М.: Канон+ 2007; 324. (Sukhanova L.P. Health Russian newborns. M.: Kanon+ 2007; 324.)
10. Гавриков Л.К., Прохорова Л.И., Давыдова А.Н. и др. Изучение особенностей формирования соматической патологии у детей с перинатальными нарушениями церебральных механизмов регуляции. Бюллетень Волгоградского научного центра РАМН 2009; 4: 37–40. (Gavrikov L.K., Prokhorova L.I., Davydova А.N. et al. The study of the formation of somatic pathology in children with perinatal lesions of the cerebral mechanisms of regulation. Byulleten’ Volgogradskogo nauchnogo tsentra RАMN 2009; 4: 37–40. )
)
11. Соколовская Т.А. Влияние перинатальной патологии на заболеваемость и инвалидизацию детей. Автореф. дисс. … канд. мед. наук. М., 2009; 25. (Sokolovskaya T.А. Influence of perinatal pathology morbidity and disability of children. Аvtoref. diss. … kand. med. nauk. M., 2009; 25.)
12. Медведев М.И., Дегтярева М.Г., Горбунов А.В. и др. Последствия перинатальных гипоксически-ишемических поражений головного мозга у доношенных новорожденных: диагностика и принципы восстановительного лечения. Педиатрия 2011; 90: 1: 66–70. (Medvedev M.I., Degtyareva M.G., Gorbunov А.V. et al. The consequences of perinatal hypoxic-ischemic brain damage in preterm infants: diagnosis and principles of rehabilitation treatment. Pediatriya 2011; 90: 1: 66–70.)
13. Зедгенизова Е. В., Иванов Д.О., Прийма Н.Ф. и др. Особенности показателей мозгового кровотока и центральной гемодинамики у детей, родившихся с задержкой внутриутробного развития (ЗВУР). Бюллетень федерального центра сердца, крови и эндокринологии им. В.А. Алмазова 2012; 3: 76–82. (Zedgenizova E.V., Ivanov D.O., Prijma N.F. et al. Features indices of cerebral blood flow and central hemodynamics in children born with intrauterine growth retardation. Byulleten’ federal’nogo tsentra serdtsa, krovi i ehndokrinologii im. V.А. Аlmazova 2012; 3: 76–82.)
В., Иванов Д.О., Прийма Н.Ф. и др. Особенности показателей мозгового кровотока и центральной гемодинамики у детей, родившихся с задержкой внутриутробного развития (ЗВУР). Бюллетень федерального центра сердца, крови и эндокринологии им. В.А. Алмазова 2012; 3: 76–82. (Zedgenizova E.V., Ivanov D.O., Prijma N.F. et al. Features indices of cerebral blood flow and central hemodynamics in children born with intrauterine growth retardation. Byulleten’ federal’nogo tsentra serdtsa, krovi i ehndokrinologii im. V.А. Аlmazova 2012; 3: 76–82.)
14. Gerda van Wezel-Meijler. Neonatal cranial ultrasonography. Springer, 2007; 168.
15. Benavides-Serralde A., Scheier M., Cruz-Martinez R. et al. Changes in central and peripheral circulation in intrauterine growth-restricted fetuses at different stages of umbilical artery flow deterioration: new fetal cardiac and brain parameters. Gynecol Obstet Invest 2011; 71: 4: 274–280.
Gynecol Obstet Invest 2011; 71: 4: 274–280.
16. Fujioka T., Takami T., Ishii H. et al. Difference in Cerebral and Peripheral Hemodynamics among Term and Preterm Infants during the First Three Days of Life. Neonatology 2014; 106: 3:181–187.
17. Подлевских Т.С., Попова И.В., Токарев А.Н. и др. Клинико-диагностическая характеристика внутрижелудочковых кровоизлияний в неонатальном периоде. Детская больница 2012: 1: 35–39. (Podlevskikh T.S., Popova I.V., Tokarev А.N. et al. Clinical and diagnostic characteristics of intraventricular hemorrhage in the neonatal period. Detskaya bol’nitsa 2012: 1: 35–39.)
18. Michoulas A., Basheer S.N., Roland E.H. et al. The role of hypoxia-ischemia in term newborns with arterial stroke. Pediatr Neurol 2011; 44: 4: 254–258.
19. Зубарева Е.А. Комплексная ультразвуковая оценка перинатальных цереброваскулярных нарушений у детей первого года жизни. Автореф. дисс. … докт. мед. наук. Москва, 2006; 55. (Zubareva E.А. Complex ultrasonic estimation of perinatal cerebrovascular disorders in children in the first year of life. Аvtoref. diss. … dokt. med. nauk. Moskva, 2006; 55.)
20. Liu J., Cao Y.H., Meng F.H. et al. The Role and Mechanism of IL-6, IL-8 and TNF-α for Regulating Cerebral Hemodynamics in Term Infants With Hypoxic-Ischemic Encephalopathy. J Turkish-German Gynecol Assoc 2007; 8: 1: 63–66.
21. Brew N., Walker D., Wong Flora Y. Cerebral vascular regulation and brain injury in preterm infants. American Journal of Physiology 2014; 306: 11: 773–786.
22. Liu J., Li J., Gu M. The correlation between myocardial function and cerebral hemodynamics in term infants with hypoxicischemic encephalopathy. J Trop Pediatr 2007; 53: 1: 44–48.
Liu J., Li J., Gu M. The correlation between myocardial function and cerebral hemodynamics in term infants with hypoxicischemic encephalopathy. J Trop Pediatr 2007; 53: 1: 44–48.
23. Nade`ge Roche-Labarbe, Fenoglio A., Aggarwal A. et al. Nearinfrared spectroscopy assessment of cerebral oxygen metabolism in the developing premature brain. Journal of Cerebral Blood Flow & Metabolism 2012; 32: 481–488.
24. Рычкова И.В., Зубарева Е.А., Зубарев А.Р. Транскраниальное дуплексное сканирование у детей (возрастные особенности артериального кровотока). Ультразвуковая и функциональная диагностика 2005; 4: 52–57. (Rychkova I.V., Zubareva E.А., Zubarev А.R. Transcranial duplex scanning in children (age characteristics of blood flow). Ul’trazvukovaya i funktsional’naya diagnostika 2005; 4: 52–57.)
25. Долгих Г.Б. Транскраниальная допплерография в диагностике венозных дистоний у детей грудного возраста. Педиатрия 2006; 3: 30–34. (Dolgikh G.B. Transcranial Doppler ultrasonography in the diagnosis of venous dystonia in infants. Pediatriya 2006; 3: 30–34.)
Долгих Г.Б. Транскраниальная допплерография в диагностике венозных дистоний у детей грудного возраста. Педиатрия 2006; 3: 30–34. (Dolgikh G.B. Transcranial Doppler ultrasonography in the diagnosis of venous dystonia in infants. Pediatriya 2006; 3: 30–34.)
Антифосфолипидный синдром у беременной и глобальная церебральная ишемия у новорожденного: есть ли связь? | Гайнетдинова
1. Fleetwood T., Cantello R., Comi C. Antiphospholipid Syndrome and the Neurologist: From Pathogenesis to Therapy. Front Neurol 2018; 26(9): 1001. DOI: 10.3389/fneur.2018.01001
2. Mayer M., Cerovec M., Rados M., Cikes N. Antiphospholipid syndrome and central nervous system. Clin Neurol Neurosurg 2010; 112(7): 602—608. DOI: 10.1016/j.clineu-ro.2010.03.023
3. Abou-Nassar K., Carrier M., Ramsay T., Rodger M.A. The association between antiphospholipid antibodies and placenta mediated complications: a systematic review and meta-analysis. Thromb Res 2011; 128(1): 77-85. DOI: 10.1016/j.throm-res.2011.02.006
Abou-Nassar K., Carrier M., Ramsay T., Rodger M.A. The association between antiphospholipid antibodies and placenta mediated complications: a systematic review and meta-analysis. Thromb Res 2011; 128(1): 77-85. DOI: 10.1016/j.throm-res.2011.02.006
4. Benedetto C., Marozio L., Tavella A.M., Salton L., Grivon S., Di Giampaolo F. Coagulation disorders in pregnancy: acquired and inherited thrombophilias. Ann N Y Acad Sci 2010; 1205: 106-117. DOI: 10.1111/j.1749-6632.2010.05674.х
5. Topel C.H., Brey R.L. Antiphospholipid Antibody Syndrome. In: Primer on Cerebrovascular Diseases (Second edition). L. R. Caplan, J. Biller, M.C. Leary, E.H. Lo, A.J. Thomas, M. Yenari et al. (eds). San Diego: Academic Press, 2017; 590-594. DOI: 10.1016/B978-0-12-803058-5.00116-8
6. Tokushige S., Matsumoto H., Takemura T., Igeta Y., Hashi-da H. Secondary hypertrophic pachymeningitis in antiphospholipid syndrome. J Neuroimmunol 2012; 250(1-2): 115— 117. DOI: 10.1016/j.jneuroim.2012.05.006
Tokushige S., Matsumoto H., Takemura T., Igeta Y., Hashi-da H. Secondary hypertrophic pachymeningitis in antiphospholipid syndrome. J Neuroimmunol 2012; 250(1-2): 115— 117. DOI: 10.1016/j.jneuroim.2012.05.006
7. Muller-Calleja N., Rossmann H., Muller C, Wild P., Blanken-berg S., Pfeiffer N. et al. Antiphospholipid antibodies in a large population-based cohort: genome-wide associations and effects on monocyte gene expression. Thromb Haemost 2016; 116(1): 115-123. DOI: 10.1160/Th25-12-0947
8. Berman H., Ugarte-Gil M.F., Espinosa G., Tassies D., Mon-teagudo J., Reverter J.C. et al. Can inherited thrombophilia modulate the clinical phenotype of patients with antiphospholipid syndrome? Clin Exp Rheumatol 2013; 31(6): 926-932.
9. Sebastiani G.D., Iuliano A. , Cantarini L., Galeazzi M. Genetic aspects of the antiphospholipid syndrome: An update. Autoimmun Rev 2016; 15(5): 433-439. DOI: 10.1016/j.autrev.2016.01.005
, Cantarini L., Galeazzi M. Genetic aspects of the antiphospholipid syndrome: An update. Autoimmun Rev 2016; 15(5): 433-439. DOI: 10.1016/j.autrev.2016.01.005
10. Tanimura K., Jin H., Suenaga T., Morikami S., Arase N., Kishida K. et al. P2-Glycoprotein I/HLA class II complexes are novel autoantigens in antiphospholipid syndrome. Blood 2015; 125(18): 2835-2844. DOI: 10.1182/blood-2014-08-593624
11. Новик Г.А., Аббакумова Л.Н., Кикнадзе К.Г. Антифосфолипидный синдром у детей. Медицина неотложных состояний 2011; 37(6): 9-12.
12. Rana A., Musto A.E. The role of inflammation in the development of epilepsy. J Neuroinflammation 2018; 15(1): 144. DOI: 10.1186/s12974-018-1192-7
13. Saliba E., Debillon T., Auvin S., Baud O., Biran V., Chaber-naud J.-L. et al. Neonatal arterial ischemic stroke: Review of the current guidelines. Arch Pediatr 2017; 24(2): 180-188. DOI: 10.1016/j.arcped.2016.11.005
14. Gordon O., Almagor Y., Fridler D., Mandel A., Qutteineh H., Yanir A. et al. De novo neonatal antiphospholipid syndrome: a case report and review of the literature. Semin Arthritis Rheum 2014; 44(2): 241-245. DOI: 10.1016/j.semar-thrit.2014.04.003
15. Jasoni C.L., Sanders T.R., Kim D.W. Do all roads lead to Rome? The role of neuro-immune interactions before birth in the programming of offspring obesity. Frontiers in Neuroscience 2015; 9: 455. DOI: 10.3389/fnins.2014.00455
16. Ruiz-Irastorza G., Crowther M., Branch W., Khamashta M.A. Antiphospholipid syndrome. Lancet 2010; 376(9751): 1498— 1509. DOI: 10.1016/S0140-6736(10)60709-X
17. Lockshin M.D., Kim M., Laskin C.A., Guerra M., Branch D.W., Merrill J. et al. Prediction of adverse pregnancy outcome by the presence of lupus anticoagulant, but not anticardiolip-in antibody, in patients with antiphospholipid antibodies. Arthritis Rheum 2012; 64(7): 2311-2318. DOI: 10.1002/art.34402
18. Moroni G., Doria A., Giglio E., Tani C., Zen M., Strigini F. et al. Fetal outcome and recommendations of pregnancies in lupus nephritis in the 21st century. A prospective multicenter study. J Autoimmun 2016; 74: 6-12. DOI: 10.1016/j.jaut.2016.07.010
19. Ergaz Z., Ornoy A. Perinatal and early postnatal factors underlying developmental delay and disabilities. Dev Disabil Res Rev 2011; 17(2): 59-70. DOI: 10.1002/ddrr.1101
20. Canaud G. New insights in the antiphospholipid syndrome associated vasculitis: the role of the AKT/mTORC pathway. Rev Med Interne 2015; 36(7): 439-443. DOI: 10.1016/j.revmed.2015.02.006
21. Гайнетдинова Д.Д., Тухфатуллина С.И. Клиническое и доплерографическое исследование женщин с цефалгией и антифосфолипидным синдромом. Журнал неврологии и психиатрии им. С.С. Корсакова 2019; 119(7): 34-39. DOI: 10.17116/jnevro201911907148
22. Di Prima F.A., Valenti O., Hyseni E., Giorgio E., Faraci M., Renda E. et al. Antiphospholipid Syndrome during pregnancy: the state of the art. J Prenat Med 2011; 5(2): 41-53.
Как проявляется церебральная ишемия у новорожденных
Ишемия головного мозга, или церебральная ишемия — это заболевание характеризующееся недостаточностью либо полным прекращением снабжения мозга кислородом.
Что касается ишемии новорожденных, на данный момент это считается достаточно серьезной патологией. Как правило, ишемия возникает вследствие дефицита кислорода, что приводит к необратимой гибели нейронов и некрозам различной тяжести.
Медики различают три степени церебральной ишемии: легкая, среднетяжелая и тяжелая. В свою очередь, легкая степень характеризуется излишним возбуждением ребенка в первые дни жизни. Если к этому прибавляются периодически повторяющиеся судороги, диагносцируют среднетяжелую степень. К проявлению тяжелой степени ишемии можно отнести развитие очаговых судорожных припадков, а также нарушение слуха и зрения.
Как правило, одной из основных причин считается возраст матери. Доказано, что у женщин старше 35 лет на 30% чаще рождаются дети с данной патологией. Однако, это не значит, что если женщина моложе этого возраста, у нее не может родиться ребенка с данным отклонением.
Кроме того, одной из причин могут быть осложнения во время родов или беременности. Такая патология часто бывает у недоношенных детей, а также при преждевременных родах или отслойке плаценты.
Первым признаком проявления данной патологии является повышенная возбудимость (или пониженная), при которой может наблюдаться излишний тонус мышц (или недостаток). Как правило, ребенок плохо реагирует на движения и не проявляет активности. Помимо этого, могут значительно снизиться рефлексы глотания и сосания.
В некоторых случаях, особенно при патологической беременности, возможно косоглазие и ассиметрия лица. Очень часто у таких детей сильно увеличен родничок.
Самым тяжелым осложнением считается коматозный синдром, при котором ребенок полностью не координирует свои движения, что говорит о нарушении связи с головным мозгом. Как правило, такие дети либо умирают, либо имеют достаточно серьезные патологии развития.
Однако, современная медицина не стоит на месте. Проведены уже сотни операций, которые прошли с значительными успехами. Такие операции помогают не только выживать детям с данной патологией, но и вести полноценную жизнь.
ЦЕРЕБРАЛЬНАЯ ИШЕМИЯ У ГРУДНИЧКА КОМАРОВСКИЙ
В области перинатальной неврологии такая патология, как ишемия головного мозга у новорождённых, рассматривается как серьёзная проблема. В медицине её ещё называют церебральной ишемией.
Дорогие читатели! Наши статьи рассказывают о типовых способах решения проблем со здоровьем, но каждый случай носит уникальный характер.
Если вы хотите узнать, как решить именно Вашу проблему — начните с программы похудания. Это быстро, недорого и очень эффективно!
Узнать детали
Церебральная ишемия у новорожденных — не приговор! Способы эффективного лечения
В области перинатальной неврологии такая патология, как ишемия головного мозга у новорождённых, рассматривается как серьёзная проблема. В медицине её ещё называют церебральной ишемией. Связано это с тем, что при современных технологиях и новейших разработках в данной сфере отсутствуют эффективные способы лечения этой болезни при третьей степени тяжести. Характеризуется она гипоксией недостаточным снабжением кислорода или аноксией полным прекращением подачи кислорода головного мозга.
Чтобы избежать патологии, молодые родители должны быть в курсе, какие факторы могут спровоцировать данное заболевание. Во всех случаях ишемия головного мозга у детей — это следствие дефицита кислорода. Основными причинами гипоксии могут стать:. Главным фактором, под действием которого диагностируется ишемия головного мозга, является серьёзное нарушение кровообращения между плацентой и маткой.
Оно влечёт за собой омертвление определённых участков мозга и гипоксию. Проявления заболевания могут быть разные в каждом отдельном случае, поэтому требуется тщательная и детальная диагностика. Среди симптомов детской ишемии головного мозга наиболее яркими и распространёнными являются:. Таким образомишемия мозга у ребёнка проявляется уже в первые часы его жизни. В роддоме чаще всего уже предполагают о наличии такого диагноза у малыша, особенно если беременность и роды сопровождались патологиями и гипоксией плода.
Однако все эти признаки могут проявляться у новорождённых в разной степени. В медицине различаются три степени детской ишемии головного мозга. Самая лёгкая степень, которая характеризуется угнетением или возбуждением ребёнка в первую неделю жизни. Чаще всего признаки проходят при быстром и своевременном реагировании врачей без серьёзных последствий для маленького организма.
Если у новорождённого наблюдаются судороги и остальные симптомы более недели, врачи диагностируют среднетяжёлую степень заболевания. Она, как и 1-ая степень, излечима при адекватной терапии. Малышей, страдающих ишемией 3-ей степени, помещают в реанимацию. Чаще всего такая форма заболевания приводит к патологическому, трудно поддающемуся лечению поражению всей центральной нервной системы. Это проявляется в атаксии, задержке психомоторного развития, нарушении зрения и слуха, очаговых судорожных припадках.
В зависимости от той или иной степени ишемии у новорождённых проводятся комплексные меры лечения. В современной педиатрии ишемия сосудов головного мозга у новорожденных успешно лечится при своевременной постановке диагноза и лёгкой степени заболевания.
Основная задача терапии — восстановление кровообращения, своевременная реанимация повреждённых участков головного мозга и спасение остальных. Методик немного:. Ишемия головного мозга у новорождённого — серьёзное заболевание, которое лечится только при своевременном и правильном лечении. Последствия патологии определяются её тяжестью. Последствия ишемии головного мозга у детей зависят от степени тяжести заболевания, наличия сопутствующих патологий, эффективности проводимой терапии.
После интенсивного курса лечения нужен реабилитационный период, от которого также будут зависеть прогнозы. Среди самых распространённых последствий отмечают:. Проблема ишемии у новорожденных в современной педиатрии достаточно актуальна. Заболевание в ряде случаев становится причиной инвалидности, оборачивается для ребёнка неспособностью к дальнейшей социальной адаптации. Комплексное лечение тяжёлых форм ишемии, её последствий — это процесс длительный и сложный, который требует усилий, терпения и внимания врачей, а также родителей.
Ишемия у новорожденного является послеродовой патологией, которая характеризуется недостаточным кислородным питанием головного мозга. Данная болезнь в большинстве случаев встречается именно у малышей, а причиной развития этой патологии могут быть самые различные причины.
О том, что это такое, а также о возможных последствиях и основных методах лечения этого заболевания, и пойдет речь. Ишемии головного мозга у новорожденных возникают из-за гипоксии, которая происходит в процессе беременности, либо в момент рождения ребенка.
К сожалению, на сегодняшний момент не существует единого метода лечения этого заболевания, но определенная терапия способствует улучшению состояния детей. Данное заболевание может быть разной степени, поэтому специалисты выделяют определенную классификацию, которая характеризуется различными симптомами и стадиями болезни. Медицинские работники различают всего несколько стадий развития болезни:. Первые две степени хорошо поддаются лечению, если оно было начато вовремя.
После прохождения терапии малыш будет полностью здоровым, без видимых отклонений и патологий. Что же касается последней степени, то ее течение оказывает негативное влияние, в результате которого оказывается уязвимой центральная нервная система ребенка. Наблюдаются явные отклонения в развитии, а также ухудшение зрения и слуха.
Ишемия головного мозга у новорожденного является следствием недостатка кислорода, от чего и происходят все негативные последствия. К прочим факторам, которые могут косвенно повлиять на эту патологию, относятся:. Помимо этих возможных причин развития ишемии, специалисты выделяют основной фактор, который в большинстве случаев провоцирует появление этого заболевание. Речь идет о нарушении кровообращения между маткой и плацентой, в результате чего происходит гипоксия и омертвление отдельных клеток мозга.
Один из возможных вариантов развития событий в таком случае — это летальный исход. Ишемия сосудов головного мозга, диагностированная у новорожденных, обладает различной степенью влияния на организм ребенка. Соответственно, и само лечение будет зависеть от стадии болезни, а также тех симптомах, которые наблюдаются у малыша. Ишемия головного мозга у новорожденных вызывает различные последствия, поэтому и лечение должно начинаться сразу же.
В результате течения этой болезни оказываются пораженными отдельные участки головного мозга. Современная медицина, несмотря на все ее достижения, попросту не может восстановить те клетки мозга, которые уже погибли. Нет ни чудодейственных лекарственных препаратов, ни специальных процедур, которые бы смогли их восстановить. Однако, не все так плохо, как может показаться на первый взгляд.
Есть определенные методы, которые могут остановить развитие заболевания, не дав ему перерасти в тяжелую степень. Также они способствуют скорейшей реабилитации ребенка, чтобы он мог чувствовать себя полноценно. Если ребенок не делает первый вздох после пары минут с момента рождения, то врачи начинают определенные реанимационные действия.
Для этого используется искусственная вентиляция легких, после чего, если все нормально, ребенку вместе с матерью переводят в палату. Если состояние по-прежнему тяжелое, то он отправляется в отделение интенсивной терапии, где за ним осуществляется самый пристальный уход и наблюдение.
Симптом, который является характерным для этого заболевания — это судороги конечностей. Для избавления от них используют фенобарбитал или фенитоин, которые также предотвращают дальнейшее поражение головного мозга. Помимо негативных последствий для головы, ишемия опасна и для сердца.
В частности, нередки случаи, когда развивается транзиторная ишемия миокарда у новорожденных. Для нормализации его работы назначаются добутамин , допамин и прочие препараты подобного типа. Стоит отметить, что медикаментозные средства назначаются только при явных поражающих факторах. Вообще, новорожденным не рекомендуется давать какие-то сильнодействующие лекарства, поэтому если у них наблюдается легкая форма заболевания, то может быть назначен лечебный массаж, задачей которого является нормализация кровообращения.
Только после того, как станет понятно, что массажные процедуры оказываются неэффективными, врач принимает решение о назначении лекарственных средств. Дальнейшее состояние ребенка полностью зависит от той степени заболевания, которая у него наблюдалась. Если у него была легкая стадия, то при правильном и своевременном лечении он сможет жить полноценной жизнью, без видимых поражений головного мозга.
Если же болезнь в достаточной степени запущена, то может наблюдаться ишемическое поражение ЦНС у новорожденных, которое характеризуется отклонениями в развитии и другими патологиями. Если лечение было начать поздно, либо оно было неэффективным, могут возникнуть следующие последствия болезни у ребенка:.
Этих вероятных последствий можно избежать, если начать лечение ишемии своевременно. В противном случае, если не лечить данный недуг, то иногда это может привести к трагическим последствиям.
Чтобы избежать все этих негативных проявлений, будет не лишним осуществлять различные профилактические меры, способствующие общем укреплению организма малыша, а также предотвращению развития болезни. Естественно, данные меры относятся к матери ребенка, ведь она оказывается ответственной за его дальнейшее здоровье.
Конечно, некоторые негативные факторы не в ее компетенции, то есть она не может изменить сложности при родовой деятельности, родовые травмы и т. Но, элементарный отказ от курения и спиртного, правильное питание и здоровый образ жизни — это то, что в силах сделать каждая женщина, которая действительно заботится и беспокоится о здоровье и состояние своего будущего ребенка. Ишемия головного мозга — ответ на кислородный голод в связи с сужением просвета или закупоркой артерий мозга.
Независимо от природы появления болезни, несвоевременно начатое лечение приводит зачастую к не хорошим последствиям. Ишемия головного мозга у новорожденного — результат гипоксии во время беременности и родов. В перинатальной неврологии эта проблема трудноразрешима, так как достаточно эффективного способа избавиться от нее до сих пор не существует. Первые две степени заболевания мозга в редких случаях считаются следствием развития неврологических патологий. И, если вовремя проведена адекватная терапия, функциональные симптомы заболевания исчезают полностью.
Тяжелое ишемическая дисфункция головного мозга способствует развитию отклонений со стороны нервной системы. Это ведет к дисфункции центральной нервной системы, в результате чего ребенок плохо развивается, у него происходят судороги, он хуже слышит и видит.
Ишемия головного мозга в грудничковом возрасте возникает как результат нехватки кислорода, которое возникло во время вынашивания ребенка или при его рождении. Нарушение кровообращения между маткой и плацентой — основной фактор гипоксии новорожденного.
Тем более, что именно головной мозг считается наиболее зависимым от недостатка кислорода. А в особо тяжелых проявлениях может произойти смерть отдельных клеток или целых участков головного мозга. Иногда у новорожденных детей диагностируется арахноидальная киста головного мозга.
Прочитав статью, вы узнаете, опасна ли она и как лечится. Миоклонии у детей довольно частое явление. Чаще всего они носят безобидный характер, а вот о том, когда следует обратиться к врачу, написано в разделе о невралгии. Любые отклонения у ребенка могут указывать на ишемию у новорожденного. Признаки дисфункции мозга у малышей разнообразны и явное отставание в развитии обязательно привлекут внимание родителей. К тому же резкая перемена поведения, потеря аппетита, постоянные капризы, частые срыгивания и реакция на смену погоды должны стать поводом для беспокойства.
Доктор комаровский ишемия головного мозга
Если врач выявит значительное отклонение показателей измерений, он должен сразу же вас отправить на МРТ головного мозга. Тогда уже будет ставиться вопрос о методах лечения и необходимости вмешательства. И не волнуйтесь — сейчас это успешно лечится. Раньше делали только шунтирование, а сейчас появилась других методов —гораздо более безопасных, например, с помощью эндоскопа. Моя школьная подруга — врач и как раз специализируется на лечении детских неврологических отклонений.
Доктор Комаровский — разочарование
Anonymous comments are disabled in this journal. Your IP address will be recorded. Log in No account? Create an account. Remember me. Facebook Twitter Google. Алена К.
Ишемия головного мозга и косоглазие
Сообщение lana! Скачивайте наши приложения. Прописали энцефабол попить месяц и прийти на контрольный осмотр. Что это такое? Если речь идет о вашем,4-х месячном ребенке,то падения в этом возрасте и даже удары головой не столь опасны из-за открытого родничка роль аммортизации. Судя по назначенному лечению опять же ничего страшного. Энцефабол-это производное витамина В6,ноотропный препапарат,улучшает питание и всякие обменные процессы в головном мозге. По мне-церебральная ишемия что то типа перинатальной энцефалопатии.
Способы эффективного лечения.
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: 10 признаков нарушения нервной системы у новорожденного которые Вы можете определить самостоятельно
Ваш IP-адрес заблокирован.
Головной мозг — это главный орган в организме. От его функционирования зависит работа всех систем органов, общее состояние и качество жизни. При развитии некоторых патологий мозг начинает страдать из-за недостатка кислорода, а это может привести к серьезным последствиям. Одним из таких заболеваний является церебральная ишемия 2 степени у новорожденных, последствия могут быть плачевными, если не предпринять срочных мер и не начать терапию.
Перинатальная гипоксия, повреждая цито-хемо-ангио-архитектонику нервной системы, приводит к полиорганным нарушениям, влияющим на адаптацию организма, степень тяжести и прогноз течения заболевания [1, 2].
.
ВИДЕО ПО ТЕМЕ: Гипоксия головного мозга у ребенка прошла, результат применение APL
Церебральная ишемия 1, 2, 3 степени у новорожденного: что это такое, последствия
Церебральная ишемия – состояние, которое чаще развивается на фоне перенесенной интранатальной (в период родов) асфиксии. Патология известна так же как гипоксически-ишемическая энцефалопатия. Это название в полной мере отражает патологические процессы, вовлеченные в патогенез – гипоксию (кислородная недостаточность), ишемию (изменения, произошедшие в нервной ткани вследствие дефицита кислорода), энцефалопатию (мозговая дисфункция).
Характеристика и степени
Церебральная ишемия – это такая патология, которая отражает последствия кислородной недостаточности ткани мозга, что у новорожденных проявляется неврологической симптоматикой. Недоношенность коррелирует с ухудшением клинической картины и прогноза. Необратимое повреждение нервных клеток приводит к развитию стойких нарушений в работе мозга. Распространенность патологии составляет около 3 случаев на 1 тыс. младенцев.
Церебральная ишемия, протекающая в легкой форме (1 степень), у новорожденного проявляется рядом симптомов – избыточным возбуждением нейронов или синдромом угнетения отделов ЦНС общей длительностью не больше 7 дней. При церебральной ишемии умеренной формы (2 степень) у новорожденных процессы возбуждения или угнетения функций ЦНС наблюдаются на протяжении более 7 дней. Сопутствующие признаки включают:
- Внутричерепную гипертензию.
- Судорожный синдром.
- Вегетативно-висцеральные нарушения (широкий спектр соматоневрологических и нейроэндокринных расстройств, которые возникают как результат нарушения нейрогуморальной регуляции, проявляются расстройством терморегуляции, сосудистыми и желудочно-кишечными патологическими реакциями).
Церебральная ишемия тяжелой формы (3 степень) у новорожденных характеризуется прогрессирующим снижением мозговой активности длительностью более 10 дней. Синдром угнетения трансформируется в коматозное состояние, в других случаях чередуется с периодами психомоторного возбуждения, для которых характерны приступы судорог. Судорожный или эпилептический статус может привести к возникновению комы.
Ишемия у новорожденного, протекающая в тяжелой форме, сопровождается дисфункций стволовых участков мозга, что проявляется в нарушении витальных функций – дыхательной и сердечно-сосудистой деятельности. Другие симптомы: вегетативно-висцеральные нарушения, внутричерепная гипертензия прогрессирующего течения.
У младенца с патологией третьей степени в ходе нейровизуализации наблюдаются процессы декортикации (истощение, атрофия коркового слоя мозга) и децеребрация (истощение, атрофия передних мозговых отделов). Перивентрикулярная ишемия у новорожденных младенцев – это такая патология, которая характеризуется поражением мозгового вещества в зоне желудочковой системы, что ассоциируется с развитием внутричерепной гипертензии. Церебральная ишемия значится в перечне заболеваний МКБ-10 под кодом «P91».
Причины возникновения
Ишемия – это такое состояние, которое у новорожденных развивается как результат кислородной недостаточности вещества головного мозга, что сопровождается повреждением и гибелью нейронов. Гипоксически-ишемическая энцефалопатия первой степени возникает как результат перенесенной внутриутробной гипоксии. Другая вероятная причина возникновения – легкая асфиксия в процессе рождения.
Церебральная ишемия умеренной (второй) степени у новорожденного возникает как результат перинатального гипоксического поражения мозга. Ишемическо-гипоксические процессы в стадии внутриутробного развития протекают на фоне инфекционно-воспалительных и других заболеваний, перенесенных матерью. В числе других влияющих факторов – употребление алкогольных напитков, курение в период гестации.
Интранатальная асфиксия, родовые травмы позвоночника, другие патологические воздействия и состояния способны спровоцировать возникновение ишемии умеренной формы. У многих новорожденных выраженные ишемические изменения в нервной ткани, образующей головной мозг, возникают в результате сочетания внутриутробной гипоксии и тяжелой интранатальной асфиксии.
В патогенезе участвуют факторы: врожденные болезни сердца, в том числе порок, респираторный дистресс-синдром (расстройство дыхательной функции на фоне недоразвития легких и дефицита сурфактанта), гиповолемический шок (быстрое сокращение объема циркулирующей крови).
Симптоматика
Церебральная ишемия – это такое состояние, которое у новорожденного проявляется характерными признаками, что позволяет сразу заподозрить диагноз. Нарушения при ишемии легкой степени тяжести коррелируют с текущим статусом ребенка. У доношенных детей чаще выявляется психомоторное возбуждение. Ишемия, возникшая у недоношенных детей, чаще проявляется угнетением ЦНС.
Клинические проявления наблюдаются на протяжении не более 7 дней. При умеренной форме нарушения длятся более 7 дней. Клиническая картина при умеренной форме дополняется судорогами тонического или атипичного вида, которые наблюдаются преимущественно у недоношенных новорожденных. Атипичные судороги чаще представлены в форме:
- Апноэ (остановка дыхательных движений) судорожного генеза.
- Спонтанно возникающих паттернов орального автоматизма.
- Тремора век.
- Патологических движений верхними конечностями, напоминающих гребущие.
- Патологических движений, совершаемых нижними конечностями, напоминающих кручение педалей.
- Миоклонии (кратковременные быстрые движения) глазных яблок.
У доношенных младенцев судороги чаще носят мультифокальный клонический характер. Судорожные приступы кратковременные, реже однократные, чаще повторные. Ишемия тяжелой формы (3 степень) проявляется прогрессирующей мозговой дисфункцией, которая продолжается дольше 10 дней. Обычно в начальные 12 часов жизни младенец пребывает в коматозном состоянии, затем происходит кратковременное повышение уровня бодрствования. По истечении суток нарастает уровень угнетения. Другие симптомы:
- Повторные судорожные приступы, возможен эпилептический статус.
- Нарушение дыхательной функции (изменение ритма, глубины, частоты дыхания).
- Глазодвигательные расстройства, патологические реакции зрачков.
- Признаки поражения полушарий или мозгового ствола: поза декортикации (верхние конечности согнуты на фоне разогнутых нижних конечностей) или децеребрации (гипертонус рук и ног по разгибательному типу). Параллельно происходит усиление рефлексов, наблюдаются патологические стопные знаки.
Вегетативно-висцеральные расстройства и внутричерепная гипертензия на этой стадии течения явно выражены. В зависимости от степени ишемическо-гипоксических изменений в мозговой ткани различают варианты клинической картины:
- Энцефалопатия 1 степени (легкая). Неврологические нарушения носят кратковременный, преходящий, обратимый характер. Перенесенное патологическое состояние не отражается на дальнейшем развитии ребенка. В начальные часы жизни отмечается угнетение функций ЦНС, которое вскоре сменяется возбуждением. Наблюдается оживление рефлексов в области сухожилий, клонус (быстрые, ритмичные движения, обусловленные непроизвольным сокращением группы мышц) стоп.
- Энцефалопатия 2 степени (умеренная). Ишемическое поражение мозгового вещества носит обратимый характер, однако длительность проявления неврологических симптомов может достигать 3 недель. В первые часы жизни у детей чаще наблюдается вялость, сонливость, понижение мышечного тонуса, что коррелирует с малой двигательной активностью спонтанного характера. У некоторых детей в отдаленный период обнаруживаются минимальные признаки мозговой дисфункции.
- Энцефалопатия 3 степени (тяжелая). Проявляется выраженной недостаточностью кровоснабжения мозга, развитием периваскулярного отека, появлением множественных очагов некроза в нервной ткани. Прогрессирующий отек мозга провоцирует судорожные приступы. Ухудшение состояния ребенка могут спровоцировать факторы: дефицит антидиуретического гормона, повреждение ткани печени гипоксического генеза. Исследование в формате электроэнцефалографии показывает усиление эпилептиформной активности.
Тяжелые гипоксически-ишемические поражения мозга у младенцев проявляются развитием комы. Сопутствующие симптомы: прерывающееся, нерегулярное дыхание, необходимость принудительной аппаратной вентиляции легких, апноэ, повторные судороги. Характерные признаки, указывающие на тяжесть состояния: адинамия (упадок сил и мышечная слабость, отсутствие спонтанной моторной активности), арефлексия (отсутствие рефлексов), атония (отсутствие нормального тонуса скелетной мускулатуры).
Исследование в формате КТ показывает наличие множественных очагов инфаркта мозга. Дисфункция мозгового ствола приводит к отсутствию зрачкового рефлекса (сужение в ответ на световой раздражитель) и остановке дыхания. В большинстве случаев новорожденные с подобной симптоматикой погибают в течение 1-х суток жизни по причине мозгового отека. Улучшение состояния на фоне проводимой терапии проявляется признаками:
- Появление сознания.
- Двигательная активность.
- Нормализация сна.
- Нормальный рефлекс Моро (защитный рефлекс, который проявляется спонтанным разведением рук в стороны с расставлением пальцев или сжиманием их в кулак при внезапном внешнем раздражающем воздействии, к примеру, после резкого хлопка в ладоши рядом с ребенком или после удара по подушке, лежащей под головой ребенка).
- Сокращение частоты или полное исчезновение судорог.
Восстановление церебрального кровотока сопровождается коррекцией показателей проницаемости на сосудисто-тканевом и клеточном уровне. При улучшении состояния одновременно наблюдается нормализация тонуса сосудистой стенки, а также факторов, характеризующих гемостаз (показатели свертываемости крови).
Диагностика
Диагноз церебральная ишемия легкой формы ставят по результатам диагностического обследования. Лабораторные анализы указывают на метаболические нарушения – гиперкарбию (повышение парциального давления углекислого газа), гипоксемию (пониженная концентрация кислорода в крови) умеренной степени, ацидоз (изменение кислотно-щелочного баланса с увеличением уровня кислотности).
В ходе инструментального исследования в формате КТ, МРТ, нейросонографии изменения морфологического строения мозговой ткани не обнаруживаются. Исследование системы церебрального кровотока показывает компенсаторное увеличение объема и скорости кровотока по магистральным мозговым артериям.
Обследование головного мозга новорожденных с церебральной ишемией умеренной степени показывает выраженное, устойчивое нарушение процессов метаболизма, а также изменение морфологической структуры нервной ткани. Изменения, вызванные гипоксически-ишемическими процессами умеренной тяжести, выявляющиеся у грудничка в ходе инструментального обследования головного мозга:
- Гиперэхогенные очаги местной локализации (по данным нейросонографии). У доношенных чаще расположены субкортикально (под корковым слоем), у недоношенных младенцев – чаще в перивентрикулярной (рядом с желудочковой системой) зоне.
- Очаговое поражение паренхимы – вещества мозга (по данным МРТ).
- Локальное очаговое понижение плотности мозгового вещества (по данным КТ). У доношенных младенцев очаги чаще расположены субкортикально или кортикально (в корковом слое), у недоношенных детей – чаще в перивентрикулярной зоне.
Исследование мозгового кровотока у новорожденных при церебральной ишемии, выраженной в средней степени, показывает понижение перфузии (просачивание, прохождение крови сквозь мозговую ткань). У доношенных патологические проявления наблюдаются в бассейне средней артерии, у недоношенных – в бассейне передней артерии. При ишемическом поражении мозгового вещества 3 степени выявляются нарушения:
- Повышение эхогенности паренхимы диффузной локализации (у доношенных по результатам нейросонографии).
- Повышение эхогенности мозговых структур перивентрикулярной локализации (у недоношенных по результатам нейросонографии).
- Сокращение объема боковых желудочков, образование кистозных полостей перивентрикулярной локализации (по результатам нейросонографии). У недоношенных младенцев обнаруживаются признаки атрофических изменений в полушариях, расширение ликворосодержащих пространств без увеличения притока ликвора.
- Уменьшение плотности паренхимы (по результатам КТ). Многоочаговое поражение мозгового вещества – участки пониженной плотности, расположенные кортикально и субкортикально. У доношенных младенцев выявляется понижение плотности тканей таламуса и структур базальных ганглиев.
Исследование церебрального кровотока при ишемии 3 степени показывает паралич (отсутствие тонуса сосудистой стенки) магистральных артерий с последующим развитием состояния устойчивого снижения перфузии. Выявляется устойчивое повышение показателей индекса резистентности (разница между фазами сердечного цикла). Высокий индекс коррелирует с повышением риска летального исхода.
Лечение
Терапия проводится с учетом тяжести повреждения мозговых структур, ведущих симптомов, состояния ребенка и результатов диагностического обследования. Основные терапевтические мероприятия:
- Контроль витальных функций.
- Коррекция и поддержание адекватных показателей температуры тела.
- Обеспечение достаточной оксигенации легких.
- Создание условий для достаточного кровообращения и гомеостаза.
- Предотвращение кровоизлияний и инфекционных поражений.
По показаниям врач назначает препараты для коррекции судорожного синдрома, кислотно-основного состояния, гипогликемии (понижение концентрации глюкозы), гипокальциемии (понижение концентрации кальция), гипомагниемии (понижение концентрации магния). Параллельно проводится лечение, направленное на нормализацию ликвородинамики и устранение отека мозгового вещества.
Применение фармацевтических средств с вазоактивным действием и ноотропных препаратов практически всегда не обосновано. Антиконвульсанты показаны при наличии как минимум 3 эпизодов судорог или в случае если длительность однократного эпизода превышает 3 минуты.
Немедикаментозные методы лечения: лазеротерапия, сухая иммерсия (моделирование условий невесомости для имитации пребывания ребенка в воде), ароматерапия и музыкотерапия, психосенсорная стимуляция, массаж, лечебная гимнастика, упражнения в воде. Массаж и ЛФК в рамках комплексного лечения при церебральной ишемии назначают после завершения острого периода для регуляции тонуса скелетных мышц и улучшения моторной функции.
Последствия и прогноз
У новорожденных последствия перенесенной тяжелой ишемии вещества, образующего головной мозг, проявляются грубыми психоневрологическими нарушениями, которые ассоциируются с детской инвалидностью. Период восстановления мозговых функций при умеренной форме ишемии может длиться до 1 года у доношенных и до 24 месяцев у недоношенных младенцев. Нарушения после перенесенной гипоксии включают:
- Синдром гипервозбудимости.
- Припадки в форме судорог, эпилептические приступы.
- Нарушение двигательной активности (парезы, мышечная слабость центрального и периферического типа, экстрапирамидные расстройства, мозжечковая дисфункция).
- Гидроцефальный синдром.
- Нарушение развития высших корковых функций – замедленное развитие, слабость доречевой и познавательной функции.
Стойко проявляющиеся, повторные судороги и длительно продолжающийся ступор ассоциируются с неблагоприятным прогнозом заболевания. Летальность составляет 20% случаев, около 25% детей после перенесенного состояния церебральной ишемии становятся инвалидами. Осложнения связаны с нарушением двигательного (ДЦП) и умственного развития (умственная отсталость разной степени тяжести).
Церебральная ишемия протекает в хронической или острой форме, отражает процесс кислородной недостаточности, затрагивающий ткани мозга. У младенцев нередко является причиной задержки моторного и психического развития. В тяжелых случаях приводит к инвалидности и летальному исходу.
Просмотров: 869
Ишемический инсульт у младенцев и детей: практическое ведение неотложной помощи
Лечение инсульта. 2011; 2011: 736965.
Микела Капелла
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Катерина Боргна-Пигнатти
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, 44121 , Италия
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Академический редактор: Халвор Наесс
Поступила в редакцию 23 сентября 2010 г .; Пересмотрено 27 апреля 2011 г .; Принята в печать 2 мая 2011 г.
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.
Abstract
Инсульт — редкое заболевание у детей, с оценочной заболеваемостью 13/100000 и значительным влиянием на заболеваемость и смертность. Клинические проявления и факторы риска, присутствующие почти у половины педиатрических пациентов, не такие, как у взрослых.Диагностика инсульта у детей часто откладывается, поскольку признаки и симптомы могут быть незаметными и неспецифическими. Анамнез и клиническое обследование должны исключить основные заболевания или предрасполагающие факторы. Нейровизуализация имеет решающее значение для постановки диагноза. В зависимости от клинической картины могут потребоваться другие тесты. Мы представляем здесь самые последние практические указания по диагностике и лечению артериального инсульта у детей в соответствии с различными международными рекомендациями по этому вопросу.
1.Введение
Всемирная организация здравоохранения (ВОЗ) определяет инсульт как «клинический синдром быстро развивающегося очагового или глобального нарушения функции мозга, длящегося более 24 часов или ведущего к смерти без очевидной несосудистой причины» [1]. Это определение следует объединить ссылкой на нейровизуализацию, которая в настоящее время считается необходимой для определения сосудисто-нервного происхождения симптомов. Современное определение может быть «клиническим синдромом, характеризующимся (1) неврологическим дефицитом, связанным с территорией перфузии церебральной артерии, и (2) нейрорадиологическими признаками ишемического поражения» [2, 3].
Преходящие ишемические атаки (ТИА) определяются как «внезапный очаговый неврологический дефицит, который длится менее 24 часов, предположительно сосудистого происхождения, ограниченный областью мозга или глаза, перфузируемой определенной артерией» [4]. В детстве, напротив, даже при наличии преходящих симптомов визуализация часто показывает инфаркт головного мозга [5].
Инсульты классически делятся на преимущественно ишемические и геморрагические. В то время как у взрослых инсульты чаще всего являются ишемическими (80%) и вызваны атеросклерозом, в детском возрасте до 45% инсультов являются геморрагическими и связаны с широким спектром факторов риска [6].
Расчетная частота ишемического инсульта у детей старше 28 дней жизни варьирует [7–9], но, согласно крупному проспективному популяционному исследованию, она составляет в среднем 13 / 100,000 для всех инсультов, 7,9 / 100,000 для ишемических инсультов, и 5.1 для геморрагических инсультов [8]. Примерно 20% детей умирают после ишемического инсульта, в то время как более 50% выживших имеют неврологические осложнения, чаще всего гемипарез [7, 9]. Сообщается, что кумулятивная частота рецидивов инсульта составляет 15% через 1 год, 19% через 5 лет [10] и до 41% через 5 лет [11].
Фактор риска присутствует почти у половины детей во время инсульта [12] (). Распространенными факторами риска в детстве являются врожденные пороки сердца, серповидноклеточная анемия, инфекции и различные протромботические состояния [13–15]. Наиболее частой причиной инсульта у детей, вероятно, является болезнь сердца, выявляемая у 19% детей с артериальным тромбозом (Канадский детский регистр ишемического инсульта) [16]. Недавние исследования подчеркивают важность инфекции: кажется, что по крайней мере треть случаев инсульта у детей происходит в таком контексте.Пятая часть детей с ишемическим инфарктом неизвестного происхождения в анамнезе перенесла ветряную оспу [16–18].
Таблица 1
Факторы риска инсульта у детей.
| Врожденный порок сердца | |
|---|---|
| Дефект межжелудочковой / межпредсердной перегородки | |
| Открытый артериальный проток | |
| Аортальный / митральный стеноз | |
| Коарктация | Коарктация | Сложные врожденные пороки сердца |
| Приобретенный порок сердца | |
| Ревматический порок сердца | |
| Протез клапана сердца | |
| Эндокардит | |
| Миокардит | |
| Миксома предсердий | |
| Аритмия | |
| Системное сосудистое заболевание | |
| Syst Эмическая гипертензия | |
| Истощение объема или системная гипотензия | |
| Гипернатриемия | |
| Синдром верхней полой вены | |
| Диабет | |
| Васкулит | |
| Системная инфекция | |
| Системная красная волчанка | |
| Узелковый полиартериит | |
| Гранулематозный ангиит | |
| Артериит Такаясу | |
| Ревматоидный артрит | |
| Дерзматоидный артрит | |
| Злоупотребление наркотиками (кокаин, амфетамины) | |
| Гемолитико-уремический синдром | |
| Васкулопатии | |
| Синдром Элерса-Данлоса | |
| Гомоцистинурия | |
| Синдром Моямоя | |
| Болезнь Фабри | |
| Злокачественный атрофический папулез | |
| Неразрывная недостаточность псевдоксантомы | |
| Неразрывная псевдоксантома | |
| Вазоспастические расстройства | |
| Мигрень | |
| Отравление спорыньей | |
| Вазоспазм и коагноидальное кровоизлияние | |
| Гемоглобинопатии (серповидно-клеточная анемия, серповидный | |
| клеточный гемоглобин C, серп-талассемия) | |
| Иммунная тромбоцитопеническая пурпура | |
| Тромботическая тромбоцитопеническая пурпура | |
| Тромбоцитоз | |
| Полицитемия | |
| Диссеминированная внутрисосудистая коагуляция | |
| Лейкемия или другие новообразования | |
| Врожденные дефекты свертывания полости рта | |
| Дефицит протеина S | |
| Дефицит протеина C | |
| Врожденный дефицит C2 сыворотки | |
| Дисфункция печени с дефектом коагуляции | |
| Дефицит витамина K | |
| Lupus Anticoagulant | |
| Структурные аномалии цереброваскулярной системы | |
| Артериальная фиброзно-мышечная дисплазия | |
| Агенезия или гипоплазия внутренней сонной артерии или | |
| позвоночных артерий | |
| Артериовенозная мальформация | |
| Наследственная геморрагическая телеангиэктазия | |
| Внутрираничный синдром | |
| Травма | |
| Жестокое обращение с детьми | |
| Жировая или воздушная эмболия | |
| Эмболия инородным телом | |
| Перевязка сонной артерии | |
| Вертебральная окклюзия после резкой ротации | |
| Посттравматическое расслоение артерии | |
| Тупая травма шейной артерии | |
| Артериография | |
| Посттравматический кавернозный свищ сонной артерии | |
| Дефек коагуляции t с незначительной травмой | |
| Проникающая внутричерепная травма |
Примерно у 80% детей с артериальным инсультом визуализация артерий не соответствует норме [12].
Целью данной статьи является предоставление актуальных практических рекомендаций по диагностике и лечению артериального инсульта у детей (от 1 месяца до 18 лет) в отделении неотложной помощи. Неонатальный инсульт не включается из-за его специфических характеристик.
При подготовке этой работы мы следовали самым последним рекомендациям по артериальному инсульту в детстве (Рабочая группа педиатрических инсультов, 2004; Американский колледж грудных врачей, 2004; Итальянское общество педиатров, 2007; Американская ассоциация инсультов, 2008).
Кроме того, был проведен обзор литературы с анализом соответствующих статей по данной теме до августа 2010 г. путем поиска в Pubmed, EMBASE, Кокрановской библиотеке и в библиографиях соответствующих статей. Ключевые слова: «инсульт», «неотложная помощь», «ребенок», «детство», «менеджмент».
2. Диагностика
2.1. Клиническая картина
Клинические проявления инсульта различаются в зависимости от возраста, пораженной артерии и причины [19, 20].
В то время как в младенчестве симптомы обычно неспецифичны, у детей старшего возраста наиболее частыми симптомами являются очаговые неврологические нарушения, такие как гемиплегия или грубый очаговый двигательный дефицит [21].
Симптомы в зависимости от пораженной артерии перечислены в. Наиболее часто поражается сосудистая территория средней мозговой артерии.
Таблица 2
Клиническая картина инсульта в зависимости от пораженной артерии.
| Сосудистая территория | Симптомы |
|---|---|
| Внутренняя сонная артерия | Гемипарез, афазия и гемианопсия |
| Передняя мозговая артерия | Гемипарез, особенно ноги |
| Гемипарез, особенно ноги | |
| Средняя мозговая артерия гемипарез, гемианопсия и афазия | |
| Задняя мозговая артерия | Гемианопсия, атаксия, гемипарез и головокружение |
| Базилярная артерия | Нарушения дыхания, чувствительности или равновесия, атаксия, нистагм, описторотонус и тремор |
| Мозжечковая артерия | Сенсорные нарушения, головная боль, лихорадка, рвота и признаки мозжечка |
2.2. Дифференциальный диагноз
Диагностика инсульта у детей часто откладывается из-за того, что признаки и симптомы могут быть незаметными и неспецифическими, такими как легкая слабость одной конечности, нарушение координации движений и сенсорные расстройства, первоначально вызванные причинами, отличными от инсульта [22].
У ребенка с острым неврологическим дефицитом до постановки диагноза ишемический инсульт необходимо учитывать другие цереброваскулярные заболевания (геморрагический инсульт, тромбоз венозного синуса головного мозга).
Частыми причинами острой гемиплегии являются паралич Тодда, при котором фокальные припадки обычно предшествуют монопарезу или гемиплегии, и гемиплегическая мигрень, при которой гемиплегии предшествуют нарушения зрения или чувствительности, за которыми следует головная боль. Также необходимо исключить менингоэнцефалит, обычно связанный с лихорадкой, головной болью и изменением сознания.
Острый неврологический дефицит может быть вызван опухолями, расстройствами центральной нервной системы, включая острый диссеминированный лейкоэнцефалит, церебеллит, обратимую заднюю лейкоэнцефалопатию, перемежающуюся гемиплегию, метаболические нарушения, эпилепсию и психогенные заболевания [23].
2.3. Раннее обследование (на презентации)
Первым шагом к обнаружению инсульта является включение этой опции в дифференциальный диагноз остро больного ребенка. Ранняя диагностика позволяет оперативно начать соответствующую терапию.
2.3.1. История болезни
Клинический анамнез должен включать этническое происхождение, наличие серповидноклеточной анемии или врожденного порока сердца, травму головы или шеи (связанную с внутричерепным кровоизлиянием и расслоением), недавнюю инфекцию (особенно ветряную оспу), васкулит и заболевания крови [19], так как а также цереброваскулярные заболевания, коагулопатии или иммунологические расстройства у родственников первой степени родства.
Очень важно, как и как быстро развиваются симптомы. До трети детей, перенесших инсульт, имеют в анамнезе недавние события, соответствующие ТИА [24].
2.3.2. Физикальное обследование
Полное физическое и неврологическое обследование, включая мониторинг жизненно важных параметров, выявит неврологические повреждения и позволит предположительно диагностировать пораженный сосуд головного мозга. Следует искать признаки системных заболеваний, повышающих риск инсульта.
2.3.3. Визуализирующие исследования
Неконтрастная компьютерная томография (КТ) может быть выполнена быстро и быстро в экстренных случаях. Он может адекватно исключить геморрагический инсульт или паренхиматозные аномалии, вызывающие массовый эффект, и может выявить поражение низкой плотности при артериальном ишемическом инсульте и тромбозе венозного синуса головного мозга. Однако КТ обычно нормальна в течение первых 12 часов после появления симптомов [6]. Его следует запрашивать, когда магнитный резонанс (МР) недоступен [19].
MR, по сути, является «золотым стандартом» метода визуализации для исследования артериального ишемического инсульта у младенцев и детей [25] из-за его большей чувствительности и специфичности. МРТ полезна для дифференциации инсульта от «имитации инсульта», но редко доступна в экстренных случаях [26]. Диагностическая эффективность МРТ может быть дополнительно улучшена перфузионными методами, которые определяют относительный церебральный кровоток, объем и время прохождения путем болюсного введения контрастного вещества на основе гадолиния [5, 27, 28].
MR с диффузионным взвешиванием очень полезен для точного определения областей ранней ишемии и инфаркта [26]. МР-ангиография — это неинвазивная процедура, позволяющая выявлять большие сосудистые аномалии [29], и она так же эффективна, как церебральная ангиография при выявлении крупных ишемических поражений [30]. МР-ангиография — разумная альтернатива традиционной артериографии у большинства пациентов [31, 32]. Если картина травмы головного мозга может соответствовать венозному инфаркту, экстренная визуализация сосудов должна включать МР-венографию.Фактически, 10% геморрагических инсультов у детей являются вторичными по отношению к тромбозу венозного синуса головного мозга [6].
Визуализация сосудов экстракраниального кровообращения, такая как МРА шейки матки или ультразвуковая допплерография, также должна быть выполнена, особенно если в анамнезе можно предположить расслоение шейной артерии.
2.3.4. Другие исследования
Могут быть полезны полный подсчет клеток крови, исследования железа, протромбиновое время, частичное тромбопластиновое время, скорость оседания и антинуклеарные антитела [19].
2.4. Исследования второй линии (через 48 часов, как указано)
После постановки диагноза инсульта несколько исследований могут быть полезны для постоянного обследования и ведения пациента.
Электрокардиограмма и трансторакальная или чреспищеводная эхокардиограмма всегда необходимы всем детям с известным или предполагаемым врожденным пороком сердца, перенесшим инсульт [20, 33].
Эхокардиография может быть полезной для диагностики открытого овального отверстия; эта аномалия может быть в четыре раза больше у детей с инсультом неустановленной этиологии, чем в общей популяции [34].
Диагностика некоторых состояний, включая расслоение экстракраниальной артерии, особенно с вовлечением заднего отдела кровообращения, и васкулит мелких сосудов, при использовании только МР-ангиографии затруднена. В этих обстоятельствах иногда требуется катетерная церебральная ангиография. Однако катетерная церебральная ангиография является инвазивной процедурой, которая обычно не проводится у детей, и имеет такую же диагностическую ценность, как МРТ в сочетании с МР-венографией и МР-артериографией [6].
Для выявления синдрома моямоя может потребоваться обычная ангиография [19].
Могут быть показаны электрофорез на гемоглобин и скрининг мочи на наркотики, особенно симпатомиметики. Полное обследование на тромбофилию целесообразно у всех детей с инсультом. Он должен включать оценку дефицита протеина C и протеина S, антитромбина III, кофактора гепарина II, плазминогена, антигена фон Виллебранда, фактора VIII, фактора XII, фактора V Лейдена, резистентности к активированному протеину C, гена протромбина 20210, гомоцистеина сыворотки, метилентетра. -гидрофолатредуктаза, липопротеин (а) и антифосфолипидные антитела [35–37].По показаниям на основании клинических подозрений могут быть выполнены более обширные диагностические исследования, такие как анализ спинномозговой жидкости, липидный профиль, ветряная оспа и вирус иммунодефицита человека, а также скрининг метаболических нарушений. Однако в большинстве случаев результаты этих исследований не повлияют на оказание неотложной помощи [19]. Предлагаем блок-схему диагностики ишемического инсульта в экстренных случаях (см.).
Схема: диагностика ишемического инсульта в экстренных случаях.
3. Ведение в чрезвычайных ситуациях
Руководств, основанных на убедительных доказательствах для оказания неотложной помощи при инсульте у детей, не существует, за исключением серповидноклеточной анемии. Таким образом, рекомендации по лечению ишемического инсульта у детей экстраполированы из рекомендаций для взрослых.
Детей с ранним острым ишемическим церебральным инсультом необходимо помещать в клиническое отделение, где возможно постоянное наблюдение. Лишь в отдельных случаях необходимо лечение в отделениях интенсивной терапии [38, 39].
3.1. Поддерживающая терапия
Общий подход в экстренных случаях включает простые меры, такие как поддержание дыхательной и сердечно-сосудистой функций, агрессивное лечение инфекции, судорог и лихорадки, поддержание нормогликемии и нормоволемии [20, 40], а также добавление кислорода для поддержания SaO 2 > 95% в течение первых 24 часов после инсульта [41]. Медикаментозное или хирургическое лечение внутричерепной гипертензии, если таковая имеется, важно, потому что у детей более высокий риск образования грыжи миндалин из-за отека мозга.Гипервентиляция — это краткосрочное решение, которое следует использовать при неизбежной грыже, пока не будет предложено окончательное лечение, такое как декомпрессивная нейрохирургия [40, 42, 43].
3.2. Антикоагулянтная терапия и антитромбоцитарные средства
Выбор между антикоагулянтами и антитромбоцитами является спорным, и существует мало данных, которые помогли бы принять это решение у детей [44].
В качестве антикоагулянтной терапии у детей с АИС применялись нефракционированный гепарин и низкомолекулярный гепарин (НМГ).Текущие рекомендации рекомендуют антикоагулянтную терапию у детей с доказанным расслоением артерии или кардиоэмболическим инсультом или в период диагностической оценки, пока не будет исключен сердечный источник или расслоение артерии [42]. Гепарин следует назначать детям с высоким риском рецидива и низким риском вторичного кровотечения [5, 45].
Согласно международной литературе, НМГ в дозе 1 мг / кг каждые 12 часов представляет собой безопасную начальную терапию ишемического инсульта у младенцев и детей.Перед началом лечения необходимо исключить геморрагический инсульт [46–49]. Низкомолекулярный гепарин предлагает несколько преимуществ по сравнению со стандартным нефракционированным гепарином и пероральными антикоагулянтами: меньший риск гепарин-индуцированной тромбоцитопении, меньшее количество лекарственных взаимодействий, меньшее неблагоприятное воздействие на кости при длительном применении и более низкая стоимость. Кроме того, НМГ вводится подкожно, и он демонстрирует предсказуемую зависящую от возраста фармакокинетику и меньшую потребность в мониторинге, что снижает потребность в множественных венепункциях [46].Эноксапарин (1 мг / кг подкожно для детей старше 2 месяцев или 1,5 мг / кг для детей младше 2 месяцев) является наиболее часто используемым НМГ у детей [47]. У детей с сердечной эмболией или расслоением сосудов НМГ назначают в течение 3–6 месяцев [50].
Что касается антитромбоцитов, то даже при отсутствии рандомизированных клинических испытаний использования аспирина в остром лечении острого инсульта у детей большинство экспертов сходятся во мнении, что это лекарство целесообразно для вторичной профилактики инсульта.В качестве вторичной профилактики рекомендуется стандартная доза от 1 до 5 мг / кг / день в течение минимум 3-5 лет после острого события [50]. Следует учитывать повышенный риск синдрома Рея. Клопидогрел применялся в дозировках около 1 мг / кг в день у детей, которые не могли принимать аспирин [42, 51].
Тромболизис тканевым активатором плазминогена (tPA) в настоящее время не используется, и Королевский колледж врачей, Совет по инсульту AHA и рекомендации ACCP не рекомендуют его. Фактически, диагноз инсульта у детей обычно ставится после интервала времени, необходимого для внутривенного или внутриартериального тромболизиса tPA (3 часа и 6 часов после начала инсульта, соответственно.) [3, 52–54].
Международная группа исследования инсульта у детей не рекомендует использовать тромболизис, если он не является частью рандомизированного контрольного исследования [55, 56].
4. Геморрагический инсульт
Геморрагический инсульт встречается так же часто, как артериальный ишемический инсульт, с оценочной частотой 1,5–2,9 на 100 000 детей в год [41]. Он включает спонтанное внутрипаренхиматозное кровоизлияние и нетравматическое субарахноидальное кровоизлияние.
Структурные поражения являются наиболее частой причиной внутрипаренхиматозных кровоизлияний в популяционной когорте [57].Наиболее часто встречаются опухоли головного мозга (27%) и артериовенозные мальформации (17%). Медицинская этиология встречается реже. Коагулопатии (13%) включают различные причины тромбоцитопении, гемофилии и болезни фон Виллебранда, серповидноклеточной анемии (6%), гипертонии (10%) и инфекций (6%). Также нередки интрапаренхиматозные кровоизлияния идиопатического происхождения (23%).
Нетравматические субарахноидальные кровоизлияния чаще всего возникают из-за внутричерепных аневризм. Разрыв аневризмы составляет 10% внутричерепных кровоизлияний у детей.Частота субарахноидального кровоизлияния увеличивается при различных врожденных и наследственных состояниях, таких как церебральные артериовенозные мальформации, сердечные заболевания (коарктация аорты, бактериальный эндокардит и миксома предсердий), аутосомно-доминантный поликистоз почек, аномалии соединительной ткани (синдром Марфана, фиброзно-мышечная дисплазия и тип IV Элерса-Данлоса), гематологические нарушения (серповидноклеточная анемия, дефицит G6PD и талассемия), факоматозы (нейрофиброматоз 1 типа, особенно после лучевой терапии и туберозный склероз) [58].
Характерными симптомами у детей являются головная боль или рвота из-за повышенного внутричерепного давления, судороги и очаговые неврологические нарушения [41]. При оценке детского инсульта обязательно исключить острое внутрипаренхиматозное кровотечение. Для этого следует провести неконтрастную ТК.
Лечение геморрагического инсульта требует многопрофильного управления командой с неврологической и нейрохирургической помощью.
Варианты ведения при геморрагическом инсульте делятся на две категории: общие усилия по стабилизации состояния пациента и меры по снижению риска повторного кровотечения [5].
Хирургическое лечение спорно, и нет никаких доказательств того, что хирургическая эвакуация супратенториальной интрапаренхиматозной гематомы эффективна в любом возрасте [59, 60]. Однако эвакуация быстро разрастающейся гематомы, вызывающей церебральную грыжу, может быть полезной [6]. Хирургическая или эндоваскулярная облитерация аневризм и артеровенозных мальформаций эффективна для многих людей, но стереотаксическая лучевая терапия все чаще используется у детей с артеровенозными мальформациями, которые малы или трудно поддаются хирургическому вмешательству.Несколько крупных ретроспективных исследований показали, что стереотаксическая лучевая терапия безопасна и эффективна для лечения детей с артеровенозной мальформацией [61, 62].
Лечение дефектов свертывания крови и гематологических нарушений должно снизить риск последующего кровотечения. Экстренная спленэктомия показана при внутрипаренхимальном кровотечении, связанном с идиопатической тромбоцитопенической пурпурой. Другими важными осложнениями нетравматического субарахноидального кровоизлияния, требующими лечения, являются гидроцефалия, вазоспазм и гипонатриемия [5].
5. Инсульт при серповидно-клеточной болезни
Наиболее частым гематологическим фактором риска инсульта является серповидно-клеточная анемия (ВСС). У восьми процентов пациентов младше 19 лет разовьется инсульт. В этой группе самый высокий уровень первого ишемического инсульта наблюдается у детей в возрасте от 2 до 5 лет, тогда как геморрагический инсульт поражает взрослых в возрасте от 20 до 30 лет. В возникновении инсульта, по-видимому, участвуют как семейные факторы, так и факторы окружающей среды [19]. При отсутствии терапии рецидив инсульта достигает 40% [63].
Маленькие инфаркты выявлялись при МРТ у 20–35% детей с ВСС при отсутствии симптомов [64, 65]. Эти так называемые «тихие инфаркты», преимущественно локализующиеся в лобной и теменной корковых, подкорковых и пограничных областях, связаны с ухудшением когнитивной функции и повышенным риском клинически симптоматического инсульта [66, 67].
Инсульт также может быть следствием васкулопатии крупных сосудов, которая обычно затрагивает территорию средней мозговой артерии.У некоторых людей развивается прогрессирующая васкулопатия внутричерепной внутренней сонной артерии и ее дистальных коллатеральных сосудов, картина, называемая синдромом моямоя. Небольшие инфаркты обычно поражают базальные ганглии и глубокое белое вещество в переднем отделе кровообращения.
Факторы риска инсульта при ВСС обобщены в.
Таблица 3
Факторы риска инсульта при серповидно-клеточной анемии.
| (i) высокая скорость кровотока при транскраниальной допплерографии |
| (ii) низкий уровень гемоглобина |
| (iii) высокий уровень HbS |
| (iv) высокий уровень лейкоцитов и тромбоцитов |
| (v) гипертония |
| (vi) тихий инфаркт головного мозга |
| (vii) криз грудной клетки в анамнезе, транзиторные ишемические атаки, менингит, судороги, хирургическое вмешательство, приапизм, острая анемия и переливание крови в течение 2 недель до ход |
5.1. Профилактика
Наличие высокой скорости мозгового кровотока, измеренной с помощью транскраниального допплера (ТД), выявляет пациентов с высоким риском первичной профилактики.
У здоровых детей скорость в средней мозговой артерии составляет около 90 см / с, а у детей с SCD — 130–140 см / с. Риск инсульта высок при скорости> 200 см / с.
Рандомизированное испытание (испытание по профилактике инсульта при серповидно-клеточной анемии: STOP) сравнивало периодическое переливание крови со стандартным лечением у 130 детей с SCD, которые были отобраны с учетом высокого риска инсульта на основании результатов TD.Исследование было остановлено из-за большого количества инсультов в группе стандартной помощи по сравнению с группой, получавшей переливание крови (11 против 1), в которой риск инсульта был снижен с 10% до <1% в год [68] .
Текущая рекомендация Национального института сердца, легких и крови Национального института здоровья (NHLBI) состоит в том, чтобы оценивать детей в возрасте от 2 до 16 лет с SCD с использованием TD с 6-месячными интервалами. Если скорость> 200 см / с, подтвержденная после контроля, проведенного через несколько недель, следует начать хроническую трансфузионную терапию [63], и ее не следует прекращать, даже если TD нормализуется (как продемонстрировало рандомизированное контролируемое исследование STOP II [5]). .
5.2. Терапия
Лечение острого ишемического инфаркта в результате ВСС включает внутривенную гидратацию и обменное переливание крови для поддержания HbS <30% и Hb между 10–12,5 г / дл [69]. Обменное переливание крови позволяет избежать теоретического риска увеличения вязкости крови, которое может сопровождать быстрое повышение гематокрита [5].
6. Выводы
Инсульт у детей встречается относительно редко, за исключением, как уже упоминалось, серповидноклеточной анемии. Однако он представляет собой одну из десяти «главных причин» детской смерти.Его относительно редкость вызывает недостаточное понимание того, что цереброваскулярные заболевания возникают у детей. Кроме того, факторы риска и клинические проявления отличаются от взрослых. По этим причинам диагноз часто откладывается. Было подсчитано, что между появлением симптомов и постановкой диагноза часто проходит 48–72 часа [70].
При обследовании ребенка с инсультом несколько тестов, включая визуализационные исследования, полезны для подтверждения диагноза, дифференциации геморрагического инсульта от ишемического инсульта и для руководства неотложной помощью.
Не существует единого подхода к лечению инсульта у детей. До тех пор, пока не будут доступны данные, основанные на рандомизированных педиатрических клинических испытаниях, рекомендации по лечению неотложной помощи детям с инсультом будут по-прежнему экстраполироваться из руководств для взрослых.
Ссылки
1. Ахо К., Хармсен П., Хатано С. Цереброваскулярные заболевания в обществе: результаты совместного исследования ВОЗ. Бюллетень Всемирной организации здравоохранения . 1980. 58 (1): 113–130. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2.Группа TPSW. Инсульт в детстве. Клинические рекомендации по диагностике, лечению и реабилитации . Саффолк, Великобритания: The Lavenham Press; 2004. [Google Scholar] 3. Хантер СП. Новые рентгенографические методы оценки цереброваскулярных нарушений у детей. Семинары по детской неврологии . 2000. 7 (4): 261–277. [PubMed] [Google Scholar] 4. Альберс Г.В., Каплан Л.Р., Истон Д.Д. и др. Транзиторная ишемическая атака — предложение нового определения. Медицинский журнал Новой Англии .2002. 347 (21): 1713–1716. [PubMed] [Google Scholar] 5. Роуч Е.С., Голомб М.Р., Адамс Р. и др. Ведение инсульта у младенцев и детей: научное заявление специальной группы авторов совета по инсульту Американской кардиологической ассоциации и совета по сердечно-сосудистым заболеваниям у молодежи. Ход . 2008. 39 (9): 2644–2691. [PubMed] [Google Scholar] 6. Флейшер Г.Р., Людвиг С. Учебник педиатрической неотложной медицины . 6-е издание. Филадельфия, Пенсильвания, США: Wolters Kluwer / Lippincott Williams & Wilkins Health; 2010 г.[Google Scholar] 7. Ganesan V, Hogan A, Shack N, Gordon A, Isaacs E, Kirkham FJ. Исход после ишемического инсульта в детстве. Медицина развития и детская неврология . 2000. 42 (7): 455–461. [PubMed] [Google Scholar] 8. Жиру М., Лемель М., Гуйон Дж. Б., Нивелон Дж. Л., Милан С., Дюма Р. Цереброваскулярные заболевания у детей до 16 лет в городе Дижон, Франция: исследование заболеваемости и клинических особенностей с 1985 по 1993 годы. Клиническая эпидемиология . 1995. 48 (11): 1343–1348.[PubMed] [Google Scholar] 9. Lanska MJ, Lanska DJ, Horwitz SJ, Aram DM. Презентация, клиническое течение и исход инсульта в детском возрасте. Детская неврология . 1991. 7 (5): 333–341. [PubMed] [Google Scholar] 10. Фуллертон Х.Дж., Ву Ю.В., Сидней С., Джонстон СК. Риск повторного артериального ишемического инсульта у детей в популяционной когорте: важность цереброваскулярной визуализации. Педиатрия . 2007. 119 (3): 495–501. [PubMed] [Google Scholar] 11. Ganesan V, Prengler M, Wade A, Kirkham FJ.Клинические и рентгенологические рецидивы после артериального ишемического инсульта в детском возрасте. Тираж . 2006. 114 (20): 2170–2177. [PubMed] [Google Scholar] 13. Ganesan V, Prengler M, McShane MA, Wade AM, Kirkham FJ. Исследование факторов риска у детей с артериальным ишемическим инсультом. Анналы неврологии . 2003. 53 (2): 167–173. [PubMed] [Google Scholar] 14. ДеВебер Г. Факторы риска инсульта в детстве: у маленьких людей инсульты разные! Анналы неврологии . 2003. 53 (2): 149–150.[PubMed] [Google Scholar] 15. Miravet E, Danchaivijitr N, Basu H, Saunders DE, Ganesan V. Клинические и радиологические особенности инфаркта головного мозга у детей после инфицирования вирусом ветряной оспы. Медицина развития и детская неврология . 2007. 49 (6): 417–422. [PubMed] [Google Scholar] 16. ДеВебер Г., Стив Роуч Е., Риела А.Р., Визницер М. Инсульт у детей: признание, лечение и будущие направления. Семинары по детской неврологии . 2000. 7 (4): 309–317. [PubMed] [Google Scholar] 17.Ciccone S, Faggioli R, Calzolari F, Sartori S, Calderone M, Borgna-Pignatti C. Инсульт после инфекции ветряной оспы: отчет о случае и обзор литературы. Журнал детских инфекционных болезней . 2010. 29 (9): 864–867. [PubMed] [Google Scholar] 18. Kirkham FJ, Prengler M, Hewes DKM, Ganesan V. Факторы риска артериального ишемического инсульта у детей. Журнал детской неврологии . 2000. 15 (5): 299–307. [PubMed] [Google Scholar] 19. Лопес-Висенте М, Ортега-Гутьеррес С., Амли-Лефонд С., Торби МТ.Диагностика и лечение ишемического инсульта у детей. Инсульт и заболевания сосудов головного мозга . 2010. 19 (3): 175–183. [PubMed] [Google Scholar] 20. Линч Дж. Цереброваскулярные нарушения у детей. Текущие отчеты по неврологии и неврологии . 2004. 4 (2): 129–138. [PubMed] [Google Scholar] 21. Фуллертон HJ, Джонстон SC, Смит WS. Расслоение артерий и инсульт у детей. Неврология . 2001. 57 (7): 1155–1160. [PubMed] [Google Scholar] 22. Габис Л.В., Янгала Р., Ленн Нью-Джерси.Задержка до диагностики инсульта у детей. Педиатрия . 2002. 110 (5): 924–928. [PubMed] [Google Scholar] 23. Shellhaas RA, Smith SE, O’Tool E, Licht DJ, Ichord RN. Мимики инсульта в детстве: характеристики предполагаемой когорты. Педиатрия . 2006. 118 (2): 704–709. [PubMed] [Google Scholar] 24. ДеВебер Г. Инсульт и мозг ребенка: обзор эпидемиологии, синдромов и факторов риска. Текущее мнение в неврологии . 2002. 15 (2): 133–138. [PubMed] [Google Scholar] 25.Гадиан Д.Г., Каламанте Ф., Киркхэм Ф.Дж. и др. Диффузионная и перфузионная магнитно-резонансная томография при инсульте у детей. Детская неврология . 2000. 15 (5): 279–283. [PubMed] [Google Scholar] 26. Джонс Б.П., Ганесан В., Сондерс Д.Е., КлингЧонг В. Визуализация при ишемическом инсульте артерий у детей. Нейрорадиология . 2010. 52 (6): 577–589. [PubMed] [Google Scholar] 27. Саншайн Дж. Л., Бамбакидис Н., Тарр Р. В. и др. Преимущества перфузионной МРТ по сравнению с диффузионной МРТ в диагностике и лечении острейшего инсульта. Американский журнал нейрорадиологии . 2001. 22 (5): 915–921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Иствуд Дж. Д., Лев М. Х., Винтермарк М. и др. Корреляция ранней динамической КТ-визуализации перфузии с МРТ-диффузией и перфузионной визуализацией всего мозга при остром полушарном инсульте. Американский журнал нейрорадиологии . 2003. 24 (9): 1869–1875. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Новак-Гёттль У., Гюнтер Г., Курник К., Стретер Р., Киркхэм Ф. Артериальный ишемический инсульт у новорожденных, младенцев и детей: обзор основных состояний, методов визуализации и методов лечения. Семинары по тромбозам и гемостазу . 2003. 29 (4): 405–414. [PubMed] [Google Scholar] 30. Husson B, Rodesch G, Lasjaunias P, Tardieu M, Sébire G. Магнитно-резонансная ангиография при инфаркте артерий головного мозга у детей: сравнительное исследование с контрастной ангиографией. Ход . 2002. 33 (5): 1280–1285. [PubMed] [Google Scholar] 31. Ганесан В., Савви Л., Чонг В.К., Киркхэм Ф.Дж. Обычная церебральная ангиография у детей с ишемическим инсультом. Детская неврология . 1999. 20 (1): 38–42.[PubMed] [Google Scholar] 32. Husson B, Lasjaunias P. Радиологический подход к заболеваниям артериальных сосудов головного мозга, связанным с артериальным инсультом в детском возрасте — сравнение МРА и контрастной ангиографии. Детская радиология . 2004. 34 (1): 10–15. [PubMed] [Google Scholar] 33. Calder K, Kokorowski P, Tran T, Henderson S. Представление педиатрического инсульта в отделении неотложной помощи. Скорая педиатрическая помощь . 2003. 19 (5): 320–328. [PubMed] [Google Scholar] 34. Мекитариан Филхо Э., Де Карвалью ВБ.Инсульт у детей. Журнал педиатрии . 2009. 85 (6): 469–479. [PubMed] [Google Scholar] 35. Nowak-Göttl U, Sträter R, Heinecke A, et al. Липопротеин (а) и генетический полиморфизм фактора свертывания крови V, протромбина и метилентетрагидрофолатредуктазы являются факторами риска спонтанного ишемического инсульта в детском возрасте. Кровь . 1999. 94 (11): 3678–3682. [PubMed] [Google Scholar] 36. Kenet G, Sadetzki S, Murad H, et al. Фактор V Лейден и антифосфолипидные антитела являются значительными факторами риска ишемического инсульта у детей. Ход . 2000. 31 (6): 1283–1288. [PubMed] [Google Scholar] 37. Несториди Э., Буонанно Ф.С., Джонс Р.М. и др. Артериальный ишемический инсульт в детстве: роль факторов риска плазменной фазы. Текущее мнение в неврологии . 2002. 15 (2): 139–144. [PubMed] [Google Scholar] 38. Аткинс Д.Л., Берг М.Д., Берг Р.А. и др. Педиатрическая базовая и расширенная система жизнеобеспечения. Педиатрия . 2006; 117 (5): e955 – e977. [PubMed] [Google Scholar] 39. Беккер К. Ведение в отделении интенсивной терапии больных, перенесших инсульт. Неврологическая клиника . 2000. 18 (2): 439–454. [PubMed] [Google Scholar] 40. Kirkham FJ. Есть ли генетическая основа для детского инсульта? Текущее мнение в педиатрии . 2003. 15 (6): 547–558. [PubMed] [Google Scholar] 41. Маккей М.Т., Гордон А. Инсульт у детей. Австралийский семейный врач . 2007. 36 (11): 896–902. [PubMed] [Google Scholar] 42. Иордания LC. Оценка и лечение инсульта у детей. Современные методы лечения в неврологии . 2008. 10 (6): 399–409.[PubMed] [Google Scholar] 43. Сахукильо Дж., Арикан Ф. Декомпрессивная трепанация черепа для лечения рефрактерного высокого внутричерепного давления при черепно-мозговой травме. Кокрановская база данных систематических обзоров . 2006; (1) Код статьи CD003983. [PubMed] [Google Scholar] 44. deVeber GA. Цереброваскулярные заболевания. В: Swaiman KF, Ashwal S, Ferriero D, редакторы. Принципы и практика детской неврологии . 4-е издание. Vol. 2. Мосби-Эльзевьер; 2006. С. 1759–1802. [Google Scholar] 46.Массикотт П., Адамс М., Марзинотто В., Брукер Л.А., Эндрю М. Низкомолекулярный гепарин у педиатрических пациентов с тромботической болезнью: исследование подбора дозы. Педиатрический журнал . 1996. 128 (3): 313–318. [PubMed] [Google Scholar] 47. Бурак ЧР, Боуэн MD, Бэррон ТФ. Применение эноксапарина у детей с острым негеморрагическим ишемическим инсультом. Детская неврология . 2003. 29 (4): 295–298. [PubMed] [Google Scholar] 48. Sträter R, Kurnik K, Heller C, Schobess R, Luigs P, Nowak-Göttl U.Аспирин против низкомолекулярного гепарина в низких дозах: антитромботическая терапия у детей с ишемическим инсультом: проспективное последующее исследование. Ход . 2001. 32 (11): 2554–2558. [PubMed] [Google Scholar] 49. Дикс Д., Эндрю М., Марзинотто В. и др. Использование низкомолекулярного гепарина у педиатрических пациентов: проспективное когортное исследование. Педиатрия . 2000. 136 (4): 439–445. [PubMed] [Google Scholar] 50. Монагл П., Чан А., Массикотт П., Чалмерс Э., Майкельсон А.Д. Антитромботическая терапия у детей: седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004; 126 (3): 645С – 687С. [PubMed] [Google Scholar] 51. Soman T, Rafay MF, Hune S, Allen A, MacGregor D, DeVeber G. Риски и безопасность клопидогрела при ишемическом инсульте артерий у детей. Ход . 2006. 37 (4): 1120–1122. [PubMed] [Google Scholar] 52. Gruber A, Nasel C, Lang W, Kitzmüller E, Bavinzski G, Czech T. Внутриартериальный тромболизис для лечения периоперационного кардиоэмболического инсульта у детей. Неврология . 2000. 54 (8): 1684–1686. [PubMed] [Google Scholar] 53.Тирумалай С.С., Шубин Р.А. Успешное лечение инсульта у ребенка с использованием рекомбинантного тканевого активатора плазминогена. Журнал детской неврологии . 2000; 15 (8): с. 558. [PubMed] [Google Scholar] 54. Zenz W, Arlt F, Sodia S, Berghold A. Внутримозговое кровоизлияние во время фибринолитической терапии у детей: обзор литературы за последние тридцать лет. Семинары по тромбозам и гемостазу . 1997. 23 (3): 321–332. [PubMed] [Google Scholar] 55. Элефтериу Д., Ганесан В. Стратегии лечения детского инсульта. Экспертное заключение по фармакотерапии . 2008. 9 (17): 2955–2967. [PubMed] [Google Scholar] 56. Амли-Лефонд С., ДеВебер Дж., Чан А.К. и др. Использование альтеплазы при артериальном ишемическом инсульте у детей: многоцентровое обсервационное когортное исследование. Ланцетная неврология . 2009. 8 (6): 530–536. [PubMed] [Google Scholar] 57. Джордан Л.С., Клейнман Дж. Т., Хиллис А. Э. Объем внутримозгового кровоизлияния указывает на плохой неврологический исход у детей. Ход . 2009. 40 (5): 1666–1671. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58.Пунт Дж. Хирургическое лечение инсульта у детей. Детская радиология . 2004. 34 (1): 16–23. [PubMed] [Google Scholar] 59. Batjer HH, Reisch JS, Allen BC, Plaizier LJ, Jen Su C. Неспособность хирургического вмешательства улучшить исход при гипертоническом путаминальном кровотечении. Проспективное рандомизированное исследование. Архив неврологии . 1990. 47 (10): 1103–1106. [PubMed] [Google Scholar] 60. Tan SH, Ng PY, Yeo TT, Wong SH, Ong PL, Venketasubramanian N. Гипертоническое кровоизлияние в базальные ганглии: проспективное исследование, сравнивающее хирургическое и нехирургическое лечение. Хирургическая неврология . 2001. 56 (5): 287–292. [PubMed] [Google Scholar] 61. Шин М., Кавамото С., Курита Х. и др. Ретроспективный анализ 10-летнего опыта стереотаксической радиохирургии при артериовенозных мальформациях у детей и подростков. Нейрохирургия . 2002. 97 (4): 779–784. [PubMed] [Google Scholar] 62. Коэн-Гадол А.А., Поллок Б.Е. Радиохирургия при артериовенозных мальформациях у детей. Журнал нейрохирургии . 2006. 104 (6): 388–391. [PubMed] [Google Scholar] 63.Булас Д. Скрининг детей на серповидно-клеточную васкулопатию: рекомендации по транскраниальной допплерографии. Детская радиология . 2005. 35 (3): 235–241. [PubMed] [Google Scholar] 64. Квятковски Дж. Л., Циммерман Р. А., Поллок А. Н. и др. Тихие инфаркты у детей раннего возраста с серповидно-клеточной анемией. Британский гематологический журнал . 2009. 146 (3): 300–305. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Стин Р.Г., Эмудиануе Т., Хэнкинс Г.М. и др. Результаты визуализации головного мозга у педиатрических пациентов с серповидно-клеточной анемией. Радиология . 2003. 228 (1): 216–225. [PubMed] [Google Scholar] 66. Армстронг Ф. Д., Томпсон Р. Дж. Мл., Ван В. и др. Когнитивное функционирование и магнитно-резонансная томография мозга у детей с серповидно-клеточной анемией. нейропсихологический комитет кооперативного исследования серповидно-клеточной анемии. Педиатрия . 1996. 97 (6): 864–870. [PubMed] [Google Scholar] 67. Миллер С.Т., Маклин Э.А., Пегелов С.Х. и др. Тихий инфаркт как фактор риска явного инсульта у детей с серповидно-клеточной анемией: отчет совместного исследования серповидно-клеточной анемии. Педиатрический журнал . 2001. 139 (3): 385–390. [PubMed] [Google Scholar] 68. Фуллертон Х.Дж., Адамс Р.Дж., Чжао С., Джонстон СК. Снижение частоты инсульта у калифорнийских детей с серповидно-клеточной анемией. Кровь . 2004. 104 (2): 336–339. [PubMed] [Google Scholar] 69. Адамс Р.Дж., Охене-Фремпонг К., Ван В. Серповидная клетка и мозг. Гематология / Американское общество гематологов. Образовательная программа . 2001: 31–46. [PubMed] [Google Scholar] 70. Куле С., Митчелл Л., Эндрю М. и др. Актуальные клинические проблемы у детей с ишемическим инсультом: анализ 1065 пациентов из службы телефонной консультации по педиатрическому инсульту 1-800-NOCLOTS. Ход . 2006. 37 (1): 116–122. [PubMed] [Google Scholar]
Ишемический инсульт у младенцев и детей: практическое ведение неотложной помощи
Лечение инсульта. 2011; 2011: 736965.
Микела Капелла
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Катерина Боргна-Пигнатти
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, 44121 , Италия
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Академический редактор: Халвор Наесс
Поступила в редакцию 23 сентября 2010 г .; Пересмотрено 27 апреля 2011 г .; Принята в печать 2 мая 2011 г.
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.
Abstract
Инсульт — редкое заболевание у детей, с оценочной заболеваемостью 13/100000 и значительным влиянием на заболеваемость и смертность. Клинические проявления и факторы риска, присутствующие почти у половины педиатрических пациентов, не такие, как у взрослых.Диагностика инсульта у детей часто откладывается, поскольку признаки и симптомы могут быть незаметными и неспецифическими. Анамнез и клиническое обследование должны исключить основные заболевания или предрасполагающие факторы. Нейровизуализация имеет решающее значение для постановки диагноза. В зависимости от клинической картины могут потребоваться другие тесты. Мы представляем здесь самые последние практические указания по диагностике и лечению артериального инсульта у детей в соответствии с различными международными рекомендациями по этому вопросу.
1.Введение
Всемирная организация здравоохранения (ВОЗ) определяет инсульт как «клинический синдром быстро развивающегося очагового или глобального нарушения функции мозга, длящегося более 24 часов или ведущего к смерти без очевидной несосудистой причины» [1]. Это определение следует объединить ссылкой на нейровизуализацию, которая в настоящее время считается необходимой для определения сосудисто-нервного происхождения симптомов. Современное определение может быть «клиническим синдромом, характеризующимся (1) неврологическим дефицитом, связанным с территорией перфузии церебральной артерии, и (2) нейрорадиологическими признаками ишемического поражения» [2, 3].
Преходящие ишемические атаки (ТИА) определяются как «внезапный очаговый неврологический дефицит, который длится менее 24 часов, предположительно сосудистого происхождения, ограниченный областью мозга или глаза, перфузируемой определенной артерией» [4]. В детстве, напротив, даже при наличии преходящих симптомов визуализация часто показывает инфаркт головного мозга [5].
Инсульты классически делятся на преимущественно ишемические и геморрагические. В то время как у взрослых инсульты чаще всего являются ишемическими (80%) и вызваны атеросклерозом, в детском возрасте до 45% инсультов являются геморрагическими и связаны с широким спектром факторов риска [6].
Расчетная частота ишемического инсульта у детей старше 28 дней жизни варьирует [7–9], но, согласно крупному проспективному популяционному исследованию, она составляет в среднем 13 / 100,000 для всех инсультов, 7,9 / 100,000 для ишемических инсультов, и 5.1 для геморрагических инсультов [8]. Примерно 20% детей умирают после ишемического инсульта, в то время как более 50% выживших имеют неврологические осложнения, чаще всего гемипарез [7, 9]. Сообщается, что кумулятивная частота рецидивов инсульта составляет 15% через 1 год, 19% через 5 лет [10] и до 41% через 5 лет [11].
Фактор риска присутствует почти у половины детей во время инсульта [12] (). Распространенными факторами риска в детстве являются врожденные пороки сердца, серповидноклеточная анемия, инфекции и различные протромботические состояния [13–15]. Наиболее частой причиной инсульта у детей, вероятно, является болезнь сердца, выявляемая у 19% детей с артериальным тромбозом (Канадский детский регистр ишемического инсульта) [16]. Недавние исследования подчеркивают важность инфекции: кажется, что по крайней мере треть случаев инсульта у детей происходит в таком контексте.Пятая часть детей с ишемическим инфарктом неизвестного происхождения в анамнезе перенесла ветряную оспу [16–18].
Таблица 1
Факторы риска инсульта у детей.
| Врожденный порок сердца | |
|---|---|
| Дефект межжелудочковой / межпредсердной перегородки | |
| Открытый артериальный проток | |
| Аортальный / митральный стеноз | |
| Коарктация | Коарктация | Сложные врожденные пороки сердца |
| Приобретенный порок сердца | |
| Ревматический порок сердца | |
| Протез клапана сердца | |
| Эндокардит | |
| Миокардит | |
| Миксома предсердий | |
| Аритмия | |
| Системное сосудистое заболевание | |
| Syst Эмическая гипертензия | |
| Истощение объема или системная гипотензия | |
| Гипернатриемия | |
| Синдром верхней полой вены | |
| Диабет | |
| Васкулит | |
| Системная инфекция | |
| Системная красная волчанка | |
| Узелковый полиартериит | |
| Гранулематозный ангиит | |
| Артериит Такаясу | |
| Ревматоидный артрит | |
| Дерзматоидный артрит | |
| Злоупотребление наркотиками (кокаин, амфетамины) | |
| Гемолитико-уремический синдром | |
| Васкулопатии | |
| Синдром Элерса-Данлоса | |
| Гомоцистинурия | |
| Синдром Моямоя | |
| Болезнь Фабри | |
| Злокачественный атрофический папулез | |
| Неразрывная недостаточность псевдоксантомы | |
| Неразрывная псевдоксантома | |
| Вазоспастические расстройства | |
| Мигрень | |
| Отравление спорыньей | |
| Вазоспазм и коагноидальное кровоизлияние | |
| Гемоглобинопатии (серповидно-клеточная анемия, серповидный | |
| клеточный гемоглобин C, серп-талассемия) | |
| Иммунная тромбоцитопеническая пурпура | |
| Тромботическая тромбоцитопеническая пурпура | |
| Тромбоцитоз | |
| Полицитемия | |
| Диссеминированная внутрисосудистая коагуляция | |
| Лейкемия или другие новообразования | |
| Врожденные дефекты свертывания полости рта | |
| Дефицит протеина S | |
| Дефицит протеина C | |
| Врожденный дефицит C2 сыворотки | |
| Дисфункция печени с дефектом коагуляции | |
| Дефицит витамина K | |
| Lupus Anticoagulant | |
| Структурные аномалии цереброваскулярной системы | |
| Артериальная фиброзно-мышечная дисплазия | |
| Агенезия или гипоплазия внутренней сонной артерии или | |
| позвоночных артерий | |
| Артериовенозная мальформация | |
| Наследственная геморрагическая телеангиэктазия | |
| Внутрираничный синдром | |
| Травма | |
| Жестокое обращение с детьми | |
| Жировая или воздушная эмболия | |
| Эмболия инородным телом | |
| Перевязка сонной артерии | |
| Вертебральная окклюзия после резкой ротации | |
| Посттравматическое расслоение артерии | |
| Тупая травма шейной артерии | |
| Артериография | |
| Посттравматический кавернозный свищ сонной артерии | |
| Дефек коагуляции t с незначительной травмой | |
| Проникающая внутричерепная травма |
Примерно у 80% детей с артериальным инсультом визуализация артерий не соответствует норме [12].
Целью данной статьи является предоставление актуальных практических рекомендаций по диагностике и лечению артериального инсульта у детей (от 1 месяца до 18 лет) в отделении неотложной помощи. Неонатальный инсульт не включается из-за его специфических характеристик.
При подготовке этой работы мы следовали самым последним рекомендациям по артериальному инсульту в детстве (Рабочая группа педиатрических инсультов, 2004; Американский колледж грудных врачей, 2004; Итальянское общество педиатров, 2007; Американская ассоциация инсультов, 2008).
Кроме того, был проведен обзор литературы с анализом соответствующих статей по данной теме до августа 2010 г. путем поиска в Pubmed, EMBASE, Кокрановской библиотеке и в библиографиях соответствующих статей. Ключевые слова: «инсульт», «неотложная помощь», «ребенок», «детство», «менеджмент».
2. Диагностика
2.1. Клиническая картина
Клинические проявления инсульта различаются в зависимости от возраста, пораженной артерии и причины [19, 20].
В то время как в младенчестве симптомы обычно неспецифичны, у детей старшего возраста наиболее частыми симптомами являются очаговые неврологические нарушения, такие как гемиплегия или грубый очаговый двигательный дефицит [21].
Симптомы в зависимости от пораженной артерии перечислены в. Наиболее часто поражается сосудистая территория средней мозговой артерии.
Таблица 2
Клиническая картина инсульта в зависимости от пораженной артерии.
| Сосудистая территория | Симптомы |
|---|---|
| Внутренняя сонная артерия | Гемипарез, афазия и гемианопсия |
| Передняя мозговая артерия | Гемипарез, особенно ноги |
| Гемипарез, особенно ноги | |
| Средняя мозговая артерия гемипарез, гемианопсия и афазия | |
| Задняя мозговая артерия | Гемианопсия, атаксия, гемипарез и головокружение |
| Базилярная артерия | Нарушения дыхания, чувствительности или равновесия, атаксия, нистагм, описторотонус и тремор |
| Мозжечковая артерия | Сенсорные нарушения, головная боль, лихорадка, рвота и признаки мозжечка |
2.2. Дифференциальный диагноз
Диагностика инсульта у детей часто откладывается из-за того, что признаки и симптомы могут быть незаметными и неспецифическими, такими как легкая слабость одной конечности, нарушение координации движений и сенсорные расстройства, первоначально вызванные причинами, отличными от инсульта [22].
У ребенка с острым неврологическим дефицитом до постановки диагноза ишемический инсульт необходимо учитывать другие цереброваскулярные заболевания (геморрагический инсульт, тромбоз венозного синуса головного мозга).
Частыми причинами острой гемиплегии являются паралич Тодда, при котором фокальные припадки обычно предшествуют монопарезу или гемиплегии, и гемиплегическая мигрень, при которой гемиплегии предшествуют нарушения зрения или чувствительности, за которыми следует головная боль. Также необходимо исключить менингоэнцефалит, обычно связанный с лихорадкой, головной болью и изменением сознания.
Острый неврологический дефицит может быть вызван опухолями, расстройствами центральной нервной системы, включая острый диссеминированный лейкоэнцефалит, церебеллит, обратимую заднюю лейкоэнцефалопатию, перемежающуюся гемиплегию, метаболические нарушения, эпилепсию и психогенные заболевания [23].
2.3. Раннее обследование (на презентации)
Первым шагом к обнаружению инсульта является включение этой опции в дифференциальный диагноз остро больного ребенка. Ранняя диагностика позволяет оперативно начать соответствующую терапию.
2.3.1. История болезни
Клинический анамнез должен включать этническое происхождение, наличие серповидноклеточной анемии или врожденного порока сердца, травму головы или шеи (связанную с внутричерепным кровоизлиянием и расслоением), недавнюю инфекцию (особенно ветряную оспу), васкулит и заболевания крови [19], так как а также цереброваскулярные заболевания, коагулопатии или иммунологические расстройства у родственников первой степени родства.
Очень важно, как и как быстро развиваются симптомы. До трети детей, перенесших инсульт, имеют в анамнезе недавние события, соответствующие ТИА [24].
2.3.2. Физикальное обследование
Полное физическое и неврологическое обследование, включая мониторинг жизненно важных параметров, выявит неврологические повреждения и позволит предположительно диагностировать пораженный сосуд головного мозга. Следует искать признаки системных заболеваний, повышающих риск инсульта.
2.3.3. Визуализирующие исследования
Неконтрастная компьютерная томография (КТ) может быть выполнена быстро и быстро в экстренных случаях. Он может адекватно исключить геморрагический инсульт или паренхиматозные аномалии, вызывающие массовый эффект, и может выявить поражение низкой плотности при артериальном ишемическом инсульте и тромбозе венозного синуса головного мозга. Однако КТ обычно нормальна в течение первых 12 часов после появления симптомов [6]. Его следует запрашивать, когда магнитный резонанс (МР) недоступен [19].
MR, по сути, является «золотым стандартом» метода визуализации для исследования артериального ишемического инсульта у младенцев и детей [25] из-за его большей чувствительности и специфичности. МРТ полезна для дифференциации инсульта от «имитации инсульта», но редко доступна в экстренных случаях [26]. Диагностическая эффективность МРТ может быть дополнительно улучшена перфузионными методами, которые определяют относительный церебральный кровоток, объем и время прохождения путем болюсного введения контрастного вещества на основе гадолиния [5, 27, 28].
MR с диффузионным взвешиванием очень полезен для точного определения областей ранней ишемии и инфаркта [26]. МР-ангиография — это неинвазивная процедура, позволяющая выявлять большие сосудистые аномалии [29], и она так же эффективна, как церебральная ангиография при выявлении крупных ишемических поражений [30]. МР-ангиография — разумная альтернатива традиционной артериографии у большинства пациентов [31, 32]. Если картина травмы головного мозга может соответствовать венозному инфаркту, экстренная визуализация сосудов должна включать МР-венографию.Фактически, 10% геморрагических инсультов у детей являются вторичными по отношению к тромбозу венозного синуса головного мозга [6].
Визуализация сосудов экстракраниального кровообращения, такая как МРА шейки матки или ультразвуковая допплерография, также должна быть выполнена, особенно если в анамнезе можно предположить расслоение шейной артерии.
2.3.4. Другие исследования
Могут быть полезны полный подсчет клеток крови, исследования железа, протромбиновое время, частичное тромбопластиновое время, скорость оседания и антинуклеарные антитела [19].
2.4. Исследования второй линии (через 48 часов, как указано)
После постановки диагноза инсульта несколько исследований могут быть полезны для постоянного обследования и ведения пациента.
Электрокардиограмма и трансторакальная или чреспищеводная эхокардиограмма всегда необходимы всем детям с известным или предполагаемым врожденным пороком сердца, перенесшим инсульт [20, 33].
Эхокардиография может быть полезной для диагностики открытого овального отверстия; эта аномалия может быть в четыре раза больше у детей с инсультом неустановленной этиологии, чем в общей популяции [34].
Диагностика некоторых состояний, включая расслоение экстракраниальной артерии, особенно с вовлечением заднего отдела кровообращения, и васкулит мелких сосудов, при использовании только МР-ангиографии затруднена. В этих обстоятельствах иногда требуется катетерная церебральная ангиография. Однако катетерная церебральная ангиография является инвазивной процедурой, которая обычно не проводится у детей, и имеет такую же диагностическую ценность, как МРТ в сочетании с МР-венографией и МР-артериографией [6].
Для выявления синдрома моямоя может потребоваться обычная ангиография [19].
Могут быть показаны электрофорез на гемоглобин и скрининг мочи на наркотики, особенно симпатомиметики. Полное обследование на тромбофилию целесообразно у всех детей с инсультом. Он должен включать оценку дефицита протеина C и протеина S, антитромбина III, кофактора гепарина II, плазминогена, антигена фон Виллебранда, фактора VIII, фактора XII, фактора V Лейдена, резистентности к активированному протеину C, гена протромбина 20210, гомоцистеина сыворотки, метилентетра. -гидрофолатредуктаза, липопротеин (а) и антифосфолипидные антитела [35–37].По показаниям на основании клинических подозрений могут быть выполнены более обширные диагностические исследования, такие как анализ спинномозговой жидкости, липидный профиль, ветряная оспа и вирус иммунодефицита человека, а также скрининг метаболических нарушений. Однако в большинстве случаев результаты этих исследований не повлияют на оказание неотложной помощи [19]. Предлагаем блок-схему диагностики ишемического инсульта в экстренных случаях (см.).
Схема: диагностика ишемического инсульта в экстренных случаях.
3. Ведение в чрезвычайных ситуациях
Руководств, основанных на убедительных доказательствах для оказания неотложной помощи при инсульте у детей, не существует, за исключением серповидноклеточной анемии. Таким образом, рекомендации по лечению ишемического инсульта у детей экстраполированы из рекомендаций для взрослых.
Детей с ранним острым ишемическим церебральным инсультом необходимо помещать в клиническое отделение, где возможно постоянное наблюдение. Лишь в отдельных случаях необходимо лечение в отделениях интенсивной терапии [38, 39].
3.1. Поддерживающая терапия
Общий подход в экстренных случаях включает простые меры, такие как поддержание дыхательной и сердечно-сосудистой функций, агрессивное лечение инфекции, судорог и лихорадки, поддержание нормогликемии и нормоволемии [20, 40], а также добавление кислорода для поддержания SaO 2 > 95% в течение первых 24 часов после инсульта [41]. Медикаментозное или хирургическое лечение внутричерепной гипертензии, если таковая имеется, важно, потому что у детей более высокий риск образования грыжи миндалин из-за отека мозга.Гипервентиляция — это краткосрочное решение, которое следует использовать при неизбежной грыже, пока не будет предложено окончательное лечение, такое как декомпрессивная нейрохирургия [40, 42, 43].
3.2. Антикоагулянтная терапия и антитромбоцитарные средства
Выбор между антикоагулянтами и антитромбоцитами является спорным, и существует мало данных, которые помогли бы принять это решение у детей [44].
В качестве антикоагулянтной терапии у детей с АИС применялись нефракционированный гепарин и низкомолекулярный гепарин (НМГ).Текущие рекомендации рекомендуют антикоагулянтную терапию у детей с доказанным расслоением артерии или кардиоэмболическим инсультом или в период диагностической оценки, пока не будет исключен сердечный источник или расслоение артерии [42]. Гепарин следует назначать детям с высоким риском рецидива и низким риском вторичного кровотечения [5, 45].
Согласно международной литературе, НМГ в дозе 1 мг / кг каждые 12 часов представляет собой безопасную начальную терапию ишемического инсульта у младенцев и детей.Перед началом лечения необходимо исключить геморрагический инсульт [46–49]. Низкомолекулярный гепарин предлагает несколько преимуществ по сравнению со стандартным нефракционированным гепарином и пероральными антикоагулянтами: меньший риск гепарин-индуцированной тромбоцитопении, меньшее количество лекарственных взаимодействий, меньшее неблагоприятное воздействие на кости при длительном применении и более низкая стоимость. Кроме того, НМГ вводится подкожно, и он демонстрирует предсказуемую зависящую от возраста фармакокинетику и меньшую потребность в мониторинге, что снижает потребность в множественных венепункциях [46].Эноксапарин (1 мг / кг подкожно для детей старше 2 месяцев или 1,5 мг / кг для детей младше 2 месяцев) является наиболее часто используемым НМГ у детей [47]. У детей с сердечной эмболией или расслоением сосудов НМГ назначают в течение 3–6 месяцев [50].
Что касается антитромбоцитов, то даже при отсутствии рандомизированных клинических испытаний использования аспирина в остром лечении острого инсульта у детей большинство экспертов сходятся во мнении, что это лекарство целесообразно для вторичной профилактики инсульта.В качестве вторичной профилактики рекомендуется стандартная доза от 1 до 5 мг / кг / день в течение минимум 3-5 лет после острого события [50]. Следует учитывать повышенный риск синдрома Рея. Клопидогрел применялся в дозировках около 1 мг / кг в день у детей, которые не могли принимать аспирин [42, 51].
Тромболизис тканевым активатором плазминогена (tPA) в настоящее время не используется, и Королевский колледж врачей, Совет по инсульту AHA и рекомендации ACCP не рекомендуют его. Фактически, диагноз инсульта у детей обычно ставится после интервала времени, необходимого для внутривенного или внутриартериального тромболизиса tPA (3 часа и 6 часов после начала инсульта, соответственно.) [3, 52–54].
Международная группа исследования инсульта у детей не рекомендует использовать тромболизис, если он не является частью рандомизированного контрольного исследования [55, 56].
4. Геморрагический инсульт
Геморрагический инсульт встречается так же часто, как артериальный ишемический инсульт, с оценочной частотой 1,5–2,9 на 100 000 детей в год [41]. Он включает спонтанное внутрипаренхиматозное кровоизлияние и нетравматическое субарахноидальное кровоизлияние.
Структурные поражения являются наиболее частой причиной внутрипаренхиматозных кровоизлияний в популяционной когорте [57].Наиболее часто встречаются опухоли головного мозга (27%) и артериовенозные мальформации (17%). Медицинская этиология встречается реже. Коагулопатии (13%) включают различные причины тромбоцитопении, гемофилии и болезни фон Виллебранда, серповидноклеточной анемии (6%), гипертонии (10%) и инфекций (6%). Также нередки интрапаренхиматозные кровоизлияния идиопатического происхождения (23%).
Нетравматические субарахноидальные кровоизлияния чаще всего возникают из-за внутричерепных аневризм. Разрыв аневризмы составляет 10% внутричерепных кровоизлияний у детей.Частота субарахноидального кровоизлияния увеличивается при различных врожденных и наследственных состояниях, таких как церебральные артериовенозные мальформации, сердечные заболевания (коарктация аорты, бактериальный эндокардит и миксома предсердий), аутосомно-доминантный поликистоз почек, аномалии соединительной ткани (синдром Марфана, фиброзно-мышечная дисплазия и тип IV Элерса-Данлоса), гематологические нарушения (серповидноклеточная анемия, дефицит G6PD и талассемия), факоматозы (нейрофиброматоз 1 типа, особенно после лучевой терапии и туберозный склероз) [58].
Характерными симптомами у детей являются головная боль или рвота из-за повышенного внутричерепного давления, судороги и очаговые неврологические нарушения [41]. При оценке детского инсульта обязательно исключить острое внутрипаренхиматозное кровотечение. Для этого следует провести неконтрастную ТК.
Лечение геморрагического инсульта требует многопрофильного управления командой с неврологической и нейрохирургической помощью.
Варианты ведения при геморрагическом инсульте делятся на две категории: общие усилия по стабилизации состояния пациента и меры по снижению риска повторного кровотечения [5].
Хирургическое лечение спорно, и нет никаких доказательств того, что хирургическая эвакуация супратенториальной интрапаренхиматозной гематомы эффективна в любом возрасте [59, 60]. Однако эвакуация быстро разрастающейся гематомы, вызывающей церебральную грыжу, может быть полезной [6]. Хирургическая или эндоваскулярная облитерация аневризм и артеровенозных мальформаций эффективна для многих людей, но стереотаксическая лучевая терапия все чаще используется у детей с артеровенозными мальформациями, которые малы или трудно поддаются хирургическому вмешательству.Несколько крупных ретроспективных исследований показали, что стереотаксическая лучевая терапия безопасна и эффективна для лечения детей с артеровенозной мальформацией [61, 62].
Лечение дефектов свертывания крови и гематологических нарушений должно снизить риск последующего кровотечения. Экстренная спленэктомия показана при внутрипаренхимальном кровотечении, связанном с идиопатической тромбоцитопенической пурпурой. Другими важными осложнениями нетравматического субарахноидального кровоизлияния, требующими лечения, являются гидроцефалия, вазоспазм и гипонатриемия [5].
5. Инсульт при серповидно-клеточной болезни
Наиболее частым гематологическим фактором риска инсульта является серповидно-клеточная анемия (ВСС). У восьми процентов пациентов младше 19 лет разовьется инсульт. В этой группе самый высокий уровень первого ишемического инсульта наблюдается у детей в возрасте от 2 до 5 лет, тогда как геморрагический инсульт поражает взрослых в возрасте от 20 до 30 лет. В возникновении инсульта, по-видимому, участвуют как семейные факторы, так и факторы окружающей среды [19]. При отсутствии терапии рецидив инсульта достигает 40% [63].
Маленькие инфаркты выявлялись при МРТ у 20–35% детей с ВСС при отсутствии симптомов [64, 65]. Эти так называемые «тихие инфаркты», преимущественно локализующиеся в лобной и теменной корковых, подкорковых и пограничных областях, связаны с ухудшением когнитивной функции и повышенным риском клинически симптоматического инсульта [66, 67].
Инсульт также может быть следствием васкулопатии крупных сосудов, которая обычно затрагивает территорию средней мозговой артерии.У некоторых людей развивается прогрессирующая васкулопатия внутричерепной внутренней сонной артерии и ее дистальных коллатеральных сосудов, картина, называемая синдромом моямоя. Небольшие инфаркты обычно поражают базальные ганглии и глубокое белое вещество в переднем отделе кровообращения.
Факторы риска инсульта при ВСС обобщены в.
Таблица 3
Факторы риска инсульта при серповидно-клеточной анемии.
| (i) высокая скорость кровотока при транскраниальной допплерографии |
| (ii) низкий уровень гемоглобина |
| (iii) высокий уровень HbS |
| (iv) высокий уровень лейкоцитов и тромбоцитов |
| (v) гипертония |
| (vi) тихий инфаркт головного мозга |
| (vii) криз грудной клетки в анамнезе, транзиторные ишемические атаки, менингит, судороги, хирургическое вмешательство, приапизм, острая анемия и переливание крови в течение 2 недель до ход |
5.1. Профилактика
Наличие высокой скорости мозгового кровотока, измеренной с помощью транскраниального допплера (ТД), выявляет пациентов с высоким риском первичной профилактики.
У здоровых детей скорость в средней мозговой артерии составляет около 90 см / с, а у детей с SCD — 130–140 см / с. Риск инсульта высок при скорости> 200 см / с.
Рандомизированное испытание (испытание по профилактике инсульта при серповидно-клеточной анемии: STOP) сравнивало периодическое переливание крови со стандартным лечением у 130 детей с SCD, которые были отобраны с учетом высокого риска инсульта на основании результатов TD.Исследование было остановлено из-за большого количества инсультов в группе стандартной помощи по сравнению с группой, получавшей переливание крови (11 против 1), в которой риск инсульта был снижен с 10% до <1% в год [68] .
Текущая рекомендация Национального института сердца, легких и крови Национального института здоровья (NHLBI) состоит в том, чтобы оценивать детей в возрасте от 2 до 16 лет с SCD с использованием TD с 6-месячными интервалами. Если скорость> 200 см / с, подтвержденная после контроля, проведенного через несколько недель, следует начать хроническую трансфузионную терапию [63], и ее не следует прекращать, даже если TD нормализуется (как продемонстрировало рандомизированное контролируемое исследование STOP II [5]). .
5.2. Терапия
Лечение острого ишемического инфаркта в результате ВСС включает внутривенную гидратацию и обменное переливание крови для поддержания HbS <30% и Hb между 10–12,5 г / дл [69]. Обменное переливание крови позволяет избежать теоретического риска увеличения вязкости крови, которое может сопровождать быстрое повышение гематокрита [5].
6. Выводы
Инсульт у детей встречается относительно редко, за исключением, как уже упоминалось, серповидноклеточной анемии. Однако он представляет собой одну из десяти «главных причин» детской смерти.Его относительно редкость вызывает недостаточное понимание того, что цереброваскулярные заболевания возникают у детей. Кроме того, факторы риска и клинические проявления отличаются от взрослых. По этим причинам диагноз часто откладывается. Было подсчитано, что между появлением симптомов и постановкой диагноза часто проходит 48–72 часа [70].
При обследовании ребенка с инсультом несколько тестов, включая визуализационные исследования, полезны для подтверждения диагноза, дифференциации геморрагического инсульта от ишемического инсульта и для руководства неотложной помощью.
Не существует единого подхода к лечению инсульта у детей. До тех пор, пока не будут доступны данные, основанные на рандомизированных педиатрических клинических испытаниях, рекомендации по лечению неотложной помощи детям с инсультом будут по-прежнему экстраполироваться из руководств для взрослых.
Ссылки
1. Ахо К., Хармсен П., Хатано С. Цереброваскулярные заболевания в обществе: результаты совместного исследования ВОЗ. Бюллетень Всемирной организации здравоохранения . 1980. 58 (1): 113–130. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2.Группа TPSW. Инсульт в детстве. Клинические рекомендации по диагностике, лечению и реабилитации . Саффолк, Великобритания: The Lavenham Press; 2004. [Google Scholar] 3. Хантер СП. Новые рентгенографические методы оценки цереброваскулярных нарушений у детей. Семинары по детской неврологии . 2000. 7 (4): 261–277. [PubMed] [Google Scholar] 4. Альберс Г.В., Каплан Л.Р., Истон Д.Д. и др. Транзиторная ишемическая атака — предложение нового определения. Медицинский журнал Новой Англии .2002. 347 (21): 1713–1716. [PubMed] [Google Scholar] 5. Роуч Е.С., Голомб М.Р., Адамс Р. и др. Ведение инсульта у младенцев и детей: научное заявление специальной группы авторов совета по инсульту Американской кардиологической ассоциации и совета по сердечно-сосудистым заболеваниям у молодежи. Ход . 2008. 39 (9): 2644–2691. [PubMed] [Google Scholar] 6. Флейшер Г.Р., Людвиг С. Учебник педиатрической неотложной медицины . 6-е издание. Филадельфия, Пенсильвания, США: Wolters Kluwer / Lippincott Williams & Wilkins Health; 2010 г.[Google Scholar] 7. Ganesan V, Hogan A, Shack N, Gordon A, Isaacs E, Kirkham FJ. Исход после ишемического инсульта в детстве. Медицина развития и детская неврология . 2000. 42 (7): 455–461. [PubMed] [Google Scholar] 8. Жиру М., Лемель М., Гуйон Дж. Б., Нивелон Дж. Л., Милан С., Дюма Р. Цереброваскулярные заболевания у детей до 16 лет в городе Дижон, Франция: исследование заболеваемости и клинических особенностей с 1985 по 1993 годы. Клиническая эпидемиология . 1995. 48 (11): 1343–1348.[PubMed] [Google Scholar] 9. Lanska MJ, Lanska DJ, Horwitz SJ, Aram DM. Презентация, клиническое течение и исход инсульта в детском возрасте. Детская неврология . 1991. 7 (5): 333–341. [PubMed] [Google Scholar] 10. Фуллертон Х.Дж., Ву Ю.В., Сидней С., Джонстон СК. Риск повторного артериального ишемического инсульта у детей в популяционной когорте: важность цереброваскулярной визуализации. Педиатрия . 2007. 119 (3): 495–501. [PubMed] [Google Scholar] 11. Ganesan V, Prengler M, Wade A, Kirkham FJ.Клинические и рентгенологические рецидивы после артериального ишемического инсульта в детском возрасте. Тираж . 2006. 114 (20): 2170–2177. [PubMed] [Google Scholar] 13. Ganesan V, Prengler M, McShane MA, Wade AM, Kirkham FJ. Исследование факторов риска у детей с артериальным ишемическим инсультом. Анналы неврологии . 2003. 53 (2): 167–173. [PubMed] [Google Scholar] 14. ДеВебер Г. Факторы риска инсульта в детстве: у маленьких людей инсульты разные! Анналы неврологии . 2003. 53 (2): 149–150.[PubMed] [Google Scholar] 15. Miravet E, Danchaivijitr N, Basu H, Saunders DE, Ganesan V. Клинические и радиологические особенности инфаркта головного мозга у детей после инфицирования вирусом ветряной оспы. Медицина развития и детская неврология . 2007. 49 (6): 417–422. [PubMed] [Google Scholar] 16. ДеВебер Г., Стив Роуч Е., Риела А.Р., Визницер М. Инсульт у детей: признание, лечение и будущие направления. Семинары по детской неврологии . 2000. 7 (4): 309–317. [PubMed] [Google Scholar] 17.Ciccone S, Faggioli R, Calzolari F, Sartori S, Calderone M, Borgna-Pignatti C. Инсульт после инфекции ветряной оспы: отчет о случае и обзор литературы. Журнал детских инфекционных болезней . 2010. 29 (9): 864–867. [PubMed] [Google Scholar] 18. Kirkham FJ, Prengler M, Hewes DKM, Ganesan V. Факторы риска артериального ишемического инсульта у детей. Журнал детской неврологии . 2000. 15 (5): 299–307. [PubMed] [Google Scholar] 19. Лопес-Висенте М, Ортега-Гутьеррес С., Амли-Лефонд С., Торби МТ.Диагностика и лечение ишемического инсульта у детей. Инсульт и заболевания сосудов головного мозга . 2010. 19 (3): 175–183. [PubMed] [Google Scholar] 20. Линч Дж. Цереброваскулярные нарушения у детей. Текущие отчеты по неврологии и неврологии . 2004. 4 (2): 129–138. [PubMed] [Google Scholar] 21. Фуллертон HJ, Джонстон SC, Смит WS. Расслоение артерий и инсульт у детей. Неврология . 2001. 57 (7): 1155–1160. [PubMed] [Google Scholar] 22. Габис Л.В., Янгала Р., Ленн Нью-Джерси.Задержка до диагностики инсульта у детей. Педиатрия . 2002. 110 (5): 924–928. [PubMed] [Google Scholar] 23. Shellhaas RA, Smith SE, O’Tool E, Licht DJ, Ichord RN. Мимики инсульта в детстве: характеристики предполагаемой когорты. Педиатрия . 2006. 118 (2): 704–709. [PubMed] [Google Scholar] 24. ДеВебер Г. Инсульт и мозг ребенка: обзор эпидемиологии, синдромов и факторов риска. Текущее мнение в неврологии . 2002. 15 (2): 133–138. [PubMed] [Google Scholar] 25.Гадиан Д.Г., Каламанте Ф., Киркхэм Ф.Дж. и др. Диффузионная и перфузионная магнитно-резонансная томография при инсульте у детей. Детская неврология . 2000. 15 (5): 279–283. [PubMed] [Google Scholar] 26. Джонс Б.П., Ганесан В., Сондерс Д.Е., КлингЧонг В. Визуализация при ишемическом инсульте артерий у детей. Нейрорадиология . 2010. 52 (6): 577–589. [PubMed] [Google Scholar] 27. Саншайн Дж. Л., Бамбакидис Н., Тарр Р. В. и др. Преимущества перфузионной МРТ по сравнению с диффузионной МРТ в диагностике и лечении острейшего инсульта. Американский журнал нейрорадиологии . 2001. 22 (5): 915–921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Иствуд Дж. Д., Лев М. Х., Винтермарк М. и др. Корреляция ранней динамической КТ-визуализации перфузии с МРТ-диффузией и перфузионной визуализацией всего мозга при остром полушарном инсульте. Американский журнал нейрорадиологии . 2003. 24 (9): 1869–1875. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Новак-Гёттль У., Гюнтер Г., Курник К., Стретер Р., Киркхэм Ф. Артериальный ишемический инсульт у новорожденных, младенцев и детей: обзор основных состояний, методов визуализации и методов лечения. Семинары по тромбозам и гемостазу . 2003. 29 (4): 405–414. [PubMed] [Google Scholar] 30. Husson B, Rodesch G, Lasjaunias P, Tardieu M, Sébire G. Магнитно-резонансная ангиография при инфаркте артерий головного мозга у детей: сравнительное исследование с контрастной ангиографией. Ход . 2002. 33 (5): 1280–1285. [PubMed] [Google Scholar] 31. Ганесан В., Савви Л., Чонг В.К., Киркхэм Ф.Дж. Обычная церебральная ангиография у детей с ишемическим инсультом. Детская неврология . 1999. 20 (1): 38–42.[PubMed] [Google Scholar] 32. Husson B, Lasjaunias P. Радиологический подход к заболеваниям артериальных сосудов головного мозга, связанным с артериальным инсультом в детском возрасте — сравнение МРА и контрастной ангиографии. Детская радиология . 2004. 34 (1): 10–15. [PubMed] [Google Scholar] 33. Calder K, Kokorowski P, Tran T, Henderson S. Представление педиатрического инсульта в отделении неотложной помощи. Скорая педиатрическая помощь . 2003. 19 (5): 320–328. [PubMed] [Google Scholar] 34. Мекитариан Филхо Э., Де Карвалью ВБ.Инсульт у детей. Журнал педиатрии . 2009. 85 (6): 469–479. [PubMed] [Google Scholar] 35. Nowak-Göttl U, Sträter R, Heinecke A, et al. Липопротеин (а) и генетический полиморфизм фактора свертывания крови V, протромбина и метилентетрагидрофолатредуктазы являются факторами риска спонтанного ишемического инсульта в детском возрасте. Кровь . 1999. 94 (11): 3678–3682. [PubMed] [Google Scholar] 36. Kenet G, Sadetzki S, Murad H, et al. Фактор V Лейден и антифосфолипидные антитела являются значительными факторами риска ишемического инсульта у детей. Ход . 2000. 31 (6): 1283–1288. [PubMed] [Google Scholar] 37. Несториди Э., Буонанно Ф.С., Джонс Р.М. и др. Артериальный ишемический инсульт в детстве: роль факторов риска плазменной фазы. Текущее мнение в неврологии . 2002. 15 (2): 139–144. [PubMed] [Google Scholar] 38. Аткинс Д.Л., Берг М.Д., Берг Р.А. и др. Педиатрическая базовая и расширенная система жизнеобеспечения. Педиатрия . 2006; 117 (5): e955 – e977. [PubMed] [Google Scholar] 39. Беккер К. Ведение в отделении интенсивной терапии больных, перенесших инсульт. Неврологическая клиника . 2000. 18 (2): 439–454. [PubMed] [Google Scholar] 40. Kirkham FJ. Есть ли генетическая основа для детского инсульта? Текущее мнение в педиатрии . 2003. 15 (6): 547–558. [PubMed] [Google Scholar] 41. Маккей М.Т., Гордон А. Инсульт у детей. Австралийский семейный врач . 2007. 36 (11): 896–902. [PubMed] [Google Scholar] 42. Иордания LC. Оценка и лечение инсульта у детей. Современные методы лечения в неврологии . 2008. 10 (6): 399–409.[PubMed] [Google Scholar] 43. Сахукильо Дж., Арикан Ф. Декомпрессивная трепанация черепа для лечения рефрактерного высокого внутричерепного давления при черепно-мозговой травме. Кокрановская база данных систематических обзоров . 2006; (1) Код статьи CD003983. [PubMed] [Google Scholar] 44. deVeber GA. Цереброваскулярные заболевания. В: Swaiman KF, Ashwal S, Ferriero D, редакторы. Принципы и практика детской неврологии . 4-е издание. Vol. 2. Мосби-Эльзевьер; 2006. С. 1759–1802. [Google Scholar] 46.Массикотт П., Адамс М., Марзинотто В., Брукер Л.А., Эндрю М. Низкомолекулярный гепарин у педиатрических пациентов с тромботической болезнью: исследование подбора дозы. Педиатрический журнал . 1996. 128 (3): 313–318. [PubMed] [Google Scholar] 47. Бурак ЧР, Боуэн MD, Бэррон ТФ. Применение эноксапарина у детей с острым негеморрагическим ишемическим инсультом. Детская неврология . 2003. 29 (4): 295–298. [PubMed] [Google Scholar] 48. Sträter R, Kurnik K, Heller C, Schobess R, Luigs P, Nowak-Göttl U.Аспирин против низкомолекулярного гепарина в низких дозах: антитромботическая терапия у детей с ишемическим инсультом: проспективное последующее исследование. Ход . 2001. 32 (11): 2554–2558. [PubMed] [Google Scholar] 49. Дикс Д., Эндрю М., Марзинотто В. и др. Использование низкомолекулярного гепарина у педиатрических пациентов: проспективное когортное исследование. Педиатрия . 2000. 136 (4): 439–445. [PubMed] [Google Scholar] 50. Монагл П., Чан А., Массикотт П., Чалмерс Э., Майкельсон А.Д. Антитромботическая терапия у детей: седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004; 126 (3): 645С – 687С. [PubMed] [Google Scholar] 51. Soman T, Rafay MF, Hune S, Allen A, MacGregor D, DeVeber G. Риски и безопасность клопидогрела при ишемическом инсульте артерий у детей. Ход . 2006. 37 (4): 1120–1122. [PubMed] [Google Scholar] 52. Gruber A, Nasel C, Lang W, Kitzmüller E, Bavinzski G, Czech T. Внутриартериальный тромболизис для лечения периоперационного кардиоэмболического инсульта у детей. Неврология . 2000. 54 (8): 1684–1686. [PubMed] [Google Scholar] 53.Тирумалай С.С., Шубин Р.А. Успешное лечение инсульта у ребенка с использованием рекомбинантного тканевого активатора плазминогена. Журнал детской неврологии . 2000; 15 (8): с. 558. [PubMed] [Google Scholar] 54. Zenz W, Arlt F, Sodia S, Berghold A. Внутримозговое кровоизлияние во время фибринолитической терапии у детей: обзор литературы за последние тридцать лет. Семинары по тромбозам и гемостазу . 1997. 23 (3): 321–332. [PubMed] [Google Scholar] 55. Элефтериу Д., Ганесан В. Стратегии лечения детского инсульта. Экспертное заключение по фармакотерапии . 2008. 9 (17): 2955–2967. [PubMed] [Google Scholar] 56. Амли-Лефонд С., ДеВебер Дж., Чан А.К. и др. Использование альтеплазы при артериальном ишемическом инсульте у детей: многоцентровое обсервационное когортное исследование. Ланцетная неврология . 2009. 8 (6): 530–536. [PubMed] [Google Scholar] 57. Джордан Л.С., Клейнман Дж. Т., Хиллис А. Э. Объем внутримозгового кровоизлияния указывает на плохой неврологический исход у детей. Ход . 2009. 40 (5): 1666–1671. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58.Пунт Дж. Хирургическое лечение инсульта у детей. Детская радиология . 2004. 34 (1): 16–23. [PubMed] [Google Scholar] 59. Batjer HH, Reisch JS, Allen BC, Plaizier LJ, Jen Su C. Неспособность хирургического вмешательства улучшить исход при гипертоническом путаминальном кровотечении. Проспективное рандомизированное исследование. Архив неврологии . 1990. 47 (10): 1103–1106. [PubMed] [Google Scholar] 60. Tan SH, Ng PY, Yeo TT, Wong SH, Ong PL, Venketasubramanian N. Гипертоническое кровоизлияние в базальные ганглии: проспективное исследование, сравнивающее хирургическое и нехирургическое лечение. Хирургическая неврология . 2001. 56 (5): 287–292. [PubMed] [Google Scholar] 61. Шин М., Кавамото С., Курита Х. и др. Ретроспективный анализ 10-летнего опыта стереотаксической радиохирургии при артериовенозных мальформациях у детей и подростков. Нейрохирургия . 2002. 97 (4): 779–784. [PubMed] [Google Scholar] 62. Коэн-Гадол А.А., Поллок Б.Е. Радиохирургия при артериовенозных мальформациях у детей. Журнал нейрохирургии . 2006. 104 (6): 388–391. [PubMed] [Google Scholar] 63.Булас Д. Скрининг детей на серповидно-клеточную васкулопатию: рекомендации по транскраниальной допплерографии. Детская радиология . 2005. 35 (3): 235–241. [PubMed] [Google Scholar] 64. Квятковски Дж. Л., Циммерман Р. А., Поллок А. Н. и др. Тихие инфаркты у детей раннего возраста с серповидно-клеточной анемией. Британский гематологический журнал . 2009. 146 (3): 300–305. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Стин Р.Г., Эмудиануе Т., Хэнкинс Г.М. и др. Результаты визуализации головного мозга у педиатрических пациентов с серповидно-клеточной анемией. Радиология . 2003. 228 (1): 216–225. [PubMed] [Google Scholar] 66. Армстронг Ф. Д., Томпсон Р. Дж. Мл., Ван В. и др. Когнитивное функционирование и магнитно-резонансная томография мозга у детей с серповидно-клеточной анемией. нейропсихологический комитет кооперативного исследования серповидно-клеточной анемии. Педиатрия . 1996. 97 (6): 864–870. [PubMed] [Google Scholar] 67. Миллер С.Т., Маклин Э.А., Пегелов С.Х. и др. Тихий инфаркт как фактор риска явного инсульта у детей с серповидно-клеточной анемией: отчет совместного исследования серповидно-клеточной анемии. Педиатрический журнал . 2001. 139 (3): 385–390. [PubMed] [Google Scholar] 68. Фуллертон Х.Дж., Адамс Р.Дж., Чжао С., Джонстон СК. Снижение частоты инсульта у калифорнийских детей с серповидно-клеточной анемией. Кровь . 2004. 104 (2): 336–339. [PubMed] [Google Scholar] 69. Адамс Р.Дж., Охене-Фремпонг К., Ван В. Серповидная клетка и мозг. Гематология / Американское общество гематологов. Образовательная программа . 2001: 31–46. [PubMed] [Google Scholar] 70. Куле С., Митчелл Л., Эндрю М. и др. Актуальные клинические проблемы у детей с ишемическим инсультом: анализ 1065 пациентов из службы телефонной консультации по педиатрическому инсульту 1-800-NOCLOTS. Ход . 2006. 37 (1): 116–122. [PubMed] [Google Scholar]
Ишемический инсульт у младенцев и детей: практическое ведение неотложной помощи
Лечение инсульта. 2011; 2011: 736965.
Микела Капелла
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Катерина Боргна-Пигнатти
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, 44121 , Италия
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Академический редактор: Халвор Наесс
Поступила в редакцию 23 сентября 2010 г .; Пересмотрено 27 апреля 2011 г .; Принята в печать 2 мая 2011 г.
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.
Abstract
Инсульт — редкое заболевание у детей, с оценочной заболеваемостью 13/100000 и значительным влиянием на заболеваемость и смертность. Клинические проявления и факторы риска, присутствующие почти у половины педиатрических пациентов, не такие, как у взрослых.Диагностика инсульта у детей часто откладывается, поскольку признаки и симптомы могут быть незаметными и неспецифическими. Анамнез и клиническое обследование должны исключить основные заболевания или предрасполагающие факторы. Нейровизуализация имеет решающее значение для постановки диагноза. В зависимости от клинической картины могут потребоваться другие тесты. Мы представляем здесь самые последние практические указания по диагностике и лечению артериального инсульта у детей в соответствии с различными международными рекомендациями по этому вопросу.
1.Введение
Всемирная организация здравоохранения (ВОЗ) определяет инсульт как «клинический синдром быстро развивающегося очагового или глобального нарушения функции мозга, длящегося более 24 часов или ведущего к смерти без очевидной несосудистой причины» [1]. Это определение следует объединить ссылкой на нейровизуализацию, которая в настоящее время считается необходимой для определения сосудисто-нервного происхождения симптомов. Современное определение может быть «клиническим синдромом, характеризующимся (1) неврологическим дефицитом, связанным с территорией перфузии церебральной артерии, и (2) нейрорадиологическими признаками ишемического поражения» [2, 3].
Преходящие ишемические атаки (ТИА) определяются как «внезапный очаговый неврологический дефицит, который длится менее 24 часов, предположительно сосудистого происхождения, ограниченный областью мозга или глаза, перфузируемой определенной артерией» [4]. В детстве, напротив, даже при наличии преходящих симптомов визуализация часто показывает инфаркт головного мозга [5].
Инсульты классически делятся на преимущественно ишемические и геморрагические. В то время как у взрослых инсульты чаще всего являются ишемическими (80%) и вызваны атеросклерозом, в детском возрасте до 45% инсультов являются геморрагическими и связаны с широким спектром факторов риска [6].
Расчетная частота ишемического инсульта у детей старше 28 дней жизни варьирует [7–9], но, согласно крупному проспективному популяционному исследованию, она составляет в среднем 13 / 100,000 для всех инсультов, 7,9 / 100,000 для ишемических инсультов, и 5.1 для геморрагических инсультов [8]. Примерно 20% детей умирают после ишемического инсульта, в то время как более 50% выживших имеют неврологические осложнения, чаще всего гемипарез [7, 9]. Сообщается, что кумулятивная частота рецидивов инсульта составляет 15% через 1 год, 19% через 5 лет [10] и до 41% через 5 лет [11].
Фактор риска присутствует почти у половины детей во время инсульта [12] (). Распространенными факторами риска в детстве являются врожденные пороки сердца, серповидноклеточная анемия, инфекции и различные протромботические состояния [13–15]. Наиболее частой причиной инсульта у детей, вероятно, является болезнь сердца, выявляемая у 19% детей с артериальным тромбозом (Канадский детский регистр ишемического инсульта) [16]. Недавние исследования подчеркивают важность инфекции: кажется, что по крайней мере треть случаев инсульта у детей происходит в таком контексте.Пятая часть детей с ишемическим инфарктом неизвестного происхождения в анамнезе перенесла ветряную оспу [16–18].
Таблица 1
Факторы риска инсульта у детей.
| Врожденный порок сердца | |
|---|---|
| Дефект межжелудочковой / межпредсердной перегородки | |
| Открытый артериальный проток | |
| Аортальный / митральный стеноз | |
| Коарктация | Коарктация | Сложные врожденные пороки сердца |
| Приобретенный порок сердца | |
| Ревматический порок сердца | |
| Протез клапана сердца | |
| Эндокардит | |
| Миокардит | |
| Миксома предсердий | |
| Аритмия | |
| Системное сосудистое заболевание | |
| Syst Эмическая гипертензия | |
| Истощение объема или системная гипотензия | |
| Гипернатриемия | |
| Синдром верхней полой вены | |
| Диабет | |
| Васкулит | |
| Системная инфекция | |
| Системная красная волчанка | |
| Узелковый полиартериит | |
| Гранулематозный ангиит | |
| Артериит Такаясу | |
| Ревматоидный артрит | |
| Дерзматоидный артрит | |
| Злоупотребление наркотиками (кокаин, амфетамины) | |
| Гемолитико-уремический синдром | |
| Васкулопатии | |
| Синдром Элерса-Данлоса | |
| Гомоцистинурия | |
| Синдром Моямоя | |
| Болезнь Фабри | |
| Злокачественный атрофический папулез | |
| Неразрывная недостаточность псевдоксантомы | |
| Неразрывная псевдоксантома | |
| Вазоспастические расстройства | |
| Мигрень | |
| Отравление спорыньей | |
| Вазоспазм и коагноидальное кровоизлияние | |
| Гемоглобинопатии (серповидно-клеточная анемия, серповидный | |
| клеточный гемоглобин C, серп-талассемия) | |
| Иммунная тромбоцитопеническая пурпура | |
| Тромботическая тромбоцитопеническая пурпура | |
| Тромбоцитоз | |
| Полицитемия | |
| Диссеминированная внутрисосудистая коагуляция | |
| Лейкемия или другие новообразования | |
| Врожденные дефекты свертывания полости рта | |
| Дефицит протеина S | |
| Дефицит протеина C | |
| Врожденный дефицит C2 сыворотки | |
| Дисфункция печени с дефектом коагуляции | |
| Дефицит витамина K | |
| Lupus Anticoagulant | |
| Структурные аномалии цереброваскулярной системы | |
| Артериальная фиброзно-мышечная дисплазия | |
| Агенезия или гипоплазия внутренней сонной артерии или | |
| позвоночных артерий | |
| Артериовенозная мальформация | |
| Наследственная геморрагическая телеангиэктазия | |
| Внутрираничный синдром | |
| Травма | |
| Жестокое обращение с детьми | |
| Жировая или воздушная эмболия | |
| Эмболия инородным телом | |
| Перевязка сонной артерии | |
| Вертебральная окклюзия после резкой ротации | |
| Посттравматическое расслоение артерии | |
| Тупая травма шейной артерии | |
| Артериография | |
| Посттравматический кавернозный свищ сонной артерии | |
| Дефек коагуляции t с незначительной травмой | |
| Проникающая внутричерепная травма |
Примерно у 80% детей с артериальным инсультом визуализация артерий не соответствует норме [12].
Целью данной статьи является предоставление актуальных практических рекомендаций по диагностике и лечению артериального инсульта у детей (от 1 месяца до 18 лет) в отделении неотложной помощи. Неонатальный инсульт не включается из-за его специфических характеристик.
При подготовке этой работы мы следовали самым последним рекомендациям по артериальному инсульту в детстве (Рабочая группа педиатрических инсультов, 2004; Американский колледж грудных врачей, 2004; Итальянское общество педиатров, 2007; Американская ассоциация инсультов, 2008).
Кроме того, был проведен обзор литературы с анализом соответствующих статей по данной теме до августа 2010 г. путем поиска в Pubmed, EMBASE, Кокрановской библиотеке и в библиографиях соответствующих статей. Ключевые слова: «инсульт», «неотложная помощь», «ребенок», «детство», «менеджмент».
2. Диагностика
2.1. Клиническая картина
Клинические проявления инсульта различаются в зависимости от возраста, пораженной артерии и причины [19, 20].
В то время как в младенчестве симптомы обычно неспецифичны, у детей старшего возраста наиболее частыми симптомами являются очаговые неврологические нарушения, такие как гемиплегия или грубый очаговый двигательный дефицит [21].
Симптомы в зависимости от пораженной артерии перечислены в. Наиболее часто поражается сосудистая территория средней мозговой артерии.
Таблица 2
Клиническая картина инсульта в зависимости от пораженной артерии.
| Сосудистая территория | Симптомы |
|---|---|
| Внутренняя сонная артерия | Гемипарез, афазия и гемианопсия |
| Передняя мозговая артерия | Гемипарез, особенно ноги |
| Гемипарез, особенно ноги | |
| Средняя мозговая артерия гемипарез, гемианопсия и афазия | |
| Задняя мозговая артерия | Гемианопсия, атаксия, гемипарез и головокружение |
| Базилярная артерия | Нарушения дыхания, чувствительности или равновесия, атаксия, нистагм, описторотонус и тремор |
| Мозжечковая артерия | Сенсорные нарушения, головная боль, лихорадка, рвота и признаки мозжечка |
2.2. Дифференциальный диагноз
Диагностика инсульта у детей часто откладывается из-за того, что признаки и симптомы могут быть незаметными и неспецифическими, такими как легкая слабость одной конечности, нарушение координации движений и сенсорные расстройства, первоначально вызванные причинами, отличными от инсульта [22].
У ребенка с острым неврологическим дефицитом до постановки диагноза ишемический инсульт необходимо учитывать другие цереброваскулярные заболевания (геморрагический инсульт, тромбоз венозного синуса головного мозга).
Частыми причинами острой гемиплегии являются паралич Тодда, при котором фокальные припадки обычно предшествуют монопарезу или гемиплегии, и гемиплегическая мигрень, при которой гемиплегии предшествуют нарушения зрения или чувствительности, за которыми следует головная боль. Также необходимо исключить менингоэнцефалит, обычно связанный с лихорадкой, головной болью и изменением сознания.
Острый неврологический дефицит может быть вызван опухолями, расстройствами центральной нервной системы, включая острый диссеминированный лейкоэнцефалит, церебеллит, обратимую заднюю лейкоэнцефалопатию, перемежающуюся гемиплегию, метаболические нарушения, эпилепсию и психогенные заболевания [23].
2.3. Раннее обследование (на презентации)
Первым шагом к обнаружению инсульта является включение этой опции в дифференциальный диагноз остро больного ребенка. Ранняя диагностика позволяет оперативно начать соответствующую терапию.
2.3.1. История болезни
Клинический анамнез должен включать этническое происхождение, наличие серповидноклеточной анемии или врожденного порока сердца, травму головы или шеи (связанную с внутричерепным кровоизлиянием и расслоением), недавнюю инфекцию (особенно ветряную оспу), васкулит и заболевания крови [19], так как а также цереброваскулярные заболевания, коагулопатии или иммунологические расстройства у родственников первой степени родства.
Очень важно, как и как быстро развиваются симптомы. До трети детей, перенесших инсульт, имеют в анамнезе недавние события, соответствующие ТИА [24].
2.3.2. Физикальное обследование
Полное физическое и неврологическое обследование, включая мониторинг жизненно важных параметров, выявит неврологические повреждения и позволит предположительно диагностировать пораженный сосуд головного мозга. Следует искать признаки системных заболеваний, повышающих риск инсульта.
2.3.3. Визуализирующие исследования
Неконтрастная компьютерная томография (КТ) может быть выполнена быстро и быстро в экстренных случаях. Он может адекватно исключить геморрагический инсульт или паренхиматозные аномалии, вызывающие массовый эффект, и может выявить поражение низкой плотности при артериальном ишемическом инсульте и тромбозе венозного синуса головного мозга. Однако КТ обычно нормальна в течение первых 12 часов после появления симптомов [6]. Его следует запрашивать, когда магнитный резонанс (МР) недоступен [19].
MR, по сути, является «золотым стандартом» метода визуализации для исследования артериального ишемического инсульта у младенцев и детей [25] из-за его большей чувствительности и специфичности. МРТ полезна для дифференциации инсульта от «имитации инсульта», но редко доступна в экстренных случаях [26]. Диагностическая эффективность МРТ может быть дополнительно улучшена перфузионными методами, которые определяют относительный церебральный кровоток, объем и время прохождения путем болюсного введения контрастного вещества на основе гадолиния [5, 27, 28].
MR с диффузионным взвешиванием очень полезен для точного определения областей ранней ишемии и инфаркта [26]. МР-ангиография — это неинвазивная процедура, позволяющая выявлять большие сосудистые аномалии [29], и она так же эффективна, как церебральная ангиография при выявлении крупных ишемических поражений [30]. МР-ангиография — разумная альтернатива традиционной артериографии у большинства пациентов [31, 32]. Если картина травмы головного мозга может соответствовать венозному инфаркту, экстренная визуализация сосудов должна включать МР-венографию.Фактически, 10% геморрагических инсультов у детей являются вторичными по отношению к тромбозу венозного синуса головного мозга [6].
Визуализация сосудов экстракраниального кровообращения, такая как МРА шейки матки или ультразвуковая допплерография, также должна быть выполнена, особенно если в анамнезе можно предположить расслоение шейной артерии.
2.3.4. Другие исследования
Могут быть полезны полный подсчет клеток крови, исследования железа, протромбиновое время, частичное тромбопластиновое время, скорость оседания и антинуклеарные антитела [19].
2.4. Исследования второй линии (через 48 часов, как указано)
После постановки диагноза инсульта несколько исследований могут быть полезны для постоянного обследования и ведения пациента.
Электрокардиограмма и трансторакальная или чреспищеводная эхокардиограмма всегда необходимы всем детям с известным или предполагаемым врожденным пороком сердца, перенесшим инсульт [20, 33].
Эхокардиография может быть полезной для диагностики открытого овального отверстия; эта аномалия может быть в четыре раза больше у детей с инсультом неустановленной этиологии, чем в общей популяции [34].
Диагностика некоторых состояний, включая расслоение экстракраниальной артерии, особенно с вовлечением заднего отдела кровообращения, и васкулит мелких сосудов, при использовании только МР-ангиографии затруднена. В этих обстоятельствах иногда требуется катетерная церебральная ангиография. Однако катетерная церебральная ангиография является инвазивной процедурой, которая обычно не проводится у детей, и имеет такую же диагностическую ценность, как МРТ в сочетании с МР-венографией и МР-артериографией [6].
Для выявления синдрома моямоя может потребоваться обычная ангиография [19].
Могут быть показаны электрофорез на гемоглобин и скрининг мочи на наркотики, особенно симпатомиметики. Полное обследование на тромбофилию целесообразно у всех детей с инсультом. Он должен включать оценку дефицита протеина C и протеина S, антитромбина III, кофактора гепарина II, плазминогена, антигена фон Виллебранда, фактора VIII, фактора XII, фактора V Лейдена, резистентности к активированному протеину C, гена протромбина 20210, гомоцистеина сыворотки, метилентетра. -гидрофолатредуктаза, липопротеин (а) и антифосфолипидные антитела [35–37].По показаниям на основании клинических подозрений могут быть выполнены более обширные диагностические исследования, такие как анализ спинномозговой жидкости, липидный профиль, ветряная оспа и вирус иммунодефицита человека, а также скрининг метаболических нарушений. Однако в большинстве случаев результаты этих исследований не повлияют на оказание неотложной помощи [19]. Предлагаем блок-схему диагностики ишемического инсульта в экстренных случаях (см.).
Схема: диагностика ишемического инсульта в экстренных случаях.
3. Ведение в чрезвычайных ситуациях
Руководств, основанных на убедительных доказательствах для оказания неотложной помощи при инсульте у детей, не существует, за исключением серповидноклеточной анемии. Таким образом, рекомендации по лечению ишемического инсульта у детей экстраполированы из рекомендаций для взрослых.
Детей с ранним острым ишемическим церебральным инсультом необходимо помещать в клиническое отделение, где возможно постоянное наблюдение. Лишь в отдельных случаях необходимо лечение в отделениях интенсивной терапии [38, 39].
3.1. Поддерживающая терапия
Общий подход в экстренных случаях включает простые меры, такие как поддержание дыхательной и сердечно-сосудистой функций, агрессивное лечение инфекции, судорог и лихорадки, поддержание нормогликемии и нормоволемии [20, 40], а также добавление кислорода для поддержания SaO 2 > 95% в течение первых 24 часов после инсульта [41]. Медикаментозное или хирургическое лечение внутричерепной гипертензии, если таковая имеется, важно, потому что у детей более высокий риск образования грыжи миндалин из-за отека мозга.Гипервентиляция — это краткосрочное решение, которое следует использовать при неизбежной грыже, пока не будет предложено окончательное лечение, такое как декомпрессивная нейрохирургия [40, 42, 43].
3.2. Антикоагулянтная терапия и антитромбоцитарные средства
Выбор между антикоагулянтами и антитромбоцитами является спорным, и существует мало данных, которые помогли бы принять это решение у детей [44].
В качестве антикоагулянтной терапии у детей с АИС применялись нефракционированный гепарин и низкомолекулярный гепарин (НМГ).Текущие рекомендации рекомендуют антикоагулянтную терапию у детей с доказанным расслоением артерии или кардиоэмболическим инсультом или в период диагностической оценки, пока не будет исключен сердечный источник или расслоение артерии [42]. Гепарин следует назначать детям с высоким риском рецидива и низким риском вторичного кровотечения [5, 45].
Согласно международной литературе, НМГ в дозе 1 мг / кг каждые 12 часов представляет собой безопасную начальную терапию ишемического инсульта у младенцев и детей.Перед началом лечения необходимо исключить геморрагический инсульт [46–49]. Низкомолекулярный гепарин предлагает несколько преимуществ по сравнению со стандартным нефракционированным гепарином и пероральными антикоагулянтами: меньший риск гепарин-индуцированной тромбоцитопении, меньшее количество лекарственных взаимодействий, меньшее неблагоприятное воздействие на кости при длительном применении и более низкая стоимость. Кроме того, НМГ вводится подкожно, и он демонстрирует предсказуемую зависящую от возраста фармакокинетику и меньшую потребность в мониторинге, что снижает потребность в множественных венепункциях [46].Эноксапарин (1 мг / кг подкожно для детей старше 2 месяцев или 1,5 мг / кг для детей младше 2 месяцев) является наиболее часто используемым НМГ у детей [47]. У детей с сердечной эмболией или расслоением сосудов НМГ назначают в течение 3–6 месяцев [50].
Что касается антитромбоцитов, то даже при отсутствии рандомизированных клинических испытаний использования аспирина в остром лечении острого инсульта у детей большинство экспертов сходятся во мнении, что это лекарство целесообразно для вторичной профилактики инсульта.В качестве вторичной профилактики рекомендуется стандартная доза от 1 до 5 мг / кг / день в течение минимум 3-5 лет после острого события [50]. Следует учитывать повышенный риск синдрома Рея. Клопидогрел применялся в дозировках около 1 мг / кг в день у детей, которые не могли принимать аспирин [42, 51].
Тромболизис тканевым активатором плазминогена (tPA) в настоящее время не используется, и Королевский колледж врачей, Совет по инсульту AHA и рекомендации ACCP не рекомендуют его. Фактически, диагноз инсульта у детей обычно ставится после интервала времени, необходимого для внутривенного или внутриартериального тромболизиса tPA (3 часа и 6 часов после начала инсульта, соответственно.) [3, 52–54].
Международная группа исследования инсульта у детей не рекомендует использовать тромболизис, если он не является частью рандомизированного контрольного исследования [55, 56].
4. Геморрагический инсульт
Геморрагический инсульт встречается так же часто, как артериальный ишемический инсульт, с оценочной частотой 1,5–2,9 на 100 000 детей в год [41]. Он включает спонтанное внутрипаренхиматозное кровоизлияние и нетравматическое субарахноидальное кровоизлияние.
Структурные поражения являются наиболее частой причиной внутрипаренхиматозных кровоизлияний в популяционной когорте [57].Наиболее часто встречаются опухоли головного мозга (27%) и артериовенозные мальформации (17%). Медицинская этиология встречается реже. Коагулопатии (13%) включают различные причины тромбоцитопении, гемофилии и болезни фон Виллебранда, серповидноклеточной анемии (6%), гипертонии (10%) и инфекций (6%). Также нередки интрапаренхиматозные кровоизлияния идиопатического происхождения (23%).
Нетравматические субарахноидальные кровоизлияния чаще всего возникают из-за внутричерепных аневризм. Разрыв аневризмы составляет 10% внутричерепных кровоизлияний у детей.Частота субарахноидального кровоизлияния увеличивается при различных врожденных и наследственных состояниях, таких как церебральные артериовенозные мальформации, сердечные заболевания (коарктация аорты, бактериальный эндокардит и миксома предсердий), аутосомно-доминантный поликистоз почек, аномалии соединительной ткани (синдром Марфана, фиброзно-мышечная дисплазия и тип IV Элерса-Данлоса), гематологические нарушения (серповидноклеточная анемия, дефицит G6PD и талассемия), факоматозы (нейрофиброматоз 1 типа, особенно после лучевой терапии и туберозный склероз) [58].
Характерными симптомами у детей являются головная боль или рвота из-за повышенного внутричерепного давления, судороги и очаговые неврологические нарушения [41]. При оценке детского инсульта обязательно исключить острое внутрипаренхиматозное кровотечение. Для этого следует провести неконтрастную ТК.
Лечение геморрагического инсульта требует многопрофильного управления командой с неврологической и нейрохирургической помощью.
Варианты ведения при геморрагическом инсульте делятся на две категории: общие усилия по стабилизации состояния пациента и меры по снижению риска повторного кровотечения [5].
Хирургическое лечение спорно, и нет никаких доказательств того, что хирургическая эвакуация супратенториальной интрапаренхиматозной гематомы эффективна в любом возрасте [59, 60]. Однако эвакуация быстро разрастающейся гематомы, вызывающей церебральную грыжу, может быть полезной [6]. Хирургическая или эндоваскулярная облитерация аневризм и артеровенозных мальформаций эффективна для многих людей, но стереотаксическая лучевая терапия все чаще используется у детей с артеровенозными мальформациями, которые малы или трудно поддаются хирургическому вмешательству.Несколько крупных ретроспективных исследований показали, что стереотаксическая лучевая терапия безопасна и эффективна для лечения детей с артеровенозной мальформацией [61, 62].
Лечение дефектов свертывания крови и гематологических нарушений должно снизить риск последующего кровотечения. Экстренная спленэктомия показана при внутрипаренхимальном кровотечении, связанном с идиопатической тромбоцитопенической пурпурой. Другими важными осложнениями нетравматического субарахноидального кровоизлияния, требующими лечения, являются гидроцефалия, вазоспазм и гипонатриемия [5].
5. Инсульт при серповидно-клеточной болезни
Наиболее частым гематологическим фактором риска инсульта является серповидно-клеточная анемия (ВСС). У восьми процентов пациентов младше 19 лет разовьется инсульт. В этой группе самый высокий уровень первого ишемического инсульта наблюдается у детей в возрасте от 2 до 5 лет, тогда как геморрагический инсульт поражает взрослых в возрасте от 20 до 30 лет. В возникновении инсульта, по-видимому, участвуют как семейные факторы, так и факторы окружающей среды [19]. При отсутствии терапии рецидив инсульта достигает 40% [63].
Маленькие инфаркты выявлялись при МРТ у 20–35% детей с ВСС при отсутствии симптомов [64, 65]. Эти так называемые «тихие инфаркты», преимущественно локализующиеся в лобной и теменной корковых, подкорковых и пограничных областях, связаны с ухудшением когнитивной функции и повышенным риском клинически симптоматического инсульта [66, 67].
Инсульт также может быть следствием васкулопатии крупных сосудов, которая обычно затрагивает территорию средней мозговой артерии.У некоторых людей развивается прогрессирующая васкулопатия внутричерепной внутренней сонной артерии и ее дистальных коллатеральных сосудов, картина, называемая синдромом моямоя. Небольшие инфаркты обычно поражают базальные ганглии и глубокое белое вещество в переднем отделе кровообращения.
Факторы риска инсульта при ВСС обобщены в.
Таблица 3
Факторы риска инсульта при серповидно-клеточной анемии.
| (i) высокая скорость кровотока при транскраниальной допплерографии |
| (ii) низкий уровень гемоглобина |
| (iii) высокий уровень HbS |
| (iv) высокий уровень лейкоцитов и тромбоцитов |
| (v) гипертония |
| (vi) тихий инфаркт головного мозга |
| (vii) криз грудной клетки в анамнезе, транзиторные ишемические атаки, менингит, судороги, хирургическое вмешательство, приапизм, острая анемия и переливание крови в течение 2 недель до ход |
5.1. Профилактика
Наличие высокой скорости мозгового кровотока, измеренной с помощью транскраниального допплера (ТД), выявляет пациентов с высоким риском первичной профилактики.
У здоровых детей скорость в средней мозговой артерии составляет около 90 см / с, а у детей с SCD — 130–140 см / с. Риск инсульта высок при скорости> 200 см / с.
Рандомизированное испытание (испытание по профилактике инсульта при серповидно-клеточной анемии: STOP) сравнивало периодическое переливание крови со стандартным лечением у 130 детей с SCD, которые были отобраны с учетом высокого риска инсульта на основании результатов TD.Исследование было остановлено из-за большого количества инсультов в группе стандартной помощи по сравнению с группой, получавшей переливание крови (11 против 1), в которой риск инсульта был снижен с 10% до <1% в год [68] .
Текущая рекомендация Национального института сердца, легких и крови Национального института здоровья (NHLBI) состоит в том, чтобы оценивать детей в возрасте от 2 до 16 лет с SCD с использованием TD с 6-месячными интервалами. Если скорость> 200 см / с, подтвержденная после контроля, проведенного через несколько недель, следует начать хроническую трансфузионную терапию [63], и ее не следует прекращать, даже если TD нормализуется (как продемонстрировало рандомизированное контролируемое исследование STOP II [5]). .
5.2. Терапия
Лечение острого ишемического инфаркта в результате ВСС включает внутривенную гидратацию и обменное переливание крови для поддержания HbS <30% и Hb между 10–12,5 г / дл [69]. Обменное переливание крови позволяет избежать теоретического риска увеличения вязкости крови, которое может сопровождать быстрое повышение гематокрита [5].
6. Выводы
Инсульт у детей встречается относительно редко, за исключением, как уже упоминалось, серповидноклеточной анемии. Однако он представляет собой одну из десяти «главных причин» детской смерти.Его относительно редкость вызывает недостаточное понимание того, что цереброваскулярные заболевания возникают у детей. Кроме того, факторы риска и клинические проявления отличаются от взрослых. По этим причинам диагноз часто откладывается. Было подсчитано, что между появлением симптомов и постановкой диагноза часто проходит 48–72 часа [70].
При обследовании ребенка с инсультом несколько тестов, включая визуализационные исследования, полезны для подтверждения диагноза, дифференциации геморрагического инсульта от ишемического инсульта и для руководства неотложной помощью.
Не существует единого подхода к лечению инсульта у детей. До тех пор, пока не будут доступны данные, основанные на рандомизированных педиатрических клинических испытаниях, рекомендации по лечению неотложной помощи детям с инсультом будут по-прежнему экстраполироваться из руководств для взрослых.
Ссылки
1. Ахо К., Хармсен П., Хатано С. Цереброваскулярные заболевания в обществе: результаты совместного исследования ВОЗ. Бюллетень Всемирной организации здравоохранения . 1980. 58 (1): 113–130. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2.Группа TPSW. Инсульт в детстве. Клинические рекомендации по диагностике, лечению и реабилитации . Саффолк, Великобритания: The Lavenham Press; 2004. [Google Scholar] 3. Хантер СП. Новые рентгенографические методы оценки цереброваскулярных нарушений у детей. Семинары по детской неврологии . 2000. 7 (4): 261–277. [PubMed] [Google Scholar] 4. Альберс Г.В., Каплан Л.Р., Истон Д.Д. и др. Транзиторная ишемическая атака — предложение нового определения. Медицинский журнал Новой Англии .2002. 347 (21): 1713–1716. [PubMed] [Google Scholar] 5. Роуч Е.С., Голомб М.Р., Адамс Р. и др. Ведение инсульта у младенцев и детей: научное заявление специальной группы авторов совета по инсульту Американской кардиологической ассоциации и совета по сердечно-сосудистым заболеваниям у молодежи. Ход . 2008. 39 (9): 2644–2691. [PubMed] [Google Scholar] 6. Флейшер Г.Р., Людвиг С. Учебник педиатрической неотложной медицины . 6-е издание. Филадельфия, Пенсильвания, США: Wolters Kluwer / Lippincott Williams & Wilkins Health; 2010 г.[Google Scholar] 7. Ganesan V, Hogan A, Shack N, Gordon A, Isaacs E, Kirkham FJ. Исход после ишемического инсульта в детстве. Медицина развития и детская неврология . 2000. 42 (7): 455–461. [PubMed] [Google Scholar] 8. Жиру М., Лемель М., Гуйон Дж. Б., Нивелон Дж. Л., Милан С., Дюма Р. Цереброваскулярные заболевания у детей до 16 лет в городе Дижон, Франция: исследование заболеваемости и клинических особенностей с 1985 по 1993 годы. Клиническая эпидемиология . 1995. 48 (11): 1343–1348.[PubMed] [Google Scholar] 9. Lanska MJ, Lanska DJ, Horwitz SJ, Aram DM. Презентация, клиническое течение и исход инсульта в детском возрасте. Детская неврология . 1991. 7 (5): 333–341. [PubMed] [Google Scholar] 10. Фуллертон Х.Дж., Ву Ю.В., Сидней С., Джонстон СК. Риск повторного артериального ишемического инсульта у детей в популяционной когорте: важность цереброваскулярной визуализации. Педиатрия . 2007. 119 (3): 495–501. [PubMed] [Google Scholar] 11. Ganesan V, Prengler M, Wade A, Kirkham FJ.Клинические и рентгенологические рецидивы после артериального ишемического инсульта в детском возрасте. Тираж . 2006. 114 (20): 2170–2177. [PubMed] [Google Scholar] 13. Ganesan V, Prengler M, McShane MA, Wade AM, Kirkham FJ. Исследование факторов риска у детей с артериальным ишемическим инсультом. Анналы неврологии . 2003. 53 (2): 167–173. [PubMed] [Google Scholar] 14. ДеВебер Г. Факторы риска инсульта в детстве: у маленьких людей инсульты разные! Анналы неврологии . 2003. 53 (2): 149–150.[PubMed] [Google Scholar] 15. Miravet E, Danchaivijitr N, Basu H, Saunders DE, Ganesan V. Клинические и радиологические особенности инфаркта головного мозга у детей после инфицирования вирусом ветряной оспы. Медицина развития и детская неврология . 2007. 49 (6): 417–422. [PubMed] [Google Scholar] 16. ДеВебер Г., Стив Роуч Е., Риела А.Р., Визницер М. Инсульт у детей: признание, лечение и будущие направления. Семинары по детской неврологии . 2000. 7 (4): 309–317. [PubMed] [Google Scholar] 17.Ciccone S, Faggioli R, Calzolari F, Sartori S, Calderone M, Borgna-Pignatti C. Инсульт после инфекции ветряной оспы: отчет о случае и обзор литературы. Журнал детских инфекционных болезней . 2010. 29 (9): 864–867. [PubMed] [Google Scholar] 18. Kirkham FJ, Prengler M, Hewes DKM, Ganesan V. Факторы риска артериального ишемического инсульта у детей. Журнал детской неврологии . 2000. 15 (5): 299–307. [PubMed] [Google Scholar] 19. Лопес-Висенте М, Ортега-Гутьеррес С., Амли-Лефонд С., Торби МТ.Диагностика и лечение ишемического инсульта у детей. Инсульт и заболевания сосудов головного мозга . 2010. 19 (3): 175–183. [PubMed] [Google Scholar] 20. Линч Дж. Цереброваскулярные нарушения у детей. Текущие отчеты по неврологии и неврологии . 2004. 4 (2): 129–138. [PubMed] [Google Scholar] 21. Фуллертон HJ, Джонстон SC, Смит WS. Расслоение артерий и инсульт у детей. Неврология . 2001. 57 (7): 1155–1160. [PubMed] [Google Scholar] 22. Габис Л.В., Янгала Р., Ленн Нью-Джерси.Задержка до диагностики инсульта у детей. Педиатрия . 2002. 110 (5): 924–928. [PubMed] [Google Scholar] 23. Shellhaas RA, Smith SE, O’Tool E, Licht DJ, Ichord RN. Мимики инсульта в детстве: характеристики предполагаемой когорты. Педиатрия . 2006. 118 (2): 704–709. [PubMed] [Google Scholar] 24. ДеВебер Г. Инсульт и мозг ребенка: обзор эпидемиологии, синдромов и факторов риска. Текущее мнение в неврологии . 2002. 15 (2): 133–138. [PubMed] [Google Scholar] 25.Гадиан Д.Г., Каламанте Ф., Киркхэм Ф.Дж. и др. Диффузионная и перфузионная магнитно-резонансная томография при инсульте у детей. Детская неврология . 2000. 15 (5): 279–283. [PubMed] [Google Scholar] 26. Джонс Б.П., Ганесан В., Сондерс Д.Е., КлингЧонг В. Визуализация при ишемическом инсульте артерий у детей. Нейрорадиология . 2010. 52 (6): 577–589. [PubMed] [Google Scholar] 27. Саншайн Дж. Л., Бамбакидис Н., Тарр Р. В. и др. Преимущества перфузионной МРТ по сравнению с диффузионной МРТ в диагностике и лечении острейшего инсульта. Американский журнал нейрорадиологии . 2001. 22 (5): 915–921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Иствуд Дж. Д., Лев М. Х., Винтермарк М. и др. Корреляция ранней динамической КТ-визуализации перфузии с МРТ-диффузией и перфузионной визуализацией всего мозга при остром полушарном инсульте. Американский журнал нейрорадиологии . 2003. 24 (9): 1869–1875. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Новак-Гёттль У., Гюнтер Г., Курник К., Стретер Р., Киркхэм Ф. Артериальный ишемический инсульт у новорожденных, младенцев и детей: обзор основных состояний, методов визуализации и методов лечения. Семинары по тромбозам и гемостазу . 2003. 29 (4): 405–414. [PubMed] [Google Scholar] 30. Husson B, Rodesch G, Lasjaunias P, Tardieu M, Sébire G. Магнитно-резонансная ангиография при инфаркте артерий головного мозга у детей: сравнительное исследование с контрастной ангиографией. Ход . 2002. 33 (5): 1280–1285. [PubMed] [Google Scholar] 31. Ганесан В., Савви Л., Чонг В.К., Киркхэм Ф.Дж. Обычная церебральная ангиография у детей с ишемическим инсультом. Детская неврология . 1999. 20 (1): 38–42.[PubMed] [Google Scholar] 32. Husson B, Lasjaunias P. Радиологический подход к заболеваниям артериальных сосудов головного мозга, связанным с артериальным инсультом в детском возрасте — сравнение МРА и контрастной ангиографии. Детская радиология . 2004. 34 (1): 10–15. [PubMed] [Google Scholar] 33. Calder K, Kokorowski P, Tran T, Henderson S. Представление педиатрического инсульта в отделении неотложной помощи. Скорая педиатрическая помощь . 2003. 19 (5): 320–328. [PubMed] [Google Scholar] 34. Мекитариан Филхо Э., Де Карвалью ВБ.Инсульт у детей. Журнал педиатрии . 2009. 85 (6): 469–479. [PubMed] [Google Scholar] 35. Nowak-Göttl U, Sträter R, Heinecke A, et al. Липопротеин (а) и генетический полиморфизм фактора свертывания крови V, протромбина и метилентетрагидрофолатредуктазы являются факторами риска спонтанного ишемического инсульта в детском возрасте. Кровь . 1999. 94 (11): 3678–3682. [PubMed] [Google Scholar] 36. Kenet G, Sadetzki S, Murad H, et al. Фактор V Лейден и антифосфолипидные антитела являются значительными факторами риска ишемического инсульта у детей. Ход . 2000. 31 (6): 1283–1288. [PubMed] [Google Scholar] 37. Несториди Э., Буонанно Ф.С., Джонс Р.М. и др. Артериальный ишемический инсульт в детстве: роль факторов риска плазменной фазы. Текущее мнение в неврологии . 2002. 15 (2): 139–144. [PubMed] [Google Scholar] 38. Аткинс Д.Л., Берг М.Д., Берг Р.А. и др. Педиатрическая базовая и расширенная система жизнеобеспечения. Педиатрия . 2006; 117 (5): e955 – e977. [PubMed] [Google Scholar] 39. Беккер К. Ведение в отделении интенсивной терапии больных, перенесших инсульт. Неврологическая клиника . 2000. 18 (2): 439–454. [PubMed] [Google Scholar] 40. Kirkham FJ. Есть ли генетическая основа для детского инсульта? Текущее мнение в педиатрии . 2003. 15 (6): 547–558. [PubMed] [Google Scholar] 41. Маккей М.Т., Гордон А. Инсульт у детей. Австралийский семейный врач . 2007. 36 (11): 896–902. [PubMed] [Google Scholar] 42. Иордания LC. Оценка и лечение инсульта у детей. Современные методы лечения в неврологии . 2008. 10 (6): 399–409.[PubMed] [Google Scholar] 43. Сахукильо Дж., Арикан Ф. Декомпрессивная трепанация черепа для лечения рефрактерного высокого внутричерепного давления при черепно-мозговой травме. Кокрановская база данных систематических обзоров . 2006; (1) Код статьи CD003983. [PubMed] [Google Scholar] 44. deVeber GA. Цереброваскулярные заболевания. В: Swaiman KF, Ashwal S, Ferriero D, редакторы. Принципы и практика детской неврологии . 4-е издание. Vol. 2. Мосби-Эльзевьер; 2006. С. 1759–1802. [Google Scholar] 46.Массикотт П., Адамс М., Марзинотто В., Брукер Л.А., Эндрю М. Низкомолекулярный гепарин у педиатрических пациентов с тромботической болезнью: исследование подбора дозы. Педиатрический журнал . 1996. 128 (3): 313–318. [PubMed] [Google Scholar] 47. Бурак ЧР, Боуэн MD, Бэррон ТФ. Применение эноксапарина у детей с острым негеморрагическим ишемическим инсультом. Детская неврология . 2003. 29 (4): 295–298. [PubMed] [Google Scholar] 48. Sträter R, Kurnik K, Heller C, Schobess R, Luigs P, Nowak-Göttl U.Аспирин против низкомолекулярного гепарина в низких дозах: антитромботическая терапия у детей с ишемическим инсультом: проспективное последующее исследование. Ход . 2001. 32 (11): 2554–2558. [PubMed] [Google Scholar] 49. Дикс Д., Эндрю М., Марзинотто В. и др. Использование низкомолекулярного гепарина у педиатрических пациентов: проспективное когортное исследование. Педиатрия . 2000. 136 (4): 439–445. [PubMed] [Google Scholar] 50. Монагл П., Чан А., Массикотт П., Чалмерс Э., Майкельсон А.Д. Антитромботическая терапия у детей: седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004; 126 (3): 645С – 687С. [PubMed] [Google Scholar] 51. Soman T, Rafay MF, Hune S, Allen A, MacGregor D, DeVeber G. Риски и безопасность клопидогрела при ишемическом инсульте артерий у детей. Ход . 2006. 37 (4): 1120–1122. [PubMed] [Google Scholar] 52. Gruber A, Nasel C, Lang W, Kitzmüller E, Bavinzski G, Czech T. Внутриартериальный тромболизис для лечения периоперационного кардиоэмболического инсульта у детей. Неврология . 2000. 54 (8): 1684–1686. [PubMed] [Google Scholar] 53.Тирумалай С.С., Шубин Р.А. Успешное лечение инсульта у ребенка с использованием рекомбинантного тканевого активатора плазминогена. Журнал детской неврологии . 2000; 15 (8): с. 558. [PubMed] [Google Scholar] 54. Zenz W, Arlt F, Sodia S, Berghold A. Внутримозговое кровоизлияние во время фибринолитической терапии у детей: обзор литературы за последние тридцать лет. Семинары по тромбозам и гемостазу . 1997. 23 (3): 321–332. [PubMed] [Google Scholar] 55. Элефтериу Д., Ганесан В. Стратегии лечения детского инсульта. Экспертное заключение по фармакотерапии . 2008. 9 (17): 2955–2967. [PubMed] [Google Scholar] 56. Амли-Лефонд С., ДеВебер Дж., Чан А.К. и др. Использование альтеплазы при артериальном ишемическом инсульте у детей: многоцентровое обсервационное когортное исследование. Ланцетная неврология . 2009. 8 (6): 530–536. [PubMed] [Google Scholar] 57. Джордан Л.С., Клейнман Дж. Т., Хиллис А. Э. Объем внутримозгового кровоизлияния указывает на плохой неврологический исход у детей. Ход . 2009. 40 (5): 1666–1671. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58.Пунт Дж. Хирургическое лечение инсульта у детей. Детская радиология . 2004. 34 (1): 16–23. [PubMed] [Google Scholar] 59. Batjer HH, Reisch JS, Allen BC, Plaizier LJ, Jen Su C. Неспособность хирургического вмешательства улучшить исход при гипертоническом путаминальном кровотечении. Проспективное рандомизированное исследование. Архив неврологии . 1990. 47 (10): 1103–1106. [PubMed] [Google Scholar] 60. Tan SH, Ng PY, Yeo TT, Wong SH, Ong PL, Venketasubramanian N. Гипертоническое кровоизлияние в базальные ганглии: проспективное исследование, сравнивающее хирургическое и нехирургическое лечение. Хирургическая неврология . 2001. 56 (5): 287–292. [PubMed] [Google Scholar] 61. Шин М., Кавамото С., Курита Х. и др. Ретроспективный анализ 10-летнего опыта стереотаксической радиохирургии при артериовенозных мальформациях у детей и подростков. Нейрохирургия . 2002. 97 (4): 779–784. [PubMed] [Google Scholar] 62. Коэн-Гадол А.А., Поллок Б.Е. Радиохирургия при артериовенозных мальформациях у детей. Журнал нейрохирургии . 2006. 104 (6): 388–391. [PubMed] [Google Scholar] 63.Булас Д. Скрининг детей на серповидно-клеточную васкулопатию: рекомендации по транскраниальной допплерографии. Детская радиология . 2005. 35 (3): 235–241. [PubMed] [Google Scholar] 64. Квятковски Дж. Л., Циммерман Р. А., Поллок А. Н. и др. Тихие инфаркты у детей раннего возраста с серповидно-клеточной анемией. Британский гематологический журнал . 2009. 146 (3): 300–305. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Стин Р.Г., Эмудиануе Т., Хэнкинс Г.М. и др. Результаты визуализации головного мозга у педиатрических пациентов с серповидно-клеточной анемией. Радиология . 2003. 228 (1): 216–225. [PubMed] [Google Scholar] 66. Армстронг Ф. Д., Томпсон Р. Дж. Мл., Ван В. и др. Когнитивное функционирование и магнитно-резонансная томография мозга у детей с серповидно-клеточной анемией. нейропсихологический комитет кооперативного исследования серповидно-клеточной анемии. Педиатрия . 1996. 97 (6): 864–870. [PubMed] [Google Scholar] 67. Миллер С.Т., Маклин Э.А., Пегелов С.Х. и др. Тихий инфаркт как фактор риска явного инсульта у детей с серповидно-клеточной анемией: отчет совместного исследования серповидно-клеточной анемии. Педиатрический журнал . 2001. 139 (3): 385–390. [PubMed] [Google Scholar] 68. Фуллертон Х.Дж., Адамс Р.Дж., Чжао С., Джонстон СК. Снижение частоты инсульта у калифорнийских детей с серповидно-клеточной анемией. Кровь . 2004. 104 (2): 336–339. [PubMed] [Google Scholar] 69. Адамс Р.Дж., Охене-Фремпонг К., Ван В. Серповидная клетка и мозг. Гематология / Американское общество гематологов. Образовательная программа . 2001: 31–46. [PubMed] [Google Scholar] 70. Куле С., Митчелл Л., Эндрю М. и др. Актуальные клинические проблемы у детей с ишемическим инсультом: анализ 1065 пациентов из службы телефонной консультации по педиатрическому инсульту 1-800-NOCLOTS. Ход . 2006. 37 (1): 116–122. [PubMed] [Google Scholar]
Ишемический инсульт у младенцев и детей: практическое ведение неотложной помощи
Лечение инсульта. 2011; 2011: 736965.
Микела Капелла
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Катерина Боргна-Пигнатти
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, 44121 , Италия
Кафедра клинической и экспериментальной медицины и педиатрии, Университет Феррары, 44121 Феррара, Италия
Академический редактор: Халвор Наесс
Поступила в редакцию 23 сентября 2010 г .; Пересмотрено 27 апреля 2011 г .; Принята в печать 2 мая 2011 г.
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.
Abstract
Инсульт — редкое заболевание у детей, с оценочной заболеваемостью 13/100000 и значительным влиянием на заболеваемость и смертность. Клинические проявления и факторы риска, присутствующие почти у половины педиатрических пациентов, не такие, как у взрослых.Диагностика инсульта у детей часто откладывается, поскольку признаки и симптомы могут быть незаметными и неспецифическими. Анамнез и клиническое обследование должны исключить основные заболевания или предрасполагающие факторы. Нейровизуализация имеет решающее значение для постановки диагноза. В зависимости от клинической картины могут потребоваться другие тесты. Мы представляем здесь самые последние практические указания по диагностике и лечению артериального инсульта у детей в соответствии с различными международными рекомендациями по этому вопросу.
1.Введение
Всемирная организация здравоохранения (ВОЗ) определяет инсульт как «клинический синдром быстро развивающегося очагового или глобального нарушения функции мозга, длящегося более 24 часов или ведущего к смерти без очевидной несосудистой причины» [1]. Это определение следует объединить ссылкой на нейровизуализацию, которая в настоящее время считается необходимой для определения сосудисто-нервного происхождения симптомов. Современное определение может быть «клиническим синдромом, характеризующимся (1) неврологическим дефицитом, связанным с территорией перфузии церебральной артерии, и (2) нейрорадиологическими признаками ишемического поражения» [2, 3].
Преходящие ишемические атаки (ТИА) определяются как «внезапный очаговый неврологический дефицит, который длится менее 24 часов, предположительно сосудистого происхождения, ограниченный областью мозга или глаза, перфузируемой определенной артерией» [4]. В детстве, напротив, даже при наличии преходящих симптомов визуализация часто показывает инфаркт головного мозга [5].
Инсульты классически делятся на преимущественно ишемические и геморрагические. В то время как у взрослых инсульты чаще всего являются ишемическими (80%) и вызваны атеросклерозом, в детском возрасте до 45% инсультов являются геморрагическими и связаны с широким спектром факторов риска [6].
Расчетная частота ишемического инсульта у детей старше 28 дней жизни варьирует [7–9], но, согласно крупному проспективному популяционному исследованию, она составляет в среднем 13 / 100,000 для всех инсультов, 7,9 / 100,000 для ишемических инсультов, и 5.1 для геморрагических инсультов [8]. Примерно 20% детей умирают после ишемического инсульта, в то время как более 50% выживших имеют неврологические осложнения, чаще всего гемипарез [7, 9]. Сообщается, что кумулятивная частота рецидивов инсульта составляет 15% через 1 год, 19% через 5 лет [10] и до 41% через 5 лет [11].
Фактор риска присутствует почти у половины детей во время инсульта [12] (). Распространенными факторами риска в детстве являются врожденные пороки сердца, серповидноклеточная анемия, инфекции и различные протромботические состояния [13–15]. Наиболее частой причиной инсульта у детей, вероятно, является болезнь сердца, выявляемая у 19% детей с артериальным тромбозом (Канадский детский регистр ишемического инсульта) [16]. Недавние исследования подчеркивают важность инфекции: кажется, что по крайней мере треть случаев инсульта у детей происходит в таком контексте.Пятая часть детей с ишемическим инфарктом неизвестного происхождения в анамнезе перенесла ветряную оспу [16–18].
Таблица 1
Факторы риска инсульта у детей.
| Врожденный порок сердца | |
|---|---|
| Дефект межжелудочковой / межпредсердной перегородки | |
| Открытый артериальный проток | |
| Аортальный / митральный стеноз | |
| Коарктация | Коарктация | Сложные врожденные пороки сердца |
| Приобретенный порок сердца | |
| Ревматический порок сердца | |
| Протез клапана сердца | |
| Эндокардит | |
| Миокардит | |
| Миксома предсердий | |
| Аритмия | |
| Системное сосудистое заболевание | |
| Syst Эмическая гипертензия | |
| Истощение объема или системная гипотензия | |
| Гипернатриемия | |
| Синдром верхней полой вены | |
| Диабет | |
| Васкулит | |
| Системная инфекция | |
| Системная красная волчанка | |
| Узелковый полиартериит | |
| Гранулематозный ангиит | |
| Артериит Такаясу | |
| Ревматоидный артрит | |
| Дерзматоидный артрит | |
| Злоупотребление наркотиками (кокаин, амфетамины) | |
| Гемолитико-уремический синдром | |
| Васкулопатии | |
| Синдром Элерса-Данлоса | |
| Гомоцистинурия | |
| Синдром Моямоя | |
| Болезнь Фабри | |
| Злокачественный атрофический папулез | |
| Неразрывная недостаточность псевдоксантомы | |
| Неразрывная псевдоксантома | |
| Вазоспастические расстройства | |
| Мигрень | |
| Отравление спорыньей | |
| Вазоспазм и коагноидальное кровоизлияние | |
| Гемоглобинопатии (серповидно-клеточная анемия, серповидный | |
| клеточный гемоглобин C, серп-талассемия) | |
| Иммунная тромбоцитопеническая пурпура | |
| Тромботическая тромбоцитопеническая пурпура | |
| Тромбоцитоз | |
| Полицитемия | |
| Диссеминированная внутрисосудистая коагуляция | |
| Лейкемия или другие новообразования | |
| Врожденные дефекты свертывания полости рта | |
| Дефицит протеина S | |
| Дефицит протеина C | |
| Врожденный дефицит C2 сыворотки | |
| Дисфункция печени с дефектом коагуляции | |
| Дефицит витамина K | |
| Lupus Anticoagulant | |
| Структурные аномалии цереброваскулярной системы | |
| Артериальная фиброзно-мышечная дисплазия | |
| Агенезия или гипоплазия внутренней сонной артерии или | |
| позвоночных артерий | |
| Артериовенозная мальформация | |
| Наследственная геморрагическая телеангиэктазия | |
| Внутрираничный синдром | |
| Травма | |
| Жестокое обращение с детьми | |
| Жировая или воздушная эмболия | |
| Эмболия инородным телом | |
| Перевязка сонной артерии | |
| Вертебральная окклюзия после резкой ротации | |
| Посттравматическое расслоение артерии | |
| Тупая травма шейной артерии | |
| Артериография | |
| Посттравматический кавернозный свищ сонной артерии | |
| Дефек коагуляции t с незначительной травмой | |
| Проникающая внутричерепная травма |
Примерно у 80% детей с артериальным инсультом визуализация артерий не соответствует норме [12].
Целью данной статьи является предоставление актуальных практических рекомендаций по диагностике и лечению артериального инсульта у детей (от 1 месяца до 18 лет) в отделении неотложной помощи. Неонатальный инсульт не включается из-за его специфических характеристик.
При подготовке этой работы мы следовали самым последним рекомендациям по артериальному инсульту в детстве (Рабочая группа педиатрических инсультов, 2004; Американский колледж грудных врачей, 2004; Итальянское общество педиатров, 2007; Американская ассоциация инсультов, 2008).
Кроме того, был проведен обзор литературы с анализом соответствующих статей по данной теме до августа 2010 г. путем поиска в Pubmed, EMBASE, Кокрановской библиотеке и в библиографиях соответствующих статей. Ключевые слова: «инсульт», «неотложная помощь», «ребенок», «детство», «менеджмент».
2. Диагностика
2.1. Клиническая картина
Клинические проявления инсульта различаются в зависимости от возраста, пораженной артерии и причины [19, 20].
В то время как в младенчестве симптомы обычно неспецифичны, у детей старшего возраста наиболее частыми симптомами являются очаговые неврологические нарушения, такие как гемиплегия или грубый очаговый двигательный дефицит [21].
Симптомы в зависимости от пораженной артерии перечислены в. Наиболее часто поражается сосудистая территория средней мозговой артерии.
Таблица 2
Клиническая картина инсульта в зависимости от пораженной артерии.
| Сосудистая территория | Симптомы |
|---|---|
| Внутренняя сонная артерия | Гемипарез, афазия и гемианопсия |
| Передняя мозговая артерия | Гемипарез, особенно ноги |
| Гемипарез, особенно ноги | |
| Средняя мозговая артерия гемипарез, гемианопсия и афазия | |
| Задняя мозговая артерия | Гемианопсия, атаксия, гемипарез и головокружение |
| Базилярная артерия | Нарушения дыхания, чувствительности или равновесия, атаксия, нистагм, описторотонус и тремор |
| Мозжечковая артерия | Сенсорные нарушения, головная боль, лихорадка, рвота и признаки мозжечка |
2.2. Дифференциальный диагноз
Диагностика инсульта у детей часто откладывается из-за того, что признаки и симптомы могут быть незаметными и неспецифическими, такими как легкая слабость одной конечности, нарушение координации движений и сенсорные расстройства, первоначально вызванные причинами, отличными от инсульта [22].
У ребенка с острым неврологическим дефицитом до постановки диагноза ишемический инсульт необходимо учитывать другие цереброваскулярные заболевания (геморрагический инсульт, тромбоз венозного синуса головного мозга).
Частыми причинами острой гемиплегии являются паралич Тодда, при котором фокальные припадки обычно предшествуют монопарезу или гемиплегии, и гемиплегическая мигрень, при которой гемиплегии предшествуют нарушения зрения или чувствительности, за которыми следует головная боль. Также необходимо исключить менингоэнцефалит, обычно связанный с лихорадкой, головной болью и изменением сознания.
Острый неврологический дефицит может быть вызван опухолями, расстройствами центральной нервной системы, включая острый диссеминированный лейкоэнцефалит, церебеллит, обратимую заднюю лейкоэнцефалопатию, перемежающуюся гемиплегию, метаболические нарушения, эпилепсию и психогенные заболевания [23].
2.3. Раннее обследование (на презентации)
Первым шагом к обнаружению инсульта является включение этой опции в дифференциальный диагноз остро больного ребенка. Ранняя диагностика позволяет оперативно начать соответствующую терапию.
2.3.1. История болезни
Клинический анамнез должен включать этническое происхождение, наличие серповидноклеточной анемии или врожденного порока сердца, травму головы или шеи (связанную с внутричерепным кровоизлиянием и расслоением), недавнюю инфекцию (особенно ветряную оспу), васкулит и заболевания крови [19], так как а также цереброваскулярные заболевания, коагулопатии или иммунологические расстройства у родственников первой степени родства.
Очень важно, как и как быстро развиваются симптомы. До трети детей, перенесших инсульт, имеют в анамнезе недавние события, соответствующие ТИА [24].
2.3.2. Физикальное обследование
Полное физическое и неврологическое обследование, включая мониторинг жизненно важных параметров, выявит неврологические повреждения и позволит предположительно диагностировать пораженный сосуд головного мозга. Следует искать признаки системных заболеваний, повышающих риск инсульта.
2.3.3. Визуализирующие исследования
Неконтрастная компьютерная томография (КТ) может быть выполнена быстро и быстро в экстренных случаях. Он может адекватно исключить геморрагический инсульт или паренхиматозные аномалии, вызывающие массовый эффект, и может выявить поражение низкой плотности при артериальном ишемическом инсульте и тромбозе венозного синуса головного мозга. Однако КТ обычно нормальна в течение первых 12 часов после появления симптомов [6]. Его следует запрашивать, когда магнитный резонанс (МР) недоступен [19].
MR, по сути, является «золотым стандартом» метода визуализации для исследования артериального ишемического инсульта у младенцев и детей [25] из-за его большей чувствительности и специфичности. МРТ полезна для дифференциации инсульта от «имитации инсульта», но редко доступна в экстренных случаях [26]. Диагностическая эффективность МРТ может быть дополнительно улучшена перфузионными методами, которые определяют относительный церебральный кровоток, объем и время прохождения путем болюсного введения контрастного вещества на основе гадолиния [5, 27, 28].
MR с диффузионным взвешиванием очень полезен для точного определения областей ранней ишемии и инфаркта [26]. МР-ангиография — это неинвазивная процедура, позволяющая выявлять большие сосудистые аномалии [29], и она так же эффективна, как церебральная ангиография при выявлении крупных ишемических поражений [30]. МР-ангиография — разумная альтернатива традиционной артериографии у большинства пациентов [31, 32]. Если картина травмы головного мозга может соответствовать венозному инфаркту, экстренная визуализация сосудов должна включать МР-венографию.Фактически, 10% геморрагических инсультов у детей являются вторичными по отношению к тромбозу венозного синуса головного мозга [6].
Визуализация сосудов экстракраниального кровообращения, такая как МРА шейки матки или ультразвуковая допплерография, также должна быть выполнена, особенно если в анамнезе можно предположить расслоение шейной артерии.
2.3.4. Другие исследования
Могут быть полезны полный подсчет клеток крови, исследования железа, протромбиновое время, частичное тромбопластиновое время, скорость оседания и антинуклеарные антитела [19].
2.4. Исследования второй линии (через 48 часов, как указано)
После постановки диагноза инсульта несколько исследований могут быть полезны для постоянного обследования и ведения пациента.
Электрокардиограмма и трансторакальная или чреспищеводная эхокардиограмма всегда необходимы всем детям с известным или предполагаемым врожденным пороком сердца, перенесшим инсульт [20, 33].
Эхокардиография может быть полезной для диагностики открытого овального отверстия; эта аномалия может быть в четыре раза больше у детей с инсультом неустановленной этиологии, чем в общей популяции [34].
Диагностика некоторых состояний, включая расслоение экстракраниальной артерии, особенно с вовлечением заднего отдела кровообращения, и васкулит мелких сосудов, при использовании только МР-ангиографии затруднена. В этих обстоятельствах иногда требуется катетерная церебральная ангиография. Однако катетерная церебральная ангиография является инвазивной процедурой, которая обычно не проводится у детей, и имеет такую же диагностическую ценность, как МРТ в сочетании с МР-венографией и МР-артериографией [6].
Для выявления синдрома моямоя может потребоваться обычная ангиография [19].
Могут быть показаны электрофорез на гемоглобин и скрининг мочи на наркотики, особенно симпатомиметики. Полное обследование на тромбофилию целесообразно у всех детей с инсультом. Он должен включать оценку дефицита протеина C и протеина S, антитромбина III, кофактора гепарина II, плазминогена, антигена фон Виллебранда, фактора VIII, фактора XII, фактора V Лейдена, резистентности к активированному протеину C, гена протромбина 20210, гомоцистеина сыворотки, метилентетра. -гидрофолатредуктаза, липопротеин (а) и антифосфолипидные антитела [35–37].По показаниям на основании клинических подозрений могут быть выполнены более обширные диагностические исследования, такие как анализ спинномозговой жидкости, липидный профиль, ветряная оспа и вирус иммунодефицита человека, а также скрининг метаболических нарушений. Однако в большинстве случаев результаты этих исследований не повлияют на оказание неотложной помощи [19]. Предлагаем блок-схему диагностики ишемического инсульта в экстренных случаях (см.).
Схема: диагностика ишемического инсульта в экстренных случаях.
3. Ведение в чрезвычайных ситуациях
Руководств, основанных на убедительных доказательствах для оказания неотложной помощи при инсульте у детей, не существует, за исключением серповидноклеточной анемии. Таким образом, рекомендации по лечению ишемического инсульта у детей экстраполированы из рекомендаций для взрослых.
Детей с ранним острым ишемическим церебральным инсультом необходимо помещать в клиническое отделение, где возможно постоянное наблюдение. Лишь в отдельных случаях необходимо лечение в отделениях интенсивной терапии [38, 39].
3.1. Поддерживающая терапия
Общий подход в экстренных случаях включает простые меры, такие как поддержание дыхательной и сердечно-сосудистой функций, агрессивное лечение инфекции, судорог и лихорадки, поддержание нормогликемии и нормоволемии [20, 40], а также добавление кислорода для поддержания SaO 2 > 95% в течение первых 24 часов после инсульта [41]. Медикаментозное или хирургическое лечение внутричерепной гипертензии, если таковая имеется, важно, потому что у детей более высокий риск образования грыжи миндалин из-за отека мозга.Гипервентиляция — это краткосрочное решение, которое следует использовать при неизбежной грыже, пока не будет предложено окончательное лечение, такое как декомпрессивная нейрохирургия [40, 42, 43].
3.2. Антикоагулянтная терапия и антитромбоцитарные средства
Выбор между антикоагулянтами и антитромбоцитами является спорным, и существует мало данных, которые помогли бы принять это решение у детей [44].
В качестве антикоагулянтной терапии у детей с АИС применялись нефракционированный гепарин и низкомолекулярный гепарин (НМГ).Текущие рекомендации рекомендуют антикоагулянтную терапию у детей с доказанным расслоением артерии или кардиоэмболическим инсультом или в период диагностической оценки, пока не будет исключен сердечный источник или расслоение артерии [42]. Гепарин следует назначать детям с высоким риском рецидива и низким риском вторичного кровотечения [5, 45].
Согласно международной литературе, НМГ в дозе 1 мг / кг каждые 12 часов представляет собой безопасную начальную терапию ишемического инсульта у младенцев и детей.Перед началом лечения необходимо исключить геморрагический инсульт [46–49]. Низкомолекулярный гепарин предлагает несколько преимуществ по сравнению со стандартным нефракционированным гепарином и пероральными антикоагулянтами: меньший риск гепарин-индуцированной тромбоцитопении, меньшее количество лекарственных взаимодействий, меньшее неблагоприятное воздействие на кости при длительном применении и более низкая стоимость. Кроме того, НМГ вводится подкожно, и он демонстрирует предсказуемую зависящую от возраста фармакокинетику и меньшую потребность в мониторинге, что снижает потребность в множественных венепункциях [46].Эноксапарин (1 мг / кг подкожно для детей старше 2 месяцев или 1,5 мг / кг для детей младше 2 месяцев) является наиболее часто используемым НМГ у детей [47]. У детей с сердечной эмболией или расслоением сосудов НМГ назначают в течение 3–6 месяцев [50].
Что касается антитромбоцитов, то даже при отсутствии рандомизированных клинических испытаний использования аспирина в остром лечении острого инсульта у детей большинство экспертов сходятся во мнении, что это лекарство целесообразно для вторичной профилактики инсульта.В качестве вторичной профилактики рекомендуется стандартная доза от 1 до 5 мг / кг / день в течение минимум 3-5 лет после острого события [50]. Следует учитывать повышенный риск синдрома Рея. Клопидогрел применялся в дозировках около 1 мг / кг в день у детей, которые не могли принимать аспирин [42, 51].
Тромболизис тканевым активатором плазминогена (tPA) в настоящее время не используется, и Королевский колледж врачей, Совет по инсульту AHA и рекомендации ACCP не рекомендуют его. Фактически, диагноз инсульта у детей обычно ставится после интервала времени, необходимого для внутривенного или внутриартериального тромболизиса tPA (3 часа и 6 часов после начала инсульта, соответственно.) [3, 52–54].
Международная группа исследования инсульта у детей не рекомендует использовать тромболизис, если он не является частью рандомизированного контрольного исследования [55, 56].
4. Геморрагический инсульт
Геморрагический инсульт встречается так же часто, как артериальный ишемический инсульт, с оценочной частотой 1,5–2,9 на 100 000 детей в год [41]. Он включает спонтанное внутрипаренхиматозное кровоизлияние и нетравматическое субарахноидальное кровоизлияние.
Структурные поражения являются наиболее частой причиной внутрипаренхиматозных кровоизлияний в популяционной когорте [57].Наиболее часто встречаются опухоли головного мозга (27%) и артериовенозные мальформации (17%). Медицинская этиология встречается реже. Коагулопатии (13%) включают различные причины тромбоцитопении, гемофилии и болезни фон Виллебранда, серповидноклеточной анемии (6%), гипертонии (10%) и инфекций (6%). Также нередки интрапаренхиматозные кровоизлияния идиопатического происхождения (23%).
Нетравматические субарахноидальные кровоизлияния чаще всего возникают из-за внутричерепных аневризм. Разрыв аневризмы составляет 10% внутричерепных кровоизлияний у детей.Частота субарахноидального кровоизлияния увеличивается при различных врожденных и наследственных состояниях, таких как церебральные артериовенозные мальформации, сердечные заболевания (коарктация аорты, бактериальный эндокардит и миксома предсердий), аутосомно-доминантный поликистоз почек, аномалии соединительной ткани (синдром Марфана, фиброзно-мышечная дисплазия и тип IV Элерса-Данлоса), гематологические нарушения (серповидноклеточная анемия, дефицит G6PD и талассемия), факоматозы (нейрофиброматоз 1 типа, особенно после лучевой терапии и туберозный склероз) [58].
Характерными симптомами у детей являются головная боль или рвота из-за повышенного внутричерепного давления, судороги и очаговые неврологические нарушения [41]. При оценке детского инсульта обязательно исключить острое внутрипаренхиматозное кровотечение. Для этого следует провести неконтрастную ТК.
Лечение геморрагического инсульта требует многопрофильного управления командой с неврологической и нейрохирургической помощью.
Варианты ведения при геморрагическом инсульте делятся на две категории: общие усилия по стабилизации состояния пациента и меры по снижению риска повторного кровотечения [5].
Хирургическое лечение спорно, и нет никаких доказательств того, что хирургическая эвакуация супратенториальной интрапаренхиматозной гематомы эффективна в любом возрасте [59, 60]. Однако эвакуация быстро разрастающейся гематомы, вызывающей церебральную грыжу, может быть полезной [6]. Хирургическая или эндоваскулярная облитерация аневризм и артеровенозных мальформаций эффективна для многих людей, но стереотаксическая лучевая терапия все чаще используется у детей с артеровенозными мальформациями, которые малы или трудно поддаются хирургическому вмешательству.Несколько крупных ретроспективных исследований показали, что стереотаксическая лучевая терапия безопасна и эффективна для лечения детей с артеровенозной мальформацией [61, 62].
Лечение дефектов свертывания крови и гематологических нарушений должно снизить риск последующего кровотечения. Экстренная спленэктомия показана при внутрипаренхимальном кровотечении, связанном с идиопатической тромбоцитопенической пурпурой. Другими важными осложнениями нетравматического субарахноидального кровоизлияния, требующими лечения, являются гидроцефалия, вазоспазм и гипонатриемия [5].
5. Инсульт при серповидно-клеточной болезни
Наиболее частым гематологическим фактором риска инсульта является серповидно-клеточная анемия (ВСС). У восьми процентов пациентов младше 19 лет разовьется инсульт. В этой группе самый высокий уровень первого ишемического инсульта наблюдается у детей в возрасте от 2 до 5 лет, тогда как геморрагический инсульт поражает взрослых в возрасте от 20 до 30 лет. В возникновении инсульта, по-видимому, участвуют как семейные факторы, так и факторы окружающей среды [19]. При отсутствии терапии рецидив инсульта достигает 40% [63].
Маленькие инфаркты выявлялись при МРТ у 20–35% детей с ВСС при отсутствии симптомов [64, 65]. Эти так называемые «тихие инфаркты», преимущественно локализующиеся в лобной и теменной корковых, подкорковых и пограничных областях, связаны с ухудшением когнитивной функции и повышенным риском клинически симптоматического инсульта [66, 67].
Инсульт также может быть следствием васкулопатии крупных сосудов, которая обычно затрагивает территорию средней мозговой артерии.У некоторых людей развивается прогрессирующая васкулопатия внутричерепной внутренней сонной артерии и ее дистальных коллатеральных сосудов, картина, называемая синдромом моямоя. Небольшие инфаркты обычно поражают базальные ганглии и глубокое белое вещество в переднем отделе кровообращения.
Факторы риска инсульта при ВСС обобщены в.
Таблица 3
Факторы риска инсульта при серповидно-клеточной анемии.
| (i) высокая скорость кровотока при транскраниальной допплерографии |
| (ii) низкий уровень гемоглобина |
| (iii) высокий уровень HbS |
| (iv) высокий уровень лейкоцитов и тромбоцитов |
| (v) гипертония |
| (vi) тихий инфаркт головного мозга |
| (vii) криз грудной клетки в анамнезе, транзиторные ишемические атаки, менингит, судороги, хирургическое вмешательство, приапизм, острая анемия и переливание крови в течение 2 недель до ход |
5.1. Профилактика
Наличие высокой скорости мозгового кровотока, измеренной с помощью транскраниального допплера (ТД), выявляет пациентов с высоким риском первичной профилактики.
У здоровых детей скорость в средней мозговой артерии составляет около 90 см / с, а у детей с SCD — 130–140 см / с. Риск инсульта высок при скорости> 200 см / с.
Рандомизированное испытание (испытание по профилактике инсульта при серповидно-клеточной анемии: STOP) сравнивало периодическое переливание крови со стандартным лечением у 130 детей с SCD, которые были отобраны с учетом высокого риска инсульта на основании результатов TD.Исследование было остановлено из-за большого количества инсультов в группе стандартной помощи по сравнению с группой, получавшей переливание крови (11 против 1), в которой риск инсульта был снижен с 10% до <1% в год [68] .
Текущая рекомендация Национального института сердца, легких и крови Национального института здоровья (NHLBI) состоит в том, чтобы оценивать детей в возрасте от 2 до 16 лет с SCD с использованием TD с 6-месячными интервалами. Если скорость> 200 см / с, подтвержденная после контроля, проведенного через несколько недель, следует начать хроническую трансфузионную терапию [63], и ее не следует прекращать, даже если TD нормализуется (как продемонстрировало рандомизированное контролируемое исследование STOP II [5]). .
5.2. Терапия
Лечение острого ишемического инфаркта в результате ВСС включает внутривенную гидратацию и обменное переливание крови для поддержания HbS <30% и Hb между 10–12,5 г / дл [69]. Обменное переливание крови позволяет избежать теоретического риска увеличения вязкости крови, которое может сопровождать быстрое повышение гематокрита [5].
6. Выводы
Инсульт у детей встречается относительно редко, за исключением, как уже упоминалось, серповидноклеточной анемии. Однако он представляет собой одну из десяти «главных причин» детской смерти.Его относительно редкость вызывает недостаточное понимание того, что цереброваскулярные заболевания возникают у детей. Кроме того, факторы риска и клинические проявления отличаются от взрослых. По этим причинам диагноз часто откладывается. Было подсчитано, что между появлением симптомов и постановкой диагноза часто проходит 48–72 часа [70].
При обследовании ребенка с инсультом несколько тестов, включая визуализационные исследования, полезны для подтверждения диагноза, дифференциации геморрагического инсульта от ишемического инсульта и для руководства неотложной помощью.
Не существует единого подхода к лечению инсульта у детей. До тех пор, пока не будут доступны данные, основанные на рандомизированных педиатрических клинических испытаниях, рекомендации по лечению неотложной помощи детям с инсультом будут по-прежнему экстраполироваться из руководств для взрослых.
Ссылки
1. Ахо К., Хармсен П., Хатано С. Цереброваскулярные заболевания в обществе: результаты совместного исследования ВОЗ. Бюллетень Всемирной организации здравоохранения . 1980. 58 (1): 113–130. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2.Группа TPSW. Инсульт в детстве. Клинические рекомендации по диагностике, лечению и реабилитации . Саффолк, Великобритания: The Lavenham Press; 2004. [Google Scholar] 3. Хантер СП. Новые рентгенографические методы оценки цереброваскулярных нарушений у детей. Семинары по детской неврологии . 2000. 7 (4): 261–277. [PubMed] [Google Scholar] 4. Альберс Г.В., Каплан Л.Р., Истон Д.Д. и др. Транзиторная ишемическая атака — предложение нового определения. Медицинский журнал Новой Англии .2002. 347 (21): 1713–1716. [PubMed] [Google Scholar] 5. Роуч Е.С., Голомб М.Р., Адамс Р. и др. Ведение инсульта у младенцев и детей: научное заявление специальной группы авторов совета по инсульту Американской кардиологической ассоциации и совета по сердечно-сосудистым заболеваниям у молодежи. Ход . 2008. 39 (9): 2644–2691. [PubMed] [Google Scholar] 6. Флейшер Г.Р., Людвиг С. Учебник педиатрической неотложной медицины . 6-е издание. Филадельфия, Пенсильвания, США: Wolters Kluwer / Lippincott Williams & Wilkins Health; 2010 г.[Google Scholar] 7. Ganesan V, Hogan A, Shack N, Gordon A, Isaacs E, Kirkham FJ. Исход после ишемического инсульта в детстве. Медицина развития и детская неврология . 2000. 42 (7): 455–461. [PubMed] [Google Scholar] 8. Жиру М., Лемель М., Гуйон Дж. Б., Нивелон Дж. Л., Милан С., Дюма Р. Цереброваскулярные заболевания у детей до 16 лет в городе Дижон, Франция: исследование заболеваемости и клинических особенностей с 1985 по 1993 годы. Клиническая эпидемиология . 1995. 48 (11): 1343–1348.[PubMed] [Google Scholar] 9. Lanska MJ, Lanska DJ, Horwitz SJ, Aram DM. Презентация, клиническое течение и исход инсульта в детском возрасте. Детская неврология . 1991. 7 (5): 333–341. [PubMed] [Google Scholar] 10. Фуллертон Х.Дж., Ву Ю.В., Сидней С., Джонстон СК. Риск повторного артериального ишемического инсульта у детей в популяционной когорте: важность цереброваскулярной визуализации. Педиатрия . 2007. 119 (3): 495–501. [PubMed] [Google Scholar] 11. Ganesan V, Prengler M, Wade A, Kirkham FJ.Клинические и рентгенологические рецидивы после артериального ишемического инсульта в детском возрасте. Тираж . 2006. 114 (20): 2170–2177. [PubMed] [Google Scholar] 13. Ganesan V, Prengler M, McShane MA, Wade AM, Kirkham FJ. Исследование факторов риска у детей с артериальным ишемическим инсультом. Анналы неврологии . 2003. 53 (2): 167–173. [PubMed] [Google Scholar] 14. ДеВебер Г. Факторы риска инсульта в детстве: у маленьких людей инсульты разные! Анналы неврологии . 2003. 53 (2): 149–150.[PubMed] [Google Scholar] 15. Miravet E, Danchaivijitr N, Basu H, Saunders DE, Ganesan V. Клинические и радиологические особенности инфаркта головного мозга у детей после инфицирования вирусом ветряной оспы. Медицина развития и детская неврология . 2007. 49 (6): 417–422. [PubMed] [Google Scholar] 16. ДеВебер Г., Стив Роуч Е., Риела А.Р., Визницер М. Инсульт у детей: признание, лечение и будущие направления. Семинары по детской неврологии . 2000. 7 (4): 309–317. [PubMed] [Google Scholar] 17.Ciccone S, Faggioli R, Calzolari F, Sartori S, Calderone M, Borgna-Pignatti C. Инсульт после инфекции ветряной оспы: отчет о случае и обзор литературы. Журнал детских инфекционных болезней . 2010. 29 (9): 864–867. [PubMed] [Google Scholar] 18. Kirkham FJ, Prengler M, Hewes DKM, Ganesan V. Факторы риска артериального ишемического инсульта у детей. Журнал детской неврологии . 2000. 15 (5): 299–307. [PubMed] [Google Scholar] 19. Лопес-Висенте М, Ортега-Гутьеррес С., Амли-Лефонд С., Торби МТ.Диагностика и лечение ишемического инсульта у детей. Инсульт и заболевания сосудов головного мозга . 2010. 19 (3): 175–183. [PubMed] [Google Scholar] 20. Линч Дж. Цереброваскулярные нарушения у детей. Текущие отчеты по неврологии и неврологии . 2004. 4 (2): 129–138. [PubMed] [Google Scholar] 21. Фуллертон HJ, Джонстон SC, Смит WS. Расслоение артерий и инсульт у детей. Неврология . 2001. 57 (7): 1155–1160. [PubMed] [Google Scholar] 22. Габис Л.В., Янгала Р., Ленн Нью-Джерси.Задержка до диагностики инсульта у детей. Педиатрия . 2002. 110 (5): 924–928. [PubMed] [Google Scholar] 23. Shellhaas RA, Smith SE, O’Tool E, Licht DJ, Ichord RN. Мимики инсульта в детстве: характеристики предполагаемой когорты. Педиатрия . 2006. 118 (2): 704–709. [PubMed] [Google Scholar] 24. ДеВебер Г. Инсульт и мозг ребенка: обзор эпидемиологии, синдромов и факторов риска. Текущее мнение в неврологии . 2002. 15 (2): 133–138. [PubMed] [Google Scholar] 25.Гадиан Д.Г., Каламанте Ф., Киркхэм Ф.Дж. и др. Диффузионная и перфузионная магнитно-резонансная томография при инсульте у детей. Детская неврология . 2000. 15 (5): 279–283. [PubMed] [Google Scholar] 26. Джонс Б.П., Ганесан В., Сондерс Д.Е., КлингЧонг В. Визуализация при ишемическом инсульте артерий у детей. Нейрорадиология . 2010. 52 (6): 577–589. [PubMed] [Google Scholar] 27. Саншайн Дж. Л., Бамбакидис Н., Тарр Р. В. и др. Преимущества перфузионной МРТ по сравнению с диффузионной МРТ в диагностике и лечении острейшего инсульта. Американский журнал нейрорадиологии . 2001. 22 (5): 915–921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Иствуд Дж. Д., Лев М. Х., Винтермарк М. и др. Корреляция ранней динамической КТ-визуализации перфузии с МРТ-диффузией и перфузионной визуализацией всего мозга при остром полушарном инсульте. Американский журнал нейрорадиологии . 2003. 24 (9): 1869–1875. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Новак-Гёттль У., Гюнтер Г., Курник К., Стретер Р., Киркхэм Ф. Артериальный ишемический инсульт у новорожденных, младенцев и детей: обзор основных состояний, методов визуализации и методов лечения. Семинары по тромбозам и гемостазу . 2003. 29 (4): 405–414. [PubMed] [Google Scholar] 30. Husson B, Rodesch G, Lasjaunias P, Tardieu M, Sébire G. Магнитно-резонансная ангиография при инфаркте артерий головного мозга у детей: сравнительное исследование с контрастной ангиографией. Ход . 2002. 33 (5): 1280–1285. [PubMed] [Google Scholar] 31. Ганесан В., Савви Л., Чонг В.К., Киркхэм Ф.Дж. Обычная церебральная ангиография у детей с ишемическим инсультом. Детская неврология . 1999. 20 (1): 38–42.[PubMed] [Google Scholar] 32. Husson B, Lasjaunias P. Радиологический подход к заболеваниям артериальных сосудов головного мозга, связанным с артериальным инсультом в детском возрасте — сравнение МРА и контрастной ангиографии. Детская радиология . 2004. 34 (1): 10–15. [PubMed] [Google Scholar] 33. Calder K, Kokorowski P, Tran T, Henderson S. Представление педиатрического инсульта в отделении неотложной помощи. Скорая педиатрическая помощь . 2003. 19 (5): 320–328. [PubMed] [Google Scholar] 34. Мекитариан Филхо Э., Де Карвалью ВБ.Инсульт у детей. Журнал педиатрии . 2009. 85 (6): 469–479. [PubMed] [Google Scholar] 35. Nowak-Göttl U, Sträter R, Heinecke A, et al. Липопротеин (а) и генетический полиморфизм фактора свертывания крови V, протромбина и метилентетрагидрофолатредуктазы являются факторами риска спонтанного ишемического инсульта в детском возрасте. Кровь . 1999. 94 (11): 3678–3682. [PubMed] [Google Scholar] 36. Kenet G, Sadetzki S, Murad H, et al. Фактор V Лейден и антифосфолипидные антитела являются значительными факторами риска ишемического инсульта у детей. Ход . 2000. 31 (6): 1283–1288. [PubMed] [Google Scholar] 37. Несториди Э., Буонанно Ф.С., Джонс Р.М. и др. Артериальный ишемический инсульт в детстве: роль факторов риска плазменной фазы. Текущее мнение в неврологии . 2002. 15 (2): 139–144. [PubMed] [Google Scholar] 38. Аткинс Д.Л., Берг М.Д., Берг Р.А. и др. Педиатрическая базовая и расширенная система жизнеобеспечения. Педиатрия . 2006; 117 (5): e955 – e977. [PubMed] [Google Scholar] 39. Беккер К. Ведение в отделении интенсивной терапии больных, перенесших инсульт. Неврологическая клиника . 2000. 18 (2): 439–454. [PubMed] [Google Scholar] 40. Kirkham FJ. Есть ли генетическая основа для детского инсульта? Текущее мнение в педиатрии . 2003. 15 (6): 547–558. [PubMed] [Google Scholar] 41. Маккей М.Т., Гордон А. Инсульт у детей. Австралийский семейный врач . 2007. 36 (11): 896–902. [PubMed] [Google Scholar] 42. Иордания LC. Оценка и лечение инсульта у детей. Современные методы лечения в неврологии . 2008. 10 (6): 399–409.[PubMed] [Google Scholar] 43. Сахукильо Дж., Арикан Ф. Декомпрессивная трепанация черепа для лечения рефрактерного высокого внутричерепного давления при черепно-мозговой травме. Кокрановская база данных систематических обзоров . 2006; (1) Код статьи CD003983. [PubMed] [Google Scholar] 44. deVeber GA. Цереброваскулярные заболевания. В: Swaiman KF, Ashwal S, Ferriero D, редакторы. Принципы и практика детской неврологии . 4-е издание. Vol. 2. Мосби-Эльзевьер; 2006. С. 1759–1802. [Google Scholar] 46.Массикотт П., Адамс М., Марзинотто В., Брукер Л.А., Эндрю М. Низкомолекулярный гепарин у педиатрических пациентов с тромботической болезнью: исследование подбора дозы. Педиатрический журнал . 1996. 128 (3): 313–318. [PubMed] [Google Scholar] 47. Бурак ЧР, Боуэн MD, Бэррон ТФ. Применение эноксапарина у детей с острым негеморрагическим ишемическим инсультом. Детская неврология . 2003. 29 (4): 295–298. [PubMed] [Google Scholar] 48. Sträter R, Kurnik K, Heller C, Schobess R, Luigs P, Nowak-Göttl U.Аспирин против низкомолекулярного гепарина в низких дозах: антитромботическая терапия у детей с ишемическим инсультом: проспективное последующее исследование. Ход . 2001. 32 (11): 2554–2558. [PubMed] [Google Scholar] 49. Дикс Д., Эндрю М., Марзинотто В. и др. Использование низкомолекулярного гепарина у педиатрических пациентов: проспективное когортное исследование. Педиатрия . 2000. 136 (4): 439–445. [PubMed] [Google Scholar] 50. Монагл П., Чан А., Массикотт П., Чалмерс Э., Майкельсон А.Д. Антитромботическая терапия у детей: седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004; 126 (3): 645С – 687С. [PubMed] [Google Scholar] 51. Soman T, Rafay MF, Hune S, Allen A, MacGregor D, DeVeber G. Риски и безопасность клопидогрела при ишемическом инсульте артерий у детей. Ход . 2006. 37 (4): 1120–1122. [PubMed] [Google Scholar] 52. Gruber A, Nasel C, Lang W, Kitzmüller E, Bavinzski G, Czech T. Внутриартериальный тромболизис для лечения периоперационного кардиоэмболического инсульта у детей. Неврология . 2000. 54 (8): 1684–1686. [PubMed] [Google Scholar] 53.Тирумалай С.С., Шубин Р.А. Успешное лечение инсульта у ребенка с использованием рекомбинантного тканевого активатора плазминогена. Журнал детской неврологии . 2000; 15 (8): с. 558. [PubMed] [Google Scholar] 54. Zenz W, Arlt F, Sodia S, Berghold A. Внутримозговое кровоизлияние во время фибринолитической терапии у детей: обзор литературы за последние тридцать лет. Семинары по тромбозам и гемостазу . 1997. 23 (3): 321–332. [PubMed] [Google Scholar] 55. Элефтериу Д., Ганесан В. Стратегии лечения детского инсульта. Экспертное заключение по фармакотерапии . 2008. 9 (17): 2955–2967. [PubMed] [Google Scholar] 56. Амли-Лефонд С., ДеВебер Дж., Чан А.К. и др. Использование альтеплазы при артериальном ишемическом инсульте у детей: многоцентровое обсервационное когортное исследование. Ланцетная неврология . 2009. 8 (6): 530–536. [PubMed] [Google Scholar] 57. Джордан Л.С., Клейнман Дж. Т., Хиллис А. Э. Объем внутримозгового кровоизлияния указывает на плохой неврологический исход у детей. Ход . 2009. 40 (5): 1666–1671. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58.Пунт Дж. Хирургическое лечение инсульта у детей. Детская радиология . 2004. 34 (1): 16–23. [PubMed] [Google Scholar] 59. Batjer HH, Reisch JS, Allen BC, Plaizier LJ, Jen Su C. Неспособность хирургического вмешательства улучшить исход при гипертоническом путаминальном кровотечении. Проспективное рандомизированное исследование. Архив неврологии . 1990. 47 (10): 1103–1106. [PubMed] [Google Scholar] 60. Tan SH, Ng PY, Yeo TT, Wong SH, Ong PL, Venketasubramanian N. Гипертоническое кровоизлияние в базальные ганглии: проспективное исследование, сравнивающее хирургическое и нехирургическое лечение. Хирургическая неврология . 2001. 56 (5): 287–292. [PubMed] [Google Scholar] 61. Шин М., Кавамото С., Курита Х. и др. Ретроспективный анализ 10-летнего опыта стереотаксической радиохирургии при артериовенозных мальформациях у детей и подростков. Нейрохирургия . 2002. 97 (4): 779–784. [PubMed] [Google Scholar] 62. Коэн-Гадол А.А., Поллок Б.Е. Радиохирургия при артериовенозных мальформациях у детей. Журнал нейрохирургии . 2006. 104 (6): 388–391. [PubMed] [Google Scholar] 63.Булас Д. Скрининг детей на серповидно-клеточную васкулопатию: рекомендации по транскраниальной допплерографии. Детская радиология . 2005. 35 (3): 235–241. [PubMed] [Google Scholar] 64. Квятковски Дж. Л., Циммерман Р. А., Поллок А. Н. и др. Тихие инфаркты у детей раннего возраста с серповидно-клеточной анемией. Британский гематологический журнал . 2009. 146 (3): 300–305. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Стин Р.Г., Эмудиануе Т., Хэнкинс Г.М. и др. Результаты визуализации головного мозга у педиатрических пациентов с серповидно-клеточной анемией. Радиология . 2003. 228 (1): 216–225. [PubMed] [Google Scholar] 66. Армстронг Ф. Д., Томпсон Р. Дж. Мл., Ван В. и др. Когнитивное функционирование и магнитно-резонансная томография мозга у детей с серповидно-клеточной анемией. нейропсихологический комитет кооперативного исследования серповидно-клеточной анемии. Педиатрия . 1996. 97 (6): 864–870. [PubMed] [Google Scholar] 67. Миллер С.Т., Маклин Э.А., Пегелов С.Х. и др. Тихий инфаркт как фактор риска явного инсульта у детей с серповидно-клеточной анемией: отчет совместного исследования серповидно-клеточной анемии. Педиатрический журнал . 2001. 139 (3): 385–390. [PubMed] [Google Scholar] 68. Фуллертон Х.Дж., Адамс Р.Дж., Чжао С., Джонстон СК. Снижение частоты инсульта у калифорнийских детей с серповидно-клеточной анемией. Кровь . 2004. 104 (2): 336–339. [PubMed] [Google Scholar] 69. Адамс Р.Дж., Охене-Фремпонг К., Ван В. Серповидная клетка и мозг. Гематология / Американское общество гематологов. Образовательная программа . 2001: 31–46. [PubMed] [Google Scholar] 70. Куле С., Митчелл Л., Эндрю М. и др. Актуальные клинические проблемы у детей с ишемическим инсультом: анализ 1065 пациентов из службы телефонной консультации по педиатрическому инсульту 1-800-NOCLOTS. Ход . 2006. 37 (1): 116–122. [PubMed] [Google Scholar]
Артериальный ишемический инсульт у детей
Что такое артериальный ишемический инсульт?
Артериальный ишемический инсульт (АИС) — это повреждение головного или спинного мозга, вызванное недостатком кислорода в пораженной области. Обычно AIS возникает в результате обструкции кровотока сгустками крови, суженными или поврежденными артериями или и тем, и другим.
Дети обычно выздоравливают после инсульта быстрее и полностью, чем взрослые, благодаря своим молодым, здоровым кровеносным сосудам и способности молодого мозга адаптироваться после травмы.Некоторые поглаживания будут иметь минимальный эффект или не будут иметь долгосрочного эффекта. Другие, однако, могут вызвать проблемы в зависимости от тяжести инсульта, пораженной части мозга и того, насколько быстро он лечится. Осложнения могут включать слабость, потерю чувствительности, проблемы со зрением, а также когнитивные или языковые нарушения.
Каковы симптомы ишемического инсульта артерии?
Симптомы артериального ишемического инсульта обычно возникают внезапно и могут поражать только одну сторону тела. Новорожденные могут не проявлять заметных симптомов, но у некоторых младенцев могут быть судороги или необычная раздражительность.
У детей старшего возраста симптомы включают:
- припадки, особенно поражающие одну сторону тела
- ощущение слабости или онемения в конечностях, обычно с одной стороны тела или лица
- Проблемы с ходьбой из-за слабости
- проблемы с речью или пониманием того, что говорят другие
- сильная головная боль, особенно сопровождающаяся сонливостью, двоением в глазах или рвотой
- головокружение, потеря равновесия или падение
- проблемы со зрением на один или оба глаза
Если у вашего ребенка есть какие-либо из этих симптомов, не ждите — немедленно обратитесь в отделение неотложной помощи.
Что вызывает артериальный ишемический инсульт?
Детские артерии могут быть закупорены по ряду причин, которые делятся на две основные группы.
Сгустки крови, вызванные:
- Заболевания крови, такие как серповидноклеточная анемия и нарушения свертывания крови
- врожденный порок сердца, приводящий к образованию тромбов, перемещающихся в мозг
- серьезные инфекции
- нарушение обмена веществ
- гиперкоагуляция или аномальное свертывание крови во время рождения (у новорожденных)
Повреждение или аномалия артерий, вызванная:
- несчастные случаи с травмами головы и шеи
- расслоение артерии, разрыв слизистой оболочки артерии, вызванный травмой или заболеванием, ослабляющим стенки артерии
- Болезнь моямоя
- церебральный артериит или васкулит
Как лечить артериальный ишемический инсульт
Дети, перенесшие артериальный ишемический инсульт, должны получать помощь многопрофильной группы специалистов, начиная с отделения неотложной помощи.В Бостонской детской больнице сотрудники нашего Центра инсульта и цереброваскулярных заболеваний приезжают в отделение неотложной помощи и при необходимости быстро доставляют вашему ребенку препараты, растворяющие тромбы. В некоторых случаях мы используем крошечные устройства на основе катетера для физического разрушения или извлечения сгустка. Наш Центр цереброваскулярной хирургии и вмешательств первым применил эти методы у детей. Если инсульт был вызван травмой или заболеванием самих артерий, мы можем использовать хирургическую или нейроинтервенционную процедуру для исправления состояния.Если инсульт связан с воспалением артерий в головном мозге, может потребоваться медицинское лечение для устранения сосудистого воспаления.
Когда непосредственная опасность миновала, наши специалисты оказывают долгосрочную помощь, составляя комплексный план реабилитации, чтобы помочь каждому ребенку восстановить наилучшее возможное качество жизни.
Типы, причины и симптомы инсульта у детей
Каковы признаки и симптомы инсульта?
Признаки и симптомы инсульта у детей включают:
- Затруднения при разговоре
- Боль или скованность в шее
- Онемение или покалывание
- Начало летаргии или затруднения при ходьбе
- Изъятие
- Внезапный обвал
- Внезапная потеря сознания
- Внезапная потеря подвижности или слабость лица, руки или ноги
- Внезапное начало сильной головной боли
- Рвота
Какие типы инсультов у детей наиболее распространены?
Инсульт — это необратимое повреждение головного мозга, вызванное кровотечением (геморрагический инсульт) или недостатком кислорода (ишемический инсульт).Инсульт может случиться в любой момент жизни человека. Инсульт в детстве, в том числе в период новорожденности, сегодня получает все большее признание. Общие типы детских инсультов включают:
- Перинатальный (новорожденный) инсульт — Инсульт у новорожденных является обычным явлением, часто остается незамеченным и недиагностированным.
- Геморрагический инсульт — Этот инсульт возникает, когда кровеносный сосуд в головном мозге или рядом с ним разрывается, вызывая кровотечение в головном мозге.
- Ишемический инсульт — Ишемический инсульт возникает, когда приток крови к мозгу снижается, обычно из-за сгустка, называемого тромбом, в одном из кровеносных сосудов головного мозга.У детей, особенно новорожденных, бывает два типа ишемического инсульта: синовенозный тромбоз и артериальный ишемический инсульт.
- Инсульт с синовенозным тромбозом — Этот инсульт возникает, когда в одной из вен головного мозга имеется тромб.
- Артериальный ишемический инсульт — Этот инсульт возникает, когда в артерии головного мозга имеется тромб.
- Церебральный венозный тромбоз (CVT) — CVT — это инсульт, который возникает в результате тромбоза (сгустка крови) в синусах твердой мозговой оболочки, отводящих кровь от головного мозга.
Каковы причины инсульта у детей?
Трудно определить причины многих случаев инсульта. В некоторых случаях цереброваскулярные аномалии — состояния, которые характеризуются деформированием кровеносных сосудов — могут вызывать симптомы инсульта у ребенка.
Основные причины:
- Генетические причины: серповидноклеточные клетки, нарушения свертывания крови и другие нарушения
- Причины, связанные с окружающей средой: отравление угарным газом, инфекция, лекарства, травмы, васкулит и расслоение.
- Врожденные причины: артериовенозная мальформация, аневризма, синдром Моямойи и другие цереброваскулярные аномалии.
Узнайте, как Институт по уходу за мозгом детской больницы лечит детей и младенцев, перенесших инсульт.
Узнайте больше о детской неврологии.
МРТ головного мозга новорожденного
Эухенио Меркури, Лилли Дубовиц и Мэри А. Резерфорд
7
Неонатальный церебральный инфаркт или инсульт можно определить как «серьезную дезорганизацию архитектуры серого и / или белого вещества, вызванную эмболическими, тромботическими или ишемическими событиями».Увеличение количества неонатальных изображений у младенцев с патологическими неврологическими признаками выявило широкий спектр этих поражений 2,
4,
6,
8,
9,
11,
13,
16,
19,
23,
26,
29
.
Инфаркты можно разделить на два основных типа: инфаркты, возникающие на территории крупной артерии, и инфаркты, возникающие в пограничной зоне или на водоразделах.
<предыдущая | наверх | содержание | следующая>
ЭТИОЛОГИЯ
Наиболее часто описываемым типом инфаркта головного мозга новорожденных у доношенных детей являются ишемические поражения в области большой мозговой артерии.Чаще всего поражается средняя мозговая артерия, и, как и при инсульте у взрослых, левая средняя мозговая артерия поражается в три-четыре раза чаще, чем правая 15 . Младенцы с поражением передней или задней церебральной артерии могут протекать бессимптомно и, следовательно, не диагностироваться. Кроме того, поражения в этих областях может быть трудно обнаружить с помощью УЗИ черепа 19, 23 .
До появления нейровизуализации инфаркт считался редким заболеванием, распознаваемым только при патологоанатомическом исследовании у младенцев с врожденным пороком сердца или другими опасными для жизни состояниями, такими как диссеминированное внутрисосудистое свертывание крови или сепсис.
После внедрения в конце 1970-х годов неонатального УЗИ черепа и компьютерной томографии инфаркты головного мозга также были выявлены у выживших младенцев, большинство из которых были связаны с тяжелой перинатальной асфиксией 2 . Крупные инфаркты также наблюдались у маленьких детей, у которых не было очевидных перинатальных проблем, и считалось, что в этих случаях инфаркты, должно быть, произошли внутриутробно. Совсем недавно ранняя и серийная визуализация новорожденных позволила нам признать, что инфаркты встречаются чаще, чем предполагалось, а также предоставила информацию о спектре этих поражений и их возможной этиологии 4,
6,
8,
9,
11,
13,
16,
19,
23,
26,
29
.
Этиология большинства артериальных инфарктов остается неясной, поскольку только меньшая часть связана с клиническими состояниями, о которых сообщалось в более ранних исследованиях. Тяжелые неблагоприятные антенатальные и перинатальные факторы относительно редки, и хотя у многих из этих младенцев есть некоторые признаки дистресс-синдрома плода, их оценка по шкале Апгар обычно нормальна через 5 минут 19 . Начало судорог в первые дни жизни обычно является первым клиническим признаком, ведущим к диагностическому исследованию. В последние годы изучалась этиологическая роль гематологических факторов при инфаркте головного мозга, при этом были получены некоторые сообщения о повышении частоты гетерозиготности по фактору V Лейдена.В нашей когорте из 24 младенцев с артериальным инфарктом пять младенцев были гетерозиготными по фактору V Лейден, у всех развилась гемиплегия, по сравнению только с одним из 19 младенцев без фактора V Лейден 24 .
КЛИНИЧЕСКИЕ ВЫВОДЫ
Младенцы с очаговым инфарктом обычно не страдают энцефалопатией; они бдительны и реагируют на визуальные и слуховые раздражители. Судороги часто являются первым и единственным клиническим признаком, который привлекает внимание к наличию поражения в первые дни жизни.Судороги вначале обычно односторонние, но во время припадка могут стать генерализованными. У некоторых младенцев может наблюдаться ненормальный тонус конечностей, обычно противоположных, но иногда ипсилатеральных по отношению к поражению 7 . Эти аномальные неонатальные признаки, если они присутствуют, часто являются временными и не предсказывают более поздний исход 23 . В некоторых случаях патологические клинические признаки в неонатальном периоде либо отсутствуют, либо настолько незаметны, что их невозможно обнаружить (рис. 7.2). Исход развития нервной системы у младенцев с перинатальным инфарктом варьирует от нормального до наличия гемиплегии.Ранняя непрерывная ЭЭГ может демонстрировать судорожную активность, но оценка фоновой активности наиболее важна для прогнозирования двигательного исхода 23, 32 . Младенцы с более поздней гемиплегией или без нее могут быть подвержены риску немоторных нарушений, которые становятся очевидными в раннем детстве (см. Истории болезни).
Рис. 7.1 (a) Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 3 недель. Небольшой инфаркт с вовлечением головки хвостатого ядра и лентиформы слева (стрелка).(b) Последовательность восстановления инверсии (IR 3800/30/800). Младенец в возрасте 12 месяцев. Обширный инфаркт и атрофия левого полушария. Слева снижена высокая интенсивность сигнала миелинизации. Желудочки расширены. (c) Взвешенная последовательность спинового эха T1 (SE 860/20). Младенец в возрасте 7 дней. Внутри хвостатой головки и лентиформ слева (длинная стрелка) наблюдается аномальная интенсивность сигнала. Имеется дополнительное выделение сильвиевой коры и низкий сигнал в соседнем подкорковом белом веществе (короткая стрелка).(d) Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 9 дней. Инфаркт левой теменной / височной / затылочной области. Поражение медиальной части затылочной доли (стрелка) указывает на территорию задней мозговой артерии. Это поражение может представлять собой асимметричное поражение водораздела. Требуется тщательное изучение всех уровней визуализации для выявления вовлечения других водоразделов.
Рис. 7.2 (a), (b), (c) Последовательность быстрого спинового эха (FSE 3000/208).Младенец в возрасте 3 дней. Этот младенец был зачислен в контрольную группу для исследования изображений. У него не было никаких признаков. Инфаркт на территории ВМА подхватили случайно. Потеря дифференциации серого / белого вещества с аномально высокой интенсивностью сигнала (стрелки), затрагивающей теменные (а), затылочные (b) и височные (с) доли. Изменения интенсивности сигнала соответствуют перинатальному инсульту.
РЕЗУЛЬТАТЫ МРТ
Спектр поражений широк, от небольших аномалий в базальных ганглиях (рис.7.1а) до очень обширных, охватывающих большую часть полушария (рис. 7.1б). Также могут быть комбинации поражений у одного и того же младенца (рис. 7.1c). Может быть трудно определить точное место инфаркта. Инфаркты в задней части средней мозговой артерии можно спутать с инфарктами, возникающими из задней мозговой артерии или в результате асимметричных водоразделов (см. Ниже) (рис. 7.1d). Путаница может возникнуть из-за индивидуальных различий в артериальном распределении мозга.Кроме того, по мере роста мозга и развития инфаркта участок аномалии на МРТ может сдвигаться, что еще больше усложняет проблему (случай 7.3).
Следующая классификация инфарктов средней мозговой артерии в зависимости от вовлеченной ветви была предложена de Vries et al. 6 :
- главный филиал
- кортикальная ветвь
- лентикулостриатная ветвь.
Хотя все эти поражения могут возникать как у недоношенных, так и у доношенных детей, поражение основной ветви или одной из кортикальных ветвей чаще наблюдается у доношенных детей, а поражения лентикулостриатной ветви у недоношенных. (см. главу 8).
Рис. 7.3 Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 14 дней. Имеется обширный инфаркт с поражением левого полушария. В базальных ганглиях, таламусе и внутренней капсуле слева есть дополнительные аномальные высокие и низкие интенсивности сигналов. Нормальный сигнал от миелина в задней части внутренней капсулы виден только справа (стрелка).
Рис. 7.4 Последовательность восстановления инверсии (IR 3800/30/950).Младенец в возрасте 6 дней. В височном полюсе слева небольшой очаг инфаркта (стрелка). Инфаркт был более обширным на верхних срезах. Небольшое геморрагическое поражение в правом среднем мозге (длинная стрелка). Субдуральное кровоизлияние вокруг поверхности мозга (короткая стрелка).
Основная ветвь / корковая ветвь
У новорожденных эти поражения в основном ишемические без геморрагического компонента, в отличие от инфарктов, которые возникают у детей старшего возраста и у взрослых.Первоначальное поражение рассматривается как потеря дифференциации серого / белого вещества с преимущественно низкой интенсивностью сигнала на T1 и высокой интенсивностью сигнала на T2-взвешенных изображениях (рис. 7.2).
Инфаркты, связанные с окклюзией основной ветви средней мозговой артерии (СМА), могут поражать белое вещество и кору в пределах лобной, теменной, височной и затылочной долей (рис. 7.2). Может иметь место дополнительное поражение внутренней ипсилатеральной капсулы и базальные ганглии / таламус (рис. 7.3).Инфаркт в области церебральной артерии также может возникать в сочетании с другими ишемическими или геморрагическими поражениями в ипсилатеральном или контралатеральном полушарии (рис. 7.4). Основной инфаркт может быть связан с контралатеральным инфарктом (случай 7.7), с более дискретными ишемическими поражениями (рис. 7.5) или точечными геморрагическими поражениями (рис. 7.6) в белом веществе. У младенцев с двусторонним поражением территории СМА может развиться перисильвиальный синдром (случай 7.7).
Локализация и степень изменений, связанных с окклюзией корковой ветви, весьма разнообразны.В нашей недавней серии из 20 младенцев с инфарктами корковых ветвей только у четырех младенцев были дополнительные поражения в базальных ганглиях / таламусе и внутренней капсуле 23 .
Используя серийную визуализацию, можно наблюдать эволюцию областей инфаркта в течение первых нескольких недель и месяцев жизни.
Рис. 7.5 Последовательность восстановления инверсии (IR 3800/30/950). (а, б) Младенец в возрасте 6 дней. В коре правой сильвиевой щели наблюдается аномально высокая интенсивность сигнала.(а) (стрелка) Имеется асимметрия интенсивности сигнала от миелина в задней конечности внутренней капсулы с уменьшенной интенсивностью сигнала справа (длинная стрелка). Есть дополнительная аномально низкая интенсивность сигнала в правом таламусе и лентиформном ядре. В левой затылочной доле имеется дополнительная область аномально высокой интенсивности сигнала (b) (стрелка). Последовательность, взвешенная по Т2 (SE 3000/120). Тот же младенец в возрасте 6 дней. (c) Нарушения в коре головного мозга воспринимаются как низкая интенсивность сигнала и более очевидны.Аномалии в чечевицеобразной форме и таламусе видны как высокая интенсивность сигнала. Задняя конечность внутренней капсулы имеет аномально высокую интенсивность сигнала на всем протяжении (стрелка). Последовательность инверсионного восстановления (IR 3400/30/800) (d) в возрасте 20 месяцев. Есть две отдельные области инфаркта (стрелки) и умеренного расширения желудочков.
Рис. 7.6 Взвешенная последовательность спинового эха T1 (SE860 / 20). (a), (b) Младенец в возрасте 7 дней (как на рис. 7.1c). В белом веществе и базальных ганглиях есть небольшие геморрагические поражения с высокой интенсивностью сигнала (стрелки).
Evolution первая неделя
Изменения в течение первых нескольких дней жизни может быть трудно идентифицировать с помощью одной только традиционной визуализации (рис. 7.7). Обычная визуализация в течение первой недели покажет потерю дифференциации серого / белого вещества с, как правило, низкой интенсивностью сигнала в области инфаркта на изображениях, взвешенных по T1. На изображениях, взвешенных по T2, наблюдается потеря дифференциации и обычно повышенная интенсивность сигнала (рис. 7.8). Изменения обычно легче идентифицировать на сканировании с взвешиванием T2 (рис.7.8). Визуализация с диффузионным взвешиванием в течение первой недели «выделяет» области инфаркта, что затем помогает обнаруживать на обычных изображениях (рис. 7.7 и рис. 7.8). Аномалии на диффузно-взвешенных изображениях становятся менее очевидными к концу первой недели, и к тому времени аномалии более очевидны на обычных T1- и T2-взвешенных изображениях (рис. 7.8). Исследования на животных показали, что изменения диффузии более очевидны через несколько часов после острого ишемического инсульта и, как правило, менее очевидны через несколько дней после этого, поэтому последовательность результатов у младенцев с инфарктами предполагает, что острое событие произошло примерно в перинатальном периоде 5 .
Рис. 7.7 Левосторонний инфаркт СМА. Младенец в возрасте 4 дней. Взвешенное спин-эхо T1 (SE 860/20) (a), последовательность взвешенного спинового эха T2 (b) и изображение, взвешенное по диффузии (c) переднезадняя сенсибилизация. Отклонения от нормы при обычной визуализации незначительны. Диффузия изменяется в соответствии с ограничением воды.
Рис. 7.8 (a) Взвешенная последовательность T1 (SE 860/20). (b) Т2-взвешенная последовательность (SE 2700/120). Левосторонний инфаркт, вероятно, в области задней мозговой артерии (стрелки).(c) Визуализация, взвешенная по диффузии. Младенец в возрасте 4 дней. Аномалии более заметны на диффузно-взвешенных изображениях. (d) Взвешенная последовательность T1 (SE 860/20). (e) Т2-взвешенная последовательность (SE 2700/120). (f) Визуализация, взвешенная по диффузии. Тот же младенец в возрасте 9 дней. Аномалии более очевидны на обычных изображениях последовательности спинового эха. Нарушения диффузии больше не очевидны.
Рис. 7.9 Полученные объемные взвешенные изображения T1, сделанные через 4 недели (a) и 3 месяца (b).В левой задней теменной доле есть область инфаркта, которая уменьшилась в размерах. После регистрации (a) и (b) наблюдается высокая интенсивность сигнала, соответствующая новому росту головного мозга (стрелка) в исходной области инфаркта (c).
Рис. 7.10 Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 12 месяцев. Инфаркт левой СМА с поражением передней височной доли (стрелка). Асимметрия среднего мозга с атрофией, соответствующая Валлеровской дегенерации слева ( стрелка ).
Рис. 7.11 Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 2 недель. Наблюдается очевидная асимметрия ствола головного мозга с атрофией левой стороны у этого младенца, у которого на 2-й день начались судороги. Инфаркт, наблюдаемый в левой передней доле (стрелка), выглядит примерно 1-2-недельной давности. Асимметрия ствола головного мозга может происходить из-за предыдущего поражения, которое больше не идентифицируется.
Рис. 7.12 Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 6 дней.В левой хвостатой головке геморрагический инфаркт (стрелка).
Рис. 7.13 Последовательность восстановления инверсии (IR 3800/30/950). Доношенный ребенок с судорожными припадками после родов на полу дома. Снимается через 5 дней. Наблюдается двусторонняя потеря дифференцировки серого / белого вещества в задней теменной и височной долях. Базальные ганглии в норме, а внутренняя капсула соответственно миелинизирована. Этот младенец стал микроцефалом, имеет легкую задержку в развитии, но нормальный двигательный исход.
Эволюция со второй по шестую неделю
В течение второй недели после инфаркта может наблюдаться усиление дифференциации серого / белого вещества с выделением участков коры, а интенсивность сигнала белого вещества становится еще более низкой при использовании Т1-взвешенной визуализации (рис. 7.8). Начиная с 2 недель может наблюдаться разрушение ткани, пораженной инфарктом. Внецеребральное пространство может расширяться. Может образоваться порэнцефалическая киста, хотя обычно в ней видна какая-то ткань, особенно если перед обработкой изображения соответствующим образом обработано окно (случай 7.1). На последовательностях, взвешенных по T1, могут появляться области с высоким уровнем сигнала вокруг полутени инфаркта. Гистологическая корреляция для этого поражения неясна, но это может отражать пролиферацию капилляров или, возможно, присутствие липидно-нагруженных макрофагов.
Evolution от 6 недель до 1 года
В течение следующих нескольких месяцев по мере роста мозга инфаркт может уменьшаться в размерах, и у некоторых младенцев может быть трудно идентифицировать исходное поражение (случай 7.3). Пораженное полушарие, однако, обычно выглядит меньше, чем непораженное, и демонстрирует общее уменьшение миелинизации, наиболее очевидное вокруг места инфаркта.Это явно связано с исходным размером поражения и его развитием. Используя специально разработанную компьютерную программу, мы смогли точно сопоставить и вычесть серийно полученные объемные изображения у младенцев с очаговыми инфарктами 27 . Используя эту технику, мы смогли идентифицировать ранние изменения интенсивности сигнала и разрушение тканей. Сопоставление и последующее вычитание серийно полученных изображений показали, что в следующие несколько месяцев может наблюдаться чрезмерный рост внутри и вокруг инфаркта (рис.7.9). Эти изменения не обнаруживаются при визуальном анализе обычных изображений. Этот чрезмерный рост может привести к фактическому исчезновению небольших инфарктов. Области неожиданного чрезмерного роста могут соответствовать ранее нераспознанным областям повреждения белого вещества (рис. 7.15). Обычная визуализация показывает, что области чрезмерного роста, по-видимому, имеют нормальные визуальные характеристики и что в целом у младенцев с очаговым инфарктом имеется относительно небольшое количество глиальной ткани при более поздних визуализации.Период избыточного роста начинается примерно через 6 недель и заканчивается примерно к 1 году жизни.
Валлеровское перерождение
В острой стадии инфаркта СМА может наблюдаться аномальная интенсивность сигнала в стволе головного мозга, предположительно в результате феномена диашизиса (случай 7.7). Диашизис — это термин, применяемый к острым метаболическим изменениям, которые происходят в связанных, но удаленных областях мозга в ответ на очаговое повреждение. Это традиционно использовалось для описания изменений в мозжечке после инфаркта переднего мозга.
При инфаркте основной перинатальной ветви и инфаркта кортикальной ветви изменения размера ствола мозга из-за вторичной атрофии, валлеровской дегенерации, становятся очевидными через 6-8 недель и могут становиться все более очевидными (рис. 7.10). Младенцы, у которых ранее проявлялась асимметрия, могли иметь дородовой инсульт в дополнение к перинатальному инфаркту (рис. 7.11). Ранняя серийная визуализация может помочь выделить отдельные оскорбления (случай 7.1). Вторичная дегенерация также может привести к атрофии ипсилатерального таламуса при отсутствии начального поражения.Как ипсилатеральная, так и контралатеральная атрофия мозжечка была продемонстрирована после очагового инфаркта. Считается, что это связано с феноменом диашизиса. Однако в серии из 10 доношенных детей с перинатальным очаговым инфарктом мы показали, что рост полушария мозжечка был симметричным и сравнимым с контролем в течение первого года жизни 14 .
Лентикулостриатное отделение
Эти поражения чаще наблюдаются у недоношенных детей6, но иногда могут наблюдаться у доношенных детей (см. Главу 8).В отличие от инфарктов на территории корковых ветвей они часто имеют геморрагический компонент. Поражения обычно включают чечевицеобразную форму, а иногда и хвостатую часть и / или таламус и внутреннюю капсулу (рис. 7.12). У младенцев также может наблюдаться сочетание поражений кортикальных ветвей и базальных ганглиев (рис. 7.3). Небольшие кистозные образования в базальных ганглиях, случайно обнаруженные при визуализации, вероятно, представляют собой небольшие старые инфаркты (случай 7.1).
<предыдущая | наверх | содержание | следующая>
ЭТИОЛОГИЯ
Инфаркт, приобретенный в перинатальном периоде, может также возникать не в области распространения одной главной артерии, а в пограничной зоне или водоразделе между артериальными территориями, так называемые парасагиттальные поражения 31 .Считается, что эти поражения, которые до сих пор были описаны только у доношенных детей, вызваны резким снижением мозгового кровотока 31 . Таким образом, пораженными областями будут те, которые наиболее подвержены гипотонии и снижению перфузии, например области в задних долях, которые представляют собой конечные поля всех трех основных мозговых артерий.
Неблагоприятные антенатальные факторы встречаются нечасто, но, по нашему опыту, эти поражения, в отличие от артериальных инфарктов, обычно связаны с перинатальным дистрессом и / или легкими признаками гипоксически-ишемической энцефалопатии.У этих младенцев могут быть аномалии КТГ, жидкость, окрашивающая меконий, и инструментальные роды часты. Им может потребоваться некоторая респираторная помощь, такая как уход за лицом O 2 или упаковка мешка, но не интубация. Оценка по шкале Апгар часто бывает низкой через 1 минуту, но быстро восстанавливается в течение 5 или 10 минут (случай 7,5). Подобная картина повреждения может также наблюдаться у младенцев с гипогликемией 1 .
КЛИНИЧЕСКИЕ ВЫВОДЫ
У младенцев с парасагиттальными поражениями могут развиться судороги в первые 48 часов, хотя это может быть не первым признаком.При неврологическом обследовании эти младенцы имеют гипотонию; Отчасти это связано с тем, что их часто оценивают после начала судорог и приема противосудорожных средств. Неонатальная ЭЭГ может быть нормальной, показывать эпилептические разряды, но нормальный фон или, в некоторых случаях, показывать прерывистую фоновую активность 23 .
РЕЗУЛЬТАТЫ МРТ
Рис. 7.14 Асимметричный инфаркт пограничной зоны. Изображение, взвешенное по диффузии, младенец в возрасте 6 дней, демонстрирующее аномальное ограничение, дающее высокую интенсивность сигнала в левой лобной, теменной, височной и затылочной долях.На этом уровне нет явного вовлечения правого полушария.
Поражения обычно двусторонние, включая заднюю выпуклость.
(Рис. 7.13, случай 7.5) и, в некоторых случаях, передние доли. Эти поражения довольно симметричны, но в некоторых случаях поражение может быть более преобладающим с одной стороны, затрагивая переднюю и заднюю доли и давая лишь минимальное поражение контралатерального полушария (рис. 7.14). Поражения являются ишемическими и проявляются как низкая интенсивность сигнала на Т1 и высокая интенсивность сигнала на Т2, но могут иметь геморрагические компоненты.Развитие этих поражений аналогично тому, что наблюдается при более очаговых инфарктах головного мозга с аналогичными изменениями чрезмерного роста, демонстрируемыми при серийной регистрации (рис. 7.15). Иногда области инфаркта видны рядом с субдуральным кровоизлиянием (случай 7.6). Точная связь между этими двумя поражениями неясна. Возможно, субдуральное кровоизлияние нарушает венозный отток, что приводит к венозному инфаркту прилегающей паренхимы. Также было высказано предположение, что инфаркт возникает в результате спазма артерии.
Рис. 7.15 Регистрация и вычитание изображений. Получение взвешенного объема T1. (а) В возрасте 2 месяцев обратите внимание на выделение по краю пораженной ткани слева (стрелка). Справа дополнительный небольшой очаг инфаркта (стрелка). (б) Возраст 6 месяцев. Во всем левом полушарии наблюдается атрофия и снижение миелина. (c) Вычитание изображения. Вокруг атрофированного левого полушария наблюдается высокая интенсивность сигнала, соответствующая росту нового мозга (стрелка).По медиальной стороне правой затылочной доли наблюдается высокая интенсивность сигнала, что приводит к уменьшению ширины межполушарной щели. Это может быть область ранее нераспознанного повреждения белого вещества.
<предыдущая | наверх | содержание | следующая>
ДВИГАТЕЛЬНЫЙ РЕЗУЛЬТАТ
Еще несколько лет назад в большинстве исследований инфарктов новорожденных, за некоторыми исключениями, сообщалось об очень высокой частоте аномальных двигательных исходов, в основном гемиплегии. 3, 10, 12, 13, 16–18, 25, 28, 30, 33 Благодаря этим ранним исследованиям родители младенцев с инфарктом головного мозга были проинформированы о высоком риске развития церебрального паралича у их детей.Однако с увеличением числа случаев выявления инфарктов у младенцев без асфиксии при рождении стало очевидно, что частота аномальных двигательных исходов ниже, чем предполагалось 8, 23 .
Мы рассмотрели серию из 24 детей, у которых была ранняя неонатальная МРТ 23 . Младенцы наблюдались в течение не менее 2 лет с целью установления лучших прогностических показателей в неонатальном периоде. Гемиплегия присутствовала только у 20% обследованных детей.Наличие неблагоприятных антенатальных и перинатальных факторов не было достоверно связано с патологическим исходом.
Нам не удалось найти какой-либо значимой связи между неврологическим обследованием новорожденных и исходом, поскольку аномальные признаки в неонатальном периоде были обнаружены у младенцев с нормальным исходом и без него.
Результаты МРТ новорожденных были лучшими предикторами исхода. Однако наличие гемиплегии, по-видимому, не связано с типом инфаркта, поскольку частота возникновения как артериального, так и пограничного инфаркта была одинаковой.Напротив, степень поражения и, в частности, сопутствующее поражение полушария, базальных ганглиев и внутренней капсулы в значительной степени были связаны с исходом. В то время как младенцы, у которых был задействован один или два из этих трех компонентов, как правило, имели нормальный моторный исход, у младенцев с вовлечением всех трех локализаций развивался патологический моторный исход (случаи 7.4 и 7.7).
Мы также показали, что неонатальная ЭЭГ может в равной степени прогнозировать отдаленный исход. В то время как у всех младенцев с нормальной фоновой активностью был нормальный двигательный исход 23 , независимо от наличия или отсутствия эпилептических разрядов, у всех младенцев с аномальной фоновой активностью, односторонней или двусторонней , развивалась гемиплегия.
Наши недавние исследования24 связи между перинатальным инфарктом и тромботическими расстройствами показали сильную связь между фактором V Лейдена и развитием гемиплегии. Необходимы дальнейшие исследования для более подробного изучения этой взаимосвязи и изучения потенциальной роли других протромботических факторов, таких как мутация G20210A в гене протромбина и мутация C677T в гене метилентетрагидрофолатредуктазы.
ВИЗУАЛЬНЫЙ РЕЗУЛЬТАТ
Связь между инфарктом головного мозга и нарушениями зрения хорошо задокументирована у детей и взрослых, страдающих от инсульта 20, 34 .В этих случаях, по-видимому, существует хорошая корреляция между тяжестью аномалий МРТ и тяжестью нарушения зрения. Поражения, затрагивающие полосатую затылочную кору и оптическое излучение, обычно связаны с контралатеральной гемианопсией и поражениями теменной доли с нарушением зрения и, в наиболее тяжелых случаях, с противоположным зрительным пренебрежением.
Используя батарею тестов, которые были специально разработаны для оценки зрительной функции в первый год жизни, мы смогли продемонстрировать, что у младенцев с инфарктом нормальная острота зрения и движения глаз, но могут быть более узкие поля зрения и аномальное зрительное внимание, так как Проверено фиксацией сдвига 21, 22 .Однако интересно, что, в отличие от взрослых, не у всех детей, у которых были поражены структуры зрительного пути на МРТ, развились аномальные зрительные функции. Только у 50% младенцев с поражением оптического излучения были аномальные поля, и только у 50% младенцев с поражением теменных долей аномальный сдвиг фиксации наблюдался в первый год жизни. Эти данные свидетельствуют о том, что незрелый мозг может до некоторой степени компенсировать ранние поражения, влияющие на зрительный путь.
НЕЙРОКОГНИТИВНЫЙ РЕЗУЛЬТАТ
Пластичность головного мозга новорожденного может обеспечить нормальную двигательную функцию при наличии обширных областей инфаркта; однако это может вызвать эффект «вытеснения» и происходить за счет нейрокогнитивных функций, которые развиваются позже в детстве (см. истории болезни). Долгосрочные проспективные последующие исследования для оценки речи, поведения и нейрокогнитивных функций у младенцев с двигательными нарушениями и без них дополнительно определят степень и качество компенсации после перинатального инфаркта.
<предыдущая | наверх | содержание | следующая>
Этот младенец мужского пола родился на 39 неделе беременности (вес при рождении 3,132 кг).
Антенатально
Его мать была первородящей белой кавказской с известным эндометриозом. Она была госпитализирована на 34 неделе с болями в животе, которые прошли спонтанно. Движение плода и мониторинг сердечного ритма были удовлетворительными.
Роды
Роды начались самопроизвольно через 39,6 недели. За пять часов до родов на кардиотокограмме (КТГ) наблюдались различные замедления до 70 ударов в минуту, для чего ей вводили кислород для лица.За три часа до родов был отмечен меконий 1 степени, образец крови плода на тот момент показал pH 7,3 2 . Продолжались переменные замедления, и было выполнено кесарево сечение по поводу отсутствия прогресса и дистресса плода. PH шнура составлял 7,1 5 . Оценка по шкале Апгар составляла 9 через 1 минуту и 10 через 5 минут, но присутствовал густой меконий. Всасывание показало, что все это было выше шнуров.
• Исход нервного развития не всегда предсказуем.
Материнская патология
На момент кесарева сечения в обоих яичниках были отмечены спайки с параметрием.При микроскопии было показано, что они содержат геморрагическую децидуальную оболочку с тромботическими сосудами. Коагуляция и тромбофильный скрининг были нормальными.
Послеродовой курс
Младенца перевели в послеродовое отделение, но через 24 часа он начал нервничать, что было более выражено слева. Эпизоды десатурации были отмечены через 36 часов, и ЭЭГ подтвердила неонатальные судороги. На ЭЭГ на 3-е сутки непрерывная фоновая активность с судорожной активностью преимущественно справа.
Неврологическое обследование
Неврологическое обследование новорожденных на 3-й день показало асимметричный фистинг тонуса конечностей и нистагм.На 9-е сутки сохранялся асимметричный тонус конечностей; его голова и зрение были плохими. Через 1 месяц у него все еще был плохой контроль головы и асимметричный тонус рук. Через 3 месяца асимметрии тона не было, но сначала он держал обе руки справа. В 9 месяцев у него был плотный правый подколенный угол, но никаких других асимметрий не было. В 4 года у него была легкая общая гипотония с очень умеренно повышенным тонусом в нижней конечности справа на ипсилатеральной стороне основного инфаркта.Он сильно отдавал предпочтение левой руке, и хотя правая была у него клешней, это было грубее, чем левой. По шкале развития Гриффитса он набрал 4-летний уровень по всем субшкалам, за исключением результатов, когда он работал на 3-летнем 8-месячном уровне. Судорог больше не было. Зрительная функция в норме.
Тромботический скрининг
Коагуляция и тромбофильный скрининг были нормальными.
Комментарий
У этого младенца был значительный инфаркт справа, но у него развилась правосторонняя гемиплегия, предположительно связанная с очень маленьким поражением, наблюдаемым в левом полушарии и связанное с аномалиями в левой внутренней капсуле.
Рис. 7.16A Ранняя визуализация, УЗИ черепа показало плотность правостороннего эхо-сигнала и небольшое левостороннее геморрагическое поражение на 5-й день. Последовательность инверсионного восстановления (IR 3800/30/950) (a) в возрасте 5 дней показывает большую область с потерей дифференциации серого / белого вещества справа (стрелка) и небольшую кисту на латеральном крае правого чечевицеобразного ядра (стрелка). Области аномалии хорошо видны на диффузионно-взвешенном изображении в корональной плоскости. Слева есть дополнительная повышенная интенсивность сигнала.(б). Ранняя ангиография (день 5) показывает плохое заполнение СМА справа (стрелка) (c). Это улучшилось через 1 неделю (день 11) (стрелка) (d).
Рис. 7.16B Поздняя визуализация. Последовательность восстановления инверсии (IR 3400/30/800). (e) Возраст 1 год. Справа большой инфаркт. Отдельное кистозное поражение видно на боковой границе чечевицеобразного ядра (длинная стрелка). Во внутренней капсуле слева (короткая стрелка) последовательности FLAIR (IR 6500/160/600) наблюдается аномальная интенсивность сигнала.(f) Аномальная интенсивность сигнала внутри внутренней капсулы рассматривается как высокая интенсивность сигнала (длинная стрелка). Это может быть связано с левосторонним поражением, видимым на ранних диффузных изображениях. Нити ткани внутри инфаркта более заметны (короткая стрелка).
Эта девочка родилась на сроке 40 недель (вес при рождении 3,956 г).
Антенатальный
Ее мать была белой первородящей. Неблагоприятных дородовых факторов не было, у нее начались самопроизвольные роды.
Работа и доставка
За 5 часов до родов была отмечена исходная тахикардия плода 160–170 уд / мин и раннее замедление до 80 уд / мин, pH кожи головы плода составлял 7,31. Была задержка второй стадии, гипертермия матери и дальнейшая брадикардия плода, поэтому она была доставлена щипцами Симпсона, что потребовало трех вытягиваний. Оценка по шкале Апгар составила 8 через 1 минуту и 10 через 5 минут.
• Хороший двигательный исход с поражением лба.
Послеродовой курс
Младенец отправился в послеродовое отделение вместе с матерью.Скрининг на инфекцию был отрицательным. Она оставалась здоровой до второго дня, когда у нее появились подергивания левой руки в руке и ноге. ЭЭГ показала всплески и резкие волны до введения фенобарбитала, но впоследствии нормализовалась.
Ранняя визуализация
УЗИ черепа показало повышенную эхогенность в области правой сильвиевой щели на 3-й день. МРТ на 10-й день показала инфаркт в правой лобной доле.
Неврологическое обследование
Неврологическое обследование новорожденных на 9-е сутки показало умеренно асимметричный тонус конечностей и некоторую гипотонию туловища.В 8-недельном возрасте тонус все еще был слегка снижен, но асимметрии не было. Через 3 месяца на ипсилатеральной стороне поражения был отмечен некоторый фистинг и более плотный подколенный угол, но к 6 месяцам она была полностью нормальной. В 3 года 6 месяцев она была полностью неврологически нормальной, но имела очень сильное предпочтение в отношении правой руки. Ее подшкалы Гриффитса варьировались от 3–6 до 4–4 мес с самым низким баллом по языку и самым высоким по шкале успеваемости. В 5-6 мес она прошла неврологический осмотр в норме. Нормальное движение ABC.Ее оценка по WIPPS составила 100 баллов по успеваемости и 85 по языку. Ее зрительная функция также была нормальной. Судороги больше не было.
Тромботический экран
Коагуляция и тромбофильный скрининг в норме.
Комментарий
Легкая асимметрия в течение первых нескольких месяцев жизни не является предиктором двигательного исхода. Ее пограничные языковые способности в возрасте 5,5 лет предполагают, что другие способности к развитию могут быть нарушены.
Фиг.7.17A Ранняя визуализация. Последовательность восстановления инверсии (IR 3800/30/950). Младенец в возрасте 10 дней. Внутри правого лобного белого вещества есть область низкой интенсивности сигнала (стрелка). Связано выделение коры. Интенсивность сигнала от миелина в задней части внутренней капсулы симметрична и нормальна.
Рис. 7.17B Поздняя визуализация. Последовательность восстановления инверсии (IR 3600/30/800) в возрасте 10 месяцев показывает инфаркт в правой лобной доле.
Этот младенец мужского пола родился на 40 неделе беременности (вес при рождении 2,8 кг).
Антенатальный
Его мать была индейской первородящей. Ее дородовой курс прошел без происшествий.
Работа и доставка
`
Произошло спонтанное начало родов, которые хорошо прогрессировали за 2 часа до родов, когда наблюдалась тахикардия плода (165–170 уд / мин) с некоторой потерей вариабельности. Они сохранялись в течение 1 часа, а затем были отмечены замедления роста плода с медленным выздоровлением.Через час было выполнено экстренное кесарево сечение в связи с отсутствием прогресса и дистрессом плода. Оценка по шкале Апгар составила 9 через 1 минуту и 10 через 10 минут.
Послеродовой курс
Младенца отправили в послеродовое отделение с матерью, где он оставался здоровым до 14 лет, когда у него появились заметные подергивания в правой руке и ноге, которые стали генерализованными через 2 часа. Ультразвук черепа был нормальным через 24 часа, но на 4-й день выявил повышенную эхогенность в области левой сильвиевой трещины.
Неврологическое обследование
Неврологическое обследование новорожденных в 14 часов выявило нервного ребенка с нормальным тонусом, хорошей фиксацией и отсутствием других аномальных движений. На 6-й день у него был слегка асимметричный тонус рук, но в остальном он был нормальным. При осмотре через 4 недели у него был совершенно нормальный тонус, но он был невнимателен. Ребенок оставался совершенно нормальным, с симметричными позами, тонусом и движениями. В 4 года 6 месяцев у него одинаковая тонкая манипуляция обеими руками, его баллы по шкале Гриффитса варьируются от 4 до 5 лет с самым низким баллом по шкале результатов.Судорог больше не было. Его зрительная функция в норме.
• Инфаркт, приобретенный в перинатальном периоде, может быть трудно выявить в более позднем возрасте.
Тромботический экран
Он показал повышенный фактор VIII.
Комментарий
Инфаркт СМА, приобретенный в перинатальном периоде, может развиваться и напоминать расщелины, которые могут быть ошибочно классифицированы как врожденные.
Рис. 7.18A Ранняя визуализация. Обычная МРТ через 2 дня показывает только минимальную низкую интенсивность сигнала в задней части теменного белого вещества на изображениях, взвешенных по T1 (a) (стрелка), и минимально высокий сигнал на изображениях, взвешенных по T2 (b) (стрелка).Нет очевидной потери дифференциации серого / белого вещества. На диффузно-взвешенном изображении явно видна аномально высокая интенсивность сигнала, более передняя часть (c). Внешний вид внутренней капсулы на всех изображениях нормальный.
Рис. 7.18B Поздняя визуализация. (d) Последовательность инверсионного восстановления (IR 3400/30/800) в возрасте 6 месяцев показывает только небольшую закрытую «щель» (стрелка) в области инфаркта, как видно на диффузионно-взвешенной визуализации.
Этот младенец мужского пола родился на сроке беременности 39 недель (вес при рождении 3.58 кг).
Антенатальный
Его мать была белой первородящей матерью, которая дважды сделала аборта в первом триместре. У нее также был язвенный колит, и на протяжении всей беременности она лечилась стероидами.
Работа и доставка
У нее на 39 неделе беременности индуцировали повышенное кровяное давление. Роды были нормальными. Оценка по шкале Апгар составила 7 через 1 минуту, ребенок был вялым и темноватым, но он быстро поправился на лице O 2 , а оценка по шкале Апгар была 10 через 5 минут.PH шнура составлял 7,0 7 .
Послеродовой курс
Младенец был переведен в послеродовое отделение вместе с матерью и оставался здоровым до 24 часов, когда было замечено, что он плохо ест и у него было три эпизода жесткости, которые были интерпретированы как судороги. ЭЭГ на 6-е сутки показала асимметричный фон с резкими волнами и спайками слева, но без судорожной активности.
Раннее изображение
УЗИ черепа показало участок повышенной эхогенности в области сильвиевой щели на 4-е сутки.
• Ранняя МРТ, ЭЭГ и наличие фактора V Лейдена могут независимо предсказывать более позднюю гемиплегию.
Неврологическое обследование
Неврологическое обследование на 5-е сутки показало некоторую асимметрию тона и плохой контроль головы. Гипотония все еще сохранялась на 19-й день, но асимметрии не было. В 7-недельном возрасте он все еще оставался умеренно гипотоническим, перемежался фистингом, но не имел асимметрии. В 6 месяцев появилась дистоническая поза правой руки и повышенный тонус в правом плечевом поясе.В 9 месяцев, в дополнение к предыдущим результатам, он начал демонстрировать заметное предпочтение рук и асимметрию подколенного угла, но симметричные вертикальные удары ногой. К 16 месяцам дистоническая поза руки была более выраженной, у него был более плотный плечевой пояс, но без ограничения пронации и супинации справа. Он предпочитал левую руку с лучшим захватом левой, но его походка была нормальной. В 4 года появились признаки легкой правой гемиплегии. У него асимметрия верхней конечности с ненормальным тонусом в плечевом поясе и ограничением пронации и супинации, но он имеет некоторые независимые движения пальцев и может класть монеты в копилку.Нижняя конечность также слабо поражена с некоторой асимметрией тонуса, но без функциональных нарушений. Его субшкалы Гриффитса варьируются от 3 лет по шкале восприятия до 4 лет 4 месяцев по практическим рассуждениям. Судорог больше не было. Он показывает небольшую асимметрию в полях зрения: правое уже, чем левое.
Тромботический экран
Этот младенец был гетерозиготным по фактору V Лейден.
Комментарий
Гемиплегию этого ребенка можно было предсказать на основании его ранней ЭЭГ с асимметричной фоновой активностью, начального паттерна повреждения на МР и, возможно, на основании его гетерозиготности по фактору V Лейдена.Помимо гемиплегии, у него есть очевидные проблемы с восприятием.
Рис. 7.19A Ранняя визуализация. Визуализация Т2-взвешенной последовательности (SE 2700/120) на 4-й день показала потерю дифференцировки серого / белого вещества в левой височно-теменной области (стрелка). Сигнал от миелина в задней конечности внутренней капсулы асимметричный. В таламусе имеется небольшая область аномально повышенной интенсивности сигнала, распространяющаяся в заднюю часть задней конечности внутренней капсулы (стрелка).Внутри сосудистого сплетения заднего рога левого бокового желудочка интенсивность сигнала низкая, что соответствует кровоизлиянию.
Рис. 7.19B Поздняя визуализация. Последовательность инверсионного восстановления (IR 3000/30/860) в возрасте 6 месяцев показывает атрофию левого полушария. Небольшой разрыв миелина в задней части внутренней капсулы слева (стрелка).
Эта девочка родилась на 41 неделе беременности (вес при рождении 2,94 кг).
Антенатальный
Это была третья беременность женщины европеоидной расы с бесплодием в анамнезе. У нее был один аборт в первом триместре и один живой ребенок с врожденными пороками сердца. Эта беременность протекала без осложнений за 3 дня до родов, когда у нее возникла сильная боль в животе. Кровотечения не было и при влагалищном исследовании не было доказательств того, что у нее были роды. КТГ в норме. Через три дня у нее начались роды.
Работа и доставка
Отмечено позднее замедление с потерей вариабельности, образец крови плода показал pH 7.1 и было запланировано экстренное кесарево сечение. Однако это было отложено еще на 2 часа из-за трудностей с установкой эпидуральной анестезии. При поставке присутствовал меконий 2–3 марок. Оценка по шкале Апгар составила 5 через 1 минуту, младенца лечили аспирацией и кислородом для лица, а оценка по шкале Апгар составляла 9 через 5 минут.
Послеродовой курс
Через 2 часа были отмечены эпизоды апноэ и пристального взгляда, но не было зарегистрировано никаких аномальных движений. ЭЭГ показала аномальную фоновую активность и непрерывную судорожную активность с разными типами приступов, происходящими одновременно в обоих полушариях.УЗИ черепа на 1-е сутки показало двустороннюю эхогенность, которая была более выражена справа. На второй день они были менее заметны.
• Младенцы с парасагиттальной травмой пограничной зоны могут иметь более выраженную энцефалопатию.
Рис. 7.20A Ранняя визуализация. (а) Диффузионно-взвешенная визуализация на высоком уровне желудочков на 4-й день показывает аномально высокую интенсивность сигнала в теменных долях с обеих сторон, что соответствует парасагиттальному инфаркту пограничной зоны.
Неврологическое обследование
Неврологическое обследование новорожденных на 2-й день показало, что у младенца плохая бдительность, аномальные движения глаз, гипотония, но без асимметрии. На 4-й день большие пальцы рук сведены, но тонус нормальный, бдительность нормальная. Через 6 недель у нее в целом была гипотония, неправильное положение пальцев, но была хорошая зрительная активность. Через 3 месяца была отмечена небольшая асимметрия тона, но в остальном она выглядела нормальной. В 10 месяцев у нее был периодический фистинг правой руки с сильным предпочтением левой руки и легкой асимметрией тонуса нижних конечностей.Ее баллы по шкале Гриффитса составляли от 10,5 до 11,5 месяцев. Результаты через 2 года были аналогичными, но на этот раз также была отмечена некоторая разница в функции руки. Тем не менее, через 3 года, хотя она отметила предпочтение левой руки, тонкая манипулятивная функция ее правой руки была превосходной. Асимметрия в тонусе верхних и нижних конечностей сохранялась. Несмотря на то, что она имела тенденцию ходить на цыпочках, она могла ходить с пятки на носок и активно сгибала ногу в тыльном направлении. По шкале Гриффитса ее результативность варьировалась от 2.От 8 месяцев до 3,6 месяцев. Ее худшим масштабом была координация глаз и рук из-за ее очень плохих способностей к рисованию. Хотя она хорошо справлялась с головоломками, у нее были и другие трудности с восприятием. Ее зрительная функция в норме. Судороги больше не было.
Тромботический статус
Фактор V Лейден не измерялся у этого ребенка, но был нормальным у обоих родителей. Также у нее повышенный фактор VIII.
Рис. 7.20B Поздняя визуализация. (b) Изображение инверсной последовательности восстановления (IR 3600/30/900) на низком уровне желудочков через 3 месяца.Сигнал от миелина в обеих задних конечностях внутренней капсулы нормальный. Миелинизация немного задерживается, так как в передней конечности миелина нет. В левой теменной доле образовалась порэнцефалическая киста. (c) Последовательность FLAIR (IR 6500/160/600) через 20 месяцев. Порэнцефальной кисты больше нет. Отмечается выраженная атрофия левой теменной доли с некоторой повышенной интенсивностью сигнала, соответствующей глиальной ткани. Оба затылочных полюса кажутся атрофированными. В заднем перивентрикулярном белом веществе справа имеется небольшое увеличение Т2.
Этот младенец мужского пола родился на 39 неделе беременности (вес при рождении 3,35 кг).
Антенатальный
Его мать была белой первородной. Беременность протекала без осложнений до дня, предшествующего родам, когда у нее возникли довольно сильные боли в животе.
Работа и доставка
У нее начались самопроизвольные роды. Были некоторые замедления КТГ с быстрым восстановлением за 6 ч до родов, но после этого качество мониторинга плода было плохим. Ребенок родился самопроизвольно через естественные родовые пути.Оценка по шкале Апгар составила 3 через 1 минуту. Младенец быстро взял отсасывающий и лицевой O 2 . PH шнура 7,06
.
Послеродовой курс
Младенец отправился в послеродовое отделение вместе с матерью и, по всей видимости, выздоровел до тех пор, пока несколько часов спустя он не стал «вялым и сонным», а уровень глюкозы в крови составил 1,4. На 2-й день он все еще был очень гибким, но уровень глюкозы в крови теперь был в пределах нормы. Он не стал сосать грудь, но хорошо взял бутылку.Было отмечено, что он ведет себя более гибко справа, и сообщалось о эпизоде нервозности продолжительностью 15 секунд. ЭЭГ и КФМ показали прерывистую фоновую активность с эпилептическими разрядами. УЗИ черепа на 2-й день показало повышенную эхогенность слева, совместимую с инфарктом.
• Артериальный инфаркт может быть связан с дополнительными геморрагическими поражениями.
Неврологическое обследование
Рис. 7.21A Ранняя визуализация. Последовательность взвешенного спин-эхо T1 (SE 860/20) на 6-й день показала множественные области коркового выделения в левом полушарии с аномально низкой интенсивностью сигнала в соседнем белом веществе.Было субдуральное кровоизлияние (длинная стрелка) и геморрагическое поражение в правом стволе мозга (рис. 7.4). Интенсивность сигнала в задней конечности внутренней капсулы асимметрична, отклонение от нормы слева (короткая стрелка). В задней части лентиформного ядра, прилегающей к задней конечности слева, имеется небольшая область аномально высокой интенсивности сигнала.
Неврологическое обследование новорожденных на 3-й день выявило расширенную осанку, снижение осевого тонуса и тонуса конечностей, но отсутствие асимметрии.На 8-й день осанка была нормальной, тонус все еще снижен и теперь асимметричный, тонус снижен слева. Через 7 недель ему лучше следовало влево, по-прежнему сохранялась некоторая гипотония, но никаких других асимметрий. Через 3 месяца его тонус был симметричным, лучше изолированные движения справа, но лучше ощущения слева. В 7,5 месяцев движения в руках были симметричными; однако он лучше бил левой ногой. Тонус в правой руке был повышен, была тенденция ходить на цыпочках справа, а также подколенный угол с этой стороны был более узким.В 2 года его грубая и мелкая моторная функция соответствовала возрасту, но имелась некоторая асимметрия тонуса в верхней и нижней конечностях. Его рука также была значительно хуже в правой руке, хотя у него было несколько независимых движений пальцев. Его баллы по Гриффитсу составляли от 22 до 22,5 месяцев. Его зрительная функция была нормальной. Судорог больше не было.
Тромботический экран
Этот младенец был гетерозиготным по Лейденскому фактору V, как и его отец.
Комментарий
Присутствие гетерозиготного фактора V Лейдена связано с аномальным нейромоторным исходом.Также существует некоторая связь с наличием дополнительных геморрагических поражений.
Этот младенец мужского пола родился на 39 неделе беременности (вес при рождении 3,049 кг).
Антенатальный
Его мать была белой первородной. Ее беременность протекала без осложнений до 36 недель, когда она была госпитализирована с сильной болью в животе. Не было никаких признаков кровотечения, и все исследования относительно причины этих симптомов были отрицательными, однако тахикардия 160 ударов в минуту регистрировалась несколько раз на КТГ, пока она находилась в стационаре.
• Двусторонний инфаркт средней мозговой артерии.
Рис. 7.22A Ранняя визуализация. Последовательность восстановления инверсии (IR 3800/30/950) на высоком желудочковом уровне на 6 день показала потерю дифференцировки серого / белого вещества на большей части левого полушария и в теменной доле справа (стрелка) (а). Последовательность, взвешенная по Т2 (SE 2700/120), визуализация среднего мозга показывает аномально повышенную интенсивность сигнала (стрелка), соответствующую острой дегенерации или диашизису (b).
Рис. 7.22B Поздняя визуализация. Т2-взвешенное изображение (SE 2700/120) (c) через 12 месяцев показывает двусторонний инфаркт с вовлечением перисильвиевой коры. Это больше заметно слева, чем справа. Рекавери инверсии (IR 3400/30/800). (d) Асимметрия ствола головного мозга с атрофией слева.
Работа и доставка
Роды начались самопроизвольно. За четыре часа до родов было зарегистрировано снижение скорости вращения до 90 ударов в минуту и продолжающееся 45 секунд, но pH кожи головы плода составлял 7.3. За час до родов регистрировались стойкие замедления до 70 уд / мин. Образец крови плода — 7,2. Младенец был доставлен с помощью простых щипцов после ручного вращения. При доставке был отмечен меконий 2-го сорта. Оценка по шкале Апгар составила 9 через 1 минуту и 10 через 5 минут.
Послеродовой курс
Младенец отправился с матерью в послеродовое отделение. В 8 часов у него были приступы сумерек, и его перевели в отделение интенсивной терапии. В течение следующих нескольких часов были отмечены дальнейшие приступы апноэ, некоторые из которых сопровождались резкими движениями рук и ног.Они были подтверждены на ЭЭГ как судороги. ЭЭГ показала двустороннюю, но асимметричную аномальную фоновую активность.
Неврологическое обследование
Неврологическое обследование на 8-е сутки показало, что у него в целом снижен тонус, но нет асимметрии. У него была хорошая слуховая и зрительная ориентация. Через 6 недель у него все еще не было асимметрии, но в целом повысился тонус обеих рук. При осмотре через 3 месяца его движения и тонус были симметричными, но через 7 месяцев было отмечено, что его правая рука остается в дистонической позе с периодическим сгибанием руки в кулак.Он явно предпочитал левую руку сидя, но когда лежал лежа, он использовал обе руки одинаково. В вертикальном подвешивании его удар был очень асимметричным. В течение следующих 18 месяцев гемиплегия стала более выраженной с дальнейшим повышением тонуса как верхней, так и нижней конечности. Несмотря на ухудшение функции руки, он хорошо использовал свою правую руку в бимануальных манипулятивных задачах. Он ходил с чрезмерно вытянутым коленом, но не имел циркумдукции, а иногда даже умудрялся походить с пятки на носок.Его основной проблемой стали его плохая артикуляция и чрезмерное слюнотечение, но у него не было серьезных когнитивных проблем. В 4 года 6 месяцев он был способным мальчиком с умеренной гемиплегией, который, несмотря на свои трудности, мог заниматься различными видами спорта, включая теннис и катание на лыжах. Его зрительная функция была нормальной. Судорог больше не было.
Тромботический статус
Профили коагуляции родителей были нормальными, но они не тестировались на фактор V Лейден.
Комментарий
Выраженные проблемы с артикуляцией и глотанием у этого ребенка соответствуют перисильвиевому синдрому. Младенцы с перинатально приобретенным двусторонним инфарктом СМА могут иметь перисильвиевый синдром.
<предыдущая | наверх | содержание | следующая>
ИЗОБРАЖЕНИЕ
- Артериальные инфаркты могут протекать бессимптомно.
- Младенцы с судорогами нуждаются в визуализации, даже если у них нормальные показатели по шкале Апгар и нет других клинических признаков.
- Раннее ультразвуковое исследование черепа в первую неделю может быть нормальным у младенцев с очаговым инфарктом.
- Выполните МРТ в конце первой недели жизни, чтобы получить больше информации о месте и степени инфаркта.
- Визуализация с диффузионным взвешиванием может помочь идентифицировать поражения в первые дни жизни.
- Чрезмерный рост происходит внутри и вокруг инфаркта через 6 недель после инфаркта.
- Некоторые инфаркты бывает трудно обнаружить в течение первого года жизни.
ПРОГНОЗ
- Прогноз для младенцев с инфарктом головного мозга можно определить по степени поражения на МРТ. Сопутствующее поражение полушария, внутренней капсулы и базальных ганглиев может быть связано с аномальным двигательным исходом.
- ЭЭГ также может быть полезным прогностическим индикатором. Аномальная фоновая активность может быть связана с аномальным двигательным исходом.
- Перинатальный инфаркт может быть связан с патологическим протромботическим состоянием.Фактор V Лейдена связан с более поздним развитием гемиплегии у младенцев с перинатальным инфарктом.
- Младенцы с очаговым инфарктом могут демонстрировать незначительные нарушения развития нервной системы в более позднем детстве, несмотря на нормальный общий моторный исход.
<предыдущая | наверх | содержание | следующая>
- Баркович А.Дж., Али Ф.А., Роули HA и др. (1998) Модели визуализации гипогликемии новорожденных. Am J Нейрорадиол 19 , 523–528.
- Бармада М.А., Мосси А.Дж. и Шуман Р.М. (1979) Церебральные инфаркты с артериальной окклюзией у новорожденных. Ann Neurol 6 , 495–502.
- Bouza H, Dubowitz LMS, Rutherford M et al. (1994) Прогнозирование исхода у детей с врожденной гемиплегией: исследование магнитно-резонансной томографии. Нейропедиатрия 25 , 60–66.
- Clancy R, Malin S, Laraque D et al. (1985) Фокальные моторные припадки, предвещающие инсульт у доношенных новорожденных. AJDC 139 , 601–606.
- Cowan FM, Pennock JM, Hanrahan JD et al. (1994) Раннее выявление инфаркта мозга и гипоксической ишемической энцефалопатии у новорожденных с помощью диффузно-взвешенной магнитно-резонансной томографии. Нейропедиатрия 25 , 172–175.
- De Vries L, Groenendal F, Eken P et al. (1997) Инфаркты в сосудистом распределении средней мозговой артерии у недоношенных и доношенных детей. Нейропедиатрия 28 , 88–96.
- Dubowitz L, Dubowitz V и Mercuri E (1999) Неврологическая оценка недоношенных и доношенных новорожденных , 2-е изд. Клиники медицины развития 148 , Лондон, McKeith Press.
- Эстан Дж. И Хоуп П. (1997) Односторонний неонатальный церебральный инфаркт у доношенных детей. Arch Dis Child 76 , F88 – F93.
- Филипек П.А., Кришнамморти К.С., Дэвис К.Р. и др. (1987) Очаговый инфаркт головного мозга у новорожденного: отдельное заболевание. Pediatr Neurol 3 , 141–147.
- Fujimoto S, Yokochi K, Togari H et al. (1988) Исход неонатального инсульта. AJDC 142 , 1086–1088.
- Hill AD, Martin J, Danemann A et al. (1983) Очаговое ишемическое повреждение головного мозга у новорожденного: диагностика с помощью ультразвука и корреляция с компьютерной томографией. Педиатрия 71 , 790–793.
- Koelfen W, Freund M, Konig S et al. (1993) Результаты паренхиматозной и ангиографической магнитно-резонансной томографии и нейропсихологического тестирования у новорожденных после инсульта. Eur J Pediatr 152 , 1030–1035.
- Koelfen W, Freund M и Varnholt V (1995) Неонатальный инсульт с вовлечением средней мозговой артерии у доношенных детей: клинические проявления, ЭЭГ и исследования изображений, а также исходы. Dev Med Child Neurol 37 , 204–212.
- Саид Н., Ле Страндж Э., Резерфорд М. (1999) Сегментация мозжечка с использованием анализа текстуры и обработки изображений на основе знаний.1SMRM. Аннотация 2190.
- Larroche JCL и Amiel CE (1966). Thrombose de l’artere sylvienne a la period neonatale. Arch Fr Pediatr 23 , 257–274.
- Леви С.Р., Абрамс И.Ф., Маршалл ПК и др. (1985) Судороги и инфаркт мозга у доношенных новорожденных. Энн Нейрол 17 , 366–370.
- Mannino FL и Trauner DA (1983) Инсульт у новорожденных. J Pediatr 102 , 605–610.
- Mantovani JF и Gerber GJ (1984) Идиопатический инфаркт головного мозга новорожденных. AJDC 138 , 359–362.
- Mercuri E, Cowan F, Rutherford M et al. (1995) Ишемические и геморрагические поражения головного мозга у новорожденных с судорогами и нормальными показателями по шкале Апгар. Arch Dis Child 73 , F67 – F74.
- Mercuri E, Spano M, Bruccini F и др. (1996) Визуальный результат у детей с врожденной гемиплегией: корреляция с данными МРТ. Нейропедиатрия 27 , 184–188.
- Mercuri E, Atkinson J, Braddick O et al. (1996) Зрительная функция при перинатальном инфаркте мозга. Arch Dis Child 75 , F76–81.
- Mercuri E, Atkinson J, Braddick O et al. (1997) Этиология задержки зрительного созревания: краткий обзор и личные данные. Eur J Paed Neurol 1 , 31–34.
- Mercuri E, Rutherford M, Cowan F et al. (1999) Ранние прогностические индикаторы исхода у младенцев с неонатальным инфарктом головного мозга: клиническое исследование ЭЭГ и МРТ. Педиатрия 103 , 39–46.
- Mercuri E, Cowan F, Gupte G и др. Коагуляционный статус у младенцев с инфарктом головного мозга новорожденных. Педиатрия (в печати).
- Перлман Дж. М., Роллинз Н. К. и Эванс Д. (1994) Неонатальный инсульт: клинические характеристики и измерения скорости мозгового кровотока. Pediatr Neurol 11 , 281–284.
- Rollins NK, Morriss MC, Evans D et al. (1993) Роль ранней МР в оценке доношенных детей с судорогами. Am J Neurol Radiol 15 , 239–248.
- Резерфорд М.А., Пеннок Дж. М., Дубовиц LMS и др. (1997) Восстанавливается ли мозг после перинатального инфаркта? Eur J Paed Neurol 1 , 13–18.
- Sran SK и Baumann RJ (1988) Исход инсульта неонта. Am J Dis Child 142 , 1086–1088.
- Suzuki S и Wada Y (1992) Инфаркт головного мозга новорожденных: симптомы, результаты компьютерной томографии и прогноз.
