Бактериофаг клебсиелл пневмонии очищенный инструкция по применению: показания, противопоказания, побочное действие – описание Bacteriophage klebsiella pneumoniae purified р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. (36380)
Препарат используют для приема внутрь (через рот), в виде клизм, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа, а также в дренированные полости: абсцессов, брюшную, плевральную, мочевого пузыря, почечной лоханки.
Bнутрь препарат принимают натощак за 0,5-1 час до приема пищи.
Рекомендуемые дозы препарата
| Возраст пациента | Доза на 1 прием при различных способах введения препарата | |
| внутрь (мл) | в клизме (мл) | |
| 0-6 мес | 5 | 10 |
| 6-12 мес | 10 | 20 |
| От 1 года до 3 лет | 15 | 20-30 |
| От 3 до 8 лет | 20 | 30-40 |
| От 8 лет и старше | 20-30 | 40-50 |
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь.
В случае обработки полости гнойного очага химическими антисептиками перед применением бактериофага она должна быть промыта стерильным 0,9 % раствором натрия хлорида.
При лечении ангин, фарингитов, ларингитов препарат используют для полосканий полости рта и глотки 3 раза в день по 10-20 мл, курс лечения 7-10 дней.
При лечении бронхитов, пневмоний препарат принимают внутрь 3 раза в день по 10-20 мл, а также применяют в виде ингаляций (без подогрева и использования ультразвука), курс лечения 15-20 дней.
При лечении отитов препарат используют для промывания и введения в полость среднего уха по 2-5 мл 1-3 раза в день. Курс лечения 7-15 дней.
При лечении воспалений пазух носа препарат используют для промывания полости носа, носоглотки и пазух носа в дозе 5-10 мл и введения в пазухи 2-3 мл. Процедуру повторяют ежедневно однократно в течение 7-10 дней. Кроме того, препарат вводят в полость носа в виде турунд, смоченных бактериофагом, по очереди в каждый носовой ход и оставляют в течение 0,5-1 часа. Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
При лечении стоматитов и хронических генерализованных пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных бактериофагом клебсиелл, на 5-10 мин, курс лечения 7-10 дней.
При конъюнктивитах и кератоконъюнктивитах, препарат применяют по 2-3 капли 4-5 раз в день, курс лечения 5-7 дней; при гнойной язве роговицы — по 4-5 капель в день в течение 7-10 дней, при гнойных иридоциклитах — по 6-8 капель каждые 3 часа в сочетании с приемом внутрь в терапевтических дозировках в течение 7-10 дней.
При абсцессах после вскрытия и удаления гнойного содержимого препарат вводят в количестве меньшем, чем объем удаленного гноя ежедневно однократно, курс лечения 7-10 дней.
При перитонитах и плевритах препарат вводят в дренированные полости -брюшную и плевральную через дренажные трубки ежедневно однократно 20-70 мл, курс лечения 10-15 дней.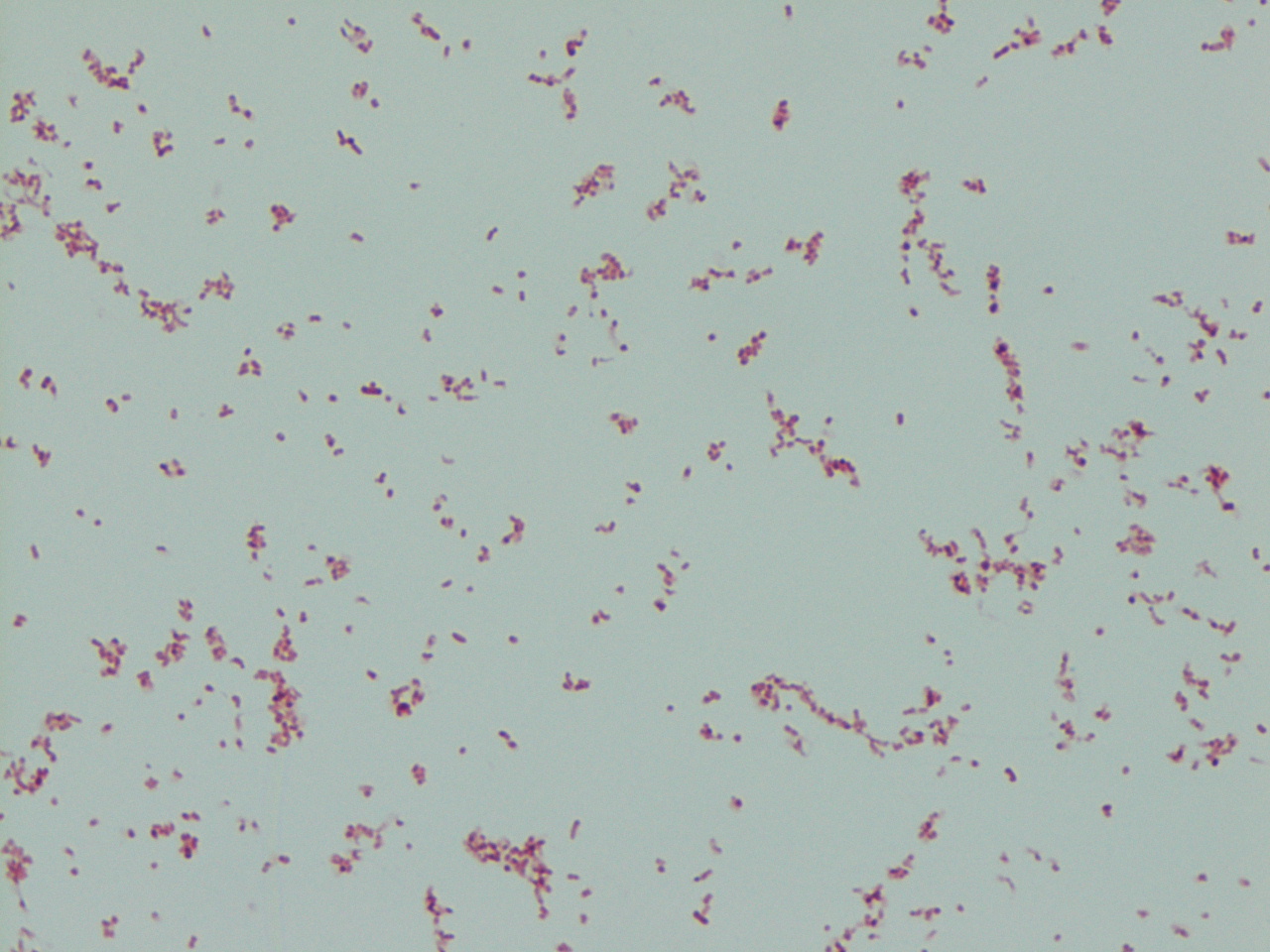
При остеомиелитах препарат вводят в полость раны через турунды, дренажи в количестве 10-30 мл ежедневно однократно, курс лечения 15-20 дней.
При лечении нагноений ран препарат применяют в виде орошения, аппликаций, повязок, введения в дренаж в дозе 5-50 мл в зависимости от очага пораженияне менее одного раза в день, курс лечения 10-15 дней.
При лечении гнойно-воспалительных гинекологических заболеваний (нагноений ран, эндометритов, вульвитов, бартолинитов, кольпитов, сальпингоофоритов) препарат используют для орошений, аппликаций, вводят в полости ран, вагины, матки по 5-20 мл один раз в день в течение 7-10 дней.
При циститах, пиелонефритах, уретритах препарат принимают внутрь в терапевтической дозе 3 раза в день за 1 час до еды в течение 10-20 дней. В том случае, если полость мочевого пузыря или почечной лоханки дренированы, препарат вводят через цистостому или нефростому 1-3 раза в день по 20-50 мл в мочевой пузырь и 5-7 мл в почечную лоханку, курс лечения 7-15 дней.
При гастроэнтероколитах, панкреатитах, холециститах, а также дисбактериозах кишечника бактериофаг принимают внутрь в возрастных дозировках 3 раза в день за 1 час до еды в течение 7-15 дней (по клиническим показаниям). При неукротимой рвоте препарат применяют в виде высоких клизм 2-3 раза в день по 20-40 мл. При дисбактериозе кишечника препарат может применяться с препаратами нормофлоры.
Для профилактики внутрибольничных хирургических инфекций препарат используют для обработки послеоперационных и свежеинфицированных ран в дозе 5 -50 мл в зависимости от очага поражения ежедневно однократно в течение 5-7 дней.
Применение препарата у детей до 1 года (включая недоношенных детей).
При гастроэнтероколите, пневмонии и сепсисе новорожденных препарат применяют через рот 2-3 раза в сутки по 3-5 мл за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно однократно в дозе 5-10 мл. Возможно сочетание ректального (в виде высоких клизм) и пероралыюго применения препарата. Курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
Возможно сочетание ректального (в виде высоких клизм) и пероралыюго применения препарата. Курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
С целью профилактики возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют по эпидемическим показаниям внутрь по 3-5 мл 3 раза в день за 30 минут до кормления в течение всего срока пребывания в стационаре.
При лечении омфалитов, пиодермии, инфицированных ран бактериофаг применяют в виде аппликаций по 5-10 мл 2-3 раза в день (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи) в течение 7-15 дней.
Применение препарата не исключает использование других антибактериальных и противовоспалительных препаратов.
Нет аппетита у грудного ребенка
Здравствуйте. Нужна помощь специалиста, подскажите, пожалуйста, куда можно обратиться, или если возможно подсказать по анализам, то подскажите возможное лечение. Сразу хочу отметить, что специалистов у нас тут по месту жительства нет. Я обошла практически всех, и участковых и платных. Результата нет. А проблема вот в чем. С 2,5 месяцев у меня ребенок плохо стал есть. Пропал аппетит. В 3 месяца ночью поднялась температура 37,7. Сдали анализы и общий и по Нечепоренко. Моча-Л-урия до 18. Поставили диагноз-инфекция мочевыводящих путей. Кроме плохих анализов и однократного увеличения температуры больше симптомов не было. Прокололи курс антибиотиков. Сделали УЗИ брюшной полости. Все в норме, кроме печени, она была увеличена до 7,7. Кал на копрологию-дрожжи+, мыла+, слизь+. Сейчас меня очень беспокоит то, что у него аппетита нет с 2,5 месяцев примерно. Ест только когда спит, я считаю, что чисто рефлекторно-сосательный рефлекс. Бывало такое, что даже сонный не ел-засыпал крепко и не сосал. Так мог пропустить 2 кормления, т.е. перерыв составлял 12 часов. При этом ребенок ведет себя активно, даже очень, голодным не выглядит. Пытаюсь кормить-тщетно, зажимает рот, отворачивается.
Сразу хочу отметить, что специалистов у нас тут по месту жительства нет. Я обошла практически всех, и участковых и платных. Результата нет. А проблема вот в чем. С 2,5 месяцев у меня ребенок плохо стал есть. Пропал аппетит. В 3 месяца ночью поднялась температура 37,7. Сдали анализы и общий и по Нечепоренко. Моча-Л-урия до 18. Поставили диагноз-инфекция мочевыводящих путей. Кроме плохих анализов и однократного увеличения температуры больше симптомов не было. Прокололи курс антибиотиков. Сделали УЗИ брюшной полости. Все в норме, кроме печени, она была увеличена до 7,7. Кал на копрологию-дрожжи+, мыла+, слизь+. Сейчас меня очень беспокоит то, что у него аппетита нет с 2,5 месяцев примерно. Ест только когда спит, я считаю, что чисто рефлекторно-сосательный рефлекс. Бывало такое, что даже сонный не ел-засыпал крепко и не сосал. Так мог пропустить 2 кормления, т.е. перерыв составлял 12 часов. При этом ребенок ведет себя активно, даже очень, голодным не выглядит. Пытаюсь кормить-тщетно, зажимает рот, отворачивается. .. И так до сих пор. Прибавка в весе маленькая. Напишу с месяца-970гр, 700, 500, 660, 420, 370, 530. Нам сейчас 7 месяцев. Ребенок до сих пор самостоятельно не сидит. Сегодня (22.12.2009) сделали УЗИ брюшной полости: печень увеличена 8,4, холедох 0,2 см, воротная вена 0,5см структура однородная, эхогенность нормальная. Желчный пузырь в норме, почки в норме, поджелудочная увеличена: Головка 1,3 см, тело 1,1см, хвост 1,8см структура неоднородная, эхогенность понижена. Селезенка увеличена 7,2х3,5, эхогенность в норме, структура однородная. Кал на копрологию (от 20.11.09): мыш.волокна+, нейтр.жир+, мыла+, дрожжи++, раст.кл.++. Еще у него дисбактериоз. E.coli Lac (+) -4.9*109; E.coli Lac (-) 1.6*108; E.coli Гем(+) 1,8*109; Enterococcus spp. >9.0*108; Klebsiella spp. 9.6*108; Прошу у врача, чтоб обследовали, а ответ практически всегда один-отстань от ребенка. Все у вас нормально и хватит ходить и все сдавать. Ходила к платному педиатру-пили поливалентный пиобактериофаг, Нормофлорин Д, повторные анализы на дисбактериоз — значения некоторые только увеличились (я их выше написала).
.. И так до сих пор. Прибавка в весе маленькая. Напишу с месяца-970гр, 700, 500, 660, 420, 370, 530. Нам сейчас 7 месяцев. Ребенок до сих пор самостоятельно не сидит. Сегодня (22.12.2009) сделали УЗИ брюшной полости: печень увеличена 8,4, холедох 0,2 см, воротная вена 0,5см структура однородная, эхогенность нормальная. Желчный пузырь в норме, почки в норме, поджелудочная увеличена: Головка 1,3 см, тело 1,1см, хвост 1,8см структура неоднородная, эхогенность понижена. Селезенка увеличена 7,2х3,5, эхогенность в норме, структура однородная. Кал на копрологию (от 20.11.09): мыш.волокна+, нейтр.жир+, мыла+, дрожжи++, раст.кл.++. Еще у него дисбактериоз. E.coli Lac (+) -4.9*109; E.coli Lac (-) 1.6*108; E.coli Гем(+) 1,8*109; Enterococcus spp. >9.0*108; Klebsiella spp. 9.6*108; Прошу у врача, чтоб обследовали, а ответ практически всегда один-отстань от ребенка. Все у вас нормально и хватит ходить и все сдавать. Ходила к платному педиатру-пили поливалентный пиобактериофаг, Нормофлорин Д, повторные анализы на дисбактериоз — значения некоторые только увеличились (я их выше написала). Пропили Креон 10 дней. В общем Аппетит не появляется. Если это поможет в постановке диагноза или лечении, то еще некоторые жалобы – спит ночью беспокойно. Крутится, часто бывает неожиданный плач во сне. Ребенок на искусственном вскармливании с 5 месяцев. Грудным молоком кормила (сцеживала) до 4 месяцев, потом СВ. В моем молоке был стафилококк эпидермальный. Вот вроде бы все… Спасибо заранее за ответ. Помогите, пожалуйста, не знаю уже к кому обратиться. Наши врачи по месту жительства от нас отмахиваются, считают, что я зря паникую. Очень жду вашего ответа.
Пропили Креон 10 дней. В общем Аппетит не появляется. Если это поможет в постановке диагноза или лечении, то еще некоторые жалобы – спит ночью беспокойно. Крутится, часто бывает неожиданный плач во сне. Ребенок на искусственном вскармливании с 5 месяцев. Грудным молоком кормила (сцеживала) до 4 месяцев, потом СВ. В моем молоке был стафилококк эпидермальный. Вот вроде бы все… Спасибо заранее за ответ. Помогите, пожалуйста, не знаю уже к кому обратиться. Наши врачи по месту жительства от нас отмахиваются, считают, что я зря паникую. Очень жду вашего ответа.
Добрый день! Результаты анализов свидетельствуют о недостаточности внешнесекреторной функции поджелудочной железы и нарушении микрофлоры кишечника. К сожалению, не все параметры исследования на дисбактериоз отражены в Вашем письме. Рекомендую провести расширенное биохимическое исследование крови, включая амилазу, липазу, АЛТ, АСТ, билирубин с фракциями, щелочную фосфатазу, ГГТ. Что касается лечения дисбактериоза, то не всегда бывает достаточно одно курса лечения. Рекомендую повторить анализ на дисбактериоз. По результатам анализов проконсультироваться с гастроэнтерологом.
Рекомендую повторить анализ на дисбактериоз. По результатам анализов проконсультироваться с гастроэнтерологом.
«Страшный зверь» стафилококк / «Мой кроха и я»
Сентябрь 2010
Наталия Рубина; консультанты: Ирина Перрэн, заведующая педиатрическим отделением Европейского Медицинского Центра; Наталья Таран, неонатолог, к. м. н., научный I сотрудник научно-консультативного отделения 1 НИИ Питания РАМН
Сразу после рождения малыш сталкивается с очень опасным врагом — золотистым стафилококком. Как распознать стафилококковую инфекцию и, по возможности, избежать её?
История одной мамы
На 12-й день после выписки из роддома Олеся обнаружила, что у её маленькой дочки опухли и стали гноиться глазки, а на попке появились покраснения. При этом малышка не переставая плакала. Участковый врач осмотрела девочку и предположила, что покраснения на её коже — результат погрешностей в питании мамы. Олеся села на жесточайшую диету.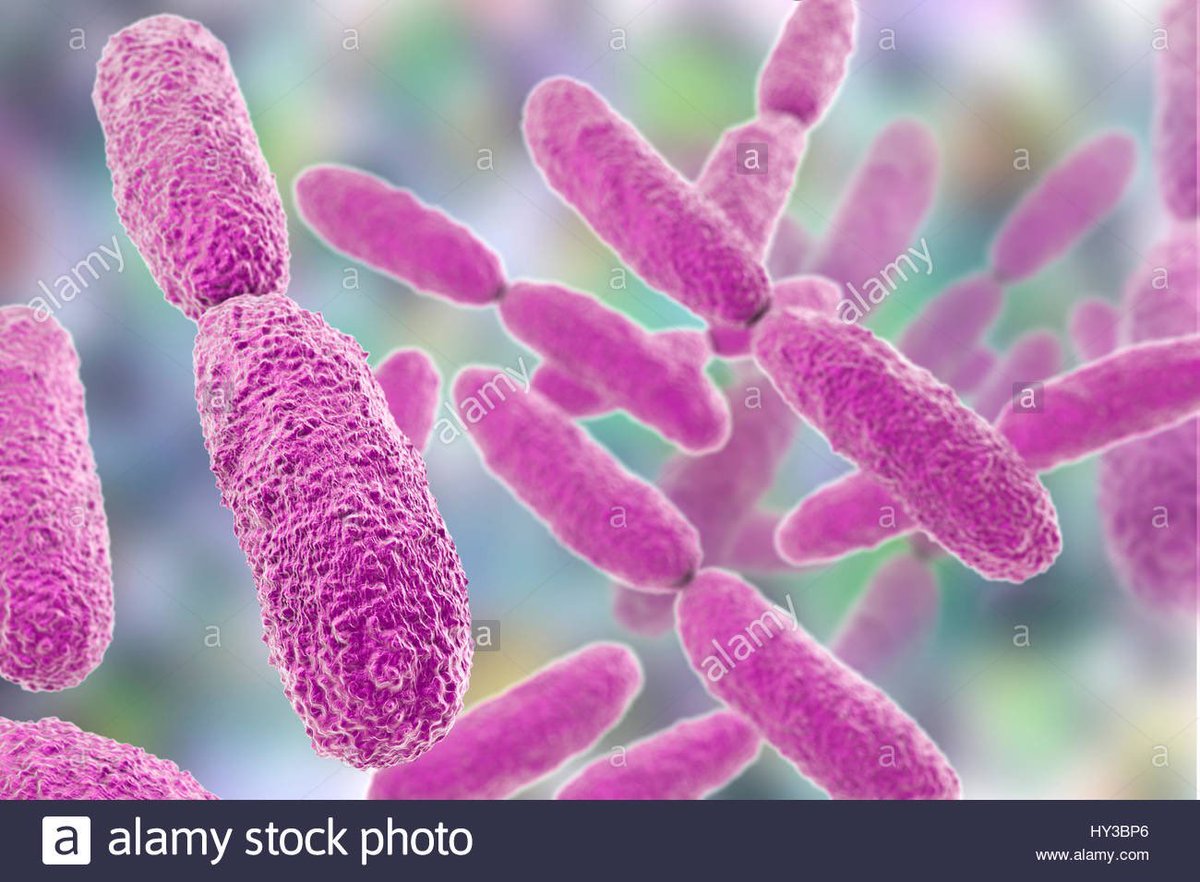 Однако ещё через две недели вокруг рта у ребёнка появились какие-то высыпания, кожа начала отчаянно шелушиться, а у самой Олеси появились трещины на сосках, грудь стала твёрдой и очень болезненной, подскочила температура.
Однако ещё через две недели вокруг рта у ребёнка появились какие-то высыпания, кожа начала отчаянно шелушиться, а у самой Олеси появились трещины на сосках, грудь стала твёрдой и очень болезненной, подскочила температура.
В детской поликлинике ей предложили сдать грудное молоко на анализ. Через пару дней стали известны его результаты — в молоке обнаружен эпидермальный и золотистый стафилококк. Участковый врач настаивала на прекращении грудного вскармливания и назначила смесь. В течение месяца Олеся и её дочь принимали антибиотики. При этом она продолжала сцеживать молоко, не давая его ребёнку. За этот месяц малышке стало заметно лучше, и отпала необходимость давать ей лекарства. Второй анализ молока показал наличие в нём только эпидермального стафилококка, но врач всё равно настаивала на отмене грудного вскармливания. Тогда Олеся решила обратиться за консультацией к другому доктору, и тот заверил её, что наличие в молоке любой разновидности стафилококка не опасно для ребёнка. Когда Олесиной дочке исполнилось 2 месяца, она уже снова питалась исключительно маминым молоком.
Когда Олесиной дочке исполнилось 2 месяца, она уже снова питалась исключительно маминым молоком.
Прокомментировать эту ситуацию мы попросили неонатолога Наталью Таран: «Скорее всего, девочка заразилась стафилококковой инфекцией ещё в роддоме, и после выписки болезнь перешла в активную форму. А уже от ребёнка через трещины на сосках заразилась и мама. Те высыпания на коже, которые участковый врач приняла за результат неправильного питания мамы, скорее всего, были также вызваны стафилококковой инфекцией. При этом странно, что врач не уделила никакого внимания симптомам конъюнктивита. Ведь он тоже может быть вызван стафилококком. Гнойное отделяемое из глаз нужно было сдать на анализ, чтобы выявить возбудителя. Зато врач явно переусердствовала, отменив грудное вскармливание. Если мама получает антибиотики против стафилококковой инфекции, то с молоком лечение против болезни получает и ребёнок. Грудное вскармливание отменяется в единственном случае — если у мамы гнойный мастит. Но молоко с гнойным отделяемым ребёнок не станет пить и сам. Хорошо, что мама не растерялась и, почувствовав сомнение, обратилась за дополнительной консультацией к другому специалисту».
Хорошо, что мама не растерялась и, почувствовав сомнение, обратилась за дополнительной консультацией к другому специалисту».
Стафилококки — это целый род бактерий. На сегодня известно множество видов стафилококка, многие из которых живут на коже и слизистых оболочках человека, а также в кишечнике. Большинство стафилококков абсолютно безвредны, вызывать болезни могут только три представителя этого семейства — эпидермальный, сапрофитный и золотистый стафилококки. Причём последний — самый опасный. Организм здорового человека с лёгкостью справляется со стафилококком. Однако если по каким-то причинам снижается иммунитет, стафилококк идёт в атаку, вызывая различные заболевания. Этот микроб также может проникнуть в организм там, где нарушена целостность кожи (у роженицы, к примеру, через трещины на сосках, а у новорождённого — через пупочную ранку).
Знакомство со стафилококком возможно сразу же после рождения — младенец может получить эту бактерию, проходя через родовые пути или же с кожи мамы, как только она впервые приложит его к груди. Большинство детей легко справляется с микробом, но у недоношенных малышей и тех, кто родился со сниженным иммунитетом вследствие осложнений во время беременности, стафилококк может вызвать различные заболевания.
Большинство детей легко справляется с микробом, но у недоношенных малышей и тех, кто родился со сниженным иммунитетом вследствие осложнений во время беременности, стафилококк может вызвать различные заболевания.
Симптомы
И у детей, и у взрослых различают раннюю и позднюю форму стафилококковой инфекции. Ранняя проявляется в течение нескольких часов после попадания бактерии в организм, болезнь при этом начинается остро и тяжело — резко повышается температура, могут начаться понос, рвота, ребёнок становится вялым, теряет аппетит. Что характерно, у младенцев с таких симптомов начинаются все инфекции. Поэтому даже не пытайтесь ставить диагноз самостоятельно, а при появлении первых признаков заболевания обращайтесь к врачу. Поздняя форма стафилококковой инфекции проявляется через 3-5 дней. Как правило, инфекция в первую очередь поражает кожу и, если вовремя не начать лечение, может пойти глубже, поражая внутренние органы, и даже вызвать сепсис.
Однако в некоторых случаях болезнь протекает и бессимптомно или с незначительными гнойничковыми поражениями кожи. Так что, если вы заметили на коже ребёнка какие-либо высыпания, не спешите списывать их на погрешности в вашем питании или потницу, — покажите их врачу. Если доктор заподозрит, что они имеют инфекционный характер, он назначит необходимые анализы, чтобы выявить возбудителя. Как правило, в таких случаях делаются соскобы с кожи и общий анализ крови, который покажет, болен ли ребёнок.
Бессимптомное носительство у взрослого крайне опасно для окружающих — ведь человек не знает, что он болен, и не предпринимает никаких мер, являясь при этом источником инфекции. В то же время в организме заболевшего человека количество стафилококка резко возрастает, а его патогенные свойства усиливаются. Поскольку стафилококковая инфекция передаётся контактным путём, то заразиться ей можно, просто прикоснувшись к больному.
«В организме ребёнка, иммунитет которого ослаблен в силу определённых причин, нарушается баланс полезных и вредных бактерий, и золотистый стафилококк может начать активно размножаться, — говорит педиатр Европейского Медицинского Центра Ирина Перрэн. — Но хочу особо отметить: даже если в анализах обнаружен стафилококк, но клинической картины заболевания нет (ребёнок хорошо себя чувствует, прибавляет в весе), то никакого медикаментозного лечения не требуется. Лечат пациента, а не анализы.
— Но хочу особо отметить: даже если в анализах обнаружен стафилококк, но клинической картины заболевания нет (ребёнок хорошо себя чувствует, прибавляет в весе), то никакого медикаментозного лечения не требуется. Лечат пациента, а не анализы.
Бить тревогу нужно, если у ребёнка есть признаки бактериальной инфекции: повышенная температура, потеря аппетита, снижение прибавки веса, появление гнойничков на коже, воспаление околопупочного кольца, понос и т. д. В таком случае следует незамедлительно обратиться к врачу, который назначит необходимое лечение».
КАК ПРОЯВЛЯЕТСЯ СТАФИЛОКОККОВАЯ ИНФЕКЦИЯ?
Стафилококковая инфекция вызывает у новорождённых множество самых различных заболеваний. Все они крайне опасны, поэтому при обнаружении первых симптомов обратитесь к врачу.
ЭНТЕРИТ (ЭНТЕРОКОЛИТ)
Признаки болезни
Частый (до 15 раз в сутки) кашицеобразный, слизистый, водянистый ступ, ребёнок плачет, часто срыгивает, его животик вздут. Может подняться высокая температура и начаться рвота. Последнее особенно опасно для младенцев, поскольку приводит к быстрому обезвоживанию организма.
Может подняться высокая температура и начаться рвота. Последнее особенно опасно для младенцев, поскольку приводит к быстрому обезвоживанию организма.
Лечение
Необходима госпитализация. Как только вы заметили первые симптомы, как можно скорее вызывайте врача. А пока доктор едет, восполняйте дефицит жидкости в организме ребёнка — каждые 10 минут давайте ему столовую ложку воды.
Народные средства — их можно использовать только параллельно с лечением в больнице или после выписки.
- Настой цветов календулы: 1 ч. л. цветов на стакан воды. Давать малышу понемногу в промежутках между кормлениями.
- Настой цветов ромашки аптечной: 1 ст. л. сухих цветов залить стаканом кипятка, кипятить 5 минут, настаивать 4 часа, процедить. Давать по 1 ч. л. после кормления.
Отвар из корок плодов граната: взять 20 г сухих корок или 50 г зёрен граната, залить стаканом воды, кипятить на медленном огне 30 минут, процедить. Давать пить по 1 ч. л. 2 раза в день.
Давать пить по 1 ч. л. 2 раза в день.
ИНФЕКЦИОННЫЙ КОНЬЮНКТИВИТ
Признаки болезни
Ребёнок плачет, его глаза покраснели, опухли и слезятся, из них выделяется гной, образуются жёлто-зелёные корки. После сна ресницы склеены гноем так, что малыш с трудом открывает глазки.
Лечение
Назначает врач. Необходимо сдать выделения из глаз в лабораторию на анализ, чтобы выявить возбудителя заболевания и правильно подобрать антибиотик.
Народные средства
- Протирать веки младенца грудным молоком. Однако это средство не подходит, если и у мамы в анализе молока обнаружен стафилококк.
- Протирать глаза ребёнка ватными тампонами, смоченными в чайной заварке (крепкий раствор чёрного чая).
- Прокипятите одну чайную ложку мёда в стакане воды в течение 2 минут. Когда медовая вода остынет, из неё делают примочки на глаза 2 раза в день по 20 минут.
 Эту же воду капают в глаза по 2-3 капли 2 раза вдень.
Эту же воду капают в глаза по 2-3 капли 2 раза вдень.
- Одну чайную ложку цветков календулы залить стаканом кипятка, настаивать 30-40 минут, затем тщательно процедить. Полученным раствором несколько раз в день промывать глазки ребёнка.
«ПУЗЫРЧАТКА» (ПЕМФИГУС) НОВОРОЖДЁННЫХ (ПОВЕРХНОСТНОЕ ГНОЙНОЕ ВОСПАЛЕНИЕ КОЖИ)
Признаки болезни
На коже (в нижней части живота, в складках шеи, на спине) образуется множество пузырьков с мутным содержимым. Кожа в этих местах отёчная, покрасневшая. Ребёнок вялый, отказывается от еды.
Лечение
Лекарства назначает только врач. Как правило, это курс антибиотиков.
Народные средства
- Протирать пузыри ваткой, смоченной в камфорном масле (до 4-5 раз в день).
МНОЖЕСТВЕННЫЕ АБСЦЕССЫ
Признаки болезни
На коже появляются багрово-красные гнойнички, которые вскрываются с выделением жёлто-зелёного гноя. У ребёнка поднимается температура, он вялый или, наоборот, капризный.
У ребёнка поднимается температура, он вялый или, наоборот, капризный.
Лечение
При первых признаках заболевания обратитесь к врачу.
СЕПСИС
По течению болезни различают септицемию и септикопиемию. Септицемия начинается бурно с развития желтухи, быстрой потери массы тела, тахикардии. Ребёнок беспокойный, у него могут начаться судороги. Септикопиемия начинается с появления гнойничков на коже, иногда развиваются абсцессы. При пупочном сепсисе пупочная ранка воспаляется, кожа вокруг отёчная, красная.
Лечение
Лечение назначает врач. Как правило, это антибиотики широкого спектра, стимулирующая терапия — переливание крови, введение плазмы, витамины.
Нона Овсепян, врач-консультант Независимой лаборатории «ИНВИТРО
Для того чтобы определить наличие стафилококка, а также других вредных бактерий в грудном молоке, необходимо сделать посев молока на микрофлору и золотистый стафилококк с определением чувствительности к антибиотикам.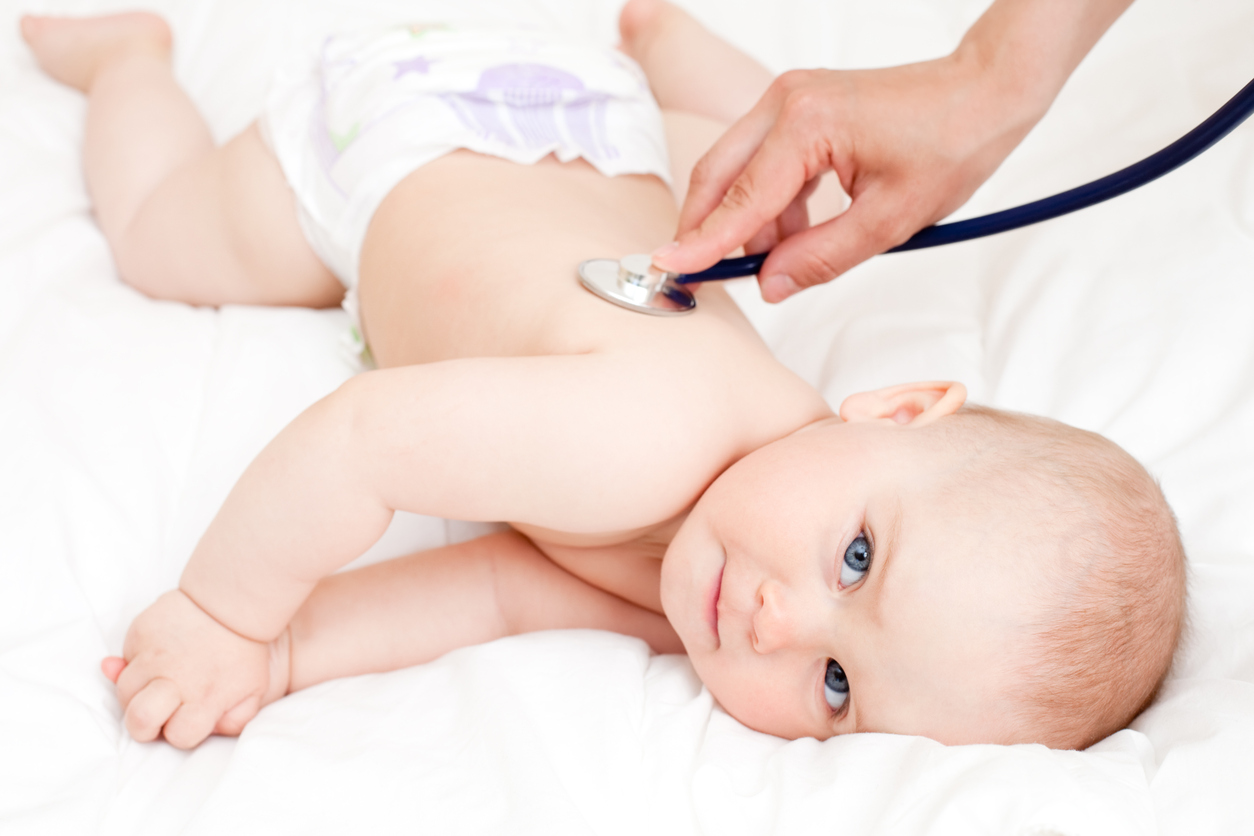 Для анализа грудное молоко сцеживают в стерильную пробирку или баночку (вы можете приобрести их в аптеке или лаборатории). Перед сцеживанием руки и молочные железы необходимо обработать мылом, ареолы сосков вытереть 70%-ным спиртом (каждая грудь обрабатывается отдельным тампоном).
Для анализа грудное молоко сцеживают в стерильную пробирку или баночку (вы можете приобрести их в аптеке или лаборатории). Перед сцеживанием руки и молочные железы необходимо обработать мылом, ареолы сосков вытереть 70%-ным спиртом (каждая грудь обрабатывается отдельным тампоном).
Первая порция (5-10 мл) анализа не используется, сцеживается в отдельную посуду, а вторая (10 мл) — в стерильную посуду для анализа. Молоко из левой и правой груди смешивать нельзя, надо собирать в отдельные контейнеры. Для точного результата анализа между сцеживанием молока и доставкой его лабораторию должно пройти не более 3-х часов.
Параллельно с определением количества и качества бактерий в молоке исследуется их устойчивость к антибиотикам и бактериофагам, это необходимо для правильного подбора препарата для лечения стафилококковой инфекции.
При подозрении на стафилококковую инфекцию у новорождённого необходимо исследование кала на патогенную и условно-патогенную микрофлору. Материалом для этого анализа служит кал после естественной дефекации, который нужно собрать в одноразовый контейнер и как можно быстрее (в течение 3-х часов) доставить в лабораторию. Для того, чтобы результаты были достовернее, рекомендуется провести 2-3 кратное исследование с интервалов 1-2 дня.
Материалом для этого анализа служит кал после естественной дефекации, который нужно собрать в одноразовый контейнер и как можно быстрее (в течение 3-х часов) доставить в лабораторию. Для того, чтобы результаты были достовернее, рекомендуется провести 2-3 кратное исследование с интервалов 1-2 дня.
Золотистый стафилококк может быть причиной развития бронхитов, пневмонии и ряда других воспалительных заболеваний дыхательной системы. В такой ситуации берётся посев с зева и носа с целью выявления золотистого стафилококка. Сдают этот анализ все пациенты, в том числе самые маленькие, строго натощак, а взрослые перед этим анализом не должны чистить зубы (поскольку может искажаться истинная картина).
Посев берётся с помощью специального зонда, который затем помещается в специальную среду для роста бактерий.
При конъюнктивите материал для анализа желательно брать утром до умывания. При наличии обильного гнойного отделяемого используют стерильный тампон. Гной собирают с внутренней поверхности нижнего века движением от наружного к внутреннему углу глазной щели. При этом веки нужно придерживать руками, чтобы при моргании ресницы не касались тампона. Если гной в небольшом количестве, то предварительно тампон смачивают дистиллированной водой.
При этом веки нужно придерживать руками, чтобы при моргании ресницы не касались тампона. Если гной в небольшом количестве, то предварительно тампон смачивают дистиллированной водой.
При кожных заболеваниях, вызванных стафилококком, необходимо брать кожный соскоб или исследовать отделяемое из раны на наличие золотистого стафилококка. Для этого следует обработать кожу вокруг раны антисептиком или ватным тампоном, смоченным 70%-ным этиловым спиртом. Стерильной марлевой салфеткой удаляют некротические (омертвевшие) массы и гной, затем с помощью специального ватного тампона берут отделяемое из раны.
«Больничная» инфекция
Стафилококковую инфекцию называют больничной или роддомовской. У пациентов этих заведений иммунитет, как правило, ослаблен, и стафилококк на этом фоне идёт в атаку. Однако, чтобы инфекция приобрела массовый характер, у неё должен быть очаг — больной человек. Им может быть кто-то из персонала, одна из рожениц или заболевший ребёнок. Механизм передачи инфекции прост — через руки. К примеру, носитель инфекции — медсестра в роддоме. У неё есть небольшие гнойнички на коже, которым она не придала должного значения. Перепеленав или обработав новорождённого без одноразовых перчаток, эта медсестра тут же заражает его. Или же если болен ребёнок, а медсестра взяла его на руки, то заражается уже она. И может передать инфекцию следующему младенцу, с которым будет контактировать.
Механизм передачи инфекции прост — через руки. К примеру, носитель инфекции — медсестра в роддоме. У неё есть небольшие гнойнички на коже, которым она не придала должного значения. Перепеленав или обработав новорождённого без одноразовых перчаток, эта медсестра тут же заражает его. Или же если болен ребёнок, а медсестра взяла его на руки, то заражается уже она. И может передать инфекцию следующему младенцу, с которым будет контактировать.
Для предотвращения вспышек инфекции с рук медперсонала, с мебели и оборудования регулярно делаются смывы — эпидемиологическая служба обрабатывает их специальным раствором, а потом исследует его на наличие различных бактерий, попутно выясняя степень их патогенности. С той же целью роддома два раза в год закрываются на мойку (и, естественно, это делается внепланово сразу же, как только обнаружена инфекция). При этом все поверхности, включая потолок, обрабатываются дезинфицирующими растворами, которые уничтожают бактерии стафилококка. Поэтому выбирая роддом, поинтересуйтесь, когда в последний раз он закрывался на мойку. Если это было несколько месяцев назад, может быть, имеет смысл обратиться в другой роддом.
Если это было несколько месяцев назад, может быть, имеет смысл обратиться в другой роддом.
Молоко безвредно?
Главные «ворота» для стафилококковой инфекции у женщины — трещины на сосках. Поэтому как только они появились, их нужно сразу обработать анилиновыми растворами, к которым стафилококк очень чувствителен, — зелёнка, фукорцин или метиленовый синий. Кормить ребёнка грудью при этом надо, используя специальные накладки на соски (в том числе для облегчения болезненных ощущений). Не стоит мыть молочные железы с мылом перед каждым кормлением, вполне достаточно принимать душ два раза в день. Частое мытье сушит кожу, а это в свою очередь способствует появлению новых трещин на сосках, куда может проникнуть инфекция.
Если трещина резко болезненная, воспалённая, вокруг неё появилось уплотнение, а из груди выделяется гной, то, возможно, мы имеем дело со стафилококковой инфекцией. В этом случае врач может порекомендовать сдать грудное молоко на анализ. Однако если у вас просто появились трещины — это ещё не повод бежать с молоком на анализ. Для этого должны быть симптомы воспаления (резкая пульсирующая боль в груди и гнойное отделяемое). В любом случае, стоит прийти на осмотр к врачу, который определит, что с вами, и поможет быстрее справиться с трещинами.
Однако если у вас просто появились трещины — это ещё не повод бежать с молоком на анализ. Для этого должны быть симптомы воспаления (резкая пульсирующая боль в груди и гнойное отделяемое). В любом случае, стоит прийти на осмотр к врачу, который определит, что с вами, и поможет быстрее справиться с трещинами.
Если в анализе молока обнаружен эпидермальный стафилококк, скорее всего, анализ был сдан неправильно, и микроб попал туда с кожи. Если же в молоке обнаружен золотистый стафилококк, то с большой вероятностью можно утверждать, что он есть и в крови у женщины. А это уже серьезная ситуация, которая бессимптомно протекать не может, — налицо должны быть проявления бактериальной инфекции (высокая температура, слабость).
Но важно помнить, что наличие любой разновидности стафилококка в молоке (если при этом у женщины нет гнойного мастита) — не повод прекращать грудное вскармливание. Женщине в таком случае нужно будет пройти курс лечения антибиотиками, разрешёнными во время лактации, которые, попадая с грудным молоком к ребёнку, одновременно защищают его от инфекции.
Лечение
Ставить диагноз, а тем более назначать лечение при стафилококковой инфекции должен только врач. Как правило, назначаются антибиотики пенициллинового ряда и бактериофаги (микроорганизмы, избирательно поражающие бактериальные клетки).
Самая распространённая ошибка мам — это самолечение. Как только у вас или ребёнка появились гнойничковые высыпания на коже, высокая температура, понос или рвота, потеря аппетита — сразу же обращайтесь к врачу.
Самая же большая ошибка врачей — это переоценка тяжести ситуации. Если вы считаете, что ваш доктор перестраховывается, например, отменяя грудное вскармливание, не поленитесь обратиться за дополнительной консультацией к другому специалисту.
ВОПРОС ОТ ПОСЕТИТЕЛЬНИЦЫ САЙТА WWW.KROKHA.RU
У ребёнка обнаружен в кале золотистый стафилококк, при этом есть симптомы обычного дисбактериоза (небольшое нарушение стула, срыгивание, лёгкое беспокойство). Надо ли лечить стафилококк? И что в таком случае делать вообще?
НАТАЛЬЯ ТАРАН: Стафилококк не вызывает дисбактериоза. Причина появления стафилококка в анализе, скорее всего, в том, что он (анализ) был неправильно собран, и микроб попал туда с кожи. Так что в первую очередь такой анализ надо пересдать (см. выше). А затем искать и устранять причину дисбактериоза.
Причина появления стафилококка в анализе, скорее всего, в том, что он (анализ) был неправильно собран, и микроб попал туда с кожи. Так что в первую очередь такой анализ надо пересдать (см. выше). А затем искать и устранять причину дисбактериоза.
ПРОФИЛАКТИКА СТАФИЛОКОККОВОЙ ИНФЕКЦИИ У НОВОРОЖДЁННЫХ
Как можно быстрее выписывайтесь из родильного дома с ребёнком домой, естественно, если врачи не возражают. Во время пребывания в роддоме, если есть такая возможность, находитесь в одноместной палате и совместно с ребёнком.
Обязательно мойте руки перед кормлением и процедурами по уходу за малышом. Если у вас на руках есть порезы, царапины, то обработайте их фукорцином или зелёнкой. Ну а если на вашей коже появились гнойнички, воспалённые места, то обязательно покажите их доктору. Пока не будет выяснена их причина, за ребёнком лучше ухаживать папе или бабушке.
Внимательно наблюдайте за своим ребёнком. Подъём температуры, вялость, отказ от еды, «беспричинный» плач, высыпания на коже, понос — все это должно насторожить вас и побудить вызвать врача.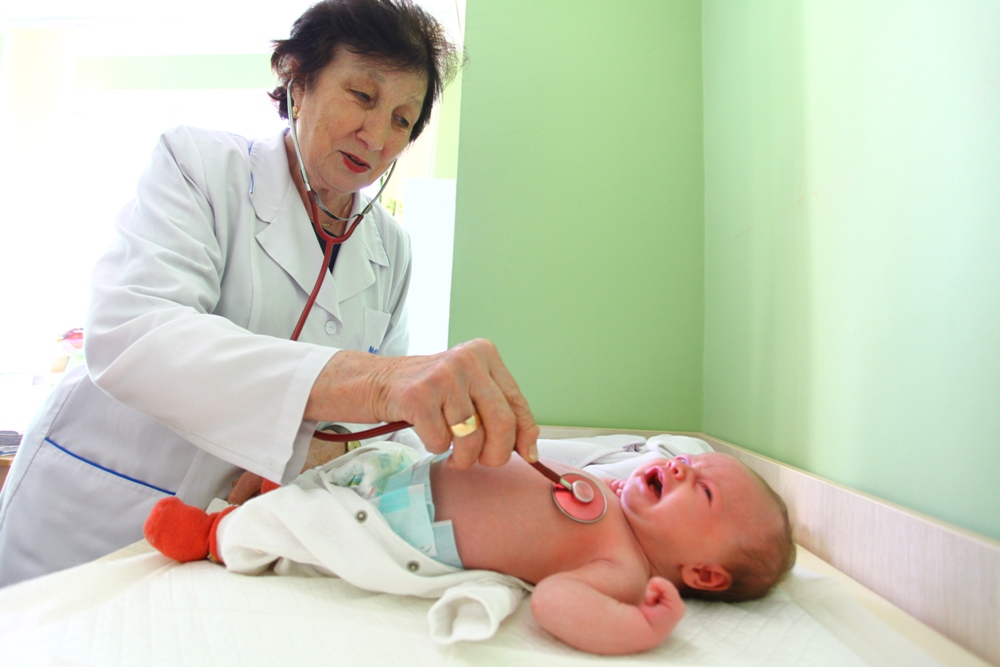
Обязательно просите всех родственников, врачей из поликлиники, которые хотят подойти и взять на руки новорождённого, тщательно вымыть руки с мылом. Выделите для них отдельное полотенце. Не стесняйтесь отказать людям, чьё здоровье внушает вам опасение.
Закаливайте малыша с первых дней жизни (см. статью в № 5 журнала «Мой кроха и Я» за 2010 г.), чтобы у него был хороший иммунитет.
Применение нифуратела в лечении микст-инфекций кишечника uMEDp
В рамках ретроспективного анализа нифурател продемонстрировал 95%-ную эффективность при лечении интестинального лямблиоза, сочетанного с дисбиозом кишечника, а также высокую эффективность в борьбе с условно-патогенными видами Escherichia coli, Citrobacter spp. и Klebsiella spp. Большинство пациентов отмечали улучшение самочувствия после лечения, что проявлялось прежде всего нормализацией частоты и оформленности стула, уменьшением флатуленции, исчезновением абдоминального дискомфорта, улучшением аппетита и снижением утомляемости. Нифурател можно считать препаратом выбора при сочетании лямблиоза с бактериальным дисбактериозом кишечника и хеликобактериозом пищеварительного тракта.
Нифурател можно считать препаратом выбора при сочетании лямблиоза с бактериальным дисбактериозом кишечника и хеликобактериозом пищеварительного тракта.
Таблица. Лабораторно подтвержденная эффективность нифуратела при лечении интестинального лямблиоза и избыточного микробного роста у больных (n = 42) микст-инфекциями кишечника
Проблема микст-инфекционных поражений кишечника в современной гастроэнтерологии весьма актуальна. Клиницистам и врачам-лаборантам приходится решать трудные задачи при диагностике и лечении заболеваний, обусловленных одновременно Helicobacter pylori(гастрит, язвенная болезнь, новообразования желудка и др.), Lamblia (астенический, аллергический и диспепсический синдромы) и другими оппортунистическими микроорганизмами, участвующими в дисбиотических состояниях кишечника, – условно-патогенными микроорганизмами родов Candida, Escherichia, Klebsiella, Proteus, Citrobacter, Staphylococcus aureus и др. (синдром раздраженного кишечника, иммунодефицитный и аллергический синдромы).
С 1981 г. Всемирной организацией здравоохранения возбудители рода Lamblia отнесены к безусловно патогенным кишечным простейшим [1]. Синдром дисбактериоза кишечника диагностируют у значительной части больных, обратившихся за помощью в лечебно-профилактические учреждения.
В Российском отраслевом стандарте «Протокол ведения больных. “Дисбактериоз кишечника”» (ОСТ 91500.11.0004-2003) под дисбактериозом кишечника понимается клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений с возможным возникновением желудочно-кишечных расстройств. Коррекция дисбиоза кишечника предполагает применение энтеросептических средств для подавления оппортунистической микробиоты в кишечной биопленке. Это в свою очередь создает условия для колонизации кишечника нормальной микрофлорой, преимущественно лактобациллами и бифидобактериями.
На этапе разработки тактики лечения остро стоит проблема выбора антимикробного препарата, действие которого было бы направлено против всех участников инфекционного процесса [2–4]. В этой связи актуально изучение препарата нифурател (Макмирор) – средства, характеризующегося широким спектром активности против возбудителей инфекционных поражений желудочно-кишечного тракта (в том числе бактериальных и простейших). Макмирор является препаратом стартовой терапии в лечении лямблиоза по протоколу, утвержденному на ХХ съезде детских гастроэнтерологов России и стран СНГ.
Материалы и методы исследования
В рамках ретроспективного исследования оценивали эффективность нифуратела (Макмирор) в лечении интестинального лямблиоза, ассоциированного с дисбиозом кишечника, у 42 пациентов (26 женщин и 18 мужчин), наблюдавшихся в консультативно-диагностическом отделении микологической клиники Санкт-Петербургской медицинской академии последипломного образования (СПбМАПО) в 2009–2010 гг., были проанализированы амбулаторные карты пациентов в возрасте от 18 до 65 лет (средний возраст 32 ± 4 года).
В исследование не включали данные амбулаторных карт пациентов, страдавших сахарным диабетом 1 и 2 типов и онкологическими заболеваниями, а также получавших одновременно другие антимикробные и/или глюкокортикостероидные препараты.
Все пациенты с микст-инфекционным поражением кишечника отмечали симптомы раздражения кишечника, а также астенический и аллергический синдромы (с различной частотой). Симптомы раздражения кишечника (чаще неоформленный кашицеобразный стул, чередующийся с запором, вздутие живота, абдоминальный болевой синдром) отмечали 27 (64%) пациентов, астенический синдром (слабость, утомляемость, снижение аппетита) – 19 (45%) больных, аллергические заболевания в фазе обострения (крапивница или атопический дерматит) – 11 (26%) пациентов.
Диагноз лямблиоза и контроль излеченности этой инфекции основывались на результатах лабораторного паразитологического исследования кала с использованием методов обогащения – формалин-эфирное осаждение и флотация (проводились в клинической лаборатории НИИ медицинской микологии СПбМАПО). Диагноз устанавливали при обнаружении вегетативных форм и/или цист простейших с указанием числа паразитов в поле зрения. Излеченность лямблиоза подтверждали двукратным исследованием кала с промежутком 5–7 дней. Серологические методы диагностики и контроля излеченности лямблиоза не применяли.
Дисбиоз кишечника выявляли с помощью стандартных бактериологических методов исследования кала, разработанных Р.В. Эпштейн-Литвак и Ф.В. Вильшанской, с определением числа КОЕ в 1 г фекалий в пересчете на десятичный логарифм. Избыточным считали рост оппортунистической микробиоты кишечника при значениях ≥ 10 000 КОЕ/г кала. Одновременно с контрольным исследованием кала на простейшие проводили контрольный анализ кала на дисбактериоз.
С обнаружением лямблий выявили избыточный рост в кале условно-патогенной кишечной палочки (гемолитической, лактозонегативной) – у 17 пациентов, грибов рода Candida – у 13, Citrobacter – у 11, Klebsiella – у 10, Proteus – у 6, S. aureus – у 5, другие – у 5. Контроль излеченности проводили в той же лаборатории (бактериологическая лаборатория микологической клиники).
Макмирор назначали по 400 мг (по 2 таблетки) 3 раза в день курсами по 7 дней (всего на курс 40 таблеток, или суммарно 8 г нифуратела). Одновременно всем пациентам было рекомендовано ограничить прием жирной и жареной пищи и полностью исключить прием алкогольных напитков. Большинство пациентов вместе с нифурателом получали пробиотики или пребиотики. Согласно принципам Хельсинкской декларации все пациенты получали полную информацию о назначенном лечении и свойствах применяемых лекарственных средств. Частоту и характер побочных эффектов терапии нифурателом (Макмирор) оценивали клинически (опрос, объективный осмотр во время второго визита). Статистическую обработку полученных данных проводили с использованием пакета программ SPSS, 12-я версия. Применяли параметрические и непараметрические методы сравнения исходя из характера распределения числовых данных. Частотные характеристики качественных переменных сравнивали с помощью таблиц сопряженности. Изучали корреляционную зависимость между признаками. Значимыми считали различия при р
Результаты
Результаты ретроспективного анализа амбулаторных карт пациентов, получавших лечение нифурателом, касаются изменений в клинической картине и контрольных анализов кала. При контрольном расспросе 59 (92,2%) из 64 пациентов отмечали улучшение самочувствия после проведенного курса лечения. Это проявлялось прежде всего нормализацией частоты и оформленности стула, уменьшением флатуленции и исчезновением абдоминального дискомфорта. Кроме того, большинство пациентов отмечали улучшение аппетита и снижение утомляемости. Из 16 пациентов с явлениями атопического дерматита или крапивницы 12 (75%) сообщили о значительном уменьшении выраженности кожного зуда и высыпаний. При этом только 6 (9,4%) из 64 пациентов отмечали нежелательные побочные эффекты – ощущение дискомфорта умеренной интенсивности в эпигастральной области, возникающее натощак, и чувство тяжести – после еды. Эти симптомы были непродолжительными, не потребовали прекращения терапии и самостоятельно исчезли после ее окончания. Нежелательных явлений в виде кожного зуда, высыпаний и бронхоспазма у пациентов не было.
Результаты лабораторного контроля кала (наличие лямблий при микроскопии и роста условно-патогенной бактериальной флоры) приведены в таблице. Как видим, нифурател показал 95%-ную эффективность при лечении интестинального лямблиоза, сочетанного с дисбиозом кишечника. Высокая эффективность нифуратела скорее всего была обусловлена фармакодинамикой препарата – хорошим накоплением активного вещества как в кишечной биопленке, так и в эпителиальном слое кишечника. Нам также удалось продемонстрировать высокую (до 100%) эффективность нифуратела против условно-патогенных видов E. coli, Citrobacter spp. и Klebsiella spp. Согласно результатам анализа нифурател можно считать препаратом выбора при сочетании лямблиоза с бактериальным дисбактериозом кишечника и хеликобактериозом пищеварительного тракта.
В то же время эффективность нифуратела при лечении кандидозного, протейного и стафилококкового дисбиоза оказалась существенно ниже: применение нифуратела по 800 мг/сут в течение 7 дней привело к санации кишечника от дрожжеподобных грибов у 6 из 21 пациента, протея – только у 3 из 9, а золотистого стафилококка – у 5 из 8 больных. Возможно, это связано со спецификой возбудителей подобных дисбиозов. Известна широкая распространенность резистентности Candida spp., Proteus spp. и S. aureus ко многим антимикробным препаратам. Видимо, при лечении этих вариантов дисбиоза кишечника требуются либо пролонгированные курсы приема нифуратела, либо применение других энтеросептиков.
Выводы
На основании проведенного исследования были сделаны следующие выводы.
1. Эффективность нифуратела (Макмирор) при лечении лямблиоза у взрослых по результатам двойных контрольных проб фекалий достигает 95%.
2. Эффективность нифуратела (Макмирор) при коррекции синдрома дисбактериоза у взрослых достигает 100%.
3. Макмирор может быть рекомендован как средство выбора с хорошим профилем безопасности при интестинальном лямблиозе, ассоциированном с дисбактериозом кишечника.
Что за супербактерия клебсиелла пневмонии и помогут ли от нее антибиотики? | Здоровая жизнь | Здоровье
В соцсети Twitter появились сообщения о супербактерии, которую не может «убить» ни один из предлагаемых для лечения антибиотиков. Один из белорусских пользователей продемонстрировал результаты анализа на чувствительность к клебсиелле пневмонии (Klebsiella pneumoniae): на фото бланка видно, что напротив названия каждого из 24 антибиотиков, которыми возможно лечение, стоит буква «R», обозначающая резистентность (устойчивость).
Klebsiella pneumoniae Фото: Public Domain
С аналогичной ситуацией не раз сталкивались и зарубежные медики. Так, в 2017 году американские ученые обнаружили у более чем трети обследованных пациентов клиник Хьюстона редкий штамм этой супербактерии, который оказался устойчивым к действию большинства используемых в Соединенных Штатах антибиотиков.
В том же году в прессе появилась информация о гибели в США 70-летней пациентки после заражения супербактерией Klebsiella pneumoniae: врачи не смогли спасти женщину, потому что бактерия оказалась устойчива ко всем 26 антибиотикам, которые могли использоваться для лечения. В итоге больная скончалась от сепсиса (заражения крови). А в 2012 году газета The Washington Post сообщала о том, что в госпитале Национальных институтов здравоохранения в результате вспышки инфекции, вызванной стойким к антибиотикам штаммом Klebsiella pneumoniae, умерли шесть пациентов.
Что за бактерия клебсиелла пневмонии и чем она опасна?
Речь идет об анаэробной палочковидной бактерии из рода клебсиелл, которая повсеместно встречается в окружающей среде, в том числе в почве и поверхностных водах. Клебсиеллу открыл в 1882 году микробиолог из Германии Карл Фридлендер, поэтому ее второе название — палочка Фридлендера. Эта условно-патогенная бактерия живет в организме человека, совершенно никак себя не проявляя, пока сохраняется здоровый баланс и поддерживается оптимальная микрофлора. Опасной она становится лишь тогда, когда «хорошие» бактерии ослабевают или их количество резко уменьшается.
Палочка Фридлендера может вызывать различные патологии, включая сепсис, инфекции мочевыводящих путей, бактериемию, менингит и абсцессы в печени. Довольно часто клебсиелла является причиной острой пневмонии. Инфицированию чаще всего подвержены люди с иммунодефицитами, тяжелыми сопутствующими заболеваниями и ослабленной иммунной системой.
Особенно опасной для человека является Klebsiella pneumoniae (клебсиелла пневмонии). Она является преобладающим возбудителем внутрибольничной инфекции в ряде стационаров. Источником инфекции, как правило, служит больной человек или бактерионоситель. Наиболее частые пути передачи — пищевой, воздушно-капельный и контактно-бытовой.
Где можно заразиться клебсиеллой пневмонии и смогут ли от нее вылечить?
«Klebsiella pneumoniae в настоящее время все чаще и чаще является возбудителем инфекции внутри стационара. Она в числе так называемых внутрибольничных инфекций. Бактерия приобретает сегодня множественную резистентность к большинству современных антибиотиков. Но правда состоит в том, что большинство механизмов резистентности уже осознаны, и в настоящее время создаются новые антибактериальные препараты, которые преодолевают эту резистентность. Да, конечно, клебсиелла представляет угрозу, если вовремя не понять, что инфекция вызвана ей. В таком случае все может закончиться плохо. Но если мы точно знаем, что причиной заболевания является эта бактерия, и знаем ее механизмы резистентности, то у медиков есть определенные возможности, чтобы с ней побороться. Все не совсем так безнадежно», — говорит врач, клинический фармаколог, заведующий кафедрой общей и клинической фармакологии РУДН Сергей Зырянов.
Почему клебсиелла становится все более устойчивой к антибиотикам?
Бактерии все чаще приспосабливаются к антибиотикам и передают ген устойчивости другим бактериям, таким образом появляются супербактерии. Это возбудители инфекционных болезней, которые устойчивы сразу к нескольким антибиотикам, традиционно использующимся для лечения данных заболеваний. Способность супербактерий противостоять антибиотикам вызывает озабоченность в мировом сообществе, проблему даже обсуждают на уровне Генеральной Ассамблеи ООН.
«Так, к сожалению, происходит, что все микробы, которые обитают в стационарах, становятся более устойчивыми и резистентными, поскольку в медицинских организациях при лечении часто назначают антибиотики. Микробы от этого становятся более устойчивыми к различным воздействиям, и врачам приходится применять больше сил, больше затрат, связанных с лечением такой инфекции», — говорит Зырянов.
В отличие от других бактерий Klebsiella обладает способностью образовывать капсулу, что делает ее устойчивой во внешней среде. Такая капсула предохраняет возбудителя от высыхания, поэтому клебсиеллы могут долгое время сохраняться при комнатной температуре. Большинство штаммов Klebsiella pneumoniaе невосприимчивы к пенициллинам, цефалоспоринам III-IV поколений, аминогликозидам, фторхинолонам.
Как ранее отмечали американские врачи, особая проблема заключается в том, что некоторые штаммы клебсиеллы также стали более устойчивы к антибиотикам группы карбапенемов. Эти лекарства ранее считались наиболее эффективными при лечении инфекций, вызванных Klebsiella pneumoniae, но в последние годы стали терять эффективность.
Какие существуют способы лечения Klebsiella pneumoniae?
По словам Зырянова, нельзя говорить о том, что на клебсиеллу не действует ни один из антибиотиков. Существуют новые антибактериальные препараты, которые созданы специально для того, чтобы преодолеть резистентность клебсиеллы. Чтобы получить эффект от лечения, также применяют комбинацию уже известных препаратов.
Терапевтический эффект может иметь лечение большей дозой антибиотиков, но все зависит от конкретного штамма бактерии, конкретного антибиотика и состояния пациента. «Увеличение дозы, в зависимости от конкретного антибиотика, может оказать воздействие на бактерию. Также это зависит от того, о каком штамме клебсиеллы идет речь. Есть определенные показатели резистентности, если они позволяют это делать, то тогда таким способом пользуются. В ряде случаев увеличение дозы действительно помогает», — говорит Зырянов.
Кроме того, врач отмечает, что вне больницы заразиться этой супербактерией практически невозможно. «Клебсиелла пневмонии, которая обладает экстремальной лекарственной резистентностью, во внебольничных условиях практически не существует. Это госпитальный возбудитель», — говорит он.
Антибиотики для лечения диареи, вызванной бактерией Clostridium difficile, у взрослых
Актуальность
Clostridium difficile (C. difficile) — это бактерия, живущая в толстой кишке и не приносящая организму никакого вреда. Однако, когда человек по какой-либо причине начинает принимать антибиотики, количество бактерий C. difficile может увеличиться и почти полностью заменить естественную бактериальную среду толстой кишки. Этот избыточный рост становится причиной диареи, вызванной бактерией C. difficile (также известной как C. difficile инфекция — CDI). Симптомы инфекции включают диарею, лихорадку и боли в животе. Инфекция может быть лёгкой, но во многих случаях является очень серьезной и, при отсутствии лечения, может привести к летальному исходу. Существует множество предлагаемых видов лечения CDI, но самым распространенным является прекращение принятия антибиотика, вызвавшего инфекцию, и выписывание другого антибиотика, который убивает эту бактерию. Многие антибиотики были тестированы на эффективность в клинических испытаниях, и этот обзор посвящен сравнению этих антибиотиков. Этот обзор является обновленной версией предыдущего опубликованного Кокрейновского обзора.
Методы
Мы провели поиск литературы по 26 января 2017 года. Все рандомизированные клинические испытания, сравнивающие два разных антибиотика или вариации дозировки одного антибиотика для лечения CDI (псевдомембранозного колита), были включены в обзор. Мы провели поиск испытаний, сравнивающих антибиотики с плацебо (например, с сахарной пилюлей), или испытаний без лечения, но, за исключением одного некачественного контролируемого испытания с плацебо, ничего найдено не было. Испытания, сравнивающие действие антибиотиков с другими видами лечения, включены не были.
Результаты
Двадцать два исследования (в целом 3215 участников) были включены в обзор. В большинстве исследований принимали участие люди со слабой и умеренной формой CDI инфекции, имевшие возможность принимать пероральные антибиотики. Шестнадцать из включённых исследований исключили участников с тяжелой формой инфекции, и мало участников с тяжелой формой инфекции были включены в другие исследования. Была произведена оценка двенадцати разных антибиотиков. В большинстве исследований сравнивали ванкомицин или метронидазол с другими антибиотиками. В одном небольшом исследовании ванкомицин сравнивали с плацебо (например, с сахарной пилюлей). Других исследований, сравнивающих лечение антибиотиками с плацебо или с группой без лечения, не было. Качество семнадцати из 22 исследований находилось под вопросом. В четырех исследованиях было установлено, что ванкомицин превосходит метронидазол в отношении достижения устойчивого симптоматического излечения (определённого как разрешение диареи без рецидива инфекции). Мы оценили качество доказательств, подтверждающих этот вывод, как среднее. Новый антибиотик, фидаксомицин, по результатам двух крупных исследований, превзошел ванкомицин. Мы оценили качество доказательств, подтверждающих этот вывод, как среднее. Стоит отметить, что разница в эффективности между этими антибиотиками была не слишком велика, и что метронидазол является менее дорогим лекарством, чем и ванкомицин, и фидаксомицин. Объединенный анализ двух небольших исследований показал, что тейкопланин может превосходить ванкомицин в достижении симптоматического излечения. Качество доказательств, подтверждающих этот вывод, очень низкое. Качество доказательств, касающихся других семи антибиотиков в этом обзоре, очень низкое, т.к. исследования были небольшими, и многие пациенты покинули их еще до завершения. Сообщалось о ста четырёх смертельных случаях во время исследований, все они были приписаны ранее существовавшим у пациентов проблемам со здоровьем. Единственными побочными эффектами, отнесёнными к антибиотикам, были редкая тошнота и временное повышение активности ферментов печени. Последние данные о затратах (июль 2016 года) показывают, что затраты — стоимость 10-дневного курса лечения метронидазолом по 500 мг, как наименее дорогостоящим антибиотиком, составит 13 долларов США. Затраты на ванкомицин 125 мг составят 1779 долларов США, в сравнении с затратами на фидаксомицин 200 мг — 3453,83 доллара США или больше, а на тейкопланин примерно 83,67 долларов США.
Выводы
Невозможно сделать однозначный вывод относительно лечения тяжелой формы инфекции антибиотиками, т.к. большинство исследований исключило пациентов с тяжелой формой. По причине отсутствия исследований с контрольными группами «без лечения» невозможно сделать вывод относительно необходимости использования антибиотиков пациентами с умеренной формой инфекции после прекращения приема антибиотика, вызвавшего инфекцию. Тем не менее, доказательства среднего качества свидетельствуют о том, что ванкомицин превосходит метронидазол, а фидаксомицин превосходит ванкомицин. Разница в эффективности этих антибиотиков оказалась небольшой, а преимущество метронидазола заключается в том, что его цена намного ниже цены других антибиотиков. Качество доказательств при исследовании тейкопланина было очень низким. Необходимы более масштабные исследования, чтобы определить, действует ли тейкопланин так же хорошо, как и другие антибиотики. Было бы интересно провести клиническое испытание, сравнивающее два самых дешевых антибиотика — метронидазол и тейкопланин.
Escherichia coli в сравнении с Klebsiella pneumoniae
Меры предосторожности при изоляции, необходимые для отделений интенсивной терапии новорожденных, являются частью пакета, направленного на предотвращение передачи, колонизации и инфицирования грамотрицательными патогенами с множественной лекарственной устойчивостью, поскольку новорожденные сталкиваются с повышенным риском смертности и заболеваемости в случае заражения. В следующем кратком отчете описывается передача 3MDRGN Klebsiella pneumoniae в отделении интенсивной терапии новорожденных университетской больницы в Германии.Эта передача произошла даже при наличии усиленных мер инфекционного контроля, что убедительно свидетельствует о важности эпиднадзора, управления вспышками и осведомленности о факторах, способствующих возникновению вспышек.
1. Введение
Обнаружение грамотрицательных патогенов с множественной лекарственной устойчивостью (MDRGN) у недоношенных и зрелых новорожденных, нуждающихся в интенсивной медицинской помощи, приводит к серьезным последствиям. В случае заражения для лечения необходимы антибиотики широкого спектра действия.Инфекции, вызванные MDRGN, связаны с худшими исходами по сравнению с инфекциями, вызванными чувствительными изолятами. Меры предосторожности при изоляции, необходимые для отделений интенсивной терапии новорожденных (NICU), являются частью пакета, направленного на предотвращение передачи, колонизации и инфицирования MDRGN [1, 2]. Из-за сильного воздействия инфекций на популяцию неонатальных пациентов рекомендации по вмешательствам, направленным на снижение риска передачи, более обширны, чем для общей популяции пациентов в некоторых национальных рекомендациях [2–4].Согласно международным стандартам, для продуцирующих карбапенемазу Enterobacteriaceae настоятельно рекомендуется изолировать в одной комнате. Немецкие стандарты идут еще дальше и дополнительно рекомендуют изоляцию пациентов с бета-лактамазами расширенного спектра (ESBL-), продуцирующими Enterobacteriaceae , в отделениях интенсивной терапии новорожденных. Рекомендации Европейского общества клинической микробиологии и инфекционных заболеваний (ESCMID) для общей популяции пациентов стратифицированы по видам.Они рекомендуют размещение в одноместном номере только по номеру Klebsiella ssp. несущие гены ESBL, но не для Escherichia coli , содержащего эти гены. Это различие основано на предполагаемом различном потенциале передачи на уровне видов. Однако доказательства ограничены и косвенны.
В Германии даны следующие рекомендации для неонатальных отделений интенсивной терапии (таблица 1).
| |||||||||||||||||||||||||||||||||||
⁺Только при лечении с повышенным риском (например,г., процедуры вентиляции). | |||||||||||||||||||||||||||||||||||
3MDRGN определяется как грамотрицательный патоген, устойчивый к трем из следующих четырех различных классов бактерицидных антибиотиков in vitro: пенициллинам широкого спектра действия, цефалоспоринам третьего или четвертого поколения, карбапенемам (у новорожденных меропенем) и фторхинолонам. 4MDRGN — патоген с устойчивостью in vitro ко всем вышеперечисленным антибиотикам. Поскольку фторхинолоны эмпирически не используются у новорожденных, определение 2MDRGN, грамотрицательного патогена, устойчивого к цефалоспоринам и пенициллинам широкого спектра действия, особенно важно для неонатальных отделений интенсивной терапии.
В этом контексте текущие рекомендации Немецкой комиссии по больничной гигиене и профилактике инфекций (KRINKO) Института Роберта Коха (RKI) в Берлине сосредоточены на еженедельном скрининге на MDRGN [2, 3]. Глобальная распространенность колонизации MDRGN значительно различается. Принимая во внимание высокий приток вновь прибывших беженцев в 2015/16 г., в основном из регионов с высокой распространенностью [5, 6], в Медицинском университете Геттингена (UMG) была разработана усовершенствованная стратегия инфекционного контроля.В дополнение к выполненным рекомендациям RKI, недавно прибывшие педиатрические беженцы были изолированы в одноместных палатах сразу при поступлении и непосредственно проверены на MDRGN. Детям, находящимся в стационаре, ранее находившимся за границей, в комбинированном отделении интенсивной терапии при поступлении был проведен скрининг на MRSA, 2MDRGN, 3MDRGN, 4MDRGN и устойчивые к ванкомицину энтерококки (VRE) с целью снижения или даже предотвращения передачи [7].
2. Материалы и методы
2.1. Эпидемиологическое расследование
Комбинированное неонатально-педиатрическое отделение интенсивной терапии на 20 коек имеет ресурсы для ухода за десятью крайне недоношенными новорожденными и десятью педиатрическими пациентами с сердечными заболеваниями.
Восьмимесячная беженка, недавно прибывшая из Ирана через Турцию и Грецию, была госпитализирована в нашу комбинированную неонатально-педиатрическую реанимацию в ноябре 2015 года. Младенец страдал от тяжелой сердечной аномалии, но ранее обращался в систему здравоохранения. было отказано несколько раз. Пациент был изолирован и обследован на наличие резистентных бактерий при поступлении в соответствии с внутренними рекомендациями UMG. 3MDRGN Klebsiella pneumoniae и 3MDRGN Escherichia coli были обнаружены исключительно в мазке из прямой кишки без клинических симптомов.Поэтому младенец оставался в одиночной комнате (с 19 ноября 2015 г. по 09 января 2016 г.). Находясь в тяжелом общем состоянии, колонизация переросла в инфекцию, и младенцу потребовалось специальное лечение антибиотиками.
Через четыре недели без каких-либо результатов мы обнаружили колонизацию K. pneumoniae у другого ребенка с идентичным профилем чувствительности к антибиотикам в рамках еженедельного неонатального скрининга, но не E. coli . Младенец жил в соседней палате еще с тремя пациентами (рис. 1).
Следовательно, был реализован ряд дополнительных мер инфекционного контроля в соответствии со стандартными операционными процедурами, а именно: уборка дважды в день не только пораженных помещений, но и всего помещения. Экологический скрининг включал мазки из медицинского оборудования и устройств (ультразвук, рентген, электрокардиография и ламинарный поток воздуха), мазки из окружающей среды в каждой палате пациента (например, дозаторы дезинфицирующих средств, дозаторы мыла, фильтры и аксессуары для медсестер, включая медицинские препараты, такие как мази) и окружение в родительских комнатах, кухне и лаборатории.Были определены всесторонние меры предосторожности при контакте для всех пациентов в отделении, последующая изоляция и группировка четырех колонизированных пациентов, а также все прямые контакты. Были закрыты помещения общего пользования, в том числе комнаты для престарелых и родителей, проведены подробные беседы с родителями и родственниками. Кроме того, в отделении ежедневно проводились междисциплинарные обходы, которые подробно документировались. Были задействованы и члены правления. Все процедуры были сохранены до конца января 2016 года.
2.2. Микробиологические методы
Мазки для скрининга окружающей среды культивировали в Caso-Bouillon (37 ° C / 24 часа) и пересевали на чашки с питательным агаром с последующей дифференциацией и идентификацией по морфологическим и биохимическим характеристикам.
Образцы пациентов для еженедельного скрининга на MDRGN были исследованы на предмет минимальной ингибирующей концентрации (МИК) как часть определения устойчивости с помощью Vitek-MIC.
Были выделены два из пяти изолятов 3MDRGN Klebsiella pneumoniae : пациенты 2 и 3 (паховый мазок 2015-12-15 и ректальный мазок 2015-12-17, рис. 1).Полногеномное секвенирование (WGS) обнаруженных штаммов Klebsiella pneumoniae было выполнено на платформе Illumina MiSeq после выделения ДНК и подготовки библиотеки, как описано ранее. Качественная обрезка, сборка de novo и дальнейшие анализы, включая мультилокусное типирование последовательностей ядра генома, были выполнены с использованием программного обеспечения SeqSphere + (Ridom, Münster, Germany) [8].
3. Результаты и обсуждение
Несмотря на превентивную изоляцию и меры инфекционного контроля, а также в соответствии с передовыми стратегиями инфекционного контроля, передача 3MDRGN Klebsiella pneumoniae произошла через четыре недели.
Все пробы окружающей среды оказались отрицательными на факультативные патогены, за исключением мазков, взятых из ближайшего окружения в комнате для пациентов. На таких устройствах, как стетоскоп, рулетка, несколько кнопок или гель с ксилокаином, можно было обнаружить только Staphylococcus epidermidis и аэробные споры. Многие образцы даже оказались стерильными. Результаты микробиологического исследования медицинских устройств и оборудования в других помещениях (пациенты, родители, кухня и лаборатория) также оказались стерильными или колонизированными патогенами, не имеющими отношения к инфекционному контролю.Частое исследование неодушевленных поверхностей обнаружило Enterococcus faecalis на одном термометре. 3MDRGN Klebsiella pneumoniae или 3MDRGN Escherichia coli не были обнаружены ни в спальне, в которой были колонизированы четыре пациента, ни в соседних комнатах. Точечный источник не может быть идентифицирован путем исследования образцов. Ни у одного из пациентов не развилась инфекция 3MDRGN Klebsiella pneumoniae , за исключением первого пациента.
Микробиологические результаты еженедельного скрининга на MDRGN (ректальные мазки) показали сходство изолятов 3MDRGN Klebsiella pneumoniae (таблица 2).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
R = устойчивый; S = разумный; п.d. = Не сделано. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Все пять образцов пациентов оказались положительными на ESBL (Vitec-MIC). Развитие устойчивости к гентамицину часто возникает быстро из-за того, что ампициллин / гентамицин является антибиотиком первой линии в педиатрической терапии.
Все доступные изоляты 3MDRGN Klebsiella pneumoniae (изоляты 2 и 3, соответствующие пациентам 2 и 3, рис. 1) были типизированы NGS, и они оказались идентичными (рис. 2). Основная цель заключалась в определении клонального родства изолятов для целей инфекционного контроля.В этом контексте, следовательно, проверяли только наличие генов бета-лактамаз расширенного спектра. Удалось выделить ген, кодирующий бета-лактамазу расширенного спектра CTX-M15.
Ретроспективный анализ выявил чрезвычайную ситуацию, которая произошла в отделении интенсивной терапии и затронула две палаты пациентов всего за несколько дней до обнаружения колонизации 3MDRGN — в обеих палатах был задействован один и тот же медперсонал. Наша гипотеза была единственной передачей в этой ситуации.
Дальнейшими последствиями борьбы со вспышкой были закрытие коек и отсрочка плановой госпитализации в комбинированное неонатально-педиатрическое отделение интенсивной терапии, а также в соседнее стандартное неонатальное отделение.
Расширенные стратегии инфекционного контроля сохранялись до конца января 2016 г. В общей сложности было потеряно 199 койко-дней в неонатально-педиатрическом отделении интенсивной терапии и 122 койко-дня в стандартном неонатальном отделении.
4. Выводы
Несмотря на внедрение усиленных комплексных мер инфекционного контроля, помимо официальных требований, передачи MDRGN невозможно полностью избежать в клинических условиях.В этом случае примечательно, что произошла передача 3MDRGN K. pneumoniae , но не 3MDRGN E. coli . Это согласуется с недавними данными о том, что K. pneumoniae более трансмиссивно, чем E. coli [9–11].
Становится очевидным, что профилактические меры гигиены постоянно влияют на повседневный уход в отделении интенсивной терапии. Эти вмешательства включают строгие режимы изоляции для пациентов с колонизацией или инфекцией, а также пациентов, контактировавших с индексными пациентами.Тем не менее, важно помнить об основных мерах инфекционного контроля и соблюдать гигиену рук, меры предосторожности при контакте, а также позаботиться об обучении и обучении персонала [12].
Педиатрические пациенты-беженцы имеют значительно более высокую распространенность колонизации MRSA, а также устойчивыми к цефотаксиму и / или цефтазидиму E. coli и K. pneumoniae , чем педиатрические пациенты, не являющиеся беженцами, как видно в описанном случае и в данных. проанализированы в нашей университетской больнице [7].Считается, что скрининг бактерий с множественной лекарственной устойчивостью имеет важное значение для целей инфекционного контроля и может дать дополнительную пользу для эмпирического лечения инфекций антибиотиками в этой популяции. Поэтому скрининг педиатрических пациентов-беженцев в нашем учреждении будет продолжен [5, 7, 13, 14].
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов в отношении публикации этой статьи.
(PDF) Факторы риска и исходы неонатального сепсиса Klebsiella pneumoniae
Curr Pediatr Res 2012 Том 16 Выпуск 2 115
Curr Pediatr Res 2012; 16 (2): 115-118
ISSN 0971-9032
Scientific Publishers of India
Факторы риска и исход сепсиса Klebsiella pneumoniae среди
новорожденных.
Закария Б.П., Вишну Бхат Б., Хариш Б.Н.
*
, Арун Бабу Т., Джозеф Н.М.
*
Кафедры педиатрии и микробиологии
*
, Джавахарлалский институт последипломного медицинского образования
(JIPMER), Пудучерри, Индия.
Abstract
Настоящее исследование было проведено с целью определения факторов риска, характера чувствительности к антибиотикам
и исходов сепсиса новорожденных, вызванных Klebsiella pneumoniae.Всем поступившим новорожденным с клиническим подозрением на сепсис
были выполнены посевы крови. Младенцы с положительным посевом крови были включены в исследование
. Были отмечены подробные истории дородового, родового и неонатального лечения, включая исход
. Из 120 клинически подозреваемых случаев неонатального сепсиса у 50 (41,6%) был положительный результат посева крови
, из которых 33 (27,5%) были связаны с Klebsiella pneumoniae. Новорожденные при рождении
с массой тела ≤ 2,5 кг, недоношенные новорожденные, врожденные дети и новорожденные с ранним началом сепсиса имели более высокий риск заражения Klebsiella pneumoniae на основе одномерного анализа.
Регрессионный анализ выявил новорожденных с массой тела при рождении ≤ 2,5 кг и врожденных детей с повышенным риском развития инфекции клебсиелл на
. Все изоляты Klebsiella pneumoniae были чувствительны к меропенаму.
Ключевые слова: Klebsiella pneumoniae, неонатальный сепсис, факторы риска, результат
Принято 25 января 2012 г.
Введение
Сепсис является частой причиной госпитализации в неонатальные отделения
и является основной причиной заболеваемости и смертности среди
новорожденных. во всем мире [1].Национальная база данных неонатального перинатального наблюдения
Индии показывает частоту 8,5 культуральных
подтвержденных случаев сепсиса на 1000 живорождений [2]. Неонатальный сепсис
обычно подразделяется на раннее или позднее начало. Ear-
Новорожденный сепсис с поздним началом возникает в течение первых 72 часов после
жизни, а поздний неонатальный сепсис — через 72 часа после
жизни. В целом, грамотрицательные бактерии являются преобладающими причинами неонатального сепсиса, и среди них наиболее распространенным патогеном является Klebsiella
pneumoniae, особенно в
развивающихся странах [1, 3-5].Следовательно, существует потребность в
для изучения факторов риска неонатального сепсиса, вызванного lo-
широко распространенными штаммами Klebsiella pneumoniae и их исходящими
штаммами. Мы выполнили это исследование, чтобы определить
различных факторов риска, связанных с неонатальным сепсисом, вызванным
Klebsiella pneumoniae, его чувствительность и исход.
Материалы и методы
Проспективное обсервационное исследование было проведено в нашей клинической больнице третичного уровня
.Это исследование было одобрено
комитетом по исследованиям и этике института, и
сформированное согласие было получено от каждого пациента из
родственников. В течение двух лет были обследованы все
новорожденных и новорожденных с клиническим подозрением на сепсис.
У всех новорожденных был выполнен посев крови.
младенцев, у которых посев крови был отрицательным, были исключены из исследования. Новорожденные с положительным результатом посева крови
на Klebsiella pneumoniae считались
случаями, а новорожденные с положительным результатом на другие патогены считались контрольными.Чувствительность к антибиотикам всех выделенных
Klebsiella pneumoniae определялась методом дисковой диффузии
Кирби-Бауэра в соответствии с рекомендациями Института лабораторных стандартов Clinical
[6]. Все изоляты
Klebsiella pneumoniae были также протестированы на ex-
β-лактамазы (БЛРС) с помощью комбинированного дискового метода
с использованием цефотаксима и цефтазидима, отдельно
и в комбинации с клавулановой кислотой [6].Тест с двойным диском
с использованием цефотаксима и цефтазидима, отдельно и в комбинации
с клавулановой кислотой, был проведен для выявления
β-лактамазы расширенного спектра (ESBL) в
Klebsiella pneumoniae, в соответствии с рекомендациями CLSI. В
этого теста суспензию ночной культуры тестируемого изолята
, скорректированную до 0,5 стандарта МакФарланда, инокулировали с использованием
стерильного ватного тампона на поверхности агара Мюллера-Хинтона
.Диски цефотаксима (30 мкг) и цефотаксим-клавулановая кислота
(30 мкг / 10 мкг) помещали на агаре
на расстоянии 20 мм друг от друга. Точно так же диски цефтазидима (30 мкг) и цефтазидима-
клавулановой кислоты (30 мкг / 10 мкг) размещали на расстоянии 20 мм друг от друга на расстоянии
. После инкубации в течение ночи при 37
o
C, применение тигециклина ≥ 5 мм в-
3-месячному младенцу с пневмонией Klebsiella с множественной лекарственной устойчивостью: отчет о клиническом случае | Патогены кишечника
После выявления подозрительных половых органов и преждевременного разрыва околоплодных вод в возрасте 38 недель с помощью кесарева сечения родился младенец мужского пола с массой тела 2900 г.Он был меньшим из множества однояйцевых близнецов.
Пациент находился на грудном вскармливании вскоре после рождения, и через 12 часов у него началась периодическая рвота. В возрасте 6 дней у него возникло клиническое подозрение на атрезию тонкой кишки и болезнь Гиршпрунга, и ему сделали энтерэктомию и илеостомию. Его однояйцевому брату-близнецу был поставлен диагноз того же заболевания, и ему была сделана аналогичная операция. После операции пациентка голодала около 1 недели. После этого он начал постепенно кормить грудью, с 5–15 мл до 25 мл каждый раз, каждые 2–3 часа, продолжая при этом часть программы внутривенного питания (около 200–300 мл в день с использованием центрального венозного катетера).У него была периодическая рвота желто-зеленой жидкостью, и из стомы непрерывно выделялись тонкие пастообразные желто-зеленые объекты в количестве от 70 до 240 мл в день. Он также страдал сепсисом, и ему назначили ванкомицин, меропенем и каспофунгин для противоинфекционной терапии. Несмотря на это лечение, у пациента время от времени продолжалась рвота, и его вес не мог увеличиваться, как ожидалось, в течение следующих 3 месяцев, поэтому его перевели в нашу больницу для дальнейшего лечения.
При поступлении его масса тела составляла 3000 г, а рост — 50 см (оценка массы тела по Z-1).Медицинский осмотр выявил серьезное недоедание и отсутствие большей части подкожно-жировой клетчатки. Вздутие живота было очевидным, и над пупком можно было увидеть разделенные с двух сторон стомы. Температура его тела составляла 37,5 ° C, пульс — 146 уд / мин, частота дыхания — 38 вдохов / мин, артериальное давление — 75/40 мм рт. Количество лейкоцитов (WBC) составляло 11,83 × 10 9 / л, а уровень С-реактивного белка (CRP) составлял 88 мг / л. Инфекцию можно контролировать с помощью внутривенного питания и применения ванкомицина и меропенема для борьбы с инфекцией.
После того, как ребенок начал кормиться, у него возник рецидив инфекции. Количество лейкоцитов и уровень СРБ увеличились до 28,9 × 10 9 / л и 156 мг / л соответственно. После введения ванкомицина и меропенема (20 мг / кг, каждые 8 часов) температура, лейкоциты и СРБ вернулись в допустимые пределы. Младенцу была проведена колоноскопия, которая показала гладкую слизистую кишечника и прозрачные сосуды стенки кишечника (рис. 1). Визуализация дистальной стомы также была проведена у младенца, который выявил жесткий просвет от поперечной ободочной кишки до нисходящей ободочной кишки (рис.2).
Рис. 1
Изображение колоноскопии (поперечная ободочная кишка). Черная стрелка показывает гладкую стенку кишечника и прозрачные сосуды
Рис. 2
a Визуализация дистальной части стомы. Максимальная ширина поперечной ободочной кишки составляла примерно 0,8 см (белая стрелка). b Рентгенограмма брюшной полости в вертикальном положении. Изображение было получено через 24 часа после предыдущего снимка. Контрастное вещество застряло в толстой кишке (синяя стрелка)
Инфекция произошла в 4-й раз после истечения срока действия центрального венозного катетера (ЦВК).У больного поднялась температура с ознобом. Весьма вероятно, что пациент заразился инфекцией кровотока, связанной с катетером, и соответствующие культуры кончика катетера выявили множественную лекарственную устойчивость Klebsiella pneumoniae , которая была чувствительна к тигециклину, полимиксину E и котримоксазолу. Минимальная ингибирующая концентрация (МИК) для тигециклина составляла ≤ 0,25. Лабораторный тест показал количество лейкоцитов 2,73 × 10 9 / л, CRP 73 мг / л, количество тромбоцитов 31 × 10 9 / л и прокальцитонин (ПКТ) 4.03 нг / мл. По результатам мы перешли на новые пропитанные антисептиком центральные венозные катетеры с гибитаном и сульфадиазином. Одновременно вводили тигециклин (3 мг / кг в качестве нагрузочной дозы и 1,5 мг / кг, каждые 12 часов в качестве поддерживающей дозы, 26 дней), котримоксазол (20 мг / кг, каждые 12 часов, 35 дней) и полимиксин E (20000 МЕ / кг каждые 8 ч, 5 дней). Для предотвращения заражения кокками в течение короткого периода применялись линезолид и рифампицин (10 мг / кг, каждые 12 ч). Периодически измеряли функцию печени, почечную функцию и профиль коагуляции (см. Дополнительный файл 1).На функцию печени, вероятно, повлияло длительное внутривенное питание и ванкомицин (дополнительный файл 1: таблица S1). Функция почек была нормальной (дополнительный файл 1: таблица S2). Функция коагуляции показала пролонгированное активированное частичное тромбопластиновое время (ЧАТВ) без определенного значения, что могло быть результатом поддержки продукта крови и тяжелой инфекции (дополнительный файл 1: таблица S3). Результат не указывал на диссеминированное внутрисосудистое свертывание, поэтому пациенту сделали энтеротомию, чтобы контролировать инфекцию.
Во время интенсивного противоинфекционного лечения был взят посев крови. Тест был положительным на микроб Candida parapsilosis . Мы решили отменить каспофунгин и добавить липосомы амфотерицина B (3 мг / кг, 21 день) — предыдущими противогрибковыми препаратами были флуконазол и каспофунгин. Для противодействия септическому шоку и повреждению печени вводили препараты крови и препараты для защиты печени. Однояйцевый брат-близнец пациента также был инфицирован сепсисом с множественной лекарственной устойчивостью Klebsiella pneumoniae и скончался из-за септического шока до получения результатов посева крови, брату не давали тигециклин.
Учитывая рецидивирующие инфекции, пациенту выполнен кишечный анастомоз и илеостомия. При хирургическом вмешательстве выявлен стеноз тонкой кишки 10 см в проксимальной части стомы. Детский хирург удалил повторно инфицированный сегмент и оставил около 100 см остаточной части тонкой кишки. Патологическая ткань помогла нам диагностировать кишечную нейрональную дисплазию (IND).
Мы предложили тщательную послеоперационную поддержку, и общий анализ крови стал нормальным (количество лейкоцитов 6,86 × 10 9 / л, нейтрофилов% 57.9%, лимфоциты% 30,8%, гемоглобин 119 г / л, тромбоциты 126 × 10 9 / л, CRP 4 мг / л). Патологические находки проявлялись дисплазией нейронов кишечника. Постепенно пациентка выздоровела и через 10 дней после операции перешла на пероральное питание. Температура, СРБ и лейкоциты пациента показаны на рис. 3. Несмотря на вздутие живота и временами диарею, масса тела пациента не уменьшалась. После сочетания сухого молока с дополнительной пищей и солями для пероральной регидратации дефекация и мочеиспускание были удовлетворительными, а электролиты сыворотки были нормальными.В период тщательного наблюдения у пациента не возникало значительных ранних или поздних побочных эффектов, таких как симптомы со стороны желудочно-кишечного тракта, острый панкреатит или изменение цвета зубов.
Рис. 3
Клиническая характеристика пациента. Черная стрелка показывает, что тигециклин применялся с 70 по 95 день
.
В настоящее время пациенту 34 месяца, вес 14 кг, рост 90 см. У него 20 полных временных зубов, ни один из которых не обесцвечен. В 18 месяцев он страдал от острой бактериальной диареи, но выздоровел через 1 неделю после того, как ему дали меропенем.Через 32 месяца после рождения он страдал от ротавирусной диареи и тяжелого обезвоживания, которые вылечили после внутривенной инфузионной терапии. Недавний визит показал, что периферический гемоглобин составляет 126 г / л. Пациент пьет Неокейт 500 мл / день и немного подкормки для ежедневного питания после выписки. Он испражняется 200–300 мл каждый день, принимая в качестве добавки соли для пероральной регидратации. Объем его мочи составляет около 1,5–2 мл / кг ч.
Факторы риска и исходы сепсиса Klebsiella pneumonia среди новорожденных в Северной Индии | Qazi
Stoll BJ.Инфекции новорожденного. В: Учебник педиатрии Нельсона, изд. Бермана, Клейгман Р.Э., Р.М. Дженсон, Х.Б. Филадельфия: W.B. Сондерс. 17-е изд. 2004: 623-39.
Эдвардс MS. Послеродовые инфекции В: Неонатально-перинатальная медицина Фанаофф и Мартинс. 8-е изд. Филадельфия: Мосби Эльзевьер; 2006: 791-804.
Vergnano S, Sharland M, Kazembe P, Wansambo CM, Heath PT. Неонатальный сепсис, международная перспектива. Arch Dis Child Fetal Neonatal Ed. 2005; 90: F220-F224.
Бакр АФ.Сепсис, связанный с внутривенными линиями, у новорожденных, поступивших в отделение интенсивной терапии в развивающейся стране. J Trop Pedia. 1 октября 2003 г .; 49 (5): 295-7.
Джоши С.Г., Гхол В.С., Нипхадкар КБ. Неонатальная грамотрицательная бактериемия. Индийский J Pediatr. 2000; 67 (1): 27-32.
Köksal N, Hacimustafaolu M, Bağci S. Меропенем при тяжелых инфекциях новорожденных, вызванных мультирезистентными грамотрицательными бактериями. Индийская J педиатрия. 2001, 1 января; 68 (1): 15-9.
Ройлидес Э., Кириакидес Г., Кадилцоглу I, Фармаки Э., Вензон Д., Кацавели А. и др.Септицемия, вызванная полирезистентной Klebsiella pneumoniae в неонатальном отделении: исследование случай-контроль. Am J Perinatol. 2000; 17 (01): 035-40.
Stoll BJ, Hansen N, Fanaroff AA, Wright LL, CarloWA, Ehrenkranz RA, et al. Поздний сепсис у новорожденных с очень низкой массой тела при рождении: опыт NICHD Neonatal Research Network. Педиатрия. 2002; 110: 285-91.
Заиди А.К., Тавер Д., Али С.А., Хан Т.А. Патогены, связанные с сепсисом у новорожденных и детей грудного возраста в развивающихся странах. Педиатр Infect Dis J.2009; 28 (Приложение 1): S10-8.
Верньяно С., Менсон Э., Кеннеа Н., Эмблтон Н., Рассел А.Б., Уоттс Т. и др. Неонатальные инфекции в Англии: Неон в сети эпиднадзора. Arch Dis Child Fetal Neonatal Ed. 2011; 96: F9-14.
Zea-Vera A, Очоа, TJ. Проблемы диагностики и лечения неонатального сепсиса. J Trop Pediatr. 2015; 61: 1-13.
Шон А.С., Баджва Р.П., Руссо Т.А. Гипервирулентная (гипермуковязкозная) Klebsiella pneumoniae: новая и опасная порода. Вирулентность. 2013; 4: 107-18.
Podschun R, Ullmann U. Klebsiella spp. как внутрибольничные возбудители: эпидемиология, систематика, методы типирования, факторы патогенности. Clin Microbiol Rev.1998; 4: 589-603.
Haller S, Eller C, Hermes J, Kaase M, Steglich M, Radonic A и др. Что вызвало вспышку Klebsiella pneumoniae, продуцирующую ESBL, в отделении интенсивной терапии новорожденных, Германия, с 2009 по 2012 год? Восстановление передачи с помощью эпидемиологического анализа и полногеномного секвенирования. BMJ. 2015; 5: e007397.
Хаертынов Х.С., Анохин В.А., Николаева И.В., Семенова Д.Р., Любин С.А., Агапова И.В.Неонатальный сепсис, вызванный клебсиеллой. Мед Новости Северного Кавказа. 2016; 1с1: 82-6.
Гельбанд Х, Миллер-Петри М, Пант С., Гандра С., Левинсон Дж., Бартер Д. и др. Состояние антибиотиков в мире. Вашингтон, округ Колумбия: Центр динамики заболеваний, экономики и политики; 2015.
Лю Ю.С., Ченг Д.Л., Линь К.Л. Klebsiella pneumoniae абсцесс печени, ассоциированный с септическим эндофтальмитом. Arch Intern Med. 1986; 146: 1913-6.
Cheng DL, Liu YC, Yen MY, Liu CY, Wang RS. Септические метастатические поражения гнойного абсцесса печени.Их связь с бактериемией Klebsiella pneumoniae у больных сахарным диабетом. Arch Intern Med. 1991; 151: 1557-9.
Wang JH, Liu YC, Lee SS, Yen MY, Chen YS, Wang JH и др. Первичный абсцесс печени, вызванный Klebsiella pneumoniae на Тайване. Clin Infect Dis. 1998; 26: 1434-8.
Decré D, Verdet C, Emirian A, Le Gourrierec T, Petit JC, Offenstadt G, et al. Возникающие тяжелые и смертельные инфекции, вызванные Klebsiella pneumoniae, в двух университетских больницах Франции. J Clin Microbiol. 2011; 49: 3012-304.
Bialek-Davenet S, Criscuolo A, Ailloud F, Passet V, Jones L, Delannoy-Vieillard AS, et al. Геномное определение клональных групп Klebsiella pneumoniae с гипервирулентностью и множественной лекарственной устойчивостью. Emerg Infect Dis. 2014; 20: 1812-20.
Yu WL, Ko WC, Cheng KC, Lee HC, Ke DS, Lee CC и др. Связь между генами rmpA и magA и клиническими синдромами, вызванными Klebsiella pneumoniae на Тайване. Clin Inect Dis. 2006; 42: 1351-8.
Чжан Р., Линь Д., Чан Э. У., Гу Д., Чен Г. X., Чен С.Появление в Китае устойчивых к карбапенемам гипервирулентных штаммов Klebsiella pneumoniae серотипа K1. Противомикробные агенты Chemother. 2015; 60: 709-11.
Surgers L, Boyd A, Girard PM, Arlet G, Decré D. Штамм гипервирулентной Klebsiella pneumoniae K2, продуцирующий ESBL, Франция. Emerg Infect Dis. 2016; 22: 1687-8.
Paczosa MK, Mecsas J. Klebsiella pneumoniae: переход в нападение с сильной защитой. Microbiol Mol Biol Rev.2016; 80: 629-61.
Zhang Y, Zhao C, Wang Q, Wang X, Chen H, Li H и др.Высокая распространенность гипервирулентной инфекции Klebsiella pneumoniae в Китае: географическое распространение, клинические характеристики и устойчивость к противомикробным препаратам. Противомикробные агенты Chemother. 2016; 60: 6115-20.
Валиулла М.С., Ислам М.Н., Сиддика М., Хоссейн М.К., Хоссейн М.А. Факторы риска, клинические проявления и бактериологический профиль неонатального сепсиса в педиатрической больнице третичного уровня. Mymensingh Med J. 2009; 18: S66-S72.
Iregbu KC, Elegba OY, Babaniyi IB. Бактериологический профиль неонатальной септицемии в специализированной больнице в Нигерии.Afr Health Sci. 2006; 6: 151-4.
Shitaye D, Asrat D, Woldeamanuel Y, Worku B. Факторы риска и этиология неонатального сепсиса в университетской больнице Тикур Анбесса, Эфиопия. Эфиоп Мед Дж. 2010; 48: 11-21.
Банерджи М., Саху К., Бхаттачарья С., Адхья С., Бхоумик П., Чакраборти П. Вспышка неонатального сепсиса с Klebsiella pneumoniae с множественной лекарственной устойчивостью. Индийский J Pediatr. 1993; 60: 25-7.
Mai JY, Zhu ML, Chen C, HeXL, Lin ZL. Клиническая характеристика неонатального сепсиса Klebsiella pneumoniae и характер чувствительности штаммов к антибиотикам.Чжонкко Донг Дай Эр Ке За Чжин. 2016; 12 (9): 700-3.
Harish BN, Menezes GA, Shekatkar S, Parija SC. Klebsiella pneumoniae, продуцирующая бета-лактамазы расширенного спектра действия, из гемокультуры. J Med Microbiol. 2007; 56: 999-1000.
Чжоу Дж., Ли Дж., Ма Х, Ян К., Йи Дж. Вспышка колонизации производящей карбапенемазу Klebsiella pneumoniae в отделении интенсивной терапии новорожденных: исследования, меры контроля и оценка. Am J Инфекционный контроль. 2015; 43 (10): 1122-4.
Серефханоглу К, Туран Х, Тимуркайнак ИП, Арслан Х.Инфекции кровотока, вызванные продуцирующими ESBL E. coli и K. pneumoniae: факторы риска множественной лекарственной устойчивости. Braz J Infect Dis. 2009; 13: 403-7.
Taneja N, Rao P, Arora J, Dogra A. Возникновение бета-лактамаз ESBL и Amp-C и восприимчивость к новым антимикробным препаратам при осложненных ИМП. Индийский J Med Res. 2008; 127: 85-8.
Cassettari VC, Silveira IR, Balsama AC, Franco F. Вспышка Klebsiella pneumonia, продуцирующая бета-лактамазу расширенного спектра, в неонатальном отделении среднего риска, связанная с онихомикозом у медицинского работника.J Педиатрия. 2006; 82 (4): 316-26.
Департамент здравоохранения штата Вайоминг. Берк К. Раздел 12: Управление антибиотиками — Министерство здравоохранения Вайоминга, 2014 г. Доступно по адресу: https://health.wyo.gov/publichealth/infectious-disease-epidemiology-unit/healthcare-associated-infections/infection-prevention-orientation -manual / antibiotic-stewardship /. По состоянию на 1 июня 2017 г.
Спеллберг Б., Бартлетт Дж. Г., Гилберт Д. Н.. Будущее антибиотиков и резистентности. N Engl J Med. 2013; 368: 299-302.
Хак ИЮ, Чаудхри В.Н., Ахтар М.Н., Андлиба С., Кадри И.Бактериофаги и их значение для биотехнологии будущего: обзор. Вирол Дж. 2012; 9 (1): 9.
Клинический профиль септицемии клебсиелл у новорожденных
Khatua SP, Das AK, Chatterjee BD et al. Неонатальная септицемия. Indian J Pediatr 1986; 53: 509–514.
PubMed
CAS
Google Scholar
Guha DK, Jaspal D, Krishan Das MS et al. Исход неонатального сепсиса, клинико-бактериологический профиль. Indian Pediatr 1978; 15: 423–427.
PubMed
CAS
Google Scholar
Лэнг И.А., Хьюм Р., Тонкин Р.В. и др. Инфекция клебсиелл в отделении интенсивной терапии новорожденных. Scot Med J 1984; 29: 218–221.
PubMed
CAS
Google Scholar
Cichon NJ, Craig CP, Sargen J et al. Нозокомиальные клебсиеллезные инфекции в отделении интенсивной терапии. South Med J 1977; 70: 33–35.
PubMed
CAS
Google Scholar
Пьерог С., Ниграм С., Лала Р.В. и др. Септицемия новорожденных, вызванная klebsiella pneumoniae типа 60. Эпидемия необычно низкой вирулентности. NY State J Med 1977; 77: 737.
CAS
Google Scholar
Джон Дж. Ф. младший, Макки К. Т. младший, Твитти Дж. А. и др. Молекулярная эпидемиология последовательных детских эпидемий, вызванных полирезистентными клебсиеллами пневмонии. J Pediatr 1983; 102: 825–830.
PubMed
Статья
Google Scholar
Бхутта З.А., Накви С.Х., Музаффар Т. и др. Неонатальный сепсис в Пакистане. Acta Paediatr Scand 1991; 80: 596–601.
PubMed
CAS
Google Scholar
Gluck L, Wood HF, Fousek MD, Септицемия у новорожденного. Pediatr Clin North Am 1966; 13: 1131–1147.
PubMed
CAS
Google Scholar
Sharma PP, Halder D, Dutta AK et al. Бактериологический профиль неонатального сепсиса. Indian Pediatr 1987; 24: 1011–1017.
PubMed
CAS
Google Scholar
Монга К., Фернандес А., Деодхар Л. Изменение бактериологии при неонатальной сепсисе. Indian J Pediatr 1986; 53: 505–508.
PubMed
CAS
Google Scholar
Джарвис В. Р., Манн Ван П., Хайсмит А. К. и др. Эпидемиология внутрибольничных инфекций, вызываемых клебсиеллами пневмонии. Inf Control 1985; 6: 68–74.
CAS
Google Scholar
Xanthou M. Картина крови лейкоцитов у здоровых доношенных и недоношенных детей в неонатальном периоде. Arch Dis Child 1970; 45: 242–249.
PubMed
CAS
Google Scholar
Стокс Дж. Клиническая бактериология . 4-е изд. Лондон: Эдвин Арнольд 1975: 216–222.
Google Scholar
Джайкишан, Мир Н.А., Эльзуки А.Ю. Холестатическая желтуха новорожденных с клебсиеллезной септицемией. Indian Pediatr 1984; 21: 865–868
Google Scholar
Саксена С., Ананд Н.К., Миттал СК. Бактериальная инфекция среди новорожденных, родившихся в домашних условиях. Клиническая картина и бактериологический профиль. Indian Pediatr 1980; 17: 17–24.
PubMed
CAS
Google Scholar
Курувилла AC. Неонатальная септицемия. Indian J Pediatr 1988; 55: 225–233.
PubMed
Статья
CAS
Google Scholar
Весикери Т., Янас М., Гронросс П. и др. Неонатальная септицемия. Arch Dis Child 1985; 6: 542–546.
Артикул
Google Scholar
Buetow KC, Klein SW, Lane RB. Септицемия у недоношенных детей. Am J Dis Child 1965; 110: 29–41.
PubMed
CAS
Google Scholar
Свеннингсен Н.В., Бекассы А.Н., Кристенсен П. и др. Нозокомиальная инфекция, вызванная клебсиеллами пневмонии. Лечебно-гигиенические мероприятия в отделении интенсивной терапии новорожденных. Scand J Infect Dis 1984; 16: 29–35.
PubMed
CAS
Статья
Google Scholar
Морган МЭИ, Харт, Калифорния, Кук, RWI. Клебсиеллезные инфекции в отделении интенсивной терапии новорожденных. Роль бактериального надзора. J Hosp Inf 1984; 5: 377–385.
Артикул
CAS
Google Scholar
Шестой младенец умер во время вспышки клебсиелл
Новорожденный ребенок (Фото: Getty Images / Gallo).
Шестой ребенок умер во вторник после вспышки пневмонии, вызванной клебсиеллой, в региональной больнице Телле Могоеран в Вослоорусе, подтвердил департамент здравоохранения Гаутенга.
По данным отдела, с июля у 12 новорожденных был обнаружен положительный результат посева крови на антибиотикорезистентную клебсиеллу. Трое новорожденных были выписаны после лечения, а еще трое, которые в настоящее время проходят лечение, находятся в стабильном состоянии.
Вспышка унесла свою первую жизнь в больнице 1 июля, еще один смертельный случай был зарегистрирован 1 августа. 25 августа два младенца умерли, а еще один умер через три дня.
ЧИТАТЬ: Зонд проводится после того, как 5 младенцев умирают в результате вспышки клебсиелл в больнице Гаутенга.
Клебсиелла пневмония — это бактерия, обитающая в кишечнике человека.
Национальный институт инфекционных заболеваний (NICD) сообщил, что Klebsiella pneumoniae, как известно, вызывает различные типы инфекций, связанных с оказанием медицинской помощи, такие как пневмония, менингит, сепсис, инфекции ран или хирургических участков.
Люди с тяжелыми заболеваниями, хирургические пациенты, те, кто находится в больнице в течение длительного времени, пациенты, перенесшие трансплантацию органов или стволовых клеток, пациенты интенсивной терапии и люди, находящиеся на искусственной вентиляции легких, подвержены риску заражения устойчивыми к карбапенемам микроорганизмами, такими как «Клебсиелла», — пояснила она.
Меры, принятые для предотвращения перекрестного заражения
NICD подтвердил News24 во вторник, что провинциальный департамент здравоохранения попросил провести расследование три недели назад.
«Расследование в настоящее время координируется NICD и Управлением по профилактике и контролю инфекций (IPC) департамента здравоохранения провинции Гаутенг. Целью текущего расследования является проверка числа пострадавших и проведение аудита IPC «, — говорится в сообщении.
По данным провинциального отделения здравоохранения, в неонатальном отделении больницы в настоящее время находится в общей сложности 70 младенцев, 19 из которых — «новые госпитализированные во вновь очищенном районе».
«За 51 новорожденным с июля по август 2018 года ведется тщательное наблюдение», — говорится в сообщении.
«Все госпитализированные после начала сентября госпитализированы во вновь стерилизованные зоны со специальным персоналом для предотвращения перекрестного заражения между предыдущими госпитализациями и новыми госпитализациями.
« Больница приняла упреждающие меры, усилив профилактику и контроль инфекций, а также внимательно наблюдая за инфекциями. Блок.Все дети, поступившие в палату, прошли обследование на предмет предотвращения дальнейших инфекций ».
Районный специалист, группа по профилактике и контролю инфекций и NICD были« вызваны для поддержки ».
% PDF-1.7
%
218 0 объект
>
эндобдж
xref
218 99
0000000016 00000 н.
0000003028 00000 н.
0000003289 00000 н.
0000003316 00000 н.
0000003371 00000 н.
0000003407 00000 н.
0000003841 00000 н.
0000004036 00000 н.
0000004231 00000 п.
0000004344 00000 п.
0000004457 00000 п.
0000004570 00000 н.
0000004683 00000 н.
0000004796 00000 н.
0000004909 00000 н.
0000005022 00000 н.
0000005133 00000 п.
0000005246 00000 н.
0000005359 00000 п.
0000005472 00000 н.
0000005584 00000 н.
0000005695 00000 п.
0000005807 00000 н.
0000005918 00000 н.
0000006077 00000 н.
0000006216 00000 н.
0000006357 00000 н.
0000006526 00000 н.
0000006682 00000 п.
0000006762 00000 н.
0000006842 00000 н.
0000006922 00000 н.
0000007001 00000 н.
0000007080 00000 н.
0000007158 00000 н.
0000007238 00000 п.
0000007317 00000 н.
0000007396 00000 н.
0000007474 00000 н.
0000007554 00000 н.
0000007813 00000 п.
0000008369 00000 н.
0000008528 00000 н.
0000009033 00000 н.
0000009390 00000 н.
0000009761 00000 н.
0000009985 00000 н.
0000010265 00000 п.
0000015660 00000 п.
0000016069 00000 п.
0000016172 00000 п.
0000016546 00000 п.
0000022926 00000 п.
0000023438 00000 п.
0000026323 00000 п.
0000026718 00000 п.
0000026927 00000 н.
0000030468 00000 п.
0000030801 00000 п.
0000031172 00000 п.
0000033305 00000 п.
0000035421 00000 п.
0000037751 00000 п.
0000039837 00000 п.
0000040005 00000 п.
0000040062 00000 п.
0000040419 00000 п.
0000040635 00000 п.
0000040920 00000 н.
0000043018 00000 п.
0000043163 00000 п.
0000043518 00000 п.
0000045608 00000 п.
0000047856 00000 п.
0000048208 00000 н.
0000048264 00000 н.
0000048553 00000 п.
0000048761 00000 п.
0000050599 00000 п.
0000050876 00000 п.
0000051418 00000 п.
0000051548 00000 н.
0000095220 00000 п.
0000095259 00000 п.
0000142278 00000 н.
0000175799 00000 н.
0000213014 00000 н.
0000222790 00000 н.
0000222847 00000 н.
0000223118 00000 н.
0000223203 00000 н.
0000223286 00000 н.
0000223392 00000 н.
0000223488 00000 н.
0000223581 00000 н.
0000223723 00000 н.
0000223816 00000 н.
0000002857 00000 н.
0000002322 00000 н.
трейлер
] / Назад 658144 / XRefStm 2857 >>
startxref
0
%% EOF
316 0 объект
> поток
hb«e`: Ā
.

 Эту же воду капают в глаза по 2-3 капли 2 раза вдень.
Эту же воду капают в глаза по 2-3 капли 2 раза вдень.