Применение Глицина при грудном вскармливании
Можно ли глицин кормящим мамам? Глицин считается безвредным препаратом, и его часто назначают для повышения сопротивляемости нервной системы при стрессе, в качестве седативного, для улучшения сна. Но применение любых лекарств в процессе кормления грудью всегда вызывает вопросы.
Можно ли использовать Глицин при лактации?
Единственное противопоказание для оригинального препарата Глицин – это индивидуальная чувствительность к его компонентам. Это значит, что женщинам, у которых есть склонность к аллергическим реакциям, чьи дети имеют диатез, следует сначала проверить свою переносимость Глицина. Вероятность развития каких-либо реакций лишь теоретическая, но ее нельзя полностью исключать. Аминокислота глицин ежедневно синтезируется в организме человека, поэтому является естественным компонентом. Качество оригинального Глицина определяется тем, что по структуре молекулы он полностью соответствует тому, который синтезируется в организме.
При сниженном нервно-мышечном тонусе у ребенка глицин кормящей маме можно принимать только по назначению врача. ГАМК-ергическое действие глицина может усилить симптомы у грудничка. При других обстоятельствах дополнительное поступление глицина в организм ребенка стимулирует его умственное развитие и улучшает адаптацию после родов.
Сейчас существуют также аналоги Глицина, большинство из которых не проходили клинических испытаний. Кроме синтезированного глицина они могут содержать витамины, вспомогательные вещества. К сожалению, точных сведений о том, каким образом компоненты аналогов в сочетании с аминокислотой будут влиять на ребенка и маму, пока не имеется.
Как применять Глицин при кормлении грудью?
Беременным и кормящим Глицин назначают при тревожности, бессоннице, для профилактики нервного истощения, чтобы ускорить восстановление после родов.
Для адаптации к стрессу кормящим Глицин назначают по 1 таблетке 2-3 раза в сутки, курсом 10-14 дней. При повышенной тревожности, нарушенной адаптации к стрессу, бессоннице, нервном истощении кормящим мамам рекомендуют принимать по 2 таблетки Глицина 3 раза в день, в течение 10 дней. Курс лечения можно продлить на усмотрение педиатра, который наблюдает грудного ребенка.
При повышенной тревожности, нарушенной адаптации к стрессу, бессоннице, нервном истощении кормящим мамам рекомендуют принимать по 2 таблетки Глицина 3 раза в день, в течение 10 дней. Курс лечения можно продлить на усмотрение педиатра, который наблюдает грудного ребенка.
При послеродовой депрессии назначение Глицина входит в схему лечения, и оговаривается с лечащим врачом.
В норме Глицин улучшает течение послеродового периода и помогает наладить лактацию. Он не накапливается в организме, разрешен для длительного применения, реализуется без рецепта.
Можно ли «Глицин» кормящей маме? Отзывы врачей
В статье разберемся, можно ли «Глицин» кормящей маме.
Многие женщины в период после родов испытывают чувство беспокойства и тревоги. Кому-то удается справиться с подобными симптомами самостоятельно, и они постепенно исчезают. А некоторым приходится прибегать к применению различных медицинских средств, поскольку самостоятельно устранить напряжение не удается, а это отрицательно влияет не только на общее состояние, но и психологическое самочувствие малыша.
В данном случае потребуется прием медикаментозных препаратов с успокаивающим эффектом, наиболее известным и распространенным из которых на сегодняшний день считается «Глицин». Он способствует устойчивости организма к влиянию стрессовых ситуаций.
Итак, выясним, можно ли «Глицин» кормящей маме?
Состав лекарственного средства
Основным действующим элементом в составе этого медицинского препарата является аминокислота, которая благотворно влияет на организм человека. Она помогает регулировать метаболические процессы в мозге, способствует проникновению кислорода в структуры нервных клеток и позволяет предотвратить беспокойные состояния.
Свойства
Благодаря минимальной концентрации действующего вещества, данный фармакологический препарат обладает щадящим и мягким воздействием. Вследствие распада аминокислоты при поступлении в кровь формируется углекислый газ и вода, ввиду чего активное вещество в организме не задерживается и не провоцирует привыкания. Однако одноразовый прием данного медикамента не позволит достичь положительного результата, использовать средство «Глицин» следует курсами.
Однако одноразовый прием данного медикамента не позволит достичь положительного результата, использовать средство «Глицин» следует курсами.
Вопрос «можно ли «Глицин» кормящей маме?» интересует многих.
Действие препарата в период кормления грудью
Медикаментозное средство в период лактации благоприятно воздействует на процессы, происходящие в организме кормящих матерей. В числе таких влияний наблюдаются следующие:
- нормализация обмена веществ;
- снижение психоэмоциональных нагрузок и переутомления;
- предотвращение перевозбуждения и развития невроза;
- повышение умственной работоспособности;
- регулирование ритмов сна и отдыха.
Производители не приводят дополнительные данные о конкретных научных исследованиях, которые обеспечивают разрешение приема «Глицина» в таблетках кормящим мамам. Согласно аннотации, медицинский препарат во время кормления грудью может лишь спровоцировать аллергические реакции при непереносимости одного из компонентов.
Если у кормящей мамы наблюдается пониженное артериальное давление, то прием лекарства ей противопоказан.
Поэтому, можно ли пить «Глицин» кормящим мамам, лучше выяснить заранее.
Признаки недостатка глицина в организме
Глицин – это необходимая каждому человеку аминокислота, на основе которой производится лекарственное средство с одноименным названием.
Невозможно обозначить конкретные клинические симптомы, которые указывают на то, что причиной сложного психологического состояния кормящей женщины можно считать недостаток в ее организме данной аминокислоты.
Однако во время лактационного периода несбалансированное питание и частые стрессы могут стать фактором развития глициновой недостаточности, о чем могут свидетельствовать следующие косвенные признаки:
- чрезмерная усталость, слабость;
- снижение аппетита;
- уменьшение в крови уровня гемоглобина;
- чрезмерная нервная возбудимость и психоэмоциональное истощение;
- нарушения сна;
- ухудшение состояния кожных покровов.

И все же, можно или нет «Глицин» в таблетках кормящим мамам?
Допускается ли прием препарата во время лактации?
На вопрос «можно ли принимать медикаментозное средство «Глицин» в период грудного вскармливания?» большинство педиатров отвечают утвердительно. Поскольку данное лекарство оказывает мягкое влияние на женский организм. Для его производства используется сырье исключительно растительного происхождения.
Медицинское средство в небольших объемах проникает в детский организм через грудное молоко. Однако этот факт не должен вызывать опасений, поскольку концентрация аминокислоты в материнском молоке настолько мала, что не может навредить развитию и самочувствию ребенка.
Препарат «Глицин» в период грудного вскармливания позволяет женщине оставаться спокойной, способствует ее нормальному реагированию на сложные ситуации в жизни. В послеродовой период это особенно важно. Также аминокислота приводит в норму сердечные ритмы у новорожденного младенца, способствует устранению возбудимости и повышенного тонуса.
Однако перед применением данного медикаментозного препарата следует обязательно проконсультироваться с врачом. Лишь профессиональным доктором может быть установлена правильная схема приема данного лекарства и осуществлен должный контроль за последствиями терапевтических мероприятий.
В некоторых случаях специалист разрешает женщине во время грудного вскармливания вместо средства «Глицин» принимать различные травяные чаи из целебных трав, обладающих успокоительным воздействием. Перед тем как кормящая мать примет первую таблетку данного лекарственного средства, следует установить причину ее нервного напряжения. В некоторых случаях внутреннюю гармонию нельзя достичь при помощи таблеток.
Дозировка и правила приема медикамента
Можно ли использовать лекарство кормящей маме, должен решать врач, ведущий наблюдение. Только специалист может определить правильную дозировку медикаментозного препарата и сроки его применения.
Как правило, женщине в период лактации назначается следующая дозировка: 2-3 раза в день по одной таблетке. Медикамент рекомендуется класть под язык, держа до полного его растворения. Длительность терапевтического курса колеблется от 14 дней до месяца. Инструкция по использованию лекарственного препарата говорит о том, что повторно принимать средство можно только по истечении месяца.
Медикамент рекомендуется класть под язык, держа до полного его растворения. Длительность терапевтического курса колеблется от 14 дней до месяца. Инструкция по использованию лекарственного препарата говорит о том, что повторно принимать средство можно только по истечении месяца.
При пониженном артериальном давлении, принимая средство «Глицин», необходимо вести постоянный контроль за давлением при помощи тонометра. В случае выраженного снижения показателей следует прекратить прием данного медикамента.
Но всегда ли можно принимать «Глицин» кормящей маме?
Противопоказания
Несмотря на то что лекарство «Глицин» является безопасным фармакологическим препаратом, оказывающим успокаивающее воздействие, использовать его при лактации следует с определенной осторожностью. У кормящей матери и у младенца могут возникать разнообразные побочные реакции.
Причинами, по которым следует прекратить лечение медицинским средством «Глицин» в лактационный период, могут выступать:
- аллергические реакции, возникающие как у матери, так и у грудничка;
- отказ ребенка от груди, сонливое и вялое состояние младенца;
- чрезмерная возбужденность грудничка, неутихающий плач и нарушения сна.

В случае возникновения подобной симптоматики необходимо проконсультироваться со специалистом, который поможет подобрать другой успокоительный лекарственный препарат.
Итак, мы выяснили, можно ли кормящей маме «Глицин» в таблетках.
Дозировки и способ применения
Во время процесса лактации назначать прием медикамента «Глицин» должен доктор, который в обязательном порядке оценивает вероятность возникновения у женщины и малыша побочных явлений и делает выводы о целесообразности назначения пациентке этого лекарственного препарата. Он устанавливает индивидуальную дозировку и сроки приема медикамента.
Обычно лекарство «Глицин» назначают кормящим женщинам в дозе 1 таблетки два (три) раза в сутки. Терапевтический курс длится от 14 дней до 1 месяца, повторить его можно еще через один месяц.
При понижении давления медицинское средство принимается под ежедневным контролем. Если во время терапии давление очень понизилось, то прием препарата отменяют.
Теперь узнаем, можно ли «Глицин» кормящей матери по отзывам врачей?
Мнение специалистов и пациентов
Лекарственное средство уже много лет пользуется популярностью у людей, страдающих нервными расстройствами. При этом отдельной категорией таких больных являются кормящие грудью женщины. Известно, что многие фармакологические лекарства им противопоказаны, поэтому препарат «Глицин» — отличное средство для кормящих мам, поскольку лактация не входит в перечень противопоказаний к применению этого медикамента.
При этом отдельной категорией таких больных являются кормящие грудью женщины. Известно, что многие фармакологические лекарства им противопоказаны, поэтому препарат «Глицин» — отличное средство для кормящих мам, поскольку лактация не входит в перечень противопоказаний к применению этого медикамента.
Отзывы врачей содержат информацию о том, что данное лекарство показано всем, кто имеет расстройства психики, у кого наблюдается тревожность и чрезмерное волнение в стрессовых ситуациях, особенно это касается кормящих женщин, психологическое состояние которых передается грудным детям. Врачи отмечают, что «Глицин» при лактации помогает избавиться от подобных проблем, однако принимать его самостоятельно, без консультации со специалистом, не рекомендуется.
Кормящие женщины, которым было приписано данное лекарство, отмечают его среднюю эффективность, они говорят, что это средство не позволяет справиться с сильным стрессом, однако существенно облегчает состояние при пассивных нервных нарушениях, например, при депрессии, подавленном настроении, повышенной тревожности. Пациентки не наблюдали побочных действий этого лекарственного препарата и говорят, что переносится он довольно хорошо.
Пациентки не наблюдали побочных действий этого лекарственного препарата и говорят, что переносится он довольно хорошо.
Итак, в статье мы рассмотрели, можно ли «Глицин» кормящей маме.
Глицин при грудном вскармливании
Истощенный беременностью, послеродовыми стрессами и хронической усталостью организм подвержен весьма частым случаям заболевания. Как известно, все болезни от нервов, и тут уже не обойтись без разного рода успокоительных препаратов. Одним из наиболее популярных средств, помогающих повысить устойчивость к стрессам, является глицин при грудном вскармливании.
Как действует глицин при лактации?
Оказывает весьма широкий спектр влияния на происходящие процессы в организме:
- приводит в норму обмен веществ;
- снимает психоэмоциональную нагрузку и переутомление;
- снижает возбудимость и нервозность;
- повышает умственную работу;
- глицин при ГВ нормализует ритмы сна и отдыха.
Производитель не предоставляет конкретных данных исследований, допускающих прием данного препарата. Инструкция глицина при лактации лишь предполагает появление возможных аллергических реакций на составляющие. Также таблетки не стоит принимать при пониженном артериальном давлении.
Инструкция глицина при лактации лишь предполагает появление возможных аллергических реакций на составляющие. Также таблетки не стоит принимать при пониженном артериальном давлении.
Можно ли принимать глицин кормящим?
Специалисты по грудному вскармливанию и детские терапевты не имеют ничего против приема глицина при кормлении. Это обусловлено натуральностью его происхождения и мягким способом воздействия на организм. Вместе с молоком матери малая доза препарата все же попадает к малышу, но она не способна нанести никакого вреда. Глицин в период лактации поможет женщине держать себя в руках, быть спокойной и уверенной. А именно этого так не хватает в послеродовой период. Также этот препарат налаживает ритмы сна у новорожденных, снимает гипертонус и возбудимость. В медицинских очерках отсутствуют утвержденные данные о том, можно ли глицин кормящим, и каково негативное влияние его приема в период беременности и грудного вскармливания.
Глицин для кормящих мам выписывается только лечащим врачом, имеющим полную картину состояния организма матери и ребенка. Именно он устанавливает предельно допустимые нормы и сроки употребления препарата, наблюдает за ответными изменениями.
Именно он устанавливает предельно допустимые нормы и сроки употребления препарата, наблюдает за ответными изменениями.
Глицин в период лактации весьма успешно можно заменить успокоительными травяными чаями на основе мяты, мелиссы или валерианы. Попробуйте сначала разобраться в причине нервозности, попросите помощи по уходу за ребенком у мужа или родственников. Не всегда таблетки помогут найти выход из ситуации и наладить внутреннее состояние. Глицин при кормлении грудью стоит принимать лишь в исключительных случаях, впрочем, как и любой другой медикамент.
Глицин при грудном вскармливании — можно ли кормящей маме
После девяти месяцев беременности и такого не простого процесса как роды, женский организм сильно истощен. Глицин при грудном вскармливании является идеальным вариантом, чтобы нормализовать психологическое состояние.
Зачем принимать Глицин в период лактации
С рождением малыша не остается времени на себя и на отдых, постоянно присутствуют стрессовые ситуации, недосыпание, усталость, появляется беспокойство за здоровье и жизнь ребенка. Иногда нет другого выхода, как начать принимать седативные препараты.
Иногда нет другого выхода, как начать принимать седативные препараты.
Без приема успокоительных не обойтись, ведь нервное истощение может привести к соматическим заболеваниям. Как и во время беременности, должен присутствовать постоянный контроль за употребляемыми продуктами и лекарствами. Токсические вещества, попадая в кровь женщины, вместе с грудным молоком передаются ребенку.
При попадании в кровь, активные вещества поступают сразу к нервным клеткам, а остатки превращаются в воду и углекислый газ. Можно ли Глицин при грудном вскармливании? Действующее вещество не воздействует и не откладывается в других тканях организма.
Для получения необходимого эффекта Глицин кормящим мамам необходимо пропить целый курс, одноразовый прием препарата не дает видимого результата. В конце курса эффект сохраняется, к глицину не вырабатывается привыкание.
Показания к применению
Женщине в период лактации разрешается принимать Глицин при наличии следующих показаниях:
- снижение работоспособности;
- снижение интеллектуальных способностей;
- физическое переутомление;
- психоэмоциональное переутомление;
- нарушение режима сна и отдыха;
- сбой обменных процессов;
- последствия вегето-сосудистой дистонии.

Врачи без опасения назначают Глицин в период лактации и при беременности. Но сам производитель не гарантирует 100% безопасность для матери и новорожденного. Не исключено возникновение аллергических реакций. Даже если женщина хорошо перенесла препарат, индивидуальная непереносимость может проявиться у малыша.
Одним из противопоказаний является пониженное давление. Мать или ребенок, страдающие гиподинамией или имеющие периодические скачки давления, могут столкнуться со слабостью, заторможенностью, упасть в обморок.
Глицин кормящей женщине
Глицин при ГВ помогает молодой матери нормализовать сон, повысить устойчивость к стрессам, снять напряжение. Но в период лактации в первую очередь приходится думать не о своем состоянии, а о здоровье ребенка.
Однозначный ответ получить непросто. С одной стороны препарат назначают грудным детям для укрепления ЦНС, уменьшения беспокойства и плаксивости. Это говорит о том, что препарат является весьма безопасным для новорожденного организма.
Но есть обратная сторона медали. Аминокислоты, которыми и является препарат глицин, передаются с молоком и малышу. Возникает вопрос: нужна ли здоровому малышу, не страдающему психическими расстройствами, доза препарата?
Терапевты и педиатры положительно относятся к тому, чтобы принимать Глицин при лактации. Таблетки состоят из вещества натурального происхождения. В свою очередь оно является аналогом аминокислоты, которая вырабатывается организмом.
Чтобы получить пользу и эффект от препарата в послеродовой период, доза должна быть не большой. Врач должен назначить такое количество препарата, которое не окажет вреда ребенка. Для этого необходим постоянный контроль за поведением малыша. В случае изменения состояния, прием лекарства прекращается.
При улучшении состояния женщины, рекомендуется следить за состоянием нервной системы более щадящими методами. Сюда относят занятия спортом, рациональное питание, травяные успокоительные чаи на основе мяты, валерианы, пустырника и т. д.
д.
Чтобы рассчитать дозу препарата и длительность курса лечения, врач должен быть знаком с пациенткой и малышом или ознакомиться с состоянием здоровья по записям из карточки.
Если пить Глицин при грудном вскармливании, он может нанести необратимый вред ребенку при некоторых наследственных и обменных заболеваниях, а также при сниженном мышечном тонусе. Если же малыш здоров, то мама может не бояться пить данное успокоительное средство.
Дозировка в период лактации
Можно ли пить Глицин кормящим мамам? Да, однако дозировка и длительность лечение подбирается строго индивидуально. В среднем в период лактации женщина может принимать 1 таблетку (100 мг) трижды в день. Для лучшего усвоения таблетка кладется под язык до полного растворения. Таблетку можно растереть в порошок и запить водой, в воде препарат не растворяют, поскольку в такой форме лечебные свойства теряются.
Глицин во время грудного вскармливания принимается курсом 2-4 недели, в зависимости от выраженности симптоматики и динамики лечения. Следующий курс можно повторить после месячного перерыва.
Следующий курс можно повторить после месячного перерыва.
Глицин кормящей маме не рекомендуется, если у пациентки появилась ранее не присущая сонливость, слабость, вялость либо противоположные симптомы, а именно перевозбуждение, чрезмерная активность. Побочные эффекты возникают крайне редко, но исключать возможность их проявления не следует.
Источники:
Видаль: https://www.vidal.ru/drugs/glycine__4429
ГРЛС: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=80b010cc-df9b-4601-90e4-d8cd11a43524&t=
Нашли ошибку? Выделите ее и нажмите Ctrl + Enter
Глицин при грудном вскармливании: можно или нет
Глицин относят к одному из самых безопасных успокаивающих средств в период лактации. Препарат положительно влияет на работу нервных клеток, устраняет усталость и раздражительность, помогает при бессоннице и снимает стресс. Кроме того, таблетки дают даже грудничкам при беспокойном сне и поведении.
Однако любые медикаменты кормящей маме можно употреблять с осторожностью и только после консультации с врачом. Даже безопасный Глицин иногда приводит к негативной реакции у грудных детей.
Состав и действие препарата
Действующее вещество в составе Глицина – аминокислота. Она стимулирует процесс метаболизма головного мозга, насыщает нервные клетки кислородом и предотвращает перевозбуждение. Глицин защищает организм от неврозов, расстройств и беспокойств, повышает устойчивость к стрессам.
Глицин выполняет следующие функции:
- Нормализует обмен веществ;
- Устраняет переутомление и нервозность;
- Понижает возбудимость и успокаивает;
- Стимулирует работу головного мозга;
- Улучшает память и концентрацию внимания;
- Стабилизирует сон и помогает при бессоннице;
- Снижает риск возникновения вегетососудистых заболеваний.
Концентрация аминокислоты в препарате минимальна, поэтому она оказывает мягкое и щадящее действие. При попадании в кровь она распадается на воду и углекислый газ, не скапливается в организме и не вызывает привыкания. Однако разового приема таблетки часто недостаточно для достижения должного эффекта. Глицин необходимо принимать курсом.
При попадании в кровь она распадается на воду и углекислый газ, не скапливается в организме и не вызывает привыкания. Однако разового приема таблетки часто недостаточно для достижения должного эффекта. Глицин необходимо принимать курсом.
Правила приема и дозировка
Курс и схему приема должен назначить доктор. Глицин при грудном вскармливании принимать можно, однако в строго разрешенной дозировке. А при возникновении негативной реакции у грудничка, кормящей маме необходимо прекратить прием.
При употреблении препарата возникают следующие побочные эффекты:
- Аллергия (сыпь, зуд и покраснения) у мамы и малыша;
- Вялость и сонливость у мамы и малыша;
- Ребенок отказывается от груди;
- Чрезмерная возбудимость и нарушение сна у новорожденного;
- Постоянный плач грудничка.
Глицин можно пить кормящей маме по одной таблетке два-три раза в день. Таблетку кладут под язык и держат до полного рассасывания. Курс составляет 2-4 недели. При необходимости и отсутствии отрицательной реакции через месяц можно повторить курс.
При необходимости и отсутствии отрицательной реакции через месяц можно повторить курс.
Глицин нельзя употреблять при пониженном артериальным давлением!
Какие еще успокоительные препараты можно употреблять кормящей маме без вреда для малыша и лактации, что избавит от стресса, читайте по ссылке https://vskormi.ru/general-questions/uspokoitelnye-dlya-kormyashhih-mam/.
Глицин при грудном вскармливании – реакция ребенка на аминокислоту
Многими врачами подтвержден факт появления большинства болезней из-за стресса, особенно после родов. Тогда полезно начать прием успокоительных, наиболее популярным из которых является Глицин. Поможет нормализовать работу нервной системы организма матери, а также самого ребенка. Разберем подробнее, можно ли пить Глицин при грудном вскармливании?
Разберем подробнее, можно ли пить Глицин при грудном вскармливании?
Свойства глицина
Лекарственное средство выпускают в виде круглых белых таблеток плоскоцилиндрической формы, содержащие:
- 100 миллиграмм действующего вещества;
- 1 миллиграмм стеариновой кислоты, выступающего в качестве вспомогательного вещества;
- 1 миллиграмм метилцеллюлозы, так же дополнительное вещество.
Расфасовку медицинских препаратов производят в ячеистых картонных упаковках. Одна такая содержит 50 таблеток. Также она содержит инструкцию по применению лекарственного средства.
Препарат состоит из аминокислот, входящих в состав всех белков. Поэтому съедая белковую пищу, невольно приходится употребить также данное вещество.
При употреблении препарата получают концентрированный глицин. Оказывает влияние мягкого успокоительного. Когда его употребляют, исключено возникновение заторможенности, сонливости. Можно спокойно пить днем.
к содержанию ↑
Применение препарата при ГВ
Терапевты уверены, что этот медикамент не относится к запрещенным медпрепаратам при лактации. Данное средство оказывает мягкое воздействие, поскольку производится исключительно из материалов растительного происхождения.
Данное средство оказывает мягкое воздействие, поскольку производится исключительно из материалов растительного происхождения.
Важно! Небольшую дозу лекарственного препарата получает новорожденный через молоко. Дозировка незначительная, риск причинения вреда ребенку минимален.
Женщине позволит спокойнее реагировать даже на тяжелые случаи, поскольку этого недостает мамам после родов.
Важно! Глицин нормализует сердечный ритм новорожденным, снимает возбудимость.
Назначать употребление медпрепарата может лишь врач, знающий состояние кормящей матери и новорожденного. Лишь доктор может определить требуемую дозу, а также сроки употребления медикамента. За результатом приема любого медпрепарата обязан наблюдать специалист.
Важно! Если разрешит доктор, глицин возможно заменить чаем, приготовленного из лечебных трав.
к содержанию ↑
Влияние на лактацию
Медикамент оказывает положительное влияние, выражающееся следующим образом:
- нормализует обмен веществ;
- помогает справляться с психическими, физическими переутомлениями;
- снижает возбуждение, нервозность;
- улучшает работу мозга;
- помогает нормализовать фазы сна, отдыха.

Не проводились исследования, подтверждающиеотсутствие негативных эффектов от его употребления при кормлении грудью. Противопоказания содержат только возможность аллергической реакции.
Важно! Нельзя принимать женщинам со сниженным артериальным давлением.
к содержанию ↑
Влияние на ребенка
Достоверные доказательства влияния препарата на ребенка при ГВ отсутствуют. Однако малыш получает небольшая его часть через молоко. Глицин имеет небольшую опасность для ребенка.
В некоторых случаях его специально рекомендуют детям с тремором конечностей, нарушением гипертонуса, проблемами с фазами сна, родовой травмой. Назначают его прямым приемом. Он улучшит сон, снизит возбудимость ребенка.
Но после употребления препарата могут проявиться побочные эффекты:
- Отсутствие сна.
- Усталость, вялые ощущения.
- Нежелание питаться грудью.
- Постоянная возбудимость.
- Аллергическая реакция.
Чтобы избежать неприятных последствий, необходимо пройти медицинскую консультацию. После приема следите за реакцией организма ребенка.
После приема следите за реакцией организма ребенка.
к содержанию ↑
Аллергия на компоненты глицина, как у матери, так и у ребенка
На множество веществ возникает аллергия, исключением не является данный препарат. Но происходит подобное крайне редко. Это возможно обусловить тем, что глицин — аминокислота. Такие вещества легко принимаются организмом, редко вызывают ответную негативную реакцию.
Принимает активное участие в обменных процессах, поскольку нервной системе трудно функционировать без аминокислот. Поэтому его часто выписывают как успокоительное. Также препарат отлично повышает работоспособность.
Важно! Шанс ответной аллергической реакции детского организма выше, чем у взрослого человека.
к содержанию ↑
Мнение доктора Комаровского
Мнение Комаровского о глицине положительное. Хоть его эффект лечения психиатрических заболеваний научно не доказан, его часто используют в качестве обычного успокоительного. Также повышает умственную работоспособность.
Также повышает умственную работоспособность.
к содержанию ↑
Дозировка
Дозировка препарата, время употребления устанавливается врачом. При грудном вскармливании принимать данный медикамент разрешено, но определенными дозами. А если у ребенка проявляется отрицательная реакция, нужно отказаться от препарата.
Кормящей женщине разрешено пить 1 таблетку 2-3 раза ежедневно. Она кладется под язык, и находится там до полного рассасывания. Длительность приема составляет 2-4 недели. Если отрицательная реакция отсутствует, возможно, повторить сеанс через месяц.
Можно ли кормящей маме Глицин?
Глицин является средством, которое влияет на нервную систему, снимает раздражительность, уменьшает проблемы со сном, и не является противопоказанным к применению женщинами в период грудного вскармливания. Его также назначают и детям при нарушениях сна и чрезмерной возбудимости, но не всем известны возможные довольно негативные последствия, о которых будет изложено ниже в статье.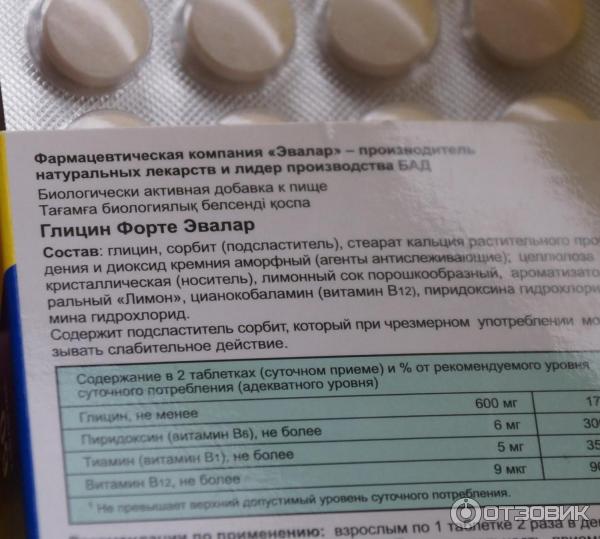
Рекомендации
Основным действующим компонентом является аминокислота, которая выполняет функции катализатора процессов метаболизма головного мозга. Исследования, проводимые в НИИ Геронтологии, показали, что при систематическом, регулярном и долговременном приеме препарата, улучшения в начале лечения сменяются резким прогрессированием метаболизма, что приводит к ускоренному старению сосудов, ангиопатии и необратимым склеротическим процессам. Именно поэтому, с 2005 года Глицин не рекомендуется к употреблению лицами, младше 60 лет.
Особенности приема:
- для достижения эффекта, а именно уменьшения раздражительности, необходимо принимать его курсами, при одноразовом приеме этот препарат не действенен;
- соответственно, разовая доза, даже в случае наступления улучшений симптомов состояния, имеет эффект плацебо. Дело в том, что Глицин является метаболическим средством, и требует определенного накопления в организме.
Именно поэтому рекомендуется воздержаться от приема Глицина в период кормления грудью, а также не давать (даже при назначениях педиатра) детям!
Альтернатива
Современная медицина может предложить кормящей матери препараты, которые действительно не являются вредными для ее и малюткиного здоровья. Так, например, это могут быть успокоительные чаи на основе натуральных трав и их масел – мелиссы, мяты, пустырника, валерианы, аниса и прочих. Из препаратов без противопоказаний к приему при ГВ являются Ново-Пассит, Нотта, Магне В6 (предпочтительнее пить жидкий, в капсулах), Sedasen Forte и др.
Так, например, это могут быть успокоительные чаи на основе натуральных трав и их масел – мелиссы, мяты, пустырника, валерианы, аниса и прочих. Из препаратов без противопоказаний к приему при ГВ являются Ново-Пассит, Нотта, Магне В6 (предпочтительнее пить жидкий, в капсулах), Sedasen Forte и др.
Наиболее оптимальным вариантом является очная консультация у терапевта, которая назначит соответствующие лекарства, и сможет наблюдать за состоянием кормящей мамы и малыша.
Смотрите также: Можно ли кормящей маме принимать корвалол?
Молекулярно-динамическое моделирование аминокислоты глицина …
Research Note
[версия 1; экспертная оценка: 1 одобрено с оговорками]
Тертеров Иван
https://orcid.org/0000-0002-6731-3875
1 , Сергей Коняхин 1,2 , Сергей Вязьмин 1 , Виталий Бойцов 1 , 3 , Михаил Дубина 1 Иван Тертеров
https://orcid.org/0000-0002-6731-3875
1 , Сергей Коняхин 1,2 , [. ..] Сергей Вязьмин 1 , Виталий Бойцов 1,3 , Михаил Дубина 1 Сведения об авторах Сведения об авторе 1 Санкт-Петербургский академический университет, Санкт-Петербург, Российская Федерация
..] Сергей Вязьмин 1 , Виталий Бойцов 1,3 , Михаил Дубина 1 Сведения об авторах Сведения об авторе 1 Санкт-Петербургский академический университет, Санкт-Петербург, Российская Федерация
2 Физико-технический институт им. Российской академии наук, Санкт-Петербург, Российская Федерация
3 Санкт-Петербургский научный центр РАН, Санкт-Петербург, Российская Федерация
ДЕТАЛИ ОТКРЫТОГО ПЕРВОГО ОБЗОРА
СТАТУС РЕЦЕНЗЕНТА
Реферат
Солевые растворы — это естественная среда, в которой действуют биологические молекулы, а растворенные ионы активно участвуют в биохимических процессах.С ионами металлов мембранные потенциалы сохраняются. Ионы имеют решающее значение для активности многих ферментов, и их способность координировать свои действия с химическими группами модулирует белок-белковые взаимодействия. Здесь мы представляем сравнительное исследование координации натрия и калия с цвиттерионным глицином с помощью явной молекулярной динамики растворителя. Мы продемонстрировали, что контактная ионная пара катионов и карбоксилатной группы расщепляется на два различных координационных состояния. Связывание натрия значительно сильнее, чем у калия.Эти результаты могут пролить свет на различную роль ионов натрия и калия в синтезе абиогенных пептидов.
Мы продемонстрировали, что контактная ионная пара катионов и карбоксилатной группы расщепляется на два различных координационных состояния. Связывание натрия значительно сильнее, чем у калия.Эти результаты могут пролить свет на различную роль ионов натрия и калия в синтезе абиогенных пептидов.
Ключевые слова
Ион калия, ион натрия, ионное спаривание, молекулярная динамика, координация ионов
Автор, ответственный за переписку: Иван Тертеров Конкурирующие интересы: Конкурирующие интересы не выявлены.
Информация о гранте: Исследование финансировалось РФФИ (14-04-01889) и Программой фундаментальных исследований Президиума РАН «Наноструктуры: физика, химия, биология и основы технологий».
Авторские права: © 2017 Тертеров И и др. . Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Данные, связанные со статьей, доступны в соответствии с условиями отказа от данных Creative Commons Zero «Права не защищены» (CC0 1.0, посвящение общественному достоянию). Как цитировать: Тертеров И., Коняхин С, Вязьмин С и др. Молекулярно-динамическое моделирование ассоциации аминокислот глицина с ионами калия и натрия в явном растворителе [версия 1; экспертная оценка: 1 одобрено с оговорками]. F1000Research 2017, 6 : 74 (https://doi.org/10.12688/f1000research.10644.1) Первая публикация: 24 января 2017 г., 6 : 74 (https://doi.org/10.12688/ f1000research.10644.1) Последний раз опубликовано: 24 янв 2017, 6 : 74 (https://doi.org/10.12688/f1000research.10644.1)
Данные, связанные со статьей, доступны в соответствии с условиями отказа от данных Creative Commons Zero «Права не защищены» (CC0 1.0, посвящение общественному достоянию). Как цитировать: Тертеров И., Коняхин С, Вязьмин С и др. Молекулярно-динамическое моделирование ассоциации аминокислот глицина с ионами калия и натрия в явном растворителе [версия 1; экспертная оценка: 1 одобрено с оговорками]. F1000Research 2017, 6 : 74 (https://doi.org/10.12688/f1000research.10644.1) Первая публикация: 24 января 2017 г., 6 : 74 (https://doi.org/10.12688/ f1000research.10644.1) Последний раз опубликовано: 24 янв 2017, 6 : 74 (https://doi.org/10.12688/f1000research.10644.1)
Введение
Солевые растворы — это естественная среда, в которой действуют биологические молекулы. Более того, сами растворенные ионы в значительной степени участвуют во многих биологических процессах на молекулярном уровне. Ионы металлов являются по существу кофакторами многих ферментов и могут координироваться с заряженными группами, таким образом модулируя белок-белковые взаимодействия и их активность 1 . Многие из этих проявлений обусловлены специфической координацией ионов с заряженными группами на поверхности белков и другими противоионами в растворах, а не изменением структуры водного раствора в объеме 2 .Такое спаривание ион-противоион было подтверждено экспериментально и теоретически описано с использованием молекулярного моделирования 3 .
Многие из этих проявлений обусловлены специфической координацией ионов с заряженными группами на поверхности белков и другими противоионами в растворах, а не изменением структуры водного раствора в объеме 2 .Такое спаривание ион-противоион было подтверждено экспериментально и теоретически описано с использованием молекулярного моделирования 3 .
Несмотря на кажущееся сходство, биологические роли натрия и калия сильно различаются. Например, соотношение концентраций ионов калия и натрия высокое внутри клетки и низкое снаружи, что приводит к возникновению мембранных потенциалов. Эти два жизненно важных иона также демонстрируют разную каталитическую способность в модельной реакции синтеза пребиотических пептидов, где калий проявляет более высокую активность 4 .Кроме того, их роль в абиогенезе представляет большой интерес 5 .
Предполагалось, что натрий связывается с заряженными группами на поверхности белков сильнее, чем калий, что, вероятно, коррелирует с «высаливанием» действия натрия на белки и «засаливанием», как известно для калия 6 . Используя исследование поглощения рентгеновских лучей растворов, содержащих растворенные ионы и молекулы ацетата или глицина, было продемонстрировано, что натрий имеет превосходное сродство к карбоксилату, одной из основных анионных групп в белках 7 .В ряде работ такое различие объяснялось с помощью комбинации молекулярной динамики и ab initio расчетов 6–9 . С помощью этого метода была рассчитана разница между свободными энергиями ассоциации ионов натрия и калия с карбоксилатными группами 9 .
Используя исследование поглощения рентгеновских лучей растворов, содержащих растворенные ионы и молекулы ацетата или глицина, было продемонстрировано, что натрий имеет превосходное сродство к карбоксилату, одной из основных анионных групп в белках 7 .В ряде работ такое различие объяснялось с помощью комбинации молекулярной динамики и ab initio расчетов 6–9 . С помощью этого метода была рассчитана разница между свободными энергиями ассоциации ионов натрия и калия с карбоксилатными группами 9 .
Используя молекулярную динамику, было продемонстрировано, что не только прямая пара ион-карбоксилат, но и общие пары ион-карбоксилат в растворителе имеют большое значение 10–12 .В частности, эти опосредованные растворителем состояния кажутся более населенными, чем ионная пара прямого контакта, и могут определять термодинамику растворов ацетатных солей 10 . Ряд из ab initio расчетов координации ионов с аминокислотами в газовой фазе был проведен ранее 13–15 ; однако эффекты растворителя значительны, и их следует принимать во внимание 10,16,17 .
Чтобы лучше понять молекулярные детали ионного спаривания во взаимодействии белок-белок, представляет интерес пространственное распределение положений ионов.Здесь мы представляем молекулярно-динамическое исследование пространственного распределения натрия и калия, скоординированных с цвиттерионным глицином, в концентрированном водно-ионном растворе.
Детали моделирования
Молекулярно-динамическое (МД) моделирование проводилось в пакете GROMACS (версия 4.6.7) 18 . Системы моделирования содержали одну цвиттерионную молекулу глицина (так как при pH 7 это наиболее вероятная форма глицина в растворе), 33 катиона, 33 хлорид-аниона и около 800 молекул воды в кубическом периодическом ящике со сторонами 3 нм, что соответствует 2 M соли. решение.Уравновешивание 10 нс предшествовало 500 нс производственного МД для каждой системы с постоянным числом частиц (N), постоянными условиями давления (P) и температуры (T) — в ансамбле NPT. Температуру 300 К и давление 1 бар поддерживали термостатом Носа-Гувера 19,20 и баростатом Парринелло-Рахмана 21 . Электростатический метод PME был использован 22 с шагом сетки 0,12 нм и отсечкой 1,0 нм, как и для ван-дер-ваальсовых взаимодействий. Для цвиттерионного глицина параметры были взяты из силового поля OPLS-AA 23 , все связи были ограничены алгоритмом LINCS 24 (для получения дополнительных сведений о параметрах см. Входные файлы запуска, доступные в наборе данных 1).Параметры для катионов были получены из 25, для хлоридов из 26 и использовалась модель воды TIP3P 27 . Функции радиального распределения были рассчитаны с шириной бина 0,004 нм с использованием утилиты g_rdf пакета GROMACS. Пространственное распределение рассчитывали с помощью утилиты g_spatial GROMACS после аппроксимации методом наименьших квадратов тяжелых атомов молекулы глицина из каждого кадра в положение начальной структуры MD.
Электростатический метод PME был использован 22 с шагом сетки 0,12 нм и отсечкой 1,0 нм, как и для ван-дер-ваальсовых взаимодействий. Для цвиттерионного глицина параметры были взяты из силового поля OPLS-AA 23 , все связи были ограничены алгоритмом LINCS 24 (для получения дополнительных сведений о параметрах см. Входные файлы запуска, доступные в наборе данных 1).Параметры для катионов были получены из 25, для хлоридов из 26 и использовалась модель воды TIP3P 27 . Функции радиального распределения были рассчитаны с шириной бина 0,004 нм с использованием утилиты g_rdf пакета GROMACS. Пространственное распределение рассчитывали с помощью утилиты g_spatial GROMACS после аппроксимации методом наименьших квадратов тяжелых атомов молекулы глицина из каждого кадра в положение начальной структуры MD.
Dataset 1. Выполните входные параметры для производственного MD в GROMACS версии 4.6.7.
Набор данных 2. Типологии входных данных и сбалансированные структуры для производственных MD (в zip-архиве).
Результаты и обсуждение
Были исследованы две системы, каждая из которых состояла из одного глицина, растворенного в чистой воде с ионами натрия и хлорида или ионами калия и хлорида. Функции радиального распределения (RDF) Na + или K + по отношению к атомам кислорода или углеродным атомам глицинкарбоксилатной группы были рассчитаны и представлены на рисунке 1. RDF O-Me + для обоих изученных ионов показывает несколько координационные оболочки с ярко выраженным первым максимумом, который значительно выше для натрия, что согласуется с предыдущими исследованиями, указывающими на превосходное сродство к Na + 6,7,10,12,17 .Однако анализ C-Me + RDF в литературе встречается не так часто. C-Me + RDF показаны на рисунке 1B и показывают два острых пика для ионов натрия при 0,28 и 0,34 нм, а также два более слабых отдельных, но различных пика для калия при 0,32 и 0,36 нм. Этот рисунок показывает, что существует два благоприятных состояния координации катионов с карбоксилатными группами, которые оба вносят вклад в единственный первый пик RDF O-Me + .
На рис. 2 показаны поверхности изоплотности ионов натрия или калия, рассчитанные для глицина, и явно показаны эти координационные состояния.Видно медиальное ( м ) координационное состояние, равноудаленное от атомов кислорода карбоксилатной группы, и латеральное (-1 ) состояние, состоящее из двух областей, находящихся ближе к одному из двух атомов кислорода. Асимметрия, которая видна в форме областей состояния ( l ), включая мост, соединяющий ( m ) и ( l ) в случае K + , возникает из-за положительно заряженного NH 3 и общая конформационная гибкость глицина.Уровни плотности в пространственном распределении для натрия значительно превышают таковой для калия, и во время моделирования мы иногда наблюдали только для глицина натрия, координированного с двумя ионами одновременно в состояниях ( m ) и ( l ) (см. Рисунок 3). Расстояния, изображенные на Фигуре 3, ясно показывают, что состояние ( m ) ближе к C карбоксилатной группы и соответствует первому пику на C-Me + RDF (0,28 нм для Na + ). Состояние ( l ) соответствует следующему пику (0.34 нм после минимума на 0,3 нм для Na + ), в то время как оба состояния принадлежат одному и тому же пику O-Me + RDF (0,23 нм для Na + ). При моделировании натрия глицин существует с Na + в ( m ) скоординированном состоянии в течение 21% времени наблюдения и с Na + только в (-1 ) скоординированном состоянии на 30%. Для моделирования калия мы получили 8% и 18% времени для согласованных состояний ( m ) и ( l ) соответственно.
Состояние ( l ) соответствует следующему пику (0.34 нм после минимума на 0,3 нм для Na + ), в то время как оба состояния принадлежат одному и тому же пику O-Me + RDF (0,23 нм для Na + ). При моделировании натрия глицин существует с Na + в ( m ) скоординированном состоянии в течение 21% времени наблюдения и с Na + только в (-1 ) скоординированном состоянии на 30%. Для моделирования калия мы получили 8% и 18% времени для согласованных состояний ( m ) и ( l ) соответственно.
Рисунок 1. Функции радиального распределения (RDF).
( A ) O-Me + RDF, ( B ) C-Me + RDF. Зеленый, натрий; фиолетовый, калий.
Рисунок 2. Пространственное распределение ионов.
Поверхности изоплотности вокруг глицина показаны для Na + ( A и B ) и K + ( C и D ). Обратите внимание, что значение плотности (отсечение) для Na + намного выше, чем для K + .
Рис. 3. Снимок траектории глицина, координированного с двумя ионами натрия одновременно в состояниях (
m ) и ( l ).
Расстояния указаны в нанометрах. Зеленый — атомы натрия; красный — кислород; серый, карбон; молекулы воды не показаны.
Набор данных 3. Траектории MD (.xtc) и входные файлы (.tpr) для систем NaCl и KCl (в zip-архиве). Позиции молекул воды не включены.
Выводы
Мы продемонстрировали, что контактная ионная пара карбоксилатной группы с Na + или K + распадается на отдельные, хорошо занятые ( m ) и ( l ) координационные состояния.Эффект может представлять интерес для исследований, посвященных расчетам ab initio и интерпретации данных по поглощению рентгеновских лучей, так как они учитывают только координационное состояние ( m ) 6–8 . Считается, что координация с ионами имеет решающее значение на первой стадии процесса полимеризации абиогенных пептидов 28 , и поэтому наблюдаемые различия в поведении натрия и калия важны для исследования условий синтеза первичных абиогенных пептидов.
Доступность данных
Набор данных 1: Выполните входные параметры для производственных MD в GROMACS версии 4.6.7. doi, 10.5256 / f1000research.10644.d149764 29
Набор данных 2: Типологии входных данных и уравновешенные структуры для производственных MD (в zip-архиве). doi, 10.5256 / f1000research.10644.d149765 30
Набор данных 3: MD траекторий (.xtc) и входные файлы (.tpr) для систем NaCl и KCl (в zip-архиве). Позиции молекул воды не включены.doi, 10.5256 / f1000research.10644.d149766 31
Вклад авторов
Разработал схему моделирования: IT SK SV VB MD. Проведенные симуляции: IT. Проанализированы данные: ИТ СК СВ ВБ МД. Написал рукопись: ИТ СК ВБ МД.
Конкурирующие доли
Конкурирующие доли участия не были раскрыты.
Информация о гранте
Исследование финансировалось РФФИ (14-04-01889) и Программой фундаментальных исследований Президиума РАН «Наноструктуры: физика, химия, биология и основы технологий».
Рекомендуется F1000
Ссылки
- 1. Коллинз К.Д., Нилсон Г.В., Эндерби Дж. Э.: Ионы в воде: характеристика сил, контролирующих химические процессы и биологическую структуру. Biophys Chem. 2007; 128 (2–3): 95–104. PubMed Аннотация | Publisher Full Text
- 2. Ло Ностро П., Нинхэм Б.В.: Феномен Хофмейстера: обновленная информация об ионной специфичности в биологии. Chem Rev. 2012; 112 (4): 2286–2322. PubMed Аннотация | Издатель Полный текст
- 3.van der Vegt NF, Haldrup K, Roke S, et al. . Спаривание ионов с участием воды: возникновение и актуальность. Chem Rev. 2016; 116 (13): 7626–41. PubMed Аннотация | Издательство Полный текст
- 4. Дубина М.В., Вязьмин С.Ю., Бойцов В.М., и др. : Ионы калия более эффективны, чем ионы натрия, в образовании пептидов, индуцированном солью. Orig Life Evol Biosph. 2013; 43 (2): 109–117. PubMed Аннотация | Издатель Полный текст | Бесплатный полный текст
- 5.
 Роде Б.М.: Пептиды и происхождение жизни. Пептиды. 1999; 20 (6): 773–786. PubMed Аннотация | Publisher Full Text
Роде Б.М.: Пептиды и происхождение жизни. Пептиды. 1999; 20 (6): 773–786. PubMed Аннотация | Publisher Full Text - 6. Vrbka L, Vondrásek J, Jagoda-Cwiklik B, et al. : Количественное определение и обоснование более высокого сродства натрия по сравнению с калием к поверхности белка. Proc Natl Acad Sci U S. A. 2006; 103 (42): 15440–15444. PubMed Аннотация | Издатель Полный текст | Бесплатный полный текст
- 7. Азиз Э.Ф., Оттоссон Н., Эйсебитт С., et al.: Катион-специфические взаимодействия с карбоксилатом в водных растворах аминокислот и ацетата: поглощение рентгеновских лучей и расчеты ab initio . J. Phys Chem B. 2008; 112 (40): 12567–12570. PubMed Аннотация | Издатель Полный текст
- 8. Ягода-Цвиклик Б., Вача Р., Лунд М., и др. : Спаривание ионов как возможный ключ к различению натрия и калия в биологических и других сложных средах. J. Phys Chem B. 2007; 111 (51): 14077–14079.
 PubMed Аннотация | Publisher Full Text
PubMed Аннотация | Publisher Full Text - 9. Vlachy N, Jagoda-Cwiklik B, Vácha R, et al. : серия Хофмайстера и специфические взаимодействия заряженных головных групп с водными ионами. Adv Colloid Interface Sci. 2009; 146 (1-2): 42–47. PubMed Аннотация | Publisher Full Text
- 10. Hess B., van der Vegt NF: Катион-специфическое связывание с поверхностными зарядами белков. Proc Natl Acad Sci U S. A. 2009; 106 (32): 13296–13300. PubMed Аннотация | Издатель Полный текст | Бесплатный полный текст
- 11.Гангули П., Шравендейк П., Хесс Б., и др. : Спаривание ионов в водных растворах электролитов с биологически значимыми анионами. J. Phys Chem B. 2011; 115 (13): 3734–3739. PubMed Аннотация | Publisher Full Text
- 12. Хаджари Т., Гангули П., ван дер Вегт Н. Ф.: Энтальпия-энтропия ассоциации катиона с ацетатным анионом в воде. J. Chem Theory Comput. 2012; 8 (10): 3804–3809. PubMed Аннотация | Издатель Полный текст
- 13.
 Jockusch RA, Lemoff AS, Williams ER: Влияние координации ионов металла и воды на структуру газофазной аминокислоты. J Am Chem Soc. 2001; 123 (49): 12255–12265. PubMed Аннотация | Publisher Full Text
Jockusch RA, Lemoff AS, Williams ER: Влияние координации ионов металла и воды на структуру газофазной аминокислоты. J Am Chem Soc. 2001; 123 (49): 12255–12265. PubMed Аннотация | Publisher Full Text - 14. Ремко М., Роде Б.М.: Влияние ионов металлов (li + , na + , k + , mg 2+ , ca 2+ , ni 2+ , cu 2+ и zn 2+ ) и водной координации на структуру глицина и цвиттерионного глицина. J. Phys Chem A. 2006; 110 : (5): 1960–1967. PubMed Аннотация | Publisher Full Text
- 15. Буш М.Ф., Ооменс Дж., Сайкалли Р.Дж., et al. : Влияние комплексообразования с ионом щелочноземельного металла на стабильность цвиттер-иона аминокислот: результаты инфракрасной спектроскопии. J Am Chem Soc. 2008; 130 (20): 6463–6471. PubMed Аннотация | Publisher Full Text
- 16. Tomé LI, Jorge M, Gomes JR, et al. : На пути к пониманию растворимости аминокислот в воде в присутствии солей: исследование с помощью моделирования молекулярной динамики.
 J. Phys Chem B. 2010; 114 (49): 16450–16459. PubMed Аннотация | Publisher Full Text
J. Phys Chem B. 2010; 114 (49): 16450–16459. PubMed Аннотация | Publisher Full Text - 17. Аннапуредди HV, Dang LX: Молекулярный механизм специфических ионных взаимодействий между щелочными катионами и ацетат-анионом в водном растворе: исследование молекулярной динамики. J. Phys Chem B. 2012; 116 (25): 7492–7498. PubMed Аннотация | Publisher Full Text
- 18. Hess B., Kutzner C, Der Spoel DV, et al. : Gromacs 4: алгоритмы для высокоэффективного, сбалансированного по нагрузке и масштабируемого молекулярного моделирования. J. Chem Theory Comput. 2008; 4 (3): 435–447. PubMed Аннотация | Publisher Full Text
- 19. Nosé S: унифицированная формулировка методов молекулярной динамики при постоянной температуре. J Chem Phy. 1984; 81 (1): 511–519. Publisher Full Text
- 20. Гувер WG: Каноническая динамика: равновесные распределения фазового пространства. Phys Rev A Gen Phys. 1985; 31 (3): 1695–1697.
 PubMed Аннотация | Издатель Полный текст
PubMed Аннотация | Издатель Полный текст - 21.Парринелло М, Рахман А: Полиморфные переходы в монокристаллах: новый метод молекулярной динамики. J. Appl Phys. 1981; 52 (12): 7182–7190. Publisher Full Text
- 22. Essmann U, Perera L., Berkowitz ML, et al. : Метод Эвальда с гладкой сеткой частиц. J. Chem Phys. 1995; 103 (19): 8577–8593. Издатель Полный текст
- 23. Камински Г.А., Фриснер Р.А., Тирадо-Ривес Дж., и др. : Оценка и повторная параметризация силового поля opls-aa для белков путем сравнения с точными квантово-химическими расчетами пептидов. J. Phys Chem B. 2001; 105 (28): 6474–6487. Publisher Full Text
- 24. Hess B, Bekker H, Berendsen HJ, et al. : Lincs: решатель линейных ограничений для молекулярного моделирования. J. Comput Chem. 1997; 18 (12): 1463–1472. Publisher Full Text
- 25. Аквист Дж .: Потенциалы взаимодействия ионов с водой, полученные из моделирования возмущений свободной энергии.
 J. Phys Chem. 1990; 94 (21): 8021–8024. Издатель Полный текст
J. Phys Chem. 1990; 94 (21): 8021–8024. Издатель Полный текст - 26.Чандрасекар Дж., Спеллмейер Д.К., Йоргенсен В.Л.: Анализ энергетических компонентов для разбавленных водных растворов ионов лития (1+), натрия (1+), фторида (1-) и хлорида (1-). J Am Chem Soc. 1984; 106 (4): 903–910. Publisher Full Text
- 27. Jorgensen WL, Chandrasekhar J, Madura JD, et al. : Сравнение простых потенциальных функций для моделирования жидкой воды. J. Chem Phys. 1983; 79 (2): 926–935. Издатель Полный текст
- 28.Ковени П.В., Свэдлинг Дж. Б., Ваттис Дж. А., и др. : Теория, моделирование и симуляция в исследованиях происхождения жизни. Chem Soc Rev. 2012; 41 (16): 5430–5446. PubMed Аннотация | Издательство Полный текст
- 29. Тертеров И., Коняхин С., Вязьмин С., и др. : Набор данных 1 в: Молекулярно-динамическое моделирование ассоциации аминокислот глицина с ионами калия и натрия в явном растворителе.
 F1000 Исследования. 2017. Источник данных
F1000 Исследования. 2017. Источник данных - 30. Тертеров И., Коняхин С., Вязьмин С., и др.: Набор данных 2 в: Молекулярно-динамическое моделирование ассоциации аминокислот глицина с ионами калия и натрия в явном растворителе. F1000 Исследования. 2017. Источник данных
- 31. Тертеров И., Коняхин С., Вязьмин С., и др. : Набор данных 3 в: Молекулярно-динамическое моделирование ассоциации аминокислот глицина с ионами калия и натрия в явном растворителе. F1000 Исследования. 2017. Источник данных
Сведения об авторе Сведения об авторе 1 St.Петербургский академический университет, Санкт-Петербург, Российская Федерация
2 Физико-технический институт им. А.Ф. Иоффе РАН, Санкт-Петербург, Российская Федерация
3 Санкт-Петербургский научный центр РАН, Санкт-Петербург, Российская Федерация
Грант информация
Работа финансируется РФФИ (14-04-01889) и Программой фундаментальных исследований Президиума РАН «Наноструктуры: физика, химия, биология и основы технологий».
Версия 1
ВЕРСИЯ 1
ОПУБЛИКОВАНА 24 января 2017 г.
Отчет рецензента 15 февраля 2017 г.
Нихаренду Чоудхури, Отдел теоретической химии, Центр атомных исследований Бхабхи (BARC), Мумбаи, Махараштра, Индия
Утверждено с оговорками: https:
Утверждено с оговорками https //doi.org/10.5256/f1000research.11470.r19642
Конкурирующие интересы: Конкурирующие интересы не были раскрыты.
Закрыть
ПРОЧИТАТЬ МЕНЬШЕ
Комментарии к статье Комментарии (0)
Версия 1
ВЕРСИЯ 1 ОПУБЛИКОВАНА 24 января 2017 г.
Комментарий
| 2.5% Травазол для инъекций аминокислоты с электролитами в 10% декстрозе | Глицин (260 мг / 100 мл) + аланин (520 мг / 100 мл) + аргинин (290 мг / 100 мл) + декстроза в неуточненной форме (10 г / 100 мл). мл) + фосфат калия (130,5 мг / 100 мл) + гистидин (120 мг / 100 мл) + изолейцин (150 мг / 100 мл) + лейцин (182,5 мг / 100 мл) + лизин (145 мг / 100 мл) + магний хлорид (25,5 мг / 100 мл) + метионин (100 мг / 100 мл) + фенилаланин (140 мг / 100 мл) + пролин (170 мг / 100 мл) + серин (125 мг / 100 мл) + ацетат натрия (170 мг / 100 мл) + хлорид натрия (29.3 мг / 100 мл) + треонин (105 мг / 100 мл) + триптофан (45 мг / 100 мл) + тирозин (10 мг / 100 мл) + валин (145 мг / 100 мл) | Раствор | Внутривенно | Baxter Corporation Clintec Nutrition Division | 1996-12-31 | 2015-08-05 | Канада | |
| Инъекция 2,5% аминокислоты Travasol с электролитами в 10% декстрозе Clinimix | Глицин (520 мг / 100 мл) + Аланин (520 мг / 100 мл) + Аргинин (260 мг / 100 мл) + Декстроза в неуточненной форме (10 г / 100 мл) + Дикалий фосфат (130.5 мг / 100 мл) + гистидин (110 мг / 100 мл) + изолейцин (120 мг / 100 мл) + L-лейцина гидрохлорид (155 мг / 100 мл) + лизина гидрохлорид (145 мг / 100 мл) + хлорид магния ( 25,5 мг / 100 мл) + метионин (145 мг / 100 мл) + фенилаланина гидрохлорид (155 мг / 100 мл) + пролин (105 мг / 100 мл) + ацетат натрия (170 мг / 100 мл) + хлорид натрия (29,3 мг. / 100 мл) + треонин (105 мг / 100 мл) + триптофан (45 мг / 100 мл) + тирозин (10 мг / 100 мл) + валин (115 мг / 100 мл) | Раствор | Внутривенно | Baxter Corporation Подразделение Clintec Nutrition | 1993-12-31 | 2015-08-05 | Канада | |
| 2.5% Травазол для инъекций аминокислоты без электролитов в 10% декстрозе Quickmix | Глицин (520 мг / 100 мл) + аланин (520 мг / 100 мл) + аргинин (260 мг / 100 мл) + декстроза в неуточненной форме (10 г / 100 мл) + гистидин (110 мг / 100 мл) + изолейцин (120 мг / 100 мл) + L-лейцина гидрохлорид (155 мг / 100 мл) + лизина гидрохлорид (195 мг / 100 мл) + метионин (195 мг / 100 мл). мл) + фенилаланина гидрохлорид (155 мг / 100 мл) + пролин (105 мг / 100 мл) + треонин (105 мг / 100 мл) + триптофан (45 мг / 100 мл) + тирозин (10 мг / 100 мл) + валин (115 мг / 100 мл) | Раствор | Внутривенно | Baxter Corporation Clintec Nutrition Division | 1995-12-31 | 2007-08-02 | Канада | |
| 2.5% травазол Аминокислота InJ.W.eleC.W 25% dex | Глицин (260 мг / 100 мл) + аланин (520 мг / 100 мл) + аргинин (290 мг / 100 мл) + декстроза в неуточненной форме ( 25 г / 100 мл) + калия фосфат (130,5 мг / 100 мл) + гистидин (120 мг / 100 мл) + изолейцин (150 мг / 100 мл) + лейцин (182,5 мг / 100 мл) + лизин (145 мг / 100 мл). мл) + хлорид магния (25,5 мг / 100 мл) + метионин (100 мг / 100 мл) + фенилаланин (140 мг / 100 мл) + пролин (170 мг / 100 мл) + серин (125 мг / 100 мл) + натрий ацетат (170 мг / 100 мл) + хлорид натрия (29.3 мг / 100 мл) + треонин (105 мг / 100 мл) + триптофан (45 мг / 100 мл) + тирозин (10 мг / 100 мл) + валин (145 мг / 100 мл) | жидкость | внутривенно | Clintec Nutrition Company | 1996-07-30 | 1998-08-13 | Канада | |
| 2,75% Travas. Аминокислота InJ.W.elecw.25% dex | Глицин (283 мг / 100 мл) + аланин (570 мг / 100 мл) + аргинин (316 мг / 100 мл) + декстроза в неуточненной форме (25 г / 100 мл) ) + Фосфат калия (261 мг / 100 мл) + гистидин (132 мг / 100 мл) + изолейцин (165 мг / 100 мл) + лейцин (201 мг / 100 мл) + лизин (159.5 мг / 100 мл) + хлорид магния (51 мг / 100 мл) + метионин (110 мг / 100 мл) + фенилаланин (154 мг / 100 мл) + пролин (187 мг / 100 мл) + серин (137,5 мг / 100 мл). мл) + ацетат натрия (215,5 мг / 100 мл) + хлорид натрия (112 мг / 100 мл) + треонин (115,5 мг / 100 мл) + триптофан (49,5 мг / 100 мл) + тирозин (11 мг / 100 мл) + Валин (159,5 мг / 100 мл) | Жидкость | Внутривенно | Clintec Nutrition Company | 1996-07-30 | 1998-08-13 | Канада | |
| 2.75% Травазол для инъекций аминокислоты с электролитами в 25% декстрозе Quickmix | Глицин (570 мг / 100 мл) + аланин (570 мг / 100 мл) + аргинин (285 мг / 100 мл) + декстроза в неуточненной форме (25 г / 100 мл) + калия фосфат (261 мг / 100 мл) + гистидин (120,5 мг / 100 мл) + изолейцин (131,5 мг / 100 мл) + L-лейцина гидрохлорид (170 мг / 100 мл) + лизина гидрохлорид (159 мг / 100 мл). 100 мл) + хлорид магния (51 мг / 100 мл) + метионин (159 мг / 100 мл) + фенилаланина гидрохлорид (170 мг / 100 мл) + пролин (115 мг / 100 мл) + ацетат натрия (215.5 мг / 100 мл) + хлорид натрия (112 мг / 100 мл) + треонин (115 мг / 100 мл) + триптофан (49,5 мг / 100 мл) + тирозин (11 мг / 100 мл) + валин (126 мг / 100 мл). мл) | Раствор | Внутривенно | Baxter Corporation Clintec Nutrition Division | 1996-02-02 | 2007-08-02 | Канада | |
| 2,75% Travasol Amino Acid Injection with Electrolites Quick in 5% Dextrose | Глицин (570 мг / 100 мл) + аланин (570 мг / 100 мл) + аргинин (285 мг / 100 мл) + декстроза в неуточненной форме (5 г / 100 мл) + дикалийфосфат (215.5 мг / 100 мл) + гистидин (120,5 мг / 100 мл) + изолейцин (131,5 мг / 100 мл) + L-лейцина гидрохлорид (170 мг / 100 мл) + лизина гидрохлорид (159 мг / 100 мл) + хлорид магния ( 51 мг / 100 мл) + метионин (159 мг / 100 мл) + фенилаланина гидрохлорид (170 мг / 100 мл) + пролин (115 мг / 100 мл) + ацетат натрия (256 мг / 100 мл) + хлорид натрия (112 мг. / 100 мл) + треонин (115 мг / 100 мл) + триптофан (49,5 мг / 100 мл) + тирозин (11 мг / 100 мл) + валин (126 мг / 100 мл) | Раствор | Внутривенно | Baxter Corporation Подразделение Clintec Nutrition | 1993-12-31 | 2007-08-02 | Канада | |
| 2.75% травазола Аминокислота InJ.W.eleC.W.5% dex. | Глицин (283 мг / 100 мл) + аланин (570 мг / 100 мл) + аргинин (316 мг / 100 мл) + декстроза в неуточненной форме (5 г / 100 мл) + дикалийфосфат (261 мг / 100 мл) + Гистидин (132 мг / 100 мл) + изолейцин (165 мг / 100 мл) + лейцин (201 мг / 100 мл) + лизин (159,5 мг / 100 мл) + хлорид магния (51 мг / 100 мл) + метионин (110 мг / 100 мл) + фенилаланин (154 мг / 100 мл) + пролин (187 мг / 100 мл) + серин (137,5 мг / 100 мл) + ацетат натрия (215 мг / 100 мл) + хлорид натрия (112 мг / 100 мл). мл) + треонин (115.5 мг / 100 мл) + триптофан (49,5 мг / 100 мл) + тирозин (11 мг / 100 мл) + валин (159,5 мг / 100 мл) | жидкость | внутривенно | Clintec Nutrition Company | 1996-12- 31 | 1999-08-10 | Канада | |
| 20% Просол | Глицин (2,06 г) + аланин (2,76 г) + аргинин (1,96 г) + аспарагиновая кислота (0,6 г) + D-метионин ( 0,76 г) + глутаминовая кислота (1,02 г) + гистидин (1,18 г) + изолейцин (1,08 г) + лейцин (1,08 г) + лизин (1.35 г) + метионин (0,76 г) + фенилаланин (1 г) + пролин (1,34 г) + серин (1,02 г) + треонин (0,98 г) + триптофан (0,32 г) + тирозин (0,05 г) + валин (1,44 г) ) | Жидкость | Внутривенно | Baxter Laboratories | 1996-10-09 | Неприменимо | Канада | |
| 4,25% аминокислота для инъекций без электролитов в 20% декстрозе Quickmix6 G 10057 | Раствор | Внутривенно | Baxter Корпорация Clintec Nutrition Division | 1995-12-31 | 2007-08-02 | Канада |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Глицин слюны является значимым предиктором ослабления образования полипов и микросреды опухоли фукоксантином у мышей AOM / DSS он оказывает химиопрофилактическое действие на моделях рака у мышей, однако механизмы, лежащие в основе этих эффектов, до конца не изучены.Таким образом, мы стремились изучить влияние Fx на микроокружение опухоли у мышей с моделью рака. Материалы и методы. Мы исследовали влияние Fx (30 мг / кг массы тела) на различные типы клеток в микроокружении опухоли модели доклинического колоректального рака α мыши и проанализировали слюну мышей в поисках предикторов химиопрофилактических эффектов рака. Результаты: введение Fx значительно уменьшило количество колоректальных полипов и имело тенденцию к уменьшению поражений толстой кишки по сравнению с необработанными контрольными мышами.Кроме того, введение Fx показало значительно меньшее количество стволовых клеток колоректального рака, таких как CD44
высокий / EpCAM высокий клеток, ассоциированные с раком фибробласты, подобные αSMA , высокие клеток, связанные с опухолью макрофаги-подобные и дендритные клетки-подобные. CD206 high клеток в 0,6, 0,5 и 0,6 раза, соответственно, по сравнению с необработанными контрольными мышами. Кроме того, лечение также показало значительно более низкие уровни глицина в слюне в 0,5 раза. Заключение: наши результаты предполагают, что глицин слюны может быть предиктором, отражающим химиопрофилактический эффект Fx у мышей.
Сокращения: AOM: азоксиметан, α-SMA: α-актин гладких мышц, BSA: бычий сывороточный альбумин, BW: масса тела, CAF: фибробласты, ассоциированные с раком, CCSC: стволовые клетки колоректального рака, Csps: колоносферы, DC : дендритные клетки, DSS: декстран сульфат натрия, DW: дистиллированная вода, EMT: эпителиально-мезенхимальный переход, Fx: фукоксантин, FxOH: фукоксантинол, TAM: опухолевые макрофаги, TME: микроокружение опухоли.
Морские бурые водоросли являются богатым источником полезных липидов, таких как высокополярные ксантофиллы, полиненасыщенные жирные кислоты и стерины, важных для здоровья человека (1, 2).Среди липидов бурых водорослей высокополярный ксантофилл, фукоксантин (Fx, рис. 1), широко присутствует в бурых водорослях, поскольку он играет важную роль в их фотосинтезе и фотозащите (3). Как показано на рисунке 1, этот ксантофилл имеет уникальную структуру, алленовую связь и 5,6-моноэпоксид. Морские бурые водоросли, такие как Undaria pinnatifida (вакамэ) и Hizikia fusiforme (хидзики), являются хорошими источниками Fx среди японских водорослевых продуктов (1, 4). Доказано, что даже в очень высоких дозах пероральное употребление Fx безопасно (5, 6).
Колоректальный рак (CRC) — это рак, от которого страдают многие люди во всем мире, и он является четвертой по частоте причиной смерти от новообразований (7). В настоящее время есть веские доказательства того, что потребление фруктов и овощей, богатых каротиноидами, связано с профилактикой CRC. Таким образом, было проведено множество профилактических испытаний каротиноидов с использованием каротиноидов, однако их влияние на CRC было решено как «ограниченное / неубедительное» (8). Насколько нам известно, нет никаких эпидемиологических исследований, оценивающих высокополярные ксантофиллы, такие как Fx, в профилактике CRC.Известно, что Fx обладает потенциалом профилактики рака на моделях рака у мышей (9-11). Наша группа и другие продемонстрировали, что Fx и его метаболит фукоксантинол (FxOH) подавляют рост раковых клеток в нескольких случаях (12-17), однако механизмы, лежащие в основе антиканцерогенных эффектов Fx и FxOH, остаются неясными.
Недавно стволовые клетки CRC (CCSC) были признаны наиболее важными мишенями для лечения рака. Самообновление, лекарственная устойчивость, метастазирование, образование сфер и опухолей являются основными характеристическими мультиплексирующими свойствами CCSC (18).Кроме того, некоторые из белков клеточной поверхности, CD44, CD133, CD166, EpCAM и LGR5, являются маркерами, связанными с этими характеристиками CCSC (19, 20). Среди этих клеток выявлены клетки, экспрессирующие CD44 + / EpCAM high , обладающие отличительной чертой CCSC-подобного фенотипа, такой как онкогенность (19). Таким образом, CCSC-подобные колоносферы (Csps), которые экспрессируют как CD44, так и EpCAM на высоких уровнях, считаются хорошей моделью для изучения CCSC. Эти колоносферы CD44 high / EpCAM high обладают CCSC-подобными свойствами, такими как образование сфероидов и онкогенность (21, 22).С другой стороны, на CCSC могут влиять микроокружение опухоли (TME), стромальные клетки, включая ассоциированные с раком фибробласты (CAF) и иммунные клетки, а также различные внеклеточные матрицы, которые в совокупности приводят к усилению прогрессирования опухоли и ее развития. метастаз (23-25). Несмотря на все это, в настоящее время доступно мало информации о влиянии Fx на TME.
Внутриклеточные аминокислоты и карбоновые кислоты используются для энергетического метаболизма, такого как гликолиз, глюконеогенез и синтез жирных кислот (26).Таким образом, белки, содержащие амино и карбоновые кислоты, могут использоваться в качестве прогностических индикаторов, отражающих статус соматического рака (27). Многие такие кандидаты в метаболиты были выделены из слюны, мочи, крови и тканей пациентов с CRC и животных (27-29). Среди этих биологических образцов слюна может быть наиболее многообещающей с точки зрения безопасности и легкости доступа. Недавно мы продемонстрировали, что глицин и / или янтарная кислота являются внутриклеточными индикаторами, которые могут предсказать распад сфер Csps после обработки FxOH (30).Более того, эти молекулы также полезны для прогнозирования момента времени развития опухоли у мышей с ксенотрансплантатом Csps при лечении Fx (31), однако необходимо дальнейшее подтверждение и исследование прогностических метаболитов, присутствующих в слюне, на дополнительных моделях рака. В настоящем исследовании мы исследовали подавляющий эффект Fx на TME при доклиническом состоянии рака на мышиной модели CRC. Кроме того, мы исследовали изменение профилей метаболитов в слюне мышей после обработки Fx.Мы предполагаем, что Fx можно использовать в качестве прогностического маркера, представляющего супрессию TME, и что глицин слюны может быть предиктором, представляющим химиопрофилактический эффект Fx у мышей.
Рисунок 1.
Структурная формула фукоксантина (Fx) (разработана с использованием ChemDraw Professional 15.1).
Материалы и методы
Химические вещества. Масло Fx (5 мас. / Об.%), Смешанное с комплексом пальмового масла (70 мас. / Об.%) С небольшой влажностью, белками, углеводами и натрием, было предоставлено Oryza Oil & Fat Chemical Co.Ltd. (Айти, Япония). Только пальмовое масло (75 мас. / Об.%) Получали в качестве контроля. Азоксиметан (AOM) (чистота ≥95%) и декстрансульфат натрия (DSS) (MB: 36 000-50 000) были получены от Wako Pure Chemicals (Осака, Япония) и MP Biomedicals (Солон, Огайо, США) соответственно. И гидрохлорид пилокарпина, и уретан были от Sigma-Aldrich (Сент-Луис, Миссури, США). CD44, конъюгированные с Alexa Fluor 488, и CD206, конъюгированные с антителами Alexa Fluor 594, были приобретены у BioLegend (Сан-Диего, Калифорния, США). EpCAM, конъюгированный с антителом APC, был получен от eBioscience (Сан-Диего, Калифорния, США).Антитело к актину гладких мышц (α-SMA) было приобретено в компании Cell Signaling Technology (Данверс, Массачусетс, США). Козий антикроличий IgG, конъюгированный с Alexa Fluor 488, и ProLong Gold Antifade, конъюгированный с 4 ’, 6-диамидино-2-фенилиндолом (DAPI), были от Invitrogen (Карлсбад, Калифорния, США). Все остальные химические вещества и растворители были аналитической чистоты от Wako Pure Chemicals (Осака, Япония).
Эксперименты на животных. Подробный протокол показан на рисунке 2A. Самцов мышей ICR приобретали в возрасте 5 недель в Sankyo Labo Service (Сидзуока, Япония).Все мыши были случайным образом разделены на пять групп (5 мышей на клетку, 10 мышей на группу) и содержались в 12-часовом цикле свет / темнота в помещении с контролируемой влажностью и температурой. Твердый корм (класс: MF, Oriental Yeast Co. Ltd.) и вода давали ad libitum до умерщвления (примерно через 10 недель). После недели акклиматизации мышам в группах 1, 2 и 3 вводили однократную внутрибрюшинную инъекцию АОМ (10 мг / кг массы тела). Группам 4 и 5 вводили только физиологический раствор (IP). Через неделю мыши в группах 1-3 получили 1.5 мас. / Об.% DSS в питьевой воде в течение 1 недели. Мышам в группах 4 и 5 в это время давали обычную воду. Мышам в группах 1, 2 и 4 давали масло Fx в дозе 30, 6 и 30 мг / кг, соответственно, с использованием желудочной иглы каждые 1 или 3 дня в течение последних 8 недель. Мышам в группах 3 и 5 давали эквивалентный объем пальмового масла. Мышей анестезировали с использованием уретана (1,0 г / кг, IP) в течение 20 минут и собирали их слюну (<500 мкл) в течение 20 минут после инъекции пилокарпина (5 мг / кг, SC) за 40 минут до умерщвления.Мышей умерщвляли путем ингаляции изофлурана. Затем толстую кишку каждой мыши вырезали, разрезали в продольном направлении и фиксировали в 10% формалине / PBS в течение по меньшей мере 48 часов. Количество и размер полипов на слизистой оболочке толстой кишки измеряли с помощью штангенциркуля микрометра. Размер полипа ( 3 мм) выражали по формуле a (мм) × b 2 (мм) / 2 (a, большой диапазон: b, короткий диапазон). Гистопатологические исследования были подтверждены на окрашенных гематоксилином и эозином срезах, изготовленных из залитых парафином блоков, приготовленных
компании Morphotechnology (Саппоро, Япония).Эксперименты проводились в соответствии с требованиями Институционального комитета по этике экспериментов на животных в области здравоохранения Университета Хоккайдо и Руководства по экспериментам на животных в области медицинских наук Университета Хоккайдо (32).
Рисунок 2.
Влияние фукоксантина на массу тела и количество колоректальных полипов у мышей AOM / DSS. (A) Протокол эксперимента с фукоксантином (Fx) на мышах AOM / DSS. Масло Fx (фукоксантин-5 ™) вводили в дозе 30 или 6 мг Fx / кг каждые 2-3 дня в течение 8 недель (черные стрелки).Контрольным группам с обработкой AOM / DSS или без нее давали эквивалентный объем (мкл) контрольного масла (без Fx). (B) Изменения массы тела со дня после приема DSS до дня окончательного введения Fx. (C) Число полипов. Среднее значение ± SE (n = 8-10). (*) p <0,05 по результатам однофакторного дисперсионного анализа с апостериорным критерием Тьюки-Крамера.
Флуоресцентная иммуногистохимия. Залитые парафином срезы слизистой оболочки толстой кишки мыши окрашивали для совместной локализации CD44 вместе с EpCAM или α-SMA вместе с CD206, используя иммунофлуоресценцию.Срезы депарафинизировали, и определение антигена выполняли с использованием 1 мМ буфера EDTA (pH 9,0) при 95 ° C в течение 20 мин. Затем срезы промывали дистиллированной водой, PBS и трис-буферным солевым раствором, содержащим 0,1% полиоксиэтилен (20) сорбитанмонолаурат (TBST), и затем блокировали в 5% растворе BSA / TBST при комнатной температуре в течение 1 часа. Для обнаружения CCSC-подобных клеток срезы (раздел-A) затем инкубировали с антителом против CD44, конъюгированным с Alexa Fluor 488, и антителом против EpCAM, конъюгированным с антителом APC в разведении 1:50 в 1% BSA / TBST в течение ночи при 4 ° C.Для обнаружения CAF, ТАМ и дендрических клеток (DC) -подобных клеток другие секции (секция-B) инкубировали с
Первичные антитела α-SMA, разведенные 1:50 в 1% BSA / TBST в течение ночи при 4 ° C, промыли TBST и затем инкубировали с козьим антикроличьим IgG, конъюгированным с Alexa Fluor 488 в разведении 1: 100 в PBST. в течение 1 часа при комнатной температуре и в темноте. Затем слайды раздела B зондировали анти-CD206, конъюгированным с антителом Alexa Fluor 594, в течение ночи при 4 ° C. Оба среза-A и -B были промыты TBST и PBS и окончательно окрашены реагентом ProLong Gold Antifade с DAPI.Иммунофлуоресцентную визуализацию выполняли с использованием конфокального микроскопа Nikon TE2000, оснащенного программным обеспечением EZ-C1 (Nikon, Мелвилл, Нью-Йорк, США). Количество клеток CD44 high / EpCAM high , α-SMA high и CD206 high оценивали на заданную площадь ткани ( 2 мм).
Рисунок 3.
Обнаружение стволовых клеток колоректального рака, подобных клеткам CD44 high / EpCAM high у мышей AOM / DSS с введением Fx или без него. Блокированный участок совместно зондировали с CD44, конъюгированным с Alexa Fluor 488, и EpCAM, конъюгированным с первичными антителами APC.Ткань окрашивали реагентом ProLong Gold Antifade, содержащим DAPI. Ядра (синяя флуоресценция), CD44 (зеленая флуоресценция) и EpCAM (красная флуоресценция) наблюдались с помощью конфокальной микроскопии. (A) Стрелки показывают клетки, обладающие высокой экспрессией CD44 и EpCAM: клетки CD44 high / EpCAM high . Длинные и короткие стержни 50 и 5 мкм соответственно. (B) Подсчитывали количество клеток CD44 high / EpCAM high на площадь ткани ( 2 мм) с помощью конфокальной микроскопии.Средние значения ± SE (n = 6). (*) p <0,05 по результатам однофакторного дисперсионного анализа с апостериорным критерием Тьюки-Крамера.
Газовая хроматография-масс-спектрометрия. Распределяли аликвоту собранной слюны 100 мкл и добавляли 0,05 мкг 2-изопропилмалевой кислоты (Sigma-Aldrich, Сент-Луис, Массачусетс, США) в качестве внутреннего стандарта. Водные компоненты экстрагировали 0,5 мл CH 3 OH / CHCl 3 / DW (2,5: 1: 1, об. / Об. / Об.), Центрифугировали при 16000 g в течение 5 мин и верхнюю фазу промывали 0,5. мл DW.Верхние экстракты сушили и затем дериватизировали с использованием гидрохлорида метоксиамина и N -метил- N (триметилсилил) трифторацетата. ГХ-МС проводили с использованием спектрометра GCMS-QP5000 (Shimadzu, Киото, Япония), оснащенного колонкой Rxi-5ms (30 м x 0,25 мм внутренний диаметр, толщина пленки: 0,25 мкм, RESTEK
Co. Ltd., GmbH, Бад-Хомбург, Германия). В образцы (1 мкл) вводили гелий (0,5 мл / мин) в качестве газа-носителя с соотношением долей 1: 3. Температурная программа колонки была следующей: i) 80 ° C в течение 2 минут, ii) 80-330 ° C в течение 4 минут и iii) 330 ° C в течение 8 минут.Температура источника ионов и границы раздела составляла 230 и 250 ° C соответственно. Идентификация низкомолекулярных метаболитов подтверждается сравнением их с аутентичными стандартами. Содержание метаболитов выражали в пикомолях (пмоль) на 100 мкл слюны.
Рисунок 4.
Обнаружение связанных с раком фибробластных клеток, таких как клетки αSMA high , и связанных с опухолью макрофагов и дендритных клеток, таких как клетки CD206 high , у мышей AOM / DSS с введением или без введения Fx.Ядра (синяя флуоресценция), α-SMA (зеленая флуоресценция) и CD206 (красная флуоресценция) наблюдались под конфокальным микроскопом. (A) Стрелки показывают клетки, обладающие высокой экспрессией αSMA (αSMA , высокие клетки , открытые стрелки) и CD206 (CD206 , высокие клетки , закрытые стрелки). Прутки 50 мкм. Под конфокальным микроскопом подсчитывали количество (B) клеток CD44 high / EpCAM high и (C) клеток CD206 high на площадь ткани ( 2 мм).Средние значения ± SE (n = 6). (*) p <0,05 по результатам однофакторного дисперсионного анализа с апостериорным критерием Тьюки-Крамера.
Статистический анализ. Все результаты выражены как среднее значение ± стандартная ошибка среднего. Значительные различия для множественных сравнительных тестов были выполнены с помощью однофакторного дисперсионного анализа с последующим апостериорным тестом Тьюки-Крамера . Различия считались статистически значимыми при p <0,05.
Результаты
Подавление образования колоректального полипа у мышей AOM / DSS с помощью Fx. Не наблюдалось различий в клинических признаках и приеме пищи при введении Fx мышам AOM / DSS с доклиническим раком в течение 8 недель. Не было значительных различий в массе тела мышей среди пяти групп в течение периода лечения Fx (рис. 2B). Интересно, что количество полипов у мышей, получавших Fx (группы 1 и 2), было значительно ниже по сравнению с полипами мышей в группе 3 ( p = 0,000021, p = 0,003832 соответственно) и было сопоставимо с количество полипов в группах 4 и 5: i) группа 1: 5.7 ± 0,4, ii) группа 2: 7,1 ± 0,6, iii группа 3, 1: 1,0 ± 1,1. iv) группа 4: 5,2 ± 0,6 и v) группа 5: 5,0 ± 0,7 полипов (рис. 2C). Никаких существенных различий в размере полипа между пятью группами не наблюдалось (Таблица I). Патологическое исследование показало, что частота и / или множественность язв слизистой оболочки, диспластических крипт, аденомы и аденокарциномы имели тенденцию быть ниже, когда Fx вводили в дозе 30 (группа 1) и / или 6 (группа 2) мг / кг по сравнению с контрольные мыши (группа 3) (таблица II).
Влияние Fx на клетки, подобные стволовым клеткам колоректального рака, у мышей AOM / DSS. Мы оценили количество CCSC-подобных клеток CD44 high / EpCAM high в криптах слизистой оболочки толстой кишки мышей AOM / DSS с помощью флуоресцентной иммуногистохимии (рис. 3A и B). CCSC-подобные клетки показали удивительно сильную флуоресценцию белков CD44 и EpCAM (CD44 высокий / EpCAM высокий ) в клетках крипт толстой кишки. Клетки CD44 high / EpCAM high в группе 1 были значительно ниже (0,6 раза, p = 0,001087) по сравнению с этими клетками у контрольных мышей AOM / DSS (группа 3) и с клетками из групп. 4 и 5.Значительная разница в количестве клеток CD44 high / EpCAM high наблюдалась между группами 1 и 2 ( p = 0,017064), но не было обнаружено между группами 2 и 3.
Влияние Fx на рак ассоциированные фибробласты, ассоциированные с опухолью макрофаги и подобные дендритным клеткам клетки у мышей AOM / DSS. Затем мы исследовали накопление CAF-подобных клеток α-SMA high и TAM- и DC-подобных клеток CD206 high в строме слизистой оболочки толстой кишки мышей AOM / DSS (рисунки 4A-C).CAF-подобные клетки показали чрезвычайно сильную флуоресценцию α-SMA (α-SMA , высокий ). Вокруг крипт толстой кишки наблюдались ассоциированные с воспалением опухоль макрофаги (ТАМ) или дендритные клетки (ДК) -подобные клетки с чрезвычайно сильной флуоресценцией белка CD206 (CD206 высокий ). Клетки α-SMA high и CD206 high существовали в области, окружающей крипт слизистой оболочки (фиг. 4A). Клетки α-SMA high в группах 1 и 2, обработанных Fx, были значительно ниже на 0.В 5 и 0,6 раза, соответственно, по сравнению с таковыми в группе 3 контрольных мышей AOM / DSS ( p = 0,000169, p = 0,000920, соответственно). Однако количество клеток α-SMA high в группах 1 и 2 было значительно выше по сравнению с клетками в группе 4 ( p = 0,000910, p = 0,000127, соответственно). Клетки CD206 high , обработанные 30 мг / кг FX в группе 1, были значительно уменьшены в 0,6 раза по сравнению с этими клетками в контрольных мышах AOM / DSS (группа 3) ( p = 0.010422), тогда как между группами 4 и 5 не было обнаружено различий в количестве клеток. Более того, значимая разница была
наблюдается между группами 2 и 4 ( p = 0,010799), но не между группами 2 и 3.
Таблица I.
Размер полипа мышей AOM / DSS с фукоксантином (Fx).
Изменения метаболитов в слюне мышей AOM / DSS под действием Fx. Количественные данные профилей метаболитов в слюне у мышей AOM / DSS, которым вводили Fx, были исследованы с помощью ГХ-МС (рис. 5). Из девяти обнаруженных метаболитов только глицин был значительно ниже у мышей из групп 1 и 2, получавших Fx, по сравнению с контрольными мышами группы 3 ( p = 0.020104, p = 0,043912 соответственно), тогда как он был на аналогичных уровнях для мышей в группах 4 и 5: i) группа 1: 39,3 ± 3,6, ii) группа 2: 43,4 ± 2,6, iii) группа 3: 76,0 ± 11,6, iv) группа 4: 52,4 ± 5,1, v) группа 5: 52,0 ± 9,3 пмоль.
Обсуждение
Наши результаты предполагают, что введение Fx подавляет образование полипов толстой кишки и TME у мышей AOM / DSS во время доклинического состояния рака. Кроме того, было обнаружено, что глицин является прогностическим индикатором, отражающим химиопрофилактическую эффективность Fx в этой модели рака у мышей.Это первый отчет, в котором предлагается индикатор слюны, связанный с ослаблением TME на моделях онкологических мышей, получавших Fx. В этом исследовании многие CCSC-подобные клетки CD44 high / EpCAM high развились в колоректальных криптах контрольных мышей AOM / DSS, которые не получали лечения (группа 3), но были значительно ниже в той же модели мышей, получавших 30 мг / кг Fx (группа 1).
Поскольку образование TME могло изменить прогрессирование онкогенеза, мы оценили, как лечение Fx может повлиять на количество CAF-, TAM- и DC-подобных клеток.Накапливающиеся данные продемонстрировали, что CAF в значительной степени состоят из элементов TME и способствуют стволу рака, росту опухоли, инвазии, метастазированию, эпителиально-мезенхимальному переходу (EMT), ангиогенезу, а также изменениям внеклеточного матрикса, опухолевого иммунитета и метаболома TME ( 33-35). CAF характеризуются высоким уровнем α-SMA, который характерен для фенотипа дифференцировки миофибробластов и считается прогностическим маркером CRC человека (36, 37). Мы обнаружили, что лечение Fx в обеих дозах 30 и 6 мг / кг было
сопровождается накоплением CAF-подобных клеток α-SMA high в строме слизистой оболочки соседних крипт толстой кишки в аналогичной степени.Другие группы ранее указали, что α-SMA-положительные CAF распространяются на соседнюю ткань CRC индуцированного AOM / DSS и / или в генетически модифицированных моделях рака у мышей по сравнению с контрольными мышами (38, 39). Нацеливание на клеточные компоненты CAFs может способствовать снижению развития опухоли и функции CCSC. Например, было показано, что IKKβ, потенциальный активатор про-онкогенной формы NF-B, происходит из CAF на моделях мышей с колоректальным раком (38). Было обнаружено, что пероральное введение регорафениба, ингибитора мультикиназы, ослабляет взаимодействие между клетками CRC человека KM125M и стромальными клетками (включая CAF) и ингибирует метастазирование клеток CRC, ангиогенез и лимфангиогенез у голых мышей (40).Как генетическое, так и фармакологическое ингибирование белка активации фибробластов (FAP), который может использоваться в качестве маркера CAF на клеточной поверхности, подавляло рост опухоли, полученной из клеток CT26 CRC мыши в модели мыши с аллогенной трансплантацией (41). Лечение аналогом ретиноевой кислоты витамина А, по-видимому, ингибирует миграцию и EMT клеток рака поджелудочной железы за счет низких уровней секретируемого IL-6 из CAF (42). Куркумин, фенол, содержащийся в куркуме, нарушает межклеточные взаимодействия CCSC-подобных Csps из клеток CRC человека HCT116 и нормальных фибробластных клеток MRC-5 человека, опосредованных подавлением TGF-β3, NFĸB, матричной металлопротеиназы-13, CCSC. маркеры клеточной поверхности и молекул, родственных ЕМТ (43).
Рисунок 5.
Влияние Fx на содержание метаболитов в слюне у мышей AOM / DSS. Слюну мышей собирали после инъекции пилокарпина под анестезией, и метаболиты анализировали с помощью ГХ-МС. Среднее ± стандартная ошибка (n = 6). (*) p <0,05 по результатам однофакторного дисперсионного анализа с апостериорным критерием Тьюки-Крамера.
Таблица II.
Частота (%) и множественность (количество поражений / толстой кишки) поражений толстой кишки. Все данные по множественности показаны как Среднее ± стандартная ошибка (n = 5).
В этом исследовании мы также обнаружили ТАМ- и ДК-подобные клетки, используя поверхностный маркер CD206 в слизистой оболочке толстой кишки мышей, который обычно сверхэкспрессируется в ТАМ и ДК (44, 45).ТАМ, тип макрофага с M2-фенотипом, и ДК являются ключевыми компонентами TME и способствуют инициированию рака, развитию опухоли, инвазии, воспалению, ангиогенезу, а также могут вызывать иммуносупрессию (24, 25, 44, 46). Инициирование и развитие CRC вызывается многими молекулярными регуляторами из TAMs и DCs через их хемокинов, цитокинов, модификаций внеклеточного матрикса (24, 25). В этом исследовании введение Fx, особенно в высокой дозе 30 мг / кг, оказало подавляющее действие на количество TAM- и DC-подобных клеток CD206 high , присутствующих в строме слизистой оболочки мышей.
Ограниченная молекулярная информация относительно ТАМ и ДК в настоящее время доступна для ТМЕ, обработанного Fx. Синтетическое производное ретиноида, фенретинид, подавляет поляризацию ТАМ, участвующую в прогрессии CRC, посредством ингибирования фосфорилирования STAT6 и, таким образом, предотвращает CRC у мышей Apc мин / + (47). Было обнаружено, что изоликвиритигенин, флавоноид из солодки, также подавляет развитие CRC у мышей AOM / DSS с ослаблением поляризации TAM, опосредующей подавление PGE2 и IL-6 (48).Наконец, инактивированные STAT3 ДК способствуют противоопухолевым иммунным ответам и подавляют рост опухоли в модели аллогенных мышей, которым вводили мышиные клетки CRC MC38, по сравнению с мышами, которым вводили контрольные ДК (49).
Показано, что многие метаболиты слюны, полученные от пациентов с раком полости рта, груди и поджелудочной железы, намного выше по сравнению со здоровыми людьми (50), однако на сегодняшний день существует мало доказательств роли этих метаболитов, выделенных из слюны рака. модели. Наши предыдущие исследования показывают, что низкие уровни глицина в опухоли и высокие уровни глицина, глутаминовой кислоты и янтарной кислоты в слюне могут быть индикаторами метаболитов, предсказывающими задержку начала опухоли у мышей с ксенотрансплантатом Csps, получавших Fx (31 ).В настоящем исследовании только глицин из девяти метаболитов, идентифицированных в слюне мышей AOM / DSS, был значительно ниже, когда мышей лечили Fx. Таким образом, глицин слюны может быть кандидатом в маркеры, указывающие на химиопрофилактическую эффективность Fx. Возможно, что наблюдаемые изменения метаболитов слюны могут быть связаны с дозой и продолжительностью введения Fx, методом отбора проб слюны, штаммом мышей и моделью рака.
Таким образом, мы обнаружили, что Fx значительно подавляет количество колоректальных полипов и образование TME, что оценивается по разному количеству CCSCs-, CAFs-, TAMs- и DCs-подобных клеток у мышей AOM / DSS при раке. доклиническое состояние, с лечением Fx или без него, наряду с низким уровнем глицина в слюне.Наши результаты предполагают, что глицин слюны может быть предиктором, связанным с химиопрофилактической эффективностью Fx в этой модели рака. Необходимы дальнейшие исследования, чтобы подтвердить диагностическую полезность глицина слюны и, возможно, других подобных метаболитов для химиопрофилактики рака на дополнительных моделях онкологических животных после лечения Fx
Благодарности
Эта работа была частично поддержана Японским обществом содействия науке KAKENHI (№ 16K07880).
Сноски
Вклад авторов
M.Терасаки задумал и разработал исследование. М. Терасаки, С. Масака, К. Фукада, М. Хузаки и Т. Танака проводили эксперименты. М. Терасаки и М. Муто написали статью. Т. Эндо, Х. Маэда и К. Мияшита рецензировали отредактированную рукопись. Все авторы прочитали и одобрили рукопись и соглашаются нести ответственность за все аспекты исследования, гарантируя, что точность или целостность любой части работы будут надлежащим образом исследованы и решены.
Эта статья находится в свободном доступе в Интернете.
Конфликт интересов
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
- Получено 15 декабря 2018 г.
- Исправление получено 11 января 2018 г.
- Принято 18 января 2019 г.
- Copyright © 2019, Международный институт противораковых исследований (д-р Джордж Дж. Делинасиос), Все права защищены
Frontiers | Глицин-гистидин-лизин (GHK) облегчает повреждение астроцитов внутримозговым кровоизлиянием через путь Akt / miR-146a-3p / AQP4
Введение
Инсульт — ведущая причина инвалидности и смертности во всем мире.На внутримозговое кровоизлияние (ICH) приходится 15–20% всех случаев инсульта, с самой высокой смертностью среди всех подтипов инсульта, что приводит к серьезному социальному бремени (Huang et al., 2019; Lo and Teitelbaum, 2020). При ICH первоначальное повреждение в результате разрыва сосудов и сдавливания расширяющейся гематомы в основном сопровождается вторичным повреждением, которое включает цитотоксичность гемоглобина, активацию микроглии и инфильтрацию воспалительных клеток в перигематомной области (Yang et al., 2020). Сопутствующие эффекты этих событий проявляются в массивном апоптозе нейронов, вызывающем уничижительное и стойкое повреждение мозга после ICH (Mohammed Thangameeran et al., 2020). Однако, в отличие от ишемического инсульта, нет эффективного лечения ВЧГ. В этом отношении необходим эффективный и новый агент для предотвращения гибели нейронов после ICH.
Апоптоз нейронов, возникающий при ICH, является основной причиной плохого прогноза после повреждения ICH (Zille et al., 2017). Как видный тип клеток в головном мозге, астроциты играют важную роль после травм головного мозга (Clarke and Barres, 2013). Несколько исследований по защите нейронов путем манипулирования астроцитами оказались эффективными, и недавно был проведен обзор роли астроцитов как нейропротекторного и усугубляющего повреждения при ВЧГ (Barreto et al., 2011; Мин и др., 2015). Причина, по которой астроциты используются в качестве терапевтических мишеней, заключается в том, что нейроны не могут выжить независимо от астроцитов (Bylicky et al., 2018). Более того, жизнеспособность астроцитов сохраняется сильнее, чем нейронов при инсульте. В связи с этим нацеливание на выжившие астроциты дает неоценимую возможность восстановить функцию нейронов и кровеносных сосудов в процессе ICH (Liu and Chopp, 2016). Однако взрывное набухание астроцита способствует его дисфункции и помогает аквапоринам (Thomas et al., 2004; Qiu et al., 2015). Как член аквапоринов, аквапорин 4 (AQP4) в изобилии присутствует в процессах астроцитов и отвечает за отек мозга (Chu et al., 2016). Накапливающиеся данные показали, что ингибирование экспрессии AQP4 может улучшить восстановление неврологической функции против апоптоза нейронов и воспалительной реакции, одновременно облегчая отек мозга (Tang and Yang, 2016). Однако ингибиторы AQP4 не определены. Следовательно, важно изучить агент, который мог бы эффективно регулировать AQP4.
Глицил-1-гистидил-1-лизин (GHK) представляет собой разновидность человеческого трипептида, состоящего из GHK. Впервые он был выделен Пикартом в 1973 году и встречается в естественных условиях в плазме, слюне и моче. Последующие исследования показали, что GHK и его хелатированная медь (II) форма (GHK-Cu) улучшают процесс регенерации, обладают противовоспалительным и антиоксидантным действием (Pickart, 2008; Pickart et al., 2015). Кроме того, было доказано, что он является вероятным пептидом для лечения хронической обструктивной болезни легких, ослабления кожного воспаления и ингибирования метастатического рака толстой кишки (Gruchlik et al., 2012; Майнерс и Эйкельберг, 2012; Пикарт и др., 2012). Кроме того, исследования показали, что GHK усиливает секрецию трофических факторов мезенхимальных стволовых клеток и оказывает нейропротекторное действие против нейродегенеративных заболеваний, подавляя воспаление, уменьшая окислительное повреждение и даже модулируя уровни железа (Miller et al., 1990; Jose et al., 2014) ). Наше предыдущее исследование показало, что GHK может облегчить повреждение нейронов с помощью VEGFA (Zhang H. et al., 2018). Однако влияние и механизм GHK на вторичное повреждение ICH, которое связано с глиальными клетками, не определено и требует дальнейшего изучения.
В этом исследовании мы изучили потенциальную роль GHK в моделях крыс ICH. Мы обнаружили, что различные концентрации GHK могут улучшить восстановление неврологической функции крыс, в то же время уменьшая отек мозга, реакцию воспаления и снижая уровень AQP4 через miR-146a-3p после ICH. Кроме того, путь фосфатидилинозитол-3-киназы (PI3K) / AKT участвует в лечении GHK при ICH. Эти результаты обеспечивают новый терапевтический подход к ICH.
Материалы и методы
Животные
Взрослых крыс-самцов линии Вистар (от 250 до 280 г) были приобретены у Changsheng Biotechnology Co., Ltd. Крыс тщательно содержали в помещении с контролируемой средой (22–25 ° C, влажность 50%) при 12-часовом дневном ритме. Пищу и воду можно было получить ad libitum .
Сто двадцать крыс были случайным образом разделены на пять групп: (1) Имитационная группа, 24 крысы прошли те же хирургические процедуры, что и крысы в контрольной группе, без инъекции коллагеназы VII. (2) Контрольная группа, 24 крысы подверглись индуцированной коллагеназой VII ICH и внутрибрюшинно вводили носители (т.е.p.), когда группам лечения вводили GHK. (3) GHK с чистотой 95% был приобретен у Chinapeptids Biotechnology Co., Ltd. (Zhou et al., 2017). Группы GHK (GHK 1 мкг / г, GHK 5 мкг / г и GHK 10 мкг / г), крысам в этих группах вводили GHK после введения коллагеназы VII. Двадцать четыре крысы в каждой группе были случайным образом разделены на четыре группы исследователем, который не знал о неврологических нарушениях у этих крыс. Шесть крыс были обезглавлены, чтобы получить образцы свежей мозговой ткани на содержание воды.Шесть крыс перфузировали фиксатором для гистологической подготовки и анализа мозга. Шесть крыс использовали для оценки неврологического дефицита до 7 дней после ICH. Шесть крыс были анестезированы внутрибрюшинной инъекцией 2% пентобарбитала внутрибрюшинно. Перед обезглавливанием им вводили 300 мл физиологического раствора для перфузии сердца. Был сделан коронарный разрез с отверстием в центре. Носовую сторону тканей перигематомы в базальных ганглиях, которые были подготовлены для биохимических анализов, помещали в жидкий азот на 30 минут перед хранением при -80 ° C в безферментных пробирках (Pei et al., 2016). Все данные были собраны и проанализированы исследователем, который не работал с группами.
Внутримозговое кровоизлияние, индуцированное коллагеназой VII Модель
Внутримозговое кровоизлияние вызывали стереотаксическим введением 0,25 Ед / мкл бактериальной коллагеназы типа VII (Sigma, США), как описано Розенбергом (Rosenberg et al., 1990). Крысам в группе лечения GHK внутрибрюшинно вводили GHK каждые 24 часа, растворенного в физиологическом растворе, в течение 3 дней после введения ICH, в то время как крысам в контрольной группе вводили равные объемы носителя.
Содержание воды в мозге
крыс были анестезированы, и мозг был взят через 3 дня после ICH. Влажный вес каждого образца сразу измеряли электронными весами, после чего мозг сушили при 100 ° C в течение 24 часов, чтобы получить сухой вес. Содержание воды рассчитывали по следующей формуле: [(влажный вес — сухой вес) / (влажный вес) × 100 (%)] (Lee et al., 2008).
Оценка неврологического дефицита
Неврологический дефицит оценивался по пятибалльной шкале, установленной Rosenberg et al.(1990). Степень кружения крыс оценивалась от 0 (кружение отсутствует) до 4 (всегда в кружке) через 3 и 7 дней после индукции ICH.
Иммуногистохимия и окрашивание по Нисслю
Иммуногистохимические эксперименты проводили с использованием набора для иммуногистохимии UltraSensitiveTM SP (мышь / кролик) (Mixim, Fu Zhou, Китай), следуя инструкциям производителя. Образцы фиксировали в течение 24 ч 4% параформальдегидом и обезвоживали 70–100% спиртом. Залитый в парафин мозг разрезали на срезы 5 мкм.Срезы подвергали извлечению антигена в условиях высокой температуры и давления, после чего их обрабатывали эндогенными блокаторами пероксидазы и затем блокировали в сыворотке в течение часа. Срезы инкубировали с антителом AQP4 1: 200 в течение ночи. Затем срезы инкубировали со вторичными антителами (козлиные антикроличьи), промывали фосфатно-солевым буфером (PBS), окрашивали DAB и окрашивали гематоксилином и эозином (H&E), дегидратировали, подвергали прозрачной обработке и устанавливали перед микроскопическим анализом.Мы случайным образом выбрали 5 полей зрения на носовой стороне перигематомы в базальных ганглиях, положительные клетки были обнаружены и проанализированы с помощью программного обеспечения ImageJ. Для окрашивания по Нисслю срезы подвергали воздействию ацетата крезил фиолетового в течение 15 мин при 23–25 ° C, промывали в PBS, дегидратировали, подвергали прозрачности и монтировали перед микроскопическим анализом.
Иммунофлуоресцентное окрашивание
Образцы фиксировали 4% параформальдегидом в течение 24 ч и обезвоживали 10–30% раствором сахарозы. Мозг, залитый ОКТ, разрезали на срезы размером 10 мкм, срезы промывали трижды PBS, блокировали в течение 1 часа 8% бычьим сывороточным альбумином (BSA), растворенным в 0.01 M фосфатный буфер (PB), содержащий 0,5% Triton-X100. Затем инкубировали при 4 ° C в течение ночи с антиглиальным фибриллярно-кислотным белком (GFAP) (технология передачи сигналов клеток, 80788), разведенным 1: 100 в 0,01 M PB, содержащем 1% BSA и 0,1% Triton-X100. После промывки PBS все срезы инкубировали при комнатной температуре в течение 2 ч с IgG козьего антикроличьего (Thermo Fisher Scientific, Alexa Fluor 488), разведенным 1: 200 в 0,01 M PB, содержащем 1% BSA и 0,3% Triton-X100. Ядра окрашивали 200 нМ 4,6-диамидино-2-фенилиндолом (DAPI) в течение 5 мин.Срезы просматривали с помощью флуоресцентного микроскопа.
Клеточная культура и
in vitro Модель геморрагической токсичности
Астроцитов и клеток 293T (Китайская академия наук, Шанхай) культивировали в среде Игла, модифицированной Дульбекко (DMEM) (Gibco, UA) с добавлением 10% фетальной телячьей сыворотки (Gibco, Австралия), после чего инкубировали при 100% влажности в среда, содержащая 5% CO 2 . Чтобы имитировать токсичность кровоизлияния in vitro , модель была сконструирована путем нанесения 100 мкМ гемина на астроциты (Huang et al., 2002; Zille et al., 2017).
Олигонуклеотиды синтетической РНК и трансфекция
Мы приобрели миметики miRNA-146a-3p, ингибиторы miRNA-146a-3p и несмысловую последовательность для использования в качестве отрицательного контроля miRNA (NC) в компании Genepharma (Шанхай, Китай) (дополнительная таблица 2). Астроциты трансфицировали липофектамином 2000 (Invitrogen, США) в соответствии с инструкциями производителя.
Экстракция РНК и количественная полимеразная цепная реакция с обратной транскрипцией (qRT-PCR)
Суммарную РНК
экстрагировали из клеточных и церебральных образцов с использованием реагента TRIzol (Invitrogen, Carlsbad, CA, США).Обратную транскрипцию miRNA выполняли с использованием набора для количественной оценки miRNA Hairpin-it qPCR (GenePharma, Шанхай, Китай) в соответствии с протоколом производителя. Система T ABI 7500 (Thermo Fisher Scientific, Карлсбад, Калифорния, США) использовалась для ПЦР в реальном времени. Относительная экспрессия miRNA каждого гена была нормализована к экспрессии U6 RNA. Праймеры были синтезированы Sangon Biotech (Шанхай). Все последовательности праймеров перечислены в дополнительной таблице 1.
Вестерн-блот анализ
Клеточные и церебральные образцы лизировали в RIPA (Beyotime, Китай), содержащем коктейль ингибиторов (Roche, Германия), в течение 20 мин, после чего лизаты центрифугировали (12000 × g) при 4 ° C в течение 15 мин.Концентрацию белка определяли с помощью набора BCA Protein Kit (Thermo, Rockford, IL, США). Образцы лизатов разделяли с помощью электрофореза в 4–14% додецилсульфат-полиакриламидном геле (SDS-PAGE), после чего белки переносили на мембраны из поливинилидендифторида (PVDF). Затем мембраны инкубировали в 1% растворе бычьего сывороточного альбумина (BSA) со следующими первичными антителами в течение ночи при 4 ° C: анти-AQP4 (Abcam, ab18956), анти-MMP2 (Abcam, ab37150), анти-MMP9 (Abcam, ab38898), антитела против TIMP1 (Abcam, ab109125) и против бета-актина (Abcam, ab8227).Затем мембраны инкубировали со вторичным антителом в течение 1 ч при комнатной температуре. Мы проанализировали относительные плотности сигналов с помощью программного обеспечения ImageJ, и плотность β-актина использовалась в качестве внутреннего контроля.
Cell Counting Kit-8 (CCK-8) Анализ жизнеспособности клеток и пролиферации клеток
Жизнеспособность клеток
определяли с использованием раствора CCK-8 (Beyotime, Китай) в соответствии с инструкциями производителя. Приблизительно 5 × 10 3 клеток высевали в каждую лунку 96-луночного планшета в течение ночи, после чего на клетки наносили гемин в течение 18 часов, одновременно в культуральную среду добавляли GHK.Обнаружение пролиферации клеток выполнялось в соответствии с инструкциями производителя. Вкратце, 2 × 10 3 клеток высевали в каждую лунку 96-луночного планшета на 4 часа, затем добавляли GHK, и на этот раз, известное как 0 часов, и клетки культивировали в течение 24 и 48 часов для обнаружения пролиферация клеток. Всего в каждую лунку добавляли 10 мкл раствора CCK-8, и клетки инкубировали в течение 1 ч в инкубаторе. Оптическую плотность каждой лунки количественно определяли при 450 нм с использованием автоматического ридера для ELISA (SpectraMax ® M5, Molecular Devices, США).Жизнеспособность клеток рассчитывали следующим образом: (A450 экспериментальных лунок / A450 нормальных лунок) × 100%.
Анализ цитотоксичности лактатдегидрогеназы (ЛДГ)
Цитотоксичность определяли с использованием набора для анализа LDH (Beyotime, Китай) в соответствии с инструкциями производителя. После нанесения гемина в течение 18 часов супернатант собирали и переносили в 96-луночные планшеты для определения высвобождения ЛДГ. Оптическую плотность каждого образца измеряли при 490 нм с использованием автоматического ридера для ELISA (SpectraMax ® M5, Molecular Devices, США).Процент цитотоксичности рассчитывали следующим образом: (A490 экспериментальной культуральной среды — A490 нормальной среды) / (A490 максимального высвобождения LDH — A490 нормальных лунок) × 100%.
Измерение TNF-α и IL-1β с помощью ELISA
Уровни TNF-α и IL-1β в перигематоме определяли с использованием наборов ELISA (USCN Life Science Inc., Ухань, Китай) в соответствии с инструкциями производителя. Оптическую плотность каждого образца определяли количественно при 450 нм с использованием автоматического ридера ELISA (SpectraMax ® M5, Molecular Devices, США).
Двойной люциферазный анализ
Экспрессионные векторы-мишени pmirGLO Dual-Luciferase miRNA были сконструированы Genepharma (Шанхай, Китай). 1 × 10 4 клеток 293T высевали в каждую лунку 24-луночного планшета в течение ночи, после чего их котрансфицировали диким типом и мутантными плазмидами промотор-люцифераза AQP4 (0,1 мкг на лунку) и 0,4 мкг miR- 146a-3p имитирует или NC с использованием Lipofectamine 2000 (Invitrogen, США). PmirGLO-wt-AQP4 и pmirGLO-mt-AQP4 были приобретены в компании Genepharma. Эффективность трансфекции стандартизировали на основе активности TK.Люциферазную активность определяли количественно с использованием системы двойного люциферазного анализа (Promega, E1910).
Статистический анализ
Каждый анализ был повторен независимо, по крайней мере, три раза, чтобы гарантировать надежность этого исследования, и данные измерений выражены как среднее значение ± стандартное отклонение. Мы также выполнили предварительный анализ мощности с использованием программного обеспечения G ∗ Power 3.1.9.2 с уровнем значимости 5% и уровнем мощности> 0,9, чтобы гарантировать, что мы использовали адекватное количество животных в группе.Все данные были проанализированы с использованием программного обеспечения SPSS 23.0 (IBM Corp., Armonk) и Graphpad Prism 5.0 (GraphPad Software). Сравнения между несколькими группами проводились с использованием однофакторного дисперсионного анализа с последующим тестом Бонферрони или SNK. Поведенческие данные анализировали с использованием теста Краскела – Уоллиса с тестом Данна для множественных сравнений. Коэффициенты корреляции анализировали методом корреляции Пирсона. Демаркация статистической значимости была установлена на уровне p <0,05.
Результаты
GHK облегчил неврологический дефицит и повысил выживаемость нейронов после ICH
Чтобы исследовать потенциальную роль GHK после ICH, мы изолировали мозг крысы через 3 дня после ICH.Мы измерили содержание воды в мозге и количество интактных нейронов у разных групп крыс. Неврологический дефицит выявлен через 3 и 7 дней после ВЧГ. Наши результаты показали, что GHK значительно снизил содержание воды в головном мозге (рис. 1A) и облегчил неврологический дефицит у крыс ICH (рис. 1B). Количество выживших нейронов было значительно увеличено у крыс, получавших GHK, по сравнению с результатами, наблюдаемыми у контрольных крыс (Фигуры 1C, D).
Рисунок 1. GHK облегчил неврологическое повреждение и апоптоз нейронов после внутримозгового кровоизлияния (ICH). (A) Доставка GHK внутрибрюшинным путем снижает содержание воды в головном мозге через 72 часа после ICH. (B) Анализ неврологического дефицита показал, что лечение как 5 мкг / г, так и 10 мкг / г GHK облегчало неврологическое восстановление через 3 и 7 дней после ICH. (C) Окрашивание по Нисслю in vivo . Срезы парафина (5 мкм) из контрольной группы и группы GHK окрашивали ацетатом крезилового фиолетового. (стрелки указывают на неповрежденные нейроны). (D) Номер интактного нейрона.( n = 6. # p <0,05 по сравнению с фиктивным; * p <0,05 по сравнению с контролем; ** p <0,01 по сравнению с контролем, ## p <0,01 vs обман).
GHK уменьшает воспаление и дисбаланс металлопротеиназы / анти-металлопротеиназы в ICH
Чтобы исследовать эффект GHK после ICH, мы оценили уровень TNF-α и IL-1β в образцах головного мозга ICH с помощью ELISA (рисунки 2A, B). Экспрессию MMP2, MMP2, TIMP1 определяли с помощью вестерн-блоттинга (Рисунки 2C – E).Результат показал, что GHK значительно снижает экспрессию TNF-α и IL-1β, которые являются решающими факторами в воспалении ICH. Кроме того, экспрессия MMP2 и MMP9 подавлялась, тогда как экспрессия TIMP1 увеличивалась. Эти данные продемонстрировали, что GHK может облегчить воспаление и обратить вспять дисбаланс металлопротеиназа / антиметаллопротеиназа после ICH. Однако активация металлопротеаз связана с повреждением астроцитов при ICH.
Рисунок 2. GHK уменьшил воспаление и дисбаланс металлопротеиназы / антиметаллопротеиназы при ICH. (A) Уровень экспрессии TNF-α. (B) Уровень экспрессии IL-1β. (C – E) Экспрессия MMP2, MMP9 и TIMP1 в разных группах крыс. ( n = 6. # p <0,05 по сравнению с фиктивным; * p <0,05 по сравнению с контролем; ** p <0,01 по сравнению с контролем).
GHK облегчает повреждение астроцитов вследствие ICH и подавления экспрессии AQP4
Астроциты являются основными глиальными клетками мозга и отвечают за поддержание гомеостаза мозга.Чтобы исследовать влияние GHK на астроциты после ICH, мы оценили жизнеспособность клеток и пролиферацию in vitro с помощью CCK-8 (рисунки 3A, C), цитотоксичность по лактатдегидрогеназе (LDH) (рисунок 3B). Мы также обнаружили активацию астроцитов вокруг гематомы, экспрессию GFAP без существенной разницы (дополнительный рисунок 2). Результаты показали, что GHK значительно увеличивает выживаемость астроцитов, но не имеет существенной разницы в пролиферации. Кроме того, мы обнаружили экспрессию AQP4 с помощью иммуногистохимии (Фигуры 4A, B) и вестерн-блоттинга (Фигуры 4C, D).Результаты определили, что уровень AQP4 снизился после увеличения концентрации GHK.
Рисунок 3. GHK улучшил выживаемость астроцитов. (A) GHK увеличивал жизнеспособность астроцитов дозозависимым образом. (B) GHK снижает цитотоксичность астроцита. (C) GHK существенно не способствовал пролиферации астроцитов. (Для повторных измерений использовался односторонний дисперсионный анализ. Данные представлены как среднее ± стандартное отклонение, n = 3.* p <0,05 по сравнению с контролем; ** p <0,01 по сравнению с контролем; ▲▲ p <0,05 по сравнению с GHK 5 мкМ).
Фигура 4. GHK подавлял экспрессию AQP4. (A) Иммуногистохимический анализ экспрессии AQP4. Срезы парафина (5 мкм) из контрольной группы и группы GHK окрашивали AQP4. (B) Количественная оценка AQP4-положительных клеток ( n = 6. # p <0,05 vs.притворство; * p <0,05 по сравнению с контролем; ** p <0,01 по сравнению с контролем). (C) Анализ вестерн-блоттинга , иллюстрирующий влияние GHK на экспрессию AQP4 в перигематомной ткани крыс ( n = 6. # p <0,05 по сравнению с имитацией; * p <0,05 по сравнению с контролем; * * p <0,01 по сравнению с контролем). (D) Экспрессия AQP4 в астроцитах при геминостимуляции. (Для повторных измерений использовался односторонний дисперсионный анализ. Данные представлены как среднее ± стандартное отклонение, n = 3.* p <0,05 по сравнению с контролем; ** p <0,01 по сравнению с контролем; ▲ p <0,05 по сравнению с GHK 5 мкм).
AQP4 был функциональным геном-мишенью miRNA-146a-3p
Чтобы исследовать причину снижения AQP4 после лечения GHK, мы прогнозировали потенциальные целевые микроРНК (miRNA) AQP4 (дополнительная таблица 1) и получили элементы пересечения с miRNA, подавляемые у пациентов с ICH (Zhu et al., 2015; Рисунок 5A). ). Затем мы обнаружили экспрессию miR-146-3p в астроцитах с помощью ПЦР в реальном времени.Результат продемонстрировал, что miR-146a-3p значительно усиливается после лечения GHK (Фигуры 5B, C). Чтобы подтвердить предсказание, мы нашли область связывания miR-146a-3p и AQP4 (рис. 5F) и трансфицировали miR-146a-3p в астроциты. Перед экспериментом уровень экспрессии определяли с помощью ПЦР в реальном времени (рис. 5D). Мы обнаружили, что экспрессия miR-146a-3p обнаруживает полностью противоположную тенденцию к экспрессии AQP4 (рис. 5E). Кроме того, для выявления взаимодействия miR-146a-3p с мРНК AQP4 использовали двойные люциферазные анализы.Значительное снижение относительной активности люциферазы наблюдалось в группе miR-146a-3p + pGLO-wt-AQP4 по сравнению с другими группами ( p <0,05) (рис. 5G).
Фигура 5. AQP4 был функциональным геном-мишенью miR-146a-3p. (A) Пересечение потенциальных miRNAs AQP4 и miRNA, подавляющая регуляцию у пациентов с ICH. (B) Уровень miR-146a-3p в перигематомальной ткани крыс ICH, обработанной GHK, с разной концентрацией, по сравнению с контрольными значениями ( n = 6, ** p <0.01 в сравнении с контролем). (C) Анализ RT-qPCR для miR-146a-3p в астроцитах при геминостимуляции по сравнению с контрольной группой ( n = 3, ** p <0,01). (D) Уровень экспрессии miR-146a-3p после трансфекции миметиков, ингибитора и NC ( n = 3, * p <0,05, ** p <0,01). (E) Экспрессия AQP4 после трансфекции миметиков miR-146a-3p, ингибитора и NC. (F) Сайты связывания для miR-146a-3p и AQP4. (G) Уровни активности люциферазы в клетках 293T, котрансфицированных miR-146a-3p и AQP4. * р <0,05.
GHK увеличивает уровни miR-146a-3p через путь PI3K / Akt, а ингибитор miR-146a-3p обращает GHK-индуцированное уменьшение AQP4 в астроцитах.
Предыдущие исследования показали, что путь PI3K / Akt играет важную роль в повреждении ICH . Cui et al. (2015, 2017) показали, что активация пути PI3K / Akt оказывает защитное действие на ICH.Кроме того, некоторые исследователи продемонстрировали ингибирование PI3Kleaded до дозозависимого подавления экспрессии зрелой miR-146a (Jiang, 2014). Чтобы изучить путь, по которому GHK увеличивают уровни miR-146a-3p, различные концентрации ингибитора PI3K / Akt добавляли в среду астроцитов, которые стимулировали одновременно 10 мкМ GHK (фиг. 6A). Мы обнаружили, что различные концентрации ингибитора PI3K LY294002 и ингибитора Akt MK-2206 2HCL подавляли повышающую регуляцию уровней miR-146a-3p, индуцированную GHK, в зависимости от концентрации (Фигуры 6B, C).Более того, ингибиторы miR-146a-3p могут обратить подавление AQP4 (рис. 6D). Эти результаты показали, что GHK снижает экспрессию AQP4 через miR-146a-3p через путь PI3K / Akt (фиг. 7).
Фигура 6. GHK увеличивает уровни miR-146a-3p посредством пути PI3K / Akt, а ингибирование miR-146a-3p обращает вспять уменьшение AQP4, индуцированное GHK в астроцитах. (A) Экспрессия p-Akt и Akt в астроцитах с различной концентрацией GHK ( n = 3, * p <0.05, ** р <0,01). (B, C) Экспрессия miR-146a-3p в астроцитах с ингибитором PI3K LY294002 и ингибитором Akt MK-2206 2HCL одновременно инкубировали с 10 мкМ GHK ( n = 3. * p <0,05 по сравнению с GHK . Анализ с использованием ImageJ). (D) Уровни белка AQP4 в астроцитах, обработанных GHK и miR-146a-3p NC или ингибитором. ( n = 3, * p <0,05. Анализ с использованием ImageJ).
Рисунок 7. Сводная модель подавления AQP4, индуцированного GHK через Akt / miR-146a-3p / AQP4 в астроцитах.
Обсуждение
GHK, человеческий трипептид, природный и нетоксичный, проявляет необычные противовоспалительные и нейропротекторные эффекты при остром повреждении легких (Pickart et al., 2014; Park et al., 2016) и нейродегенеративных заболеваниях (Pickart et al. , 2012, 2017). В нашем исследовании GHK защищал от повреждения ICH, уменьшая отек мозга и способствуя выживанию нейронов.Неожиданно мы обнаружили, что внутрибрюшинное введение в дозе 10 мкг / г значительно облегчило неврологический дефицит до 7 дней после ICH, что предполагает, что доза 10 мкг / г также может играть роль в подострой фазе после ICH. Эти данные предоставили дополнительные доказательства того, что GHK может быть доступным агентом для терапии ICH. Наши результаты продемонстрировали новое понимание потенциальной роли вторичной травмы GHK ICH.
Внутримозговое кровоизлияние в основном является результатом вторичного повреждения после образования гематомы, включая цитотоксичность гемоглобина и взрывную воспалительную реакцию, что в основном привело к отеку мозга и гибели нейронов (Shi et al., 2012; Zhang et al., 2014). Следовательно, своевременный контроль цитотоксического отека может способствовать облегчению геморрагического повреждения. Мы наблюдали, что GHK значительно облегчил отек мозга, неврологический дефицит, улучшил выживаемость нейронов и снизил уровень TNF-α и IL-1β. Кроме того, мы обнаружили, что GHK синхронно устраняет дисбаланс матричной металлопротеиназы (MMP). Согласно предыдущему исследованию, уровень матриксной металлопротеиназы четко оценивался после ICH, и активация MMP9 в астроцитах усиливала ICH (Lattanzi et al., 2020). Мы полагаем, что GHK может быть эффективным агентом для ICH, воздействуя на астроциты.
Накапливающиеся данные показали, что астроциты играют различные гомеостатические роли в головном мозге (Sofroniew and Vinters, 2010; Sticozzi et al., 2013). Активность астроцитов — важная основа для выживания нейронов при повреждении головного мозга (Ouyang et al., 2014). Помимо создания гематоэнцефалического барьера и секретирования нейротрофических факторов, астроциты также ответственны за отек мозга и воспалительную реакцию после ICH (Chen-Roetling et al., 2015). В этом исследовании мы обнаружили, что GHK может повысить жизнеспособность и снизить цитотоксичность астроцитов. Эти результаты показали, что GHK значительно облегчил повреждение астроцитов из-за ICH. Аквапорины играют важную роль в нервном повреждении (Wang et al., 2015). AQP4 является одним из ключевых транспортных каналов в центральной нервной системе, который в изобилии присутствует в отростках стоп астроцитов (Bonomini and Rezzani, 2010). Предыдущие исследования показали, что реактивность AQP4 увеличивается после ICH, который играет решающую роль в отеке мозга и гибели цитотоксических клеток (Appelboom et al., 2015; Qiu et al., 2015). Все больше данных указывает на то, что ингибирование AQP4 облегчает травму головного мозга и улучшает восстановление ICH (Zhong et al., 2013; Wang et al., 2015). Мы наблюдали, что экспрессия AQP4 значительно снижалась при лечении GHK. Однако механизм регуляции AQP4 GHK требует дальнейшего изучения.
Несколько исследований инсульта продемонстрировали, что сигнальные пути регулируют экспрессию AQP4, такие как путь MAPK и путь NF-κB (Qi et al., 2011; Boldin and Baltimore, 2012).Более того, несколько miRNA, такие как miR-29b и miR-130a, регулируют экспрессию AQP4 при ишемическом инсульте. miRNA служат важным компонентом некодирующих РНК. Они связываются с комплементарными последовательностями на мРНК-мишени, что приводит к негативной регуляции за счет деградированной мРНК-мишени или репрессии трансляции (Beermann et al., 2016). Наши предыдущие результаты показали, что miR-146a-3p значительно снижается в периферической крови пациентов с ICH (Zhu et al., 2015). Ji et al. (2013) продемонстрировали, что miR-146a регулирует уровень SOD в H 2 O 2 стимулированных клетках PC 12.Кроме того, miR-146a-3p широко известна как важная молекула в связанной с астроцитами воспалительной реакции при нейропатии, такой как болезнь Альцгеймера и эпилепсия (Aronica et al., 2010; Cui et al., 2010; Iyer et al. , 2012). Мы обнаружили, что AQP4 является функциональным геном-мишенью для miR-146a-3p, а уровень miR-146a-3p полностью противоречит AQP4 после обработки GHK. Более того, двойная люциферазная активность miR-146a-3p и AQP4 значительно подавлялась, что указывало на прямой эффект miR-146a-3p на AQP4.Эти результаты предполагают, что miR-146a-3p играет роль в регуляции GHK AQP4.
Накапливающиеся данные показали, что активация пути PI3K / Akt включает улучшение неврологического функционального восстановления на ICH (Niu and Hu, 2017; Zhang W. et al., 2018). Jiang (2014) показал, что активация пути PI3K / Akt способствует экспрессии miR-146a-3p в альвеолярных эпителиальных клетках человека, Walsh et al. (2015) сообщили, что путь PI3K / Akt участвует в регуляции miR-146a в Т-клетках.Более того, существующие данные продемонстрировали, что ингибирование фосфорилирования PI3K может увеличивать экспрессию AQP4, что позволяет предположить, что PI3K / Akt участвует в регуляции AQP4 (Song et al., 2018). В этом исследовании мы наблюдали, что GHK увеличивает фосфорилирование Akt в астроцитах. Более того, GHK повышал уровень miR-146a-3p и снижал экспрессию AQP4, тогда как LY294002 и MK-2206 2HCL могли обратить эти эффекты. Следовательно, мы предположили, что путь PI3K / Akt участвует в GHK-индуцированной активации miR-146a-3p и что ось miR-146a-3p / AQP4 играет роль в манипулировании астроцитами после повреждения ICH.
Некоторые ограничения в нашем исследовании должны быть задокументированы. В этом исследовании мы использовали модель ICH, индуцированную коллагеназой VII, которая не может полностью моделировать патофизиологический процесс ICH. Мы обнаружили, что GHK может увеличивать фосфорилирование пути PI3K / Akt, но мы не сосредотачиваемся на компоненте прямого связывания. Однако мы фокусируемся на эффекте GHK только на астроциты, а не на взаимодействии с нейронами. Следовательно, особая роль GHK в ICH требует дальнейшего изучения.
Заключение
В заключение, наши результаты продемонстрировали, что GHK уменьшал отек мозга, улучшал неврологическое восстановление и уменьшал воспаление на крысиной модели ICH.Кроме того, мы наблюдали, что обработка GHK подавляла экспрессию AQP4 и уменьшала повреждение астроцитов, вероятно, за счет активации miR-146a-3p. Более того, ингибирование активации PI3K / Akt сдерживало GHK-индуцированную активацию miR-146a-3p и подавление AQP4. Наши результаты показали, что GHK может стать новым терапевтическим средством от ICH.
Заявление о доступности данных
Все наборы данных, созданные для этого исследования, включены в статью / Дополнительные материалы.
Заявление об этике
Все процедуры были проведены в соответствии с положениями законодательства Китая о защите животных и одобрены Комитетом по этике животных Китайского медицинского университета (2012-38-1 и 2017008).
Авторские взносы
HZ: курирование данных, расследование, методология, написание оригинального проекта, расследование. YW: формальный анализ курирования данных, методология, концептуализация. LL: визуализация. ЧР: написание — просмотр и редактирование. ZH: привлечение финансирования, концептуализация, надзор, написание — рецензирование и редактирование.Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование финансировалось Национальным фондом естественных наук Китая (81571120). Это исследование было поддержано грантами Южно-Китайской международной базы сотрудничества по раннему вмешательству и функциональной реабилитации неврологических заболеваний (2015B050501003), Провинциального инженерного центра по лечению основных неврологических заболеваний провинции Гуандун, Инновационной платформы трансляционной медицины провинции Гуандун для диагностики и лечения основных неврологических заболеваний. , Провинциальный клинический исследовательский центр неврологических заболеваний Гуандун.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим за поддержку Департамент клеточной биологии развития, Отдел клеточной биологии, Ключевая лаборатория клеточной биологии, Министерство здравоохранения, Ключевая лаборатория медицинской клеточной биологии, Министерство образования, Медицинский университет Китая.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fnins.2020.576389/full#supplementary-material
Дополнительный рисунок 1 | Уровень фосфорилат-Akt в ткани головного мозга, определяемый методом вестерн-блоттинга.
Дополнительный рисунок 2 | Экспрессия GFAP вокруг гематомы.
Дополнительный рисунок 3 | Ингибирование AQP4 в астроцитах улучшает выживаемость нейронов.
Дополнительный рисунок 4 | Экспрессия AQP4 в астроцитах, обработанных GHK и miR-146a-3p NC или имитаторами.
Дополнительная таблица 1 | Целевые миРНК AQP4.
Дополнительная таблица 2 | Последовательности олигонуклеотидов РНК.
Дополнительная таблица 3 | Последовательности праймеров.
Список литературы
Аппельбум, Г., Брюс, С., Дурен, А., Пьяцца, М., Монахан, А., Кристоф, Б. и др. (2015).Вариант гена аквапорина-4 независимо ассоциирован с отеком после внутримозгового кровоизлияния. Neurol. Res. 37, 657–661. DOI: 10.1179 / 1743132815Y.0000000047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Aronica, E., Fluiter, K., Iyer, A., Zurolo, E., Vreijling, J., van Vliet, E.A., et al. (2010). Паттерн экспрессии mir-146a, микрорны, связанной с воспалением, при экспериментальной и височной эпилепсии человека. Eur. J. Neurosci. 31, 1100–1107.DOI: 10.1111 / j.1460-9568.2010.07122.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баррето, Г., Уайт, Р. Э., Оуян, Ю., Сюй, Л., и Джиффард, Р. Г. (2011). Астроциты: мишени для нейропротекции при инсульте. Central Nerv. Syst. Agents Med. Chem. 11, 164–173. DOI: 10.2174 / 187152411796011303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берманн, Дж., Пикколи, М. Т., Вирек, Дж., И Тум, Т. (2016). Некодирующие РНК в развитии и заболевании: предпосылки, механизмы и терапевтические подходы. Physiol. Ред. 96, 1297–1325. DOI: 10.1152 / Physrev.00041.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bylicky, M.A., Mueller, G.P., и Day, R.M. (2018). Механизмы эндогенного нейропротекторного действия астроцитов при черепно-мозговой травме. Оксидат. Med. Клетка. Longev. 2018: 6501031. DOI: 10.1155 / 2018/6501031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен-Рётлинг, Дж., Сонг, В., Шиппер, Х.М., Риган, С.С., Риган, Р.Ф. (2015). Сверхэкспрессия гемоксигеназы-1 в астроцитах улучшает исход после внутримозгового кровоизлияния. Инсульт 46, 1093–1098. DOI: 10.1161 / STROKEAHA.115.008686
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chu, H., Huang, C., Ding, H., Dong, J., Gao, Z., Yang, X., et al. (2016). Аквапорин-4 и цереброваскулярные заболевания. Внутр. J. Mol. Sci. 17: 1249. DOI: 10.3390 / ijms17081249
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куй, Х.J., Yang, A.L., Zhou, H.J., Wang, C., Luo, J.K., Lin, Y., et al. (2015). Отвар Buyang huanwu способствует ангиогенезу через активацию рецептора-2 фактора роста эндотелия сосудов через путь pi3k / akt в модели внутримозгового кровоизлияния у мышей. BMC Дополнение Альтерн. Med. 15:91. DOI: 10.1186 / s12906-015-0605-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Дж., Цуй, К., Цуй, Ю., Ли, Р., Шэн, Х., Цзян, X., и др. (2017). Трансплантация мезенхимальных стволовых клеток костного мозга увеличивает экспрессию gap-43 через пути erk1 / 2 и pi3k / akt при внутримозговых кровоизлияниях. Cell. Physiol. Biochem. 42, 137–144. DOI: 10.1159 / 000477122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Дж. Г., Ли, Ю. Ю., Чжао, Ю., Бхаттачарджи, С., и Лукив, В. Дж. (2010). Дифференциальная регуляция киназы-1, связанной с рецептором интерлейкина-1 (ирак-1), и ирак-2 с помощью микрорна-146а и nf-каппаба в стрессированных астроглиальных клетках человека и при болезни Альцгеймера. J. Biol. Chem. 285, 38951–38960. DOI: 10.1074 / jbc.M110.178848
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гручлик, А., Юрзак, М., Ходурек, Э., Дзежевич, З. (2012). Влияние gly-gly-his, gly-his-lys и их комплексов с медью на tnf-альфа-зависимую секрецию il-6 в нормальных фибробластах кожи человека. Acta Pol. Pharm. 69, 1303–1306.
Google Scholar
Хуанг, Ф. П., Си, Г., Кип, Р. Ф., Хуа, Ю., Немояну, А., и Хофф, Дж. Т. (2002). Отек мозга после экспериментального внутримозгового кровоизлияния: роль продуктов распада гемоглобина. J. Neurosurg. 96, 287–293.DOI: 10.3171 / jns.2002.96.2.0287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг П., Фриман В. Д., Эденфилд Б. Х., Бротт Т. Г., Меския Дж. Ф. и Зубайр А. С. (2019). Безопасность и эффективность внутрижелудочковой доставки мезенхимальных стволовых клеток костного мозга в модели геморрагического инсульта. Sci. Отчет 9: 5674. DOI: 10.1038 / s41598-019-42182-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айер, А., Зуроло, Э., Prabowo, A., Fluiter, K., Spliet, W.G., van Rijen, P.C., et al. (2012). Microrna-146a: ключевой регулятор воспалительной реакции, опосредованной астроцитами. PLoS One 7: e44789. DOI: 10.1371 / journal.pone.0044789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ji, G., Lv, K., Chen, H., Wang, T., Wang, Y., Zhao, D., et al. (2013). Mir-146a регулирует экспрессию sod2 в клетках pc12, стимулированных h3o2. PLoS One 8: e69351. DOI: 10.1371 / journal.pone.0069351
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзян, X.(2014). Различные сигнальные пути регулируют индуцированную il-1beta зрелую и первичную экспрессию mirna-146a в альвеолярных эпителиальных клетках человека. Acta Physiol. Висела. 101, 282–290. DOI: 10.1556 / APhysiol.101.2014.3.3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хосе, С., Хьюбэнкс, М. Л., Биндер, Б. Ю., Ингавл, Г. К., и Лич, Дж. К. (2014). Повышенная секреция трофических факторов мезенхимальными стволовыми / стромальными клетками с помощью альгинатных гидрогелей, модифицированных глицин-гистидин-лизин (ghk). Acta Biomater. 10, 1955–1964. DOI: 10.1016 / j.actbio.2014.01.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Латтанци, С., Ди Наполи, М., Риччи, С., и Дивани, А. А. (2020). Матричные металлопротеиназы при остром внутримозговом кровоизлиянии. Нейротерапия 17, 484–496. DOI: 10.1007 / s13311-020-00839-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, С. Т., Чу, К., Юнг, К. Х., Ким, С. Дж., Ким, Д.Х., Канг, К. М. и др. (2008). Противовоспалительный механизм внутрисосудистой трансплантации нервных стволовых клеток при геморрагическом инсульте. Мозг 131, 616–629. DOI: 10.1093 / мозг / awm306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю З., Чопп М. (2016). Астроциты, терапевтические мишени для нейропротекции и нейровосстановления при ишемическом инсульте. Прог. Neurobiol. 144, 103–120. DOI: 10.1016 / j.pneurobio.2015.09.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ло, Б.В. Ю., Тейтельбаум, Дж. С. (2020). Гипертермия, отек мозга и исход внутримозгового кровоизлияния: чертовски жарко. Неврология 94, 687–688. DOI: 10.1212 / WNL.0000000000009284
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Майнерс, С., Эйкельберг, О. (2012). Персонализированное открытие нового поколения лекарств: трипептид ghk занимает центральное место в лечении хронической обструктивной болезни легких. Genome Med. 4:70. DOI: 10.1186 / GM371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер, Д.М., Де Сильва, Д., Пикарт, Л., и Ауст, С. Д. (1990). Эффекты глицил-гистидил-лизил-хелатированной Cu (ii) на ферритин-зависимое перекисное окисление липидов. Adv. Exp. Med. Биол. 264, 79–84. DOI: 10.1007 / 978-1-4684-5730-8_11
CrossRef Полный текст | Google Scholar
Мин, Х., Хонг, Дж., Чо, И. Х., Янг, Ю. Х., Ли, Х., Ким, Д. и др. (2015). Tlr2-индуцированная активация астроцитов mmp9 нарушает гематоэнцефалический барьер и усугубляет внутримозговое кровоизлияние в моделях на животных. Мол. Мозг 8:23. DOI: 10.1186 / s13041-015-0116-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mohammed Thangameeran, S. I., Tsai, S.-T., Hung, H.-Y., Hu, W.-F., Pang, C.-Y., Chen, S.-Y., et al. (2020). Роль стресса эндоплазматического ретикулума во внутримозговых кровоизлияниях. Ячейки 9: 750. DOI: 10.3390 / Cell
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ню, Дж., И Ху, Р. (2017). Роль флунаризина гидрохлорида во вторичном повреждении головного мозга после внутримозгового кровоизлияния у крыс. Внутр. J. Immunopathol. Pharmacol. 30, 413–419. DOI: 10.1177 / 0394632017742224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оуян, Ю. Б., Сюй, Л., Юэ, С., Лю, С., и Джиффард, Р. Г. (2014). Нейрозащита астроцитами при ишемии головного мозга: важность микрорн. Neurosci. Lett. 565, 53–58. DOI: 10.1016 / j.neulet.2013.11.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Парк, Дж. Р., Ли, Х., Ким, С.И., Янг С. Р. (2016). Комплекс трипептида ghk-cu улучшает вызванное липополисахаридом острое повреждение легких у мышей. Oncotarget 7, 58405–58417. DOI: 10.18632 / oncotarget.11168
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пей, Х., Цзян, Т., Лю, Г., Ли, З., Луо, К., Ан, Дж., И др. (2016). Влияние малоинвазивной аспирации гематомы на путь передачи сигнала jnk после экспериментального внутримозгового кровоизлияния у крыс. Внутр.J. Mol. Sci. 17: 710. DOI: 10.3390 / ijms17050710
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пикарт, Л., Васкес-Солтеро, Дж. М., и Марголина, А. (2012). Человеческий трипептид ghk-cu в профилактике окислительного стресса и дегенеративных состояний старения: последствия для когнитивного здоровья. Оксид. Med. Клетка. Longev. 2012: 324832. DOI: 10.1155 / 2012/324832
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пикарт, Л., Васкес-Солтеро, Дж. М., и Марголина, А. (2015). Пептид Ghk как естественный модулятор множественных клеточных путей регенерации кожи. BioMed Res. Int. 2015: 648108. DOI: 10.1155 / 2015/648108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пикарт, Л., Васкес-Солтеро, Дж. М., и Марголина, А. (2017). Влияние человеческого пептида ghk на экспрессию генов, влияющих на функцию нервной системы и снижение когнитивных функций. Brain Sci. 7:20. DOI: 10.3390 / brainsci7020020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Qi, L. L., Fang, S. H., Shi, W. Z., Huang, X. Q., Zhang, X. Y., Lu, Y. B., et al. (2011). Опосредованная рецептором Cyslt2 повышающая регуляция aqp4 участвует в ишемическом повреждении через активацию erk и p38 mapk в астроцитах крыс. Life Sci. 88, 50–56. DOI: 10.1016 / j.lfs.2010.10.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цю, Г. П., Сюй, Дж., Zhuo, F., Sun, S.Q., Liu, H., Yang, M., et al. (2015). Утрата поляризованной локализации aqp4 с потерей иммунореактивности бета-дистрогликана может вызвать отек мозга после внутримозгового кровоизлияния. Neurosci. Lett. 588, 42–48. DOI: 10.1016 / j.neulet.2014.12.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розенберг, Г. А., Мун-Брайс, С., Уэсли, М., и Корнфельд, М. (1990). Индуцированное коллагеназой внутримозговое кровоизлияние у крыс. Инсульт 21, 801–807.DOI: 10.1161 / 01.STR.21.5.801
CrossRef Полный текст | Google Scholar
Ши Б. З., Мэн Х. Ф., Ян Дж. Х., Хао Х. В., Цуй Т., Лу, З. Ф. и др. (2012). Влияние эритроцитов на содержание воды в головном мозге и экспрессию гемоксигеназы-1 у крыс с травматическим внутримозговым кровоизлиянием. Acta Neurochir. 154, 1081–1086. DOI: 10.1007 / s00701-012-1335-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сонг, Д., Лю, X., Дяо, Ю., Сунь, Ю., Гао, Г., Чжан, Т. и др. (2018). Обогащенный водородом раствор против повреждения миокарда и экспрессии аквапорина через сигнальный путь pi3k / akt во время искусственного кровообращения у крыс. Мол. Med. Реп. 18, 1925–1938. DOI: 10.3892 / mmr.2018.9198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стикоцци, К., Бельмонте, Г., Мейни, А., Карботти, П., Грассо, Г., и Палми, М. (2013). Il-1beta индуцирует экспрессию gfap in vitro и in vivo и защищает нейроны от апоптоза, связанного с травматическим повреждением, в полосатом теле мозга крысы через сигнальный путь nfkappab / ca (2) (+) — кальмодулин / erk митоген-активируемой протеинкиназы. Неврология 252, 367–383. DOI: 10.1016 / j.neuroscience.2013.07.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Thomas, R., Salter, M. G., Wilke, S., Husen, A., Allcock, N., Nivison, M., et al. (2004). Острое ишемическое повреждение астроцитов опосредуется котранспортом na-k-cl, а не притоком Ca2 + в ключевой момент развития белого вещества. J. Neuropathol. Exp. Neurol. 63, 856–871. DOI: 10.1093 / jnen / 63.8.856
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уолш, М.К., Ли, Дж., И Чой, Ю. (2015). Фактор некроза опухоли, связанный с рецептором фактора 6 (traf6), регуляция развития, функции и гомеостаза иммунной системы. Immunol. Ред. 266, 72–92. DOI: 10.1111 / imr.12302
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Б. Ф., Цуй, З. В., Чжун, З. Х., Сунь, Ю. Х., Сан, К. Ф., Ян, Г. Ю. и др. (2015). Куркумин уменьшает отек мозга у мышей с внутримозговым кровоизлиянием за счет ингибирования экспрессии aqp4 и aqp9. Acta Pharmacol. Грех. 36, 939–948. DOI: 10.1038 / aps.2015.47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян, Г.-К., Хуанг, Дж.-К., Юань, Дж.-Дж., Чжан, К., Гонг, К.-Х., Чен, К., и др. (2020). Prdx1 снижает повреждение головного мозга, вызванное внутримозговым кровоизлиянием, за счет нацеливания на стабильность мРНК, связанную с воспалением и апоптозом. Фронт. Neurosci. 14: 181. DOI: 10.3389 / fnins.2020.00181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Х., Ван, Ю., и Хе, З. (2018). Глицин-гистидин-лизин (ghk) облегчает апоптоз нейронов из-за внутримозгового кровоизлияния через путь mir-339-5p / vegfa. Фронт. Neurosci. 12: 644. DOI: 10.3389 / fnins.2018.00644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, W., Cui, Y., Gao, J., Li, R., Jiang, X., Tian, Y., et al. (2018). Рекомбинантный остеопонтин улучшает неврологическое функциональное восстановление и защищает от апоптоза через путь pi3k / akt / gsk-3beta после внутримозгового кровоизлияния. Med. Sci. Монит. 24, 1588–1596. DOI: 10.12659 / MSM.
0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Z., Liu, Y., Huang, Q., Su, Y., Zhang, Y., Wang, G., et al. (2014). Активация Nf-каппаба и гибель клеток после внутримозгового кровоизлияния у пациентов. Neurol. Sci. 35, 1097–1102. DOI: 10.1007 / s10072-014-1657-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжун, З., Ван, Б., Дай, М., Сунь, Ю., Sun, Q., Yang, G., et al. (2013). Карвакрол снимает отек головного мозга, модулируя экспрессию aqp4 после внутримозгового кровоизлияния у мышей. Neurosci. Lett. 555, 24–29. DOI: 10.1016 / j.neulet.2013.09.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу, X. M., Wang, G. L., Wang, X. B., Liu, L., Zhang, Q., Yin, Y., et al. (2017). Пептид Ghk ингибирует индуцированный блеомицином фиброз легких у мышей, подавляя tgfβ1 / smad-опосредованный переход эпителия в мезенхиму. Фронт. Pharmacol. 8: 904. DOI: 10.3389 / fphar.2017.00904
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжу, Ю., Ван, Дж. Л., Хэ, З. Ю., Цзинь, Ф., и Тан, Л. (2015). Связь измененных микробов сыворотки с отеком перигематомы после острого внутримозгового кровоизлияния. PLoS One 10: e0133783. DOI: 10.1371 / journal.pone.0133783
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зилле, М., Каруппагаундер, С.S., Chen, Y., Gough, P.J., Bertin, J., Finger, J., et al. (2017). Гибель нейронов после геморрагического инсульта in vitro и in vivo имеет общие черты ферроптоза и некроптоза. Инсульт 48, 1033–1043. DOI: 10.1161 / STROKEAHA.116.015609
PubMed Аннотация | CrossRef Полный текст | Google Scholar
| Обозначение | Позиция (я) | Описание Действия | Графическое изображение | 34 — 41 | Информация получена на основе комбинации экспериментальных и расчетных данных без ручной проверки. Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 8 | ||
|---|---|---|---|---|---|---|---|---|
Этот подраздел раздела «Структура» используется для обозначения положений экспериментально определенных спиральных областей внутри последовательность белка. Helix i | 42 — 58 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 17 | |||||
| Бета-нить i | 63-69 | Автоматическое утверждение, выводимое на основе комбинации экспериментальных и расчетных данных i | 7 | |||||
| Helix i | 72-80 | экспериментальное утверждение и вычислительные доказательства i | 9 | |||||
| Бета-цепочка i | 85-91 | Автоматическое утверждение, выведенное из комбинации экспериментальных и вычислительных данных i | 905 | |||||
| Спираль i | 92-97 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 6 | |||||
Этот подраздел «Структура» используется для обозначения положений экспериментально определенных витков с водородными связями в последовательности белка. Эти элементы соответствуют коду вторичной структуры DSSP «T». Turn i | 98–100 | Автоматическое утверждение, выведенное из комбинации экспериментальных и вычислительные данные i | 3 | |||||
| Helix i | 108-123 | Автоматическое утверждение, выведенное из комбинации экспериментальных и вычислительных данных i | Бета-нить i | 125-127 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 3 | ||
| Бета s trand i | 137 — 142 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 6 | |||||
| Helix i | 143 на основе комбинации экспериментальных и расчетных данных i | 7 | ||||||
| Бета-цепочка i | 152 — 154 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных 0779 0779 | ||||||
| Helix i | 155–163 | Автоматическое утверждение, полученное на основе комбинации экспериментальных и расчетных данных i | 9 | |||||
| Beta 168 | Автоматическое утверждение, полученное из комбинации экспериментальных и вычислительных данных i | 4 | ||||||
| Helix i | 172-174 | Автоматическое утверждение, выведенное из комбинации i расчетных данных 000 | 3 | |||||
| Бета-цепочка i | 176-179 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 9057 9059 9059 180 — 187 | Автоматическое утверждение, выведенное из комбинации экспериментальных и вычислительных данных i | 8 | |||
| Бета-цепочка i | 192-196 | экспериментальная комбинация и автоматическая комбинация, выведенная как автоматическая комбинация d вычислительное свидетельство i | 5 | |||||
| Helix i | 199-201 | Автоматическое утверждение, выведенное из комбинации экспериментального и вычислительного свидетельства i | Helix i | 202-207 | Автоматическое утверждение, полученное на основе комбинации экспериментальных и расчетных данных i | 6 | ||
| Автоматическая цепочка Beta i | 8 | |||||||
| Helix i | 222-225 | Автоматическое утверждение, сделанное из комбинации экспериментальных и вычислительных данных | ||||||
| Бета-цепочка i | 228-230 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 3 | |||||
| — 248 | Автоматическое утверждение, выведенное из комбинации экспериментальных и вычислительных данных i | 7 | ||||||
| Helix i | 249 — 254 | автоматическое подтверждение результатов i | 6 | |||||
| Helix i | 258-263 | Автоматическое утверждение на основе комбинации экспериментальных и расчетных данных i | я | Автоматическое утверждение, выводимое из комбинации экспериментальных и расчетных данных i | 4 | |||
| Helix i | 271-282 | red вычислительное свидетельство i | 12 | |||||
| Helix i | 288-298 | Автоматическое утверждение, выведенное из комбинации экспериментального и вычислительного свидетельства i | 300-302 | Автоматическое утверждение, выведенное из комбинации экспериментальных и расчетных данных i | 3 |
|
|
| ||||||||||||||||||||||




 Роде Б.М.: Пептиды и происхождение жизни. Пептиды. 1999; 20 (6): 773–786. PubMed Аннотация | Publisher Full Text
Роде Б.М.: Пептиды и происхождение жизни. Пептиды. 1999; 20 (6): 773–786. PubMed Аннотация | Publisher Full Text PubMed Аннотация | Publisher Full Text
PubMed Аннотация | Publisher Full Text Jockusch RA, Lemoff AS, Williams ER: Влияние координации ионов металла и воды на структуру газофазной аминокислоты. J Am Chem Soc. 2001; 123 (49): 12255–12265. PubMed Аннотация | Publisher Full Text
Jockusch RA, Lemoff AS, Williams ER: Влияние координации ионов металла и воды на структуру газофазной аминокислоты. J Am Chem Soc. 2001; 123 (49): 12255–12265. PubMed Аннотация | Publisher Full Text J. Phys Chem B. 2010; 114 (49): 16450–16459. PubMed Аннотация | Publisher Full Text
J. Phys Chem B. 2010; 114 (49): 16450–16459. PubMed Аннотация | Publisher Full Text PubMed Аннотация | Издатель Полный текст
PubMed Аннотация | Издатель Полный текст J. Phys Chem. 1990; 94 (21): 8021–8024. Издатель Полный текст
J. Phys Chem. 1990; 94 (21): 8021–8024. Издатель Полный текст F1000 Исследования. 2017. Источник данных
F1000 Исследования. 2017. Источник данных