Некротизирующий энтероколит новорожденных | Морозовская ДГКБ ДЗМ
Некротизирующий энтероколит новорожденных (НЭК) – тяжелое заболевание кишечника, возникающее на фоне перенесенной острой гипоксии, нарушения нормальной колонизации кишечника микрофлорой, приводящее к некрозу и перфорации кишечной стенки, перитониту.
Частота встречаемости 1 — 5 случаев на 1000 живорожденных детей. Чаще всего болеют недоношенные дети и дети с низкой массой тела при рождении.
Факторы приводящие к возникновению НЭК:
- Преждевременные роды
- Острая гипоксия в родах
- Заболевания легких
- Врожденные пороки сердца
- Рождение двойни
- Гемолитическая болезнь новорожденных
- «Агрессивное энтеральное кормление»
- Катетеризация пупочной вены
- Анемия новорожденных
- Охлаждение
- Наркозависимость матери
- Врожденные пороки развития – болезнь Гиршпрунга, гастрошизис, кишечная непроходимость.
Классификация НЭК по Bell (1978) в модификации Walsh and Kliegman (1987):
I стадия – начальных проявления: изменения поведения ребенка (возбудимость или вялость), вздутие живота, отделяемое по желудочному зонду, задержка стула.
I а – скрытая кровь в стуле
I б – явная кровь в стуле
II стадия – разгар заболевания: вялость, гипотония, адинамия, изменение частоты и глубины дыхания, учащенное сердцебиение, нарастание вздутия живота, отсутствие перистальтики кишечника, застойное отделяемое по желудочному зонду, задержка стула или увеличение патологических примесей (слизь, кровь) в стуле. Появляются рентгенологические признаки (пневматоз стенок кишечника), и ультрозвуковые признаки (снижение перистальтики, отек стенки кишки, появление статичной петли кишки).
II а – среднетяжелое течение
II б – тяжелое течение с симптомами системной интоксикации
III а – некроз кишечника без перфорации
III б – перфорация кишечника.
III стадия – развитие осложнений: септическое состояние ребенка, адинамия, тяжелые водно-электролитные нарушения, нарушения микроциркуляции, кровоточивость, склонность к тромбозам, напряжение и вздутие живота, отек и гиперемия передней брюшной стенки, контурирование подкожной венозной сети, отсутствие перистальтики кишечника. При ультразвуковом исследовании наличие свободной жидкости в брюшной полости, газа в портальной системе печени, выявление инфильтрата в брюшной полости, некротизированной пели кишки с обедненным кровотоком. На рентгенограмме неравномерное вздутие петель кишечника, свободный воздух в брюшной полости.
При ультразвуковом исследовании наличие свободной жидкости в брюшной полости, газа в портальной системе печени, выявление инфильтрата в брюшной полости, некротизированной пели кишки с обедненным кровотоком. На рентгенограмме неравномерное вздутие петель кишечника, свободный воздух в брюшной полости.
При обратимой стадии НЭК удается вылечить ребенка, не прибегая к оперативному пособию. Ребенок не кормится, устанавливается желудочный зонд, проводится инфузионная терапия, назначаются антибиотики, проводится иммунотерапия, профилактика тромбообразования.
В случае осложненного течения НЭК выполняют оперативное лечение лапароскопию, лапаротомию, резекция пораженного участка кишечника, формирование первичного анастомоза, выведение энтеростомы.
В послеоперационном периоде ребенок требует проведение интенсивной инфузионной и антибактериальной терапии, после восстановления работы кишечника осторожно вводят энтеральное кормление.
Применение современных методик диагностики и лечения НЭК, позволят сократить летальность при данной патологии. К отдаленным осложнениям НЭК относят синдром короткой кишки, стеноз кишки, синдром нарушения всасывания.
К отдаленным осложнениям НЭК относят синдром короткой кишки, стеноз кишки, синдром нарушения всасывания.
На качество жизни детей перенесших НЭК влияет сопутствующая патология, характерная для недоношенных детей: бронхо-легочная дисплазия, хронические заболевания легких, последствия перинатального поражения ЦНС, ретинопатия недоношенных, задержка физического и психомоторного развития.
Журнал: «Медицина целевые проекты» статья: Консервативная терапия некротического энтероколита у новорожденных
Настороженность в отношении развития НЭК у детей группы риска, отработанный алгоритм лечения по стадиям процесса, ранняя диагностика осложнений НЭК, соблюдение правил введения энтеральной нагрузки, парентерального питания с постепенным переходом на энтеральное питание позволили уменьшить и остановить процесс на более ранних стадиях развития, уменьшить летальность в этой группе пациентов на 85%
Главный врач ГБУЗ Самарской области «Тольяттинская городская клиническая больница № 5», к. м.н., врач высшей квалификационной категории, заслуженный врач РФ Николай Ренц
м.н., врач высшей квалификационной категории, заслуженный врач РФ Николай Ренц
Заместитель главного врача по акушерству и гинекологии ГБУЗ СО «Тольяттинская городская клиническая больница № 5», к.м.н, врач высшей квалификационной категории Наталья Хуторская
Заведующий отделением реанимации и интенсивной терапии новорожденных межрайонного перинатального центра, врач высшей квалификационной категории Евгений Алексеевнин
Летальностьпри язвенно-некротическом энтероколите (НЭК) и перфорации желудочно-кишечного тракта составляет 40–80%, достигая 100% у пациентов с наиболее тяжелыми формами заболевания и сопутствующей патологией. Клиническое течение НЭК и перфораций желудочно-кишечного тракта (ЖКТ) у новорожденных сопровождается перитонитом, высоким внутрибрюшным давлением с развитием синдрома полиорганной недостаточности
Факторы риска
Патологическое течение беременности, применение женщиной во время беременности наркотических препаратов, асфиксия в родах, синдром дыхательных расстройств, значительное охлаждение ребенка, синдром малого сердечного выброса при врожденных пороках развития сердца, полицитемия, медикаменты, нарушающие мезентериальный кровоток (индометацин, витамин Е).
Клиническая картина
По течению заболевания выделяют следующие формы:
· Молниеносная форма.От первых нечетких симптомов дискомфорта в состоянии ребенка до возникновения перфорации проходит не более 1,5–2 суток.
· Острая форма.Заболевание начинается с ярко выраженных симптомов со стороны брюшной полости, отказа от еды, срыгивания и рвоты, вздутия живота, нарушения пассажа по кишечнику, что соответствует Iстадии. Вскоре присоединяются общесоматические симптомы, свидетельствующие об интоксикации и дисфункции жизненно важных органов и систем (IIcтадия). При неадекватности или неэффективности консервативной терапии заболевание может быстро перейти в IIIстадию развития процесса, что требует незамедлительного хирургического лечения.
· Подострая форма.Симптомы со стороны ЖКТ появляются постепенно и имеют перемежающийся характер, т.е. периоды клинического благополучия сменяются дисфункцией органов ЖКТ.
В зависимости от распространенности процесса выделяют:
· локальную форму – поражение ограничено небольшим участком кишки;
· мультисегментарную форму – поражено несколько участков кишки;
· тотальное поражение кишечника,или паннекроз.
Молниеносная форма НЭК характерна для доношенных («крупных») детей, перенесших в родах асфиксию, а также для новорожденных с гемолитической болезнью (после повторных заменных переливаний крови) и для пациентов с пороками развития ЖКТ..jpg) Первые симптомы заболевания при молниеносной форме НЭК появляются несколько раньше (на 3–5-й день жизни), чем при других вариантах течения болезни. Своевременная диагностика этой формы заболевания нередко затруднена из-за преморбидного фона и очень тяжелого общего состояния ребенка. Появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Первые симптомы заболевания при молниеносной форме НЭК появляются несколько раньше (на 3–5-й день жизни), чем при других вариантах течения болезни. Своевременная диагностика этой формы заболевания нередко затруднена из-за преморбидного фона и очень тяжелого общего состояния ребенка. Появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Острая формаНЭК характерна для недоношенных детей с массой более 1000 г. При этой форме чаще встречается локальное поражение тонкой кишки, причем от первых симптомов до возникновения перфорации кишки, обычно проходит 2–3 суток. Заболевание начинается остро на 10–28-й день жизни с появления признаков поражения ЖКТ. Быстро присоединяются или нарастают общесоматические симптомы, состояние прогрессивно ухудшается. У больных выявляют локальное поражение тонкой кишки или некроз стенки желудка.
У больных выявляют локальное поражение тонкой кишки или некроз стенки желудка.
Подострая формахарактерна для глубоко недоношенных детей и детей с критически низкой массой тела. Первые симптомы появляются на 12–45-е сутки жизни. Ребенок перестает усваивать питание, начинает срыгивать, возникает вздутие живота, меняется характер стула: он может учащаться, в нем появляется примесь зелени и крови, а иногда, наоборот, становится более редким и прекращается вообще. При подострой форме НЭК нередко в последующем развивается частичная, а затем и полная кишечная непроходимость.
Диагностика
Консультация хирурга на всех этапах НЭК.
Рентгенологическое обследование:
Расширение кишечных петель – наиболее частый симптом. Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении.
Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении.
Пневматоз кишечной стенкиявляется одним из наиболее важных радиологических признаков НЭК. Этот симптом чаще возникает чаще у детей, уже получавших энтеральное питание, чем у пациентов, которые не кормились.
На рентгенограмме могут одновременно определяться два вида пневматоза – кистовидный и линейный.
Газ в воротной вене – очень грозный признак, часто свидетельствующий о далеко зашедшем процессе. Наличие газа в системе воротной вены встречается у детей с тотальным некрозом кишки и предопределяет неблагоприятный прогноз, поэтому наличие данного симптома является абсолютным показанием к хирургическому лечению. Наличие неподвижной (статичной) петли кишки, не изменяющей свое положение на повторных снимках, свидетельствует о кишечной ишемии. Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6–8 часов), помогает дифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Этот симптом считается патогномоничным для некроза кишки, а соответственно, позволяющим ставить показания к операции.
Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6–8 часов), помогает дифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Этот симптом считается патогномоничным для некроза кишки, а соответственно, позволяющим ставить показания к операции.
Снижение пневматизации и неравномерное газонаполнение кишечных петель позволяют продолжить консервативную терапию с тщательным контролем за состоянием ребенка и изменением рентгенологической картины. Внезапное появление на рентгенограммах признаков асцита является неблагоприятным фактором, говорящим о реакции брюшины на бактериальный перитонит, о возможной прикрытой перфорации кишки. Сочетание асцита и появления газа в воротной вене сопровождается высокой смертностью пациентов.
Пневмоперитонеум – скопление свободного газа в брюшной полости, чаще под куполами диафрагмы, у детей с НЭК неопровержимо свидетельствует о перфорации полого органа.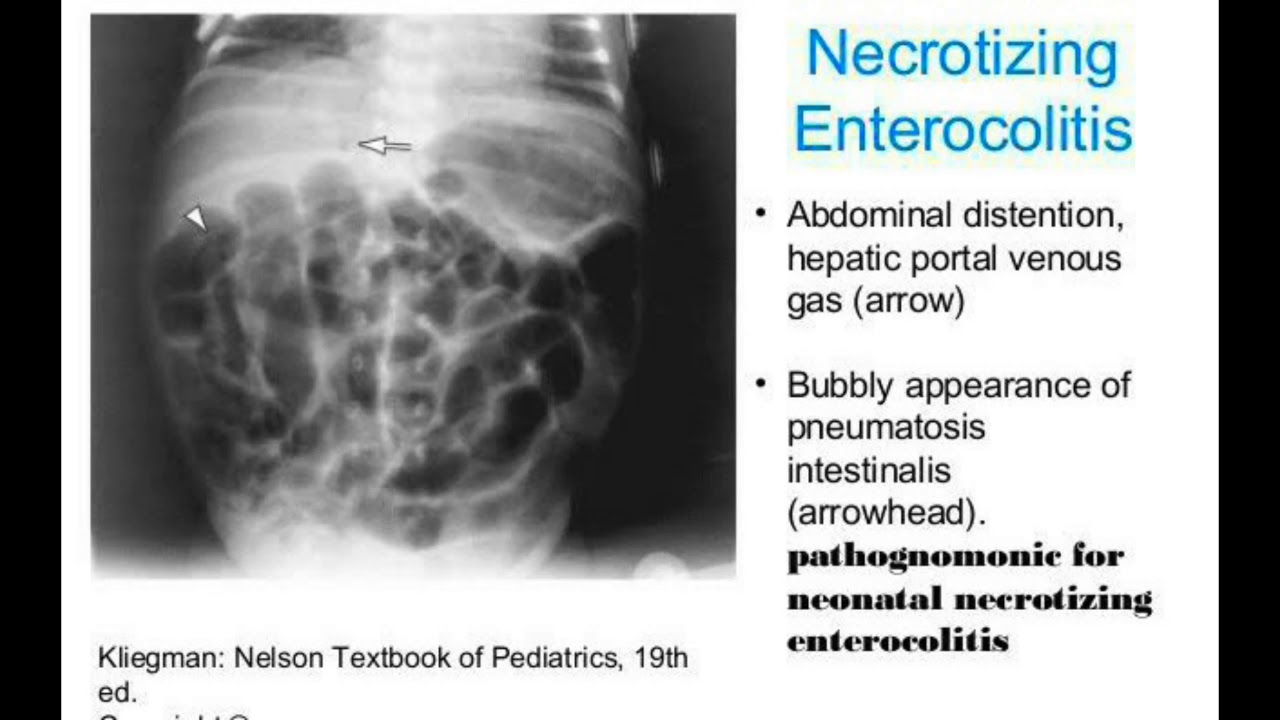 Отсутствие на рентгенограмме газа в свободной брюшной полости при наличии перфорации объясняется тем, что перфорация может быть прикрытой или «открываться» в карман или полость сальниковой сумки, изолированные от свободной брюшной полости.
Отсутствие на рентгенограмме газа в свободной брюшной полости при наличии перфорации объясняется тем, что перфорация может быть прикрытой или «открываться» в карман или полость сальниковой сумки, изолированные от свободной брюшной полости.
УЗИ органов брюшнойполости и забрюшинного пространства – для выявления выпота в брюшной полости, инфильтратов, абсцессов.
Лапароцентез.Получение из брюшной полости при аспирация более чем 1,0 мл желто-коричневого или зеленого мутного содержимого свидетельствует о некрозе кишки.
Лабораторная диагностика – специфических тестов не существует.
Таким образом, основной целью обследования детей с НЭК является выявление всего комплекса клинических проявлений, позволяющих как можно раньше диагностировать заболевание и оперировать больных до развития перфорации кишки или желудка.
Абсолютные показания к хирургическому лечению
Появление в брюшной полости пальпируемого опухолевидного образования, свидетельствующего о наличии внутрибрюшного абсцесса или конгломерата спаянных между собой некротизированных кишечных петель.
Лечение некротического энтероколита зависит от стадии заболевания и степени выраженности симптомов и складывается из консервативного и хирургического этапов.
Консервативное лечение некротического энтероколита
1. Энтеральное питание – режим трофического кормления (1ml/kg – микроструйное введение) при НЭК 1 ст.
При малейшем подозрении на НЭК IIа ст. – отмена энтерального питания.
– отмена энтерального питания.
Постановка в желудок для декомпрессии постоянного назогастрального или орогастрального зонда (держать открытым).
2. Респираторная поддержка (ИВЛ, неинвазивная вентиляция легких).
3. Антибактериальная терапия (карбапенемы +гликопептиды иликомбинированные цефалоспорины).
Схемы введения антибактериальной терапии:
Карбапенемы: меропенем (меронем) – 20 мг/кг.
Менее 32 недель гестации – менее 14 дней – каждые 12 часов.
Старше 14 дней – каждые 8 часов.
Старше 32 недель гестации – 1–7 дней – каждые 12 часов.
Старше 7 дней – каждые 8 часов.
Тиенам (имипенем-циластатин) – 20–25 мг/кг каждые 12 часов.
Гликопептиды: ванкомицин (эдицин) – 15 мг/кг.
Менее 29 недель гестации – менее 14 дней – через18 часов.
Старше 14 дней – через 12 часов.
30–40 недель гестации – 0–14 дней – через 12 часов.
Старше 14 дней – через 8 часов .
При выделении вероятного инфекционного агента-возбудителя – смена антибактериальной терапии с учетом спектра его чувствительности.
4. Препарат глутамина для парентерального питания («Дипептивен» – 2 мл/кг).
5. Седация и аналгезия (наркотические аналгетики <фентанил – 1–3 мкг/кг/ч>),
Бензодиазепины (седуксен – 0,02–0,3 мг/кг), согласно шкале СRIES.
Натрия оксибутират (100–200 мг/кг/мин).
6. Добутамин – 2–5 мкгр/кг/ч. – с появления первых симптомов НЭК.
7. Полигаммаглобулины («Пентоглобин» – 5 мл/кг).
8. Гемо- и плазмотрансфузия по показаниям.
9. Целенаправленная терапия патологического состояния, которое было первичным у ребенка и потенцировало развитие НЭК.
10. Полное парэнтеральное питание (TPN).
Критерии для проведения TPN:
1. TPN проводится при развитии НЭК II–IIIстадии и продолжается в ранние сроки после хирургического лечения (3–5-е сутки).
2. Для назначения TPN необходимо добиться полной стабилизации состояния больного (коррекция метаболических нарушений и КОС, стабилизация гемодинамики, отмена планового наркотического обезболивания).
TPN начинают детям, рожденным с массой <1500 г, или новорожденным, которые не могут получить энтеральное питание, обеспечивающее им 80–90 ккал/кг/сут. к концу 1-й недели жизни.
к концу 1-й недели жизни.
Период энтерального голода недлительный (7–8 дней). Энтеральное кормление возобновляется с того момента, как у ребенка восстанавливается пассаж по кишечнику, исчезает вздутие живота, появляется стойкая тенденция к улучшению или нормализации лабораторных показателей и рентгенологических данных.
Наилучшим видом питания для новорожденного ребенка, конечно, является грудное молоко. Однако после тяжелых воспалительных заболеваний ЖКТ, длительной антибактериальной терапии развивается тяжелый дисбактериоз, в связи чем в качестве первой смеси для энтерального питания можно использовать смесь типа «Альфаре».
По мере повышения толерантности организма к вводимой смеси, стабилизации весовых прибавок ребенка постепенно переводят на вскармливание грудным молоком.
Профилактика некротического энтероколита
· Профилактика НЭК должна начинаться еще до рождения ребенка.
· Заместительная терапия внутривенным человеческим иммуноглобулином.
· «Пентаглобин».
· Оптимальный выбор антибактериальной терапии с лабораторным контролем ее эффективности.
· Соблюдение правил введения энтеральной нагрузки.
Выводы
1. К группе риска по развитию НЭК относятся недоношенные дети, перенесшие гипоксию, и дети, угрожаемые по развитию интранатальной и внутриутробной инфекции.
2. Новорожденные должны быть проконсультированы детским хирургом при появлении первых симптомов НЭК, до развития хирургических осложнений.
3. Улучшение результатов лечения НЭК возможно лишь при тесном взаимодействии врачей различных специальностей, занимающихся выхаживанием недоношенных детей.
445846, г. Тольятти, бульвар Здоровья, д. 25
Тел.: (8482) 79-00-00
Сайт: http://www.medvaz.tlt.ru
Некротизирующий энтероколит новорожденных Текст научной статьи по специальности «Клиническая медицина»
НЕКРОТИЗИРУЮЩИЙ ЭНТЕРОКОЛИТ НОВОРОЖДЕННЫХ
Чубарова А.И.
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
Чубарова Антонина Игоревна E-mail: <[email protected]>
CD
РЕЗЮМЕ
Некротизирующий энтероколит (НЭК) новорожденных представляет собой воспалительное заболевание кишечника и является одним из самых грозных заболеваний в неонатальной гастроэнтерологии.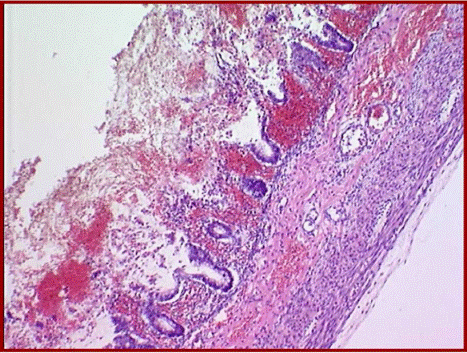 Средняя частота заболеваемости некротизирующим энтероколитом составляет 2,4:1000 новорожденных (от 1 до 10:1000), или около 2,1% (от 1 до 7%) от общего числа детей, поступающих в неонатальные отделения интенсивной терапии. Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК. В работе обобщены результаты собственных исследований и данных литературы, посвященных этой проблеме.
Средняя частота заболеваемости некротизирующим энтероколитом составляет 2,4:1000 новорожденных (от 1 до 10:1000), или около 2,1% (от 1 до 7%) от общего числа детей, поступающих в неонатальные отделения интенсивной терапии. Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК. В работе обобщены результаты собственных исследований и данных литературы, посвященных этой проблеме.
Ключевые слова: некротизирующий энтероколит; новорожденный; дети.
summary
Necrotizing enterocolitis (NEC) is a neonatal inflammatory bowel disease and is one of the most threatening disease in neonatal gastroenterology. The average incidence of necrotizing enterocolitis 2,4:1000 infants (1 to 10:1000), or about 2.1% (from 1 to 7%) of the total number of children entering the neonatal intensive care unit. The incidence of disease increases with decreasing gestational age at birth. The share of full-term infants accounts for 10-20% of cases of NEC. This paper summarizes the results of own researches and the literature dedicated to this problem. Keywords: necrotizing enterocolitis; newborn; children.
The incidence of disease increases with decreasing gestational age at birth. The share of full-term infants accounts for 10-20% of cases of NEC. This paper summarizes the results of own researches and the literature dedicated to this problem. Keywords: necrotizing enterocolitis; newborn; children.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Некротизирующий энтероколит (НЭК) новорожденных представляет собой воспалительное заболевание кишечника, является одним из самых грозных заболеваний в неонатальной гастроэнтерологии. Средние показатели летальности при НЭК составляют от 10 до 45% и зависят, помимо степени зрелости, также от стадии и распространенности процесса. Дети, развившие перфорации кишечника и перитонит, имеют наиболее высокую летальность, особенно при распространении воспалительного процесса на тощую кишку и проксимальнее: на 12-перстную кишку и желудок (до 63%).
Средняя частота заболеваемости некротизирующим энтероколитом составляет 2,4:1000 новорожденных (от 1 до 10:1000), или около 2,1%
(от 1 до 7%) от общего числа детей, поступающих в неонатальные отделения интенсивной терапии. Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК.
Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК.
НЭК рассматривают как полиэтиологическое воспалительное заболевание кишечника. К факторам риска развития НЭК относят: 1) недоношенность, 2) гипоксию/асфиксию, 3) бактериальную колонизацию кишечника патогенной микрофлорой, 4) энтеральное питание.
Недоношенность как таковая может являться благоприятным фоном для развития заболевания в связи с:
• большей частотой внутриутробной гипоксии и асфиксии в родах;
• особенностями формирования биоценоза кишечника в условиях проведения интенсивной терапии;
• особенностями взаимодействия клеток кишечника с иммунокомпетентными клетками у новорожденных и избыточной активностью воспалительного ответа,
• незрелостью нервной системы кишечника и механизмов регуляции моторики кишечника;
• нарушением механизмов адаптации к энтераль-ному питанию у недоношенных в связи с незрелостью и отсутствием раннего естественного вскармливания;
• несовершенством местного иммунитета. Одним из ведущих звеньев патогенеза НЭК, по
мнению большинства авторов, является нарушение микроциркуляции в кишечнике. Гипоксия, особенно внутриутробная, может существенно изменять кровоснабжение желудочно-кишечного тракта. У детей, перенесших внутриутробную гипоксию, изменения кровотока в системе мезентериальных сосудов сохраняются и постнатально, при этом в этой группе детей гораздо чаще (в 86% по сравнению с 24% в контрольной группе) встречаются симптомы дизадаптации желудочно-кишечного тракта к энтеральному питанию. Гипоксия как мощный стрессорный фактор активирует иммунную систему, что отражается в повышении синтеза провоспали-тельных цитокинов и других регуляторных веществ. Однако ишемия кишечной стенки не является единственным патогенетическим фактором при НЭК. Клинические и патоморфологические изменения при НЭК свидетельствуют о синергизме действия ишемии и бактериальных факторов агрессии в ходе развития заболевания.
Ишемия с последующей реперфузией способствует поддержанию повышенной проницаемости кишечной стенки, характерной для недоношенных детей. Повышенная проницаемость облегчает транслокацию бактерий в стенку кишки, а затем в системный кровоток. Важно при этом, что массивное обсеменение полости кишечника бактериями может привести к транслокации даже при отсутствии изменения проницаемости и нарушений межклеточных контактов, например у ряда доношенных детей с НЭК.
У детей с НЭК в высоком проценте случаев высеваются микроорганизмы, способные оказывать повреждающее действие на стенку кишки: E. coli, Klebsiella, Staphilococcus, Bactеroides fra-gilis, Clostridium perfringens, Clostridium deficile, Enterobacter. Однако статистический анализ факторов риска возникновения НЭК не позволяет выявить какой-либо один микроорганизм, обсеменение которым являлось бы независимым фактором риска возникновения энтероколита. Особая роль в инициации воспалительного процесса в кишечной стенке при НЭК принадлежит липополисахариду (ЛПС)
грамотрицательных бактерий. Содержание ЛПС в стуле детей с НЭК существенно выше, чем у детей без НЭК; отмечается также разница выраженности экскреции липополи-сахарида со стулом при разных стадиях заболевания. ЛПС в результате взаимодействия с ТЬВ.2-рецепторами на энтероците активирует продукцию циклооксигеназы 2, обеспечивающей реакции синтеза про-стагландинов, тромбоксанов и лейкотриенов в энтероците. При НЭК обнаружен более высокий уровень (по сравнению с уровнем при пороках развития кишки) интерлейкина 1Р (1Ь-1Р), более высокий уровень шВ.ЫЛ фактора некроза опухоли а (ТМБ-а), 1Ь-8, И-11, Н-18, И-12. 84% детей с НЭК имеют все признаки не только локальной, но и системной воспалительной реакции, при развитии перфораций кишечника частота встречаемости системной воспалительной реакции достигает 100%.
НЭК развивается в 70-80% случаев после начала энтерального питания, поэтому принято факт наличия энтерального питания относить к факторам риска развития НЭК. Однако возможно возникновение заболевания и на полном парентеральном питании (ППП). Практика последних десятилетий, а также ряд научных работ доказывают важную роль практики вскармливания в развитии НЭК. Более осторожное назначение энтерального питания под строгим контролем усвоения снизило частоту возникновения заболевания во многих неонатальных центрах. В настоящее время не вызывает сомнений необходимость строгого клинического и лабораторного контроля за усвоением энтерального питания недоношенными детьми.
Увеличение доли грудного молока в питании детей с очень низкой массой тела снижает частоту НЭК и сепсиса по сравнению с детьми, вскармливаемыми смесями для недоношенных. Частота НЭК падает прямо пропорционально в зависимости от доли грудного молока в питании недоношенных. Профилактическая роль естественного вскармливания заключается, вероятно, в способности снижать провоспалительный ответ и обеспечивать репарацию слизистой.
НЭК гистологически характеризуется воспалением и обширным повреждением тканей стенки кишки. Специфичными гистопатологическими изменениями на начальных стадиях являются отек и отслойка эпителия ворсин, выраженная лейкоцитарная инфильтрация, затем появляются признаки деструкции ворсин, отека подслизи-стой оболочки, появление в ней микрогеморрагий, микротромбозов, стаза крови в капиллярах. При тяжелом течении может произойти полное исчезновение структуры ворсинок, изъязвления слизистой, визуализируются пузырьки газа (пневматоз), в
Ü 3<
ш
<
OJ
подслизистой оболочке и под серозной оболочкой. Пневматоз кишечной стенки часто обнаруживается при НЭК у новорожденных, но не является специфическим симптомом, так как встречается и при других патологиях и в более старшем возрасте. Некоторые авторы расценивают пневматоз желудка как маркер фульминантного течения НЭК. Серозная оболочка утолщается за счет отека. На стадии прогрессирования на фоне диффузного воспаления кишечной стенки возникают участки некроза и перфорации. При прогрессировании процесса развивается трансмуральный некроз кишечной стенки с последующей перфорацией. В некоторых случаях множественные некротические сегменты кишки перемежаются с пораженными, но жизнеспособными тканями. Как при наличии перфорации, так и при массивном некрозе кишки без перфорации развивается перитонит.
Наиболее частой локализацией перфораций являются терминальный отдел подвздошной кишки, слепая кишка, печеночный и селезеночные углы толстой кишки.
У больных с НЭК выявлены типичные симптомы вторичной нейронной дисплазии. Обнаруживаются дегенеративные изменения подслизистого и межмышечного сплетения нервной системы кишки. Сплетения теряют глиальные клетки и нейроны, в ганглиях обнаруживаются участки лизиса в
центре, ганглии напоминают «пустые корзины». Обнаруживаются повреждения, напоминающие фокальный аганглиоз. Снижается продукция ин-гибирующих мышечный тонус нейромедиаторов: вазоактивного интестинального пептида и оксида азота. Изменения в подслизистом сплетении доминируют, и они тем выраженнее, чем сильнее повреждение слизистой. Таким образом, при НЭК наблюдаются дегенеративные изменения нервных сплетений кишечника, возможно, вторичные по отношению к гипоксемии.
Процессы репарации в кишечной стенке в период реконвалесценции происходят медленно. Деструктивные изменения слизистой (отек, отслойка эпителия ворсин) могут сохраняться до месяца и более. В исходе воспаления в некоторых фрагметах кишки могут формироваться участки стеноза.
Классификация НЭК предложена впервые в 1978 году M. Bell и соавторами. Согласно классификации Белла, различают следующие стадии НЭК:
I стадия:
1. наличие крови в стуле;
2. большой остаточный объем в желудке при зондовом питании;
3. вздутие и напряжение живота, пальпация плотных петель кишечника;
4. на рентгенограмме — растяжение кишечных петель, пневматоз кишки.
КЛАССИФИКАЦИЯ НЕКРОТИЗИРУЮЩЕГО ЭНТЕРОКОЛИТА (НЭК) (M. WALsH, R. KLEIGMAN, 1986)
Стадии течения НЭК Симптомы
общие со стороны ЖКТ Rg-логические
Подозреваемый НЭК 1А Неустойчивая 1°, апноэ, брадикардия, вялость. Незначительное вздутие живота Кишечные петли обычные или расширены, возможно появление горизонтальных уровней жидкости
1Б Те же Те же + примесь крови в кале Те же
Явный НЭК 2А обратимая стадия Те же Те же + парез кишечника с или без реакции на пальпацию живота Расширение кишечных петель с множественными горизонтальными уровнями, пневматоз кишечной стенки
2Б необратимая стадия Те же + умеренно выраженный ацидоз и тромбо-цитопения Те же Те же + газ в воротной вене, асцит
Прогрессирующий НЭК ЗА Те же + смешанный ацидоз, тромбоцитопения, ней-тропения, артериальная гипотензия, коагуляцион-ные нарушения Разлитой перитонит, резкое вздутие живота, кровавый стул, парез кишечника с реакцией на пальпацию живота Расширение кишечных петель, множественные горизонтальные уровни, пневматоз кишечной стенки, газ в воротной вене, выраженный асцит
ЗБ Те же + ДВС-синдром Разлитой перитонит, резкое вздутие живота, кровавый стул, парез кишечника с реакцией на пальпацию живота. Расширение кишечных петель, множественные горизонтальные уровни, пневматоз кишечной стенки, газ в воротной вене, выраженный асцит, пневмоперитонеум
II стадия:
1. нарастание увеличения живота и напряжения передней брюшной стенки, ее покраснение или цианоз на фоне ухудшения состояния;
2. нарастающие тромбоцитопения и ацидоз;
3. на рентгенограмме — наличие жидкости в брюшной полости.
III стадия:
1. развитие перфорации и перитонита;
2. развитие шока.
В последующем предложена классификация Walsh и Kleigman (1986), учитывающая стадийные изменения общеклинических, гастроэнтерологических и рентгенологических симптомов (см. табл.).
КЛИНИКА НЭК
В отечественной практике в клиническом течении НЭК принято выделять 4 стадии. Принципиальным отличием от классификации Бэлла является выделение стадии продрома, когда нет достоверных признаков НЭК. Большой вклад в изучение проблемы НЭК внесли представители отечественной школы детских хирургов, в частности Т.В. Красовская. Выделение данной стадии снижает риск несвоевременной диагностики и позволяет вовремя изменить тактику ведения больного.
1. Стадия продрома.
• Вздутие живота.
• Увеличивается объем застойного содержимого в желудке.
• Срыгивание.
• Стул зеленый со слизью.
• Иногда сначала появляются симптомы со стороны дыхательной системы — увеличивается работа дыхания, требуются более жесткие параметры ИВЛ, возникают приступы апноэ.
2. Стадия клинических проявлений. Вялое сосание.
Частое срыгивание, в том числе с примесью желчи.
Потеря в весе. Урежение стула.
Кровь в стуле (определяемая визуально или по реакции на скрытую кровь). Иногда стул жидкий, развивается эксикоз.
3. Стадия предперфорации. Рвота кишечным содержимым и желчью. Рвота «кофейной гущей». Резкое вздутие живота.
Напряжение, болезненность передней брюшной стенки.
Отечность, синюшность передней брюшной стенки.
Перистальтика вялая или ее нет. Стула нет или скудный с алой кровью. Анус сомкнут, легкая ранимость слизистой кишки.
4. Стадия перфорации и перитонита. Перитонеальный шок.
Признаки наличия воздуха в брюшной полости.
Детей с НЭК следует рассматривать как группу высокого риска по развитию сепсиса. У 84% детей с НЭК выявляются признаки системной воспалительной реакции. У 60% детей в период течения НЭК выявляются другие гнойно-воспалительные заболевания. Как минимум у 75% детей с НЭК наблюдается полиорганная недостаточность с вовлечением 2 и более систем; для НЭК типичны нарушения кислотно-щелочного равновесия — метаболический ацидоз, гипо- и гипергликемия, ДВС-синдром. Частота встречаемости системного воспаления и полиорганной недостаточности нарастает с прогресси-рованием заболевания.
Течение заболевания чаще циклическое, однако возможны рецидивы заболевания, в том числе после закрытия кишечных стом.
Диагностика основана на оценке вышеназванных факторов риска, клинической картины, рентгенологическом исследовании. Также используется ультразвуковое исследование брюшной полости, в сомнительных случаях — лапароцентез.
Рентгенологические признаки НЭК.
1. Расширение кишечных петель (55100% случаев).
2. Снижение газонаполнения и асимметричное расположение кишечных петель
3. Пневматоз кишечной стенки (19-98%).
4. Газ в портальной системе (61% при тотальном поражении).
5. Пневмоперитонеум (12-30%).
6. Жидкость в брюшной полости (11%), косвенными признаками наличия которой являются:
• сильное вздутие живота при отсутствии газонаполнения кишечных петель;
• переполненные газом петли кишечника в центре
брюшной полости;
• разделение кишечных петель.
1. Персистирующая дилатация кишечных петель.
2. Наличие неподвижной (статичной) петли.
3. Токсическая дилатация толстой кишки.
4. Расширение желудка.
Рентгеноконтрастное исследование с метриза-мидом используется для диагностики перфорации полого органа. В стадии реконвалесценции и при подготовке к оперативному вмешательству по закрытию ранее наложенной кишечной стомы для оценки проходимости кишечника используется рентгеноконтрастное исследование отводящего отдела.
При ультразвуковом исследовании брюшной полости также могут быть выявлены газ в брюшной полости, наличие жидкости, симптом «мишени», утолщение стенок кишечных петель, пневматоз, газ в системе портальной вены..
Для комплексной диагностики и мониторинга состояния оценивается наличие следующих данных дополнительных методов обследования:
1. Признаков воспалительной реакции в клиническом анализе крови (лейкоцитоз или лейкопения, нейтрофилез или нейтропения, лимфопения, сдвиг формулы влево, тромбоцитопения).
2. По данным биохимического анализа крови — воспалительного синдрома (повышение С-реактивного белка, прокальцитонина, a2-фракции глобулинов), гипонатриемии, признаков нарушения экскреторной функции почек, синдрома цитолиза, синдрома холестаза.
3. Метаболического ацидоза по данным КОС.
4. Положительная реакция на скрытую кровь в кале.
5. Признаков ДВС-синдрома в коагулограмме.
6. Положительных результатов посева крови.
7. Для подбора адекватной антибактериальной терапии показано проведение посевов из ануса, кишечной стомы (при ее наличии) с определением антибиотикочувствительности микрофлоры. Желательно определение метаболитов анаэробной флоры и грибов в крови.
ЛЕЧЕНИЕ
При подозрении на НЭК немедленно проводят следующие консервативные мероприятия:
1. Прекращают энтеральное питание и отменяют прием препаратов per os.
2. Проводят декомпрессию желудка (назо- или орогастральный зонд открывают и опускают отверстие зонда ниже уровня желудки ребенка, объем и характер отделяемого фиксируют).
3. Проводят посиндромную терапию: респираторную поддержку, купирование нарушений гемодинамики, коррекцию КОС, электролитных нарушений, эксикоза, нарушений гемостаза, болевого синдрома.
4. Проводят полное парентеральное питание (соответственно постконцептуальному возрасту и с учетом наличия сепсиса, полиорганной недостаточности).
5. Текущие антибиотики заменяют с учетом возможной роли анаэробной флоры в сочетании с госпитальными штаммами Гр- и Гр+ бактерий с последующей сменой с учетом чувствительности.
Проведение очистительных клизм при энтероколите может спровоцировать перфорацию кишечника.
Показания к хирургическому лечению:
1. Опухолевидное образование брюшной полости.
2. Воспалительные изменения брюшной стенки. Уплотнение, отек или фиброзное воспаление подкожной клетчатки брюшной стенки — грозные признаки, которые обычно появляются при наличии подлежащего абсцесса, перитонита или гангрены кишки.
3. Специфическая рентгенологическая картина (пневмоперитонеум, признаки асцита, симптом «статичной петли»).
4. Лабораторные данные. Остро возникшая тромбоцитопения, коагуляционные нарушения, тяжелая гипонатриемия и стойкий ацидоз подтверждают наличие некроза кишечной стенки.
5. Абдоминальный парацентез. О некрозе кишечной стенки свидетельствуют следующие данные: мутная жидкость коричневого цвета, выявление при окраске по Граму внеклеточных бактерий, большое число лейкоцитов, преобладание нейтрофилов — более 80%.
Возобновление ЭП у больных с НЭК проводится постепенно. Назначение ЭП возможно в случае полного купирования болевого синдрома, отсутствия признаков раздражения брюшины, синдрома срыгивания, геморрагического синдрома, восстановления перистальтики (обычно не ранее 3 суток), купирования системного воспаления и ДВС-синдрома. После устранения перечисленных клинических симптомов возможно начало энте-рального питания. В ряде учреждений предваряют питание введением изоосмолярной жидкости: физиологического раствора или глюкозо-солевого раствора в объеме, соответствующем трофическому питанию (около 0,5 мл/кг/час), в течение 0,5-1 суток. При удовлетворительном усвоении жидкости: отсутствии застойного содержимого в желудке, срыгивания, нарастания вздутия живота, сохранении удовлетворительной перистальтики, наличии самостоятельного стула без примеси крови возможно назначение продуктов для эн-терального питания. Появление перечисленных симптомов НЭК на любом из этапов проведения питания является показанием к его отмене и возобновлению полного парентерального питания. В качестве первого продукта для энтерального питания в случае наличия молока у матери возможно назначение нативного грудного молока собственной матери в сочетании с препаратами лактазы. При отсутствии нативного грудного молока после периода парентерального питание предпочтительно вскармливание смесями на основе гидролизата белка высокой степени в разведении водой 3:1 (25%-ная смесь), затем 1:1 (50%-ная смесь), потом в стандартной концентрации. После полного купирования воспалительного процесса и перевода на полное энтеральное питание смесями на основе гидролизата белка недоношенным постепенно вводятся смеси для недоношенных детей, доношенным детям — стандартные адаптированные смеси или безлактозные смеси в зависимости от наличия вторичной лактазной недостаточности. По показаниям назначаются панкреатические ферменты, проводится коррекция дисбиотических нарушений. Вскармливание детей, перенесших в связи с перфорацией или некрозом кишечника оперативное вмешательство, проводится по соответствующим
протоколам ведения детей с пострезекционным синдромом.
Исходы. У детей, перенесших НЭК, но не потребовавших резекции кишечника, могут сохраняться нарушения моторики кишечника, вторичная лактазная недостаточность в течение 1-3 месяцев после заболевания, но к 3 месяцам в большинстве случаев переваривающая и всасывательная функции нормализуются. У детей, перенесших резекцию кишечника в связи с некрозом кишки, перфорацией, перитонитом, прогноз будет определяться
объемом резекции (наиболее неблагоприятны варианты с обширной резекцией тощей кишки), уровнем наложения стомы (если первое оперативное вмешательство проводилось с выведением стомы), состоянием отдела кишки, находящегося дистальнее перфорации. Дети с НЭК являются наиболее многочисленной группой среди детей, формирующих синдром короткой кишки (кишечную недостаточность в связи с потерей поверхности всасывания).
И] з<
ш
<
ЛИТЕРАТУРА
1. WalshM, KleigmanR. Necrotizing enterocolitis: treatment based on staging criteria.Pediat Clin N Amer, 1986; 33: 179-201.
2. Красовская Т.В., Кобзева Т.Н. Диагностика и интенсивная терапия в хирургии новорожденных. — М., 2001.
3. Гланц С. Медико-биологическая статистика. — М.: Практика, 1999.
t-П
Редкое осложнение некротического энтероколита у новорожденного
Некротический энтероколит (НЭК) является распространенным заболеванием новорожденных, которое требует неотложной помощи [1, 2, 4, 6]. За последнее десятилетие отмечается тенденция к снижению летальности от НЭК (17% в развитых странах и 42% в странах с низким и средним уровнем экономики соответственно) [2, 3, 5, 6]. Успех лечения при НЭК зависит от многих факторов, особенно от своевременной диагностики перехода заболевания из терапевтической стадии в хирургическую. Абсолютными показаниями к оперативному вмешательству являются перитонит, перфорация толстой кишки, ухудшение общего состояния [1-3, 5]. В клинике детской хирургии Запорожья мы наблюдали редкое осложнение НЭК. Приводим наше наблюдение.
Больной С., 6 мес, поступил в клинику детской хирургии с тонкокишечным и толстокишечным свищами.
Из анамнеза известно, что 15.08.14 ребенок родился недоношенным массой тела 2700 г, оценка по шкале Апгар 7 баллов.
К груди новорожденного приложили через 2 ч. На 2-е сутки ребенок стал беспокойным, отказывался от груди. Появился жидкий стул, температура 37,7 °С. В левой поясничной области был обнаружен участок гиперемии и инфильтрации размером 4×3 см. Ребенок направлен в клинику детской хирургии с диагнозом: «флегмона новорожденного».
При поступлении состояние тяжелое, температура 38,6 °С. Патологических изменений органов грудной клетки не выявили. Живот вздут, мягкий, безболезненный. Печень и селезенка не увеличены. Стул 4 раза, мочится свободно. В левой поясничной области виден инфильтрат размером 6×4,5 см, кожа над ним гиперемирована. 17.08 ребенок оперирован с диагнозом: «обширная флегмона новорожденного левой поясничной области». Флегмону вскрыли 16 разрезами, получили гной, раны дренировали турундами с гипертоническим раствором. Назначили антибиотики, перевязки 2 раза в сутки.
Состояние ребенка ухудшилось вечером 20.08, когда живот стал резко вздутым, появились напряжение передней брюшной стенки, рвота кишечным содержимым. После предоперационной подготовки ребенка оперировали 21.08 с диагнозом «распространенный перитонит». После срединной лапаротомии в брюшной полости обнаружили большое количество гноя. В нисходящем отделе ободочной кишки выявили множество перфоративных язв. Этот отдел толстой кишки на протяжении 11 см оказался некротизированным. Кроме того, диагностировали забрюшинную флегмону и гнойный паранефрит слева. Брюшную полость промыли фурацилином и резецировали нисходящую ободочную кишку на протяжении 15 см. Дистальный отдел нисходящей ободочной кишки ушили наглухо, проксимальный вывели через дополнительный разрез в левом подреберье в виде одноствольной колостомы. Забрюшинное и паранефральное пространства дренировали через разрез в левой поясничной области двумя трубками. Пересекли подвздошную кишку на расстоянии 20 см от баугиниевой заслонки. Дистальный конец тонкой кишки ушили наглухо, проксимальный вывели через отдельный разрез в правой подвздошной области в виде терминальной илеостомы. Тонкую кишку интубировали. Срединную рану ушили наглухо. Послеоперационное течение тяжелое. После 2-недельного пребывания в реанимационном отделении и в отделении патологии новорожденных (также в течение 2 нед) ребенка выписали в удовлетворительном состоянии.
За 5 мес ребенок прибавил в массе 3 кг. Его общее состояние удовлетворительное. В правой подвздошной области имеется терминальная илеостома, в левом — одноствольная колостома. Живот мягкий, безболезненный.
02.03.15 ребенку выполнили реконструктивно-восстановительную операцию — ликвидировали илеостому и колостому.
В ходе вмешательства между поперечной ободочной кишкой и дистальным отделом нисходящей ободочной кишки, а также между приводящей петлей тонкой кишки и дистальным участком подвздошной кишки сформировали два анастомоза по типу конец в конец.
Послеоперационное течение без осложнений, швы сняты на 10-е сутки, больного выписали на 16-е сутки в удовлетворительном состоянии.
Наблюдение приводим в связи с удачным лечением при редком осложнении некротического энтероколита. У ребенка возник некротический энтероколит нисходящей ободочной кишки, осложненный забрюшинной флегмоной и паранефритом слева, инфильтратом в левой поясничной области, который был принят за флегмону новорожденного. Окончательный диагноз сформулировали только в ходе диагностического этапа лапаротомии.
Некротический энтероколит новорожденных — причины, симптомы, диагностика и лечение
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения
Некротический энтероколит новорожденных или «болезнь выживших недоношенных» – это гетерогенная патология, которая характеризуется развитием язв и некрозов стенки кишечника с дальнейшей перфорацией. Более 90% больных детей – недоношенные, с массой тела до 1500г. Общая заболеваемость составляет 0,5-3 на 1000 новорожденных. Прогноз, как правило, неясен, т. к. для НЭК характерно резкое ухудшение состояния на фоне мнимого благополучия. Часто требуется хирургическое вмешательство. Летальность в зависимости от формы колеблется от 25 до 55%. Даже после успешного проведения операции показатель смертности составляет свыше 60%. При условии выживания ребенка наблюдается тяжелый период реабилитации, остается высокий риск послеоперационных осложнений.
Некротический энтероколит новорожденных
Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Ишемия кишечника может быть обусловлена внутриутробной асфиксией плода, при которой наблюдается централизация кровообращения, постановкой катетера в пупочную артерию, влекущей за собой спазм артерий и их тромбоэмболию, явлением «сгущения крови» и артериальной гипотензией, при которых нарушается ток крови и поступление питательных веществ. К алиментарным причинам развития некротического энтероколита новорожденных относят питание ребенка искусственными смесями и их резкую смену, использование гипертонических растворов, повреждающих слизистую оболочку кишечника, врожденную непереносимость молока, непосредственную инвазию патогенных агентов через ЖКТ. Наиболее часто причиной НЭК становятся Kl. pneumonia, E. coli, клостридии, стафилококки, стрептококки и грибы рода Candida.
Классификация НЭК новорожденных
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
- Молниеносная. Перфорация стенки кишечника возникает на протяжении 36-48 часов после проявления первых симптомов – незначительного нарушения общего состояния ребенка. Характерна для доношенных детей с аномалиями развития ЖКТ (гастрошизис), гемолитической анемией, травмами ЦНС.
- Острая. Дебют характеризуется абдоминальными симптомами. Как правило, спустя 8-16 часов присоединяются соматические проявления, резко ухудшается общее состояние ребенка. Без соответствующего лечения НЭК быстро переходит в 3 стадию. Наблюдается у детей с массой тела при рождении свыше 1500 г.
- Подострая. Первичные абдоминальные проявления имеют перемежающийся характер, возникают поэтапно. Соматические расстройства развиваются медленно. Для этой формы характерно рецидивирующее течение. Обычно возникает у глубоко недоношенных детей с массой тела менее 1500 г.
В зависимости от массивности поражения различают следующие варианты НЭК:
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
В группу соматических симптомов входят патологические реакции организма на развитие НЭК: приступы апноэ, респираторный дистресс, олигурия, ухудшение микроциркуляции (позитивный симптом «белого пятна»). К абдоминальным признакам НЭК относятся симптомы раздражения брюшной полости и дисфункция ЖКТ: потеря аппетита, метеоризм, рвота желчью и кровью, отсутствие перистальтических шумов, мелена, асцит, покраснение кожи, отечность подкожной жировой клетчатки и резкое напряжение мышц передней брюшной стенки. Нарушения в организме ребенка, возникшие в результате прогрессирования некротического энтероколита новорожденных, объединяют в группу генерализованных проявлений. Сюда входят гипертермия, переходящая в гипотермию, артериальная гипотония, бледность и диффузный цианоз, выраженная вялость и сонливость, ДВС-синдром, дыхательная и сердечно-сосудистая недостаточность.
Большинство осложнений некротического энтероколита новорожденных, как правило, развиваются после проведенного хирургического лечения. Наиболее часто после оперативного вмешательства возникает кишечный свищ, синдром «укороченной кишки», хроническая диарея, демпинг-синдром, обезвоживание, синдром мальабсорбции, стриктура толстого кишечника, абсцесс, задержка физического развития. Также при НЭК могут встречаться патологические состояния, вызванные полным парентеральным питанием: дефицит витамина D (рахит), поражение печени (гепатит) и костей (деминерализация).
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Ведущую роль в диагностике некротического энтероколита новорожденных играют инструментальные методы: рентгенография, УЗИ, КТ и МРТ. Они дают возможность визуализировать отек стенок кишечного тракта, плюс-ткань, наличие воздуха в брюшной полости, в просвете портальной или печеночной вен, а также отсутствие перистальтики на серии последовательных снимков. В педиатрии для подтверждения диагноза «некротический энтероколит новорожденных» и определения стадии заболевания применяется шкала Walsh и Kliegman. При использовании данной шкалы учитываются присутствующие у ребенка соматические симптомы, проявления со стороны желудочно-кишечного тракта и рентгенологические признаки. В зависимости от количества и выраженности проявлений выделяют подозреваемый НЭК (1а и 2а ст.), явный НЭК (2а и 2б ст.), прогрессирующий НЭК (3а и 3б ст.). Это имеет существенное значение при выборе тактики лечения.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Детям с 2б, 3а и 3б стадиями показано хирургическое вмешательство. Объем операции зависит от распространенности поражения кишечника. Как правило, проводится экономная резекция пораженного участка с формированием энтеростомы или колостомы. При локальных формах НЭК возможно наложение анастомоза по типу «конец в конец». После операции назначается инфузионная терапия и медикаментозное лечение, аналогичное более ранним стадиям.
Прогноз и профилактика НЭК новорожденных
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
Исследование томского учёного поможет спасти жизни недоношенных новорожденных
По итогам конкурса «Российского фонда фундаментальных исследований» на лучшие проекты фундаментальных научных исследований, выполняемые молодыми учеными, обучающимися в аспирантуре, аспирант СибГМУ Леонид Ким получил финансирование на выполнение исследовательского проекта «Ранняя диагностика некротизирующего энтероколита у недоношенных новорожденных детей». Научным руководителем выступит доктор медицинских наук, заведующий кафедрой госпитальной педиатрии, профессор Виктор Желев. Полученные средства пойдут на изучение белка I-FABP в качестве предиктора возникновения заболевания.
Некротизирующий энтероколит (НЭК) – тяжелое желудочно-кишечное заболевание новорожденных, характеризующееся воспалением, приводящим к некрозу и перфорации кишечной стенки, перитониту. Некротизирующий энтероколит может возникнуть по нескольким причинам: генетическая предрасположенность, кишечная незрелость, неправильная микробная колонизация. НЭК называют «болезнью выживших недоношенных». По статистике, около 2,1% новорожденных, поступающих в отделение патологии новорождённых и недоношенных детей, страдают данным заболеванием. Как правило, болезнь развивается в первые две недели жизни, но у 16% пациентов может возникнуть и сразу после рождения. Прогноз заболевания, зачастую, неоднозначен – нередко у маленьких пациентов возникает резкое ухудшение состояния на фоне общей положительной динамики.
Среди врачей, на сегодняшний день, нет единого мнения о патогенезе заболевания. Ученые и врачи находятся в поиске способов профилактики и ранней диагностики заболевания. Среди специфических признаков заболевания выделяют пневматоз кишечника на рентгенограмме или газ в воротной вене при УЗИ, но данная симптоматика появляется на поздних стадиях болезни. Неспецифические ранние признаки НЭК часто ошибочно диагностируют, как сепсис у новорожденных. Именно поэтому детские хирурги и неонатологи чаще сталкиваются с заболеванием уже на стадии перитонита, когда прогноз для жизни больных ухудшается, а летальность достигает 70%, в случае развития обширного некроза кишечника — 100%.
Таким образом, для спасения жизни пациентов с некротизирующим энтероколитом необходимо выбрать корректную тактику лечения на самых ранних этапах, а это возможно только при выявлении новых биомаркеров, подходящих для ранней диагностики НЭК.
«Некротизирующий энтероколит характеризуется разрушением слизистого слоя и трансмуральным некрозом кишечной стенки, — прокомментировал Леонид Ким. — Поэтому мы будем исследовать неинвазивный тест, который отразит это разрушение до того, как оно станет видимым на рентгеновском снимке».
Суть теста заключается в измерении концентрации кишечного белка Intestinal Fatty-Acid Banding Protein (I-FABP) в моче пациента. Кишечный белок, связывающий жирные кислоты – это небольшой цитоплазматический белок, расположенный в энтероцитах, участвующих в поглощении и транспорте полярных липидов, таких как жирные кислоты, из просвета тонкой кишки. Данный белок попадает в кровоток во время смерти энтероцитов. Его содержание в зрелых энтероцитах составляет до 2%. Поэтому содержание I-FABP увеличивается в сыворотке даже у здоровых людей после операций на брюшной полости, травм или употребления алкоголя, и может являться маркером повреждения клеток кишечника. Благодаря небольшому размеру (14-15 кДа) белок I-FABP может быстро проходить через почку, что и дает возможность оперативного определения его концентрации в моче.
В ходе исследования планируется изучить белок I-FABP в качестве предиктора возникновения НЭК и на его основе разработать дополнительные критерии тяжести и неблагоприятного течения заболевания. Разработанные критерии позволят не только выявлять НЭК на ранних стадиях развития заболевания у новорождённых, но и диагностировать некротический энтероколит, что позволит улучшить выживаемость пациентов.
Ультразвуковая диагностика некротического энтероколита | Пыков
1. Кучеров Ю.И., Жиркова Ю.В.,. Шишкина Т.Н., Михалев И.А., Арса А.В., Чеботаева Л.И. Диагностика и лечение некротического энтероколита у недоношенных. Российский вестник перинатологии и педиатрии, 2014, 6: 18-25.
2. Нассер М.М.А.М. Заболеваемость и лечебнодиагностическая тактика ведения новорожденных с язвенно-некротическим энтероколитом. Бюллетень медицинских интернет-конференций, 2014, 4(5). ID: 2014-05-4-Т-3811.
3. Bhatt D, Travers C, Patel RM, Shinnick J, Arps K, Keene S, Raval MV. Predicting Mortality or Intestinal Failure in Infants with Surgical Necrotizing Enterocolitis. J. Pediatr, 2017 Dec, 191: 22-27.
4. Zhang LP, Lei XP, Luo LJ, Dong WB. Risk factors for necrotizing enterocolitis in very preterm infants: a case-control study in southwest China. J Matern Fetal Neonatal Med, 2017 Nov, 2: 1-6.
5. Frost BL, Modi BP, Jaksic T, Caplan MS. New Medical and Surgical Insights Into Neonatal Necrotizing Enterocolitis: A Review. JAMA Pediatr, 2017 Jan 1, 171(1): 83-88.
6. Velazco CS, Fullerton BS, Hong CR, Morrow KA, Edwards EM3, Soll RF, Jaksic T, Horbar JD, Modi BP. Morbidity and mortality among «big» babies who develop necrotizing enterocolitis: A prospective multicenter cohort analysis. J Pediatr Surg, 2017 Oct 12. pii: S 0022-34 (17) 30650-4.
7. Parigi GB. Pathogenesis and treatment of necrotizing enterocolitis. Lecture. Dept. of Paediatric Surgery. University of Pavia and «S. Matteo». Research Hospital: Pavia, 2010, 11.
8. Федоров Д.А. Хирургическое лечение некротизирующего энтероколита у новорожденных с синдромом интраабдоминальной гипертензии (экспериментально-клиническое исследование): Автореф. дисс. … канд. мед. наук. Омск 2012, 23.
9. Katheleen M, Moss L. Necrotizing enterocolitis. Clinics inperinatology, 2012: 387-401.
10. Караваева С.А. СПб. Некротический энтероколит – диагностика и лечение. http://www.medico.ru/articles/surgery/article_003.htm.
11. Дамиров О.Н. Обоснование тактики лечения хирургического лечения язвенно-некротического энтероколита у новорожденных: Автореф. дисс. … канд. мед.наук. Волгоград, 2015, 23.
12. Choi YS, Song IG. Fetal and preterm infant microbiomes: a new perspective of necrotizing enterocolitis. Korean J Pediatr, 2017 Oct, 60 (10): 307-311.
13. Esposito F, Mamone R, Di Serafino M, Mercogliano C, Vitale V, Vallone G, Oresta P. Diagnostic imaging features of necrotizing enterocolitis: a narrative review. Quant Imaging Med Surg, 2017 Jun, 7(3): 336-344.
14. Hashem RH, Mansi YA, Almasah NS, Abdelghaffar S. Doppler ultrasound assessment of the splanchnic circulation in preterms with neonatal sepsis at risk for necrotizing enterocolitis. J Ultrasound, 2017 Jan 23, 20(1): 59-67.
15. Staryszak J, Stopa J, Kucharska-Miąsik I, Osuchowska M, Guz W, and Witold. Usefulness of Ultrasound Examinations in the Diagnostics of Necrotizing Enterocolitis. Polih Journal of Radiology, 2015, 80: 1–9.
16. Aliev MM, Dekhqonboev AA, Yuldashev RZ. Advantages of abdominal ultrasound in the management of infants with necrotizing enterocolitis. Pediatr Surg Int, 2017 Feb, 33(2): 213-216.
17. Пыков М.И., Гуревич А.И., Османов И.М., Галкина Я.А., Полещук Л.А., Балашов В.В. Детская ультразвуковая диагностика: Учебник. Том 1. Гастроэнтерология. Под ред. М.И. Пыкова. М.: Издательский дом Видар-М, 2014. 256 с.
18. Миронюк О.А., Пыков М.И. Ультразвуковые симптомы некротического энтероколита. Ультразвуковая и функциональная диагностика, 2013, 4: 49-54.
19. Barczuk-Falęcka M, Bombiński P, Majkowska Z, Brzewski M, Warchoł S. Hepatic Portal Venous Gas in Children Younger Than 2 Years Old — Radiological and Clinical Characteristics in Diseases Other Than Necrotizing Enterocolitis. Pol J Radiol, 2017 May 19, 82: 275-278.
Некротический энтероколит (для родителей) — Nemours Kidshealth
Что такое некротический энтероколит?
Некротический энтероколит (nek-roh-TIE-zing en-ter-oh-coh-LIE-tis), или NEC, является наиболее распространенным и серьезным заболеванием кишечника среди недоношенных детей. Это происходит при повреждении или воспалении тканей тонкой или толстой кишки. Это может привести к отмиранию кишечной ткани и, в некоторых случаях, к отверстию (перфорации) в стенке кишечника.
В NEC кишечник больше не может удерживать отходы.Итак
бактерии могут попасть в кровоток и вызвать опасную для жизни инфекцию. Отходы могут попасть в брюшную полость ребенка и вызвать сильное заболевание ребенка. Травмированный кишечник или его части могут погибнуть, и их необходимо удалить.
Каковы признаки и симптомы некротического энтероколита?
У ребенка с некротическим энтероколитом могут быть следующие симптомы:
- опухший, красный или болезненный живот
- проблемы с кормлением
- Пища остается в желудке дольше, чем ожидалось
- запор
- диарея и / или темный или кровавый стул (фекалии)
- менее активен или апатичен
- низкая или нестабильная температура тела
- зеленая рвота (содержащая желчь)
- апноэ (паузы на дыхании)
- брадикардия (замедление пульса)
- гипотония (пониженное давление)
Симптомы NEC могут варьироваться от ребенка к ребенку и быть похожими на симптомы, вызванные другими проблемами пищеварения.
Что вызывает некротический энтероколит?
Не существует единой устойчивой причины некротического энтероколита. В большинстве случаев конкретная причина не обнаруживается. Но эксперты считают, что эти вещи могут сыграть роль:
- недоразвитый (преждевременный) кишечник
- Недостаточный приток кислорода или крови к кишечнику при рождении или позже
- Повреждение слизистой оболочки кишечника
- Сильный рост бактерий в кишечнике, разрушающий стенку кишечника
- Вирусная или бактериальная инфекция кишечника
- кормление смесью (младенцы, находящиеся на грудном вскармливании, имеют более низкий риск НЭК)
NEC иногда, кажется, происходит «группами», поражая нескольких младенцев в одной и той же детской.Это могло быть случайным совпадением, но около
вирусы и бактерии иногда обнаруживаются у детей с НЭК. NEC не передается от одного ребенка к другому, но может передаваться вызывающими его вирусами или бактериями. Это одна из причин, по которой все детские сады и отделения интенсивной терапии принимают очень строгие меры предосторожности, чтобы предотвратить распространение инфекции.
Кто заболевает некротическим энтероколитом?
В большинстве случаев некротический энтероколит встречается у детей, родившихся до 32 недель беременности. Но доношенные дети, у которых есть проблемы со здоровьем, например, порок сердца, тоже могут иметь это.У младенцев с НЭК он обычно развивается в течение первых 2–4 недель жизни.
с.
Как диагностируется некротический энтероколит?
У младенцев с симптомами НЭК диагноз может быть подтвержден, если на рентгеновском снимке выявляются патологические газы. Это похоже на появление пузырьков или полосок газа в стенках кишечника.
В тяжелых случаях воздух выходит из кишечника и обнаруживается в крупных венах печени или брюшной полости. Врач может ввести иглу в живот, чтобы удалить жидкость, чтобы проверить, есть ли отверстие в кишечнике.
Как лечится некротический энтероколит?
После постановки диагноза лечение начинается немедленно. Включает:
- временная остановка всех кормлений
- Назогастральный или орогастральный дренаж (введение трубки через нос или рот в желудок для удаления воздуха и жидкости из желудка и кишечника)
- Внутривенные (вводимые в вену) жидкости для восполнения жидкости и питания
- Антибиотики для лечения или профилактики инфекций
- частые осмотры и рентген брюшной полости
- Консультация детского хирурга для обсуждения операции, при необходимости
- в тяжелых случаях может потребоваться немедленная операция
В каловых массах ребенка проверяют наличие крови и регулярно проверяют размер живота.Отверстие в кишечнике или инфекция в брюшной полости вызывают вздутие живота. Если живот ребенка настолько раздут, что мешает дыханию, дополнительный кислород или дыхательный аппарат (вентилятор) помогут ребенку дышать. Кроме того, анализы крови будут искать бактерии и проверять анемию (уменьшение красных кровяных телец).
После реакции на лечение ребенок может вернуться к обычному кормлению через неделю или две. Когда кормление начинается снова, рекомендуется грудное молоко. Грудное молоко полезно для детей с НЭК, потому что оно легко переваривается, поддерживает рост здоровых бактерий в кишечном тракте и повышает иммунитет ребенка, что особенно важно для недоношенных детей с незрелой иммунной системой.
Женщинам, которые не могут кормить грудью или обеспечивать достаточное количество грудного молока, врачи могут порекомендовать давать ребенку пастеризованное грудное молоко из банка молока, что считается безопасной альтернативой. Также может использоваться специальная формула.
Некоторым младенцам потребуется операция, если их состояние ухудшится, несмотря на медицинскую помощь. Хирург будет искать отверстие в кишечнике и удалять мертвые или умирающие ткани кишечника. В некоторых случаях после удаления здоровый кишечник можно снова сшить.В других случаях, особенно если ребенок очень болен или был удален большой участок кишечника, выполняется стома . Во время стомы хирурги подводят часть кишечника к отверстию на брюшной полости (стоме), чтобы стул мог безопасно выйти из тела. Вторая операция может быть сделана для повторного обследования кишечника. Если сделана стома, ее закрывают через 6–8 недель, после того как кишечник полностью заживет и снова станет здоровым.
Чего я могу ожидать?
Большинство детей, у которых развивается НЭК, полностью выздоравливают и больше не имеют проблем с кормлением.В некоторых случаях кишечник имеет рубцы, сужение или закупорку. В таком случае может потребоваться дополнительная операция.
Мальабсорбция (когда кишечник не может нормально усваивать питательные вещества) может быть постоянной проблемой со стороны NEC. Это чаще встречается у младенцев, у которых удалена часть кишечника. Ребенку с нарушением всасывания может потребоваться питание, вводимое непосредственно в вену, пока кишечник не заживет достаточно хорошо, чтобы переносить нормальное кормление.
Если у вашего ребенка NEC, беспокоиться нормально. И невозможность кормить ребенка может расстраивать — младенцы такие маленькие, что просто не кажется правильным прекращать кормление или отнимать драгоценное время для связывания.Но это может быть лучшим вариантом для вашего ребенка во время лечения. И помните, есть большая вероятность, что ваш ребенок скоро вернется к обычному кормлению.
А пока спросите члена вашей группы по уходу, что вы можете сделать, чтобы заботиться о своем ребенке и поддерживать с ним связь. Есть способы, которыми вы можете помочь. Члены вашей группы по уходу готовы поддержать родителей недоношенных детей, а также самих недоношенных детей на пути к выздоровлению.
Некротический энтероколит — НОРД (Национальная организация по редким заболеваниям)
НОРД благодарит Арвина Бандху, доктора медицины, и Адама Матсона, доктора медицины, отделения неонатологии Детского медицинского центра Коннектикута, Хартфорд, Коннектикут; Департаменту педиатрии Медицинской школы Университета Коннектикута, Фармингтон, Коннектикут, за подготовку этого отчета.
Общие обсуждения
Резюме
Некротический энтероколит, сокращенно НЭК, представляет собой разрушительное заболевание, поражающее кишечник новорожденного. Обычно это происходит у недоношенных детей, родившихся менее 37 недель, и характеризуется тяжелым воспалением тонкого или толстого кишечника ребенка, которое может прогрессировать до отмирания тканей (некроза). НЭК встречается примерно в 1 случае на 1000 живорожденных [1]. НЭК может возникать у доношенных детей, но гораздо чаще встречается у очень недоношенных детей, особенно у детей с очень низкой массой тела при рождении — заболеваемость колеблется от 3% у младенцев с массой тела при рождении от 1251 до 1500 граммов (2 фунта 12,5 кг).От 13 унций до 3 фунтов (4,91 унции) до 11% для младенцев, рожденных с массой тела менее 750 граммов (1 фунт 10,46 унции) [2]. НЭК обычно возникает у новорожденного в возрасте нескольких недель, получающего энтеральное питание. Первоначально у младенцев наблюдается рвота, большой вздутие живота, кровавый стул, длительные паузы в дыхании и снижение активности. Это может привести к некрозу и перфорации кишечника. Медикаментозное лечение включает прекращение энтерального питания (введение полноценного питания непосредственно в желудок), назначение антибиотиков широкого спектра действия и поддерживающую терапию [3].Хирургическое вмешательство показано при наличии признаков перфорации и некроза кишечника. Это серьезное заболевание желудочно-кишечного тракта связано со значительной заболеваемостью (осложнениями, связанными с заболеванием) и смертностью. Несмотря на лечение, около 15% младенцев, у которых развивается НЭК, умирают, а некоторые выжившие младенцы страдают от многочисленных осложнений, таких как синдром короткой кишки, медленный рост и долгосрочные нарушения развития нервной системы [4]. Точный механизм этого заболевания, хотя и не полностью изучен, считается многофакторным и связан с преждевременным кишечником, аномальной микробной колонизацией кишечника и воспалением кишечника.
Введение
НЭК остается ведущей причиной заболеваемости и смертности в отделении интенсивной терапии новорожденных, несмотря на значительные успехи в оказании помощи недоношенным детям [5; 6]. Это остается в первую очередь болезнью недоношенных. У доношенных детей с такими факторами риска, как врожденный порок сердца, сепсис или гипотензия (низкое артериальное давление), также может развиться НЭК [7]. Классификация Белла была введена в 1978 г. и до сих пор широко используется для определения клинической стадии НЭК в зависимости от тяжести заболевания: при подозрении на НЭК I стадия, подтвержденная стадия II НЭК и подтвержденная стадия III с перфорацией кишечника и / или мультисистемным вовлечением [8 ].Совсем недавно терминология приобретенных неонатальных кишечных заболеваний (ANID) была введена Gordon et al. для дальнейшей классификации НЭК на подгруппы на основе связанных клинических факторов: к ним относятся НЭК у доношенных новорожденных, НЭК, связанная с переливанием эритроцитов, НЭК, связанная с непереносимостью коровьего молока, НЭК, связанная с инфекцией и / или лимфоцитозом, НЭК, связанная с крайней недоношенностью, и NEC-подобные заболевания [9].
Признаки и симптомы
Начало НЭК обычно в течение первых нескольких недель после рождения, когда было начато кормление, и возраст начала обратно пропорционально связан с гестационным возрастом при рождении.На ранней стадии заболевания у новорожденных могут проявляться признаки непереносимости пищи с рвотой, повышенным содержанием желудочного аспирата, желчным (зеленым) желудочным аспиратом или пониженным шумом кишечника с вздутием живота и болезненностью. Грубая или скрытая кровь может присутствовать в стуле, что указывает на повреждение слизистой оболочки. Многие из этих признаков неспецифичны и могут возникать при других заболеваниях. Прогрессирование НЭК приводит к системным признакам, таким как летаргия, длительные паузы в дыхании, называемые апноэ, нестабильность температуры и плохая перфузия (перекачка жидкости через орган или ткань.В конечном итоге это может привести к дыхательной недостаточности и сердечно-сосудистому коллапсу, требующим искусственной вентиляции легких и вазопрессоров. Пальпируемое образование и эритема (патологическое покраснение кожи из-за закупорки капилляров, как при воспалении) брюшной стенки указывают на более запущенный процесс заболевания.
Причины
После многих лет исследований и клинических наблюдений этиология и патогенез НЭК остаются неуловимыми. Некоторые ключевые факторы риска постоянно идентифицировались как важные предпосылки для инициирования кишечного повреждения, ведущего к НЭК.К ним относятся недоношенность, кормление смесями, аномальная микробная колонизация кишечника и ишемия (когда кровеносные сосуды кишечника сужаются или блокируются, что снижает кровоток) [3; 10; 11].
Недоношенность остается основным важным фактором риска, связанным с НЭК. Незрелость кишечного эпителиального клеточного барьера и иммунной системы, по-видимому, вносит свой вклад в патогенез. До рождения плод имеет стерильную кишечную среду и после рождения быстро становится колонизированным бактериями.Неправильная колонизация с преобладанием грамотрицательных бактерий может привести к нарушению нормального кишечного эпителия, бактериальной транслокации и вызвать чрезмерный воспалительный ответ [10; 12-14]. Отличительными гистологическими находками, наблюдаемыми при НЭК, являются воспаление и коагуляционный некроз [11] (паттерн гибели тканей). Ишемия — еще один важный патофизиологический фактор в развитии НЭК. Снижение поступления кислорода к клеткам кишечника может привести к клеточному повреждению и некрозу.
Диагноз
NEC диагностируется клинически и рентгенологически.Как только возникает клиническое подозрение, в качестве первоначальной оценки выполняется рентгенография брюшной полости. Это повторяется серийно в зависимости от остроты болезни и клинического течения для оценки прогрессирования заболевания. Характерные признаки процесса НЭК на рентгенограммах брюшной полости включают кишечник пневматоз (воздух в стенке кишечника), аномальные стойкие расширенные петли, утолщение стенки кишечника, пневмоперитонеум и газ в воротной вене. Пневмоперитонеум, определяемый как свободный воздух в брюшной полости, представляет собой неотложное хирургическое вмешательство, указывающее на перфорацию кишечника и обычно требующее вмешательства.Ультразвуковое исследование брюшной полости также может использоваться для оценки наличия свободной жидкости в брюшной полости или образования абсцесса. Дополнительные лабораторные исследования для оценки тяжести НЭК включают посев крови, исследования свертывания крови и полный анализ крови с ручным дифференцированием для оценки лейкоцитоза с бандемией, нейтропенией, анемией и тромбоцитопенией. Газы крови проверяются серийно, чтобы оценить тяжесть ацидоза и потребность в респираторной поддержке или для помощи в отведении жидкости.
Стандартные методы лечения
Лечение
Лечение НЭК зависит от клинической стадии.В случаях подозрения на НЭК, стадия I, начальное лечение состоит из покоя кишечника с прекращением энтерального питания, назогастральной декомпрессии, посева крови и назначения антибиотиков широкого спектра действия. Пока младенец остается НКО, «ничего во рту», начинают внутривенное парентеральное питание. Необходимо тщательное наблюдение с серийными обследованиями и рентгенограммами. Консультация хирурга проводится после подтверждения НЭК, II или III стадии. Поддерживающая терапия включает респираторную поддержку, инотропную (сердечную) поддержку, жидкостную реанимацию и коррекцию кислотно-щелочного дисбаланса.У пациентов с НЭК может развиться диссеминированное внутрисосудистое свертывание (ДВС-синдром) (состояние, которое препятствует нормальному свертыванию крови) из-за потребления факторов свертывания крови и необходимости переливания продуктов крови. Основным показанием к хирургическому вмешательству при НЭК является перфорированная или некротическая кишка. Другие показания включают клиническое ухудшение и серьезное вздутие живота, вызывающее синдром брюшной полости (дисфункция или отказ органов из-за сильного повышения давления в брюшной полости.) Обычно выполняются два хирургических доступа в зависимости от клинической картины: лапаротомия с резекцией (удалением) некротизированной кишки или первичный перитонеальный дренаж (процедура введения дренажа Пенроуза в пространство в брюшной полости, которое содержит кишечник, желудок и печень. ).
Профилактика НЭК имеет наибольший потенциал для снижения неблагоприятных исходов, связанных с НЭК. В настоящее время было ясно показано, что грудное молоко защищает от НЭК по сравнению с кормлением смесью [15; 16].Установление стандартизированного протокола кормления с объективными критериями отказа от кормления также снижает риск НЭК [17]. Пробиотики могут предотвращать НЭК за счет восстановления микробной флоры кишечника, но это все еще требует дальнейших исследований в отношении оптимальной дозировки и продолжительности лечения [18].
Исследовательские методы лечения
Информация о текущих клинических испытаниях размещена в Интернете по адресу www.clinicaltrials.gov. Все исследования, финансируемые правительством США, а некоторые исследования поддерживаются частным сектором, размещены на этом правительственном веб-сайте.
Для получения информации о клинических испытаниях, проводимых в клиническом центре NIH в Бетесде, штат Мэриленд, свяжитесь с отделом приема пациентов NIH:
(бесплатный звонок): (800) 411-1222 TTY: (866) 411-1010 Электронная почта: [электронная почта protected]
Для получения информации о клинических испытаниях, спонсируемых из частных источников, обращайтесь:
www.centerwatch.com
Для получения дополнительной информации о клинических испытаниях, проведенных в Европе, обращайтесь: https://www.clinicaltrialsregister.eu/
Информация в базе данных редких заболеваний NORD предназначена только для образовательных целей и не предназначена для замены рекомендаций врача или другого квалифицированного медицинского специалиста.
Содержание веб-сайта и баз данных Национальной организации по редким заболеваниям (NORD) защищено авторским правом и не может быть воспроизведено, скопировано, загружено или распространено каким-либо образом в коммерческих или общественных целях без предварительного письменного разрешения и согласия. от НОРД. Физические лица могут распечатать одну бумажную копию отдельного заболевания для личного использования при условии, что содержание не изменено и включает авторские права NORD.
Национальная организация редких заболеваний (NORD)
55 Kenosia Ave., Danbury CT 06810 • (203)744-0100
Некротический энтероколит (NEC) | Блаженство
Что такое некротизирующий энтероколит (НЭК)?
Некротический энтероколит (НЭК) — серьезное заболевание, которое может поражать новорожденных, при котором воспаляются ткани кишечника (тонкий и толстый кишечник). Врачи также могут описать НЭК как воспаление кишечника.
NEC может поражать только небольшую часть кишечника, а иногда и весь кишечник.
Насколько серьезно NEC?
NEC — серьезное заболевание. Младенцы могут очень плохо себя чувствовать из-за NEC. Иногда ткани в некоторых частях кишечника повреждаются и умирают, и их необходимо удалить хирургическим путем. У нас есть дополнительная информация об операции по лечению NEC, которая может вам пригодиться.
К сожалению, некоторые младенцы умрут от NEC. Некоторые дети могут быть слишком плохо себя чувствуют для операции или могут не поправиться после лечения. Медицинские работники, занимающиеся уходом за вашим ребенком, должны объяснить все риски, связанные с оказываемым им уходом.Вы можете поговорить с ними, если у вас возникнут какие-либо опасения или опасения.
У нас есть дополнительная информация о принятии решений о неотложной помощи, паллиативной помощи и о тяжелой утрате.
Что вызывает NEC?
Врачи не до конца понимают, что вызывает НЭК. Младенцы, рожденные недоношенными или больными, имеют более незрелый кишечник, а это означает, что у них больше шансов заболеть НЭК, чем у детей, рожденных здоровыми или доношенными. Вероятно, здесь задействовано несколько факторов.
Кто, скорее всего, получит NEC?
NEC обычно поражает новорожденных в первые несколько недель после рождения.Чаще встречается в:
- недоношенных детей (особенно младенцев, родившихся до 32 недель или с массой тела менее 1500 г)
- младенцев с множеством других медицинских проблем
- младенцев, которые плохо себя чувствовали до своего рождения (например, младенцы, которые не растут в утробе, как и ожидалось).
NEC, скорее всего, повлияет на младенцев до того, как они уйдут домой из неонатального отделения.
NEC также может поражать доношенных детей, которые в остальном были здоровыми, хотя это случается редко.
Какие приметы NEC?
NEC может быть сложно диагностировать. Но есть признаки того, что ребенок может проявить недомогание с помощью NEC . Скорее всего, врачи обнаружат эти признаки у вашего ребенка в неонатальном отделении.
Признаки NEC у вашего ребенка могут включать общие признаки плохого самочувствия или борьбы с инфекцией, например:
- учащенное сердцебиение
- низкое кровяное давление
- нерегулярное, быстрое или медленное и поверхностное дыхание
- высокая, низкая или быстро меняющаяся температура.
В некоторых случаях могут развиться более специфические признаки, которые могут включать:
- не ест как обычно
- кровь в стуле (фекалии)
- болезненный, опухший или обесцвеченный животик
- тошнота (рвота), особенно если они рвут зеленой жидкостью (желчью)
- с большим объемом зеленого жидкость или кровь, возвращающаяся обратно в трубку NG вашего ребенка (если ребенок получает питание через трубку).
Если врачи считают, что у вашего ребенка НЭК, они сделают рентген и анализы крови.Однако бывает трудно понять, вызваны ли эти признаки NEC или другими причинами.
Вам следует всегда проконсультироваться с врачом , если ваш ребенок не ведет себя как обычно или вы думаете, что ваш ребенок плохо себя чувствует.
Иногда ребенок может серьезно заболеть очень быстро, и ему потребуется серьезная медицинская помощь. Если вы подозреваете, что ваш ребенок серьезно заболел, сообщите об этом медицинским работникам в неонатальном отделении или позвоните по номеру 999, если вы находитесь дома.
Могу ли я снизить риск заражения моего ребенка NEC?
Исследования показывают, что грудное молоко может помочь снизить риск NEC . Большинство детей, рожденных недоношенными, не могут кормить грудью в первые несколько недель. Если это произойдет, возможно, вы захотите сцеживать молоко своему ребенку. Затем он подается им через трубку в живот. Поступая так, ваш ребенок по-прежнему сможет получать от грудного молока все преимущества.
Если ваш ребенок не может принимать молоко в это время, но вы хотите кормить ребенка грудным молоком позже (путем грудного вскармливания или кормления из бутылочки), вам следует продолжать сцеживать грудное молоко.Использование грудного молока также может быть полезно, когда ваш ребенок выздоравливает от NEC и может снова начать кормление грудью. Если вам трудно сцеживать грудное молоко, некоторые отделения могут иметь доступ к донорскому молоку. Поговорите с персоналом вашего подразделения для получения дополнительной информации.
Медицинские работники смогут помочь вам с кормлением вашего ребенка. Вы также можете посетить наши страницы о кормлении для получения дополнительной информации.
Каковы возможные методы лечения NEC?
Если у вашего ребенка НЭК в легкой форме или медицинские работники, ухаживающие за вашим ребенком, думают, что у вашего ребенка может быть НЭК, можно начать следующее лечение:
- Прекращение кормления молоком .Это сделано потому, что отдых кишечника может помочь ему восстановиться. Когда нельзя давать молоко, вашему ребенку могут давать пищу, например жир, сахар, белок и витамины, через длинную очередь. Это необходимо для того, чтобы ваш ребенок рос, пока вы не кормите его молоком. Длинная линия — это длинная мягкая пластиковая трубка, вставленная в вену на руке или ноге ребенка.
- Стартовые антибиотики для лечения и профилактики инфекций .
Если ваш ребенок в целом плохо себя чувствует, могут потребоваться другие виды лечения, например, увеличение количества кислорода или помощь при дыхании.Многие дети с НЭК выздоравливают после этого лечения.
Однако, если область кишечника умирает, ваш ребенок не реагирует на лечение или есть перфорация (отверстие) в кишечнике, вашему ребенку потребуется операция. У нас есть дополнительная информация об операции по лечению NEC, которая может вам пригодиться.
Медицинская бригада вашего ребенка должна постоянно держать вас в курсе заботы о вашем ребенке, и вы должны иметь возможность принимать вместе с ними решения относительно ухода за ним.
Что может произойти после лечения моего ребенка от NEC?
Многие дети, выздоравливающие после НЭК, больше не имеют проблем.Но не исключено, что могут возникнуть и другие проблемы.
Эти проблемы включают следующее:
- NEC возвращается (повторяется). Если это произойдет, вашему ребенку может потребоваться операция. У нас есть дополнительная информация об операции по лечению NEC.
- Стриктуры — место сужения кишечника из-за рубцовой ткани. Это может быть вызвано повреждением кишечника из-за NEC или хирургическим вмешательством по поводу NEC. Если это произойдет, потребуется операция, чтобы расширить область кишечника или, возможно, удалить узкую область.
Вашему ребенку может потребоваться операция, если какие-либо проблемы не исчезнут.
В долгосрочной перспективе некоторые исследования показывают, что NEC иногда может влиять на развитие мозга некоторых детей. Но все дети развиваются по-разному, . Специалисты в области здравоохранения будут регулярно проверять и контролировать развитие вашего ребенка.
Некротический энтероколит у новорожденных | SpringerLink
Lin PW, Stoll BJ. Некротизирующий энтероколит. Lancet 2006; 368 (9543): 1271–83
PubMed
Статья
Google Scholar
Гиббс К., Лин Дж., Хольцман И.Р. Некротизирующий энтероколит: состояние науки. Indian J Pediatr 2007; 74 (1): 67–72
PubMed
Статья
Google Scholar
Клигман Р.М. Модели патогенеза некротического энтероколита. J Pediatr 1990 июл; 117 (1 Pt 2): S2–5
PubMed
Статья
CAS
Google Scholar
Паниграхи П. Некротический энтероколит: практическое руководство по его профилактике и лечению.Pediatr Drugs 2006; 8 (3): 151–65
Статья
Google Scholar
Hsueh W., Caplan MS, Qu X, et al. Некротический энтероколит новорожденных: клинические аспекты и патогенетические концепции. Pediatr Dev Path 2002; 6 (1): 6–23
Статья
Google Scholar
Генри М., Мосс Р.Л. Актуальные вопросы лечения некротического энтероколита. Сем перинатол 2004; 28 (3): 221–33
Статья
Google Scholar
Ананд Р.Дж., Leaphart CL, Моллен К.П. и др. Роль кишечного барьера в патогенезе некротического энтероколита. Шок 2007; 27 (2): 124–33
PubMed
Статья
CAS
Google Scholar
Berseth CL. Гестационная эволюция моторики тонкого кишечника у недоношенных и доношенных детей. J Pediatr 1989; 115 (4): 646–51
PubMed
Статья
CAS
Google Scholar
Warner BW, Warner BB. Роль эпидермального фактора роста в патогенезе некротического энтероколита новорожденных. Семин Педиатр Хирург 2005; 14 (3): 175–80
PubMed
Статья
Google Scholar
Уорнер ББ, Райан А.Л., Сигер К. и др. Онтогенез слюнного эпидермального фактора роста и некротический энтероколит. J Pediatr 2007; 150 (4): 358–63
PubMed
Статья
CAS
Google Scholar
Shin CE, Falcone RA, Stuart L, et al. Снижение уровней эпидермального фактора роста у младенцев с некротическим энтероколитом. J Pediatr Surg 2000; 35 (2): 173–7
PubMed
Статья
CAS
Google Scholar
Rabinowitz SS, Dzakpasu P, Piecuch S, et al. Фактор активации тромбоцитов у младенцев из группы риска некротического энтероколита. J Pediatr 2001; 138 (1): 81–6
PubMed
Статья
CAS
Google Scholar
Миллар М., Уилкс М., Костлото К. Пробиотики для недоношенных детей? Arch Dis Child Fetal Neonatal Ed 2003; 88 (5): 354–8
Статья
Google Scholar
Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, et al. Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J Pediatr Gastroenterol Nutr 2000; 30 (1): 61–7
PubMed
Статья
CAS
Google Scholar
Berseth CL, Bisquera JA, Paje VU. Продолжительное кормление небольшими объемами в раннем возрасте снижает частоту возникновения некротического энтероколита у младенцев с очень низкой массой тела при рождении. Педиатрия 2003; 111 (3): 529–34
PubMed
Статья
Google Scholar
Sisk PM, Lovelady CA, Dillard RG, et al. Раннее кормление грудным молоком связано с более низким риском некротического энтероколита у младенцев с очень низкой массой тела при рождении. J Perinat 2007; 27 (12): 428–33
Статья
CAS
Google Scholar
Lee JS, Polin RA. Лечение и профилактика некротического энтероколита. Sem Neonatol 2003; 8 (6): 449–59
Статья
Google Scholar
Апдегроув К. Некротический энтероколит: доказательства использования грудного молока для профилактики и лечения. J Hum Lact 2004; 20 (3): 335–9
PubMed
Статья
Google Scholar
Хендерсон Г., Крейг С., Броклхерст П. и др.Режимы кормления Enterai и некротический энтероколит у недоношенных детей: многоцентровое исследование случай-контроль. Arch Dis Child Fetal Neonatal Ed. Epub 3 сентября 2007 г.
Клигман Р.М., Уолш М.К. Некротический энтероколит новорожденных: патогенез, классификация и спектр заболеваний. Curr Prob Pediatr 1987; 17 (4): 213–88
CAS
Google Scholar
Эпельман М., Данеман А., Наварро О.М. и др. Некротический энтероколит: обзор современных результатов визуализации с патологической корреляцией.Радиография 2007; 27 (2): 285–305
PubMed
Статья
Google Scholar
Белл М.Дж., Тернберг Дж.Л., Фейгин Р.Д. и др. Некротический энтероколит новорожденных: терапевтические решения, основанные на клинической стадии. Ann Surg 1978; 187 (1): 1–7
PubMed
Статья
CAS
Google Scholar
Rees CM, Pierro A, Eaton S. Результаты нервного развития новорожденных с медикаментозным и хирургическим лечением некротического энтероколита.Arch Dis Child Fetal Neonatal Ed 2007; 92 (3): 193–8
Статья
Google Scholar
Гуле О., Соват Ф. Синдром короткой кишки и трансплантация кишечника у детей. Curr Opin Clin Nutr Metab Care 2006; 9 (3): 304–13
PubMed
Статья
Google Scholar
Блейкли М.Л., Тайсон Дж. Э., Лалли К. П. и др. Лапаротомия по сравнению с дренированием брюшины при некротическом энтероколите или изолированной перфорации кишечника у младенцев с крайне низкой массой тела при рождении: результаты через 18 месяцев с поправкой на возраст.Педиатрия 2006; 117 (4): 680–7
Статья
Google Scholar
Уолш М.К., Клигман Р.М., Хак М. Тяжесть некротического энтероколита: влияние на исход в возрасте 2 лет. Педиатрия 1989; 84 (5): 808–14
PubMed
CAS
Google Scholar
Merritt CR, Goldsmith JP, Sharp MJ. Сонографическое определение газа в воротной вене у младенцев с некротическим энтероколитом.Am J Roentgenol 1984; 143 (5): 1059–62
CAS
Google Scholar
Faingold R, Daneman A, Tomlinson G, et al. Некротический энтероколит: оценка жизнеспособности кишечника с помощью цветного допплера. Радиология 2005; 235 (2): 587–94
PubMed
Статья
Google Scholar
Silva CT, Daneman A, Navarro OM, et al. Корреляция результатов сонографии и результатов при некротическом энтероколите.Педиатр радиологии 2007; 37 (3): 274–82
Статья
Google Scholar
Мосс Р.Л., Диммит Р.А., Генри М.К. и др. Мета-анализ перитонеального дренажа в сравнении с лапаротомией при перфорированном некротическом энтероколите. J Pediatr Surg 2001, август; 36 (8): 1210–3
PubMed
Статья
CAS
Google Scholar
Холл, Нью-Джерси, Карри Дж., Дрейк Д.П. и др. Резекция и первичный анастомоз — эффективный хирургический вариант для младенцев с некротическим энтероколитом с массой тела менее 1000 г.Arch Surg 2005; 140 (12): 1149–51
PubMed
Статья
CAS
Google Scholar
Гриффитс Д.М., Форбс Д.А., Пембертон П.Дж. и др. Первичный реанастомоз при некротизирующем энтероколите: опыт 12 лет. J Pediatr Surg 1989; 24 (6): 515–8
PubMed
Статья
CAS
Google Scholar
Мосс Р.Л., Диммит Р.А., Блейкли М.Л. и др. Лапаротомия в сравнении с дренированием брюшины при некротическом энтероколите и перфорации.N Engl J Med 2006; 354 (21): 2225–34
PubMed
Статья
CAS
Google Scholar
Робертс Д., Далзил С. Антенатальные кортикостероиды для ускорения созревания легких плода у женщин с риском преждевременных родов. Кокрановская база данных Syst Rev 2006; (3): CD004454
Капики А., Косталос С., Ойкономиду С. и др. Влияние смеси с фруктоолигосахаридами на кишечную флору недоношенных детей.Early Hum Dev 2007; 83 (5): 335–9
PubMed
Статья
CAS
Google Scholar
Лукас А., Коул Т.Дж. Грудное молоко и некротический энтероколит новорожденных. Lancet 1990; 336 (8730): 1519–23
PubMed
Статья
CAS
Google Scholar
Сиу Ю.К., Нг ПК, Фунг СКК и др. Двойное слепое рандомизированное плацебо-контролируемое исследование перорального применения ванкомицина в профилактике некротического энтероколита у недоношенных детей с очень низкой массой тела при рождении.Arch Dis Child Fetal Neonatal Ed 1998; 79 (2): 105–9
Статья
Google Scholar
Grylack LJ, Scanion JW. Пероральная терапия гентамицином в профилактике некротического энтероколита новорожденных: контролируемое двойное слепое исследование. Am J Dis Child 1978; 132 (12): 1192–4
PubMed
CAS
Google Scholar
Бери Р.Г., Тудехоп Д. Антибиотики Энтераи для профилактики некротического энтероколита у недоношенных или маловесных детей.Кокрановская база данных Syst Rev 2001; (1): CD000405
Хаммерман С., Бин-Нун А., Каплан М. Борьба с зародышами: пробиотики для защиты преждевременного кишечника. Clin Perinatol 2004; 31 (3): 489–500
PubMed
Статья
Google Scholar
Costalos C, Skouteri V, Gounaris A, et al. Enterai кормление недоношенных детей Saccharomyces boulardii . Early Hum Dev 2003; 74 (2): 89–96
PubMed
Статья
CAS
Google Scholar
Дани С., Биадайоли Р., Бертини Дж. И др. Пробиотики кормления в профилактике инфекции мочевыводящих путей, бактериального сепсиса и некротического энтероколита у недоношенных детей: проспективное исследование. Biol Neonate 2002; 82 (2): 103–8
PubMed
Статья
CAS
Google Scholar
Lin HC, Su BH, Chen AC, et al. Пероральные пробиотики снижают частоту и тяжесть некротического энтероколита у младенцев с очень низкой массой тела при рождении.Педиатрия 2005; 115 (1): 1–4
PubMed
Google Scholar
Бин-Нун А., Бромикер Р., Вильшански М. и др. Пероральные пробиотики предотвращают некротический энтероколит у новорожденных с очень низкой массой тела при рождении. J Pediatr 2005; 147 (2): 192–6
PubMed
Статья
Google Scholar
Deshpande G, Rao S, Patole S. Пробиотики для профилактики некротического энтероколита у недоношенных новорожденных с очень низкой массой тела при рождении: систематический обзор рандомизированных контролируемых исследований.Lancet 2007; 369 (9573): 1614–20
PubMed
Статья
Google Scholar
Кунц А.Н., Ноэль Дж. М., Фэрчок МП. Два случая бактериемии лактобацилл во время лечения пробиотиками синдрома короткой кишки. J Pediatr Gastroenterol Nutr 2004; 38 (4): 457–8
PubMed
Статья
Google Scholar
Паррачо Х., Маккартни А.Л., Гибсон Г.Р. Пробиотики и пребиотики в детском питании.Proc Nutr Soc 2007; 66 (3): 405–11
PubMed
Статья
Google Scholar
Лоуренс Г., Тудехоп Д., Бауманн К. и др. Enterai human IgG для профилактики некротического энтероколита: плацебо-контролируемое рандомизированное исследование. Lancet 2001; 357 (9274): 2090–4
PubMed
Статья
CAS
Google Scholar
Фостер Дж., Коул М. Пероральный иммуноглобулин для предотвращения некротического энтероколита у недоношенных новорожденных и новорожденных с низкой массой тела.Кокрановская база данных Syst Rev 2004; (1): CD001816
Дэвис Дж. М., Розенфельд В. Н., Рихтер С. Е. и др. Безопасность и фармакокинетика многократных доз рекомбинантной супероксиддисмутазы CuZn человека, вводимой интратрахеально недоношенным новорожденным с респираторным дистресс-синдромом. Педиатрия 1997; 100 (1): 24–30
PubMed
Статья
CAS
Google Scholar
Soghier LM, Brion LP. Добавки цистеина, цистина или N-ацетилцистеина у новорожденных, получающих парентеральное питание.Кокрановская база данных Syst Rev 2006; (4): CD004869
Dvorak B, Halpern MD, Holubec H, et al. Эпидермальный фактор роста снижает развитие некротического энтероколита у новорожденных крыс. Am J Physiol Gastrointest Liver Physiol 2002; 282 (1): G156–64
PubMed
CAS
Google Scholar
Sullivan PB, Lewindon PJ, Cheng C, et al. Ремоделирование слизистой оболочки кишечника рекомбинантным эпидермальным фактором роста человека 1–48 у новорожденных с тяжелым некротическим энтероколитом.J Pediatr Surg 2007; 42 (3): 462–9
PubMed
Статья
Google Scholar
Becker RM, Wu G, Galanko JA, et al. Снижение концентрации аминокислот в сыворотке крови у младенцев с некротическим энтероколитом. J Pediatr 2000; 137 (6): 785–93
PubMed
Статья
CAS
Google Scholar
Замора С.А., Амин Х.Дж., Макмиллан Д.Д. и др. Концентрации L-аргинина в плазме у недоношенных детей с некротическим энтероколитом.J Pediatr 1997; 131 (2): 226–32
PubMed
Статья
CAS
Google Scholar
Amin HJ, Zamora SA, McMillan DD, et al. Добавка аргинина предотвращает некротический энтероколит у недоношенных детей. J Pediatric 2002; 140 (4): 425–31
Статья
CAS
Google Scholar
Некротический энтероколит | Бостонская детская больница
Некротический энтероколит (НЭК) — серьезное кишечное заболевание у младенцев, которое приводит к отмиранию тканей кишечника.NEC может привести к образованию отверстий или участков сужения (стриктуры) в кишечнике и является причиной синдрома короткой кишки (SBS). В SBS ребенку не хватает тонкого кишечника, чтобы усваивать все питательные вещества, необходимые его растущему организму.
Что вызывает некротический энтероколит?
Причина некротического энтероколита (НЭК) неизвестна. Недоношенные или больные новорожденные подвергаются наибольшему риску развития НЭК, который встречается примерно у 10 процентов детей с массой тела менее 3 фунтов 5 унций.
Как диагностируется некротический энтероколит?
Ваш врач осмотрит вашего ребенка на предмет следующих симптомов:
- вздутие живота (вздутие живота)
- кормлений, которые остаются в желудке
- Желчная (зеленая) жидкость в желудке
- Кровавый стул
- признаков инфекции, таких как апноэ (остановка дыхания), низкий пульс и вялость (вялость)
Затем мы можем предложить рентген для поиска воздуха в кишечнике или крупных венах печени.В некоторых случаях ваш врач может ввести иглу в брюшную полость вашего ребенка, чтобы найти кишечную жидкость, что часто является признаком NEC.
Как лечится некротический энтероколит?
Лечение НЭК может включать следующее:
- прекращение кормления
- введение назогастрального зонда (из носа в желудок), чтобы желудок оставался пустым
- Жидкости для внутривенного введения для питания и восполнения жидкости
- Антибиотики от инфекции
- частые рентгеновские снимки для наблюдения за прогрессом болезни
- Дополнительный кислород или дыхание с механической поддержкой
- процедуры изоляции (например, защитные халаты и перчатки) для предотвращения распространения инфекции.
В более тяжелых случаях детям с НЭК могут потребоваться:
- Операция по удалению пораженного кишечника или кишечника
- соединение части кишечника или кишечника со стомой (отверстие на брюшной полости)
Как лечить некротический энтероколит
В Бостонской детской больнице мы лечим детей с NEC в нашем Центре продвинутой кишечной реабилитации (CAIR), который включает команду экспертов с многолетним опытом ухода за детьми с проблемами кишечника и их семьями.Среди наших специалистов:
- врачи, прошедшие подготовку в области хирургии, гастроэнтерологии и диетологии
- дипломированных диетологов
- практикующих медсестер
- медсестры
- фармацевт
- социальный работник
Некротический энтероколит новорожденных | Семейная детская больница Университета Айовы Стед
Стивен Дж. МакЭлрой, доктор медицины
Статус экспертной оценки: внутренняя экспертная проверка
Определение
- Некротический энтероколит новорожденных (НЭК) — воспалительное заболевание кишечника новорожденных.
- По всей стране NEC затрагивает 1-3% всех поступающих в ОИТН и 7% младенцев с массой тела при рождении менее 1500 г
- Смертность по стране составляет около 20-30%
- Заболеваемость обратно пропорциональна массе тела при рождении и гестационному возрасту.
- Наибольший риск для младенцев, рожденных <30 недель и весом <1000 г
- Несмотря на более высокую заболеваемость младенцев с ЭНМТ, у большинства младенцев НЭК не развивается до 28 недель скорректированной беременности (обычно через 2–3 недели после рождения)
Факторы риска
- Недоношенность
- Энтеральное питание
- Бактериальная колонизация
Доношенные
- До 10% младенцев с НЭК рождаются в срок
- Нормальный уровень развития НЭК у доношенных детей равен 0.5%
- Факторы риска развития НЭК у доношенных детей
- Гастрошизис
- Врожденный порок сердца (особенно HLHS — синдром гипоплазии левых отделов сердца и TA — arteriosus truncus)
- Доношенные дети с врожденным пороком сердца, у которых развивается НЭК,
- Повышенная смертность (39-57%)
- Более раннее начало (средний возраст 7 дней после рождения)
Профилактика
- ТОЛЬКО Доказанная в настоящее время профилактика НЭК — кормление грудным молоком матери
- У младенцев, вскармливаемых грудным молоком, выработано в 6-10 раз меньше NEC , чем у младенцев, вскармливаемых только смесями, и в 3 раза меньше, чем у младенцев, вскармливаемых грудным молоком + смесью
Лечение
- Антибиотики
- Выбор антибиотиков будет зависеть от предыдущей терапии, наличия инвазивных линий, эпидемиологии питомника и, как правило, нацелен на анаэробы и грамотрицательные организмы.Как правило, начинайте с ванкомицина и гентамицина. Флагил следует добавлять в случае перфорации кишечника.
- НПО
- Продолжительность NPO зависит от тяжести заболевания. Любой ребенок с определенным НЭК должен находиться в НКО не менее 7 дней. Все дети должны получать парентеральное питание с липидами, начиная с разрешения острого сепсиса.
- Всасывание орогастрия:
- Трубка отсасывающего катетера с большим отверстием, соединенная с отсасывающим устройством через низкую прерывистую стенку, должна быть сначала запущена и поддерживаться до тех пор, пока не исчезнет растяжение, не исчезнет пневматоз и не будет выходить менее 10 мл / кг / день.
- Серийные оценки
- Обхват живота
- Электролиты сыворотки
- Общий анализ крови
- Газы крови при метаболическом ацидозе
- Рентген брюшной полости
- Хирургия
- Ранняя консультация хирурга
- Показания к операции: свободный воздух в брюшной полости, ухудшение клинических симптомов, признаки перитонита
- В настоящее время нет единой литературы в поддержку рутинного использования пробиотиков
- В настоящее время нет литературы, подтверждающей прямую причинно-следственную связь между переливаниями крови и NEC
- В настоящее время нет единого мнения о том, что донорское молоко является окончательно профилактическим средством против NEC.
Список литературы
- Йи, В.H. и др. Частота и время проявления некротического энтероколита у недоношенных детей. Педиатрия 129 , e298-304 (2012). =
- Neu, J. & Walker, W.A. Некротический энтероколит. N Engl J Med 364 , 255-264 (2011).
- Fitzgibbons, S.C. , et al. Смертность от некротического энтероколита, выраженная по весовым категориям при рождении. J Pediatr Surg 44 , 1072-1075; обсуждение 1075-1076 (2009).
- Lin, P.W., Nasr, T.R. И Столл, Б.Дж.Некротический энтероколит: последние научные достижения в патофизиологии и профилактике. Семин Перинатол 32 , 70-82 (2008).
- МакЭлрой, С.Дж., Андервуд, М.А., Шерман, М.П. Клетки Панета и некротический энтероколит: новая гипотеза патогенеза заболеваний. Неонатология 103 , 10-20 (2012).
Некротический энтероколит: будущее — FullText — Neonatology 2020, Vol.117, № 2
Аннотация
Прогресс в нашем понимании патофизиологии, профилактики и лечения некротического энтероколита (НЭК) был затруднен по многим причинам. К их числу относится тот факт, что то, что мы называем «НЭК», вероятно, представляет различные процессы заболевания, которые необходимо очертить, прежде чем оценивать отдельные патогенные механизмы и пытаться разработать прогностические и диагностические биомаркеры.Лечение также может быть затруднено, потому что не все различные субъекты, называемые «NEC», будут реагировать на один и тот же режим. В этом обзоре некоторые из этих сущностей будут обсуждаться более подробно с предложениями по совершенствованию нашего подхода к совершенствованию методов их диагностики, профилактики и лечения.
© 2020 S. Karger AG, Базель
Введение
Некротический энтероколит (НЭК) — это заболевание, которое наблюдается в основном у недоношенных детей [1].В некотором смысле НЭК является побочным продуктом успехов, достигнутых в неонатологии, где сейчас выживают младенцы с низким гестационным возрастом, которые не выжили бы 30–40 лет назад. NEC превратился в одно из самых разрушительных заболеваний, возникающих в реанимации новорожденных. В дополнение к чрезвычайно высокой заболеваемости и смертности и высокой стоимости, к долгосрочным осложнениям относятся стриктуры и спайки кишечника, холестаз, синдром короткой кишки, задержка развития и задержка нервного развития [2].К сожалению, не было достигнуто большого прогресса в его лечении или профилактике [3]. Изучая литературу, можно рассматривать НЭК как единое однородное образование, но становится ясно, что НЭК — это несколько различных заболеваний или эндотипов [4]. В этом обзоре будет обобщена патофизиология некоторых из этих образований и их отличие от более классической формы НЭК. Лучшее понимание этих различий имеет решающее значение для нашей способности диагностировать эти сущности на раннем этапе с разработкой соответствующих прогностических и диагностических биомаркеров для отдельных заболеваний.Помимо улучшенной диагностики, можно улучшить индивидуальные стратегии профилактики и лечения. Затем я кратко резюмирую патофизиологию каждой из этих сущностей, поднимая некоторые вопросы и комментируя, как мы могли бы лучше всего действовать в будущем с точки зрения улучшения нашего понимания, предотвращения и лечения этих сущностей, которые мы теперь называем «NEC».
Почему так много исследований и так мало прогресса?
За последние несколько десятилетий, кажется, было очень мало прогресса в нашей профилактике или лечении болезни, которую мы называем «НЭК» [3, 5].Один из аргументов, который можно привести, заключается в том, что мы наблюдаем гораздо большую выживаемость крайне недоношенных детей, которые, как известно, имеют более высокую заболеваемость этим заболеванием [6]. Другой аргумент заключается в том, что у нас нет четкого определения этого заболевания, а критерии, использованные 40 лет назад, вероятно, не подходят для современной помощи в отделениях интенсивной терапии новорожденных (NICU). Например, критерии постановки Белла, разработанные в конце 1970-х годов, включают 3 различных этапа. Стадия 1 описывает непереносимость кормления, вздутие живота, респираторную нестабильность и ряд других неспецифических признаков, которые наблюдаются у большинства младенцев с крайне низкой массой тела при рождении в отделении интенсивной терапии.Хотя многие недавние наблюдательные ретроспективные исследования избегали включения этих младенцев в свои данные и заявляют, что включены только стадии 2 или 3, проблемы все еще остаются. Стадия 2 основана на клинических признаках и рентгенологических критериях, которые могут быть не очень специфичными, но часто интерпретируются как НЭК. Например, в отчетах о рентгенографии брюшной полости указывается, что имеется локальный «пузырчатый» вид, который может коррелировать или не коррелировать с клиническими симптомами или другими лабораторными показателями. Пузырящийся вид можно спутать со стулом в нормальном кишечнике, в первую очередь в толстой кишке.Контрольный фильм через 6 часов рекомендуется для наблюдения за изменениями положения в случае стула. Если этот рентгенологический результат сохраняется на повторных рентгенограммах, сделанных в течение первых 24–48 часов после первого фильма, и если это соответствует клиническим признакам, таким как вздутие живота и повышенные маркеры воспаления, вполне вероятно, что это свидетельствует о заболевании. Однако этот вывод часто записывается в выписке как «NEC». Другие рентгенологические маркеры, такие как серповидный вид воздуха в брюшной стенке и / или газ в воротной вене, или свободный внутрибрюшинный воздух (лучше всего демонстрируется на рентгенограммах левого бокового пролежня), являются более серьезными признаками и могут предвещать тяжелое заболевание [7].Как уже упоминалось, наличие свободного воздуха в брюшной полости обычно предвещает серьезное заболевание. Однако это не является специфическим для NEC и может представлять собой спонтанную перфорацию кишечника (SIP) или другой объект, который не является классическим NEC. Если лапаротомия не выполняется и устанавливается только перитонеальный дренаж, как это сейчас является обычной практикой, это может быть внесено в карту пациента как «NEC». Таким образом, использование критериев Белла, основанных на чисто клинических и рентгенологических данных, имеет значительные ограничения.
Совсем недавно УЗИ брюшной полости использовалось для диагностики НЭК, и некоторые авторы настоятельно рекомендуют его отчасти из-за его чувствительности к обнаружению пневматоза [8-10].Тем не менее, все еще остаются вопросы о чувствительности и специфичности этого метода, поскольку его необходимо оценивать по «золотому стандарту», которого у нас, вероятно, нет, за исключением некроза кишечника, наблюдаемого при хирургическом вмешательстве или вскрытии. Хотя этот метод является многообещающим, его рутинное использование еще не показано без проспективных, хорошо спланированных и подтвержденных исследований [11].
Есть и другие причины, лежащие в основе нашего отсутствия прогресса с NEC. Как упоминалось ранее, NEC считалась однородной сущностью, но с разными путями, способствующими ее развитию [12].Это в некотором роде похоже на рассмотрение всех случаев диабета как одной болезни. Однако теперь ясно, что диабет неоднороден и состоит не только из заболеваний типа 1 и 2, но и из разных эндотипов диабета 1 типа [13]. Подобно диабету, хотя НЭК рассматривается как единое целое, у новорожденных наблюдается несколько различных состояний, которые могут приводить к сходной симптоматике [4]; однако они требуют более индивидуального подхода к профилактике и лечению.
Чтобы добиться прогресса в понимании, лечении и профилактике сущностей, которые мы называем «NEC», нам сначала нужно обобщить некоторые общие черты, а также особенности, которые различают эти сущности. Мы должны подчеркнуть тот факт, что многие из широко распространенных высоко оцененных баз данных, доступных для оценки «NEC», имеют изъяны, и эти недостатки необходимо признавать всякий раз, когда проводятся ретроспективные оценки с использованием этих наборов данных.
Заболевания, обычно диагностируемые как NEC
Спонтанная перфорация кишечника
Когда-то они считались формой NEC [14], но примерно 40 лет назад SIP начали выделяться как отдельная сущность [15-17].Основным дифференцирующим фактором является то, что SIP чаще всего обнаруживается в виде изолированной перфорации в терминальном отделе подвздошной кишки в антимезентерийном месте, при этом оставшаяся часть кишечника выглядит в целом нормальной [18]. Хотя патофизиология SIP остается плохо изученной, очевидно, что это заболевание, отличное от NEC [19]. Перфорация в SIP имеет минимальный окружающий некроз или нейтрофильный инфильтрат. Средний возраст начала SIP обычно раньше, чем у более классической формы NEC. Хотя использование отдельных агентов, по-видимому, не увеличивает риск, комбинированное использование нестероидных противовоспалительных агентов, таких как индометацин и ибупрофен, и послеродовых кортикостероидов значительно увеличивает риск [20].Кишечный пневматоз и газ в воротной вене обычно не предшествуют SIP, как это часто наблюдается при более классической форме NEC. Есть некоторые предположения, что определенные биомаркеры, такие как уровни интер-альфа-ингибиторов в крови, могут быть значительно снижены при NEC по сравнению с SIP и подобранными контролями [21]. Однако такие исследования трудно интерпретировать, если у нас нет «золотого стандарта» диагноза NEC и SIP.
И NEC, и SIP можно предположить по наличию вздутия живота и свободного воздуха в брюшной полости.Их часто лечат аналогичным образом, устанавливая перитонеальные дренажи [22]. Таким образом, нет ясности, поскольку неизвестно, подвергся ли кишечник значительному некрозу, наблюдаемому при NEC, по сравнению с простой перфорацией, наблюдаемой при SIP. Это невозможно полностью прояснить без окончательной лапаротомии. Таким образом, вероятно заражение наших наборов данных между NEC и SIP, и часто все эти кишечные повреждения регистрируются как NEC. Неясно, в какой степени это вызывает проблемы при анализе этих наборов данных в наблюдательных исследованиях.
Ишемический некроз кишечника
Ишемия кишечника может быть результатом нескольких форм врожденного порока сердца, и ее следует дифференцировать от классической НЭК. Это состояние низкого кровотока наблюдается у доношенных новорожденных, но может также встречаться и у недоношенных [23, 24]. При ишемическом некрозе кишечника, вторичном по отношению к болезни сердца, наиболее часто поражается толстая кишка. Синдром гипоплазии левых отделов сердца, артериальный ствол, обструкция дуги аорты и аортопульмональное окно являются причиной большинства случаев кардиогенного ишемического некроза кишечника [25].Я предлагаю классифицировать это заболевание как отдельную сущность, а не ставить диагноз «НЭК». Более подходящим диагностическим названием было бы «кардиогенный ишемический некроз кишечника».
Синдром энтероколита непереносимости пищевых белков
Синдром энтероколита, индуцированного пищевыми белками (FPIES), который в первую очередь рассматривается как проблема, наблюдаемая за пределами неонатального периода, также может возникать в неонатальном периоде, проявляясь вздутием живота, кровью стула и изменением цвета бока , которые улучшаются после обработки гидролизованной формулой [26-28].Проблема с коровьим молоком и даже грудное вскармливание (если мать подвергается воздействию определенных белков) могут привести к рецидиву. FPIES — это не-IgE-опосредованное заболевание, которое остается плохо изученным, особенно у новорожденных. Диагностические биомаркеры для FPIES, которые могут помочь дифференцировать это заболевание от NEC, еще не доступны, но недавние сообщения о случаях предполагают, что это заболевание может быть занижено у новорожденных [29]. Важно отличать FPIES от NEC, потому что лечение отличается: при FPIES может быть достаточно удаления вызывающего антигена и симптоматической поддержки, тогда как при NEC лечение более обширное с использованием антибиотиков, отказом от кормов и предоставлением парентеральное питание примерно в течение недели.
Врожденные аномалии кишечника, имитирующие NEC
У пациентов с болезнью Гиршпрунга может развиться воспалительный энтероколит, который приводит к значительной заболеваемости и смертности [30]. Клинические признаки этого заболевания включают рвоту, ректальное кровотечение, жидкий стул и вздутие живота, что иногда затрудняет дифференциацию от классической НЭК. Кишечная непроходимость из-за заворота, инвагинации и кишечной непроходимости из-за кистозного фиброза может также проявляться признаками и симптомами «НЭК», включая рентгенографические признаки, такие как кишечный пневматоз, и это следует учитывать при дифференциальной диагностике «НЭК.»
« Классический »NEC
NEC может быть быстро прогрессирующим заболеванием, которое часто прогрессирует от первых симптомов до полномасштабного заболевания и смерти в течение 24–48 часов. В результате важно диагностировать его на самых ранних стадиях. Хотя есть некоторая полезность с точки зрения постановки тяжести заболевания, критерии Белла, разработанные в конце 1970-х годов, могут вводить в заблуждение. Автор считает, что эта постановочная система устарела. Более информативно просто использовать термины «медицинский NEC» для обозначения состояния с четко определенными клиническими симптомами плюс радиологические признаки (т.е.например, газ в воротной вене и определенный кишечник пневматоз) и «хирургический НЭК» применительно к окончательному некрозу кишечника, наблюдаемому при хирургическом вмешательстве или вскрытии.
Патофизиология «классического» NEC
Следующие факторы считаются важными предшественниками в патофизиологии «классического» NEC.
Кишечная незрелость и воспаление
Барьерная функция, регуляция кровообращения, моторика, пищеварение и абсорбция, а также иммунная защита недоношенных новорожденных являются незрелыми.Кроме того, баланс между эффекторным и толерантным иммунным ответом может быть не полностью развит [31, 32]. Классический NEC, по-видимому, связан с чрезмерными воспалительными реакциями со значительным повышением сывороточных цитокинов и хемокинов, особенно IL-8 [33]. Другие факторы, которые повышены и потенциально могут использоваться в качестве биомаркеров NEC, включают клаудин 3 (белок плотного соединения), белок, связывающий жирные кислоты кишечника, который вырабатывается эпителиальными клетками, и калпротектин фекалий, который является продуктом воспалительных клеток [32] .
Колонизация микробов и взаимодействие с иммунной системой
Считается, что дисбаланс обычной здоровой микробной экосистемы желудочно-кишечного тракта, называемый «дисбактериозом», также вносит свой вклад в патогенез НЭК [34]. В недавних исследованиях с использованием методов, не основанных на культуре, был изучен микробиом кишечника до начала НЭК. По-видимому, происходит смещение микробов с увеличением уровня Proteobacteria и уменьшением уровня Firmicutes [33].В высшей степени спекулятивная гипотеза предполагает, что чрезмерная воспалительная реакция хозяина вызывает этот микробный сдвиг и может быть, по крайней мере, частично ответственна за запуск NEC. Требуются дальнейшие исследования для рассмотрения этой гипотезы и ее возможных механизмов.
Диагноз
Клиническая картина того, что было названо НЭК, может быть очень разнообразной, с признаками и симптомами, неотличимыми от сепсиса. Наличие кишечного пневматоза и / или газа в воротной вене или прямая визуализация некроза кишечника во время операции четко дифференцируют НЭК от фульминантного сепсиса.Лабораторные тесты, обычно выполняемые при подозрении на диагноз НЭК, включают полный анализ клеток крови, электролитов и воспалительных маркеров, таких как С-реактивный белок. Они имеют низкую чувствительность, специфичность и положительную прогностическую ценность для диагностики НЭК, и очевидно, что требуются более качественные биомаркеры.
Управление и профилактика
Когда болезнь начинается, ее трудно остановить. Прекращение энтерального питания, декомпрессия желудка, антибиотики широкого спектра действия и парентеральное питание являются основой лечения.Часто бывает трудно решить, следует ли выполнить лапаротомию или установить перитонеальный дренаж для лечения или в качестве временной меры. Есть несколько стратегий, которые использовались в попытках предотвратить NEC. Обеспечение грудным молоком, по-видимому, приносит наибольшую пользу. Существует много популярных представлений о профилактике НЭК, не основанных на четких доказательствах, которые включают чрезвычайно медленное начало энтерального кормления, отказ от кормления недоношенных детей во время переливания крови, отказ от кормления грудных детей, если у них есть пупочная артериальная или пупочная венозная линия. место, а не кормление младенцев, если они лечатся такими лекарствами, как индометацин, ибупрофен или другими вазоактивными препаратами.Что касается энтерального питания, недавнее хорошо спланированное клиническое испытание продемонстрировало, что увеличение количества кормов от 20 до 30 мл / кг / день не увеличивает вероятность развития НЭК по сравнению с младенцами, которые получали кормление медленнее [35]. Использование антибиотиков у недоношенных детей в первые несколько дней после рождения очень распространено и не основано на четких доказательствах. Однако появляются данные о том, что дисбактериоз может быть вызван использованием антибиотиков, и это может повлиять на развивающуюся иммунную систему и привести к воспалению кишечника и НЭК [32].В настоящее время проводятся исследования для оценки этой проблемы.
Был большой ажиотаж по поводу микробных терапевтических средств, таких как пре-, про-, пост- и синбиотики для профилактики НЭК. Хотя метаанализы предполагают пользу от повседневного использования пробиотиков, они не дают никаких указаний относительно того, какие пробиотики следует использовать, их дозировку, для какой возрастной группы они обеспечивают наибольшую пользу, следует ли использовать их вместе с пребиотическими препаратами. , и как долго они должны быть даны.Кроме того, не все пробиотики одинаковы. Автор считает, что эти агенты должны пройти проспективные испытания с теми же строгими критериями безопасности и эффективности, что и другие терапевтические фармацевтические агенты, с нормативными рекомендациями [36].
Заявление о раскрытии информации
1 Исследование, проведенное ведущим исследователем с использованием бактериальных терапевтических средств для младенцев
2 Научно-консультативный совет Medela
3 Научно-консультативный совет Astarte
Источники финансирования
Нет.
Список литературы
- Neu J, Walker WA. Некротический энтероколит. N Engl J Med. 2011 Янв; 364 (3): 255–64.
- Базаклю С, Ной Дж.Некротический энтероколит: отдаленные осложнения. Curr Pediatr Rev.2019; 15 (2): 115–24.
- Neu J. Некротический энтероколит: загадка продолжается. Неонатология. 2014; 106 (4): 289–95.
- Ной Дж., Моди Н., Каплан М.Некротический энтероколит бывает разных форм: исторические перспективы и определение болезни. Semin Fetal Neonatal Med. 2018 декабрь; 23 (6): 370–3.
- Обладен М. Некротический энтероколит — 150 лет бесплодных поисков причины. Неонатология. 2009. 96 (4): 203–10.
- Фитцгиббонс С.К., Чинг Ю., Ю Д., Карпентер Дж., Кенни М., Велдон С. и др.Смертность от некротического энтероколита, выраженная по весовым категориям при рождении. J Pediatr Surg. 2009 июнь; 44 (6): 1072–5.
- Сони Р., Катана А., Карри Дж. И., Хамфрис П. Д., Уэртас-Себальос А. Как использовать рентгеновские лучи брюшной полости у недоношенных детей с подозрением на развитие некротизирующего энтероколита.Arch Dis Child Educ Pract. Ed. 2020 фев; 105 (1): 50–7.
- Kim WY, Kim WS, Kim IO, Kwon TH, Chang W, Lee EK. Сонографическая оценка новорожденных с некротическим энтероколитом на ранней стадии. Pediatr Radiol. 2005 ноя; 35 (11): 1056–61.
- Ким Дж.Роль УЗИ брюшной полости в диагностике НЭК. Clin Perinatol. 2019 Март; 46 (1): 119–27.
- Куна А.С., Ли Дж.С., Робинсон А.Л., Аллен Н.Х., Фоли Дж. Э., Чан СС. УЗИ кишечника для диагностики некротического энтероколита: метаанализ. Ультразвук, сентябрь 2018 г .; 34 (3): 113–8.
- Янссен Лок М, Мияке Х, Хок А, Данеман А, Пьеро А, Оффринга М.Значение УЗИ брюшной полости в лечении некротического энтероколита: систематический обзор и метаанализ. Pediatr Surg Int. 2018 июн; 34 (6): 589–612.
- Гордон П.В., Суонсон-младший. Некротический энтероколит — одно заболевание, имеющее множество причин и потенциальных средств профилактики.Патофизиология. 2014 Февраль; 21 (1): 13–9.
- Батталья М., Ахмед С., Андерсон М.С., Аткинсон М.А., Беккер Д., Бингли П.Дж. и др. Представляем концепцию эндотипа для решения проблемы неоднородности заболевания при диабете 1 типа. Уход за диабетом. 2020 Янв; 43 (1): 5–12.
- Алдана-Валенсуэла C, Маннино, Флорида.[Спонтанная перфорация кишечника у новорожденных. Форма некротического энтероколита. Bol Méd Hosp Infant México. 1989; 46: 30–4.
- Замир О., Гольдберг М., Удассин Р., Пелег О., Ниссан С., Эяль Ф. Идиопатическая перфорация желудочно-кишечного тракта у новорожденного. J Pediatr Surg. 1988 Апрель; 23 (4): 335–7.
- Аддерсон Э., Паппин А, Павия АТ. Спонтанная перфорация кишечника у недоношенных детей: отдельное клиническое проявление, связанное с системным кандидозом. J Pediatr Surg. 1998 Октябрь; 33 (10): 1463–147.
- Минц А.С., Эпплбаум Х.Очаговые перфорации желудочно-кишечного тракта, не связанные с некротическим энтероколитом у новорожденных с очень низкой массой тела. J Pediatr Surg. 1993 июн; 28 (6): 857–60.
- Pumberger W, Mayr M, Kohlhauser C, Weninger M. Спонтанная локальная перфорация кишечника у младенцев с очень низкой массой тела при рождении: отдельная клиническая картина, отличная от некротического энтероколита.J Am Coll Surg. 2002 декабрь; 195 (6): 796–803.
- Вонгбхавит К., Андервуд Массачусетс. Перфорация кишечника у недоношенного ребенка. J Neonatal Perinatal Med. 2017; 10 (3): 281–9.
- Пакетт Л., Фридлих П., Раманатан Р., Сери I.Одновременное применение индометацина и дексаметазона увеличивает риск спонтанной перфорации кишечника у новорожденных с очень низкой массой тела при рождении. J Perinatol. 2006 август; 26 (8): 486–92.
- Шах Б.А., Мильори А., Курихара И., Шарма С., Лим Ю.П., Падбери Дж. Уровень интер-альфа-ингибиторов в крови отличает некротический энтероколит от спонтанной перфорации кишечника.J Pediatr. 2017 Янв; 180: 135–140.e1.
- Eicher C, Seitz G, Bevot A, Moll M, Goelz R, Arand J и др. Хирургическое лечение новорожденных с крайне низкой массой тела при рождении с перфорацией кишечника новорожденного: опыт одного центра и обзор литературы. Неонатология. 2012; 101 (4): 285–92.
- Остли DJ, Спилде Т.Л., Сент-Питер С.Д., Секстон Н., Миллер К.А., Шарп Р.Дж. и др. Некротический энтероколит у доношенных детей. J Pediatr Surg. Июль 2003 г .; 38 (7): 1039–42.
- McElhinney DB, Hedrick HL, Bush DM, Pereira GR, Stafford PW, Gaynor JW и др.Некротический энтероколит у новорожденных с врожденным пороком сердца: факторы риска и исходы. Педиатрия. 2000 ноя; 106 (5): 1080–7.
- Спиннер Дж. А., Моррис С. А., Нанди Д., Костарино А. Т., Марино Б. С., Россано Дж. В. и др. Некротический энтероколит и связанная с ним смертность у новорожденных с врожденными пороками сердца: мультиинституциональное исследование.Pediatr Crit Care Med. 2019 Сентябрь; 1 .; Epub впереди печати.
- Caubet JC, Cianferoni A, Groetch M, Nowak-Wegrzyn A. Синдром энтероколита, вызванного пищевым белком. Clin Exp Allergy. 2019 сентябрь; 49 (9): 1178–90.
- Мицели Сопо С, Джельсомино М, Риветти С, Дель Весково Э.Синдром энтероколита, индуцированного пищевыми белками: предложения по новым определениям. Медицина (Каунас). 2019 Май; 55 (6): 55.
- Петросино М.И., Скапарротта А., Ди Филиппо П., Аттанази М., Ди Пилло С., Кьярелли Ф. и др. Синдром энтероколита, вызванного пищевыми белками, у детей: что известно? Какие новости? Eur Ann Allergy Clin Immunol.2018 Май; 50 (3): 99–107.
- Lenfestey MW, de la Cruz D, Neu J. Энтероколит, вызванный пищевыми белками, вместо некротического энтероколита? Серия случаев отделения интенсивной терапии новорожденных. J Pediatr. 2018; 200: 270-3.
- Госейн А., Фрикман П.К., Коулз Р.А., Хортон Дж., Левитт М., Ротштейн Д.Х. и др.; Группа интересов по болезни Гиршпрунга Американской педиатрической хирургической ассоциации. Рекомендации по диагностике и лечению энтероколита, ассоциированного с Гиршпрунгом. Pediatr Surg Int. 2017 Май; 33 (5): 517–21.
- Weitkamp JH, Koyama T, Rock MT, Correa H, Goettel JA, Matta P и др.Некротический энтероколит характеризуется нарушением иммунной регуляции и снижением соотношения регуляторных (FOXP3) / эффекторных (CD4, CD8) Т-клеток слизистой оболочки. Кишечник. 2013, январь; 62 (1): 73–82.
- Ван Белкум М., Мендоза Альварес Л., Ной Дж. Иммунология недоношенных новорожденных на интерфейсе кишечника.Cell Mol Life Sci. 2019 Октябрь; Epub впереди печати. https://doi.org/10.1007/s00018-019-03316-w.
- Benkoe TM, Mechtler TP, Weninger M, Pones M, Rebhandl W., Kasper DC. Сывороточные уровни интерлейкина-8 и кишечных биомаркеров при диагностике некротического энтероколита у недоношенных детей.J Pediatr Surg. 2014 Октябрь; 49 (10): 1446–51.
- Claud EC, Walker WA. Гипотеза: неправильная колонизация преждевременного кишечника может вызвать некротический энтероколит новорожденных. FASEB J., июнь 2001; 15 (8): 1398–403.
- Дорлинг Дж., Эбботт Дж., Беррингтон Дж., Бозиак Б., Боулер Ю., Бойл Е. и др.; Группа следователей SIFT. Контролируемое испытание двух инкрементных доз молока у недоношенных детей. N Engl J Med. 2019 Октябрь; 381 (15): 1434–43.
- Ленфестей М.В., Ной Дж. Пробиотики у новорожденных и детей. Pediatr Clin North Am. 2017 декабрь; 64 (6): 1271–89.
Автор Контакты
Josef Neu, MD
Педиатрия / неонатология, Университет Флориды
1600 SW Archer Road
Gainesville, FL 32610 (USA)
neuj @ peds.ufl.edu
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 27 февраля 2020 г.
Дата принятия: 28 февраля 2020 г.
Опубликована онлайн: 10 марта 2020 г.
Дата выпуска: июль 2020
Количество страниц для печати: 5
Количество рисунков: 0
Количество столов: 0
ISSN: 1661-7800 (печатный)
eISSN: 1661-7819 (онлайн)
Для дополнительной информации: https: // www.karger.com/NEO
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности.
