Противопоказания | Прививки.уз — Предупредить. Защитить. Привить.
Противопоказания и меры предосторожности при вакцинации
Противопоказание к вакцинации – редкая особенность вакцинируемого, повышающая риск серьезной побочной реакции.
Одной из серьезнейших реакций после вакцинации является анафилаксия, которая представляет собой единственное противопоказание, применимое к очередным дозам той же вакцины.
Большинство таких противопоказаний, в частности, тяжелые острые заболевания (например, острая инфекция дыхательных путей) или курс лечения стероидами, являются временными, и прививку можно сделать позже.
Эти противопоказания являются временными или относительными.( См.СанПин № 0239-07 и инструкцию к вакцине).
В отличие от противопоказаний, под мерами предосторожности имеется в виду вероятность возникновения побочные проявления или состояния, которую следует принимать во внимание при определении того, на сколько выгоды от прививки перевешивают риски (особенно когда речь идет о потенциальном реципиенте с ослабленным иммунитетом или о беременной женщине).
Мера предосторожности не является противопоказанием
Упоминаемые в листках-вкладышах к препарату меры предосторожности иногда истолковывают неверно, приравнивая их к противопоказаниям, что приводит к упущенным возможностям вовремя сделать прививку.
Противопоказания и меры предосторожности
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ниже приводятся состояния и указания в анамнезе, которые не относятся ни к пртивопоказаниям ни к мерам предосторожности и расцениваются как ложные.
Ложные противопоказания
|
|
|
|
|
Какие побочные эффекты могут возникнуть после прививки от полиомиелита?
Фото: Алексей БУЛАТОВ
Эксперты утверждают: вакцина совершенно безвредна. Все возникающие проблемы – совпадения.
Все возникающие проблемы – совпадения.
В народе ходит очень много мифов и пересудов по поводу прививок. Немало родителей опасаются, что после них могут проявиться какие-то неприятные последствия. На вопрос, возможны ли во время прямой линии в редакции «КП в Украине» ответила медицинский эксперт фонда ЮНИСЕФ Екатерина Булавинова.
— Ничто в мире не является полностью безобидным. На прививки тоже бывают побочные реакции. Однако, оральная полиовакцина одна из самых безопасных в мире. На нее бывает крайне редкая реакция – вакцинноассоциированый полиомиелит. Но в наших, украинских, условиях она полностью исключена за счет правильной схемы профилактики: никто не получает живую полиовакцину как первую дозу. Поэтому острая реакция на эту вакцину исключается. Единственное, что возможно – покраснение и легкая боль в месте укола, — утверждает Екатерина Булавинова.
По ее словам, чаще всего происходят совпадения. Вне зависимости от прививки у ребенка может начаться сезонный насморк или что-то подобное, а это сразу связывают с ней.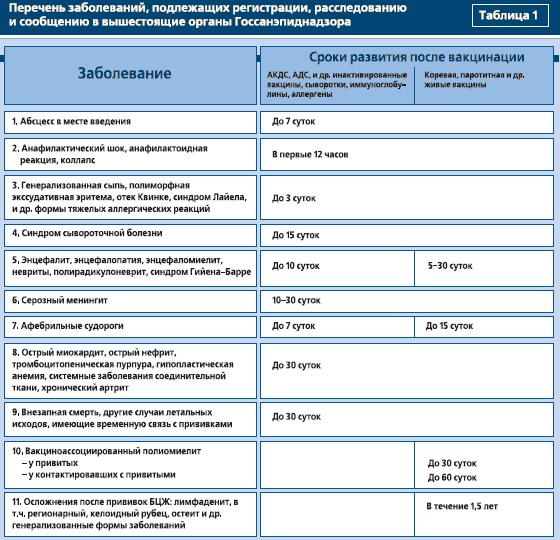 Был случай, когда школьнику ввели вакцину, а он через 10 минут упал в обморок. Оказалось, что он не кушал ни утром, ни накануне вечером.
Был случай, когда школьнику ввели вакцину, а он через 10 минут упал в обморок. Оказалось, что он не кушал ни утром, ни накануне вечером.
ЧИТАЙТЕ ТАКЖЕ
Какая вакцина от полиомиелита используется в Украине?
Специалисты утверждают: эти французские препараты совершенно безопасны в применении. Многие родители переживают: делать своему ребенку прививку от нашумевшего полиомиелита или нет? Уж очень противоречивых разговоров крутится относительно качества вакцины. О том, какая она действительно на прямой линии в редакции «КП в Украине» медицинский эксперт фонда ЮНИСЕФ Екатерина Булавинова.
— На данный момент используются 2 вакцины: инактивированная полиовакцина (ИПВ) и оральная (ОПВ). Обе произведены во Франции, фирма «Санофи Пастер». Первая убитая, полученная из цельных неактивных вирусов или бактерий. Она вводится уколом в переднюю часть бедра или плечо. Вторая живая в виде сиропа. Правильно сперва вакцинироваться инактивированной, а затем, через месяц вводить в организм живой препарат, — говорит Екатерина Булавинова.
Последствия прививок
Работаем без выходных и праздников
Вакцинация – безусловно, защищает человека от опасных болезней и спасла немало жизней, но у многих отношение к ней, мягко скажем, неоднозначное. Людей пугают возможные осложнения, вплоть до серьезных. И хотя статистика утверждает, что процент не то что осложнений, а даже простых побочных реакций от современных прививок крайне незначительный, впечатлительных людей, особенно мам, можно понять: что им до статистики, если речь идет о здоровье их родного ребенка.
В этой статье мы расскажем о возможных последствиях прививок, как отличить типичные поствакцинальные реакции от осложнений, опишем наиболее часто встречающиеся и посоветуем, что делать в подобных случаях.
Реакции и осложнения после прививки
С точки зрения организма любая вакцина – это попытка внедрить в него чужеродные вещества, на что наш организм, естественно, реагирует. Как правило, вакцинация проходит либо бессимптомно, либо с незначительными побочными реакциями: они не продолжительные, не стойкие и не приводят к каким-либо тяжелым последствиям для здоровья.
Как правило, вакцинация проходит либо бессимптомно, либо с незначительными побочными реакциями: они не продолжительные, не стойкие и не приводят к каким-либо тяжелым последствиям для здоровья.
Но в очень редких случаях случаются серьезные осложнения с риском стойких нарушений здоровья. Правда, стоит сказать, что различить постпрививочные реакции и поствакцинальные осложнения иногда бывает затруднительно – симптоматика зачастую совпадает: принято даже называть реакции и осложнения единым термином «побочные реакции».
Поствакцинальные реакции
Поствакцинальные реакции – это нормальная реакция организма на введение вакцины. Все они характеризуются небольшой продолжительностью (как правило, 1-2 дня, максимум до 5), проходят сами без внешнего вмешательства и, что самое важное, не вызывают никаких отрицательных последствий для организма привитого человека.
Конкретные реакции во многом зависят от вида вакцины (для живых вакцин они могут быть похожи на симптомы болезни), и их принято делить на местные и общие.
Местные реакции
Это реакции, локализованные в месте введения вакцины. Самые типичные:
- Покраснения и уплотнения, отек, уплотнения лимфоузлов
- Болезненные ощущения
- Аллергическая сыпь
Это типичные реакции на нарушение кожного покрова при уколе и появление в организме «чужаков». Но надо быть внимательным: если, например, покраснение больше 8 см, а отек – 5 см, стоит посоветоваться с врачом. Болезненные ощущения должны проходить в течение 1-3 дней, если боль сильная или мешает спать, можно дать обезболивающее.
При повторной вакцинации местные реакции возникают чаще: например, для АКДС – до 50%, пневмококковой – до 20%, для остальных прививок – от 5 до 15%. Из живых вакцин чаще всего замечены местные реакции для БЦЖ (от туберкулеза).
Иногда вакцины специально изготавливаются так, чтобы вызвать местные реакции – это повышает иммунный ответ организма. Для таких вакцин (АКДС, АДС, от гепатита А, В) местные реакции закономерны и не должны вызывать беспокойства.
На местные реакции и их интенсивность влияет и метод введения вакцины: лучше это делать внутримышечно, так как мышцы хорошо снабжаются кровью – в результате вакцина быстрее всасывается и повышается эффективность вакцины.
Подробнее c местными реакциями вы можете ознакомиться в отдельной статье.
Общие реакции
Реакции, затрагивающие организм в целом, но быстро проходящие, не вызывающие последующих осложнений. Наиболее типичные из них:
- Наиболее известное – повышение температуры: если она не превышает 38-38,5 градусов и проходит через 2-3 дня, беспокоиться не о чем.
- Общая вялость, дискомфорт, ощущение недомогания, головная боль, головокружение, беспокойство могут длиться 2-3 дня и слабо выражены, не нарушают привычную активность.
- Иногда наблюдаются кратковременные проблемы со сном и даже потеря аппетита.
- Некоторые компоненты вакцин изредка могут вызывать аллергические реакции, которые проявляются в появлении сыпи.

- При использовании живых вакцин могут наблюдаться слабо выраженные симптомы болезни, от которой проводится вакцинация: это нормальная реакция для такого типа вакцин.
Нормальные реакции
Приведем нормальные реакции на некоторые вакцины, в том числе входящим в национальный календарь прививок:
- АКДС – место инъекции может болеть и наблюдаться небольшой отек, непродолжительное, до 3-х дней повышение температуры до субфебрильного и даже фебрильного уровня.
- БЦЖ – папула в месте укола, которая эрозируется и на её месте остается рубчик.
- Гепатит В – возможна боль в месте укола не более 3 дней.
- ОПВ – без общих реакций.
- Корь – невысокая температура может появиться на 7-12 день, держится она не более 3-х дней и не требует жаропонижающих препаратов. Крайне редко встречается коревая сыпь.
- Краснуха – через 6-14 дней могут проявиться простудные симптомы: невысокая температура, першение в горле, насморк, но всё это быстро проходит без постороннего вмешательства.

- Эпидемический паротит – боль в месте инъекции, небольшое повышение температуры и легкое недомогание на 5-15 день.
- Ветряная оспа – в течение 3 недель могу появляться небольшое число элементов ветряночной сыпи, небольшое повышение температуры.
- Ротавирусная инфекция – повышение температуры, рвота и диарея, которые быстро проходят.
- COVID-19 в большинстве случаев носят легкий или умеренный характер и являются непродолжительными: повышение температуры, слабость, головная боль. боль в мышцах, озноб, диарея, боль в месте инъекции. Вероятность возникновения какого-либо из указанных побочных эффектов различается в зависимости от вакцины.
Более серьезные и продолжительные реакции возможны, однако встречаются крайне редко. Кроме того, вакцины постоянно проходят новые проверки. Это делается, что выявить редкие побочные эффекты.
Приведенный перечень возможных побочных явлений ни в коем случае не претендует на полноту и абсолютную истину: мы просто хотим успокоить родителей, чьим детям сделали прививки.
Частота побочных реакций
Последствия применения известных вакцин хорошо изучены, в том числе и частота побочных реакций: они встречаются не более чем у 10% привитых, а в 95% случаев симптомы настолько незначительны, что не требуют обращения к врачам. Вакцина против краснухи в среднем в 5% случаев вызывает общие реакции, против гепатита В – 7% местных реакций.
Что касается возможных осложнений, то они встречаются несравненно реже побочных реакций: для большинства вакцин – 1 случай на миллион и более прививок, а тяжелые – еще на порядок реже.
Сроки возникновения реакций
Обычно рано (в течение нескольких часов) проявляются побочные реакции на инактивные вакцины, но они слабо выражены и быстро проходят.
Как правило, побочные действия вакцин проявляются в пределах 4 недель, и лишь после БЦЖ побочные реакции могут наблюдаться даже через 14 недель.
Реакции на живую вакцину от кори не могут проявиться ранее 4 дней и позднее 12-14 дней, для полиомиелитной и паротитной вакцин – 30 дней.
Поствакцинальные осложнения
Поствакцинальные осложнения, в отличие от побочных реакций, протекает гораздо сложнее и могут иметь тяжелые последствия. Но и встречаются они намного реже – примерно по одному случаю на миллион прививок. При этом не лишним будет напомнить, что аналогичные осложнения в случае заболевания, от которого защищает прививка, случаются в сотни раз чаще.
Причины осложнений
Можно выделить три основные группы причин возникновения осложнений после вакцинации:
- Реактогенные свойства вакцины зависят от её компонентов, иммунной активности препарата, изменения свойств вакцинного штамма, загрязнения вакцины. Наиболее реактогенные – АКДС и БЦЖ, самые «тяжелые» препараты используются в вакцинах против краснухи, паротита, гепатита В, полиомиелита.
- Особенности организма: скрытые патологии, которые могут обостриться из-за реакции организма на вакцину, склонность организма к аллергии, аутоиммунные патологии, ослабленный иммунитет и другое.

- Нарушения техники прививки медицинскими работниками, к сожалению, являются одними из самых частных причин осложнений после прививки: неверная дозировка, плохая стерилизация, неверная техника иммунизации или нарушены инструкции, использован неправильный растворитель, вакцина неправильно разведена или не перемешана, неправильное хранение, не учтены противопоказания.
Виды поствакцинальных осложнений
Все возможные осложнения после прививки можно условно разделить на несколько групп:
- Реакция организма на компоненты вакцины:
- острая аллергия: анафилактический шок, крапивница, синдромы Лайелла и Стивенса-Джонсона, отек Квинке; при своевременной помощи, как правило, не оставляет последствий;
- через несколько часов после прививки, обычно АКДС, ребенок начинает громко плакать, визжать: слушать это тяжело, но часа через 3 проходит, и опасности для малыша не представляет;
- через 1-3 часа может возникнуть резкая мышечная слабость, которая сама быстро проходит.

- Реакции из-за низкого качества вакцины, обычно вызванные нарушением правил её хранения и перевозки:
- заявленный иммунитет так и не формируется;
- более заметные местные реакции;
- при нарушении стерильности вакцины могут возникать абсцессы, флегмоны или другие острые воспалительные изменения.
- Поствакцинальные осложнения (ПВО) часто связаны с нарушением технологии ввода вакцины, нарушением правил асептики: они могут привести к гнойно-воспалительным заболеваниям. Если вакцина БЦЖ вводится не внутрикожно, а подкожно, то развивается холодный абсцесс. При введении вакцины в ягодичную мышцу вместо большеберцовой или дельтовидной есть риск травмировать седалищный нерв или получить воспаление подкожной жировой клетчатки. Несоблюдение правил асептики грозит острым общим или местным воспалением. А если уколоть вакцину, предназначенную для приема через рот, не исключены ярко выраженные местные или общие реакции.

- Ввод вакцины может спровоцировать заболевание, от которого она предназначена.
- Тяжелые осложнения может спровоцировать иммунодефицит у детей: менингит, вакциноассоциированный полиомиелит или энцефалит, БЦЖ-остеомиелит, БЦЖ-инфекция. К счастью, даже при ослабленном иммунитете такие осложнения крайне редки. И самое главное: без прививки осложнения после перенесенной инфекции могут быть более выраженными и прогностически неблагоприятными.
Далее описаны возможные осложнения после конкретных прививок – все они подробно изложены в инструкциях к препаратам перечисленных ниже заболеваний:
- От гепатита В – редко бывает температура выше 39 градусов, общие реакции (тошнота и рвота, головная боль, слабость, артрит), кожная сыпь, неврит зрительного нерва и некоторые другие.
- У вакцины АКДС высокий риск осложнений и аллергических реакций. Самый опасный компонент вакцины – коклюшный, он может поражать головной мозг.
 А вот разновидность АКДС – вакцина АДСМ, не содержит коклюшного компонента, поэтому от неё побочные реакции, не говоря уже об осложнениях, наблюдаются крайне редко.
А вот разновидность АКДС – вакцина АДСМ, не содержит коклюшного компонента, поэтому от неё побочные реакции, не говоря уже об осложнениях, наблюдаются крайне редко.
Общие реакции на АКДС – температура 38-39 градусов, местные – боль, покраснения или уплотнения, возможные тяжелые осложнения: сильный плач ребенка, переходящий в визг, температура до 40 градусов, рвота, судороги, поствакцинальный энцефалит, неврит, полирадикулоневрит, кожные аллергические проявления. - Единственное тяжелое последствие прививки ОПВ от полиомиелита – вакциноассоциированный полиомиелит, но он бывает крайне редко, да и то обычно на фоне дефицита иммунитета.
- После прививок от кори, краснухи и паротита серьезные осложнения встречаются очень, очень редко: тромбоцитопения, пневмония, односторонняя глухота, панэнцефалит.
- Возможные реакции на прививку БЦЖ от туберкулеза:
- местные: рубец, язва, холодный абсцесс, региональный лимфаденит;
- остеиты, лимфадениты, крайне редко – аллергические васкулиты или красная волчанка;
- очень редко у детей с Т-клеточным иммунодефицитом может развиться генерализованная БЦЖ-инфекция;
- аллергические реакции: сыпь, узловатая эритема, кольцевидная гранулема, сыпь, анафилактический шок, вторичная инфекция.
Советы и рекомендации
Несмотря на пугающий список возможных побочных реакций и осложнений от вакцин, надо помнить главное – тяжелые последствия встречаются крайне редко и с ними умеют бороться, а местные и общие реакции не столь часты, слабо выражены и не опасны для здоровья.
Тем не менее, в течение нескольких дней или недель после прививки (сколько именно, зависит от конкретной вакцины), следует внимательно следить за самочувствием ребенка:
- Высокая температура в течение 3-х и более дней, одышка, судороги, частая рвота, сильная головная боль и другие заметные и постоянные отклонения от нормального самочувствия – повод вызвать врача.
- Введение вакцины – это всегда дополнительная нагрузка на организм, иногда весьма значительная, поэтому в первые дни после вакцинации стоит больше отдыхать и избегать заметных физических и эмоциональных нагрузок.
- При повышении температуры выше 38° используют жаропонижающие препараты в сочетании с физическими методами – холодные компрессы, обтирание влажной губкой. Особенно важно снижать температуру у детей, склонных к судорогам, с гипертензионно-гидроцефальным синдромом.
- Внимательно следите за состоянием организма, если у привитого, особенно, ребенка высок риск аллергических реакций.
- В течение первых 2-х недель перед прививкой и после неё лучше избегать продуктов – облигатных аллергенов: морепродукты, мёд и шоколад, яйца, клубника, малина, цитрусовые.
- В первые 7-10 дней старайтесь избегать контакта с другими людьми для снижения риска простудных заболеваний. Особенно это касается людей с пониженным иммунитетом и хроническими заболеваниями.
- Рекомендуется через 3 – 4 недели после прививки сделать общий анализ мочи для выявления возможных осложнений со стороны почек: это особенно важно для детей, имеющих заболевания органов мочевыделения. Анализ также позволит своевременно обнаружить отклонения и принять необходимые меры.
Список вакцинаций для детей от 3-х месяцев | Вакцинация | Профилактика и оздоровление
Вакцинация для детей, начиная с трехмесячного возраста, включает в себя прививки от таких заболеваний:
- коклюш (пентаксим, инфанрикс, АКДС, инфанрикс — гекса)
- столбняк
- дифтерия
- полиомиелит (пентаксим, полиорикс, имовакс полио, инфанрикс-гекса, ОПВ)
Инфанрикс
Инфанрикс – это комбинированная вакцина с коклюшным бесклеточным компонентом, которая первой начала использоваться в России для профилактики таких заболеваний, как коклюш, столбняк и дифтерия.
Факмакологические свойства
После введения «Инфанрикса» соответственно утвержденной схемы вакцинации формируется специфически иммунный ответ против коклюша, столбняка и дифтерии. Производство вакцины из субстанций биологического происхождения против перечисленных выше болезней соответствует всем требованиям ВОЗ.
Преимущества препарата
К преимуществам можно отнести:
- Долговременный опыт применения вакцины Инфанрикс в мире и в нашей стране
- Хорошая переносимость. Сравнительно с цельноклеточными АКДС-вакцинами обладает меньшей реактогенностью (переносится лучше)
- Высокая иммуногенность (способность формировать защиту от инфекций.
- Полное соответствие российскому Национальному календарю прививок
- Длительная и действенная защита, которая доказана при проведении массовой иммунизации
Способ использования
Вакцина «Инфанрикс» используется для первичной вакцинации детей.
Препарат вводится глубоко внутримышечно, во время курса вакцинации места введения обязательно чередуются. Инфанрикс нельзя вводить внутривенно и подкожно. Вакцина вводится в рекомендуемой разовой дозе 0,5 мл, курс иммунизации состоит из 3 инъекций.
Соответственно Национальному календарю профилактических прививок России первое введение вакцины начинают с 3-х месячного возраста жизни малыша с интервалом 1, 5 месяца (3 — 4,5 — 6 месяцев).
Кроме того, данный препарат показан для ревакцинации малышей в полтора года, если они раньше получали 3 дозы цельноклеточной или бесклеточной АКДС-вакцины.
Меры предосторожности и особые указания
По календарю прививок Инфанрикс можно в один день проводить вместе с другими вакцинами. Категорически запрещено смешивать препарат в одном шприце вместе с другими (исключение становит только вакцина Хиберикс).
При хранении Инфанрикса суспензия может разделяться на надосадочную прозрачную жидкость и осадок белого цвета.
Записаться на прививку в Детской клинике или записаться на прием к врачу иммунологу-вакцинологу (педиатру) можно по телефону в Санкт-Петербурге: 8(812)301-62-47, +7(812)942-06-05
Пентаксим
Вакцину Пентаксим используют для профилактики распространенных опасных детских инфекций – коклюша, столбняка, полиомиелита, дифтерии, а также инфекции, которую вызывает Hah4ophilus influenzaeтип b (одна из наиболее частых причин возникновения септицемии, менингита и др.). Вводят ее детям, начиная с 3-х месяцев.
Преимущества вакцины
К преимуществам препарата можно отнести:
- Сравнительно легкая переносимость вакцины в результате наличия в ней коклюшного бесклеточного компонента.
- Иммуногенность (способность сформировать защиту от инфекций) соответствует такой, если бы все вакцины вводились отдельно. При этом удается снизить инъекционную нагрузку на малыша (ведь вместо трех вводится один укол).
- Отсутствие риска возможного возникновения вакциноассоциированного полиомиелита из-за наличия в составе препарата убитого (инактивированного) вируса. Полиомиелитный инактивированный компонент позволяет устранить риск возникновения тех осложнений, которые может вызвать живой вирус вакцины.
- Хиб-компонент позволяет защитить от частых ОРЗ, отитов, синуситов, пневмоний, менингитов, которые эта инфекция может вызвать в очень раннем возрасте.
- Применяется больше 10 лет в 75 странах мира.
- Соответствует российскому календарю профилактических прививок по 4-м компонентам, эффективно дополнен Хиб-компонентом.
Способ использования
Вакцина Пентаксим вводится в дозе 0,5 мл внутримышечно в передне-латеральную поверхность бедра (средняя треть). Препарат не вводится внутривенно.
Соответственно календарю профилактических прививок России иммунизация для профилактики столбняка, дифтерии, полиомиелита и коклюша включает в себя 3 введения препарата в возрасте 3, 4,5 и 6 месяцев (интервал между инъекциями – 1, 5месяца). Ревакцинацию проводят однократно в 18 месяцев.
Если нарушен график вакцинации, то в последующем при введении очередной дозы вакцины интервалы не меняются. Это касается и интервала перед введением 4-й дозы вакцины – ревакцинацией – он составляет 12 месяцев или врач-иммунолог устанавливает для ребенка индивидуальный график, который зависит от конкретного случая.
При нарушении графика иммунизации Вы во всех случаях все вопросы, которые касаются прививок, можете решить с врачом и определить индивидуальный график для их проведения.
Записаться на прививку в Детской клинике или записаться на прием к врачу иммунологу-вакцинологу (педиатру) можно по телефону в Санкт-Петербурге: +7(812) 942-06-05, 301-62-47
Вакцина Инфанрикс Гекса
Вакцина Инфанрикс Гекса производится в Великобритании компанией ГлаксоСмитКляйн К.Х.
Показания
Инфанрикс Гекса используется с целью первичной иммунизации для профилактики коклюша, столбняка, дифтерии, гепатита В, инфекции, что вызывает Hah4ophilus influenzae и полиомиелита у детей, которым исполнилось 6 недель. Такую вакцину можно назначить грудничкам, которым была введена при рождении первая доза вакцины против гепатита В.
Способ использования
Вакцина Инфанрикс Гекса вводится глубоко в широкую латеральную мышцу бедра (переднебоковой участок его верхней или средней части). Соответственно календарю профилактических прививок России препарат вводится 0,5 мл троекратно в 3, 4,5 месяцев и в 1 год. Между введением препарата интервал должен становить не менее 1 месяца. О схемах вакцинации препаратом Инфанрикс Гекса более подробно можно проконсультироваться с педиатром.
Суспензию перед употреблением необходимо хорошо встряхнуть для получения белой мутной взвеси.
Противопоказания к использованию
Вакцина Инфанрикс Гекса не назначается тем лицам, у которых есть гиперчувствительность к какому либо компоненту вакцины или тем, у которых наблюдалась повышенная чувствительность после предыдущей вакцинации для профилактики дифтерии, коклюша, полиомиелита, столбняка, гемофильной инфекции или гепатита В. Инфанрикс Гекса нельзя вводить, если у малыша ранее, на протяжении 7 дней после предыдущей прививки вакциной, что содержит коклюшный компонент, была энцефалопатия неизвестного происхождения. В этом случае прививка против коклюша прекращается и продолжается иммунизация вакцинами для профилактики таких болезней, как гепатит В, дифтерия, столбняк, инактивированная полиомиелитная вакцина и вакцина против Hib.
Побочные эффекты
Клинические исследования показали, что самыми распространенными реакциями (более 10% случаев), которые наблюдались после первичной иммунизации, были:
- местные – отек гиперемия, болезненные ощущения;
- системные – лихорадка, анорексия, раздражительность, сонливость.
В исследованиях принимали участие 4083 лиц (при этом дозы вакцины задокументировали). Из тех реакций, что расценивались вероятно обусловленными или обусловленными вакцинацией, были отмечены повышенная раздражительность и реакции в месте введения препарата. Крайне редко встречались аллергические реакции, включая анафилактоидные после введения вакцин, которые содержат DTPa. Вакцины с коклюшным компонентом крайне редко вызывали случаи шокоподобного состояния или коллапса, а также судорог спустя 2-3 дня с момента проведения прививки. Все вакцинированные с перечисленными выше реакциями выздоравливали без каких-либо осложнений.
Взаимодействие
Препарат Инфанрикс Гекса запрещается смешивать с любыми другими вакцинами в одном шприце.
Записаться на прививку в Детской клинике или записаться на прием к врачу иммунологу-вакцинологу (педиатру) можно по телефону в Санкт-Петербурге: +7(812) 942-06-05, 301-62-47
Полиорикс
Полиорикс – бельгийский препарат, изготовлен компанией GlaxoSmithKline Biologicals. Он являет собой инактивированную вакцину, которая используется для профилактики полиомиелита.
Что же являет собой это заболевание? Это инфекция, которую вызывает один из 3-х полиомиелитных вирусов, она имеет острое начало и характеризуется широким диапазоном симптомов. Полиомиелит бывает паралитический и не паралитический. Особую опасность представляет паралитический полиомиелит, в результате которого могут остаться выраженные длительные параличи разных мышечных групп, в результате которых наступает инвалидизация человека или его смерть.
Инактивированную вакцину разработали для того, чтобы заменить живую полиомиелитную оральную вакцину, потому что она может спровоцировать такое опасное осложнение, как вакциноассоциированный полиомиелит. Это болезнь, которая протекает так же, как обычный полиомиелит, но возбудитель его – не дикий вирус, а компонент вакцины. Клиническое течение и исходы обеих вариантов полиомиелита похожи между собой, но встречается вакциноассоциированный полиомиелит крайне редко.
После введения хотя бы 2 доз инактивированной вакцины снижает к нулю возможность возникновения вакциноассоциированного полиомиелита. В составе вакцины есть инактивированный полиомиелитный вирус 1,2,3 типов.
Показания к вакцинации
Вакцина Полиорикс используется для профилактики полиомиелита в детском возрасте, начиная с 3-хмесячного возраста, а также взрослых.
Способ использования
Вакцину Полиорикс вводят внутримышечно. Чаще всего у маленьких деток это средняя треть бедра (четырехглавая бедренная мышца), а в детей старшего возраста и взрослых – в плечо (дельтовидная мышца). В настоящее время не практикуют инъекций в ягодицу. Можно ввести вакцину и подкожно. Категорически запрещено внутривенное введение.
Дозирование
Полиорикс вводится в разовой дозе 0,5 мл. Поставляется вакцина во флаконах со специальными крышечками. Полиорикс забирают из флакона и затем вводят стерильным шприцем. Все это происходит под строжайшим соблюдении правил антисептики и асептики. Препарат нельзя хранить во вскрытом флаконе.
Побочные действия
Профиль безопасности, что представлен ниже, основывается на результатах проведенных клинических испытаний у детей (ранний и старший возраст). Но так как одновременно вводили и другие вакцины, то нельзя установить причинную связь перечисленных симптомов с Полиориксом.
Все нежелательные реакции сгруппированы по частоте их встречаемости:
- очень часто – покраснение, припухлость и боль в месте инъекции, сонливость, лихорадка, возбудимость, беспокойство, потеря аппетита, необычный плач
- часто – рвота, жидкий стул
- крайне редко — аллергические проявления, в том числе анафилактоидные и анафилактические реакции
Противопоказания
Можно выделить такие противопоказания к использованию вакцины Полиорикс:
- острые инфекционные и неинфекционные болезни
- обострение хронической патологии
- заболевания, которые сопровождаются повышением температуры тела
В таких случаях иммунизация откладывается до полного выздоровления.
Кроме того, Полиорикс не вводится при аллергии к ее компонентам (как активным, так и вспомогательным), а также к полимиксину В, неомицину и стрептомицину, при аллергиях на предыдущие введения вакцины.
Взаимодействие с другими препаратами
Препарат Полиорикс можно вводить вместе со всеми другими вакцинами препаратами из национального календаря профилактических прививок в один день, при этом инъекции проводят в разные участки тела. Исключение составляет вакцина БЦЖ.
Использовать вакцину можно у детей и взрослых только полностью здоровых. Перед планируемой вакцинацией врач проводит осмотр пациента, чтобы исключить у него острые заболевания или обострение хронических болезней. Если курс иммунизации против полиомиелита продолжается у лиц старше 18 лет, который прививался в детстве, то в таком случае курс вакцинации являет собой введение каждые 10 лет одной прививки.
Записаться на прививку в Детской клинике или записаться на прием к врачу иммунологу-вакцинологу (педиатру) можно по телефону в Санкт-Петербурге: +7(812) 942-06-05, 301-62-47
Вакцина ОПВ для профилактики полиомиелита
Пероральная полиомиелитная вакцина – это препарат, который изготовлен из аттенуированных штаммов Сэбина полиомиелитного вируса 1, 2, 3 типов, что выращивают на первичной клеточной культуре почек зеленых африканских мартышек или на перевиваемой клеточной культуре линии Vero в форме раствора с гидролизатом лактальбумина 0.5 % в растворе Эрла.
После введения вакцины у 90-95% привитых создается стойкий иммунитет к полиомиелитным вирусам 1, 2, 3 типов.
Препарат предназначается исключительно для перорального использования.
Применяют вакцину на 1 прием 4 капли. Ее прививочная доза закапывается в рот за 1 час до приема пищи капельницей, что прилагается к флакону или пипеткой. После прививки нельзя запивать препарат водой или другой жидкостью, также пить или есть на протяжении часа после вакцинации.
По эпидпоказаниям, кратность прививок устанавливают индивидуально в зависимости от конкретного случая. При этом учитываются особенности эпидпроцесса полиомиелита. В дальнейшем другие плановые прививки для профилактики полиомиелита выполняются в установленные сроки.
Результаты всех прививок против полиомиелита регистрируются в установленных учетных формах, где указывается наименование препарата, его серия, номер, доза, дата проведения вакцинации и реакции на нее.
Передозировка
При передозировке нежелательных последствий не возникает.
Взаимодействие с другими препаратами
Вакцинацию против полиомиелита можно провести вместе с вакцинацией АКДС (АДС- или АДС-М анатоксином). Допускается одновременно вводить вместе с полиомиелитной вакциной и другие препараты российского календаря профилактических прививок.
При введении вакцины ОПВ побочных действий практически нет.
IX. Мероприятия по профилактике вакциноассоциированныхслучаев полиомиелита (ВАПП)
9.1. Для профилактики ВАПП у реципиента вакцины:
— первые 2 вакцинации против полиомиелита проводят вакциной ИПВ в сроки, установленные национальным календарем профилактических прививок, — детям до года, а также детям более старшего возраста, не получившим прививки против полиомиелита ранее;
— детям, имеющим противопоказания к применению вакцины ОПВ, иммунизация против полиомиелита осуществляется только вакциной ИПВ в сроки, установленные национальным календарем профилактических прививок.
9.2. Для профилактики ВАПП у контактных с детьми, получившими прививки ОПВ, проводятся мероприятия в соответствии с пунктами 9.3 — 9.7 настоящих санитарных правил.
9.3. При госпитализации детей в стационар в направлении на госпитализацию указывают прививочный статус ребенка (количество сделанных прививок, дата последней прививки против полиомиелита и название вакцины).
9.4. При заполнении палат в медицинских организациях не допускается госпитализация не привитых против полиомиелита детей в одну палату с детьми, получившими прививку ОПВ в течение последних 60 дней.
9.5. В медицинских организациях, дошкольных организациях и общеобразовательных учреждениях, летних оздоровительных организациях детей, не имеющих сведений об иммунизации против полиомиелита, не привитых против полиомиелита или получивших менее 3 доз полиомиелитной вакцины, разобщают с детьми, привитыми вакциной ОПВ в течение последних 60 дней, на срок 60 дней с момента получения детьми последней прививки ОПВ.
9.6. В детских закрытых коллективах (дома ребенка и других) в целях профилактики возникновения контактных случаев ВАПП, обусловленных циркуляцией вакцинных штаммов полиовирусов, для вакцинации и ревакцинации детей применяется только вакцина ИПВ.
9.7. При иммунизации вакциной ОПВ одного из детей в семье медицинский работник должен уточнить у родителей (опекунов), имеются ли в семье не привитые против полиомиелита дети, и при наличии таковых рекомендовать вакцинировать непривитого ребенка (при отсутствии противопоказаний) или разобщить детей сроком на 60 дней.
Открыть полный текст документа
Что такое полиомиелит, обратиться к педиатру Калининград 32 14 14
Полиомиелит — это высоко инфекционное вирусное заболевание, вызванное полиовирусом. Полиовирус поражает нервную систему и может вызвать паралич или даже смерть всего за несколько часов.
Кто подвержен риску заражения полиомиелитом?
Заражению полиомиелитом подвержены, главным образом, дети в возрасте до 5 лет.
Как передается полиомиелит?
Дикий полиовирус (ДП) попадает в организм через рот, вместе с водой или пищей, в том случаи, если они были загрязнены фекалиями зараженного человека. Данный вирус размножается в кишечнике и выделяется с фекалиями зараженного человека, таким образом он может заразить других людей.
Каковы симптомы полиомиелита?
Инкубационный период обычно составляет 7-10 дней (колеблется от 4 до 35 дней)
Первыми симптомами полиомиелита являются:
- высокая температура
- усталость
- головная боль
- рвота
- болезненность в области затылка
- боль в конечностях
Каковы последствия полиомиелита?
Многолетние наблюдения выявили следующие последствия вызванные вирусом полиомиелита:
- У одного из каждых 200 человек, зараженных полиомиелитом, наступает необратимый паралич ног.
- Из числа парализованных детей 5%-10% умирают при параличе дыхательных мышц, вызванном вирусом.
- Летальность среди заболевших паралитическим полиомиелитом подростков и взрослых составляет от 15 до 30%.
Осложнения, вызванные вирусом полиомиелита:
- Стойкий необратимый паралич и возникающие в результате него деформации нижних конечностей являются обычным последствием заболевания.
- Другие частые осложнения: пневмония, ателектазы легких, интерстициальный миокардит; иногда развиваются острое расширение желудка, тяжелые желудочно-кишечные расстройства с кровотечением, язвами, прободением.
Существует ли средство от полиомиелита?
Средства от полиомиелита не существует. Полиомиелит неизлечим, его можно только предотвращать. Заболевание можно предотвратить только с помощью иммунизации. Существует безопасная и эффективная вакцина от полиомиелита — оральная полиовакцина (ОПВ). ОПВ обеспечивает необходимую и достаточную защиту детей от полиомиелита. В случае неоднократного применения оральной полиовакцины ребенок получает пожизненную защиту против полиомиелита.
Почему столько внимания уделяется полиомиелиту, а не другим заболеваниям?
Полиомиелит — это одна из немногих болезней, которые можно полностью ликвидировать, как это когда-то произошло с оспой. Большинство болезней, например ВИЧ и малярию, ликвидировать нельзя, поскольку для этого в настоящее время не существует возможностей. В отличии от других вирусов, вирус полиомиелита не может существовать среди животных и никогда не переносится насекомыми. Вирус не может выжить в окружающей среде и хотя он является заразным, его инфекционный период относительно непродолжителен. Для защиты детей от полиомиелита существует безопасная и эффективная вакцина. Искоренение полиомиелита высокоприоритетные задача и её решение принесет пользу детям всего мира так как ни одному ребенку не придется больше ощутить паралич, вызванный полиомиелитом.
Зачем детям дают оральную полиовакцину
От полиомиелита нет лекарств. Полиовакцина является единственным и очень действенным средством защиты от полиомиелита — парализующей болезни. Крайне важно обеспечить иммунизацию от полиомиелита каждого ребенка в возрасте до 5 лет. Оральная полиовакцина является безопасной и очень эффективной.
Существуют ли у оральной полиовакцины какие-либо побочные эффекты?
Оральная полиовакцина (ОПВ) это одна из самых безопасных вакцин, которые когда-либо создавались. Она настолько безопасна, что ее можно давать заболенвшим детям и даже новорожденным. Оральная поливакцина используется во всем мире для защиты детей от полиомиелита. Риск заболеть полиомиелитом для детей значительно выше, чем риск побочных последствий, возникающих от применения полиовакцины.
Безопасно ли неоднократно давать дозы ОПВ детям?
Да это абсолютно безопасно. Можно неоднократно давать детям дозы ОПВ. Эта вакцина предназначена именно для неоднократного применения, с целью обе5спечить всеобъемлющую и полную защиту ребёнка. В тропических регионах для обеспечения натиболее полной защиты ребенка необходимо использовать несколько доз полиовакцины, зачастую более десяти. Каждая дополнительная доза способствует дальнейшему усилению иммунитета ребенка против вируса полиомиелита.
Сколько доз ОПВ требуется ребенку для обеспечения защиты?
Оральную вакцину необходимо применять несколько раз, чтобы она подействовала в полной мере. Количество доз, необходимых для иммунизации ребенка, всецело зависит от его здоровья и числа других вирусов, воздействию которых подвергся ребенок. В организме каждого непривитого ребенка может скрываться вирус полиомиелита.
Следует ли давать ребенку ОПВ во время кампаний борьбы с полиомиелитом и в ходе плановой иммунизации?
Каждая дополнительная доза означает, что ребенок получает дополнительную защиту от полиомиелита. Оральная полиовакцина (ОПВ) безопасна и эффективна. Для достижения полного иммунитета против полиомиелита необходимы несколько доз ОПВ. Если ребенок получал вакцину ранее, то дополнительные дозы будут способствовать развитию ценного дополнительного иммунитета против полиомиелита.
Безопасна ли ОПВ для больных детей и новорожденных?
Оральная полиовакцина безопасна как для больных детей так и для новорожденных. На самом деле крайне важно вакцинировать и больных детей и новорожденных, поскольку их уровень иммунитета ниже, чем у других детей.
Какие прививки входят в казахстанский календарь вакцинации
Почему сложно найти вакцины, которые не входят в национальный календарь
На прошлой неделе в рамках нашего проекта вышло интервью с председателем Комитета санитарно-эпидемиологического контроля Минздрава Республики Казахстан Айжан Есмагамбетовой. Часть ответов о том, почему родители не всегда могут поставить вакцины, которые не входят в национальный календарь, мы решили включить в этот материал.
«Далеко не все производители заинтересованы представлять вакцину на нашем рынке»
— На сайте национального центра экспертизы лекарственных средств есть зарегистрированная вакцина от ротавируса, ветрянки, менингококка, но в свободном доступе их нет. Видимо, не так много будет людей, которые захотят вакцинироваться платно, поэтому частным прививочным центрам невыгодно их закупать. Государство может предпринять какие-то меры, чтобы эти вакцины появились на рынке?
— Если вакцина зарегистрирована, всегда есть возможность завести даже ее минимальную партию. Но если она не входит в национальный прививочный календарь частным медицинским организациям, действительно, невыгодно ее закупать и завозить в страну. И еще есть важный момент, связанный с регистрацией новых вакцин. Это сложная и многоэтапная для производителей процедура. Она включает в себя специализированную экспертизу, при которой выполняется детальный, тщательный анализ всех материалов, касающихся безопасности и эффективности, рассматриваются результаты всех предыдущих этапов, дается оценка вспомогательных веществ, стабильности, специфичности, чувствительности и т.д. Поэтому далеко не все производители заинтересованы представлять вакцину на нашем рынке. По мировым меркам он очень маленький – у нас страна с населением около 19 миллионов человек. Нас часто критикуют: почему такая-то вакцина есть в других странах, а Казахстан ее не закупает? Но мы независимое государство со своими регуляторными механизмами и правилами и не можем опираться лишь на то, что вакцина зарегистрирована в других странах. Она должна пройти эти процедуры и у нас. Но не всем производителям это интересно. Поэтому и нет некоторых вакцин на нашем рынке.
Неблагоприятные события после иммунизации оральным полиовирусом в Киншасе, Демократическая Республика Конго: предварительные результаты
Pathog Glob Health. 2013 Октябрь; 107 (7): 381–384.
Дидье Нзоло
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Мишель Нтетани Алони
2 Университетская больница Киншасы, Медицинский факультет, Университет Киншасы
, Демократическая Республика
Thérèse Mpiempie Ngamasata
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Bibiche Mvete Luemba
1 Национальный центр конгамы по фармаконадзору
, Санитарный надзор,
, Санитарный центр Демократической Республики Киншаса, Университет Киншасы
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Матильда Ботале Экила
3 Отделение инфекций, Отделение внутренней медицины, Университетская больница Киншасы, Медицинский факультет Университета Киншасы, Демократическая Республика lic of Congo
Célestin Ndosimao Nsibu
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Narcisse Lutete Tona
1 Национальный центр фармаконадзора, Университет Демократической Республики Конго,
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
2 Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Демократическая Республика Конго
3 Отделение инфекций, Департамент Внутренняя медицина, Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Демократическая Республика Конго
Для корреспонденции: М.Н. Алони, отделение гематоонкологии и педиатрии нефрологии, Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Киншаса, Демократическая Республика Конго. Электронная почта: rf.oohay@3002inolalehcimЭту статью цитируют другие статьи в PMC.
Abstract
Цель
Мы исследовали природу и частоту нежелательных явлений после иммунизации (ПППИ), связанных с пероральными полиовакцинами (ОПВ), среди населения в целом в Киншасе, Демократическая Республика Конго (ДР Конго).
Методы
Национальный центр фармаконадзора ДР Конго организовал активное наблюдение за ПППИ во время кампаний массовой иммунизации населения в целом с марта по июнь 2011 года. Отчет о безопасности индивидуального случая пациента был использован в качестве вопросника и адресован ученикам и студентам средних школ и университеты, у которых были какие-либо нежелательные явления после приема ОПВ. Мы использовали предпочтительный термин из терминологии ВОЗ по побочным реакциям для обозначения AEFI. Здесь представлены результаты второго этапа кампании массовой иммунизации.
Результаты
Всего 767 пациентов сообщили о ПППИ на втором этапе. Распределение по полу показывает, что 512 (66,8%) студентов были женщинами, а 255 (33,2%) — мужчинами, что дает соотношение девочек и мужчин 2: 1. Средний возраст составил 16,8 ± 5,19 года (от 6 до 35,5 лет). Каждый человек сообщил о среднем значении 1,33 ± 0,6 AEFI. Средняя продолжительность начала ПППИ составила 1,74 ± 1,16 дня после вакцинации, от 1 до 9 дней. Головная боль (22,4%), боль в животе (17,2%), лихорадка (11,7%), диарея (9,9%) и астения (7,1%).5%) были общими симптомами. Паралич и астматические реакции были редкими и серьезными побочными эффектами в этом исследовании. Больше всего пострадали желудочно-кишечный тракт (33,5%) и нервная система (29,3%). Повторный вызов был положительным у 173 человек (22,6%).
Заключение
ПППИ, связанные с ОПВ, не редкость, хотя о них не сообщается. Активный надзор за ПППИ во время кампаний массовой иммунизации очень важен и может помочь выявить редкие и серьезные побочные эффекты. Дальнейшие исследования будут важны для выявления риска ПППИ с ОПВ у взрослых и необходимы для выяснения причины этой связи в конголезской среде.
Ключевые слова: Неблагоприятные события после иммунизации, Оральный полиовирус, Студенты, Киншаса, Демократическая Республика Конго
Введение
В 1988 году Всемирная ассамблея здравоохранения приняла решение искоренить полиомиелит во всем мире. Глобальная кампания по искоренению полиомиелита позволила снизить более чем на 90% количество случаев полиомиелита во всем мире за последние 11 лет с момента ее запуска. 1 Живая аттенуированная пероральная вакцина против полиомиелита (ОПВ) имеет много преимуществ по сравнению с инактивированной вакциной против полиомиелита (ИПВ) для ликвидации полиовируса в кампании массовой иммунизации.Он наделяет кишечным иммунитетом, делая недавних реципиентов ОПВ устойчивыми к инфекции дикими полиовирусами; обеспечивает длительную защиту от паралитических заболеваний за счет стойкого гуморального иммунитета; его пероральное применение исключает проблемы безопасности инъекции и программные ошибки, связанные с инъекцией; иммунизация ОПВ обходится дешевле, чем ИПВ, и должна быть выбором для кампании массовой вакцинации в развивающихся странах. Из-за риска вакцинно-ассоциированного паралитического полиомиелита в некоторых странах ОПВ была заменена ИПВ. 2
Системы эпиднадзора за ПППИ являются важными инструментами для мониторинга связи между вакцинацией и предполагаемыми побочными эффектами. В европейских странах было рекомендовано ввести отчетность и надзор за побочными эффектами после иммунизации (ПППИ) в каждой стране как часть системы мониторинга. 3 В Африке ПППИ менее документированы, особенно те, которые связаны с ОПВ. 4 , 5 Кроме того, ОПВ чаще всего вводят младенцам, что делает описание ПППИ менее точным, а во время плановой иммунизации вакцину против полиомиелита вводят вместе с другими вакцинами, что затрудняет оценку причинно-следственной связи.
В Демократической Республике Конго (ДР Конго) ОПВ вводится четыре раза во время плановой иммунизации младенцев при рождении, на шестой, десятой и четырнадцатой неделях. Ежегодно проводятся Национальные дни иммунизации, когда кампания иммунизации проводится по всей стране. Если в некоторых районах появляются новые случаи паралича, связанного с диким полиовирусом, может быть проведена ограниченная кампания иммунизации в соответствующем районе, а затем могут быть проведены дополнительные мероприятия по иммунизации.
В 2010 и 2011 годах, после вспышки мутантного вируса полиомиелита в Центральноафриканском регионе, некоторые случаи были зарегистрированы даже среди взрослых. 6 Министерство здравоохранения ДР Конго начало кампанию массовой иммунизации населения. Большинство людей, включая взрослых, получали ОПВ четыре раза за 4 месяца. На первом и втором этапах вводили моновалентную ОПВ типа 1. На третьем этапе вводили бивалентную ОПВ 1 и 3 типов. «Национальный центр фармаконадзора (CNPV)» ДР Конго, расположенный в Университете Киншасы, разработал активный эпиднадзор за ПППИ во время этих кампаний массовой иммунизации, чтобы получить дополнительную информацию об ОПВ-ассоциированных ПППИ.
Наша конечная цель — создать основу для разработки и реализации эффективных профилактических вмешательств. Наше исследование было разработано для информирования клинической практики, образования, рекомендаций по консультированию и всех заинтересованных сторон, участвующих в системе иммунизации. Целью данной работы является оценка характера и частоты ПППИ, связанных с ОПВ, среди населения Киншасы в целом.
Пациенты и методы
Это перекрестное исследование, проведенное среди учащихся и студентов университетов в период с марта 2011 г. по июнь 2011 г. в Киншасе, Демократическая Республика Конго.23–27 марта моновалентная ОПВ типа 1 (мОПВ1) была введена 9 863 458 пациентам. С 28 апреля по 2 мая мОПВ1 получили 10 091 567 человек. 26–30 мая бивалентная ОПВ типа 1 и 3 (биОПВ) была введена 9 724 982 пациентам, а 10 206 785 получили мОПВ1 25–29 июня.
Анкета, разработанная CNPV, была адресована в основном тем, у кого были какие-либо ПППИ после иммунизации ОПВ. Анкета была предоставлена как отчет о безопасности отдельного случая пациента (ICSR пациента) и включала необходимую информацию для отчетности по ПППИ в последовательных массовых кампаниях.Обязательной информацией, включенной в анкету, были: исходная информация пациента, возраст, пол, история лекарственной терапии в течение последней недели перед иммунизацией и информация о нежелательном явлении, включая описание пациента, дату начала, дату окончания и историю реакции на предыдущую иммунизацию. Перед заполнением анкеты объяснили пользу вакцинации, а также возможность возникновения нежелательных явлений. Все анкеты были собраны и обработаны CNPV.
Это исследование является результатом активного надзора за ПППИ Национальным центром фармаконадзора Университета Киншасы в соответствии с рекомендациями Всемирной организации здравоохранения для кампании массовой иммунизации, а также для плановой иммунизации.
Каждый месяц сбор данных начинался на четвертый день иммунизации, который обычно был датой окончания, и длился 10 дней после окончания кампании иммунизации. Сбор данных был завершен только по первым трем этапам этой четырехэтапной кампании массовой иммунизации. Более 1500 человек сообщили о возникновении ПППИ на первых трех этапах. В этом предварительном исследовании мы сосредоточились только на результатах второго этапа, которые позволяют нам оценить частоту повторного заражения, связанного с ПППИ, ассоциированными с моновалентной ОПВ 1 типа.
Перед обращением к студентам было получено письменное согласие от властей вуза. Отчет студентов об AEFI был бесплатным.
Для анализа мы использовали предпочтительный термин из терминологии ВОЗ по побочным реакциям. Данные представлены в виде средних значений ± стандартное отклонение, когда распределение было нормальным, и медианы с диапазоном, когда распределение не было нормальным. Частота появления различных симптомов и признаков выражается в пропорциях (%).
Результаты
CNPV получил и проанализировал отчеты AEFI от 767 человек во время второго этапа.Все пациенты, заполнившие анкету, были здоровы во время иммунизации. Распределение по полу показывает, что 512 (66,8%) были женщинами, а 255 (33,2%) были мужчинами, что дает соотношение женщины: мужчины 2: 1. Средний возраст составил 16,8 ± 5,19 года.
Каждый человек сообщил о среднем значении 1,33 ± 0,6 AEFI. Всего было зарегистрировано 1020 AEFI. Головная боль, боль в животе, лихорадка, диарея и астения были частыми симптомами при обращении с частотой 22,4%, 17,2%, 11,7%, 9,9% и 7,5% соответственно ().После иммунизации было пять случаев мышечной слабости и два случая паралича. Один из них выздоровел до 1 месяца, второй все еще был парализован через 1 месяц. Сообщалось об одном случае астматической реакции с положительным повторным заражением. Средняя продолжительность начала ПППИ составила 1,74 ± 1,16 дня после вакцинации, варьировалась от 1 до 9 дней. Повторный вызов был положительным у 173 человек (22,6%). Наиболее сильно пострадали желудочно-кишечный тракт (33,5%), центральная и периферическая нервная система (29.3%) и тело в целом (21,8%). В этой серии 4,2% людей сообщили о нарушениях опорно-двигательного аппарата и 3,2% о заболеваниях кожи и придатков, включая крапивницу, сыпь и зуд.
Таблица 1
AEFI после OPV в популяции нашего исследования
| AEFI | Число случаев | Частота (%) | ||||||
| Головная боль | 228 90,4 боль | 175 | 17.2 | |||||
| Лихорадка | 119 | 11,7 | ||||||
| Диарея | 101 | 9,9 | ||||||
| Астения и / или недомогание | 14 79 | 14 79 | ||||||
| Тошнота и / или рвота | 47 | 4,6 | ||||||
| Скелетно-мышечная боль | 23 | 2,3 | ||||||
| Кашель | 21 | 2.1 | ||||||
| Ринит | 21 | 2,1 | ||||||
| Конъюнктивит | 18 | 1,8 | ||||||
| Фарингит | 17 | 4 | 1,7 | 17 | 4 | 15 | 1,5 | |
| Боль в спине | 9 | 0,9 | ||||||
| Зуд | 7 | 0,7 | ||||||
| Крапивница | 7 01427 | |||||||
| Слабость мышц | 5 | 0,5 | ||||||
| Одышка | 2 | 0,2 | ||||||
| Паралич | 2 | 4 | 901 | 2 | Всего | 1020 | 100 |
Обсуждение
Насколько нам известно, настоящее исследование является первой попыткой описать ПППИ в нашей популяции. Это первая оценка клинических событий после кампании иммунизации ОПВ в регионе Центральной Африки.Это исследование является результатом активного эпиднадзора за ПППИ во время кампании массовой иммунизации, охватывающей население разного возраста, и показало, что вспышка полиомиелита встречается даже у взрослых. Однако этот исследуемый образец был подмножеством населения Киншасы
Головная боль, боль в животе, лихорадка, диарея и астения были частыми симптомами при обращении с частотой 22,4%, 17,2%, 11,7%, 9,9% и 7,5%. %, соответственно. Было пять случаев мышечной слабости и два подозрения на вакцино-ассоциированный полиомиелит.Сообщалось о двух случаях паралича после иммунизации. Сообщалось об одном случае астматической реакции с положительным повторным заражением.
Мы зафиксировали головную боль как наиболее частый симптом (22,4%). Подобные наблюдения были описаны и с другими вакцинами. 7 — 10 Было обнаружено, что другие признаки и симптомы, описанные в этом исследовании, аналогичны тем, которые описаны в других источниках для других вакцин. 8 — 10
Ни одного случая ПППИ, связанного с ОПВ, у взрослого и педиатрического населения не было обнаружено при использовании доступных компьютерных программ поиска медицинской литературы.Однако, согласно документу ВОЗ, озаглавленному «Дополнительная информация о безопасности вакцины, фоновой частоте нежелательных явлений после иммунизации», 11 распространенными незначительными реакциями на вакцину, связанными с ОПВ, являются лихорадка, раздражительность, недомогание и неспецифические симптомы, такие как диарея. , головная боль и / или мышечная боль. Этот результат похож на наш. Согласно этому документу, эти общие реакции возникают в течение одного или двух дней после иммунизации. Это близко к нашему исследованию, где средняя продолжительность начала ПППИ составила 1.74 ± 1,16 сут. В том же документе описан паралитический полиомиелит, связанный с вакцинацией, как основная редкая и серьезная вакцинационная реакция, связанная с ОПВ, с оценочным риском 1 на 1,4–3,4 миллиона для первой дозы. Два случая паралича, о которых мы сообщали, произошли после введения первой дозы, и около 10 миллионов человек получили эту дозу; К сожалению, не было проведено никаких дальнейших исследований, чтобы подтвердить, был ли это паралитический полиомиелит, связанный с вакцинацией.
Заключение
ПППИ, связанные с ОПВ, не редкость среди взрослых конголезцев, хотя о них недостаточно.Активное наблюдение после кампании массовой иммунизации позволило выявить некоторые редкие ПППИ, связанные с ОПВ, например, возможный вакцино-ассоциированный полиомиелит.
Принимая во внимание важность иммунизации для индивидуального и коллективного иммунитета, требуется хорошее сотрудничество всех заинтересованных сторон, участвующих в каждом отдельном случае неблагоприятного события. Дальнейшие исследования будут важны для определения риска ПППИ, связанного с ОПВ, у взрослых и необходимы для выяснения причины этой связи в конголезской среде.Это первый шаг в индивидуальном ведении данного клинического объекта.
Пределы исследования
Мы объявили пациентов нашего исследования здоровыми до иммунизации на основании их заявления об отсутствии в анамнезе лекарственной терапии. Никаких дополнительных исследований для подтверждения того, были ли они действительно здоровыми до иммунизации, не проводилось. В это перекрестное исследование не были включены контрольные группы (например, взрослые, не получающие ОПВ) из-за массового характера кампании вакцинации среди всего населения Киншасы в течение периода исследования; поэтому интерпретировать эту информацию сложно.В проспективном исследовании необходимы более точные данные для оценки частоты ПППИ, вызванной ОПВ, и для сравнения с контрольной группой. Будущие проспективные исследования должны ответить на следующие вопросы:
Отличались ли ПППИ у взрослых, получавших ОПВ, от детей?
Есть ли разница между ПППИ после мОПВ и биОПВ?
Можно ли назвать ОПВ безопасной вакциной для взрослых на основе результатов текущих и будущих проспективных исследований?
Ссылки
1.Обновленная информация Центров по контролю и профилактике заболеваний (CDC) по полиовирусам вакцинного происхождения — во всем мире, апрель 2011 г. — июнь 2012 г. MMWR Morb Mortal Wkly Rep. 2012; 61: 741–6. [PubMed] [Google Scholar] 2. Центры по контролю и профилактике заболеваний (CDC). Обновленная информация о полиовирусах вакцинного происхождения — во всем мире, июль 2009 г. — март 2011 г. MMWR Morb Mortal Wkly Rep. 20116025846–50. [PubMed] [Google Scholar] 3. Schumacher Z, Bourquin C, Heininger U. Эпиднадзор за побочными эффектами после иммунизации (AEFI) в Швейцарии — 1991–2001 гг.Вакцина. 2010. 28: 4059–64. [PubMed] [Google Scholar] 4. Уандаого CR, Yaméogo TM, Diomandé FV, Sawadogo C, Ouédraogo B, Ouédraogo-Traoré R, et al. Неблагоприятные события после иммунизации во время кампаний массовой вакцинации при первом введении конъюгированной менингококковой вакцины A в Буркина-Фасо, 2010 г. Вакцина. 2012; 30: B46–51. [PubMed] [Google Scholar] 5. Лунд Н., Андерсен А., Монтейро И., Оби П., Бенн К. С.. Не оказывает влияния пероральная вакцина против полиомиелита, вводимая при рождении, на смертность и иммунный ответ на БЦЖ. Естественный эксперимент.Вакцина. 2012; 30: 6694–9. [PubMed] [Google Scholar] 6. Ле Менах А., Льоса А.Е., Муниаман-Нара И., Куасси Ф., Нгала Дж., Боксалл Н. и др. Вспышка полиомиелита, Пуэнт-Нуар, Республика Конго, сентябрь 2010 г. — февраль 2011 г. Emerg Infect Dis. 2011; 17: 1506–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Вальдман Э.А., Лум К.Р., Монтейро С.А., де Фрейтас ФР. Наблюдение за побочными эффектами после вакцинации и безопасность программ иммунизации. Rev Saude Publica. 2011; 45: 173–84. [PubMed] [Google Scholar] 8.Ankrah DN, Mantel-Teeuwisse AK, De Bruin ML, Amoo PK, Ofei-Palm CN, Agyepong I и др. Частота нежелательных явлений среди медицинских работников после массовой иммунизации против h2N1 в Гане: проспективное исследование. Drug Saf. 2013; 36: 259–66. [PubMed] [Google Scholar] 9. Уандаого CR, Yaméogo TM, Diomandé FV, Sawadogo C, Ouédraogo B, Ouédraogo-Traoré R, et al. Неблагоприятные события после иммунизации во время кампаний массовой вакцинации при первом введении конъюгированной менингококковой вакцины A в Буркина-Фасо, 2010 г.Вакцина. 2012; 30: B46–51. [PubMed] [Google Scholar] 10. Махаджан Д., Роомиани I, Голд М.С., Лоуренс Г.Л., Макинтайр П.Б., Мензис Р.И. Годовой отчет: эпиднадзор за побочными эффектами после иммунизации в Австралии, 2009 г. Commun Dis Intell Q Rep. 2010; 34: 259–76. [PubMed] [Google Scholar] 11. Всемирная организация здравоохранения, Департамент вакцин и биологии. Дополнительная информация о безопасности вакцины; Часть 2: Базовая частота нежелательных явлений после иммунизации [документ в Интернете]. ВОЗ / V & B / 00.36. Женева: ISO; Декабрь 2000 г. [цитируется 24 июня 2013 г.]. Доступно по адресу: http://whqlibdoc.who.int/hq/2000/WHO_V&B_00.36.pdf. [Google Scholar]
Неблагоприятные события после иммунизации оральным полиовирусом в Киншасе, Демократическая Республика Конго: предварительные результаты
Pathog Glob Health. 2013 Октябрь; 107 (7): 381–384.
Дидье Нзоло
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Мишель Нтетани Алони
2 Университетская больница Киншасы, Медицинский факультет, Университет Киншасы
, Демократическая Республика
Thérèse Mpiempie Ngamasata
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Bibiche Mvete Luemba
1 Национальный центр конгамы по фармаконадзору
, Санитарный надзор,
, Санитарный центр Демократической Республики Киншаса, Университет Киншасы
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Матильда Ботале Экила
3 Отделение инфекций, Отделение внутренней медицины, Университетская больница Киншасы, Медицинский факультет Университета Киншасы, Демократическая Республика lic of Congo
Célestin Ndosimao Nsibu
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Narcisse Lutete Tona
1 Национальный центр фармаконадзора, Университет Демократической Республики Конго,
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
2 Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Демократическая Республика Конго
3 Отделение инфекций, Департамент Внутренняя медицина, Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Демократическая Республика Конго
Для корреспонденции: М.Н. Алони, отделение гематоонкологии и педиатрии нефрологии, Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Киншаса, Демократическая Республика Конго. Электронная почта: rf.oohay@3002inolalehcimЭту статью цитируют другие статьи в PMC.
Abstract
Цель
Мы исследовали природу и частоту нежелательных явлений после иммунизации (ПППИ), связанных с пероральными полиовакцинами (ОПВ), среди населения в целом в Киншасе, Демократическая Республика Конго (ДР Конго).
Методы
Национальный центр фармаконадзора ДР Конго организовал активное наблюдение за ПППИ во время кампаний массовой иммунизации населения в целом с марта по июнь 2011 года. Отчет о безопасности индивидуального случая пациента был использован в качестве вопросника и адресован ученикам и студентам средних школ и университеты, у которых были какие-либо нежелательные явления после приема ОПВ. Мы использовали предпочтительный термин из терминологии ВОЗ по побочным реакциям для обозначения AEFI. Здесь представлены результаты второго этапа кампании массовой иммунизации.
Результаты
Всего 767 пациентов сообщили о ПППИ на втором этапе. Распределение по полу показывает, что 512 (66,8%) студентов были женщинами, а 255 (33,2%) — мужчинами, что дает соотношение девочек и мужчин 2: 1. Средний возраст составил 16,8 ± 5,19 года (от 6 до 35,5 лет). Каждый человек сообщил о среднем значении 1,33 ± 0,6 AEFI. Средняя продолжительность начала ПППИ составила 1,74 ± 1,16 дня после вакцинации, от 1 до 9 дней. Головная боль (22,4%), боль в животе (17,2%), лихорадка (11,7%), диарея (9,9%) и астения (7,1%).5%) были общими симптомами. Паралич и астматические реакции были редкими и серьезными побочными эффектами в этом исследовании. Больше всего пострадали желудочно-кишечный тракт (33,5%) и нервная система (29,3%). Повторный вызов был положительным у 173 человек (22,6%).
Заключение
ПППИ, связанные с ОПВ, не редкость, хотя о них не сообщается. Активный надзор за ПППИ во время кампаний массовой иммунизации очень важен и может помочь выявить редкие и серьезные побочные эффекты. Дальнейшие исследования будут важны для выявления риска ПППИ с ОПВ у взрослых и необходимы для выяснения причины этой связи в конголезской среде.
Ключевые слова: Неблагоприятные события после иммунизации, Оральный полиовирус, Студенты, Киншаса, Демократическая Республика Конго
Введение
В 1988 году Всемирная ассамблея здравоохранения приняла решение искоренить полиомиелит во всем мире. Глобальная кампания по искоренению полиомиелита позволила снизить более чем на 90% количество случаев полиомиелита во всем мире за последние 11 лет с момента ее запуска. 1 Живая аттенуированная пероральная вакцина против полиомиелита (ОПВ) имеет много преимуществ по сравнению с инактивированной вакциной против полиомиелита (ИПВ) для ликвидации полиовируса в кампании массовой иммунизации.Он наделяет кишечным иммунитетом, делая недавних реципиентов ОПВ устойчивыми к инфекции дикими полиовирусами; обеспечивает длительную защиту от паралитических заболеваний за счет стойкого гуморального иммунитета; его пероральное применение исключает проблемы безопасности инъекции и программные ошибки, связанные с инъекцией; иммунизация ОПВ обходится дешевле, чем ИПВ, и должна быть выбором для кампании массовой вакцинации в развивающихся странах. Из-за риска вакцинно-ассоциированного паралитического полиомиелита в некоторых странах ОПВ была заменена ИПВ. 2
Системы эпиднадзора за ПППИ являются важными инструментами для мониторинга связи между вакцинацией и предполагаемыми побочными эффектами. В европейских странах было рекомендовано ввести отчетность и надзор за побочными эффектами после иммунизации (ПППИ) в каждой стране как часть системы мониторинга. 3 В Африке ПППИ менее документированы, особенно те, которые связаны с ОПВ. 4 , 5 Кроме того, ОПВ чаще всего вводят младенцам, что делает описание ПППИ менее точным, а во время плановой иммунизации вакцину против полиомиелита вводят вместе с другими вакцинами, что затрудняет оценку причинно-следственной связи.
В Демократической Республике Конго (ДР Конго) ОПВ вводится четыре раза во время плановой иммунизации младенцев при рождении, на шестой, десятой и четырнадцатой неделях. Ежегодно проводятся Национальные дни иммунизации, когда кампания иммунизации проводится по всей стране. Если в некоторых районах появляются новые случаи паралича, связанного с диким полиовирусом, может быть проведена ограниченная кампания иммунизации в соответствующем районе, а затем могут быть проведены дополнительные мероприятия по иммунизации.
В 2010 и 2011 годах, после вспышки мутантного вируса полиомиелита в Центральноафриканском регионе, некоторые случаи были зарегистрированы даже среди взрослых. 6 Министерство здравоохранения ДР Конго начало кампанию массовой иммунизации населения. Большинство людей, включая взрослых, получали ОПВ четыре раза за 4 месяца. На первом и втором этапах вводили моновалентную ОПВ типа 1. На третьем этапе вводили бивалентную ОПВ 1 и 3 типов. «Национальный центр фармаконадзора (CNPV)» ДР Конго, расположенный в Университете Киншасы, разработал активный эпиднадзор за ПППИ во время этих кампаний массовой иммунизации, чтобы получить дополнительную информацию об ОПВ-ассоциированных ПППИ.
Наша конечная цель — создать основу для разработки и реализации эффективных профилактических вмешательств. Наше исследование было разработано для информирования клинической практики, образования, рекомендаций по консультированию и всех заинтересованных сторон, участвующих в системе иммунизации. Целью данной работы является оценка характера и частоты ПППИ, связанных с ОПВ, среди населения Киншасы в целом.
Пациенты и методы
Это перекрестное исследование, проведенное среди учащихся и студентов университетов в период с марта 2011 г. по июнь 2011 г. в Киншасе, Демократическая Республика Конго.23–27 марта моновалентная ОПВ типа 1 (мОПВ1) была введена 9 863 458 пациентам. С 28 апреля по 2 мая мОПВ1 получили 10 091 567 человек. 26–30 мая бивалентная ОПВ типа 1 и 3 (биОПВ) была введена 9 724 982 пациентам, а 10 206 785 получили мОПВ1 25–29 июня.
Анкета, разработанная CNPV, была адресована в основном тем, у кого были какие-либо ПППИ после иммунизации ОПВ. Анкета была предоставлена как отчет о безопасности отдельного случая пациента (ICSR пациента) и включала необходимую информацию для отчетности по ПППИ в последовательных массовых кампаниях.Обязательной информацией, включенной в анкету, были: исходная информация пациента, возраст, пол, история лекарственной терапии в течение последней недели перед иммунизацией и информация о нежелательном явлении, включая описание пациента, дату начала, дату окончания и историю реакции на предыдущую иммунизацию. Перед заполнением анкеты объяснили пользу вакцинации, а также возможность возникновения нежелательных явлений. Все анкеты были собраны и обработаны CNPV.
Это исследование является результатом активного надзора за ПППИ Национальным центром фармаконадзора Университета Киншасы в соответствии с рекомендациями Всемирной организации здравоохранения для кампании массовой иммунизации, а также для плановой иммунизации.
Каждый месяц сбор данных начинался на четвертый день иммунизации, который обычно был датой окончания, и длился 10 дней после окончания кампании иммунизации. Сбор данных был завершен только по первым трем этапам этой четырехэтапной кампании массовой иммунизации. Более 1500 человек сообщили о возникновении ПППИ на первых трех этапах. В этом предварительном исследовании мы сосредоточились только на результатах второго этапа, которые позволяют нам оценить частоту повторного заражения, связанного с ПППИ, ассоциированными с моновалентной ОПВ 1 типа.
Перед обращением к студентам было получено письменное согласие от властей вуза. Отчет студентов об AEFI был бесплатным.
Для анализа мы использовали предпочтительный термин из терминологии ВОЗ по побочным реакциям. Данные представлены в виде средних значений ± стандартное отклонение, когда распределение было нормальным, и медианы с диапазоном, когда распределение не было нормальным. Частота появления различных симптомов и признаков выражается в пропорциях (%).
Результаты
CNPV получил и проанализировал отчеты AEFI от 767 человек во время второго этапа.Все пациенты, заполнившие анкету, были здоровы во время иммунизации. Распределение по полу показывает, что 512 (66,8%) были женщинами, а 255 (33,2%) были мужчинами, что дает соотношение женщины: мужчины 2: 1. Средний возраст составил 16,8 ± 5,19 года.
Каждый человек сообщил о среднем значении 1,33 ± 0,6 AEFI. Всего было зарегистрировано 1020 AEFI. Головная боль, боль в животе, лихорадка, диарея и астения были частыми симптомами при обращении с частотой 22,4%, 17,2%, 11,7%, 9,9% и 7,5% соответственно ().После иммунизации было пять случаев мышечной слабости и два случая паралича. Один из них выздоровел до 1 месяца, второй все еще был парализован через 1 месяц. Сообщалось об одном случае астматической реакции с положительным повторным заражением. Средняя продолжительность начала ПППИ составила 1,74 ± 1,16 дня после вакцинации, варьировалась от 1 до 9 дней. Повторный вызов был положительным у 173 человек (22,6%). Наиболее сильно пострадали желудочно-кишечный тракт (33,5%), центральная и периферическая нервная система (29.3%) и тело в целом (21,8%). В этой серии 4,2% людей сообщили о нарушениях опорно-двигательного аппарата и 3,2% о заболеваниях кожи и придатков, включая крапивницу, сыпь и зуд.
Таблица 1
AEFI после OPV в популяции нашего исследования
| AEFI | Число случаев | Частота (%) | ||||||
| Головная боль | 228 90,4 боль | 175 | 17.2 | |||||
| Лихорадка | 119 | 11,7 | ||||||
| Диарея | 101 | 9,9 | ||||||
| Астения и / или недомогание | 14 79 | 14 79 | ||||||
| Тошнота и / или рвота | 47 | 4,6 | ||||||
| Скелетно-мышечная боль | 23 | 2,3 | ||||||
| Кашель | 21 | 2.1 | ||||||
| Ринит | 21 | 2,1 | ||||||
| Конъюнктивит | 18 | 1,8 | ||||||
| Фарингит | 17 | 4 | 1,7 | 17 | 4 | 15 | 1,5 | |
| Боль в спине | 9 | 0,9 | ||||||
| Зуд | 7 | 0,7 | ||||||
| Крапивница | 7 01427 | |||||||
| Слабость мышц | 5 | 0,5 | ||||||
| Одышка | 2 | 0,2 | ||||||
| Паралич | 2 | 4 | 901 | 2 | Всего | 1020 | 100 |
Обсуждение
Насколько нам известно, настоящее исследование является первой попыткой описать ПППИ в нашей популяции. Это первая оценка клинических событий после кампании иммунизации ОПВ в регионе Центральной Африки.Это исследование является результатом активного эпиднадзора за ПППИ во время кампании массовой иммунизации, охватывающей население разного возраста, и показало, что вспышка полиомиелита встречается даже у взрослых. Однако этот исследуемый образец был подмножеством населения Киншасы
Головная боль, боль в животе, лихорадка, диарея и астения были частыми симптомами при обращении с частотой 22,4%, 17,2%, 11,7%, 9,9% и 7,5%. %, соответственно. Было пять случаев мышечной слабости и два подозрения на вакцино-ассоциированный полиомиелит.Сообщалось о двух случаях паралича после иммунизации. Сообщалось об одном случае астматической реакции с положительным повторным заражением.
Мы зафиксировали головную боль как наиболее частый симптом (22,4%). Подобные наблюдения были описаны и с другими вакцинами. 7 — 10 Было обнаружено, что другие признаки и симптомы, описанные в этом исследовании, аналогичны тем, которые описаны в других источниках для других вакцин. 8 — 10
Ни одного случая ПППИ, связанного с ОПВ, у взрослого и педиатрического населения не было обнаружено при использовании доступных компьютерных программ поиска медицинской литературы.Однако, согласно документу ВОЗ, озаглавленному «Дополнительная информация о безопасности вакцины, фоновой частоте нежелательных явлений после иммунизации», 11 распространенными незначительными реакциями на вакцину, связанными с ОПВ, являются лихорадка, раздражительность, недомогание и неспецифические симптомы, такие как диарея. , головная боль и / или мышечная боль. Этот результат похож на наш. Согласно этому документу, эти общие реакции возникают в течение одного или двух дней после иммунизации. Это близко к нашему исследованию, где средняя продолжительность начала ПППИ составила 1.74 ± 1,16 сут. В том же документе описан паралитический полиомиелит, связанный с вакцинацией, как основная редкая и серьезная вакцинационная реакция, связанная с ОПВ, с оценочным риском 1 на 1,4–3,4 миллиона для первой дозы. Два случая паралича, о которых мы сообщали, произошли после введения первой дозы, и около 10 миллионов человек получили эту дозу; К сожалению, не было проведено никаких дальнейших исследований, чтобы подтвердить, был ли это паралитический полиомиелит, связанный с вакцинацией.
Заключение
ПППИ, связанные с ОПВ, не редкость среди взрослых конголезцев, хотя о них недостаточно.Активное наблюдение после кампании массовой иммунизации позволило выявить некоторые редкие ПППИ, связанные с ОПВ, например, возможный вакцино-ассоциированный полиомиелит.
Принимая во внимание важность иммунизации для индивидуального и коллективного иммунитета, требуется хорошее сотрудничество всех заинтересованных сторон, участвующих в каждом отдельном случае неблагоприятного события. Дальнейшие исследования будут важны для определения риска ПППИ, связанного с ОПВ, у взрослых и необходимы для выяснения причины этой связи в конголезской среде.Это первый шаг в индивидуальном ведении данного клинического объекта.
Пределы исследования
Мы объявили пациентов нашего исследования здоровыми до иммунизации на основании их заявления об отсутствии в анамнезе лекарственной терапии. Никаких дополнительных исследований для подтверждения того, были ли они действительно здоровыми до иммунизации, не проводилось. В это перекрестное исследование не были включены контрольные группы (например, взрослые, не получающие ОПВ) из-за массового характера кампании вакцинации среди всего населения Киншасы в течение периода исследования; поэтому интерпретировать эту информацию сложно.В проспективном исследовании необходимы более точные данные для оценки частоты ПППИ, вызванной ОПВ, и для сравнения с контрольной группой. Будущие проспективные исследования должны ответить на следующие вопросы:
Отличались ли ПППИ у взрослых, получавших ОПВ, от детей?
Есть ли разница между ПППИ после мОПВ и биОПВ?
Можно ли назвать ОПВ безопасной вакциной для взрослых на основе результатов текущих и будущих проспективных исследований?
Ссылки
1.Обновленная информация Центров по контролю и профилактике заболеваний (CDC) по полиовирусам вакцинного происхождения — во всем мире, апрель 2011 г. — июнь 2012 г. MMWR Morb Mortal Wkly Rep. 2012; 61: 741–6. [PubMed] [Google Scholar] 2. Центры по контролю и профилактике заболеваний (CDC). Обновленная информация о полиовирусах вакцинного происхождения — во всем мире, июль 2009 г. — март 2011 г. MMWR Morb Mortal Wkly Rep. 20116025846–50. [PubMed] [Google Scholar] 3. Schumacher Z, Bourquin C, Heininger U. Эпиднадзор за побочными эффектами после иммунизации (AEFI) в Швейцарии — 1991–2001 гг.Вакцина. 2010. 28: 4059–64. [PubMed] [Google Scholar] 4. Уандаого CR, Yaméogo TM, Diomandé FV, Sawadogo C, Ouédraogo B, Ouédraogo-Traoré R, et al. Неблагоприятные события после иммунизации во время кампаний массовой вакцинации при первом введении конъюгированной менингококковой вакцины A в Буркина-Фасо, 2010 г. Вакцина. 2012; 30: B46–51. [PubMed] [Google Scholar] 5. Лунд Н., Андерсен А., Монтейро И., Оби П., Бенн К. С.. Не оказывает влияния пероральная вакцина против полиомиелита, вводимая при рождении, на смертность и иммунный ответ на БЦЖ. Естественный эксперимент.Вакцина. 2012; 30: 6694–9. [PubMed] [Google Scholar] 6. Ле Менах А., Льоса А.Е., Муниаман-Нара И., Куасси Ф., Нгала Дж., Боксалл Н. и др. Вспышка полиомиелита, Пуэнт-Нуар, Республика Конго, сентябрь 2010 г. — февраль 2011 г. Emerg Infect Dis. 2011; 17: 1506–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Вальдман Э.А., Лум К.Р., Монтейро С.А., де Фрейтас ФР. Наблюдение за побочными эффектами после вакцинации и безопасность программ иммунизации. Rev Saude Publica. 2011; 45: 173–84. [PubMed] [Google Scholar] 8.Ankrah DN, Mantel-Teeuwisse AK, De Bruin ML, Amoo PK, Ofei-Palm CN, Agyepong I и др. Частота нежелательных явлений среди медицинских работников после массовой иммунизации против h2N1 в Гане: проспективное исследование. Drug Saf. 2013; 36: 259–66. [PubMed] [Google Scholar] 9. Уандаого CR, Yaméogo TM, Diomandé FV, Sawadogo C, Ouédraogo B, Ouédraogo-Traoré R, et al. Неблагоприятные события после иммунизации во время кампаний массовой вакцинации при первом введении конъюгированной менингококковой вакцины A в Буркина-Фасо, 2010 г.Вакцина. 2012; 30: B46–51. [PubMed] [Google Scholar] 10. Махаджан Д., Роомиани I, Голд М.С., Лоуренс Г.Л., Макинтайр П.Б., Мензис Р.И. Годовой отчет: эпиднадзор за побочными эффектами после иммунизации в Австралии, 2009 г. Commun Dis Intell Q Rep. 2010; 34: 259–76. [PubMed] [Google Scholar] 11. Всемирная организация здравоохранения, Департамент вакцин и биологии. Дополнительная информация о безопасности вакцины; Часть 2: Базовая частота нежелательных явлений после иммунизации [документ в Интернете]. ВОЗ / V & B / 00.36. Женева: ISO; Декабрь 2000 г. [цитируется 24 июня 2013 г.]. Доступно по адресу: http://whqlibdoc.who.int/hq/2000/WHO_V&B_00.36.pdf. [Google Scholar]
Неблагоприятные события после иммунизации оральным полиовирусом в Киншасе, Демократическая Республика Конго: предварительные результаты
Pathog Glob Health. 2013 Октябрь; 107 (7): 381–384.
Дидье Нзоло
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Мишель Нтетани Алони
2 Университетская больница Киншасы, Медицинский факультет, Университет Киншасы
, Демократическая Республика
Thérèse Mpiempie Ngamasata
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Bibiche Mvete Luemba
1 Национальный центр конгамы по фармаконадзору
, Санитарный надзор,
, Санитарный центр Демократической Республики Киншаса, Университет Киншасы
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Матильда Ботале Экила
3 Отделение инфекций, Отделение внутренней медицины, Университетская больница Киншасы, Медицинский факультет Университета Киншасы, Демократическая Республика lic of Congo
Célestin Ndosimao Nsibu
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
Narcisse Lutete Tona
1 Национальный центр фармаконадзора, Университет Демократической Республики Конго,
1 Национальный центр фармаконадзора, Университет Киншасы, Демократическая Республика Конго
2 Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Демократическая Республика Конго
3 Отделение инфекций, Департамент Внутренняя медицина, Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Демократическая Республика Конго
Для корреспонденции: М.Н. Алони, отделение гематоонкологии и педиатрии нефрологии, Университетская больница Киншасы, Медицинский факультет, Университет Киншасы, Киншаса, Демократическая Республика Конго. Электронная почта: rf.oohay@3002inolalehcimЭту статью цитируют другие статьи в PMC.
Abstract
Цель
Мы исследовали природу и частоту нежелательных явлений после иммунизации (ПППИ), связанных с пероральными полиовакцинами (ОПВ), среди населения в целом в Киншасе, Демократическая Республика Конго (ДР Конго).
Методы
Национальный центр фармаконадзора ДР Конго организовал активное наблюдение за ПППИ во время кампаний массовой иммунизации населения в целом с марта по июнь 2011 года. Отчет о безопасности индивидуального случая пациента был использован в качестве вопросника и адресован ученикам и студентам средних школ и университеты, у которых были какие-либо нежелательные явления после приема ОПВ. Мы использовали предпочтительный термин из терминологии ВОЗ по побочным реакциям для обозначения AEFI. Здесь представлены результаты второго этапа кампании массовой иммунизации.
Результаты
Всего 767 пациентов сообщили о ПППИ на втором этапе. Распределение по полу показывает, что 512 (66,8%) студентов были женщинами, а 255 (33,2%) — мужчинами, что дает соотношение девочек и мужчин 2: 1. Средний возраст составил 16,8 ± 5,19 года (от 6 до 35,5 лет). Каждый человек сообщил о среднем значении 1,33 ± 0,6 AEFI. Средняя продолжительность начала ПППИ составила 1,74 ± 1,16 дня после вакцинации, от 1 до 9 дней. Головная боль (22,4%), боль в животе (17,2%), лихорадка (11,7%), диарея (9,9%) и астения (7,1%).5%) были общими симптомами. Паралич и астматические реакции были редкими и серьезными побочными эффектами в этом исследовании. Больше всего пострадали желудочно-кишечный тракт (33,5%) и нервная система (29,3%). Повторный вызов был положительным у 173 человек (22,6%).
Заключение
ПППИ, связанные с ОПВ, не редкость, хотя о них не сообщается. Активный надзор за ПППИ во время кампаний массовой иммунизации очень важен и может помочь выявить редкие и серьезные побочные эффекты. Дальнейшие исследования будут важны для выявления риска ПППИ с ОПВ у взрослых и необходимы для выяснения причины этой связи в конголезской среде.
Ключевые слова: Неблагоприятные события после иммунизации, Оральный полиовирус, Студенты, Киншаса, Демократическая Республика Конго
Введение
В 1988 году Всемирная ассамблея здравоохранения приняла решение искоренить полиомиелит во всем мире. Глобальная кампания по искоренению полиомиелита позволила снизить более чем на 90% количество случаев полиомиелита во всем мире за последние 11 лет с момента ее запуска. 1 Живая аттенуированная пероральная вакцина против полиомиелита (ОПВ) имеет много преимуществ по сравнению с инактивированной вакциной против полиомиелита (ИПВ) для ликвидации полиовируса в кампании массовой иммунизации.Он наделяет кишечным иммунитетом, делая недавних реципиентов ОПВ устойчивыми к инфекции дикими полиовирусами; обеспечивает длительную защиту от паралитических заболеваний за счет стойкого гуморального иммунитета; его пероральное применение исключает проблемы безопасности инъекции и программные ошибки, связанные с инъекцией; иммунизация ОПВ обходится дешевле, чем ИПВ, и должна быть выбором для кампании массовой вакцинации в развивающихся странах. Из-за риска вакцинно-ассоциированного паралитического полиомиелита в некоторых странах ОПВ была заменена ИПВ. 2
Системы эпиднадзора за ПППИ являются важными инструментами для мониторинга связи между вакцинацией и предполагаемыми побочными эффектами. В европейских странах было рекомендовано ввести отчетность и надзор за побочными эффектами после иммунизации (ПППИ) в каждой стране как часть системы мониторинга. 3 В Африке ПППИ менее документированы, особенно те, которые связаны с ОПВ. 4 , 5 Кроме того, ОПВ чаще всего вводят младенцам, что делает описание ПППИ менее точным, а во время плановой иммунизации вакцину против полиомиелита вводят вместе с другими вакцинами, что затрудняет оценку причинно-следственной связи.
В Демократической Республике Конго (ДР Конго) ОПВ вводится четыре раза во время плановой иммунизации младенцев при рождении, на шестой, десятой и четырнадцатой неделях. Ежегодно проводятся Национальные дни иммунизации, когда кампания иммунизации проводится по всей стране. Если в некоторых районах появляются новые случаи паралича, связанного с диким полиовирусом, может быть проведена ограниченная кампания иммунизации в соответствующем районе, а затем могут быть проведены дополнительные мероприятия по иммунизации.
В 2010 и 2011 годах, после вспышки мутантного вируса полиомиелита в Центральноафриканском регионе, некоторые случаи были зарегистрированы даже среди взрослых. 6 Министерство здравоохранения ДР Конго начало кампанию массовой иммунизации населения. Большинство людей, включая взрослых, получали ОПВ четыре раза за 4 месяца. На первом и втором этапах вводили моновалентную ОПВ типа 1. На третьем этапе вводили бивалентную ОПВ 1 и 3 типов. «Национальный центр фармаконадзора (CNPV)» ДР Конго, расположенный в Университете Киншасы, разработал активный эпиднадзор за ПППИ во время этих кампаний массовой иммунизации, чтобы получить дополнительную информацию об ОПВ-ассоциированных ПППИ.
Наша конечная цель — создать основу для разработки и реализации эффективных профилактических вмешательств. Наше исследование было разработано для информирования клинической практики, образования, рекомендаций по консультированию и всех заинтересованных сторон, участвующих в системе иммунизации. Целью данной работы является оценка характера и частоты ПППИ, связанных с ОПВ, среди населения Киншасы в целом.
Пациенты и методы
Это перекрестное исследование, проведенное среди учащихся и студентов университетов в период с марта 2011 г. по июнь 2011 г. в Киншасе, Демократическая Республика Конго.23–27 марта моновалентная ОПВ типа 1 (мОПВ1) была введена 9 863 458 пациентам. С 28 апреля по 2 мая мОПВ1 получили 10 091 567 человек. 26–30 мая бивалентная ОПВ типа 1 и 3 (биОПВ) была введена 9 724 982 пациентам, а 10 206 785 получили мОПВ1 25–29 июня.
Анкета, разработанная CNPV, была адресована в основном тем, у кого были какие-либо ПППИ после иммунизации ОПВ. Анкета была предоставлена как отчет о безопасности отдельного случая пациента (ICSR пациента) и включала необходимую информацию для отчетности по ПППИ в последовательных массовых кампаниях.Обязательной информацией, включенной в анкету, были: исходная информация пациента, возраст, пол, история лекарственной терапии в течение последней недели перед иммунизацией и информация о нежелательном явлении, включая описание пациента, дату начала, дату окончания и историю реакции на предыдущую иммунизацию. Перед заполнением анкеты объяснили пользу вакцинации, а также возможность возникновения нежелательных явлений. Все анкеты были собраны и обработаны CNPV.
Это исследование является результатом активного надзора за ПППИ Национальным центром фармаконадзора Университета Киншасы в соответствии с рекомендациями Всемирной организации здравоохранения для кампании массовой иммунизации, а также для плановой иммунизации.
Каждый месяц сбор данных начинался на четвертый день иммунизации, который обычно был датой окончания, и длился 10 дней после окончания кампании иммунизации. Сбор данных был завершен только по первым трем этапам этой четырехэтапной кампании массовой иммунизации. Более 1500 человек сообщили о возникновении ПППИ на первых трех этапах. В этом предварительном исследовании мы сосредоточились только на результатах второго этапа, которые позволяют нам оценить частоту повторного заражения, связанного с ПППИ, ассоциированными с моновалентной ОПВ 1 типа.
Перед обращением к студентам было получено письменное согласие от властей вуза. Отчет студентов об AEFI был бесплатным.
Для анализа мы использовали предпочтительный термин из терминологии ВОЗ по побочным реакциям. Данные представлены в виде средних значений ± стандартное отклонение, когда распределение было нормальным, и медианы с диапазоном, когда распределение не было нормальным. Частота появления различных симптомов и признаков выражается в пропорциях (%).
Результаты
CNPV получил и проанализировал отчеты AEFI от 767 человек во время второго этапа.Все пациенты, заполнившие анкету, были здоровы во время иммунизации. Распределение по полу показывает, что 512 (66,8%) были женщинами, а 255 (33,2%) были мужчинами, что дает соотношение женщины: мужчины 2: 1. Средний возраст составил 16,8 ± 5,19 года.
Каждый человек сообщил о среднем значении 1,33 ± 0,6 AEFI. Всего было зарегистрировано 1020 AEFI. Головная боль, боль в животе, лихорадка, диарея и астения были частыми симптомами при обращении с частотой 22,4%, 17,2%, 11,7%, 9,9% и 7,5% соответственно ().После иммунизации было пять случаев мышечной слабости и два случая паралича. Один из них выздоровел до 1 месяца, второй все еще был парализован через 1 месяц. Сообщалось об одном случае астматической реакции с положительным повторным заражением. Средняя продолжительность начала ПППИ составила 1,74 ± 1,16 дня после вакцинации, варьировалась от 1 до 9 дней. Повторный вызов был положительным у 173 человек (22,6%). Наиболее сильно пострадали желудочно-кишечный тракт (33,5%), центральная и периферическая нервная система (29.3%) и тело в целом (21,8%). В этой серии 4,2% людей сообщили о нарушениях опорно-двигательного аппарата и 3,2% о заболеваниях кожи и придатков, включая крапивницу, сыпь и зуд.
Таблица 1
AEFI после OPV в популяции нашего исследования
| AEFI | Число случаев | Частота (%) | ||||||
| Головная боль | 228 90,4 боль | 175 | 17.2 | |||||
| Лихорадка | 119 | 11,7 | ||||||
| Диарея | 101 | 9,9 | ||||||
| Астения и / или недомогание | 14 79 | 14 79 | ||||||
| Тошнота и / или рвота | 47 | 4,6 | ||||||
| Скелетно-мышечная боль | 23 | 2,3 | ||||||
| Кашель | 21 | 2.1 | ||||||
| Ринит | 21 | 2,1 | ||||||
| Конъюнктивит | 18 | 1,8 | ||||||
| Фарингит | 17 | 4 | 1,7 | 17 | 4 | 15 | 1,5 | |
| Боль в спине | 9 | 0,9 | ||||||
| Зуд | 7 | 0,7 | ||||||
| Крапивница | 7 01427 | |||||||
| Слабость мышц | 5 | 0,5 | ||||||
| Одышка | 2 | 0,2 | ||||||
| Паралич | 2 | 4 | 901 | 2 | Всего | 1020 | 100 |
Обсуждение
Насколько нам известно, настоящее исследование является первой попыткой описать ПППИ в нашей популяции. Это первая оценка клинических событий после кампании иммунизации ОПВ в регионе Центральной Африки.Это исследование является результатом активного эпиднадзора за ПППИ во время кампании массовой иммунизации, охватывающей население разного возраста, и показало, что вспышка полиомиелита встречается даже у взрослых. Однако этот исследуемый образец был подмножеством населения Киншасы
Головная боль, боль в животе, лихорадка, диарея и астения были частыми симптомами при обращении с частотой 22,4%, 17,2%, 11,7%, 9,9% и 7,5%. %, соответственно. Было пять случаев мышечной слабости и два подозрения на вакцино-ассоциированный полиомиелит.Сообщалось о двух случаях паралича после иммунизации. Сообщалось об одном случае астматической реакции с положительным повторным заражением.
Мы зафиксировали головную боль как наиболее частый симптом (22,4%). Подобные наблюдения были описаны и с другими вакцинами. 7 — 10 Было обнаружено, что другие признаки и симптомы, описанные в этом исследовании, аналогичны тем, которые описаны в других источниках для других вакцин. 8 — 10
Ни одного случая ПППИ, связанного с ОПВ, у взрослого и педиатрического населения не было обнаружено при использовании доступных компьютерных программ поиска медицинской литературы.Однако, согласно документу ВОЗ, озаглавленному «Дополнительная информация о безопасности вакцины, фоновой частоте нежелательных явлений после иммунизации», 11 распространенными незначительными реакциями на вакцину, связанными с ОПВ, являются лихорадка, раздражительность, недомогание и неспецифические симптомы, такие как диарея. , головная боль и / или мышечная боль. Этот результат похож на наш. Согласно этому документу, эти общие реакции возникают в течение одного или двух дней после иммунизации. Это близко к нашему исследованию, где средняя продолжительность начала ПППИ составила 1.74 ± 1,16 сут. В том же документе описан паралитический полиомиелит, связанный с вакцинацией, как основная редкая и серьезная вакцинационная реакция, связанная с ОПВ, с оценочным риском 1 на 1,4–3,4 миллиона для первой дозы. Два случая паралича, о которых мы сообщали, произошли после введения первой дозы, и около 10 миллионов человек получили эту дозу; К сожалению, не было проведено никаких дальнейших исследований, чтобы подтвердить, был ли это паралитический полиомиелит, связанный с вакцинацией.
Заключение
ПППИ, связанные с ОПВ, не редкость среди взрослых конголезцев, хотя о них недостаточно.Активное наблюдение после кампании массовой иммунизации позволило выявить некоторые редкие ПППИ, связанные с ОПВ, например, возможный вакцино-ассоциированный полиомиелит.
Принимая во внимание важность иммунизации для индивидуального и коллективного иммунитета, требуется хорошее сотрудничество всех заинтересованных сторон, участвующих в каждом отдельном случае неблагоприятного события. Дальнейшие исследования будут важны для определения риска ПППИ, связанного с ОПВ, у взрослых и необходимы для выяснения причины этой связи в конголезской среде.Это первый шаг в индивидуальном ведении данного клинического объекта.
Пределы исследования
Мы объявили пациентов нашего исследования здоровыми до иммунизации на основании их заявления об отсутствии в анамнезе лекарственной терапии. Никаких дополнительных исследований для подтверждения того, были ли они действительно здоровыми до иммунизации, не проводилось. В это перекрестное исследование не были включены контрольные группы (например, взрослые, не получающие ОПВ) из-за массового характера кампании вакцинации среди всего населения Киншасы в течение периода исследования; поэтому интерпретировать эту информацию сложно.В проспективном исследовании необходимы более точные данные для оценки частоты ПППИ, вызванной ОПВ, и для сравнения с контрольной группой. Будущие проспективные исследования должны ответить на следующие вопросы:
Отличались ли ПППИ у взрослых, получавших ОПВ, от детей?
Есть ли разница между ПППИ после мОПВ и биОПВ?
Можно ли назвать ОПВ безопасной вакциной для взрослых на основе результатов текущих и будущих проспективных исследований?
Ссылки
1.Обновленная информация Центров по контролю и профилактике заболеваний (CDC) по полиовирусам вакцинного происхождения — во всем мире, апрель 2011 г. — июнь 2012 г. MMWR Morb Mortal Wkly Rep. 2012; 61: 741–6. [PubMed] [Google Scholar] 2. Центры по контролю и профилактике заболеваний (CDC). Обновленная информация о полиовирусах вакцинного происхождения — во всем мире, июль 2009 г. — март 2011 г. MMWR Morb Mortal Wkly Rep. 20116025846–50. [PubMed] [Google Scholar] 3. Schumacher Z, Bourquin C, Heininger U. Эпиднадзор за побочными эффектами после иммунизации (AEFI) в Швейцарии — 1991–2001 гг.Вакцина. 2010. 28: 4059–64. [PubMed] [Google Scholar] 4. Уандаого CR, Yaméogo TM, Diomandé FV, Sawadogo C, Ouédraogo B, Ouédraogo-Traoré R, et al. Неблагоприятные события после иммунизации во время кампаний массовой вакцинации при первом введении конъюгированной менингококковой вакцины A в Буркина-Фасо, 2010 г. Вакцина. 2012; 30: B46–51. [PubMed] [Google Scholar] 5. Лунд Н., Андерсен А., Монтейро И., Оби П., Бенн К. С.. Не оказывает влияния пероральная вакцина против полиомиелита, вводимая при рождении, на смертность и иммунный ответ на БЦЖ. Естественный эксперимент.Вакцина. 2012; 30: 6694–9. [PubMed] [Google Scholar] 6. Ле Менах А., Льоса А.Е., Муниаман-Нара И., Куасси Ф., Нгала Дж., Боксалл Н. и др. Вспышка полиомиелита, Пуэнт-Нуар, Республика Конго, сентябрь 2010 г. — февраль 2011 г. Emerg Infect Dis. 2011; 17: 1506–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Вальдман Э.А., Лум К.Р., Монтейро С.А., де Фрейтас ФР. Наблюдение за побочными эффектами после вакцинации и безопасность программ иммунизации. Rev Saude Publica. 2011; 45: 173–84. [PubMed] [Google Scholar] 8.Ankrah DN, Mantel-Teeuwisse AK, De Bruin ML, Amoo PK, Ofei-Palm CN, Agyepong I и др. Частота нежелательных явлений среди медицинских работников после массовой иммунизации против h2N1 в Гане: проспективное исследование. Drug Saf. 2013; 36: 259–66. [PubMed] [Google Scholar] 9. Уандаого CR, Yaméogo TM, Diomandé FV, Sawadogo C, Ouédraogo B, Ouédraogo-Traoré R, et al. Неблагоприятные события после иммунизации во время кампаний массовой вакцинации при первом введении конъюгированной менингококковой вакцины A в Буркина-Фасо, 2010 г.Вакцина. 2012; 30: B46–51. [PubMed] [Google Scholar] 10. Махаджан Д., Роомиани I, Голд М.С., Лоуренс Г.Л., Макинтайр П.Б., Мензис Р.И. Годовой отчет: эпиднадзор за побочными эффектами после иммунизации в Австралии, 2009 г. Commun Dis Intell Q Rep. 2010; 34: 259–76. [PubMed] [Google Scholar] 11. Всемирная организация здравоохранения, Департамент вакцин и биологии. Дополнительная информация о безопасности вакцины; Часть 2: Базовая частота нежелательных явлений после иммунизации [документ в Интернете]. ВОЗ / V & B / 00.36. Женева: ISO; Декабрь 2000 г. [цитируется 24 июня 2013 г.]. Доступно по адресу: http://whqlibdoc.who.int/hq/2000/WHO_V&B_00.36.pdf. [Google Scholar]
Вакцина от полиомиелита | Бэбицентр
Каковы преимущества вакцины против полиомиелита?
Вакцина против полиомиелита защищает от полиомиелита (полиомиелита), очень заразного заболевания, вызываемого вирусом, поражающим нервную систему. До того, как вакцина была введена в 1954 году, в Соединенных Штатах ежегодно регистрировалось более 20 000 случаев полиомиелита, и ежегодно умирало около 1000 человек.
До 95 процентов людей, инфицированных вирусом, не имеют никаких симптомов, а у многих из тех, кто действительно болеет, наблюдаются лишь легкие симптомы, такие как боль в горле, лихорадка, боль в желудке или тошнота. Менее распространенные симптомы включают головную боль и ригидность шеи, спины или ног. Менее 1 процента людей, заболевших полиомиелитом, становятся парализованными.
Полиомиелит, вызванный диким вирусом, ликвидирован в Западном полушарии. Ни одного случая заболевания в США с 1979 года или в Северной и Южной Америке с 1994 года не было.
Вспышки полиомиелита до сих пор случаются в Африке и на Ближнем Востоке, поэтому путешественник может легко вернуть полиомиелит в эту страну. В последний раз это произошло в 1993 году. Однако представители здравоохранения считают, что вакцина против полиомиелита может ликвидировать болезнь во всем мире в течение десятилетия.
Вакцина вводится перорально или в виде укола?
Все четыре дозы инактивированной полиовакцины (ИПВ) вводятся путем инъекции. Иногда их вводят вместе с вакцинами DTaP, гепатита B или Hib.
Другой тип вакцины — оральная полиомиелитная вакцина (ОПВ), которая производится из живой ослабленной версии вируса — не использовалась в США с 2000 года. ОПВ считалась несколько более эффективной, чем ИПВ.
К сожалению, у него был очень редкий, но опасный побочный эффект: около одного из 2,4 миллиона человек, получивших ОПВ, заразился полиомиелитом. Решив, что риск введения этой вакцины слишком велик, правительство США исключило ее из графика. Применяемый сегодня ИПВ был усилен для защиты детей от полиомиелита так же эффективно, как и ОПВ, без опасного потенциального побочного эффекта.
Какой рекомендуемый график?
Рекомендуемое количество доз
Четыре дозы
Рекомендуемый возраст
- В 2 месяца
- В 4 месяца
- От 6 до 18 месяцев
- От 4 до 6 лет
Чтобы отслеживать иммунизацию вашего ребенка, используйте Планировщик иммунизации BabyCenter.
Кому нельзя делать вакцину от полиомиелита?
Ребенку, у которого когда-либо была опасная для жизни аллергическая реакция на антибиотики неомицин, стрептомицин или полимиксин B, или у которого была тяжелая реакция на предыдущую дозу вакцины, не следует делать прививку от полиомиелита.
Какие меры предосторожности мне следует предпринять?
Детям со средним или тяжелым заболеванием можно посоветовать подождать, пока они выздоровеют, прежде чем делать прививку от полиомиелита.
Каковы возможные побочные эффекты или риски нежелательной реакции?
Многие дети ощущают небольшую болезненность в месте укола. О серьезных побочных эффектах ИПВ не сообщалось.
Тяжелые аллергические реакции редки, но возможны с любой вакциной. Посмотрите, что говорит наш эксперт о том, как определить, есть ли у вашего ребенка неблагоприятная реакция.
Если у вашего ребенка наблюдается побочная реакция на эту или любую другую вакцину, поговорите с врачом вашего ребенка и сообщите об этом в Систему сообщений о побочных эффектах вакцины.
Узнайте больше о других вакцинах и иммунизациях, рекомендованных для младенцев и детей.
Время глобального перехода от пероральной полиомиелитной вакцины к инактивированной полиомиелитной вакцине | Клинические инфекционные болезни
Редактору — Полиомиелит (часто называемый полиомиелит ) — это острое вирусное инфекционное заболевание, вызываемое полиовирусом.Полиомиелит был одним из самых смертоносных детских болезней 20 века [1].
Две вакцины против полиомиелита широко используются во всем мире. Первый был разработан Йонасом Солком в 1952 году; второй — оральная вакцина, разработанная Альбертом Сабином. Эти две вакцины ликвидировали полиомиелит в большинстве стран и снизили заболеваемость полиомиелитом во всем мире с 350 000 случаев в 1988 г. до всего 1300 случаев в 2007 г. [1, 2].
Вакцина Солка или инактивированная полиовирусная вакцина (ИПВ) основана на трех вирулентных эталонных штаммах — Mahoney, MEF-1 и Saukett.Вакцина Солка обеспечивает иммуноглобулин G-опосредованный иммунитет в кровотоке, который предотвращает прогрессирование инфекции до виремии и защищает нейроны. Вакцина Солка эффективна на 60–70% против полиовируса 1 и на 90% эффективна против полиовируса 2 и 3 [1].
Оральная вакцина против полиомиелита (ОПВ) — это живая аттенуированная вакцина: ее получают путем прохождения полиовируса через нечеловеческие клетки при субфизиологической температуре, что вызывает спонтанные мутации в вирусном геноме. ОПВ превосходит ИПВ по простоте введения, и нет необходимости в стерильных шприцах, как в случае с ИПВ.ОПВ также обеспечивает более длительный иммунитет, чем вакцина Солка. Однако OPV предъявляет строгие требования к транспортировке и хранению, и это большая проблема в некоторых жарких или отдаленных районах [2, 3]. В таблице 1 представлены основные различия между ОПВ и ИПВ.
Таблица 1
Сравнение пероральной полиомиелитной вакцины (ОПВ) и инактивированной полиовакцины (ИПВ)
Таблица 1
Сравнение пероральной полиовакцины (ОПВ) и инактивированной полиовакцины (ИПВ)
Основная проблема ОПВ способность вернуться к форме, которая может вызвать паралич.Вспышки вакцино-ассоциированного паралитического полиомиелита (ВАПП) зарегистрированы во многих странах мира [2, 4].
В 2005 г. сообщалось, что дети в небольшой деревне в США заразились полиомиелитом, полученным от вакцины. В Нигерии зарегистрировано> 70 случаев. Согласно отчету Подкомитета по иммунизации Индийской медицинской ассоциации об Инициативе по искоренению полиомиелита в 2006 г. в Индии произошло около 1600 случаев вакцино-индуцированного полиомиелита. Следует отметить, что этих случаев было зарегистрировано во время повторных кампаний массовой иммунизации, в ходе которых вводились повторные дозы ОПВ.В 2008 г. было зарегистрировано множество случаев полиомиелита во всех провинциях Пакистана, где ОПВ используется для повторных кампаний массовой иммунизации. Эти связанные с вакцинами случаи представляют собой серьезную проблему для научного сообщества, если мы хотим достичь цели ликвидации полиомиелита, и необходимы быстрые действия для борьбы с этой проблемой [1–5].
По данным Всемирной организации здравоохранения, плановая иммунизация ОПВ должна быть прекращена после ликвидации полиовируса из-за опасности вспышек циркулирующего полиовируса вакцинного происхождения и риска ВАПП.В регионах мира, в которых был ликвидирован полиовирус дикого типа, переход к последовательному графику ИПВ или ИПВ / ОПВ снизит или устранит риск ВАПП и вспышек циркулирующего полиовируса вакцинного происхождения, а также увеличит вероятность заражения. страны соглашаются прекратить применение ОПВ после достижения искоренения. ИПВ также можно использовать с ОПВ в плановых схемах для усиления иммунного ответа и уменьшения циркуляции полиовируса дикого типа в странах, в которых передача не остановлена.Один только ИПВ оказался очень успешным в уничтожении полиовируса дикого типа во многих европейских странах и использовался исключительно в Соединенных Штатах с января 2000 года.
Приведенные выше наблюдения позволяют предположить, что ОПВ утратила свою эффективность в обеспечении коллективного иммунитета. Похоже, что дети заражаются полиомиелитом от ОПВ, а также кажется, что ОПВ оказалась неэффективной в предотвращении передачи полиомиелита из другого источника. Поэтому, на мой взгляд, весь мир — и особенно развивающиеся страны — должны перейти от ОПВ к ИПВ.По-прежнему существует потребность в активных исследованиях для изучения различных стратегий вакцинации против полиомиелита и борьбы с побочными эффектами, связанными с вакцинацией против полиомиелита; в противном случае мечта об искоренении полиомиелита никогда не осуществится [2–4].
Благодарности
Я благодарен г-же Габриэле Фидер (Венский университет) за ее любезную поддержку.
Возможный конфликт интересов. А.С .: конфликтов нет.
Список литературы
1.
Золотой юбилей вакцинации против полиомиелита
,
Indian J Med Res
,
2004
, vol.
119
(стр.
1
—
17
) 2.
Кампания по ликвидации полиомиелита справилась с необычной вспышкой
,
Nat Med
,
2007
, vol.
13
стр.
1394
3.
Глобальная кампания против полиомиелита обречена на провал, предупреждают эксперты
,
Nat Med
,
2005
, vol.
11
стр.
1260
4.
Проблемы с пероральной вакциной против полиомиелита
,
Nat Med
,
2008
, vol.
14
стр.
9
5.,
Уроки кампании против полиомиелита. Индус, 19 ноября 2006 г.
© 2009 Американского общества инфекционистов
клинических испытаний показали, что вакцина Moderna COVID-19 безопасна; его побочные эффекты в основном легкие
ТРЕБОВАТЬ
«80% людей, принимавших вакцину Moderna, имели серьезные побочные эффекты»; «дети в Судане заразились полиомиелитом от вакцины против полиомиелита»
ДЕТАЛИ
Заблуждение : Побочные эффекты, вызванные вакциной Moderna COVID-19, включают боль в руке, жар и утомляемость.В основном это незначительные краткосрочные эффекты, которые не вызывают долгосрочных проблем со здоровьем.
Отсутствует контекст : Пероральная вакцина против полиомиелита производится с использованием живого ослабленного полиовируса. Он не вызывает полиомиелита у детей, получивших вакцину. Однако живой вирус распространяется в окружающую среду вакцинированными людьми и в редких случаях может вызывать заболевание у непривитых людей. Следовательно, решение состоит в том, чтобы обеспечить высокий охват вакцинацией, а не прекращать вакцинацию, как предлагается в видео.
КЛЮЧ ВЗЯТЬ
Вакцина Moderna COVID-19 может вызывать легкие и непродолжительные побочные эффекты, такие как лихорадка, головная боль или усталость. Ни один из этих эффектов не имеет долгосрочных последствий. Могут возникнуть серьезные аллергические реакции на вакцину, но они редки и поддаются лечению. Вакцинация оказалась эффективной в искоренении полиомиелита в подавляющем большинстве развивающихся стран, предотвратив, по оценкам, 16 миллионов случаев заболевания и 1,5 миллиона случаев смерти во всем мире. Хотя случаи полиомиелита, вызванного вакцинацией, действительно случаются, они очень редки, и их можно избежать, улучшив санитарию и охват вакцинацией уязвимых сообществ.
ПОЛНАЯ ПРЕТЕНЗИЯ: «По словам Билла Гейтса, у 80% людей, принимавших вакцину Moderna, наблюдались значительные побочные эффекты»; «дети в Судане получили вакцину от полиомиелита и получили полиомиелит от вакцины»
ОБЗОР
10 февраля 2021 года на подкаст-канале The Joe Rogan Experience на платформе Spotify было размещено видео, в котором комментатор Джо Роган (интервьюирующий своего коллегу-комментатора Майкла Мэлиса) сделал ряд заявлений о побочных эффектах COVID-19 вакцина.Джо Роган сослался на более раннее интервью, которое он провел с теоретиком заговора Алексом Джонсом. Отрывок из видео от 10 февраля 2021 года был опубликован в Facebook 18 марта 2021 года, где всего за несколько дней он превысил 150 000 просмотров. В этом отрывке из оригинального видео обсуждались возможные побочные эффекты вакцины COVID-19, разработанной фармацевтической компанией Moderna.
Претензия 1 (вводящая в заблуждение): «
80% людей, принимавших вакцину Moderna, имели значительные побочные эффекты, согласно Билла Гейтса»
В видео утверждалось, что 80% людей, получивших вакцину Moderna COVID-19, серьезно пострадали от последствий для здоровья, приписывая эту цифру заявлениям, сделанным Биллом Гейтсом во время интервью CBS 23 июля 2020 года.
Во время интервью интервьюер отметил, что не менее 80% участников испытали системный побочный эффект, варьирующийся от сильного озноба до лихорадки после второй дозы. На вопрос, безопасны ли эти вакцины, Билл Гейтс ответил, что «побочные эффекты не были серьезными, то есть не вызывали постоянных проблем со здоровьем», добавив, что «мы должны убедиться, что нет побочных эффектов» и что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) «хорошо поработает над этим, несмотря на давление».
Однако в видео Рогана не было той части интервью, в которой разъяснялось, что большинство побочных эффектов вакцины не были серьезными.
По данным Центров по контролю и профилактике заболеваний США (CDC), побочные эффекты, которые могут возникнуть после вакцинации, включают местные реакции, такие как боль, покраснение и отек, а также системные побочные эффекты, такие как усталость, головная боль, мышечные боли, озноб и т. Д. лихорадка или тошнота.
В ноябре 2020 года Moderna подала в FDA разрешение на экстренное использование вакцины, для которой она ранее провела тесты на безопасность и эффективность, которые являются частью клинических испытаний фазы 3.Эти испытания проводились с участием 30 350 участников, половина из которых получила вакцину, а другая половина — плацебо. 25% участников исследования были старше 65 лет.
Из более чем 15 000 участников испытаний, получивших дозу вакцины, 84% сообщили о боли в месте инъекции после первой дозы и 88% — после второй. Десять процентов сообщили об увеличении лимфатических узлов в руке после первой дозы и 14% после второй дозы. Средняя продолжительность этой реакции составляла один день.
Возникшие системные реакции включали усталость (68% вакцинированных участников), головную боль (63%), боль в суставах (45%), тошноту (21%) или лихорадку (17%). Симптомы обычно исчезали в течение нескольких дней после вакцинации; было всего семь случаев стойкой лихорадки более одной недели. Во время клинических испытаний не было обнаружено значительных неблагоприятных условий для здоровья, связанных с вакцинами.
Вакцина Moderna COVID-19 была связана только с редкими случаями тяжелых аллергических реакций на вакцину, в основном у людей, которые ранее страдали аллергией.Эта реакция может возникнуть в течение от нескольких минут до часа после вакцинации. Симптомы этой реакции могут включать затрудненное дыхание, отек лица, учащенное сердцебиение или генерализованную сыпь по всему телу. Эта аллергическая реакция может привести к анафилаксии — заболеванию, которое может быть смертельным, если его не лечить.
В период с 21 декабря 2020 года по 18 декабря 2021 года в США было введено около 7,5 миллионов доз вакцины Moderna, зарегистрировано 19 анафилактических реакций (2.5 случаев / миллион введенных доз). Примечательно, что ни одна из этих аллергических реакций не была смертельной [1] .
Таким образом, нет никаких доказательств того, что вакцина Moderna COVID-19 вызывает серьезные побочные эффекты, помимо анафилаксии, поскольку они не были обнаружены ни в клинических испытаниях, ни у миллионов людей, получивших вакцину на сегодняшний день.
Претензия 2 (контекст отсутствует): «
детей в Судане получили вакцину от полиомиелита и заразились полиомиелитом от вакцины »
Во второй половине видеоролика обсуждались эффекты вакцины против полиомиелита, используемой в нескольких африканских странах, особенно в Судане.Он упомянул статью, опубликованную Associated Press (AP), согласно которой вакцина против полиомиелита вызывает заболевание у вакцинированных детей. В статье AP, в свою очередь, цитируется заявление Всемирной организации здравоохранения (ВОЗ) с описанием двух случаев паралича, вызванного полиомиелитом, обнаруженного в Судане в 2020 году. Эти случаи соответствуют двум детям, которые были вакцинированы пероральной вакциной против полиомиелита в 2019 году. Всего в регионе выявлено 13 случаев, которые могут быть связаны с этой вакциной.
Полиомиелит — очень заразное заболевание, вызываемое полиовирусом, которое может привести к параличу некоторых частей тела [2] . Доступны две вакцины против полиомиелита. Одна из них — это инактивированная вакцина против полиомиелита, разработанная Джонасом Солком (называемая инактивированной вакциной, ИПВ или вакциной Солка), которая содержит «убитый» полиовирус и вводится внутримышечно. Вторая вакцина была разработана Альбертом Сабином (называемая аттенуированной вакциной, ОПВ или вакциной Сэбина) и содержит живой ослабленный полиовирус [3] .Вакцина Солка придает иммунитет к болезни, но не предотвращает ее передачу [4] .
С другой стороны, ОПВ содержит ослабленный, ослабленный полиовирус, который придает иммунитет и предотвращает заражение. Эта вакцина вводится перорально в виде капель, и один флакон вакцины позволяет вакцинировать несколько человек. Хотя страны, в которых уже ликвидирован полиомиелит, перешли на вакцину Солка, ОПВ по-прежнему используется в странах, где полиомиелит все еще является эндемическим, поскольку она предотвращает распространение болезни.
В редких случаях ослабленная вакцина может вызвать инфекцию у непривитых людей в непосредственной близости от человека, получившего вакцину. Эти случаи известны как «циркулирующий полиовирус вакцинного происхождения» или цПВВП, и они явились причиной двух вспышек, описанных в Судане в отчете ВОЗ. Лучшая стратегия предотвращения этого — полная вакцинация населения [5,6].
Существует также небольшая вероятность того, что ОПВ может вызвать неблагоприятный эффект у людей с первичным иммунодефицитным заболеванием или подавленным иммунным ответом, поскольку их иммунная система неспособна уничтожить даже ослабленный вирус [5] .По этой причине ВОЗ не рекомендует использовать ОПВ людям с такими иммунологическими заболеваниями.
Сводка
Помимо анафилаксии, на сегодняшний день не было обнаружено серьезных последствий для здоровья, вызванных вакциной Moderna COVID-19 ни у участников клинических испытаний, ни у миллионов людей, получивших вакцину. Единственные сопутствующие побочные эффекты — это незначительные неудобства (например, повышенная температура или усталость) и кратковременные, поскольку они исчезают в течение нескольких дней. ОПВ, используемая в нескольких странах Африки и Азии, показала свою эффективность в искоренении болезни.Спорадические вспышки, вызванные вакциной, содержащей ослабленный полиовирус, можно предотвратить путем вакцинации всего населения.
ССЫЛКИ
IPOL, дозировка ИПВ (инактивированная полиовирусная вакцина), показания, взаимодействия, побочные эффекты и др.
Монитор Тесно (1) адалимумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Closely (1) алефасепт снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Тщательно (1) анакинра снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) антитимоцитарный глобулин лошадиный снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) антитимоцитарный глобулин кролика снижает эффекты вакцины против полиовируса, инактивированной фармакодинамическим антагонизмом.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) азатиоприн снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Closely (1) базиликсимаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) белимумаб снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) будесонид снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор.По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) канакинумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор.также повышают риск заражения при использовании сопутствующих живых вакцин.
Монитор Тщательно (1) цертолизумаб пегол снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) кортизон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Closely (1) циклоспорин снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом.Тщательно измените терапию / монитор. Если возможно, завершите все соответствующие возрасту вакцинации как минимум за 2 недели до начала терапии иммунодепрессантами. Пациенты вакцинированы
Monitor Closely (1) дефлазакорт снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) вакцина против денге, инактивированная вакцина против полиовируса. неуказанный механизм взаимодействия. Используйте Осторожно / Монитор. Отсутствуют данные, позволяющие установить безопасность и иммуногенность совместного введения вакцины против денге с рекомендованными вакцинами для подростков.
Monitor Close (1) дексаметазон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) этанерцепт снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) эверолимус снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) флудрокортизон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Монитор близко (1) глатирамер снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) голимумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) гидрокортизон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) ибрутиниб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор.По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) ифосфамид снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) инфликсимаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) лефлуномид снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Close (1) ломустин снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) мехлорэтамин снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения.Тщательно измените терапию / монитор. Совместное применение с терапией иммунодепрессантами может снизить эффективность вакцины. Если возможно, завершите все соответствующие возрасту вакцинации по крайней мере за 2 недели до начала терапии иммунодепрессантами. Вакцинированные пациенты
Монитор Тщательно (1) мелфалан снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) меркаптопурин снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) метотрексат снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) метилпреднизолон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) муромонаб CD3 снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) микофенолат снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Close (1) обинутузумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, получающие химиотерапию анти-В-клеточными антителами, должны подождать = 6 месяцев после терапии, прежде чем вакцинироваться инактивированными вакцинами.
Монитор Тщательно (1) окрелизумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Close (1) офатумумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, получающие химиотерапию анти-В-клеточными антителами, должны подождать = 6 месяцев после терапии, прежде чем вакцинироваться инактивированными вакцинами.
Серьезный — Альтернатива использования (1) офатумумаб SC снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения.Избегайте или используйте альтернативные лекарства. Проведите все иммунизации в соответствии с инструкциями по иммунизации, по крайней мере, за 2 недели до начала подкожной вакцинации офатумумаба для инактивированных вакцин и по возможности.
Монитор Тщательно (1) онасемноген абепарвовек снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения. Тщательно измените терапию / монитор. Отрегулируйте вакцинацию с учетом сопутствующего введения кортикостероидов до и после инфузии онсемногена абепарвовека.При начале терапии системными кортикостероидами подождите 2 недели после введения инактивированной вакцины.
Monitor Close (1) оксалиплатин снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Minor (1) озанимод снижает эффекты вакцины против полиовируса, инактивированной иммуносупрессивными эффектами; риск заражения. Незначительное / значение неизвестно. Нет клинических данных об эффективности и безопасности вакцинации у пациентов, принимающих озанимод. При одновременном применении с озанимодом вакцинация может быть менее эффективной.
Монитор Тщательно (1) понесимод снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения.Используйте Осторожно / Монитор. Если возможно, завершите все соответствующие возрасту прививки как минимум за 4 недели до начала приема понесимода.
Monitor Close (1) преднизолон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) преднизон снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Monitor Closely (1) прокарбазин снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Монитор Тщательно (1) рилонасепт снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) ритуксимаб снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, получающие химиотерапию анти-В-клеточными антителами, должны подождать = 6 месяцев после терапии, прежде чем вакцинироваться инактивированными вакцинами.
Монитор Тщательно (1) ритуксимаб-гиалуронидаза снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения.Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, получающие химиотерапию анти-В-клеточными антителами, должны подождать = 6 месяцев после терапии, прежде чем вакцинироваться инактивированными вакцинами.
Серьезное применение — альтернатива (1) секукинумаб снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения. Избегайте или используйте альтернативные лекарства. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной.Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Серьезно — Альтернатива использования (1) сипонимод снижает эффекты полиовирусной вакцины, инактивированной иммуносупрессивным действием; риск заражения. Избегайте или используйте альтернативные лекарства. Приостановите вакцинацию за 1 неделю до начала приема сипонимода и на 4 недели после прекращения лечения.Совместное введение с живыми аттенуированными вакцинами может увеличить риск инфицирования.
Монитор Тщательно (1) сиролимус снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) такролимус снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена. .
Монитор Тщательно (1) темсиролимус снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Close (1) тоцилизумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Closely (1) суспензия для инъекций триамцинолона ацетонида снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом. Тщательно измените терапию / монитор. По возможности избегайте вакцинации во время химиотерапии или лучевой терапии, поскольку реакция антител может быть неоптимальной. Пациенты, вакцинированные в течение 14 дней до начала или во время иммуносупрессивной терапии, должны быть ревакцинированы = через 3 месяца после прекращения терапии, если иммунная компетентность была восстановлена..
Monitor Close (1) устекинумаб снижает эффекты полиовирусной вакцины, инактивированной фармакодинамическим антагонизмом.

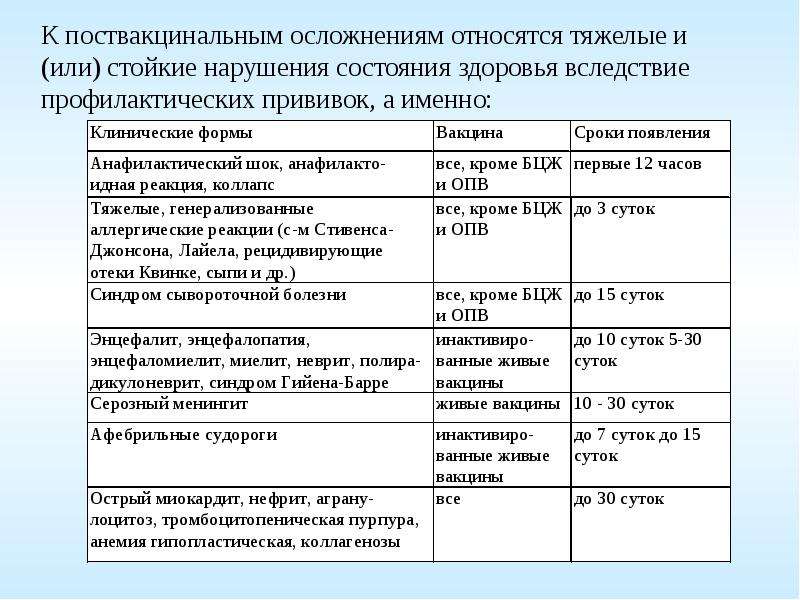
 , анафилаксия) после предыдущей дозы или на компоненты вакцины
, анафилаксия) после предыдущей дозы или на компоненты вакцины
 , анафилаксия) после предыдущей дозы или на компоненты вакцины
, анафилаксия) после предыдущей дозы или на компоненты вакцины , анафилаксия) после предыдущей дозы или на компоненты вакцины
, анафилаксия) после предыдущей дозы или на компоненты вакцины





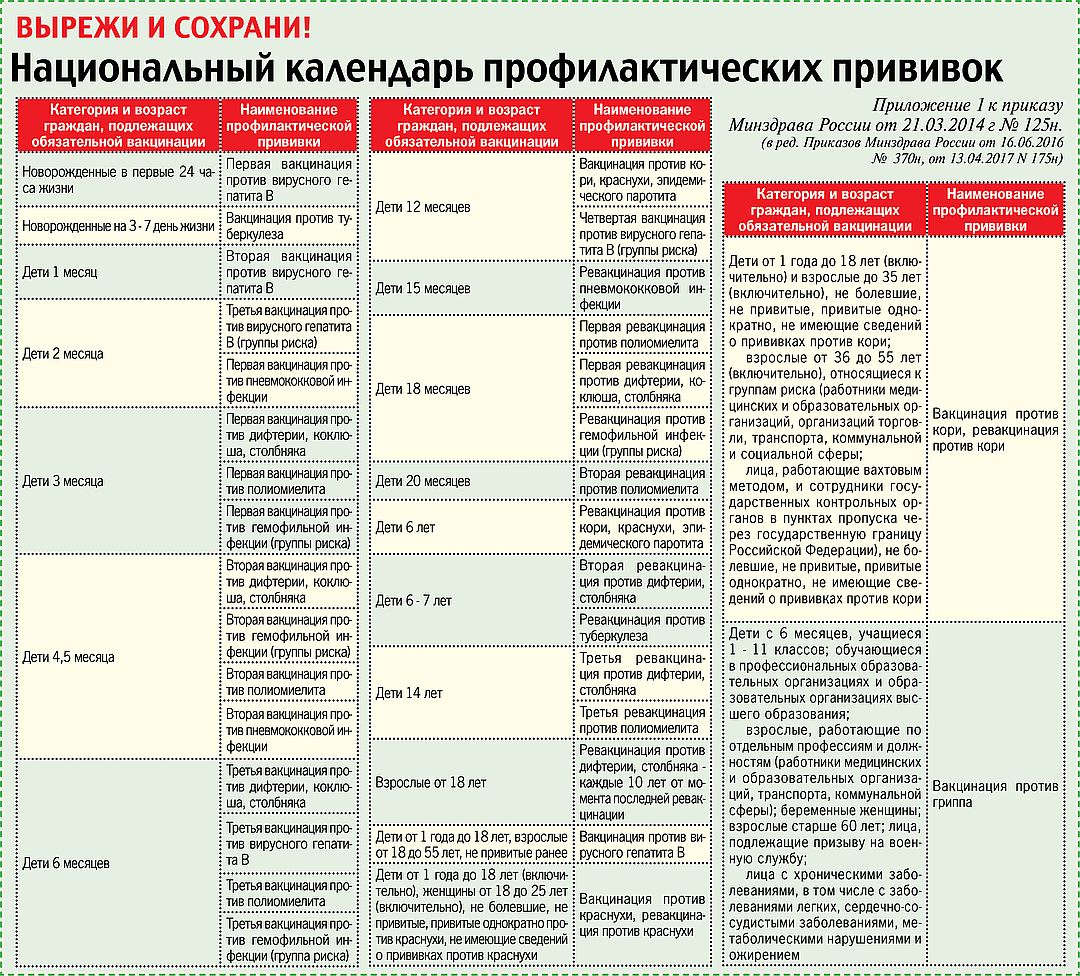
 А вот разновидность АКДС – вакцина АДСМ, не содержит коклюшного компонента, поэтому от неё побочные реакции, не говоря уже об осложнениях, наблюдаются крайне редко.
А вот разновидность АКДС – вакцина АДСМ, не содержит коклюшного компонента, поэтому от неё побочные реакции, не говоря уже об осложнениях, наблюдаются крайне редко.