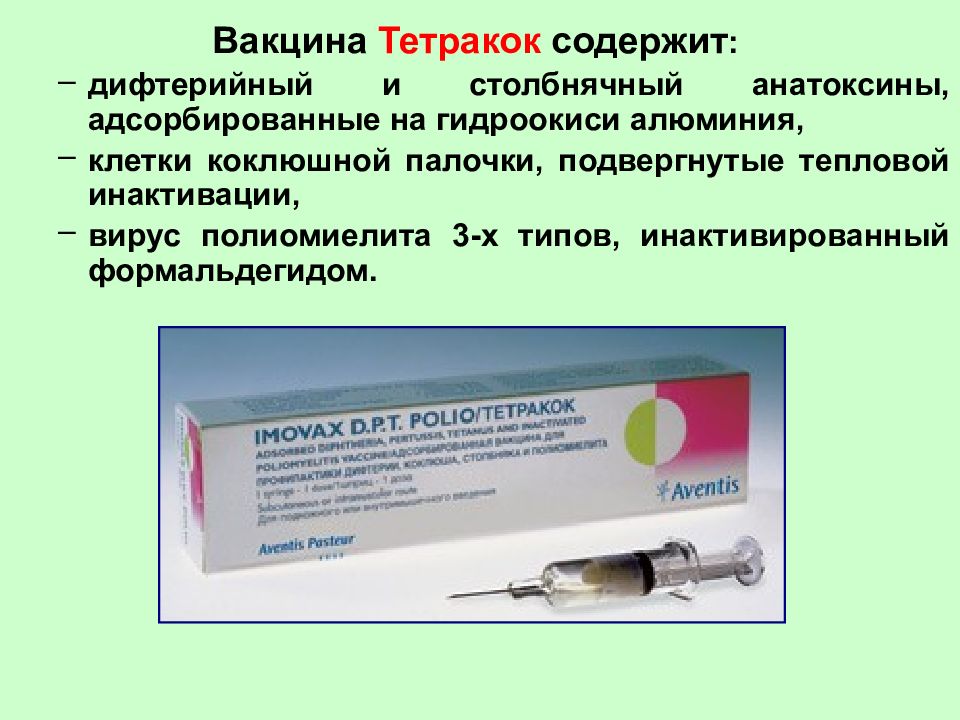
Вакцина против пневмококковой инфекции
«Превенар 13» -вакцинация против пневмококковой инфекции (производитель — Пфайзер Айрлэнд Фармасьютикалз, Ирландия).
«Превенар 13» – суспензия, состоящая из полисахаридов разных вариаций стрептококка.
Основополагающим мотивом для внедрения данной вакцины – является формирование устойчивого иммунитета от инфекции. Средство не является антибиотиком или медикаментозным препаратом, которое способно победить стрептококк. Но это стимулирующий вариант вакцины, которая заставляет клетки опознавать инфицированные бактерии, и оперативно реагировать на их присутствие в организме.
К особой группе риска поражающего действия стрептококковых инфекций подвержены дети. И именно «Превенар 13», вводимый в первые месяцы жизни, успешно переносится малышами.
Стоит ли производить прививку «Превенар 13»?
Нет сомнений в том, что прививка детям, направленная против пневмококковой инфекции, является единственным эффективным средством защиты, которая способна подготовить организма к адекватной реакции на возбудитель именно с первых дней!
Недаром данная вакцина показана к применению не только детям, но и людям с ослабленным иммунитетом, например, лицам старше 65 лет, пациентам с сахарным диабетом, людям с пониженной функцией печени и иммунодефицитным состоянием, включая ВИЧ инфицированных.
Важно! В более ранних версиях «Превенар»- вакцинациях применялась степень защиты лишь от 7 вариантов пневмококка. На сегодняшний день существует «Превенар 13», способный сформировать устойчивый иммунитет сразу против всех 13 стереотипов микроорганизма
Какие могут быть противопоказания к проведению вакцинации?
Прививка от пневмококка не желательна, если:
- человек находится на стадии беременности;
- у человека было обнаружена выраженная реакция на предыдущую процедуру;
- у пациента есть предписания к аллергической склонности к компонентам препарата;
- человек уже переживает острое заболевание или инфекцию.
Прививка от пневмококковой инфекции в Днепре
Пневмококковая инфекция – вызывается бактерией Streptococcus pneumonia, передается эта инфекция воздушно-капельным способом. Она признана одной из самых распространенных и опасных.
Она признана одной из самых распространенных и опасных.
Как проявляется пневмококковая инфекция:
- бронхит;
- отит, синусит, фарингит;
- сложное заболевание — пневмония;
- гнойный менингит;
- артроз.
Крайне опасной пневмококковая инфекция может быть для ребенка, поскольку вызывает осложнения и необратимые последствия. Для предотвращения развития заболеваний этой группы были разработаны специальные вакцины против инфекции пневмококк, позволяющие предотвратить заражение.
Что такое прививка от пневмококка?
Прививка против пневмококка начала разрабатываться только в прошлом столетии. Основная их сложность заключается в объемности группы бактерий возбудителей (они насчитывают более 90 типов). В конце 70-х начала использоваться 14-ти валентная вакцина, которая в дальнейшем улучшалась и совершенствовалась. Фармацевтические компании разработали в лабораториях конъюгированную вакцину, используемую и сегодня. Она является самым эффективным и действенным инструментом предотвращения заболеваний этой группы.
Вакцинация от пневмококка стимулирует организм сформировать свой устойчивый иммунитет к пневмококку, а в случае заболевания после полученной прививки, симптомы не так болезненны, не возникают осложнения.
Особенность бактерии пневмококка заключается в том, что она может не проявлять себя, при этом находясь в верхних дыхательных путях длительный период. Однако при возникновении «благоприятных» условий, она быстро активизируется и вызывает заболевание. К таким благоприятным условиям можно отнести:
- переутомление;
- переохлаждение;
- стресс;
- по какой-либо причине сниженный иммунитет;
- регулярное курение.
Таким образом, достаточно привычные, для современного мира, процессы могут спровоцировать жизнедеятельность бактерии, которые в свою очередь вызывают сложные заболевания.
Схема вакцинации, которая запланирована от пневмококковой инфекции
| 6 недель — 6 месяцев | 7-11 месяцев | 1 — 5 лет |
| 3 дозы + ревакцинация | 2 дозы + ревакцинация | 2 дозы, ревакцинация по показанию врача |
| 3 дозы, интервал между ними будет не менее 30 дней, далее ревакцинация через 1-1,5 года | 2 дозы, с интервалом не менее 30 дней, после чего будет проводиться ревакцинация в 2 года | Вводится 2 дозы вакцины с небольшим интервалом не менее 2 месяцев |
Врач, в зависимости от индивидуальных особенностей и состояния здоровья ребенка, может вносить коррективы в схему вакцинации, но при этом не стоит увеличивать интервалы между каждой последующей прививкой, поскольку это снижает эффективность действия курса.
Вакцинация против пневмококковой инфекции во время беременности для профилактики инфекции у младенцев
Недостаточно доказательств, чтобы оценить, может ли вакцинация против пневмококковой инфекции во время беременности предотвратить инфекции у младенцев.
Хотя заболеваемость инвазивными пневмококковыми инфекциями в разных странах мира разная, частота серьезных форм болезни или смерти высока у детей с этой инфекцией. Микроорганизм (бактерия) Streptococcus pneumoniae (пневмококк) колонизирует верхние дыхательные пути и может вызвать бактериемию (бактерии в крови), менингит, пневмонию и другие инфекции нижних дыхательных путей, а также инфекции верхних дыхательных путей, в том числе средний отит и синусит. Схемы вакцинации новорожденных, включающие три первичные дозы с бустерной дозой, могут уменьшить последствия пневмококковой инфекции у иммунизированных [привитых] детей, но эти вакцинации [прививки] не имеют защитного эффекта у младенцев младше трехмесячного возраста. Иммунизация матерей против пневмококка во время беременности может быть одним из способов предотвращения пневмококковой инфекции у младенцев в течение первых месяцев жизни. Мы включили семь рандомизированных контролируемых испытаний. Всего 919 беременных женщин участвовали в шести рандомизированных контролируемых испытаниях, данные из которых были включены в этот обзор. Эти испытания сравнивали 23-валентную пневмококковую полисахаридную вакцину с контрольной вакциной. Все женщины получили однократную инъекцию пневмококковой или контрольной вакцины. В среднем, срок беременности у женщин на момент иммунизации/вакцинации был между 27 и 38 неделями, там, где это было указано. Только два испытания с включением 241 беременности сообщали об инфекциях у новорожденных. Не было достаточно информации, чтобы сказать, приводит ли вакцинация против пневмококковой инфекции во время беременности к уменьшению инфекций у младенцев. В двух испытаниях с включением 146 беременностей сообщали о назальном [в полости носа] носительстве пневмококков (колонизация пневмококками), которое было недостаточным доказательством, чтобы показать эффект снижения колонизации в двух-трехмесячном возрасте или в возрасти шести-семи месяцев.
Иммунизация матерей против пневмококка во время беременности может быть одним из способов предотвращения пневмококковой инфекции у младенцев в течение первых месяцев жизни. Мы включили семь рандомизированных контролируемых испытаний. Всего 919 беременных женщин участвовали в шести рандомизированных контролируемых испытаниях, данные из которых были включены в этот обзор. Эти испытания сравнивали 23-валентную пневмококковую полисахаридную вакцину с контрольной вакциной. Все женщины получили однократную инъекцию пневмококковой или контрольной вакцины. В среднем, срок беременности у женщин на момент иммунизации/вакцинации был между 27 и 38 неделями, там, где это было указано. Только два испытания с включением 241 беременности сообщали об инфекциях у новорожденных. Не было достаточно информации, чтобы сказать, приводит ли вакцинация против пневмококковой инфекции во время беременности к уменьшению инфекций у младенцев. В двух испытаниях с включением 146 беременностей сообщали о назальном [в полости носа] носительстве пневмококков (колонизация пневмококками), которое было недостаточным доказательством, чтобы показать эффект снижения колонизации в двух-трехмесячном возрасте или в возрасти шести-семи месяцев. Включенные испытания были приемлемого качества. Не было различий между группами с применением пневмококковой вакцины и контрольной вакцины в отношении болезненности в месте инъекции. Ни о каких серьезных неблагоприятных событиях в этих испытаниях не сообщали.
Включенные испытания были приемлемого качества. Не было различий между группами с применением пневмококковой вакцины и контрольной вакцины в отношении болезненности в месте инъекции. Ни о каких серьезных неблагоприятных событиях в этих испытаниях не сообщали.
Стрептококк у детей
Стрептококки – это микроорганизмы в виде бактерий, имеющих форму шара, объединенных общими свойствами и существующих в окружающей нас среде — на растениях, животных, в земле и организме человека. Многие стрептококки совершенно безопасны для людей и являются естественным атрибутом микрофлоры вполне здорового человека. Но среди семейства стрептококковых есть некоторые виды, вызывающие заболевания у детей и взрослых различной степени тяжести.
Стрептококковая инфекция проявляется совершенно по-разному у каждого ребенка. Более того, если малыш является носителем этой инфекции, то, не болея сам и не проявляя симптомов болезни, он может заразить другого человека. В зоне риска находятся дети с нарушениями в работе иммунной системы, когда организм плохо защищен и не способен дать отпор инфекции, передаваемой воздушно-капельным путем. Стрептококк легко передается и через поврежденные кожные покровы (трещинки, порезы, пупочные ранки у новорожденных, различные травмы), а также половым путем и вследствие нарушения правил личной гигиены.
В зоне риска находятся дети с нарушениями в работе иммунной системы, когда организм плохо защищен и не способен дать отпор инфекции, передаваемой воздушно-капельным путем. Стрептококк легко передается и через поврежденные кожные покровы (трещинки, порезы, пупочные ранки у новорожденных, различные травмы), а также половым путем и вследствие нарушения правил личной гигиены.
Располагаясь в полости носоглотки, в дыхательных и пищеварительных путях, в мочевыводящей системе стрептококки вызывают у детей такие заболевания как скарлатина, ангина, тонзиллиты, пневмония, бронхиты. Попадая на пораженную кожу, бактерии стрептококка могут вызвать рожистое воспаление, стрептодермию, сепсис. Коварная стрептококковая инфекция не обходит вниманием и нервную и аутоиммунную системы, провоцируя развитие у детей стрептококкового менингита, ревматизма, остеомиелита и других опасных для жизни и здоровья заболеваний.
Виды стрептококков:
- Бета-гемолитические стрептококки группы А.
 Чаще всего располагаются в глотке и вызывают различные болезни в виде ангины, фарингита, менингита, сепсиса, скарлатины;
Чаще всего располагаются в глотке и вызывают различные болезни в виде ангины, фарингита, менингита, сепсиса, скарлатины; - Пневмококк. Находится в дыхательных путях, вызывая острые пневмонии, бронхит, менингит у детей и т.д.;
- Стрептококки группы B. Обитают в ЖКТ, а также часто встречаются у беременных, и при прохождении ребенка по родовым путям зараженной матери могут вызвать менингит и бактериемию у новорожденного. У взрослых такой стрептококк часто становится причиной пневмонии;
- Негемолитические (зеленящие) стрептококки обитают в ротовой полости и кишечнике, легко попадая в кровоток и разносясь по организму. Могут спровоцировать развитие кариеса, сепсиса, инфекционного эндокардита.
Диагностика
Самым простым способом выявления стрептококков является специальный бактериологический посев с очагов инфекции: мазок из зева, с кожного покрова, мокроты из легких и т. д. Взятый биоматериал проверяют на чувствительность к антибиотикам для назначения эффективного лечения. Также для уточнения диагноза ребенку проводят анализы мочи, крови, электрокардиографию. Возможно назначение УЗИ органов, предположительно зараженных стрептококком.
д. Взятый биоматериал проверяют на чувствительность к антибиотикам для назначения эффективного лечения. Также для уточнения диагноза ребенку проводят анализы мочи, крови, электрокардиографию. Возможно назначение УЗИ органов, предположительно зараженных стрептококком.
По результатам анализов лечением юного пациента занимаются в зависимости от местонахождения стрептококковой инфекции соответствующие детские специалисты — отоларинголог, детский уролог, нефролог, дерматолог, пульмонолог, педиатр.
Лечение
Для лечения стрептококковой инфекции чаще всего используют антибиотики, иммуностимулирующие средства, симптоматическую терапию.
Наши клиники в Санкт-Петербурге
Медицентр Юго-Запад
Пр. Маршала Жукова 28к2
Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону
+7 (812) 640-55-25
Памятка для родителей по вакцинопрофилактике
Предупредить! Защитить! Привить!
Вакционопрофилактика – система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путём проведения профилактических прививок.
Одним из важнейших мероприятий, предпринимаемых для сохранения и укрепления здоровья детей, является организация и проведение профилактических прививок.
Защиту организма от возбудителей инфекционных заболеваний осуществляет иммунная система. Она способна защитить ребенка от постоянно окружающих нас микроорганизмов (кишечной палочки, стрептококков и других), но не всегда в силах справиться с возбудителями дифтерии, вирусного гепатита «А», «В», столбняка, коклюша, кори и других инфекционных заболеваний. Прививки, полученные в детстве, в большинстве случаев, создают основу иммунитета против отдельных инфекций на всю жизнь.
Рекомендации перед вакцинацией и после
Перед прививкой ребенка нужно оберегать от контактов с больными. При наличии пищевой аллергии необходимо строго соблюдать диету, не вводить в рацион новые продукты. Такой же тактики нужно придерживаться в течение 5-7 дней после прививки.
После прививки у некоторых детей может наблюдаться постпрививочная реакция, такая как: повышение температуры, покраснение или уплотнение в месте введения вакцины. Это закономерная реакция, которая говорит о начале формирования защиты от инфекции. Как правило, такая реакция носит кратковременный характер (1-3 дня).
Это закономерная реакция, которая говорит о начале формирования защиты от инфекции. Как правило, такая реакция носит кратковременный характер (1-3 дня).
При повышении температуры до 380 не требуется никакого лечения, температура выше 380, необходимо использовать жаропонижающие средства, назначение сделает врач-педиатр, в соответствии с возрастом вашего ребенка.
В случае покраснения и уплотнения в месте введения вакцины, необходимо поставить в известность медработника, проводившего прививку. Для детей, у которых наблюдалась постпрививочная реакция, рекомендуются подготовительные мероприятия, которые назначит врач перед следующей прививкой.
Каждый человек имеет право сделать свой выбор – прививаться или нет, но родители должны знать, что отказываясь от прививок, они лишают своих детей прав на здоровье. Кроме того, если в детском учреждении карантин по какой-то инфекции, а у вашего ребёнка отсутствует прививка, то его могут не принять в детский коллектив.
Родители! Отказываясь от прививок, Вы не только лишаете защиты своего ребенка, но и подвергаете опасности других детей, а также способствуете распространению инфекционных заболеваний в обществе.
Важно подчеркнуть, что современная медицина не имеет пока более эффективного средства профилактики инфекционных заболеваний, чем вакцинация.
Календарь профилактических прививок детям
Возраст | Название прививки | Вид вакцинации |
12 часов | вирусный гепатит В (ВГВ) | первая вакцинация |
3-5 суток | туберкулез (БЦЖ) | вакцинация |
1 мес. | ВГВ | вторая вакцинация |
3 мес. | полиомиелит | первая вакцинация |
4 мес. | АКДС, полиомиелит | вторая вакцинация |
5 мес. | АКДС, ВГВ, полиомиелит [или инактивированная полиомиелитная вакцина (ИПВ)] | третья вакцинация |
1 год | корь, краснуха, эпидемический паротит | первая вакцинация |
2 года | полиомиелит | вторая ревакцинация |
6 лет | корь, краснуха, эпидемический паротит дифтерия, столбняк | ревакцинация |
7 лет | полиомиелит туберкулез (БЦЖ) | третья ревакцинация ревакцинация |
13 лет | ВГВ (если ранее не прививался) | трехкратная вакцинация |
14 лет | туберкулез (БЦЖ) | ревакцинация |
Каждый год до 15 лет ребенку проводится туберкулинодиагностика (проба Манту)
Вакцинация защищает здоровье человека на каждом этапе его жизни
Пять причин сделать прививку:
- Предупредить ненужные страдания, связанные с заболеванием.

- Предупредить развитие осложненных форм болезни.
- Предупредить негативное влияние на планы семьи.
- Наличие широкого спектра вакцин с высоким профилем безопасности и профилактической эффективности.
Возможность индивидуализации иммунизации: применение разных схем и методов вакцинации для создания достаточного иммунитета у каждого прививаемого человека
Иммунизация – метод создания искусственного иммунитета у людей и животных.
Всемирный день борьбы с пневмонией — Новости — Пациентам
Всемирный день борьбы с пневмонией ежегодно отмечается 12 ноября, он появился в календаре по инициативе Глобальной коалиции против детской пневмонии.
В 2009 году ВОЗ и ЮНИСЕФ объявили о «Глобальном плане действий по профилактике пневмонии и борьбе с ней (GAPP)». Его целью является активизация борьбы с пневмонией путем проведения комбинированных мероприятий по защите детей от пневмонии, ее профилактике и лечению.
Именно дети страдают от пневмонии в первую очередь. Это заболевание является главной причиной смертности несовершеннолетних во всем мире. Ежегодно оно уносит жизни 1,4 миллиона детей в возрасте до пяти лет. Это больше, чем СПИД, малярия и корь вместе взятые. Согласно мировой статистике, каждую минуту от этого заболевания погибает четыре ребенка. Пневмония распространена повсеместно, но больше всего от нее страдают дети в Южной Азии и в Африке.
Это заболевание является главной причиной смертности несовершеннолетних во всем мире. Ежегодно оно уносит жизни 1,4 миллиона детей в возрасте до пяти лет. Это больше, чем СПИД, малярия и корь вместе взятые. Согласно мировой статистике, каждую минуту от этого заболевания погибает четыре ребенка. Пневмония распространена повсеместно, но больше всего от нее страдают дети в Южной Азии и в Африке.
В России показатель смертности от пневмонии снизился на 10,1% по сравнению с 2015 годом и на 20,2 % в сравнении с 2013 годом. В 2016 году регистрировался 21 случай на 100 тысяч человек, за первые 9 месяцев 2017 года — 17 случаев на 100 тысяч человек.
Две главные опасности пневмонии заключаются в том, что инфекция распространяется воздушно-капельным путем и ее легко принять за ОРВИ, грипп или обычную простуду.
Что такое пневмония
Пневмония (или воспаление легких) — острое респираторное инфекционное заболевание, вызывающее поражение ткани легких. По статистике, от 5 до 10 % случаев заболеваемости пневмонией заканчиваются летальным исходом.
По статистике, от 5 до 10 % случаев заболеваемости пневмонией заканчиваются летальным исходом.
Признаки заболевания такие же как при ОРВИ, гриппе или простуде:
- повышение температуры, озноб;
- утомляемость и слабость;
- кашель сначала сухой, а затем — влажный с обильным выделением мокроты;
- одышка при физических нагрузках;
- возможна боль в груди при попытке глубоко вздохнуть.
Виды пневмонии
- Бактериальная (пневмококки, гемофильная палочка, стафилококки, стрептококки и др.). Самый распространенный вид пневмонии (30–40% от всего количества случаев заболевания).
- Вирусная (грипп, респираторно-синцитиальный вирус, риновирусы, аденовирусы и др.). Если причиной пневмонии является вирус, антибиотики будут бесполезны.
- Грибковая (аспергиллы, кандиды, пневмоцисты и др.). Грибковые пневмонии случаются, как правило, на фоне резкого снижения иммунитета.

- Атипичная (легионеллы,микоплазмы, хламидии и пр.) Опасна тем, что основные признаки заболевания «стерты» и воспаление легких легко можно спутать с обычной простудой.
- Вялотекущая. Может возникнуть после пневмонии или ОРВИ, если пациент не долечился. Вялотекущая пневмония бывает у пожилых людей на фоне других заболеваний, особенно при наличии хронических форм со стороны органов дыхательной системы. Зачастую эту пневмонию путают с заболеваниями сердца, обострениями хронической вирусной инфекции.
Что делать, чтобы не допустить болезнь
- Закаляться. Закаливающие процедуры укрепляют иммунную защиту и повышают сопротивляемость организма любым инфекциям. Профилактика пневмоний обычно включает контрастные водные процедуры и обливание ног.
- Заниматься дыхательной гимнастикой. Дыхательная гимнастика направлена на улучшение вентиляции легких. Чтобы предупредить воспаление, нужно надувать воздушные шары или регулярно делать глубокие движения типа вдох-выдох.
- Ежегодно проводить вакцинацию против гриппа, что является способом профилактики вирусных пневмоний.
- Сделать прививку против пневмококковой инфекции, которая защитит от пневмоний стрептококковой этиологии. Профилактические прививки против пневмококковой инфекции проводятся в рамках национального календаря профилактических прививок, прививаются дети в возрасте от 0 до 1 года (получают три прививки: в возрасте 2 месяцев, 4,5 месяцев и в 15 месяцев). В Токсовской МБ бесплатно проводится иммунизация против пневмококковой инфекции лиц в возрасте старше 60 лет. Особенно нужна прививка при любых хронических заболеваниях, способных угнетать иммунитет: сахарном диабете, заболеваниях крови, болезнях печени и ВИЧ-инфицированным.
- Лечить хронические очаги инфекции.
- Укреплять иммунитет. Поддерживать сопротивляемость организма с помощью здорового питания, отдыха и регулярных физических упражнений.
- Избегать переохлаждений, контактов с больными людьми.
- Избегать большого скопления людей при вспышках инфекций. Пользоваться одноразовыми масками, если вы стали источником инфекции маску нужно менять каждый 2 часа.
- Тщательно мыть руки после улицы и перед едой.
- Отказаться от курения. Курение снижает естественную устойчивость бронхов и лёгких к респираторным инфекциям.
Своевременное обращение к врачу, правильные диагностика и лечение помогут вылечиться и избежать серьезных осложнений.
Прививка от пневмококка | Медицинский центр Медлайн
Что такое пневмококк?
Пневмококк (или Streptococcus pneumoniae — стрептококк пневмонии) — это очень распространенная бактерия, который вызывает такие заболевания, как воспаление легких (пневмония), бронхит, синусит, а также такие распространенные инфекции, как сепсис (заражение крови), воспаление коры головного мозга (менингоэнцефалит) и другие.
Вакцинация взрослых коньюгированной вакциной Превенар 13. Стоимость вместе с приемом врача 3500 р.
Для чего нужна вакцинация?
Ряд заболеваний и состояний сопряжен с повышенным риском тяжелой формы болезни и агрессивного поведения пневмококка. Для снижения этого риска нужна вакцинация.
Кому нужна вакцинация?
Группам повышенного риска развития тяжелых форм пневмококковой инфекции, таким, как:
- Все дети до 2 лет.
- Все взрослые в возрасте 65 лет и старше.
- Больные хроническими заболеваниями, например, сахарным диабетом и другими хроническими нарушениями обмена веществ, болезнями сердца и кровеносных сосудов, гепатитом и/или циррозом печени или хроническими болезнями легких (ХОБЛ, астма и др.).
- Лица с врожденным или приобретенным иммунодефицитом, включая онкогематологические заболевания, злокачественные новообразования и ВИЧ-инфекцию.
- Лица с нарушениями работы селезенки (включая серповидноклеточную анемию) или с удаленной селезенкой или при подготовке к удалению селезенки.
- Лица, прошедшие пересадку органов или пересадку костного мозга.
- Лица с хронической почечной недостаточностью или нефротическим синдромом, а также находящиеся на диализе.
Какие бывают вакцины?
В РФ есть два вида вакцин, которые не содержат живых возбудителей:
- Пневмококковая конъюгированная вакцина (ПКВ13). Это вакцина, содержащая белок, связанный с компонентами оболочки 13 штаммов пневмококка. К ней относятся Превенар 13 и Синфлорикс. ПКВ13 рекомендована для всех детей младше 2 лет и людей 2 лет и старше с определенными заболеваниями. Взрослые 65 лет и старше также могут обсудить вопрос со своим врачом и принять решение о вакцинации ПКВ13.
- Пневмококковая полисахаридная вакцина (ППСВ23). Это вакцина, содержащая компоненты полисахаридной оболочки 23 штаммов пневмококка. К ней относится Пневмовакс 23. ППСВ23 рекомендуется для всех взрослых в возрасте 65 лет и старше, людей от 2 до 64 лет с определенными заболеваниями и курящих табак взрослых от 19 до 64 лет. Дети младше 2 лет не должны получать эту вакцину.
Какая схема вакцинации используется?
Для взрослых, которые относятся к группам риска, рекомендуется одна доза коньюгированной вакцины (Превенар 13). Лица из групп особо высокого риска в дополнение к конъюгированной вакцине вакцине должны получить две дозы полисахаридной вакцины (Пневмовакс 23). В таких случаях рекомендуется начать с серии конъюгатных вакцин, а после этого сделать прививку полисахаридной вакциной.
Вторая доза вакцины пневмовакс (через 5 лет после первой дозы) рекомендуется для прошедших вакцинацию лиц с особо высоким риском тяжелой пневмококковой инфекции. Эту прививку рекомендуется сделать еще один раз.
Лицам в возрасте 65 лет и старше, которые до достижения 65 лет получили одну дозу вакцины, рекомендуется дополнительная доза, когда им исполнится 65 лет (если прошло не менее 5 лет с момента получения последней дозы).
Вакцинация взрослых коньюгированной вакциной Превенар 13. Стоимость вместе с приемом врача 3500 р.
Насколько хорошо действуют эти вакцины?
Некоторые пневмококковые инфекции являются инвазивными. Инвазивное заболевание означает, что микробы проникают в те части тела, которые обычно свободны от микробов. Инвазивное заболевание обычно очень серьезное и может привести к смерти.
Вакцины, которые помогают защитить от пневмококковой инфекции, работают хорошо, но не могут предотвратить все случаи.
Исследования показывают, что как минимум 1 доза пневмококковой конъюгированной вакцины защищает:
- По крайней мере, 8 из 10 детей от серьезных инфекций, называемых инвазивным пневмококком.
- 75 из 100 взрослых в возрасте 65 лет и старше против инвазивного пневмококкового заболевания.
- 45 из 100 взрослых в возрасте 65 лет и старше против пневмококковой пневмонии.
Исследования * показывают, что 1 доза пневмококковой полисахаридной вакцины защищает
- От 50 до 85 из 100 здоровых взрослых против инвазивной пневмококковой инфекции.
Каковы побочные явления при прививках от пневмококка?
Превенар
У 10 — 20% лиц, получивших прививку, наблюдаются местные побочные явления — краснота, отек или боли в области инъекции. В более редких случаях возможно краткосрочное повышение температуры или ощущение беспокойства. Очень редкие побочные явления включают судороги, вялость и повышенную чувствительность (в 0,01 — 0,1% случаев).
Такие побочные явления, как тяжелая аллергическая (анафилактическая) реакция случаются крайне редко.
Пневмовакс
Наиболее частыми являются местные побочные явления, а более редкие включают временное повышение температуры, боли в мышцах, слабость и рвоту. Случаи повышенной чувствительности бывают редко.
Вакцинация взрослых коньюгированной вакциной Превенар 13. Стоимость вместе с приемом врача 3500 р.
Какой интервал следует соблюдать при выполнении прививок от пневмококка по отношению к другим прививкам?
Прививки от пневмококка можно делать в те же сроки, что и другие прививки, или в любое время до или после них.
Какой интервал рекомендуется соблюдать между прививками превенар и пневмовакс?
Для лиц старше 18 лет — рекомендуется ввести превенар, а через 8 недель пневмовакс. Если же вакцинация начинается с пневмовакса, а затем вводят превенар, то рекомендуемый интервал между ними должен составлять один год.
Когда не следует делать прививки от пневмококка?
- Если у вас или у вашего ребенка была опасная для жизни аллергическая реакция или тяжелая аллергия на вакцины.
- Люди с легким заболеванием, например с простудой, вероятно, могут получить вакцину. Людям с более серьезным заболеванием, вероятно, следует подождать, пока они не выздоровеют. Проконсультируйтесь с врачом в такой ситуации.
Можно ли проводить вакцинацию против пневмококковой инфекции вместе с вакцинацией против гриппа?
Иммунизацию против пневомококка можно проводить в течение всего года. Если планируется организация программы массовой вакцинации против гриппа, то удобно провести эту вакцинацию одновременно с иммунизацией против пневмококковой инфекции перед началом сезона ОРЗ и гриппа, что соответствует рекомендациям Всемирной организации здравоохранения.
Можно ли привиться во время беременности?
Нет никаких доказательств того, что ПКВ13 или ППСВ23 вредны для беременной женщин или плода. Однако в качестве меры предосторожности женщинам, которым необходима вакцина, следует по возможности сделать ее до беременности.
Пневмококковая (стрептококковая) вакцина: стоит ли ее получать?
Доктор Кеннет Лин является сертифицированным терапевтом в отделении Inova General Internal Medicine Group — Ballston . Он имеет 21-летний клинический опыт и особые интересы в профилактической медицине, питании и дерматологических процедурах.
Streptococcus pneumoniae, обычно называемый «стрептококком» или «пневмококком», представляет собой знакомый тип бактерий, вызывающих различные инфекции, от фарингита и инфекций среднего уха до опасных для жизни заболеваний, таких как пневмония и менингит.Пожилые и маленькие дети подвергаются более высокому риску заражения этими опасными для жизни заболеваниями и осложнениями.
Пневмококковые инфекции заразны и передаются от человека к человеку через дыхательные пути. Поскольку респираторные заболевания чаще встречаются зимой и ранней весной, пневмококковые инфекции являются наиболее распространенными. К счастью, есть две вакцины, которые очень эффективны для защиты от стрептококковых инфекций.
Prevnar13 ® (PCV13) был представлен в 2010 году и обеспечивает защиту от 13 типов (серотипов) пневмококка.Эта вакцина вводится в виде серии иммунизации детям младшего возраста. Графики дозирования различаются в зависимости от возраста, в котором ребенок начинает получать прививки.
Дети в возрасте 6 лет и старше и взрослые в возрасте до 65 лет, относящиеся к группе «высокого риска» (с серповидно-клеточной анемией, кохлеарным имплантатом, утечкой спинномозговой жидкости, статусом после спленэктомии, ВИЧ-положительными или другими состояниями с ослабленным иммунитетом) должны получить однократную дозу. . Все взрослые 65 лет и старше также должны получить разовую дозу.
Pneumovax23 ® (PPSV23) защищает от 23 видов пневмококка. Он дополняет Prevnar13 и должен применяться в дополнение к Prevnar13. Рекомендуется всем взрослым старше 65 лет и лицам с высоким риском от 2 лет и старше. Также рекомендуется курильщикам сигарет в возрасте от 19 до 64 лет.
Взрослые, не получившие ни одной вакцины, должны начинать с Prevnar13, а затем с Pneumovax23. Pneumovax23 следует вводить как минимум через 8 недель после иммунизации Prevnar13.
Побочные эффекты пневмококковых вакцин могут включать покраснение, отек и болезненность в месте инъекции; жар; болезненность; и усталость.
Лица, у которых в анамнезе были известные аллергические реакции на любую из этих вакцин или на вакцину TdAP, не должны получать пневмококковую вакцину. Если в настоящее время у вас есть симптомы респираторной или другой инфекции, лучше отложить вакцинацию до исчезновения симптомов.
Исследования, проведенные в США и других странах, показали, что эти вакцины не только резко снижают распространенность тяжелого пневмококкового заболевания у вакцинированных лиц, но также снижают риск заболевания у невакцинированных людей.Это показывает, что вакцины помогают ограничить распространение бактерий в обществе. Помните, что вакцинация предназначена не только для вашей защиты — она может защитить наиболее уязвимых окружающих вас людей.
Рекомендации AAP по вакцинации против инфекции Streptococcus Pneumoniae — Практические рекомендации
CARRIE ARMSTRONG
Am Fam Physician. 15 октября 2010 г .; 82 (8): 996.
Инвазивное заболевание, вызываемое Streptococcus pneumoniae, остается проблемой общественного здравоохранения у детей, несмотря на широкое использование семивалентной пневмококковой конъюгированной вакцины (PCV7; Prevnar).По оценкам, в 2000 году у детей младше пяти лет было зарегистрировано 14,5 миллиона случаев заболевания, что привело к примерно 826 000 смертельных исходов.
Возросла частота инвазивного пневмококкового заболевания, связанного с серотипами, не включенными в PCV7, что вызвало необходимость в пневмококковой конъюгированной вакцине с расширенным охватом. В феврале 2010 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США лицензировало 13-валентную пневмококковую конъюгированную вакцину (PCV13; Prevnar 13) для использования у детей в возрасте от 2 до 71 месяца.PCV13 заменит PCV7. Он содержит те же семь пневмококковых капсульных полисахаридов, что и в PCV7, плюс шесть дополнительных серотипов, которые ответственны за высокие показатели инвазивного пневмококкового заболевания у детей в США. Он вводится серией из четырех доз в возрасте двух, четырех, шести и от 12 до 15 месяцев.
PCV13 будет проходить в соответствии с теми же графиками плановой и наверстывающей иммунизации, рекомендованными Консультативным комитетом по практике иммунизации Центров по контролю и профилактике заболеваний.Все дети в возрасте от 2 до 59 месяцев должны получить вакцину, так же как и дети в возрасте от 60 до 71 месяца, у которых есть сопутствующие заболевания, повышающие риск инвазивного пневмококкового заболевания (например, дети с хроническими заболеваниями сердца или легких, сахарным диабетом, серпом). клеточное заболевание; анатомическая или функциональная аспления; инфекция, вызванная вирусом иммунодефицита человека [ВИЧ] или другое иммунодефицитное состояние; или кохлеарный имплантат или утечка спинномозговой жидкости). Дети, получившие хотя бы одну дозу PCV7, должны завершить серию вакцинации PCV13, как только она станет доступной.Ранее введенные дозы PCV7 засчитываются для завершения рекомендованной серии вакцинаций.
Разовая дополнительная доза PCV13 рекомендуется для здоровых детей в возрасте от 14 до 59 месяцев, которые были полностью вакцинированы PCV7. Рекомендуется интервал не менее восьми недель между последней дозой PCV7 и дополнительной дозой PCV13. Дополнительная доза также рекомендуется детям в возрасте от 14 до 71 месяца, которые подвержены высокому риску пневмококковой инфекции и были полностью иммунизированы ЦВС7.Детей не следует вызывать для вакцинации, но дополнительную дозу следует вводить при следующем соответствующем медицинском визите.
Однократная доза PCV13 следует вводить детям в возрасте от шести до 18 лет, которые подвержены повышенному риску инвазивного пневмококкового заболевания, независимо от того, получили ли они вакцину PCV7 или 23-валентную пневмококковую полисахаридную вакцину (PPSV; Pneumovax).
Дети с высоким риском инвазивной пневмококковой инфекции в возрасте не менее двух лет должны получать PPSV после завершения серии PCV13; PPSV следует вводить как минимум через восемь недель после последней дозы PCV13, но как можно скорее после постановки диагноза хронического заболевания.Еще одна доза PPSV — всего две дозы — рекомендуется через пять лет после первой дозы для детей с серповидно-клеточной анемией, анатомической или функциональной аспленией, ВИЧ-инфекцией или другими иммунодефицитными состояниями.
Streptococcus Vaccine — обзор
Streptococcus agalactiae (Стрептококки группы B)
Стрептококки группы B (GBS), с единственным видом Streptococcus agalactiae , были впервые описаны в 1887 году, когда они были выделены в 1887 году. случай мастита крупного рогатого скота.До 1937 года они не считались патогенами человека, но затем были идентифицированы как причина сепсиса у новорожденных. За последние пару десятилетий они стали серьезной проблемой для здоровья и основной причиной бактериального менингита у новорожденных, приводя к инвазивным заболеваниям примерно у 1 из 1000 живорождений. Заражение новорожденных GBS не только характеризуется высокой смертностью, но и большой процент выживших также страдает от последующего повреждения нейронов. СГБ проявляется в виде бессимптомной флоры половых путей почти у 25% взрослых женщин, и инфицирование новорожденного обычно происходит во время родов, когда новорожденный подвергается воздействию бактерий в родовых путях.Инфекция GBS матери также вызывает преждевременный разрыв амниотической оболочки, ведущий к преждевременным родам. Распространение организма из влагалища в околоплодные воды во время беременности, когда плод может аспирировать зараженную жидкость, является еще одним механизмом, который может привести к инвазивному заболеванию или даже к внутриутробной смерти. Иммунитет у новорожденного неполный, и из-за пониженного количества альвеолярных макрофагов стрептококки группы B могут легко колонизировать легкие. Оттуда они могут проникать в кровь и образовывать системную инфекцию.Точные механизмы того, как GBS попадает в кровоток из легких, еще не известны, хотя считается, что порообразующий токсин GBS β-гемолизин / цитолизин способствует инвазии эпителиальных клеток легких и проникновению через легочный барьер.
Инфекция новорожденного делится на два разных типа в зависимости от промежутка времени между рождением и развитием болезни. При раннем начале заболевания симптомы проявляются в течение первых 6 дней после рождения. Смертность от раннего начала заболевания составляет примерно 12%, и оно характеризуется высоким уровнем неврологических последствий, таких как потеря слуха, судороги и отклонения в развитии нервной системы или задержка выживания.При позднем начале болезни симптомы могут появиться через много недель после рождения, и основным проявлением является менингит. 6% смертность намного ниже, чем при раннем начале болезни; однако заболеваемость высока, выжившие страдают от неврологических осложнений, таких как слепота и глухота. СГБ также стал важным патогеном среди небеременных взрослых, в частности, пожилых людей и пациентов с хроническим основным заболеванием с клиническими проявлениями, включая бактериемию, пневмонию и инфекцию кожи или мягких тканей.Однако частота этих случаев не так высока, как у новорожденных.
Профилактика заболевания, вызываемого стрептококками группы B (GBS)
Основная проблема инфекций, вызываемых GBS, заключается в быстром и резком прогрессировании заболевания, которое невозможно вылечить с помощью антибиотиков. Поскольку колонизация матери является основным фактором риска инфекции новорожденных, и многие женщины детородного возраста были колонизированы GBS в области влагалища, каждая беременная женщина должна быть проверена на этот микроорганизм перед родами.С 1990-х годов лечение беременных женщин с положительным результатом теста на колонизацию СГБ с помощью профилактических антибиотиков было эффективным в снижении частоты ранних проявлений СГБ. Однако это лечение не предотвращает позднего начала заболевания СГБ, и опасения по поводу увеличения устойчивости к антибиотикам среди изолятов СГБ и риска для матери и новорожденного неблагоприятного воздействия на здоровье, вызванного антибиотиками, сделали желательной разработку альтернативы антибиотикам. терапия. Клинические исследования показали, что младенцы, матери которых имеют высокий титр антител против СГБ, редко инфицируются.Таким образом, вакцинация женщин детородного возраста для пассивной защиты новорожденных представляется многообещающей стратегией.
Вакцина GBS, способная индуцировать специфические антитела как в сыворотке, так и на поверхности слизистой оболочки, обеспечит два уровня защиты новорожденного. Во-первых, перенос материнских антител к GBS через плаценту обеспечит пассивный иммунитет к GBS, а во-вторых, предотвращение колонизации репродуктивного тракта защитит новорожденного от инфекции в утробе или во время родов.Поскольку капсула GBS является важным фактором вирулентности, были предприняты попытки использовать ее в качестве кандидата на вакцину. Основываясь на структуре полисахаридной капсулы, GBS делится на 10 различных серотипов, из которых серотипы Ia, Ib, II, III и V чаще всего участвуют в инвазивном заболевании. В глобальном масштабе серотип III является наиболее часто определяемым серотипом, составляя почти половину всех изолятов, за ним следуют серотипы Ia, V, Ib и II. Также были выделены нетипируемые штаммы, на которые приходится до 14% изолятов в США и Европе.
Антигенная вариация, существующая в капсульном полисахариде, усложнила попытки разработать вакцину на основе капсулы, поскольку вакцина, обеспечивающая защиту от одного серотипа, может не обеспечивать защиту от других серотипов. Кроме того, полисахарид слабо иммуногенен и не вызывает стойкого иммунитета. В попытке преодолеть эти проблемы была разработана трехвалентная полисахаридно-белковая конъюгированная вакцина, которая в настоящее время проходит испытания на людях.Эта вакцина включает полисахариды серотипов Ia, Ib и III, которые вместе вызывают большинство инвазивных заболеваний в раннем младенчестве. Конъюгирование полисахарида с белковым конъюгатом также помогает повысить иммуногенность и спровоцировать ответ В-клеток памяти. Тем не менее, идеальная вакцина против GBS могла бы обеспечить защиту, не зависящую от серотипа. По этой причине интерес сместился в сторону использования поверхностного белка в качестве кандидата на вакцину. Основными поверхностными белками GBS являются α- и β-антигены комплекса белков C.Из двух белков α потенциально более полезен в качестве компонента вакцины, поскольку присутствует примерно в 50% всех изолятов GBS по сравнению с только 10% для β. Совсем недавно был идентифицирован другой поверхностный белок, Rib. Rib экспрессируется почти на всех штаммах GBS серотипа III; следовательно, большинство штаммов GBS, не экспрессирующих α, экспрессируют Rib. Фактически, около 90% всех штаммов GBS, ответственных за инвазивное заболевание, экспрессируют либо Rib, либо α, что делает комбинацию этих белков потенциально полезной для вакцины GBS с широкой специфичностью.Компоненты пилюса также представляют интерес как потенциальные кандидаты в вакцины. Все протестированные изоляты GBS содержат по крайней мере один из трех геномных островков, кодирующих пилусы, которые являются высококонсервативными. Это означает, что вакцина, включающая компоненты пилуса, потенциально может обеспечить охват 99% изолятов. Sip, поверхностный белок с неизвестной функцией, также представляет интерес, поскольку он экспрессируется GBS всех серотипов и, следовательно, может также обеспечивать широкую защиту. На животных моделях было показано, что эти белки вызывают защитный иммунный ответ, что делает их многообещающими кандидатами в вакцины.Однако, несмотря на острую потребность в вакцине против СГБ, разработка все еще находится на начальной стадии.
Путь к вакцинам против стрептококка группы А: Дорожная карта технологий исследований и разработок Всемирной организации здравоохранения и предпочтительные характеристики продуктов | Клинические инфекционные болезни
Абстрактные
Группа A Streptococcus (GAS) инфекции приводят к значительному недооцененному бремени острых и хронических заболеваний во всем мире. Резолюция Всемирной ассамблеи здравоохранения 2018 г. призывает к более эффективному контролю и профилактике.Предоставление рекомендаций по глобальным потребностям в исследованиях в области здравоохранения является важным направлением деятельности Всемирной организации здравоохранения (ВОЗ), влияющим на приоритизацию инвестиций. Здесь обсуждаются роль, статус и направления исследований ГАЗ-вакцин. Кратко представленные характеристики продуктов, предпочитаемые ВОЗ, и дорожная карта технологий исследований и разработок, предлагают действенную основу для разработки вакцины для принятия нормативных и политических решений, ее доступности и использования. ГАЗ-вакцины следует рассматривать для глобальной профилактики ряда клинических проявлений и связанного с ними использования антибиотиков.Обсуждаются препятствия, связанные с разнообразием антигенов, проблемы безопасности и сложность определения эффективности вакцины против ревматической болезни сердца. Демонстрация эффективности вакцины против фарингита и кожных инфекций является ключевой стратегической целью на ближайшую перспективу. Необходимы инвестиции и совместные партнерства для диверсификации и продвижения кандидатов на вакцины.
Группа A Streptococcus (GAS, Streptococcus pyogenes ) вызывает широкий спектр острых и хронических клинических проявлений у людей.Инфекции, вызванные ГАЗ, и их неблагоприятные последствия, по оценкам, вызывают около 0,5 миллиона смертей в год во всех возрастных диапазонах, в основном среди молодых людей [1]. Тем не менее, ГАГ уделяется мало внимания в глобальных программах здравоохранения, а существующие средства профилактики недостаточны. В резолюции 2018 г. о ревматическом заболевании сердца (РБС), потенциальном осложнении инфекций, вызванных ГАЗ, Всемирная ассамблея здравоохранения подчеркнула интерес к вакцинам против ГАЗ в качестве дополнения к стратегиям борьбы [2].
Всемирная организация здравоохранения (ВОЗ) дает рекомендации по приоритетам научных исследований и разработок (НИОКР), чтобы обеспечить удовлетворение глобальных потребностей в области здравоохранения.Выражение приоритетных целей и мероприятий может повлиять на государственные и благотворительные инвестиции, особенно когда рыночные стимулы недостаточны для адекватного стимулирования участия частного сектора [3].
Отсутствие соответствующих животных моделей, высокое генетическое разнообразие антигенных мишеней, проблемы безопасности и отсутствие консенсуса по клиническим конечным точкам для установления доказательства концепции на сегодняшний день создают серьезные препятствия для прогресса в разработке вакцины против ГАЗ [4]. Неопределенные и / или недостаточные рыночные стимулы остаются препятствием для взаимодействия с частным сектором, что приводит к тому, что они полагаются на государственные и благотворительные инвестиции для подпитки и продвижения ассортимента вакцин против ГАЗ.После спонсируемого ВОЗ процесса консультаций по достижению консенсуса с участием экспертов из академических кругов, промышленности, финансовых органов, регулирующих органов и других государственных и общественных организаций здравоохранения были рассмотрены стратегические цели и подходы к устранению существующих препятствий. В ожидании требований к нормативным и политическим рекомендациям и для помощи в определении ценностного предложения для разрабатываемых вакцин были предложены предпочтительные характеристики продукта ВОЗ (PPC, предшественник на ранней стадии разработки профилей целевых продуктов для конкретных классов или продуктов) [5] и представлен план развития технологий исследований и разработок [5], который кратко приводится здесь (Таблицы 1 и 2).
Таблица 1. Приоритетные мероприятия
, изложенные в дорожной карте технологии разработки вакцин для группы A Streptococcus Вакцины
| Ключевые стратегические области | Предлагаемые приоритетные мероприятия |
| Исследования | Улучшить глобальные оценки бремени болезней и улучшить глобальные оценки бремени болезней эпидемиология ГАЗ-инфекций |
| Дальнейшее описание спектра естественных заболеваний в анамнезе | |
| Стимулирование улучшенного понимания ГАЗ-связанных вторичных иммуноопосредованных заболеваний | |
| Определить последствия ГАЗ-связанных использования антибиотиков и оценить влияние использования вакцины на использование антибиотиков и заболеваемость и смертность, связанные с устойчивостью к противомикробным препаратам | |
| Разработка вакцины | Продолжить усилия по открытию антигена, увеличивая количество потенциальных вакцин на стадии разработки | Разработать согласованное руководство по надлежащему использованию инструментов мониторинга безопасности в испытаниях вакцин-кандидатов |
| Охарактеризовать иммунологические суррогаты / корреляты защиты | |
| Определить соответствующий основной дизайн клинических испытаний, адаптированный к краткосрочным и краткосрочным исследованиям. долгосрочные стратегические цели | |
| Ключевые возможности | Определить подходящее использование имеющихся и будущих моделей животных для оценки безопасности и эффективности ГАЗ-вакцины в соответствии с их актуальностью для реакции человека |
| Разработка клинически релевантной экспериментальной модели инфекции человеческого ГАЗ (s) для поддержки ранней проверки концепции вакцины | |
| Создание экспертных исследовательских центров ГАЗ в СНСД с потенциалом для проведения исследований в области надлежащей клинической практики и соответствующим нормативным и этическим надзором; установить исходные показатели эффективности и безопасности | |
| Доступ к производству недорогих вакцин в соответствии с действующей надлежащей производственной практикой для поздних стадий разработки и коммерческого производства | |
| Разработка стандартизированных платформ иммуноанализа, отвечающих требованиям качества | |
| Политика, коммерциализация и реализация | Обеспечение рентабельности и разработка сценария (ов) финансовых вложений в исследования и реализацию для поддержки соответствующего финансирования и принятия политических решений на глобальном и национальном уровнях с учетом всего объема затрат и выгод |
| Обеспечить наличие, доступность и приемлемость функциональной и рентабельной платформы для проведения иммунизации | |
| Разработка платформ бдительности эффективности и безопасности для постимплементационного надзора |
| Ключевые стратегические направления | Предлагаемые приоритетные направления деятельности |
| Исследования | Улучшить глобальные оценки бремени болезней и лучше охарактеризовать эпидемиологию инфекций ГАЗ |
| Дальнейшее описание спектра естественных болезней | |
| Способствовать лучшему пониманию связанных с ГАЗ вторичных иммуноопосредованных заболеваний | |
| Определить последствия использования антибиотиков, связанных с ГАЗ, и оценить влияние использования вакцины на использование антибиотиков, а также на заболеваемость и смертность, связанные с устойчивостью к противомикробным препаратам | |
| Разработка вакцины | Продолжать усилия по открытию антигена, увеличивая количество потенциальных вакцин на стадии разработки |
| Разработать согласованное руководство по надлежащему использованию инструментов мониторинга безопасности в испытаниях вакцин-кандидатов | |
| Охарактеризуйте иммунологические суррогаты / корреляты защиты | |
| Определите соответствующий план основного клинического исследования, адаптированный к краткосрочным и долгосрочным стратегическим целям | |
| Ключевые возможности | Определите надлежащее использование имеющихся и будущих животных модели для оценки безопасности и эффективности вакцины GAS в соответствии с их релевантностью для реакции человека |
| Разработка клинически значимых экспериментальных моделей инфекции GAS человека для поддержки ранней проверки концепции вакцины | |
| Установить GAS экспертные исследовательские центры в СНСУД, обладающие потенциалом для проведения исследований в области надлежащей клинической практики и надлежащим нормативным и этическим надзором; установить исходные показатели эффективности и безопасности | |
| Доступ к производству недорогих вакцин в соответствии с действующей надлежащей производственной практикой для поздних стадий разработки и коммерческого производства | |
| Разработка стандартизированных платформ иммуноанализа, отвечающих требованиям качества | |
| Политика, коммерциализация и реализация | Обеспечение рентабельности и разработка сценария (ов) финансовых вложений в исследования и реализацию для поддержки соответствующего финансирования и принятия политических решений на глобальном и национальном уровнях с учетом всего объема затрат и выгод |
| Обеспечить наличие, доступность и приемлемость функциональной и рентабельной платформы для проведения иммунизации | |
| Разработать платформы бдительности эффективности и безопасности для постимплементационного надзора |
Таблица 1.
Приоритетные мероприятия, изложенные в Дорожной карте технологии разработки вакцин для группы А Streptococcus Вакцины
| Ключевые стратегические области | Предлагаемые приоритетные мероприятия |
| Исследования | Улучшить глобальные оценки бремени эпидемии и улучшить характер Инфекции ГАЗ |
| Далее описать спектр естественных заболеваний в анамнезе | |
| Способствовать лучшему пониманию связанных с ГАЗ вторичных иммуноопосредованных заболеваний | |
| Определить последствия использования антибиотиков, связанных с ГАЗ, и оценить влияние использования вакцины на использование антибиотиков, а также на заболеваемость и смертность, связанные с устойчивостью к противомикробным препаратам | |
| Разработка вакцины | Продолжить усилия по открытию антигена, увеличивая количество потенциальных вакцин на стадии разработки |
| Разработать согласованное руководство по надлежащему использованию инструментов мониторинга безопасности в испытаниях вакцин-кандидатов | |
| Охарактеризовать иммунологические суррогаты / корреляты защиты | |
| Определить соответствующий основной дизайн клинического исследования, адаптированный к краткосрочным и долгосрочным -срочные стратегические цели | |
| Ключевые возможности | Определить подходящее использование имеющихся и будущих моделей животных для оценки безопасности и эффективности ГАЗ-вакцины в соответствии с их актуальностью для реакции человека |
| Разработать клинически значимую экспериментальную модель инфекции ГАЗ человека ( s) для поддержки ранней проверки концепции вакцины | |
| Создание экспертных исследовательских центров ГАЗ в СНСУД с возможностями проведения исследований в области надлежащей клинической практики и соответствующим нормативным и этическим надзором; установить исходные показатели эффективности и безопасности | |
| Доступ к производству недорогих вакцин в соответствии с действующей надлежащей производственной практикой для поздних стадий разработки и коммерческого производства | |
| Разработка стандартизированных платформ иммуноанализа, отвечающих требованиям качества | |
| Политика, коммерциализация и реализация | Обеспечение рентабельности и разработка сценария (ов) финансовых вложений в исследования и реализацию для поддержки соответствующего финансирования и принятия политических решений на глобальном и национальном уровнях с учетом всего объема затрат и выгод |
| Обеспечить наличие, доступность и приемлемость функциональной и рентабельной платформы для проведения иммунизации | |
| Разработать платформы бдительности эффективности и безопасности для постимплементационного надзора |
| Ключевые стратегические направления | Предлагаемые приоритетные направления деятельности |
| Исследования | Улучшить глобальные оценки бремени болезней и лучше охарактеризовать эпидемиологию инфекций ГАЗ |
| Дальнейшее описание спектра естественных болезней | |
| Способствовать лучшему пониманию связанных с ГАЗ вторичных иммуноопосредованных заболеваний | |
| Определить последствия использования антибиотиков, связанных с ГАЗ, и оценить влияние использования вакцины на использование антибиотиков, а также на заболеваемость и смертность, связанные с устойчивостью к противомикробным препаратам | |
| Разработка вакцины | Продолжать усилия по открытию антигена, увеличивая количество потенциальных вакцин на стадии разработки |
| Разработать согласованное руководство по надлежащему использованию инструментов мониторинга безопасности в испытаниях вакцин-кандидатов | |
| Охарактеризуйте иммунологические суррогаты / корреляты защиты | |
| Определите соответствующий план основного клинического исследования, адаптированный к краткосрочным и долгосрочным стратегическим целям | |
| Ключевые возможности | Определите надлежащее использование имеющихся и будущих животных модели для оценки безопасности и эффективности вакцины GAS в соответствии с их релевантностью для реакции человека |
| Разработка клинически значимых экспериментальных моделей инфекции GAS человека для поддержки ранней проверки концепции вакцины | |
| Установить GAS экспертные исследовательские центры в СНСУД, обладающие потенциалом для проведения исследований в области надлежащей клинической практики и надлежащим нормативным и этическим надзором; установить исходные показатели эффективности и безопасности | |
| Доступ к производству недорогих вакцин в соответствии с действующей надлежащей производственной практикой для поздних стадий разработки и коммерческого производства | |
| Разработка стандартизированных платформ иммуноанализа, отвечающих требованиям качества | |
| Политика, коммерциализация и реализация | Обеспечение рентабельности и разработка сценария (ов) финансовых вложений в исследования и реализацию для поддержки соответствующего финансирования и принятия политических решений на глобальном и национальном уровнях с учетом всего объема затрат и выгод |
| Обеспечить наличие, доступность и приемлемость функциональной и рентабельной платформы для проведения иммунизации | |
| Разработать платформы бдительности эффективности и безопасности для постимплементационного надзора |
Таблица 2.
Предпочтительные характеристики продукта для группы A Streptococcus Вакцины
| Параметр | Предпочтительные характеристики |
| Показание | Профилактика ГАЗ-ассоциированного фарингита, поверхностных кожных инфекций и целлюлита использование антибиотиков, вторичная ревматическая лихорадка, ревматическая болезнь сердца и постстрептококковый гломерулонефрит |
| Примечания: Профилактика фарингита и кожных инфекций будет актуальной и выполнимой целью ранней разработки вакцины.Дополнительные сведения об оценке эффективности см. В разделе «Эффективность». | |
| Целевая группа для первичной иммунизации | Первичный график: младенцы и / или дети младшего возраста. |
| Примечания: Необходимы дополнительные доказательства для определения оптимального возраста вакцинации в соответствии с эпидемиологическими условиями, а также того, будет ли вакцинация GAS наиболее целесообразно вводиться в раннем младенчестве или потребовать более поздних доз для раннего детства и поздних бустерных доз . Исследования должны определить роль первичной иммунизации в следующих особых обстоятельствах: • Вторичная профилактика у субъектов с повышенным риском RHD • Иммунизация взрослых с повышенным риском целлюлита или тяжелых инвазивных заболеваний, таких как пожилые люди и люди с диабетом, ожирением , или другие иммунодепрессивные состояния • Женщины, включая беременных, для профилактики послеродового и неонатального сепсиса • Кампании иммунизации для прекращения вспышек заболеваний, связанных с ГАЗ | |
| График первичной иммунизации и повторной иммунизации | Не более 3 доз требуется для первичной иммунизации. |
| Примечания: Исследования должны определить необходимое количество доз и график первичной иммунизации, а также требования к бустерным дозам. Можно предложить повышение в школьном возрасте, молодом возрасте и / или беременности и старости. Учитывая возрастное распределение бремени болезни, может потребоваться и приемлемо несколько бустерных доз. | |
| Целевые показатели эффективности | Предпочтения целевой эффективности различаются в зависимости от тяжести синдрома целевого заболевания: • 80% защита от нетяжелого, неинвазивного подтвержденного ГАЗ-заболевания • 70% защита от подтвержденного ГАЗ-целлюлита и других инвазивных инфекций • 50% защита от долгосрочных иммуноопосредованных последствий |
| Примечания: Нижние пределы приемлемой эффективности вакцины здесь не определены.С учетом возрастного распределения риска заболевания требуется долгосрочная защита. Предпочтительный минимальный срок наблюдения для оценки эффективности составляет 2 года. Должны быть определены соответствующие определения случаев конечной точки эффективности и методологии установления для испытаний вакцин. Предпочтительные пороги эффективности для более тяжелых исходов ниже, чем для менее тяжелых из-за общественной и индивидуальной оценки ценности. Следует разработать стратегию, включающую заранее определенные критерии стадии-выхода, с целью минимизировать риск и ускорить разработку вакцины, а также способствовать ответственным инвестициям в исследования: • Наличие клинически релевантной экспериментальной модели инфекции человека может оказаться ценным. • Раннее подтверждение концепции с упором на более частые и менее тяжелые конечные точки (с фарингитом и кожной инфекцией в качестве приоритета) должно установить потенциальный защитный профиль. • Эффективность вакцины против целлюлита и других инвазивных инфекций потребует большего размера выборки. • Влияние на долгосрочные, менее частые и тяжелые осложнения может потребоваться оценить в ходе пилотных исследований или исследований после получения лицензии. Следует охарактеризовать влияние вакцины на носительство и передачу инфекции. | |
| Охват штамма и серотипа | Целевые показатели эффективности устанавливаются независимо от соображений штамма / серотипа. Состав вакцины должен гарантировать, что подавляющее большинство (предпочтение не менее 90%) существующих болезнетворных изолятов из региона, намеченного для использования, предотвращено. |
| Примечания: Следует охарактеризовать роль изменений во времени и возможность замещения бактериальной популяции. Необходимы дальнейшие исследования для определения роли иммуноанализов в определении специфичности защиты по штамму / серотипу. | |
| Безопасность | Профиль безопасности и реактогенности, по крайней мере, такой же благоприятный, как текущие стандартные вакцины, рекомендованные ВОЗ. |
| Примечания: Как минимум, стандартный план мониторинга безопасности должен быть реализован в рамках усилий по клинической разработке. Соответствующее использование дополнительных инструментов мониторинга безопасности, включая тестирование иммунной реактивности человеческого антигена и эхокардиографию, должно быть заранее определено с учетом риска получения неспецифических, случайных результатов, особенно если запланированы множественные сравнения. Интенсивность исследований безопасности должна соответствовать количеству собранных доказательств профиля безопасности. Представляющие интерес конечные точки безопасности должны быть определены протоколом и подтверждены анализом размера выборки. | |
| Требование к адъюванту | Должны быть получены доказательства, оправдывающие включение адъюванта в состав. |
| Примечания: Адъюванты с установленными благоприятными профилями безопасности предпочтительнее новых адъювантов. | |
| Иммуногенность | Установленный коррелят / суррогат защиты на основе валидированного анализа, измеряющего уровни / функциональность иммунных эффекторов. |
| Примечания: Продолжительность иммунного ответа должна быть охарактеризована, и должна быть исследована связь с продолжительностью защиты. Совместные усилия по созданию соответствующих доклинических анализов с использованием эталонных реагентов с открытым исходным кодом (включая иммунные сыворотки) с международными стандартами качества могут в значительной степени способствовать оценке сопоставимости, выработке нормативно приемлемого коррелята защиты, в конечном итоге поддерживая этапы создания иммунных мостиков и клиническую разработку упрощение плана и ускорение процесса получения лицензий.Признается роль справочных лабораторий. | |
| Невмешательство | Демонстрация благоприятной безопасности и иммунологического невмешательства при совместном введении с другими рекомендованными вакцинами, если они используются в той же целевой популяции. |
| Способ введения | Для инъекций (в / м или п / к) с использованием стандартных объемов для инъекций, как указано в программной пригодности для ПК или безыгольной доставки. |
| Примечания: Следует учитывать роль безболезненной доставки через слизистую оболочку через глотку или носоглотку, а также доставки через кожу.Предпочтение IM или SC вместо ID. | |
| Регистрация, преквалификация и программная пригодность | Вакцина должна быть преквалифицирована в соответствии с процедурой, описанной в Процедурах оценки принципиальной приемлемости вакцин для закупки учреждениями Организации Объединенных Наций. Должны соблюдаться определенные ВОЗ критерии программной пригодности вакцин. |
| Ценностное предложение | Дозировка, режим и стоимость товаров, поставляемых по доступной цене.Вакцина должна быть рентабельной, а цена не должна быть препятствием для доступа, в том числе в странах с низким и средним уровнем дохода. |
| Примечания: Сокращение использования антибиотиков в повседневной практике имело бы большую добавленную стоимость. Влияние вакцины на системы здравоохранения, экономическое воздействие и другие аспекты науки о внедрении следует оценивать в крупных испытаниях, до или после утверждения, насколько это возможно. |
| Параметр | Предпочтительные характеристики |
| Показание | Профилактика ГАЗ-ассоциированного фарингита, поверхностных кожных инфекций, целлюлита, токсин-опосредованных заболеваний, инвазивных инфекций, вторичных ревматических инфекций и ассоциированного ревматизма. сердечно-сосудистые заболевания и постстрептококковый гломерулонефрит |
| Примечания: Профилактика фарингита и кожных инфекций будет актуальной и выполнимой целью ранней разработки вакцины.Дополнительные сведения об оценке эффективности см. В разделе «Эффективность». | |
| Целевая группа для первичной иммунизации | Первичный график: младенцы и / или дети младшего возраста. |
| Примечания: Необходимы дополнительные доказательства для определения оптимального возраста вакцинации в соответствии с эпидемиологическими условиями, а также того, будет ли вакцинация GAS наиболее целесообразно вводиться в раннем младенчестве или потребовать более поздних доз для раннего детства и поздних бустерных доз . Исследования должны определить роль первичной иммунизации в следующих особых обстоятельствах: • Вторичная профилактика у субъектов с повышенным риском RHD • Иммунизация взрослых с повышенным риском целлюлита или тяжелых инвазивных заболеваний, таких как пожилые люди и люди с диабетом, ожирением , или другие иммунодепрессивные состояния • Женщины, включая беременных, для профилактики послеродового и неонатального сепсиса • Кампании иммунизации для прекращения вспышек заболеваний, связанных с ГАЗ | |
| График первичной иммунизации и повторной иммунизации | Не более 3 доз требуется для первичной иммунизации. |
| Примечания: Исследования должны определить необходимое количество доз и график первичной иммунизации, а также требования к бустерным дозам. Можно предложить повышение в школьном возрасте, молодом возрасте и / или беременности и старости. Учитывая возрастное распределение бремени болезни, может потребоваться и приемлемо несколько бустерных доз. | |
| Целевые показатели эффективности | Предпочтения целевой эффективности различаются в зависимости от тяжести синдрома целевого заболевания: • 80% защита от нетяжелого, неинвазивного подтвержденного ГАЗ-заболевания • 70% защита от подтвержденного ГАЗ-целлюлита и других инвазивных инфекций • 50% защита от долгосрочных иммуноопосредованных последствий |
| Примечания: Нижние пределы приемлемой эффективности вакцины здесь не определены.С учетом возрастного распределения риска заболевания требуется долгосрочная защита. Предпочтительный минимальный срок наблюдения для оценки эффективности составляет 2 года. Должны быть определены соответствующие определения случаев конечной точки эффективности и методологии установления для испытаний вакцин. Предпочтительные пороги эффективности для более тяжелых исходов ниже, чем для менее тяжелых из-за общественной и индивидуальной оценки ценности. Следует разработать стратегию, включающую заранее определенные критерии стадии-выхода, с целью минимизировать риск и ускорить разработку вакцины, а также способствовать ответственным инвестициям в исследования: • Наличие клинически релевантной экспериментальной модели инфекции человека может оказаться ценным. • Раннее подтверждение концепции с упором на более частые и менее тяжелые конечные точки (с фарингитом и кожной инфекцией в качестве приоритета) должно установить потенциальный защитный профиль. • Эффективность вакцины против целлюлита и других инвазивных инфекций потребует большего размера выборки. • Влияние на долгосрочные, менее частые и тяжелые осложнения может потребоваться оценить в ходе пилотных исследований или исследований после получения лицензии. Следует охарактеризовать влияние вакцины на носительство и передачу инфекции. | |
| Охват штамма и серотипа | Целевые показатели эффективности устанавливаются независимо от соображений штамма / серотипа. Состав вакцины должен гарантировать, что подавляющее большинство (предпочтение не менее 90%) существующих болезнетворных изолятов из региона, намеченного для использования, предотвращено. |
| Примечания: Следует охарактеризовать роль изменений во времени и возможность замещения бактериальной популяции. Необходимы дальнейшие исследования для определения роли иммуноанализов в определении специфичности защиты по штамму / серотипу. | |
| Безопасность | Профиль безопасности и реактогенности, по крайней мере, такой же благоприятный, как текущие стандартные вакцины, рекомендованные ВОЗ. |
| Примечания: Как минимум, стандартный план мониторинга безопасности должен быть реализован в рамках усилий по клинической разработке. Соответствующее использование дополнительных инструментов мониторинга безопасности, включая тестирование иммунной реактивности человеческого антигена и эхокардиографию, должно быть заранее определено с учетом риска получения неспецифических, случайных результатов, особенно если запланированы множественные сравнения. Интенсивность исследований безопасности должна соответствовать количеству собранных доказательств профиля безопасности. Представляющие интерес конечные точки безопасности должны быть определены протоколом и подтверждены анализом размера выборки. | |
| Требование к адъюванту | Должны быть получены доказательства, оправдывающие включение адъюванта в состав. |
| Примечания: Адъюванты с установленными благоприятными профилями безопасности предпочтительнее новых адъювантов. | |
| Иммуногенность | Установленный коррелят / суррогат защиты на основе валидированного анализа, измеряющего уровни / функциональность иммунных эффекторов. |
| Примечания: Продолжительность иммунного ответа должна быть охарактеризована, и должна быть исследована связь с продолжительностью защиты. Совместные усилия по созданию соответствующих доклинических анализов с использованием эталонных реагентов с открытым исходным кодом (включая иммунные сыворотки) с международными стандартами качества могут в значительной степени способствовать оценке сопоставимости, выработке нормативно приемлемого коррелята защиты, в конечном итоге поддерживая этапы создания иммунных мостиков и клиническую разработку упрощение плана и ускорение процесса получения лицензий.Признается роль справочных лабораторий. | |
| Невмешательство | Демонстрация благоприятной безопасности и иммунологического невмешательства при совместном введении с другими рекомендованными вакцинами, если они используются в той же целевой популяции. |
| Способ введения | Для инъекций (в / м или п / к) с использованием стандартных объемов для инъекций, как указано в программной пригодности для ПК или безыгольной доставки. |
| Примечания: Следует учитывать роль безболезненной доставки через слизистую оболочку через глотку или носоглотку, а также доставки через кожу.Предпочтение IM или SC вместо ID. | |
| Регистрация, преквалификация и программная пригодность | Вакцина должна быть преквалифицирована в соответствии с процедурой, описанной в Процедурах оценки принципиальной приемлемости вакцин для закупки учреждениями Организации Объединенных Наций. Должны соблюдаться определенные ВОЗ критерии программной пригодности вакцин. |
| Ценностное предложение | Дозировка, режим и стоимость товаров, поставляемых по доступной цене.Вакцина должна быть рентабельной, а цена не должна быть препятствием для доступа, в том числе в странах с низким и средним уровнем дохода. |
| Примечания: Сокращение использования антибиотиков в повседневной практике имело бы большую добавленную стоимость. Влияние вакцины на системы здравоохранения, экономическое воздействие и другие аспекты науки о внедрении следует оценивать в крупных испытаниях, до или после утверждения, насколько это возможно. |
Таблица 2.
Предпочтительные характеристики продукта для группы A Streptococcus Вакцины
| Параметр | Предпочтительные характеристики |
| Показания | Профилактика кожных инфекций, связанных с GAS, фарингит, поверхностный фарингит опосредованное заболевание, инвазивные инфекции и связанное с ними использование антибиотиков, вторичная ревматическая лихорадка, ревматическая болезнь сердца и постстрептококковый гломерулонефрит |
| Примечания: Профилактика фарингита и кожных инфекций является актуальными и выполнимыми целями ранней разработки вакцины.Дополнительные сведения об оценке эффективности см. В разделе «Эффективность». | |
| Целевая группа для первичной иммунизации | Первичный график: младенцы и / или дети младшего возраста. |
| Примечания: Необходимы дополнительные доказательства для определения оптимального возраста вакцинации в соответствии с эпидемиологическими условиями, а также того, будет ли вакцинация GAS наиболее целесообразно вводиться в раннем младенчестве или потребовать более поздних доз для раннего детства и поздних бустерных доз . Исследования должны определить роль первичной иммунизации в следующих особых обстоятельствах: • Вторичная профилактика у субъектов с повышенным риском RHD • Иммунизация взрослых с повышенным риском целлюлита или тяжелых инвазивных заболеваний, таких как пожилые люди и люди с диабетом, ожирением , или другие иммунодепрессивные состояния • Женщины, включая беременных, для профилактики послеродового и неонатального сепсиса • Кампании иммунизации для прекращения вспышек заболеваний, связанных с ГАЗ | |
| График первичной иммунизации и повторной иммунизации | Не более 3 доз требуется для первичной иммунизации. |
| Примечания: Исследования должны определить необходимое количество доз и график первичной иммунизации, а также требования к бустерным дозам. Можно предложить повышение в школьном возрасте, молодом возрасте и / или беременности и старости. Учитывая возрастное распределение бремени болезни, может потребоваться и приемлемо несколько бустерных доз. | |
| Целевые показатели эффективности | Предпочтения целевой эффективности различаются в зависимости от тяжести синдрома целевого заболевания: • 80% защита от нетяжелого, неинвазивного подтвержденного ГАЗ-заболевания • 70% защита от подтвержденного ГАЗ-целлюлита и других инвазивных инфекций • 50% защита от долгосрочных иммуноопосредованных последствий |
| Примечания: Нижние пределы приемлемой эффективности вакцины здесь не определены.С учетом возрастного распределения риска заболевания требуется долгосрочная защита. Предпочтительный минимальный срок наблюдения для оценки эффективности составляет 2 года. Должны быть определены соответствующие определения случаев конечной точки эффективности и методологии установления для испытаний вакцин. Предпочтительные пороги эффективности для более тяжелых исходов ниже, чем для менее тяжелых из-за общественной и индивидуальной оценки ценности. Следует разработать стратегию, включающую заранее определенные критерии стадии-выхода, с целью минимизировать риск и ускорить разработку вакцины, а также способствовать ответственным инвестициям в исследования: • Наличие клинически релевантной экспериментальной модели инфекции человека может оказаться ценным. • Раннее подтверждение концепции с упором на более частые и менее тяжелые конечные точки (с фарингитом и кожной инфекцией в качестве приоритета) должно установить потенциальный защитный профиль. • Эффективность вакцины против целлюлита и других инвазивных инфекций потребует большего размера выборки. • Влияние на долгосрочные, менее частые и тяжелые осложнения может потребоваться оценить в ходе пилотных исследований или исследований после получения лицензии. Следует охарактеризовать влияние вакцины на носительство и передачу инфекции. | |
| Охват штамма и серотипа | Целевые показатели эффективности устанавливаются независимо от соображений штамма / серотипа. Состав вакцины должен гарантировать, что подавляющее большинство (предпочтение не менее 90%) существующих болезнетворных изолятов из региона, намеченного для использования, предотвращено. |
| Примечания: Следует охарактеризовать роль изменений во времени и возможность замещения бактериальной популяции. Необходимы дальнейшие исследования для определения роли иммуноанализов в определении специфичности защиты по штамму / серотипу. | |
| Безопасность | Профиль безопасности и реактогенности, по крайней мере, такой же благоприятный, как текущие стандартные вакцины, рекомендованные ВОЗ. |
| Примечания: Как минимум, стандартный план мониторинга безопасности должен быть реализован в рамках усилий по клинической разработке. Соответствующее использование дополнительных инструментов мониторинга безопасности, включая тестирование иммунной реактивности человеческого антигена и эхокардиографию, должно быть заранее определено с учетом риска получения неспецифических, случайных результатов, особенно если запланированы множественные сравнения. Интенсивность исследований безопасности должна соответствовать количеству собранных доказательств профиля безопасности. Представляющие интерес конечные точки безопасности должны быть определены протоколом и подтверждены анализом размера выборки. | |
| Требование к адъюванту | Должны быть получены доказательства, оправдывающие включение адъюванта в состав. |
| Примечания: Адъюванты с установленными благоприятными профилями безопасности предпочтительнее новых адъювантов. | |
| Иммуногенность | Установленный коррелят / суррогат защиты на основе валидированного анализа, измеряющего уровни / функциональность иммунных эффекторов. |
| Примечания: Продолжительность иммунного ответа должна быть охарактеризована, и должна быть исследована связь с продолжительностью защиты. Совместные усилия по созданию соответствующих доклинических анализов с использованием эталонных реагентов с открытым исходным кодом (включая иммунные сыворотки) с международными стандартами качества могут в значительной степени способствовать оценке сопоставимости, выработке нормативно приемлемого коррелята защиты, в конечном итоге поддерживая этапы создания иммунных мостиков и клиническую разработку упрощение плана и ускорение процесса получения лицензий.Признается роль справочных лабораторий. | |
| Невмешательство | Демонстрация благоприятной безопасности и иммунологического невмешательства при совместном введении с другими рекомендованными вакцинами, если они используются в той же целевой популяции. |
| Способ введения | Для инъекций (в / м или п / к) с использованием стандартных объемов для инъекций, как указано в программной пригодности для ПК или безыгольной доставки. |
| Примечания: Следует учитывать роль безболезненной доставки через слизистую оболочку через глотку или носоглотку, а также доставки через кожу.Предпочтение IM или SC вместо ID. | |
| Регистрация, преквалификация и программная пригодность | Вакцина должна быть преквалифицирована в соответствии с процедурой, описанной в Процедурах оценки принципиальной приемлемости вакцин для закупки учреждениями Организации Объединенных Наций. Должны соблюдаться определенные ВОЗ критерии программной пригодности вакцин. |
| Ценностное предложение | Дозировка, режим и стоимость товаров, поставляемых по доступной цене.Вакцина должна быть рентабельной, а цена не должна быть препятствием для доступа, в том числе в странах с низким и средним уровнем дохода. |
| Примечания: Сокращение использования антибиотиков в повседневной практике имело бы большую добавленную стоимость. Влияние вакцины на системы здравоохранения, экономическое воздействие и другие аспекты науки о внедрении следует оценивать в крупных испытаниях, до или после утверждения, насколько это возможно. |
| Параметр | Предпочтительные характеристики |
| Показание | Профилактика ГАЗ-ассоциированного фарингита, поверхностных кожных инфекций, целлюлита, токсин-опосредованных заболеваний, инвазивных инфекций, вторичных ревматических инфекций и ассоциированного ревматизма. сердечно-сосудистые заболевания и постстрептококковый гломерулонефрит |
| Примечания: Профилактика фарингита и кожных инфекций будет актуальной и выполнимой целью ранней разработки вакцины.Дополнительные сведения об оценке эффективности см. В разделе «Эффективность». | |
| Целевая группа для первичной иммунизации | Первичный график: младенцы и / или дети младшего возраста. |
| Примечания: Необходимы дополнительные доказательства для определения оптимального возраста вакцинации в соответствии с эпидемиологическими условиями, а также того, будет ли вакцинация GAS наиболее целесообразно вводиться в раннем младенчестве или потребовать более поздних доз для раннего детства и поздних бустерных доз . Исследования должны определить роль первичной иммунизации в следующих особых обстоятельствах: • Вторичная профилактика у субъектов с повышенным риском RHD • Иммунизация взрослых с повышенным риском целлюлита или тяжелых инвазивных заболеваний, таких как пожилые люди и люди с диабетом, ожирением , или другие иммунодепрессивные состояния • Женщины, включая беременных, для профилактики послеродового и неонатального сепсиса • Кампании иммунизации для прекращения вспышек заболеваний, связанных с ГАЗ | |
| График первичной иммунизации и повторной иммунизации | Не более 3 доз требуется для первичной иммунизации. |
| Примечания: Исследования должны определить необходимое количество доз и график первичной иммунизации, а также требования к бустерным дозам. Можно предложить повышение в школьном возрасте, молодом возрасте и / или беременности и старости. Учитывая возрастное распределение бремени болезни, может потребоваться и приемлемо несколько бустерных доз. | |
| Целевые показатели эффективности | Предпочтения целевой эффективности различаются в зависимости от тяжести синдрома целевого заболевания: • 80% защита от нетяжелого, неинвазивного подтвержденного ГАЗ-заболевания • 70% защита от подтвержденного ГАЗ-целлюлита и других инвазивных инфекций • 50% защита от долгосрочных иммуноопосредованных последствий |
| Примечания: Нижние пределы приемлемой эффективности вакцины здесь не определены.С учетом возрастного распределения риска заболевания требуется долгосрочная защита. Предпочтительный минимальный срок наблюдения для оценки эффективности составляет 2 года. Должны быть определены соответствующие определения случаев конечной точки эффективности и методологии установления для испытаний вакцин. Предпочтительные пороги эффективности для более тяжелых исходов ниже, чем для менее тяжелых из-за общественной и индивидуальной оценки ценности. Следует разработать стратегию, включающую заранее определенные критерии стадии-выхода, с целью минимизировать риск и ускорить разработку вакцины, а также способствовать ответственным инвестициям в исследования: • Наличие клинически релевантной экспериментальной модели инфекции человека может оказаться ценным. • Раннее подтверждение концепции с упором на более частые и менее тяжелые конечные точки (с фарингитом и кожной инфекцией в качестве приоритета) должно установить потенциальный защитный профиль. • Эффективность вакцины против целлюлита и других инвазивных инфекций потребует большего размера выборки. • Влияние на долгосрочные, менее частые и тяжелые осложнения может потребоваться оценить в ходе пилотных исследований или исследований после получения лицензии. Следует охарактеризовать влияние вакцины на носительство и передачу инфекции. | |
| Охват штамма и серотипа | Целевые показатели эффективности устанавливаются независимо от соображений штамма / серотипа. Состав вакцины должен гарантировать, что подавляющее большинство (предпочтение не менее 90%) существующих болезнетворных изолятов из региона, намеченного для использования, предотвращено. |
| Примечания: Следует охарактеризовать роль изменений во времени и возможность замещения бактериальной популяции. Необходимы дальнейшие исследования для определения роли иммуноанализов в определении специфичности защиты по штамму / серотипу. | |
| Безопасность | Профиль безопасности и реактогенности, по крайней мере, такой же благоприятный, как текущие стандартные вакцины, рекомендованные ВОЗ. |
| Примечания: Как минимум, стандартный план мониторинга безопасности должен быть реализован в рамках усилий по клинической разработке. Соответствующее использование дополнительных инструментов мониторинга безопасности, включая тестирование иммунной реактивности человеческого антигена и эхокардиографию, должно быть заранее определено с учетом риска получения неспецифических, случайных результатов, особенно если запланированы множественные сравнения. Интенсивность исследований безопасности должна соответствовать количеству собранных доказательств профиля безопасности. Представляющие интерес конечные точки безопасности должны быть определены протоколом и подтверждены анализом размера выборки. | |
| Требование к адъюванту | Должны быть получены доказательства, оправдывающие включение адъюванта в состав. |
| Примечания: Адъюванты с установленными благоприятными профилями безопасности предпочтительнее новых адъювантов. | |
| Иммуногенность | Установленный коррелят / суррогат защиты на основе валидированного анализа, измеряющего уровни / функциональность иммунных эффекторов. |
| Примечания: Продолжительность иммунного ответа должна быть охарактеризована, и должна быть исследована связь с продолжительностью защиты. Совместные усилия по созданию соответствующих доклинических анализов с использованием эталонных реагентов с открытым исходным кодом (включая иммунные сыворотки) с международными стандартами качества могут в значительной степени способствовать оценке сопоставимости, выработке нормативно приемлемого коррелята защиты, в конечном итоге поддерживая этапы создания иммунных мостиков и клиническую разработку упрощение плана и ускорение процесса получения лицензий.Признается роль справочных лабораторий. | |
| Невмешательство | Демонстрация благоприятной безопасности и иммунологического невмешательства при совместном введении с другими рекомендованными вакцинами, если они используются в той же целевой популяции. |
| Способ введения | Для инъекций (в / м или п / к) с использованием стандартных объемов для инъекций, как указано в программной пригодности для ПК или безыгольной доставки. |
| Примечания: Следует учитывать роль безболезненной доставки через слизистую оболочку через глотку или носоглотку, а также доставки через кожу.Предпочтение IM или SC вместо ID. | |
| Регистрация, преквалификация и программная пригодность | Вакцина должна быть преквалифицирована в соответствии с процедурой, описанной в Процедурах оценки принципиальной приемлемости вакцин для закупки учреждениями Организации Объединенных Наций. Должны соблюдаться определенные ВОЗ критерии программной пригодности вакцин. |
| Ценностное предложение | Дозировка, режим и стоимость товаров, поставляемых по доступной цене.Вакцина должна быть рентабельной, а цена не должна быть препятствием для доступа, в том числе в странах с низким и средним уровнем дохода. |
| Примечания: Сокращение использования антибиотиков в повседневной практике имело бы большую добавленную стоимость. Влияние вакцины на системы здравоохранения, экономическое воздействие и другие аспекты науки о внедрении следует оценивать в крупных испытаниях, до или после утверждения, насколько это возможно. |
БРЕМЯ ЗАБОЛЕВАНИЙ И КЛИНИЧЕСКОЕ РАЗНООБРАЗИЕ
ГАЗ является ведущей причиной бремени инфекционных заболеваний во всем мире.Спектр заболевания ГАЗ простирается от поверхностных инфекций (например, фарингит, импетиго) до инвазивных заболеваний (например, абсцессы, целлюлит, сепсис), токсин-опосредованных заболеваний (например, скарлатины, синдрома токсического шока, некротизирующего фасциита) и аутоиммунных последствий. (например, острая ревматическая лихорадка [ARF], постстрептококковый гломерулонефрит и RHD). Наиболее частыми проявлениями являются фарингит, с> 616 миллионами случаев в год, и кожные инфекции, с примерно 162 миллионами распространенных случаев импетиго [1, 6].По оценкам, ежегодно возникает не менее 18 миллионов новых случаев тяжелых заболеваний, связанных с ГАЗ (RHD, ARF, гломерулонефрит и инвазивные инфекции) [1]. Одна только RHD является причиной очень большого бремени хронической инвалидности и смертей, в основном среди подростков и молодых людей, особенно беременных женщин. По оценкам, в 2015 г. глобальная распространенность случаев РБС составляла 33 миллиона человек [7].
Сообщается, что во всем мире болезнь ГАЗ и ее осложнения вызывают 500 000 смертей в год, из которых 319 000 связаны с RHD [1].Население из стран с низким и средним уровнем дохода (СНСД) подвергается наибольшему риску. Глобальная смертность от РБС несколько снизилась с 1990 г., но значительного снижения в регионах, которые несут наибольшее бремя болезней, не наблюдалось [7, 8]. Пробелы в наличии данных снижают точность оценок глобального бремени. Нехватка регистров болезней в большинстве СНСД, использование пассивных систем эпиднадзора и занижение сведений о случаях продолжают оставаться проблемой [7, 8].
Своевременное и целенаправленное лечение антибиотиками ГАЗ-инфекций составляет основу профилактики осложнений [9].Осуществление профилактических вмешательств было затруднено в условиях хрупких систем здравоохранения и ограниченного доступа к медицинской помощи, и их было недостаточно для того, чтобы продемонстрировать серьезные последствия [7]. В то время как странам с высоким уровнем доходов (СВД) удалось значительно снизить бремя РЖС, другие проявления инфекции ГАЗ — сепсис, целлюлит, некротический фасциит и синдром токсического шока — остаются превалирующими. В Соединенном Королевстве наблюдается всплеск вспышек скарлатины, а также рост числа инвазивных инфекций ГАЗ [10], о чем также сообщалось в США и Канаде [11, 12].Среди случаев инвазивных заболеваний как в СНСД, так и в СВД существует определенное бремя болезней матери и ребенка в раннем возрасте [13, 14]. К числу факторов, способствующих неблагоприятным исходам, относятся задержка в выявлении степени тяжести и начале лечения, а также ограничения в доступности инъекционных антибиотиков первого ряда [13, 14].
ГАЗ также является важным фактором использования антибиотиков [15]. Чтобы справиться с острыми инфекциями и предотвратить осложнения, боль в горле и кожные инфекции часто лечат антибиотиками, что часто не соответствует рекомендациям.Большинство случаев фарингита вызвано вирусами [16], но данные обследований амбулаторной практики в Соединенных Штатах показывают, что 60% консультаций по поводу боли в горле приводят к назначению антибиотиков как для детей, так и для взрослых [15–17]. Часто без надобности используются антибиотики широкого спектра действия [17]. Чрезмерное употребление антибиотиков без рецепта — серьезная проблема во многих СНСД [18]. Хотя ГАЗ остается универсально чувствительным к пенициллину, воздействие антибиотиков на комменсальную флору способствует долгосрочному дисбактериозу и возникновению устойчивости к антибиотикам, что усугубляет кризис общественного здравоохранения [18].
ИММУНИТЕТ К ГАЗУ И МОЛЕКУЛЯРНАЯ ЭПИДЕМИОЛОГИЯ
Вакцина против ГАЗ может снизить соответствующее бремя для отдельных лиц, сообществ, систем здравоохранения и общества в целом и, за счет сокращения использования антибиотиков, помочь сдержать устойчивость к противомикробным препаратам и уменьшить дисбактериоз.
Лучшее понимание детерминант иммунитета в условиях естественного воздействия может помочь в разработке стратегий. Наблюдение за тем, что неинвазивные инфекции гораздо чаще встречаются у детей, чем у взрослых, предполагает, что естественное воздействие может вызвать частичный иммунитет.В настоящее время предполагается, что повторные инфекции разными серотипами приводят к частичной, опосредованной антителами защите от перекрестных штаммов [19]. У взрослых уровень циркулирующих антител к ГАЗ выше, чем у детей [20]. Частота инвазивных и других тяжелых инфекций ГАЗ также выше у детей раннего возраста, чем у взрослых молодого и среднего возраста. Повышенная заболеваемость у пожилых людей может быть связана со старением иммунной системы и распространенностью сопутствующих заболеваний [21]. Антитела могут также связывать и нейтрализовать стрептококковые токсины, такие как пирогенные экзотоксины стрептококков A, B и C и эритрогенный экзотоксин B [22].
В настоящее время сведения об иммунных детерминантах ГАЗ-носительства ограничены. Для других бактериальных вакцин было показано, что сокращение носительства и передачи было важным фактором воздействия [23]. Лучшее понимание вклада слизистых оболочек и системного иммунитета в предотвращение поверхностной колонизации и инвазивных инфекций может дать критическую информацию о том, как оптимально использовать вакцины GAS для максимизации выгод для населения и экономической эффективности, особенно в условиях СНСД.Иммуноэпидемиологические исследования также могут дать представление о медиаторах приобретенного иммунитета после естественного воздействия.
Другой важной детерминантой воздействия вакцин GAS будет широта ответов против иммунодоминантных антигенов-мишеней, демонстрирующих высокую степень генетического разнообразия. Кодируемый геном emm М-белок на бактериальной поверхности является основным вирулентным и иммунологическим детерминантом [24]. М-типирование было приоритетным подходом к характеристике глобального молекулярного разнообразия GAS.Впервые было идентифицировано около 50 различных серотипов [25, 26]. Совсем недавно методы молекулярной биологии поддержали классификацию типов emm , сгруппированных в кластеры emm в соответствии с полными последовательностями белка M и соответствующими биологическими свойствами [27].
Глобальное распространение типов GAS emm чрезвычайно разнообразно: emm 1 и emm 12 — это 2 наиболее распространенных типа в Азии, Латинской Америке и самых богатых странах с наименьшим разнообразием штаммов.Эти преобладающие штаммы в СВД менее распространены в Африке и Тихоокеанском регионе, где существует большее разнообразие штаммов [24]. Разнообразие, вероятно, зависит от нескольких факторов, включая социальные детерминанты, как показано в исследовании в городе Сальвадор в Бразилии, показывающем, что разнообразие видов в трущобах было больше, чем в соседних пригородах с высоким доходом [28].
Обширное разнообразие типов emm создает проблемы для разработки вакцин, специфичных для М-белка. Последовательности, выбранные в соответствии с преобладающими штаммами в СВД, могут дать плохой охват в регионах с высоким бременем [24].Хотя кросс-опсонические антитела против невакцинных серотипов были продемонстрированы in vitro после вакцинации 30-валентной вакциной на основе М-белка, клиническое значение еще предстоит определить [29]. Необходима дальнейшая характеристика изолятов GAS и их эпидемиологического распределения, чтобы помочь в разработке рациональных вакцин [24]. Необходимы усилия по открытию консервативных антигенов для улучшения существующего ассортимента вакцин.
ТРУБОПРОВОД ВАКЦИНЫ
Только 2 вакцины-кандидаты активно проходят испытания на людях.Недавно было сообщено о клиническом испытании фазы 1 вакцины-кандидата MJ8VAX, разработанной Квинслендским институтом медицинских исследований, Австралия. Вакцинный антиген представляет собой пептид длиной 29 аминокислот (J8) из консервативной области карбоксильного конца белка М [30], конъюгированный с дифтерийным анатоксином и адсорбированный на гидроксиде алюминия. Запланированы дополнительные исследования для дальнейшей оптимизации иммуногенности.
30-валентная StreptAnova, разработанная в Университете Теннесси и в Университете Далхаузи, Канада, представляет собой вакцину на основе М-белка с 4 рекомбинантными субъединицами, каждая из которых содержит 7 или 8 N-концевых фрагментов 30 различных типов emm , связанных в тандеме [29].N-концевой фрагмент антигена Spa18 также включен в конструкцию. Пептиды были выбраны из изолятов острых и инвазивных заболеваний, наиболее распространенных в Северной Америке и Европе. Недавно была завершена фаза 1 клинических испытаний вакцины с адъювантом квасцов. Эта программа основана на благоприятной оценке безопасности и иммуногенности предыдущих родственных конструкций, включая меньшее количество последовательностей типа emm [29].
В доклинической разработке конструкция-кандидат вакцины StreptIncor, разработанная Университетом Сан-Паулу, Бразилия, основана на консервативной области белка M5, который включает 55-аминокислотный полипептид, содержащий консервативные B- и T-клеточные эпитопы.Ожидается, что в 2018–2019 годах начнется фаза 1 / 2а клинических испытаний антигена-кандидата на вакцину, содержащего квасцы [31]. Инвестиции основных производителей вакцин в исследования и разработки вакцин против ГАЗ были ограниченными. Один кандидат на основе консервативных антигенов стрептолизина O, SpyAD, SpyCEP и углеводов группы A, конъюгированных с белком-носителем, разрабатывается GlaxoSmithKline [32]. Отобранные антигены являются высококонсервативными и преобладающими, либо экспонируются на поверхности, либо секретируются, экспрессируются во время инфицирования человека, растворимы и иммуногенны у животных.
В целом нехватка продуктов в разработке, как указано выше, подчеркивает необходимость расширения и диверсификации поставок вакцин.
СООБРАЖЕНИЯ БЕЗОПАСНОСТИ
Проблемы безопасности стали серьезным препятствием для прошлых усилий по разработке вакцины. В 1969 г. сообщалось о возникновении ОПН после стрептококковой вакцинации у 3 из 21 добровольца, вакцинированного частично очищенным белком М3 [33]. Это вызвало обеспокоенность по поводу безопасности вакцин против ГАЗ и теоретического риска аутоиммунитета.В 1979 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) запретило использование организмов GAS и их производных в любых бактериальных вакцинах [34]. Однако впоследствии обоснованность таких опасений, высказанных в этом единственном исследовании, была поставлена под сомнение. У всех трех детей была задокументирована инфекция ГАЗ до начала ОПН, и все они были братьями и сестрами пациентов с ОПН. Они подвергались многократному введению очень высоких доз неочищенного вакцинного состава с М-белком. Эти факторы могли повлиять на их риск развития ОПН.Постановление FDA было отменено в 2006 году, когда агентство признало предыдущее понимание как «устаревшее и предполагаемое препятствие для разработки вакцины GAS» [34]. Не было сообщений об испытании вакцины против ГАЗ в течение 25 лет. Исследования вакцины возобновлены, но подобных неблагоприятных сигналов безопасности не выявлено.
Тем не менее, эта область выиграет от достижения консенсуса в отношении стратегий управления рисками безопасности, соответствующим образом адаптированных к статусу разработки вакцины. В исследованиях часто использовался панельный скрининг сыворотки на аутоиммунитет, иммунофлуоресцентный анализ антител с перекрестной реакцией тканей и эхокардиография для отслеживания потенциальных аутоиммунных событий, возникающих после вакцинации [30].Несмотря на необходимость должной осмотрительности, существует сильное мнение, что панели аутоантител и эхокардиографический мониторинг являются плохими инструментами скрининга и имеют ограниченную ценность, поскольку адекватный мониторинг безопасности требует достаточной конечной чувствительности и специфичности, особенно когда количество участников испытаний ограничено, как в случае ранней вакцины. разработка. В клинической практике эти тесты редко используются изолированно, поскольку их вклад в диагностику во многом определяется вероятностью предварительного тестирования, определяемой клиническим контекстом.Пограничные результаты и неспецифические данные затрудняют интерпретацию [35]. Панели скрининга и эхокардиографическую оценку лучше всего использовать для скрининга субъектов с повышенным риском аномалий, обнаруженных до начала исследовательских исследований вакцины.
ДОКЛИНИЧЕСКИЕ ИНСТРУМЕНТЫ, РАННЕЕ ОСНОВАНИЕ КЛИНИЧЕСКОГО ПОДТВЕРЖДЕНИЯ КОНЦЕПЦИИ И ДОЛГОСРОЧНЫЕ ЦЕЛИ
GAS является исключительно патогеном человека, и многие из его факторов вирулентности активны только против человеческих клеток и белков.Несмотря на то, что модели на животных были разработаны и использованы для изучения патогенеза GAS и кандидатов в вакцины GAS, большое разнообразие клинических проявлений является проблемой для разработки соответствующей и репрезентативной модели болезни животных [36]. Еще одним препятствием является высокий уровень разнообразия штаммов, поскольку ни один штамм не может считаться репрезентативным для бактериальной популяции в целом, и только несколько штаммов продемонстрировали вирулентность на различных моделях животных [37]. Следовательно, несмотря на то, что они полезны для доклинических исследований токсичности и в качестве инструментов скрининга, общая роль исследований на животных в разработке вакцины GAS может быть ограничена.
В отсутствие соответствующих моделей на животных для оптимального управления инвестиционным риском необходимо наличие первых этапов стратегического развития и конечных точек эффективности, подтверждающих концепцию. Модели контролируемых инфекций человека, когда они доступны, обеспечивают возможность быстрого и раннего отказа, ключевой актив в управлении ресурсами и представляют собой мощный инструмент для анализа патогенеза и механизмов иммунной защиты, а также установления коррелятов защиты [4].
Трудность продемонстрировать эффективность вакцины против РБС — важный, но отдаленный результат — стала серьезным препятствием для усилий по разработке вакцины.Для решения этой проблемы предлагаются пути клинической разработки, включающие раннюю демонстрацию эффективности вакцины против ГАЗ-фарингита и кожных инфекций, что иллюстрируется краткосрочной стратегической целью, изложенной в дорожной карте технологий НИОКР (Таблица 3). Фарингит и кожные инфекции часто встречаются у детей, распространены во всем мире и являются причиной широкого применения антибиотиков [15–17, 38]. Данные показывают, что эти инфекции являются обязательной причиной многих тяжелых исходов инфекций GAS, включая инвазивные инфекции и RHD [39].Профилактика этих неинвазивных инфекций, вероятно, также предотвратит прогрессирование заболевания и долгосрочные последствия. Этот подход совместим с планом клинической разработки, предложенным ключевыми участниками разработки вакцины против ГАЗ [35]. Особая трудность при демонстрации эффективности вакцины против кожных инфекций, вызываемых ГАЗом, связана с частой ассоциацией с чесоткой, особенно в тропических регионах. Следует дополнительно рассмотреть влияние на оценки вакцины [38].
| Ближайшие стратегические цели | Долгосрочные стратегические цели |
| Продемонстрировать благоприятную безопасность и доказательство эффективности вакцин-кандидатов против фарингита и кожных инфекций группы A Streptococcus у детей. | Разработать безопасные, глобально эффективные и доступные вакцины группы A Streptococcus для профилактики острых инфекций (фарингит, кожные инфекции, целлюлит, инвазивные заболевания) и связанных с ними использования антибиотиков и вторичных иммуно-опосредованных последствий (болезнь почек, ревматическая лихорадка, и ревматическая болезнь сердца) и связанная с этим смертность. |
| Ближайшие стратегические цели | Долгосрочные стратегические цели |
| Продемонстрировать благоприятную безопасность и доказательство эффективности вакцин-кандидатов против фарингита и кожных инфекций группы A Streptococcus у детей. | Разработать безопасные, глобально эффективные и доступные вакцины группы A Streptococcus для профилактики острых инфекций (фарингит, кожные инфекции, целлюлит, инвазивные заболевания) и связанных с ними использования антибиотиков и вторичных иммуно-опосредованных последствий (болезнь почек, ревматическая лихорадка, и ревматическая болезнь сердца) и связанная с этим смертность. |
| Ближайшие стратегические цели | Долгосрочные стратегические цели |
| Продемонстрировать благоприятную безопасность и доказательство эффективности вакцин-кандидатов против фарингита и кожных инфекций группы A Streptococcus у детей. | Разработать безопасные, глобально эффективные и доступные вакцины группы A Streptococcus для профилактики острых инфекций (фарингит, кожные инфекции, целлюлит, инвазивные заболевания) и связанных с ними использования антибиотиков и вторичных иммуно-опосредованных последствий (болезнь почек, ревматическая лихорадка, и ревматическая болезнь сердца) и связанная с этим смертность. |
| Ближайшие стратегические цели | Долгосрочные стратегические цели |
| Продемонстрировать благоприятную безопасность и доказательство эффективности вакцин-кандидатов против фарингита и кожных инфекций группы A Streptococcus у детей. | Разработать безопасные, глобально эффективные и доступные вакцины группы A Streptococcus для профилактики острых инфекций (фарингит, кожные инфекции, целлюлит, инвазивные заболевания) и связанных с ними использования антибиотиков и вторичных иммуно-опосредованных последствий (болезнь почек, ревматическая лихорадка, и ревматическая болезнь сердца) и связанная с этим смертность. |
Долгосрочные цели связаны с оценкой всего объема пользы для здоровья населения от вакцины.В зависимости от рассматриваемой сущности заболевания или критериев воздействия, доказательства могут быть получены в результате крупных испытаний фазы 3, проводимых при условии успешного достижения краткосрочных стратегических целей. В качестве альтернативы, профилактика некоторых заболеваний, возможно, потребуется изучить после получения лицензии, в пилотных демонстрационных исследованиях, поскольку это становится все более необходимым для оценки эффективности вакцины и оценки экономической эффективности вакцины.
ПРЕДПОЧТИТЕЛЬНЫЕ ХАРАКТЕРИСТИКИ ПРОДУКТА
Документы ВОЗ по КПК содержат рекомендации относительно предпочтений ВОЗ в отношении новых вакцин в областях с приоритетными заболеваниями, способствуют разработке вакцин с оптимальной эффективностью и пригодностью для использования в СНСД и помогают определить ценностное предложение рынков СНСД для разрабатываемых вакцин с последующим информированием профили целевых продуктов для конкретных классов или продуктов.КПК ВОЗ нацелены на поддержку исследований в областях, связанных с потребностями общественного здравоохранения, устанавливая реалистичные ожидания в отношении ключевых характеристик, которые могут способствовать принятию положительных решений. Документы ВОЗ по КПК не нацелены на выражение минимальных приемлемых критериев, а скорее на выражение желаемых целей, тогда как профили целевых продуктов, которые являются опорой отрасли, обычно устанавливают целевые критерии эффективности для конкретного продукта для конкретного кандидата на вакцину. Любой лицензированный на местном уровне продукт может рассматриваться для предварительной квалификации ВОЗ и принятия политических решений в соответствии с установленным процессом, даже если выраженные предпочтения не соблюдаются, поскольку КПП не являются официальным руководством и не препятствуют проведению каких-либо нормативных обзоров или политических решений.
Вкратце, как было сказано выше, хотя доказательство концепции, вероятно, будет основываться на демонстрации эффективности против фарингита и кожных инфекций, долгосрочная оценка, возможно, после первоначального лицензирования, должна предоставить доказательства защиты от более широкого спектра заболеваний. Маленькие дети должны быть вакцинированы до пика заболеваемости ГАЗ-фарингитом, но с точки зрения будущего практики иммунизации следует предусмотреть стратегию на протяжении всей жизни, включающую бустеры, поскольку глобальное бремя, особенно с учетом инвазивных инфекций, широко распределяется по возрастные категории.Предпочтительные целевые показатели эффективности отражают воспринимаемую ценность требуемых инвестиций, причем ценность таких инвестиций выше, когда целевой результат более серьезен.
Сокращенная версия КПК ВОЗ для ГАЗ-вакцин представлена в таблице 2 с пояснительными примечаниями высокого уровня, содержащими дополнительные соображения о предпочтительных характеристиках. Для получения полной информации читателям рекомендуется обратиться к источнику [5].
ДОРОЖНАЯ КАРТА НИОКР
Спустя пятнадцать лет после первых оценок глобального бремени, в которых подчеркивается основное всемирное бремя болезней, связанных с ГАЗ, эта область остается в значительной степени недофинансированной, и ограниченные ресурсы были направлены на поддержку усилий по разработке вакцин.Отсутствие консенсуса в отношении того, что составляет основные научные пробелы и способы их устранения, а также нечеткое видение ценности инвестиций в разработку вакцины против ГАЗ, мешает правительствам, спонсорам и производителям уделять приоритетное внимание посевным инвестициям. Выражение стратегического видения разработки вакцин, представленного в дорожной карте технологий НИОКР, направлено на то, чтобы повлиять и направить принятие решений в этой давно забытой области. Предлагаются приоритетные направления деятельности. Фоновые исследования должны дополнительно установить глобальные эпидемиологические особенности, естественный анамнез заболевания и детерминанты неблагоприятных иммунологических исходов.Ключевые возможности, модели болезней, а также инструменты иммунологического мониторинга и мониторинга безопасности должны получить дальнейшее развитие для поддержки клинических испытаний вакцин во всех географических регионах. Сокращенная версия дорожной карты представлена в таблице 1. Для получения полной информации читателям рекомендуется обратиться к источнику [5].
СИЛА ПАРТНЕРСТВА, АДВОКАЦИИ И АНАЛИЗ ЦЕННЫХ ПРЕДЛОЖЕНИЙ
Создание совместной партнерской сети для руководства реализацией Дорожной карты ВОЗ по разработке технологий разработки вакцин GAS в соответствии с видением, выраженным в документе GAS Vaccine PPC, могло бы направлять, стимулировать и ускорять прогресс в разработке и внедрении вакцины GAS.Одним из приоритетных результатов такого партнерства будет всесторонний анализ полной общественной ценности ГАЗ-вакцин с учетом клинической, а также социально-экономической, нормативной, политической, поставочной и пользовательской точек зрения. Это полностью общественное ценностное предложение проинформирует различные заинтересованные стороны о том, как потенциальная вакцина против ГАЗ может удовлетворить их интересы и потребности, направляя более информированные инвестиции, рациональным образом мобилизуя потенциал и повышая предсказуемость на пути к этой столь необходимой вакцине.
Банкноты
Благодарности. Авторы благодарны Wellcome Trust, в частности Зои Сигер и Сушмите Саркар, за поддержку в организации консультации Всемирной организации здравоохранения (ВОЗ) по вакцине группы A Streptococcus в Лондоне в мае 2018 года, а также всем лицам, которые принимала участие.
Отказ от ответственности. Эта публикация содержит коллективные взгляды международной группы экспертов и не обязательно отражает решения или политику ВОЗ или официальную позицию Центров по контролю и профилактике заболеваний.Спонсор не участвовал в определении содержания высказанных здесь соображений и решения о публикации.
Финансовая поддержка. Wellcome Trust внесла неденежный вклад в поддержку процессов консультаций ВОЗ, описанных здесь.
Возможный конфликт интересов. Все авторы: о конфликтах не сообщалось. Все авторы подали форму ICMJE для раскрытия информации о потенциальном конфликте интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.Авторы заявляют никакого конфликта интересов.
Список литературы
1.
Carapetis
JR
,
Steer
AC
,
Mulholland
EK
,
Weber
M
.
Глобальное бремя стрептококковых заболеваний группы А
.
Lancet Infect Dis
2005
;
5
:
685
—
94
.4.
Osowicki
J
,
Vekemans
J
,
Kaslow
DC
,
Friede
MH
,
Kim
JH
AC
Steer
000
Глобальные консультации ВОЗ / IVI с заинтересованными сторонами по разработке вакцины против группы A Streptococcus : отчет о встрече, состоявшейся 12–13 декабря 2016 г.
.
Вакцина
2018
;
36
:
3397
—
405
.6.
Bowen
AC
,
Mahé
A
,
Hay
RJ
и др.
Глобальная эпидемиология импетиго: систематический обзор популяционной распространенности импетиго и пиодермии
.
PLoS One
2015
;
10
:
e0136789
.7.
Watkins
DA
,
Johnson
CO
,
Colquhoun
SM
и др.
Глобальное, региональное и национальное бремя ревматической болезни сердца, 1990–2015 годы
.
N Engl J Med
2017
;
377
:
713
—
22
.8.
Sanyahumbi
AS
,
Colquhoun
S
,
Wyber
R
,
Carapetis
JR
.
Глобальное бремя болезней группы A Streptococcus
. В:
Ferretti
JJ
,
Stevens
DL
,
Fischetti
VA
, ред.
Streptococcus pyogenes : от базовой биологии до клинических проявлений
.
Оклахома-Сити
:
Центр медицинских наук Университета Оклахомы
,
2016
.9.
Картикеян
G
,
Mayosi
BM
.
Является ли первичная профилактика ревматической лихорадки недостающим звеном в борьбе с ревматической болезнью сердца в Африке?
Обращение
2009
;
120
:
709
—
13
. 13.
Acosta
CD
,
Knight
M
.
Сепсис и материнская смертность
.
Curr Opin Obstet Gynecol
2013
;
25
:
109
—
16
. 14.
Seale
AC
,
Davies
MR
,
Anampiu
K
, et al.
Инвазивная инфекция группы A Streptococcus среди детей, сельские районы Кении
.
Emerg Infect Dis
2016
;
22
:
224
—
32
. 15.
Dooling
KL
,
Shapiro
DJ
,
Van Beneden
C
,
Hersh
AL
,
Hicks
LA
.
Избыточное назначение и неправильный выбор антибиотиков для детей с фарингитом в США, 1997–2010 годы
.
JAMA Pediatr
2014
;
168
:
1073
. 16.
Ebell
MH
,
Smith
MA
,
Barry
HC
,
Ives
K
,
Carey
M
.
Рациональное клиническое обследование. У этого пациента ангина?
JAMA
2000
;
284
:
2912
—
8
. 17.
Barnett
ML
,
Linder
JA
.
Назначение антибиотиков взрослым, страдающим ангиной, в США, 1997–2010 годы
.
JAMA Intern Med
2014
;
174
:
138
—
40
. 18.
Morgan
DJ
,
Okeke
IN
,
Laxminarayan
R
,
Perencevich
EN
,
Weisenberg
S
.
Использование противомикробных препаратов без рецепта во всем мире: систематический обзор
.
Lancet Infect Dis
2011
;
11
:
692
—
701
.19.
Tsoi
SK
,
Smeesters
PR
,
Frost
HR
,
Licciardi
P
,
Steer
AC
.
Корреляты защиты вакцин на основе белка M против группы A Streptococcus
.
J Immunol Res
2015
;
2015
:
167089
.20.
Brandt
ER
,
Hayman
WA
,
Currie
B
, et al.
Опсонические человеческие антитела из эндемичной популяции, специфичные для консервативного эпитопа на белке М стрептококков группы А
.
Иммунология
1996
;
89
:
331
—
7
. 21.
Lamagni
TL
,
Darenberg
J
,
Luca-Harari
B
и др.Strep-EURO Study Group.
Эпидемиология тяжелой болезни Streptococcus pyogenes в Европе
.
J Clin Microbiol
2008
;
46
:
2359
—
67
. 22.
Каннингем
МВт
.
Патогенез стрептококковых инфекций группы А
.
Clin Microbiol Rev
2000
;
13
:
470
—
511
. 23.
Balmer
P
,
Burman
C
,
Serra
L
,
York
LJ
.
Влияние менингококковой вакцинации на носительство и передачу заболеваний: обзор литературы
.
Hum Vaccin Immunother
2018
;
14
:
1118
—
30
. 24.
Steer
AC
,
Law
I
,
Matatolu
L
,
Beall
BW
,
Carapetis
JR
.
Глобальное распределение стрептококков группы A по типу emm: систематический обзор и значение для разработки вакцины
.
Lancet Infect Dis
2009
;
9
:
611
—
6
,25.
Wannamaker
LW
,
Денни
FW
,
Perry
WD
,
Siegel
AC
,
Rammelkamp
CH
Jr. Исследования на иммунитет
Jr.
AMA Am J Dis Child
1953
;
86
:
347
—
8
. 26.
Лэнсфилд
RC
.
Персистенция типоспецифических антител у человека после инфицирования стрептококками группы А
.
J Exp Med
1959
;
110
:
271
—
92
,27.
Sanderson-Smith
M
,
De Oliveira
DM
,
Guglielmini
J
и др. Группа изучения белков М.
Систематическая и функциональная классификация Streptococcus pyogenes , служащая новым инструментом для молекулярного типирования и разработки вакцины
.
J Инфекция Dis
2014
;
210
:
1325
—
38
. 28.
Tartof
SY
,
Reis
JN
,
Andrade
AN
,
Ramos
RT
,
Reis
MG
,
Riley
Факторы, связанные с диверсификацией типа Streptococcus emm группы А в большом городе в Бразилии: перекрестное исследование
.
BMC Infect Dis
2010
;
10
:
327
, 29.
Дейл
JB
,
Penfound
TA
,
Chiang
EY
,
Walton
WJ
.
Новая вакцина на основе 30-валентного М-белка вызывает перекрестные опсонические антитела против невакцинных серотипов стрептококков группы А
.
Вакцина
2011
;
29
:
8175
—
8
.30.
Sekuloski
S
,
Batzloff
MR
,
Griffin
P
и др.
Оценка безопасности и иммуногенности вакцины-кандидата от Streptococcus группы A (MJ8VAX) в рандомизированном клиническом исследовании
.
PLoS One
2018
;
13
:
e0198658
.31.
Guilherme
L
,
Ferreira
FM
,
Köhler
KF
,
Postol
E
,
Kalil
J
.
Вакцина против Streptococcus pyogenes : потенциал для предотвращения ревматической лихорадки и ревматической болезни сердца
.
Am J Cardiovasc Drugs
2013
;
13
:
1
—
4
.32.
Bensi
G
,
Mora
M
,
Tuscano
G
и др.
Многофункциональный высокопроизводительный подход для высокоселективной идентификации вакцин-кандидатов: случай группы A Streptococcus
.
Mol Cell Proteomics
2012
;
11
:
M111.015693
.33.
Massell
BF
,
Honikman
LH
,
Amezcua
J
.
Ревматическая лихорадка после вакцинации против стрептококка. Протокол трех дел
.
JAMA
1969
;
207
:
1115
—
9
,35.
Schödel
F
,
Moreland
NJ
,
Wittes
JT
и др.
Стратегия клинической разработки вакцины против стрептококка группы A
.
Вакцина
2017
;
35
:
2007
–
14
.36.
Watson
ME
,
Neely
MN
,
Caparon
MG
.
Животные модели заражения Streptococcus pyogenes
. В:
Ferretti
JJ
,
Stevens
DL
,
Fischetti
VA
, ред.
Streptococcus pyogenes : от базовой биологии до клинических проявлений
.
Оклахома-Сити
:
Центр медицинских наук Университета Оклахомы
,
2016
.37.
Hu
MC
,
Стены
MA
,
Stroop
SD
,
Reddish
MA
,
Beall
B
,
Dale J
000.
Иммуногенность 26-валентной вакцины против стрептококка группы А
.
Infect Immun
2002
;
70
:
2171
—
7
,38.
Hay
RJ
,
Johns
NE
,
Williams
HC
и др.
Глобальное бремя кожных заболеваний в 2010 г .: анализ распространенности и воздействия кожных заболеваний
.
J Invest Dermatol
2014
;
134446
:
1527
—
34
.39.
Парки
T
,
Smeesters
PR
,
Steer
AC
.
Стрептококковая инфекция кожи и ревматический порок сердца
.
Curr Opin Infect Dis
2012
;
25
:
145
—
53
.
© Автор (ы) 2019. Опубликовано Oxford University Press для Общества инфекционных болезней Америки.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа правильно процитирована.
Новый толчок к разработке первой в мире вакцины против смертельной бактерии Strep A, убивающей сотни тысяч — IVI
Бактерии Streptococcus pyogenes, вызывающие скарлатину и другие инфекции
30 мая 2019 г., СЕУЛ, Южная Корея — Международный институт вакцин (IVI) и Австралийский детский исследовательский институт Мердока (MCRI) будут координировать глобальные усилия по освобождению мира от стрептококков группы A (Strep A), заразных бактерии, которые ежегодно убивают полмиллиона человек и развивают устойчивость к антибиотикам.
Британский фонд биомедицинских исследований Wellcome Trust предоставил IVI и MCRI 2,25 миллиона долларов для координации мировых усилий по разработке вакцины против Strep A и поиска производителей.
Генеральный директор IVI д-р Джером Ким сказал, что Strep A, бактериальный патоген, является одним из самых смертоносных инфекционных заболеваний среди туберкулеза (ТБ), ВИЧ и малярии, но в глобальном масштабе в исследования Strep A было инвестировано очень мало. .
«Strep A — одна из основных причин смерти от инфекционных заболеваний, уносящая 500 000 жизней в год; однако мало кто об этом знает », — сказал д-р Ким.
«Strep A обычно начинается с боли в горле, но если ее не лечить, она становится сверхактивной, что приводит к ревматической болезни сердца, которая повреждает сердечные клапаны и со временем вызывает сердечную недостаточность и смерть. Это затрагивает более 33 миллионов человек во всем мире, и подавляющее большинство смертей приходится на страны с низким и средним уровнем доходов. Вакцина станет наиболее эффективным и экономичным способом борьбы с инфекцией ».
Ребенок обследован на фарингит.
Всемирная организация здравоохранения сделала приоритетным вакцину против Strep A в 2014 году, а в 2018 году единогласно приняла резолюцию, призывающую к действиям против ревматической болезни сердца, включая вакцину против Strep A.
Руководитель отдела инфекций и иммунитета
MCRI, профессор Эндрю Стир, сказал, что в научном сообществе есть опасения по поводу эффективности антибиотиков для лечения Strep A в будущем, поскольку группы Strep A эволюционировали, чтобы быть устойчивыми к антибиотикам азитромицину и кларитромицину.
«Уже инвазивные инфекции Strep A, такие как пресловутые« плотоядные бактерии »и« токсический шок », ежегодно убивают 150 000 человек во всем мире», — сказал профессор Стир.
«Но общественность, политики и даже ученые мало осведомлены о Strep A — и поэтому у крупных производителей вакцин не было особых стимулов поддерживать разработку вакцин».
«IVI и MCRI создали международный консорциум, чтобы объединить знания и ресурсы, чтобы приступить к давно назревшему процессу разработки одной из вакцин, в которой мир наиболее срочно нуждается и крайне недофинансируется.”
Работа по повышению осведомленности и созданию глобальной поддержки для разработки вакцины против Strep A поддерживается новым грантом Wellcome. «Мы создадим средства для международной пропаганды расширения исследований вакцин и разработки аргументов в пользу инвестиций в вакцины против Strep A на уровне бизнеса и политики», — сказал д-р Ким. «К концу проекта мы также надеемся определить крупного производителя вакцины».
Глава отдела вакцин Wellcome Trust, доктор Чарли Веллер, сказал, что вакцины чрезвычайно эффективны в предотвращении распространения инфекционных заболеваний во всем мире.
«Бактерия Strep A вызывает множество серьезных инфекций, включая скарлатину и ревматический порок сердца», — сказал доктор Веллер.
«Это одна из 10 основных причин смерти во всем мире, и растет беспокойство по поводу эффективности антибиотиков, которые у нас есть для лечения пациентов. С помощью вакцины против стрептококка A можно защитить огромное количество жизней, но этого невозможно добиться без международного сотрудничества и поддержки.
«Мы надеемся ускорить разработку инвестиционного обоснования для вакцины против Strep A и лучше понять влияние, которое она окажет на глобальное здоровье населения.”
Международный институт вакцин
Международный институт вакцин — единственная в мире международная организация, занимающаяся исключительно разработкой и внедрением новых и улучшенных вакцин для защиты беднейших слоев населения мира, особенно детей в развивающихся странах. Основанная в 1997 году, IVI действует как независимая международная организация в соответствии с соглашением, подписанным 35 странами и Всемирной организацией здравоохранения. Институт проводит исследования в более чем 30 странах Азии, Африки и Латинской Америки по вакцинам против кишечных и диарейных инфекций, японского энцефалита, БВРС-КоВ и лихорадки денге, а также разрабатывает новые и улучшенные вакцины в своей штаб-квартире в Сеуле, Республика Корея. .Для получения дополнительной информации посетите www.ivi.int.
Детский научно-исследовательский институт Мердока
Детский научно-исследовательский институт Мердока, расположенный в Мельбурне, является крупнейшим научно-исследовательским институтом здоровья детей в Австралии и входит в тройку лучших в мире. Команда из более чем 1200 исследователей стремится делать открытия по профилактике и лечению детских заболеваний. MCRI уделяет большое внимание разработке новых вакцин. Исследователи MCRI обнаружили ротавирус, вызывающий вирусный патоген, в 1973 году и разработали новую вакцину против ротавируса для новорожденных.MCRI изучает здоровье сообществ, чтобы понять, какие факторы влияют на здоровье детей на уровне населения, и изучает инфекционные заболевания как на местном, так и на глобальном уровне.
О Wellcome Trust
Wellcome Trust существует для улучшения здоровья, помогая процветать великим идеям.
Wellcome поддерживает исследователей, решает серьезные проблемы со здоровьем, проводит кампании за лучшую науку и помогает всем участвовать в научных исследованиях и исследованиях в области здравоохранения.
Wellcome — политически и финансово независимый фонд.
КОНТАКТЫ ДЛЯ СМИ
Tae Kyung Byun, IVI
+82 2 881 1159 | [email protected]
Кристин Тондорф, Детский научно-исследовательский институт Мердока
+61 3 9936 6197 / +61 0413 307 092 | [email protected]
Контролируемая инфекция человека для вакцинации против Streptococcus Pyogenes — Просмотр полного текста
Стрептококк группы A (GAS) является повсеместным патогеном человека.Его влияние начинается в раннем детстве и больше всего ощущается теми, у кого меньше всего. В глобальном масштабе влияние ГАЗ во всех его формах на службы здравоохранения огромно и поражает на всех уровнях — от первичной до интенсивной терапии. Несмотря на признание необходимости разработки вакцины против ГАЗ, прогрессу препятствуют серьезные препятствия. Модель заражения человека обещает помочь изменить инерцию в разработке вакцины против ГАЗ.
Целью данного исследования является использование наблюдательного стационарного исследования с эскалацией дозы для определения дозы ГАЗ, вводимой путем прямой инокуляции в ротоглотку, необходимой для достоверного получения частоты приступа фарингита ≥ 60% у тщательно отобранных здоровых взрослых добровольцев.Штамм GAS был специально отобран и подготовлен для этого исследования, чтобы гарантировать безопасность и клиническую значимость. Потенциальные участники в возрасте от 18 до 40 лет, возрастной диапазон, связанный с наименьшим риском инвазивного ГАЗ-заболевания, будут тщательно проверены, чтобы минимизировать риск и максимизировать вероятность достижения конечной точки фарингита.
Результаты трех исследований вакцины против глотки человека GAS, проведенных в 1970-х годах, обнадеживают и обнадеживают. Проба GAS действительно вызвала фарингит и была безопасной, все участники ответили на антибиотики, и ни у одного не возникло осложнений, несмотря на эти исследования с использованием более агрессивных штаммов GAS.8 КОЕ / мл. В соревновании будут участвовать минимум 20 и максимум 80 участников. Процедура заражения очень похожа на ту, что успешно использовалась в исследованиях с GAS в 1970-х годах у человека. До появления симптомов ожидается инкубационный период от 36 до 72 часов. После заражения участники будут находиться под интенсивным стационарным наблюдением в течение шести дней. Первичным критерием оценки является ГАЗ-фарингит, определяемый сочетанием положительных клинических и лабораторных признаков. Все участники, у которых развивается фарингит, будут лечиться антибиотиками, а те, у кого нет фарингита, также получат лечение через 5 дней.4 КОЕ / мл.
Модель заражения также обещает беспрецедентную возможность использовать современные методы для описания иммунобиологии инфекции GAS. Образцы крови и слюны будут собираться в разные моменты времени до, во время и после заражения. Тестирование серийных образцов добавит новый динамический уровень к клиническим основам модели заражения, позволяя проводить углубленное сравнение между участниками, у которых развивается фарингит или нет, и открывая путь к выявлению иммунных коррелятов защиты.
New Strep Модель заражения человека открывает путь к тестированию вакцин против смертельных бактерий
Исследователи успешно разработали новую модель заражения человека Strep A, проложив путь к тестированию вакцин против обычных смертельных бактерий, вызывающих боль в горле, скарлатину и кожные язвы.
Совместные исследования, проведенные Детским научно-исследовательским институтом Мердока (MCRI) и опубликованные в The Lancet Microbe , показали, что модель, которая преднамеренно заражала здоровых взрослых добровольцев бактериями в контролируемой среде, была безопасной и теперь будет использоваться. к испытанию вакцин-кандидатов против Strep A.
Стрептококковая инфекция А поражает около 750 миллионов человек и ежегодно убивает более 500 000 человек во всем мире — больше, чем грипп, брюшной тиф или коклюш. Strep A может также вызывать серьезные опасные для жизни инфекции, такие как синдром токсического шока и болезнь поедания мяса, а также постинфекционные заболевания, такие как острый ревматизм, ревматическая болезнь сердца и болезнь почек.
Strep A инфекции непропорционально поражают детей младшего возраста, пожилых людей, беременных женщин и коренных австралийцев.В настоящее время нет вакцины для предотвращения Strep A, и ее потенциально можно лечить только антибиотиками.
MCRI доктор Джош Осовицки сказал, что при использовании Strep A только естественно инфицированных людей исследователи были ограничены в том, что они могли узнать в лаборатории и на моделях животных.
«Человеческие модели заражения можно использовать для тестирования вакцин, лекарств и диагностических тестов, а также для стимулирования всевозможных замечательных научных совместных работ, чтобы лучше понять, как действуют болезни и как их остановить», — сказал он.
«Мы разработали единственную существующую модель контролируемой инфекции человека Strep A, готовую к использованию в качестве платформы для оценки новых вакцин-кандидатов и терапевтических средств».
Д-р Osowicki сказал, что исследовательская группа проверила штамм Strep A, который, по их мнению, вызовет стрептококковое горло и вряд ли вызовет острые или хронические проблемы со здоровьем.
В исследовании участвовали 25 добровольцев в возрасте 18-40 лет, которые оставались в Nucleus Network, отделении клинических испытаний фазы 1, базирующемся в Мельбурне, на срок до шести дней с регулярным сбором анализов крови и мазков из слюны и горла.
Доктор Osowicki сказал, что у 85 процентов участников убедительный случай стрептококковой ангины, что намного больше, чем ожидалось по крайней мере 60 процентов.
«Начиная с одной десятой дозы, использованной в старых исследованиях 1970-х годов, мы применили наш специальный штамм Strep A на задней части горла каждого участника», — сказал он. «К нашему удивлению, с самого первого участника при низкой начальной дозе наше напряжение вызвало стрептококковое горло у большинства участников».
У добровольцев появились симптомы от легкой до умеренной, включая боль в горле, потоотделение, жар и головную боль.Согласно исследованию, все быстро выздоровели и наблюдались в течение шести месяцев после отправки домой.
Дочке жительницы Мельбурна Тани О’Мира Иден было всего 11 месяцев, когда она чуть не потеряла ногу из-за пожирающей плоть бактериальной инфекции, вызванной Strep A.
«Мы уложили нашу дочь спать с чем-то вроде простуды, но на следующее утро она проснулась с лихорадкой и была очень бледной, безвольной и обезвоженной», — сказала она.
«Мы отвезли ее в больницу, но врач не смог ввести капельницу, потому что Иден была настолько обезвожена, и они были вынуждены вбить ее в ногу.Они также заметили, что кожа на ее ноге выглядела так, будто меняла цвет «.
Мисс О’Мира сказала, что Иден потребовалась операция на правой икре, чтобы удалить мертвую плоть.
«Нам сказали, что она может умереть, и мы собрались, поэтому было чудом, что они смогли спасти ее ногу и даже икроножную мышцу», — сказала она.
Иден, которому сейчас три года, потребовалось еще три операции, и с тех пор он полностью выздоровел.
Г-жа О’Мира сказала, что она рада, что вакцина для Шага А может быть не так уж далеко.
«Я не хочу, чтобы какая-либо другая семья пережила то, через что прошли мы. Это абсолютная трагедия, что эта бактерия сокращает столько жизней», — сказала она.
Профессор MCRI Эндрю Стир сказал, что команда планирует начать тестирование кандидатных вакцин против Strep A, разработанных исследователями в Австралии и за рубежом, до конца года.
Испытания, которые будут проводиться в Мельбурне, будут включать около 50 участников, которые получат вакцину-кандидат или плацебо и наложат контрольный штамм Strep A на горло.
«Глобальное бремя Strep A — это неудовлетворенная проблема общественного здравоохранения. Мы надеемся, что это исследование ускорит разработку вакцины и продвинет ее к более масштабным полевым испытаниям», — сказал профессор Стир.
«Вакцина от Strep A будет спасать сотни тысяч жизней каждый год и предотвращать миллионы инфекций, из-за которых дети и взрослые отправляются в больницу или к врачу».
###
Исследователи из Мельбурнского университета, Королевской детской больницы, Свободного университета Брюсселя, Университета Монаша, Университета Гриффита, Университета Теннесси, Университета Квинсленда, Oxford Vaccine Group и Telethon Kids Institute также внесли свой вклад в исследование.
Публикация: Джошуа Осовицки, Кристи И. Аззопарди, Лорейн Фабри, Ханна Р. Фрост, Таня Ривера-Эрнандес, Мелани Р. Ниланд, Алана Л. Уиткомб, Аннеке Гроблер, Сара Дж. Гутман, Сиара Бейкер, Джанет М.Ф. Вонг, Джейсон Д. Ликлитер, Клэр С. Уоддингтон, Маниша Пандей, Тибор Шустер, Аллен С. Ченг, Эндрю Дж. Поллард, Джеймс С. Маккарти, Майкл Ф. Гуд, Джеймс Б. Дейл, Майкл Батцлофф, Николь Дж. Морленд , Марк Дж. Уокер, Джонатан Р. Карапетис, Пьер Р. Смистерс и Эндрю С. Стир.«Модель контролируемой инфекции человека Streptococcus pyogenes pharyngitis: наблюдательное исследование с поиском дозы (CHIVAS-M75)», The Lancet Microbe . DOI: 10.1016 / S2666-5247 (20) 30240-8
* MCRI несет исключительную ответственность за содержание этого сообщения и не отражает точку зрения NHMRC.
Доступно для собеседования:
Д-р Джошуа Осовицки, Исследовательская группа по тропическим болезням MCRI
Профессор Эндрю Стир, руководитель темы MCRI, инфекции и иммунитет
Таня О’Мира, мама Эдема, 3 года, перенесла плотоядную бактериальную инфекцию, вызванную Strep A
.

 Чаще всего располагаются в глотке и вызывают различные болезни в виде ангины, фарингита, менингита, сепсиса, скарлатины;
Чаще всего располагаются в глотке и вызывают различные болезни в виде ангины, фарингита, менингита, сепсиса, скарлатины;