Вакцинация от ротавирусной инфекции
Вся правда о вакцинации: наша цель не что-либо доказать, не навязать, а изложить лишь факты:
- продолжительность жизни увеличилась благодаря вакцинации на десятки лет
- благодаря прививкам мы не видим эпидемии оспы, полиомиелита, дифтерии, кори
- но корь в наше время есть, за счет увеличения «прослойки» невакцинированных
- инфекционные болезни не так страшны для людей, как раньше
Перестав бояться болезней, люди стали боятся прививок!
Появилось АНТИПРИВИВОЧНОЕ ДВИЖЕНИЕ, которое подпитывается видеострашилками в интернете.
РЕЗУЛЬТАТ:
- Отказ от вакцинации — угроза здоровью своих детей на протяжении всей жизни
- перенос вакцинации на более поздние сроки — угроза здоровью, а иногда и жизни ребенка в младенчестве
- Снижение коллективного иммунитета и появление случаев управляемых инфекций (как, анпример, сейчас — корь)
Мнение некоторых родителей: прививка – «садит» иммунитет.

ФАКТ: Иммунный ответ на прививку в целом такой же, как и на любой инфекционный агент, только с тем отличием, что антиген ослабленный или убитый! Это как «подобие» микроба. Вакцинный антиген не способен причинить вред организму!
Заблуждение: «грудное молоко — всё убивает».
ФАКТ: Несомненно, что грудное молоко содержит большое количество биоактивных факторов, которые способствуют здоровому развитию. Да! Груднички болеют реже. Но БОЛЕЮТ, особенно недоношенные!
Позиция антивакцинаторов: вред прививок состоит во вмешательстве в эволюционный процесс. То есть, пусть иммунная систем сама разбирается. Основной признак эволюции – «выживает сильнейший».
Мы против селекционного подхода!
«ДОРОГ КАЖДЫЙ РЕБЕНОК» – так написано в Конвенции о правах ребенка и это наша позиция.
Задайте себе вопрос: « Готовы вы пожертвовать своими детьми ради беспрепятственной работы эволюции?»
«Пусть иммунитет сам работает» — говорят антипрививочники.
ФАКТ: Для развития имунной системы достаточно болеть легкими ОРВИ и не обязательно болеть, рискуя жизнью, например, переносить корь, дифтерию, грипп …
Страхи родителей: «В вакцинах много вредных примесей».
ФАКТ: В вакцине кроме прививочного агента, действительно, есть целый ряд других веществ. Они обеспечивают стабильность вакцины, некоторые работают как усилитель иммунного ответа. Эти соединения добавлены в вакцину не с целью принести вред ребенку! Цель – обеспечить безопасность вакцинации!
«Но ведь ртуть токсична?»
ФАКТ: Безусловно! Но ничтожные количества ртути, которые содержаться в вакцинах, вреда здоровью причинить не могут! Все зависит от дозы! «В ложке — лекарство, в чашке — яд» – слова Парацельса.
«Никто в мире столько вакцин не ставит»
ФАКТ: Ставят. Даже еще больше, чем в нашем Национальном календаре!
«Вакцины не имеют эффекта, это производители зарабатывают деньги»
ФАКТ: Следуя этой логике, легче и проще производить лекарства. Чем больше больных — тем лучше.
Чем больше больных — тем лучше.
«А осложнения?»
ФАКТ: Дорогие родители! Не все события, наблюдаемые после прививки, являются следствием вакцинации! Вакцины — не единственный фактор, влияющий негативно на здоровье. Существует много всего: генетика, плохая экология, неправильное питание и т.п.
Энтеровирусная инфекция — Грязинская ЦРБ
Энтеровирусная инфекция
В последние годы наметилась четкая тенденция активизации энтеровирусной инфекции в мире, о чем свидетельствуют постоянно регистрируемые в разных странах эпидемиологические подъемы заболеваемости и вспышки. География энтеровирусных инфекций чрезвычайно широка и охватывает все страны мира.
Болезнь поражает в первую очередь детей.
Что же это такое – энтеровирусная инфекция?
Энтеровирусная инфекция – это группа острых инфекционных болезней, вызываемых кишечными вирусами (энтеровирусами). Эти вирусы способны поражать центральную нервную систему, сердце и сосуды, желудочно – кишечный тракт, легкие, печень, почки и др. органы. Существует множество типов энтеровирусов. Все они отличаются высокой устойчивостью во внешней среде, способны сохранять жизнеспособность в воде поверхностных водоемов и влажной почве до 2-х месяцев.
органы. Существует множество типов энтеровирусов. Все они отличаются высокой устойчивостью во внешней среде, способны сохранять жизнеспособность в воде поверхностных водоемов и влажной почве до 2-х месяцев.
Как можно заболеть энтеровирусной инфекцией, и кто может заболеть?
Источником инфекции является человек (больной или вирусоноситель). Заболеть может любой из нас, но чаще болеют дети и молодые люди. Энтеровирусам свойственна высокая контагиозность (заразность). Болеют чаще летом и осенью. Передача инфекции осуществляется водным, пищевым, контактно – бытовым путями, а также воздушно –капельным и пылевым путями. Эпидемиологическую значимость представляет вода открытых водоемов. Энтеровирусная инфекция распространена повсеместно. То есть подхватить энтеревирус (а их более 60 разновидностей) можно как угодно: съев плохо помытое яблоко, выпив некипяченой воды, подержавшись за поручень в автобусе и т. д. В конечном счете, все решает состояние иммунитета человека: люди, у которых он ослаблен ( дети, пожилые, хронические больные) имеют более высокие шансы заразиться. Иммунитет после перенесенного заболевания достаточно продолжительный (до нескольких лет).
Иммунитет после перенесенного заболевания достаточно продолжительный (до нескольких лет).
Каковы проявления энтеровирусной инфекции?
Энтеровирусная инфекция характеризуется разнообразием клинических проявлений и множественными поражениями органов и систем. Одним из проявлений болезни является серозный менингит. Менингит – это воспаление оболочек головного и спинного мозга. Есть несколько видов менингита, они отличаются по симптомам и способам лечения. Основные симптомы – головная боль, озноб, лихорадка, повышение температуры, тошнота, обостренная реакция на свет и звук. На ранней стадии, особенно у детей, заболевание сопровождается раздражительностью и сонливостью.
По сути, менингит – одно из клинических проявлений какой-либо инфекции. Протекает серозный менингит при энтеровирусной инфекции , в отличие от гнойного, намного легче, быстрее лечится, чаще всего исход благоприятный, и крайне редки случаи стойких негативных последствий. Также инфекция может протекать с поражением желудочно –кишечного тракта (понос, боли в животе, метеоризм, нечастая рвота). Респираторная (катаральная) форма проявляется заложенностью носа, сухим редким кашлем, покраснением ротоглотки. Наиболее частая форма энтеровирусной инфекции — это энтеровирусная лихорадка (3-х дневная лихорадка),протекает с умеренными симптомами интоксикации, самочувствие нарушено мало, температура сохраняется 2-4 дня. Энтеровирусная экзантема характеризуется появлением с 1-2 дня болезни на лице, туловище, конечностях высыпаний розового цвета. Для паралитической формы энтеровирусной инфекции характерно развитие острых вялых параличей одной или обеих ног, реже рук с выраженным болевым синдромом мышечного характера. Возможно поражение сердца от незначительных нарушений до тяжелых поражений сердечной деятельности. Наибольшую опасность конечно же представляют тяжелые клинические формы с поражением нервной системы.
Респираторная (катаральная) форма проявляется заложенностью носа, сухим редким кашлем, покраснением ротоглотки. Наиболее частая форма энтеровирусной инфекции — это энтеровирусная лихорадка (3-х дневная лихорадка),протекает с умеренными симптомами интоксикации, самочувствие нарушено мало, температура сохраняется 2-4 дня. Энтеровирусная экзантема характеризуется появлением с 1-2 дня болезни на лице, туловище, конечностях высыпаний розового цвета. Для паралитической формы энтеровирусной инфекции характерно развитие острых вялых параличей одной или обеих ног, реже рук с выраженным болевым синдромом мышечного характера. Возможно поражение сердца от незначительных нарушений до тяжелых поражений сердечной деятельности. Наибольшую опасность конечно же представляют тяжелые клинические формы с поражением нервной системы.
Как осуществляется лечение данной инфекции?
Лечатся пациенты как в домашних условиях так и в стационаре .Обязательной госпитализации подлежат больные с поражением нервной системы, сердца и глаз. Обязательной изоляции подлежат лица из организованных коллективов и проживающие в общежитиях. Лечение осуществляют врачи-инфекционисты, терапевты , педиатры, а стационарное лечение осуществляется в инфекционных стационарах .Препаратов, действующих на данный вирус непосредственно нет. Для лечения используются препараты оказывающие противовирусное действие (виферон, кипферон, генферон, амиксин, арбидол др.). Назначаются витамины, общеукрепляющие средства и средства для лечения различных симптомов болезни. Курс лечения продолжается от 5-7 дней до 2-3недель.
Обязательной изоляции подлежат лица из организованных коллективов и проживающие в общежитиях. Лечение осуществляют врачи-инфекционисты, терапевты , педиатры, а стационарное лечение осуществляется в инфекционных стационарах .Препаратов, действующих на данный вирус непосредственно нет. Для лечения используются препараты оказывающие противовирусное действие (виферон, кипферон, генферон, амиксин, арбидол др.). Назначаются витамины, общеукрепляющие средства и средства для лечения различных симптомов болезни. Курс лечения продолжается от 5-7 дней до 2-3недель.
Как избежать заражения энтеровирусной инфекцией?
Чтобы уберечь себя и своих детей от энтеровирусной инфекции надо соблюдать элементарные правила личной гигиены: тщательно мыть руки перед кормлением ребенка, после посещения туалета, перед приемом пищи. Кроме того, необходимо тщательно мыть овощи и фрукты, ополаскивая их кипяченой водой. Для предупреждения заболевания энтеровирусной инфекцией необходимо соблюдать меры профилактики, в основном, те же, что и при кишечных инфекциях:
— соблюдение правил хранения пищевых продуктов и приготовления готовых блюд;
— питьевой режим с преимущественным использованием бутилированной воды, преимущественно, в детских и медицинских организациях;
— при появлении признаков респираторного или острого кишечного заболевания , в т. ч. у детей организованных учреждений, — вызов врача на дом;
ч. у детей организованных учреждений, — вызов врача на дом;
— текущая дезинфекция в домашних условиях с применением дезинфицирующих средств, действующих на вирусы;
— применение средств неспецифической профилактики: иммуномодуляторов и противовирусных препаратов, назначаемых медработником;
— в домашних очагах медицинское наблюдение за детьми дошкольного возраста и взрослыми, работающими на пищевых, коммунально-бытовых объектах, в детских учреждениях.
Несмотря на жаркое лето, категорически запрещается купание во всех открытых водоемах, т.к. практически все открытые водоемы инфицированы энтеровирусами.
Учитывая возможную передачу энтеровирусов воздушно-капельным путем, необходимо соблюдать масочный режим при возникновении в коллективе или в семье случая заболевания энтеровирусной инфекции. Помещения необходимо тщательно проветривать. Наиболее эффективно сквозное проветривание.
Помните, что заболевание легче предупредить, соблюдая элементарные меры профилактики, чем лечить..gif)
Будьте здоровы!
Врач-инфекционист Трофимова Елена Николаевна.
ПАМЯТКА ДЛЯ НАСЕЛЕНИЯ
Энтеровирусная инфекция
Распространенность и пути передачи
– группа острых заболеваний, вызываемых энтеровирусами (более 90 типов) и характеризующееся многообразием клинических проявлений от легких лихорадочных состояний до тяжелых с поражением оболочек мозга, сердечной мышцы, периферических нервов. Энтеровирусы устойчивы во внешней среде и длительное время могут сохраняться в сточных водах, плавательных бассейнах, открытых водоемах, предметах обихода, продуктах питания (молоко, фрукты, овощи). Вирус быстро погибает при прогревании, кипячении.
Максимальная заболеваемость регистрируется в летне-осенние месяцы. ЭВИ характеризуются высокой контагиозностью и быстрым распространением заболевания.
Возможные пути передачи инфекции: чаще всего осуществляется водным (особую эпидемиологическую значимость в летнее время представляет вода бассейнов, открытых водоемов, используемая в качестве рекреационных зон для купания населения), пищевым и контактно-бытовым путями, в отдельных случаях не исключается и аэрозольный механизм инфицирования (воздушно-капельным и пылевым путями).
Источник инфекции: больные; вирусоносители; больные бессимптомной формой.
Иммунитет: восприимчивость всеобщая, после перенесенного заболевания человек остается защищенным только против ЭВИ, вызванным данным типом вируса и остается риск инфицирования всеми другими энтеровирусами, циркулирующими на территории. В настоящее время каких-либо специфических средств профилактики (вакцины) и леченияпротив данной инфекции не существует.
Клинические проявления могут протекать в форме ОРВИ, герпетических ангин, экзантем (с кожными высыпаниями на туловище и конечностях), тяжелых менингоэнцефалитов, миокардитов, невритов. Наиболее часто регистрируемой и тяжелой формой энтеровирусной инфекции является серозный вирусный менингит.
При серозном менингите заболевание начинается остро, с подъема температуры тела до 39-40 градусов. Появляется сильная головная боль, головокружение, тошнота, рвота, иногда боли в животе, в тяжелых случаях – судороги и нарушение сознания, нерезко выраженные катаральные проявления со стороны ротоглотки, верхних дыхательных путей.
Меры профилактики
Чтобы свести риск заражения энтеровирусной инфекцией до минимума, рекомендуем придерживаться следующих правил:
- Не пить воду из непроверенных источников, при употреблении напитков в общественных точках и из питьевых фонтанчиков предпочтительнее использовать индивидуальный одноразовый стакан.
- Не использовать для питья воду из случайных природных водоисточников (колодцы, фонтаны, ключи, озера, реки и т.д).
- Тщательно мыть фрукты и овощи водой гарантированного качества (бутилированная, кипяченая).
- При купании в открытых водоемах, плавательных бассейнах избегать попадания воды в рот. Помните, что это наиболее вероятная возможность заразиться.
- Не купаться в непроточных водоемах и фонтанах, в местах несанкционированных пляжей.
- При осложнении эпидемиологической ситуации избегать и максимально сократить пребывание в закрытых помещениях, в местах массового скопления людей, контакты с больными людьми.

- Соблюдать элементарные правила личной гигиены (мытье рук перед едой и приготовлением пищи, после возвращения с улицы, посещения туалета, контакта с больными людьми).
- Проводить влажную уборку жилых помещений (желательно ежедневно), проветривание помещений.
- Не приобретать продукты у частных лиц, в неустановленных для торговли местах.
В целях раннего выявления заболевания необходимо наблюдение за людьми, бывшими в контакте с больным, с термометрией не реже 2 раз в день в течение 20 дней.
Алгоритм действий
При появлении вышеперечисленных симптомов заболевания Вам необходимо:
▪ не заниматься самолечением;
▪ не посещать самостоятельно поликлинику;
▪ срочно обратиться за медицинской помощью путем вызова на дом врача из поликлиники по месту жительства или (в случае тяжелого состояния) скорой медицинской помощи;
▪ до прихода врача срочно изолировать больного, свести к минимуму контакт с окружающими Вас людьми.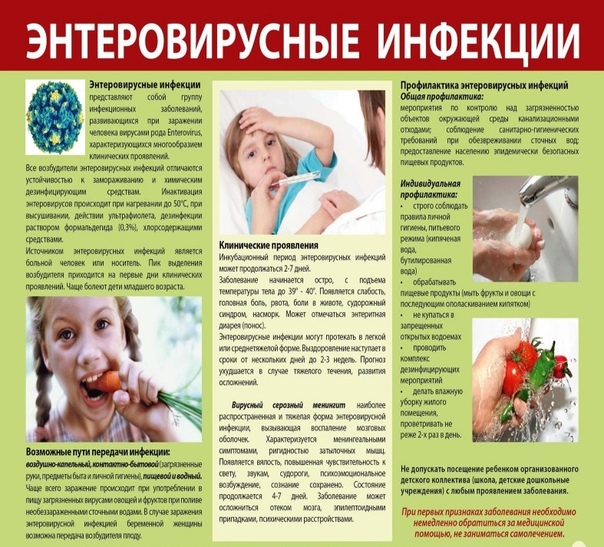
Убедительно просим Вас соблюдать меры профилактики
и серьезно относиться к своему здоровью!
Управление Роспотребнадзора по Липецкой области, 398002, г. Липецк, ул. Гагарина, 60а, тел. 308 8
Памятка для населения по профилактике энтеровирусной инфекции
Энтеровирусная инфекция (ЭВИ) — группа острых заболеваний, вызванных энтеровирусами,
с многообразием клинических проявлений от легких лихорадочных состояний до тяжелых менингоэнцефалитов, миокардитов. ЭВИ характеризуются
высокой контагиозностью и быстрым распространением заболевания. Случаи заболеваний регистрируются в течение всего года, но
максимальная заболеваемость ЭВИ приходится на летне-осенние месяцы. Инфекция передается воздушно-капельным, пищевым, водным
и контактно-бытовыми путями. Источником инфекции являются больные люди, вирусоносители, больные бессимптомной формой.
Источником инфекции являются больные люди, вирусоносители, больные бессимптомной формой.
Энтеровирусы устойчивы во внешней среде и длительное время могут сохраняться в сточных водах, плавательных бассейнах, открытых
водоемах, на предметах обихода, продуктах питания (молоко, фрукты, овощи). Вирус быстро погибает при прогревании, кипячении.
Заболевание начинается остро, с подъема температуры тела до 39-40 градусов. Появляется сильная головная боль, головокружение,
рвота, иногда боли в животе, спине, судорожный синдром, не резко выраженные катаральные проявления со стороны ротоглотки,
верхних дыхательных путей, возможны кожные высыпания. Серозный вирусный менингит является наиболее типичной и тяжелой формой
энтеровирусной инфекции.
При появлении аналогичных жалоб необходимо срочно изолировать больного, т. к. он является источником заражения для окружающих,
к. он является источником заражения для окружающих,
не заниматься самолечением, не посещать самостоятельно поликлинику и обратиться за медицинской помощью путем вызова на дом
врача из поликлиники по месту жительства, при тяжелом состоянии больного – вызвать скорую медицинскую помощь.
Территория Удмуртской Республики остается неблагополучной по заболеваемости ЭВИ. Начиная с 2005г. зарегистрированы эпидемические
подъемы заболеваемости, отмечена вспышечная (групповая) заболеваемость в Шарканском, Вавожском, Каракулинском, Балезинском
районах, г.Ижевске. Основными причинами заболевания послужило несоблюдение санитарно-гигиенических требований по благоустройству
городов и районов республики, купание, особенно детей, в открытых водоемах, не предусмотренных для данных целей, пренебрежение
правилами личной гигиены..gif) В 2013г. в республике продолжался рост заболеваемости ЭВИ по сравнению с 2012г. на 34%, в том числе
В 2013г. в республике продолжался рост заболеваемости ЭВИ по сравнению с 2012г. на 34%, в том числе
серозными менингитами энтеровирусной этиологии в 1,4 раза.
Меры профилактики
Чтобы свести риск заражения энтеровирусной инфекции до минимума, рекомендуем придерживаться следующих правил:
-Употреблять для питья только кипяченую или бутилированную воду и напитки в фабричной расфасовке.
-Не использовать для питья воду из случайных природных источников – колодцы, фонтаны, ключи, озера, реки и т.д.
-Тщательно мыть фрукты и овощи водой гарантированного качества (бутилированная, кипяченая).
-Купаться в местах, отведенных для купания.
-При купании в открытых водоемах, плавательных бассейнах исключить попадание воды в полость рта. Помните, что это наиболее
вероятная возможность заразиться.
-Соблюдать элементарные правила личной гигиены.
-При нахождении на территории неблагоприятных по заболеваемости ЭВИ регионов РФ (Ростовская, Липецкая области, Краснодарский
край и т.д.), на территории КНР и регионов РФ, граничащих с КНР (Читинская, Амурская области, Еврейская автономная область,
Хабаровский и Приморский край) или прибытии из них, при выявлении симптомов ЭВИ (сыпь на лице, руках и ногах, лихорадка, респираторный
синдром расстройство желудочно-кишечного тракта и др. ) необходимо незамедлительно обратиться за медицинской помощью в лечебное
) необходимо незамедлительно обратиться за медицинской помощью в лечебное
учреждение.
-Для предупреждения заражения при выезде в неблагополучные по заболеваемости ЭВИ страны и регионы РФ проконсультироваться
с врачом об использовании противовирусных препаратов.
Профилактика энтеровирусной инфекции | ГАУЗ «Краевой клинический кожно-венерологический диспансер»
Профилактика энтеровирусной инфекции
(ПАМЯТКА для родителей)
Энтеровирусные инфекции (ЭВИ) — группа острых заболеваний, вызываемых энтеровирусами, характеризующихся многообразием клинических проявлений от легких лихорадочных состояний до тяжелых менингитов.
Энтеровирусы устойчивы во внешней среде и длительное время могут сохраняться в сточных водах, плавательных бассейнах, открытых водоемах, предметах обихода, продуктах питания (молоко, фрукты, овощи). Вирус быстро погибает при прогревании, кипячении.
Вирус быстро погибает при прогревании, кипячении.
ЭВИ характеризуются быстрым распространением заболевания.
Как передается энтеровирусная инфекция
Механизм передачи может быть воздушно-капельный (при чихании и кашле с капельками слюны от больного ребенка к здоровому) и фекально-оральный при не соблюдении правил личной гигиены. Чаще всего заражение происходит через воду, при употреблении сырой (не кипяченой) воды. Так же возможно заражение детей через игрушки, если дети их берут в рот.
Болеют чаще всего дети в возрасте от 3 до 10 лет. У детей, находящихся на грудном вскармливании, в организме присутствует иммунитет, полученный от матери через грудное молоко, однако, этот иммунитет не стойкий и после прекращения грудного вскармливания быстро исчезает.
Быстрое распространение ЭВИ при не соблюдении мер, направленных на их профилактику отмечается в организованных детских учреждениях, особенно в период формирования коллективов — в сентябре.
Инкубационный период (период от попадания вируса в организм ребенка, до появления первых клинических признаков) у всех энтеровирусных инфекций одинаковый – от 2 до 10 дней (чаще 2-5 дней).
Серозный вирусный менингит является наиболее типичной и тяжелой формой энтеровируской инфекции.
Источником инфекции являются больные и вирусоносители, в том числе больные бессимптомной формой.
Заболевание начинается остро, с подъема температуры тела до 39-40 градусов. Появляется сильная головная боль, головокружение, рвота, иногда боли в животе, спине, судорожный синдром, нередко выраженные катаральные проявления со стороны ротоглотки, верхних дыхательных путей.
При появлении аналогичных жалоб необходимо срочно изолировать больного, т.к. он является источником заражения, для окружающих, и обратиться к врачу.
Учитывая возможные пути передачи, меры личной профилактики должны заключаться в соблюдении правил личной гигиены, соблюдении питьевого режима (кипяченая вода, бутилированная вода), тщательной обработки употребляемых фруктов, овощей и последующим ополаскиванием кипятком.
Рекомендуется влажная уборка жилых помещений не реже 2 раз в день, проветривание помещений.
Ни в коем случае не допускать посещения ребенком организованного детского коллектива (школа, детские дошкольные учреждения) с любыми проявлениями заболевания.
Профилактика энтеровирусной инфекции
Большая роль в профилактике заболеваемости ЭВИ среди детей отводится родителям. Именно вы должны научить ребенка правилам личной гигиены, употреблять только качественные помытые фрукты, овощи и ягоды, пить кипяченную или бутилированную воду.
При регистрации в семье случая заболевания простудными инфекциями, необходимо изолировать больного в квартире, выделить отдельную посуду, не допускать до больного детей, ухаживать должен один из членов семьи, при кашле и чихании прикрывать нос одноразовым платочком, проводить текущую уборку с применением дезинфицирующих средств, проводить регулярное проветривание помещений.
Возможно применение средств экстренной профилактики ЭВИ, в том числе при контакте с больным (противовирусных и иммуномодулирующих препаратов), но только после консультации с лечащим врачом.
Ротавирусная инфекция, лечение | H-Clinic
11.12.2019
Ротавирусная инфекция – это острая вирусная инфекция желудочно-кишечного тракта, которая клинически проявляется в виде гастроэнтерита и может сопровождаться поражением органов дыхания, в связи с чем ее так же называют кишечным гриппом. Ротавирус поражает и детей, и взрослых, однако у взрослых заболевание чаще протекает в легкой форме или бессимптомно. Основными клиническими проявлениями болезни у взрослых являются тошнота, потеря аппетита и спазматическая боль в животе. При этом, наличие диареи у взрослого пациента не так опасно, как у детей. У детей и людей пожилого возраста ротавирусный гастроэнтерит может привести к значительной степени обезвоживания вплоть до летального исхода.
Во всем мире ротавирус вызывает около 125 млн случаев детской диареи ежегодно и является самой главной причиной обезвоживания. Более 2 млн детей ежегодно госпитализируются из-за ротавирусного гастроэнтерита и около 500тыс. умирают от этой болезни.
По оценочным данным, практически каждый ребенок в мире инфицируется ротавирусом в возрасте от 3 до 5 лет. В странах с низким доходом средний возраст заболеваемости детей – от 6 до 9 месяцев и 80% ротавирусных инфекций развиваются в возрасте до года. В странах с высоким доходом заболеваемость немного отсрочена – от 2 до 5 лет и 65% заболевают в возрасте до года.
Диагностикой и лечением больных с ротавирусными гастроэнтеритами занимается врач-инфекционист. Но при появлении первых симптомов заболевания люди обычно обращаются к семейному врачу, к педиатру — в случае заболевания ребенка или вызывают скорую помощь. Важно своевременно распознать признаки обезвоживания, особенно у детей младшего возраста и незамедлительно начать адекватное лечение.
До семидесятых годов двадцатого века причина кишечных инфекций устанавливалась лишь в 30% случаев. В 1973 году Рут Бишоп с коллегами выделили и, с помощью электронной микроскопии, описали вирусные частицы из тканей кишечника у детей с клиническим гастроэнтеритом. Их назвали ротавирусами – за характерный внешний вид, напоминающий колесо (rota по латыни – колесо).
Возбудитель ротавирусного гастроэнтерита – вирус из отряда Rotavirus, семейства Reoviridae.
Вирион представляет из себя 2-цепочечную фрагментированную РНК из 11 фрагментов, которая содержится внутри 3-слойного капсида.
Благодаря трехслойной оболочке, вирус устойчив в окружающей среде. Он может сохранять жизнеспособность до нескольких часов на руках, а на сухих твердых поверхностях до нескольких недель и даже месяцев, если не применялись дезинфицирующие средства.
Ротавирус попадает в организм через рот и размножение вируса происходит в тонком кишечнике, что в свою очередь приводит к нарушению всасывания натрия, глюкозы, воды, снижению активности лактазы, щелочной фосфатазы и сахаразы, и в результате к возникновению изотонической диареи, обезвоживанию, дисбалансу электролитов и метаболическому ацидозу.
Иммунный ответ изучен не полностью. Важную роль в иммунной защите организма, а так же в восстановлении после заболевания играют антитела, циркулирующие в плазме и в слизистых оболочках, выработанные в ответ на внедрение вируса.
Ребенок, переболевший ротавирусным гастроэнтеритом, не имеет пожизненно стойкого иммунитета и повторное заражение возможно в любом возрасте. С каждым последующим инфицированием иммунная защита выше, а клинические проявления заболевания все более легкие.
Вирус очень заразен, легко передается от человека к человеку, распространяется в семьях, детских садах и больницах. Распространять вирус могут как взрослые и дети с клиническими проявлениями, так и с бессимптомным течением заболевания. Наибольший риск для заражения ротавирусом имеют дети от 4 до 24 месяцев. Взрослые могут заразиться при уходе за инфицированным ребенком.
Резервуаром инфекции является желудочно-кишечный тракт больного. Механизм передачи – фекально-оральный, реализация передачи происходит, если:
• не соблюдаются гигиенические нормы и правила (частота и качество) мытья рук;
• человек касается рта после прикосновения к предмету (подгузник, игрушка), загрязненному зараженным калом;
• употребляют пищу или питьевую воду, загрязненную вирусом (редко).
Наибольшее количество вируса в биоматериале обнаруживается за 2 дня до проявления симптомов болезни и сохраняется до 10 дней после их исчезновения.
Стоит отметить, что лица с иммунодефицитом могут распространять вирус намного дольше, так как в их кале вирус может обнаруживаться до 30 дней после выздоровления.
В основном заболеваемость сезонная – в осенне-зимний период. Инкубационный период развития заболевания достаточно короткий – менее 48 часов.
Клинические проявления варьируют, в зависимости от того, первое это инфицирование или повторное. Таким образом, течение заболевания может быть бессимптомным, может ограничиваться умеренным диарейным синдромом, а может проявляться тяжелой диареей, приводящей к обезвоживанию, сопровождающейся лихорадкой и рвотой. Наиболее тяжелое течение заболевания отмечается при первичном инфицировании детей первых 6 месяцев жизни. У трети детей с ротавирусной инфекцией заболевание сопровождается высокой лихорадкой до 39С.
При опросе заболевшие нередко упоминают о недавнем контакте с больным человеком.
Наиболее распространенные симптомы:
• снижение аппетита, тошнота, рвота
• лихорадка
• водянистый стул без крови, диарея может привести к развитию обезвоживания
• боли в животе
При физикальном осмотре не выявляется примечательных симптомов, за исключением симптомов, которые могут быть связаны с развитием обезвоживания: заторможенность, снижение диуреза, отсутствие слез при плаче, сухая холодная кожа, сухие слизистые ротовой полости, впалые глаза или родничок, выраженная жажда.
Гастроинтестинальные симптомы (рвота и диарея) разрешаются в течение 3-7 дней. У людей с иммунодефицитными состояниями заболевание может приобретать тяжелый персистирующий характер с дальнейшим развитием полиорганных поражений.
Клинические проявления заболевания достаточно неспецифичны, поэтому для подтверждения диагноза требуется проведение лабораторного тестирования.
Лабораторная диагностика ротавирусной инфекции основана на выявлении специфических антигенов вируса в образцах кала.
Основным методом, который используется в этих целях, является ИФА (иммуноферментный анализ) – применение специализированных коммерческих тест-систем, которые позволяют обнаружить антигены в исследуемом материале в среднем в течение 5 дней от начала заболевания.
Так же могут быть использованы электронная микроскопия, ПЦР-методика. У 2/3 всех детей с гастроэнтеритами ротавирусной этиологии тяжелого течения антиген ротавируса может быть обнаружен в плазме крови на 3-7 день от начала заболевания, но сейчас в рутинной практике применяется только исследование образцов кала.
Специфического лечения ротавирусного гастроэнтерита не существует. При этом следует отметить, что показана регидратационная, симптоматическая терапия и противопоказана антибактериальная, так как антибактериальные препараты бесполезны в борьбе с вирусами, но могут способствовать дальнейшему прогрессированию дисбактериоза кишечника и в результате ухудшению состояния больного.
Основа терапии это адекватное восполнение водного и электролитного баланса – в основном, за счёт оральной регидратации – с этой целью можно использовать препарат «Регидрон» — 1пакетик развести в 1литре холодной кипяченной воды, принимать дробно по 5-100мл каждые3-5минут в течение 3-5 часов. Препарат противопоказан при гиперчувствительности и сахарном диабете, почечной недостаточности, стоимость упаковки 20 пакетиков – 370-400р. Можно применять и домашние методы приготовления регидратационных растворов — воду с добавлением соли (из расчета 1 чайная ложка поваренной соли на 1 литр воды), иногда и с добавлением соды и сахара.
Противорвотные препараты применяются ограниченно и только по назначению лечащего врача. Противодиарейные препараты могут применяться при затяжных эпизодах диареи, также строго по назначению доктора.
Жаропонижающие препараты могут применяться при лихорадке выше 38,5С (до этих цифр сбивать температуру не рекомендуется, если ребенок нормально ее переносит, так как повышение температуры тела указывает на активную борьбу организма с инфекцией – во время лихорадки активизируется продукция антител, ускоряется процесс фагоцитоза и т.д.) – это такие препараты как «Панадол», «Нурофен», «Цефекон» — по назначению врача.
При тяжелом течении заболевания и наличии признаков обезвоживания показана госпитализация в стационар и внутривенная регидратационнаяинфузионная терапия.
Диета при заболевании взрослых предполагает исключение молочных продуктов, кофеин-содержащих напитков, жирной и жареной, а также консервированной пищи.
После купирования острого периода, когда ребенок отказывается от еды и важна лишь адекватная регидратация, детям рекомендованы: смеси на основе сои, диетическая мягкая еда – каши на безлактозном молоке или воде, перетертые овощные супы, нежирное мясо, вареные или тушенные овощи, печеные яблоки, кисель, отвары из шиповника, компоты из сухофруктов.
Если есть заболевшие в детском саду – необходимо разделять детей с симптомами от детей без симптомов, ухаживающий персонал должен быть разным для обеих групп.
Желательно использовать спирт-содержащие средства для рук – санитайзеры или салфетки.
Соблюдение правил гигиены и мытья рук – важный фактор профилактики передачи ротавирусной инфекции, но этого не всегда достаточно. В настоящее время одним из основных методов специфической профилактики ротавирусных гастроэнтеритов является вакцинация. После внедрения вакцин заболеваемость ротавирусом существенно снизилась не только среди детей младше 5 лет, но и среди лиц старшего возраста.
Вакцины вызывают выработку иммунной защиты, так как состоят из микроорганизмов и клеточных компонентов, которые стимулируют выработку антител с определенными защитными свойствами.
В феврале 2006 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (UnitedStatesFoodandDrugAdministration, FDA) одобрило вакцину RotaTeq.
RotaTeq – пятивалентная вакцина, которая содержит 5 штаммов ротавируса (G1-4 и А) и белок Р1А (генотип Р). Режим вакцинации — 3 отдельные дозы в виде оральных капель вводятся в возрасте 2, 4, 6месяцев.
В 2008 году одобрили Rotarix (другая оральная вакцина) – защищает от гастроэнтерита, вызванного G1, G3, G4, G9 штаммов и назначается 2 дозы в возрасте от 6 до 24 недель.
Клинические испытания показали, что каждая вакцина предотвращает 74-78% всех гастроэнтеритов, вызванных ротавирусом, и практически все госпитализации по причине ротавирусных гастроэнтеритов. Минимальный рекомендуемый возраст вакцинации – 6 недель. Минимальный промежуток между дозами 4недели, максимальный — 8месяцев. Полный курс вакцинации рекомендуется завершить к возрасту 16 недель жизни и обязательно завершить к 24 неделям (6 месяцев).
Грудное вскармливание может продолжаться в обычной режиме до и после вакцинации против ротавируса.
В России в настоящее время зарегистрирована и разрешена к использованию вакцина RV5 («РотаТек»). Всемирная организация здравоохранения рекомендует внедрить вакцинацию от ротавирусной инфекции в Национальный календарь профилактических прививок и рассматривать этот метод профилактики, как приоритетный. Такая работа (вакцинация грудных детей в поликлиниках) уже проводится в некоторых регионах нашей страны.
Автор: врач Университетской клиники H-Clinic Коновалова Анастасия Александровна
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич
Возврат к списку
Лекарство от гриппа и простуды. Эффективное лечение простуды и гриппа
Простуда, или ОРВИ (острая респираторная вирусная инфекция), представляет собой широкую группу инфекционных заболеваний, которые сопровождаются схожими симптомами и поражают верхние дыхательные пути. Вирусов, которые вызывают простуду, великое множество, и протоколы лечения учитывают это. Так, на сегодняшний день науке известно более 300 штаммов пневмотропных (поражающих верхние дыхательные пути) вирусов-возбудителей простуды. В свою очередь, проводить лечение простуды или гриппа необходимо с учетом возбудителя заболевания, а терапия требует комплексного подхода.
Лечение простуды
Каждый штамм имеет свои особенности, симптомы и требует определенного лечения с применением конкретного лекарства от простуды. В зависимости от возбудителя простуда может быть более или менее заразной, иметь излюбленные локализации и симптомы, сопровождаться невысокой температурой или лихорадкой, иметь высокий или низкий риск развития осложнений и особенности лечения. Например, простуда взрослых, вызванная различными штаммами рода риновирусов и коронавирусов, чаще всего ограничивается ринитом. Простуда, вызванная штаммами рода энтеровирусов, проявляется ринитом и фарингитом (воспаление слизистой оболочки глотки). Простуда взрослых, вызванная штаммами семейства реовирусов и парамиксовирусов, проявляется бронхитом и ларингитом (воспаления слизистой оболочки гортани). Естественно, лечить простуду разных видов необходимо определенными препаратами.
Как определить простуду
Основные симптомы:
- Насморк и заложенность носа. Эти симптомы простуды встречаются едва ли не у каждого заболевшего ОРВИ и возникают вследствие отека слизистой оболочки носа. Сам по себе насморк не представляет большой опасности. Однако из-за нарушения оттока жидкости из гайморовых пазух при простуде есть риск присоединения вторичной бактериальной инфекции с развитием гайморита. Для лечения заложенности носа следует использовать сосудосуживающий препарат в форме капель или спрея.
- Покраснение глаз. Этот симптом очень характерен для гриппа и редко встречается при обычных простудах. Зачастую именно покраснение глаз и слезотечение оказываются первыми симптомами заболевания и знаком, что пора незамедлительно начать его лечение.
- Боль в горле (фарингит, реже тонзиллит). Также является типичным симптомом обычной простуды. Возникает в результате воспаления слизистой оболочки глотки (фарингит) и/или небных миндалин (тонзиллит), обычно сопровождается першением и сухостью в горле. Боль в горле обычно усиливается при глотании; ее лечение обеспечивают таблетки для рассасывания с содержанием анестетиков.
- Сухой кашель. Небольшой сухой кашель может возникать при разных формах простуды, а также в течение нескольких дней после лечения. Обычно у взрослых он бывает связан с сухостью слизистых оболочек трахеи или стеканием слизи по задней стенке глотки. Сопровождается отделением небольшого количества мокроты. Громкий «лающий» кашель, особенно приступообразного характера, является признаком поражения гортани и голосовых связок (ларингит) и характерен для парагриппа. Самостоятельно подобрать препарат от простуды не всегда возможно. Рекомендуется обратиться к врачу для постановки диагноза и назначения терапии.
- Влажный кашель. Появление кашля с отделением большого количества мокроты говорит о вовлечении в инфекционный процесс простуды трахеи и бронхов. Появление в мокроте зеленоватых сгустков может свидетельствовать о присоединении бактериальной инфекции, но также может быть обусловлено скоплениями фибрина в мокроте.
- Повышение температуры. В большинстве случаев для простуды характерно повышение температуры до 38-38,5 градусов. Обычно высокая температура сохраняется на протяжении 3-4 дней лечения, после чего спадает. При парагриппе температура до 38,5 градусов у взрослых может сохраняться до 7 и более дней. Повышение температуры до 39 и более градусов характерно для гриппа и является поводом для вызова врача, который пропишет эффективное средство от гриппа и простуды.
Важно: если влажный кашель и высокая температура сохраняются более 7 дней или мокрота приобрела пенистый характер с красноватым оттенком, лечить простуду жизненно необходимо – возможно, ОРВИ осложнилась пневмонией.
Симптомы гриппа и парагриппа
Однако наибольшую опасность для взрослых людей представляют не простуды, а вирусы гриппа. Заболевания, вызванные этими возбудителями, протекают наиболее тяжело, характеризуются высоким риском осложнений и нередко приводят к летальным исходам. Чтобы избежать неприятных последствий, основные признаки гриппа и парагриппа у взрослых желательно знать, а лечение гриппа осуществлять под наблюдением врача.
Отдельно перечислим основные симптомы гриппа и парагриппа.
Грипп:
- острое начало;
- слезотечение и покраснение глаз;
- лихорадка, ознобы – температура тела может подниматься до 39,5-40 градусов;
- нет заложенности носа, она появляется только на 3-4 день заболевания;
- головная боль, тошнота; неуклонное нарастание этих симптомов может оказаться признаком вирусного менингита;
- ломота в теле, слабые боли в мышцах и суставах, утомляемость.
Парагрипп:
- постепенное начало с насморка и болей в горле;
- осиплость голоса;
- сухой громкий «лающий» кашель, иногда приступообразного характера;
- температура повышается до 38-38,5 градусов и сохраняется до 7 и более дней;
- у детей до 5 лет спазм голосовых связок может вызывать удушье.
Заметив подобные симптомы, обратитесь к специалисту, который подберет оптимальное и эффективное средство от гриппа и простуды.
№ регистрации | Название |
2752872 | ИНГИБИТОР РЕПЛИКАЦИИ КОРОНАВИРУСА SARS-COV-2 НА ОСНОВЕ ГУМИНОВЫХ ВЕЩЕСТВ |
2753606 | АНТИБАКТЕРИАЛЬНОЕ ГУМИНОВОЕ СРЕДСТВО |
2753609 | ПРОТИВОВИРУСНОЕ ГУМИНОВОЕ СРЕДСТВО |
2751488 | СПОСОБ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ |
2751108 | ПРОТИВОВИРУСНАЯ КОМПОЗИЦИЯ |
2747890 | СРЕДСТВО ДЛЯ СНИЖЕНИЯ РИСКА И ОБЛЕГЧЕНИЯ СИМПТОМОВ ЗАРАЖЕНИЯ БЕТА-КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ |
2747550 | СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ ИНТЕРСТИЦИАЛЬНОЙ ПНЕВМОНИИ |
2747467 | СПОСОБ ЗАЩИТЫ ОТ КОРОНАВИРУСНОЙ ИНФЕКЦИИ |
2747156 | СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ С ХРОНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ОРГАНОВ ДЫХАНИЯ |
2747408 | СПОСОБ КОМПЛЕКСНОГО ЛЕЧЕНИЯ НАРУШЕНИЯ ГЕМОДИНАМИКИ БУЛЬБАРНОЙ КОНЪЮНКТИВЫ У ЛИЦ, ПЕРЕНЕСШИХ COVID-19 АССОЦИИРОВАННУЮ ПНЕВМОНИЮ |
2747018 | ИНГИБИТОР РЕПЛИКАЦИИ КОРОНАВИРУСА SARS-COV-2 НА ОСНОВЕ МЕЛАНИНА ИЗ ГРИБА INONOTUS OBLIQUUS |
2746692 | НОВЫЕ СОСТАВЫ 2-(ИМИДАЗОЛ-4-ИЛ)-ЭТАНАМИДА ПЕНТАНДИОВОЙ-1,5 КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИРУСНЫХ ЗАБОЛЕВАНИЙ |
2746161 | ФАРМАЦЕВТИЧЕСКИЙ НАБОР ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ COVID19 (SARSCOV2) И СПОСОБ ЕГО ПРИМЕНЕНИ |
2746362 | КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНЫМ ЭФФЕКТОМ В ОТНОШЕНИИ НОВОГО КОРОНАВИРУСА SARS-COV-2 |
2745774 | СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ С НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ (COVID-19) |
2745986 | ПРОТИВОКОРОНАВИРУСНОЕ СРЕДСТВО ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ COVID-19 (SARS-COV-2) И СПОСОБ ЛЕЧЕНИЯ |
2745985 | АНТИКОРОНАВИРУСНЫЙ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ — ЗАМЕЩЕННЫЙ 7-ГИДРОКСИ-3,4,12,12А-ТЕТРАГИДРО-1H-[1,4]ОКСАЗИНО[3,4-C]ПИРИДО[2,1-F][1,2,4]ТРИАЗИН-6,8-ДИОН ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ COVID-19 |
2745535 | СПОСОБ ЛЕЧЕНИЯ COVID19 ПНЕВМОНИИ |
2744429 | ПРОТИВО-РНК ВИРУСНОЕ, В ТОМ ЧИСЛЕ ПРОТИВОКОРОНАВИРУСНОЕ СРЕДСТВО — ЗАМЕЩЕННЫЙ ХИНОКСАЛИН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ |
2744274 | МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К RBD ФРАГМЕНТУ В СОСТАВЕ S БЕЛКА ВИРУСА SARS-COV-2 |
2742505 | АЭРОЗОЛЬ ДЛЯ ИНВАЗИВНОЙ МЕХАНИЧЕСКОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ ПРИ COVID-19 |
2741714 | ИНГИБИТОР РЕПЛИКАЦИИ КОРОНАВИРУСА SARS-COV-2 НА ОСНОВЕ ВОДНОГО ЭКСТРАКТА ГРИБА INONOTUS OBLIQUUS |
2742116 | ПРОТИВОКОРОНАВИРУСНОЕ СРЕДСТВО ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ COVID-19 |
2741502 | СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ 2МЕТИЛТИО6НИТРО1,24ТРИАЗОЛО[5,1С]1,2,4ТРИАЗИН7ОНА, ДИГИДРАТА, ОБЛАДАЮЩЕЙ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID19 |
2739212 | ПРЕПАРАТ ДЛЯ КОМПЛЕКСНОЙ ТЕРАПИИ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ БЕТА-КОРОНАВИРУСАМИ |
2738686 | СПОСОБ СНИЖЕНИЯ ТЯЖЕСТИ ГИПОКСИИ У ПАЦИЕНТОВ С КОРОНАВИРУСОМ, НАХОДЯЩИХСЯ НА ИВЛ |
2738719 | СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ КОРОНАВИРУСНЫХ, РЕТРОВИРУСНЫХ ИНФЕКЦИЙ И ГЕПАТИТА С |
2366411 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2654482 | КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ВИРУСНОЙ ПОЛИМЕРАЗЫ |
2622640 | СЕЛЕКТИВНЫЕ И ОБРАТИМЫЕ ИНГИБИТОРЫ УБИХИТИН-СПЕЦИФИЧЕСКОЙ ПРОТЕАЗЫ 7 |
2718690 | СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ |
2505306 | КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2431476 | МАТЕРИАЛЫ И СПОСОБЫ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ С ПОМОЩЬЮ СОЕДИНЕНИЯ ЦИСТЕАМИНА |
2380100 | СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГРИППА А И В |
2301669 | ПРИМЕНЕНИЕ СОЕДИНЕНИЙ АНТИВИРУСНОГО КЛАССА ДЛЯ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИРУСНОЙ ИНФЕКЦИИ ДЫХАТЕЛЬНОГО ТРАКТА |
2518314 | СПОСОБ И СРЕДСТВО АКТИВАЦИИ IRF-3 ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ (+) PHK-СОДЕРЖАЩИМИ ВИРУСАМИ |
2580304 | ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ СУММЫ ФЛАВОНОИДОВ ИЗ Alchemilla vulgaris L. |
2504397 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФЕРМЕНТ РИБОНУКЛЕАЗУ И ГЛИЦИРРИЗИНОВУЮ КИСЛОТУ ИЛИ ЕЕ СОЛИ: ГЛИЦИРРИЗИНАТ АММОНИЯ, ИЛИ ДИКАЛИЯ, ИЛИ ТРИНАТРИЯ |
2398596 | СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА ПТИЦ A/H5N1, С ИСПОЛЬЗОВАНИЕМ ИНДУКТОРА ИНТЕРФЕРОНА И ИНГИБИТОРА НЕЙРАМИНИДАЗЫ |
2665848 | ИММУНОГЕННАЯ ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ, СОДЕРЖАЩАЯ РЕКОМБИНАНТ ЖИВОЙ БЦЖ, ВЫДЕЛЯЮЩИЙ АНТИГЕНЫ МЕТАПНЕВМОВИРУСА (HMPV) В СУСПЕНЗИЮ, ПРИГОТОВЛЕННУЮ ИЗ ЛИОФИЛИЗАТА БЕЗ ДОБАВЛЕНИЯ АДЪЮВАНТА |
2501560 | КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФЕРМЕНТ РИБОНУКЛЕАЗУ И/ИЛИ СТЕАРИЛГЛИЦИРРЕТИНАТ ИЛИ ГЛИЦИРРИЗИНОВУЮ КИСЛОТУ ИЛИ ЕЕ СОЛИ — ГЛИЦИРРИЗИНАТ АММОНИЯ, ИЛИ ДИКАЛИЯ, ИЛИ ТРИНАТРИЯ |
2441647 | ВИРОСОМЫ, ВКЛЮЧАЮЩИЕ ГЕМАГГЛЮТИНИН, ВЫДЕЛЕННЫЙ ИЗ ВИРУСА ГРИППА, ПОЛУЧЕННОГО В ЛИНИИ КЛЕТОК, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ ВИРОСОМЫ, СПОСОБЫ ИЗГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ |
2586283 | ИНЪЕКЦИОННЫЙ ИЛИ ИНФУЗИОННЫЙ РАСТВОР L-АРГИНИНИЕВОЙ СОЛИ 5-МЕТИЛ-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-а]ПИРИМИДИН-7-ОНА МОНОГИДРАТА ДЛЯ ТЕРАПИИ ГРИППА И ДРУГИХ ВИРУСНЫХ ИНФЕКЦИЙ |
2422444 | ПОЛИЦИКЛИЧЕСКИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ |
2572558 | ПРОТИВОВИРУСНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ |
2566296 | ПРОИЗВОДНОЕ ДИФЕНИЛСУЛЬФИДА И ФАРМАЦЕВТИЧЕСКИЙ ПРОДУКТ, КОТОРЫЙ СОДЕРЖИТ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА |
2505312 | КОМПЛЕКСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГРИППА РАЗЛИЧНЫХ ТИПОВ |
2234313 | СРЕДСТВО ИНАКТИВАЦИИ КОРОНАВИРУСОВ |
2527688 | СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА С ТИПОМ ПОВЕРХНОСТОГО АНТИГЕНА Н1N1 И ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА С ТИПОМ ПОВЕРХНОСТНОГО АНТИГЕНА Н1N1 |
2488407 | ПОЛИВАЛЕНТНЫЕ ИММУНОГЕННЫЕ КОМПОЗИЦИИ PCV2 И СПОСОБЫ ПОЛУЧЕНИЯ ТАКИХ КОМПОЗИЦИЙ |
2409356 | ПРИМЕНЕНИЕ АМБРОКСОЛА ДЛЯ ЛЕЧЕНИЯ РИНОВИРУСНЫХ ИНФЕКЦИЙ |
2701694 | КОМПОЗИЦИИ И СПОСОБЫ, ОСНОВАННЫЕ НА НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛАХ, ДОСТАВЛЯЕМЫХ ИНТРАНАЗАЛЬНО, ДЛЯ УЛУЧШЕННОЙ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ |
2288723 | 2288723 ПРОФИЛАКТИЧЕСКОЕ И ТЕРАПЕВТИЧЕСКОЕ ЛЕЧЕНИЕ ИНФЕКЦИОННЫХ И ДРУГИХ ЗАБОЛЕВАНИЙ С ПОМОЩЬЮ ИММУНОЭФФЕКТИВНЫХ СОЕДИНЕНИЙ |
2689788 | ПИРАЗОЛО[1,5-а] ПИРИМИДИНЫ В КАЧЕСТВЕ ПРОТИВОВИРУСНЫХ СОЕДИНЕНИЙ |
2626003 | АМИД 1,2,4-ТРИАЗОЛ-3-ИЛТИОГЛИКОЛЕВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЙ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА |
2577134 | УЛУЧШЕННЫЕ АМИНОКИСЛОТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, НАПРАВЛЕННЫЕ ПРОТИВ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА ЧЕЛОВЕКА (HRSV), И ПОЛИПЕПТИДЫ, ВКЛЮЧАЮЩИЕ ТАКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ, ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ |
2655616 | ПРИМЕНЕНИЕ КОМПОЗИЦИИ ФИЛЛИРИНА/ФИЛЛИГЕНИНА ПРИ ПРИГОТОВЛЕНИИ МЕДИКАМЕНТА ИЛИ ПРОДУКТА МЕДИЦИНСКОГО НАЗНАЧЕНИЯ ДЛЯ ОБЛЕГЧЕНИЯ И/ИЛИ НАЗНАЧЕНИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ, И МЕДИКАМЕНТ ИЛИ ПРОДУКТ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ |
2530554 | ПРИМЕНЕНИЕ 1,7,7-ТРИМЕТИЛБИЦИКЛО [2.2.1] ГЕПТАН-2-ИЛИДЕН-АМИНОЭТАНОЛА В КАЧЕСТВЕ ИНГИБИТОРА РЕПРОДУКЦИИ ВИРУСА ГРИППА |
2478377 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ОРВИУМ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА |
2568849 | СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ АМИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С 5-АМИНОУРАЦИЛОМ, ПРОЯВЛЯЮЩЕЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА A/h2N1 |
2624018 | АМИД 5-(ТЕТРАГИДРОФУРАН-2-ИЛ)-1,2,4-ТРИАЗОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЙ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ |
2521593 | МОНО И ДИФТОРЗАМЕЩЕННЫЕ ЭТИЛ (3R,4R,5S)-5-АЗИДО-4-АЦЕТИЛАМИНО-3-(1-ЭТИЛПРОПОКСИ)-ЦИКЛОГЕКСЕН-1-КАРБОКСИЛАТЫ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ |
2502745 | НАНОАНТИТЕЛО «ANTI-FLU», РЕКОМБИНАНТНЫЕ ВИРУСНЫЕ ВЕКТОРЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ ГРИППА ТИПА А |
2529487 | 5-МЕТИЛ-6-НИТРО-7-ОКСО-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-АЛЬФА]ПИРИМИДИНИД L-АРГИНИНИЯ МОНОГИДРАТ |
2608519 | ПРОЛЕКАРСТВЕННАЯ ФОРМА ЗАМЕЩЕННОГО ПОЛИЦИКЛИЧЕСКОГО ПРОИЗВОДНОГО КАРБАМОИЛПИРИДОНА |
2700415 | ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСОВ ГРИППА |
2542488 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2657575 | ПРОТИВОВИРУСНАЯ ЭФФЕКТИВНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2461544 | ПРОИЗВОДНЫЕ 1-(1-АДАМАНТИЛ)ЭТИЛАМИНА И ИХ ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ |
2685730 | СОСТАВЫ СОЕДИНЕНИЙ АЗАИНДОЛА |
2380366 | ПРОИЗВОДНЫЕ ПИРИДАЗИНИЛАМИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ИНГИБИТОРОВ ПИКОРНАВИРУСОВ |
2518277 | СПОСОБ ЛЕЧЕНИЯ ГРИППА И ГРИППОПОДОБНЫХ ЗАБОЛЕВАНИЙ, ОСЛОЖНЕННЫХ ПНЕВМОНИЕЙ |
2369401 | КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПОРАЖЕНИЙ ПОЛОСТИ РТА И ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ |
2234922 | АНТИГРИППОЗНЫЙ КОМПЛЕКСНЫЙ ПРЕПАРАТ |
2683793 | ЗАМЕЩЕННЫЕ АМИНОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ |
2448711 | КОМПОЗИЦИИ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА, СОДЕРЖАЩИЕ КОМБИНАЦИИ АНТИБАКТЕРИАЛЬНЫХ АГЕНТОВ И АГЕНТОВ, ИЗМЕНЯЮЩИХ РЕАКЦИЮ ОРГАНИЗМА-НОСИТЕЛЯ |
2411042 | КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО СИНДРОМА (SARS) |
2306137 | СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГРИППА |
2302236 | СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИГИПОКСИЧЕСКОЙ И ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТЯМИ, ИСПОЛЬЗУЕМОЕ ДЛЯ СНИЖЕНИЯ ТОКСИЧНОСТИ РЕМАНТАДИНА ПРИ ЛЕЧЕНИИ ГРИППОЗНОЙ ИНФЕКЦИИ |
2318499 | СПОСОБ ПРОФИЛАКТИКИ ЗАБОЛЕВАЕМОСТИ ГРИППА И ОСТРЫХ РЕСПИРАТОРНО-ВИРУСНЫХ ИНФЕКЦИЙ У ДЕТЕЙ ПЕРВОГО ДЕТСТВА |
2237470 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА (ВАРИАНТЫ) |
2401263 | АМИНОПРОИЗВОДНЫЕ АДАМАНТАНА, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА |
2237475 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ И ГРИППА (ВАРИАНТЫ) |
2303441 | ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ РЕСПИРАТОРНЫХ БОЛЕЗНЕЙ ТЕЛЯТ |
2360680 | ПРИМЕНЕНИЕ МЕЛОКСИКАМА ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СВИНЕЙ |
2281097 | ЛЕКАРСТВЕННОЕ СРЕДСТВО, ВКЛЮЧАЮЩЕЕ ЦИКЛОФЕРОН, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И ПРИМЕНЕНИЯ |
2599013 | СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ |
2609857 | ИСПОЛЬЗОВАНИЕ КОМПОЗИЦИИ, СОСТОЯЩЕЙ ИЗ КАТИОННОГО ПЕПТИДА LTP И МОЛЕКУЛ РНК ПРОТИВ РЕСПИРАТОРНЫХ ВИРУСОВ |
2564899 | СПОСОБ ЛЕЧЕНИЯ ДЕТЕЙ С РОТАВИРУСНОЙ ИНФЕКЦИЕЙ |
2502512 | СПОСОБ ЛЕЧЕНИЯ ГРИППА ПТИЦ |
2703535 | КОМБИНАЦИЯ ПРОТИВОВИРУСНЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ВИРУСНОЙ ГРИППОЗНОЙ ПНЕВМОНИИ И ЕЕ ПРИМЕНЕНИЕ |
2651754 | ПРИМЕНЕНИЕ АЛИФАТИЧЕСКИХ ИМИНОПРОИЗВОДНЫХ КАМФОРЫ В КАЧЕСТВЕ ЭФФЕКТИВНЫХ ИНГИБИТОРОВ РЕПРОДУКЦИИ ВИРУСА ГРИППА ШТАММ A/CALIFORNIA/07/09 (h2N1) PDM09 И A/PUERTO RICO/8/34 (h2N1) |
2633085 | ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО В ВИДЕ КАПСУЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ |
2228177 | НАЗАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПРОСТУДЫ И ГРИППА ВИРУСНОГО ПРОИСХОЖДЕНИЯ |
2404182 | НАТРИЕВАЯ СОЛЬ 2-ЭТИЛТИО-6-НИТРО-1,2,4-ТРИАЗОЛО[5,1-c]-1,2,4-ТРИАЗИН-7-ОНА ДИГИДРАТ |
2609661 | АНТИГЕННЫЕ КОМПОЗИЦИИ РЕСПИРАТОРНОГО СИНЦИТИАЛЬНОГО ВИРУСА И СПОСОБЫ |
2489422 | ФТОРЗАМЕЩЕННЫЕ (3R,4R,5S)-5-ГУАНИДИНО-4-АЦИЛАМИНО-3-(ПЕНТАН-3-ИЛОКСИ)ЦИКЛОГЕКСЕН-1-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ЭФИРЫ И СПОСОБ ПРИМЕНЕНИЯ |
2458046 | ГИДРАТИРОВАННЫЕ N-ФУЛЛЕРЕН-АМИНОКИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ |
2537025 | ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ДИИНДОЛИЛМЕТАНА И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ГРИППА И РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ |
2670204 | ПРОИЗВОДНЫЕ 2-ТИОУРАЦИЛА, ОБЛАДАЮЩИЕ ПРОТИВОАДЕНОВИРУСНОЙ АКТИВНОСТЬЮ |
2536956 | ПРОТИВОВИРУСНОЕ ОДНОДОМЕННОЕ МИНИ-АНТИТЕЛО, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, ЭКСПРЕССИРУЮЩИЙ РЕКОМБИНАНТНЫЙ ВИРУСНЫЙ ВЕКТОР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ТЕРАПИИ ГРИППА ТИПА А |
2616523 | ИНТРАНАЗАЛЬНАЯ МАЗЬ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ РЕСПИРАТОРНОЙ ИНФЕКЦИИ |
2469020 | (3R,4R,5S)-5-АМИНО-4-АЦИЛАМИНО-3-(1-ЭТИЛ-ПРОПОКСИ)-ЦИКЛОГЕКС-1-ЕН-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ЭФИРЫ И СПОСОБ ПРИМЕНЕНИЯ |
2486185 | ПОЛИЦИКЛИЧЕСКИЕ АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫХ ВИРУСНЫХ ИНФЕКЦИЙ |
2518738 | КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ И СИМПТОМОКОМПЛЕКСА ГРИППА |
2612530 | ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ ВИРУСНОЙ ИНФЕКЦИИ |
2412718 | СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ И БАКТЕРИАЛЬНЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ |
2628800 | АМИДНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ РНК-СОДЕРЖАЩИМИ ВИРУСАМИ |
2256451 | ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АТИПИЧНОЙ ПНЕВМОНИИ |
2523554 | СПОСОБ ЗАЩИТЫ ОРГАНИЗМА ОТ ИНФЕКЦИИ, ВЫЗВАННОЙ ШТАММАМИ СУБТИПА h2N1 ВИРУСА ГРИППА А ПРЕПАРАТОМ НА ОСНОВЕ АЛЬФА-2 ИНТЕРФЕРОНА ЧЕЛОВЕКА |
2720305 | ЗАМЕЩЕННЫЙ 3,4,12,12А-ТЕТРАГИДРО-1Н-[1,4]ОКСАЗИНО[3,4-C]ПИРИДО[2,1-F] [1,2,4]ТРИАЗИН-6,8-ДИОН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ |
2546006 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2229877 | СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГРИППА |
2330018 | ПРОИЗВОДНЫЕ 4-АМИНОМЕТИЛ-6-БРОМ-5-ГИДРОКСИИНДОЛ-3-КАРБОКСИЛАТОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ПРИМЕНЕНИЕ |
2684100 | ПРОИЗВОДНОЕ ФИЛЛИГЕНИНА И ГЛЮКУРОНОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ |
2650636 | СОСТАВЫ НА ОСНОВЕ ПОЛИИНОЗИНОВОЙ-ПОЛИЦИТИДИЛОВОЙ КИСЛОТЫ (POLY(I:С)) ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ |
2520836 | (3R,4R,5S)-4-АМИНО-5-(2,2-ДИФТОРАЦЕТИЛАМИНО)-3-(1-ЭТИЛПРОПОКСИ)-ЦИКЛОГЕКС-1-ЕНКАРБОНОВАЯ КИСЛОТА И ЕЕ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ |
2436583 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2643371 | НОВЫЕ СОЕДИНЕНИЯ |
2695336 | КОМПОЗИЦИЯ НА ОСНОВЕ ПЕПТИДА, ПОДАВЛЯЮЩЕГО РЕПЛИКАЦИЮ ВИРУСА ГРИППА А |
2448692 | ФАРМАЦЕВТИЧЕСКИЕ СОЛИ АМИНОБИЦИКЛО[2.2.1]ГЕПТАНОВ КАК ИНГИБИТОРЫ ТРАНСКРИПЦИОННОГО ФАКТОРА NF-KB С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) И ИХ ПРИМЕНЕНИЕ |
2611383 | КОМБИНИРОВАННЫЙ ПРЕПАРАТ ДЛЯ УСТРАНЕНИЯ СИМПТОМОВ И ЛЕЧЕНИЯ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ И ГРИППА |
2712275 | ЗАМЕЩЕННЫЕ ПОЛИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИДОНА И ИХ ПРОЛЕКАРСТВА |
2398595 | ФЛАВОНОИДНОЕ СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ |
2433827 | ПРОФИЛАКТИЧЕСКИЙ ИЛИ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ПРОТИВ ВИРУСНОГО ЗАБОЛЕВАНИЯ |
2399388 | СРЕДСТВО ДЛЯ ИНАКТИВАЦИИ ВИРУСОВ, ОБЛАДАЮЩЕЕ ОДНОВРЕМЕННОЙ РИБОНУКЛЕАЗНОЙ, МЕМБРАНОЛИТИЧЕСКОЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЯМИ |
2403053 | КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ ПРОСТУДНЫХ ЗАБОЛЕВАНИЙ |
2564919 | ПРОТИВОВИРУСНОЕ СРЕДСТВО |
2391113 | КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭКСТРАКТЫ Sanguinaria ИЛИ Macleaya |
2440123 | ПРИМЕНЕНИЕ LACTOBACILLUS ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2359955 | ПРОИЗВОДНЫЕ БЕНЗОТРОПОЛОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИРУСОВ |
2305547 | ПРИМЕНЕНИЕ АПОПРОТЕИНОВ СЫВОРОТКИ МОЛОКА В ПРОФИЛАКТИКЕ ИЛИ ЛЕЧЕНИИ МИКРОБНОЙ ИЛИ ВИРУСНОЙ ИНФЕКЦИИ |
2622640 | СЕЛЕКТИВНЫЕ И ОБРАТИМЫЕ ИНГИБИТОРЫ УБИХИТИН-СПЕЦИФИЧЕСКОЙ ПРОТЕАЗЫ 7 |
2424234 | НОВЫЕ ИНГИБИТОРЫ ЦИСТЕИНОВЫХ ПРОТЕАЗ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ |
2311194 | ГОМЕОПАТИЧЕСКОЕ СРЕДСТВО «АНАВИАРИН-ГОМЕОАНТИГРИППИН», ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ (ВАРИАНТЫ) |
2491092 | СНИЖЕНИЕ СОПУТСТВУЮЩИХ ИНФЕКЦИЙ У СВИНЕЙ С ПОМОЩЬЮ АНТИГЕНА PCV2 |
2694210 | ПРЕПАРАТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА-АЛЬФА СОБАКИ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ ПРИРОДНЫХ ВИРУСНЫХ ИНФЕКЦИЙ СОБАК |
2678105 | ПРИМЕНЕНИЕ ТАУРИНА ДЛЯ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСАМИ РОДА КОРОНАВИРУСОВ И/ИЛИ РОДА РОТАВИРУСОВ |
2500422 | КОМПЛЕКСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ И СПОСОБ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2672888 | ПРОТИВОВИРУСНОЕ ИММУНОТРОПНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОРВИ |
2665638 | АМИДНОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ РНК-СОДЕРЖАЩИМИ ВИРУСАМИ |
2590706 | ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ |
2606947 | БОРСОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ |
2630690 | МОЛЕКУЛЫ АНАЛОГОВ ЦИКЛОСПОРИНА, МОДИФИЦИРОВАННЫЕ ПО 1 и 3 АМИНОКИСЛОТЕ |
2552422 | ПРОИЗВОДНЫЕ ИНДОЛ-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ |
2366411 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2698902 | ПРОИЗВОДНЫЕ 4-АМИНО-ИМИДАЗОХИНОЛИНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ АГОНИСТАМИ TLR7 И/ИЛИ TLR8 |
2453556 | СОЕДИНЕНИЯ ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА |
2524304 | ПРИМЕНЕНИЕ СОЛИ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2505306 | КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ |
2396273 | ПРОТИВОМИКРОБНЫЕ ПЕПТИДЫ, СОДЕРЖАЩИЕ АРГИНИН — И ЛИЗИНСОДЕРЖАЩИЙ МОТИВ |
2695455 | ПРОТИВОМИКРОБНЫЙ ПЕПТИД |
2639559 | ПЕПТИДЫ, ПОДАВЛЯЮЩИЕ ИНФЕКЦИИ РЕСПИРАТОРНЫХ ВИРУСОВ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ |
2656160 | АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, СПОСОБНЫЙ СВЯЗЫВАТЬСЯ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-6 ЧЕЛОВЕКА |
2726119 | НОВЫЕ ПРОИЗВОДНЫЕ ПОЛИОЛОВ, ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ |
2725800 | КОМБИНИРОВАННЫЕ ВИДЫ ТЕРАПИИ |
2727772 | ПРОИЗВОДНЫЕ ПИРИМИДИНА ПРОТИВ ВИРУСА ГРИППА |
2728939 | ПРИМЕНЕНИЕ ДАЛАРГИНА ДЛЯ ПРОИЗВОДСТВА СРЕДСТВ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19 |
2728938 | ПРИМЕНЕНИЕ ДАЛАРГИНА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРОФИЛАКТИКИ ПНЕВМОНИИ |
2728821 | СПОСОБ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА ДАЛАРГИНОМ И ЛЕГОЧНЫМ СУРФАКТАНТОМ |
2731932 | ПРОТИВО-COVID-19 (SARS-COV-2) ВИРУСНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ |
2732291 | ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ОСНОВЕ ТРАВЫ АЛТЕЯ ЛЕКАРСТВЕННОГО ДЛЯ ЛЕЧЕНИЯ ПРОСТУДНЫХ И ОСТРЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ |
2733269 | СПОСОБ ПРОИЗВОДСТВА ИНГАЛЯЦИОННОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ГЕКСАПЕПТИДА |
2733361 | СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИРУСА SARS-COV-2, ОПОСРЕДОВАННОГО РНК-ИНТЕРФЕРЕНЦИЕЙ |
2735797 | СПОСОБ УЛУЧШЕНИЯ ОКСИГЕНИРУЮЩЕЙ ФУНКЦИИ ЛЕГКИХ У БОЛЬНЫХ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ (COVID-19) С ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТЬЮ, НАХОДЯЩИХСЯ НА РЕСПИРАТОРНОЙ ПОДДЕРЖКЕ |
2737800 | ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ В ВИДЕ СУППОЗИТОРИЯ, СОДЕРЖАЩАЯ ГЕКСАПЕПТИД |
2737799 | ИНГАЛЯЦИОННЫЙ ГЕКСАПЕПТИД ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ИНТЕРЛЕЙКИНОМ-6 |
2738449 | СПОСОБ ПРОФИЛАКТИКИ ВИРУСНЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ |
Детские энтеровирусные инфекции: основы практики, история вопроса, патофизиология
Автор
Дэниел Оуэнс, BM, MRCPCH (Великобритания) Научный сотрудник по клиническим исследованиям, Центр клинических исследований NIHR, Больница общего профиля Саутгемптона, Великобритания
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Сол Н. Фауст, MA, MBBS, PhD, MRCPCH (Великобритания) Старший преподаватель педиатрической иммунологии и инфекционных заболеваний, Медицинский факультет Саутгемптонского университета; Директор Центра клинических исследований NIHR, Университетская больница Саутгемптона, NHS Foundation Trust, Великобритания
Сол Н. Фауст, магистр медицины, бакалавр медицины и биологии, доктор философии, MRCPCH (Великобритания) является членом следующих медицинских обществ: Британской педиатрической группы аллергии, иммунитета и инфекций, Европейской Общество детских инфекционных заболеваний, Международное общество инфекционных заболеваний, Королевский колледж педиатрии и здоровья детей
Раскрытие информации: выступать (d) в качестве докладчика или члена бюро докладчиков по вопросам: менингококковых вакцин Pfizer
Получен грант на исследования от : Учреждение Pfizer
(без личных гонораров) получало консультационные услуги от Pfizer, Sanofi, Seqrius, Merck, Medimmune, AstraZeneca.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Mark R Schleiss, MD Minnesota American Legion and A Additional Heart Research Foundation Кафедра педиатрии, профессор педиатрии, директор отделения, Отделение инфекционных болезней и иммунологии, Департамент педиатрии, Медицинская школа Университета Миннесоты
Mark R Schleiss, MD является членом следующих медицинских обществ: Американского педиатрического общества, Американского общества инфекционных заболеваний, Общества педиатрических инфекционных болезней, Общества педиатрических исследований
Раскрытие информации: не подлежит разглашению.
Главный редактор
Рассел Стил, доктор медицины Профессор-клиницист, Медицинский факультет Тулейнского университета; Врач, штатный врач, Ochsner Clinic Foundation
Рассел Стил, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологии, Американского общества инфекционных болезней, Медицинского центра штата Луизиана. Общество, Общество детских инфекционных болезней, Общество педиатрических исследований, Южная медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Дополнительные участники
Джозеф Домачовске, доктор медицины Профессор педиатрии, микробиологии и иммунологии, кафедра педиатрии, отделение инфекционных заболеваний, Медицинский университет штата Нью-Йорк, Государственный университет штата Нью-Йорк
Джозеф Домачовске, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha , Американская академия педиатрии, Американское общество микробиологии, Общество инфекционных заболеваний Америки, Общество педиатрических инфекционных заболеваний, Phi Beta Kappa
Раскрытие: Получен грант на исследования от: Pfizer; GlaxoSmithKline; AstraZeneca; Merck; Американской академии педиатрии, Novavax, Regeneron , Diassess, Actelion
Полученный доход в размере 250 долларов США или более от: Sanofi Pasteur.
Леонард Р. Крылов, доктор медицины Заведующий отделением детских инфекционных болезней и международного усыновления, заместитель председателя педиатрического отделения больницы Уинтропского университета; Профессор педиатрии, Медицинский факультет Университета Стони Брук
Леонард Р. Крылов, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американского педиатрического общества, Американского общества инфекционных болезней, Общества педиатрических инфекционных болезней, Общества педиатрических исследований.
Раскрытие информации: раскрывать нечего.
Mobeen H Rathore, MD, CPE, FAAP, FIDSA Начальник отдела детских инфекционных заболеваний / иммунологии, заместитель председателя педиатрического отделения Медицинского колледжа Университета Флориды в Джексонвилле; Эпидемиолог больницы и начальник отдела инфекционных болезней и иммунологии детской больницы Вольфсона; Директор Центра исследований, образования и обслуживания в области ВИЧ / СПИДа Университета Флориды (UF CARES)
Mobeen H Rathore, MD, CPE, FAAP, FIDSA является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества микробиологов. , Медицинская ассоциация Флориды, Общество инфекционных болезней Америки, Общество педиатрических инфекционных болезней, Общество эпидемиологии здравоохранения Америки, Общество педиатрических исследований, Южная медицинская ассоциация, Южное общество педиатрических исследований, Флоридское отделение Американской академии педиатрии, Педиатрическое общество Флориды , Европейское общество детских инфекционных болезней
Раскрытие информации: нечего раскрывать.
Николас Джон Беннетт, MBBCh, PhD, FAAP, MA (Cantab) Доцент педиатрии, содиректор отдела управления противомикробными препаратами, медицинский директор, Отделение детских инфекционных заболеваний и иммунологии Детского медицинского центра Коннектикута
Николас Джон Беннетт, MBBCh, PhD, FAAP, MA (Cantab) является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия педиатрии
Раскрытие информации: получил исследовательский грант от: Cubist
Полученный доход в размере не менее чем 250 долларов США от: Horizon Pharmaceuticals, Shire
Юридические консультации по вопросам Medico: Разн.
Благодарности
Авторы и редакторы eMedicine выражают признательность предыдущему автору Мишель Мовад, доктору медицины, за вклад в первоначальное написание и разработку этой статьи.
Рис. 5 представляет собой фотографию случая атипичной HFMD, которую видели д-р Генри Федер и д-р Николас Беннетт. Разрешение на использование фотографии было предоставлено семьей пациента. Изображение перепечатано из The Lancet Infectious Diseases, Vol.14 (1), Федер, Беннет и Модлин, Атипичное заболевание рук, ног и рта: пузырно-пузырчатая сыпь, вызванная вирусом Коксаки A6, страницы 83-86., Copyright (2014), с разрешения Elsevier.
границ | Вирусный сепсис у детей
Введение
Сепсис — основная причина детской смертности (1). Определяемый как синдром системного воспалительного ответа при наличии подозреваемой или подтвержденной инфекции, это клинический синдром, который в основном характеризуется нарушением регуляции врожденного иммунного ответа хозяина и может привести к иммунному фенотипу, сочетающему системное воспаление и иммуносупрессию (2).Патологические перекрестные связи между воспалительными и коагуляционными каскадами, активацией комплемента и нейроэндокринными сигналами наносят ущерб гомеостатическому контролю. Этот гипервоспалительный ответ оказывает неблагоприятное воздействие на сердечно-легочную систему, эндотелий сосудов и кишечник, ускоряя прогрессирующую дисфункцию органа до тех пор, пока хозяин не погибнет (3). Заболеваемость, смертность и расходы, связанные с детским сепсисом, ложатся тяжелым бременем на медицинское сообщество и мировую экономику (4, 5). Watson et al сообщили, что средняя продолжительность пребывания в больнице составляет 31 день, при этом около 2 миллиардов долларов ежегодно расходуются на медицинские расходы, связанные с тяжелым детским сепсисом (1).Международные рекомендации по ведению сепсиса и септического шока подчеркивают важность быстрой реанимации, своевременного введения противомикробных препаратов и поддерживающей терапии дисфункции органов как основы лечения детского сепсиса (6).
Вирусный сепсис можно определить как тяжелую воспалительную реакцию на подозреваемую или подтвержденную вирусную инфекцию. Однако постановка окончательного диагноза вирусного сепсиса у ребенка является особенно сложной задачей для врачей. Проницательный клиницист должен включить историю болезни пациента, физический осмотр, лабораторные и рентгенографические данные, чтобы определить вероятность вирусной этиологии сепсиса.Даже при положительном вирусном тесте следует учитывать ограничения результата тестирования. Несмотря на эти проблемы, своевременная диагностика вирусного сепсиса имеет большое значение для клинического ведения, включая руководство по использованию соответствующей противовирусной терапии и информирование о стратегиях изоляции и сдерживания. Более того, своевременная диагностика вирусного сепсиса может предотвратить неоправданно длительное воздействие антибактериальной терапии и, таким образом, может помочь предотвратить последующую антибактериальную резистентность и пагубное воздействие на микробиом хозяина.В этом обзоре изложено наше текущее понимание вирусного сепсиса у детей, включая его эпидемиологию и патофизиологию реакции вирусного хозяина во время активной инфекции. Описаны клинические проявления, соответствующие диагностические тесты и лечение, характерные только для вирусных инфекций.
Эпидемиология
Истинная частота вирусного сепсиса, особенно среди детей, остается неизвестной. Поскольку бактериальный сепсис поддается лечению и, по-видимому, встречается чаще, при остром проявлении сепсиса тестирование на вирусы часто не проводится.Однако недавнее исследование взрослых пациентов с сепсисом показало, что вирусные респираторные патогены, а именно вирус гриппа A, метапневмовирус человека, коронавирус и респираторно-синцитиальный вирус (RSV), не были замечены у 70% пациентов (7). В многонациональном эпидемиологическом исследовании детей с тяжелым сепсисом инфекционная этиология была доказана только у 65% пациентов, из них примерно у одной трети была вирусная инфекция (8). Наиболее частыми очагами инфекции были дыхательные пути (40%) и кровоток (20%), при этом чаще всего выделялись риновирус, RSV и аденовирус.Напротив, группа по изучению сепсиса в Австралии и Новой Зеландии выявила патоген примерно у 50% пациентов с сепсисом и септическим шоком (9). Из этих пациентов только одна пятая имела вирусную этиологию, причем наиболее частыми идентифицированными вирусами были RSV, цитомегаловирус (CMV), вирус Эпштейна-Барра (EBV), вирус простого герпеса (HSV), вирус ветряной оспы (VZV) и грипп. в этом исследовании. Недавно Ames et al. сообщили, что 16% педиатрических пациентов с септическим шоком имели первичное вирусное заболевание (10).В другом исследовании новорожденных с сепсисом бактериальная этиология была обнаружена только примерно в 15% случаев, что делает вирусную инфекцию более вероятной причиной сепсиса у этих пациентов (11).
В педиатрическом отделении интенсивной терапии (PICU) вирус гриппа является основной причиной вирусного сепсиса и кариеса, особенно высокой смертности (12). Также было обнаружено, что RSV вызывает тяжелый бронхиолит и может проявляться сепсисом, особенно у детей с преждевременными родами в анамнезе, хроническими заболеваниями легких, врожденными пороками сердца или первичным иммунодефицитом (13, 14).Сепсис также наблюдался у новорожденных с HSV, пареховирусом человека (HPeV) и энтеровирусной инфекцией (15–18). Пациенты с иммунодефицитом, вызванным инфекцией вируса иммунодефицита человека (ВИЧ), очень восприимчивы к вирусному сепсису в зависимости от стадии заболевания, доступа к лечению и реакции на него (19). У этих пациентов общие вирусные инфекции, вызывающие сепсис, включают RSV, грипп, парагрипп, аденовирус, CMV, EBV и VZV (19). Диарейные заболевания, вторичные по отношению к вирусным инфекциям, также могут приводить к сепсису, особенно в развивающихся странах (20).Ротавирус, хотя и редко, связан с сепсисом из-за бактериальной коинфекции (21). Несмотря на несколько крупных исследований вирусного сепсиса в целом (см. Выше), а также конкретных вирусов, в отсутствие стандартного вирусного тестирования во время диагностической оценки сепсиса истинная частота вирусной инфекции как причины сепсиса остается неясной.
Патофизиология и ответ хозяина на вирусный сепсис
Реакция хозяина на инфекцию состоит из множества одновременных процессов, направленных на нейтрализацию инфекционной угрозы и инициирование восстановления поврежденной ткани.Сепсис характеризуется системным и нерегулируемым воспалением, которое может привести к порочному кругу эндотелиопатии сосудов, гипоперфузии микроциркуляторного русла, дисфункции кишечного барьера, шока кровообращения, митохондриальной недостаточности и смерти (22–24). Более того, сопутствующий синдром компенсаторного противовоспалительного ответа, который характеризуется апоптозом лимфоцитов и иммунным параличом, предрасполагает хозяина к вторичной нозокомиальной инфекции и латентной вирусной активации (25, 26). Тип используемых механизмов варьируется в зависимости от вируса, но обычно приводит к некоторой комбинации (1) высвобождения цитокинов, (2) эндотелиопатии и (3) цитотоксичности хозяина (27).Хотя углубленный обзор патогенеза всех вирусов, вызывающих болезни человека, выходит за рамки данной рукописи, мы обрисовали общую патофизиологию ниже, выделив основные иллюстративные вирусные примеры, где это возможно.
Высвобождение цитокинов (Рисунок 1)
Рецепторы распознавания патогенов (PRR) — это клеточные сенсоры, распознающие специфическую молекулярную структуру патогена (28). Толл-подобные рецепторы (TLR) и рецепторы, индуцируемые ретиноевой кислотой, подобные гену-I (RIG-I) (RLR), представляют собой два типа PRR, которые участвуют в вирусном зондировании (28).TLR, которые обнаруживаются на поверхности клеток или внутри эндосом моноцитов, макрофагов, дендритных, эпителиальных и эндотелиальных клеток, сталкиваются с патоген-ассоциированными молекулярными паттернами (PAMP) (29, 30). Внутриклеточные TLR-7 и TLR-8 распознают одноцепочечную рибонуклеиновую кислоту (РНК) вирусов, таких как HPeV, энтеровирусы, метапневмовирус человека и грипп; внутриклеточный TLR-9 распознает двухцепочечную (ds) ДНК вирусов, подобных вирусам герпеса (например, HSV-1 и -2, EBV), аденовирусу и CMV; а TLR-3 распознает дцРНК, продуцируемую во время внутриклеточной репликации вируса (31).Активация TLR завершается первичным ответом миелоидной дифференцировки 88 (MyD88, через TLR-7, -8 и -9) или адаптерным белком, содержащим домен рецептора Toll / интерлейкина (IL) -1, индуцирующим IFN-β (TRIF, через TLR-3). ) активация (32). Эти белки, в свою очередь, активируют ядерный фактор, усиливающий каппа-легкую цепь активированных В-клеток (NF-κB) и транскрипцию цитокинов, опосредованную IFN-регуляторным фактором (IFR) (33–35). RLR являются цитозольными сенсорами врожденного иммунитета для вирусной РНК. Были идентифицированы три члена RLR: RIG-I, фактор дифференцировки меланомы 5 (MDA5) и лаборатория генетики и физиологии 2 (LGP2) (36).RIG-I и MDA5 распознают дцРНК в ответ на различные РНК-вирусы и сигнализируют о продукции провоспалительных цитокинов и IFN типа 1 (37). Пролиферация цитокинов запускает провоспалительный каскад, который приводит к активации комплемента, хемотаксису нейтрофилов, привлечению цитотоксического кластера дифференцировки (CD) 8+ Т-клеток и высвобождению протеазы из лейкоцитов и эндотелиальных клеток, особенно трипсина (38) и гепараназы (39). . Трипсин активируется и высвобождается эндотелием сосудов (38), и было показано, что он расщепляет циркулирующую проматриксную металлопротеиназу (про-ММП), высвобождаемую макрофагами, с образованием активированных ММП (40).ММП вместе с гепараназой разрушают эндотелиальный гликокаликс (41, 42). Более того, вирусные частицы индуцируют генерацию активных форм кислорода циркулирующими нейтрофилами, эозинофилами и макрофагами (43, 44), которые дополнительно повреждают эндотелиальный гликокаликс (45) и активируют передачу сигналов клеток NF-κB (46), распространяя петлю положительной обратной связи, которая приводит к эндотелиопатии и повреждению органов-мишеней.
Рисунок 1 . Вирус-индуцированная регуляция и высвобождение цитокинов. Двухцепочечные вирусные рибонуклеиновые кислоты (дцРНК) распознаются в цитозоле клетки-хозяина индуцируемыми ретиноевой кислотой ген-I (RIG-I) -подобными рецепторами (RLR) — RIG-I, MDA5 и LGP2.RLR, связанные с вирусной дцРНК, претерпевают конформационные изменения и образуют комплекс с митохондриальным антивирусным сигнальным белком (MAVS) на поверхности митохондрий. Взаимодействие RLR-MAVS запускает сборку белков-хозяев для активации факторов, связанных с рецептором TNF (TRAF), тем самым индуцируя ядерный фактор, усиливающий каппа-легкую цепь активированных В-клеток (NF-κB) и фактор регулятора интерферона (IRF). -опосредованная транскрипция цитокинов в ядре клетки-хозяина. Вирусные нуклеиновые кислоты также распознаются в Toll-подобных рецепторах (TLR) в эндосомах клетки-хозяина, вызывая первичный ответ миелоидной дифференцировки 88 (MyD88) и пути, индуцирующие адаптер интерферона-β, содержащие Toll / рецептор интерлейкина-1 (TRIF), которые также активируют транскрипцию цитокинов, опосредованную NF-κB и IRF, в ядре клетки-хозяина.
Эндотелиопатия (Рисунок 2)
Системное распространение вируса, по-видимому, является этиологией вирусного сепсиса. Точные механизмы, с помощью которых вирусы, которые обычно выделяются из респираторного или покровного эпителия, достигают кровотока, неизвестны. Однако вполне вероятно, что виремия возникает в результате прямой инвазии эпителиальных клеток (или нейронов, как в случае ВПГ или ветряной оспы), чтобы достичь окружающей сосудистой сети (47). Попадая в кровь, вирус может вызывать деградацию эндотелиального гликокаликса, активируя лейкоциты, тромбоциты и эндотелиальные клетки для секреции ММП и гепараназы, которые нацелены на компоненты гликокаликса (39, 48).Нарушение эндотелиального гликокаликса обнажает селектины и молекулы внутриклеточной адгезии, делая их доступными для адгезии и активации лейкоцитов (49). Распад гликокаликса также высвобождает гепарансульфат, который может связывать и активировать антитромбин III и обнажает связанные с мембраной гликопротеиновые комплексы Ib / IX / V (50), которые могут связывать циркулирующий фактор фон Виллебранда (51) и Р-селектины на тромбоцитах (52, 53), провоцирующая коагулопатия. Кроме того, потеря целостности богатого белком гликокаликса изменяет равновесие жидкости в микрососудистой системе между просветом сосудов и субгликокаликсом, увеличивая фильтрацию жидкости и макромолекул через эндотелий в окружающий интерстиций (54).Конечным результатом повреждения эндотелиального гликокаликса является провоспалительное распространение и сосудистая утечка, которая может нарушить функцию органа.
Рисунок 2 . Патофизиологические механизмы вирусной эндотелиопатии. Активация врожденной иммунной системы во время вирусного сепсиса ускоряет дегрануляцию лейкоцитов и высвобождение ферментов и активных форм кислорода (АФК), которые разрушают эндотелиальный гликокаликс. Обнаженный эндотелиальный гликокаликс обнажает молекулы клеточной адгезии (например,g., ICAM-1, VCAM-1, E-селектин, P-селектин), которые увеличивают границу и активацию лейкоцитов, дополнительно способствуя воспалительной реакции. Кроме того, медиаторы воспаления, а именно тромбин, АФК и фактор роста эндотелия сосудов (VEGF), способствуют экзоцитозу тельца Вейбеля-Паладе, высвобождая ангиопоэтин-2 (Agpt-2) в кровоток. Agpt-2 противодействует рецептору Tie2 эндотелиальных клеток, позволяя Src-опосредованному ферменту RhoA реконфигурировать цитоскелет эндотелиальных клеток и способствовать интернализации VE-кадгерина из соединения адгезивов.Нарушение целостности гликокаликса и адгезивных соединений позволяет увеличить транс-клеточный белок и движение жидкости из просвета сосудов в интерстиций. ICAM-1, молекула межклеточной адгезии 1; VCAM-1, молекула адгезии сосудистых клеток 1.
Циркулирующие вирусные частицы могут также вызывать структурные изменения эндотелиальных клеток, которые приводят к разрушению барьера и дальнейшей утечке из сосудов. Эндотелиальные клетки прикреплены друг к другу через адгезивные соединения, состоящие преимущественно из сосудистого эндотелия (VE) -кадгерина, который прикреплен к эндотелиальному цитоскелету через бета-катенин и p120-катенин (55, 56).В эндотелиальных клетках человека патогенные штаммы хантавируса, по-видимому, связываются с β3-интегринами клеточной поверхности, тем самым способствуя интернализации VE-кадгерина и дестабилизации слипчивых соединений (57). Дестабилизация VE-кадгерина также может опосредоваться через рецептор Tie2 клеточной мембраны. Рецептор Tie2 активируется ангиопоэтином-1 (Agpt-1), который продуцируется периэндотелиальными клетками (58, 59). При активации рецептор Tie2 активирует передачу сигналов выживания клеток PI3K / Akt и опосредованную Rac1 стабилизацию цитоскелета (60).Медиаторы воспаления, такие как тромбин (61), активные формы кислорода (62) и VEGF (63), стимулируют экзоцитоз тельца Weibel-Palade эндотелиальных клеток, высвобождая антагонист Tie2 Agpt-2 (64). Agpt-2 действует аутокринно, подавляя передачу сигналов Tie2, тем самым способствуя активности киназы RhoA и дестабилизации VE-кадгерина (60). У мышей, инфицированных патогенным штаммом вируса гриппа h4N2, развивается острое повреждение легких, которое устраняется васкулотидом, агонистом Tie2 (65), что позволяет предположить, что рецептор Tie2 является неотъемлемой частью развития эндотелиопатии во время вирусного сепсиса.Точные механизмы, которые использует каждый вирус, чтобы вызвать дисфункцию эндотелиальных клеток, не ясны; однако типичное проявление капиллярной утечки при вирусном сепсисе предполагает общий путь нарушения целостности эндотелия.
Цитотоксичность хозяина (Рисунок 3)
Индуцированная вирусами цитотоксичность хозяина опосредуется цитопатическими эффектами, клеточным перепрограммированием и / или инициацией иммунных цитотоксических ответов хозяина. Вирусы захватывают и используют внутриклеточные механизмы хозяина для репликации, истощая запасы энергии и транскрипционный потенциал клеток-хозяев.Кроме того, инфицированные вирусом клетки могут активироваться для каспазозависимого апоптоза (66). Вирусы также могут косвенно способствовать апоптозу посредством перепрограммирования макрофагов. Было показано, что макрофаги, инфицированные птичьим гриппом H5N1, повышают выработку и высвобождение лиганда, индуцирующего апоптоз (TRAIL), связанного с фактором некроза опухоли (TNF), который способствует апоптозу Т-клеток (67). Хотя влияние TRAIL на другие клеточные клоны не было определено, вероятно, что эффект, наблюдаемый в Т-клетках, может быть более диффузным.Системное распространение вируса из мест первичной инфекции (например, метапневмовируса человека в дыхательных путях или HPeV в желудочно-кишечном тракте) может происходить через эти апоптотические механизмы, посредством которых высвобождаются новые вирионы, инфицируют местные эндотелиальные клетки и вызывают дальнейший клеточный апоптоз и системный вирусный вирус. распространять. Инвазивность и распространенность вирусной инфекции, вероятно, обусловлены клеточным тропизмом и генетически детерминированной вирулентностью, поскольку вирусы с большей цитопатогенностью, такие как птичий грипп H5N1 (66) и HPeV-3 (68), с большей вероятностью вызывают сепсис у иммунокомпетентных хозяев, чем вирусы с минимальной ассоциированной цитопатологией (например,g., RSV или парагриппа) (69). Наконец, эффекторы иммунной системы хозяина, такие как естественные киллеры (NK), цитотоксические CD8 + Т-клетки и комплемент, атакуют и разрушают инфицированные вирусом клетки-хозяева.
Рисунок 3 . Индуцированная вирусами цитотоксичность хозяина через внешние и внутренние пути апоптоза. Фактор некроза опухоли альфа (TNF-α) высвобождается после распознавания вирусом врожденной иммунной системой, а связанный с TNF лиганд, индуцирующий апоптоз (TRAIL), высвобождается из перепрограммированных вирусом макрофагов, оба из которых связывают гибель соответствующих клеток-хозяев. рецепторы для активации внешнего пути апоптоза.Природные киллеры (NK) и кластер дифференцировки 8 (CD8 +) Т-клетки вводят перфорин в мембраны инфицированных клеток-хозяев, через которые они секретируют гранзимы, которые вызывают внутренний путь апоптоза. Внутренний путь может быть активирован после распознавания вирусного белка клеткой-хозяином или после вставки суицидного гена цитотоксическими вирусами.
Патогенез вирусов у детей также варьируется в зависимости от степени иммунокомпетентности хозяина. Как правило, у младенцев значительно снижена экспрессия TLR, активность антигенпрезентирующих клеток, чувствительность NK-клеток, функциональность Т-клеток, зрелость В-клеток и концентрация комплемента (70).Эта незрелость развивающейся иммунной системы подвергает младенцев значительно более высокому риску тяжелого заболевания, вызываемого вирусами, которые обычно причиняют минимальный вред детям старшего возраста и взрослым (например, HSV, HPeV, энтеровирусы, CMV). Точно так же дети с врожденными или приобретенными иммунодефицитами более восприимчивы к вирусным патогенам. Специфические иммунодефициты, повышающие риск вирусного сепсиса у детей, включают дефицит NK-клеток, дефицит рецепторов интерферона (IFN) -γ, дефицит TLR-3, дефицит эссенциального модулятора ядерного фактора-каппа B, тяжелый комбинированный иммунодефицит, тяжелую Т-клеточную лимфопению по ДиДжорджи. синдром, агаммаглобулинемия и синдром hyperIgM (71).Тяжелые РНК-вирусные инфекции также наблюдались у пациентов с мутацией потери функции IFN, индуцированной геном геликазы C домена 1 (IFIh2), который кодирует RLR MDA5 (36, 37, 72). Более того, дети, получающие иммуномодулирующую или иммуносупрессивную терапию из-за злокачественных новообразований, трансплантации или аутоиммунного заболевания, более восприимчивы к вирусной инфекции или реактивации.
Клинические признаки и факторы риска вирусного сепсиса
Конституционные симптомы и клинические признаки вирусного сепсиса часто неотличимы от бактериального или грибкового сепсиса.Симптомы и признаки включают лихорадку, озноб, сыпь, респираторный дистресс, тошноту, рвоту, диарею, дизурию, спутанность сознания и изменение психического статуса. Ни один из этих симптомов не является патогномоничным для сепсиса, не говоря уже о вирусном сепсисе. Более того, классические признаки системного воспаления могут быть не у всех, особенно у детей с ослабленным иммунитетом. Лихорадка — один из наиболее распространенных симптомов у детей с сепсисом, связанный с пирогенной активностью IL-1, IL-6, IFN и TNF-α.Было замечено, что эти вещества увеличивают синтез простагландина E2 в гипоталамусе (73, 74), что приводит к повышению заданной температуры ядра центральной нервной системы хозяина, регулируемой пре-оптическим и дорсомедиальным ядрами гипоталамуса (75). С другой стороны, переохлаждение — менее частый, но более конкретный индикатор сепсиса, который может служить предиктором тяжести заболевания и смерти, особенно у детей младшего возраста и хронически ослабленных пациентов (74). Повреждение эндотелия сосудов может привести к поражению множества органов, что проявляется в спутанности сознания, тошноте, рвоте, диарее, олигурии и коагулопатии.Можно увидеть множество сердечно-легочных проявлений, от легкого тахипноэ и тахикардии до острого респираторного дистресс-синдрома и шока (76). Представляющие симптомы обычно зависят от типа вируса. Клиническая картина у пациентов с респираторными вирусными инфекциями может варьироваться от полностью бессимптомной до тяжелой респираторной недостаточности, вызванной пневмонией. Диарейные заболевания наблюдались у пациентов, инфицированных ротавирусом, норовирусом, энтеровирусом и аденовирусом. Инфекция VZV и HSV может проявляться везикулярной сыпью.Дети с ВПГ или арбовирусной инфекцией могут иметь спутанность сознания, изменение психического статуса или судороги из-за энцефалита. Повышение уровня трансаминаз характерно для ВПГ и энтеровирусных инфекций, которые могут осложняться гепатитом, коагулопатией и энцефалитом. Неонатальная инфекция HPeV может имитировать другие энтеровирусные инфекции на начальном этапе. Часто у этих пациентов наблюдаются жар, сыпь, раздражительность, непереносимость пищи и судороги (17). У них может развиться сепсис, как болезнь или энцефалит.У пациентов с острой ВИЧ-инфекцией часто наблюдаются симптомы гриппа, такие как жар, головная боль и сыпь, которые обычно проходят спонтанно. Эти пациенты вскоре вступают в фазу клинической латентности, пока у них не разовьется синдром приобретенного иммунодефицита, обычно предвещаемый приобретением оппортунистической инфекции.
Как и другие типы сепсиса, вирус-индуцированный сепсис требует высокого индекса подозрительности, особенно у очень маленьких детей и детей с хроническими заболеваниями. Новорожденные и младенцы младшего возраста подвергаются более высокому риску сепсиса от HSV, HPeVs и энтеровируса.ВПГ обычно передается перинатально от матерей с генитальным герпесом. Матери с первичным герпесом с большей вероятностью передают инфекцию по сравнению с матерями с рецидивирующим и непервичным герпесом (77). Nielsen et al. Сообщили, что вторые дети подвергаются более высокому риску инфицирования HPeV-3, чем первенцы (78). Судороги, сонливость и летаргия, а также отсутствие поражений полости рта связаны с тяжелой энтеровирусной инфекцией у детей (79). При инфекции RSV сопутствующие заболевания, которые, как сообщается, повышают риск тяжелой инфекции, включают в себя недоношенность в анамнезе, врожденные пороки сердца, хронические заболевания легких и иммунодефицит (13).В недавнем исследовании Eggleston et al. Обнаружили, что пациенты с метапневмовирусной инфекцией с большей вероятностью были старше и имели врожденные пороки сердца по сравнению с пациентами, инфицированными RSV (80). Напротив, астматики и недоношенные дети были подвержены более высокому риску риновирусной инфекции (81). Наконец, предрасполагающие условия для тяжелой детской инфекции гриппа включают возраст менее 2 лет; астма; сердечные, почечные, печеночные, гематологические, неврологические или нервно-мышечные состояния; длительная терапия аспирином; иммуносупрессивная терапия и проживание в лечебном учреждении для хронических больных (82).Риск перинатальной передачи ВИЧ от матери ребенку выше у матерей с числом CD4 <200 клеток / мкл и ниже у младенцев, получающих антиретровирусную профилактику (83, 84). Если пациенты с любым из этих состояний поступают с сепсисом, диагностическое вирусное тестирование и соответствующее эмпирическое противовирусное лечение должны быть строго рассмотрены в соответствии с индивидуальными факторами риска.
Связь с вторичными бактериальными инфекциями и вирусными коинфекциями
Вторичные бактериальные инфекции обычно связаны с респираторными вирусными инфекциями (85).Зимой 1995–96 гг. У здоровых детей, перенесших ранее перенесенное вирусное заболевание гриппом А, возникла вспышка пневмонии, вызванной Streptococcus pneumoniae (86). Во время пандемии гриппа А в 2009–2010 годах у одной трети больных гриппом в критическом состоянии были диагностированы сопутствующие бактериальные инфекции (87). В этом исследовании основными тремя бактериальными коинфекциями были Staphylococcus aureus, Pseudomonas spp . И Haemophilus influenza (87).У детей, госпитализированных по поводу RSV, наиболее частыми микроорганизмами, изолированными от тех, у кого развилась бактериемия, были Haemophilus influenzae и S treptococcus pneumoniae (88). Эти вторичные бактериальные инфекции могут усугубить дисфункцию врожденного иммунитета (89) и существенно повысить риск худших исходов (90, 91). Однако на сегодняшний день механизмы, лежащие в основе бактериального синергизма и повышенной восприимчивости к вторичной бактериальной инфекции на фоне предшествующей респираторно-вирусной инфекции, остаются неясными.В целом, это явление, по-видимому, связано с нарушением защиты респираторного эпителия и врожденной иммунной системы. Вирусное разрушение эпителия дыхательных путей влияет на мукоцилиарный клиренс, позволяя бактериям прикрепляться к муцинам и в конечном итоге колонизировать дыхательные пути (92, 93). Кроме того, индуцированная вирусами повышающая регуляция IFN-γ и TNF-α может привести к нарушению регуляции ответа Т-клеток хозяина, снижению хемотаксиса нейтрофилов и нарушению фагоцитоза макрофагов, что увеличивает восприимчивость хозяина к вторичным бактериальным патогенам (94).Повышающая регуляция рецептора поверхностного фактора активации тромбоцитов на эпителиальных клетках и лейкоцитах провоспалительными цитокинами также может увеличивать адгезию и инвазию некоторых вирулентных штаммов пневмококка (95).
Ротавирусная инфекция также связана с вторичными бактериальными инфекциями (21). Хотя точные механизмы, приводящие к сепсису и дисфункции органов, неизвестны, основная гипотеза предполагает перемещение бактерий и эндотоксина через поврежденный эпителий кишечника в внутреннюю циркуляцию, системное увеличение выработки оксида азота и циркулирующих провоспалительных цитокинов, таких как TNF и IL-1β. , и белок коробки 1 группы с высокой подвижностью, что приводит к последовательной органной недостаточности (96).ВИЧ-инфекция может привести к апоптозу Т-лимфоцитов CD4, нарушению функции Т- и В-лимфоцитов, снижению продукции IFN-γ, IL-2 и иммуноглобулинов, а также снижению активности NK-клеток (97–99). Это приводит не только к повышенному риску вторичных бактериальных инфекций, но также к повышенной восприимчивости к другим вирусам и внутриклеточным организмам, таким как микобактерии и Pneumocystis jiroveci .
Подобно бактериальным коинфекциям, тяжелобольные дети могут одновременно инфицироваться несколькими вирусами.Течение болезни у пациентов с вирусной коинфекцией зависит от взаимодействия вируса с вирусом. Были предложены различные механизмы вирулентности заболевания при вирусных коинфекциях, включая взаимодействия вирусных генов, иммунологические взаимодействия и изменение среды хозяина (100). Несмотря на то, что клиническое значение таких взаимодействий неизвестно, исследование Rhedin et al. сообщили о повышенном риске тяжелого респираторного заболевания у пациентов с вирусными коинфекциями по сравнению с пациентами с одиночными вирусными инфекциями (101).Примерно у 20% пациентов была вирусная коинфекция, а RSV, бокавирус и аденовирус были наиболее распространенными вирусами, ассоциированными с коинфекциями (101). В другом исследовании, проведенном в Канаде на пациентах с респираторными вирусными инфекциями, примерно у 17% пациентов были вирусные коинфекции (102). Не было различий в риске госпитализации или тяжести заболевания у пациентов с одиночными вирусными инфекциями и пациентов с вирусными коинфекциями (102). Другое исследование, проведенное в Греции, показало гораздо более высокий уровень вирусной коинфекции (42%) с наиболее частыми коинфекциями с вирусами RSV, гриппа, риновируса и парагриппа (103).Повышенный риск госпитализации наблюдается у пациентов с вирусными коинфекциями (103). Однако систематические обзоры и метаанализы детей с вирусными коинфекциями не показали какой-либо связи с увеличением клинической тяжести (104, 105). Пациенты, инфицированные ВИЧ, подвергаются высокому риску вторичных вирусных инфекций, таких как ЦМВ, ВПГ, и респираторных вирусов, таких как РСВ, грипп и метапневмовирус.
Диагностическое тестирование
Диагноз вирусного сепсиса обычно исключается.Бактериальный сепсис, первичный или вторичный, обычно вызывает большую первоначальную озабоченность, поскольку неспособность распознать этот диагноз и своевременно ввести системные антибиотики имеет летальные последствия. К сожалению, при нашем нынешнем состоянии ограниченного противовирусного лечения даже быстрое распознавание и лечение вирусного сепсиса не может быстро улучшить клиническое течение пациента. Тем не менее, ранняя и окончательная диагностика первичного вирусного септического процесса может дать информацию для принятия решения о лечении и помочь ограничить ненужное системное введение антибиотиков.У детей с клиническими проявлениями в критическом состоянии выявление вирусной этиологии может играть важную роль в ведении и повлиять на исход этих пациентов.
В настоящее время не существует стандартных подходов к диагностическому тестированию на вирусы. Тестирование на антиген в месте оказания медицинской помощи (POC) относительно недорогое и обеспечивает быстрое обнаружение распространенных респираторных вирусов из носоглоточного мазка, таких как RSV или распространенные штаммы человеческого гриппа. Однако POC-тестированию может не хватать чувствительности, необходимой для определения этиологии опасного для жизни сепсиса (106).Тестирование прямых флуоресцентных антител (DFA) может обеспечить лучшую специфичность и более широкий диапазон обнаружения вирусных штаммов, чем тестирование POC, но тест зависит от сбора достаточного количества эпителиальных клеток для адекватного обнаружения вируса (107). Культура клеток является традиционным золотым стандартом для диагностики вирусов, в том числе для ВПГ, однако длительное время получения результатов значительно ограничивает ее полезность для оперативной диагностики (108). Коммерческие или разработанные в лаборатории тесты амплификации нуклеиновых кислот (NAAT) (e.g., полимеразная цепная реакция, ПЦР или изотермическая амплификация, опосредованная обратной транскрипцией) может обеспечить большую чувствительность и специфичность, чем тестирование POC или DFA, но для его выполнения требуется сложное оборудование и специально обученный лабораторный персонал (109, 110). Дополнительным преимуществом NAAT является высокая степень мультиплексирования с новой коммерчески доступной технологией, такой как мультиплексная ПЦР Biofire ® FilmArray ® (111). К сожалению, использование NAAT ограничено из-за высокой стоимости, задержки результатов и невозможности отличить вирусные нуклеиновые кислоты от живых вирусов (112).В конечном счете, доступные методы своевременного обнаружения вирусов ограничены техникой сбора образцов и доступностью институциональных ресурсов.
Стоит отметить несколько ограничений текущего диагностического тестирования на вирусы-возбудители, и результаты вирусного тестирования всегда следует интерпретировать с осторожностью. Например, хотя HPeV является типом энтеровируса, он не может быть обнаружен с помощью стандартного ПЦР-анализа энтеровируса. HPeV-специфическая ПЦР необходима для обнаружения этого вируса в образцах респираторных органов, спинномозговой жидкости и стула инфицированных детей и должна рассматриваться как часть обследования новорожденных и детей раннего возраста с сепсисом (113).Клиническая применимость панелей вирусной респираторной ПЦР также ограничена их высокими показателями положительных результатов без клинических коррелятов. Обнаружение вируса у пациента с сепсисом не обязательно указывает на причинную связь. Некоторые исследования показали, что респираторный вирус может быть обнаружен примерно у одной трети бессимптомных детей (114, 115). Анализ вирусной ПЦР особенно трудно интерпретировать из-за его высокой чувствительности к вирусным нуклеиновым кислотам, что затрудняет для клинициста различение активного вирусного заболевания и вирусной нуклеиновой кислоты или носительства живого вируса (112, 116, 117).Положительный результат теста может быть результатом бессимптомной колонизации, длительного выделения вируса или сочетанной вирусной инфекции. В исследовании Rhedin et al. при сравнении результатов ПЦР между симптоматическими и бессимптомными пациентами, вирусы RSV, метапневмовируса и парагриппа имели значительно более высокий уровень выявления у детей с острой респираторной инфекцией, что позволяет предположить причинно-следственную связь; однако другие вирусы (энтеровирус, коронавирус, бокавирус, риновирус и аденовирус) имели столь же высокие показатели обнаружения у бессимптомных детей (101).Из-за этих положительных результатов выявления вирусов у бессимптомных детей важно, чтобы клиницисты рассмотрели общую картину и учли другую важную информацию, которая может указывать на активную текущую бактериальную инфекцию, прежде чем прекратить прием антибактериальных препаратов на основе вирусного анализа. Использование биомаркеров сыворотки (см. Раздел ниже) и анализа экспрессии генов в цельной крови (118) может сыграть решающую роль в этих условиях, чтобы отличить вирус от бактериального сепсиса. При столкновении с ребенком с сепсисом, у которого необычное проявление сепсиса, он не отвечает на обычные методы лечения или постоянно имеет отрицательные диагностические оценки, необходимо учитывать вирусную этиологию и рекомендуется консультация со специалистом по инфекционным заболеваниям.
Биомаркеры вирусного сепсиса
Несколько биомаркеров сыворотки, включая лактат, С-реактивный белок (СРБ) и прокальцитонин (ПКТ), используются для руководства при сепсисе и являются важной частью ранней целенаправленной терапии (119). ПКТ чаще используется в отделениях интенсивной терапии для раннего определения вероятности бактериальной этиологии сепсиса и определения продолжительности приема антимикробных препаратов (120, 121). Было показано, что уровень ПКТ в сыворотке повышен при бактериальных инфекциях и превосходит СРБ при оценке тяжести и течения заболевания (122).Однако средняя чувствительность ПКТ как биомаркера сепсиса остается низкой и составляет 77% при специфичности 79% (123, 124). К сожалению, в целом эти биомаркеры неспецифичны для различения бактериальной и вирусной инфекции (125).
В последние годы было идентифицировано несколько вирусоспецифичных биомаркеров. Многие сигнатуры транскрипции были разработаны, чтобы отличать вирусные инфекции от бактериальных инфекций, а также от неинфекционных состояний (126, 127). Заас и др. определили сигнатуру из 30 генов, чтобы отличить субъектов, инфицированных гриппом А с симптомами, от здоровых и инфицированных бактериями субъектов (128).В недавнем исследовании Herberg et al. Сигнатура 2-транскрипта РНК [ FAM89A и IFI44L ) показала многообещающие результаты в ее способности различать бактериальные и вирусные инфекции, демонстрируя, что экспрессия IFI44L была увеличена в у пациентов с вирусной инфекцией, тогда как экспрессия FAM89A была увеличена у пациентов с бактериальной инфекцией (118). Другое недавнее исследование выявило сигнатуру экспрессии четырех генов в цельной крови, чтобы отличить вирусные инфекции от других этиологий (129).Белок устойчивости к миксовирусу человека 1 (MxA) является важным промежуточным продуктом в IFN-опосредованном противовирусном ответе против различных вирусов. Уровни MxA в сыворотке значительно выше у пациентов с вирусными инфекциями по сравнению с бактериальными инфекциями в педиатрической популяции и, таким образом, могут быть дополнительным полезным биомаркером для дифференциации вирусного заболевания от бактериального (130).
Превентивные стратегии и управление
Данных о лечении и ведении вирусной инфекции очень мало.Поддерживающая терапия в настоящее время является основой терапии большинства вирусных инфекций, особенно респираторных вирусов. Хотя антибиотикотерапия широкого спектра действия может быть разумной до тех пор, пока не будет окончательно исключен бактериальный источник сепсиса, длительное лечение антибиотиками не играет никакой роли в лечении вирусного сепсиса, за исключением случаев бактериальных коинфекций. Многие вирусные инфекции можно предотвратить с помощью гигиены рук, дезактивации окружающей среды, использования средств индивидуальной защиты, устранения вторичного табачного дыма и изоляции инфицированных детей (131).Дополнительную защиту можно обеспечить путем введения вакцин против распространенных инфекционных вирусов. Эти профилактические стратегии особенно важны для пациентов из группы высокого риска. Поскольку объем доступных вакцин и противовирусных препаратов остается довольно ограниченным, разработка новых вакцин и лечения имеет решающее значение (131).
В отношении инфекции RSV лечение в настоящее время ограничивается пассивной иммунизацией младенцев из группы риска. Паливизумаб, моноклональное антитело к RSV, одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для профилактики инфекции у младенцев с высоким риском заражения в сезон RSV.Американская академия педиатрии выпустила более четкие рекомендации по применению паливизумаба, в которых говорится, что его следует вводить в виде ежемесячной инъекции в течение сезона RSV детям, родившимся менее 29 недель, 0 дней беременности и младше 12 месяцев или детям с врожденный порок сердца, хроническое заболевание легких (132). Исследования показали переменную эффективность паливизумаба при снижении частоты госпитализаций, связанных с РСВ, примерно на 60% (133). В настоящее время рибавирин в форме аэрозоля является единственным препаратом, одобренным FDA для лечения RSV-инфекции, хотя его использование остается спорным (134).На сегодняшний день вакцины против RSV и противовирусные препараты остаются активной областью исследований (135). В рандомизированном контролируемом исследовании, проведенном у взрослых пациентов с инфекцией RSV, сравнивали ингибитор проникновения RSV GS-5806 с плацебо и продемонстрировали снижение как вирусной нагрузки, так и клинической тяжести инфекции у пациентов, получавших GS-5806 (136). Подобные ингибиторы слияния, такие как ALX-0171 (137), JNJ-2408068 (138), MDT-637 (139) и VP14637 (138), демонстрируют эффективность in vitro , а ALX-0171 проходит фазу II клинических испытаний в младенцы, госпитализированные по поводу RSV (клинические испытания.государственный регистрационный номер NCT02979431). Аналогичным образом было показано, что использование ALS-008176, ингибитора полимеразы RSV, снижает вирусную нагрузку, быстро устраняет RSV и улучшает тяжесть заболевания у взрослых с RSV-инфекцией (140). ALN-RSV01 представляет собой систему наночастиц на основе липидов, содержащую малую интерферирующую РНК (siRNA), которая демонстрирует многообещающие противовирусные эффекты против RSV у пациентов с трансплантатом легких (141) за счет воздействия на мРНК нуклеокапсидного белка RSV, тем самым ограничивая репликацию вируса (142). .Однако до тех пор, пока эти новые методы лечения не пройдут соответствующие клинические испытания, педиатрическое медицинское сообщество должно продолжать ждать эффективной противовирусной терапии RSV.
В отличие от RSV, для лечения вирусных инфекций гриппа доступны сезонные вакцины и несколько противовирусных препаратов. Вакцина против сезонного гриппа продемонстрировала разумную эффективность в ослаблении вирусного заболевания гриппа A и B (143). В настоящее время доступны две формы вакцины против гриппа для детей: живая аттенуированная вакцина в форме назального спрея и инактивированная вакцина в форме инъекций.Противовирусные агенты, используемые для лечения и постконтактной профилактики инфекций гриппа, включают ингибиторы нейраминидазы (осельтамивир и занамивир) и адамантаны (амантадин и римантадин). Осельтамивир является наиболее часто используемым лекарством из-за высокой распространенности резистентности к адамантану. Осельтамивир оказался полезным и переносимым у детей с гриппом при приеме в течение первых 48 часов после болезни (144, 145). Однако в случаях тяжелой инфекции начало приема осельтамивира по истечении 48 часов после появления симптомов все же может принести пользу (146).Вакцины на основе нанотехнологий также разрабатываются против вируса гриппа. InflexalR V и InfluvacR — две виросомные вакцины, эффективность которых против гриппа доказана (147, 148). STP702, другой нанотерапевтический агент, представляет собой разрабатываемую миРНК, предназначенную для ингибирования консервативных областей в штаммах h2N1 и H5N1 вируса гриппа и предотвращения репликации вируса (116). Нанолапки, такие как сиалилнеолакто-N-тетраоза с (LSTc) -содержащие липосомальные ловушки, связываются с гемагглютининами вируса гриппа и предотвращают распространение вируса в vitro, демонстрируя потенциальную эффективность против вируса гриппа (117).Ингибитор полимеразы гриппа Т-705 (фавипиравир) продемонстрировал значительное ослабление активности вируса гриппа (149). Интересно, что в более высоких концентрациях он также показал свою эффективность против полиовируса, риновируса и RSV (149). Другие исследуемые агенты включают CS-8958, ингибитор нейраминидазы длительного действия, и DAS181, ингибитор прикрепления (150). Исследования на животных также показали многообещающие результаты при комбинированной терапии (150). Также были предложены различные иммуномодулирующие агенты для смягчения нерегулируемой воспалительной реакции хозяина при тяжелом гриппе (151), включая ингибиторы циклооксигеназы-2 (152), доксициклин (153), глюкокортикоиды (154), макролиды (155, 156), пролифераторы пероксисом. активированные агонисты рецепторов, такие как гемфиброзил (157), сфингозин-1-фосфат (158) и активатор рецептора Tie2 васкулотид (65).Необходимы дальнейшие исследования для определения эффективности этих методов лечения инфекции гриппа человека.
Плеконарил, пероральный ингибитор вирусного капсида, показал свою эффективность против пикорнавирусов, особенно энтеровирусов и риновирусов (159). Абзуг и др. сообщили о большей выживаемости у пациентов с энтеровирусным сепсисом новорожденных, получавших плеконарил (159). Точно так же у пациентов с риновирусной инфекцией, получавших плеконарил, продолжительность симптомов короче, в зависимости от восприимчивости вируса к лекарству (160).Противовирусной активности плеконарила против HPeV не наблюдалось (18). Внутривенный иммуноглобулин показал потенциальную пользу при лечении энтеровирусных инфекций (161).
Профилактика неонатальной инфекции ВПГ более труднодостижима, поскольку неонатальная болезнь ВПГ часто возникает после передачи от бессимптомных женщин с первичной инфекцией ВПГ (162). В случае активного материнского генитального герпеса кесарево сечение может снизить частоту неонатальной инфекции ВПГ, особенно если оно выполняется в течение 4 часов после разрыва плодных оболочек (163).Субъединичная вакцина против ВПГ показала многообещающие результаты в профилактике генитального герпеса и в настоящее время проходит III фазу испытаний (164). Было продемонстрировано, что противовирусная профилактика ацикловиром на поздних сроках беременности, хотя и не рекомендуется в плановом порядке, снижает выделение вируса, что приводит к снижению частоты кесарева сечения и рецидивов герпеса (165, 166). Пациентам с тяжелой неонатальной инфекцией ВПГ (с диссеминированным заболеванием и инфекцией ЦНС) следует вводить ацикловир внутривенно в течение 21 дня (167).
Вирусный сепсис может возникать у ВИЧ-инфицированных детей из-за оппортунистических или других вторичных вирусных инфекций (19). Расширение использования высокоактивной антиретровирусной терапии (ВААРТ) значительно улучшило выживаемость ВИЧ-инфицированных детей за счет уменьшения прогрессирования синдрома приобретенного иммунодефицита (СПИД), тем самым поддерживая иммунокомпетентность хозяина, которая защищает от развития вирусного сепсиса (168–171). Однако ВААРТ связана с потенциально опасными последствиями, что делает выбор времени терапии весьма спорным для пациентов с активным сепсисом (19).
Результаты
Не проводилось обширных исследований, чтобы охарактеризовать влияние вирусного сепсиса на исходы. В недавнем исследовании Hon et al. не обнаружили разницы в смертности между пациентами с вирусными инфекциями и без них, поступившими в отделение интенсивной терапии интенсивной терапии (172). Shi et al. Провели систематический обзор инфекций RSV в 2015 году и оценили уровень летальности среди детей с RSV-инфекцией примерно в 2,2% (в возрасте до 6 месяцев) и 2,4% (в возрасте 6–11 месяцев) в развивающихся странах.Показатели летальности в странах с более высокими доходами были значительно ниже (0,2 в течение <6 месяцев и 0,9 в течение 6–11 месяцев) (173). В другом исследовании самая высокая смертность от RSV-инфекции наблюдалась в среднем в возрасте 6,2–7,5 месяцев, причем три четверти этих случаев были связаны с сопутствующими заболеваниями (174).
Сезонные эпидемии гриппа и различные пандемии исторически приводили к значительной заболеваемости и смертности в прошлом либо из-за обострения основного заболевания, либо из-за вторичных бактериальных инфекций.Смертность от гриппа зависит не только от сезона, но и от преобладающего штамма гриппа и эффективности вакцины против гриппа каждый сезон. По оценкам, в первый год пандемии h2N1 2009 глобальная смертность среди детей в возрасте 0–17 лет достигла ~ 45 000 случаев, при этом большинство случаев смерти приходилось на Юго-Восточную Азию и Африку (175). Как у детей, так и у взрослых пациентов во время этой пандемии наблюдалось очень быстрое прогрессирование дыхательной недостаточности, и им требовалась длительная искусственная вентиляция легких и вазопрессорная поддержка (176, 177).В литературе сообщалось о различных внелегочных осложнениях, вторичных по отношению к грипповому сепсису. К ним относятся, помимо прочего, почечная недостаточность, рабдомиолиз, энцефалопатия, миокардит и полиорганная недостаточность. Эти осложнения также приводят к худшим результатам (178).
Сепсис, вызванный HPeV, может вызывать значительную заболеваемость новорожденных и детей раннего возраста. Хотя большинство инфекций проходят самостоятельно, у этих пациентов наблюдались долгосрочные неврологические нарушения, такие как нарушение обучаемости, задержка в развитии, паралич и эпилепсия (179, 180).Инфекции HPeV также были связаны с энцефалитом, гепатитом и коагулопатией (18). Кроме того, у этих пациентов наблюдались редкие осложнения, включая некротический энтероколит, миокардит, миозит, гемолитико-уремический синдром и синдром Рея (18). Другие энтеровирусные инфекции могут привести к аналогичным осложнениям и долгосрочным неврологическим нарушениям. У этих пациентов также может наблюдаться нарушение функции печени и сердца (181–183). При инфекции ВПГ у инфицированных новорожденных наблюдались неврологические осложнения, такие как задержка развития и судороги (15).Смертность от системной инфекции ВПГ обычно возникает из-за тяжелой коагулопатии, гепатита и пневмонита (15). В многоцентровом исследовании Spaeder et al. наблюдали уровень смертности 9% у пациентов с тяжелой метапневмовирусной инфекцией (184). Повышенная смертность от метапневмовирусной инфекции наблюдается у детей с хроническими заболеваниями женского пола и пациентов, заразившихся инфекцией в больнице (184). Аналогичным образом, инфекции RSV, парагриппа и гриппа, приобретенные в больнице, были связаны с повышенной смертностью (185).Ротавирусная инфекция может привести к внекишечным осложнениям, таким как судороги и менингоэнцефалит (186, 187). У пациентов с ВИЧ вероятность прогрессирования СПИДа и смертности зависит от времени приобретения ВИЧ, вирусной нагрузки, количества CD4 и времени начала ВААРТ. Примерно 80% смертности наблюдается в развивающихся странах с ограниченным доступом к ВААРТ (188). Осложнения, которые приводят к повышению заболеваемости и смертности у этих пациентов, включают тяжелую ЦМВ-инфекцию, энцефалопатию, повторяющиеся опасные для жизни бактериальные инфекции, туберкулез и пневмоцистную инфекцию (189).
Отказ органов-мишеней является основным фактором смертности при сепсисе и септическом шоке, включая вирус-индуцированный сепсис. Такие осложнения, как острый респираторный дистресс-синдром, диссеминированное внутрисосудистое свертывание и острое повреждение почек, часто приводят к худшему прогнозу. В развивающихся странах часто непропорционально выше смертность пациентов с вирусными инфекциями (190), вероятно, из-за поздней диагностики и лечения. Риск тяжелого сепсиса также связан с местом инфицирования, при этом эндокардит и инфекции ЦНС связаны со смертностью до 20% (1).Помимо места заражения, тип вируса также определяет риск смерти. Например, менингит, вызванный вирусом папилломы человека, является частой причиной сепсиса у новорожденных и детей младшего возраста, но у этих пациентов низкая смертность (179). HPeV3 связан с более тяжелым заболеванием, чем HPeV1 (113). Более того, степень системного поражения может предсказать развитие полиорганной недостаточности и, как следствие, смертность (191). Сообщалось о смертности, связанной с сепсисом, при других вирусных инфекциях, включая лихорадку денге (192).Тем не менее, необходимы дальнейшие исследования, чтобы оценить влияние вирусного сепсиса на исходы, включая заболеваемость, смертность и расходы на здравоохранение.
Сводка
Хотя частота вирусно-индуцированного сепсиса точно не известна, предполагается, что он является обычным явлением и может представлять важную подгруппу детей с «сепсисом с отрицательным посевом». Поэтому для клиницистов крайне важно подозревать и проводить тестирование на вирусную инфекцию у детей с сепсисом с отрицательным посевом, если необходимо своевременно принять соответствующие меры по сдерживанию инфекции и в интересах раннего выявления детей с вирусными инфекциями, поддающихся лечению.Эти соображения особенно важны для детей из группы высокого риска, таких как недоношенные дети, дети с врожденными пороками сердца, хроническими заболеваниями легких или иммунодефицитом. Надлежащая диагностика вирусного сепсиса может дать врачу дополнительную уверенность в ограничении продолжительности эмпирического антибактериального воздействия на детей с сепсисом и, следовательно, может быть полезной в борьбе с устойчивыми к антибиотикам бактериями. Необходимы дальнейшие исследования для выявления новых вирусоспецифичных биомаркеров и терапевтических средств.
Взносы авторов
NG, RR, SR и MK внесли свой вклад в концепцию, написание и окончательное редактирование этой рукописи.
Финансирование
Эта работа финансировалась Национальными институтами здравоохранения (NHLBI 5K08HL119359-02) для MK.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Уотсон Р.С., Карсилло Дж. А., Линде-Цвирбл В. Т., Клермон Дж., Лидикер Дж., Ангус, округ Колумбия. Эпидемиология тяжелого сепсиса у детей в США. Am J Respir Crit Care Med. (2003) 167: 695–701. DOI: 10.1164 / rccm.200207-682OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Зингер М., Дойчман К.С., Сеймур К.В., Шанкар-Хари М., Аннан Д., Бауэр М. и др. Третье международное согласованное определение сепсиса и септического шока (Сепсис-3). JAMA (2016) 315: 801–10. DOI: 10.1001 / jama.2016.0287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Кость RC. Синдром сепсиса. Определение и общий подход к менеджменту. Clin Chest Med . (1996) 17: 175–81.
PubMed Аннотация | Google Scholar
5. Fleischmann-Struzek C, Goldfarb DM, Schlattmann P, Schlapbach LJ, Reinhart K, Kissoon N. Глобальное бремя детского и неонатального сепсиса: систематический обзор. Ланцет Респир Мед . (2018) 6: 223–30. DOI: 10.1016 / S2213-2600 (18) 30063-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Родос А., Эванс Л. Е., Альхазани В., Леви М. М., Антонелли М., Феррер Р. и др. Кампания по выживанию после сепсиса: международные рекомендации по ведению сепсиса и септического шока: 2016 г. Intensive Care Med . (2017) 43: 304–77. DOI: 10.1007 / s00134-017-4683-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Ljungstrom LR, Jacobsson G, Claesson BEB, Andersson R, Enroth H. У пациентов с подозрением на сепсис респираторные вирусные инфекции не диагностируются. Eur J Clin Microbiol Infect Dis . (2017) 36: 1767–76. DOI: 10.1007 / s10096-017-2990-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Weiss SL, Fitzgerald JC, Pappachan J, Wheeler D, Jaramillo-Bustamante JC, Salloo A, et al. Глобальная эпидемиология тяжелого сепсиса в педиатрии: исследование распространенности, исходов и методов лечения сепсиса. Am J Respir Crit Care Med . (2015) 191: 1147–57. DOI: 10.1164 / rccm.201412-2323OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Schlapbach LJ, Straney L, Alexander J, MacLaren G, Festa M, Schibler A, et al. Смертность, связанная с инвазивными инфекциями, сепсисом и септическим шоком у детей в критическом состоянии в Австралии и Новой Зеландии, 2002–2013 годы: многоцентровое ретроспективное когортное исследование. Ланцет Infect Dis . (2015) 15: 46–54. DOI: 10.1016 / S1473-3099 (14) 71003-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10.Эймс С.Г., Уоркман Дж. К., Олсон Дж. А., Коргенски Е. К., Масотти С., Кнакстедт Е. Д. и др. Инфекционные этиологии и исходы у пациентов при детском септическом шоке. J Pediatric Infect Dis Soc. (2017) 6: 80–6. DOI: 10.1093 / jpids / piv108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Байингтон С.Л., Энрикес Ф.Р., Хофф К., Туохи Р., Таггарт Е.В., Хиллард Д.Р. и др. Серьезные бактериальные инфекции у младенцев с лихорадкой от 1 до 90 дней с вирусными инфекциями и без них. Педиатрия (2004) 113: 1662–6.
PubMed Аннотация | Google Scholar
12. Бхат Н., Райт Дж. Г., Бродер К. Р., Мюррей Е. Л., Гринберг М. Е., Гловер М. Дж. И др. Смертность детей, связанных с гриппом, в США, 2003–2004 гг. N Engl J Med. (2005) 353: 2559–67. DOI: 10.1056 / NEJMoa051721
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Закон Б.Дж., Карбонелл-Эстрани X, Симоэс Э.А. Обновленная информация об эпидемиологии респираторно-синцитиального вируса: взгляд из развитых стран. Респир Мед . (2002) 96 (Приложение B): S1–7. DOI: 10.1016 / S0954-6111 (02)
-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Шарп Дж., Харрисон К.Дж., Пакетт К., Селвараджу С.Б., Пенаранда С., Никс В.А. и др. Характеристики младенцев раннего возраста, у которых пареховирус человека, энтеровирус или ни один из них не был обнаружен в спинномозговой жидкости во время оценки сепсиса. Pediatr Infect Dis J . (2013) 32: 213–6. DOI: 10.1097 / INF.0b013e318276b328
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Verboon-Maciolek MA, Krediet TG, Gerards LJ, de Vries LS, Groenendaal F, van Loon AM. Тяжелая неонатальная пареховирусная инфекция и сходство с энтеровирусной инфекцией. Pediatr Infect Dis J. (2008) 27: 241–5. DOI: 10.1097 / INF.0b013e31815c1b07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Randolph AG, McCulloh RJ. Детский сепсис: важные соображения для диагностики и лечения тяжелых инфекций у младенцев, детей и подростков. Вирулентность (2014) 5: 179–89.DOI: 10.4161 / viru.27045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Флореску Д.Ф., Калил А.С. Цитомегаловирусные инфекции у пациентов с ослабленным и ослабленным иммунитетом в отделении интенсивной терапии. Infect Disord Drugs Targets (2011) 11: 354–64.
PubMed Аннотация | Google Scholar
26. Карсилло Дж. А., Подд Б., Анеха Р., Вайс С. Л., Холл М. В., Корнелл Т. Т. и др. Патофизиология синдрома полиорганной недостаточности у детей. Pediatr Crit Care Med . (2017) 18 (Приложение 1): S32–45. DOI: 10.1097 / PCC.0000000000001052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Стейнберг Б. Е., Гольденберг Н. М., Ли В. Л.. Имитируют ли вирусные инфекции бактериальный сепсис? Роль проницаемости микрососудов: обзор механизмов и методов. Противовирусный Res . (2012) 93: 2–15. DOI: 10.1016 / j.antiviral.2011.10.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Ng CS, Kato H, Fujita T. Распознавание вирусов в цитоплазме с помощью RLR и других геликаз — как конформационные изменения, митохондриальная динамика и убиквитинирование контролируют врожденные иммунные ответы. Инт Иммунол . (2012) 24: 739–49. DOI: 10.1093 / intimm / dxs099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Jensen S, Thomsen AR. Зондирование РНК-вирусов: обзор рецепторов врожденного иммунитета, участвующих в распознавании инвазии РНК-вируса. J Virol. (2012) 86: 2900–10.DOI: 10.1128 / JVI.05738-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Nimmerjahn F, Dudziak D, Dirmeier U, Hobom G, Riedel A, Schlee M, et al. Активная передача сигналов NF-kappaB является предпосылкой для заражения вирусом гриппа. Дж. Вирол . (2004) 85: 2347–56. DOI: 10.1099 / vir.0.79958-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Като Х., Такеучи О, Сато С., Йонеяма М., Ямамото М., Мацуи К. и др. Различная роль геликаз MDA5 и RIG-I в распознавании РНК-вирусов. Nature (2006) 441: 101–5. DOI: 10.1038 / nature04734
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Ван С., Ле ТК, Курихара Н., Чида Дж., Сиссе Й., Яно М. и др. Цикл вирус-цитокин-протеаза гриппа в патогенезе повышенной проницаемости сосудов при тяжелом гриппе. J Заразить Dis . (2010) 202: 991–1001. DOI: 10.1086 / 656044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Puerta-Guardo H, Glasner DR, Harris E.Вирус денге NS1 разрушает эндотелиальный гликокаликс, что приводит к повышенной проницаемости. PLoS Pathog. (2016) 12: e1005738. DOI: 10.1371 / journal.ppat.1005738
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Дункан М.Э., Ричардсон Дж. П., Мюррей Дж. И., Мелвин В. Т., Фотергилл Дж. Э. Матричная металлопротеиназа-9 человека: активация ограниченным воздействием трипсина и образование моноклональных антител, специфичных для активированной формы. Eur J Biochem . (1998) 258: 37–43.DOI: 10.1046 / j.1432-1327.1998.2580037.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Рамнат Р., Фостер Р., Цю Й., Коуп Дж., Батлер М. Дж., Салмон А. Х. и др. Опосредованное матриксной металлопротеиназой 9 выделение синдекана 4 в ответ на фактор некроза опухоли альфа: участник дисфункции гликокаликса эндотелиальных клеток. FASEB J . (2014) 28: 4686–99. DOI: 10.1096 / fj.14-252221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42.Chappell D, Jacob M, Rehm M, Stoeckelhuber M, Welsch U, Conzen P и др. Гепариназа избирательно выводит гепарансульфат из эндотелиального гликокаликса. Биол Химия . (2008) 389: 79–82. DOI: 10.1515 / BC.2008.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Перроне Л.А., Белсер Дж. А., Уодфорд Д. А., Кац Дж. М., Тампей TM. Индуцируемый оксид азота способствует вирусному патогенезу после инфицирования мышей высокопатогенным вирусом гриппа. J Заразить Dis .(2013) 207: 1576–84. DOI: 10.1093 / infdis / jit062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Rubio-Gayosso I, Platts SH, Duling BR. Активные формы кислорода опосредуют модификацию гликокаликса во время ишемического реперфузионного повреждения. Am J Physiol Heart Circ Physiol . (2006) 290: h3247–56. DOI: 10.1152 / ajpheart.00796.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Гарофало Р.П., Колли Д., Казола А. Респираторно-синцитиальная вирусная инфекция: механизмы окислительно-восстановительного контроля и новые терапевтические возможности. Антиоксидный окислительно-восстановительный сигнал . (2013) 18: 186–217. DOI: 10.1089 / ars.2011.4307
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Армстронг С.М., Мубарека С., Ли В.Л. Эндотелий микрососудов легких как терапевтическая мишень при тяжелом гриппе. Противовирусный Res . (2013) 99: 113–8. DOI: 10.1016 / j.antiviral.2013.05.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Chen HR, Chao CH, Liu CC, Ho TS, Tsai HP, Perng GC, et al.Фактор ингибирования миграции макрофагов имеет решающее значение для индуцированной денге NS1 деградации эндотелиального гликокаликса и повышенной проницаемости. PLoS Pathog. (2018) 14: e1007033. DOI: 10.1371 / journal.ppat.1007033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Константинеску А.А., Винк Х., Спаан Я.А. Гликокаликс эндотелиальных клеток модулирует иммобилизацию лейкоцитов на поверхности эндотелия. Артериосклер тромб Vasc Biol . (2003) 23: 1541–7. DOI: 10.1161 / 01.ATV.0000085630.24353.3D
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Ву Г., Эссекс Д.В., Мелони Ф.Дж., Такафута Т., Фудзимура К., Конкл Б.А. и др. Эндотелиальные клетки человека в культуре и in vivo, экспрессируют на своей поверхности все четыре компонента гликопротеинового комплекса Ib / IX / V. Кровь (1997) 90: 2660–9.
PubMed Аннотация | Google Scholar
51. Ruggeri ZM. Фактор фон Виллебранда, взаимодействие тромбоцитов и эндотелиальных клеток. J Thromb Haemost. (2003) 1: 1335–42.
PubMed Аннотация | Google Scholar
52. Коэдам Дж. А., Крамер Е. М., Бринд Э, Фьюри Б., Фьюри Б. К., Вагнер Д. Д.. Р-селектин, белок мембран гранул тромбоцитов и эндотелиальных клеток, следует регулируемому секреторному пути в клетках AtT-20. Дж. Клеточная Биол . (1992) 116: 617–25.
PubMed Аннотация | Google Scholar
53. Berndt MC, Shen Y, Dopheide SM, Gardiner EE, Andrews RK. Сосудистая биология комплекса гликопротеинов Ib-IX-V. Thromb Haemost. (2001) 86: 178–88.
PubMed Аннотация | Google Scholar
55. Сяо К., Эллисон Д. Ф., Коттке М. Д., Саммерс С., Сореску Г. П., Фаундез В. и др. Механизмы процессинга и деградации VE-кадгерина в эндотелиальных клетках микрососудов. Дж. Биол. Хим. . (2003) 278: 19199–208. DOI: 10.1074 / jbc.M211746200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Поттер М.Д., Барберо С, Череш Д.А. Фосфорилирование VE-кадгерина тирозином предотвращает связывание p120- и бета-катенина и поддерживает мезенхимальное состояние клетки. J. Biol Chem. (2005) 280: 31906–12. DOI: 10.1074 / jbc.M505568200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Горбунова Э., Гавриловская И.Н., Маков Э.Р. Патогенные хантавирусы Вирус Анд и вирус Хантаан вызывают разрушение спаек, управляя интернализацией кадгерина эндотелия сосудов в эндотелиальных клетках человека. J Virol. (2010) 84: 7405–11. DOI: 10.1128 / JVI.00576-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Дэвис С., Олдрич Т.Х., Джонс П.Ф., Ачесон А., Комптон Д.Л., Джайн В. и др. Выделение ангиопоэтина-1, лиганда рецептора TIE2, путем клонирования экспрессии секреторной ловушки. Cell (1996) 87: 1161–9.
PubMed Аннотация | Google Scholar
61. Левин Дж. Д., Харлан Дж. М., Харкер Л. А., Джозеф М. Л., графы РБ. Тромбин-опосредованное высвобождение антигена фактора VIII из эндотелиальных клеток пупочной вены человека в культуре. Кровь (1982) 60: 531–4.
PubMed Аннотация | Google Scholar
62.Vischer UM, Jornot L, Wollheim CB, Theler JM. Промежуточные продукты реактивного кислорода индуцируют регулируемую секрецию фактора фон Виллебранда культивируемыми эндотелиальными клетками сосудов человека. Кровь (1995) 85: 3164–72.
PubMed Аннотация | Google Scholar
63. Мацусита К., Ямакучи М., Моррелл С.Н., Одзаки М., О’Рурк Б., Ирани К. и др. Регуляция фактора роста эндотелия сосудов экзоцитоза тельца Вейбеля-Паладе. Кровь (2005) 105: 207–14. DOI: 10.1182 / кровь-2004-04-1519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64.Fiedler U, Scharpfenecker M, Koidl S, Hegen A, Grunow V, Schmidt JM и др. Tie-2-лиганд ангиопоэтин-2 накапливается и быстро высвобождается при стимуляции эндотелиальных клеток тельцами Вейбеля-Палада. Кровь (2004) 103: 4150–6. DOI: 10.1182 / кровь-2003-10-3685
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Сугияма М.Г., Армстронг С.М., Ван Ч., Хван Д., Леонг-Пои Х., Адвани А. и др. Васкулотид, агонист Tie2, спасает мышей от инфекции вирусом гриппа. Научная репутация . (2015) 5: 11030. DOI: 10.1038 / srep11030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Дайдодзи Т., Кома Т., Ду А., Янг С.С., Уэда М., Икута К. и др. Вирус птичьего гриппа H5N1 вызывает апоптотическую гибель клеток эпителия дыхательных путей млекопитающих. Дж Вирол . (2008) 82: 11294–307. DOI: 10.1128 / JVI.01192-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Zhou J, Law HK, Cheung CY, Ng IH, Peiris JS, Lau YL.Функциональная продукция индуцирующего апоптоз лиганда, связанного с фактором некроза опухоли, макрофагами, инфицированными вирусом птичьего гриппа. J Заразить Dis . (2006) 193: 945–53. DOI: 10.1086 / 500954
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Олийве Л., Дженнингс Л., Уоллс Т. Человеческий пареховирус: все более признанная причина сепсисоподобных заболеваний у детей раннего возраста. Clin Microbiol Ред. . (2018) 31: e00047–17. DOI: 10.1128 / CMR.00047-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Чжан Л., Пиплз М.Э., Буше Р.С., Коллинз П.Л., Пиклз Р.Дж. Инфекция респираторно-синцитиальным вирусом эпителиальных клеток дыхательных путей человека поляризована, специфична для реснитчатых клеток и не имеет явной цитопатологии. Дж Вирол . (2002) 76: 5654–66. DOI: 10.1128 / JVI.76.11.5654-5666.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Асгари С., Шлапбах Л. Дж., Анчиси С., Хаммер С., Барта И., Джунье Т. и др. Тяжелые вирусные респираторные инфекции у детей с мутациями потери функции IFIh2. Proc Natl Acad Sci USA. (2017) 114: 8342–7. DOI: 10.1073 / pnas.1704259114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Dinarello CA, Kent EF, Jr. Химическая характеристика вещества, индуцирующего интерлейкин-1, полученного в результате реакций смешанных лейкоцитов человека: Вещество, индуцирующее IL-1, не является гамма-интерфероном. Йельский институт биологии и медицины . (1985) 58: 101–13.
Google Scholar
74. Харрис Р.Л., Мушер Д.М., Блум К., Гате Дж., Райс Л., Шугарман Б. и др.Проявления сепсиса. Arch Intern Med. (1987) 147: 1895–906.
PubMed Аннотация | Google Scholar
75. Zhao ZD, Yang WZ, Gao C, Fu X, Zhang W., Zhou Q, et al. Гипоталамический контур, контролирующий температуру тела. Proc Natl Acad Sci USA. (2017) 114: 2042–7. DOI: 10.1073 / pnas.1616255114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Краус М.М., Перель А., Эймерл Д., Котев С. Сердечно-легочные эффекты объемной нагрузки у пациентов с септическим шоком. Энн Сург . (1977) 185: 429–34.
PubMed Аннотация | Google Scholar
77. Браун З.А., Уолд А., Морроу Р.А., Селке С., Зе Дж., Кори Л. Влияние серологического статуса и кесарева сечения на скорость передачи вируса простого герпеса от матери к ребенку. JAMA (2003) 289: 203–9.
PubMed Аннотация | Google Scholar
78. Нильсен Н.М., Мидгли С.Е., Нильсен А.С., Кристиансен С.Б., Фишер Т.К. Тяжелые инфекции, вызванные пареховирусом человека, у младенцев и роль старших братьев и сестер. Am J Epidemiol . (2016) 183: 664–70. DOI: 10.1093 / AJE / kwv206
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Owatanapanich S, Wutthanarungsan R, Jaksupa W., Thisyakorn U. Факторы риска тяжелых энтеровирусных инфекций у детей. J Med Assoc Thai . (2016) 99: 322–30.
PubMed Аннотация | Google Scholar
80. Эгглстон HA, Ганвилл К.Ф., Миллер Д.И., Зонтаг М.К., Мурани П.М. Сравнение характеристик и исходов тяжелых метапневмовирусных инфекций человека и респираторно-синцитиальных вирусных инфекций у детей, находящихся на лечении в отделении интенсивной терапии. Pediatr Infect Dis J . (2013) 32: 1330–4. DOI: 10.1097 / INF.0b013e3182a2261b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Нгвенде С., Гомбе Н.Т., Мидзи С., Чиманга М., Шамбира Дж., Чадамбука А. Факторы, связанные с ВИЧ-инфекцией среди детей, рожденных матерями, в программе профилактики передачи от матери ребенку в больнице Читунгвиза, Зимбабве, 2008. BMC Общественное здравоохранение (2013) 13: 1181. DOI: 10.1186 / 1471-2458-13-1181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84.де Лемос Л.М., Липпи Дж., Резерфорд Г.В., Дуарте Г.С., Мартинс Н.Г., Сантос В.С. и др. Факторы материнского риска заражения ВИЧ-инфекцией у младенцев на северо-востоке Бразилии. Int J Infect Dis . (2013) 17: e913–8. DOI: 10.1016 / j.ijid.2013.04.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. О’Брайен К.Л., Уолтерс М.И., Селлман Дж., Квинлиск П., Регнери Н., Шварц Б. и др. Тяжелая пневмококковая пневмония у ранее здоровых детей: роль предшествующей гриппозной инфекции. Клиническая инфекция . (2000) 30: 784–9. DOI: 10.1086 / 313772
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Randolph AG, Vaughn F, Sullivan R, Rubinson L, Thompson BT, Yoon G, et al. Дети в критическом состоянии во время пандемии гриппа 2009-2010 гг. В США. Педиатрия (2011) 128: e1450–8. DOI: 10.1542 / peds.2011-0774
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Cebey-Lopez M, Pardo-Seco J, Gomez-Carballa A, Martinon-Torres N, Martinon-Sanchez JM, Justicia-Grande A, et al.Бактериемия у детей, госпитализированных с респираторно-синцитиальной вирусной инфекцией. PLoS ONE (2016) 11: e0146599. DOI: 10.1371 / journal.pone.0146599
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Холл М.В., Гейер С.М., Го С.Й., Паноскальцис-Мортари А., Жуве П., Фердинанд Дж. И др. Врожденная иммунная функция и смертность у тяжелобольных детей с гриппом: многоцентровое исследование. Crit Care Med . (2013) 41: 224–36. DOI: 10.1097 / CCM.0b013e318267633c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90.Morens DM, Taubenberger JK, Fauci AS. Преобладающая роль бактериальной пневмонии как причины смерти при пандемическом гриппе: последствия для готовности к пандемическому гриппу. J Infect Dis. (2008) 198: 962–70. DOI: 10.1086 / 5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Финелли Л., Фиоре А., Дхара Р., Браммер Л., Шей Д. К., Камимото Л. и др. Детская смертность, связанная с гриппом, в США: увеличение коинфекции Staphylococcus aureus . Педиатрия (2008) 122: 805–11. DOI: 10.1542 / педс.2008-1336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Уилсон Р., Доулинг Р. Б., Джексон А. Д.. Биология бактериальной колонизации и инвазии слизистой оболочки дыхательных путей. Eur Respir J . (1996) 9: 1523–30.
PubMed Аннотация | Google Scholar
93. Avadhanula V, Rodriguez CA, Devincenzo JP, Wang Y, Webby RJ, Ulett GC, et al. Респираторные вирусы усиливают адгезию бактериальных патогенов к респираторному эпителию в зависимости от вида вируса и типа клеток. J Virol. (2006) 80: 1629–36. DOI: 10.1128 / JVI.80.4.1629-1636.2006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Rynda-Apple A, Робинсон KM, Alcorn JF. Грипп и бактериальная суперинфекция: освещение иммунологических механизмов болезни. Infect Immun. (2015) 83: 3764–70. DOI: 10.1128 / IAI.00298-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Канделл Д. Р., Джерард Н. П., Джерард К., Иданпаан-Хейккила И., Туоманен Е. И.. Streptococcus pneumoniae прикрепляется к активированным клеткам человека рецептором фактора активации тромбоцитов. Nature (1995) 377: 435–8. DOI: 10.1038 / 377435a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Гоулдер П.Дж., Джина П., Тюдор-Уильямс Г., Берчетт С. Детская ВИЧ-инфекция: корреляты защитного иммунитета и глобальные перспективы профилактики и лечения. Бр Мед Булл . (2001) 58: 89–108.
PubMed Аннотация | Google Scholar
98.Тюдор-Вильямс G, Pizzo PA. Инфекция, вызванная вирусом иммунодефицита человека у детей. В: Stiehm ER, редактор. Иммунологические расстройства у младенцев и детей. 4-е изд . Филадельфия, Пенсильвания: WB Saunders Company (1996). п. 510–52.
99. Хоган С.М., Хаммер С.М. Детерминанты хозяина в ВИЧ-инфекции и болезни. Часть 1: клеточные и гуморальные иммунные ответы. Энн Интерн Мед. . (2001) 134: 761–76.
PubMed Аннотация | Google Scholar
101. Rhedin S, Lindstrand A, Rotzen-Ostlund M, Tolfvenstam T, Ohrmalm L, Rinder MR, et al.Клиническая применимость ПЦР для выявления распространенных вирусов при острых респираторных заболеваниях. Педиатрия (2014) 133: e538–45. DOI: 10.1542 / педс.2013-3042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Аснер С.А., Роуз В., Петрич А., Ричардсон С., Тран Д. Является ли коинфекция вирусом предиктором тяжести респираторных вирусных инфекций у детей? Clin Microbiol Infect . (2015) 21: 264.e1–6. DOI: 10.1016 / j.cmi.2014.08.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103.Kouni S, Karakitsos P, Chranioti A, Theodoridou M, Chrousos G, Michos A. Оценка сочетанных вирусных инфекций у госпитализированных и не госпитализированных детей с респираторными инфекциями с помощью микроматриц. Clin Microbiol Infect . (2013) 19: 772–7. DOI: 10.1111 / 1469-0691.12015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Лим Ф.Дж., де Клерк Н., Блит С.К., Фатима П., Мур ХК. Систематический обзор и мета-анализ респираторно-вирусных коинфекций у детей. Респирология (2016) 21: 648–55. DOI: 10.1111 / resp.12741
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Скотта М.С., Чакр В.К., де Моура А., Беккер Р.Г., де Соуза А.П., Джонс М.Х. и др. Коинфекция респираторно-вирусными инфекциями и тяжесть заболевания у детей: систематический обзор и метаанализ. Дж. Клин Вирол . (2016) 80: 45–56. DOI: 10.1016 / j.jcv.2016.04.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Асланзаде Дж., Чжэн Х, Ли Х., Тетро Дж., Раткевич И., Мэн С. и др.Проспективная оценка экспресс-тестов на антигены для диагностики респираторно-синцитиального вируса и метапневмовирусных инфекций человека. Дж. Клин Микробиол . (2008) 46: 1682–5. DOI: 10.1128 / JCM.00008-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Гриффитс С., Дрюс С.Дж., Марчант Д.Дж. Респираторно-синцитиальный вирус: инфекция, обнаружение и новые возможности профилактики и лечения. Clin Microbiol Ред. . (2017) 30: 277–319. DOI: 10.1128 / CMR.00010-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109.Сирато К., Нисимура Х., Сайджо М., Окамото М., Нода М., Таширо М. и др. Диагностика респираторно-синцитиальной вирусной инфекции человека с использованием изотермической амплификации, опосредованной обратной транскрипцией. J Virol Methods (2007) 139: 78–84. DOI: 10.1016 / j.jviromet.2006.09.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. де-Пари Ф., Бек С., Мачадо А.Б., Пайва Р.М., да Силва Менезеш Д., де Соуза Нуньес Л. и др. Оптимизация одностадийной дуплексной ОТ-ПЦР в реальном времени для обнаружения вируса гриппа и респираторно-синцитиального вируса в носоглоточных аспиратах. J Virol Methods (2012) 186: 189–92. DOI: 10.1016 / j.jviromet.2012.07.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Кутюрье М.Р., Барни Т., Алджер Дж., Хаймас В.С., Стивенсон Дж. Б., Хиллард Д. и др. Оценка респираторной панели Filmarray (R) для клинического использования в большой детской больнице. Анал J Clin Lab . (2013) 27: 148–54. DOI: 10.1002 / jcla.21576
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112.Гилл П.Дж., Ричардсон С.Е., Оструу О., Фридман Дж. Тестирование на респираторные вирусы у детей: мазать или не мазать. Педиатр JAMA . (2017) 171: 798–804. DOI: 10.1001 / jamapediatrics.2017.0786
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Wolthers KC, Benschop KS, Schinkel J, Molenkamp R, Bergevoet RM, Spijkerman IJ, et al. Пареховирусы человека как важная вирусная причина сепсисоподобных заболеваний и менингита у детей раннего возраста. Клиническая инфекция .(2008) 47: 358–63. DOI: 10.1086 / 589752
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Мо Н, Педерсен Б., Нордбо С.А., Сканке Л.Х., Крокстад С., Смирнайос А. и др. Обнаружение респираторного вируса и клиническая диагностика у детей, посещающих дневной стационар. PLoS ONE (2016) 11: e0159196. DOI: 10.1371 / journal.pone.0159196
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Martin ET, Fairchok MP, Kuypers J, Magaret A, Zerr DM, Wald A, et al.Частое и продолжительное выделение бокавируса у маленьких детей, посещающих детские сады. J Заразить Dis . (2010) 201: 1625–32. DOI: 10.1086 / 652405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Хендрикс Г.Л., Вейрих К.Л., Вишванатан К., Ли Дж., Шрайвер З.Х., Ашур Дж. И др. Липосомные липосомальные ловушки, несущие сиалилнеолакто-N-тетраозу с (LSTc), захватывают вирус гриппа А. Дж. Биол. Хим. . (2013) 288: 8061–73. DOI: 10.1074 / jbc.M112.437202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118.Herberg JA, Kaforou M, Wright VJ, Shailes H, Eleftherohorinou H, Hoggart CJ, et al. Точность диагностического теста сигнатуры РНК хозяина с двумя транскриптами для различения бактериальной и вирусной инфекции у детей с лихорадкой. JAMA (2016) 316: 835–45. DOI: 10.1001 / jama.2016.11236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Риверс Э, Нгуен Б., Хавстад С., Ресслер Дж., Маззин А., Кноблих Б. и др. Ранняя целенаправленная терапия в лечении тяжелого сепсиса и септического шока. N Engl J Med. (2001) 345: 1368–77. DOI: 10.1056 / NEJMoa010307
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Prkno A, Wacker C, Brunkhorst FM, Schlattmann P. Терапия под контролем прокальцитонина у пациентов отделения интенсивной терапии с тяжелым сепсисом и септическим шоком — систематический обзор и метаанализ. Crit Care (2013) 17: R291. DOI: 10.1186 / cc13157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Доунс К.Дж., Вайс С.Л., Гербер Дж.С., Клигер С.Б., Фицджеральд Дж.С., Баламут Ф. и др.Прагматический алгоритм, основанный на биомаркерах, для руководства использованием антибиотиков в педиатрическом отделении интенсивной терапии: исследование «Оптимизация антибиотических стратегий при сепсисе» (OASIS). J Pediatric Infect Dis Soc . (2017) 6: 134–41. DOI: 10.1093 / jpids / piw023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Meisner M, Tschaikowsky K, Palmaers T, Schmidt J. Сравнение плазменных концентраций прокальцитонина (PCT) и С-реактивного белка (CRP) при различных показателях SOFA во время сепсиса и MODS. Crit Care (1999) 3: 45–50. DOI: 10.1186 / cc306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Wacker C, Prkno A, Brunkhorst FM, Schlattmann P. Прокальцитонин как диагностический маркер сепсиса: систематический обзор и метаанализ. Ланцет Infect Dis . (2013) 13: 426–35. DOI: 10.1016 / S1473-3099 (12) 70323-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Ху Х, Ю Дж, Кросби С.Д., Сторч Г.А. Профили экспрессии генов у детей с лихорадкой и определенной вирусной и бактериальной инфекцией. Proc Natl Acad Sci USA. (2013) 110: 12792–7. DOI: 10.1073 / pnas.1302968110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
127. Вудс К.В., Макклейн М.Т., Чен М., Заас А.К., Николсон Б.П., Варки Дж. И др. Сигнатура транскрипции хозяина для пресимптоматического обнаружения инфекции у людей, подвергшихся воздействию вируса гриппа h2N1 или h4N2. PLoS ONE (2013) 8: e52198. DOI: 10.1371 / journal.pone.0052198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128.Заас А.К., Чен М., Варки Дж., Велдман Т., Герой АО III, Лукас Дж. И др. Сигнатуры экспрессии генов позволяют диагностировать грипп и другие симптоматические респираторные вирусные инфекции у людей. Клеточный микроб-хозяин (2009) 6: 207-17. DOI: 10.1016 / j.chom.2009.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
129. Сэмпсон Д.Л., Фокс Б.А., Ягер Т.Д., Бхид С., Кермелли С., МакХью Л.С. и др. Сигнатура крови с четырьмя биомаркерами позволяет отличить системное воспаление, вызванное вирусной инфекцией, от других этиологий. Научная репутация . (2017) 7: 2914. DOI: 10.1038 / s41598-017-02325-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Энгельманн И., Дубош Ф., Лоберт П.Е., Хусен С., Дега В., Сардет А. и др. Диагностика вирусных инфекций с помощью протеина устойчивости к миксовирусу А (MxA). Педиатрия (2015) 135: e985–93. DOI: 10.1542 / peds.2014-1946
PubMed Аннотация | CrossRef Полный текст | Google Scholar
131. Альтер С.Дж., Беннетт Дж.С., Корани К., Креппель А., Саймон Р.Распространенные детские вирусные инфекции. Curr Probl Pediatr Adolesc Health Care (2015) 45: 21–53. DOI: 10.1016 / j.cppeds.2014.12.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132. Комитет Американской академии педиатрии по инфекционным заболеваниям D, Рекомендации Американской академии педиатрии по бронхиолиту C. Обновленное руководство по профилактике паливизумабом среди младенцев и детей раннего возраста с повышенным риском госпитализации по поводу респираторно-синцитиальной вирусной инфекции. Педиатрия (2014) 134: 415–20. DOI: 10.1542 / peds.2014-1665
PubMed Аннотация | CrossRef Полный текст
133. Комитет по инфекционным заболеваниям D. От американской академии педиатрии: политические заявления — модифицированные рекомендации по использованию паливизумаба для профилактики респираторно-синцитиальных вирусных инфекций. Педиатрия (2009) 124: 1694–701. DOI: 10.1542 / peds.2009-2345
PubMed Аннотация | CrossRef Полный текст
134. Конрад Д.А., Кристенсон Дж. К., Ванер Дж. Л., Маркс М. И..Аэрозольный рибавирин для лечения респираторно-синцитиальной вирусной инфекции у младенцев, госпитализированных во время эпидемии. Pediatr Infect Dis J. (1987) 6: 152–8.
PubMed Аннотация | Google Scholar
135. Мазур Н.И., Мартинон-Торрес Ф., Баральди Э., Фору Б., Гриноу А., Хейккинен Т. и др. Инфекция нижних дыхательных путей, вызванная респираторно-синцитиальным вирусом: текущее лечение и новые методы лечения. Ланцет Респир Мед . (2015) 3: 888–900. DOI: 10.1016 / S2213-2600 (15) 00255-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136.Де Винченцо Дж. П., Уитли Р. Дж., Макман Р. Л., Скаглиони-Вайнлих С., Харрисон Л., Фаррелл Е. и др. Оральная активность GS-5806 в исследовании заражения респираторно-синцитиальным вирусом. N Engl J Med. (2014) 371: 711–22. DOI: 10.1056 / NEJMoa1401184
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Detalle L, Stohr T, Palomo C, Piedra PA, Gilbert BE, Mas V, et al. Создание и характеристика ALX-0171, нового мощного терапевтического нанотела для лечения респираторно-синцитиальной вирусной инфекции. Противомикробные агенты Chemother . (2016) 60: 6–13. DOI: 10.1128 / AAC.01802-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Дуглас Дж. Л., Панис М. Л., Хо Э, Лин К. Ю., Кравчик Ш., Грант Д. М. и др. Небольшие молекулы VP-14637 и JNJ-2408068 ингибируют слияние респираторно-синцитиального вируса с помощью аналогичных механизмов. Противомикробные агенты Chemother . (2005) 49: 2460–6. DOI: 10.1128 / AAC.49.6.2460-2466.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139.Ким И.И., Пэрик Р., Мерфи Р., Харрисон Л., Фаррелл Е., Кук Р. и др. Противовирусные эффекты ингибитора слияния RSV, MDT-637, на клинические изоляты, по сравнению с его достижимыми концентрациями в дыхательных путях человека и в сравнении с рибавирином. Другие респирные вирусы гриппа (2017) 11: 525–30. DOI: 10.1111 / irv.12503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Де Винченцо Дж. П., МакКлюр М. В., Саймонс Дж. А., Фати Х., Вестленд С., Чанда С. и др. Активность перорального ALS-008176 в исследовании заражения респираторно-синцитиальным вирусом. N Engl J Med. (2015) 373: 2048–58. DOI: 10.1056 / NEJMoa1413275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
141. Замора М.Р., Будев М., Рольф М., Готтлиб Дж., Хумар А., Девинченцо Дж. И др. РНК-интерференционная терапия у пациентов с трансплантатом легких, инфицированных респираторно-синцитиальным вирусом. Am J Respir Crit Care Med . (2011) 183: 531–8. DOI: 10.1164 / rccm.201003-0422OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143.Фланнери Б., Рейнольдс С.Б., Блэнтон Л., Сантибанес Т.А., О’Халлоран А., Лу П.Дж. и др. Эффективность вакцины против гриппа против детской смертности: 2010-2014 гг. Педиатрия (2017) 139: 977–981. DOI: 10.1542 / педс.2016-4244
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144. Малош Р.Э., Мартин Е.Т., Хейккинен Т., Брукс В.А., Уитли Р.Дж., Монто А.С. Эффективность и безопасность осельтамивира у детей: систематический обзор и метаанализ индивидуальных данных пациентов рандомизированных контролируемых исследований. Клиническая инфекция . (2018) 66: 1492–500. DOI: 10.1093 / cid / cix1040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Уитли Р.Дж., Хайден Ф.Г., Райзингер К.С., Янг Н., Дутковски Р., Ипе Д. и др. Пероральное лечение гриппа осельтамивиром у детей. Pediatr Infect Dis J. (2001) 20: 127–33.
PubMed Аннотация | Google Scholar
146. Pickering LKBC, Kimberlin DW, Long SS. Грипп. Красная книга: Отчет Комитета по инфекционным заболеваниям, Американская академия педиатрии, 2012 г., (2012), стр.439–53.
148. Herzog C, Hartmann K, Kunzi V, Kursteiner O, Mischler R, Lazar H, et al. Одиннадцать лет вакцины против гриппа Inflexal V-a с виросомным адъювантом. Vaccine (2009) 27: 4381–7. DOI: 10.1016 / j.vaccine.2009.05.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Фурута Й., Такахаши К., Фукуда Й., Куно М., Камияма Т., Козаки К. и др. In vitro и in vivo активности соединения вируса гриппа Т-705. Противомикробные агенты Chemother . (2002) 46: 977–81. DOI: 10.1128 / AAC.46.4.977-981.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
152. Zheng BJ, Chan KW, Lin YP, Zhao GY, Chan C, Zhang HJ, et al. Отсроченное лечение противовирусными препаратами и иммуномодуляторами по-прежнему снижает смертность мышей, инфицированных большим количеством инокулята вируса гриппа A / H5N1. Proc Natl Acad Sci USA. (2008) 105: 8091–6. DOI: 10.1073 / pnas.0711942105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
153.Нг ХХ, Нарасараджу Т, Фун MC, Сим МК, Сит Дж. Э., Чоу ВТ. Лечение доксициклином ослабляет острое повреждение легких у мышей, инфицированных вирулентным вирусом гриппа h4N2: вовлечение матриксных металлопротеиназ. Опыт Мол Патол . (2012) 92: 287–95. DOI: 10.1016 / j.yexmp.2012.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
154. Quispe-Laime AM, Bracco JD, Barberio PA, Campagne CG, Rolfo VE, Umberger R, et al. Острое повреждение легких, связанное с вирусом гриппа h2N1: ответ на комбинацию осельтамивира и длительное лечение кортикостероидами. Мед. Интенсивной терапии . (2010) 36: 33–41. DOI: 10.1007 / s00134-009-1727-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
155. Сато К., Шуга М., Акаике Т., Фудзи С., Муранака Н., Дои Т. и др. Терапевтический эффект эритромицина на повреждение легких, вызванное вирусом гриппа, у мышей. Am J Respir Crit Care Med . (1998) 157 (3 Pt 1): 853–7. DOI: 10.1164 / ajrccm.157.3.9703098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
156.Ямая М., Шинья К., Хатачи Й., Кубо Х., Асада М., Ясуда Х. и др. Кларитромицин подавляет инфекцию вируса сезонного гриппа типа А в эпителиальных клетках дыхательных путей человека. Дж. Pharmacol Exp Ther . (2010) 333: 81–90. DOI: 10.1124 / jpet.109.162149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
157. Бадд А., Аллева Л., Альшарифи М., Коскинен А., Смайт В., Мулбахер А. и др. Повышение выживаемости после лечения гемфиброзилом тяжелого гриппа мышей. Противомикробные агенты Chemother .(2007) 51: 2965–8. DOI: 10.1128 / AAC.00219-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
158. Уолш К.Б., Тейджаро-младший, Розен Х., Олдстон МБ. Преодоление шторма: использование передачи сигналов рецептора сфингозин-1-фосфата для ослабления цитокинового шторма, вызванного вирусом гриппа. Immunol Res. (2011) 51: 15–25. DOI: 10.1007 / s12026-011-8240-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
159. Абзуг М.Дж., Майклс М.Г., Уолд Э., Джейкобс Р.Ф., Ромеро Д.Р., Санчес П.Дж. и др.Рандомизированное двойное слепое плацебо-контролируемое исследование плеконарила для лечения новорожденных с энтеровирусным сепсисом. J Pediatric Infect Dis Soc . (2016) 5: 53–62. DOI: 10.1093 / jpids / piv015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
160. Пивер, округ Колумбия, Хайден Ф.Г., Деменчук Т.М., Бароне Л.Р., Маккинли М.А., Коллетт М.С. Взаимосвязь восприимчивости к плеконарилу и клинических исходов при лечении простудных заболеваний, вызванных риновирусами. Противомикробные агенты Chemother .(2005) 49: 4492–9. DOI: 10.1128 / AAC.49.11.4492-4499.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
161. Abzug MJ, Keyserling HL, Lee ML, Levin MJ, Rotbart HA. Энтеровирусная инфекция новорожденных: вирусология, серология и эффекты внутривенного иммуноглобулина. Клиническая инфекция . (1995) 20: 1201–6.
PubMed Аннотация | Google Scholar
162. Уитли Р.Дж., Кори Л., Арвин А., Лейкман Ф.Д., Сумая К.В., Райт П.Ф. и др. Изменение представления инфекции вируса простого герпеса у новорожденных. J Заразить Dis . (1988) 158: 109–16.
PubMed Аннотация | Google Scholar
163. Нахмиас А., Джоси В.Е., Наиб З.М., Фриман М.Г., Фернандес Р.Дж., Уилер Дж. Х. Перинатальный риск, связанный с инфекцией, вызванной вирусом простого герпеса у матери. Am J Obstetr Gynecol. (1971) 110: 825–37. DOI: 10.1016 / 0002-9378 (71)
-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
164. Стэнберри Л. Р., Спруанс С. Л., Каннингем А. Л., Бернштейн Д. И., Миндел А., Сакс С. и др.Гликопротеин-D-адъювантная вакцина для профилактики генитального герпеса. N Engl J Med. (2002) 347: 1652–61. DOI: 10.1056 / NEJMoa011915
PubMed Аннотация | CrossRef Полный текст | Google Scholar
165. Braig S, Luton D, Sibony O, Edlinger C, Boissinot C, Blot P, et al. Профилактика ацикловиром на поздних сроках беременности предотвращает рецидив генитального герпеса и выделение вируса. Eur J Obstet Gynecol Reprod Biol . (2001) 96: 55–8. DOI: 10.1016 / S0301-2115 (00) 00406-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
166.Скотт Л.Л., Санчес П.Дж., Джексон Г.Л., Зерай Ф., Вендель Г.Д., младший. Подавление ацикловира для предотвращения кесарева сечения после первого эпизода генитального герпеса. Акушерский гинекол . (1996) 87: 69–73.
PubMed Аннотация | Google Scholar
167. Пикеринг LKBC, Kimberlin DW, Long SS (редакторы). Простой герпес. В: Красная книга: Отчет Комитета по инфекционным болезням. 25-е изд . Деревня Элк-Гроув, Иллинойс: Американская академия педиатрии (2000).
168. Гибб Д.М., Дуонг Т., Туки П.А., Шарланд М., Тюдор-Уильямс Дж., Новелли В. и др.Снижение смертности, СПИДа и количества госпитализаций у перинатально инфицированных ВИЧ-1 детей в Соединенном Королевстве и Ирландии. BMJ (2003) 327: 1019. DOI: 10.1136 / bmj.327.7422.1019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
169. Санчес Дж.М., Амадор Дж.Т.Р., Де Мигель С.Ф., Томе МИГ, Конехо П.Р., Вивас П.Ф. и др. Влияние высокоактивной антиретровирусной терапии на заболеваемость и смертность испанских детей, инфицированных вирусом иммунодефицита человека. Детская инфекционная болезнь J. (2003) 22: 863–8. DOI: 10.1097 / 01.inf.00000
.70253.5f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
170. де Мартино М., Тово П.А., Бальдуччи М., Галли Л., Габиано С., Резза Г. и др. Снижение смертности благодаря доступности антиретровирусной терапии для детей с перинатальной инфекцией ВИЧ-1. Итальянский регистр ВИЧ-инфекции у детей и Итальянский национальный регистр СПИДа. JAMA (2000) 284: 190–7.
Google Scholar
171.Gortmaker SL, Hughes M, Cervia J, Brady M, Johnson GM, Seage GR III и др. Влияние комбинированной терапии, включающей ингибиторы протеазы, на смертность детей и подростков, инфицированных ВИЧ-1. N Engl J Med. (2001) 345: 1522–8. DOI: 10.1056 / NEJMoa011157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
172. Hon KL, Luk MP, Fung WM, Li CY, Yeung HL, Liu PK, et al. Смертность, продолжительность пребывания, кровоток и респираторные вирусные инфекции в педиатрическом отделении интенсивной терапии. J Crit Care (2017) 38: 57–61. DOI: 10.1016 / j.jcrc.2016.09.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
173. Ши Т., Макаллистер Д.А., О’Брайен К.Л., Симоэс ЭАФ, Мадхи С.А., Гесснер Б.Д. и др. Глобальные, региональные и национальные оценки бремени острых респираторных инфекций нижних дыхательных путей, вызванных респираторно-синцитиальным вирусом, у детей младшего возраста в 2015 г .: систематический обзор и исследование на основе моделирования. Ланцет (2017) 390: 946–58. DOI: 10.1016 / S0140-6736 (17) 30938-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
174.Byington CL, Wilkes J, Korgenski K, Sheng X. Смертность, связанная с респираторно-синцитиальным вирусом, у госпитализированных младенцев и детей младшего возраста. Педиатрия (2015) 135: e24–31. DOI: 10.1542 / peds.2014-2151
PubMed Аннотация | CrossRef Полный текст | Google Scholar
175. Давуд Ф. С., Юлиано А. Д., Рид С., Мельцер М. И., Шей Д. К., Ченг П. Я. и др. Расчетная глобальная смертность, связанная с первыми 12 месяцами пандемического гриппа 2009 г. Циркуляция вируса h2N1: модельное исследование. Ланцет Infect Dis . (2012) 12: 687–95. DOI: 10.1016 / S1473-3099 (12) 70121-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
176. Кумар А., Зарычанский Р., Пинто Р., Кук Д. Д., Маршалл Дж., Лакруа Дж. И др. Критически больные пациенты с инфекцией гриппа A (h2N1) 2009 г. в Канаде. JAMA (2009) 302: 1872–9. DOI: 10.1001 / jama.2009.1496
PubMed Аннотация | CrossRef Полный текст | Google Scholar
177. Домингес-Черит Г., Лапинский С.Е., Масиас А.Е., Пинто Р., Эспиноза-Перес Л., де ла Торре А. и др.Критические пациенты с гриппом A (h2N1) 2009 г. в Мексике. JAMA (2009) 302: 1880–7. DOI: 10.1001 / jama.2009.1536
PubMed Аннотация | CrossRef Полный текст | Google Scholar
178. Продавцы С.А., Хаган Р.С., Хайден Ф.Г., Фишер В.А. II. Скрытое бремя гриппа: обзор внелегочных осложнений гриппозной инфекции. Другие респирные вирусы гриппа (2017) 11: 372–93. DOI: 10.1111 / irv.12470
PubMed Аннотация | CrossRef Полный текст | Google Scholar
179.Хатами А., Макмаллан Б.Дж., Уэббер М., Стюарт П., Фрэнсис С., Тиммерс К.Дж. и др. Сепсисоподобное заболевание у младенцев, вызванное пареховирусом человека 3 типа во время вспышки в Австралии. Клиническая инфекция . (2015) 60: 228–36. DOI: 10.1093 / cid / ciu784
PubMed Аннотация | CrossRef Полный текст | Google Scholar
180. Verboon-Maciolek MA, Groenendaal F, Hahn CD, Hellmann J, van Loon AM, Boivin G, et al. Пареховирус человека вызывает энцефалит с повреждением белого вещества у новорожденных. Энн Нейрол .(2008) 64: 266–73. DOI: 10.1002 / ana.21445
PubMed Аннотация | CrossRef Полный текст | Google Scholar
181. Абзуг MJ. Прогноз для новорожденных с энтеровирусным гепатитом и коагулопатией. Pediatr Infect Dis J . (2001) 20: 758–63.
PubMed Аннотация | Google Scholar
182. Фройнд М.В., Кляйнвельд Г., Кредиет Т.Г., ван Лун А.М., Вербун-Масиолек М.А. Прогноз для новорожденных с энтеровирусным миокардитом. Arch Dis Child Fetal Neonatal Ed. (2010) 95: F206–12.DOI: 10.1136 / adc.2009.165183
PubMed Аннотация | CrossRef Полный текст | Google Scholar
184. Spaeder MC, Custer JW, Bembea MM, Aganga DO, Song X, Scafidi S. Многоцентровый анализ исходов у детей с тяжелой вирусной респираторной инфекцией, вызванной метапневмовирусом человека. Pediatr Crit Care Med . (2013) 14: 268–72. DOI: 10.1097 / PCC.0b013e3182720fc7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
185. Spaeder MC, Fackler JC. Внутрибольничная вирусная инфекция увеличивает смертность детей с тяжелой респираторной вирусной инфекцией. Pediatr Crit Care Med . (2011) 12: e317–21. DOI: 10.1097 / PCC.0b013e3182230f6e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
186. Сугата К., Танигучи К., Юи А., Мияке Ф., Суга С., Асано И. и др. Анализ ротавирусной антигенемии и внекишечных проявлений у детей с ротавирусным гастроэнтеритом. Педиатрия (2008) 122: 392–7. DOI: 10.1542 / педс.2007-2290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
187.Дики М., Джеймисон Л., Мишо Л., Кэр М., Бернштейн Д. И., Государственный штат Массачусетс. Ротавирусный менингоэнцефалит у ранее здорового ребенка и обзор литературы. Pediatr Infect Dis J . (2009) 28: 318–21. DOI: 10.1097 / INF.0b013e31818ddbe9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
188. Taha TE, Graham SM, Kumwenda NI, Broadhead RL, Hoover DR, Markakis D, et al. Заболеваемость среди африканских детей, инфицированных вирусом иммунодефицита человека-1 и не инфицированных. Педиатрия (2000) 106: E77.DOI: 10.1097 / INF.0b013e31822cca05
PubMed Аннотация | CrossRef Полный текст | Google Scholar
189. Центры по контролю и профилактике заболеваний. 1994 г. Пересмотренная система классификации инфицирования вирусом иммунодефицита человека у детей младше 13 лет; Официальные разрешенные дополнения: коды инфекций, вызываемых вирусом иммунодефицита человека, и официальные инструкции по кодированию и отчетности ICD-9-CM. Болезненный. Смертный. Неделя. Rep. (1994) 43: 1–10.
Google Scholar
190.Zanone SM, Krause LK, Madhi SA, Bassat Q, Jha P, Simoes EA и др. Проблемы при оценке уровня смертности, связанной с RSV. Ланцет Респир Мед. (2016) 4: 345–7. DOI: 10.1016 / S2213-2600 (16) 30042-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
191. Leclerc F, Leteurtre S, Duhamel A, Grandbastien B, Proulx F, Martinot A, et al. Кумулятивное влияние органных дисфункций и септического состояния на смертность детей в критическом состоянии. Am J Respir Crit Care Med. (2005) 171: 348–53. DOI: 10.1164 / rccm.200405-630OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
192. Jaramillo-Bustamante JC, Marin-Agudelo A, Fernandez-Laverde M, Bareno-Silva J. Эпидемиология сепсиса в педиатрических отделениях интенсивной терапии: первое многоцентровое исследование в Колумбии. Pediatr Crit Care Med. (2012) 13: 501–8. DOI: 10.1097 / PCC.0b013e31823c980f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pleconaril — обзор | Темы ScienceDirect
Специфическая терапия
Специфическая терапия энтеровирусной инфекции не одобрена для использования в США.При тяжелой, катастрофической и генерализованной неонатальной инфекции вполне вероятно, что ребенок не получил от матери специфических антител к конкретному вирусу. В этой ситуации, вероятно, целесообразно ввести младенцу иммунный сывороточный глобулин человека. Даган и соавторы [534] исследовали три партии глобулина сыворотки человека и обнаружили наличие нейтрализующих антител к нескольким обычно циркулирующим и редко циркулирующим энтеровирусам. Хотя нет никаких доказательств того, что эта терапия эффективна при лечении острых неонатальных инфекций, есть доказательства некоторого успеха в лечении хронических энтеровирусных инфекций у пациентов с агаммаглобулинемией [535].Поскольку Хаммонд с соавторами [536] обнаружил, что однократная доза внутримышечного иммуноглобулина приводила к небольшому изменению циркулирующих нейтрализующих антител к вирусу Коксаки B4 и эховирусу 11 у семи младенцев, при принятии решения о терапии рекомендуется использовать внутривенное введение высоких доз. иммуноглобулин. Один новорожденный с диссеминированной инфекцией эховируса 11 с гепатитом, пневмонитом, менингитом, диссеминированным внутрисосудистым свертыванием, сниженной функцией почек и анемией выжил после получения большой дозы внутривенного иммуноглобулина и поддерживающей терапии [537].
Abzug и его коллеги [538] провели небольшое контролируемое исследование, в котором девять инфицированных энтеровирусом новорожденных получали внутривенный иммуноглобулин, а семь младенцев с аналогичной инфекцией получали поддерживающую терапию. В этом исследовании не было существенной разницы в клинических показателях, значениях антител или величине виремии и вирурии у младенцев, получавших лечение, по сравнению с младенцами контрольной группы. Однако пятерым младенцам внутривенно вводили иммуноглобулин с высоким титром нейтрализующих антител (≥1: 800) к их отдельным вирусным изолятам, и у них было более быстрое прекращение виремии и вируса.
Jantausch et al. [539] сообщили о ребенке с диссеминированной инфекцией эховируса 11, который выжил после переливания материнской плазмы. Роль этих переливаний в выздоровлении ребенка неизвестна, и эта форма терапии не может быть рекомендована. Новорожденный с молниеносным гепатитом, вызванным инфекцией эховируса 11, выжил после ортотопической трансплантации печени [540].
Многие антипикорнавирусные препараты и биологические препараты были изучены в течение последних 30 лет [68,69].Противовирусный препарат плеконарил многообещающий для лечения энтеровирусных инфекций. * Этот препарат представляет собой новое соединение, которое интегрируется в капсид энтеровирусов. Он предотвращает прикрепление вируса к клеточным рецепторам и предотвращает снятие оболочки и последующее высвобождение вирусной РНК в клетку-хозяин. В двойном слепом плацебо-контролируемом исследовании 39 пациентов с энтеровирусным менингитом было отмечено статистически значимое сокращение продолжительности заболевания с 9,5 дней в контроле до 4 дней у реципиентов препарата [68].Плеконарил также использовался для лечения пациентов с опасной для жизни инфекцией [542]. Лечились несколько категорий энтеровирусных заболеваний: хронический менингоэнцефалит у пациентов с агаммаглобулинемией или гипогаммаглобулинемией, неонатальный сепсис, миокардит, полиомиелит (дикого типа или связанный с вакциной), энцефалит и пациенты с трансплантацией костного мозга. Благоприятные клинические ответы наблюдались у 22 из 36 пролеченных пациентов, в том числе у 12 из 18 пациентов с хроническим менингоэнцефалитом.В отсутствие контроля степень, в которой благоприятные исходы могут быть связаны с приемом плеконарила, неизвестна. В настоящее время плеконарил недоступен в США.
При тяжелых заболеваниях, таких как миокардит новорожденных или энцефалит, часто возникает соблазн назначить кортикостероиды. Хотя некоторые исследователи считали этот подход полезным при лечении миокардита, вызванного вирусом Коксаки, мы считаем, что кортикостероиды не следует назначать во время острых энтеровирусных инфекций.Вредные эффекты этих агентов при инфекциях вируса Коксаки мышей [543] особенно убедительны. Иммуносупрессивная терапия миокардита неизвестного происхождения с использованием преднизона и циклоспорина или азатиоприна была оценена в контролируемом исследовании 111 взрослых, при этом положительного эффекта не наблюдалось [544].
Поскольку в большинстве случаев неонатальных энтеровирусных инфекций нельзя исключить возможность бактериального сепсиса, антибиотики следует назначать против наиболее вероятных потенциальных патогенов.Настоятельно рекомендуется осторожность при выборе и применении антибиотиков, чтобы токсичность лекарства не усугубляла проблемы пациента. У новорожденных с менингитом или менингоэнцефалитом, а также у некоторых младенцев с сепсисоподобными заболеваниями следует тщательно рассмотреть возможность инфекций, вызванных вирусом простого герпеса, и после проведения соответствующих исследований на герпесвирус следует назначить эмпирическое лечение ацикловиром внутривенно.
Лечение неонатальных энтеровирусных инфекций | Журнал Общества детских инфекционных болезней
(См. Оригинальную статью Абзуга и др. На страницах 53–62.)
Новорожденный человек уникально восприимчив к серьезным, часто смертельным энтеровирусным инфекциям в первые 2 недели жизни, которые связаны с острым материнским заболеванием, преждевременными родами, мужским полом и отсутствием материнских антител против инфекционного серотипа энтеровируса. Хотя термин «сепсис» иногда используется для описания неонатального энтеровирусного заболевания, патология вскрытия подтверждает, что тяжелый миокардит и / или гепатит, часто сопровождающийся энцефалитом, адекватно объясняют спектр энтеровирусного заболевания у новорожденных.Реже младенцы могут заболеть пневмонитом, который также может быть смертельным [1]. Эти инфекции возникают спорадически и кластерами с появлением вновь развивающихся серотипов энтеровирусов [2, 3]. Общее воздействие на население недостаточно изучено, поскольку неполиомиелитные энтеровирусные инфекции, как правило, не подлежат регистрации.
Не существует одобренного лечения энтеровирусных инфекций. Внутривенный иммуноглобулин (ВВИГ) часто вводят инфицированным новорожденным, но без удовлетворительных доказательств его эффективности [4–6].Плеконарил был разработан в 1990-х годах как связывающий капсид противовирусный агент, который предотвращает снятие оболочки всех чувствительных энтеровирусов с вирионов после проникновения в клетки, а также ингибирует прикрепление к клеткам для подгруппы энтеровирусов. Препарат проявляет сильную активность in vitro против многих серотипов энтеровирусов и риновирусов человека и благоприятный фармакокинетический профиль при пероральном введении [7, 8]. В клинических испытаниях с участием подростков и взрослых с энтеровирусным менингитом плеконарил вызвал несколько серьезных побочных эффектов и уменьшил продолжительность головной боли при введении в течение 2 дней с момента появления [9].Неконтролируемое исследование пациентов, получавших плеконарил в рамках программы лечения, включая 6 новорожденных, показало эффективность против серьезных энтеровирусных инфекций [10]. Однако разработчик решил получить разрешение на маркетинг для лечения заболеваний верхних дыхательных путей, основываясь на снижении симптомов риновирусной и энтеровирусной простуды у взрослых на 1 день [11]. По рекомендации Консультативного комитета по вакцинам и родственным биологическим продуктам заявка была отклонена U.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в 2002 году из-за умеренной эффективности по этому показанию и из-за внезапных менструальных кровотечений у некоторых женщин, принимавших оральные контрацептивы, которые принимали плеконарил в течение 6 недель для профилактики инфекций верхних дыхательных путей.
В 1999 г., до решения FDA, группа совместных антивирусных исследований NIH (CASG) инициировала плацебо-контролируемое испытание перорального плеконарила для лечения тяжелой энтеровирусной инфекции у новорожденных. Результаты этого исследования сообщают Abzug et al.в этом номере журнала [12]. Исследование столкнулось с препятствиями с самого начала из-за нечастого возникновения заболевания у новорожденных и трудностей с получением согласия родителей на плацебо-контролируемое исследование потенциально смертельного инфекционного заболевания. Чтобы стимулировать регистрацию, в 2000 году протокол был изменен, чтобы разрешить одновременное использование ВВИГ. В конце концов, исследование было прекращено через 11 лет, когда закончился доступный запас лекарств и почти не было достигнуто целевое количество 45 лабораторно подтвержденных случаев энтеровирусной инфекции.Первичная конечная точка не могла быть оценена, потому что вирусные культуры ротоглотки были отрицательными для всех включенных младенцев после 5 дней лечения, в среднем через 10 дней после начала заболевания [12]. Этот результат не должен вызывать удивления, потому что, хотя данные о новорожденных отсутствуют, энтеровирусы могут быть изолированы из ротоглотки только у части младенцев старшего возраста и детей с первичной инфекцией, а затем на короткие периоды времени, как правило, исчезают с развитием сывороточных нейтрализующих антител. [13–15].Тем не менее, исследование предоставило существенные доказательства эффективности плеконарила, поскольку среднее время получения отрицательного посева вируса из всех участков составляло 4 дня в группе плеконарила по сравнению с 7 днями в группе плацебо, разница, которая не только приближалась к статистической значимости, но и составляет клинически значимо и согласуется с наблюдаемым улучшением выживаемости [12].
Исследователи заслуживают похвалы за то, что привели это сложное исследование к успешному завершению. Эти данные подтверждают потенциал плеконарила в улучшении исходов у новорожденных с серьезными энтеровирусными инфекциями и повышают вероятность дальнейшего улучшения выживаемости при более раннем лечении.К сожалению, у врачей остается мало вариантов. С момента начала исследования CASG права на разработку плеконарила принадлежали нескольким компаниям, но препарат в настоящее время недоступен (Марк МакКинли, личное сообщение). Другие препараты, предназначенные для лечения энтеровирусных инфекций, проходят клиническую разработку, включая покапавир (V-073, ранее SCH 48973), еще один пероральный ингибитор капсида с немного ограниченным спектром активности энтеровируса по сравнению с плеконарилом [16].Покапавир, который разрабатывается для лечения хронической энтеровирусной инфекции у пациентов с ослабленным иммунитетом, значительно сократил продолжительность выведения полиовируса пероральной вакциной в недавнем рандомизированном исследовании на здоровых взрослых шведах [17]. Однако на данный момент у разработчика нет программы лечения IND.
Результаты исследования CASG служат важным руководством для будущих антивирусных исследований у новорожденных [12]. Они указывают на то, что клинический результат, такой как смертность, как основной результат, будет легче измерить и, несомненно, более важен, чем лабораторный маркер.К этому моменту, хотя ПЦР-анализ явно более чувствителен, чем вирусная культура в идентификации новорожденных, инфицированных энтеровирусом, вирусная культура может быть лучше в оценке ответа на лечение из-за длительного сохранения вирусной РНК в нескольких местах как у леченных, так и у нелеченных пациентов. Будущим исследователям также необходимо будет решить вопрос об одновременном введении ВВИГ, которое может искажать результаты и уменьшать возможность наблюдать положительный эффект исследуемого противовирусного агента.Кроме того, после публикации этих результатов спонсоры, исследователи и институциональные наблюдательные советы столкнутся с неприятным вопросом о том, является ли плацебо-контролируемое испытание нового противовирусного агента этически оправданным, независимо от того, доступен ли для сравнения плеконарил или нет.
Таким образом, исследование CASG предоставило клинически значимые доказательства эффективности плеконарила, несмотря на трудности, с которыми пришлось столкнуться при изучении этой популяции пациентов в течение более чем десятилетия. Опыт исследователей CASG подчеркивает трудности в обеспечении доступности эффективного лекарства для относительно небольшого числа младенцев с серьезной, но потенциально поддающейся лечению вирусной инфекцией.Мы можем надеяться, что данные этого исследования когда-нибудь приведут к регистрации орфанного препарата плеконарила или другого эффективного противовирусного агента для столь необходимого лечения этих разрушительных вирусных инфекций у новорожденных.
Список литературы
1
Сыщик
SH
,
Hirsch
MS
,
Келлер
EW
,
Кейм
DE
.
Неонатальная пневмония со смертельным исходом, вызванная эховирусом типа 9 [буква]
.
Am J Dis Child
1977
;
131
:
1169
.
2
Модлин
JF
.
Перинатальная эховирусная инфекция: информация из литературы о 61 случае серьезной инфекции и 16 вспышках в яслях
.
Rev. Заразить Dis
1986
;
8
:
918
—
26
.
3
Каплан
MH
,
Кляйн
SW
,
Макфи
Дж
,
Харпер
RG
.
Инфекции, вызванные вирусом Коксаки группы B, у детей младше трех месяцев: серьезное детское заболевание
.
Rev. Заразить Dis
1983
;
5
:
1019
—
32
.
4
Абзуг
МДж
,
Кейсерлинг
HL
,
Ли
ML
,
Левин
МДж
,
Ротбарт
HA
.
Энтеровирусная инфекция новорожденных: вирусология, серология и эффекты внутривенного иммуноглобулина
.
Clin Infect Dis
1995
;
20
:
1201
—
6
.
5
Bae
EY
,
Ли
EJ
,
Хан
SB
,
Ли
иен
,
Чжон
постоянного тока
,
Кан
JH
.
Случай миокардита после неонатального менингита, вызванного вирусом Коксаки B1, несмотря на внутривенное лечение иммуноглобулином
.
J Trop Pediatr
2014
;
60
:
164
—
7
.
6
Линь
TY
,
Као
HT
,
Ше
SH
и другие.
.
Неонатальные энтеровирусные инфекции: акцент на факторах риска тяжелых и смертельных инфекций
.
Pediatr Infect Dis J
2003
;
22
:
889
—
94
.
7
Кирнс
GL
,
Брэдли
JS
,
Джейкобс
РФ
и другие.
.
Фармакокинетика однократной дозы плеконарила у новорожденных
.
Pediatr Infect Dis J
2000
;
19
:
833
—
9
.
8
Певеар
постоянного тока
,
Талл
TM
,
Зайпель
ME
,
Groarke
JM
.
Активность плеконарила в отношении энтеровирусов
.
Противомикробные агенты Chemother
1999
;
43
:
2109
—
15
.
9
Десмонд
RA
,
Accortt
NA
,
Талли
л
,
Виллано
SA
,
Сунг
SJ
,
Уитли
RJ
.
Энтеровирусный менингит: естественное течение и исход терапии плеконарилом
.
Противомикробные агенты Chemother
2006
;
50
:
2409
—
14
.
.
10
Ротбарт
HA
,
Вебстер
АБР
.
Лечение потенциально опасных для жизни энтеровирусных инфекций плеконарилом
.
Clin Infect Dis
2001
;
32
:
228
—
35
.
11
Хайден
FG
,
Херрингтон
ДТ
,
Пальто
TL
и другие.
.
Эффективность и безопасность перорального плеконарила для лечения простуды, вызванной пикорнавирусами, у взрослых: результаты 2 двойных слепых рандомизированных плацебо-контролируемых исследований
.
Clin Infect Dis
2003
;
36
:
1523
—
32
.
12
Абзуг
МДж
,
Майклс
м
,
Вальд
E
и другие.
.
Рандомизированное двойное слепое плацебо-контролируемое исследование плеконарила для лечения новорожденных с энтеровирусным сепсисом
.
J Pediatr Infect Dis Soc
2016
;
5
:
53
—
62
.
13
Верле
ПФ
,
Райхерт
R
,
Карбонаро
O
,
Портной
В
.
Влияние предшествующей активной иммунизации на наличие вируса полиомиелита в глотке и стуле семейных контактов пациентов с паралитическим полиомиелитом
.
Педиатрия
1958
;
21
:
353
—
61
.
14
Когон
А
,
Спигланд
Я
,
Frothingham
TE
и другие.
.
Программа Virus Watch: постоянный надзор за вирусными инфекциями в семьях столичного Нью-Йорка
.
Am J Epidemiol
1969
;
89
:
51
—
61
.
15
Абзуг
МДж
,
Облако
G
,
Брэдли
Дж
и другие.
.
Двойное слепое плацебо-контролируемое испытание плеконарила у младенцев с энтеровирусным менингитом
.
Pediatr Infect Dis J
2003
;
22
:
335
—
40
.
16
Buontempo
PJ
,
Кокс
S
,
Райт-Миноуг
Дж
и другие.
.
SCH 48973: сильнодействующее антиэнтеровирусное соединение широкого спектра действия
.
Противомикробные агенты Chemother
1997
;
41
:
1220
—
5
.
17
Коллетт
MS
,
Hincks
JR
,
Oberste
MS
,
Ван Эр Аворт
HGM
, ред.
Антиполиовирусная активность покапавира в модели заражения mOPV1 человека
.
,
2013
.
© Автор, 2015 г. Опубликовано издательством Oxford University Press от имени Общества педиатрических инфекционных болезней. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
детей | Бесплатный полнотекстовый | Обновленная информация о вирусных инфекциях, поражающих центральную нервную систему, у педиатрических пациентов
1.Введение
Инфекции центральной нервной системы (ЦНС) в основном вызываются вирусами, и эти инфекции могут быть опасными для жизни педиатрических пациентов [1,2,3]. Уровень заболеваемости вирусными инфекциями ЦНС колеблется от 10 до 20 случаев на 100 000 детей в год в странах с высоким уровнем доходов [4,5]. Фактическая заболеваемость педиатрическим населением во многих странах с низкими доходами до сих пор не ясна, а региональные отчеты часто зависят от повторяющихся вспышек. На глобальную эпидемиологию вирусных инфекций ЦНС повлияли распространение более эффективных методов диагностики, внедрение программ вакцинации и появление новых патогенов.В большом обсервационном исследовании, проведенном в Великобритании более 50 лет, средний уровень госпитализации по поводу вирусного менингита составил 13,5 на 100 000 детей в год [6]. Авторы наблюдали значительное снижение заболеваемости в конце 1980-х годов среди детей в возрасте от 1 до 14 лет, вероятно, из-за введения иммунизации против эпидемического паротита, который был основной причиной инфекции ЦНС. Однако сообщалось о росте числа госпитализаций с 2003 г., что совпало с увеличением использования ПЦР в пробах спинномозговой жидкости.В странах Восточной Азии аналогичные тенденции были зарегистрированы после программ иммунизации против вируса японского энцефалита (JEV), который был ведущей региональной причиной острого энцефалита у детей [7,8]. Можно выделить два пика заболеваемости: первый пик у младенцев в возрасте до 1 года и второй пик у детей примерно пяти лет [9,10]. Большинство случаев возникает летом и осенью, поскольку энтеровирусы и арбовирусы проявляют большую активность в эти периоды. Вирусные инфекции ЦНС часто поражают иммунокомпетентных детей; фактически, в своем большом исследовании Hasburn et al.наблюдали, что у 91,4% детей с вирусным менингитом или энцефалитом не было зарегистрировано основных заболеваний [5]. Хотя прогноз часто благоприятный, смертность и долгосрочные последствия из-за вирусного менингита и энцефалита могут возникнуть [3]. Более того, эти состояния ложатся тяжелым бременем на системы общественного здравоохранения: средняя стоимость госпитализации составляет 60 000 долларов на пациента [11]. Однако вирусный менингит и энцефалит представляют собой диагностическую проблему, и конкретные варианты лечения все еще отсутствуют.Цели этого повествовательного обзора состояли в том, чтобы описать специфические микробиологические и клинические особенности наиболее частых патогенов и предоставить обновленную информацию о диагностических подходах и стратегиях лечения вирусных инфекций ЦНС у детей.
Мы провели обзор новейшей литературы, изучив базу данных Medline (онлайн-система анализа и поиска медицинской литературы) с помощью поисковых систем PubMed и Google Scholar. Использованы ключевые слова: «вирусный / асептический менингит», «вирусный / асептический энцефалит», «p (a) ediatric» и «дети».Мы включили клинические испытания, обсервационные исследования, обзоры и мета-анализы острых вирусных инфекций, поражающих ЦНС. Критериями исключения были пациенты старше 18 лет, невирусные инфекции, серия случаев с менее чем 20 пациентами и статьи, опубликованные не на английском языке.
3. Диагноз
Почти во всех случаях клинические признаки не могут отличить вирусную инфекцию ЦНС от бактериальной, и часто профили ЦСЖ бактериальных и вирусных инфекций совпадают. По этой причине, до получения результатов посевов спинномозговой жидкости и вирусологических исследований, эмпирическое лечение должно охватывать наиболее распространенные и вероятные патогены [57].Точный анамнез и физическое обследование могут дать подсказки для диагностического подхода. Классические симптомы и признаки менингеального воспаления (например, лихорадка, ригидность шеи, головная боль, светобоязнь, признаки Кернига и Брудзинского), связанные с типичными проявлениями вирусных инфекций (например, сыпь, специфические поражения кожи, герпангина, конъюнктивит, фарингит, рвота, диарея) предполагают вирусную этиологию [57]. Очаговая моторная или сенсорная недостаточность указывает на энцефалит, который часто вызывается вирусами [57]. Кроме того, следует учитывать контакт с больными, клещами, комарами или грызунами, а также сезонные вспышки вирусных инфекций [57].Люмбальную пункцию (ЛП) у педиатрических пациентов следует выполнять как можно скорее при подозрении на инфекцию ЦНС [58]. Показания к нейровизуализации перед LP ограничиваются тяжелым депрессивным психическим состоянием, гидроцефалией в анамнезе, недавней травмой или нейрохирургическим вмешательством с шунтом спинномозговой жидкости, отеком диска зрительного нерва и очаговыми неврологическими нарушениями, кроме паралича VI или VII черепного нерва [57,58]. Однако в этих условиях не следует откладывать посев крови и эмпирические антибиотики перед нейровизуализацией. Состояния, представляющие потенциальные противопоказания для LP, ограничиваются риском церебральной грыжи (т.например, внутричерепные объемные образования с масс-эффектами, аномальным внутричерепным давлением и мальформациями Арнольда-Киари), повышенным риском кровотечения и местными инфекциями в месте прокола [56]. В таблице 1 обобщены лабораторные, микробиологические и визуальные оценки для подозреваемых. Инфекции ЦНС. Дети могут болеть вирусным менингитом, когда люмбальная пункция выявляет количество лейкоцитов в СМЖ: 50% мононуклеарных клеток, белок СМЖ 58]. Однако при подозрении на инфекцию ЦНС всегда следует собирать образцы спинномозговой жидкости и крови и отправлять их на окрашивание по Граму и бактериальный посев.Шкала бактериального менингита (BMS) — это проверенный инструмент для оценки риска бактериального менингита у педиатрических пациентов, который может использоваться при дифференциальной диагностике [59]. BMS включает в себя следующие переменные: положительное окрашивание по Граму ЦСЖ (2 балла), абсолютное количество нейтрофилов в ЦСЖ ≥1000 клеток / мкл (1 балл), белок ЦСЖ ≥80 мг / дл (1 балл), количество нейтрофилов периферической крови ≥ 10 000 клеток / мкл (1 балл) и история приступов до или во время предъявления (1 балл). Оценка 0 указывает на «очень низкий риск» бактериального менингита.В метаанализе восьми валидационных исследований оценка ≥1 предсказывала бактериальный менингит с чувствительностью и специфичностью 99,3% и 62,1% соответственно. Однако наиболее полезной особенностью BMS является ее отрицательная прогностическая ценность 99,6% [60]. В случаях подозрения на вирусную инфекцию ЦНС образцы спинномозговой жидкости следует отправлять на анализ с помощью полимеразной цепной реакции (ПЦР) для обнаружения вирусных нуклеиновых кислот. ПЦР в значительной степени заменила вирусный посев и серологическую диагностику вирусного менингита, повысив точность диагностики.Более того, ПЦР очень чувствительна и специфична, а результаты доступны раньше, чем вирусная культура [61,62,63,64]. Всегда следует проводить ПЦР на ЭВ и ВПГ, а возможность тестирования других патогенов зависит от эпидемиологии и клинических данных. Для улучшения выявления вирусов мазки из стула и зева также могут быть отправлены на ПЦР или посев на вирус [62]. Серологические исследования могут быть получены для менее распространенных вирусов; кроме того, также может быть проверено наличие специфических IgG и IgM для WNV в спинномозговой жидкости [62]. При подозрении на инфекцию ВПГ следует провести посев образцов кожных поражений, если они есть, и ПЦР образцов крови [62].Острый педиатрический нейропсихиатрический синдром (PANS), то есть недавно определенное состояние, основанное на симптомах, которое в основном возникает у детей и подростков, описанное после вирусных инфекций, включая SARS-CoV-2 [65,66]. Это возникающая иммуноопосредованная энцефалопатия, характеризующаяся внезапным появлением, казалось бы, необъяснимых сложных психоневрологических симптомов, включая навязчивые идеи, компульсии и гетерогенные тики [65]. PANS имеет рецидивирующе-ремиттирующее течение симптомов, и необходимы дальнейшие исследования по его диагностике и лечению.
4. Лечение
Педиатрические пациенты с симптомами и признаками инфекций ЦНС всегда нуждаются в госпитализации для получения поддерживающей помощи и специального лечения [57]. Пациентов следует лечить в изолированной комнате с адекватной оксигенацией, вентиляцией и кровообращением, а также предоставлять ацетаминофен от головной боли, боли и лихорадки. Некоторым пациентам, особенно тем, у кого есть ВПГ-1 и ВПГ-2, может потребоваться интенсивная поддерживающая терапия. Внутривенная инфузионная терапия — важный аспект поддерживающей терапии.Краеугольным камнем поддерживающей терапии является баланс между лечением гиповолемии и предотвращением неадекватной секреции синдрома антидиуретического гормона (SIADH) [57]. Это пугающее осложнение возникает при олигурии, уровень натрия в сыворотке 100 мОсм / л. Если возникает такая ситуация, показано ограничение жидкости ( 2 / день). Нет данных о преимуществах кортикостероидов при вирусных инфекциях ЦНС, независимо от их этиологии. При подозрении на вирусную инфекцию ЦНС следует назначать эмпирическую противовирусную терапию ацикловиром до тех пор, пока не будут обнаружены результаты специфической ПЦР на ВПГ в образцах спинномозговой жидкости. быть отрицательным [67,68,69,70,71,72].ВПГ-энцефалит — разрушительная инфекция, которая может иметь незаметные проявления и требует немедленного лечения [73]. У новорожденных ВПГ также следует исключать с помощью посева на коже при появлении кожных повреждений или ПЦР крови до прекращения эмпирического ацикловира [74,75]. В связи с этим сценарием использование эмпирического ацикловира в последние десятилетия увеличилось, что вызывает озабоченность по поводу его применения. целесообразность, учитывая, что эмпирический курс противовирусной терапии, особенно старше неонатального возраста, может быть связан с побочными эффектами и может продлить госпитализацию [74,76].С другой стороны, заболеваемость энцефалитом, вызванным вирусом простого герпеса, кажется очень низкой у детей и подростков, составляя 1 случай на 1 000 000 детей и подростков в год и составляя 0,4% случаев энцефалита у младенцев в возрасте до 3 месяцев [67]. Некоторые недавние исследования показали, что эмпирическое лечение младенцев и детей старшего возраста следует рассматривать только в соответствующих клинических сценариях, в которых у пациента есть клинические признаки острого энцефалита (например, очаговые неврологические нарушения, судороги, измененный психический статус, наводящие на размышления результаты нейровизуализации или электроэнцефалографии. ) и у пациентов с ослабленным иммунитетом [76,77].Однако этот подход часто неосуществим из-за частого совпадения клинических проявлений у детей с вирусным менингитом или вирусным энцефалитом. Более того, в настоящее время быстро доступны результаты молекулярного анализа спинномозговой жидкости, включая ПЦР на ВПГ, что позволяет отменить ацикловир после нескольких доз, когда в этом нет необходимости, и минимизировать влияние использования ацикловира на продолжительность пребывания в больнице и затраты. Что касается потенциальной нефротоксичности ацикловира, недавние исследования показали, что побочные эффекты могут быть обычными, но обычно не тяжелыми, а риск острого повреждения почек увеличивается у более больных пациентов, нуждающихся в интенсивной терапии, у пациентов с подтвержденными инфекциями ВПГ и у пациентов, получающих сопутствующие нефротоксические препараты, предполагающие, что большинство событий может быть связано с основными клиническими состояниями [78,79,80,81].На сегодняшний день эмпирическое лечение ацикловиром у пациентов с подозрением на вирусную инфекцию ЦНС остается рекомендованным до тех пор, пока не будет исключена инфекция ВПГ. В таблице 2 приведены рекомендуемые схемы приема ацикловира. Ацикловир также следует назначать детям и подросткам с признаками VZV-инфекции, особенно детям с плеоцитозом в спинномозговой жидкости и кожно-слизистыми пузырьками, судорогами, летаргией, тромбоцитопенией, гепатомегалией, асцитом или повышенными трансаминазами [82]. Развитие менингита из-за реактивации VZV относительно редко, особенно у иммунокомпетентных пациентов.В литературе описано всего несколько случаев у педиатрических пациентов. В этих случаях рекомендуется немедленная терапия ацикловиром [83].
Другие выбранные противовирусные агенты были протестированы против некоторых вирусных патогенов, но данных об эффективных специфических методах лечения мало.
Недавние исследования изучали активность ингибиторов капсида в отношении ЭВ, которые нарушают прикрепление вируса и снятие оболочки [84]. В исследовании 61 новорожденного с подозрением на инфекцию ЦНС из-за ЭВ, которым случайным образом был назначен семидневный прием плеконарила или плацебо, наблюдалась тенденция к более быстрому выведению вируса и снижению общей смертности среди младенцев, получавших плеконарил [85].Другое клиническое исследование менингита ЭВ показало лишь умеренную пользу плеконарила [86]. Однако плеконарил еще не доступен на рынке. Противовирусная терапия обычно не показана при приобретенной ЦМВ-инфекции у иммунокомпетентных детей, поскольку эта инфекция обычно купируется самостоятельно; однако лечение может быть рассмотрено у иммунокомпетентных детей с серьезными симптоматическими инфекциями, а терапия рекомендуется для пациентов с ослабленным иммунитетом [87,88]. У этих пациентов ганцикловир 12 мг / кг / день i.v., разделенная на две дневные дозы в течение 2–3 недель, является рекомендуемым режимом. Пациентам с ослабленным иммунитетом рекомендуется последующая поддерживающая схема перорального приема валганцикловира 15 мг / кг / доза два раза в день в течение 12 месяцев [89]. Арбовирусные инфекции обычно лечат симптоматически [90]. Существует несколько исследований, посвященных оценке конкретных экспериментальных методов лечения инфекции WNV. Gnann JW Jr et al. провели клиническое испытание, сравнивающее поликлональные антитела человека против WNV с внутривенным иммуноглобулином и физиологическим раствором, не показав клинических преимуществ со специфическими поликлональными антителами [90].Ацикловир использовался для лечения нейроинвазивного заболевания ЛЗН в нерандомизированных сериях случаев, но клинических преимуществ не наблюдалось [91]. Детей и подростков, пораженных гриппом с неврологическими нарушениями, следует как можно скорее лечить противовирусными препаратами [92]. Первый выбор представлен ингибиторами нейроаминидазы (NAI), которые эффективны против гриппа A и B [93]. Осельтамивир — препарат выбора. Перамивир — еще один доступный NAI, лицензированный для применения у детей в возрасте старше 6 месяцев, но доказательства его эффективности у пациентов с тяжелым гриппом отсутствуют [94].Что касается SARS-CoV-2, почти все дети с COVID-19 и неврологическими проявлениями, о которых сообщалось до сих пор, полностью выздоровели, хотя у некоторых детей это выздоровление произошло через несколько недель. Этим пациентам рекомендуется стандартное лечение COVID-19 [95].
5. Прогноз
Большинство детей и подростков с вирусной инфекцией ЦНС полностью выздоравливают за 7-10 дней без специального лечения. Однако прогноз для детей и подростков с вирусной инфекцией ЦНС зависит от возраста пациента и возбудителя болезни [96].Смертность детей от нелеченного энцефалита, вызванного ВПГ, достигает 70%, и даже у леченных педиатрических пациентов часто наблюдаются долгосрочные последствия (то есть 30% случаев) [73]. Электромобили неизвестны. Для новорожденных частота осложнений и смертности составляет до 74% и 10% соответственно. Наиболее частыми летальными осложнениями являются печеночная недостаточность для эховирусов и миокардит для вирусов Коксаки [97,98]. Младенцы и дети с иммунокомпетентным менингитом обычно выздоравливают без неврологических последствий.Однако менингит EV71 с системным поражением был связан с задержкой развития и снижением когнитивной функции [99]. Более того, долгосрочные последующие исследования детей с инфекциями ЦНС, вызванными пачеховирусом человека, выявили неврологические нарушения примерно у четверти младенцев, особенно когда инфекция встречается у новорожденных и детей раннего возраста [100]. Смертность, связанная с нейроинвазивным заболеванием WNV у детей, составляет приблизительно 1%, что значительно ниже, чем показатели, сообщаемые для взрослого населения, которые составляют до 14% [101].
Что касается COVID-19, окончательные выводы о его долгосрочных последствиях сделать нельзя из-за небольшого количества тематических исследований и ограниченного времени наблюдения. С другой стороны, нельзя исключить риск того, что, по крайней мере, у некоторых детей могут сохраниться некоторые долгосрочные неврологические проблемы.
Других данных о прогнозе вирусных инфекций ЦНС у педиатрических пациентов нет.
7. Выводы
Из-за отсутствия специфической терапии лечение вирусных инфекций ЦНС в основном основано на поддерживающей терапии.Диагностическая LP и молекулярный анализ образцов CSF должны быть выполнены незамедлительно, а эмпирическое лечение инфекции HSV должно быть начато как можно скорее. Некоторые исследователи подвергли сомнению роль ацикловира как эмпирического противовирусного средства у детей старшего возраста из-за низкой частоты инфицирования ВПГ в этой популяции и отметили, что энцефалит ВПГ может быть клинически распознаваемым после неонатального возраста, тем самым побуждая нас ограничить его использование пациентами с подозрением на ВПГ-инфекция. Однако реальное соотношение пользы и риска селективных подходов неясно, и необходимы дальнейшие исследования для определения соответствующих показаний для эмпирического применения ацикловира.
Существует немного специфических методов лечения инфекций ЦНС, вызванных вирусами, отличными от HSV. Необходимы исследования, чтобы найти специфические методы лечения появляющихся патогенов. Хотя прогноз часто благоприятный, могут возникнуть неврологические осложнения, и детям может потребоваться длительное клиническое и рентгенологическое наблюдение. Подходящие сроки мониторинга неврологического развития, проведения нейровизуализационных исследований и исследования эффективности реабилитации во время последующего наблюдения следует оценивать с помощью долгосрочных исследований.
Энтеровирус D68 (EV-D68): симптомы, лечение и профилактика
Обзор
Что такое энтеровирус D68 (EV-D68)?
Энтеровирус D68 (EV-D68) — это заразный вирус, вызывающий респираторные инфекции, в основном у детей и подростков. Но взрослые тоже могут это получить. Обычно это вызывает легкие симптомы, похожие на симптомы простуды. Если вы или ваш ребенок не очень больны, вы можете не знать, что у вас EV-D68.
У некоторых людей, инфицированных вирусом, возникают опасные для жизни респираторные заболевания.У небольшого числа детей с инфекциями EV-D68 развивается заболевание нервной системы, называемое острым вялым миелитом (AFM). Это заболевание вызывает сильную мышечную слабость. В редких случаях у ребенка с АСМ бывает необратимый паралич.
Что такое энтеровирусы?
Энтеровирусы — это группа вирусов, вызывающих различные типы инфекционных инфекций. Всего существует более 300 видов энтеровирусов.
EV-D68 — подтип энтеровируса, поражающий дыхательную систему.Поставщики медицинских услуг относят EV-D68 к категории неполиомиелитных энтеровирусов. Существует более 100 неполиомиелитных энтеровирусов.
Подобно вирусу, вызывающему полиомиелит, некоторые из этих энтеровирусов поражают нервную систему. Они вызывают ряд проблем со здоровьем, в том числе:
Насколько распространен энтеровирус D68?
Сотни различных типов энтеровирусов ежегодно заражают от 10 до 30 миллионов американцев. Трудно определить цифры заражения EV-D68. Люди с легкими симптомами не обращаются за медицинской помощью и не проходят тест на энтеровирус.
В 2014 году почти 1400 детей и взрослых были госпитализированы с тяжелыми респираторными инфекциями, вызванными EV-D68. Это была первая национальная вспышка EV-D68, которая вызвала большое количество тяжелых симптомов. Были также вспышки в 2016 и 2018 годах. Вероятно, миллионы людей имели EV-D68 в каждый из этих лет, но имели более легкие симптомы.
Как энтеровирус D68 влияет на беременность?
Большинство беременных женщин выработали определенный уровень иммунитета (защиты) к болезням EV-D68 из-за предшествующего воздействия.Вирус не вызывает проблем во время беременности.
Если у вас есть вирус во время родов или кормления грудью, есть небольшая вероятность, что ваш ребенок может заразиться им. Вирус редко вызывает серьезные проблемы у младенца. Тем не менее, вам следует поговорить со своим врачом, если вы почувствуете себя плохо во время беременности или кормления грудью.
Симптомы и причины
Как распространяется энтеровирус D68?
EV-D68 — заразный вирус. Вы можете заразиться им в любое время, но наиболее распространены инфекции с августа по ноябрь.
Вирус обитает в слизи, слюне (слюне), мокроте легких и стуле (фекалиях). Распространяется через:
- Капельки в воздухе при чихании или кашле инфицированного человека.
- Контакт с фекалиями инфицированного человека (например, при смене подгузника или помощи ребенку в пользовании туалетом).
- Поцелуй кого-то, у кого вирус.
- Совместное использование столовых приборов и чашек.
- Прикосновение к загрязненным дверным ручкам, игрушкам или другим поверхностям.
Каковы симптомы энтеровируса D68?
Дети и подростки с большей вероятностью будут иметь заметные симптомы EV-D68, потому что у них не было времени на формирование иммунитета к вирусу.
EV-D68 обычно вызывает легкие симптомы простуды, например:
У людей, страдающих астмой или слабой иммунной системой, могут развиться более серьезные симптомы. В этих условиях у вас или вашего ребенка могут быть хрипы и затрудненное дыхание. Эти симптомы требуют немедленной медицинской помощи.
Можно ли заразиться энтеровирусом D68 более одного раза?
Да. EV-D68 похож на простуду или грипп. Вы можете заразиться вирусом в любое время, когда находитесь рядом с кем-то, у кого он есть. Тем не менее, ваша иммунная система становится лучше бороться с вирусом с каждым контактом.Вот почему у взрослых при приеме EV-D68 симптомы обычно слабо выражены или вообще отсутствуют.
Диагностика и тесты
Как диагностируется энтеровирус D68?
Ваш лечащий врач может заподозрить EV-D68 на основании симптомов и сообщений о вспышках в этом районе. Анализ крови может подтвердить наличие энтеровируса.
Требуются узкоспециализированные лабораторные тесты, чтобы точно определить вирус EV-D68 в выделениях из носа или крови человека. Вашему провайдеру может потребоваться отправить образцы в департамент здравоохранения вашего штата или в Центры по контролю и профилактике заболеваний (CDC), чтобы окончательно диагностировать инфекцию EV-D68.
Ведение и лечение
Как лечится энтеровирус D68?
Легкие симптомы инфекции EV-D68 обычно проходят через неделю или две при минимальном уходе на дому. Противовирусные препараты не эффективны против этого вируса.
Чтобы облегчить симптомы, вы можете предпринять следующие шаги:
Какие осложнения вызывает энтеровирус D68?
Людям, у которых затруднено дыхание или у которых развиваются такие проблемы, как пневмония, требуется госпитализация. Во время вспышки 2014 г. 14 человек умерли, и более 130 детей заболели острым вялым миелитом (ОВМ).После вспышек EV-D68 в 2016 и 2018 годах также резко увеличилось количество детей, у которых развивается AFM.
Эксперты считают, что вирус может оседать в спинномозговой жидкости, что приводит к АСМ. Признаки АСМ появляются внезапно и похожи на инсульт:
- Слабость в руке или ноге.
- Невнятная речь.
- Обвисание лица.
AFM обычно развивается через несколько недель после выздоровления ребенка от респираторной инфекции. При появлении симптомов AFM немедленно обратитесь за медицинской помощью. .
Профилактика
Как я могу предотвратить энтеровирус D68?
Вы можете замедлить или остановить распространение инфекции EV-D68, соблюдая правила гигиены, в том числе:
- Чихайте или кашляйте в сгиб локтя.
- Дезинфицируйте поверхности, вызывающие сильное прикосновение, например игрушки, столешницы и дверные ручки.
- Не делитесь столовыми приборами, чашками, полотенцами или одеждой.
- По возможности отделяйте больных детей от здоровых членов семьи и одноклассников.
- Часто мойте руки водой с мылом в течение не менее 20 секунд.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с энтеровирусом D68?
Большинство людей, получивших EV-D68, не знают, что у них вирус. У них может быть легкое простудное заболевание — если у них вообще есть какие-либо симптомы. Люди, которым требуется госпитализация из-за серьезных проблем с дыханием, часто выздоравливают.
Самым серьезным осложнением здоровья является AFM. Со временем дети с АСМ могут восстановить некоторую степень силы и функций.Могут помочь физиотерапия и трудотерапия. У небольшого количества детей паралич носит постоянный характер.
Жить с
Когда мне позвонить врачу?
Вы должны позвонить своему врачу, если у вас возникли проблемы:
Какие вопросы я должен задать своему врачу?
Вы можете спросить своего поставщика медицинских услуг:
- Как лучше всего лечить мои симптомы?
- Как я могу предотвратить распространение инфекции среди других людей?
- Могу ли я столкнуться с другими проблемами?
- Стоит ли обращать внимание на признаки осложнений?
Записка из клиники Кливленда
EV-D68 не является распространенным энтеровирусом, но вспышки случаются.Большинство людей не испытывают серьезных проблем и могут никогда не узнать, что у них есть вирус. Дети и взрослые с респираторными проблемами или проблемами с иммунитетом чаще нуждаются в госпитализации. EV-D68 может привести к редкой проблеме, называемой острым вялым миелитом (AFM), которая вызывает пожизненную мышечную слабость. Вы можете предпринять шаги, чтобы снизить распространение EV-D68 и других вирусных инфекций среди членов семьи и других людей.
Обоснование энтеровирусной вакцинации и противовирусной терапии при диабете человека 1 типа
Гундерсен Э. (1927) Имеет ли диабет инфекционное происхождение? J Infect Dis 41: 1975–1979
Google ученый
Родригес-Кальво Т., Сабури С., Анкетиль Ф., фон Херрат М.Г. (2016) Вирусная парадигма при диабете 1 типа: кто основные подозреваемые? Аутоиммунный Rev 15 (10): 964–969. https://doi.org/10.1016/j.autrev.2016.07.019
CAS
Статья
PubMed
Google ученый
Gamble DR, Taylor KW (1969) Сезонная заболеваемость сахарным диабетом. Br Med J 3 (5671): 631–633. https://doi.org/10.1136/bmj.3.5671.631
CAS
Статья
PubMed
PubMed Central
Google ученый
Гэмбл Д.Р., Тейлор К.В., Камминг Х. (1973) Вирусы Коксаки и сахарный диабет. Br Med J 4 (5887): 260–262. https://doi.org/10.1136/bmj.4.5887.260
CAS
Статья
PubMed
PubMed Central
Google ученый
Lee HS, Briese T, Winkler C et al (2013) Секвенирование нового поколения вирусов у детей с быстро развивающимся диабетом 1 типа. Диабетология 56 (8): 1705–1711. https://doi.org/10.1007/s00125-013-2924-y
CAS
Статья
PubMed
PubMed Central
Google ученый
Stene LC, Oikarinen S, Hyoty H et al (2010) Энтеровирусная инфекция и прогрессирование от островкового аутоиммунитета до диабета 1 типа: исследование диабета и аутоиммунитета у молодых (DAISY).Диабет 59 (12): 3174–3180. https://doi.org/10.2337/db10-0866
CAS
Статья
PubMed
PubMed Central
Google ученый
Ashton MP, Eugster A, Walther D et al (2016) Неполный иммунный ответ на вирусы Коксаки B связан с ранним аутоиммунитетом против инсулина. Научный журнал 6 (1): 32899. https://doi.org/10.1038/srep32899
CAS
Статья
PubMed
PubMed Central
Google ученый
Salminen K, Sadeharju K, Lonnrot M et al (2003) Энтеровирусные инфекции связаны с индукцией бета-клеточного аутоиммунитета в проспективном когортном исследовании новорожденных. J Med Virol 69 (1): 91–98. https://doi.org/10.1002/jmv.10260
Артикул
PubMed
Google ученый
Hyoty H (2016) Вирусы при диабете 1 типа. Детский диабет 17 (Приложение 22): 56–64. https://doi.org/10.1111/pedi.12370
Артикул
PubMed
Google ученый
Lin HC, Wang CH, Tsai FJ et al (2015) Энтеровирусная инфекция связана с повышенным риском развития диабета 1 типа у детей на Тайване: общенациональное популяционное когортное исследование. Диабетология 58 (1): 79–86. https://doi.org/10.1007/s00125-014-3400-z
CAS
Статья
PubMed
Google ученый
Allen DW, Kim KW, Rawlinson WD, Craig ME (2018) Материнские вирусные инфекции во время беременности и диабет 1 типа у их потомства: систематический обзор и метаанализ наблюдательных исследований.Rev Med Virol 28 (3): e1974. https://doi.org/10.1002/rmv.1974
CAS
Статья
PubMed
Google ученый
Хонканен Х., Оикаринен С., Нурминен Н. и др. (2017) Обнаружение энтеровирусов в стуле на несколько месяцев предшествует островковому аутоиммунитету: возможные доказательства медленно действующих механизмов вирус-индуцированного аутоиммунитета. Диабетология 60 (3): 424–431. https://doi.org/10.1007/s00125-016-4177-z
Артикул
PubMed
Google ученый
Laitinen OH, Honkanen H, Pakkanen O et al (2014) Вирус Коксаки B1 связан с индукцией аутоиммунитета β-клеток, который предвещает диабет 1 типа. Диабет 63 (2): 446–455. https://doi.org/10.2337/db13-0619
CAS
Статья
PubMed
Google ученый
Smyth DJ, Cooper JD, Bailey R et al (2006) Полногеномное исследование ассоциации несинонимичных SNP идентифицирует локус диабета 1 типа в области интерферон-индуцированной геликазы (IFIh2).Нат Генет 38: 617–619
CAS
Статья
Google ученый
Domsgen E, Lind K, Kong L et al (2016) Полиморфизм гена IFIh2, связанный с риском аутоиммунитета, регулирует канонические пути противовирусной защиты в островках поджелудочной железы человека, инфицированных вирусом Коксаки. Научный журнал 6 (1): 39378. https://doi.org/10.1038/srep39378
CAS
Статья
PubMed
PubMed Central
Google ученый
Richardson SJ, Rodriguez-Calvo T, Gerling IC et al (2016) Гиперэкспрессия антигенов HLA класса I островковыми клетками: определяющая особенность диабета 1 типа. Диабетология 59 (11): 2448–2458. https://doi.org/10.1007/s00125-016-4067-4
CAS
Статья
PubMed
PubMed Central
Google ученый
Looney BM, Xia CQ, Concannon P, Ostrov DA, Clare-Salzler MJ (2015) Влияние полиморфизмов IFIh2, связанных с диабетом 1 типа, на функцию и экспрессию MDA5.Curr Diab Rep 15 (11): 96. https://doi.org/10.1007/s11892-015-0656-8
CAS
Статья
PubMed
Google ученый
Colli ML, Moore F, Gurzov EN, Ortis F, Eizirik DL (2010) MDA5 и PTPN2, два гена-кандидата на диабет 1 типа, изменяют ответы бета-клеток поджелудочной железы на двухцепочечный вирусный побочный продукт. РНК. Hum Mol Genet 19 (1): 135–146. https://doi.org/10.1093/hmg/ddp474
CAS
Статья
PubMed
Google ученый
Marroqui L, Dos Santos RS, Op de Beeck A et al (2017) Интерферон-альфа опосредует сверхэкспрессию HLA класса I бета-клеток человека, стресс эндоплазматического ретикулума и апоптоз, три признака раннего диабета типа 1 у человека. Диабетология 60 (4): 656–667. https://doi.org/10.1007/s00125-016-4201-3
CAS
Статья
PubMed
Google ученый
Юн Дж. У., Остин М., Онодера Т., Ноткинс А. Л. (1979) Выделение вируса из поджелудочной железы ребенка с диабетическим кетоацидозом.N Engl J Med 300 (21): 1173–1179. https://doi.org/10.1056/NEJM197
3002102
CAS
Статья
PubMed
Google ученый
Dotta F, Censini S, van Halteren AG и др. (2007) Инфекция бета-клеток вирусом Коксаки B4 и инсулит из естественных клеток-киллеров у недавно начавшихся пациентов с диабетом 1 типа. Proc Natl Acad Sci U S A 104 (12): 5115–5120. https://doi.org/10.1073/pnas.0700442104
CAS
Статья
PubMed
PubMed Central
Google ученый
Kobayashi T, Nishida Y, Tanaka S, Aida K (2011) Патологические изменения поджелудочной железы при молниеносном диабете 1 типа и медленно прогрессирующем инсулинозависимом сахарном диабете (SPIDDM): врожденный иммунитет при молниеносном диабете 1 типа и SPIDDM. Diabetes Metab Res Rev 27 (8): 965–970. https://doi.org/10.1002/dmrr.1237
CAS
Статья
PubMed
Google ученый
Ричардсон SJ, Willcox A, Bone AJ, Foulis AK, Morgan NG (2009) Распространенность иммуноокрашивания энтеровирусного капсидного белка vp1 в островках поджелудочной железы при диабете типа 1 человека.Диабетология 52 (6): 1143–1151. https://doi.org/10.1007/s00125-009-1276-0
CAS
Статья
PubMed
Google ученый
Richardson SJ, Leete P, Bone AJ, Foulis AK, Morgan NG (2013) Экспрессия энтеровирусного капсидного белка VP1 в островковых клетках пациентов с диабетом 1 типа связана с индукцией протеинкиназы R и подавлением регуляции МКЛ-1. Диабетология 56 (1): 185–193. https: // doi.org / 10.1007 / s00125-012-2745-4
CAS
Статья
PubMed
Google ученый
Крогволд Л., Эдвин Б., Буанес Т. и др. (2015) Обнаружение энтеровирусной инфекции низкой степени злокачественности на островках Лангерганса у живых пациентов, у которых впервые диагностирован диабет 1 типа. Диабет 64 (5): 1682–1687. https://doi.org/10.2337/db14-1370
CAS
Статья
PubMed
Google ученый
Крогволд Л., Эдвин Б., Буанес Т. и др. (2014) Биопсия поджелудочной железы путем минимальной резекции хвоста у живых взрослых пациентов в начале диабета 1 типа: опыт исследования DiViD. Диабетология 57 (4): 841–843. https://doi.org/10.1007/s00125-013-3155-y
Артикул
PubMed
Google ученый
Krogvold L, Genoni A, Puggioni A et al (2017) Энтеровирус в поджелудочной железе живых взрослых пациентов с впервые диагностированным диабетом 1 типа.Результаты исследования DiViD. Диабетология 60: S167 (Реферат)
Google ученый
Richardson SJ, Leete P, Dhayal S. et al (2014) Оценка точности иммуномечения, полученного с клоном 5D8 / 1, моноклональным антителом, направленным против энтеровирусного капсидного белка VP1 в поджелудочной железе человека. Диабетология 57 (2): 392–401. https://doi.org/10.1007/s00125-013-3094-7
CAS
Статья
PubMed
Google ученый
Morgan NG, Richardson SJ (2014) Энтеровирусы как возбудители диабета 1 типа: нерешенные вопросы или безнадежное дело? Тенденции метаболизма эндокринола 25 (12): 611–619. https://doi.org/10.1016/j.tem.2014.08.002
CAS
Статья
PubMed
Google ученый
Чапман Н.М., Ким К.С. (2008) Стойкая инфекция, вызванная вирусом Коксаки: персистенция энтеровируса при хроническом миокардите и дилатационной кардиомиопатии. Curr Top Microbiol Immunol 323: 275–292
CAS
PubMed
Google ученый
Tracy S, Smithee S, Alhazmi A, Chapman N (2015) Вирус Коксаки может сохраняться в поджелудочной железе мышей путем делеции 5′-концевых геномных последовательностей. J Med Virol 87 (2): 240–247. https://doi.org/10.1002/jmv.24039
CAS
Статья
PubMed
Google ученый
Kim KS, Tracy S, Tapprich W. и др. (2005) 5′-Терминальные делеции возникают в вирусе Коксаки В3 во время репликации в сердцах мышей и культурах сердечных миоцитов и коррелируют с инкапсидацией вирусной РНК с отрицательной цепью.Дж. Вирол 79 (11): 7024–7041. https://doi.org/10.1128/JVI.79.11.7024-7041.2005
CAS
Статья
Google ученый
Lloyd RE (2006) Контроль трансляции вирусными протеиназами. Virus Res 119 (1): 76–88. https://doi.org/10.1016/j.virusres.2005.10.016
CAS
Статья
PubMed
Google ученый
Colli ML, Nogueira TC, Allagnat F et al (2011) Воздействие побочного вирусного продукта дцРНК или вируса Коксаки В5 запускает апоптоз бета-клеток поджелудочной железы через дисбаланс Bim / Mcl-1.PLoS Pathog 7 (9): e1002267. https://doi.org/10.1371/journal.ppat.1002267
CAS
Статья
PubMed
PubMed Central
Google ученый
Ifie E, Russell MA, Dhayal S. et al (2018) Неожиданное субклеточное распределение специфической изоформы Коксаки и рецептора аденовируса CAR-SIV в бета-клетках поджелудочной железы человека. Диабетология 61 (11): 2344–2355. https://doi.org/10.1007/s00125-018-4704-1
CAS
Статья
PubMed
PubMed Central
Google ученый
Sioofy-Khojine AB, Lehtonen J, Nurminen N et al (2018) Инфекции, вызванные вирусом Коксаки B1, связаны с инициированием инсулино-зависимого аутоиммунитета, который прогрессирует до диабета 1 типа. Диабетология 61 (5): 1193–1202. https://doi.org/10.1007/s00125-018-4561-y
CAS
Статья
PubMed
Google ученый
Elmastour F, Jaidane H, Benkahla M et al (2017) Anti-coxsackievirus B4 (CV-B4), увеличивающий активность сыворотки, связанную с повышенной вирусной нагрузкой и патологией у мышей, повторно инфицированных CV-B4.Вирулентность 8 (6): 908–923. https://doi.org/10.1080/21505594.2016.1252018
CAS
Статья
PubMed
Google ученый
Kuss SK, Best GT, Etheredge CA et al (2011) Кишечная микробиота способствует репликации кишечного вируса и системному патогенезу. Наука 334 (6053): 249–252. https://doi.org/10.1126/science.1211057
CAS
Статья
PubMed
PubMed Central
Google ученый
Afonso G, Mallone R (2013) Инфекционные триггеры при диабете 1 типа: есть ли случай для мимикрии эпитопа? Диабет, ожирение, метаболизм 15 (Приложение 3): 82–88. https://doi.org/10.1111/dom.12166
CAS
Статья
PubMed
Google ученый
Eizirik DL, Miani M, Cardozo AK (2013) Сигнальная опасность: стресс эндоплазматического ретикулума и развернутый белковый ответ при воспалении островков поджелудочной железы. Диабетология 56 (2): 234–241.https://doi.org/10.1007/s00125-012-2762-3
CAS
Статья
PubMed
Google ученый
Марре М.Л., Джеймс Э.А., Пиганелли Д.Д. (2015) β-клеточный стресс ER и последствия для иммуногенности при диабете 1 типа. Front Cell Dev Biol 3:67
Статья
Google ученый
Phelps EA, Cianciaruso C, Michael IP et al (2016) Аберрантное накопление аутоантигена диабета GAD65 в мембранах Гольджи в условиях стресса ER и аутоиммунитета.Диабет 65 (9): 2686–2699. https://doi.org/10.2337/db16-0180
CAS
Статья
PubMed
PubMed Central
Google ученый
Cianciaruso C, Phelps EA, Pasquier M et al (2017) Первичные β-клетки человека и крысы высвобождают внутриклеточные аутоантигены GAD65, IA-2 и проинсулин в экзосомах вместе с индуцированными цитокинами усилителями иммунитета. Диабет 66 (2): 460–473. https://doi.org/10.2337/db16-0671
CAS
Статья
PubMed
Google ученый
Serreze DV, Ottendorfer EW, Ellis TM, Gauntt CJ, Atkinson MA (2000) Ускорение диабета 1 типа инфекцией, вызванной вирусом Коксаки, требует наличия критической массы аутореактивных Т-клеток в островках поджелудочной железы. Диабет 49 (5): 708–711. https://doi.org/10.2337/diabetes.49.5.708
CAS
Статья
PubMed
Google ученый
Канно Т., Ким К., Коно К., Дрешер К.М., Чепмен Н.М., Трейси С. (2006) Диабетогенный фенотип вируса Коксаки группы B коррелирует с эффективностью репликации.Дж. Вирол 80 (11): 5637–5643. https://doi.org/10.1128/JVI.02361-05
CAS
Статья
Google ученый
Larsson PG, Lakshmikanth T, Laitinen OH et al (2015) Доклиническое исследование эффективности и безопасности новой вакцины против вируса Коксаки B1 не выявило риска ускоренного развития диабета на моделях мышей. Диабетология 58 (2): 346–354. https://doi.org/10.1007/s00125-014-3436-0
CAS
Статья
PubMed
Google ученый
Horwitz MS, Ilic A, Fine C, Balasa B, Sarvetnick N (2004) Диабет, опосредованный вирусом Коксаки: индукция требует антигенпрезентирующих клеток и сопровождается фагоцитозом бета-клеток. Clin Immunol 110 (2): 134–144. https://doi.org/10.1016/j.clim.2003.09.014
CAS
Статья
PubMed
Google ученый
Хорвиц М.С., Брэдли Л.М., Харбертсон Дж., Краль Т., Ли Дж., Сарветник Н. (1998) Диабет, индуцированный вирусом Коксаки: инициирование случайным повреждением, а не молекулярной мимикрией.Nat Med 4: 781–785
CAS
Статья
Google ученый
Pugliese A (2017) Аутореактивные Т-клетки при диабете 1 типа. Дж. Клин Инвест 127 (8): 2881–2891. https://doi.org/10.1172/JCI94549
Артикул
PubMed
PubMed Central
Google ученый
Gallagher GR, Brehm MA, Finberg RW et al (2015) Вирусная инфекция привитых островков человека приводит к диабету.Диабет 64 (4): 1358–1369. https://doi.org/10.2337/db14-1020
CAS
Статья
PubMed
Google ученый
Кунду Р., Найт Р., Дунга М., Пикман М. (2018) Подходы in silico и ex vivo указывают на иммунное давление на капсидные и некапсидные области вирусов Коксаки B в организме человека. PLoS One 13 (6): e0199323. https://doi.org/10.1371/journal.pone.0199323
CAS
Статья
PubMed
PubMed Central
Google ученый
Stone VM, Hankaniemi MM, Svedin E et al (2018) Вакцина от вируса Коксаки В защищает от вирус-индуцированного диабета в экспериментальной мышиной модели диабета 1 типа. Диабетология 61 (2): 476–481. https://doi.org/10.1007/s00125-017-4492-z
CAS
Статья
PubMed
Google ученый
Insel RA, Dunne JL, Atkinson MA et al (2015) Стадия предсимптомного диабета 1 типа: научное заявление JDRF, Эндокринного общества и Американской диабетической ассоциации.Уход за диабетом 38 (10): 1964–1974. https://doi.org/10.2337/dc15-1419
CAS
Статья
PubMed
PubMed Central
Google ученый
Alidjinou EK, Sane F, Bertin A, Caloone D, Hober D (2015) Постоянная инфекция клеток поджелудочной железы человека вирусом Коксаки В4 излечивается флуоксетином. Antivir Res 116: 51–54. https://doi.org/10.1016/j.antiviral.2015.01.010
CAS
Статья
PubMed
Google ученый
Okada M, Enomoto M, Kawada N, Nguyen MH (2017) Эффекты противовирусной терапии у пациентов с хроническим гепатитом B и циррозом печени. Эксперт Рев Гастроэнтерол Гепатол 11 (12): 1095–1104. https://doi.org/10.1080/17474124.2017.1361822
CAS
Статья
PubMed
Google ученый
Сориано В., Лабарга П., Фернандес-Монтеро Дж. В. и др. (2016) Лечение гепатита С с помощью противовирусной терапии — преимущества не только для печени.Антивир Тер 21 (1): 1–8. https://doi.org/10.3851/IMP2975
CAS
Статья
PubMed
Google ученый
Badia-Boungou F, Sane F, Alidjinou EK et al (2017) Маркер инфекции Коксаки-В4 в слюне пациентов с диабетом 1 типа. Diabetes Metab Res Rev 33: e2916
Статья
Google ученый
Hammerstad SS, Tauriainen S, Hyoty H, Paulsen T, Norheim I, Dahl-Jorgensen K (2013) Обнаружение энтеровируса в ткани щитовидной железы у пациентов с болезнью Грейвса.J Med Virol 85 (3): 512–518. https://doi.org/10.1002/jmv.23476
CAS
Статья
PubMed
Google ученый
Hammerstad SS, Jahnsen FL, Tauriainen S, Hyöty H, Paulsen T, Norheim I, Dahl-Jørgensen K (2013) Воспаление и повышенная экспрессия белка A устойчивости к миксовирусу в ткани щитовидной железы на ранних стадиях тиреоидита Хашимото. Щитовидная железа 23 (3): 334–341. https://doi.org/10.1089/thy.2012.0264
CAS
Статья
PubMed
Google ученый
Nederstigt C, Uitbeijerse B, Janssen L, Corssmit EP, de Koning E, Dekkers O (2018) Ассоциированное аутоиммунное заболевание у пациентов с диабетом 1 типа: систематический обзор и метаанализ. Eur J Endocrinol: 137–146. https://doi.org/10.1530/EJE-18-0515
Oikarinen M, Tauriainen S, Oikarinen S. et al (2012) Диабет типа 1 связан с энтеровирусной инфекцией слизистой оболочки кишечника.Диабет 61 (3): 687–691. https://doi.org/10.2337/db11-1157
CAS
Статья
PubMed
PubMed Central
Google ученый
Proventionbio (2017) Provention Bio, Inc. объявляет о клинической программе, направленной на выявление и предотвращение развития диабета 1 типа.

