Смесь Humana Bifidus 300г c 0 месяцев
Заменитель Humana Bifidus (Хумана Бифидус) с лактулозой с рождения до 6 мес. 300 г
Адаптированная сухая молочная смесь с лактулозой для детей с рождения до 6 месяцев. Для лечебного и профилактического питания при запорах и дисбактериозе кишечника. По рекомендации врача может быть рекомендована как единственное питание или как замена нескольких кормлений в сутки (до нормализации консистенции и частоты стула).
- Для лечебного и профилактического питания при запорах и дисбактериозе кишечника.
- Перед началом применения смеси проконсультируйтесь с педиатром.
- Энергетическая ценность: 100 г порошка — 510 ккал, 100 мл готового продукта (13,5 г порошка + 90 мл воды) — 69 ккал.
- Питательная ценность в 100 мл продукта (13,5 г порошка + 90 мл воды): белок — 1,4 г, сывороточный белок/казеин — 60/40, углеводы- 7,9 г, жир — 3,5 г.
Состав: обезжиренное молоко, деминерализованная молочная сыворотка, растительные масла (пальмовое, низкоэруковое рапсовое, подсолнечное), лактоза, лактулоза, соевый лецитин, кальция карбонат, концентрат белков молочной сыворотки, калия хлорид, натрия хлорид, L-аргинин, калия цитрат, L-фенилаланин, L-тирозин, натрия цитрат, таурин, L-триптофан, магния карбонат, железа лактат, L-карнитин, цинка оксид, цинка сульфат, меди сульфат, калия йодат, марганца сульфат, натрия селенат, витамины (С, Е, А, В1, В2, В6, В12, D3, К, фолиевая кислота, пантотеновая кислота, биотин, ниацин).
Приготовление: Точно следуйте рекомендациям по способу приготовления и дозировке, руководствуясь таблицей кормления. Воду вскипятите и охладите до 70°С. Необходимое количество подготовленной воды налейте в бутылочку. В бутылочку с водой добавьте точное количество мерных ложек смеси без горки. Закрыв бутылочку, встряхивайте до полного растворения порошка. Проверьте температуру готовой смеси на внутренней стороне запястья (37°С). Используйте только прилагаемую мерную ложку (1 мерная ложка без горки содержит около 4,5 г порошка).
Условия хранения:
- До вскрытия пачки продукт хранить в сухом прохладном месте при t не выше 25°С.
- После открытия продукт хранить плотно закрытым, содержимое использовать в течение 3-х недель.
- Срок годности: 18 месяцев.
Внимание! Для питания детей раннего возраста предпочтительнее грудное вскармливание. Не следует применять смесь при индивидуальной непереносимости молочного белка.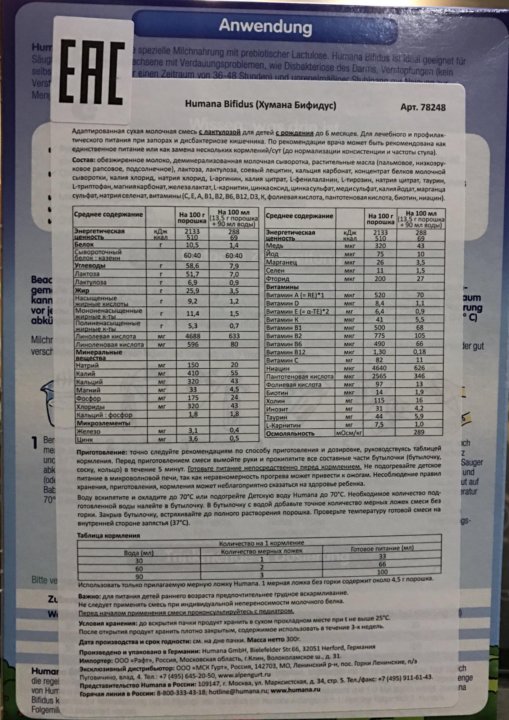 Перед началом применения смеси проконсультируйтесь с педиатром.
Перед началом применения смеси проконсультируйтесь с педиатром.
ХУМАНА БИФИДУС 300гр с пребиотиком и лактулозой
Молоко матери – это наилучшее, идеальное и генетически родное питание для малыша. В тех случаях, когда отсутствует возможность кормления грудью или материнского молока явно не хватает – необходимым питанием для младенца становится адаптированная молочная смесь, максимально удовлетворяющая потребности детского организма во всех питательных веществах и энергии, обеспечивая малышу полноценный рост и развитие.
Смесь «Хумана Бифидус» предназначена для детей с рождения, также может применяться детьми постарше и взрослыми при запорах и дисбактериозе. Можно рекомендовать при запорах у беременных. Содержит в составе: омега-3 и омега-6, пребиотики. Эффективно нормализует пищеварение, кишечную микрофлору и регулярность стула. Смесь не содержит пробиотиков!
Особенности применения смеси в том, что она может вводиться перед основным кормлением.![]() В первые трое суток заменяется одно кормление (по 30-50 мл ежедневно), на 4-й день заменяется еще одно кормление и т.д. до получения нужного эффекта, при котором частота и консистенция стула нормализуются. Смесь можно использовать как единственный и основной источник питания или заменить 2-3 кормления, комбинировать в различных пропорциях с базовыми смесями. Имея мягкое физиологическое действие, смесь не вызывает привыкания. Перед выбором питания посоветуйтесь с педиатром.
В первые трое суток заменяется одно кормление (по 30-50 мл ежедневно), на 4-й день заменяется еще одно кормление и т.д. до получения нужного эффекта, при котором частота и консистенция стула нормализуются. Смесь можно использовать как единственный и основной источник питания или заменить 2-3 кормления, комбинировать в различных пропорциях с базовыми смесями. Имея мягкое физиологическое действие, смесь не вызывает привыкания. Перед выбором питания посоветуйтесь с педиатром.
Состав: обезжиренное коровье молоко, деминерализованная молочная сыворотка, растительные жиры (пальмовое, подсолнечное, рапсовое, масла), лактоза, лактулоза, эмульгатор: лецитин, карбонат кальция, концентрат сывороточного белка, хлорид калия, L-аргинин, цитрат калия, витамины (витамин С, пантотеновая кислота, витамин Е, витамин А, витамин В1, витамин В6, витамин В2, фолиевая кислота, витамин К, биотин, витамин D3, витамин В12), L-фениланина, L-тирозин, цитрат натрия, таурин, L-триптофан, карбонат магния, лактат железа, ниацин, L-карнитин, оксид цинка, сульфат цинка, сульфат меди, йодат калия, сульфат марганца, селенат натрия.![]()
Характеристики:
- Возраст: с рождения
- Вес (г): 300
- Материал упаковки: картонная коробка
- Молочная основа: на основе коровьего молока
- Свойства: без глютена, с Омега 3, с пребиотиками
- Рекомендуется при дисбактериозе, запоре
- Объем готового продукта: 2100 мл
состав детского питания, виды и фото
Основная цель всех детских молочных смесей – заменить грудное молоко. Использование смеси Humana не ограничивается одним искусственным вскармливанием. Ими кормят детей со сбоями в функционировании пищеварительной системы, а также в случае аллергии. Детское питание фирмы Humana представлено широким ассортиментом смесей, оказывающих лечебное действие при разнообразных нарушениях. Продукция легко усвояема и является гарантией полноценного развития ребенка. Найти отзывы о продукции и фото можно из нашего обзора.
Состав и виды смесей «Хумана»
Все смеси «Хумана» созданы для вскармливания детей в случае невозможности кормления материнским молоком и имеют традиционное деление по возрасту ребенка и назначению. Почему следует выбрать питание «Хумана»?
Почему следует выбрать питание «Хумана»?
- Данное детское питание хорошо адаптировано под нужды детского организма, отличается качественными ингредиентами.
- Молоко поступает исключительно из семейных фермерских хозяйств вблизи г. Херфорд, которые тщательно следят за животными и качеством их питания.
- Используются компоненты только премиального качества, а сырье сразу после поступления идет на переработку.
- Более 600 тестов гарантируют строгий контроль качества и безопасность.
- Производитель – концерн DMK GMBH входит в ТОП 10 ведущих компаний молочной отрасли Европы.
- Единственное питание по-настоящему немецкого качества, так как производится исключительно в Германии.
- Наличие многочисленных сертификатов качества.
youtube.com/embed/djgU5kiFqXU?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Лучшая детская смесь на козьем молоке
Этот вариант детского питания появился на отечественных рынках не так давно, но уже завоевал большую популярность. Связано это с теорией о том, что козье молоко усваивается незрелым детским организмом легче, чем коровье и по своим свойствам приравнивается к грудному молоку матери. Также она подходит для питания новорожденных, у которых аллергия на коровье молоко. При этом выбор мам, решивших перейти на такой продукт, невелик – на рынке представлено только 4 подобные марки, которые и будут подробно описаны.
При этом выбор мам, решивших перейти на такой продукт, невелик – на рынке представлено только 4 подобные марки, которые и будут подробно описаны.
Нэнни
Новозеландский продукт, который по праву считается лучшей молочной смесью на козьем молоке. Главное его отличие от продуктов других марок состоит в высоком содержании казеиновых белков, которые легче переварить незрелому организму. Другая особенность заключаются в отсутствии дополнительной обработки молока, что обеспечивает максимальное сохранение его полезных качеств. Кроме того, в продукте этой марки не содержится пальмовое масло
Все это в совокупности обеспечивает минимальный риск возникновения аллергии, что очень важно, когда речь идет о новорожденном ребенке
Достоинства:
- высокое качество продукции
- отсутствие пальмового масла и сывороточного белка
- минимальный риск возникновения аллергии
Недостатки:
высокая стоимость
Детская смесь от испанского производителя содержит казеиновые и сывороточные белки в равных пропорциях. Продукт не успел завоевать большую популярность, так как появился на прилавках относительно недавно. Тем не менее, мамы, попробовавшие его, отмечают, что у молока на его основе приятный сладкий вкус, который нравится детям. Статистика аллергических реакций также минимальна.
Продукт не успел завоевать большую популярность, так как появился на прилавках относительно недавно. Тем не менее, мамы, попробовавшие его, отмечают, что у молока на его основе приятный сладкий вкус, который нравится детям. Статистика аллергических реакций также минимальна.
Достоинства:
- пропорциональное соотношение сывороточных и казеиновых белков
- насыщена пребиотиками
Недостатки:
сложно найти (продается не во всех магазинах)
Кабрита
Детское питание из Голландии, содержащая комплекс жиров Digest X, патент на который принадлежит производителю. Этот вид жиров призван улучшать пищеварение, а также способствовать повышению усвояемости кальция. Такие показатели являются очень важными для детского питания в первые месяцы после рождения. По отзывам большинства мам, Кабрита – это лучшее соотношение цены и качества среди смесей на козьем молоке.
Достоинства:
- содержание специального комплекса жиров
- оптимальное соотношение стоимости и качества продукции
Недостатки:
сложно найти в магазинах
MDмил SP Козочка
Детская смесь с хорошим составом совместного производства Швейцарии и Испании. В отличие от других марок детского питания, насыщенность молока белками и солями находится в пределах нормы (в других продуктах она либо превышает допустимые пределы, либо находится на их верхней границе). Такое оптимальное сочетание позволяет избежать излишней нагрузки на такие детские органы, как кишечник и почки. Кроме того, здесь соотношение омега-кислот, наиболее приближенное к грудному молоку, что положительно влияет на развитие детской нервной системы.
В отличие от других марок детского питания, насыщенность молока белками и солями находится в пределах нормы (в других продуктах она либо превышает допустимые пределы, либо находится на их верхней границе). Такое оптимальное сочетание позволяет избежать излишней нагрузки на такие детские органы, как кишечник и почки. Кроме того, здесь соотношение омега-кислот, наиболее приближенное к грудному молоку, что положительно влияет на развитие детской нервной системы.
Достоинства:
- оптимальный состав с минимальным риском возникновения аллергии
- нормализация стула и отсутствие колик при употреблении
Недостатки:
высокая цена
Важно знать! Никогда не храните сухую смесь в открытом виде, так как в воздухе находятся микроорганизмы, которые также могут попасть в питание. Рекомендуем к просмотру видео Контрольной закупки о детской смеси!
Рекомендуем к просмотру видео Контрольной закупки о детской смеси!
Молочные смеси для здоровых детей
Выпускаются в упаковках по 350 г. Из содержимого одной банки «Хумана Эксперт 1» можно приготовить 2,7 л готового питания, «Хумана Эксперт 2» – 2,5 л. Рекомендованы в качестве основного питания в случае отсутствия грудного молока или для дополнительного при его недостатке.
Из содержимого одной банки «Хумана Эксперт 1» можно приготовить 2,7 л готового питания, «Хумана Эксперт 2» – 2,5 л. Рекомендованы в качестве основного питания в случае отсутствия грудного молока или для дополнительного при его недостатке.
- «Хумана Эксперт 1» («Humana Expert 1») для здоровых детей с рождения и до 6 месяцев.
- «Хумана Эксперт 2» («Humana Expert 2») для здоровых детей с 6 и до 12 месяцев.
- «Хумана Эксперт 3» («Humana Expert 3») для здоровых детей с 12 месяцев.
Питание содержит жизненно необходимый набор питательных веществ, витаминов и микроэлементов. В составе присутствуют омега-3 и омега-6 жирные кислоты, необходимые для мозга и зрения малыша, пребиотики (галактоолигосахариды) для питания полезной микрофлоры кишечника, нуклеотиды, способствующие формированию иммунитета.
Важно! Все смеси «Хумана» не содержат искусственных консервантов, красителей, подсластителей и ГМО.
Лучшие профилактические смеси с пребиотиками от запоров
Самый важный компонент в детском питании, предназначающемся для профилактики и устранения запоров – это пребиотики. Эти компоненты направлены на размягчение каловых масс, а также улучшение микрофлоры кишечника. Улучшить его перистальтику помогут лакто- и бифидобактерии, натуральные пищевые волокна. Какие смеси лучше для новорожденных при запорах подскажет педиатр, отзывы опытных родителей и рекомендации экспертов в текущем обзоре.
Эти компоненты направлены на размягчение каловых масс, а также улучшение микрофлоры кишечника. Улучшить его перистальтику помогут лакто- и бифидобактерии, натуральные пищевые волокна. Какие смеси лучше для новорожденных при запорах подскажет педиатр, отзывы опытных родителей и рекомендации экспертов в текущем обзоре.
Нестожен 1 Prebio
Бюджетный продукт с профилактическим действием против дискомфорта в животе. Предназначается для малышей с первых дней жизни, помимо основной функции регулирует стул, а также снижает интенсивность колик. Богатый состав является источником деминерализованной молочной сыворотки и обезжиренного молока, лактозы, мальтодекстрина, соевого лецитина, пребиотиков, лактобактерий. Дополнительные полезные компоненты – это комплекс витаминов и минералов, L-карнитин, таурин для поддержания иммунитета. Пищевые волокна облегчают процесс пищеварения, что в свою очередь приводит в норму каловые массы. Противопоказанием выступает только гиперчувствительность к составу.
Достоинства
- Отсутствие пальмового масла;
- Многокомпонентный состав;
- Пребиотики и лактобактерии для кишечника;
- Проверенный годами производитель;
- Приятный вкус;
- Удобная упаковка;
- Недорого.
Недостатки
- Вероятность развития аллергии;
- Неточные дозировки в инструкции.
Это один из самых популярных продуктов в своем сегменте, что будет по карману большинству покупателей. Педиатры хвалят состав, родители – вкусовые качества, добавки в виде витаминов и минералов, удобную упаковку, отсутствие пальмового масла. Недостатком отмечают неточные дозировки к приготовлению, для получения подробной информации потребуется консультация врача. Редко, но все же состав вызывает аллергию.
Агуша 1
Для пока еще неокрепшего желудочно-кишечного тракта новорожденных компания Агуша предлагает профилактическую смесь от запоров и колик. Цифра «1» на упаковке говорит о том, что ее можно применять с самого рождения.__300_g_1.jpg) В составе такого продукта не входит сахар, крахмал, глютен, консерванты. Помимо молочного адаптированного сырья производитель включил в формулу пребиотики, они размягчают каловые массы, улучшают перистальтику кишечника и его микрофлору. Также здесь наблюдается премикс минералов, витаминов, нуклеотидов. Приятный молочный вкус и запах придется по душе ребенку. В продаже можно видеть несколько пачек с разным объемом. Противопоказанием выступает только индивидуальная непереносимость какого-либо компонента в составе.
В составе такого продукта не входит сахар, крахмал, глютен, консерванты. Помимо молочного адаптированного сырья производитель включил в формулу пребиотики, они размягчают каловые массы, улучшают перистальтику кишечника и его микрофлору. Также здесь наблюдается премикс минералов, витаминов, нуклеотидов. Приятный молочный вкус и запах придется по душе ребенку. В продаже можно видеть несколько пачек с разным объемом. Противопоказанием выступает только индивидуальная непереносимость какого-либо компонента в составе.
Достоинства
- Продуманный состав;
- Наличие витаминов, минералов, пребиотиков;
- Приятный вкус, запах;
- Экономичный расход;
- Недорого.
Недостатки
- Пальмовое масло;
- Мягкая непрактичная упаковка.
Отечественная продукция широко используется во многих городах России в качестве питания на бесплатных молочных кухнях. Это говорит о ее качестве, надежности.
Бибиколь Нэнни 1 с пребиотиками
При вопросе в кабинете педиатра, как подобрать смесь для новорожденного при запорах, лучшей рекомендацией будет смесь на козьем молоке с пребиотиками от Бибиколь. Первое, чем она преимущественно отличается от предыдущих номинантов – отсутствие коровьего молока в составе. Также ее предпочитают многие родители, потому что – это абсолютно гипоаллергенный продукт. В нем не содержится синтетических добавок, пальмового масла, все компоненты на 100% натуральные. Для профилактики застойных процессов в кишечнике Бибиколь Ненни 1 включает в себя уникальный комплекс пребиотиков Orafti. В продаже можно видеть два объема банок – 400 и 800 г. Казеин демонстрирует хороший процент жирности, высокую биодоступность, отличную переносимость организмом. Для поддержания пищеварения в комплекс внесен мальтодекстрин, олигофруктоза, инулин, макроэлементы, масла, витамины и жирные кислоты. Подойдет для детей с диспепсическими расстройствами.
Первое, чем она преимущественно отличается от предыдущих номинантов – отсутствие коровьего молока в составе. Также ее предпочитают многие родители, потому что – это абсолютно гипоаллергенный продукт. В нем не содержится синтетических добавок, пальмового масла, все компоненты на 100% натуральные. Для профилактики застойных процессов в кишечнике Бибиколь Ненни 1 включает в себя уникальный комплекс пребиотиков Orafti. В продаже можно видеть два объема банок – 400 и 800 г. Казеин демонстрирует хороший процент жирности, высокую биодоступность, отличную переносимость организмом. Для поддержания пищеварения в комплекс внесен мальтодекстрин, олигофруктоза, инулин, макроэлементы, масла, витамины и жирные кислоты. Подойдет для детей с диспепсическими расстройствами.
Достоинства
- На козьем молоке;
- Только натуральные компоненты;
- Гипоаллергенно;
- Источник ценных нутриентов;
- Устранение синдрома диспепсии;
- Удобство приготовления.
Недостатки
- Цена;
- Нужно запивать из-за высокой жирности.

Качественное питание, которое устраняет запоры у новорожденных, не вызывает аллергии и подходит детям с непереносимостью молочного белка. Покупатели в минусах отмечают цену выше среднего уровня, но готовы платить за 100% натуральный состав без синтетических компонентов
Важно учесть, что из-за высокой жирности Бибиколь требует питья воды
Детские смеси для новорожденных с проблемами пищеварения
Помимо обязательных компонентов, которые должна содержать смесь для обеспечения пищевых и энергетических потребностей растущего организма, она имеет свои особенности состава, которые нацелены на устранение и профилактику нарушений пищеварения.
«Хумана ГА 1 гипоаллергенная» («Humana НА 1») с рождения и до 6 месяцев
Относится к профилактическому детскому питанию. Содержит частично гидролизованные белки молочной сыворотки, которые снижают риск возникновения аллергии. Питание обогащено пребиотиками, нуклеотидами, жирными кислотами. Для детей старше 6 месяцев выпускается «Хумана ГА 2 гипоаллергенная» («Humana НА 1»). Масса нетто 300 г.
Масса нетто 300 г.
Гипоаллергенное питание для новорожденных
«Хумана низколактозная ЛП» («Humana HN») с рождения
Лечебное детское питание. Используется при нарушениях пищеварения различного генеза, в том числе лактазной недостаточности. Терапевтическое действие связано с наличием в составе пребиотиков, волокон банана, низкого содержания лактозы (1,5 г на 100 мл питания) и жира. Обладает приятным банановым вкусом. Если ребенок маленький, то используется как смесь, а для детей постарше как каша (содержит рисовую муку, картофельный крахмал). Из минусов – в составе нет нуклеотидов, рыбьего жира (источник омега-3 и омега-6 жирных кислот). Масса нетто 300 г.
Низколактозное питание для детей
«Хумана низколактозная ЛП+СЦТ» («Humana HN+МСТ») с рождения
Лечебное детское питание со вкусом банана. Рекомендовано при кишечных расстройствах, лактазной недостаточности, целиакии, муковисцидозе. Обогащено среднецепочечными триглицеридами, которые хорошо всасываются даже при дефиците липазы и желчных кислот. Пищевые волокна из банана (пребиотики фруктоолигосахариды) поддерживают здоровую микрофлору и сорбируют вредные токсины. Сниженное содержание лактозы (0,5 г на 100 мл питания) и жира. Если ребенок маленький, то используется как смесь, а для детей постарше как каша (содержит рисовую муку). Из минусов – в составе нет нуклеотидов, рыбьего жира. Масса нетто 300 г.
Пищевые волокна из банана (пребиотики фруктоолигосахариды) поддерживают здоровую микрофлору и сорбируют вредные токсины. Сниженное содержание лактозы (0,5 г на 100 мл питания) и жира. Если ребенок маленький, то используется как смесь, а для детей постарше как каша (содержит рисовую муку). Из минусов – в составе нет нуклеотидов, рыбьего жира. Масса нетто 300 г.
«Хумана антиколики» («Humana AntiColic») с рождения
Сухая молочная смесь для детей, склонных к коликам, запорам, вздутию живота, срыгиваниям. Содержит частично гидролизованные белки молочной сыворотки, которые меньше задерживаются в желудке и легко усваиваются. В составе присутствует β-пальмитат (жир, в котором пальмитиновая кислота находится в положении 2 в триглицеридах, как и в грудном молоке), полученный на основе молочного коровьего жира, предупреждающий образование кальциевых мыл. Тем самым увеличивается усвояемость жирных кислот, кальция, устраняются запоры и колики. Низкое содержание лактозы позволяет использовать питание при лактазной недостаточности. Содержит галактоолигосахариды, обладающие пребиотическим эффектом, нуклеотиды, рыбий жир. Масса нетто 300 г.
Содержит галактоолигосахариды, обладающие пребиотическим эффектом, нуклеотиды, рыбий жир. Масса нетто 300 г.
Питание при запорах и коликах
«Хумана бифидус» («Humana Bifidus») с рождения и до 6 месяцев
Лечебная и лечебно-профилактическая молочная смесь с пребиотиком лактулозой, обладающим бифидогенными свойствами при дисбактериозе и запорах. Из минусов – не содержит нуклеотиды и рыбий жир. Масса нетто 300 г.
«Хумана антирефлюксная» («Humana AR») с рождения
Сухая молочная смесь для кормления детей, склонных к срыгиванию. Способствует снижению частоты и интенсивности срыгиваний за счет наличия натурального загустителя – камеди бобов рожкового дерева. Данный компонент также снижает интенсивность колик, делает стул более мягким, уменьшая вероятность запоров. Смесь не содержит пребиотиков, нуклеотидов. Масса нетто 400 г.
Антирефлюксное питание
«Хумана соя» («Humana SL») с рождения
Безмолочная безлактозная смесь на основе концентрата соевого белка. Рекомендована для детей с аллергией на белок коровьего молока, нарушениями углеводного обмена (непереносимость галактозы, лактозы, фруктозы, сахарозы). Из минусов – смесь не содержит пребиотиков, нуклеотидов, рыбьего жира. Масса нетто 500 г.
Рекомендована для детей с аллергией на белок коровьего молока, нарушениями углеводного обмена (непереносимость галактозы, лактозы, фруктозы, сахарозы). Из минусов – смесь не содержит пребиотиков, нуклеотидов, рыбьего жира. Масса нетто 500 г.
Соевые смеси
Когда назначают смесь «Хумана Низколактозная»?
В основном низколактозные смеси назначают при вторичной (частичной, приобретенной) лактазной недостаточности, но также и в других случаях:
- Диарея различного генеза,
- Наличие острых кишечных инфекций,
- Целиакия,
- Муковисцидоз,
- Другие функциональные нарушения работы желудочно-кишечного тракта, в том числе сопровождающиеся гипотрофией – обильные срыгивания, метеоризм и колики.
Читайте — почему младенец часто срыгивает?
Внимание: назначить низколактозную смесь может только врач, мама не должна сама принимать решение о переходе на подобное лечебное питание!
Преимущества и недостатки по отзывам педиатров и родителей
Мамы и врачи-педиатры выделяют ряд преимуществ смеси «Хумана» для детей от 0 до 6 месяцев:
- адаптирована под возрастные особенности детей;
- легко готовится, приятная на вкус.

К недостаткам относят:
- наличие в составе пальмового масла;
- найти питание можно далеко не в каждом магазине;
- цена сравнительно высокая и сильно зависит от валютного курса, так как заводы по изготовлению продукта находятся за границей РФ.
Смесь обычно хорошо переносится детьми и большинство родителей ею довольны. Однако, в истории производителя этого детского питания, как и, впрочем, некоторых других, были и черные полосы. Например в 2003 году, когда недостаток витамина В1 в соевой смеси «Хумана» привел к смерти нескольких младенцев из Израиля и запрету ввоза продукции данного производителя в Россию. Через некоторое время запрет сняли, так как никаких нарушений в отношении смесей, поставляемых на российский рынок, обнаружено не было. Далее продукция Humana еще раз запрещалась к ввозу в 2013 году уже в связи с низким качеством. Сегодня никаких ограничений по ввозу на территорию РФ нет.
Важно! Перед тем как покупать продукт проконсультируйтесь со специалистом для выбора наиболее оптимального вида смеси «Хумана» для вашего ребенка.
Отзывы родителей и врачей о детском питании Хумана
Самые разнообразные комментарии молодых родителей, которые покупали данную продукцию, и педиатров можно встретить на форумах.
Положительные
- Оптимальный состав, который учитывает все потребности организма любого малыша в разный период;
- Отличное усвоение организмом карапуза;
- Высокая питательность;
- Удобная упаковка и спец ложка;
- Имеет приятный вкус, нравится младенцам.
Отрицательные
- Пальмовое масло в составе;
- Сложности с приобретением;
- Высокая цена;
- Отсутствие пробиотиков;
- Редко советуют педиатры из-за скандала десятилетней давности. Два ребенка из Израиля умерли, а десятки пострадали из-за соевого питания Хумана, в котором отсутствовало нужное количество витамина В1. Производителем была выплачена компенсация, а меры по контролю над качеством производимой продукции усилены.
Вывод от нашего сайта: Продукция компании Humana Gmbh — не очень подходящий выбор для ребенка искусственника.
По
Как развести смесь ребенку – пошаговая инструкция
- Важно точно следовать инструкции по применению, указанной на упаковке.
- Руки должны быть хорошо вымытыми с мылом.
- Приготовление питания необходимо вести в чистой, бутылочке, которую вместе с соской и кольцом надо простерилизовать.
- Воду нужно предварительно вскипятить и остудить до 50°С.

- Мерную ложечку из упаковки с продуктом перед первым использованием ополосните водой и высушите.
- Набирая порошок, следите, чтобы не было горки. Излишки можно убрать ножом.
- В бутылочку сначала налейте воду, а затем, используя таблицу кормления для дозирования, насыпьте необходимое количество порошка. Если сделать наоборот, на дне может образоваться трудно растворимый сгусток.
- Хорошо перемешайте содержимое бутылочки.
- Температура смеси не должна превышать 37°С.
- Если смесь слишком сильно остыла, не подогревайте ее в микроволновой печи. Из-за неравномерного прогрева жидкости может обжечь ребенка.
- Если ребенок съел не весь объем детского питания, остатки хранить больше одного часа нельзя.
- Вскрытую банку следует хранить в прохладном, достаточно сухом месте. Холодильник для этой цели не подходит.
Переводить ребенка на смесь “Хумана” следует постепенно, небольшими порциями, начав с утреннего кормления. В течение недели надо увеличивать объем питания и количество кормлений пока ребенок полностью не перейдет на новый заменитель молока.
Как понять, что смесь не подходит
Очень редко бывает так, что смесь не подходит ребенку. В большинстве случаев это обусловлено индивидуальными особенностями детского организма. Проявления носят следующий характер:
- сыпь или покраснение на коже;
- понос или запор:
- срыгивание;
- беспокойство ребенка.
При обнаружении одного или нескольких упомянутых признаков следует прекратить давать смесь «Хумана» ребенку и обратиться за консультацией по подбору смеси к специалисту.
Купить смесь “Хумана” в магазине Акушерство
Какими бывают?
К детскому питанию возможно применить следующую классификацию:
- Максимально приближенные к грудному молоку (адаптированные) и частично.
- Предназначенные для кормления:
Кисломолочные – содержащие полезные микроорганизмы, и пресные. Сухие и жидкие. Казеиновые и сывороточные. Причем казеин менее благоприятен для грудничка.
Состав детских смесей, таблица:
| Наименование | Адаптация | Основа | Предназначение | Витамины, микроэлементы | Пребиотики | Глютен | Сахар | Вредные вещества |
| Малютка 1 | Адаптированная | Деминерализованная сыворотка | Для детей 0+ | Комплекс | есть | Может содержаться | Нет | Пальмовое масло |
| Малютка 2 | Адаптированная | Деминерал-ная сыворотка | Для детей 2 -6 мес. | Комплекс | есть | Может содержаться | нет | Пальм. масло |
| Малютка 3 | Частично | Молоко обезжиренное | Для детей после 12+ | Комплекс | Есть | Может содержаться | нет | Пальм. масло |
| Малютка с рождения | Частично | Молоко обезжиренное | Для здоровых детей 0+, | Комплекс | Да | Может содержаться | нет | Пальм. масло масло |
| Малютка премиум | Адаптированная | Деминерал-ная сыворотка | Для здоровых детей 0-6 мес. | Комплекс | Да | Может содержаться | нет | нет |
| НАН 1 | Адаптированная | Деминерал-ная сыворотка | Для здоровых детей 0-6 мес. | Комплекс | Есть | нет | нет | Пальмовое масло |
| НАН 2 | Адаптированная | Молоко обезжиренное | Для здоровых детей 6-12 мес. | Комплекс | Есть | нет | нет | Пальмовое масло |
| НАН 3 | Адаптированная | Молоко обезжиренное | Для здоровых детей 12+ | Комплекс | Есть | нет | нет | Пальмовое масло |
| НАН премиум | Адаптированная | Деминерал-ная сыворотка | Для здоровых детей | Комплекс | Есть | нет | нет | Пальмовое масло |
| НАН комфорт состав смеси | Адаптированная | Деминерал-ная сыворотка | Для здоровых детей | Комплекс | Есть | нет | нет | Пальмовое масло |
| НАН гиппоалергенный | Адаптированная | Деминерал-ная сыворотка | Для детей с аллергией | Комплекс | Есть | нет | нет | Пальмовое масло |
| НАН безлактозный | Адаптированная | Деминерал-ная сыворотка | Для детей с аллергией | Комплекс | Есть | нет | нет | Пальмовое масло |
| Детская смесь Нестожен | Адаптированная | Деминерал-ная сыворотка | Для детей с хорошим здоровьем 0-12 мес. | Комплекс | Есть | нет | нет | нет |
| Смесь Малыш состав(г. Истра) | Адаптированная | Деминерализованная сыворотка | Для детей без особенностей, связанных со здоровьем 0-12+ | Есть ограниченное количество | Нет | Есть (не во всех смесях) | нет | нет |
| Смесь Хумана состав | Адаптированная | Деминерализованная сыворотка, Молоко обезжиренное | Для здоровых детей 0-12+ | Комплекс | Есть | Нет | нет | Пальмовое масло |
| Детская смесь Нутрилон состав | Адаптированная | Казеин, Деминерализованная сыворотка | Для здоровых детей 0-12+ | Комплекс | Есть | нет | нет | Пальмовое масло |
| Фрисолак | Адаптированная | Казеин, Деминерализованная сыворотка | Для здоровых детей 0-12+, аллергиков | Комплекс | Есть | нет | нет | Пальм. масло масло |
| Симилак | Адаптированная | Деминерализованная сыворотка | Для здоровых 0-12+, аллергиков | Комплекс | Да | нет | нет | нет |
| Хипп | Адаптированная | Деминерализованная сыворотка | Для здоровых 0-12+, аллергиков | Комплекс | Есть | нет | нет | Пальм. масло |
| Матерна | Адаптированная | Деминерализованная сыворотка | Для здоровых 0-12+, аллергиков и с незначительными расстройствами пищеварения | Комплекс | Есть | нет | нет | нет |
| Нутрилак | Адаптированная | Деминерализованная сыворотка | Для здоровых 0-12+, аллергиков, с незначительными расстройствами пищеварения, с патологиями 0-12+ | Комплекс | Да | нет | нет | нет |
| Беллакт | Адаптированная | Деминерализованная сыворотка | Для здоровых детей, лечебно-профилактические смеси 0-12+ | Комплекс | Есть | нет | нет | Соя, пальм. масло масло |
| Фруто Няня | Частично | Натуральные злаки, фрукты, овощи, мясо | Для здоровых малышей и аллергиков (4) 6+ | Есть | Есть | Присутствует в зависимости от вида продукта | Нет, присутствует фруктоза | нет |
| Агуша | Адаптированная | Деминерализованная сыворотка | Для здоровых малышей, аллергиков 0-12+ | Комплекс | да | Может содержаться | нет | Пальмовое масло |
При выборе питания для своего малыша прислушайтесь к рекомендациям вашего педиатра и изучите состав детских смесей. Только врач, основываясь на результатах анализов и общем состоянии малыша, может правильно подобрать смесь. Кроме того, реакция вашего чада не заставит себя ждать
Обращайте на неё внимание
Конечно, хочется надеяться, что для детей производится все самое лучшее. Но на деле иногда случается иначе. Если вы столкнулись с отсутствием качества, не молчите – действуйте. Добивайтесь справедливости. Информацию о том, что предпринять и как себя вести, вы сможете найти на нашем сайте.
Добивайтесь справедливости. Информацию о том, что предпринять и как себя вести, вы сможете найти на нашем сайте.
Humana HA при аллергии Украина
Детское питание Humana HA при аллергии на белок коровьего молока: молочные гипоаллергенные смеси — Хумана НА 1, Хумана НА 2, Хумана НА 3. Состав гипоаллергенных смесей Хумана оптимально подобран согласно физиологическим потребностям детей в питательных веществах, обеспечивая адекватный рост и развитие. Принцип действия смеси — это не добавление лекарственных препаратов, а расщепленный белок молока, который легко усваивается, не провоцируя аллергические реакции.
Важно: 1. Гипоаллергенные смеси Хумана — это Ваш инструмент в борьбе с аллергией. Во время кормления этим питанием, вы полностью исключаете аллергию на молочный белок, тем самым можете определить на что другое у вас реакция. Найден аллерген — аллергия побеждена. 2. Рекомендуем прочитать комментарии к каждому продукту о особенностях назначения и применения.
На странице:
15255075100
Сортировка:
По умолчаниюНаименование (А -> Я)Наименование (Я -> А)Цена (по возрастанию)Цена (по убыванию)Рейтинг (по убыванию)Рейтинг (по возрастанию)Модель (А -> Я)Модель (Я -> А)
Humana 0 — это лучший продукт для недоношенных деток, грудничков, когда необходимо повысить..
220грн.
Humana 0-HA является более распространенным и дешевым аналогом Special Care это питание для недон..
80грн.
Humana 0-HA является более распространенным и дешевым аналогом Special Care. Это питание для недо..
150грн.
С феврая 2014г Humana DMK прекратили поставки в Украину гипоаллергенных смесей. Опираясь на м..
350грн.
Прекращены поставки в Украину. Рекомендуем перейти на Симилак Гипоаллергенный 2. Humana HA 2 соде..
320грн.
В связи с отсутствием в Украине Humana SL, предлагаем абсолютный аналог Симилак Изомил, который я..
200грн.
Коррекция транзиторных дисфункций пищеварительной системы
26 ноября 2015 года в г. Киеве состоялась научно-практическая конференция «Актуальные вопросы детской гастроэнтерологии», в рамках которой прозвучало множество интересных докладов. В данной статье речь пойдет о проблеме выбора оптимальной смеси с целью коррекции транзиторных дисфункций пищеварительной системы у детей раннего возраста, или так называемых функциональных гастроинтестинальных расстройств (ФГР), которая была подробно рассмотрена в докладе заведующей кафедрой педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования, доктора медицинских наук, профессора Ольги Юрьевны Белоусовой.
В данной статье речь пойдет о проблеме выбора оптимальной смеси с целью коррекции транзиторных дисфункций пищеварительной системы у детей раннего возраста, или так называемых функциональных гастроинтестинальных расстройств (ФГР), которая была подробно рассмотрена в докладе заведующей кафедрой педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования, доктора медицинских наук, профессора Ольги Юрьевны Белоусовой.
– Нарушения деятельности органов пищеварения у детей могут носить как функциональный, так и органический характер. По данным Американской академии педиатрии, у 92% детей, страдающих заболеваниями кишечника, органическая патология отсутствует, а причины имеющихся функциональных заболеваний прежде всего связаны с расстройствами нервной регуляции деятельности того или иного органа. Таким образом, рассуждая о функциональных нарушениях органов пищеварения, врачи, как правило, подразумевают преимущественно моторно-эвакуаторные нарушения. В норме толстая кишка сокращается один раз в минуту, а длительность волны перистальтики составляет 40-50 с. При нарушении этого ритма (дискинезия, дизритмия) наблюдается замедление или учащение сокращений, что клинически проявляется соответственно запорами или диареей. При этом в структуре распространенности расстройств ЖКТ в развитых странах функциональный запор занимает 2-е место (во всех возрастных группах), а хроническая диарея – 3-е место в структуре жалоб, с которыми обращаются к детскому гастроэнтерологу.
В норме толстая кишка сокращается один раз в минуту, а длительность волны перистальтики составляет 40-50 с. При нарушении этого ритма (дискинезия, дизритмия) наблюдается замедление или учащение сокращений, что клинически проявляется соответственно запорами или диареей. При этом в структуре распространенности расстройств ЖКТ в развитых странах функциональный запор занимает 2-е место (во всех возрастных группах), а хроническая диарея – 3-е место в структуре жалоб, с которыми обращаются к детскому гастроэнтерологу.
Причины развития диареи и запора многообразны и необязательно связаны именно с патологией пищеварительной системы. Поэтому зачастую практикующий врач назначает лечение симптоматически, исходя из самого факта наличия диареи или запора, но без учета механизмов их развития и особенностей действия лекарственных препаратов. Такое лечение в лучшем случае неэффективно, а в худшем – может нанести вред здоровью ребенка. Стоит отметить, что какова бы ни была причина диареи или запора, каким бы заболеванием они ни были вызваны, нутрициологические аспекты – универсальный ключ к решению проблемы данных транзиторных дисфункций ЖКТ.
В большинстве случаев причиной длительных диарей у детей раннего возраста является лактазная недостаточность (ЛН). Лактаза – фермент, связанный с апикальной частью слизистой оболочки, поэтому, в отличие от дефицита ряда других ферментов, ЛН возникает при повреждении слизистой любой этиологии. Особое значение проблема ЛН имеет в раннем возрасте, поскольку лактоза составляет примерно 80–85% углеводов грудного молока и содержится в нем в количестве 6–7 г/100 мл. При наблюдении за малышами, которые страдали от кишечных колик, D. Infante, O. Segarra и B. le Luer (2011) установили, что 62% из них имели проявления разных типов ЛН. При лечении некоторых типов ЛН у младенцев врачу приходится решать вопрос о возможности продолжения грудного вскармливания. Если возникает необходимость перевода ребенка с ЛН на искусственное вскармливание, то оптимальным выходом из ситуации является использование качественных детских смесей, специально разработанных для детей с ЛН. Такие смеси могут иметь низкое содержание лактозы либо вообще ее не содержать.![]() Для определения содержания лактозы следует обращать внимание на буквенную маркировку на упаковках со смесью: SL (sine lactose), LF (lactose free) – не содержащие лактозу; LL (low lactose) – с низким содержанием лактозы. К последним, например, относятся широко известные на рынке Украины и Европы низколактозные смеси Хумана HN (лактоза 1,5 г/100 мл) и Хумана HN mit MCT (лактоза 0,5 г/100 мл). Они выпускаются компанией Humana (Германия) и являются полностью сбалансированным питанием для младенцев с ЛН, заболеваниями кишечника и диареей различного генеза. При выборе безлактозных смесей для детей с ЛН следует обратить внимание на смесь Хумана СЛ, в составе которой основная часть углеводов (8,3 г/100 мл) представлена легкоусвояемыми декстринами. В этом продукте отсутствуют лактоза, галактоза, фруктоза и сахароза.
Для определения содержания лактозы следует обращать внимание на буквенную маркировку на упаковках со смесью: SL (sine lactose), LF (lactose free) – не содержащие лактозу; LL (low lactose) – с низким содержанием лактозы. К последним, например, относятся широко известные на рынке Украины и Европы низколактозные смеси Хумана HN (лактоза 1,5 г/100 мл) и Хумана HN mit MCT (лактоза 0,5 г/100 мл). Они выпускаются компанией Humana (Германия) и являются полностью сбалансированным питанием для младенцев с ЛН, заболеваниями кишечника и диареей различного генеза. При выборе безлактозных смесей для детей с ЛН следует обратить внимание на смесь Хумана СЛ, в составе которой основная часть углеводов (8,3 г/100 мл) представлена легкоусвояемыми декстринами. В этом продукте отсутствуют лактоза, галактоза, фруктоза и сахароза.
Особого внимания педиатров заслуживает смесь Хумана Антиколик, которая может стать незаменимым средством при диетотерапии младенческих колик и ЛН. Особенностью данной смеси является ее состав: натуральные пребиотики галактоолигосахариды, низкое содержание лактозы (0,4 г/100 мл), гидролизат сывороточного белка, а также натуральный структурированный молочный жир LipoMilk® с высоким содержанием β-пальмитата (27% от общего количества жиров). Смесь Хумана Антиколик вводят в рацион постепенно, начиная с замены 1-го кормления, при этом в последующие 3–5 дней она может назначаться в полном объеме либо заменять часть суточного рациона.
Особенностью данной смеси является ее состав: натуральные пребиотики галактоолигосахариды, низкое содержание лактозы (0,4 г/100 мл), гидролизат сывороточного белка, а также натуральный структурированный молочный жир LipoMilk® с высоким содержанием β-пальмитата (27% от общего количества жиров). Смесь Хумана Антиколик вводят в рацион постепенно, начиная с замены 1-го кормления, при этом в последующие 3–5 дней она может назначаться в полном объеме либо заменять часть суточного рациона.
Что же касается профилактики и лечения функциональных запоров у детей раннего возраста, то в таком случае детям, находящимся на искусственном вскармливании, целесообразно включать в рацион молочную смесь Хумана Бифидус, которая содержит пребиотическое количество лактулозы. Смесь Хумана Бифидус характеризуется хорошей переносимостью и является оптимальной для профилактики запоров у здоровых детей первого года жизни, лишенных материнского молока, а также для детей, нуждающихся в коррекции уже возникших функциональных расстройств ЖКТ, сопровождающихся запорами.
Таким образом, лечение детей раннего возраста с транзиторными дисфункциями ЖКТ должно быть комплексным и подбираться индивидуально в зависимости от конкретной ситуации. Обязательным его компонентом является диетотерапия. Для детей первого года жизни, которые находятся на смешанном или искусственном вскармливании, особое значение имеет оптимальный выбор молочной смеси.
Подготовил Антон Вовчек
Смеси молочные специальные — Справочник
Смеси для маловесных и недоношенных детей
Отличаются большим содержанием белка и значительным преобладанием его сывороточного компонента, высокой энергетической ценностью, увеличенным количеством витаминов. В названиях таких смесей нередко присутствует цифра 0 (нулевые формулы) или приставка «пре-».
Примеры: Пренутрилак (Нутритек, Россия), Пре НАН (Нестле, Нидерланды, Швейцария), Пре Нутрилон (Нутриция, Нидерланды), Фрисопре (ФрисоЛенд, Нидерланды), Хумана О (Хумана, Германия) и др.
Смеси для детей с лактазной недостаточностью
Лактазная недостаточность — частичная или полная, врожденная или приобретенная недостаточность лактазы — фермента, обеспечивающего расщепление молочного сахара (лактозы). В специальных смесях, применяемых при лактазной недостаточности, количество лактозы либо значительно уменьшено, либо она отсутствует вообще (заменяется декстринмальтозой).
Примеры: Нутрилак безлактозный, Нутрилак низколактозный (Нутритек, Россия), НАН безлактозный (Нестле, Нидерланды, Швейцария), Нутрилон низколактозный (Нутриция, Нидерланды), Хумана ЛП, Хумана ЛП+СЦТ (Хумана, Германия), Мамэкс безлактозный (Интернешнл Нутришн Ко, Дания) и др.
Смеси, применяемые при функциональных расстройствах желудочно-кишечного тракта
Эффективны при запорах, коликах, рвоте, срыгиваниях.
Смеси, используемые при склонности к срыгиваниям, называют антирефлюксными. Они содержат специальные вещества, делающие смесь более густой — камедь (клейковину рожкового дерева) или крахмал (рисовый, кукурузный, картофельный).
Они содержат специальные вещества, делающие смесь более густой — камедь (клейковину рожкового дерева) или крахмал (рисовый, кукурузный, картофельный).
Примеры: Нутрилон АР (Нутриция, Нидерланды), Фрисовом (ФрисоЛенд, Нидерланды), Нутрилак АР (Нутритек, Россия), Семпер Лемолак (Семпер, Швеция), Энфамил АР (Мид Джонсонс Нутришиналс, Голландия).
При склонности к запорам также используют смеси, обогащенные камедью, поскольку она обладает свойствами пищевых волокон (удерживает воду и стимулирует перистальтику кишечника). Альтернатива камеди в таких смесях — лактулоза: дисахарид, не расщепляемый ферментами человека, но активно стимулирующий рост бифидумбактерий.
Варианты смесей, содержащих лактулозу: Детолакт Бифидус (ОАО «Балтский молочно-консервный комбинат детских продуктов», Украина), Семпер Бифидус (Семпер, Швеция).
Смеси для детей, страдающих пищевой аллергией
Вероятность пищевой аллергии имеет прямую связь с молекулярной массой белков, входящих в состав смеси. В смесях, предназначенных для вскармливания детей с пищевой аллергией (гипоаллергенных смесях), белок подвергнут гидролизу (расщеплению), как следствие его молекулярная масса значительно уменьшается.
В смесях, предназначенных для вскармливания детей с пищевой аллергией (гипоаллергенных смесях), белок подвергнут гидролизу (расщеплению), как следствие его молекулярная масса значительно уменьшается.
Примеры: Фрисопеп, Фрисопеп АС (ФрисоЛенд, Нидерланды), Нутрилак ГА, Нутрилак Пептиди СЦТ (Нутритек, Россия), Хипп ГА (ХИПП, Германия), НАН ГА, Альфаре (Нестле, Нидерланды, Швейцария), Хумана ГА (Хумана, Германия) и др.
Самый распространенный вариант пищевой аллергии у грудных детей — аллергия на белок коровьего молока. Во многих смесях коровий белок полностью отсутствует и заменяется соевым белком — соевые смеси.
Примеры соевых смесей: Фрисосой (ФрисоЛенд, Нидерланды), Нутрилак-соя (Нутритек, Россия), Соя-Семп (Семпер, Швеция), Хумана СП (Хумана, Германия), Энфамил-соя (Мид Джонсонс Нутришиналс, Голландия), Симилак Изомил (ЭББОТ лабораториз, США), Туттели-соя (Валио, Финляндия) и др.
Еще один вариант смесей, используемых при пищевой аллергии, — смеси на основе козьего молока. Типичные представители таких смесей — МД мил Козочка (Лайпак, Нидерланды), Ненни и Ненни золотая козочка (Витакэа, Новая Зеландия).
опубликовано 15/07/2020 00:30
обновлено 15/07/2020
— Wiki доктора Комаровского
Хумана инструкция, цена в Моя Аптека от 123,60 до 230,85 грн
Состав
Изготовлен из свежего экологически чистого молока от здоровых коров из собственных ферм в Германии. Максимум полезности сохраняется благодаря бережным технологиям производства и хранения.
В составе содержится комплекс белков, жиров, углеводов, витаминов, минеральных веществ и микроэлементов для здорового роста малыша.
Благодаря натуральному яблоку обладает приятным молочно-фруктовым вкусом.
Натуральные пробиотики галактоолигосахариды (ГОС) и продукты жизнедеятельности бактерий (короткоцепочечные жирные кислоты) активизируют рост собственных бифидо- и лактобактерий в кишечнике ребенка, предохраняя от дисбиоза.
Без глютена и кристаллического сахара.
Состав: сухое обезжиренное коровье молоко, лактоза, мальтодекстрин, растительные жиры (пальмовое, подсолнечное, рапсове масла), галактоолигосахаридный сироп, порошок из яблок, рисовый порошок, карбонат кальция, ортофосфат кальция, витамины (витамин C, ниацин, витамин Е, пантотеновая кислота, витамин А, витамин В1, витамин В6, витамин В2, фолиевая кислота, витамин К1, біотин, витамин D3, витамин В12), цитран натрия, карбонат магния, L-триптофан, дифосфат железа, оксид цинка, сульфат меди, сульфат магния, йодат калия, цитрат калия, селенат натрия, хлорид калия.
Показания
предназначения питания детей от 10 месяцев.
Используется как альтернатива цельному коровьему молоку.
Способ применения и дозы
Способ приготовления: 1 мерная ложка смеси без вершка (5 г) разводится на 30 мл воды. Количество готовой смеси примерно 33 мл.
Количество готовой смеси примерно 33 мл.
Рекомендуется кормить малыша свежеприготовленной смесью – готовится смесь на одно кормление и непосредственно перед кормлением.
При необходимости готовую (разведенную сухую) смесь можно хранить в герметично закрытой бутылочке при комнатной температуре не более 4-х часов или в холодильнике при температуре не выше +4°С до 30 часов (рекомендации ESPGHAN, 2004).
Инструкции по приготовлению детского питания: не подогревайте детскую смесь в микроволновой печи (риск ожога). Перед приготовлением смеси тщательно вымойте руки и посуду, из которой ребенок будет употреблять смесь. Закипятите необходимое количество воды, предназначенной для детского питания, и остудите до 50-60°С. Налейте примерно половину необходимого количества воды в чистую бутылку. Мерной ложкой, которая находится в пачке, наберите необходимое количество порошка в бутылочку. Всегда придерживайтесь рекомендованных пропорций смеси и воды. Вершок с ложки снимайте при помощи ножа. Закройте бутылку и тщательно взболтайте. Затем добавьте остаток воды и еще раз встряхните бутылочку до полного растворения порошка. Остудите готовую смесь до температуры кормления 36-37 °С: на несколько минут опустите бутылочку со смесью в чашу с холодной водой или подержите под струёй холодной воды. Встряхните бутылочку снова и проверьте температуру готовой смеси еще раз на тыльной стороне запястья. Остатки смеси после кормления не используйте повторно. Открытый пакет со смесью тщательно закрывайте после использования. Храните в прохладном сухом месте и используйте в течение 3-х недель.
Закройте бутылку и тщательно взболтайте. Затем добавьте остаток воды и еще раз встряхните бутылочку до полного растворения порошка. Остудите готовую смесь до температуры кормления 36-37 °С: на несколько минут опустите бутылочку со смесью в чашу с холодной водой или подержите под струёй холодной воды. Встряхните бутылочку снова и проверьте температуру готовой смеси еще раз на тыльной стороне запястья. Остатки смеси после кормления не используйте повторно. Открытый пакет со смесью тщательно закрывайте после использования. Храните в прохладном сухом месте и используйте в течение 3-х недель.
Bifidobacterium — обзор | ScienceDirect Topics
Влияние олигосахаридов грудного молока на рост
Bifidobacterium : Lacto- N -Biose Hypothesis
Бифидобактерии составляют около 95–99,9% от общей микрофлоры толстой кишки у младенцев, вскармливаемых грудью в течение 1 недели после рождения. Эта доля ниже во флоре грудных детей, находящихся на искусственном вскармливании, даже когда в заменителе молока присутствуют пребиотические олигосахариды, такие как лактулоза, галактоолигосахариды или фруктоолигосахариды.Кал 700 детей на грудном вскармливании, 232 детей на искусственном вскармливании и 98 детей, получавших сочетание грудного вскармливания и вскармливания смеси, собирали через 1 месяц после родов, а затем изучали микрофлору толстой кишки с использованием количественного анализа ПЦР в реальном времени после извлечение микробной ДНК. Как у детей, вскармливаемых грудью, так и на искусственном вскармливании преобладали бифидобактерии в микрофлоре толстой кишки, но дети на искусственном вскармливании чаще содержали Escherichia coli , Clostridium difficile , Bacteroides fragilis и Lactobacillus видыв микрофлоре толстой кишки, чем у их сверстников, находящихся на грудном вскармливании. Было высказано предположение, что компоненты молока стимулируют рост бифидобактерий толстой кишки.
Эта доля ниже во флоре грудных детей, находящихся на искусственном вскармливании, даже когда в заменителе молока присутствуют пребиотические олигосахариды, такие как лактулоза, галактоолигосахариды или фруктоолигосахариды.Кал 700 детей на грудном вскармливании, 232 детей на искусственном вскармливании и 98 детей, получавших сочетание грудного вскармливания и вскармливания смеси, собирали через 1 месяц после родов, а затем изучали микрофлору толстой кишки с использованием количественного анализа ПЦР в реальном времени после извлечение микробной ДНК. Как у детей, вскармливаемых грудью, так и на искусственном вскармливании преобладали бифидобактерии в микрофлоре толстой кишки, но дети на искусственном вскармливании чаще содержали Escherichia coli , Clostridium difficile , Bacteroides fragilis и Lactobacillus видыв микрофлоре толстой кишки, чем у их сверстников, находящихся на грудном вскармливании. Было высказано предположение, что компоненты молока стимулируют рост бифидобактерий толстой кишки. Как упоминалось выше, считается, что ОПЗ действуют как пребиотики, которые стимулируют рост бифидобактерий в нижнем отделе кишечника; это снижает pH толстой кишки, что может подавлять рост патогенных бактерий, таких как E. coli .
Как упоминалось выше, считается, что ОПЗ действуют как пребиотики, которые стимулируют рост бифидобактерий в нижнем отделе кишечника; это снижает pH толстой кишки, что может подавлять рост патогенных бактерий, таких как E. coli .
Какие из более чем 130 различных ОПЗ стимулируют рост бифидобактерий толстой кишки младенца? Китаока и его коллеги предположили, что олигосахариды молока, содержащие LNB, являются специфическими факторами роста для некоторых видов Bifidobacterium .Эта гипотеза о лакто- N -биозе основана на опубликованной информации о геноме, относящейся к бифидобактериям и клонированию гликогидролаз, гликофосфорилазы и переносчика ABC из штамма Bifidobacterium longum . Первоначально эта гипотеза была основана на открытии фермента в клеточных экстрактах B. bifidum , который фосфоролизирует лакто- N -биозу, продукты которой представляют собой галактозо-1-фосфат и N -ацетилглюкозамин: впоследствии был очищен, и его ген, lnp A , из B. longum был клонирован. Ген lnp A был обнаружен в новом опероне метаболизма галактозы, который также включает гены муциндесульфатазы и Gal-1-P уридилтрансферазы и UDP-Glc-4-эпимеразы, а также ген АТФ-связывающий кассетный транспортер сахара (см. Рисунок 2, ). Кроме того, было продемонстрировано, что лакто- N -биоза фосфорилаза может также использовать галакто- N -биозу (GNB; Gal (β1-3) GalNAc), которая является основной единицей муцина, в качестве субстрата, но не N -ацетиллактозамин (LacNAc, Gal (β1-4) GlcNAc).
longum был клонирован. Ген lnp A был обнаружен в новом опероне метаболизма галактозы, который также включает гены муциндесульфатазы и Gal-1-P уридилтрансферазы и UDP-Glc-4-эпимеразы, а также ген АТФ-связывающий кассетный транспортер сахара (см. Рисунок 2, ). Кроме того, было продемонстрировано, что лакто- N -биоза фосфорилаза может также использовать галакто- N -биозу (GNB; Gal (β1-3) GalNAc), которая является основной единицей муцина, в качестве субстрата, но не N -ацетиллактозамин (LacNAc, Gal (β1-4) GlcNAc).
Высокое содержание и увеличение концентраций LNB-содержащих олигосахаридов, таких как LNT, LNFP I и LNDFH I в молоке / молозиве на ранних стадиях, может значительно повлиять на формирование бифидофлоры в толстой кишке младенца. Метаболизм LNFP I, который является доминирующей HMO, с помощью B. bifidum JCM1254 был уточнен путем клонирования α-фукозидазы, которая катализирует высвобождение невосстанавливающей фукозы из LNFP I, и лакто- N -биозидазы. , который катализирует гидролиз LNB с образованием LNB и лактозы, а также путем очистки и кристаллизации транспортера типа ABC, который доставляет LNB через клеточную мембрану.Поскольку лакто- N -биозофосфорилаза была очищена из экстракта этого штамма бифидобактерий, было высказано предположение, что его α-фукозидаза продуцирует LNT из LNFP I, в то время как его лакто- N -биозидаза высвобождает LNB из LNT, что является с последующим захватом LNB через клеточную мембрану; LNB затем метаболизируется до галактозо-1-фосфата и N, -ацетилглюкозамина, как показано на фиг. Можно с уверенностью ожидать, что это форма симбиоза между такими B.bifidum и другой штамм бифидобактерий, который имеет переносчик типа ABC и фосфорилазу лакто- N -биоза, но не имеет α-фукозидазы и лакто- N -биозидазы. Возможный метаболический путь для N -ацетилглюкозамина, продуцируемого из LNFP I или LNT (см. Выше), предлагается на основе анализа генных продуктов оперона галактозы B.
, который катализирует гидролиз LNB с образованием LNB и лактозы, а также путем очистки и кристаллизации транспортера типа ABC, который доставляет LNB через клеточную мембрану.Поскольку лакто- N -биозофосфорилаза была очищена из экстракта этого штамма бифидобактерий, было высказано предположение, что его α-фукозидаза продуцирует LNT из LNFP I, в то время как его лакто- N -биозидаза высвобождает LNB из LNT, что является с последующим захватом LNB через клеточную мембрану; LNB затем метаболизируется до галактозо-1-фосфата и N, -ацетилглюкозамина, как показано на фиг. Можно с уверенностью ожидать, что это форма симбиоза между такими B.bifidum и другой штамм бифидобактерий, который имеет переносчик типа ABC и фосфорилазу лакто- N -биоза, но не имеет α-фукозидазы и лакто- N -биозидазы. Возможный метаболический путь для N -ацетилглюкозамина, продуцируемого из LNFP I или LNT (см. Выше), предлагается на основе анализа генных продуктов оперона галактозы B. longum ssp. longum NCC2705; N -ацетилглюкозамин превращается в N -ацетилглюкозамин-1-фосфат новым ферментом N -ацетилгексозамин-1-киназой и затем в UDP- N -ацетилглюкозамин, наконец, UDP-глюкозо-гексозеридтрансфат-1-фосфат вступая в метаболический путь аминосахаров.На основании этих результатов можно частично объяснить стимулирующий рост эффект ОПЗ на некоторые штаммы бифидобактерий, такие как B. bifidum .
longum ssp. longum NCC2705; N -ацетилглюкозамин превращается в N -ацетилглюкозамин-1-фосфат новым ферментом N -ацетилгексозамин-1-киназой и затем в UDP- N -ацетилглюкозамин, наконец, UDP-глюкозо-гексозеридтрансфат-1-фосфат вступая в метаболический путь аминосахаров.На основании этих результатов можно частично объяснить стимулирующий рост эффект ОПЗ на некоторые штаммы бифидобактерий, такие как B. bifidum .
Рисунок 2. Гипотеза лакто- N -биоза. BL, Bifidobacterium longum ; GL-BP, галакто- N -биоза / лакто- N -биоза I-связывающий белок; GLNBP, галакто- N -биоза / лакто- N -биоза I. фосфорилаза.
Как уже упоминалось, доминирующими олигосахаридами грудного молока / молозива являются 2′-FL, LNFP I, LNDFH I и LNT, последние три из которых являются олигосахаридами типа I, которые содержат элемент LNB; они составляют 25–30% от общего количества олигосахаридов молока. Однако молоко или молозиво почти всех млекопитающих, кроме человека, содержит только олигосахариды типа II, которые содержат N -ацетиллактозамин (Gal (β1-4) GlcNAc). Недавно были изучены молочные олигосахариды видов, которые тесно связаны с людьми, а именно человекообразных обезьян (шимпанзе, бонобо, горилла и орангутан) и более мелких обезьян (сиаманг). Было обнаружено, что молоко горилл и сиаманг, как и молоко других млекопитающих, кроме человека, содержит только олигосахариды типа II, тогда как молоко или молозиво шимпанзе, бонобо и орангутана содержат как тип I, так и тип II, но олигосахариды типа II преобладают над типом I.Эти результаты показывают, что преобладание олигосахаридов типа I в молоке / молозиве является особенностью, специфичной для людей, и предполагают, что приобретение этого преобладания могло иметь селективное преимущество для людей по сравнению с бифидофлорой у их младенцев.
Однако молоко или молозиво почти всех млекопитающих, кроме человека, содержит только олигосахариды типа II, которые содержат N -ацетиллактозамин (Gal (β1-4) GlcNAc). Недавно были изучены молочные олигосахариды видов, которые тесно связаны с людьми, а именно человекообразных обезьян (шимпанзе, бонобо, горилла и орангутан) и более мелких обезьян (сиаманг). Было обнаружено, что молоко горилл и сиаманг, как и молоко других млекопитающих, кроме человека, содержит только олигосахариды типа II, тогда как молоко или молозиво шимпанзе, бонобо и орангутана содержат как тип I, так и тип II, но олигосахариды типа II преобладают над типом I.Эти результаты показывают, что преобладание олигосахаридов типа I в молоке / молозиве является особенностью, специфичной для людей, и предполагают, что приобретение этого преобладания могло иметь селективное преимущество для людей по сравнению с бифидофлорой у их младенцев.
Состав грудного молока и микробиоты фекалий младенцев в течение первых трех месяцев жизни: пилотное исследование
Польза грудного молока для здоровья и развития младенцев хорошо задокументирована 1,8,10,12,17 , 20 . Грудное молоко признано основным источником биоактивных компонентов, включая бактерии, которые могут способствовать колонизации желудочно-кишечного тракта новорожденных, а также развитию и созреванию иммунной системы на важнейших ранних стадиях развития 8,9,10 . Сообщалось о различиях в составе микробиоты детей, находящихся на грудном вскармливании, по сравнению с младенцами, вскармливаемыми смесями, при этом первые страдали меньшей аллергией и желудочно-кишечными инфекциями 3,4 . Таким образом, микробиота младенцев, находящихся на грудном вскармливании, считается золотым стандартом с точки зрения здоровой микробиоты желудочно-кишечного тракта младенцев.Всесторонняя характеристика микробиоты грудного молока жизненно важна для лучшего понимания ее значения и активности в отношении развивающейся микробиоты кишечника младенца и его здоровья.
Грудное молоко признано основным источником биоактивных компонентов, включая бактерии, которые могут способствовать колонизации желудочно-кишечного тракта новорожденных, а также развитию и созреванию иммунной системы на важнейших ранних стадиях развития 8,9,10 . Сообщалось о различиях в составе микробиоты детей, находящихся на грудном вскармливании, по сравнению с младенцами, вскармливаемыми смесями, при этом первые страдали меньшей аллергией и желудочно-кишечными инфекциями 3,4 . Таким образом, микробиота младенцев, находящихся на грудном вскармливании, считается золотым стандартом с точки зрения здоровой микробиоты желудочно-кишечного тракта младенцев.Всесторонняя характеристика микробиоты грудного молока жизненно важна для лучшего понимания ее значения и активности в отношении развивающейся микробиоты кишечника младенца и его здоровья.
В этом исследовании секвенирование Illumina MiSeq показало, что 12 родов; Pseudomonas, Staphylococcus, Streptococcus, Elizabethkingia, Variovorax, Bifidobacterium, Flavobacterium, Lactobacillus, Stenotrophomonas, Brevundimonas, Chryseobacterium и , составляющие лактобактерии Enterobacter , преобладали в молоке большинства женщин, в молоке преобладали лактобактерии Enterobacter . Присутствие и относительная численность остальных 195 родов были уникальными для отдельных матерей и могли изменяться с течением времени. Основная микробиота составляла 81% таксонов, идентифицированных на 1, 3 и 6 неделе, однако к 12 неделе это уменьшилось до 73%, что свидетельствует о том, что выбранная основная микробиота определяет ранние стадии, но индивидуальные таксоны становятся более важными на более поздних стадиях. лактация.
Присутствие и относительная численность остальных 195 родов были уникальными для отдельных матерей и могли изменяться с течением времени. Основная микробиота составляла 81% таксонов, идентифицированных на 1, 3 и 6 неделе, однако к 12 неделе это уменьшилось до 73%, что свидетельствует о том, что выбранная основная микробиота определяет ранние стадии, но индивидуальные таксоны становятся более важными на более поздних стадиях. лактация.
Pseudomonas был зарегистрирован как доминирующий член микробиоты грудного молока в нескольких исследованиях, включая Ward et al ., где он составлял 61% относительной численности в образцах молока, взятых между 9 и 30 днями после родов 14,21,22 . Точно так же Staphylococcus , как было установлено, является частым компонентом микробиоты молока как независимыми, так и зависимыми исследованиями от культуры 11,14,15,21,22,23 . В исследовании шведских младенцев, находящихся на грудном вскармливании, родившихся как через естественные родовые пути, так и после кесарева сечения, 100% детских фекалий были колонизированы Staphylococcus с третьего дня жизни. Эпидермис стафилококка , в частности, по-видимому, имеет биологическое значение, поскольку было показано, что он является преобладающим видом в грудном молоке и фекалиях младенцев, находящихся на грудном вскармливании, и реже встречается в стуле детей, вскармливаемых смесью 11,24, 25 . Роды, ассоциированные с полостью рта, такие как Streptococcus и Veillonella ’, описанные Hunt et al . и Кабрера-Рубио и др. . также преобладали в этом исследовании 14,15 .Хотя ранее в микробиоме грудного молока не сообщалось, Variovorax, штаммов которого были выделены из ротовой полости человека, были последовательно обнаружены во всех образцах 26 .
Эпидермис стафилококка , в частности, по-видимому, имеет биологическое значение, поскольку было показано, что он является преобладающим видом в грудном молоке и фекалиях младенцев, находящихся на грудном вскармливании, и реже встречается в стуле детей, вскармливаемых смесью 11,24, 25 . Роды, ассоциированные с полостью рта, такие как Streptococcus и Veillonella ’, описанные Hunt et al . и Кабрера-Рубио и др. . также преобладали в этом исследовании 14,15 .Хотя ранее в микробиоме грудного молока не сообщалось, Variovorax, штаммов которого были выделены из ротовой полости человека, были последовательно обнаружены во всех образцах 26 .
Обнаружение большой доли типичных обитателей кожи и микробиоты полости рта может указывать на то, что в данном случае происхождение — вторичное заражение. Однако здесь и в других исследованиях 15,21 были обнаружены анэробные кишечно-ассоциированные популяции, такие как Bacteroides, Blautia, Faecalibacterium, Ruminococcus, Roseburia, Subdoligranulum, Enterococcus и Escherichia-Shigella . Bifidobacterium также постоянно обнаруживался, что подтверждает выводы Jost et al . И Hunt et al ., Однако Cabrera-Rubio et al . и Уорд и др. . не сообщали о наличии Bifidobacterium. Эти различия, вероятно, связаны с используемым методом экстракции ДНК, поскольку в последних исследованиях не использовался этап взбивания шариков. При сравнении исследований важно отметить, что на различия в составе микробного сообщества также могли повлиять такие факторы, как гипервариабельная область исследуемого гена 16S (мы нацелены на гипервариабельные области V3 – V4 рДНК 16S), географические различия. и большая глубина секвенирования, достигаемая с помощью секвенирования Illumina MiSeq здесь, по сравнению с пиросеквенированием Roche 454, используемым в других исследованиях.Эти факторы, как известно, влияют на оценки разнообразия и богатства и могут сильно влиять на микробиом людей.
Bifidobacterium также постоянно обнаруживался, что подтверждает выводы Jost et al . И Hunt et al ., Однако Cabrera-Rubio et al . и Уорд и др. . не сообщали о наличии Bifidobacterium. Эти различия, вероятно, связаны с используемым методом экстракции ДНК, поскольку в последних исследованиях не использовался этап взбивания шариков. При сравнении исследований важно отметить, что на различия в составе микробного сообщества также могли повлиять такие факторы, как гипервариабельная область исследуемого гена 16S (мы нацелены на гипервариабельные области V3 – V4 рДНК 16S), географические различия. и большая глубина секвенирования, достигаемая с помощью секвенирования Illumina MiSeq здесь, по сравнению с пиросеквенированием Roche 454, используемым в других исследованиях.Эти факторы, как известно, влияют на оценки разнообразия и богатства и могут сильно влиять на микробиом людей.
При рассмотрении микробиоты фекалий младенцев было обнаружено, что она менее разнообразна, чем микробиота грудного молока. Сообщества были наиболее похожи в отношении Staphylococcus , на долю которого приходилась средняя относительная численность 15% и 19% на 1-й неделе в грудном молоке и фекалиях младенцев, соответственно. Ряд обычно ассоциированных с кишечником родов были общими как для грудного молока, так и для детских фекалий, включая Bifidobacterium, Bacteroides, Enterococcus, Lactobacillus, Clostridium, Coprococcus, Escherichia-Shigella и представителей семейства Lachnospiraceae.Интересно, что на эти общие роды приходилось 70–88% от общего числа считываний в образцах фекалий младенцев на протяжении всего периода отбора проб. Это согласуется с другими исследованиями в парах мать-младенец, которые показали, что бактериальный состав фекальной микробиоты грудных детей отражает тот, который обнаружен в грудном молоке 12,24,27,28,29,30 . В этих исследованиях роды Lactobacillus, Staphylococcus, Enterococcus и Bifidobacterium часто использовались совместно с грудным молоком и детскими фекалиями.
Сообщества были наиболее похожи в отношении Staphylococcus , на долю которого приходилась средняя относительная численность 15% и 19% на 1-й неделе в грудном молоке и фекалиях младенцев, соответственно. Ряд обычно ассоциированных с кишечником родов были общими как для грудного молока, так и для детских фекалий, включая Bifidobacterium, Bacteroides, Enterococcus, Lactobacillus, Clostridium, Coprococcus, Escherichia-Shigella и представителей семейства Lachnospiraceae.Интересно, что на эти общие роды приходилось 70–88% от общего числа считываний в образцах фекалий младенцев на протяжении всего периода отбора проб. Это согласуется с другими исследованиями в парах мать-младенец, которые показали, что бактериальный состав фекальной микробиоты грудных детей отражает тот, который обнаружен в грудном молоке 12,24,27,28,29,30 . В этих исследованиях роды Lactobacillus, Staphylococcus, Enterococcus и Bifidobacterium часто использовались совместно с грудным молоком и детскими фекалиями. Jimenez et al . В исследовании с 23 парами мать-младенец идентифицировали Staphylococcus как преобладающий вид в фекалиях грудных и грудных детей 25 . Gronlund et al. . Сообщили, что количество бифидобактерий в материнском грудном молоке влияет на фекалии младенцев Уровни Bifidobacterium 27 . В то время как Jost et al . Идентифицировали ряд ассоциированных с кишечником анаэробных родов, таких как Bifidobacterium, Bacteroides и представители класса Clostridia, общие для молока и детских фекалий 30 .
Jimenez et al . В исследовании с 23 парами мать-младенец идентифицировали Staphylococcus как преобладающий вид в фекалиях грудных и грудных детей 25 . Gronlund et al. . Сообщили, что количество бифидобактерий в материнском грудном молоке влияет на фекалии младенцев Уровни Bifidobacterium 27 . В то время как Jost et al . Идентифицировали ряд ассоциированных с кишечником анаэробных родов, таких как Bifidobacterium, Bacteroides и представители класса Clostridia, общие для молока и детских фекалий 30 .
Более убедительные доказательства вертикальной передачи вируса от матери к ребенку включают идентификацию идентичных штаммов. Lactobacillus и Bifidobacterium часто рассматриваются как представители здоровой микробиоты с преобладанием Bifidobacterium , в частности, характерных для здорового ребенка, находящегося на грудном вскармливании, и поэтому были нацелены на идентификацию штамма. Несмотря на то, что они были обнаружены с помощью секвенирования MiSeq, культивируемые Lactobacillus и Bifidobacterium были обнаружены только в одном образце молока с низким количеством бактерий 3 × 10 3 КОЕ / мл и 1 × 10 2 КОЕ / мл соответственно.Аналогичным образом, Albesharat et al . Не смогли выделить какие-либо бифидобактерии из образцов грудного молока 29 . Неясно, было ли это связано с их низким содержанием в материнском молоке, присутствием антимикробных соединений, продолжительностью хранения образцов до культивирования и, в случае бифидобактерий, их анаэробностью, т.е. жизнеспособностью, но не культивированием. Поскольку при секвенировании MiSeq не делается различий между живыми и мертвыми клетками, также возможно, что мертвые клетки переносятся во время кормления, что, тем не менее, вызывает иммунный ответ.В данном случае интересно то, что эти культивируемые изоляты принадлежали к тому же виду, что и изоляты, выделенные из соответствующих образцов фекалий младенцев, а именно L.
Несмотря на то, что они были обнаружены с помощью секвенирования MiSeq, культивируемые Lactobacillus и Bifidobacterium были обнаружены только в одном образце молока с низким количеством бактерий 3 × 10 3 КОЕ / мл и 1 × 10 2 КОЕ / мл соответственно.Аналогичным образом, Albesharat et al . Не смогли выделить какие-либо бифидобактерии из образцов грудного молока 29 . Неясно, было ли это связано с их низким содержанием в материнском молоке, присутствием антимикробных соединений, продолжительностью хранения образцов до культивирования и, в случае бифидобактерий, их анаэробностью, т.е. жизнеспособностью, но не культивированием. Поскольку при секвенировании MiSeq не делается различий между живыми и мертвыми клетками, также возможно, что мертвые клетки переносятся во время кормления, что, тем не менее, вызывает иммунный ответ.В данном случае интересно то, что эти культивируемые изоляты принадлежали к тому же виду, что и изоляты, выделенные из соответствующих образцов фекалий младенцев, а именно L.![]() plantarum и B. breve . Анализ PFGE подтвердил, что в этой паре мать-ребенок был общий штамм бактерий, что подтверждает идею вертикального переноса через грудное молоко. Другие исследования также выделили те же штаммы Bifidobacterium и Lactobacillus из грудного молока и фекалий младенцев, включая штаммы B.breve и L. plantarum 13,28 .
plantarum и B. breve . Анализ PFGE подтвердил, что в этой паре мать-ребенок был общий штамм бактерий, что подтверждает идею вертикального переноса через грудное молоко. Другие исследования также выделили те же штаммы Bifidobacterium и Lactobacillus из грудного молока и фекалий младенцев, включая штаммы B.breve и L. plantarum 13,28 .
Ограничением этого исследования является относительно небольшой размер выборки, и для подтверждения этих результатов и расширения знаний о микробиоме молока запланированы дальнейшие исследования на более крупных популяциях, включая образцы фекалий матери. Таким образом, наши данные демонстрируют большое разнообразие микробиоты грудного молока, в котором идентифицировано более 207 бактериальных родов. Их относительная численность была уникальной для каждой матери и могла меняться с течением времени.В сочетании с нашим выводом о том, что одни и те же штаммы Bifidobacterium и Lactobacillus были обнаружены в материнском материнском молоке и соответствующих образцах фекалий младенцев, эти результаты позволяют предположить, что существует микробиота, специфичная для каждой пары мать-младенец, которая может дать определенные преимущества. младенец. Это особенно актуально, поскольку имеющиеся в продаже смеси для младенцев и донорское молоко стерилизованы / пастеризованы и, как таковые, содержат мало микробов или совсем не содержат их. Результаты этой работы также подтвердили присутствие микробов, обычно связанных с микробиотой кишечника в образцах молока, предлагая полезные стратегии воздействия на кишечник матери с помощью бактерий, которые могут принести пользу младенцу.Эти данные подчеркивают, что грудное молоко является важным источником широкого спектра бактерий для кишечника младенца и может способствовать его колонизации и, следовательно, здоровью ребенка.
младенец. Это особенно актуально, поскольку имеющиеся в продаже смеси для младенцев и донорское молоко стерилизованы / пастеризованы и, как таковые, содержат мало микробов или совсем не содержат их. Результаты этой работы также подтвердили присутствие микробов, обычно связанных с микробиотой кишечника в образцах молока, предлагая полезные стратегии воздействия на кишечник матери с помощью бактерий, которые могут принести пользу младенцу.Эти данные подчеркивают, что грудное молоко является важным источником широкого спектра бактерий для кишечника младенца и может способствовать его колонизации и, следовательно, здоровью ребенка.
Олигосахариды грудного молока, полученные из грудного молока, способствуют взаимодействию Bifidobacterium в рамках одной экосистемы
О’Нил И., Скофилд З., Холл Л.Дж.. Изучение роли члена микробиоты Bifidobacterium в модулировании иммуно-связанных заболеваний. Emerg Top Life Sci.2017; 1: 333–49.
Google Scholar

Вампах Л., Хайнц-Бушарт А., Фриц Дж. В., Рамиро-Гарсия Дж., Хабье Дж., Герольд М. и др. Режим рождения определяет функции кишечного микробиома и иммуностимулирующий потенциал, обусловленные штаммом на ранней стадии. Nat Commun. 2018; 9: 1–14.
Бэкхед Ф., Росвалл Дж., Пэн Й., Фенг К., Цзя Х., Ковачева-Датчари П. и др. Динамика и стабилизация микробиома кишечника человека в течение первого года жизни.Клеточный микроб-хозяин. 2015; 17: 690–703.
PubMed
Google Scholar
Gomez de Aguero M, Ganal-Vonarburg SC, Fuhrer T., Rupp S, Uchimura Y, Li H, et al. Материнская микробиота способствует раннему постнатальному развитию врожденного иммунитета. Наука. 2016; 351: 1296–302.
PubMed
Google Scholar
Сиван А., Корралес Л., Хуберт Н., Уильямс Дж. Б., Акино-Майклс К., Эрли З. М. и др.Commensal Bifidobacterium способствует противоопухолевому иммунитету и повышает эффективность против PD-L1. Наука. 2015; 350: 1084–9.
Наука. 2015; 350: 1084–9.
CAS
PubMed
PubMed Central
Google Scholar
Оки К., Акияма Т., Мацуда К., Гавад А., Макино Н., Исикава Е. и др. Длительная колонизация более шести лет с раннего детства Bifidobacterium longum subsp. longum в кишечнике человека. BMC Microbiol. 2018; 18: 209.
CAS
PubMed
PubMed Central
Google Scholar
Stachowicz JJ. Мутуализм, содействие и структура экологических сообществ: позитивные взаимодействия играют важную, но недооцененную роль в экологических сообществах, снижая физические или биотические нагрузки в существующих средах обитания и создавая новые среды обитания. Биология. 2013; 51: 235–46.
Google Scholar
Trosvik P, de Muinck EJ. Экология бактерий в желудочно-кишечном тракте человека — идентификация ключевых и основных таксонов. Микробиом. 2015; 3:44.
Микробиом. 2015; 3:44.
PubMed
PubMed Central
Google Scholar
Doare K Le, Holder B, Bassett A, Pannaraj PS. Материнское молоко: целенаправленный вклад в развитие детской микробиоты и иммунитета. Фронт Иммунол. 2018; 9: 1–10.
ВОЗ. Запечатлеть момент. Раннее начало грудного вскармливания: лучшее начало для каждого новорожденного. http://www.who.int/nutrition/publications/infantfeeding/capture-moment-early-initiation-bf/en/2018; 41.
Forbes JD, Azad MB, Vehling L, Tun HM, Konya TB, Guttman DS, et al. Связь воздействия смеси в больнице и последующей практики вскармливания младенцев с микробиотой кишечника и риском избыточного веса в первый год жизни. JAMA Pediatr 2018; 172: 1–11.
Google Scholar
Ly NP, Litonjua A, Gold DR, Celedón JC. Микробиота кишечника, пробиотики и витамин D: взаимосвязанные воздействия, влияющие на аллергию, астму и ожирение? J Allergy Clin Immunol. 2011; 127: 1087–94.
2011; 127: 1087–94.
CAS
PubMed
PubMed Central
Google Scholar
Туррони Ф., Милани С., Дуранти С., Махони Дж., Ван Синдерен Д., Вентура М. Утилизация гликанов и перекрестное кормление бифидобактериями. Trends Microbiol. 2018; 26: 339–50.
CAS
PubMed
Google Scholar
Ninonuevo MR, Park Y, Yin H, Zhang J, Ward RE, Clowers BH, et al.Стратегия аннотирования гликома грудного молока. J. Agric Food Chem. 2006; 54: 7471–80.
CAS
PubMed
Google Scholar
Томсон П., Медина Д.А., Гарридо Д. Олигосахариды грудного молока и бифидобактерии кишечника младенца: молекулярные стратегии их использования. Food Microbiol. 2017; 75: 1–10.
Google Scholar
Ферретти П., Пазолли Э., Тетт А., Асникар Ф., Горфер В., Феди С. и др.Передача микробов от матери к ребенку из разных участков тела формирует развивающийся микробиом кишечника младенца. Клеточный микроб-хозяин. 2018; 24: 133–45.e5.
и др.Передача микробов от матери к ребенку из разных участков тела формирует развивающийся микробиом кишечника младенца. Клеточный микроб-хозяин. 2018; 24: 133–45.e5.
CAS
PubMed
PubMed Central
Google Scholar
Яссур М., Джейсон Э., Хогстром Л.Дж., Артур Т.Д., Трипати С., Сильяндер Х. и др. Штаммовый анализ передачи бактерий от матери ребенку в течение первых нескольких месяцев жизни. Клеточный микроб-хозяин. 2018; 24: 146–54. E4.
CAS
PubMed
PubMed Central
Google Scholar
Села Д.А., Чепмен Дж., Адеуя А., Ким Дж. Х., Чен Ф., Уайтхед Т. Р. и др. Последовательность генома Bifidobacterium longum subsp. Infantis обнаруживает адаптацию к усвоению молока в микробиоме младенца. Proc Natl Acad Sci. 2008; 105: 18964–9.
CAS
PubMed
Google Scholar
Джеймс К. , Мазеруэй М.О., Боттачини Ф., ван Синдерен Д. Bifidobacterium breve UCC2003 метаболизирует олигосахариды грудного молока, лакто-N-тетраозу и лакто-N-нео-тетраозу, через перекрывающиеся, но разные пути. Научный доклад 2016; 6: 38560.
, Мазеруэй М.О., Боттачини Ф., ван Синдерен Д. Bifidobacterium breve UCC2003 метаболизирует олигосахариды грудного молока, лакто-N-тетраозу и лакто-N-нео-тетраозу, через перекрывающиеся, но разные пути. Научный доклад 2016; 6: 38560.
CAS
PubMed
PubMed Central
Google Scholar
Ашида Х., Мияке А., Киёхара М., Вада Дж., Йошида Е., Кумагаи Х. и др. Две различные l-фукозидазы из Bifidobacterium bifidum необходимы для использования фукозилированных олигосахаридов и гликоконъюгатов молока.Гликобиология. 2009; 19: 1010–7.
CAS
PubMed
Google Scholar
Asnicar F, Manara S, Zolfo M, Truong DT, Scholz M, Armanini F, et al. Изучение вертикальной передачи микробиома от матери младенцу с помощью метагеномного профилирования на уровне штаммов. mSystems. 2017; 2: 1–13.
Google Scholar

Барретт Э., Дешпандей А.К., Райан К.А., Демпси Э.М., Мерфи Б., О’Салливан Л. и др.В кишечнике новорожденных обитают различные штаммы бифидобактерий. Arch Dis Child — Fetal Neonatal Ed. 2015; 100: F405–10.
PubMed
Google Scholar
Яцуненко Т., Рей Ф. Э., Манари М. Дж., Трехан И., Домингес-Белло М. Г., Контрерас М. и др. Микробиом кишечника человека в зависимости от возраста и географии. Природа. 2012; 486: 222–7.
CAS
PubMed
PubMed Central
Google Scholar
Turroni F, Peano C, Pass DA, Foroni E, Severgnini M, Claesson MJ и др. Разнообразие бифидобактерий в кишечной микробиоте младенцев. PLoS One. 2012; 7: e36957.
CAS
PubMed
PubMed Central
Google Scholar
Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B и др. Документ о консенсусе экспертов: Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков относительно области применения и надлежащего использования термина пробиотик. Нат Рев Гастроэнтерол Гепатол. 2014; 11: 9.
Нат Рев Гастроэнтерол Гепатол. 2014; 11: 9.
Google Scholar
Milani C, Lugli GA, Duranti S, Turroni F, Bottacini F, Mangifesta M, et al. Геномная энциклопедия типовых штаммов рода Bifidobacterium . Appl Environ Microbiol. 2014; 80: 6290–302.
PubMed
PubMed Central
Google Scholar
Milani C, Lugli GA, Duranti S, Turroni F, Mancabelli L, Ferrario C и др.Бифидобактерии проявляют социальное поведение за счет обмена углеводов в кишечнике. Научный доклад 2015; 5: 15782.
CAS
PubMed
PubMed Central
Google Scholar
Lugli GA, Milani C, Turroni F, Duranti S, Mancabelli L, Mangifesta M, et al. Сравнительный геномный и филогеномный анализ семейства Bifidobacteriaceae. BMC Genomics. 2017; 18: 568.
PubMed
PubMed Central
Google Scholar

Боттачини Ф., Моррисси Р., Эстебан-Торрес М., Джеймс К., ван Брин Дж., Дикарева Е. и др. Сравнительная геномика и ассоциации генотип-фенотип Bifidobacterium breve . Научный доклад 2018; 8: 10633.
PubMed
PubMed Central
Google Scholar
Арболея С., Боттачини Ф., О’Коннелл-Мазервэй М., Райан К.А., Росс Р.П., ван Синдерен Д. и др. Соответствие генов по пангеному Bifidobacterium longum показывает значительное разнообразие в катаболизме углеводов среди человеческих младенцев.BMC Genomics. 2018; 19: 1–16.
Google Scholar
Wu G, Zhang C, Wu H, Wang R, Shen J, Wang L, et al. Геномное микроразнообразие Bifidobacterium pseudocatenulatum, лежащее в основе дифференциальной реакции на уровне штамма на диетическое вмешательство углеводов. MBio. 2017; 8: e02348–16.
CAS
PubMed
PubMed Central
Google Scholar

Milani C, Turroni F, Duranti S, Lugli GA, Mancabelli L, Ferrario C и др.Геномика рода Bifidobacterium обнаруживает видоспецифичную адаптацию к богатой гликанами среде кишечника. Appl Environ Microbiol. 2016; 82: 980–91.
CAS
PubMed
PubMed Central
Google Scholar
Juge N, Tailford L, Owen CD. Сиалидазы кишечных бактерий: мини-обзор. Biochem Soc Trans. 2016; 44: 166–75.
CAS
PubMed
PubMed Central
Google Scholar
Egan M, Motherway MOC, Ventura M, van Sinderen D. Метаболизм сиаловой кислоты с помощью Bifidobacterium breve UCC2003. Appl Environ Microbiol. 2014; 80: 4414–26.
PubMed
PubMed Central
Google Scholar
Гарридо Д., Руис-Мояно С., Лемай Д.Г., Села Д.А., Герман Дж.Б., Миллс Д.А. Сравнительная транскриптомика выявляет ключевые различия в реакции на олигосахариды молока младенческих кишечных бифидобактерий. Научный представитель2015; 5: 13517.
Научный представитель2015; 5: 13517.
PubMed
PubMed Central
Google Scholar
Гарридо Д., Руис-Мояно С., Кирмиз Н., Дэвис Дж. К., Тоттен С. М., Лемей Д. Г. и др. Новый кластер генов позволяет предпочтительно использовать фукозилированные олигосахариды молока в Bifidobacterium longum subsp. longum SC596. Научный отчет 2016; 6: 35045.
CAS
PubMed
PubMed Central
Google Scholar
Нишимото М., Китаока М. Идентификация N-ацетилгексозамин-1-киназы в полном метаболическом пути Lacto-N-Biose I / Galacto-N-Biose в Bifidobacterium longum . Appl Environ Microbiol. 2007. 73: 6444–9.
CAS
PubMed
PubMed Central
Google Scholar
Nishiyama K, Nagai A, Uribayashi K, Yamamoto Y, Mukai T., Okada N. Две внеклеточные сиалидазы из Bifidobacterium bifidum способствуют деградации сиалил-олигосахаридов и поддерживают рост 113 Bifveidobacterium breidobacterium. Анаэроб. 2018; 52: 22–8.
Анаэроб. 2018; 52: 22–8.
CAS
PubMed
Google Scholar
Нишияма К., Ямамото Ю., Сугияма М., Такаки Т., Урасима Т., Фукия С. и др. Bifidobacterium bifidum внеклеточная сиалидаза усиливает адгезию к поверхности слизистой оболочки и поддерживает ассимиляцию углеводов. MBio. 2017; 8: e00928–17.
CAS
PubMed
PubMed Central
Google Scholar
Смиловиц Дж. Т., О’Салливан А., Бариле Д., Герман Дж. Б., Лоннердал Б., Слупский С. М.. Метаболом грудного молока обнаруживает различные профили олигосахаридов. J Nutr. 2013; 143: 1709–18.
CAS
PubMed
PubMed Central
Google Scholar
Ward RE, Niñonuevo M, Mills DA, Lebrilla CB, German JB. Ферментация олигосахаридов грудного молока in vitro с помощью Bifidobacterium infantis и Lactobacillus gasseri .Appl Environ Microbiol. 2006; 72: 4497–9.
2006; 72: 4497–9.
CAS
PubMed
PubMed Central
Google Scholar
Мацуки Т., Яхаги К., Мори Х., Мацумото Х., Хара Т., Таджима С. и др. Ключевой генетический фактор использования фукозиллактозы влияет на развитие микробиоты кишечника младенца. Nat Commun. 2016; 7: 11939.
CAS
PubMed
PubMed Central
Google Scholar
Села Д.А., Гарридо Д., Лерно Л., Ву С., Тан К., Эом Х.-Дж. И др.Bifidobacterium longum subsp. Infantis ATCC 15697 альфа-фукозидазы активны в отношении фукозилированных олигосахаридов грудного молока. Appl Environ Microbiol. 2012; 78: 795–803.
CAS
PubMed
PubMed Central
Google Scholar
Bohari MH, Yu X, Zick Y, Blanchard H. Основанное на структуре обоснование дифференциального распознавания гликосфинголипидов лакто- и неолакто-ряда N-концевым доменом галектина-8 человека. Научный доклад 2016; 6: 1–12.
Научный доклад 2016; 6: 1–12.
Google Scholar
Каллаган А.О., Ван Синдерен Д. Бифидобактерии и их роль в составе микробиоты кишечника человека. Front Microbiol. 2016; 15: 7.
Google Scholar
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB, et al. Различия в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve .Appl Environ Microbiol. 2013; 79: 6040–9.
CAS
PubMed
PubMed Central
Google Scholar
Milani C, Mancabelli L, Lugli GA, Duranti S, Turroni F, Ferrario C и др. Изучение вертикальной передачи бифидобактерий от матери к ребенку. Appl Environ Microbiol. 2015; 81: 7078–87.
CAS
PubMed
PubMed Central
Google Scholar
Като К. , Одамаки Т., Мицуяма Э, Сугахара Х., Сяо Дж.З., Осава Р.Возрастные изменения в составе кишечника Bifidobacterium видов. Curr Microbiol. 2017; 74: 987–95.
, Одамаки Т., Мицуяма Э, Сугахара Х., Сяо Дж.З., Осава Р.Возрастные изменения в составе кишечника Bifidobacterium видов. Curr Microbiol. 2017; 74: 987–95.
CAS
PubMed
PubMed Central
Google Scholar
Нагпал Р., Куракава Т., Цудзи Х., Такахаши Т., Кавасима К., Нагата С. и др. Эволюция популяции кишечника Bifidobacterium у здоровых японских младенцев в течение первых трех лет жизни: количественная оценка. Научный доклад 2017; 7: 1–11.
CAS
Google Scholar
Engfer MB, Stahl B, Finke B, Sawatzki G, Daniel H. Олигосахариды грудного молока устойчивы к ферментативному гидролизу в верхних отделах желудочно-кишечного тракта. Am J Clin Nutr. 2000; 71: 1589–96.
CAS
PubMed
Google Scholar
О’Коннелл Мазервэй М., О’Брайен Ф., О’Дрисколл Т., Кейси П.Г., Шанахан Ф. , ван Синдерен Д. Синтрофия углеводов способствует установлению Bifidobacterium breve UCC2003 в кишечнике новорожденных.Научный доклад 2018; 8: 10627.
, ван Синдерен Д. Синтрофия углеводов способствует установлению Bifidobacterium breve UCC2003 в кишечнике новорожденных.Научный доклад 2018; 8: 10627.
PubMed
PubMed Central
Google Scholar
Schwab C, Ruscheweyh HJ, Bunesova V, Pham VT, Beerenwinkel N, Lacroix C. Трофические взаимодействия детских бифидобактерий и eubacterium hallii во время деградации L-фукозы и фукозиллактозы. Front Microbiol. 2017; 8: 95.
PubMed
PubMed Central
Google Scholar
D’Souza G, Shitut S, Preussger D, Yousif G, Waschina S, Kost C.Экология и эволюция метаболических взаимодействий между бактериями. Nat Prod Rep.2018; 35: 455–88.
PubMed
Google Scholar
Mee MT, Collins JJ, Church GM, Wang HH. Синтрофный обмен в синтетических микробных сообществах. Proc Natl Acad Sci. 2014; 111: E2149–56.
CAS
PubMed
Google Scholar
Пачеко А.Р., Моэль М., Сегре Д. Незатратные метаболические выделения как движущие силы межвидовых взаимодействий в микробных экосистемах.Nat Commun. 2019; 10: 103.
PubMed
PubMed Central
Google Scholar
Smith NW, Shorten PR, Altermann E, Roy NC, McNabb WC. Классификация и эволюция бактериального перекрестного вскармливания. Передняя часть Ecol Evol. 2019; 7: 1–15.
Google Scholar
Fanning S, Hall LJ, Cronin M, Zomer A, MacSharry J, Goulding D, et al. Поверхностный экзополисахарид бифидобактерий способствует взаимодействию комменсала с хозяином посредством иммуномодуляции и защиты от патогенов.Proc Natl Acad Sci. 2012; 109: 2108–13.
CAS
PubMed
Google Scholar
Алкон-Гинер С. , Далби М., Кайм С., Кецкемети Дж., Шоу А., Сим К. и др. Добавление микробиоты Bifidobacterium и Lactobacillus изменяет микробиоту и метаболом кишечника недоношенных детей. 2019. [Препринт] bioRxiv. https://doi.org/10.1101/698092.
, Далби М., Кайм С., Кецкемети Дж., Шоу А., Сим К. и др. Добавление микробиоты Bifidobacterium и Lactobacillus изменяет микробиоту и метаболом кишечника недоношенных детей. 2019. [Препринт] bioRxiv. https://doi.org/10.1101/698092.
Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T., Yarza P, et al.Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты. Nucleic Acids Res. 2013; 41: 590–6.
Google Scholar
Альтшул С.Ф., Мэдден Т.Л., Шеффер А.А., Чжан Дж., Чжан З., Миллер В. и др. Gapped BLAST и PSI-BLAST: новое поколение программ поиска по базам данных белков. Nucleic Acids Res. 1997; 25: 3389–402.
CAS
PubMed
PubMed Central
Google Scholar
Хусон Д., Митра С., Рушевей Х. Интегративный анализ экологических последовательностей с использованием MEGAN4. Genome Res. 2011; 21: 1552–60.
CAS
PubMed
PubMed Central
Google Scholar

Page AJ, De Silva N, Hunt M, Quail MA, Parkhill J, Harris SR, et al. Надежный высокопроизводительный конвейер сборки и улучшения prokaryote de novo для данных Illumina. Микрогеномика. 2016; 2: e000083.
Google Scholar
Geer LY, Marchler-Bauer A, Geer RC, Han L, He J, He S и др. База данных NCBI BioSystems. Nucleic Acids Res. 2010. 38: D492–6.
CAS
PubMed
Google Scholar
Seemann T. Prokka: быстрая аннотация генома прокариот. Биоинформатика. 2014; 30: 2068–9.
CAS
PubMed
Google Scholar
Пейдж AJ, Cummins CA, Hunt M, Wong VK, Reuter S, Holden MTG и др.Roary: быстрый крупномасштабный анализ генома прокариот. Биоинформатика. 2015; 31: 3691–3.
CAS
PubMed
PubMed Central
Google Scholar
Katoh K, Standley DM. Программное обеспечение MAFFT для множественного выравнивания последовательностей, версия 7: улучшения производительности и удобства использования. Mol Biol Evol. 2013; 30: 772–80.
Программное обеспечение MAFFT для множественного выравнивания последовательностей, версия 7: улучшения производительности и удобства использования. Mol Biol Evol. 2013; 30: 772–80.
CAS
PubMed
PubMed Central
Google Scholar
Castresana J. Выбор консервативных блоков из нескольких выравниваний для их использования в филогенетическом анализе. Mol Biol Evol. 2000; 17: 540–52.
CAS
PubMed
Google Scholar
Talavera G, Castresana J. Улучшение филогении после удаления расходящихся и неоднозначно выровненных блоков из выравнивания последовательностей белков. Syst Biol. 2007; 56: 564–77.
CAS
PubMed
Google Scholar
Gouy M, Guindon S, Gascuel O. Вид на море, версия 4: мультиплатформенный графический пользовательский интерфейс для выравнивания последовательностей и построения филогенетического дерева. Mol Biol Evol. 2010; 27: 221–4.
Mol Biol Evol. 2010; 27: 221–4.
CAS
PubMed
Google Scholar
Гуиндон С., Дюфаярд Дж. Ф., Лефорт В., Анисимова М., Хордийк В., Гаскуэль О. Новые алгоритмы и методы для оценки филогении максимального правдоподобия: оценка производительности PhyML 3.0. Syst Biol. 2010; 59: 307–21.
CAS
PubMed
Google Scholar
Причард Л., Гловер Р. Х., Хамфрис С., Эльфинстон Дж. Г., Тот И. К.. Геномика и таксономия в диагностике продовольственной безопасности: энтеробактериальные патогены растений с мягким гниением. Анальные методы. 2016; 8: 12–24.
Google Scholar
Huerta-Cepas J, Forslund K, Coelho LP, Szklarczyk D, Jensen LJ, Von Mering C, et al. Быстрая функциональная аннотация по всему геному через назначение ортологии с помощью eggNOG-mapper.Mol Biol Evol. 2017; 34: 2115–22.
CAS
PubMed
PubMed Central
Google Scholar

Huerta-Cepas J, Szklarczyk D, Forslund K, Cook H, Heller D, Walter MC, et al. EGGNOG 4.5: иерархическая структура ортологии с улучшенными функциональными аннотациями для эукариотических, прокариотических и вирусных последовательностей. Nucleic Acids Res. 2016; 44: D286–93.
CAS
PubMed
Google Scholar
Yin Y, Mao X, Yang J, Chen X, Mao F, Xu Y. DbCAN: веб-ресурс для автоматической аннотации углеводно-активных ферментов. Nucleic Acids Res. 2012; 40: 445–51.
Google Scholar
Арндт Д., Грант Дж. Р., Марку А., Саджед Т., Пон А., Лян И. и др. PHASTER: улучшенная и быстрая версия инструмента поиска фагов PHAST. Nucleic Acids Res. 2016; 44: W16–21.
CAS
PubMed
PubMed Central
Google Scholar
Чжоу Y, Лян Y, Линч К. Х., Деннис Дж. Дж., Уишарт Д. С.. PHAST: инструмент быстрого поиска фагов.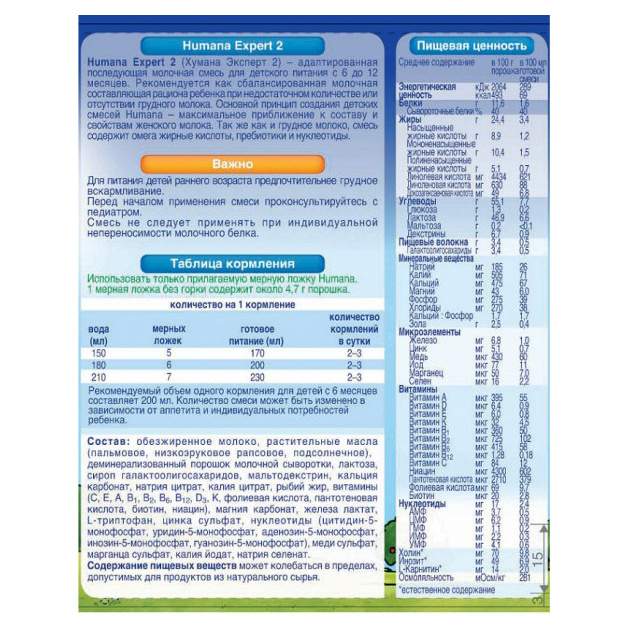 Nucleic Acids Res. 2011; 39: W347–52.
Nucleic Acids Res. 2011; 39: W347–52.
CAS
PubMed
PubMed Central
Google Scholar
de Vos MGJ, Zagorski M, McNally A, Bollenbach T. Сети взаимодействия, экологическая стабильность и коллективная толерантность к антибиотикам при полимикробных инфекциях. Proc Natl Acad Sci. 2017; 114: 201713372.
Google Scholar
Возрастные изменения в составе видов кишечных бифидобактерий
Avershina E, Lundgård K, Sekelja M, Dotterud C, Storrø O, Øien T, Johnsen R, Rudi K (2016) Переход от микробиоты кишечника, подобной младенческой, к взрослой. Environ Microbiol 18: 2226–2236. DOI: 10.1111 / 1462-2920.13248
CAS
Статья
PubMed
Google Scholar
Avershina E, Storrø O, Øien T, Johnsen R, Wilson R, Egeland T, Rudi K (2013) Сети сукцессии и корреляции бифидобактерий в большой невыбранной когорте матерей и их детей. Appl Environ Microbiol 79: 497–507. DOI: 10.1128 / AEM.02359-12
Appl Environ Microbiol 79: 497–507. DOI: 10.1128 / AEM.02359-12
CAS
Статья
PubMed
PubMed Central
Google Scholar
Конлон М.А., Берд А.Р. (2015) Влияние диеты и образа жизни на микробиоту кишечника и здоровье человека. Питательные вещества 7: 17–44. DOI: 10.3390 / nu7010017
Артикул
Google Scholar
Di Gioia D, Aloisio I, Mazzola G, Biavati B (2014) Бифидобактерии: их влияние на состав микробиоты кишечника и их применение в качестве пробиотиков у младенцев.Appl Microbiol Biotechnol 98: 563–577. DOI: 10.1007 / s00253-013-5405-9
Артикул
PubMed
Google Scholar
Иган М., О’Коннелл Мазервэй М., Вентура М., ван Синдерен Д. (2014) Метаболизм сиаловой кислоты с помощью Bifidobacterium breve UCC2003. Appl Environ Microbiol 80: 4414–4426. DOI: 10.1128 / AEM.01114-14
Appl Environ Microbiol 80: 4414–4426. DOI: 10.1128 / AEM.01114-14
Артикул
PubMed
PubMed Central
Google Scholar
Fanning S, Hall LJ, Cronin M, Zomera A, MacSharrya J, Gouldingd D, O’Connell Motherway M, Shanahana F, Nallya K, Dougand G, van Sinderena D (2012) Поверхностный экзополисахарид бифидобактерий способствует взаимодействию комменсалов с хозяином через иммуномодуляция и защита от патогенов. Proc Natl Acad Sci USA 109: 2108–2113. DOI: 10.1073 / pnas.1115621109
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ferrario C, Milani C, Mancabelli L, Lugli GA, Duranti S, Mangifesta M, Viappiani A, Turroni F, Margolles A, Ruas-Madiedo P, van Sinderen D, Ventura M (2016) Модуляция эпсомной транскрипции бифидобактерии путем моделирования кишечной среды человека. FEMS Microbiol Ecol. DOI: 10.1093 / femsec / fiw056
DOI: 10.1093 / femsec / fiw056
Google Scholar
Gavini F, Cayuela C, Antoine JM, Lecoq C, Lefebvre B, Membré J, Neut C (2001) Различия в распределении бифидобактериальных и энтеробактериальных видов в фекальной микрофлоре человека трех разных типов (дети, взрослые, пожилые) возрастные группы.Microb Ecol Health D 13: 40–45. DOI: 10.1080 / 08
Артикул
Google Scholar
Hao Y, Huang D, Guo H, Xiao M, An H, Zhao L, Zuo F, Zhang B, Hu S, Song S, Chen S, Ren F (2011) Полная последовательность генома Bifidobacterium longum subsp. longum BBMN68, новый штамм здорового китайского долгожителя. J Bacteriol 193: 787–788. DOI: 10.1128 / JB.01213-10
CAS
Статья
PubMed
Google Scholar
Hopkins MJ, Sharp R, Macfarlane GT (2001) Возрастные и связанные с заболеванием изменения в популяциях кишечных бактерий, оцененные по культуре клеток, содержанию 16S рРНК и профилям жирных кислот в клетках сообщества. Кишечник 48: 198–205. DOI: 10.1136 / gut.48.2.198
Кишечник 48: 198–205. DOI: 10.1136 / gut.48.2.198
CAS
Статья
PubMed
PubMed Central
Google Scholar
Kim BJ, Kim H-Y, Yun Y-J, Kim BJ, Kook YH (2010) Дифференциация видов Bifidobacterium с использованием последовательностей гена частичной {бета} -субъединицы РНК-полимеразы (rpoB).Int J Syst Evol Microbiol 60: 2697–2704. DOI: 10.1099 / ijs.0.020339-0
Артикул
PubMed
Google Scholar
Leahy SC, Higgins DG, Fitzgerald GF, Van Sinderen D (2005) Улучшение с помощью бифидобактерий. J Appl Microbiol 98: 1303–1315. DOI: 10.1111 / j.1365-2672.2005.02600.x
CAS
Статья
PubMed
Google Scholar
Liu S, Zhao L, Ren F, Sun E, Zhang M, Guo H (2015) Полная последовательность генома Bifidobacterium adolesentis BBMN23, пробиотического штамма от здорового долгожителя. J Biotechnol 198: 44–45. DOI: 10.1016 / j.jbiotec.2015.02.003
J Biotechnol 198: 44–45. DOI: 10.1016 / j.jbiotec.2015.02.003
CAS
Статья
PubMed
Google Scholar
Макино Х., Кусиро А., Исикава Э. и др. (2011) Передача кишечных Bifidobacterium longum subsp. longum от матери к ребенку, определенная с помощью мультилокусного секвенирования и полиморфизма длины амплифицированных фрагментов.Appl Environ Microbiol 77: 6788–6793. DOI: 10.1128 / AEM.05346-11
CAS
Статья
PubMed
PubMed Central
Google Scholar
Мацуки Т., Ватанабе К., Фудзимото Дж., Кадо Ю., Такада Т., Мацумото К., Танака Р. (2004) Количественная ПЦР с видоспецифичными праймерами, нацеленными на ген 16S рРНК, для анализа кишечных бифидобактерий человека. Appl Environ Microbiol 70: 167–173. DOI: 10.1128 / AEM.70.1.167
CAS
Статья
PubMed
PubMed Central
Google Scholar

Matsuki T, Watanabe K, Tanaka R, Fukuda M, Oyaizu H (1999) Распределение видов бифидобактерий в микрофлоре кишечника человека, исследованной с помощью видоспецифичных праймеров, нацеленных на ген 16S рРНК. Appl Environ Microbiol 65: 4506–4512
CAS
PubMed
PubMed Central
Google Scholar
Мацуки Т., Ватанабе К., Танака Р., Ойадзу Х. (1998) Быстрая идентификация кишечных бифидобактерий человека с помощью праймеров, нацеленных на 16S рРНК, видоспецифичных и групповых.FEMS Microbiol, октябрь 167: 113–121
CAS
Статья
Google Scholar
Mattarelli P, Bonaparte C, Pot B, Biavati B (2008) Предложение реклассифицировать три биотипа Bifidobacterium longum как три подвида: Bifidobacterium longum subsp. longum subsp. nov., Bifidobacterium longum subsp. infantis комб. ноя и Bifidobacterium longum subsp. suis комб. ноя Int J Syst Evol Microbiol 58: 767–772. DOI: 10.1099 / ijs.0.65319-0
suis комб. ноя Int J Syst Evol Microbiol 58: 767–772. DOI: 10.1099 / ijs.0.65319-0
CAS
Статья
PubMed
Google Scholar
Milani C, Duranti S, Lugli GA, Bottacini F, Strati F, Arioli S, Foroni E, Turroni F, van Sinderen D, Ventura M (2013) Сравнительная геномика Bifidobacterium animalis subsp. lactis показывает строгий монофилетический таксон бифидобактерий.Appl Environ Microbiol 79: 4304–4315. DOI: 10.1128 / AEM.00984-13
CAS
Статья
PubMed
PubMed Central
Google Scholar
Milani C, Lugli GA, Duranti S, Turroni F, Mancabelli L, Ferrario C, Mangifesta M, Hevia A, Viappiani A, Scholz M, Arioli S, Sanchez B, Lane J, Ward DV, Hickey R , Мора Д., Сегата Н., Марголлес А., ван Синдерен Д., Вентура М. (2015) Бифидобактерии проявляют социальное поведение за счет обмена углеводными ресурсами в кишечнике. Sci Rep 5: 15782. DOI: 10.1038 / srep15782
Sci Rep 5: 15782. DOI: 10.1038 / srep15782
CAS
Статья
PubMed
PubMed Central
Google Scholar
Мицуока Т. (2005) Исследование микробиоты человека — настоящее и будущее. J Intest Microbiol 19: 179–192
Google Scholar
Мицуока Т. (2014) Создание кишечной бактериологии. Микробиота Biosci, пища Heal 33: 99–116.DOI: 10.12938 / bmfh.33.99
Артикул
Google Scholar
O’Callaghan A, Bottacini F, O’Connell Motherway M, van Sinderen D (2015) Анализ пангенома Bifidobacterium longum и сайт-направленный мутагенез путем обхода систем рестрикции-модификации. BMC Genomics 16: 832. DOI: 10.1186 / s12864-015-1968-4
Артикул
PubMed
PubMed Central
Google Scholar

Odamaki T, Horigome A, Sugahara H, Hashikura N, Minami J, Xiao JZ, Abe F (2015) Сравнительная геномика выявила генетическое разнообразие и различия на уровне видов / штаммов в метаболизме углеводов трех видов пробиотических бифидобактерий. Int J Genomics 2015: 567809. DOI: 10.1155 / 2015/567809
Артикул
PubMed
PubMed Central
Google Scholar
Odamaki T, Kato K, Sugahara H, Hashikura N, Takahashi S, Xiao JZ, Abe F, Osawa R (2016) Возрастные изменения в составе микробиоты кишечника от новорожденного к столетнему: перекрестное исследование .BMC Microbiol 16:90. DOI: 10.1186 / s12866-016-0708-5
Артикул
PubMed
PubMed Central
Google Scholar
Odamaki T, Sugahara H, Yonezawa S, Yaeshima T, Iwatsuki K, Tanabe S, Tominaga T, Togashi H, Benno Y, Xiao JZ (2012) Эффект перорального приема йогурта, содержащего Bifidobacterium longum BB536 о количестве клеток энтеротоксигенного Bacteroides fragilis в микробиоте. Анаэроб 18: 14–18. DOI: 10.1016 / j.anaerobe.2011.11.004
Анаэроб 18: 14–18. DOI: 10.1016 / j.anaerobe.2011.11.004
Артикул
PubMed
Google Scholar
Ottman N, Smidt H, de Vos WM, Belzer C (2012) Функция нашей микробиоты: кто там и что они делают? Front Cell Infect Microbiol 2: 104. DOI: 10.3389 / fcimb.2012.00104
Артикул
PubMed
PubMed Central
Google Scholar
Ouwehand AC, Bergsma N, Parhiala R, Lahtinen S, Gueimonde M, Finne-Soveri H, Strandberg T., Pitkälä K, Salminen S (2008) Микробиота бифидобактерий и параметры иммунной функции у пожилых людей. FEMS Immunol Med Microbiol 53: 18–25. DOI: 10.1111 / j.1574-695X.2008.00392.x
CAS
Статья
PubMed
Google Scholar
Sakata S, Kitahara M, Sakamoto M, Hayashi H, Fukuyama M, Benno Y (2002) Объединение Bifidobacterium infantis и Bifidobacterium suis как Bifidobacterium longum . Int J Syst Evol Microbiol, 52 ноября: 1945–1951
Int J Syst Evol Microbiol, 52 ноября: 1945–1951
CAS
Google Scholar
Sheu SJ, Hwang WZ, Chiang YC, Lin WH, Chen HC, Tsen HY (2010) Использование праймеров на основе гена tuf для ПЦР-обнаружения пробиотических видов Bifidobacterium и подсчета бифидобактерий в ферментированном молоке культурными и количественными методами ПЦР в реальном времени. J Food Sci, октябрь doi: 10.1111 / j.1750-3841.2010.01816.x
Google Scholar
Тамура К., Стечер Г., Петерсон Д., Филипски А., Кумар С. (2013) MEGA6: молекулярно-эволюционный генетический анализ, версия 6.0. Mol Biol Evol 30 (12): 2725–2729. DOI: 10.1093 / molbev / mst197
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tannock GW, Lawley B, Munro K, Gowri Pathmanathan S, Zhou SJ, Makrides M, Gibson RA, Sullivan T, Prosser CG, Lowry D, Hodgkinson AJ (2013) Сравнение составов микробиот стула младенцев, которых кормили смесью из козьего молока, смесью на основе коровьего молока или грудным молоком. Appl Environ Microbiol 79: 3040–3048. DOI: 10.1128 / AEM.03910-12
Appl Environ Microbiol 79: 3040–3048. DOI: 10.1128 / AEM.03910-12
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tsuji H, Oozeer R, Matsuda K, Matsuki T, Ohta T, Nomoto K, Tanaka R, Kawashima M, Kawashima K, Nagata S, Yamashiro Y (2012) Молекулярный мониторинг развития кишечной микробиоты в Японские младенцы. Benef Microbes 3: 113–125
CAS
Статья
PubMed
Google Scholar
Turroni F, Bottacini F, Foroni E, Mulder I, Kim JH, Zomer A, Sánchez B, Bidossi A, Ferrarini A, Giubellini V, Delledonne M, Henrissat B, Coutinho P, Oggioni M, Fitzgerald GF, Mills D, Margolles A, Kelly D, van Sinderen D, Ventura M (2010) Анализ генома Bifidobacterium bifidum PRL2010 показывает метаболические пути для кормления гликанов, полученных от хозяина. Proc Natl Acad Sci USA 107: 19514–19519. DOI: 10.1073 / pnas.1011100107
CAS
Статья
PubMed
PubMed Central
Google Scholar

Turroni F, Foroni E, Pizzetti P, Giubellini V, Ribbera A, Merusi P, Cagnasso P, Bizzarri B, de Angelis GL et al (2009) Изучение разнообразия популяции бифидобактерий в кишечном тракте человека. Appl Environ Microbiol 75: 1534–1545. DOI: 10.1128 / AEM.02216-08
CAS
Статья
PubMed
PubMed Central
Google Scholar
Underwood MA, German JB, Lebrilla CB, Mills DA (2015) Bifidobacterium longum подвид infantis : чемпион по колонизации кишечника младенцев.Pediatr Res 77: 229–235. DOI: 10.1038 / pr.2014.156
CAS
PubMed
Google Scholar
Ventura M, Reniero R, Zink R (2001) Специфическая идентификация и целенаправленная характеристика Bifidobacterium lactis из различных экологических изолятов с помощью комбинированного подхода мультиплексной ПЦР. Appl Environ Microbiol 67: 2760–2765. DOI: 10.1128 / AEM.67.6.2760-2765.2001
DOI: 10.1128 / AEM.67.6.2760-2765.2001
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ventura M, Turroni F, Zomer A, Foroni E, Giubellini V, Bottacini F, Canchaya C, Claesson MJ, He F, Mantzourani M, Mulas L, Ferrarini A, Gao B, Delledonne M, Henrissat B, Coutinho P, Oggioni M, Gupta RS, Zhang Z, Beighton D (2009) Последовательность генома Bifidobacterium dentium Bd1 отражает его генетическую адаптацию к ротовой полости человека. PLoS Genet 5: e1000785. DOI: 10.1371 / journal.pgen.1000785
Артикул
PubMed
PubMed Central
Google Scholar
Wang F, Huang G, Cai D, Li D, Liang X, Yu T, Shen P, Su H, Liu J, Gu H, Zhao M, Li Q (2015) Качественный и полуколичественный анализ фекалий Bifidobacterium видов в долгожители, проживающие в Баме, Гуанси, Китай. Curr Microbiol 71: 143–149. DOI: 10.1007 / s00284-015-0804-z
DOI: 10.1007 / s00284-015-0804-z
CAS
Статья
PubMed
Google Scholar
Woodmansey EJ (2007) Кишечные бактерии и старение.J Appl Microbiol 102: 1178–1186. DOI: 10.1111 / j.1365-2672.2007.03400.x
CAS
Статья
PubMed
Google Scholar
Woodmansey EJ, McMurdo ME, Macfarlane GT, Macfarlane S (2004) Сравнение составов и метаболической активности фекальных микробиот у молодых людей и у пожилых людей, лечившихся и не принимавших антибиотики. Appl Environ Microbiol 70: 6113–6122. DOI: 10.1128 / AEM.70.10.6113-6122.2004
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ямада К., Гото А., Саканака М. и др. (2017) Молекулярное понимание эволюции симбиоза между грудными младенцами и членом микробиома кишечника человека Bifidobacterium longum . Cell Chem Biol. DOI: 10.1016 / j.chembiol.2017.03.012
Cell Chem Biol. DOI: 10.1016 / j.chembiol.2017.03.012
PubMed
Google Scholar
Ян Х, Лю А., Чжан М., Ибрагим С.А., Панг З., Ленг Х, Рен Ф (2009) Пероральное введение живых субштаммов Bifidobacterium , выделенных из долгожителей, усиливает функцию кишечника у мышей. Curr Microbiol 59: 439–445. DOI: 10.1007 / s00284-009-9457-0
CAS
Статья
PubMed
Google Scholar
Яцуненко Т., Рей Ф.Е., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М., Идальго Г., Балдассано Р.Н., Анохин А.П., Хит А.С., Уорнер Б. Caporaso JG, Lozupone CA, Lauber C, Clemente JC, Knights D, Knight R (2012) Микробиом кишечника человека в зависимости от возраста и географии.Природа 486: 222–227. DOI: 10.1038 / nature11053
CAS
PubMed
PubMed Central
Google Scholar
Микробиом детского кишечника и пробиотики, которые работают
Осенью 2018 года группа исследователей из Института науки Вейцмана в Израиле опубликовала данные о том, что коктейль из 11 штаммов Lactobacillus и Bifidobacterium имеет минимальное немедленное воздействие. воздействие и отсутствие длительного воздействия на состав кишечного микробиома мышей или людей.Фактически, пробиотические бактерии не были обнаружены ни у одного из четырнадцати взрослых участников после прекращения приема добавок.
воздействие и отсутствие длительного воздействия на состав кишечного микробиома мышей или людей.Фактически, пробиотические бактерии не были обнаружены ни у одного из четырнадцати взрослых участников после прекращения приема добавок.
Эти недавние открытия получили довольно много внимания в прессе и усилили мнение общественности о том, что пробиотики — живые микроорганизмы, которые, как предполагается, приносят пользу человеческому хозяину, — не работают. Десятилетия исследований показали, что большинство пробиотиков не способны колонизировать кишечник человека и не оказывать ему длительного воздействия. Некоторые критики даже предположили, что пробиотики не могут быть многообещающим средством лечения болезней или иного улучшения здоровья и благополучия.Но мы подумали: «Не выбрасывайте ребенка вместе с водой из ванны — наша работа показывает, что правильный пробиотик может работать в кишечнике младенца». Результаты, опубликованные нами в 2017 году, показали, что кормление грудных детей пробиотиком, который включал в себя определенный штамм Bifidobacterium longum подвид infantis ( B. infantis EVC001), приводило к 10-миллионному увеличению в среднем уровней фекалий B. infantis. . Этот уровень сохранялся в течение одного месяца после приема добавки и оставался повышенным в течение одного года после лечения.
infantis EVC001), приводило к 10-миллионному увеличению в среднем уровней фекалий B. infantis. . Этот уровень сохранялся в течение одного месяца после приема добавки и оставался повышенным в течение одного года после лечения.
Чтобы понять, почему микробиом кишечника младенца так сильно изменился за последнее столетие, мы попытались понять, как формируется микробиом кишечника младенца.
Колонизация кишечника младенца B. infantis имела защитные эффекты, такие как снижение уровней потенциальных кишечных патогенов и фекального эндотоксина, компонента внешней мембраны грамотрицательных организмов, вызывающих воспаление. Мы также обнаружили, что у младенцев, получавших пробиотик B. infantis , уменьшилось воспаление кишечника по сравнению с младенцами на грудном вскармливании, которые не получали пробиотик.Микробиомы кишечника младенцев, получавших B. infantis , содержали меньше генов устойчивости к антибиотикам — признак меньшего количества патогенов — и демонстрировали меньшую деградацию муцина, гликопротеина, секретируемого кишечным эпителием, который защищает эпителиальные клетки от прямого контакта с кишечными микробами. Эти данные подтверждают более ранние выводы Марка Андервуда и его коллег из Калифорнийского университета в Дэвисе. В 2013 году команда Андервуда показала, что при кормлении недоношенных детей другой штамм, B.Infantis ATCC15697, привело к большему увеличению фекальных Bifidobacterium и снижению уровней потенциальных патогенов по сравнению с младенцами, получавшими пробиотик, содержащий B. lactis .
Эти данные подтверждают более ранние выводы Марка Андервуда и его коллег из Калифорнийского университета в Дэвисе. В 2013 году команда Андервуда показала, что при кормлении недоношенных детей другой штамм, B.Infantis ATCC15697, привело к большему увеличению фекальных Bifidobacterium и снижению уровней потенциальных патогенов по сравнению с младенцами, получавшими пробиотик, содержащий B. lactis .
В то время как научное сообщество и общественность неоднократно сталкивались с неоднократными выводами о том, что пробиотические добавки, принимаемые взрослыми, не всегда эффективно колонизируют кишечник или приносят пользу, теперь у нас есть убедительные доказательства того, что микробиомы кишечника детей невероятно хорошо реагируют на определенные штаммы B .Infantis . Вопрос был в том, почему.
Происхождение микробиома
Подсказки о микробиоме младенцев можно найти в статьях столетней давности о комменсальных бактериях в детских фекалиях. У. Р. Логан, клинический патолог из исследовательской лаборатории Королевского колледжа врачей в Эдинбурге, был первым, кто 100 лет назад сообщил, что бактерии в фекальных мазках младенцев, находящихся на грудном вскармливании, представляют собой почти монокультуру Bacillus bifidus , которая является сегодня известен как род Bifidobacterium .В отличие от этого, мазки фекалий младенцев, вскармливаемых искусственными смесями того времени, содержали множество бактерий, в том числе относительно небольшое количество Bifidobacterium , что больше похоже на микробное разнообразие, обнаруживаемое у современных младенцев, вскармливаемых грудью.
У. Р. Логан, клинический патолог из исследовательской лаборатории Королевского колледжа врачей в Эдинбурге, был первым, кто 100 лет назад сообщил, что бактерии в фекальных мазках младенцев, находящихся на грудном вскармливании, представляют собой почти монокультуру Bacillus bifidus , которая является сегодня известен как род Bifidobacterium .В отличие от этого, мазки фекалий младенцев, вскармливаемых искусственными смесями того времени, содержали множество бактерий, в том числе относительно небольшое количество Bifidobacterium , что больше похоже на микробное разнообразие, обнаруживаемое у современных младенцев, вскармливаемых грудью.
Эти поразительные изменения в составе микробиома кишечника, наблюдавшиеся за последнее столетие, согласовывались с нашим недавним открытием, что pH кала у младенцев на грудном вскармливании резко увеличился с pH 5,0 до 6,5 за последние 100 лет, что связано с очевидной потерей из поколения в поколение Bifidobacterium и сопутствующее увеличение числа потенциальных патогенов.Снижение уровня Bifidobacterium в микробиоме кишечника младенцев, находящихся на грудном вскармливании, вероятно, является непреднамеренным последствием медицинской практики, которая может спасти жизни, но не поддерживает рост Bifidobacterium . Такая медицинская практика включает лечение антибиотиками, к которым чувствительны Bifidobacterium ; детская смесь, не содержащая того питания, которое требуется бактериям; и большее количество родов путем кесарева сечения, которые обходят путь передачи бактерии от матери к ребенку.Эти медицинские практики связаны с повышенным риском аллергических и аутоиммунных заболеваний, распространенных в странах, богатых природными ресурсами. Предполагается, что снижение уровня Bifidobacterium и увеличение количества провоспалительных микробов в раннем младенчестве происходит во время критического периода развития иммунной системы и, таким образом, может повышать риск иммунных заболеваний в более позднем возрасте.
Чтобы понять, почему микробиом кишечника младенца так сильно изменился за последнее столетие, мы попытались понять, как формируется это сообщество.Колонизация кишечного микробиома младенца начинается при родах с контакта с материнскими микробами — в основном вагинальными и фекальными микробами у младенцев, рожденных естественным путем, или преимущественно микробами из кожи, рта и окружающей среды у младенцев, рожденных путем кесарева сечения. После рождения младенцы подвергаются бомбардировке огромным количеством микробов, встречающихся в окружающей среде, в том числе в грудном молоке, но виды, которые становятся прочными членами микробного сообщества, часто передаются матерями младенцев через физический контакт.
Дети продолжают приобретать виды кишечного микробиома от своих матерей и других членов общества в раннем возрасте. Это контрастирует с микробиомом кишечника взрослого человека, который стабилен и сопротивляется изменениям в значительной степени потому, что доступное пространство и пища уже используются установленными микробами — экологические ниши просто заняты в кишечнике взрослого человека. Таким образом, логично, что пробиотик имеет больше шансов сохраниться в кишечнике младенца, где он сталкивается с меньшей конкуренцией, и, следовательно, с большей вероятностью будет иметь пищу, которую он может потреблять, и место, где он может расти.Пробиотик служит для младенца еще одним источником контакта с новыми бактериями.
Осознавая это, мы начали задаваться вопросом: в наших исследованиях, какую экологическую нишу занял B. infantis , что поддерживало его сохранение у младенцев еще долгое время после прекращения приема пробиотиков?
Изменяющийся микробиом младенцаИсторически микробиом кишечника грудного ребенка представлял собой почти монокультуру Bifidobacterium ( J Pathol Bacteriol , 18: 527–51, 1913).Микробиом кишечника младенцев на искусственном вскармливании был намного разнообразнее. Микробиом кишечника детей, вскармливаемых грудью, и микробиом кишечника детей, вскармливаемых искусственными смесями, теперь более похожи на исторический микробиом кишечника детей, вскармливаемых грудным молоком, хотя современные дети, вскармливаемые грудью, имеют больше Bifidobacterium , чем современные дети, вскармливаемые молочными смесями. |
См. Полную инфографику: WEB | PDF
Подготовка к работе
Основным фактором, определяющим, какие бактерии процветают в кишечнике, является доступность их углеводных источников пищи.Таким образом, чтобы пробиотик работал у младенца, микроорганизмы должны быть выбраны таким образом, чтобы источник пищи, который они использовали, наиболее эффективно соответствовал доступному — пища, которая присутствует и еще не потребляется другими бактериями. Мы решили определить, какие углеводы B. infantis потребляет в кишечнике младенца.
Естественно, мы обратились к грудному молоку, которое на протяжении миллионов лет было единственным продуктом питания, способным исключительно питать и защищать младенцев в течение первых шести месяцев жизни.Грудное молоко содержит питательные вещества, а также непитательные биоактивные молекулы, включая углеводы, известные как олигосахариды грудного молока (HMOs). Еще в середине 1900-х годов Пауль Дьёрдь, всемирно известный биохимик, диетолог и педиатр из больницы Пенсильванского университета, и его коллеги по незнанию ссылались на больничные кассы, когда они предполагали существование «бифидного фактора», чего-то уникального в мире. грудное молоко, которым кормили Bifidobacterium . Хотя люди не могут переваривать ОПЗ, оказывается, что Bifidobacterium , особенно B.Infantis , кан. В 2007 году наша группа в Калифорнийском университете в Дэвисе использовала инструменты на основе масс-спектрометрии в сочетании с микробиологией, чтобы показать, что B. infantis поглощает HMO в качестве единственного источника энергии, в то время как другие виды Bifidobacterium потребляют только некоторые HMO в дополнение к растениям. , углеводы животного и хозяйского происхождения.
HMOs представляют собой разнообразный класс сложных углеводных молекул, синтезируемых молочной железой. Имея примерно 200 различных молекулярных видов, они представляют собой третий по распространенности твердый компонент в грудном молоке после лактозы и жира.Поскольку ОПЗ сложны и различаются по структуре, их производство дорого. Современные смеси для младенцев могут содержать одну или две простые структуры HMO, но в меньшей концентрации, чем в грудном молоке. Детским смесям не хватает изобилия и сложности ОПЗ для выборочного кормления полезных кишечных микробов, а также для связывания и нейтрализации патогенных микроорганизмов из кишечника.
Виды бактерий в кишечнике младенца, способные потреблять ОПЗ, можно рассматривать как ориентированный на молоко микробиом (МОМ).Хотя B. infantis , по-видимому, является наиболее эффективным потребителем ОПЗ, другие виды Bifidobacterium , в частности B. breve и B. bifidum , могут потреблять и потребляют некоторые ОПЗ, но также потребляют растения, углеводы животного и хозяйского происхождения. Виды Bifidobacterium , которые колонизируют кишечник, изменяются на протяжении всей жизни в ответ на доступные углеводы в рационе хозяина. Например, B. infantis , B. breve и B.bifidum — это бифидобактерии MOM, которые обычно обнаруживаются в стуле детей, находящихся на исключительно грудном вскармливании, а B. longum и B. adolescentis , которые преимущественно потребляют углеводы растительного и животного происхождения, обычно обнаруживаются в стуле взрослых. Тем не менее, существуют различия и совпадения между видами, присутствующими на разных этапах жизни.
Основным фактором, определяющим, какие бактерии процветают в кишечнике, является доступность их углеводного источника пищи.
Из бифидобактерий MOM, обнаруженных в микробиоме кишечника младенца, разные виды могут иметь разное значение для микробиома.Например, когда мы давали младенцам исключительно грудного вскармливания добавку с пробиотиком B. infantis EVC001, в их кишечнике преобладали представители рода Bifidobacterium — относительная численность кишечного микробиома составляла более 80 процентов, а количество потенциальных патогенов составляло менее 10 процентов сообщества. С другой стороны, микробиомы кишечника младенцев, вскармливаемых исключительно грудью, которым не вводили B. infantis EVC001, имели гораздо более низкие уровни Bifidobacterium , с относительной численностью лишь около 30 процентов, а потенциальные патогены составляли около 40 процентов микробов. в их интуиции, результаты, которые согласуются с предыдущей работой нашей группы и других.Эта почти монокультура Bifidobacterium , по-видимому, вызывалась B. infantis , что составляло около 90 процентов от общего количества Bifidobacterium у младенцев, получавших пробиотик. Напротив, B. longum были преобладающими Bifidobacterium кишечника в контрольной группе, за которыми следовали B. brev e и B. bifidum . Эти данные подчеркивают жизненно важное значение штаммовой специфичности пробиотиков и сочетание присутствия B.Infantis и кормление грудью для поддержания защитной среды кишечника у младенцев.
Чтобы понять, как дополнительный B. infantis может так успешно конкурировать с другими микробами в кишечнике младенца, мы глубоко погрузились в его стратегию кормления. Оказывается, он разборчив в еде, питается исключительно ОПЗ, а когда ОПЗ в изобилии, B. infantis жадно их пожирает. В отличие от других бифидобактерий MOM, B. infantis обладает всеми генами, необходимыми для полной внутренней деградации HMO, и предпочтительно использует HMO по сравнению с любым другим источником углеводов.Другие бифидобактерии MOM, такие как штаммы B. bifidum и B. breve , обладают способностью к росту только с подмножеством ОПЗ. B. infantis , таким образом, имеет конкурентное преимущество, когда грудное молоко составляет весь рацион.
Исследование 2008 года, проведенное коллегами из Калифорнийского университета в Дэвисе и их соавторами, показало, как B. infantis быстро использует HMO: со связывающими белками для захвата HMO из просвета кишечника и переносчиками, которые направляют их в цитоплазму, расщепляя их на моносахариды. которые затем ферментируются в лактат и ацетат короткоцепочечных жирных кислот, которые секретируются из клетки.Эти конечные продукты поддерживают более низкий pH в кишечной среде, поддерживая транспорт этих соединений в эпителий кишечника для использования хозяином и создавая нежелательную среду для потенциальных патогенов. Производство ацетата также блокирует проникновение токсичных молекул, продуцируемых патогенными бактериями, за счет усиления барьерной функции кишечника и ингибирования провоспалительных и апоптотических реакций. Недавние результаты одного исследования in vitro показали, что количество ацетата и лактата, продуцируемого различными видами бифидобактерий, зависит от того, насколько хорошо они потребляют доступные им углеводы.Следовательно, если кормить потребляющим углеводы микробом его предпочтительным углеводом, у него будет больший потенциал для производства большего количества своих защитных конечных продуктов.
Другая причина, по которой B. infantis превосходит другие штаммы бифидобактерий в кишечнике младенцев, вскармливаемых грудью, заключается в том, что все процессы переваривания HMO происходят внутри бактериальной клетки. B. bifidum , с другой стороны, переваривает ОПЗ извне. Это внеклеточное пищеварение высвобождает простые углеводы и может обеспечивать перекрестное питание других видов Bifidobacterium , но также и перекрестное питание и, таким образом, открывает экологическую нишу для других, возможно, менее полезных микробов.Перекрестное кормление микробами разнообразит микробиом кишечника, что в целом считается полезным для взрослых.
Но есть ли преимущество в наличии почти монокультуры Bifidobacterium у младенцев? Задав этот вопрос, мы сосредоточились на развитии иммунной системы.
Молочный микробиомОлигосахариды грудного молока (HMOs) представляют собой сложные углеводы, которые микробные виды молочно-ориентированного микробиома (MOM) могут использовать в качестве источника пищи. Bifidobacterium infantis кодирует множество белков, которые специфически связывают и транспортируют все типы HMO в ее клетку и переваривают их внутри. Другие виды Bifidobacterium переваривают только некоторые ОПЗ, а некоторые делают это извне. Переваривание HMO с помощью MOM Bifidobacterium приводит к выработке лактата и ацетата короткоцепочечных жирных кислот, которые секретируются в просвет кишечника. Эти молекулы снижают pH в кишечной среде, что улучшает их транспорт в эпителий для использования хозяином и создает нежелательную среду для потенциальных патогенов, таких как E.coli . © laurie o’keefe | |
© laurie o’keefe | B. infantis преимущественно потребляет все виды ОПЗ, а не любые другие источники углеводов.
|
© laurie o’keefe | B. bifidum питается только частью ОПЗ.
|
См. Полную инфографику: WEB | PDF
Преимущества
Bifidobacterium
Снижение уровня Bifidobacterium в микробиомах кишечника младенцев и связанное с этим нарушение регуляции микробного сообщества с большим количеством потенциальных патогенов было предложено как один из возможных факторов увеличения числа аутоиммунных заболеваний, которые чума жителей богатых ресурсами стран.И наоборот, обсервационные исследования показали положительные иммунные эффекты наличия в фекальном микробиоме доминирования Bifidobacterium . В двух исследованиях с участием младенцев и детей раннего возраста из Бангладеш, численность кала B. infantis и Bifidobacterium в возрасте двух месяцев сильно коррелировала с улучшением реакции на вакцину в возрасте шести месяцев и двух лет по сравнению с младенцами, не колонизированными B. или с низкой относительной численностью Bifidobacterium .
Кроме того, бифидобактерии с меньшей вероятностью, чем другие микробы, особенно потенциальные патогены, несут и разделяют гены устойчивости к противомикробным препаратам, что может привести к более высокому риску устойчивых к антибиотикам инфекций. В обсервационном исследовании младенцев из Бангладеш и Швеции преобладание кишечной Bifidobacterium было связано со значительным сокращением как количества, так и распространенности генов устойчивости к антибиотикам. Более того, по сравнению с младенцами из контрольной группы, вскармливаемыми грудью, добавка B.infantis EVC001 привел к снижению генов устойчивости к антибиотикам на 90 процентов, что в значительной степени обусловлено снижением уровней Escherichia , Clostridium и Staphylococcus — потенциально патогенных бактерий, которые играют важную роль в эволюции и распространение генов устойчивости к антибиотикам.
В попытке восстановить микробиом кишечника младенцев с преобладанием Bifidobacterium , который был типичным для детей, вскармливаемых грудью 100 лет назад, мы решили провести рандомизированное контролируемое исследование с использованием B.Infantis EVC001 пробиотик. Учитывая, что не все штаммов B. infantis эффективно потребляют все ОПЗ, мы выбрали B. infantis EVC001, потому что мы знали, что этот штамм имеет полную кассету генов, необходимую для полного переваривания всех ОПЗ. Здоровые доношенные младенцы, находящиеся на грудном вскармливании, были рандомизированы для употребления B. infantis EVC001 в течение 21 дня подряд, начиная с 7-го дня после рождения, или для отказа от пробиотика.
ПРОБИОТИК, КОТОРЫЙ КЛЕЙ: электронные микрофотографии образцов младенческих фекалий показывают значительное увеличение количества микробов Bifidobacterium у тех, кто получал пробиотик под названием EVC001 (справа), по сравнению с контрольной группой (слева).
По сравнению с контрольными младенцами, находившимися на грудном вскармливании, которые не получали пробиотик, добавка привела к увеличению в 10000000 раз в среднем уровней фекальных B. infantis и к увеличению фекальных Bifidobacterium на 79 процентов в течение периода приема добавок, и это все еще оставалось верно через месяц после приема добавок. Это означает, что колонизация Bifidobacterium продолжалась без продолжения приема пробиотиков. Кроме того, колонизация B.infantis сохранялся до одного года, если младенцы продолжали потреблять грудное молоко и не подвергались воздействию антибиотиков. Важно отметить, что у младенцев, получавших добавки, наблюдалось 80-процентное снижение количества потенциальных кишечных патогенов, принадлежащих к семействам Enterobacteriaceae и Clostridiaceae , а также снижение содержания эндотоксина в фекалиях. Кроме того, мы наблюдали 2-кратное увеличение содержания лактата и ацетата в кале и 10-кратное снижение pH кала. Микробиомы и биохимия кишечника младенцев с добавками напоминают нормы, соблюдаемые столетие назад.
Мы также нашли некоторые подсказки о последствиях «модернизации» микробиома кишечника. Младенцы, находящиеся на грудном вскармливании с низким уровнем фекалий Bifidobacterium , выделяли в 10 раз больше HMO со стулом в течение двухмесячного периода исследования, чем младенцы, получавшие добавку B. infantis EVC001, что указывает на то, что HMO — третий по содержанию компонент в грудном молоке — были будет тратить впустую. Мы также обнаружили, что младенцы с низким содержанием фекальных Bifidobacterium имели в несколько раз более высокие уровни провоспалительных цитокинов
фекалий по сравнению с младенцами, в кишечных микробиомах которых преобладали Bifidobacterium после приема B.Infantis EVC001.
Взятые вместе, эти данные демонстрируют, что этот конкретный штамм B. infanti s, предоставленный в качестве пробиотика грудным детям, резко колонизировал микробиом кишечника младенца во время и после приема добавок и благотворно реконструировал микробную, биохимическую и иммунологическую среду. в кишечнике младенца. Многие младенцы во всем мире никогда не получают B. infantis , но сочетание грудного вскармливания и приема пробиотиков с этой бактерией, по-видимому, приводит к питательной и защитной среде кишечника.
Многие младенцы во всем мире никогда не получают B. infantis , но сочетание кормления грудью и приема пробиотиков с этой бактерией, по-видимому, приводит к созданию питательной и защитной среды кишечника.
Наши результаты также подтверждают гипотезу о том, что неэффективность некоторых пробиотиков у взрослых отчасти связана с тем, что они вводят новый вид в устоявшееся сообщество с небольшим количеством открытых экологических ниш. Пробиотики могут не работать у младенцев, если существует несоответствие между потребностью в пробиотиках в углеводах и наличием высокоспецифических углеводов, таких как HMO, в грудном молоке.Поскольку B. infantis эффективно потребляет почти все ОПЗ, обнаруженные в грудном молоке, он, вероятно, найдет открытую экологическую нишу, а затем вытеснит другие микробы, особенно провоспалительные патогены.
Многие ученые работают над тем, чтобы понять, что на самом деле означает микробиом кишечника младенцев для здоровья на протяжении всей жизни. Между тем, мы обращаем наше внимание на другие вопросы: Чем отличаются модели колонизации Bifidobacterium в младенческих популяциях во всем мире от младенчества до отъема от груди? И какие твердые продукты поддерживают здоровье кишечника и иммунной системы? Работая при финансовой поддержке Национального института здоровья, мы сейчас проводим исследование, призванное понять, как углеводные структуры прикорма влияют на микробную функцию, которая будет поддерживать здоровый микробиом кишечника и развитие иммунной системы в позднем младенчестве и раннем детстве.Конечная цель — определить конкретные углеводные структуры в рационе, которые избирательно питают полезные кишечные микробы у детей в критический период иммунного развития для здоровья на протяжении всей жизни.
Дженнифер Смиловиц — заместитель директора Программы исследований человека в Институте пищевых продуктов для здоровья и научный сотрудник Департамента пищевых наук и технологий Калифорнийского университета в Дэвисе. Диана Хазард Тафт — научный сотрудник лаборатории Дэвида Миллса в Департаменте пищевых наук и технологий и член Института продуктов питания для здоровья в Калифорнийском университете в Дэвисе.
Вклад Bifidobacterium breve в микробиом грудного молока человека и энтеромаммарный перенос Bifidobacterium breve
Abstract
Все больше данных подтверждают важность микробиома грудного молока в посеве кишечника младенца. Однако происхождение бактерий в молоке и процесс опосредованного молочными микробами посева кишечника младенца требуют дальнейшего изучения. Предполагаемые источники бактерий в молоке включают места взаимодействия матери с младенцем и матери с окружающей средой.Мы исследуем роль взаимодействия матери и ребенка в отношении микробов грудного молока. Метагеномика дробовика и секвенирование гена 16S рРНК идентифицировали молочные микробы пар мать-младенец у младенцев на грудном вскармливании и у младенцев, которые никогда не прикладывались к груди. Хотя грудное молоко имеет низкую общую биомассу, молочные микробы играют важную роль в посеве кишечника младенца. Бактерии грудного молока в основном состояли из Staphylococcus , Streptococcus , Acinetobacter и Enterobacter , главным образом, происходящих из ареолярной кожи матери и участков ротовой полости ребенка в парах, кормящих грудью.Это говорит о том, что процесс грудного вскармливания является потенциально важным механизмом распространения микробов грудного молока через ретроградный поток через оральный и ареолярный контакт младенца с кожей. У одного ребенка, родившегося с помощью кесарева сечения, в прямой кишке, грудном молоке и стуле ребенка был обнаружен отдельный штамм Bifidobacteria breve , что может указывать на прямую передачу. Это может подтверждать существование микробной транслокации этих анаэробных бактерий через энтеромаммарный путь у людей, где материнские бактерии перемещаются через материнский кишечник и переносятся в молочные железы.Регулирование источников посева микробиома грудного молока потенциально предполагает возможность в конечном итоге повлиять на развитие микробиома младенца и его здоровье.
Образец цитирования: Kordy K, Gaufin T, Mwangi M, Li F, Cerini C, Lee DJ, et al. (2020) Вклад в микробиом грудного молока и энтеромаммарный перенос Bifidobacterium breve . PLoS ONE 15 (1):
e0219633.
https://doi.org/10.1371/journal.pone.0219633
Редактор: Хуан Дж.Лоор, Иллинойсский университет, США
Поступила: 14 июня 2019 г .; Одобрена в печать: 11 ноября 2019 г .; Опубликовано: 28 января 2020 г.
Авторские права: © 2020 Kordy et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Номера доступа: данные о секвенировании доступны в Кратком архиве чтения NCBI (SRA) при подаче SUB4724831 и BioProject PRJNA295847.
Финансирование: Это исследование было частично поддержано премией NIH K12 за развитие карьеры в области детского здравоохранения (HD052954), выданной KK. Спонсор не принимал участия в планировании исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Я ознакомился с политикой журнала, и у авторов этой рукописи есть следующие конкурирующие интересы: Д-р Корди выполнил эту работу во время работы в CHLA и в настоящее время связан с Novartis.Мы подтверждаем, что это не влияет на нашу приверженность политике PLOS ONE в отношении обмена данными и материалами.
Введение
Сложное взаимодействие между микробиомом, составляющими материнского иммунитета и колонизацией кишечника младенца имеет большое значение для развития микробиома человека, однако источники микробов в грудном молоке все еще требуют дальнейшего изучения. Как культуральные, так и не культуральные методы идентифицировали аэробные и анаэробные виды бактерий в молоке, в том числе строгие анаэробы, обычно находящиеся в кишечнике [1–6].До родов преколострум содержит виды бактерий, аналогичные молоку после родов [6–8]. Одни и те же микробы были обнаружены как в молоке, так и в кале пар мать-младенец [5]. Грудное молоко играет важную роль в формировании микробиома кишечника младенца, служа источником бактерий, продуцирующих молочную кислоту, и олигосахаридов грудного молока для кишечника младенца [9, 10]. Подобно мышиным моделям [11], грудное молоко и содержащиеся в нем микробы способствуют дифференцировке эпителия кишечника новорожденных, развитию лимфоидной ткани, ассоциированной с кишечником, и созреванию иммунной системы новорожденных [12].
Предполагаемые источники бактерий в грудном молоке включают кожные и ареолярные бактерии, окружающую среду и микробиоту ротовой полости младенца через ретроградный поток, который происходит во время кормления грудью [6, 8, 13]. Изменения бактериального состава грудного молока были связаны с ИМТ матери, увеличением веса, гормонами, стадией лактации, сроком беременности и способом родоразрешения [13, 14]. Хотя спорно, но наличие энтеромаммарного пути, посредством которого бактерии с помощью дендритных клеток перемещаются через слизистую оболочку кишечника матери и доставляются в кормящую молочную железу, было предложено в качестве одного из источников бактерий, включая анаэробы в пре-молозиве и молоке. [8, 15].Существуют некоторые подтверждающие доказательства того, что прием пробиотиков в организм матери увеличивает уровень этих микробов в грудном молоке [16–18]. Если окажется, что этот путь существует у людей, это предполагает, что изменение микрофлоры кишечника матери может напрямую влиять на здоровье ребенка [15]. В то время как исследования на мышах [11, 19] и крупного рогатого скота [20, 21] предполагают, что бактерии попадают в молоко через энтеромаммарный путь, это сложно доказать на людях и является предметом дискуссий.
Определить роль потенциальных источников бактерий в грудном молоке сложно.Мы стремились оценить грудное вскармливание и потенциальный ретроградный поток бактерий из ротовой полости младенца, выполнив секвенирование гена 16S рРНК на образцах из двух групп пар мать-младенец, в одной из которых младенцы цеплялись за грудь своей матери, а во второй группе младенцев никогда не было. защелкнулся. Кроме того, мы исследуем потенциальную роль энтеромаммарного пути к микробиому грудного молока, выполняя метагеномное секвенирование у младенца, рожденного через кесарево сечение. Мы обнаружили, что процесс грудного вскармливания является потенциально важным механизмом размножения микробов грудного молока через ретроградный поток через оральный и ареолярный контакт младенца с кожей.Наши данные также предполагают связь между Bifidobacteria breve в кишечнике матери и грудном молоке, что позволяет предположить, что бактерии кишечного происхождения могут перемещаться в молочную железу и колонизировать кишечник младенца.
Материалы и методы
Подмножество пар «мать-младенец» было отобрано из более широкой когорты, родившей в Лос-Анджелесе, штат Калифорния, с 2010 по 2014 год. Наблюдательный совет детской больницы Лос-Анджелеса одобрил исследование и было получено письменное согласие.Для сравнения были отобраны пятнадцать пар мать-младенец, захваченных грудным вскармливанием, и 5 младенцев, которые никогда не прикладывались к груди. Собранные образцы включали сцеженное молоко, мазки с ареолярной кожи матери и образцы детского стула, как описано ранее [22]. Образцы мазков были также получены из слизистой оболочки полости рта, влагалища и прямой кишки матери и слизистой оболочки рта младенца. Чтобы зафиксировать, чему на самом деле подвергся ребенок, координатор исследования в стандартных лабораторных перчатках собрал по одному мазку (Копан, Мурриета, Калифорния, США) из каждой ареолы матери после того, как мать выполнила свою обычную очистку, но до того, как ребенок защелкнулся.После сбора образцы транспортировали на льду, а затем либо помещали в буфер для стабилизации ДНК стула (Stratec, Берлин, Германия), либо замораживали «в чистом виде» в течение 4 часов после сбора и хранили при -80 ° C.
Экстракция и очистка ДНК
была проведена на замороженных образцах грудного молока, образцах ареолярной кожи, образцах стула и мазках, полученных из слизистой оболочки полости рта, влагалища и прямой кишки, как описано ранее [22]. Количественная ПЦР (кПЦР) использовалась для определения копий генов 16S и GAPDH на нг общей ДНК, экстрагированной из каждого образца грудного молока.Праймеры для нацеливания 16S 515F (GTG YCA GCM GCC GCG GTA A) и 806R (GGA CTA CNV GGG TWT CTA AT) были разработаны на основе Caporaso et al [23] и получены от Eurofins Genomics (Луисвилл, Кентукки). Праймеры GAPDH GAPDH-for (ACC ACA GTC CAT GCC ATC AC) и GAPDH-rev (TCC ACC ACC CTG TTG CTG TA) были приобретены у IDT (Скоки, Иллинойс) в качестве готовых праймеров. Количественное определение мишеней 16S и GAPDH проводили отдельно в реакциях кПЦР, содержащих 1x SSO Advanced Universal SYBR Green Supermix (Bio-Rad, Hercules, CA) и 0.5 мкМ каждого парного праймера и приблизительно 1 нг матричной ДНК. Термоциклинг кПЦР проводили с использованием прибора Bio-Rad CFX96 при следующих условиях: GAPDH, 98 ° C, выдержка в течение 2 минут, затем 40 циклов при 98 ° C в течение 20 секунд и 60,5 ° C в течение 40 секунд; 16S, 98C, выдержка в течение 2 минут, затем 40 циклов 98C в течение 20 секунд и 61.C в течение 40 секунд. Стандарты для GAPDH получали 10-кратными серийными разведениями ДНК, экстрагированной из Т-клеток человека, а стандарты для ДНК 16S получали, как описано ранее [22].Образцы и стандарты были проанализированы в трех экземплярах с использованием программы CFx Maestro (Bio-Rad), и результаты представлены как среднее значение log копий / нг общей ДНК.
Для всех 20 субъектов область V4 гена 16S рРНК была амплифицирована и секвенирована, как описано ранее [22, 24, 25]. Затем количественно определяли концентрацию ампликона ДНК на анализаторе 2100 Bioanalyzer (Agilent Technologies, Санта-Клара, Калифорния, США). Объединенные библиотеки секвенировали на приборе Illumina MiSeq с использованием химии 2x150bp v2 [25].DADA2 версии 1.4 использовался для исправления ошибок, вывода последовательности и фильтрации химер с настройками по умолчанию. Таксономическая классификация проводилась с использованием наивного байесовского классификатора RDP. Варианты загрязняющих последовательностей были идентифицированы как варианты, численность которых не менее 10% была получена из образцов отрицательного контроля, и были исключены из всех последующих анализов, как описано ранее [26]. Анализ разнообразия, ординации и перестановочного многомерного дисперсионного анализа (PERMANOVA) выполнялся с использованием «phyloseq» (версия 1.22.3) и веганский (версия 2.5–2) пакеты R. PERMANOVA оценивает общую микробную изменчивость, измеряя долю дисперсии, которая может быть объяснена каждой ковариатой. Нулевые отрицательные биномиальные регрессионные модели (ZINB) были использованы для проверки дифференциальной численности конкретных бактериальных таксонов с использованием разреженных последовательностей в качестве результата и клинических ковариат в качестве независимой переменной. Младенческий возраст в днях был включен в качестве ковариаты во все модели для учета различий в микробном составе по возрасту.Метод Benjamini-Hochberg FDR использовался для контроля нескольких гипотез, и результаты с скорректированным значением p менее 0,05 были приняты как значимые. Анализ отслеживания источника, чтобы помочь определить вклад сайта в грудное молоко и детский стул, был выполнен с использованием SourceTracker версии 1.0.0 с параметрами по умолчанию и таблицей вариантов последовательности ампликона (ASV) в качестве входных данных.
Метагеномное секвенирование
Shotgun было выполнено, как описано ранее [2], на 6 субъектах в когорте с фиксацией.Метагеномные библиотеки были сконструированы из ранее экстрагированной ДНК с использованием набора для подготовки библиотеки ДНК Illumina Nextera XT в соответствии с инструкциями производителя. Секвенирование выполнялось на платформе NextSeq500 до целевой глубины 5 миллионов считываний на образец. Обрезка адаптера и качественная фильтрация были выполнены с использованием изобилии обрезки, последовательности-хозяева были удалены с помощью knadData, а таксономическая классификация была выполнена с помощью Kraken (v0.15-beta). ConStrains использовался для выполнения анализа уровня деформации с параметрами «минимальное покрытие 5».
Результаты
Были включены пятнадцать пар мать-младенец, в которых младенец прикладывался к груди во время грудного вскармливания, и 5 пар мать-младенец, матери которых сцеживали грудное молоко, но младенцы не прикладывались к груди по медицинским причинам (Таблица 1). Возраст матери и продолжительность беременности были одинаковыми в двух группах. Тем не менее, больше пар мать-младенец в группе с защелкиванием родилось вагинально (53%), в то время как большинство (80%) группы без фиксации подверглись невыборному кесареву сечению.Больше детей из этих младенцев, не принимавших лапы (40%) и матерей (80%), получали антибиотики, чем их сверстники с защелками. В когорте, в которой никогда не фиксировалась фиксация, две пары мать-младенец получали антибиотики как матери во время родов, так и в послеродовом периоде. Их образцы были собраны в течение первых 3 недель жизни. Две другие пары мать-младенец, никогда не принимавшие участие в эксперименте, получали только антибиотики для матери во время родов. Их отбирали в первые 3 дня жизни. В когорте с фиксацией одна пара мать-младенец получала антибиотики как матери во время родов, так и в послеродовой период; Образец младенца был взят в ДОЛ 19.Еще шесть матерей в группе с защелкой получали антибиотики только во время родов, и в них были взяты пробы от DOL 3 до 55.
Из 20 пар мать-младенец 15 пар (13 фиксированных и 2 незафиксированных) были включены в окончательный анализ. Пять пар были исключены из-за недостаточного количества восстановленных количественной ПЦР молочных бактерий или ДНК и не дали истинных положительных результатов при КПЦР (1,69–5,22 log 16S V4 копий / нг ДНК). Из включенных никогда не защелкивающихся пар у 1 субъекта было продольно отобрано 4 разных образца молока в течение первых двух недель жизни, которые анализировались индивидуально.В группе грудного вскармливания бактерии грудного молока в основном состояли из Staphylococcus , Streptococcus , Acinetobacter и Enterobacter , которые в основном были получены из ареолярной кожи и участков ротовой полости младенцев согласно анализу SourceTracker (Таблица 2). Примечательно, что у двух матерей с никогда не находившимися грудными детьми были обнаружены разные композиции с чистым Staphylococcus в одном и Staphylococcus , Finegoldia и Corynebacterium в другом (рис. 1A).
Рис. 1. Состав микробиома образцов грудного молока.
(A) Возраст младенца (дни) на момент отбора проб, относительная численность, антибиотики для матери за 14 дней до отбора, способ родоразрешения и разнообразие образцов грудного молока по Шеннону от матерей с младенцами, которые либо зафиксировали, либо никогда не прикладывали . Образцы от одной матери, собранные в разные дни, группируются. В молоке от матерей, у которых никогда не вставляли грудных детей, преобладали Staphylococcus в одном и Staphylococcus , Finegoldia и Corynebacterium в другом.Обратите внимание на отсутствие Streptococcus и меньшее общее разнообразие никогда не фиксируемых образцов. Напротив, образцы от матерей с защелкнутыми младенцами, также рожденных посредством кесарева сечения в первые 10 дней жизни (n = 5), содержали Streptococcus , Acinetobacter и Enterobacter в дополнение к Staphylococcus . (B) Относительная численность Bifidobacterium рода по результатам целевого секвенирования гена 16S рРНК (слева) и метагеномики дробовика (справа) в одном образце молока (стрелка), показанном на панели A. Bifidobacterium breve , по-видимому, избирательно культивируется в материнском молоке и затем составляет большую часть микробиома кишечника ее младенца.
https://doi.org/10.1371/journal.pone.0219633.g001
В поданализе фиксированных образцов PERMANOVA определила исключительно грудное вскармливание как значительную движущую силу общей микробной изменчивости (R 2 = 0,028, p <0,001). Никаких существенных различий в разнообразии или относительной численности конкретных бактериальных таксонов не было отмечено исключительно грудным вскармливанием, родами или полом.Интересно, что род Bifidobacterium при секвенировании 16S рРНК был обнаружен в грудном молоке, детском стуле и ректальных образцах матери от пары мать-одиночка при кесаревом сечении. Мы использовали метагеномику дробовика для дальнейшего определения штамма этих общих бифидобактерий. Анализ на уровне видов показал, что Bifidobacterium breve является лишь второстепенным компонентом кишечного сообщества матери (относительная численность 0,07%), но составляет значительно большую часть микробиомов грудного молока и кишечника младенцев (28.Относительная численность 44% и 67,7% соответственно) (рис. 1B). Мутационные профили на уровне штаммов также показали, что отдельный штамм Bifidobacterium breve является общим для этих трех образцов из одной пары мать-ребенок.
Обсуждение
Процесс грудного вскармливания играет решающую роль в развитии микробиома кишечника младенца. Первоначальный посев кишечника младенца в первые несколько месяцев жизни необходим для развития иммунитета и общего состояния здоровья младенца [27–31], при этом исключительность грудного вскармливания и процентное содержание критически влияют на микробиом кишечника младенца [22, 31].В нашем анализе грудное молоко и микробиомы младенцев попадают в организм несколькими путями, но в основном из ареолярной кожи и участков ротовой полости младенцев. Кроме того, пара кормящих грудью мать-одиночка и младенец предоставляет интригующие доказательства того, что энтеромаммарный путь способствует тому же штамму Bifidobacterium breve , обнаруженному в кишечнике матери и грудном молоке, а также в кишечнике ее младенца. Этот ребенок был доставлен через кесарево сечение, что ограничило возможность колонизации ребенка во время родов.Более того, даже несмотря на то, что Bifidobacterium breve составляли менее 1% материнского ректального образца, он составлял 28% материнского молока. Затем этот единственный вид бактерий составлял 68% кишечного микробиома младенца.
Появляется все больше свидетельств того, что анаэробные бифидобактерии переносятся из кишечника матери в грудное молоко, а затем колонизируются и размножаются в кишечнике младенца [5]. Бифидобактерии являются одними из первых бактерий, колонизирующих кишечник младенца, и связаны со снижением риска ожирения, астмы, атопии и общей смертности от некротического энтероколита у недоношенных детей [27, 32, 33].Учитывая важность бифидобактерий для здоровья младенцев, для матерей логично выборочно обогащать и поддерживать колонизацию этой бактериальной популяцией.
Молочные протоки — это двунаправленные каналы [34], поэтому вполне вероятно, что в грудное молоко попадают бактерии с кожи и ротовой полости младенца. Более того, в последнее время появилась поддержка того, что штаммы бактерий, обнаруженные в преколоструме, могут иметь значительное влияние на первоначальное формирование микробиоты полости рта у младенцев [6]. Наш анализ также наводит на мысль о роли ретроградного перорального посева бактерий в материнское молоко в результате грудного вскармливания грудного ребенка.В обеих парах мать-младенец с достаточными данными, где ребенок никогда не прикладывался к груди, преобладала кожная флора, состоящая в основном из Staphylococc us и примерно Corynebacterium с заметным отсутствием Streptococcus . Напротив, большинство образцов молока от прикладывающихся пар содержали, по крайней мере, часть, а часто и большую часть Streptococcus , присутствующих в их образцах. Замкнутые образцы также имели большее общее разнообразие, включая Acinetobacter , Enterobacter , Veillonella и Haemophilus в дополнение к Staphylococcus , Streptococcus и Corynebacterium 13, что согласуется с предыдущими исследованиями 13 [].Однако, учитывая, что только у 2 из никогда не прикладывавшихся матерей в молоке присутствует достаточное количество бактерий для анализа, наших данных недостаточно, чтобы сделать какие-либо окончательные выводы о роли прикорма в составе молочных микробов.
Наше исследование ограничено небольшим размером выборки, диапазоном гестационного возраста новорожденных при рождении, диапазоном возрастов при взятии образцов и неспособностью показать направленность бактериального переноса. Некоторые микробы, обнаруженные на ареолярной коже, также присутствуют на слизистых оболочках желудочно-кишечного тракта [8], и наши методы не позволяют определить источник этих микробов в грудном молоке.Предыдущие исследования продемонстрировали энтеромаммарный путь у животных [8, 15] и жизнеспособный штамм Bifidobacterium breve в фекалиях матери, грудном молоке и неонатальных фекалиях у младенцев, рожденных естественным путем [5]. Хотя наш отчет предлагает доказательства энтеромаммарного пути путем обнаружения одного штамма Bifidobacterium breve в прямой кишке, грудном молоке и детском стуле матери, существует вероятность того, что фекальные микробы матери могут распространяться самой матерью на кожу и грудь, хотя это менее вероятно у ребенка, рожденного с помощью кесарева сечения.Требуются более окончательные доказательства, подтверждающие роль энтеромаммарного пути у людей в перемещении критических микробных сообществ в грудное молоко и, в конечном итоге, в заселении кишечника младенца через грудное вскармливание. Наши результаты должны быть изучены с помощью более крупных когорт и молекулярных исследований или анализа на основе культур, чтобы подтвердить данные метагеномики дробовика.
В заключение, наши данные предполагают, что процесс грудного вскармливания и взаимодействие между ареолярной кожей и ротовой полостью младенца потенциально имеют решающее значение для посева микробиома молока.Кроме того, в нашем отчете представлены интригующие доказательства, указывающие на энтеромаммарный путь у людей с переносом одного штамма Bifidobacterium breve в кишечник матери, грудное молоко и детский стул у ребенка, рожденного через кесарево сечение. Эти источники посева микробиома молока, если они будут подтверждены в более крупных исследованиях, могут поддерживать возможности для регулирования бактерий, обнаруженных в грудном молоке человека, и, в конечном итоге, развитие микробиома младенца.
Благодарности
Авторы благодарны волонтерам, их семьям и их поставщикам медицинских услуг за участие в этом исследовании.Особая благодарность Амиту Обераи за его помощь в первоначальном анализе этих данных.
Список литературы
- 1.
Хименес Э., Дельгадо С., Фернандес Л., Гарсия Н., Альбухар М., Гомес А. и др. Оценка бактериального разнообразия молозива человека и скрининг популяций стафилококков и энтерококков на предмет потенциальных факторов вирулентности. Res Microbiol. 2008. 159 (9–10): 595–601. pmid: 18845249 - 2.
Asnicar F, Manara S, Zolfo M, Truong DT, Scholz M, Armanini F и др.Изучение вертикальной передачи микробиома от матери к младенцу с помощью метагеномного профилирования на уровне штамма. mSystems. 2017; 2 (1). - 3.
Collado MC, Delgado S, Maldonado A, Rodriguez JM. Оценка бактериального разнообразия грудного молока здоровых женщин с помощью количественной ПЦР в реальном времени. Lett Appl Microbiol. 2009. 48 (5): 523–8. pmid: 19228290 - 4.
Hunt KM, Foster JA, Forney LJ, Schutte UM, Beck DL, Abdo Z и др. Характеристика разнообразия и временной стабильности бактериальных сообществ грудного молока.PLoS One. 2011; 6 (6): e21313. pmid: 21695057 - 5.
Jost T, Lacroix C, Braegger CP, Rochat F, Chassard C. Вертикальная передача материнских кишечных бактерий новорожденным через грудное вскармливание. Environ Microbiol. 2014. 16 (9): 2891–904. pmid: 24033881 - 6.
Руис Л., Бачигалупе Р., Гарсиа-Карраль С., Бойш-Аморос А., Аргуэлло Н., Сильва С.Б. и др. Микробиота преколострума человека и его потенциальная роль в качестве источника бактерий для ротовой полости младенца. Научные отчеты. 2019; 9 (1): 8435.pmid: 31182726 - 7.
Доннет-Хьюз А., Перес П.Ф., Дор Дж., Леклерк М., Левенес Ф., Беньякуб Дж. И др. Возможная роль кишечной микробиоты матери в иммунном образовании новорожденных. Proc Nutr Soc. 2010. 69 (3): 407–15. pmid: 20633308 - 8.
Rodriguez JM. Происхождение бактерий грудного молока: существует ли бактериальный путь в кишечнике и молочной железе на поздних сроках беременности и в период лактации? Adv Nutr. 2014. 5 (6): 779–84. pmid: 25398740 - 9.
Мартин Р., Ланга С., Ревириего С., Хименес Э., Марин М.Л., Хаус Дж. И др.Грудное молоко является источником молочнокислых бактерий для кишечника младенца. J Pediatr. 2003. 143 (6): 754–8. pmid: 14657823 - 10.
Marcobal A, Sonnenburg JL. Потребление олигосахаридов грудного молока кишечной микробиотой. Клиническая микробиология и инфекции: официальное издание Европейского общества клинической микробиологии и инфекционных заболеваний. 2012; 18 Дополнение 4: 12–5. - 11.
Gaboriau-Routhiau V, Rakotobe S, Lecuyer E, Mulder I, Lan A, Bridonneau C и др.Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов Т-хелперных клеток кишечника. Иммунитет. 2009. 31 (4): 677–89. pmid: 19833089 - 12.
Перес П.Ф., Дор Дж., Леклерк М., Левенес Ф., Беньякуб Дж., Серрант П. и др. Бактериальный импринтинг иммунной системы новорожденных: уроки материнских клеток? Педиатрия. 2007; 119 (3): e724–32. pmid: 17332189 - 13.
Кабрера-Рубио Р., Колладо М.К., Лайтинен К., Салминен С., Изолаури Э., Мира А. Микробиом грудного молока изменяется в период лактации и определяется весом матери и способом родоразрешения.Am J Clin Nutr. 2012. 96 (3): 544–51. pmid: 22836031 - 14.
Ходяр-Пардо П., Мира-Паскуаль Л., Колладо М.С., Мартинес-Коста С. Влияние стадии лактации, гестационного возраста и способа родоразрешения на микробиоту грудного молока. J Perinatol. 2014; 34 (8): 599–605. pmid: 24674981 - 15.
Мартин Р., Ланга С., Ревириего С., Хименес Э., Марин М.Л., Оливарес М. и др. Комменсальная микрофлора грудного молока: новые перспективы пищевой бактериотерапии и пробиотиков. Тенденции в пищевой науке и технологиях.2004; 15: 121–7. - 16.
Абрахамссон Т.Р., Синкевич Г., Якобссон Т., Фредриксон М., Бьоркстен Б. Пробиотические лактобациллы в грудном молоке и детском стуле в зависимости от перорального приема в течение первого года жизни. Журнал детской гастроэнтерологии и питания. 2009. 49 (3): 349–54. pmid: 19525871 - 17.
Арройо Р., Мартин V, Мальдонадо А., Хименес Э., Фернандес Л., Родригес Дж. М.. Лечение инфекционного мастита в период лактации: антибиотики по сравнению с пероральным приемом лактобацилл, выделенных из грудного молока.Clin Infect Dis. 2010. 50 (12): 1551–8. pmid: 20455694 - 18.
Simpson MR, Avershina E, Storro O, Johnsen R, Rudi K, Oien T. Связанная с грудным вскармливанием микробиота грудного молока после добавления Lactobacillus rhamnosus GG, Lactobacillus acidophilus La-5 и Bifidobacterium animalis ssp. lactis Bb-12. J Dairy Sci. 2018; 101 (2): 889–99. pmid: 29248229 - 19.
Иванов И.И., Атараши К., Манель Н., Броди Э.Л., Шима Т., Караоз У. и др. Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями.Клетка. 2009. 139 (3): 485–98. pmid: 19836068 - 20.
Ойкономоу Г., Мачадо В.С., Сантистебан К., Шуккен Ю.Х., Бикальо Р.К. Микробное разнообразие бычьего маститного молока, как описано пиросеквенированием метагеномной 16s рДНК. PLoS One. 2012; 7 (10): e47671. pmid: 23082192 - 21.
Контрерас Г.А., Родригес Дж. М.. Мастит: сравнительная этиология и эпидемиология. Журнал биологии и неоплазии молочных желез. 2011. 16 (4): 339–56. pmid: 21947764 - 22.
Паннарадж П.С., Ли Ф., Церини С., Бендер Дж. М., Ян С., Ролли А. и др.Ассоциация между бактериальными сообществами грудного молока и становлением и развитием кишечного микробиома младенца. JAMA Pediatr. 2017; 171 (7): 647–54. pmid: 28492938 - 23.
Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Lozupone CA, Turnbaugh PJ и др. Глобальные паттерны разнообразия 16S рРНК на глубине миллионов последовательностей на образец. Proc Natl Acad Sci U S. A. 2011; 108 Приложение 1: 4516–22. - 24.
Тобин Н.Х., Вудворд С., Забих С., Ли DJ, Ли Ф, Альдрованди GM.Метод целевого секвенирования 16S образцов человеческого молока. J Vis Exp. 2018 (133). - 25.
Капорасо Дж. Г., Лаубер С. Л., Уолтерс В. А., Берг-Лайонс Д., Хантли Дж., Фирер Н. и др. Сверхвысокопроизводительный анализ микробного сообщества на платформах Illumina HiSeq и MiSeq. ISME J. 2012; 6 (8): 1621–4. pmid: 22402401 - 26.
Бендер Дж. М., Ли Ф, Адисетийо Х, Ли Д., Забих С., Хунг Л. и др. Количественная оценка вариации и влияния биомассы в целевых исследованиях секвенирования гена 16S рРНК.Микробиом. 2018; 6 (1): 155. pmid: 30201048 - 27.
Fujimura KE, Lynch SV. Микробиота при аллергии и астме и возникающая связь с микробиомом кишечника. Клеточный микроб-хозяин. 2015; 17 (5): 592–602. pmid: 25974301 - 28.
Тоскано М., Де Гранди Р., Гросси Э., Драго Л. Роль человеческой микробиоты грудного молока в иммунной системе новорожденных: краткий обзор. Front Microbiol. 2017; 8: 2100. pmid: 252 - 29.
Азад МБ, Конья Т., Моган Х., Гутман Д.С., Филд С.Дж., Чари Р.С. и др.Микробиота кишечника здоровых канадских младенцев: профили в зависимости от способа родов и питания младенцев в 4 месяца. CMAJ. 2013; 185 (5): 385–94. pmid: 23401405 - 30.
Гауфин Т., Тобин Н.Х., Альдрованди Г.М. Значение микробиома в педиатрии и детских инфекционных заболеваниях. Curr Opin Pediatr. 2018; 30 (1): 117–24. pmid: 2 - 31.
Хо Н.Т., Ли Ф., Ли-Сарвар К.А., Тун Х.М., Браун Б.П., Паннарадж П.С. и др. Метаанализ воздействия исключительно грудного вскармливания на микробиоту кишечника младенцев в разных популяциях.Связь природы. 2018; 9 (1): 4169. pmid: 30301893 - 32.
Каллиомаки М., Колладо М.К., Салминен С., Изолаури Э. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am J Clin Nutr. 2008. 87 (3): 534–8. pmid: 18326589 - 33.
Патоле С.К., Рао С.К., Кейл А.Д., Натан Э.А., Доэрти Д.А., Симмер К.Н. Преимущества добавления Bifidobacterium breve M-16V у недоношенных новорожденных — ретроспективное когортное исследование. PLoS One. 2016; 11 (3): e0150775. pmid: 26953798 - 34.Рамзи Д.Т., Кент Дж. К., Оуэнс Р. А., Хартманн ЧП. Ультразвуковое исследование выделения молока в груди кормящих женщин. Педиатрия. 2004. 113 (2): 361–7. pmid: 14754950
49
пробиотических штаммов Bifidobacterium и галактоолигосахаридов улучшают барьерную функцию кишечника у взрослых с ожирением, но не проявляют синергизма при совместном использовании в качестве синбиотиков | Microbiome
Joyce SA, Gahan CGM. Микробиота кишечника и метаболическое здоровье хозяина. Курр Опин Гастроэнтерол.2014; 30: 120–7.
Артикул
PubMed
CAS
Google Scholar
Клементе Дж. К., Урселл Л. К., Парфри Л. В., Найт Р. Влияние микробиоты кишечника на здоровье человека: комплексный взгляд. Клетка. 2012; 148: 1258–70.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Флинт Х.Дж., Скотт К.П., Луис П., Дункан Ш. Роль микробиоты кишечника в питании и здоровье.Нат Рев Гастроэнтерол Гепатол. 2012; 9: 577–89.
Артикул
PubMed
CAS
Google Scholar
Marchesi JR, Adams DH, Fava F, Hermes GDA, Hirschfield GM и др. Микробиота кишечника и здоровье хозяина: новый клинический рубеж. Кишечник. 2015; 65: 330–9.
Артикул
PubMed
PubMed Central
Google Scholar
Зоммер Ф., Бэкхед Ф. Кишечная микробиота — хозяева развития и физиологии хозяина.Nat Rev Microbiol. 2013; 11: 227–38.
Артикул
PubMed
CAS
Google Scholar
Cani PD, Everard A. Говорящие микробы: когда кишечные бактерии взаимодействуют с диетой и органами хозяина. Mol Nutr Food Res. 2016; 60: 58–66.
Артикул
PubMed
CAS
Google Scholar
Tran CD, Grice DM, Wade B., Kerr CA, Bauer DC, et al. Проницаемость кишечника, его взаимодействие с микрофлорой кишечника и влияние на метаболизм опосредуются лимфатической системой, печенью и желчной кислотой.Future Microbiol. 2015; 10: 1339–53.
Артикул
PubMed
CAS
Google Scholar
Фархади А., Банан А., Филдс Дж., Кешаварзян А. Кишечный барьер: граница между здоровьем и болезнью. J Gastroenterol Hepatol. 2003. 18: 479–97.
Артикул
PubMed
Google Scholar
Ле Шателье Э, Нильсен Т., Цинь Дж., Прифти Э, Хильдебранд Ф. и др. Богатство микробиома кишечника человека коррелирует с метаболическими маркерами.Природа. 2013; 500: 541–6.
Артикул
PubMed
CAS
Google Scholar
Esser N, Legrand-Poels S, Piette J, Scheen AJ, Paquot N. Воспаление как связь между ожирением, метаболическим синдромом и диабетом 2 типа. Диабет Res Clin Pract. 2014; 105: 141–50.
Артикул
PubMed
CAS
Google Scholar
Zeyda M, Stulnig TM. Ожирение, воспаление и инсулинорезистентность — мини-обзор.Геронтология. 2009; 55: 379–86.
Артикул
PubMed
CAS
Google Scholar
Кани П.Д., Амар Дж., Иглесиас М.А., Поджи М., Кнауф С. и др. Метаболическая эндотоксемия вызывает ожирение и инсулинорезистентность. Сахарный диабет. 2007; 56: 1761–72.
Артикул
PubMed
CAS
Google Scholar
Невес А.Л., Коэльо Дж., Коуту Л., Лейте-Морейра А., Ронкон-Альбукерке Р.Метаболическая эндотоксемия: молекулярная связь между ожирением и сердечно-сосудистым риском. J Mol Endocrinol. 2013; 51: R51–64.
Артикул
PubMed
CAS
Google Scholar
Cani PD. Взаимодействие между кишечными микробами и клетками-хозяевами контролирует кишечный барьер и метаболизм. Int J Obes Suppl. 2016; 6: S28–31.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM и др. Изменения микробиоты кишечника контролируют метаболическое воспаление, вызванное диетой, при ожирении и диабете, вызванном диетой с высоким содержанием жиров. Сахарный диабет. 2008; 57: 1470–81.
Артикул
PubMed
CAS
Google Scholar
Cani PD, Osto M, Geurts L, Everard A. Вовлечение микробиоты кишечника в развитие воспаления низкой степени и диабета 2 типа, связанного с ожирением.Кишечные микробы. 2012; 3: 279–88.
Артикул
PubMed
PubMed Central
Google Scholar
Акбари П., Брабер С., Ализаде А., Верхейден К., Шотерман М. и др. Галактоолигосахариды защищают кишечный барьер, поддерживая сеть плотных контактов и модулируя воспалительные реакции после заражения микотоксином дезоксиниваленолом в монослоях клеток Caco-2 человека и мышах B6C3F1. J Nutr. 2015; 145: 1604–13.
Артикул
PubMed
CAS
Google Scholar
Акбари П., Финк-Греммельс Дж., Виллемс РАМ, Дифилиппо Э., Схолс Н.А. и др. Характеристика независящих от микробиоты эффектов олигосахаридов на эпителиальные клетки кишечника: понимание роли структуры и размера: взаимосвязь между структурой и активностью неперевариваемых олигосахаридов. Eur J Nutr. 2017; 56: 1919–30.
Артикул
PubMed
CAS
Google Scholar
Ализаде А., Акбари П., Дифилиппо Э., Схолс Н.А., Ульфман Л.Х. и др. Поросенок как модель для изучения диетических компонентов в рационах младенцев: влияние галактоолигосахаридов на функции кишечника. Br J Nutr. 2015; 115: 605–18.
Артикул
PubMed
CAS
Google Scholar
Мэдсен К., Корниш А., Сопер П., МакКейни С., Джихон Х. и др. Пробиотические бактерии усиливают барьерную функцию кишечного эпителия мышей и человека.Гастроэнтерология. 2001; 121: 580–91.
Артикул
PubMed
CAS
Google Scholar
Hsieh C-Y, Osaka T., Moriyama E, Date Y, Kikuchi J, et al. Укрепление плотного соединения эпителия кишечника с помощью Bifidobacterium bifidum. Physiol Rep.2015; 3: e12327.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Го С., Гиллингем Т., Го Й, Мэн Д., Чжу В., Уокер В. А. и др.Секреции Bifidobacterium infantis и Lactobacillus acidophilus защищают барьерную функцию кишечного эпителия. J Pediatr Gastroenterol Nutr. 2017; 64: 404–12.
Артикул
PubMed
CAS
Google Scholar
Андерсон Р.К., Куксон А.Л., Макнабб В.К., Келли В.Дж., Рой Н. Lactobacillus plantarum DSM 2648 является потенциальным пробиотиком, который усиливает барьерную функцию кишечника. FEMS Microbiol Lett. 2010; 309: 184–92.
PubMed
CAS
Google Scholar
Mujagic Z, De Vos P, Boekschoten MV, Govers C, Pieters HJH, De Wit NJ, et al. Влияние Lactobacillus plantarum на барьерную функцию тонкого кишечника и транскрипцию генов слизистой оболочки; рандомизированное двойное слепое плацебо-контролируемое исследование. Научный доклад 2017; 4: 40128.
Артикул
CAS
Google Scholar
Ren C, Dokter-Fokkens J, Figueroa Lozano S, Zhang Q, Haan BJ, et al. Молочнокислые бактерии могут влиять на функцию кишечного барьера, модулируя бокаловидные клетки.Mol Nutr Food Res. 2018; 62: 1700572.
Cani PD, Neyrinck AM, Fava F, Knauf C, Burcelin RG, et al. Избирательное увеличение бифидобактерий в микрофлоре кишечника улучшает диабет, вызванный диетой с высоким содержанием жиров, у мышей за счет механизма, связанного с эндотоксемией. Диабетология. 2007. 50: 2374–83.
Артикул
PubMed
CAS
Google Scholar
Cani PD, Delzenne NM. Взаимодействие между ожирением и связанными с ним нарушениями обмена веществ: новое понимание микробиоты кишечника.Curr Opin Pharmacol. 2009; 9: 737–43.
Артикул
PubMed
CAS
Google Scholar
Миллс Д.А. Номенклатура пробиотиков имеет значение: путаница с Bifidobacterium longum subsp. Infantis сохраняется. Curr Med Res Opin. 2017; 33: 2097.
Артикул
PubMed
Google Scholar
Ewaschuk JB, Diaz H, Meddings L, Diederichs B, Dmytrash A, et al.Секретируемые биоактивные факторы Bifidobacterium infantis усиливают барьерную функцию эпителиальных клеток. Am J Physiol Gastrointest Liver Physiol. 2008; 295: G1025–34.
Артикул
PubMed
CAS
Google Scholar
Бергманн К.Р., Лю SXL, Тиан Р., Кушнир А., Тернер Дж. Р. и др. Бифидобактерии стабилизируют клаудины в плотных контактах и предотвращают дисфункцию кишечного барьера при некротическом энтероколите у мышей. Am J Pathol. 2013; 182: 1596–606.
Артикул
CAS
Google Scholar
Гриффитс Э.А., Даффи Л.С., Шанбахер Флорида, Цяо Х., Дриджа Д. и др. Влияние бифидобактерий и лактоферрина на концентрацию эндотоксина в кишечнике и иммунитет слизистой оболочки мышей balb / c in vivo. Dig Dis Sci. 2004. 49: 579–89.
Артикул
PubMed
CAS
Google Scholar
Wang Z, Xiao G, Yao Y, Guo S, Lu K и др.Роль бифидобактерий в барьерной функции кишечника после термической травмы у крыс. J Травма-травма Infect Crit Care. 2006; 61: 650–7.
Артикул
Google Scholar
Чен Дж, Ван РР-Л, Ли Х-Ф, Ван РР-Л. Добавка Bifidobacterium adolescentis улучшает накопление висцерального жира и чувствительность к инсулину в экспериментальной модели метаболического синдрома. Br J Nutr. 2012; 107: 1429–34.
Артикул
PubMed
CAS
Google Scholar
Reichold A, Brenner SA, Spruss A, Förster-Fromme K, Bergheim I, et al. Bifidobacterium adolescentis защищает от развития неалкогольного стеатогепатита на мышиной модели. J Nutr Biochem. 2014; 25: 118–25.
Артикул
PubMed
CAS
Google Scholar
Мартинес И., Уоллес Дж., Чжан С., Легге Р., Бенсон А. К. и др. Индуцированные диетой улучшения метаболизма на модели гиперхолестеринемии у хомяков тесно связаны с изменениями микробиоты кишечника.Appl Environ Microbiol. 2009. 75: 4175–84.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Fanaro S, Marten B, Bagna R, Vigi V, Fabris C и др. Галактоолигосахариды бифидогенны и безопасны при отъеме: двойное слепое рандомизированное многоцентровое исследование. J Pediatr Gastroenterol Nutr. 2009. 48: 82–8.
Артикул
PubMed
CAS
Google Scholar
Сьерра С., Бернал М.-Дж., Бласко Дж., Мартинес Р., Далмау Дж. И др. Эффект пребиотика в течение первого года жизни у здоровых младенцев, получавших смесь, содержащую GOS в качестве единственного пребиотика: многоцентровое, рандомизированное, двойное слепое и плацебо-контролируемое исследование. Eur J Nutr. 2015; 54: 89–99.
Артикул
PubMed
CAS
Google Scholar
Хаарман М., Кнол Дж. Количественный анализ ПЦР в реальном времени фекальных видов Lactobacillus у младенцев, получающих пребиотическую смесь для грудных детей.Appl Environ Microbiol. 2006. 72: 2359–65.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Дэвис Л.М.Г., Мартинес И., Уолтер Дж., Хаткинс Р. Дозозависимое влияние пребиотических галактоолигосахаридов на кишечную микробиоту здоровых взрослых. Int J Food Microbiol. 2010; 144: 285–92.
Артикул
PubMed
CAS
Google Scholar
Walton GE, van den Heuvel EGHM, Kosters MHW, Rastall RA, Tuohy KM, et al. Рандомизированное перекрестное исследование, изучающее влияние галактоолигосахаридов на фекальную микробиоту у мужчин и женщин старше 50 лет. Br J Nutr. 2012; 107: 1466–75.
Артикул
PubMed
CAS
Google Scholar
Вулевич Дж., Юрич А., Цорцис Дж., Гибсон Г.Р. Смесь трансгалактоолигосахаридов снижает маркеры метаболического синдрома и модулирует фекальную микробиоту и иммунную функцию взрослых с избыточным весом.J Nutr. 2013: 324–31.
Bouhnik Y, Raskine L, Simoneau G, Paineau D, Bornet F. Способность короткоцепочечных фруктоолигосахаридов стимулировать фекальные бифидобактерии: исследование зависимости от дозы у здоровых людей. Нутр Дж. 2006; 5: 8.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Рамирес-Фариас С., Слезак К., Фуллер З., Дункан А., Холтроп Г. и др. Влияние инулина на микробиоту кишечника человека: стимуляция Bifidobacterium adolescentis и Faecalibacterium prausnitzii.Br J Nutr. 2008; 101: 541–50.
PubMed
Google Scholar
Clarke ST, Brooks SP, Inglis GD, Yanke LJ, Green J, Petronella N., Ramdath DD, Bercik P, Green-Johnson JM, Kalmokoff M. Влияние β2-1 фруктана на изменения фекального сообщества: результаты плацебо-контролируемого рандомизированного двойного слепого перекрестного исследования у здоровых взрослых. Br J Nutr. 2017; 118: 441–53.
Дэвис Л., Мартинес И., Уолтер Дж., Гоин С., Хаткинс Р.В.Пиросеквенирование со штрих-кодом показывает, что потребление галактоолигосахаридов приводит к высокоспецифичному бифидогенному ответу у людей. PLoS One. 2011; 6: e25200.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Мартинес И., Ким Дж., Даффи П.Р., Шлегель В.Л., Вальтер Дж. Резистентные крахмалы типов 2 и 4 по-разному влияют на состав фекальной микробиоты у людей. PLoS One. 2010; 5: e15046.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Ringel-Kulka T, Cheng J, Ringel Y, Salojärvi J, Carroll I, et al. Кишечная микробиота у здоровых маленьких детей и взрослых в США — высокопроизводительный микроматричный анализ. PLoS One. 2013; 8: e64315.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Аганс Р., Ригсби Л., Кенче Х., Михаил С., Хамис Х.Д. и др.Микробиота дистального отдела кишечника детей подросткового возраста отличается от таковой взрослых. FEMS Microbiol Ecol. 2011; 77: 404–12.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Salonen A, Lahti L, Salojärvi J, Holtrop G, Korpela K, et al. Влияние диеты и индивидуальных особенностей на состав кишечной микробиоты и продукты ферментации у мужчин с ожирением. ISME J. 2014; 8: 2218–30.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Venkataraman A, Sieber JR, Schmidt AW, Waldron C, Theis KR, et al. Различные ответы микробиомов человека на пищевые добавки с резистентным крахмалом. Микробиом. 2016; 4:33.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Колида С, Гибсон ГР. Синбиотики в здоровье и болезни. Annu Rev Food Sci Technol. 2011; 2: 373–93.
Артикул
PubMed
Google Scholar
Mallon CA, Van Elsas JD, Salles JF. Микробные инвазии: процесс, закономерности и механизмы. Trends Microbiol. 2015; 23: 719–29.
Артикул
PubMed
CAS
Google Scholar
Вальтер Дж., Мальдонадо-Гомес М.Х., Мартинес И. Приживать или не приживать: экологическая основа для модуляции микробиома кишечника с помощью живых микробов. Curr Opin Biotechnol. 2017; 49: 129–39.
Артикул
PubMed
CAS
Google Scholar
Freitas MB, Moreira EAM, de Lima Oliveira D, Tomio C, Rosa JS, Moreno YMF и др. Эффект синбиотических добавок у детей и подростков с муковисцидозом: рандомизированное контролируемое клиническое исследование. Eur J Clin Nutr.2018; 72: 736–43.
Паниграхи П., Парида С., Нанда, Северная Каролина, Сатпатия Р., Прадхан Л. и др. Рандомизированное испытание синбиотиков для профилактики сепсиса среди младенцев в сельских районах Индии. Природа. Epub в преддверии печати 2017 г. https://doi.org/10.1038/nature23480.
Росси М., Джонсон Д. В., Моррисон М., Паско Е. М., Кумбс Дж. С. и др. Синбиотики, облегчающие почечную недостаточность за счет улучшения микробиологии кишечника (SYNERGY): рандомизированное исследование. Clin J Am Soc Nephrol. 2016; 11: 223–31.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Огава Т., Асаи Ю., Ясуда К., Сакамото Х. Оральная иммуноадъювантная активность нового синбиотика Lactobacillus casei subsp casei в сочетании с декстраном у мышей BALB / c.Nutr Res. 2005; 25: 295–304.
Артикул
CAS
Google Scholar
Танака Р., Такаяма Х., Моротоми М., Куросима Т., Уэяма С. и др. Влияние введения TOS и Bifidobacterium breve 4006 на фекальную флору человека. Бифидобактная микрофлора. 1983; 2: 17–24.
Артикул
CAS
Google Scholar
Пьетро Ф.А., Лучери С., Долара П., Джаннини А., Биггери А. и др.Противоопухолевое действие пребиотика инулина, обогащенного олигофруктозой, в сочетании с пробиотиками Lactobacillus rhamnosus и Bifidobacterium lactis на индуцированный азоксиметаном канцерогенез толстой кишки у крыс. Канцерогенез. 2002; 23: 1953–60.
Артикул
Google Scholar
Ван Х, Браун Иллинойс, Эванс А.Дж., Конвей ПЛ. Защитное действие гранул кукурузного крахмала с высоким содержанием амилозы (амиломаиза) на выживаемость Bifidobacterium spp.в кишечном тракте мышей. J Appl Microbiol. 1999; 87: 631–9.
Артикул
PubMed
CAS
Google Scholar
Krumbeck JA, Maldonado-Gomez MX, Martínez I., Frese SA, Burkey TE, et al. Селекция in vivo для выявления штаммов бактерий с улучшенными экологическими характеристиками при применении синбиотиков. Appl Environ Microbiol. 2015; 81: 2455–65.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Крамбек Дж., Уолтер Дж., Хаткинс Р. У. Синбиотики для улучшения здоровья человека: последние события, проблемы и возможности. Annu Rev Food Sci Technol. 2018; 9: 451–79.
Мальдонадо-Гомес М.Х., Мартинес И., Боттачини Ф., О’Каллаган А., Вентура М. и др. Стабильное приживление Bifidobacterium longum Ah2206 в желудочно-кишечном тракте человека зависит от индивидуальных особенностей резидентного микробиома. Клеточный микроб-хозяин. 2016; 20: 515–26.
Артикул
PubMed
CAS
Google Scholar
Bindels LB, Munoz RRS, Gomes-Neto JC, Mutemberezi V, Martínez I., Salazar N, et al. Резистентный крахмал может улучшить чувствительность к инсулину независимо от микробиоты кишечника. Микробиом. 2017; 5: 12.
Артикул
PubMed
PubMed Central
Google Scholar
Wu RY, Määttänen P, Napper S, Scruten E, Li B и др. Неперевариваемые олигосахариды напрямую регулируют кином хозяина, чтобы модулировать воспалительные реакции хозяина без изменения микробиоты кишечника.Микробиом. 2017; 5: 135.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Fransen F, Sahasrabudhe NM, Elderman M, Bosveld M, El Aidy S, Hugenholtz F, et al. β2 → 1-фруктаны модулируют иммунную систему in vivo в зависимости от микробиоты и независимо от нее. Фронт Иммунол. 2017; 8: 154.
PubMed
PubMed Central
Google Scholar
Покусаева К., Фицджеральд Г.Ф., Синдерен Д. Углеводный обмен у бифидобактерий. Genes Nutr. 2011; 6: 285.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Вернацца К.Л., Гибсон Г.Р., Расталл Р. Предпочтение углеводов, кислотная толерантность и толерантность к желчи в пяти штаммах Bifidobacterium. J Appl Microbiol. 2006; 100: 846–53.
Артикул
PubMed
CAS
Google Scholar
Тонгарам Т., Хефлингер Дж. Л., Чоу Дж., Миллер М. Дж. Метаболизм пребиотических галактоолигосахаридов пробиотическими лактобактериями и бифидобактериями. J. Agric Food Chem. 2017; 65: 4184–92.
Артикул
PubMed
CAS
Google Scholar
Alander M, Mättö J, Kneifel W, Johansson M, Koegle B и др. Влияние добавок галактоолигосахаридов на фекальную микрофлору человека, а также на выживаемость и устойчивость Bifidobacterium lactis Bb-12 в желудочно-кишечном тракте.Int Dair. 2001; 11: 817–25.
Артикул
CAS
Google Scholar
Малинен Э., Мэтто Дж., Салмити М., Аландер М., Саарела М. и др. ПЦР-ИФА II: анализ популяций Bifidobacterium в образцах фекалий человека из испытания потребления с Bifidobacterium lactis Bb-12 и препаратом галактоолигосахарида. Syst Appl Microbiol. 2002. 25: 249–58.
PubMed
CAS
Google Scholar
Satokari RM, Vaughan EE, Akkermans AD, Saarela M, de Vos WM. Полимеразная цепная реакция и мониторинг денатурирующего градиентного гель-электрофореза популяций фекальных Bifidobacterium в испытании кормления пребиотиками и пробиотиками. Syst Appl Microbiol. 2001; 231: 227–31.
Weiss S, Xu ZZ, Peddada S, Amir A, Bittinger K, et al. Стратегии нормализации и дифференциальной численности микробов зависят от характеристик данных. Микробиом. 2017; 5: 1–18.
Артикул
Google Scholar
Тайпале Т., Пиенихаккинен К., Исолаури Э., Ларсен Ц., Брокманн Э. и др. Bifidobacterium animalis subsp. lactis BB-12 в снижении риска инфекций в младенчестве. Br J Nutr. 2010; 105: 409–16.
Артикул
PubMed
CAS
Google Scholar
Shaikh M, Rajan K, Forsyth CB, Voigt RM, Keshavarzian A. Одновременное газохроматографическое измерение мочи с помощью зондов сахара для оценки кишечной проницаемости: использование анализа динамики изменений для оптимизации его использования для оценки региональной проницаемости кишечника.Clin Chim Acta. 2015; 10: 24–32.
Артикул
CAS
Google Scholar
Фархади А., Гундлапалли С., Шейх М., Францидес С., Харрелл Л. и др. Восприимчивость к неплотности кишечника: возможный механизм эндотоксемии при неалкогольном стеатогепатите. Liver Int. 2008. 28: 1026–33.
Артикул
PubMed
PubMed Central
Google Scholar
Хилсден Р., Меддингс Дж., Сазерленд Л.Изменения кишечной проницаемости в ответ на ацетилсалициловую кислоту у родственников пациентов с болезнью Крона. Гастроэнтерология. 1996; 110: 1395–403.
Артикул
PubMed
CAS
Google Scholar
Бен X-M, Li J, Feng Z-T, Shi S-Y, Lu Y-D, et al. Низкий уровень галактоолигосахарида в детской смеси стимулирует рост кишечных бифидобактерий и лактобактерий. Мир Дж. Гастроэнтерол. 2008. 14: 6564–8.
Артикул
PubMed
PubMed Central
Google Scholar
Вулевич Дж., Дракулараку А., Якуб П., Цорцис Дж., Гибсон Г.Р. Модуляция профиля фекальной микрофлоры и иммунной функции с помощью новой смеси трансгалактоолигосахаридов (B-GOS) у здоровых пожилых добровольцев. Am J Clin Nutr. 2008; 88: 1438–46.
PubMed
CAS
Google Scholar
Chandel D, Perez-Munoz M, Yu F, Boissy R, Satpathy R, et al. Изменения микробиоты кишечника после раннего приема пероральных синбиотиков младенцам в Индии.J Pediatr Gastroenterol Nutr. 2017; 65: 218–24.
Артикул
PubMed
PubMed Central
Google Scholar
Ковачева-Датчари П., Нильссон А., Акрами Р., Ли Ю.С., Де Ваддер Ф. и др. Улучшение метаболизма глюкозы за счет пищевых волокон связано с увеличением количества Prevotella. Cell Metab. 2015; 22: 971–82.
Артикул
PubMed
CAS
Google Scholar
Wu GD, Chen J, Hoffmann C, Bittinger K, Chen Y, et al. Связывание долгосрочных диетических моделей с кишечными микробными энтеротипами. Наука (80-). 2011; 334: 105–9.
Артикул
CAS
Google Scholar
Hjorth MF, Roager HM, Larsen TM, Poulsen SK, Licht TR, et al. Отношение микробов Prevotella к Bacteroides до лечения определяет успех потери жира в организме в течение 6-месячного рандомизированного контролируемого диетического вмешательства. Int J Obes.2018; 42: 580–3.
Angelakis E, Lagier JC. Примеры и методы, подчеркивающие связь между ожирением и микробиотой Microb Pathog Epub в преддверии печати 2016 г. https://doi.org/10.1016/j.micpath.2016.01.024.
Blekhman R, Goodrich JK, Huang K, Sun Q, Bukowski R, et al. Генетическая изменчивость хозяев влияет на состав микробиома на разных участках тела человека. Genome Biol. 2015; 16: 191.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Тишкофф С.А., Рид Ф.А., Ранчиаро А., Войт Б.Ф., Кортни С. и др. Конвергентная адаптация персистенции лактазы человека в Африке и Европе. Нат Жене. 2007; 39: 31–40.
Артикул
PubMed
CAS
Google Scholar
Szilagyi A. Новое определение лактозы как условного пребиотика. Можно J Гастроэнтерол. 2004; 18: 163–7.
Артикул
PubMed
Google Scholar
Parche S, Jacobs D, Arigoni F, Titgemeyer F, Jankovic I. Предпочтение лактозы перед глюкозой в Bifidobacterium longum NCC2705: glcP, кодирующий переносчик глюкозы, подвергается репрессии лактозы. J Bacteriol. 2006; 188: 1260–5.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Азкарат-Перил MA, Риттер А.Дж., Саваиано Д., Монтеагудо-Мера А., Андерсон С., Магнесс СТ, Кленхаммер Тр. Влияние короткоцепочечных галактоолигосахаридов на микробиом кишечника людей с непереносимостью лактозы.PNAS. 2017; 114: E367–75.
Антони Л., Нудинг С., Векамп Дж., Штанге Э.Ф. Кишечный барьер при воспалительном заболевании кишечника. World J Gastrointerol. 2014; 20: 1165–79.
Артикул
CAS
Google Scholar
Скарпеллини Е., Лупо М., Иегри С., Гасбаррини А., Де Сантис А. и др. Кишечная проницаемость при неалкогольной жировой болезни печени: ось кишечник-печень. Rev Последние клинические испытания. 2014; 9: 141–14.
PubMed
CAS
Google Scholar
Форсайт К., Шеннон К., Кордовер Дж., Фойгт Р., Шейх М. и др. Повышенная кишечная проницаемость коррелирует с окрашиванием альфа-синуклеином слизистой сигмовидной кишки и маркерами воздействия эндотоксина на ранних стадиях болезни Паркинсона. PLoS One. 2011; 6: e28032.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Чжун Ю., Цай Д., Цай В., Гэн С., Чен Л. и др. Защитный эффект энтерального питания с добавлением галактоолигосахаридов на барьерную функцию кишечника у крыс с тяжелым острым панкреатитом.Clin Nutr. 2009; 28: 575–80.
Артикул
PubMed
CAS
Google Scholar
Мартин Р., Лаваль Л., Чейн Ф, Микель С., Нативидад Дж. И др. Bifidobacterium animalis ssp. lactis CNCM-I2494 восстанавливает проницаемость кишечного барьера у мышей с хроническим легким воспалением. Front Microbiol. 2016; 7: 1–12.
Google Scholar
Агостини С., Губерн М., Тондеро В., Сальвадор-Картье С., Безирар В. и др.Продаваемый на рынок ферментированный молочный продукт, содержащий Bifidobacterium lactis CNCM I-2494, подавляет гиперчувствительность кишечника и нарушение кишечного барьера, вызванное острым стрессом у крыс. Нейрогастроэнтерол Мотил. 2012; 24: 376 – e172.
Артикул
PubMed
CAS
Google Scholar
Schroeder B, Birchenough GM, Stahlman M, Arike L, Johansson ME, et al. Бифидобактерии или клетчатка защищают от вызванного диетой разрушения слизи толстой кишки, опосредованного микробиотой.Клеточный микроб-хозяин. 2018; 23: 27–40.e7.
Артикул
PubMed
CAS
Google Scholar
Морел Ф., Дай К., Ни Дж., Томас Д., Парнет П. и др. α-Галактоолигосахариды в зависимости от дозы снижают аппетит и уменьшают воспаление у взрослых с избыточным весом. J Nutr. 2015; 145: 2052–9.
Артикул
PubMed
CAS
Google Scholar
Rodes L, Saha S, Tomaro-Duchesneau C, Prakash S.Микроинкапсулированные Bifidobacterium longum subsp. Infantis ATCC 15697 благоприятно модулирует микробиоту кишечника и снижает уровень эндотоксинов в крови у крыс F344. Biomed Res Int. 2014; 602832. https://www.hindawi.com/journals/bmri/2014/602832/abs/.
Canfora EE, van der Beek, Christina M Hermes GDA, Gijs GH, Jocken JWE, Holst JJ, et al. Дополнение диеты галактоолигосахаридами увеличивает бифидобактерии, но не повышает чувствительность к инсулину у лиц с преддиабетом, страдающих ожирением. Гастроэнтерология.2017; 153: 87–97.e3.
Артикул
PubMed
CAS
Google Scholar
Карвалью-Уэллс А.Л., Гельмольц К., Узел С., Мольцер С., Леонард С. и др. Определение пребиотического потенциала цельнозернового завтрака на основе кукурузы in vivo: исследование кормления человека.




