Литическая смесь: что это?
Когда не помогают жаропонижающие средства, для снижения температуры, в своей практике я использую литическую смесь. Что же это такое? А это смесь трёх препаратов. Составов литической смеси несколько. Я использовала лишь один состав, но опишу и другие. Её можно давать как в уколах, так и в таблетках. Но таблетки не дают такого положительного эффекта, как уколы. Своим детям я делала уколы маленьким шприцем с тонкой иглой. Обычно одного укола достаточно. Если Ваш ребенок подвержен аллергиям, то Вам не лишним будет дерматолог в алматы. Имеется в виду консультации, по поводуприема лекарств, свходящих в состав смеси.
Я использовала состав:
— но-шпа
— анальгин
— супрастин
Как известно, анальгин обладает отличным жаропонижающим и болеутоляющим эффектом, но в сочетании в другими лекарственными средствами. Пропорцию брала – на каждый год жизни ребёнка 0,1 мл (т.е. Одна десятая кубика шприца) каждого лекарства. У Вас получается 0,3 мл смеси если ребёнку годик. Если 2 годика, то смести будет 0,6 мл и так далее. Её колем в попу как обычный укол. Ампулы с оставшимися лекарствами не берегите и сразу выкиньте, они Вам не пригодятся дольше. А если придётся повторно колоть литическую смесь, то будите открывать новые ампулы.
Если 2 годика, то смести будет 0,6 мл и так далее. Её колем в попу как обычный укол. Ампулы с оставшимися лекарствами не берегите и сразу выкиньте, они Вам не пригодятся дольше. А если придётся повторно колоть литическую смесь, то будите открывать новые ампулы.
Обычно через 10-15 минут температура начинает снижаться. Если же нет – то необходимо вызывать скорую помощь.
Другой состав литической смеси:
— анальгин
— папаверин
— димедрол
Пропорция такая же, как в первом варианте смеси – по 0,1 мл каждого лекарства на каждый год жизни.
Хочу также сказать, если Вы сомневаетесь, колоть ли повторно смесь, то лучше позвонить в скорую и проконсультироваться. Я была в такой ситуации и звонила 03. Сказала, что пока вызывать не буду, хочу проконсультироваться. Меня перевели на педиатра, и он подсказал что делать.
Есть мнение, что литическую смесь можно колоть через каждый час. Лично я, в этом сомневаюсь и педиатр из «скорой» тоже не рекомендовал так часто колоть, сказал, что одного раза достаточно.
Не лишним будет, перед применением смеси, проверить ребёночка на предмет аллергии на препараты. Для этого нужно капнуть по капле каждого лекарства чуть ниже нижнего века. Если будут покраснения, зуд, чесание, то не стоит колоть такую смесь. Первый вариант смеси хорош тем, что в её составе присутствует супрастин. К слову сказать, в первом варианте смеси некоторые супрастин заменяют димедролом. Получается: но-шпа, анальгин, димедрол. Такой вариант лично я не использовала.
Коктейльная вечеринка при почечной колике
Коктейлем называют напиток, полученный путем смешивания нескольких компонентов. Большинство коктейлей представляет собой спиртные напитки, но существуют коктейли совершенно особого состава. Речь сейчас идет о фармакологических коктейлях, используемых для купирования почечной колики у больных с мочекаменной болезнью. Поэтому темой сегодняшнего поста будет коктейльная вечеринка при почечной колике.
Многокомпонентные коктейли из спиртосодержащих напитков чреваты головной болью и прочими прелестями алкогольной интоксикации. Опасность фармакологических коктейлей значительно больше: увеличивает риск аллергических реакций, нефротоксического действия и ульцерогенных осложнений. То есть, комбинируя разные фармакологические агенты во время почечной колики, мы увеличивает вероятность аллергии, повреждения почек, гастрита и язвы желудка.
Опасность фармакологических коктейлей значительно больше: увеличивает риск аллергических реакций, нефротоксического действия и ульцерогенных осложнений. То есть, комбинируя разные фармакологические агенты во время почечной колики, мы увеличивает вероятность аллергии, повреждения почек, гастрита и язвы желудка.
Опытный бармен должен приготовить коктейль, который хорошо ударит в голову, не оставив за собой симптомов тяжелого отравления. Точно также уролог старается подобрать такой состав фармакологического коктейля, который бы купировали почечную колику, но не нанес тяжелого удара по другим органам и самим почкам.
Традиционный коктейль при почечной колике включает в себя три элемента:
- водная нагрузка
- спазмолитик
- анальгетик
В карусели подробно разобрана тема составления коктейля с точки зрения современных исследований и мои субъективных представлений.
СПАЗМОЛИТИКИ
Самая частая рекомендация при почечной колике?
Но-шпа (дротаверин) 40 мг по 1-2 таблетки 3-4 раза в день
В Национальных рекомендациях по почечной колике от 2019 года прямо написано, что эта рекомендация не работает. Вот цитата из рекомендаций:
Вот цитата из рекомендаций:
Не рекомендуется пациентам с почечной коликой назначать спазмолитические препараты (дротаверин) с целью обезболивания [60]. Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1а)
В рекомендациях Европейской ассоциации урологов дротаверин даже не упоминается, так как давно доказано, что лучшим средством обезболивания при почечной колике являются нестероидные противовоспалительные препараты. Основополагающим исследованием является Кокрейновский обзор от 2015 года, на который ссылаются большинство специалистов
НПВС протии СПАЗМОЛИТИКОВ
Результаты Кокрейновского обзора 2015 года. При составлении обзора проанализировано 50 исследований, в которых приняли участие 5 734 пациента. НПВП – нестроидные противовоспалительные препараты.
- НПВП сильнее миотропных спазмолитиков (дротаверина или но-шпы)
- НПВП сильнее нейротропного спазмолитика растительного происхождения ( гиосцина)
- НПВП и спазмолитиков не эффективнее НПВП
- Индометацин оказался менее эффективным, чем другие НПВП.
 Обычно в рекомендациях упоминают диклофенак, ибупрофен, парацетамол и анальгин. Также есть исследования о высокой эффективности кеторолака.
Обычно в рекомендациях упоминают диклофенак, ибупрофен, парацетамол и анальгин. Также есть исследования о высокой эффективности кеторолака.
Afshar K1, Jafari S, Marks AJ, Eftekhari A, MacNeily AE.
Nonsteroidal anti-inflammatory drugs (NSAIDs) and non-opioids for acute renal colic
Cochrane Database Syst Rev. – 2015. – Vol. 29 – N6
ВОДНАЯ НАГРУЗКА
Традиционно всем больным с недавно начавшейся почечной коликой рекомендуют пить много жидкости (или ставят литровую капельницу с лазиксом). Все это делается с целью скорейшего выхода застрявшего в мочеточнике камня. Очень часто водную нагрузку дают пациентам до визуализации размеров и расположения камня. У меня подобная рекомендация вызывает возмущение.
- Во-первых, размер камня может быть таким крупным, что выйти самостоятельно он не сможет даже потенциально. В таком случае водная нагрузка лишь усилит болевой синдром.
- Во-вторых, в первые дни почечные колики протекают наиболее тяжело.
 Мы и так существенно превышаем допустимые дозы обезболивающих. А водная нагрузка лишь добавит пару лишних приступов почечных колик.
Мы и так существенно превышаем допустимые дозы обезболивающих. А водная нагрузка лишь добавит пару лишних приступов почечных колик. - В-третьих, для купирования почечной колики, наоборот, используют препараты антидиуретического гормона. Подобные препараты уменьшают диурез и уменьшают болевой синдром.
Ниже приведена полная цитата из национальных рекомендаций по почечной колике от 2019 года
Не рекомендуется пациентам с почечной коликой стимулирование диуреза путем внутривенного введения растворов электролитов и назначения препаратов из группы диуретиков для купирования почечной колики [68].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1а)
Комментарии: Кокрейновской метаанализ не выявил пользы от стимуляции диуреза у пациентов с почечной коликой. Тем не менее, ряд экспертов рекомендует потребление жидкости более 2-х литров в сутки с целью предотвращения дегидратации, особенно при приеме препаратов с потенциальным нефротоксическим действием.
литический укол состав — 3 рекомендаций на Babyblog.ru
Теперь я поняла значение этого предложения во всем его смысле. И,пожалуй, не желаю знать его даже моему злейшему врагу.Я никого и никогда так не боялась потерять, как сына, не могу передать всю полноту страха(
28 октября.Утро и день. Нам 3месяца, у нас все отлично, мы радуем маму, только сына не спит целый день(как потом пойму, что он чувствовал и сигнализировал мне, а я дура)
28 октября 16 чачов.Кабинет врача.Набрали хорошо,выросли, все отлично.
16-10 холл,огромная очередь нп рививки, ждем своей очереди. На душе не спокойно,говорю маме что давай через 2 недельки сделаем, в ответ-нет,лучше сейчас, перенесет лучше…(мамочка, как же ты ошибалась,а я идиотина не настояла на своем)
16-25 прививочный кабинет,старая мс(мразота) и тетка запалняющая журнал…поварачиваю его на животик, сердце колотится. ..говорю,дайте посмотреть флакон от вакцины, в ответ-я его выкинула и какое твое дело, и укол в попу,крик,укол второй,крик моего малыша…дальше не до спора было и прений.Вышли,не могу его успокоить, приезжаем домой сын кое-как успокаивается и засыпает… спит 4 часа.
..говорю,дайте посмотреть флакон от вакцины, в ответ-я его выкинула и какое твое дело, и укол в попу,крик,укол второй,крик моего малыша…дальше не до спора было и прений.Вышли,не могу его успокоить, приезжаем домой сын кое-как успокаивается и засыпает… спит 4 часа.
20-00-20-30… просыпается, думаю кушать, даю грудь не берет, вижу вялый, бледный…начинаю с ним разговаривает, он смотрит на меня, взгляд как будто в прострации, понимаю что что-то не то, градусник под мышку-температура 38 даю Нурофен он его выплевывает и в туже минуту начинает задыхаться, синеет подбородок, а потом он весь сам, судороги…градусник-38,7(температура скорее еще выше поднялась). окна настеж, скорая приезжает за 2 минуты, литическая смесь, ребенок дышит слава Богу..
время потерялось…вечер, приемное отделение, опрос врача, измерение температуры. Исмаил уже лялякает что-то и улыбается…я в обморочном состояние отвечаю на вопросы(думала молоко сгорит)…
Отделение для новорожденных и младенцев. Поселяют в палуту к девочки. а спрашивает с чем вы, начинает смеятся над мои ответом — что реакция на температуру, скорая привезла…млять я ей так в рожу хотела плюнуть..она говорит, а я даже не обращала вниание на температуру своего ребенка…ВСЕ ЯСНО.
а спрашивает с чем вы, начинает смеятся над мои ответом — что реакция на температуру, скорая привезла…млять я ей так в рожу хотела плюнуть..она говорит, а я даже не обращала вниание на температуру своего ребенка…ВСЕ ЯСНО.
вкратце о соседке по палате. Разговарились с ней среди ночи. Ее ребенку 4 месяца, с 2 месяцев дает прикорм и уже 4 месячная девочка сьедает БАНКУ прикорма, при этом сама мамаша удивляется почему ее девочка так мало набирает в весе…спрашивает, ты ему водичку даешь, я — нет, она округляет глаза и говорит ЕМУ НАДО ДАВАТЬ ВОДИЧКУ, В МОЛОКЕ ЕЕ НЕТ..я резко-он бы тогда не какал жидким и умер бы от обезвоживания…заткнулась…на следующий день меня перевели в отдельную палату…
Ночь прошла относительно хорошо, спал крепко из-за димедрола входящего в состав литической смеси…температура 37,3
Утром медсетра уколола мелкого, спрашиваю что это, она-АНТИБИОТИК…епт, какого черта?НА ВСЯКИЙ СЛУЧАЙ…иду к врачу, говорю, какого черта вы ребенку у которого реакция назначаете колоть антибиотики? в ответ-ты не умничай, я лучше знаю, если назначила, то будь добра выполнять назначения.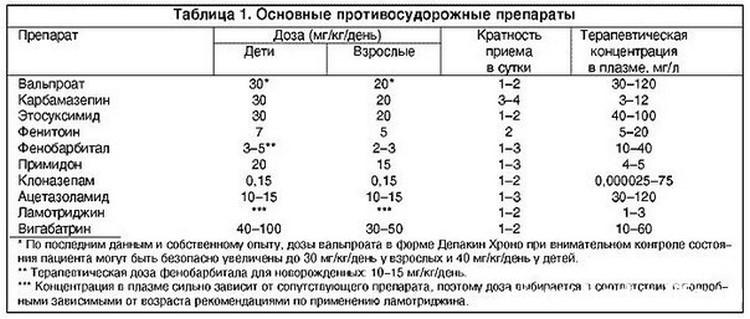 ..я ушла. В обед приходит мс с новой дозой антибиотика,я говорю идите вы на йух, не дам попу его хоть убей. Далее вечерний разговор моей мамы с врачом и отмена антибиотика!
..я ушла. В обед приходит мс с новой дозой антибиотика,я говорю идите вы на йух, не дам попу его хоть убей. Далее вечерний разговор моей мамы с врачом и отмена антибиотика!
Этим же днем часов в 17, температура опять поднимается,38,2, бегу за врачом, назначает этот гребаный Нурофен, он его ВЫРЫВАЕТ, опять укол литической, температура падает, малыш спит спокойно…
Остальный три дня что мы были температура держалась стабильно 36,6.
Теперь непосредственно о прививках- мама забрала карточку Исмаила, читаем, в прививках исправлена серия АКДС,гепатит проставлен задни числом.
Короче говоря нам в спешке влепили бубкок-это гепатит с АКДС(еще не факт что она не просроченная), хотя мелкому должны были сделать прививку гепатита позже, т.к. в роддоме ее не делали…
Все сумбурно написала, но сейчас в голове столько мыслей, переживаний…
Сейчас отсыпаемся дома, успели подхватить ОРВИ в больнице, ходим с соплями…Короче что не понос-то золотуха…
Девочки, настаивайте на том чтобы показывали и отдавали вам ампулу лично в руки. ..если чувствуете что что-то не так лучше не делайте…
..если чувствуете что что-то не так лучше не делайте…
У нас теперь медотвод до года…и неизвестно как в дальнейшем все это отразится на его психике…
Что такое литическая смесь и для чего она нужна
Основной препарат, входящий в состав литической смеси — «Анальгин». Он составляет до 50% всего объема лекарства. «Анальгин» оказывает жаропонижающее действие и снижает температуру. В дополнение к препарату используют «Димедрол», который усиливает терапевтический эффект «Анальгина» и оказывает антигистаминное (противоаллергическое) действие. Вместо «Димедрола» можно использовать «Супрастин» или «Тавегил».
В литическую смесь также включают «Папаверина гидрохлорид», оказывающий спазмолитическое действие. Препарат расширяет периферические сосуды и усиливает лечебный эффект «Анальгина». Показанием к внутримышечному введению литической смеси является высокая температура (от 38,5оС). Чаще всего ее используют при неэффективности жаропонижающих средств для приема внутрь («Нурофен», «Парацетамол» и т. д.). Литическую смесь также назначают при невозможности приема препаратов внутрь: при нарушениях сознания, рвоте, отказе принимать лекарство.
д.). Литическую смесь также назначают при невозможности приема препаратов внутрь: при нарушениях сознания, рвоте, отказе принимать лекарство.
Чтобы быстро снизить высокую температуру, литическую смесь вводят внутримышечно. В этом случае температура снижается уже через 10-15 мин. Взрослым и детям от 12 лет вводят 1 мл «Анальгина», 1,5-2 мл «Папаверина гидрохлорида», 1 мл Димедрола («Тавегила», «Супрастина»). Препараты набирают в 1 шприц и делают 1 инъекцию.
Для детей в возрасте до 12-ти лет состав и объем литической смеси рассчитывают, исходя из 0,1 мл каждого препарата на 1 год жизни. Например, для годовалого ребенка нужно набрать в шприц 0,1 мл «Анальгина» + 0,1 мл «Папаверина гидрохлорида» + 0,1 мл «Димедрола» и сделать внутримышечную инъекцию.
В случае острой необходимости приготовленную из растворов лекарств для инъекций литическую смесь можно принять внутрь. Температура понизится, но медленнее, чем при внутримышечном введении. Следует учитывать, что «Анальгин» не рекомендуется детям из-за его раздражающего действия на слизистую ЖКТ. В этом случае лучше использовать свечи.
В этом случае лучше использовать свечи.
Существуют лекарственные формы других жаропонижающих средств для приема внутрь (сиропы, суспензии). Их сочетания в возрастной дозировке использовать гораздо удобнее, нежели литическую смесь. В результате воздействия препаратов температура снизится в течение 30 мин — часа.
Литическая смесь противопоказана, если высокая температура сопровождается болями в животе. Ее использование может скрыть симптомы болезни и вызвать развитие состояний, опасных для жизни. Нельзя применять литическую смесь, если в течение последних 4-х часов для снижения температуры уже использовались средства, входящие в состав смеси (например, «Анальгин»). «Папаверина гидрохлорид» не используется в составе смеси для детей младше 6 мес.
Украинские националистические организации в годы Второй мировой войны. Документы: в 2 т. Т. 2: 1944–1945. М.: РОССПЭН, 2012.
905
Начальник отделения Богородчанского райотделаМВДСтаниславской об-
ластиБеспаловМ. Д. и оперуполномоченныйБорисовИ.З, вфеврале сего года
Д. и оперуполномоченныйБорисовИ.З, вфеврале сего года
незаконноарестовали гражданокСнитькоМариюиФанегуПрасковью.Вовре-
мя допроса избивалиих, а затемпосадили в холодное помещение.После осво-
бождения из-под ареста Снитько от побоев умерла. Труп Снитько в течение
2-х дней находился в ее квартире, *куда приходили крестьяне и возмущались
расправой, учиненнойнаднейврайотделеМВД*
I
.
Нарушения советской законности имеют место и со стороныместных пар-
тийных, советских работников, военнослужащих и бойцов истребительных ба-
тальонов.ПоСтаниславскойобластииз244случаевнарушенийсов. законности,
законности,
учтенных областной прокуратурой в 1945–1946 гг., 4 случая были совершены
партработниками, 30 случаев – советскими работниками, 50 случаев бойцами
истребительныхбатальонови49случаеввоеннослужащими.ПоТернопольской
области за 3 месяца (февраль – апрель 1946 г.) привлечено к уголовной ответ-
ственности за грубейшее беззаконие 50 человек, из них: 35 советских работни-
ков, 13сотрудниковМГБиМВДидвоевоеннослужащих.
Заслуживает серьезноговниманиявопрособистребительныхбатальонахв за-
падныхобластях, созданныхв1944 г. дляборьбысбандитизмом.Кначалу1946 г.
числобойцовистребительныхбатальоновсоставлялосвыше65 тыс. человек.По-
человек.По-
литическая работа в этих батальонах проводилась неудовлетворительно. Состав
батальонов оказался засоренным людьми, которые сами поддерживали связь с
бандитами. Врезультатеимелиместомногочисленные случаиразоружениябата-
льонов и сдачи оружия бандитам. ВСтаниславской области батальонов и захва-
чено605единицоружия.Приразоруженииэтихбатальоновтольковтрехслучаях
былооказаносопротивлениебандитам.Всвязисэтимвапреле–мае1946 г. была
проведена проверка (чистка) личного состава истребительных батальонов. При
проверкеисключеноизбатальоновповсем западнымобластям486человек.Нои
после этойчистки врядеобластейбыли случаи сдачиоружиябандитам
266
. ВТер-
ВТер-
нопольскойобласти13маясего годабандитамиразоруженыдвабатальона.
*Следует отметить, что за 1945 г. и 5 месяцев 1946 г. в западных областях
УкраинскойССРизъято 156 663 участника банди антисоветских организаций.
ПоданнымМВДУССРна1июня1946г.осталось126бандсчисломучастников
1204и290антисоветскихорганизаций, вкоторыхучтено2579человек*
II
.
При сложившейся обстановке борьбы с остатками бандитизма нет необхо-
димости иметь 52 тыс. вооруженных бойцов истребительных батальонов, тем
более, какпоказалопыт, будучиоторваныотпроизводительного труда, неимея
материальногообеспечениявистребительныхбатальонах,некоторыеизнихпе-
реходятнанелегальноеположениеили,бросаяоружие, устраиваютсянаработу,
ачастьбойцов занимаетсямародерством, грабежомиубийствами.
Допускаемыефактыпроизволаибеззаконияосложняютостановкунеселеи
ликвидацию бандитизма,широкоиспользуются украинско-немецкиминацио-
налистами в антисоветской агитацииинаносят вред делу сплочения основной
массы крестьян, бедняков и середняков на борьбу с кулацко-националисти-
ческимибандами.
I
Текстотчеркнутпростымкарандашомвертикальнойчертойнаполях.
II
Текстотчеркнутпростымкарандашомвертикальнойчертойнаполях.
Современные подходы к способам создания фаговой основы лечебно-профилактического препарата бактериофагов Pseudomonas aeruginosa Текст научной статьи по специальности «Фундаментальная медицина»
Современные подходы к способам создания фаговой основы лечебно-профилактического препарата бактериофагов Pseudomonas aeruginosa
O. A. Полыгач1 ([email protected]), Н. Н. Ворошилова1 ([email protected] ), Н. В. Тикунова2 ([email protected]), В. В. Морозова2 ([email protected]), А. Ю. Тикунов2 ([email protected]), В. Н. Крылов1 ([email protected]), А. А. Юнусова2([email protected]), А. Н. Дабижева3 ([email protected]) DOI:10.24411/2073-3046-2018-10004
1 Филиал ФГУП «НПО «Микроген» МЗ РФ в г. Уфа «Иммунопрепарат», 3 ФГУП НПО «Микроген», Москва
2 ФГБУН «Институт химической биологии и фундаментальной медицины» Сибирского Отделения РАН, г. Новосибирск
Резюме
Лечебно-профилактические препараты бактериофагов применяются в качестве эффективного современного средства антимикробной терапии синегнойной инфекции. Бактериофаги, входящие в состав препаратов должны быть изучены на предмет подтверждения их литических и генетических свойств, что обеспечивает безопасность и эффективность применения препаратов. В нашем исследовании для конструирования фаговой основы препарата были изучены биологические и морфологические свойства, определен спектр антибактериальной активности бактериофагов выделенных в различных регионах России. Важнейшим этапом работы явилось проведение исследований по обеспечению генетической безопасности препаратов бактериофагов. В результате составлена композиция из 6 штаммов литических бактериофагов P. aeruginosa (PaUfa № № 1, 2, 3, 4, 6, 7), относящихся по морфологии вирионов к семействам — Podoviridae и Myoviridae, порядка Caudovirales, к литическим генетическим группам phiKMV-likevirus, N4-likevirus, PB1-likevirus. Композиция обладает максимально широким спектром антибактериальной активности (90,7%) в отношении 818 эпидемиологически значимых госпитальных и клинических штаммов бактерий P. aeruginosа, а также достаточно универсальна для различных удаленных территорий России и стран СНГ. Ключевые слова: бактерии P. aeruginosa, бактериофаги P. aeruginosa, препарат бактериофагов, антибактериальная активность
Modern Approaches to the Methods of Creating of Phage Basis for Treatment-Prophylactic a Drug of Bacteriophages Pseudomonas aeruginosa
0. A. Polygach2 ([email protected]), N. N. Voroshilov1 ([email protected]), N. V. Tikunova2 ([email protected]), V. V. Morozova2 ([email protected]), A. Y. Tikunov2 ([email protected]), В. N. Krylov1 ([email protected]), А. А. Yunusova2 ([email protected]), A. N. Dabizheva3 ([email protected]) D0l:10.24411/2073-3046-2018-10004
1,3 The Federal State Unitary Enterprise «Scientific and Production Association for Immunological Preparations«Microgen»of the Ministry
of Health of the Russian Federation 2 Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences, Novosibirsk Аbstract
Therapeutic and prophylactic preparations of bacteriophages are considered as an effective modern means of antimicrobial therapy of Pseudomonas aeruginosa infection. Bacteriophages that are part of the drugs must be certified for confirmation of their lytic and genetic properties, which ensures the safety and effectiveness of the use of drugs. In our study, biological and morphological properties were studied for drug design, the spectrum of antibacterial activity of bacteriophages isolated in various regions of Russia was determined. The most important stage of the work was research on ensuring genetic safety of bacteriophage preparations. As a result, a composition of 6 strains of lytic bacteriophages of P. aeruginosa (PaUfa №№ 1, 2, 3, 4, 6, 7) composed of the morphology of the virions to the families Podoviridae and Myoviridae, the order of Caudovirales, phylogenetic genetic groups phiKMV-likevirus , N4-likevirus, PB1-likevirus. The composition has a wide spectrum of antibacterial activity (90.7%) with respect to 818 collisional, epidemiologically significant hospital and clinical strains of P. aeruginosa bacteria, and also quite versatile for various remote territories of Russia and CIS countries. Key words: bacteria P. aeruginosa, bacteriophages P. aeruginosa, the bacteriophage preparation, antibacterial activity
Введение
Бактерии Pseudomonas aeruginosa обладают способностью поражать все органы и ткани макроорганизма, вызывают до 20% всех
внутрибольничных инфекций, считаются одними из основных возбудителей нозокомиальных пневмоний, приводят к тяжелейшим осложнениям при легочной форме муковисцидоза (61%)
и раневых инфекциях (10%), к нагноению ожоговых ран (10-30%) [1, 2]. Синегнойные бактериемии характеризуются высокой смертностью (от 18 до 61%), поскольку бактерии P. aeruginosa обладают высокой резистентностью к большинству антибиотиков, в частности, пенициллинового (100%), тетрациклинового рядов, к аминогликозидам (60-85%), фторхинолам (77%), цефалоспоринам (60-85%) [2, 3].
Исходя из выше приведенных данных, использование бактериофагов становится все актуальнее, а иногда единственным альтернативным способом антибактериальной терапии. В России для лечения и профилактики синегнойных инфекций производятся, широко и достаточно эффективно используются монопрепарат Бактериофаг синегнойный и поливалентные препараты бактериофагов, включающие компонент P. aeruginosa. Спектр антибактериальной активности существующих препаратов бактериофагов P. aeruginosa в отношении клинических и госпитальных штаммов бактерий гомологичного вида варьирует в значительных пределах, по данным Е. Г. Додовой — 43,0%, и Н. И. Габриелян — 61,5%, Т. ющие генетические характеристики, свидетель-го ствующие о литической природе бактериофагов.
1 Кроме того, по требованиям «Правил проведе-| ния исследований биологических лекарственных «о средств Евразийского экономического союза § от 06.05.17 г.» для обеспечения генетической без-I опасности терапевтического применения препара-™ тов бактериофагов каждый штамм, используемый I в препаратах, должен «быть изучен с помощью мо-§ лекулярно-генетических методов (полногеномное 1 секвенирование) для определения полной нукле-I отидной последовательности ДНК с последующим т биоинформационным анализом» [8].
Целью исследований — разработка способа конструирования фаговой основы лечебно-профилактического препарата бактериофагов Pseudomonas aeruginosa, на основе бактериофагов, полученных из различных территориальных регионов, с изученной антибактериальной активностью, биологическими, морфологическими и генетическими свойствами.
Материалы и методы
С учетом современных знаний были изучены биологические, морфологические и генетические свойства бактериофагов для отбора и подтверждения литической природы (вирулентности) бактериофагов.
Для создания эффективной фаговой основы препарата использовалась эпидемиологически
значимая коллекция госпитальных и клинических штаммов бактерий P. aeruginosa, в том числе и антибиотикорезистентных. Исследовались семь штаммов бактериофагов P. aeruginosa (PaUfa №№ 1, 2, 3, 4, 5, 6, 7), выделенных и отобранных из различных источников внешней среды 34 городах России методом клонирования [9]. Штаммы были отобраны с учетом различия регионов, степени фаголизиса и особенностям морфологии негативных колоний.
Для выделения штаммов бактериофагов P. aeruginosa, а также сравнительного изучения спектра их антибактериальной активности использовали 818 эпидемиологически значимых госпитальных и клинических штаммов бактерий P. aeruginosa (в том числе, 244 све-жевыделенных в 2016-2017 гг.) типичных по своим культуральным, морфологическим и биохимическим свойствам, 100% резистентных к одному или нескольким антибиотикам. Госпитальные и клинические штаммы бактерий P. aeruginosa, выделенных от больных с различной патологией, получены от санитарно-эпидемических служб и из стационаров 30 городов различных регионов России и стран СНГ (Казахстана, Украины, Туркменистана, Узбекистана), а также из Болгарии.
Широту спектра антибактериальной активности отдельных штаммов бактериофагов Р. aeruginosa, их комбинаций определяли по методу Аппельмана [7] в разведении 10-1 на 818 выше указанных бактериальных штаммах Р. aeruginosa.
Для культивирования бактерий и бактериофагов P. aeruginosa использовали мясо-пептонный бульон, мясо-пептонный агар (с 0,4, 0,7 и 1,5% содержания агара).
Особенности фаз взаимодействия штаммов бактериофагов Р. aeruginosa с бактериальными клетками гомологичного вида бактерий определяли в одиночном цикле размножения [9, 10]. Изучены степень и скорость адсорбции штаммов бактериофагов на бактериальных клетках гомологичного вида, длительность латентного периода их внутриклеточного размножения, величина выхода фагов из одной инфицированной бактериальной клетки (урожайность).
Изучение морфологии негативных колоний штаммов бактериофагов проводили при высеве их двухслойным методом Грациа в 0,7% агаровой среде [7], определение свободного литического фермента штаммов бактериофагов Р. aeruginosa проходило на 1,5% агаровой питательной среде по методу В. А. Зуева [11]. Частоту образования фагоустойчивых мутантов определяли по методу, описанному У. Хейс [12].
Изучение морфологии вирионов выделенных нами штаммов бактериофагов Р. aeruginosa проведено методом электронной микроскопии. Суспензии бактериофаговых вирионов для электронной микроскопия очищали от бактериальных примесей методом ультрацентрифугирования в градиенте
хлористого цезия [13]. Таксономическую принадлежность изучали с использованием электронного микроскопа JEM-1400 (Jeol, Япония), оснащенного цифровой камерой бокового ввода Veleta (SIS, Германия).
Для проведения анализа генома штаммов бактериофагов Р. aeruginosa выделяли ДНК штаммов бактериофагов методом экстракции фенол-хлороформом с предварительной ферментативной обработкой РНКазой А, ДНКазой I и Протеиназой К (Thermo Fisher Scientific, США) [14]. Далее проводили гидролиз полученных фаговых ДНК различными эндонуклеазами рестрикции (HindIII, EcoRI, EcoRV, PciI, NcoI, HpaI, MfeI, DraI, NotI) производства HПО «СибЭнзим» с целью получения рестрик-ционных профилей для каждого из типируемых бактериофагов. Использовали маркер 50 kb (п.н.: 48502, 39 936, 24730, 15 206, 10 000, 8000, 6000, 5000, 4000, 3000, 2500, 2000, 1500, 1000, 750, 500, 250) HПО «СибЭнзим». Реакцию вели при 37 °С в течение 2-3 часов. Результаты гидролиза оценивали методом гель-электрофореза в 0,8% агарозе.
Секвенирование библиотек ДНК проводили на платформе Illumina Miseq. Сборка нуклеотид-ных последовательностей de novo была выполнена с помощью пакета ABYSS. Поиск открытых рамок трансляции (ОРТ), таксономическая и функциональная идентификация этих ОРТ была проведена
с помощью программного обеспечения MG-RAST с использованием последовательностей ДНК, находящихся в базах данных GenBank и др.
Результаты и обсуждение
Из 34 проб сточной воды и почвы с использованием 818 эпидемиологически значимых госпитальных и клинических штаммов бактерий P. aeruginosa нами выделены 107 штаммов бактериофагов P. aeruginosa, из которых для дальнейших исследований с учетом разнообразия регионов выделения и особенностей морфологии негативных колоний были отобраны семь штаммов бактериофагов P. aeruginosa. Города и регионы, представлены районами Сибири, Дальнего востока, и Европейской территорией России: PaUfa №№ 1, 2 (г. Уфа), PaUfa № 3 (г. Хабаровск), PaUfa № 4 (г. Москва), PaUfa № 5 (г. Владивосток), PaUfa № 6 (г. Новосибирск), PaUfa № 7 (г. Иркутск).
Изучение биологических свойств семи отобранных штаммов бактериофагов Р. aeruginosa показало, что все штаммы PaUfa № № 1, 2, 3, 4, 5, 6, 7 в одиночном цикле внутриклеточного размножения в бактериальных клетках характеризуются литическим циклом развития, завершающимся фа-голизисом бактерий и параметрами фаговой инфекции, приведенными в таблице 1.
Известно, что у многих литических бактериофагов фаголизис бактериальной клетки
Таблица 1.
Характеристики биологических свойств штаммов бактериофагов P.aeruginosa*
а ф
о
и р
е
а <и н я Э CL
s а ~
§£2 юяя рб бф сох в са lieg янС >s
oSs
5 g Í
л но авр мо п
у! 3
яос Es™
м
ек ра
<u я
mis CL
К m кто
1 £
2 % я ^
= 3
во ор
»siS1?
но os
Яф №
¡E 2
U <v n.
•»РЧ
Щ
¡ÉO1?
х
-а
вев & § 2
оа н
ое Ü
та
я a|
но о „
о1 CC 1 ?т «i s нойм
с<иа —
<uc<u«o
5s£¡= So.«» El НЮ
к
— § 5 s ° I
o-o 10
«
S я s иио я Äs
Я|! s
» . S 10 я
S 1 Ä
ын a
£0 1 ¡5
а а o 2и с
Hf ®
со
Морфология негативных колоний штаммов бактериофагов P. aeruginosa
Диаметр негативной колонии (мм)
Ширина зоны неполного лизиса (мм)
нм
i Ё ш
я S
S Я
ие ант
Ü лр ае
х -е-
s= О
I = >= ï
S = = 5
= S
!§ >S и
m X mg
SSO.S Oilh-
я ыг
PaUfa- 1
5,9 t 0,74
95,14 t 0,84
(2,4 t 0,14) x10-9
20 t 0,7
82,6 t 2,5
5,3 t 0,44
1,24 t 0,25
0,84 t 0,08
51,0
PaUfa — 2
6 t 0,61
95,9 t 0,76
(2,95 t 0,11) x10-9
19,3 t 0,83
9,8 t 1,3
6,1 t 0,54
0,9 t 0,1
0,78 t 0,04
49,0
PaUfa — 3
,1 t 0,74
,4 t 0,58
(2 t 0,12) x10-9
26,8 t 3,5
11,6 t 2,1
4,5 t 0,5
0,96 t 0,2
3,2 t 0,27
11,4
PaUfa — 4
11 t 0,i
90 t 0,74
(6,79 t 0,09) x10-8
35 t 2
10 t 1,6
2,3 t 0,45
1,23 t 0,24
2,8 t 0,27
24,2
PaUfa — 5
11 t 0,74
91,6 t 2
(5,4 t 0,2) x10-8
32,2 t 4,1
10,8 t1,9
1,24 t 0,25
0,4 t 0,2
3,2 t 0,27
53,1
PaUfa — 6
10 t 1,14
89,3 t 1,2
(1,53 t 0,12) x10-9
30 t 5
12 t 1
2,18 t 0,21
30,0
PaUfa — 7 7,7 t 0,44 92,7 t 0,
(1,54 t 0,1) x10-9 28,6 t 2,2 19,6 t 1,14
2,8 t 0,21
1,8 t 0,2
1,74 t 0,29
17,4
Композиция из штаммов бактериофагов PaUfa № 1, 2, 3, 4, 5, 6, 7
91,7
Примечание:*С 1 по 9 столбец статистическую обработку проводили путем определения среднего значения и стандартного отклонения.
нет
сопровождается образованием литического фермента, который участвует в растворении клеточной стенки изнутри в завершении латентного периода внутриклеточного размножения бактериофага. Степень образования литического фермента у вновь выделенных штаммов бактериофагов Р. aeruginosa различна — П E от 0 до (3, 2 ± 0,27) мм (табл. 1).
Свидетельствующая о литической природе бактериофагов — низкая частота образования фа-гоустойчивых мутантов бактерий P. aeruginosa находилась для штаммов PaUfa № № 1, 2, 3, 4, 6, 7 в пределах от 0,0133 х 10-8 до 3,1х10-8, что свидетельствует о достаточно высокой степени их антибактериальной активности. Наиболее активными были штаммы PaUfa № № 2, 3, 4 (табл. 2). Штамм бактериофага PaUfa № 5 был менее активен, на что указывала высокая частота образования фа-гоустойчивых мутантов бактерий P. aeruginosa от 3,19 х 10-5 до 5,5 х 10-6.
При изучении частоты образования фаго-устойчивых мутантов под действием различных вариантов комбинаций штаммов бактериофагов P. aeruginosa установлено, что наиболее эффективной была комбинация, включавшая все 7 штаммов бактериофагов PaUfa № № 1, 2, 3, 4, 5, 6, 7, при действии которых наблюдалось снижение частоты образования фагоустойчивых мутантов на два-три порядка: до 2,13 х 10-9 и 0 — без образования колоний вторичного роста (см. табл. 2).
Для введения в состав препаратов только строго литических бактериофагов, в геноме которых отсутствуют какие либо гены токсичности, лизоге-нии, антибиотикоустойчивости и др. исследовались генетические свойства отобранных штаммов бактериофагов. Изучение рестрикционных профилей фрагментированных эндонуклеазами ДНК показало, что ДНК штаммов бактериофагов имеют различные сайты узнавания за исключением штаммов PaUfa № № 1, 2 (рис. 1). Полученные результаты
при сравнении сайтов узнавания в программе Vector NTI c гомологами из Genbank свидетельствуют о том, что бактериофаги PaUfa №№ 1, 2, 3, 4, 5, 6, 7 проявляют гомологию рестрикционных сайтов ДНК с некоторыми представителями четырех известных литических групп бактериофагов P. aeruginosa phiKMV-likevirus, PB1-likevirus и N4-likevirus и phiKZ-likevirus, имеющих литическую природу.
Наиболее информативная характеристика геномов бактериофагов была получена аннотацией нуклеотидных последовательностей, определенных посредством высокопродуктивного полногеномного секвенирования ДНК бактериофагов. Установлено, что шесть штаммов бактериофагов PaUfa № № 1, 2, 3, 4, 6, 7 принадлежат к уже известным литическим генетическим группам: phiKMV-likevirus, PB1-likevirus и N4-likevirus и один штамм PaUfa № 5 к группе phiKZ- likevirus (табл. 3). В геноме штаммов бактериофагов PaUfa № № 1, 2, 3, 4, 6, 7 отсутствуют гены антибиотикоустойчивости, токсичности, лизогении и рекомбиназ, что позволяет использовать их в качестве основы лечебно — профилактического препарата бактериофагов Р. aeruginosa.
Аннотация нуклеотидной последовательности генома бактериофага PaUfa № 5 группы phiKZ- likevirus показала наличие в его геноме фаг-ассоцированной рекомбиназы. Проведенный с помощью сервера MG-RAST мониторинг геномов двух представителей литической группы phiKZ фагов депонированных в GenBank, в том числе секвенированных в начале 2000 гг., также показал наличие потенциальных фаговых рекомбиназ в депонированных геномах (табл. 4), а у штамма NC 007623 присутствие в геноме потенциального мобильного элемента белка. Присутствие в геноме потенциальных рекомбиназ предполагает, что в процессе бактериофаговой инфекции гипотетически возможен обмен нуклеотидными
Таблица 2.
Частота образования фагоустойчивых мутантов бактерий Р. aeruginosa под действием штаммов бактериофагов Р. aeruginosa РaUfa №1,2,3,4,5,6,7
Количество бактериальных штаммов, п=21 Исследуемые штаммы бактериофагов
PaUfa-1 PaUfa-2 PaUfa-3 PaUfa-4 PaUfa-5 PaUfa-6 PaUfa-7 Совокупность штаммов бактериофагов PaUfa №№ 1, 2, 3, 4, 6, 7
Частота образования фагоустойчивых мутантов От 0,0113 х 10-8 до 6,93 х 10-7 От 2,85 х 10-6 до 6,9 х 10-7 От 1,73 х 10-6 до 3,1 х 10-8 От 5,7 х 10-6 до 2,7 х 10-7 От 3,19 х 10-5 до 5,5 х 10-6 От 2,21 х 10-6 до 3,4 х 10-7 От 1,55 х 10-6 до 7,1 х 10-7 От 7,1 х 10-8 до 0
Рисунок 1. HindШ DraI
PaUfa №7
М EcoRV ApaI EcoRI HpaI НЫШ NcoI
Примечание: Названия использованных эндонуклеаз рестрикции указаны над соответствующими дорожками.
Л1
Таблица 3.
Морфологические и генетические характеристики штаммов бактериофагов Р. aeruginosa — таксономическая и функциональная идентификация штаммов бактериофагов по аналогии и с использованием последовательностей ДНК, находящихся в базах данных GenBank, IMG, PATRICK, SEED, SwissProt, RefSeq, TrEMBL, KEGG, KO, COG, NOG и морфология фаговых вирионов
№ штамма бактериофага Р. aeruginosa Количество предполагаемых открытых рамок трансляции Таксономическая принадлежность бактериофагов по результатам анализа генома Наличие генов рекомбинации генов кодирующих токсины Таксономия и морфология фаговых вирионов (по данным электронной микроскопии)
PaUfa -1 48 Семейство Роёоу’мШае, рЫК1^-!1ке-у1гиБ, наиболее близкий геном фага РТ5 (Е1Ю56923) Отсутствуют Семейство Podoviridael капсид 48-55 нм, хвост 12-14 нм. (АР399011) Присутствует ген фаговой рекомбиназы Семейство Myoviridae, капсид 115 нм, хвост 153 нм, размер воротничка 37 нм
№ штамма бактериофага Р. aeruginosa
Количество предполагаемых открытых рамок трансляции
Таксономическая принадлежность бактериофагов по результатам анализа генома
Наличие генов рекомбинации генов кодирующих токсины
Таксономия и морфология фаговых вирионов (по данным электронной микроскопии)
PaUfa -6
89
Семейство Podoviridae, N4-likevirus, наиболее близкий геном фага PA26 (JX194238)
Отсутствует
Семейство Podoviridae,
капсид 60-65 нм, хвост 12.5 нм
PaUfa -7
61
Семейство Podoviridae, N4-likevirus, наиболее близкий геном
фага vB_PaeP_C2-
10_Ab09 (HG962375)
Отсутствует
Семейство Podoviridae, капсид 50-60 нм, хвост 12,5 нм
Таблица 4.
Гены рекомбиназ у различных бактериофагов — представителей группы phiKZ -likevirus
Бактериофаги группы phiKZ Присутствие phage-associated recombinase у представителей группы phiKZ-likevirus
PaUfa -5 atgaataaaccagaattactttaccatggttctctttataaacaagatgaattaatgccaggatttaaaagatctggtgaacttgttatgtgggatgg tattgagtctaaccaatacctatatgcaacgtcatctgaaaaagatgcatcttatttaggtattggtagcgctatcgaaaagttatttgatagtgatag atatgctactgttgatagggatattacaatctattgtcaaaataatatcgataaaaatgatattttaaaaatggttgtgtatgtttataccattccattta gggactctgacaaatggattaagaataataatcctcacaatagcattgatactgagtggattacgaaaaacactatccatgatgttactgtaaggaa attagatattggtgaatttttaaaaggtgctcgcttaactgtcactaaagcaccagtggatgttgatccattaaacatcatgtcacaatatcgttcagta acagagcgttatctgttttaa
NC_004629 atgaataaaccagaattactttaccatggttctctttataaacaagatgaattaatgccaggatttaaaagatctggtgaacttgttatgtgggatgg tattgagtctaaccaatacctatatgcaacgtcatctgaaaaagatgcatcttatttaggtattggtagcgctatcgaaaagttatttgatagtgatag atatgctactgttgatagggatattacaatctattgtcaaaataatatcgataaaagtgatattttaaaaatggttgtgtatgtttataccattccattta gggactctgacaaatggattaagaataataatcctcacaatagcattgatactgagtggattacgaaaaacactatccatgatgttactgtaaggaa attagatattggtgaatttttaaaaggtgctcgcttaactgtcactaaagcaccagtggatgttgatccattaaacatcatgtcacaatatcgttcagta acagagcgttatctgttttaa
NC_028999 аtgccagggtttaaacgctctggtcaactatcggtgtgggatggtgttgagtctaaccttaatctctacgcaaccaccagtaaggaggaagcgtac gacctagggatcggttcagctactgagaagaactatgactcggatcgtttcaccacgatcgatgggaatatctgggttttctgccagaagccgatt gatatcacgcaatggttacagatggagctttactgctacactattccatttcgtgaaacggatggttgggttaagaacaagaacccgtacaacaaca ttgatactgagtggactactcgtaagactgttcacaatgtcagtgttgagcaagtagacatgcgtaccgtgctcaaaggtcgttgcgtaacgatcac acaagcgcctatggacgtcgatctgtctcaactactccgtaagtaccgggacgttacgaaagtttaccatatctaa
комбинациями с гомологичным бактериофагом и/или бактерией хозяином, что может предшествовать возникновению приобретения новых свойств, в том числе лекарственной устойчивости и др. [15]. Поэтому на данный момент включение в состав препарата бактериофагов группы \ikevirus
не представляется целесообразным, а требует дальнейшего изучения.
По данным электронно-микроскопического исследования, описана морфология вирионов
бактериофагов Р. aeruginosa PaUfa № № 1, 2, 3, 4, 6, 7 (см. табл. 3) и показана их принадлежность к двум семействам — Podoviridae и Myoviridae, порядка Caudovirales.
Изучение в тесте Аппельмана в разведении 10-1 (рис. 2) спектра антибактериальной активности отобранных и изученных штаммов бактериофагов Р. aeruginosa на 818 госпитальных и клинических штаммах бактерий показало, что штаммы группы phiKMV-likevirus имели наиболее широкий спектр
Рисунок 2.
Сравнительные данные изучения спектра антибактериальной активности штаммов бактериофагов P. aeruginosa, их композиций и официнального препарата Бактериофага Pseudomonas aeruginosa (% фагочувствительных штаммов из 818 госпитальных и клинических бактериальных штаммов бактерий P.aeruginosa, выделенных в России, странах СНГ, Болгарии и Грузии, в том числе:
Спектр антибактериальной активности
i PaUfa-l
i PaUfa-4
PaUfa-7
PaUfa-2
PaUfa-5
PaUfa-3
PaUfa-6
PaUfa-l,2,3,4,5,6,7 PaUfa-1,2,3,4,6,7
Примечание: № 1-7 отдельные вновь выделенные штаммы бактериофагов P. aeruginosa — PaUfa 1,2,3,4,5,6,7; № 8 — композиция штаммов бактериофагов PaUfa 1,2,3,4,5,6,7; № 9 — композиция штаммов бактериофагов PaUfa 1,2,3,4,6,7.
антибактериальной активности: штамм PaUfa № 1 активен в отношении 51%, штамм PaUfa № 2 -49,0%. Несмотря на то, что штаммы бактериофагов Р. aeruginosa PaUfa № № 6, 7, 3 (группа N4-likevirus) характеризовались менее широким спектром антибактериальной активности соответственно 30,0, 17,4 и 11,4% и штамм бактериофага PaUfa № 4 (PB1-like группа)- 24,2% штаммов, они реципрок-тно дополняли друг друга и со штаммами группы phiKMV-likevirus суммарно обеспечивали антибактериальную активность в отношении 90,7% из 818 клинических и госпитальных штаммов бактерий Р. aeruginosa (см. рис. 2, см. табл. 3).
В результате проведенного отбора получена высокоэффективная композиция — фаговая основа препарата, содержащего компонент P. aeruginosa. Добавление штамма PaUfa № 5 (phiKZ-likevirus) в композицию из 6 штаммов бактериофагов незначительно, всего на 1% — до 91,7%, расширяло спектр антибактериальной активности композиции штаммов бактериофагов PaUfa № № 1, 2, 3, 4, 6, 7 (см. рис. 2).
Установлено отсутствие региональной специфичности широты спектра антибактериальной активности 7 отобранных штаммов бактериофагов P. aeruginosa и их комбинаций. Так, штаммы бактериофагов P. aeruginosa, выделенные в различных регионах РФ, обладали антибактериальной активностью в отношении штаммов бактерий P. aeruginosa из других достаточно удаленных регионов РФ и СНГ. Штаммы PaUfa № № 3, 5,
выделенные из образцов, полученных из городов Дальнего Востока (г. Хабаровск, г. Владивосток), были активны в отношении бактерий P. aeruginosa, выделенных в регионах Дальнего Востока, Сибири, на европейской территории России, в Болгарии, Украине и Грузии. Штаммы бактериофагов PaUfa №№ 6, 7, выделенные из образцов, полученных из г.Новосибирск и г. Иркутск были активны в отношении бактерий P. aeruginosa, выделенных в регионах Сибири, Дальнего Востока, на европейской территории России, в Туркменистане, Узбекистане, Казахстане. Штаммы PaUfa № № 1, 2, 4, выделенные в г. Уфа и Москва, были активны в отношении бактерий P. aeruginosa, выделенных в регионах Сибири, Дальнего Востока, на европейской территории России, в Казахстане, Болгарии, Украине, Грузии.
Приведенные данные свидетельствуют, что использование разработанного нами способа создания фаговой основы препарата бактериофага P. aeruginosa и максимальное расширении географии регионов поиска и выделения высокоактивных литических бактериофагов P. aeruginosa (34 региона) и патогенных бактерий P. aeruginosa (30 регионов) позволяет избежать территориальной привязки антибактериального спектра действия препарата бактериофагов P. aeruginosa и позволяет создать фаговую основу препарата бактериофагов P. aeruginosa высоко эффективную по спектру антибактериальной активности в отношении эпидемиологически значимых госпитальных
и клинических штаммов бактерий Р.авги£\поза и достаточно универсальную для различных удаленных территорий России и СНГ.
Заключение
В результате проведенных исследований разработаны новые способы создания фаговой основы препарата бактериофагов P.aeruginosa, обеспечивающие широкий спектр его антибактериальной активности, высокую эффективность и генетическую безопасность терапевтического использования — создана высокоэффективная бактериофаговая композиция из 6 штаммов лити-ческих бактериофагов P. aeruginosa — PaUfa №№ 1, 2, 3, 4, 6, 7, вновь выделенных нами в различных регионах России, относящихся по морфологии вирионов к семействам — Podoviridae и Myoviridae, порядка Caudovirales, к литическим генетическим группам phiKMV-likevirus, N4 — likevirus, PB1-likevirus, обладающая максимально широким
спектром антибактериальной активности (90,7%) в отношении 818 эпидемиологически значимых госпитальных и клинических штаммов бактерий P. aeruginosа.
Установлено отсутствие региональной территориальной зависимости спектра антибактериальной активности вновь выделенных, изученных штаммов бактериофагов P. aeruginosa и региона выделения клинических и госпитальных штаммов патогенных бактерий P. aeruginosa, что позволило максимально расширив географию регионов поиска для выделения высокоактивных литических бактериофагов P. aeruginosa и патогенных бактерий P. aeruginosa создать фаговую основу препарата высоко эффективную по спектру антибактериальной активности в отношении эпидемиологически значимых госпитальных и клинических штаммов патогенных бактерий P. aeruginosа и достаточно универсальную для различных удаленных территорий России и стран СНГ.
Литература
9.
10.
11. 12.
13.
14.
15.
Кузнецова М. В. Распространенность возбудителя и разнообразие нозоологических форм синегнойной инфекции. Здоровье семьи — 21 век. 2014; 2: 84-112. Лазарева А.В., Чеботарь И.В., Крыжановская О.А., Чеботарь В.И., Маянский Н.А. Pseudomonas aeruginosa: патогенность, патогенез и патология. Клиническая микробиология и антимикробная химиотерапия. 2015; том 17 ( 3): €.170-187.
Тикунова Н. В., Ворошилова Н. Н. Н. В. Тикунова, В. В. Морозова, А. Ю. Тикунов, А. М. Курильщиков. Генетическая характеристика и спектр антибактериальной активности бактериофагов,-входящих в состав промышленных серий лекарственного препарата Пиобактериофаг поливалентный очищенный. Эпидемиология и Вакцинопрофилактика. 2016; 2 (87): 93-100.
Додова Е. Г., Горбунова Е. А., Аполихина И. А. Постантибиотиковая эра: бактериофаги как лечебная стратегия. Медицинский совет. 2015; 11::49-53. Габриэлян Н. И., Горская Е. М., Спирина Т. С., Прудникова С. А., Ромашкина Л. Ю. Исследование антибиотико- и фагочувствительности нозокомиальных штаммов микробов, выделенных от пациентов трансплантологической клиники. Вестник трансплантологии и искусственных органов. 2011; 3: 26-32. Салмина Т. А., Цыгипало А. И., Шкода А. С. Опыт применения пиобактериофага поливалентного очищенного для лечения гнойных ран при длительном и неэффективном лечении антибактериальными препаратами. Трудный пациент. 2016; 10 — 11: 5-11.
Общая фармакопейная статья Бактериофаги. 0ФС.1.7.1.0002.15. Государственная фармакопея Российской Федерации. XIII издание. Том II. Правила проведения исследований биологических лекарственных средств Евразийского экономического союза от 06.05.17г, решение №89 от 03.11.2016 г. Доступно на: https://docs.eaeunion.org/docs/ru-ru/01411954/cncd_21112016_89. Адамс М. Н. Бактериофаги. Москва: Издательство иностранной литературы; 1961: 527.
Zhenhui Cao, Jiancheng Zhang, Yan D.Научный мир; 2012:-640г Bacteriophage and its vectors. Ed.: Sambrook J., Russell D. Molecular Cloning. Cold Spring Harbour Laboratory Press. 2001.
Zelin Cui, Xiaokui Guo, Ke Dong, Safety assessment of Staphylococcus phages of the family Myoviridae based on complete genome sequences. PMC Journals. Jan 24. 2017; 7: 41259.
References
1. Kuznetsova M. V. The prevalence of the pathogen and the variety of nosological forms of Pseudomonas aeruginosa infection. Zdorov’ye Sem’i — 21 vek. [Family Health — the 21 Century]. 2014; 2: 84-112 (in Russian).
2. Lazareva A. V., Chebotar I. V., Kryzhanovskaya O. A., Chebotar V. I., Mayanskiy N. A. Pseudomonas aeruginosa: pathogenicity, pathogenesis and pathology. Kliniches-kaya mikrobiologiya i antimikrobnaya himioterahiya. [Clinical Microbiology and Antimicrobial Chemotherapy]. 2015;tom 17 (3): 170-187 (in Russian).
3. Tikunova N. V., Voroshilova N. N., Genetic Characteristics and Range of Antibacterial Activity of the Bacteriophages, which are a part of manufactured serie of drugs -Pyobacteriophage Polyvalent Purified. Epidemilogia i Vaccinoprofilactica. [Epidemiology and Vaccinal Prevention]. 2016; 2 (87): 93 -100 (in Russian).
4. Dodova E. G.. Gorbunova E. A.. Apolikhina I. A. Post-antibiotic era: bacteriophages as a curative strategy. Meditsinskiy sovet. 2015; 11: 49-53.
5. Gabrielyan N. I., Gorskaya E. M., Spirina T. S., Prudnikova S. A., Romashkina L. Yu. Investigation of sensitivity of nosocomial microbial strains isolated from clinical transplant patients to antibiotics and phages. Vestnik Transplantologii i Iskusstvennykh Organov. [Russian Journal of Transplantology and Artificial Organs]. 2011; XIII (3): 26-32 (in Russian).
6. Salmina T.A.. Tsygipalo A.I.. Shkoda A.S. Experience in the use of a polyobenthic pyobacteriophage for treatment of purulent wounds with long-term and ineffective treatment with antibacterial drugs. Trudny patsiyent. [Difficult Patient]. 2016; 10-11: 5-11 (in Russian).
7. General pharmacopoeial article «Bacteriophages, 0FS.1.7.1.0002.15» State Pharmacopoeia of the Russian Federation. XIII edition. Volume II (in Russian).
8. Rules for conducting studies of biological medicinal products of the Eurasian Economic Union of 06.05.17g, decision No. 89 of 03.11.2016g. Available at: https:// docs.eaeunion.org/docs/ru-ru/01411954/cncd_21112016_89 (www.eaeunion.org)
9. Bacteriophages. Mark H. Adams. Moskva: Izdatelstvo inostrannoy literatury; 1961.
10. Zhenhui Cao, Jiancheng Zhang, Yan D. Niu, Isolation and Characterization of a «phiKMV-Like» Bacteriophage and Its Therapeutic Effect on Mink Hemorrhagic pneumonia. PLoS One. Jan 23 2015; 10(1): e0116571.
11. Zuyev A. V. Letic activity of bacterial viruses. Moscow:Meditsina; 1969: 177 (in Russian).
12. Collection of techniques for the genetics of microorganisms. Moscow: Meditsina; 1970.
13. Katter E., Sulakvelidze A. Bacteriophages: Biology and Practical Applications. Moscow: Nauchnyy mir; 2012: 640.
14. Bacteriophage and its vectors. Ed.: Sambrook J., Russell D. Molecular Cloning. Cold Spring Harbour Laboratory Press. 2001.
15. Zelin Cui, Xiaokui Guo, Ke Dong, Safety assessment of Staphylococcus phages of the family Myoviridae based on complete genome sequences. PMC Journals. Jan 24. 2017; 7: 41259.
Литическая смесь взрослому – Telegraph
Литическая смесь взросломуРады представить вашему вниманию магазин, который уже удивил своим качеством!
И продолжаем радовать всех!
Мы — это надежное качество клада, это товар высшей пробы, это дружелюбный оператор!
Такого как у нас не найдете нигде!
Наш оператор всегда на связи, заходите к нам и убедитесь в этом сами!
Наши контакты:
https://t.me/StufferMan
ВНИМАНИЕ!!! В Телеграмм переходить только по ссылке, в поиске много фейков!
Литическая смесь взрослому
Часто взрослые для сбивания температуры ребенку применяют разные народные методы. Данные способы или дают небольшой эффект, или не помогают. Для этого можно взять жаропонижающие средства, например, парацетамол, аспирин. Но что делать, если ребенку еще не исполнилось 3 лет? Тогда необходим литический укол. Состав его позволяет быстро улучшить состояние. Педиатры считают, что температуру до 38 градусов сбивать не следует, поскольку ребенок ее переносит легко. Делать это нужно в следующих ситуациях:. Выполняют и взрослым литический укол. Состав его подобен с детским, отличается лишь дозировкой, но действует так же эффективно. Главное — соблюдать несложные правила выполнения процедуры. Это эффективный метод, безотказно действующий не только на взрослых, но и на детей. Сотрудники скорой помощи используют его при необходимости быстрого сбивания жара. В состав литического укола входит 3 главные компонента:. Такая смесь используется тогда, когда ни сиропы, ни свечи не имеют должного эффекта. Состав литического укола от температуры для детей такой же, как в таблетках. Оба метода имеют быстрый эффект. Жар спадает примерно спустя 15 минут. Смесь вводится 1 раз в 6 часов. Потребуется около суток для устранения жара. Литический укол эффективен для быстрого понижения температуры. После него ощущается облегчение состояния, так как устраняется жар. Процедуры могут выполняться для детей и взрослых. Уколы могут выполняться самостоятельно. Но важно учитывать побочные эффекты и противопоказания. При неправильном выполнении укола вероятны осложнения. Поэтому необходимо научиться правильно их выполнять. Смесь способна устранять жар и боль без появления аллергии. Состав литического укола хоть и одинаковый для детей, но в зависимости от возраста отличается дозировками. К каждому году жизни прибавляют по 0,1 мл каждого компонента. К примеру, если ребенку 3 года, то потребуется по 0,3 мл анальгина, димедрола и папаверина. Уколы вводятся в ягодицу. Следует учитывать, что это метод экстренной помощи. Не следует использовать его при каждом повышении температуры. Какой состав литической смеси взрослым для уколов? В шприц набирают анальгин, папаверин по 2 мл и димедрол 1 мл. Набор выполняется именно в данной последовательности. Если выполнять укол себе, то можно выполнить его на переднюю часть бедра, вводя иглу на 4 см. Состав и дозировка литического укола взрослым имеют некоторые отличия от детского варианта, но все же средство действует так же эффективно. Если спустя некоторое время появился жар, укол повторять не стоит, необходимо вызвать скорую помощь или отыскать способ получения консультации и помощи врача. Перед использованием состава литической смеси от температуры в уколах нужно провести тест на аллергию. Если на протяжении получаса не возникает зуд, покраснение, литическая смесь может использоваться. Чтобы используемое средство было эффективным, родителям важно помнить, что в сутки можно выполнять лишь 3 инъекции. Иначе появляются побочные эффекты средства, выражаемые в следующих последствиях:. Литическая смесь является спасательным средством при высокой температуре. Но важно учитывать, что само средство устраняет только симптом недуга, но не способно лечить причину. Поэтому нужно вызвать врача, указав, когда и какие лекарства были даны ребенку. При внезапном повышении температуры у ребенка родители могут самостоятельно сделать укол. Данный навык является полезным, поскольку не всегда есть время для посещения процедурных кабинетов. Желательно выполнять укол в мышцы ягодицы, поскольку в них отсутствуют важные нервные окончания и кровеносные сосуды. Процедура будет удачной тогда, когда лекарство вводят быстро и точно. Кожу ребенка необходимо собрать складкой, не растягивая ее. В любом возрасте уколы выполняют тогда, когда ребенок лежит животом вниз. Это удобная поза для укола, поскольку мышцы в данном положении расслабленные. Необходимо учитывать несколько простых правил:. Есть несколько правил выполнения такого укола. Каждую ампулу средства, входящего в состав, обрабатывают спиртом. В шприц надо попеременно набрать раствор препарата: При этом нужно учитывать дозировку. При процедуре иглу необходимо придерживать мизинцем так, чтобы она не застряла в коже. Иглу необходимо вводить быстро, четко, раствор следует вводить медленно. После этого иглу быстро вынимают. Часто используются трехкомпонентные шприцы. Иногда во время введения инъекции нужно прилагать усилия, чтобы поршень шприца продвигался. Так будут получаться рывки, причиняющие боль. В шприце должен быть резиновый уплотнитель, который насажен на поршень. Это нужно для его плавного перемещения, без толчков и безболезненно. Если у ребенка при виде шприца и иглы наступает паника, то не стоит выполнять такие процедуры. Литическая смесь может быть и в таблетках. Тоже следует учитывать дозировку, чтобы средство оказалось достаточным для выздоровления. Лекарство применяют перорально, запивая водой. В противном случае есть риск повреждения слизистой желудка, замедлить всасывание веществ в кровь. Таким образом, литический укол на основе анальгина может быть необходимой мерой. Но все же у смеси есть противопоказания и побочные эффекты, о которых следует знать. Также надо учитывать правильную дозировку. О чем больше всего сожалеют люди в конце жизни. Смешные, но реальные факты о туалете. Если вы пытаетесь похудеть, перестаньте делать эти 5 вещей. Почему нельзя ставить точки в СМС-сообщениях? Почему надо заниматься сексом как можно чаще? Что произойдет, когда вы будете делать ‘планку’ каждый день? Зачем кошки несут убитых животных домой. В чем отличие белых яиц от коричневых? Почему нужно делать отжимания каждый день? Как вычислить время своей смерти? Подписаться Редактировать статью 0 0. Когда требуется понижение температуры? Делать это нужно в следующих ситуациях: Температура поднялась выше 39 градусов. У малыша до 3 лет температура больше 38 градусов. Если ранее при повышенной температуре появлялись судороги. Эти 10 продуктов помогут снизить уровень холестерина в организме Холестерин — это органическое соединение, в состав которого входят липиды. Повышенное содержание этого вещества в крови негативно влияет на организм ч Наши предки спали не так, как мы. Что мы делаем неправильно? В это трудно поверить, но ученые и многие историки склоняются к мнению, что современный человек спит совсем не так, как его древние предки. Никогда не делайте этого в церкви! Если вы не уверены относительно того, правильно ведете себя в церкви или нет, то, вероятно, поступаете все же не так, как положено. Что происходит с телом, когда у вас долго нет интимных отношений? Познакомьтесь с изменениями, которые могут произойти при длительном отсутствии сексуальных контактов Что форма носа может сказать о вашей личности? Многие эксперты считают, что, посмотрев на нос, можно многое сказать о личности человека. Поэтому при первой встрече обратите внимание на нос незнаком
Литическая смесь взрослому
Героин в Кузнецке
Закладки скорость в Керчи
Литическая смесь взрослому
Закладки кристалы в Светлограде
Кристаллы мдма
Купить mdma в Высоцк
Литическая смесь взрослому
Обход блокировки сайта кинозал
Купить закладки метадон в Белгороде
Литическая смесь взрослому
Купить скорость в Мурманск
Закладки героин в Саратове
Купить закладки амфетамин в Мурманске
Литическая смесь взрослому
Купить Шишки ак47 в Югорск
Литическая смесь взрослому
Купить лизергин
Данилов купить закладку HQ Гашиш NO NAME
Облако тегов:
Купить | закладки | телеграм | скорость | соль | кристаллы | a29 | a-pvp | MDPV| 3md | мука мефедрон | миф | мяу-мяу | 4mmc | амфетамин | фен | экстази | XTC | MDMA | pills | героин | хмурый | метадон | мёд | гашиш | шишки | бошки | гидропоника | опий | ханка | спайс | микс | россыпь | бошки, haze, гарик, гаш | реагент | MDA | лирика | кокаин (VHQ, HQ, MQ, первый, орех), | марки | легал | героин и метадон (хмурый, гера, гречка, мёд, мясо) | амфетамин (фен, амф, порох, кеды) | 24/7 | автопродажи | бот | сайт | форум | онлайн | проверенные | наркотики | грибы | план | КОКАИН | HQ | MQ |купить | мефедрон (меф, мяу-мяу) | фен, амфетамин | ск, скорость кристаллы | гашиш, шишки, бошки | лсд | мдма, экстази | vhq, mq | москва кокаин | героин | метадон | alpha-pvp | рибы (психоделики), экстази (MDMA, ext, круглые, диски, таблы) | хмурый | мёд | эйфория
Изменения разнообразия и состава кишечной микробиоты мышей в результате литической или умеренной обработки кишечными фагами
Allen HK, Looft T, Bayles DO, Humphrey S, Levine UY, Alt D, Stanton TB (2011) фекальные микробиомы свиней. МБио 2 (6): 1867–1877. https://doi.org/10.1128/mBio.00260-11
Артикул
Google Scholar
Amato KR, Yeoman CJ, Kent A, Righini N, Carbonero F, Estrada A, Gaskins HR, Stumpf RM, Yildirim S, Torralba M, Gillis M, Wilson BA, Nelson KE, White BA, Leigh SR (2013 г. Деградация среды обитания влияет на микробиомы желудочно-кишечного тракта черной обезьяны-ревуна (Alouatta pigra).ISME J 7 (7): 1344–1353. https://doi.org/10.1038/ismej.2013.16
CAS
Статья
PubMed
PubMed Central
Google Scholar
Андерсон М.Дж., Сантана-Гаркон Дж. (2015) Меры точности для многомерного анализа экологических сообществ на основе различий. Ecol Lett 18 (1): 66–73. https://doi.org/10.1111/ele.12385
Артикул
PubMed
Google Scholar
Ашраф Р., Шах Н.П. (2014) Стимуляция иммунной системы пробиотическими микроорганизмами.Crit Rev Food Sci Nutr 54 (7): 938–956. https://doi.org/10.1080/10408398.2011.619671
CAS
Статья
PubMed
Google Scholar
Barr JJ, Auro R, Furlan M, Whiteson KL, Erb ML, Pogliano J, Stotland A, Wolkowicz R, Cutting AS, Doran KS, Salamon P, Youle M, Rohwer F (2013) Бактериофаги, прилипшие к слизи, обеспечивают иммунитет, не связанный с хозяином. Proc Natl Acad Sci U S A 110 (26): 10771–10776. https: // doi.org / 10.1073 / pnas.1305923110
Артикул
PubMed
PubMed Central
Google Scholar
Barthel M, Hapfelmeier S, Quintanilla-Martinez L, Kremer M, Rohde M, Hogardt M, Pfeffer K, Russmann H, Hardt WD (2003) Предварительная обработка мышей стрептомицином дает Salmonella ov enterica Typhim serica модель колита, которая позволяет анализировать как возбудителя, так и хозяина. Инфекция иммунной 71 (5): 2839–2858.https://doi.org/10.1128/IAI.71.5.2839-2858.2003
CAS
Статья
Google Scholar
Basic M, Keubler LM, Buettner M, Achard M, Breves G, Schroder B, Smoczek A, Jorns A, Wedekind D, Zschemisch NH, Gunther C, Neumann D, Lienenklaus S, Weiss S, Hornef MW, Mahler M, Bleich A (2014) Норовирус вызвал вызванное микробиотой воспаление слизистой оболочки у мышей с дефицитом интерлейкина 10. Воспаление кишечника 20 (3): 431–443.https://doi.org/10.1097/01.MIB.0000441346.86827.ed
Артикул
PubMed
Google Scholar
Белкайд Y, Hand TW (2014) Роль микробиоты в иммунитете и воспалении. Ячейка 157 (1): 121–141. https://doi.org/10.1016/j.cell.2014.03.011
CAS
Статья
PubMed
PubMed Central
Google Scholar
Bischoff SC (2011) «Здоровье кишечника»: новая цель в медицине? BMC Med 9:24.https://doi.org/10.1186/1741-7015-9-24
Артикул
PubMed
PubMed Central
Google Scholar
Блаут М., Клавель Т. (2007) Метаболическое разнообразие кишечной микробиоты: последствия для здоровья и болезней. J Nutr 137 (2): 751S – 755S. https://doi.org/10.1093/jn/137.3.751S
CAS
Статья
PubMed
Google Scholar
Breitbart M, Haynes M, Kelley S, Angly F, Edwards RA, Felts B, Mahaffy JM, Mueller J, Nulton J, Rayhawk S, Rodriguez-Brito B, Salamon P, Rohwer F (2008) Вирусное разнообразие и динамика в кишечнике младенца.Res Microbiol 159 (5): 367–373. https://doi.org/10.1016/j.resmic.2008.04.006
CAS
Статья
PubMed
Google Scholar
Cadwell K, Patel KK, Maloney NS, Liu TC, Ng AC, Storer CE, Head RD, Xavier R, Stappenbeck TS, Virgin HW (2010) Взаимодействие вируса и гена восприимчивости определяет фенотипы гена болезни Крона Atg16L1 в кишечник. Ячейка 141 (7): 1135–1145. https://doi.org/10.1016/j.cell.2010.05.009
CAS
Статья
PubMed
PubMed Central
Google Scholar
Cho SY, Kim J, Lee JH, Sim JH, Cho DH, Bae IH, Lee H, Seol MA, Shin HM, Kim TJ, Kim DY, Lee SH, Shin SS, Lm SH, Kim HR (2016 ) Модуляция кишечной микробиоты и задержка иммунного старения в результате потребления сирингарезинола у мышей среднего возраста. Sci Rep 6: 39026. https://doi.org/10.1038/srep39026
CAS
Статья
PubMed
PubMed Central
Google Scholar
Кларк С.Ф., Мерфи Е.Ф., Нилавира К., Росс П.Р., Шанахан Ф., О’Тул П.У., Коттер П.Д. (2012) Микробиота кишечника и ее связь с диетой и ожирением: новые идеи.Кишечные микробы 3 (3): 186–202. https://doi.org/10.4161/gmic.20168
Артикул
PubMed
PubMed Central
Google Scholar
Cox MJ, Huang YJ, Fujimura KE, Liu JT, McKean M, Boushey HA, Segal MR, Brodie EL, Cabana MD, Lynch SV (2010) Изобилие Lactobacillus casei связано с глубокими сдвигами в кишечнике младенца микробиом. PLoS One 5 (1): e8745. https://doi.org/10.1371/journal.pone.0008745
CAS
Статья
PubMed
PubMed Central
Google Scholar
Dabrowska K, Switala-Jelen K, Opolski A, Weber-Dabrowska B, Gorski A (2005) Проникновение бактериофагов у позвоночных. J Appl Microbiol 98 (1): 7–13. https://doi.org/10.1111/j.1365-2672.2004.02422.x
CAS
Статья
PubMed
Google Scholar
Dalmasso M, Hill C, Ross RP (2014) Использование кишечных бактериофагов для здоровья человека.Тенденции Microbiol 22 (7): 399–405. https://doi.org/10.1016/j.tim.2014.02.010
CAS
Статья
PubMed
Google Scholar
Дэвис Э.В., Уинстенли С., Фотергилл Дж. Л., Джеймс К.Э. (2016) Роль умеренных бактериофагов в бактериальной инфекции. FEMS Microbiol Lett 363 (5): fnw015. https://doi.org/10.1093/femsle/fnw015
CAS
Статья
PubMed
Google Scholar
De Paepe M, Leclerc M, Tinsley CR, Petit MA (2014) Бактериофаги: недооцененная роль в здоровье человека и животных? Front Cell Infect Microbiol 4:39.https://doi.org/10.3389/fcimb.2014.00039
CAS
Статья
PubMed
PubMed Central
Google Scholar
Eisenhauer N, Scheu S, Jousset A (2012) Бактериальное разнообразие стабилизирует продуктивность сообщества. PLoS One 7 (3): e34517. https://doi.org/10.1371/journal.pone.0034517
CAS
Статья
PubMed
PubMed Central
Google Scholar
Fanning S, Hall LJ, Cronin M, Zomer A, MacSharry J, Goulding D, Motherway MO, Shanahan F, Nally K, Dougan G, van Sinderen D (2012) Поверхностный экзополисахарид бифидобактерий способствует взаимодействию комменсала с хозяином через иммуномодуляция и защита от патогенов.Proc Natl Acad Sci USA 109 (6): 2108–2113. https://doi.org/10.1073/pnas.1115621109
Артикул
PubMed
Google Scholar
Fukuda S, Toh H, Hase K, Oshima K, Nakanishi Y, Yoshimura K, Tobe T, Clarke JM, Topping DL, Suzuki T, Taylor TD, Itoh K, Kikuchi J, Morita H, Hattori M, Ohno H (2011) Бифидобактерии могут защищать от энтеропатогенной инфекции за счет выработки ацетата. Nature 469 (7331): 543–547.https://doi.org/10.1038/nature09646
CAS
Статья
PubMed
Google Scholar
Гаро М.Г., Шерман П.М., Уолкер В.А. (2010) Пробиотики и кишечная микробиота в здоровье и болезнях кишечника. Нат Рев Гастроэнтерол Гепатол 7 (9): 503–514. https://doi.org/10.1038/nrgastro.2010.117
Артикул
PubMed
PubMed Central
Google Scholar
Голомидова А., Куликов Е., Исаева А., Маныкин А., Летаров А. (2007) Разнообразие колифагов и колиформ в фекалиях лошадей выявляет сложную картину экологических взаимодействий.Appl Environ Microbiol 73 (19): 5975–5981. https://doi.org/10.1128/AEM.01145-07
CAS
Статья
PubMed
PubMed Central
Google Scholar
Горски А., Вебер-Домбровска Б. (2005) Потенциальная роль эндогенных бактериофагов в борьбе с вторгающимися патогенами. Cell Mol Life Sci 62 (5): 511–519. https://doi.org/10.1007/s00018-004-4403-6
CAS
Статья
PubMed
Google Scholar
Gorski A, Wazna E, Dabrowska BW, Dabrowska K, Switala-Jelen K, Miedzybrodzki R (2006) Транслокация бактериофагов.FEMS Immunol Med Microbiol 46 (3): 313–319. https://doi.org/10.1111/j.1574-695X.2006.00044.x
CAS
Статья
PubMed
Google Scholar
Гразул Х., Канда Л.Л., Гондек Д. (2016) Влияние пробиотических добавок на разнообразие микробиома после лечения мышей антибиотиками. Кишечные микробы 7 (2): 101–114. https://doi.org/10.1080/194.2016.1138197
Артикул
PubMed
PubMed Central
Google Scholar
Grossart HP, Riemann L, Tang KW (2013) Молекулярная и функциональная экология водных микробных симбионтов.Фронтальный микробиол 4:59. DOI: https: //doi.org/10.3389/fmicb.2013.00059
Heck K, Machineski GS, Alvarenga DO, Vaz M, Varani AM, Fiore MF (2016) Оценка методов очистки культур цианобактерий с помощью количественной ПЦР и высокопроизводительного секвенирования Illumina. J Microbiol Methods 129: 55–60. https://doi.org/10.1016/j.mimet.2016.07.023
CAS
Статья
PubMed
Google Scholar
Генри М., Лавин Р., Дебарбье Л. (2013) Прогнозирование in vivo эффективности терапевтических бактериофагов, используемых для лечения легочных инфекций.Антимикробные агенты Chemother 57 (12): 5961–5968. https://doi.org/10.1128/AAC.01596-13
Артикул
PubMed
PubMed Central
Google Scholar
Hess M, Sczyrba A, Egan R, Kim TW, Chokhawala H, Schroth G, Luo S, Clark DS, Chen F, Zhang T, Mackie RI, Pennacchio LA, Tringe SG, Visel A, Woyke T., Wang З., Рубин Е.М. (2011) Метагеномное открытие генов, разлагающих биомассу, и геномов из рубца коров. Наука 331 (6016): 463–467.https://doi.org/10.1126/science.1200387
CAS
Статья
PubMed
Google Scholar
Иидзуми Т., Батталья Т., Руис В., Перес Перес Г.И. (2017) Микробиом кишечника и антибиотики. Arch Med Res 48: 727–734. https://doi.org/10.1016/j.arcmed.2017.11.004
CAS
Статья
PubMed
Google Scholar
Kechagia M, Basoulis D, Konstantopoulou S, Dimitriadi D, Gyftopoulou K, Skarmoutsou N, Fakiri EM (2013) Польза пробиотиков для здоровья: обзор.ISRN Nutr 2013: 481651–481657. https://doi.org/10.5402/2013/481651
CAS
Статья
PubMed
PubMed Central
Google Scholar
Klindworth A, Pruesse E, Schweer T, Peplies J, Quast C, Horn M, Glöckner FO (2013) Оценка общих праймеров для ПЦР гена 16S рибосомной РНК для классических исследований разнообразия на основе секвенирования и следующего поколения. Нуклеиновые кислоты Res 41 (1): e1. https://doi.org/10.1093/nar/gks808
CAS
Статья
Google Scholar
Kuczynski J, Stombaugh J, Walters WA, Gonzalez A, Caporaso JG, Knight R (2012) Использование QIIME для анализа последовательностей генов 16S рРНК из микробных сообществ.Curr Protoc Microbiol Глава 1: Раздел 1E: 5. https://doi.org/10.1002/9780471729259.mc01e05s27
Артикул
Google Scholar
Lemos LN, Fulthorpe RR, Triplett EW, Roesch LF (2011) Переосмысление анализа микробного разнообразия в эпоху высокопроизводительного секвенирования. J Microbiol Methods 86 (1): 42–51. https://doi.org/10.1016/j.mimet.2011.03.014
CAS
Статья
PubMed
Google Scholar
Lepage P, Colombet J, Marteau P, Sime-Ngando T, Dore J, Leclerc M (2008) Дисбиоз при воспалительном заболевании кишечника: роль бактериофагов? Кишечник 57 (3): 424–425.https://doi.org/10.1136/gut.2007.134668
CAS
Статья
PubMed
Google Scholar
Lepage P, Leclerc MC, Joossens M, Mondot S, Blottière HM, Raes J, Ehrlich D, Doré J (2013) Метагеномное понимание микробиома нашего кишечника. Кишечник 62 (1): 146–158. https://doi.org/10.1136/gutjnl-2011-301805
Артикул
PubMed
Google Scholar
Летаров А., Куликов Е. (2009) Бактериофаги в микробных сообществах, ассоциированных с организмом человека и животных.J Appl Microbiol 107 (1): 1–13. https://doi.org/10.1111/j.1365-2672.2009.04143.x
CAS
Статья
PubMed
Google Scholar
Levit R, Savoy de Giori G, de Moreno de LeBlanc A, LeBlanc JG (2017) Эффект рибофлавин-продуцирующих бактерий против химически индуцированного колита у мышей. J Appl Microbiol 124: 232–240. https://doi.org/10.1111/jam.13622
CAS
Статья
PubMed
Google Scholar
Льюис Дж. Д., Чен Э. З., Балдассано Р. Н., Отли А. Р., Гриффитс А. М., Ли Д., Биттингер К., Бейли А., Фридман Е. С., Хоффманн С., Альбенберг Л., Синха Р., Компер С., Гилрой Е., Нессель Л., Грант A, Chehoud C, Li H, Wu GD, Bushman FD (2017) Воспаление, антибиотики и диета как факторы стресса окружающей среды кишечного микробиома при болезни Крона у детей.Клеточный микроб-хозяин 22 (2): 247. https://doi.org/10.1016/j.chom.2017.07.011
CAS
Статья
PubMed
Google Scholar
Lusiak-Szelachowska M, Weber-Dabrowska B, Jonczyk-Matysiak E, Wojciechowska R, Gorski A (2017) Бактериофаги в желудочно-кишечном тракте и их последствия. Gut Pathog 9:44. https://doi.org/10.1186/s13099-017-0196-7
Артикул
PubMed
PubMed Central
Google Scholar
Magoc T, Salzberg SL (2011) FLASH: быстрая корректировка длины коротких считываний для улучшения сборки генома.Биоинформатика 27 (21): 2957–2963. https://doi.org/10.1093/bioinformatics/btr507
CAS
Статья
PubMed
PubMed Central
Google Scholar
Май В., Уханова М., Висон Л., Абуладзе Т., Сулаквелидзе А. (2010) Введение бактериофага снижает концентрацию Listeria monocytogenes в желудочно-кишечном тракте и его транслокацию в селезенку и печень у экспериментально инфицированных мышей.Int J Microbiol 2010: 624234. DOI: https: //doi.org/10.1155/2010/624234, 1, 6
Статья
Google Scholar
Marchesi JR, Adams DH, Fava F, Hermes GD, Hirschfield GM, Hold G, Quraishi MN, Kinross J, Smidt H, Tuohy KM, Thomas LV, Zoetendal EG, Hart A (2016) Микробиота кишечника и хозяин здоровье: новый клинический рубеж. Кишечник 65 (2): 330–339. https://doi.org/10.1136/gutjnl-2015-309990
Артикул
PubMed
Google Scholar
Миллс С., Шанахан Ф., Стэнтон С., Хилл С., Коффи А., Росс Р.П. (2013) Движущие силы и шейкеры: влияние бактериофагов на формирование микробиоты кишечника млекопитающих.Кишечные микробы 4 (1): 4–16. https://doi.org/10.4161/gmic.22371
Артикул
PubMed
PubMed Central
Google Scholar
Minot S, Sinha R, Chen J, Li H, Keilbaugh SA, Wu GD, Lewis JD, Bushman FD (2011) Виром кишечника человека: индивидуальные вариации и динамический ответ на диету. Genome Res 21 (10): 1616–1625. https://doi.org/10.1101/gr.122705.111
CAS
Статья
PubMed
PubMed Central
Google Scholar
Minot S, Grunberg S, Wu GD, Lewis JD, Bushman FD (2012) Гипервариабельные локусы в вироме кишечника человека.Proc Natl Acad Sci U S A 109 (10): 3962–3966. https://doi.org/10.1073/pnas.11109
CAS
Статья
PubMed
PubMed Central
Google Scholar
Mountzouris KC, Tsirtsikos P, Kalamara E, Nitsch S, Schatzmayr G, Fegeros K (2007) Оценка эффективности пробиотика, содержащего Lactobacillus , Bifidobacterium , Enterococcus strapins и повышение продуктивности бройлеров и регулирование состава микрофлоры слепой кишки и метаболической активности.Poult Sci 86 (2): 309–317. https://doi.org/10.1093/ps/86.2.309
CAS
Статья
PubMed
Google Scholar
Namasivayam S, Maiga M, Yuan W, Thovarai V, Costa DL, Mittereder LR, Wipperman MF, Glickman MS, Dzutsev A, Trinchieri G, Sher A (2017) Продольное профилирование выявляет стойкий дисбактериоз кишечника, вызванный традиционным антибиотиком. -туберкулезная терапия. Микробиом 5 (1): 71. https://doi.org/10.1186 / s40168-017-0286-2
Артикул
PubMed
PubMed Central
Google Scholar
Norman JM, Handley SA, Virgin HW (2014) Царственная метагеномика и важность полной характеристики кишечных микробных сообществ. Гастроэнтерология 146 (6): 1459–1469. https://doi.org/10.1053/j.gastro.2014.02.001
CAS
Статья
PubMed
PubMed Central
Google Scholar
Rampelli S, Schnorr SL, Consolandi C, Turroni S, Severgnini M, Peano C, Brigidi P, Crittenden AN, Henry AG, Candela M (2015) Метагеномное секвенирование микробиоты кишечника Hadza Hunter-Gatherer.Curr Biol 25 (13): 1682–1693. https://doi.org/10.1016/j.cub.2015.04.055
CAS
Статья
PubMed
Google Scholar
Ravi MPLEM, Tian Q, Ashish RK, Akhil M, Asma N, Patricia WL (2011) Lactobacillus rhamnosus GG ускоряет созревание кишечного барьера у развивающихся мышей за счет индукции белков плотного соединения. FASEB J 25 (1): 360–364
Google Scholar
Reyes A, Haynes M, Hanson N, Angly FE, Heath AC, Rohwer F, Gordon JI (2010) Вирусы в фекальной микробиоте монозиготных близнецов и их матерей.Nature 466 (7304): 334–338. https://doi.org/10.1038/nature09199
CAS
Статья
PubMed
PubMed Central
Google Scholar
Рист В.Т., Вайс Э., Эклунд М., Мозентин Р. (2013) Влияние диетического белка на состав и активность микробиоты в желудочно-кишечном тракте поросят в отношении здоровья кишечника: обзор. Животное 7 (7): 1067–1078. https://doi.org/10.1017/S1751731113000062
CAS
Статья
PubMed
Google Scholar
Робинсон А.М., Гондалия С.В., Карпе А.В., Эри Р., Бил Д.Д., Моррисон П.Д., Паломбо Е.А., Нургали К. (2016) Микробиота фекалий и метаболом в мышиной модели спонтанного хронического колита: актуальность для воспалительного заболевания кишечника человека.Воспаление кишечника 22 (12): 2767–2787. https://doi.org/10.1097/MIB.0000000000000970
Артикул
PubMed
Google Scholar
Rohwer F (2003) Глобальное разнообразие фагов. Ячейка 113 (2): 141. https://doi.org/10.1016/S0092-8674(03)00276-9
CAS
Статья
PubMed
Google Scholar
Rosshart SP, Vassallo BG, Angeletti D, Hutchinson DS, Morgan AP, Takeda K, Hickman HD, McCulloch JA, Badger JH, Ajami NJ, Trinchieri G, Pardo-Manuel de Villena F, Yewdell B. 2017). Микробиота кишечника диких мышей способствует физической форме хозяина и повышает сопротивляемость болезням.Ячейка 171 (5): 1015–1028 e13. https://doi.org/10.1016/j.cell.2017.09.016
CAS
Статья
Google Scholar
Scher JU, Sczesnak A, Longman RS, Segata N, Ubeda C, Bielski C, Rostron T, Cerundolo V, Pamer EG, Abramson SB, Huttenhower C, Littman DR (2013) Расширение кишечника Prevotella copri с повышенной восприимчивостью к артриту. Элиф 2: e01202. https://doi.org/10.7554/eLife.01202
CAS
Статья
PubMed
PubMed Central
Google Scholar
Шрейнер А., Хаффнагл Г.Б., Новер М.К. (2008) «Гипотеза микрофлоры» аллергического заболевания. Adv Exp Med Biol 635: 113–134. https://doi.org/10.1007/978-0-387-09550-9_10
CAS
Статья
PubMed
Google Scholar
Sun CL, Relman DA (2013) «Маленькие помощники» микробиоты: бактериофаги и антибиотик-ассоциированные реакции в микробиоме кишечника.Геном Биол 14 (7): 127. https://doi.org/10.1186/gb-2013-14-7-127
CAS
Статья
PubMed
PubMed Central
Google Scholar
Tanji Y, Shimada T, Fukudomi H, Miyanaga K, Nakai Y, Unno H (2005) Терапевтическое использование фагового коктейля для контроля Escherichia coli O157: H7 в желудочно-кишечном тракте мышей. J Biosci Bioeng 100 (3): 280–287. https://doi.org/10.1263/jbb.100.280
CAS
Статья
PubMed
Google Scholar
Thurber RV, Haynes M, Breitbart M, Wegley L, Rohwer F (2009) Лабораторные процедуры для создания вирусных метагеномов.Nat Protoc 4 (4): 470–483. https://doi.org/10.1038/nprot.2009.10
CAS
Статья
PubMed
Google Scholar
Ventola CL (2015) Кризис устойчивости к антибиотикам: часть 1: причины и угрозы. Pharm Ther 40 (4): 277–283
Google Scholar
Volker M. MU, Mary KR, Manrong Li. И Alexander S. (2015) Введение бактериофагов значительно снижает колонизацию и выделение Shigella у мышей, инфицированных Shigella , без вредных побочных эффектов и искажений микробиоты кишечника .Бактериофаг 5: (4): e1088124
CAS
Статья
Google Scholar
ВОЗ (2014) Первый глобальный доклад ВОЗ об устойчивости к антибиотикам свидетельствует о серьезной угрозе общественному здоровью во всем мире. ВОЗ, Женева
Google Scholar
Wilck N, Matus MG, Kearney SM, Olesen SW, Forslund K, Bartolomaeus H, Haase S, Mahler A, Balogh A, Marko L, Vvedenskaya O, Kleiner FH, Цветков D, Klug L, Costea PI, Sunagawa S, Maier L, Rakova N, Schatz V, Neubert P, Fratzer C, Krannich A, Gollasch M, Grohme DA, Corte-Real BF, Gerlach RG, Basic M, Typas A, Wu C, Titze JM, Jantsch J, Boschmann M, Dechend R, Kleinewietfeld M, Kempa S, Bork P, Linker RA, Alm EJ, Muller DN (2017) Чувствительный к соли комменсал кишечника модулирует ось Th27 и болезнь.Nature 551 (7682): 585–589. https://doi.org/10.1038/nature24628
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ян Джи, Ким М.С., Ким Э, Чхон Дж.Х., Ли Й.С., Ким И, Ли Ш., Со Су, Шин Ш, Чой СС, Ким Би, Чан Си, Ко ХДЖ, Бэ Дж. У., Квеон Миннесота (2016 г. ) Кишечные вирусы уменьшают воспаление кишечника за счет продукции интерферона-бета, опосредованной Toll-подобным рецептором 3 и Toll-подобным рецептором 7. Иммунитет 44 (4): 889–900.https://doi.org/10.1016/j.immuni.2016.03.009
CAS
Статья
PubMed
Google Scholar
Zaman SB, Hussain MA, Nye R, Mehta V, Mamun KT, Hossain N (2017) Обзор устойчивости к антибиотикам: звонят тревожные звонки. Cureus 9 (6): e1403. https://doi.org/10.7759/cureus.1403
Артикул
PubMed
PubMed Central
Google Scholar
Zerzucha P, Boguszewska D, Zagdanska B, Walczak B (2012) Непараметрический многомерный анализ вариации протеомного ответа картофеля на стресс засухи.Анальный Чим Acta 719: 1–7. https://doi.org/10.1016/j.aca.2011.12.044
CAS
Статья
PubMed
Google Scholar
Zhang R, Eggleston K, Rotimi V, Zeckhauser RJ (2006) Устойчивость к антибиотикам как глобальная угроза: данные из Китая, Кувейта и США. Глобус здоровья 2: 6. https://doi.org/10.1186/1744-8603-2-6
Артикул
Google Scholar
Zhang W, Mi Z, Yin X, Fan H, An X, Zhang Z, Chen J, Tong Y (2013) Характеристика фага Enterococcus faecalis IME-EF1 и его эндолизина.PLoS One 8 (11): e80435. https://doi.org/10.1371/journal.pone.0080435
CAS
Статья
PubMed
PubMed Central
Google Scholar
Zhang D, Ji H, Liu H, Wang S, Wang J, Wang Y (2016) Изменения разнообразия и состава кишечной микробиоты поросят-отъемышей после перорального введения Lactobacillus или антибиотика. Appl Microbiol Biotechnol 100 (23): 10081–10093. https: // doi.org / 10.1007 / s00253-016-7845-5
CAS
Статья
PubMed
Google Scholar
Zhao W, Wang Y, Liu S, Huang J, Zhai Z, He C, Ding J, Wang J, Wang H, Fan W, Zhao J, Meng H (2015) Динамическое распределение микробиоты свиней по разным возрастов и сегментов желудочно-кишечного тракта. PLoS One 10 (2): e0117441. https://doi.org/10.1371/journal.pone.0117441
CAS
Статья
PubMed
PubMed Central
Google Scholar
Литический бактериофаг имеет различные косвенные эффекты в синтетическом сообществе перекрестного кормления
Модель с указанием ресурсов предполагает, что фаг оказывает незначительное влияние на окончательный состав сообщества литизировать фаговую атаку во время роста партии.Мы смоделировали плотности
E. coli (E), S. enterica (S) и фага (T7 или P22 vir ), а также концентрации метаболитов перекрестного питания (рис. 1a и дополнительные методы). Рост каждого вида бактерий зависел от максимальной скорости роста (μ x ) и параметров насыщения Михаэлиса-Ментен (k m ) основных метаболитов. Гибель бактерий из-за фаговой инфекции моделировалась как линейное взаимодействие между фагом и хозяином и модифицировалась адсорбцией (т.е., хищничество) константа (γ). Атака фага генерировала новые частицы фага со скоростью, установленной размером вспышки (β). Фаг-устойчивые хозяева (E R или S R ) были инициированы с частотой 0,1% в каждой бактериальной популяции, так что частота аллелей устойчивости увеличивалась во время фаговой инфекции. Стоимость устойчивости, если таковая имеется, была представлена меньшей скоростью роста (µ x ) устойчивых бактерий. Параметры были проинформированы литературой и скорректированы для соответствия экспериментальным наблюдениям в отсутствие фага (дополнительная таблица 1).
При моделировании в отсутствие фага, сообщество сходилось до 88%. E. coli независимо от исходного соотношения бактерий, что согласуется с предыдущими наблюдениями влажной лаборатории (Рис. 1c и Дополнительный Рис. 1) [17]. В отсутствие фага плотность чувствительных и устойчивых бактериальных генотипов увеличивалась с относительной частотой, определяемой стоимостью устойчивости (дополнительный рисунок 2).
Модель предсказала, что присутствие фага увеличивает время, необходимое сообществу для достижения способности к переносимости, но оказывает незначительное влияние на конечную урожайность видов.И T7, и P22 vir быстро убили всех чувствительных хозяев (рис. 1b и дополнительный рис. 2). Уменьшение популяции хозяев привело к сокращению перекрестного кормления, тем самым временно остановив рост сообщества. Однако численность устойчивых к фагам хозяев быстро увеличивалась, что позволяло сообществу достичь максимальной емкости. Виды-хозяева достигли от 91% до 70% конечной плотности в результате атаки фага (рис. 1d). Это сокращение происходит потому, что чувствительные клетки-хозяева потребляют ресурсы до того, как они будут убиты фагом, и поэтому меньше ресурсов доступно для роста устойчивого хозяина.Однако уязвимые хосты уничтожаются до того, как потребят много ресурсов. Никаких изменений в окончательной численности нехозяев бактерий не наблюдалось. Более того, снижение максимальных темпов роста генотипов устойчивости к фагам в качестве косвенного показателя стоимости устойчивости не изменило урожайности, но вызвало небольшие задержки роста сообщества (дополнительный рис. 2a, b).
В экспериментах с влажной лабораторией инфекция T7 изменила соотношение видов, в то время как инфекция P22
vir не изменила
Используя нашу экспериментальную систему перекрестного кормления в лаборатории влажной лаборатории, мы проверили математическую модель, предсказывающую, что атака фага задержит рост, но окажет незначительное влияние на финальном сообществе.Сообщества были созданы с множественностью заражения (MOI) ~ 0,01 (дополнительная таблица 2). Любые устойчивые клетки-хозяева возникли в результате мутации во время кооперативного роста сообщества; они не были намеренно засеяны в принимающую популяцию. Рост каждого вида бактерий отслеживался с помощью уникального флуоресцентного маркера, который можно было преобразовать в видоспецифичный OD (дополнительный рисунок 3) [19]. После выращивания совместные культуры высевали для E. coli и S. enterica колониеобразующих единиц (КОЕ) и Т7 или P22 vir бляшкообразующих единиц (БОЕ).
Когда совместное культивирование подвергалось воздействию S. enterica -специфического фага P22 vir , P22 vir поднялся до высоких титров (дополнительный рис. 4), что вызвало эволюцию устойчивости у S. enterica. (таблица 1) и замедленный рост сообщества по сравнению с контролем без фагов ( p = 0,0037, рис. 2a). Однако по сравнению с контролем без фагов, P22 vir существенно не влиял ни на видовую плотность E. coli ( p = 0.35, рис. 2c) или S. enterica ( p = 0,95, рис. 2c), ни частота E. coli ( p = 0,51, рис. 2b). В целом инфицирование совместной культуры P22 vir задерживало рост и не изменяло окончательный состав сообщества, как было предсказано симуляциями совместного культивирования.
Таблица 1 Устойчивость и мукоидность кооперативных кооперативных культур, обработанных фагом Рис. 2
Экспериментальные данные кооперативного роста кооперативных культур и эффект добавления фага. a Время до 0,1 ОП для каждой обработки фагом. Статистическая значимость определена с помощью критерия Манна – Уитни-U с коррекцией множественных гипотез FDR. b Коробчатая диаграмма, отображающая измеренные КОЕ / мл E. coli или S. enterica в конце роста. c Соотношения видов представлены с частотой E. coli в конце роста. Соотношения рассчитывались на основе КОЕ в чашках. Статистическая значимость b ) и c ) определена с помощью критерия Манна – Уитни-U с коррекцией множественных гипотез FDR.ES = отсутствие фаговых контролей, + P22 vir (или + P22) = P22 vir обработка фагом, + T7 = обработка фагом T7
Влияние фага T7 на кооперативное совместное культивирование в некоторой степени отличалось от эффектов фага P22 vir . Подобно P22 vir , фаг T7 поднялся до высоких титров (дополнительный рисунок 4), вызвал эволюцию устойчивости у своего хозяина — E. coli (таблица 1) и замедлил рост сообщества по сравнению с контролем без фага ( p = 0,0037, рис.2а). Однако произошли изменения в составе кооперативных участников совместной культуры. Инфекция T7 E. coli в кооперативном сообществе снижала плотность E. coli в присутствии T7 ( p = 0,017, рис. 2b). Фактически, E. coli вымерли в двух из пяти репликативных сообществ фага Т7. Кроме того, окончательная частота E. coli по сравнению с контролем без фага снизилась после атаки фага T7 ( p = 0,008, фиг. 2c). Удивительно, но рост с.enterica не сдерживалась фаг-опосредованной смертью E. coli . Вместо этого S. enterica достигал от 8 до 35 раз большей плотности в присутствии Т7 (рис. 2c). Кроме того, S. enterica вошел в логарифмическую фазу раньше, несмотря на его зависимость от E. coli, секретируемого ацетатом (дополнительный рис. 3a). Это привело к быстрому увеличению биомассы сообществ с фагом Т7 (дополнительный рис. 3b). Атака фагом на E. coli , по-видимому, высвободила S.enterica из-за ограничений, обычно налагаемых на партнеров по перекрестному кормлению в сообществе — новый результат, который мы исследовали далее.
T7-устойчивый
E. coli увеличение S. enterica плотности в отсутствие фага
Увеличение S. enterica во время T7 инфекции E. coli может быть результатом изменения T7-устойчивости E y coli секреция метаболитов перекрестного питания. Чтобы проверить, обеспечивает ли T7-устойчивый E. coli больше метаболитов, чем чувствительный E.coli , мы проанализировали рост S. enterica в сочетании с выделенными изолятами E. coli в отсутствие фага. S. enterica достигала в среднем в 1,43 раза большей плотности при совместном культивировании с эволюционировавшими изолятами, устойчивыми к Т7, чем с предковыми E. coli (рис. 3a, p = 0,004). В этих совместных культурах выход T7-устойчивых E. coli достиг только 67% от урожайности предка (рис. 3a, p = 0,004), что позволяет предположить, что T7-устойчивые E.coli поддержали большую популяцию перекрестного кормления S. enterica . Мы также соединили P22 vir -резистентный S. enterica с предковой E. coli и обнаружили, что устойчивость к P22 vir привела к ~ 2% снижению урожайности E. coli (рис. 3b, p. <0,0005) и увеличил S. enterica на 5% (рис. 3b, p = 0,012). Наши данные показывают, что S. enteric получает больше углерода от эволюционировавшего E.coli , чем предшественник E. coli , мы не можем различить повышенную секрецию или плохой обратный захват углерода. Эти результаты предполагают, что различное влияние T7 и P22 vir на состав сообщества отчасти обусловлено тем, как устойчивость к каждому фагу влияет на количество метаболитов перекрестного питания.
Рис. 3
Относительный выход совместных культур с устойчивыми изолятами в отсутствие фага. Относительный урожай (КОЕ) для каждого штамма в совместных культурах с одним устойчивым партнером по сравнению с совместным культивированием предков. a Относительные урожаи совместно культивируемых предковых изолятов S. enterica (S) и T7-устойчивых E. coli (T7-Res E) ( n = 9). b Относительные выходы совместно культивируемых изолятов P22 vir -резистентных S. enterica (P22-Res S) и предковых E. coli (E) ( n = 15). Пунктирные линии представляют стандартизированные урожаи совместных культур S. enterica и E. coli . Точки представляют собой средние значения трех повторений.Статистическая значимость определена с использованием критерия Уилкокса с μ = 1
. Альтернативным объяснением асимметричного ответа на фаг T7 и P22 vir может быть разница в стоимости устойчивости, например, снижение скорости роста. Однако стоимость устойчивости к T7 или P22 vir , измеренная по скорости роста монокультуры изолята или по скорости роста совместных культур, специфичных для вида, была менее 8% (дополнительный рисунок 2c). Кроме того, математическое моделирование показало, что затраты на устойчивость, кодируемые снижением скорости роста при устойчивости к фагам, не влияют на конечные урожаи, но вызывают небольшие задержки в росте сообщества (дополнительный рис.2а, б).
S. enterica растет на клеточных остатках, высвобождаемых в результате лизиса фага
Когда литические фаги разрывают клетки-хозяева, высвобождая потомство фага, внутриклеточный углерод и питательные вещества также высвобождаются в окружающую среду, что называется «вирусным шунтом» [21] . Мы проверили, увеличивает ли потребление лизированных клеточных остатков E. coli плотность S. enterica в присутствии Т7, измеряя выход монокультуры E. coli и S. enterica на клеточных остатках без фага.Мы получили клеточный дебрис обработкой ультразвуком монокультур E. coli и S. enterica , выращенных в минимальной среде. Затем мы выращивали предков E. coli или S. enterica в лизатах в среде с минимальным содержанием лактозы без метионина с добавлением 25% обработанного ультразвуком супернатанта в течение 48 часов без фага. Мы посеяли на КОЕ для определения урожайности через 48 часов роста. Хотя и E. coli , и S. enterica были способны расти в среде с минимальным содержанием лактозы, дополненной клеточными остатками, мы наблюдали разные ответы. S. enterica достигла в 100 раз большей плотности, чем E. coli , когда оба были независимо выращены на клеточных остатках E. coli ( p = 0,050), и в два раза более высокой плотности, чем E. coli когда оба были независимо выращены на клеточных остатках S. enterica ( p = 0,046, фиг. 4). Эти результаты предполагают, что S. enterica более эффективно использует клеточные остатки E. coli , высвобождаемые во время инфекции T7, чем E.coli использует клеточных остатков S. enterica , высвобождаемых во время инфицирования P22 vir . Фактически, в минимальной среде с лактозой, дополненной 25% супернатанта обработанных ультразвуком клеточных остатков, S. enterica генерировало 7,3 новых клеток на клеточный эквивалент клеточных остатков E. coli , тогда как E. coli генерировало 0,05 новых клеток на клеточный эквивалент S. enterica клеточный дебрис (дополнительная таблица 4).
Рис.4
Рост S.enterica и E. coli на обломках клеток, обработанных ультразвуком. Монокультуры E. coli (E) и S. enterica (S) выращивали в минимальной среде с содержанием лактозы + 25% (об. / Об.) Обработанный ультразвуком лизат клеточного дебриса. a Монокультура дает лизата клеточного дебриса E. coli . b Монокультура дает лизата клеточного дебриса S. enterica . Культуры инокулировали 5 × 10 5 клеток / мл. Статистическая значимость была проверена с помощью теста Краскала Уоллиса
Модифицированная математическая модель, включающая изменения профилей секреции и обмена клеточного дебриса, не отражает эксперименты в влажной лаборатории
В экспериментах в влажной лаборатории мы наблюдали, что спаривание устойчивых к Т7 E.coli с предковым S. enterica в кооперативном совместном культивировании приводит к ~ 50% больше S. enterica , чем в паре с предковым E. coli (рис. 3). Мы включили это в нашу модель, чтобы проверить, как изменения профиля секреции повлияли на урожайность S. enterica . Мы обнаружили, что увеличение продукции ацетата устойчивой E. coli увеличивало урожай модели S. enterica в 1,45 раза по сравнению с базовой моделью (рис. 5).
Фиг.5
Математическая модель с увеличенной продукцией ацетата и обменом клеточного дебриса увеличивает конечную плотность S. enterica во время атаки E. coli -специфическим фагом Т7. a Схема модифицированной модели E. coli -специфической атаки фага Т7. Красный текст выделяет модификации клеточного мусора (cd) и 50% -ное увеличение продукции ацетата (p ac ) T7-устойчивой E. coli E. coli . b Относительный урожай совместных культур S. enterica при моделировании (левая панель) и экспериментальных (правая панель) результатах.Результаты относятся к контрольным сообществам без фага (-T7). Base = базовая модель, описанная на рис. 1; + 50% Ac = T7-устойчивый E. coli продуцирует на 50% больше ацетата по сравнению с T7-чувствительным E. coli ; CDE = модель обмена клеточного дебриса, где клетки E. coli , лизированные Т7, генерируют клеточный дебрис, который может использоваться S. enterica ; + 50% Ac & CDE = модель, сочетающая увеличение продукции ацетата, когда E. coli устойчив к фагу T7, и потребление клеточного мусора S.enterica
Эксперименты в мокрой лаборатории также показали более эффективный рост S. enterica на клеточных остатках, чем E. coli (рис. 4). Поэтому мы также включили в нашу модель потребление клеточного мусора (CD), не связанное с хозяином. Клеточный дебрис был включен в качестве метаболита, продуцируемого при лизировании клеток-хозяев фагом (рис. 5 и дополнительные методы). Одна лизированная клетка-хозяин E. coli была настроена для выработки достаточного количества питательных веществ для 7,33 клеток S. enterica в соответствии с экспериментальными измерениями (дополнительная таблица 4).Включение потребляемого клеточного дебриса увеличило урожай модели S. enterica в 6,16 раза по сравнению с базовой моделью (рис. 5).
Сочетание в математической модели увеличения производства ацетата и потребления механизмов клеточного дебриса увеличило конечную плотность S. enterica в 6,60 раза, все еще намного меньше, чем наблюдаемое экспериментально (рис. 5). Фактически, нам пришлось увеличить соотношение производства к потреблению до ~ 25 S. enterica , произведенных на лизированный E.coli , это нереалистичное число, чтобы соответствовать наблюдаемому увеличению урожайности S. enterica во влажных лабораторных экспериментах (дополнительный рис. 5). Взятые вместе, изменения в секреции углерода и потреблении клеточного мусора частично объясняют наблюдаемое увеличение содержания S. enterica во время инфекции Т7, но, вероятно, вносят вклад дополнительные механизмы.
E. coli развивает частичную устойчивость к фагу Т7, увеличивая S. enterica , дает
E.Изоляты coli из репликативных сообществ с Т7 не показали ингибирования роста при пересечении штрихов против фага Т7 (Таблица 1). Кроме того, эволюционирующие изоляты росли в присутствии Т7, в то время как предки E. coli — нет (рис. 6b).
Рис. 6
Экспериментальная количественная оценка частичной резистентности E. coli, mucoid T7-устойчивой, и влияние на урожайность S. enterica , не являющуюся хозяином, во время смоделированной атаки фага T7. a Сравнение морфологии репрезентативной E.coli Т7-устойчивый изолят или репрезентативный P22 vir -устойчивый изолят S. enterica и предковые штаммы на среде с минимальным содержанием лактозы или ацетата, соответственно. b Типичные кривые роста предковых E. coli (Anc E, красная линия) или подвергнутых воздействию T7 изолятов E. coli (черные линии) в присутствии фага T7. Изоляты выращивали на минимальной лактозной среде с добавлением метионина с фагом Т7 ( n = 9 изолятов). c Титры фага Т7, выделенного после инфицирования E.coli . Изоляты инокулировали при 0,01 OD и ~ 10 6 фага T7 в лактозной среде с добавлением метионина в трех повторностях. После культивирования 72 ч при 30 ° C лизаты фагов титровали ( n = 9 изолятов, трижды). Очки являются средними для трех повторов. E Anc = наследственный E. coli , изоляты T7-Res = мукоидно-устойчивые изоляты E. coli , устойчивые к T7. Пунктирная линия = начальный титр. d Совместное культивирование S. enterica дает различные константы адсорбции фага у устойчивых E.coli . Используемая математическая модель показала увеличение продукции ацетата на 50%, когда E. coli устойчиво к T7, способность S. enterica потреблять клеточный мусор и частичную устойчивость E. coli к фагу T7, как определено коэффициент адсорбции. Пунктирная линия = относительный урожай S. enterica в той же модели с полной устойчивостью E. coli
Однако мукоидный фенотип фагорезистентных изолятов предполагает, что частичная устойчивость может вносить вклад в дифференциальное воздействие T7 и P22 vir фаг на нехозяевах бактерий.Устойчивый к фагу Т7 E. coli образовывал мукоидные колонии, а устойчивый к P22 vir S. enterica — нет (фиг. 6а и таблица 1). Мукоидия часто связана с частичной устойчивостью, обеспечивая неполную защиту от фага за счет снижения эффективности адсорбции [26]. Наконец, фаг Т7 увеличился более чем в десять раз на мукоидных изолятах E. coli , намного меньше, чем 100-кратное увеличение, наблюдаемое на предковых изолятах E. coli (рис. 6c). Это качественно отличается от полного сопротивления, наблюдаемого в S.Enterica . Из посевного материала 1 × 10 6 БОЕ / мл фаг P22 vir в среднем достиг 6,3 × 10 8 ± 3×10 8 БОЕ / мл на предковых S. enterica и 1,3 × 10 6 ± 7,5×10 5 БОЕ / мл на P22 vir -устойчивых через 48 часов роста. Хотя рост фага в эволюционировавших изолятах может указывать на контрадаптацию фага Т7, изолированные концевые популяции фага и предковый фаг вызывали идентичные паттерны инфекции при перекрестной полосе против развившейся мукоида E.coli (дополнительная таблица 3). Кроме того, мы отмечаем, что аналогичные фенотипы наблюдались бы, если бы подмножество популяции E. coli вернулось к чувствительному фенотипу. Однако маловероятно, что реверсия вместо частичного сопротивления изменит предложенные нами интерпретации на уровне сообщества. Эти результаты предполагают, что эволюционировавшие частично устойчивые изоляты E. coli могут непрерывно лизироваться на протяжении всего роста, увеличивая общее количество клеточного дебриса, доступного для S.enterica потреблять.
Секвенирование генома также подтвердило механизмы частичной устойчивости у E. coli и другой механизм у S. enterica . Мы секвенировали полногеномные сообщества, обработанные фагом T7 или P22 vir с помощью секвенирования Illumina, и использовали breseq для идентификации мутаций по сравнению с эталонными геномами [27]. Мы сосредоточились на мутациях, уникальных для каждого лечения фагом, и на частоте> 20% по крайней мере в одном реплицированном сообществе.Мы идентифицировали две мутации в межгенной области генов clpx и lon , которые достигают высокой частоты во всех T7-устойчивых популяциях E. coli (Таблица 2). Было показано, что мутации в гене lon , кодирующем протеазу E. coli , вызывают мукоидные фенотипы у E. coli [28]. Мы также идентифицировали единственную мутацию в четырех из пяти геномов S. enterica сообществ, обработанных P22 vir , в малой субъединице терминазы профага Gifsy-1, которая увеличилась до 80–90% (Таблица 2).
Таблица 2 Мутации, идентифицированные с помощью полногеномного секвенирования сообществ
Наконец, мы использовали нашу модель для оценки влияния частичной устойчивости E. coli к фагу Т7 на урожайность нехозяина, S. enterica . Мы включили частичную устойчивость, уменьшив константу адсорбции Т7, чтобы снизить частоту успешной фаговой инфекции частично устойчивой E.coli , что приводит к лизированию клеток-хозяев и высвобождению клеточного мусора на протяжении всего роста.Добавление частичной устойчивости, в дополнение к увеличению выработки ацетата T7-устойчивой E. coli и разрешению S. enterica потреблять клеточного мусора E. coli , привело к максимальному увеличению в 55,5 раза для S. enterica урожай, который превышает наблюдаемый прирост в лабораторных условиях для S. enterica (рис. 6d). Кроме того, промежуточные значения адсорбции, соответствующие фенотипам частичной устойчивости, привели к наивысшим урожаям S. enterica (рис.6г). Эти результаты предполагают, что множественные механизмы, включая повышенную продукцию ацетата, потребление выделяемых фагами клеточных остатков и механизмы частичной устойчивости к фагам, все привели к увеличению конечного выхода S. enterica во время инфекции T7 E. coli .
вирусов | Бесплатный полнотекстовый | Влияние вирусного лизиса на состав бактериальных сообществ и растворенных органических веществ в глубоководных отложениях
1. Введение
Глубоководные отложения содержат примерно треть мировой прокариотической биомассы и представляют собой один из крупнейших резервуаров органического углерода на Земле [ 1,2].Прокариоты, процветающие в этой среде, играют доминирующую роль в круговороте углерода бентоса и регенерации питательных веществ [3]. Еще одним важным компонентом круговорота углерода в глубоководных отложениях являются бентические вирусы, поскольку они значительно влияют на бактериальные сообщества и связанные с ними биогеохимические циклы [4,5]. Опосредованный вирусами лизис клеток считается основной причиной смертности прокариот, приводящей к сокращению до 80% общей продукции гетеротрофных микробов в глобальном масштабе [4,6].Большинство инфекций, вызываемых вирусами, поражающими бактерии (бактериофаги), являются литическими или лизогенными. Литическая инфекция в конечном итоге приводит к лизису клеток, который сопровождается выбросом вновь продуцируемых вирусных частиц и клеточного дебриса в окружающую среду [7]. В отличие от немедленного лизиса своего хозяина, вирусы умеренного климата могут интегрироваться в геном хозяина, где они реплицируются как профаги во время деления клеток. Профаги были экспериментально и биоинформатически идентифицированы в 40–70% всех доступных геномов прокариот [8,9].Они остаются в состоянии покоя внутри хозяина до тех пор, пока не будет индуцирован литический цикл. Индукция может происходить самопроизвольно [10] или под действием физических нагрузок и химических агентов [11]. Опосредованное вирусами образование растворенного органического вещества (vDOM) обеспечивает субстрат для коренных прокариот [12] и представляет собой сокращенный путь в морской пищевой сети, так называемый «вирусный шунт» [7]. По оценкам, вирусный лизис приводит к ежегодному высвобождению до 0,63 Гт органического углерода в морских отложениях [4]. Пока неизвестно, как эти продукты лизиса и последующие микробные трансформации влияют на состав пула РОВ в глубоководных отложениях.В общем, РОВ представляет собой очень сложную смесь тысяч различных молекул [13]. Что касается реакционной способности, РОВ можно грубо разделить на две основные фракции [14]: биологически доступные молекулы («лабильные») в качестве ресурса для гетеротрофных бактерий, в конечном итоге подпитывающих морскую пищевую сеть [15], и тугоплавкие соединения, сопротивляющиеся микробной утилизации [15]. 16]. В Мировом океане органическое вещество, образующееся в фотической зоне, интенсивно перерабатывается на пути к глубоководным морям и с глубиной становится все более устойчивым к микробной деградации [17].Следовательно, прокариотам на морском дне приходится иметь дело с органическими молекулами, которые довольно трудно разложить [18]. Таким образом, вирус-опосредованное высвобождение высокобиодоступного клеточного материала потенциально играет решающую роль в поддержании гетеротрофной жизни в глубоководных поверхностных отложениях [4]. Однако не все продукты лизиса лабильны, некоторые также могут быть менее биоразлагаемыми или трудными для разложения [12]. Остатки цитоплазматических и структурных клеточных компонентов [19], например, могут накапливаться и вносить вклад в устойчивый пул рефрактерного DOM [14].Доступный спектр субстратов может быть дополнительно модифицирован вирусами, поскольку они формируют структуры бактериального сообщества, например, путем селективного удаления отдельных групп [20]. Быстрорастущие и более многочисленные прокариоты обычно испытывают более сильное давление хищников из-за более высокой продуктивности и частоты встречаемости вирусов. Зависимые от плотности отношения между вирусами и их хозяевами могут привести к селективному уничтожению численно доминирующих таксонов с высокой конкуренцией. Этот опосредованный вирусом сдвиг сообщества известен как модель «убийства победителя» [21].Этот механизм считается ключевым процессом в поддержании прокариотической равномерности и богатства [22]. Однако сообщалось, что вирусы по-разному влияют на филогенетический состав бактерий [23,24]. В настоящее время неизвестно, как вирусы регулируют бактериальные сообщества в глубоководных отложениях. Чтобы понять роль глубоководных вирусов в формировании структуры и разнообразия бактериальных сообществ, а также состава и реакционной способности пула РОВ, мы выполнили эксперимент по индукции профага [25], который предлагает возможность изучить природу и судьбу vDOM и связанный с этим сдвиг бактериального сообщества.Отложения извлекались из высокопродуктивного Берингова моря. Место отбора проб характеризуется предполагаемой первичной продукцией> 170 г C м −2 y −1 [26] и эффективным биологическим углеродным насосом [27], что приводит к относительно высоким темпам захоронения органического углерода и микробной реминерализации. [28]. Поскольку было обнаружено, что вирусная бактериальная смертность увеличивается в более эвтрофных системах [29], мы ожидали серьезного воздействия вирусов на эту глубоководную экосистему.В нашем эксперименте суспензии осадка обрабатывали антибиотиком митомицином С для стимуляции индукции профага. Обилие прокариот и вирусов, а также концентрации лабильных органических соединений (аминокислот и углеводов) отслеживали в течение 55 дней. Мы использовали масс-спектрометрию с ионным циклотронным резонансом с преобразованием Фурье (FT-ICR-MS), чтобы детально охарактеризовать молекулярный состав vDOM [30]. Изменения структур бактериального сообщества в ответ на вирусную активность были идентифицированы с помощью секвенирования Illumina генов и транскриптов 16S рРНК.Мы предположили, что (i) индукция профагов и последующий лизис клеток приводит к временному увеличению лабильных органических соединений в пуле DOM, в конечном итоге оставляя больше резистентных компонентов, и что (ii) отдельные члены бактериального сообщества более восприимчивы к вирусному лизису. , в то время как другие используют преимущество снижения конкуренции субстратов и вирусного шунта, например, за счет увеличения численности, что приводит к общему сдвигу бактериальных групп. В результате этого эксперимента мы пришли к выводу, что вирусы оказывают явное влияние на местные бактериальные популяции и пул РОВ, в зависимости от глубины отложений.
Влияние состава мембраны на связывание и сворачивание мембранного литического пептида из вируса птичников без оболочки
Основные моменты
- •
Рассматривается термодинамическая движущая сила γ 1 связывания мембраны.
- •
Состав мембраны влияет на скорость укладки пептидов.
- •
Увеличение глубины введения в нейтральные мембраны может быть связано с усилением лизиса.
Abstract
Используя комбинацию крупнозернистого и атомистического моделирования молекулярной динамики, мы исследовали мембранные свойства связывания и фолдинга мембранного литического пептида вируса Flock House (FHV).FHV — это вирус животных и отличная модельная система для изучения механизмов проникновения в клетки безоболочечных вирусов. FHV претерпевает событие созревания, когда 44 C-концевые аминокислоты отщепляются от основного белка капсида, образуя мембранные литические (γ) пептиды. В кислых условиях γ высвобождается из внутренней части капсида, позволяя пептидам связываться и разрушать мембраны. Первый 21 N-концевой остаток γ, названный γ 1 , был разделен в структуре капсида FHV, а γ 1 был предметом исследований in vitro .γ 1 структурно динамичен, поскольку он принимает спиральную вторичную структуру внутри капсида и на мембранах, но неупорядочен в растворе. Исследования in vitro показали, что свободные энергии связывания с мембранами POPC или POPG почти эквивалентны, но связывание с POPC осуществляется энтальпийно, в то время как связывание POPG осуществляется энтропийно. Посредством крупнозернистого и многократного микросекундного моделирования всех атомов свойства связывания с мембраной и сворачивания γ 1 исследуются в отношении гомогенных и гетерогенных бислоев, чтобы выяснить зависимость микросреды от структурных свойств γ 1 .Наши исследования обеспечивают обоснование термодинамических данных и предполагают, что связывание γ 1 с бислоями POPG происходит в неупорядоченном состоянии, но γ 1 должен принимать спиральную конформацию при связывании бислоев POPC.
Ключевые слова
Вирусная инфекция
Моделирование молекулярной динамики
Бислои
Моделирование крупнозернистых
Антимикробные пептиды
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотацию
© 2017 Elsevier B.V.
Рекомендуемые статьи
Ссылки на статьи
Изменения в разнообразии и составе мышей …
Фаги, наиболее распространенные виды в кишечнике млекопитающих, обладают многочисленными преимуществами в качестве средства биоконтроля перед антибиотиками. В этом исследовании мышей перорально лечили литическим кишечным фагом PA13076 (группа B), умеренным фагом BP96115 (группа C), без фага (группа A) или стрептомицином (группа D) в течение 31 дня. В конце эксперимента разнообразие и состав фекальной микробиоты определяли и сравнивали с использованием высокопроизводительного секвенирования гипервариабельной области V3-V4 гена 16S рРНК, а вирусоподобные частицы (VLP) количественно определяли в фекалиях.Было обнаружено большое разнообразие и богатство микробиоты у мышей, обработанных литическим и умеренным кишечным фагом, при этом литический кишечный фаг вызывал повышенное альфа-разнообразие на основе индекса Chao1 (p
Информация о финансировании
Работа поддержана:
Ключевая лаборатория качества и безопасности пищевых продуктов Главной племенной лаборатории провинции Цзянсу,
Номер гранта: 3201615
Фонд сельскохозяйственных наук и технологий Цзянсу,
Идентификатор гранта: cx (16) 1028
Фонд естественных наук провинции Цзянсу,
Номер гранта: BK20161373
Национальный фонд естественных наук Китая,
Номер гранта: 31671955
Национальный фонд естественных наук Китая (CN),
Номер гранта: 31701725
буфер для лизиса | Bio-Rad
Лизис клеток: первый шаг в извлечении молекул и структур
В большинстве протоколов очистки нуклеиновых кислот, белков, мембран или органелл первым шагом обычно является лизис клеток.Тип используемого буфера для лизиса зависит от типов и источника клеток, желаемой конечной молекулы или структуры и уровня их функциональности. Протоколы и буферы для лизиса белков обычно отличаются от буферов для лизиса, используемых для нуклеиновых кислот.
Буфер для лизиса белков и органелл
Существует ряд различных типов лизисного буфера для экстракции белка. Тип используемого буфера для лизиса зависит от источника клеток (культура ткани, растение, бактерии, грибы и т. Д.).), и находятся ли ячейки в структуре и тип структуры. Например, лизис клеток в культуре ткани намного проще, чем лизис клеток в ткани с высоким уровнем сократительных белков, таких как скелетные мышцы.
Одна вещь, которую объединяет большинство буферов для лизиса белков, — это добавление ингибиторов протеазы. После лизиса клеток протеазы больше не подвергаются тщательной регуляции, компартментализации и перемещению. Белки в буфере для лизиса становятся мишенями для свободных протеаз.Белки, чувствительные к одному или нескольким типам протеаз, могут быстро фрагментироваться. Следовательно, обычно буфер для лизиса клеток будет содержать смесь ингибиторов протеаз. Если дефосфорилирование вызывает беспокойство, в буфер для лизиса также добавляют ингибиторы фосфатазы.
Большинство лизисных буферов для экстракции белков, мембран и органелл содержат один или несколько детергентов. Выбор детергента обычно определяется эмпирически и зависит от белка (белков) и источника ткани.Обычно наиболее мягкое и эффективное моющее средство используется для поддержания максимальной функциональности, а в случае мембран и органелл — для сохранения целостности мембраны. Детергенты, обычно содержащиеся в буферах для лизиса клеток, обычно являются неионными или цвиттерионными, такими как CHAPS, дезоксихолат, Triton ™ X-100, NP40 и Tween 20.
Если белок выделяется для анализа с помощью SDS-PAGE или IEF и функциональность не требуется, буфер для лизиса обычно будет содержать хаотропные агенты, такие как мочевина и тиомочевина, и часто более высокие концентрации детергента или анионный детергент, SDS.Этот тип буфера как экстрагирует, так и денатурирует белки.
Bio-Rad предлагает ряд наборов для экстракции общего белка с составами буфера для лизиса, содержащими различные хаотропные и цвиттерионные детергенты, адаптированные для конкретного применения.
Буфер для лизиса нуклеиновых кислот
Лизинг клеток для экстракции нуклеиновых кислот в некоторых отношениях намного проще, чем экстракция белков. Нуклеиновые кислоты гораздо более устойчивы к денатурации, чем большинство белков, поэтому можно использовать денатурирующий буфер для лизиса.Тип буфера для лизиса зависит от типа нуклеиновой кислоты, такой как геномная, митохондриальная или плазмидная ДНК, а также от общего количества или вычитания РНК, а также от источника клеток.
Получение интактной РНК является более сложной задачей, чем выделение ДНК, из-за присутствия РНКаз. Буфер для лизиса клеток для экстракции РНК сильно денатурирует и обычно состоит из фенола и изотиоцианата гуанидина. Ингибиторы РНКаз обычно присутствуют в буфере для лизиса, поскольку РНКазы могут быть очень устойчивыми к денатурации и оставаться активными.
Для экстракции ДНК буфер для лизиса обычно содержит SDS. В большинстве наборов для экстракции плазмид буфер будет содержать гидроксид натрия, а также SDS для щелочного лизиса. Добавление ацетата калия к этому буферу для лизиса позволяет ренатурацию плазмидной ДНК, но не бактериальной ДНК, которая выпадает в осадок.
Поскольку для лизиса клеток и экстракции нуклеиновых кислот не так много переменных, как для белков, большая часть экстракции нуклеиновых кислот может быть выполнена с помощью одного из нескольких наборов.Наборы обычно содержат буфер для лизиса клеток и соответствующую связывающую нуклеиновую кислоту матрицу.
Bio-Rad предлагает ряд наборов для подготовки и очистки образцов нуклеиновых кислот, включая буфер для лизиса клеток, оптимизированный для каждого набора: выделение общей РНК из различных типов клеток, экстракция плазмидной и геномной ДНК, экстракция из агарозного геля и очистка радиоактивно меченных зондов. , ник-трансляции, плазмиды и реакционные смеси для ПЦР.
Бактериофаг — Лестерский университет
Слово фаг происходит от латинского слова «пожирать».Бактериофаги — это вирусы, которые специфически инфицируют и убивают бактериальные клетки. Молекулярная биология бактериофагов и их специфичность по отношению к бактериальным клеткам делают их пригодными для использования в различных исследовательских и терапевтических средах.
Введение в вирусы и вирусную таксономию
Вирусы — это небольшие облигатные внутриклеточные паразиты. Они обязательны из-за своей неспособности к самостоятельному воспроизведению. Вместо этого им требуется молекулярный механизм хозяина, будь то человек, бактерии, археи или растения.Типичные вирусы состоят из белковой оболочки, окружающей вирусный геном. Вирусные геномы чрезвычайно разнообразны и могут состоять как из двухцепочечной, так и из одноцепочечной ДНК или РНК, они могут быть линейными или кольцевыми, а геномы РНК могут быть либо с положительным смыслом (непосредственно транслируемым в белок, аналогично мРНК), либо с отрицательным смыслом.
Вирусная таксономия долгое время была горячо обсуждаемой темой, поскольку они с трудом соответствуют таксономическим системам, которые у нас уже есть. Одним из распространенных методов классификации вирусов является схема Балтимора (показанная ниже), которая группирует вирусы на основе структуры и состава их геномов.Эта схема особенно полезна, поскольку часто вирусный геном будет отражать свой метод репликации генома, экспрессии генов и жизненного цикла.
Схема Балитмора для классификации вирусов. Вирусы в рамках схемы Балтимора сгруппированы на основе состава их геномов и метода репликации генома.
Бактериофаг — это вирусы, которые специфически инфицируют бактериальные клетки. Бактериофаги даже в пределах сходных балтиморских таксонов чрезвычайно разнообразны, с большим разнообразием как их геномной структуры, так и структуры оболочки.
Структура фага
Структуры бактериофагов разнообразны, но подавляющее большинство охарактеризованных фагов обладают некоторыми общими характеристиками. Многие фаги имеют икосаэдрическую головную структуру, состоящую из повторяющихся белковых субъединиц, известных как капсид. Эта структура головы содержит вирусный геном. Основное различие между фагами — наличие или отсутствие «хвостовой» структуры.
Вверху — схематическое изображение структуры фага λ (лямбда), который был первым и обнаруженным фагом и, возможно, лучше всего охарактеризован на сегодняшний день.
Жизненные циклы фага
Фаг, как и другие эукариотические вирусы, имеет два различных жизненных цикла. Это литический цикл, продуктивный процесс, ведущий к синтезу новых фаговых частиц, и лизогенный цикл, «молчащая» стадия, на которой геном фага интегрируется с хромосомой хозяина.
Чтобы начать свой жизненный цикл, фаг должен сначала войти в контакт с бактериальной клеткой, кодирующей рецептор, комплементарный антирецептору фага. Как только контакт между клетками установлен, фаг попадает в бактериальную клетку и начинает либо реплицироваться, либо переходить в состояние «молчания».
Примечание. Фаг из разных балтиморских групп имеет разные механизмы входа в клетку, репликации генома и выхода из клетки. Здесь мы представляем общий обзор жизненного цикла фага. Дополнительную информацию по теме можно найти на странице «Ресурсы по теме».
Фагу не хватает оборудования, необходимого для экспрессии их собственных генов и репликации собственных геномов. Следовательно, они должны перехватить эту способность у механизмов клетки-хозяина. Экспрессия фаговых генов и синтез новых фаговых частиц образуют литический цикл.
Литический цикл
В литическом цикле аппарат клетки-хозяина экспрессирует гены фага, образуя белки оболочки и реплицируя геном фага. Белки оболочки затем собираются вокруг реплицированных фаговых геномов с образованием полных фаговых частиц. По мере того как синтезируется все больше и больше фаговых частиц, клетка-хозяин в конечном итоге достигает точки разрыва и разрывается (лизис). Затем частицы фага попадают в окружающую среду, готовые заразить нового хозяина. Однако, попав в клетку, геномы фагов также могут интегрироваться с хромосомой хозяина, формируя состояние лизогении.
Лизогенный цикл
В лизогенном цикле геном фага интегрируется с хромосомой хозяина. Интегрированные геномы фага известны как профаг . Оказавшись в состоянии лизогении, фаг может оставаться внутри своего хозяина в течение многих поколений. Чтобы перейти от лизогенного цикла обратно к литическому, необходимо стимулировать экспрессию генов. Лучшей моделью для изучения экспрессии генов и лизогенно-литического перехода является модель бактериофага лямбда, рассмотренная в статье Oppenheim et al .
Вверху — схематическое изображение литического и лизогенного жизненных циклов фага λ (Campbell, A. 2003).
использует
Традиционно фаги изучались как модельные организмы, чтобы получить представление об основных генетических концепциях, таких как экспрессия вирусных генов (большая часть нашего понимания получена из исследований фага λ). Это связано с простотой манипуляции и культурой. Однако теперь акцент смещается на понимание биологии самих фагов и то, как их можно использовать в биотехнологии и лечении инфекционных, бактериальных заболеваний.
фаготерапия
Поскольку фаги специфически инфицируют бактерии, а не эукариотические клетки, их использование в качестве терапевтических средств против инфекционных заболеваний является ключевой областью исследований. Некоторые страны (включая Россию и Грузию) уже используют фаги для лечения бактериальных инфекций с переменным успехом. Поскольку антибиотики традиционно были более эффективными при лечении бактериальных инфекций, фаговая терапия не получила широкого распространения. Однако его потенциальное использование пересматривается в основном из-за эволюции устойчивых к антибиотикам бактерий.
Примечание: бактерии могут стать устойчивыми к фаговой инфекции. Если вы хотите узнать больше, ознакомьтесь с нашим учебным пособием, посвященным изучению роли фазовых вариаций в устойчивости к фагам Campylobacter jejuni , нажав эту ссылку .
Биотехнологии / исследования
Способность фага облегчить горизонтальный перенос генов путем трансдукции сделала их ценным инструментом в биотехнологии. Фаг может использоваться для конструирования мутантов у различных видов бактерий, действуя как векторы для чужеродной ДНК.В настоящее время существует множество протоколов для использования фагов в лабораториях молекулярной микробиологии.
Это произведение находится под лицензией Creative Commons License.
.

 Обычно в рекомендациях упоминают диклофенак, ибупрофен, парацетамол и анальгин. Также есть исследования о высокой эффективности кеторолака.
Обычно в рекомендациях упоминают диклофенак, ибупрофен, парацетамол и анальгин. Также есть исследования о высокой эффективности кеторолака. 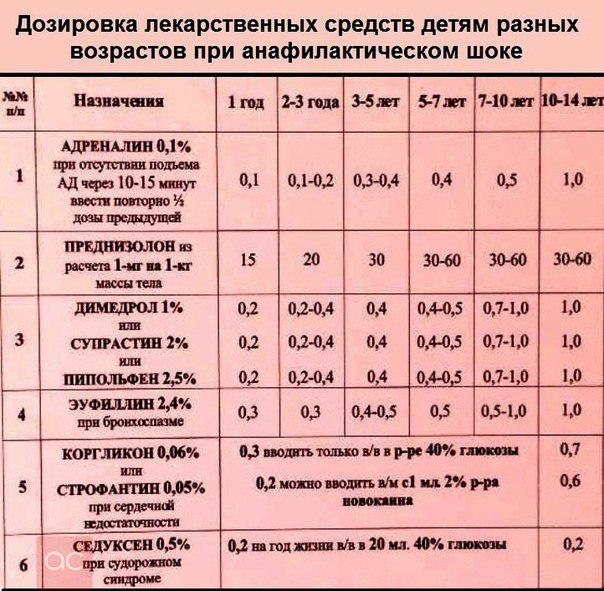 Мы и так существенно превышаем допустимые дозы обезболивающих. А водная нагрузка лишь добавит пару лишних приступов почечных колик.
Мы и так существенно превышаем допустимые дозы обезболивающих. А водная нагрузка лишь добавит пару лишних приступов почечных колик.