лечение, симптомы, норма, чего боится
Клебсиелла у грудничка в кале – это не всегда признак заболевания. Данные микроорганизмы относятся к условно-патогенным, и в небольшим количестве могут присутствовать в кишечнике ребенка постоянно.
Что такое клебсиелла
При определенных условиях происходит активизация микроорганизмов, увеличивается их количество и развивается воспалительная реакция с появлением соответствующей симптоматики. Одновременно клебсиеллы появляются в кале. В этом случае требуется диагностика дисбактериоза, а также соответствующая терапия.
Один из симптомов появления клебсиеллы в организме — дисбактериоз
Выделяется несколько видов микроорганизмов. При попадании в ткани они вызывают развитие воспалительных процессов в различных органах. В детском возрасте клебсиелла приводит к возникновению следующих болезней:
- менингит;
- пневмония;
- острый средний отит;
- синуситы;
- пиелонефрит;
- гнойные процессы в мягких тканях различной локализации.

При выраженном снижении иммунитета клебсиеллы провоцируют развитие сепсиса. Состояние сопровождается появлением и размножением микроорганизмов в крови с последующим распространением по всему организму.
Почему активизируется инфекция
Клебсиелла у грудничка в кале появляется из-за увеличения количества микроорганизмов в кишечнике. Обычно это происходит при воздействии определенных факторов:
- нарушение метаболизма на фоне сахарного диабета;
- врожденный иммунодефицит;
- снижение иммунитета;
- хронические заболевания, способствующие истощению организма младенца;
- длительное применение антибиотиков, приводящее к угнетению нормальной микрофлоры и активизации условно-болезнетворных микроорганизмов;
- искусственное вскармливание.
Также увеличение количества бактерий в кишечнике может происходить при употреблении пищи немытыми руками, при контакте с животными.
Важно следить за чистотой в доме. Младенец в процессе познания окружающего мира норовит попробовать различные предметы на вкус. Из-за недостаточной гигиены повышается риск развития кишечных инфекций, включая сальмонеллез и шигеллез. Грудничок может легко заразиться гельминтами, что тоже провоцирует рост количества клебсиелл.
Из-за недостаточной гигиены повышается риск развития кишечных инфекций, включая сальмонеллез и шигеллез. Грудничок может легко заразиться гельминтами, что тоже провоцирует рост количества клебсиелл.
Симптомы, которые указывают на наличие клебсиеллы в организме
На возможную активизацию клебсиеллы указывают такие симптомы:
- вздутие живота;
- частое отхождение газов;
- систематическое срыгивание;
- субфебрильная температура;
- колики, вызывающие выраженное беспокойство ребенка;
- частый жидкий стул;
- появление в кале прожилок крови, слизи, гноя;
- ухудшение аппетита;
- нарушение сна;
- гнилостный запах стула.
Клебсиелла у грудничка в кале с повышением количества микробов вызывает дисбактериоз
На фоне функциональных нарушений пищеварительной системы страдают другие органы. Ребенок становится вялым, капризным, плохо ест и спит. Кожные покровы бледные, часто имеют сероватый оттенок. Отмечается недостаточная прибавка веса.
Отмечается недостаточная прибавка веса.
Диагностика
Выявление клебсиелл в кале проводится при помощи бактериологического исследования. Это лабораторный анализ, который подразумевает посев кала или мазка со слизистой оболочки прямой кишки на специальные питательные среды.
Исследование дает возможность установить:
- факт наличия клебсиеллы у грудничка в кале;
- количество микроорганизмов в единице объема исследуемого биологического материала;
- вид и штамм бактерий — у ребенка в кале обычно появляется клебсиелла окситока;
- устойчивость выделенных микроорганизмов к антибиотикам.
Бактериологический посев – это информативное и ценное исследование. Определение устойчивости к антибиотикам дает возможность оценить, чего боится бактерия, а также подобрать наиболее эффективный препарат для лечения. Это очень важно в современных условиях, так как большое количество штаммов клебсиелл обладает устойчивостью к различным антибиотикам.
Для выяснения причины появления микроорганизмов в кале младенца назначаются различные методики исследований:
- клинический анализ крови и мочи;
- анализ на определение концентрации глюкозы;
- иммунологические и аллергические пробы;
- выявление антител к различным возбудителям инфекционных заболеваний;
- при необходимости, исследование мочи, мокроты, крови на наличие возбудителя;
- УЗИ внутренних органов.
На основании всех данных объективного обследования врач определяет дальнейшую лечебно-профилактическую тактику. Норма клебсиелл в 1 г кала не должна превышать 105 клеток. При эпизодическом увеличении количества назначается медицинское наблюдение с периодическим бактериологическим посевом кала.
Последствия и осложнения
Систематическое повышение количества клебсиелл в кале ребенка провоцирует развитие осложнений:
- нарушение пищеварения с недостаточным усваиванием питательных веществ и витаминов;
- отставание ребенка в развитии;
- повышение риска развития воспалений в различных органах и тканях;
- снижение активности иммунитета, провоцирующее присоединение других инфекций, включая кандидоз;
- развитие острой кишечной инфекции.

Перед лечением от клебсиеллы нужно провести диагностику
В большинстве случаев у детей с диагностированными пневмонией, менингитом, пиелонефритом, синуситами, которые были вызваны клебсиеллами, отмечалось увеличение количества бактерий в кишечнике.
Лечение
Проведение терапевтических мероприятий требуется, когда количество клебсиелл в кале ребенка превышает норму. Лечение заключается в следующем:
- уменьшение количества клебсиелл;
- профилактика инфекционно-воспалительных процессов различной локализации;
- восстановление нормальной микрофлоры кишечника;
- улучшение работы пищеварительной системы и других органов.
Терапевтические мероприятия проводятся в 2 этапа:
- Снижение количества клебсиелл с помощью антибактериальных средств: антибиотики назначаются только врачом по строгим показаниям. Обычно предварительно проводится определение чувствительности выделенных микроорганизмов к антибиотику. Как правило, используются средства с широким спектром действия, к которым относятся полусинтетические пенициллины и цефалоспорины.

- Восстановление нормальной микрофлоры – назначение пробиотиков. Одновременно рекомендуется увеличить количество кисломолочных продуктов в рационе.
Назначаются мероприятия, направленные на снижение факторов, спровоцировавших увеличение количества клебсиелл в кишечнике.
Лечение дисбактериоза должен назначать только врач. Попытки самостоятельно восстановить микрофлору кишечника приводят к усугублению состояния и развитию негативных последствий.
Также интересно почитать: открытое овальное окно в сердце у детей
Симптомы клебсиеллы | Пробиотики Нормофлорины – лечение дисбактериоза
Назад к списку
18. 06.2012
06.2012
Загрузка…
В летний период становятся актуальны заболевания вызванные инфекционными агентами.
Особенно активны микроорганизмы семейства энтеробактерий – грамотрицательные, палочкообразные, с жгутиками для передвижения и прикрепления, факультативные анаэробы: кишечная палочка, сальмонелла, клебсиелла и др. Так, клебсиелла – klebsiella, может существовать в почве, воде, месяцами оставаясь жизнеспособной, сохраняется на пище и пыли.
Клебсиеллы могут попасть в организм через желудочно-кишечный тракт, с плохо вымытых рук, овощей и фруктов, с водой, с почвой. Однако, этот микроорганизм входит в группу условно-патогенной микрофлоры и определяется у абсолютно здоровых детей и взрослых, считается одним из элементов нормальной флоры кишечника.
При этом, клебсиелла является одной из самых распространённых внутрибольничных инфекций, т. к. она устойчива к действию факторов окружающей среды, высоким температурам. Хотя, за несколько минут она гибнет от дезинфектантов, а при очень высоких температурах через 1-1,5 часа. При несоблюдении надлежащих правил гигиены, санитарных норм в помещениях, встречаются случаи заражения новорожденных клебсиеллой в роддомах. Малыш постоянно плачет и не может заснуть, его беспокоят колики и частый понос. А причина – клебсиелла – бактерия, устойчивая к губительному действию внешней среды, покрытая плотной капсулой.
к. она устойчива к действию факторов окружающей среды, высоким температурам. Хотя, за несколько минут она гибнет от дезинфектантов, а при очень высоких температурах через 1-1,5 часа. При несоблюдении надлежащих правил гигиены, санитарных норм в помещениях, встречаются случаи заражения новорожденных клебсиеллой в роддомах. Малыш постоянно плачет и не может заснуть, его беспокоят колики и частый понос. А причина – клебсиелла – бактерия, устойчивая к губительному действию внешней среды, покрытая плотной капсулой.
Факторы развития клебсиеллеза
Клебсиеллы относятся к одному семейству с бактериями рода Serratia и Enterobacter. Этими возбудителями, особенно Serratia, обладающий наибольшей лекарственной устойчивостью, обусловливаются вспышки инфекции в стационарах, в связи с загрязнением ряда медикаментозных средств, лекарственных растворов, применяемых в терапии органов дыхания. Их трудно, но можно дифференцировать только с помощью специальных проб. Klebsiella Enterobacter и Serratia, вызывающие внутрибольничную пневмонию, инфекцию мочевого тракта, бактериемию, обладают различной чувствительностью к противомикробным препаратам.
Klebsiella Enterobacter и Serratia, вызывающие внутрибольничную пневмонию, инфекцию мочевого тракта, бактериемию, обладают различной чувствительностью к противомикробным препаратам.
Позитивное окрашивание. Клетка K. pneumaniae. Ув. x6000
Если защита организма человека по какой то причине ослаблена: снижен общий иммунитет, часто грипп, ОРВИ, применение антибиотиков, употребление загрязненных, некачественных продуктов, сахарный диабет, алкоголизм и др., клебсиелла начинает активно размножаться, выделять токсины, вызывая эндотоксимию и воспалительные процессы в разных органах. Развиваются такие заболевания, как воспаление легких, воспалительные заболевания мочевыводящих путей, менингит, конъюнктивит, кишечные инфекции, сепсис и достаточно редкие болезни – озена (зловонный насморк), риносклерома.
Наиболее часто клебсиелла вызывает пневмонию и поражение кишечника. У взрослых людей чаще встречается пневмония, вызванная палочкой Фридлендера. В связи с особенностью иммунитета новорожденных и недостаточностью у них нормальной микрофлоры на коже, в дыхательных путях и особенно в кишечнике – клебсиелла – Klebsiella oxytoca – чаще вызывает поражения желудочно-кишечного тракта – толстого кишечника.
Симптомы клебсиеллы (клебсиеллёза) в ЖКТ у грудничков
Симптомы клебсиеллы у малышей схожи с симптомами дисбактериоза: вздутие, метеоризм, колики, срыгивание. Но чаще проявляются – жидким стулом со слизью, кровью и резким запахом, повышением температуры, лихорадкой, болями в животе и сильным обезвоживанием организма. В зависимости от того, какой иммунитет у малыша, течение заболевания может протекать как в лёгкой форме, так и грозить тяжелыми инфекционными осложнениями. Если клебсиелла в организме быстро размножается, выделяет токсины, нарастает интоксикация, обезвоживание, то заболевание может проявиться в течение нескольких часов и потребует срочной госпитализации ребенка.
Поэтому, при любом расстройстве стула, необходимо обратиться к врачу, сдать кал ребёнка на анализ, пройти обследование, чтобы точно выявить, какие именно бактерии вызвали изменение состояния ребёнка. Большую роль в восстановлении иммунитета и нормальной микрофлоры у новорожденного играет грудное вскармливание. При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания, лечении ребенка в больнице, назначают сложную терапию с применением антибиотиков. Если заболевание грудничка протекает в лёгкой форме, то для коррекции микрофлоры кишечника назначают пробиотики. Синбиотики – Нормофлорины Л и Б – обладают активным противовоспалительным, антисептическим и питательным действием, что важно при клебсиеллёзной инфекции. Ребенок может чувствовать себя нормально, а при обследовании находят в анализах повышение количества клебсиелл. Тогда препараты с лакто- и бифидобактериями назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета, улучшения собственной полезной микрофлоры.
При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания, лечении ребенка в больнице, назначают сложную терапию с применением антибиотиков. Если заболевание грудничка протекает в лёгкой форме, то для коррекции микрофлоры кишечника назначают пробиотики. Синбиотики – Нормофлорины Л и Б – обладают активным противовоспалительным, антисептическим и питательным действием, что важно при клебсиеллёзной инфекции. Ребенок может чувствовать себя нормально, а при обследовании находят в анализах повышение количества клебсиелл. Тогда препараты с лакто- и бифидобактериями назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета, улучшения собственной полезной микрофлоры.
Симптомы клебсиеллы в других органах и системах
Если клебсиеллы попадают в мочевыделительную систему, то они способны вызывать уретрит, пиелонефрит, со стойким рецидивирующим течением, плохо поддающимся терапии и часто измененной чувствительностью к антибиотикам. В редких случаях клебсиеллёза, возможно такое осложнение, как – озена – зловонный насморк, с поражением слизистой носа, образованием гнойных, болезненных, кровоточащих корок.
В редких случаях клебсиеллёза, возможно такое осложнение, как – озена – зловонный насморк, с поражением слизистой носа, образованием гнойных, болезненных, кровоточащих корок.
Симптомы и признаки инфекций мочевыводящих путей, желчного пузыря и в брюшной полости, вызываемых клебсиеллами, не отличаются от симптоматики, обусловленной кишечной палочкой. Развиваются они чаще у больных сахарным диабетом и у пациентов, получающих антимикробные препараты, к которым устойчив возбудитель заболевания. Клебсиелла является также важным этиологическим фактором септического шока.
Клебсиелла известна как фактор развития легочных заболеваний, однако, среди причин, вызывающих бактериальную пневмонию, имеет около 1% всех случаев. Встречается преимущественно у мужчин в возрасте старше 40 лет, с хроническими бронхолегочными заболеваниями, больных сахарным диабетом и лиц с алкоголизмом. У пожилых людей, грамотрицательные бактерии заселяют ротоглотку и могут распространиться по дыхательному тракту, вызывая пневмонию или гнойный бронхит.
Клинические симптомы клебсиеллёзной пневмонии сходны с проявлениями при пневмококковой пневмонии, но чаще характеризуются более тяжелым течением: внезапным началом, ознобов, стойким повышением температуры тела, продуктивным кашлем, иногда с прожилками крови и резким запахом, с сильными плевральными болями, появлением одышки. Больные часто находятся в прострации и бредовом состоянии, за счет интоксикации. Чаще всего очаг воспаления располагается в правой верхней доле легкого, но может быстро прогрессировать, если лечение не проводится и распространиться с одной доли на другую. Появляются цианоз и одышка, могут возникнуть желтуха, рвота, диарея. Выявляется, при обследовании, образование плеврального выпота, уплотнение легочной ткани, или некротизирующая пневмония, с быстрой кавернизацией. На фоне интоксикации определяется снижение количества лейкоцитов в периферической крови, а не повышение, как при воспалении. Гораздо чаще наблюдаются абсцессы и эмпиемы легких. Это объясняется способностью клебсиелл вызывать деструкцию ткани. Не всегда выявляются характерные признаки при рентгеновском обследовании: уменьшение объема легкого, его уплотнение, эмфизематозные изменения. При медленном прогрессировании инфекционного воспалительного процесса может развиться хронический некротизирующий пневмонит, напоминающий туберкулез, с продуктивным кашлем, слабостью, выраженной анемией.
Это объясняется способностью клебсиелл вызывать деструкцию ткани. Не всегда выявляются характерные признаки при рентгеновском обследовании: уменьшение объема легкого, его уплотнение, эмфизематозные изменения. При медленном прогрессировании инфекционного воспалительного процесса может развиться хронический некротизирующий пневмонит, напоминающий туберкулез, с продуктивным кашлем, слабостью, выраженной анемией.
Лечение клебсиеллезов
Лечение заболеваний, вызванных клебсиеллой, зависит от локализации и выраженности патологического процесса. Антибиотики назначают в тяжелых случаях по чувствительности, при легком течении или только обнаружении в анализах повышения клебсиелл – не применяют. Обязательно используют разнообразные препараты, восстанавливающие кишечную микрофлору.
Клебсиелла пневмония
Как правило, антимикробную терапию рекомендуют начинать еще до получения результатов посева и определения лекарственной чувствительности к антибиотикам. В этом случае биокомплексы Нормофлорины, содержащие продукты жизнедеятельности живых лакто- и бифидобактерий с активным антисептическим, противовоспалительным действием, оказывают лечебный эффект при клебсиеллёзах, что доказано научными исследованиями и многолетней практикой, как у новорожденных, беременных, кормящих, так и взрослых и пожилых.
В этом случае биокомплексы Нормофлорины, содержащие продукты жизнедеятельности живых лакто- и бифидобактерий с активным антисептическим, противовоспалительным действием, оказывают лечебный эффект при клебсиеллёзах, что доказано научными исследованиями и многолетней практикой, как у новорожденных, беременных, кормящих, так и взрослых и пожилых.
Назад к списку
Бактериофаг клебсиелл пневмонии очищенный инструкция по применению: показания, противопоказания, побочное действие – описание Bacteriophage klebsiella pneumoniae purified р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. (36380)
Препарат используют для приема внутрь (через рот), в виде клизм, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа, а также в дренированные полости: абсцессов, брюшную, плевральную, мочевого пузыря, почечной лоханки.
Bнутрь препарат принимают натощак за 0,5-1 час до приема пищи.
Рекомендуемые дозы препарата
| Возраст пациента | Доза на 1 прием при различных способах введения препарата | |
| внутрь (мл) | в клизме (мл) | |
| 0-6 мес | 5 | 10 |
| 6-12 мес | 10 | 20 |
| От 1 года до 3 лет | 15 | 20-30 |
| От 3 до 8 лет | 20 | 30-40 |
| От 8 лет и старше | 20-30 | 40-50 |
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь.
В случае обработки полости гнойного очага химическими антисептиками перед применением бактериофага она должна быть промыта стерильным 0,9 % раствором натрия хлорида.
При лечении ангин, фарингитов, ларингитов препарат используют для полосканий полости рта и глотки 3 раза в день по 10-20 мл, курс лечения 7-10 дней.
При лечении бронхитов, пневмоний препарат принимают внутрь 3 раза в день по 10-20 мл, а также применяют в виде ингаляций (без подогрева и использования ультразвука), курс лечения 15-20 дней.
При лечении отитов препарат используют для промывания и введения в полость среднего уха по 2-5 мл 1-3 раза в день. Курс лечения 7-15 дней.
При лечении воспалений пазух носа препарат используют для промывания полости носа, носоглотки и пазух носа в дозе 5-10 мл и введения в пазухи 2-3 мл. Процедуру повторяют ежедневно однократно в течение 7-10 дней. Кроме того, препарат вводят в полость носа в виде турунд, смоченных бактериофагом, по очереди в каждый носовой ход и оставляют в течение 0,5-1 часа. Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
При лечении стоматитов и хронических генерализованных пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных бактериофагом клебсиелл, на 5-10 мин, курс лечения 7-10 дней.
При конъюнктивитах и кератоконъюнктивитах, препарат применяют по 2-3 капли 4-5 раз в день, курс лечения 5-7 дней; при гнойной язве роговицы — по 4-5 капель в день в течение 7-10 дней, при гнойных иридоциклитах — по 6-8 капель каждые 3 часа в сочетании с приемом внутрь в терапевтических дозировках в течение 7-10 дней.
При абсцессах после вскрытия и удаления гнойного содержимого препарат вводят в количестве меньшем, чем объем удаленного гноя ежедневно однократно, курс лечения 7-10 дней.
При перитонитах и плевритах препарат вводят в дренированные полости -брюшную и плевральную через дренажные трубки ежедневно однократно 20-70 мл, курс лечения 10-15 дней.
При остеомиелитах препарат вводят в полость раны через турунды, дренажи в количестве 10-30 мл ежедневно однократно, курс лечения 15-20 дней.
При лечении нагноений ран препарат применяют в виде орошения, аппликаций, повязок, введения в дренаж в дозе 5-50 мл в зависимости от очага пораженияне менее одного раза в день, курс лечения 10-15 дней.
При лечении гнойно-воспалительных гинекологических заболеваний (нагноений ран, эндометритов, вульвитов, бартолинитов, кольпитов, сальпингоофоритов) препарат используют для орошений, аппликаций, вводят в полости ран, вагины, матки по 5-20 мл один раз в день в течение 7-10 дней.
При циститах, пиелонефритах, уретритах препарат принимают внутрь в терапевтической дозе 3 раза в день за 1 час до еды в течение 10-20 дней. В том случае, если полость мочевого пузыря или почечной лоханки дренированы, препарат вводят через цистостому или нефростому 1-3 раза в день по 20-50 мл в мочевой пузырь и 5-7 мл в почечную лоханку, курс лечения 7-15 дней.
При гастроэнтероколитах, панкреатитах, холециститах, а также дисбактериозах кишечника бактериофаг принимают внутрь в возрастных дозировках 3 раза в день за 1 час до еды в течение 7-15 дней (по клиническим показаниям). При неукротимой рвоте препарат применяют в виде высоких клизм 2-3 раза в день по 20-40 мл. При дисбактериозе кишечника препарат может применяться с препаратами нормофлоры.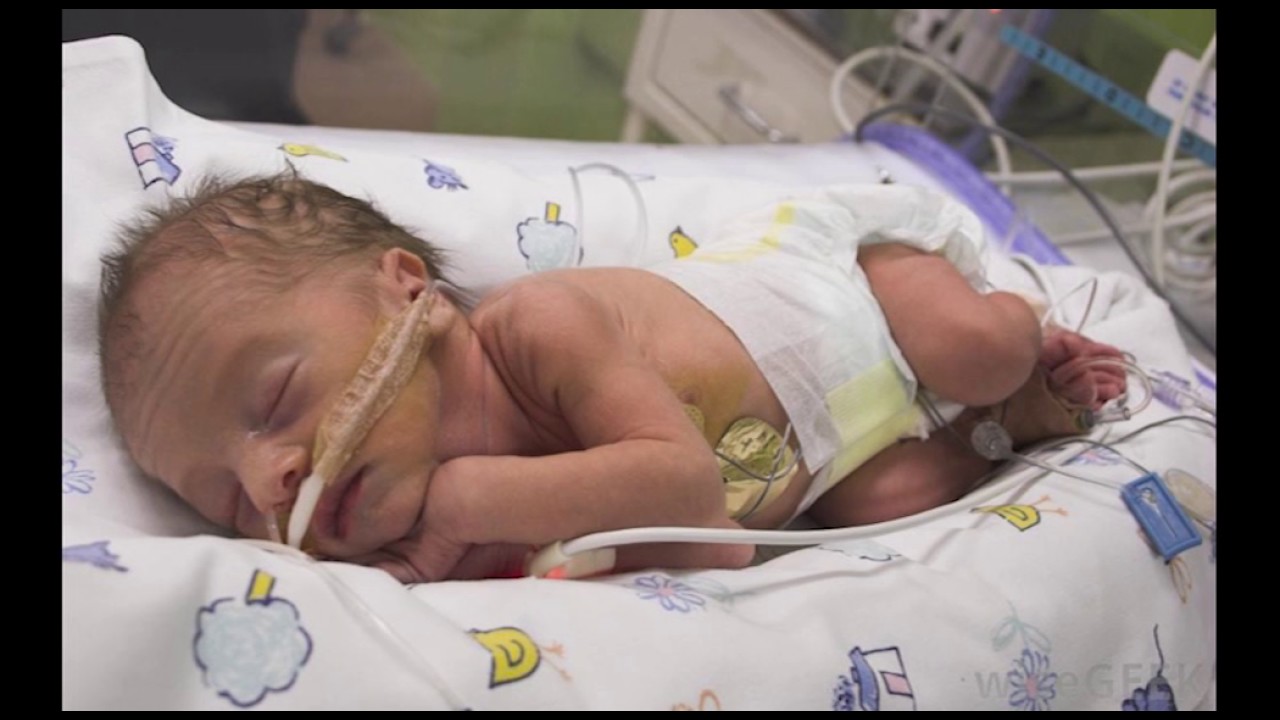
Для профилактики внутрибольничных хирургических инфекций препарат используют для обработки послеоперационных и свежеинфицированных ран в дозе 5 -50 мл в зависимости от очага поражения ежедневно однократно в течение 5-7 дней.
Применение препарата у детей до 1 года (включая недоношенных детей).
При гастроэнтероколите, пневмонии и сепсисе новорожденных препарат применяют через рот 2-3 раза в сутки по 3-5 мл за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно однократно в дозе 5-10 мл. Возможно сочетание ректального (в виде высоких клизм) и пероралыюго применения препарата. Курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
С целью профилактики возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют по эпидемическим показаниям внутрь по 3-5 мл 3 раза в день за 30 минут до кормления в течение всего срока пребывания в стационаре.
При лечении омфалитов, пиодермии, инфицированных ран бактериофаг применяют в виде аппликаций по 5-10 мл 2-3 раза в день (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи) в течение 7-15 дней.
Применение препарата не исключает использование других антибактериальных и противовоспалительных препаратов.
Клебсиелла относится к лактозонегативным энтеробактериям, количество клебсиеллы не должно превышать: У детей
Клебсиелла относится к лактозонегативным энтеробактериям, количество клебсиеллы не должно превышать:
У детей — менее чем 10*4 клеток в 1 г фекалий.
У взрослых – менее чем 10*4 клеток в 1 г фекалий.
Повышенное содержание клебсиеллы в кишечнике у ребенка может быть вызвано дисбиозом кишечника. Клебсиелла растет с превышением нормы только при снижении количества бифидо- и лактобактерий.
Превышение нормы по клебсиелле
Симптомы превышения нормы по клебсиелле: диарея, жидкий стул с примесью слизи, боли в животе, ребенок беспокоен, не прибавляет в весе. В бактериологическом анализе кала выявляется соответствующий тип клебсиеллы. Повышенное количество клебсиелл приводит к развитию аллергий, запоров, проявлениям лактазной недостаточности.
Косвенный признак превышения нормы по клебсиелле — зеленый стул со слизью, кислый запах кала (симптомы бродильной диспепсии). Клебсиелла является одним из возбудителей кишечных инфекций, а также пневмонии в детском возрасте. Заражение может также происходить через пищу и воду
Клебсиелла у новорожденных
У новорожденного Клебсиелла может вызывать симптомы инфекционного заболевания, протекающего в лёгкой форме, а может, в зависимости от силы иммунитета, приводить к тяжёлому течению: с повышением температуры, ознобом, лихорадкой, болями в животе, диареей и сильным обезвоживанием организма. При появлении таких симптомов необходимо обратиться к врачу, а также сдать кал малыша на исследования.
Вытеснение клебсиеллы
Прием жидких пробиотиков Бифидум БАГ и Трилакт курсом 3-4 месяца вытесняет клебсиеллу со слизистых оболочек кишечника, устраняет запоры и боли в животе, восстанавливает микробный пейзаж до нормы.
Трилакт (концентрат лактобактерий) – прямой антагонист клебсиеллы, надежно вытесняет ее из кишечника.
Препараты Бифидум БАГ и Трилакт можно принимать до результата анализа, так как клебсиелла активно растет только при дефиците бифидобактерий и лактобактерий.
Нашей девочке 4,5 месяца. Мы полностью на ГВ. За все это время стул ребенка нестабилен: в основном жидкий с непереваренными комочками, иногда просто водой, очень часто сплошная слизистая тягучая масса зеленого цвета. Кроме того, что всегда после кормления долго остается надутая, как шарик, и мучается пуками, но без капризов- нас ничего не беспокоит. Решили сдать анализ на дисбактериоз. У мамы в молоке в одной груди обнаружили Стафилококк epidermikus c не очень мне понятной припиской «немассивная обсемененная». Кал ребенка, картина такая: Патогенной флоры — не обнаружено. E.coli с нормальной ферментной активностью – 15*10 в 10 E.coli со сниженной ферментной активностью – 0 E.coli гемолитические- 0 Золотистый стафилококк- 4* 10 во 2 Бифидо
13 Дек Нашей девочке 4,5 месяца. Мы полностью на ГВ. За все это время стул ребенка нестабилен: в основном жидкий с непереваренными комочками, иногда просто водой, очень часто сплошная слизистая тягучая масса зеленого цвета. Кроме того, что всегда после кормления долго остается надутая, как шарик, и мучается пуками, но без капризов- нас ничего не беспокоит. Решили сдать анализ на дисбактериоз. У мамы в молоке в одной груди обнаружили Стафилококк epidermikus c не очень мне понятной припиской «немассивная обсемененная». Кал ребенка, картина такая: Патогенной флоры – не обнаружено. E.coli с нормальной ферментной активностью – 15*10 в 10 E.coli со сниженной ферментной активностью – 0 E.coli гемолитические- 0 Золотистый стафилококк- 4* 10 во 2 Бифидо- 10в 9 Лакто – 10 в 8 Клебсиелла – 3* 10 в7. Нужно ли лечиться маме и как лечить ребенка, не прибегая к антибиотикам, по более щадящей , но надежной схеме. Нужно ли вообще лечить ребенка с такими анализами и беспокойным стулом? Будем очень благодарны за консультацию
Posted at 14:24h
in вопрос-ответ
by admin
У Вашего ребёнка дисбиоз кишечника, аэробно-анаэробный, декомпенсированный. Лечение требуют два микроба:
– Стафилококк золотистый ( Staphylococcus aureus) — факультативный и наиболее частый возбудитель стафилококкоза, частый представитель микрофлоры носа и кожи
Стафилококк золотистый способен вызывать целую вереницу болезней, от минорных заболеваний кожи, таких как прыщи, папулы, пиодермия, фурункулы, целлюлит, гиподермит, жировая гранулема, карбункулы и т.д.Под его влияние попадают многие органы: кожа, мягкие ткани, кости, суставы; вызывает инфекции в ранах. Как и прежде относится к числу пяти наиболее частых причин нозокомиальных (больничных) инфекций, часто является причиной постоперационных ран (нагноений).
– Клебсиелла ( Klebsiella) — условно-патогенная бактерия.
Представители рода встречаются в фекалиях человека, на коже и слизистых дыхательных путей, в почве, воде, фруктах и овощах. Благодаря капсуле устойчивы в окружающей среде. Бактерии этого рода Вызывают пневмонию, урогенитальные инфекции, в том числе у новорожденных, у ослабленных и пожилых лиц, конъюнктивиты, менингиты, сепсис, острые кишечные инфекции. Klebsiella pneumoniae subsp. ozaenae и Klebsiella pneumoniae subsp. rhinoscleromatis вызывают соответственно озену и риносклерому (гранулематозное поражение слизистой оболочки верхних дыхательных путей).
Для лечения дисбиоза кишечника Вам необходимо обратиться к педиатру по месту жительства или вызвать врача из «Доброго Доктора» по телефону 8029-333-88-77 ежедневно с 9.00 до 19.00.
Эпидермальный стафилококк, который был обнаружен у мамы, в лечении не нуждается.
ЧУВСТВИТЕЛЬНОСТЬ К АНТИБИОТИКАМ ШТАММОВ KLEBSIELLA PNEUMONIAE, ВЫДЕЛЕННЫХ В МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ | Козлова
1. Баранцевич Е.П., Баранцевич Н.Е., Шляхто Е.В. Продукция карбапенемаз нозокомиальными штаммами Klebsiella pneumoniae в Санкт-Петербурге // Клиническая микробиология и антимикробная химиотерапия. 2016. Т. 18, № 3. С. 196–199.
2. Егорова С.А., Кафтырева Л.А., Липская Л.В., Коноваленко И.Б., Пясетская М.Ф., Курчикова Т.С., Ведерникова Н.Б., Морозова О.Т., Смирнова М.В., Попенко Л.Н., Любушкина М.И., Савочкина Ю.А., Макарова М.А., Сужаева Л.В., Останкова Ю.В., Иванова М.Н., Павелкович А.М., Наабер П., Сепп Э., Кыльялг С., Мицюлявичене И., Балоде А. Штаммы энтеробактерий, продуцирующие бета-лактамазы расширенного спектра и металло-бета-лактамазу NDM-1, выделенные в стационарах в странах Балтийского региона // Инфекция и иммунитет. 2013. Т. 3, № 1. С. 29–36.
3. Козлов Р.С., Голуб А.В. Выбор антимикробных препаратов при неосложненных инфекциях мочевых путей: как принять соломоново решение? // Клиническая микробиология и антимикробная химиотерапия. 2014. Т. 16, № 1. С. 18–25.
4. Козлова Н.С., Баранцевич Н.Е., Иванова Л.В., Гоик В.Г., Баранцевич Е.П. Антибиотикорезистентность энтеробактерий, выделенных из мочи пациентов многопрофильного стационара // Проблемы медицинской микологии. 2015. Т. 17, № 3. С. 22–26.
5. Козлова Н.С., Баранцевич Н.Е, Иванова Л.В., Гоик В.Г., Баранцевич Е.П. Чувствительность к антимикробным препаратам энтеробактерий различного происхождения в многопрофильном стационаре // Проблемы медицинской микологии. 2016. Т 18, № 3. С. 30–35.
6. Косякова К.Г., Каменева О.А., Морозова С.Е. Микробный пейзаж и уровень антибиотикорезистентности в отделении реанимации новорожденных // Профилактическая и клиническая медицина. 2015. № 2 (55). С. 12–17.
7. Кофтырева Л.А., Егорова С.А., Кожухова Е.А., Макарова М.А., Козлова Н.С., Матвеева З.Н., Шестакова Т.И., Петрова Л.Ю., Кича Е.В. Резистентность энтеробактерий к антимикробным препаратам выбора при лечении острых кишечных инфекций // Казанский медицинский журнал. 2009. Т. 90, № 5. С. 699–704.
8. Руководство по медицинской микробиологии. Книга III. T. 1. Оппортунистические инфекции: возбудители и этиологическая диагностика. Под ред. Лабинской А.С., Костюковой Н.Н. М.: Бином, 2013. 751 c.
9. Сухорукова М.В., Эйдельштейн М.В., Склеенова Е.Ю., Иванчик Н.В., Микотина А.В., Дехнич А.В., Козлов Р.С. и исследовательская группа «МАРАФОН». Антибиотикорезистентность нозокомиальных штаммов Enterobacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования «МАРАФОН» в 2013–2014 гг. // Клиническая микробиология и антимикробная химиотерапия. 2017. Т. 19, № 1. С. 49–56.
10. Эйдельштейн М.В., Журавлев В.С., Шек Е.А. Распространенность карбапенемаз среди нозокомиальных штаммов Еnterobacteriacea в России // Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология. 2017. Т. 17, № 1. С. 36–41.
11. European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2014. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC, 2015. 130 p. URL: http://apps.who.int/medicinedocs/documents/s23165en/s23165en.pdf (13.03.2018)
12. European Committee on Antimicrobial Susceptibility Testing. Clinical breakpoints (2013). URL: http://www.eucast.org/clinical_breakpoints/ (13.03.2018)
13. Pitout J.D.D., Nordmann P., Poirel L. Carbapenemase-producing Klebsiella pneumoniae, a key pathogen set for global nosocomial dominance. Antimicrob. Agents Chemother., 2015, vol. 59, no. 10, pp. 5873–5884. doi: 10.1128/AAC.01019-15
14. Shevchenko O.V., Mudrak D.Y., Skleenova E.Y., Kozyreva V.K., Ilina E.N., Ikryannikova L.N., Alexandrova I.A., Sidorenko S.V., Edelstein M.V. First detection of VIM-4 metallo-?-lactamase-producing Escherichia coli in Russia. Clin. Microbiol. Infect., 2012, vol. 18, iss. 7, pp. 214–217. doi: 10.1111/j.1469-0691.2012.03827.x
15. Tzouvelekis L.S., Markogiannakis A., Psichogiou M., Tassios P.T., Daikos G.L. Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae: an evolving crisis of global dimensions. Clin. Microbiol. Rev., 2012, vol. 25, no. 4, pp. 682–707. doi: 10.1128/CMR.05035-11
симптомы, причины, методы терапии, отзывы
Сразу после появления на свет практически все системы и органы ребенка находятся в стадии дозревания. Поэтому они подвержены различным заболеваниям, вызванным условно-патогенной флорой. К таковым относятся бактерии, которые живут на слизистых и коже человека. Однако под воздействием некоторых факторов они начинают приносить вред организму. К числу подобных причисляется клебсиелла. В сегодняшней статье мы более подробно рассмотрим, какими симптомами сопровождается ее активность, что необходимо предпринять в качестве терапевтической меры.
Клебсиелла у грудничка в кале — что это значит?
Клебсиелла — это грамотрицательная бактерия, имеющая вид палочки. Впервые ее описание представил немецкий патологоанатом Эдвин Клебс. Микроб относится к категории анаэробных, то есть он размножается исключительно в бескислородной среде. Однако и на воздухе клебсиелла в течение длительного времени может сохранять свою жизнеспособность. При кипячении она гибнет.
Выделяют 8 видов бактерий. У маленьких детей преимущественно встречаются только два из них: клебсиелла пневмония и клебсиелла окситока. Они обитают в кишечнике и каловых массах, на коже и слизистых оболочках. Пока иммунитет полноценно работает, бактерия не представляет опасности. При ослабевании защитной системы условно-патогенная флора начинает активно развиваться, отравляя организм. У маленьких детей иммунитет находится в стадии формировании, а слизистые практически стерильны. Поэтому заражение клебсиеллой может привести к серьезным заболеваниям.
Основные причины
Многих родителей пугает выявление клебсиеллы у грудничка в кале. Что это за бактерия, мы рассказали чуть выше. По каким причинам она может появиться?
Условно все причины принято разделять на две группы: внешние и внутренние. К первой категории относятся:
- контакт младенца с инфицированным взрослым человеком;
- распространение бактерии посредством грязной воды, игрушек или больных животных;
- употребление в пищу зараженных продуктов.
Проникая в организм, клебсиелла не всегда представляет опасность даже для маленького организма. Нередко она вступает в своеобразный симбиоз с микрофлорой хозяина и начинает участвовать в основных процессах жизнедеятельности. Возможность провоцировать развитие воспалительных заболеваний возникает при бурном росте бактерии.
Среди внутренних причин можно выделить:
- ослабленный иммунитет;
- дисбаланс внутренней микрофлоры кишечника;
- аллергия на некоторые продукты питания;
- нехватка «полезных» бактерий на фоне антибактериальной терапии;
- присутствие в кишечнике патогенной флоры, которая уничтожает здоровую.
Достаточно часто клебсиелла выявляется вместе со стафилококком. Эти бактерии существуют сообща. Как только стафилококки заканчивают уничтожение полезных микроорганизмов, клебсиеллы занимают их место своими колониями.
Клиническая картина
Клебсиелла пневмония у детей дошкольного возраста встречается редко. Наиболее распространенна ее кишечная разновидность. Однако самостоятельно выявить ее родителям трудно. По причине недостаточно сформированной микрофлоры кишечника у новорожденных часто развивается дисбактериоз, за который часто и воспринимают клебсиеллезную инфекцию. Поэтому при подозрении на недуг без медицинской помощи не обойтись.
Основными симптомами клебсиеллы в кале у грудничка выступают следующие:
- вздутие и повышенное газообразование в животе;
- колики;
- частые и обильные срыгивания «фонтаном»;
- лихорадка и гипертермия;
- понос с примесями слизи;
- кислый запах от фекалий.
Активное размножение бактерии может привести к обезвоживанию организма.
Симптомы клебсиеллы пневмонии у грудничка схожи с таковыми при ОРВИ. Повышается температура до 38-39 градусов, появляется сильный сухой кашель. Через несколько дней он становится влажным, может выделяться мокрота с прожилками крови и неприятным запахом. При этом ребенок становится капризным и вялым, отказывается от пищи.
Появление перечисленных симптомов требует незамедлительного обращения к педиатру. Доктор должен назначить обследование на выявление патогенных микроорганизмов.
Методы диагностики
При возникновении симптомов клебсиеллы у грудничка лечением и диагностикой должен заниматься педиатр или гастроэнтеролог. Диагноз устанавливается по результатам лабораторных исследований. Для анализа выполняется забор:
- кала;
- мочи;
- крови;
- мокроты;
- отделяемого из носовой или ротовой полости.
Для получения полной клинической картины может потребоваться общий анализ крови и копрограмма.
Поскольку активность бактерии в организме не сопровождается специфическими симптомами, в ходе комплексного обследования маленького пациента необходимо исключить заболевания с похожими проявлениями. Клебсиеллу дифференцируют от стафилококка и различных патологий ЖКТ.
Результаты обследования могут вызвать беспокойство только в случае превышения нормативных значений числа бактерий в грамме биоматериала. В идеале этот показатель не должен быть более 106.
Когда проведенные анализы подтверждают и имеются симптомы клебсиеллы у грудничка в кале, диагностируется клебсиеллезный гастроэнтерит. При этом количество бактерий в грамме биологического материала составляет 108. В случае концентрации в мокроте свыше 106 на грамм, врач делает заключение о клебсиеллезной пневмонии.
Принципы лечения
Основная опасность бактерии — наличие крепкой капсулы, которая защищает ее от действия активных веществ лекарственных средств. Поэтому ее обнаружение в анализах сопровождается длительной терапией, которая чаще всего проводится в условиях стационара. Одновременно она преследует несколько целей: уничтожение непосредственно патогенных агентов, восстановление баланса кишечной микрофлоры. На весь период лечения дополнительно требуется соблюдение диеты со стороны мамы, если малыш находится на грудном вскармливании, или ребенка.
Грудничков обычно стараются оградить от применения антибиотиков. Если инфекционная патология имеет смешанный характер, а ее признаки не пропадают в течение длительного времени, от использования антибактериальных средств отказываться нельзя.
Известный детский педиатр Комаровский имеет свое мнение по данному вопросу. Он полагает, что даже при наличии симптомов клебсиеллы у грудничка в кале лечение специфического характера не требуется. Лекарства практически не влияют на активность бактерии. По его мнению, достаточно наладить режим питания маме и ребенку, нормализовать стул, заниматься укреплением иммунитета доступными методами. Со временем иммунная система малыша окрепнет, а сами бактерии продолжат мирно сосуществовать в его организме вместе с полезными.
Применение антибиотиков
Лечение клебсиеллы у грудничка антибиотиками показано в следующих случаях:
- осложненная форма патологии, когда ее течение сопровождается стафилококком или иными бактериологическими поражениями;
- отсутствие эффективности от альтернативной терапии;
- высокий риск осложнений.
В перечисленных случаях маленькому пациенту назначают цефалоспорины 3-4 поколения («Цефтриаксон», «Супракс»). Стоит заметить, что бактерия проявляет устойчивость к антибиотикам пенициллиновой и оксациллиновой групп.
Все медикаменты подбираются индивидуально. Первоначально «забранную» из мочи или кала ребенка клебсиеллу в лабораторных условиях подвергают атаке несколькими противомикробными средствами. Тот препарат, который сумеет убить ее, будет выбран в качестве основного для терапии. Его дают совместно с иммуномодуляторами для повышения способности иммунитета ребенка к сопротивлению. Весь этот процесс обычно занимает от 7 до 21 суток. Он обязательно протекает под врачебным контролем во избежание распространения инфекции на другие органы. Кроме того, при низкой резистенции выбранный изначально антибиотик заменяют другим.
После окончания курса приема препаратов требуется восстановить равновесие микрофлоры. Поскольку их применение убивает и полезные бактерии, а не только клебсиеллу у грудничка.
Лечение бактериофагами
Если маленький пациент после подтверждения диагноза хорошо себя чувствует, идеальным вариантом для уменьшения количества колоний бактерий в кишечнике считается применение бактериофагов. Это специально созданные вирусы, которые воздействуют исключительно на источник недуга. Они не наносят вред остальным микроорганизмам, не нарушают баланс полезной микрофлоры в ЖКТ. Курс лечения обычно составляет до 3 недель.
Необходимость в регидратации
Организм взрослого примерно на 75 % состоит из воды, а новорожденного — на 90 %. Поэтому так важно своевременно пополнять запасы жидкости. В случае кишечной инфекции ребенок быстро теряет в весе, происходит обезвоживание. Впоследствии достаточно трудно провести регидратацию — восполнение воды в организме, поэтому нельзя допускать критических значений.
Симптомы клебсиеллы у грудничка проявляются в виде рвоты и жидкого стула. Вместе с каловыми и рвотными массами выходит вода, запасы минеральных солей. При появлении первых симптомов нарушения следует начинать отпаивать ребенка.
Врачи с этой целью рекомендуют популярный препарат «Регидрон». Это порошок, расфасованный по пакетикам. Содержимое одного из них нужно развести в литре воды, дать малышу. Полученный раствор имеет в своем составе необходимые соли и минералы. Однако существенным его недостатком является достаточно неприятный вкус.
Специально для грудничков были разработаны аналоги «Регидрона» с различными вкусовыми добавками. Например, «Хумана Электролит» и «Гастролит». Они дополнительно содержат фенхель, который отвечает за снятие спазмов и вздутие живота.
Когда в домашней аптечке нет специальных препаратов для регидратации, можно воспользоваться минеральной водой или приготовить ее самостоятельно. Потребуется в литре воды смешать 18 г сахара и 3 г соли. Основное правило регидратации — поить маленькими глотками. В зависимости от возраста пациента разовая доза составляет 1-2 чайные ложки. В противном случае поступающая в организм жидкость спровоцирует очередной выброс рвоты. В особо серьезных случаях, когда симптомы клебсиеллы у грудничка длительное время не проходят, подобную процедуру проводят в условиях стационара и с использованием капельниц.
Применение пробиотиков
Основными показаниями к назначению пробиотиков выступают следующие случаи:
- Самостоятельная терапия для устранения клебсиеллы. Речь идет о слабых формах недуга, когда ребенка ничего не беспокоит.
- Одна из мер восстановительного лечения. После курса терапии, особенно с применением антибиотиков, необходимо заселить кишечник полезной микрофлорой.
С этой целью для устранения симптомов клебсиеллы у грудничка и лечения используются «Бифиформ малыш», «Бифидус», «Примадофилус Бейби». Препараты выпускаются в форме порошка. Их удобно добавлять в воду или молоко. Пробиотики позволяют быстро восстановить работу ЖКТ, избавить ребенка от проблем со стулом.
Возможные опасности и последствия
Выбор метода устранения симптомов клебсиеллы у грудничка всегда остается за врачом. Прогноз на выздоровление и длительность проведения терапии во многом определяются своевременностью обращения к педиатру со стороны родителей. Именно поэтому важно не заниматься самолечением. Даже обычные рвота и понос могут быть причиной клебсиеллы. При появлении этих признаков необходимо вызвать врача.
В случае ухудшения клинической картины, когда стремительно повышается температура и присутствует сильная диарея, увеличивается на этом фоне риск обезвоживания, следует вызвать «Скорую помощь». Бояться инфекционного стационара не стоит. В условиях медучреждения ребенку будет оказана необходимая помощь, назначено грамотное лечение.
Стоит заметить, что симптомы клебсиеллы в кишечнике у грудничка не ограничиваются нарушением стула. В запущенной и агрессивной форме недуг может привести к менингиту, негативно отразиться на состоянии суставов, вызвать бактериальный системный сепсис. Несмотря на то что вероятность возникновения подобных осложнений мала, рисковать жизнью ребенка не стоит.
Отзывы родителей
Согласно отзывам, симптомами и лечением клебсиеллы у грудничка в кале или моче должен заниматься педиатр. Самостоятельные попытки терапии в таком случае оказываются не только не эффективны, но могут спровоцировать развитие осложнений.
Большинство родителей, детям которых пришлось столкнуться с этой бактерией, предупреждают о длительной терапии. Однако бояться антибиотиков не стоит. Современные препараты, назначаемые врачами для лечения детям, помогают справиться с клебсиеллой практически без последствий. Важно только соблюдать все рекомендации педиатра, не пренебрегать на этапе восстановления пробиотиками и бактериофагами.
Способы профилактики
Симптомы клебсиеллы у грудничка, по отзывам родителей, практически всегда проявляются рвотой и диареей. Лечение лишь в некоторых случаях обходится без применения антибиотиков. Поэтому родители желают любыми способами предостеречь своего ребенка от этой бактерии.
Профилактика сводится в первую очередь к укреплению иммунитета, а не к созданию стерильной чистоты в домашних условиях. Для этого даже новорожденный ребенок достаточно времени должен проводить на свежем воздухе. В его рационе должны присутствовать необходимые витамины и микроэлементы, обеспечивающие полноценную работу всего организма.
При появлении первых признаков любой болезни не стоит давать малышу сразу сиропы и таблетки. Все дело в том, что разнообразные вирусы и бактерии буквально тренируют иммунитет, который постепенно формирует антитела к разным возбудителям недугов. В попытках укрепить иммунитет некоторые родители начинают давать иммуномодуляторы и иммуностимуляторы. В профилактических целях их использование не рекомендуется. Исключение составляют подтвержденные случаи иммунодефицитов, когда подобные препараты прописывает врач в качестве основной терапии.
Сопутствующая профилактика появления симптомов клебсиеллы у грудничка основывается на соблюдении элементарных правил и норм гигиены. Взрослые зачастую даже не догадываются, что являются носителями этой бактерии. Поэтому они должны каждый раз после туалета мыть руки с мылом. Непосредственно самому ребенку также необходимо мыть руки с мылом, особенно после контакта с животными, прогулки.
Воздушно-капельным путем передается только одна разновидность бактерии — клебсиелла пневмония. Предупредить ее проникновение в организм достаточно трудно. Можно лишь избегать мест повышенного скопления людей.
Снизить частоту заболеваемости могут и сами родители уже заразившегося ребенка. После подтверждения диагноза по анализам они должны ограничить общение малыша со сверстниками, совместное использование игрушек и постельными принадлежностями до полного выздоровления.
[Клиническая характеристика неонатального сепсиса Klebsiella pneumoniae и характер чувствительности штаммов к антибиотикам]
Цель:
Изучить клинические характеристики неонатального сепсиса, вызванного Klebsiella pneumoniae, и характер чувствительности штаммов Klebsiella pneumoniae к антибиотикам.
Методы:
Ретроспективно изучены клинические данные 42 случаев неонатального сепсиса, вызванного Klebsiella pneumoniae, с января 2000 г. по август 2009 г.
Полученные результаты:
Клинические проявления были неспецифическими, включая лихорадку или гипотермию, тахипноэ, апноэ и непереносимость пищи. Уровень С-реактивного белка (СРБ) увеличился в 95% случаев. Летальность составила 21%. У новорожденных с ранним началом сепсиса штаммы Klebsiella pneumoniae были чувствительны к амоксициллину / клавулановой кислоте, пиперациллину / тазобактаму, цефокситину, имипенему, цефоперазону / и сульбактаму.У новорожденных с поздним началом сепсиса чувствительные к антибиотикам штаммы Klebsiella pneumoniae были меньше, включая цефокситин, пиперациллин / тазобактам и имипенем. Штаммы Klebsiella pneumoniae не были чувствительны к пенициллинам и цефалоспоринам ни у новорожденных с ранним, ни у позднего сепсиса. Штаммы, продуцирующие β-лактамазы расширенного спектра (БЛРС), были обнаружены в 92% случаев. Новорожденные с поздним началом сепсиса имели более высокую распространенность штаммов, продуцирующих БЛРС, чем новорожденные с ранним началом сепсиса (100% против 70%; P <0.05).
Выводы:
Клинические проявления неонатального сепсиса, вызванного Klebsiella pneumoniae, обычно неспецифичны. Обнаружение CRP важно для ранней диагностики сепсиса. Существуют различия в чувствительности штаммов к антибиотикам между новорожденными с ранним и поздним началом сепсиса Klebsiella pneumoniae.
Escherichia coli в сравнении с Klebsiella pneumoniae
Меры предосторожности при изоляции, необходимые для отделений интенсивной терапии новорожденных, являются частью комплекса, направленного на предотвращение передачи, колонизации и инфицирования грамотрицательными патогенами с множественной лекарственной устойчивостью, поскольку новорожденные сталкиваются с повышенным риском смертности и заболеваемости в случае заражения.В следующем кратком отчете описывается передача 3MDRGN Klebsiella pneumoniae в отделении интенсивной терапии новорожденных университетской больницы в Германии. Эта передача произошла даже при наличии усиленных мер инфекционного контроля, что убедительно свидетельствует о важности эпиднадзора, управления вспышками и осведомленности о факторах, способствующих возникновению вспышек.
1. Введение
Обнаружение грамотрицательных патогенов с множественной лекарственной устойчивостью (MDRGN) у недоношенных и зрелых детей, нуждающихся в интенсивной медицинской помощи, вызывает серьезные последствия.В случае заражения для лечения необходимы антибиотики широкого спектра действия. Инфекции, вызванные MDRGN, связаны с худшими исходами по сравнению с инфекциями, вызванными чувствительными изолятами. Меры предосторожности при изоляции, необходимые для отделений интенсивной терапии новорожденных (NICU), являются частью пакета, направленного на предотвращение передачи, колонизации и инфицирования MDRGN [1, 2]. Из-за сильного воздействия инфекций на популяцию неонатальных пациентов рекомендации по вмешательствам, направленным на снижение риска передачи, более обширны, чем для общей популяции пациентов в некоторых национальных рекомендациях [2–4].Согласно международным стандартам, для продуцирующих карбапенемазу Enterobacteriaceae настоятельно рекомендуется изолировать в одной комнате. Немецкие стандарты идут еще дальше и дополнительно рекомендуют изоляцию пациентов с бета-лактамазами расширенного спектра (ESBL-), продуцирующими Enterobacteriaceae , в отделениях интенсивной терапии новорожденных. Рекомендации Европейского общества клинической микробиологии и инфекционных заболеваний (ESCMID) для общей популяции пациентов стратифицированы по видам.Они рекомендуют размещение в одноместном номере только для номера Klebsiella ssp. несущие гены ESBL, но не для Escherichia coli , содержащей эти гены. Это различие основано на предполагаемом различном потенциале передачи на уровне видов. Однако доказательства являются лишь ограниченными и косвенными.
В Германии даны следующие рекомендации для неонатальных отделений интенсивной терапии (таблица 1).
| |||||||||||||||||||||||||||||||||||
| 9 ⁺Только при лечении с повышенным риском (например,г., процедуры вентиляции). | |||||||||||||||||||||||||||||||||||
3MDRGN определяется как грамотрицательный патоген, устойчивый к трем из следующих четырех различных классов бактерицидных антибиотиков in vitro: пенициллинам широкого спектра действия, цефалоспоринам третьего или четвертого поколения, карбапенемам (меропенем у новорожденных) и фторхинолонам. 4MDRGN — патоген с устойчивостью in vitro ко всем вышеперечисленным антибиотикам. Поскольку фторхинолоны эмпирически не используются у новорожденных, определение 2MDRGN, грамотрицательного патогена, устойчивого к цефалоспоринам и пенициллинам широкого спектра действия, особенно важно для неонатальных отделений интенсивной терапии.
В этом контексте текущие рекомендации Немецкой комиссии по больничной гигиене и профилактике инфекций (KRINKO) Института Роберта Коха (RKI) в Берлине сосредоточены на еженедельном скрининге на MDRGN [2, 3]. Глобальная распространенность колонизации MDRGN значительно различается. Учитывая высокий приток вновь прибывших беженцев в 2015/16 г., в основном из регионов с высокой распространенностью [5, 6], в Медицинском университете Геттингена (UMG) была разработана усовершенствованная стратегия инфекционного контроля.В дополнение к выполненным рекомендациям RKI, недавно прибывшие дети-беженцы были изолированы в одноместных палатах сразу при поступлении и непосредственно проверены на MDRGN. Детям, находящимся в стационаре, ранее находившимся за границей, в комбинированном отделении интенсивной терапии при поступлении был проведен скрининг на MRSA, 2MDRGN, 3MDRGN, 4MDRGN и устойчивые к ванкомицину энтерококки (VRE) с целью снижения или даже предотвращения передачи [7].
2. Материалы и методы
2.1. Эпидемиологическое расследование
Комбинированное неонатально-педиатрическое отделение интенсивной терапии на 20 коек имеет ресурсы для ухода за десятью крайне недоношенными новорожденными и десятью педиатрическими пациентами с сердечными заболеваниями.
Восьмимесячная беженка, недавно прибывшая из Ирана через Турцию и Грецию, была госпитализирована в нашу комбинированную неонатально-педиатрическую реанимацию в ноябре 2015 года. Младенец страдал от тяжелой сердечной аномалии, но ранее обращался в систему здравоохранения. было отказано несколько раз. Пациент был изолирован и обследован на наличие устойчивых бактерий при поступлении в соответствии с внутренними рекомендациями UMG. 3MDRGN Klebsiella pneumoniae и 3MDRGN Escherichia coli были обнаружены исключительно в ректальном мазке без клинических симптомов.Таким образом, младенец оставался в одиночной комнате (с 19 ноября 2015 г. по 09 января 2016 г.). Находясь в тяжелом общем состоянии, колонизация переросла в инфекцию, и младенцу требовалось лечение антибиотиками.
Через четыре недели без каких-либо результатов мы обнаружили колонизацию K. pneumoniae у другого ребенка с идентичным профилем чувствительности к антибиотикам в рамках еженедельного неонатального скрининга, но без E. coli . Младенец жил в соседней палате еще с тремя пациентами (рис. 1).
Следовательно, был реализован ряд дополнительных мер инфекционного контроля в соответствии со стандартными рабочими процедурами компании, а именно: уборка дважды в день не только пораженных помещений, но и всего помещения. Экологический скрининг включал мазки из медицинского оборудования и устройств (ультразвук, рентген, электрокардиография и ламинарный поток воздуха), мазки из окружающей среды в каждой палате пациента (например, дозаторы дезинфицирующих средств, дозаторы мыла, фильтры и аксессуары для медсестер, включая медицинские препараты, такие как мази) и окружение в родительских комнатах, кухне и лаборатории.Были определены всесторонние меры предосторожности при контакте для всех пациентов в отделении, последующая изоляция и группировка четырех колонизированных пациентов, а также все прямые контакты. Были закрыты помещения общего пользования, в том числе комнаты для престарелых и родителей, проведены подробные беседы с родителями и родственниками. Кроме того, в отделении ежедневно проводились междисциплинарные обходы, которые подробно документировались. Были задействованы и члены правления. Все процедуры были сохранены до конца января 2016 года.
2.2. Микробиологические методы
Мазки для скрининга окружающей среды культивировали в Caso-Bouillon (37 ° C / 24 часа) и пересевали на чашки с питательным агаром с последующей дифференциацией и идентификацией по морфологическим и биохимическим характеристикам.
Образцы пациентов для еженедельного скрининга на MDRGN были исследованы на предмет минимальной ингибирующей концентрации (МИК) как часть определения устойчивости с помощью Vitek-MIC.
Были выделены два из пяти изолятов 3MDRGN Klebsiella pneumoniae : пациенты 2 и 3 (паховый мазок 2015-12-15 и ректальный мазок 2015-12-17, рис. 1).Полногеномное секвенирование (WGS) обнаруженных штаммов Klebsiella pneumoniae было выполнено на платформе Illumina MiSeq после выделения ДНК и подготовки библиотеки, как описано ранее. Качественная обрезка, сборка de novo и дальнейшие анализы, включая мультилокусное типирование последовательностей ядра генома, были выполнены с использованием программного обеспечения SeqSphere + (Ridom, Münster, Germany) [8].
3. Результаты и обсуждение
Несмотря на превентивную изоляцию и меры инфекционного контроля, а также в соответствии с передовыми стратегиями инфекционного контроля, передача 3MDRGN Klebsiella pneumoniae произошла через четыре недели.
Все пробы окружающей среды оказались отрицательными на факультативные патогены, за исключением мазков, взятых из ближайшего окружения в комнате для пациентов. На таких устройствах, как стетоскоп, рулетка, несколько кнопок или гель с ксилокаином, можно было обнаружить только Staphylococcus epidermidis и аэробные споры. Многие образцы даже оказались стерильными. Результаты микробиологического исследования медицинских устройств и оборудования в других помещениях (пациенты, родители, кухня и лаборатория) также оказались стерильными или колонизированными патогенами, не имеющими отношения к инфекционному контролю.Частое исследование неодушевленных поверхностей обнаружило Enterococcus faecalis на одном термометре. 3MDRGN Klebsiella pneumoniae или 3MDRGN Escherichia coli не были обнаружены ни в спальне, в которой были колонизированы четыре пациента, ни в соседних комнатах. Точечный источник не может быть идентифицирован путем исследования образцов. Ни у одного из пациентов не развилась инфекция 3MDRGN Klebsiella pneumoniae , за исключением первого пациента.
Микробиологические результаты еженедельного скрининга на MDRGN (ректальные мазки) показали сходство изолятов 3MDRGN Klebsiella pneumoniae (Таблица 2).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
R = стойкий; S = разумный; п.d. = Не сделано. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Все пять образцов пациентов оказались положительными на ESBL (Vitec-MIC). Развитие устойчивости к гентамицину часто возникает быстро из-за того, что ампициллин / гентамицин является антибиотиком первой линии в педиатрической терапии.
Все доступные изоляты 3MDRGN Klebsiella pneumoniae (изоляты 2 и 3, соответствующие пациентам 2 и 3, рис. 1) были типизированы NGS, и они оказались идентичными (рис. 2). Основная цель состояла в том, чтобы определить клональное родство изолятов для целей инфекционного контроля.Поэтому в данном контексте проверяли только наличие генов бета-лактамаз расширенного спектра. Удалось выделить ген, кодирующий бета-лактамазу расширенного спектра CTX-M15.
Ретроспективный анализ выявил чрезвычайную ситуацию, которая произошла в отделении интенсивной терапии и затронула две палаты пациентов всего за несколько дней до обнаружения колонизации 3MDRGN — в обеих палатах был задействован один и тот же медперсонал. Наша гипотеза была единственной передачей в этой ситуации.
Дальнейшими последствиями борьбы со вспышкой были закрытие коек и отсрочка плановой госпитализации в комбинированное неонатально-педиатрическое отделение интенсивной терапии, а также в соседнее стандартное неонатальное отделение.
Расширенные стратегии инфекционного контроля сохранялись до конца января 2016 г. В общей сложности было потеряно 199 койко-дней в неонатально-педиатрическом отделении интенсивной терапии и 122 койко-дня в стандартном неонатальном отделении.
4. Выводы
Несмотря на внедрение усиленных комплексных мер инфекционного контроля, выходящих за рамки официальных требований, передачи MDRGN невозможно полностью избежать в клинических условиях.В этом случае примечательно, что произошла передача 3MDRGN K. pneumoniae , но не 3MDRGN E. coli . Это согласуется с недавними данными о том, что K. pneumoniae более трансмиссивна, чем E. coli [9–11].
Становится очевидным, что профилактические меры гигиены постоянно влияют на повседневный уход в отделении интенсивной терапии. Эти вмешательства включают строгие режимы изоляции для пациентов с колонизацией или инфекцией, а также пациентов, контактировавших с индексными пациентами.Тем не менее, важно помнить об основных мерах инфекционного контроля и соблюдать гигиену рук, меры предосторожности при контакте, а также позаботиться об обучении и обучении персонала [12].
Педиатрические пациенты-беженцы имеют значительно более высокую распространенность колонизации MRSA, а также устойчивыми к цефотаксиму и / или цефтазидиму E. coli и K. pneumoniae , чем педиатрические пациенты, не являющиеся беженцами, как видно из описанного случая и данных проанализированы в нашей университетской больнице [7].Считается, что скрининг бактерий с множественной лекарственной устойчивостью имеет важное значение для целей инфекционного контроля и может дать дополнительную пользу для эмпирического лечения инфекций антибиотиками в этой популяции. Поэтому скрининг педиатрических пациентов-беженцев в нашем учреждении будет продолжен [5, 7, 13, 14].
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов в отношении публикации этой статьи.
Тенденции чувствительности к антибиотикам и заболеваемости поздним началом неонатального сепсиса Klebsiella pneumoniae за шестилетний период в отделении интенсивной терапии новорожденных в Карачи, Пакистан
Введение
Частота, изменение чувствительности к антибиотикам и факторы риска, связанные с Смертность от позднего начала Klebsiella pneumoniae сепсиса в период 2006–2011 гг. в отделении интенсивной терапии новорожденных (ОИТН) развивающейся страны.
Методы
Получены медицинские карты новорожденных с диагнозом сепсис с поздним началом K. pneumoniae . Регистрировались демографические особенности, гестационный возраст, дата и год поступления, чувствительность изолятов к антибиотикам и статус выписки. Сообщается о позднем начале K. pneumoniae случаев на 1000 госпитализаций в ОИТ и факторах риска смертности из-за позднего сепсиса K. pneumoniae .
Результаты
В период 2006–2011 гг. У 104 из 2768 новорожденных развилось позднее начало K.pneumoniae сепсис. Общая заболеваемость сепсисом с поздним началом K. pneumoniae составила 3,7% (37 из 1000 поступлений в ОИТН), при этом самая высокая годовая заболеваемость составила 53/1000 в 2010 г. Большинство случаев были у мужчин ( n = 64; 62%) и большинство из них были преждевременными и имели очень низкий вес при рождении ( n = 68; 65%). Более 80% изолятов были устойчивы к ампициллину + клавулановая кислота, гентамицину, азтреонаму и цефалоспоринам. Наблюдалась тенденция к увеличению устойчивости к амикацину, фторхинолонам, пиперациллину / тазобактаму и имипенему.В 2011 г. три четверти (72%; n = 13) K. pneumoniae с поздним началом были CR K. pneumoniae . Семнадцать (16%) новорожденных умерли. Мужчина ( p = 0,06, скорректированное отношение шансов (AOR) 9,2, 95% доверительный интервал (CI) 1,3–66,9), имеющий чрезвычайно низкий вес при рождении ( p = 0,01, AOR 6,1, 95% CI 0,8– 44,4), с тяжелой тромбоцитопенией ( p = 0,07, AOR 3,9, 95% ДИ 1,2–13,0) и невозможностью достичь микробиологического клиренса ( p <0.001, AOR 19,6, 95% ДИ 4,0–98,0) были значимо связаны со смертностью из-за позднего сепсиса K. pneumoniae .
Заключение
Наблюдается рост числа устойчивых к карбапенемам штаммов с поздним началом K. pneumoniae , что связано с повышенной смертностью и ограниченным выбором антибактериальных препаратов. Похоже, что борьба с противомикробными препаратами и строгие меры инфекционного контроля являются единственным способом ограничить распространение этих штаммов.
Факторы риска и исходы сепсиса Klebsiella pneumonia среди новорожденных в Северной Индии | Qazi
Stoll BJ.Инфекции новорожденного. В: Учебник педиатрии Нельсона, изд. Бермана, Клейгман Р.Э., Р.М., Дженсон Х.Б. Филадельфия: W.B. Сондерс. 17-е изд. 2004: 623-39.
Эдвардс MS. Послеродовые инфекции В: Неонатально-перинатальная медицина Фанаофф и Мартинс. 8-е изд. Филадельфия: Мосби Эльзевьер; 2006: 791-804.
Vergnano S, Sharland M, Kazembe P, Wansambo CM, Heath PT. Неонатальный сепсис, международная перспектива. Arch Dis Child Fetal Neonatal Ed. 2005; 90: F220-F224.
Бакр АФ.Сепсис, связанный с внутривенными линиями, у новорожденных, поступивших в отделение интенсивной терапии в развивающейся стране. J Trop Pedia. 1 октября 2003 г .; 49 (5): 295-7.
Джоши С.Г., Гхол В.С., Нипхадкар КБ. Неонатальная грамотрицательная бактериемия. Индийский J Pediatr. 2000; 67 (1): 27-32.
Köksal N, Hacimustafaolu M, Bağci S. Меропенем при тяжелых инфекциях новорожденных, вызванных мультирезистентными грамотрицательными бактериями. Индийская J педиатрия. 2001, 1 января; 68 (1): 15-9.
Ройлидес Э., Кириакидес Г., Кадилцоглу I, Фармаки Э., Вензон Д., Кацавели А. и др.Септицемия, вызванная полирезистентной Klebsiella pneumoniae в неонатальном отделении: исследование случай-контроль. Am J Perinatol. 2000; 17 (01): 035-40.
Stoll BJ, Hansen N, Fanaroff AA, Wright LL, CarloWA, Ehrenkranz RA, et al. Поздний сепсис у новорожденных с очень низкой массой тела при рождении: опыт NICHD Neonatal Research Network. Педиатрия. 2002; 110: 285-91.
Заиди А.К., Тавер Д., Али С.А., Хан Т.А. Патогены, связанные с сепсисом у новорожденных и детей грудного возраста в развивающихся странах. Педиатр Infect Dis J.2009; 28 (Приложение 1): S10-8.
Верньяно С., Менсон Э., Кеннеа Н., Эмблтон Н., Рассел А.Б., Уоттс Т. и др. Инфекции новорожденных в Англии: Неон в сети эпиднадзора. Arch Dis Child Fetal Neonatal Ed. 2011; 96: F9-14.
Zea-Vera A, Очоа, TJ. Проблемы диагностики и лечения неонатального сепсиса. J Trop Pediatr. 2015; 61: 1-13.
Шон А.С., Баджва Р.П., Руссо Т.А. Гипервирулентная (гипермуковязкозная) Klebsiella pneumoniae: новая и опасная порода. Вирулентность. 2013; 4: 107-18.
Podschun R, Ullmann U. Klebsiella spp. как внутрибольничные возбудители: эпидемиология, систематика, методы типирования, факторы патогенности. Clin Microbiol Rev.1998; 4: 589-603.
Haller S, Eller C, Hermes J, Kaase M, Steglich M, Radonic A и др. Что вызвало вспышку Klebsiella pneumoniae, продуцирующую ESBL, в отделении интенсивной терапии новорожденных, Германия, с 2009 по 2012 год? Восстановление передачи с помощью эпидемиологического анализа и полногеномного секвенирования. BMJ. 2015; 5: e007397.
Хаертынов Х.С., Анохин В.А., Николаева И.В., Семенова Д.Р., Любин С.А., Агапова И.В.Неонатальный сепсис, вызванный клебсиеллой. Мед Новости Северного Кавказа. 2016; 1с1: 82-6.
Гельбанд Х, Миллер-Петри М, Пант С., Гандра С., Левинсон Дж., Бартер Д. и др. Состояние антибиотиков в мире. Вашингтон, округ Колумбия: Центр динамики заболеваний, экономики и политики; 2015.
Лю YC, Cheng DL, Lin CL. Klebsiella pneumoniae абсцесс печени, ассоциированный с септическим эндофтальмитом. Arch Intern Med. 1986; 146: 1913-6.
Cheng DL, Liu YC, Yen MY, Liu CY, Wang RS. Септические метастатические поражения гнойного абсцесса печени.Их связь с бактериемией Klebsiella pneumoniae у пациентов с диабетом. Arch Intern Med. 1991; 151: 1557-9.
Wang JH, Liu YC, Lee SS, Yen MY, Chen YS, Wang JH и др. Первичный абсцесс печени, вызванный Klebsiella pneumoniae на Тайване. Clin Infect Dis. 1998; 26: 1434-8.
Decré D, Verdet C, Emirian A, Le Gourrierec T, Petit JC, Offenstadt G, et al. Возникающие тяжелые и смертельные инфекции, вызванные Klebsiella pneumoniae, в двух университетских больницах Франции. J Clin Microbiol. 2011; 49: 3012-304.
Bialek-Davenet S, Criscuolo A, Ailloud F, Passet V, Jones L, Delannoy-Vieillard AS и др. Геномное определение клональных групп Klebsiella pneumoniae с гипервирулентностью и множественной лекарственной устойчивостью. Emerg Infect Dis. 2014; 20: 1812-20.
Yu WL, Ko WC, Cheng KC, Lee HC, Ke DS, Lee CC и др. Связь между генами rmpA и magA и клиническими синдромами, вызванными Klebsiella pneumoniae на Тайване. Clin Inect Dis. 2006; 42: 1351-8.
Чжан Р., Линь Д., Чан Э. В., Гу Д., Чен Г. X., Чен С.Появление в Китае устойчивых к карбапенемам гипервирулентных штаммов Klebsiella pneumoniae серотипа K1. Антимикробные агенты Chemother. 2015; 60: 709-11.
Surgers L, Boyd A, Girard PM, Arlet G, Decré D. Штамм гипервирулентной Klebsiella pneumoniae K2, продуцирующий ESBL, Франция. Emerg Infect Dis. 2016; 22: 1687-8.
Paczosa MK, Mecsas J. Klebsiella pneumoniae: переход в нападение с сильной защитой. Microbiol Mol Biol Rev.2016; 80: 629-61.
Zhang Y, Zhao C, Wang Q, Wang X, Chen H, Li H и др.Высокая распространенность гипервирулентной инфекции Klebsiella pneumoniae в Китае: географическое распространение, клинические характеристики и устойчивость к противомикробным препаратам. Антимикробные агенты Chemother. 2016; 60: 6115-20.
Валиулла М.С., Ислам М.Н., Сиддика М., Хоссейн М.К., Хоссейн М.А. Факторы риска, клинические проявления и бактериологический профиль неонатального сепсиса в педиатрической больнице третичного уровня. Mymensingh Med J. 2009; 18: S66-S72.
Iregbu KC, Elegba OY, Babaniyi IB. Бактериологический профиль неонатальной септицемии в специализированной больнице в Нигерии.Afr Health Sci. 2006; 6: 151-4.
Shitaye D, Asrat D, Woldeamanuel Y, Worku B. Факторы риска и этиология неонатального сепсиса в университетской больнице Тикур Анбесса, Эфиопия. Эфиоп Мед Дж. 2010; 48: 11-21.
Банерджи М., Саху К., Бхаттачарья С., Адхья С., Бховмик П., Чакраборти П. Вспышка неонатальной сепсиса с множественной лекарственной устойчивостью Klebsiella pneumoniae. Индийский J Pediatr. 1993; 60: 25-7.
Mai JY, Zhu ML, Chen C, HeXL, Lin ZL. Клиническая характеристика неонатального сепсиса Klebsiella pneumoniae и характер чувствительности штаммов к антибиотикам.Чжонкво Донг Дай Эр Ке За Чжин. 2016; 12 (9): 700-3.
Harish BN, Menezes GA, Shekatkar S, Parija SC. Klebsiella pneumoniae, продуцирующая бета-лактамазы расширенного спектра действия, из гемокультуры. J Med Microbiol. 2007; 56: 999-1000.
Чжоу Дж., Ли Дж., Ма Х, Ян К., Йи Дж. Вспышка колонизации производящей карбапенемазу Klebsiella pneumoniae в отделении интенсивной терапии новорожденных: исследования, меры контроля и оценка. Am J Инфекционный контроль. 2015; 43 (10): 1122-4.
Серефханоглу К, Туран Х, Тимуркайнак ИП, Арслан Х.Инфекции кровотока, вызванные продуцирующими ESBL E. coli и K. pneumoniae: факторы риска множественной лекарственной устойчивости. Braz J Infect Dis. 2009; 13: 403-7.
Taneja N, Rao P, Arora J, Dogra A. Возникновение бета-лактамаз ESBL и Amp-C и восприимчивость к новым антимикробным препаратам при осложненных ИМП. Индийский J Med Res. 2008; 127: 85-8.
Cassettari VC, Silveira IR, Balsama AC, Franco F. Вспышка Klebsiella pneumonia, продуцирующая бета-лактамазу расширенного спектра, в неонатальном отделении среднего риска, связанная с онихомикозом у медицинского работника.J Педиатрия. 2006; 82 (4): 316-26.
Департамент здравоохранения штата Вайоминг. Берк К. Раздел 12: Управление антибиотиками — Министерство здравоохранения Вайоминга, 2014 г. Доступно по адресу: https://health.wyo.gov/publichealth/infectious-disease-epidemiology-unit/healthcare-associated-infections/infection-prevention-orientation -manual / antibiotic-stewardship /. По состоянию на 1 июня 2017 г.
Спеллберг Б., Бартлетт Дж. Г., Гилберт Д. Н.. Будущее антибиотиков и резистентности. N Engl J Med. 2013; 368: 299-302.
Хак ИЮ, Чаудхри В.Н., Ахтар М.Н., Андлиба С., Кадри И.Бактериофаги и их значение для биотехнологии будущего: обзор. Вирол Дж. 2012; 9 (1): 9.
Клинический профиль септицемии клебсиелл у новорожденных
Khatua SP, Das AK, Chatterjee BD et al. Неонатальная септицемия. Indian J Pediatr 1986; 53: 509–514.
PubMed
CAS
Google Scholar
Guha DK, Jaspal D, Krishan Das MS et al. Исход неонатального сепсиса, клинико-бактериологический профиль. Indian Pediatr 1978; 15: 423–427.
PubMed
CAS
Google Scholar
Лэнг И.А., Хьюм Р., Тонкин Р.В. и др. Инфекция клебсиелл в отделении интенсивной терапии новорожденных. Scot Med J 1984; 29: 218–221.
PubMed
CAS
Google Scholar
Cichon NJ, Craig CP, Sargen J et al. Нозокомиальные клебсиеллезные инфекции в отделении интенсивной терапии. South Med J 1977; 70: 33–35.
PubMed
CAS
Google Scholar
Пьерог С., Ниграм С., Лала Р.В. и др. Септицемия новорожденных, вызванная klebsiella pneumoniae типа 60. Эпидемия необычно низкой вирулентности. NY State J Med 1977; 77: 737.
CAS
Google Scholar
Джон Дж. Ф. младший, Макки К. Т. младший, Твитти Дж. А. и др. Молекулярная эпидемиология последовательных детских эпидемий, вызванных полирезистентными клебсиеллами пневмонии. J Pediatr 1983; 102: 825–830.
PubMed
Статья
Google Scholar
Бхутта З.А., Накви С.Х., Музаффар Т. и др. Неонатальный сепсис в Пакистане. Acta Paediatr Scand 1991; 80: 596–601.
PubMed
CAS
Google Scholar
Gluck L, Wood HF, Fousek MD, Септицемия у новорожденного. Pediatr Clin North Am 1966; 13: 1131–1147.
PubMed
CAS
Google Scholar
Sharma PP, Halder D, Dutta AK et al. Бактериологический профиль неонатального сепсиса. Indian Pediatr 1987; 24: 1011–1017.
PubMed
CAS
Google Scholar
Монга К., Фернандес А., Деодхар Л. Изменение бактериологии при неонатальной сепсисе. Indian J Pediatr 1986; 53: 505–508.
PubMed
CAS
Google Scholar
Джарвис В. Р., Манн Ван П., Хайсмит А. К. и др. Эпидемиология внутрибольничных инфекций, вызываемых клебсиеллами пневмонии. Inf Control 1985; 6: 68–74.
CAS
Google Scholar
Xanthou M. Картина крови лейкоцитов у здоровых доношенных и недоношенных детей в неонатальном периоде. Arch Dis Child 1970; 45: 242–249.
PubMed
CAS
Google Scholar
Стокс Дж. Клиническая бактериология . 4-е изд. Лондон: Эдвин Арнольд 1975: 216–222.
Google Scholar
Джайкишан, Мир Н.А., Эльзуки А.Ю. Холестатическая желтуха новорожденных с клебсиеллезной септицемией. Indian Pediatr 1984; 21: 865–868
Google Scholar
Саксена С., Ананд Н.К., Миттал СК. Бактериальная инфекция среди новорожденных, родившихся в домашних условиях. Клиническая картина и бактериологический профиль. Indian Pediatr 1980; 17: 17–24.
PubMed
CAS
Google Scholar
Курувилла AC. Неонатальная септицемия. Indian J Pediatr 1988; 55: 225–233.
PubMed
Статья
CAS
Google Scholar
Весикери Т., Янас М., Гронросс П. и др. Неонатальная септицемия. Arch Dis Child 1985; 6: 542–546.
Артикул
Google Scholar
Buetow KC, Klein SW, Lane RB. Септицемия у недоношенных детей. Am J Dis Child 1965; 110: 29–41.
PubMed
CAS
Google Scholar
Свеннингсен Н.В., Бекассы А.Н., Кристенсен П. и др. Нозокомиальная инфекция, вызванная клебсиеллами пневмонии. Лечебно-гигиенические мероприятия в отделении интенсивной терапии новорожденных. Scand J Infect Dis 1984; 16: 29–35.
PubMed
CAS
Статья
Google Scholar
Морган МЭИ, Харт, Калифорния, Кук, RWI. Клебсиеллезные инфекции в отделении интенсивной терапии новорожденных. Роль бактериального надзора. J Hosp Inf 1984; 5: 377–385.
Артикул
CAS
Google Scholar
Трехлетнее исследование в педиатрической больнице Тебриза, Иран
128
младенцев (16), а также Бруун и Паэррегад у 7% из 81
датских новорожденных (27). В нашем исследовании все пациенты с
полимикробной инфекцией крови были недоношенными, у
был какой-то катетер.Увеличение использования внутрисосудистых катетеров
у новорожденных привело к увеличению положительных посевов крови
, особенно на коагулазонегативные стафилококки
, и неопределенность результатов посева
(28). В нашем исследовании факторами риска бактериемии были
катетеризация, переедание и искусственная вентиляция легких
. Большинство младенцев (особенно младенцев с очень низкой массой тела при рождении)
подвергаются одной или нескольким процедурам, которые подвергают их риску заражения
инфекцией.Преобладание младенцев мужского пола очевидно в
почти всех исследованиях сепсиса у новорожденных (29). В нашем исследовании
более высокая восприимчивость младенцев мужского пола еще более очевидна в случаях сепсиса, вызванного грамотрицательными кишечными палочками
, чем в случае сепсиса, вызванного грамположительными кокками (P <0,05).
Ключевым выводом этого исследования является то, что K. pneumoniae является наиболее распространенным грамотрицательным бактериальным агентом сепсиса у новорожденных.
В этом исследовании, хотя коагулазонегативные стафилококки были
наиболее распространенными патогенами, из-за самой высокой смертности
грамотрицательных микроорганизмов (40 из 66 случаев, почти
60%), наши данные предполагают, что эмпирические антибиотики, выбранные для лечения подозрения на сепсис у младенцев
, должны покрывать отрицательные патогены Gram-
, особенно K.пневмония.
ССЫЛКИ
1. Arbo, M.D.J. и Снидман, Д. (1994): Влияние результатов посева крови
на выбор антибиотиков при лечении бактериемии. Arch. Междунар.
Мед., 154, 2641-2645.
2. Biendebach, D.J., Moet, G.J. и Джонс, Р. (2004): Сравнение встречаемости и паттернов устойчивости к противомикробным препаратам
среди изолятов инфекции кровотока
из программы
по надзору за противомикробными препаратами SENTERY (1997–2002).Диаг. Microbiol. Заразить. Дис., 50, 59-69.
3. Moor, D.L. (1996): Нозокомиальные инфекции в отделениях для новорожденных и отделении интенсивной терапии новорожденных
. п. 175-195. В C.G. Мэйхилл (ред.), Госпиталь
Эпидемиология и инфекционный контроль. Maple Press, Балтимор.
4. Royle, J., Halasz, S., Eagles, G., et al. (1999): Вспышка β-лактамазы расширенного спектра
, продуцирующая Klebsiella pneumoniae, в отделении для новорожденных
. Arch. Дис. Ребенок. Фетальный новорожденный.Изд., 80, F64-F68.
5. Kim, Y.K., Pai, H., Lee, H.J., et al. (2002): Инфекции кровотока, вызываемые
Escherichia coli и Klebsiella
pneumoniae, продуцирующими лактамазы расширенного спектра действия, у детей: эпидемиология и клинические исходы. Противомикробный.
Agents Chemother., 46, 1481–1491.
6. Hart, C.A. (1993): клебсиелла и новорожденные. J. Hosp. Инфекция., 23, 83-86.
7. Kuhn, I., Ayling-Smith, B., Tullus, K., et al. (1993): использование скорости колонизации
и эпидемического индекса в качестве инструментов для иллюстрации эпидемиологии фекальных штаммов Enterobacteriaceae
в неонатальных отделениях Швеции.J. Hosp.
Инфекция., 23, 287-297.
8. Podschun, R., Acktun, H., Okpara, J., et al. (1998): Изоляция
Klebsiella planticola от новорожденных в неонатальном отделении. J. Clin.
Microbiol., 36, 2331-2332.
9. Корвик Дж. А., Брайан К. С., Фарбер Б. и др. (1992): проспективное наблюдение —
vational исследование бактериемии Klebsiella у 230 пациентов: результат для
комбинаций антибиотиков по сравнению с монотерапией. Противомикробный. Агенты
Chemother., 36, 2639-2644.
10. Гарнер, Дж. С., Джарвис, В. Р., Эмори, Т. Г., и др. (1988): CDC определения
для нозокомиальных инфекций. Являюсь. J. Infect. Контроль, 16, 128-140.
11.Farmer, J.J. (2002): Enterobacteriacae: введение и идентификация.
стр. 438-449. В P.R. Murray (ed.), Manual of Clinical Microbiology. 6-е
изд. ASM Press, Вашингтон, округ Колумбия,
12. Национальный комитет по клиническим лабораторным стандартам (2000): Стандарт Perfor-
для тестов на чувствительность дисков к антимикробным препаратам.7-е изд.
Утвержденный стандарт M2-A7. Национальный комитет клинических лабораторий —
tory Standards, Wayne, Pa.
13. Klein, J.O. (2001): Бактериальный сепсис и менингит. п. 943-984. В J.S.
Ремингтон и Дж. О. Кляйн (ред.), Инфекции, болезни плода и
новорожденных. 5-е изд. WB Saunders Co., Филадельфия.
14. Karlowicz, M.G., Buescher, E.S. и Surka, A.E. (2000): Fulminant
, сепсис с поздним началом в отделении интенсивной терапии новорожденных, 1988–1997 гг., и влияние
на отказ от эмпирической терапии вакомицином.Педиатрия, 106, 1387-1390.
15. Гладстон И.М., Эренкранц Р.А., Эдберг С.С. и др. (1990): Обзор неонатального сепсиса за десять
лет и сравнение с предыдущим опытом за пятьдесят
лет. Педиатр. Заразить. Дис. J., 9, 819.
16. Весикари, Т., Исолаури, Э. и Туппурайнен, Н. (1989): Неонатальный сепсис —
миа в Финляндии 1981-85. Acta Pediatr. Сканд., 78, 44-50.
17. Winfred, I. (1984): Заболеваемость новорожденными инфекциями в отделении
в учебной больнице Университета Амаду Белло, Зария, Нигерия.
Восток. Afr. Med. J., 61, 197-202.
18. Хэнси, О.Дж., Харт, К.А. и Cooke, R.W. (1985): Серьезная инфекция в отделении интенсивной терапии новорожденных
: двухлетнее исследование. J. Hyg. (Камб), 95,
289-297.
19. Ohlsson, A., Bailey, T. и Takieddine, F. (1986): Изменение этиологии
и исход сепсиса в Рияхе, Саудовская Аравия. Acta Pediatr. Сканд.,
75, 540-544.
20. Saloojee, H., Liddle, B., Gous, H., et al. (1998): Изменение моделей устойчивости к антибиотикам
в неонатальном отделении и их значение для использования антибиотиков
.(Абстрактный). Представлено на Международном педиатрическом конгрессе
Хирургия и педиатрия. Кейптаун, Южная Африка. 1-6 февраля.
21. Лейбовиц Э., Флидель-Римон О., Юстер-Райхер А. и др. (1997): Сепсис
в отделении интенсивной терапии новорожденных: четырехлетнее ретроспективное исследование (1989 —
1992). Isr. J. Med. Sci., 33, 734-738.
22. Мартинес-Агилар, Г., Алпуч-Аранда, К.М., Анайя, К. и др. (2001):
Вспышка внутрибольничного сепсиса и пневмонии в отделении интенсивной терапии новорожденных
, вызванная мультирезистентной бета-лактамазой расширенного спектра действия
Klebsiella pneumoniae: большое влияние на смертность.Заразить. Control Hosp.
Epidemiol., 22, 725-728.
23. Гиоргис Б. (1997): Неонатальный сепсис в Аддис-Абебе, Эфиопия: обзор
151 новорожденного с бактериальной инфекцией. Эфиоп. Med. J., 35, 169-176.
24. Talwar, V., Ramachandran, V.G., Kaul, P.B., et al. (1993): Клинический профиль
септицемии клебсиелл у новорожденных. Indian J. Pediatr., 60, 565-572.
25. Аггарвал Р., Саркар Н., Деорари А.К. и др. (2001): Сепсис у новорожденного
.Индиан Дж. Педиатр., 68, 1143–1147.
26. Тессин И., Троллфорс Б., Тирингер К. и др. (1991): Ампициллин-
комбинации аминогликозидов в качестве начального лечения неонатального сепсиса-
миа или менингита, ретроспективная оценка 12-летнего опыта.
Acta Paediatr. Сканд., 80, 911-916.
27. Bruun, B. и Paerregaard, A. (1991): Септицемия в датском отделении интенсивной терапии новорожденных
, 1984-1988 гг. Педиатр. Заразить. Дис. J., 10, 159-160.
28. Rello, J., Ochagavia, A., Sabanes, E., et al. (2000): Оценка
случаев инфекций, связанных с внутривенным катетером, у пациентов в критическом состоянии.
Am. J. Crit. Care Med., 162, 1027-1030.
29. Кордеро, Л., Рау, Р., Тейлор, Д. и др. (2004): Кишечные грамотрицательные
бациллярных инфекций кровотока: 17-летний опыт работы в отделении интенсивной терапии новорожденных. Являюсь. J. Infect. Контроль, 32, 189–195.
Уроки недавней вспышки устойчивой к карбапенемам Klebsiella pneumoniae в неонатальном отделении — Адри Беккер — REVIVE
ОБРАТИТЕ ВНИМАНИЕ: точки зрения на нашем веб-сайте должны быть прочитаны и доступны всем.Если они переиздаются, следует использовать следующий текст: «Эта точка зрения изначально была опубликована на веб-сайте REVIVE revive.gardp.org, деятельности Глобального партнерства по исследованиям и развитию антибиотиков (GARDP)».
Наша больница — это специализированный специализированный центр в Южной Африке, который принимает до 8000 родов высокого риска в год, из которых 45% новорожденных имеют низкий вес при рождении (<2500 граммов). В неонатальном отделении имеется более 100 коек для ухода за больными новорожденными (четыре отделения и восемь коек интенсивной терапии для новорожденных), и в основном оно заполнено на полную мощность.До декабря 2018 года мы наблюдали только один случай бактериемии, вызванной устойчивостью к карбапенемам Klebsiella pneumoniae , которые принадлежат к семейству бактерий под названием Enterobacteriaceae. Однако в период с 1 декабря 2018 г. по 2 января 2019 г. в нашей больнице у новорожденных были получены четыре положительных посева крови, подтверждающих наличие устойчивой к карбапенемам инфекции Enterobacteriaceae (CRE); трое новорожденных выжили, а один, к сожалению, умер. После этих инфекций CRE мы объявили о вспышке неонатальной инфекции CRE 3 января 2019 г.
CRE — это грамотрицательные бактерии, которые могут вызывать серьезные инфекции. Они часто устойчивы к широко используемым антибиотикам, а также к карбапенемным антибиотикам, таким как меропенем, имипенем и эртапенем, которые часто используются в качестве последнего средства для лечения серьезных инфекций, что приводит к инфекциям, которые трудно вылечить. По этой причине такие инфекции связаны с высокой смертностью.
Улучшенные меры профилактики инфекций и борьбы с ними для сдерживания вспышки
После четырех случаев инфицирования CRE в неонатальном отделении были реализованы различные стратегии сдерживания вспышки.CRE может легко передаваться от пациента к пациенту через руки ухаживающих за ними людей, а также может сохраняться на больничных поверхностях в течение длительных периодов времени. Поскольку у нас было ограниченное количество индивидуальных средств изоляции, доступных для предотвращения распространения Klebsiella или любых штаммов CRE, мы объединяли всех новорожденных, инфицированных CRE (с симптомами инфекции и положительным посевом крови) или колонизированных CRE (положительный результат на CRE при ректальном исследовании). мазок, но не больной) в кабинах в палатах. После того, как новорожденный стал колонизированным CRE, было сделано предположение, что ребенок может подвергнуться риску заражения CRE или потенциально передать CRE другим в течение одного года.По этой причине мы решили не отправлять никого из этих детей в другие учреждения (чтобы не рисковать распространением CRE), а отправлять их только домой из нашей больницы.
Мы также оперативно улучшили наши меры по профилактике и контролю инфекций (ПИИК) в неонатальных отделениях. Универсальные меры предосторожности при контакте (перчатки, фартуки, закрытые инкубаторы и отдельные пакеты для опасных отходов) были введены во всех отделениях новорожденных. Мы инициировали кампанию по очистке, в частности, усовершенствовали наши методы очистки окружающей среды и внедрили стандартизированные методы очистки оборудования, такого как инкубаторы, которые обычно используются в отделениях для новорожденных.Все медицинские работники прошли переподготовку по принципам ПИИК. Посетители были ограничены только родителями.
Строгий контроль над антибиотиками для сохранения эффективности наших последних лекарств
Нам повезло, что в нашей больнице работает хороший комитет по контролю над антибиотиками (специалисты по детским инфекционным заболеваниям и микробиологи), и вместе мы пересмотрели и пересмотрели нашу политику в отношении антибиотиков. Из-за вспышки и того, что многие дети были колонизированы CRE, если ребенок заболел из-за инфекции, нам приходилось вводить эмпирический колистин в сочетании с карбапенемом с целью прекращения приема антибиотиков в течение 48-72 часов, если нет показаний. .Несмотря на то, что старый антибиотик колистин не очень эффективен и может вызывать побочные эффекты со стороны почек, это был один из немногих антибиотиков, оставшихся для лечения инфекций CRE у новорожденных. Строго соблюдались правила обращения с антибиотиками, и эти антибиотики можно было давать пациенту только после получения разрешения от комитета по контролю над антибиотиками.
CRE остается проблемой
Несмотря на все комбинированные стратегии сдерживания вспышки, спорадические случаи CRE все еще имеют место, отчасти из-за нашей неспособности закрыть неонатальное отделение для поступающих направлений.Из-за того, что в провинции имеется немного коек для новорожденных, у нас по-прежнему есть постоянный приток маленьких больных новорожденных. В то же время из-за риска передачи CRE, а также из-за того, что периферийные больницы и клиники не имеют доступа к колистину, перевод новорожденных, колонизированных CRE, из нашей больницы в другие медицинские учреждения остается сложной задачей. Учитывая, что у нас всегда 100% койко-мест, меры инфекционного контроля имеют первостепенное значение для предотвращения вспышек неонатальных заболеваний.Эффективная очистка окружающей среды и стандартные протоколы очистки оборудования повышают риск передачи инфекционных патогенов.
Что нужно для борьбы с инфекциями CRE в будущем?
Опыт нашей больницы подтверждает важность разработки эффективных средств борьбы с инфекциями CRE у новорожденных. Старые антибиотики могут быть повторно использованы против этих устойчивых грамотрицательных бактерий после клинических испытаний фармакокинетических параметров и параметров безопасности для установления эффективной дозировки.Необходимо разработать новые антибиотики для борьбы с этими инфекциями для младенцев, а для обеспечения эффективного лечения от CRE в будущем следует разработать стратегии IPC, чтобы новые антибиотики были защищены от широкого применения и использовались только при необходимости.
.