Заморский вирус — Южные горизонты
Фото: Shutterstock
Вирус Коксаки добрался до Южного Чертанова. Чем он опасен и что делать, чтобы предотвратить заражение, выяснили «ЮГ».
В этом году о вирусе Коксаки не говорит только ленивый. Об опасности заражения на турецких курортах сообщил Роспотребнадзор, а в сетях мамы делятся информацией о случаях на Южном побережье Крыма и Кавказа. В Южном Чертанове диагностирован случай заражения вирусом Коксаки. Еще в Турции, в Анталье, у девятимесячного ребенка появились симптомы заболевания. В Москве малыша привезли в детскую больницу, где врачи визуально диагностировали энтеровирусную инфекцию. Они прописали антигистаминные препараты и отпустили родителей с маленьким пациентом домой.
Врачи поступили правильно. Если заболевание протекает в легкой форме, лечить не надо. Нужно обеспечить больному покой и обильное питье, остальное организм сделает сам.
Вирус группы Коксаки распространен повсеместно. Путь заражения — и контактный, и воздушно-капельный. Размножение вируса происходит в кишечнике. Многие люди являются бессимптомными носителями вируса Коксаки, так что предположить, где ты подцепишь «свою» заразу, невозможно.
Путь заражения — и контактный, и воздушно-капельный. Размножение вируса происходит в кишечнике. Многие люди являются бессимптомными носителями вируса Коксаки, так что предположить, где ты подцепишь «свою» заразу, невозможно.
Как правило, эпидемические вспышки, подобные нынешней, происходят один раз в 5 лет.
Дети переносят болезнь тяжелее, чем взрослые, потому что рвота и понос вызывают обезвоживание. Для взрослых энтеровирусная инфекция опасности не представляет. Однако в редких случаях возникает герпетическая ангина (высыпания в горле похожи на герпес) и вирусный менингит. Как правило, он протекает без осложнений.
Вирус Коксаки требует госпитализации только в исключительных случаях. Болезнь проходит самостоятельно за 3–4 дня и у взрослых, и у детей. Но если ребенок заболел, вызвать педиатра нужно в любом случае. Он оценит ситуацию и скажет, что нужно вашему ребенку.
В случае осложненного течения он предложит госпитализацию, от которой нельзя отказываться.
Post Views:
563
Энтеровирусная инфекция | Областное бюджетное учреждение здравоохранения особого типа «Медицинский информационно-аналитический центр» —
В Ивановской области в период 2015-2016г. отмечена тенденция к росту заболеваемости энтеровирусной инфекцией. В 2016г. зарегистрировано 98 случаев заболевания, что выше уровня 2015 года на 39,3%. Регистрировались как единичная, так и вспышечная заболеваемость в детских дошкольных учреждениях. Это явилось следствием нарушений санитарно-противоэпидемического режима в этих учреждениях.
отмечена тенденция к росту заболеваемости энтеровирусной инфекцией. В 2016г. зарегистрировано 98 случаев заболевания, что выше уровня 2015 года на 39,3%. Регистрировались как единичная, так и вспышечная заболеваемость в детских дошкольных учреждениях. Это явилось следствием нарушений санитарно-противоэпидемического режима в этих учреждениях.
За 7 мес. 2017 года в Ивановской области зарегистрировано 8 случаев энтеровирусной инфекции, в основном у детей до 6 лет. Проведено исследование сточной воды с очистных сооружений в г. Иванове и Кинешме. Из 56 проб только в одной пробе выявлен энтеровирус.
Пути передачи. Вирусы находятся в кишечнике больного ребёнка или вирусоносителя, попадают в окружающую среду с испражнениями. В окружающей среде они живут довольно долго, так как хорошо переносят неблагоприятные воздействия. В организме переболевшего ребёнка они могут сохраняться в течение нескольких месяцев.
Заражение может происходить воздушно-капельным путём (при чихании, кашле, с капельками слюны больного ребёнка или вирусоносителя), так же фекально-оральным путём при несоблюдении правил личной гигиены.
Чаще всего заражение происходит через употребление некипячёной воды, через общие игрушки, если дети берут их в рот.
Заболевание начинается остро, с подъёма температуры, болей в мышцах, увеличения шейных лимфатических узлов; на слизистой полости рта, миндалинах появляются высыпания в виде пузырьков. У ребёнка появляются боли в горле при глотании, боли при жевании. Может быть сыпь на коже туловища, ладонях, стопах.
Энтеровирусы могут поражать центральную нервную систему, с развитием энтеровирусного менингита. При поражении кишечника может наблюдаться жидкий стул. При поражении печени может развиваться острый гепатит. Энтеровирусная инфекция может поражать мышцу сердца с развитием эндокардита.
При появлении первых признаков заболевания необходимо срочно показать ребёнка врачу. Лёгкие формы заболевания не требуют госпитализации в стационар. При поражении центральной нервной системы — развития менингита, энцефалита, необходима госпитализация. Заболевание протекает как правило в течение 5-6 дней и заканчивается выздоровлением. Летальных случаев энтеровирусной инфекции нет.
Летальных случаев энтеровирусной инфекции нет.
Профилактика энтеровирусной инфекции: соблюдение личной гигиены, мытьё рук перед едой, питье только кипячёной воды или воды из заводской бутылки, тщательное мытье игрушек. Во время купания стараться не заглатывать воду!
Вакцины против энтеровирусной инфекции не существует.
Насколько опасен вирус Коксаки для детей
Заражение вирусом Коксаки может протекать с разной степенью тяжести, от легкого недомогания до опасных для жизни ребенка состояний. Безусловно, всегда лучше предупредить заболевание, чем после его лечить.
Источник: [email protected]_ev
Вирусы Коксаки это разновидность энтеровирусов и близкие родственники эховирусов (ECHO). Проявлений может быть множество, но основными признаками, как правило, является резкое ухудшение состояния ребенка, тошнота, рвота, понос и некоторые другие. Эти вирусы считаются «детским», поскольку заболевают преимущественно дети от 3 до 10 лет.
Как происходит заражение вирусом Коксаки
Любые энтеровирусные инфекции считаются болезнями грязных рук, и вирус Коксаки не исключение. Заразиться вирусом Коксаки можно от человека-носителя, причем как заболевшего, так и при отсутствии признаков заболевания. Распространяется вирус орально-фекальным путем – то есть, заносится в рот с грязными руками. Энтеровирусы, в том числе вирус Коксаки, попадая на слизистую рта всасывается в кровь и по кровотоку оказывается в кишечнике, где и происходит размножение вируса и выход с каловыми массами.
Вирус Коксаки может сохранять жизнеспособность во внешней среде достаточно долго, возможно заражение воздушно-капельным путем, через зараженные продукты, которые не прошли термическую обработку и даже воду.
Кто в группе риска заражения вирусом Коксаки
Считается, что дети до 3-месячного возраста защищены от этого энтеровируса, а после 10-12 лет практически все уже имеют за плечами опыт заражения, после которого вырабатывается устойчивый иммунитет. Таким образом, в группу риска заражения вирусом Коксаки попадают дети старше 3 месяцев и до 12 лет, однако пик заболевания выпадает на период от 3 до 10 лет. Считается что невозможно вырастить ребенка и ни разу не столкнуться с эентеровирусной инфекцией.
Таким образом, в группу риска заражения вирусом Коксаки попадают дети старше 3 месяцев и до 12 лет, однако пик заболевания выпадает на период от 3 до 10 лет. Считается что невозможно вырастить ребенка и ни разу не столкнуться с эентеровирусной инфекцией.
Источник: [email protected]
Симптомы и признаки заражения вирусом Коксаки
Инкубационный период от 2 до 10 дней, чаще всего заболевание проявляется на 3-4 день.
- Начинается остро, поднимается температура до 39 градусов и выше, ребенок чувствует слабость и сильное недомогание, может ощущать боль в мышцах и жаловаться на головную боль – все похоже на признаки ОРВИ. Это признаки общей интоксикации, когда вирусы массово проникают в кровоток.
Уже на следующий день проявляются характерные признаки вируса Коксаки:
- На слизистой рта и горла появляются мелкие пузырьки, возможно поражение миндалин
- Может покраснеть кожа, особенно в верхней части тела, и сосуды склеры.
- Очень часто у детей увеличены и болезненны подчелюстные и шейные лимфоузлы.

- Сыпь выступает на ладошках и стопах ребенка, причем она напоминает ветрянку по скорости распространения и виду – небольшие пузырьки, заполненные жидкостью. В отличие от ветрянки, сыпь не зудит и не распространяется по всему телу, хотя может появиться, например, на ягодицах, внутренней стороне предплечья и бедер.
- Синдром рука-нога-рот – сыпь появляется одновременно на слизистой рта, ладонях и ступнях
- Ребенка тошнит и начинается сильный понос, до 5-10 раз в день. Стул водянистый без примесей слизи или крови.
Burda Media
Возможные осложнения
Считается, что заражение вирусом Коксаки и эховирусом не опасно для ребенка и в подавляющем большинстве случаев проходит без последствий при правильном уходе за малышом. Однако, проявления энтеровирусов настолько многообразны, что вероятность осложнений существует всегда. Многое зависит от разновидности вируса Коксаки (группы А и В), концентрации и везения.
Опасность обезвоживания существует всегда, когда у ребенка повышается температура и понос. Чем младше ребенок, тем опаснее для него обезвоживание и выше его вероятность.
Чем младше ребенок, тем опаснее для него обезвоживание и выше его вероятность.
Серрозный менингит. Основной признак ригидность (напряженность) затылочных мышц.
Герпетическая ангина. Единичные папулы на небе и миндалинах превращаются в пузырьки, затем в язвочки, окруженные красным венчиком.
Это далеко не все возможные проявления вируса Коксаки, но в любом случае, диагноз должен ставит врач, а так же назначать соответствующее лечение. К счастью, в подавляющем большинстве случаев болезнь проходит без последствий и без госпитализации.
Антибиотиками вирусные инфекции не лечат! Более того, они могут значительно ухудшить состояние ребенка. Антибактериальные препараты врач может назначить, если к вирусной инфекции присоединилась бактериальная.
Как восстановит ребенка после кишечной инфекции рассказывает доктор Комаровский
Источник: YouTube, автор Доктор Комаровский
Еще больше интересных материалов читайте, подписавшись на журнал О чем врачи вам не говорят ⇒
Мнение редакции может не совпадать с мнением автора статьи.
Использование фото: П.4 ст.21 ЗУ «Об авторских и смежных правах — «Воспроизведение с целью освещения текущих событий средствами фотографии или кинематографии, публичное сообщение или сообщение произведений, увиденных или услышанных во время таких событий, в объеме, оправданном информационной целью.»
как уберечь детей в 2020 году
В этой статье мы разберем следующие вопросы: Что такое вирус Коксаки? Какие симптомы у турецкого вируса? Болеют ли им дети в 2020 году? Можно ли спокойно ехать на отдых и не думать об этой проблеме?
Нам предстоит понять, опасно ли брать ребенка на отдых в Турцию в 2020 году
Третий год подряд беспокоит вопрос о вирусной инфекции, вспыхнувшей в Турции. Особое внимание уделяется детской аудитории. Это не мудрено, ведь дети сильнее подвержены заболеванию Коксаки, чем взрослые. Первые заболевшие привезли инфекцию домой еще в 2016 году. И уже на следующий год родители сильно забеспокоились о здоровье своих малышей. Стали отменять заранее запланированные и оплаченные поездки.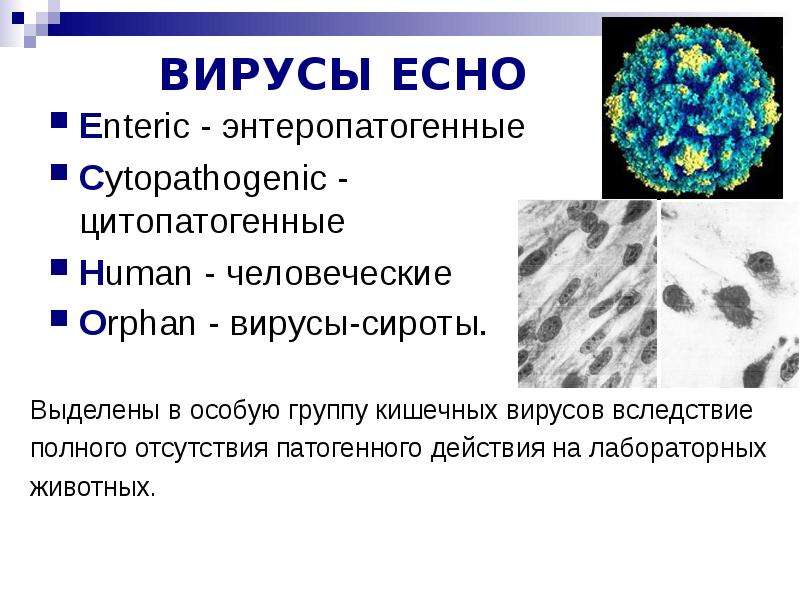
Мысли родителей: незачем идти на такой риск, ставя под угрозу жизни своих крох.
Что кроется под словом Коксаки?
Вот так выглядит тот самый вирус Коксаки под микроскопом
Коксаки ‒ энтеровирусная кишечная инфекция, другими словами ‒ турецкий грипп. Он распространен в Турции, так как в данном государстве преимущественно жаркий и влажный климат. Имеет очень схожие признаки с обычным гриппом.
Как протекает болезнь Коксаки?
- Температура тела поднимается до 39 градусов и сопровождается вялым и сонливым состоянием ребенка
- Очень сильно болит горло. Все процессы связанные с глотанием (особенно прием твердой еды), вызывают сильные болевые ощущения
- Поражение в виде высыпаний на коже и слизистой оболочке
Симптомы могут проявиться как по отдельности, так и все одновременно. После болезни возможны осложнения, о них мы расскажем немного позже.
Теперь, когда мы немного узнали о вирусе Коксаки, самое время посмотреть рекомендации, следуя которым можно избежать заболевания…
Как не заболеть? Рекомендации для родителей
Если придерживаться абсолютно простых гигиенических мер, то этой болячки можно избежать.
Придерживаться стандартных правил гигиены – залог здорового ребенка
Простые правила
- Самое важное, что нужно делать – часто мыть руки с мылом. Именно руками переносится огромное количество инфекции. Особенно после туалета
- Пользоваться антибактериальными средствами (салфетки, спреи)
- Нужно мыть все фрукты и овощи, купленные на рынках или взятые с ресторана
- Брать с собой пить фильтрованную, бутилированную воду.Благо во многих отелях с этим нет никаких проблем, на каждом углу стоят бесплатные бутылки с очищенной водой
- По возможности избегать мест с очень большим скоплением людей. Особенно детских игровых комнат.Лучше привести ребенка немного позже, когда часть людей разойдется
- Если уже так случилось, и в вашем отеле появился больной ребенок, нужно проследить, чтобы не трогать те предметы, к которым он прикасался.То есть заразиться можно и воздушно-капельным путем и контактно-бытовым, через игрушки, например
Что делать, если появилось подозрение на вирус Коксаки?
Если появились подозрения, что ребенок заболел — сразу сообщите на ресепшен. К вам обязательно направят врача.
К вам обязательно направят врача.
Никто не хочет болеть, тем не менее. Предупрежден – значит, вооружен!
Симптомы и последствия инфекции
Первое, что бросается в глаза, ‒ это вялость и усталость в поведении малыша. Главное не перепутать с усталостью, после сумасшедшего дня, когда ребенок пол дня носился по территории отеля, играл с другими ребятами и много купался… В таком ритме усталость это нормально, особенно в начале отдыха.
Симптомы вируса Коксаки
А вот конкретные первые симптомы, которые будут сопровождаться:
- высокой температурой
- высыпаниями на различных участках кожи (руки, ноги, слизистая ротовой полости)
- мелкие язвочки на языке, небе, миндалинах
- малыш станет жаловаться на боль в горле. Глотать даже слюни очень больно
- плохой аппетит
Схожие высыпания во рту как при герпангине (это такой вид ангины). Болезнь может включать что-то одно ‒ высокая температура или боль в горле.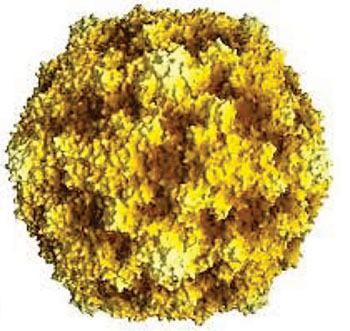 Либо все вместе взятое.
Либо все вместе взятое.
Участки с высыпаниями при Коксаки и Герпангине
Если у ребенка появился один из этих симптомов, сразу обращайтесь за помощью к врачу. Здесь не обойтись без медицинской помощи. Не занимайтесь самолечением! Врач назначит нужные препараты, которые снимут жар и воспаления.
Какие могут быть последствия?
По мнению медиков, патологии чаще протекают в легкой форме. Болезнь проходит быстро, даже незаметно. Без последствий. При тяжелой форме, вирус поражает разные органы и дает осложнения на:
- печень
- поджелудочную железу
- сердце
- работу головного мозга
Как будут лечить и когда наступит выздоровление?
Так как эта инфекция вирусная, то и лечение исключительно симптоматическое (другими словами, что проявилось то и лечим). Очень важно соблюдать правильный прием медикаментов, во избежание всяческих осложнений. Повышенную температуру, при необходимости, сбивают жаропонижающими средствами. Это классические препараты, которыми можно пользоваться без рекомендации врача. В дорожной аптечке мамы всегда есть такие средства:
Это классические препараты, которыми можно пользоваться без рекомендации врача. В дорожной аптечке мамы всегда есть такие средства:
- Ибупрофен
- Нурофен
- Панадол
В отличие от ОРВИ, которое длится пять-семь дней, вирус Коксаки протекает дольше ‒ до десяти дней.
Лучше в любое путешествие брать с собой аптечку
И не забывайте воспользоваться страховым полисом. Медицинских расходов все равно не избежать, а страховка покроет расходы.
Об этом вам лучше расскажет турагент, у которого вы покупаете путевку.
Вирус может проявиться после поездки. По возвращению домой. Инкубационный период составляет от четырех до десяти дней. Самый опасный период в осеннее время, когда воздух сильно обогащен влагой.
По данным Роспотребнадзора, при первых признаках ухудшения самочувствия следует обращаться за медицинской помощью. И на приеме у врача обязательно сообщить о стране пребывания.
Во время лечения нужно придерживаться некоторых правил
- три-четыре раза в день проветривать комнату заболевшего
- придерживаться нормального уровня влажности детской комнаты
- принимать как можно больше жидкости, подойдет обычная вода, компоты
Никаких горячих и даже теплых напитков. Все комнатной температуры.
Все комнатной температуры.
Тут важно – ни в коем случае не допускать обезвоживания. Мы понимаем, что пить воду при заболевании болезненно, но это очень важно!
Списки отелей, попавших под запрет
По словам отдыхающих можно выделить следующую группу риска отелей, в которых вспыхнула инфекция в 2016-2017 годах.
Лучше ездить в проверенные отели. Поспрашивайте знакомых, тур-агента или почитайте отзывы в интернете
| Города | Отели |
| Сиде | Sunrise Resort Nashira Starlight Resort Starlight Resort |
| Кемер | Limak Limra Grand Haber PGS Rose Residence Amaraprestige |
| Белек | Papillon Belvil Adora Resort Calista Luxury |
| Аланья | Kahya Resort Aqua |
Синдром «рука-нога-рот» или что говорит доктор Комаровский
Что говорит доктор Комаровский о вирусе Коксаки:
Все симптомы энтеровирусной инфекции.
Когда высыпание на руках, ногах и во рту. Не стоит паниковать, а больше внимания уделять ребенку. Детский возраст. Часто болеют. Самое главное получать правильный уход и медикаментозную помощь. Как можно больше питья. Чаи комнатной температуры, водичка, фруктовые напитки, даже газировка.
Фрагмент видео с доктором Комаровским о вирусе Коксаки
Актуально ли заболевание в 2020 году
Турция – любимое место для отдыха детей и взрослых. По медицинским данным и новостям СМИ на 2020 год жалоб от туристов не поступало. Обострение вируса на данный момент зафиксировано на Кипре в Лимасолле.
Доктор Мария Агафоклеус, заведующая отделением педиатрии центрального госпиталя Лимассола, сообщила журналистам, что «отмечено несколько случаев заболевания детей вирусом Коксаки». По ее словам, в больнице находятся трое детей с этим заболеванием.
По ее словам, в больнице находятся трое детей с этим заболеванием.
Вирус Коксаки — Выводы
В заключение, хочется подчеркнуть, что вирус Коксаки – это кишечная инфекция и заболеть ей можно на любом побережье.
Любой отдых идет на пользу здоровью. Не болейте!
Кипр, Греция, Испания, Италия в 2017 году так же испытали на себе этот вирус. Поэтому стоит или нет отправляться на турецкие курорты, это самостоятельное решение каждого человека.
Опытных родителей, лечивших своих детей от ОРВИ, энтеровирус не испугает. И заболеть этой инфекцией можно где угодно. Естественно, болеть никто не хочет, тем более на отдыхе. Важно знать и быть готовым для профилактических мер. Главное – следите за своими детьми, не упускайте их из виду ни на одну минуту.
У каждого отдыхающего, побывавшего на заморских берегах, есть своя отдельная история. И очень хотелось, чтобы вы поделились личным опытом, оставили свой отзыв в комментариях. Какие впечатления отдых в Турции оставил у вас? Что вы думаете о вирусе Коксаки? Болел ли ваш ребенок? Как протекала болезнь? Эти и многие другие вопросы крайне важны. Они будут очень полезными для наших читателей.
Они будут очень полезными для наших читателей.
Молекулярно-эпидемиологические особенности циркуляции энтеровируса Коксаки А10 в Дальневосточном федеральном округе | Бутакова
Введение
Актуальность энтеровирусной инфекции (ЭВИ) для населения России обусловлена возникновением на ее территории ежегодных сезонных подъемов заболеваемости с формированием вспышечных очагов. ЭВИ имеет многочисленные клинические проявления и поражает различные возрастные группы. Учитывая, что в большинстве случаев ЭВИ протекает при отсутствии ярко выраженных специфических признаков, имеется высокая вероятность неправильного или/и несвоевременного установления диагноза. В свою очередь это является одной из причин быстрого распространения инфекции и приводит к возникновению очагов заболеваемости.
Энтеровирусы (ЭВ) входят в состав крупного семейства Picornaviridae и представляют собой мелкие безоболочечные вирусы с геномом в виде одноцепочечной положительно заряженной РНК.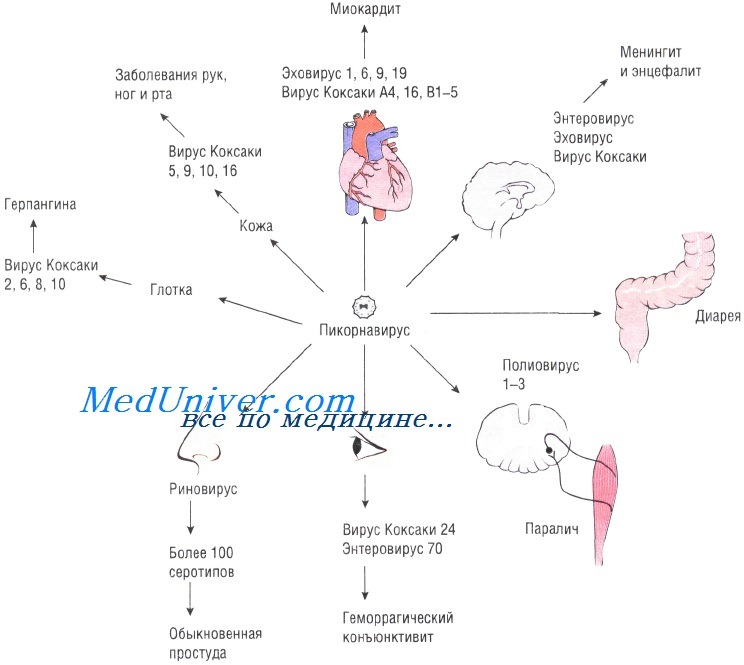 ЭВ, вызывающие заболевания у человека, образуют 4 вида: A, B, C и D [1].
ЭВ, вызывающие заболевания у человека, образуют 4 вида: A, B, C и D [1].
ЭВ Коксаки А10 является одним из наиболее часто выявляемых типов ЭВ и впервые был выделен Г. Далдорфом и сотр. в США в 1950 г. от больных серозным менингитом [2]. Кроме того, Коксаки А10 идентифицируют у пациентов с герпангиной, респираторной формой ЭВИ, экзантемой полости рта и конечностей (HFMD — hand, foot and mouth disease), плевродинией [3]. Несмотря на то что для большинства случаев ЭВИ, обусловленных Коксаки А10, характерно благоприятное течение, в некоторых случаях могут наблюдаться тяжелые неврологические и кардиопульмональные осложнения [4], а также летальные исходы у новорожденных [5].
В последнее десятилетие ЭВ Коксаки А10, наряду с ЭВ Коксаки А6, стал чаще выявляться при вспышках HFMD, которые ранее в основном вызывали ЭВ А71 и Коксаки А16 [6]. Так, имеются публикации об участии Коксаки А10 в возникновении эпидемической заболеваемости HFMD в Финляндии в 2008 г. [7], Испании в 2008 г. [8], Сингапуре в 2008 г. [9], Франции в 2010 г. [10], Китае в 20122013 гг. [11].
[8], Сингапуре в 2008 г. [9], Франции в 2010 г. [10], Китае в 20122013 гг. [11].
Цель настоящей работы — изучить особенности циркуляции ЭВ Коксаки А10 на территории Дальневосточного федерального округа (ДФО) в 2014-2018 гг.
Материалы и методы
Для анализа регистрируемой заболеваемости ЭВИ в ДФО использованы статистические данные государственных форм отчетности № 1 и 2 «Сведения об инфекционной и паразитарной заболеваемости», № 23-09 «Сведения о вспышках инфекционных заболеваний», отчеты Дальневосточного регионального научно-методического центра по изучению энтеровирусных инфекций (ФБУН «Хабаровский НИИ эпидемиологии и микробиологии» Роспотребнадзора).
Биологический материал от лиц с подозрением на ЭВИ, поступавший из субъектов ДФО в 20142018 гг., был исследован молекулярно-генетическими методами. Тип ЭВ в положительных образцах устанавливали с помощью секвенирования фрагментов областей генома VP1 («370 нуклеотидных оснований (н.о.)) и VP2 («368 н.о.) с последующим сравнением полученных нуклеотидных последовательностей с референсными, представленными в GenBank.
В настоящем исследовании дополнительно получены полные нуклеотидные последовательности гена VP1 (длина = 894 н.о.) штаммов ЭВ Коксаки А10, необходимые для проведения более оптимального филогенетического анализа. В качестве референсных из GenBank были взяты 800 нуклеотидных последовательностей, представляющих полный участок VP1 (894 н.о.) и полный геном Коксаки А10 («7400 н.о.). После выравнивания всех референсных последовательностей некачественные сиквенсы были удалены (с наличием гэпов, неопределенных нуклеотидов), остальные подвергнуты анализу с целью выявления сходных друг с другом на 1-3%, т.к. исключение похожих последовательностей может считаться оптимальным подходом при выборе референсных сиквенсов для филогенетического анализа [12].
Реконструкцию эволюционных взаимоотношений со статистической обработкой данных осуществляли с использованием байесовского алгоритма с методами Монте-Карло по схеме цепи Маркова, представленного в программном обеспечении «BEAST v1. 8.4». Для аннотирования применяли «TreeAnnotator v1.8.4», последующую визуализацию дерева с максимальным доверием к кладам проводили в «FigTree 1.4.3».
8.4». Для аннотирования применяли «TreeAnnotator v1.8.4», последующую визуализацию дерева с максимальным доверием к кладам проводили в «FigTree 1.4.3».
Результаты и обсуждение
ДФО является неблагополучной территорией по ЭВИ. Показатели регистрируемой в сезонный период заболеваемости ЭВИ ежегодно значительно превышают общероссийские (рис. 1). За проанализированный нами период времени с 2014 по 2018 г. в ДФО наблюдались 2 пика заболеваемости ЭВИ: в 2016 г. (40,4 на 100 тыс. населения) и 2018 г. (39,9 на 100 тыс. населения).
Рис. 1. Заболеваемость ЭВИ в ДФО в многолетней динамике в сравнении с Россией (на 100 тыс. населения).
Fig. 1. The incidence of enterovirus infections in the Far Eastern Federal District in long-term dynamics in comparison with Russia (per 100 thousand population).
Среди субъектов ДФО наибольшее число случаев ЭВИ с 2006 по 2015 г. регистрировалось в Хабаровском крае (показатель заболеваемости в среднем равнялся 76,4 на 100 тыс. населения). С 2016 г. отмечен рост заболеваемости ЭВИ в Сахалинской области, достигший в 2018 г. максимума за 10 лет официальной регистрации инфекции. При этом Сахалинская область с 2016 по 2018 г. была лидирующим субъектом по заболеваемости ЭВИ и в ДФО, и в целом по России с показателями заболеваемости 103,0; 103,3 и 222,6 на 100 тыс. населения соответственно. Кроме того, в 2017 г. были впервые зафиксированы случаи ЭВИ в Чукотском автономном округе.
населения). С 2016 г. отмечен рост заболеваемости ЭВИ в Сахалинской области, достигший в 2018 г. максимума за 10 лет официальной регистрации инфекции. При этом Сахалинская область с 2016 по 2018 г. была лидирующим субъектом по заболеваемости ЭВИ и в ДФО, и в целом по России с показателями заболеваемости 103,0; 103,3 и 222,6 на 100 тыс. населения соответственно. Кроме того, в 2017 г. были впервые зафиксированы случаи ЭВИ в Чукотском автономном округе.
ЭВИ среди населения ДФО с 2014 по 2018 г. в основном протекала в виде герпангины, серозного менингита и экзантемы. В эпидемический процесс были вовлечены все возрастные группы, но основное количество заболеваний зарегистрировано у детей 3-6 лет. Помимо спорадической заболеваемости ЭВИ в субъектах ДФО в 2014-2018 гг. фиксировались очаги инфекции в детских организованных коллективах, большинство из которых было обусловлено ЭВ Коксаки А6. Среди других неполиомиелитных ЭВ (НПЭВ), ответственных за вспышки ЭВИ в указанный период времени, следует отметить Коксаки А5, А10, В3, В4 и В5, ECHO6, 9 и 30.
С 2014 по 2018 г. в лаборатории Дальневосточного регионального научно-методического центра по изучению ЭВИ с помощью молекулярно-генетических методов исследованы пробы от 2494 человек из 9 субъектов ДФО. Были получены 1360 нуклеотидных последовательностей НПЭВ 39 типов, относившиеся к видам А (ЭВА — 54,1%), В (ЭВВ — 43,3%) и С (ЭВС — 2,6%). Несмотря на общее преобладание ЭВА в течение рассматриваемого в данной работе периода времени, в 2014 и 2016 гг. в ДФО доминировали ЭВВ. Внутри каждого вида наиболее часто выявляемыми типами НПЭВ были: среди ЭВА — Коксаки А6, А10 и А5; ЭВВ — ECHO30, ECHO6 и Коксаки В5; ЭВС — Коксаки А1, А19 и А24. ЭВ Коксаки А6 с 2014 по 2018 г. лидировал по количеству обнаружений во всех субъектах ДФО, кроме Приморского края, где преобладали ECHO-вирусы. Помимо Коксаки А6 наибольшее число идентифицированных в 20142018 гг. нуклеотидных последовательностей ЭВ в ДФО принадлежало к ECHO30 и Коксаки А10.
Всего за 2014-2018 гг. в ДФО методом секвенирования выявлено 120 штаммов ЭВ Коксаки А10, для 117 из которых удалось получить полные нуклеотидные последовательности участка генома VP1 длиной 894 н. о.. Циркуляция Коксаки А10 зафиксирована во всех субъектах ДФО, за исключением Чукотского автономного округа, где из НПЭВ молекулярно-генетическими методами обнаружен лишь Коксаки А6.
о.. Циркуляция Коксаки А10 зафиксирована во всех субъектах ДФО, за исключением Чукотского автономного округа, где из НПЭВ молекулярно-генетическими методами обнаружен лишь Коксаки А6.
С 2014 по 2016 г. Коксаки А10 выявлялся в клиническом материале от лиц с подозрением на ЭВИ в небольшом количестве (процент выявляемости в эти годы от числа других НПЭВ составлял лишь 2,3-3,7%). В 2017 г. отмечена активизация циркуляции Коксаки А10 в ДФО (31,3% среди идентифицированных НПЭВ), который потеснил безусловного лидера предыдущих лет — ЭВ Коксаки А6. В 2017 г. получены 92 штамма Коксаки А10 (преимущественно из Хабаровского края и Сахалинской области), что составило 76,7% от числа всех выделенных Коксаки А10 за 2014-2018 гг. В 2018 г. Коксаки А10 был идентифицирован лишь в 1 (0,5%) случае.
Циркуляция Коксаки А10 в отдельных субъектах ДФО по годам также была неравномерной. Так, в 2014 г. он выявлялся в Республике Саха (Якутия) и Еврейской автономной области, в 2015 г. — в Хабаровском и Камчатском краях, в 2016 г.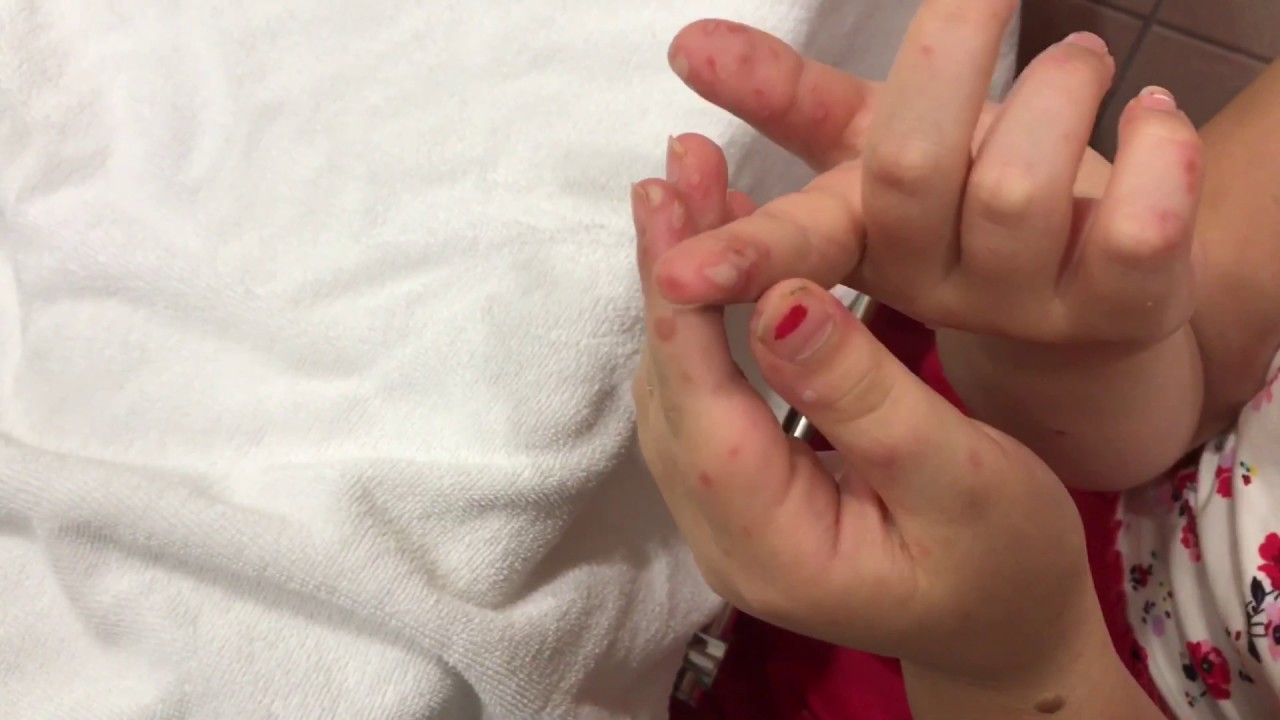 — в Хабаровском и Приморском краях, Амурской области и Республике Саха (Якутия). В 2017 г. Коксаки А10 был изолирован от пациентов с ЭВИ из Хабаровского и Приморского краев, Сахалинской, Еврейской автономной и Магаданской областей, Республики Саха (Якутия). При этом в 2017 г. Коксаки А10 обусловил подъем заболеваемости ЭВИ в Хабаровском крае и Сахалинской области. В 2018 г. удалось получить штамм Коксаки А10 только у 1 заболевшего ЭВИ ребенка из Приморского края.
— в Хабаровском и Приморском краях, Амурской области и Республике Саха (Якутия). В 2017 г. Коксаки А10 был изолирован от пациентов с ЭВИ из Хабаровского и Приморского краев, Сахалинской, Еврейской автономной и Магаданской областей, Республики Саха (Якутия). При этом в 2017 г. Коксаки А10 обусловил подъем заболеваемости ЭВИ в Хабаровском крае и Сахалинской области. В 2018 г. удалось получить штамм Коксаки А10 только у 1 заболевшего ЭВИ ребенка из Приморского края.
Инфекция, вызванная ЭВ Коксаки А10, среди населения ДФО протекала в виде герпангины, респираторных проявлений и серозного менингита. Случаи тяжелого течения, осложнения после перенесенного заболевания не установлены.
С 2014 по 2018 г. в ДФО был зафиксирован лишь 1 очаг групповой заболеваемости, обусловленный Коксаки А10. Он идентифицирован у 4 детей с герпангиной, посещавших детский сад № 17 г. Амурска Хабаровского края в 2016 г.
Завозных случаев ЭВИ на территории ДФО с участием Коксаки А10 не было зарегистрировано, что может быть связано с недостаточным сбором эпидемиологического анамнеза у лиц с ЭВИ.
Филогенетический анализ полученных нами полных нуклеотидных последовательностей участка генома VP1 ЭВ Коксаки А10 показал, что с 2014 по 2018 г. на территории ДФО циркулировали 2 разные генетические линии этого вируса (рис. 2). Поскольку в настоящее время устоявшаяся система генотипов для ЭВ Коксаки А10 отсутствует [12], для удобства представления полученных данных в этой работе мы условно обозначили их как линии А и В. Различие между штаммами, относящимися к разным линиям, составило 18-21% по нуклеотидной последовательности. Причем дивергенция линий А и В произошла около 1950 г. (95% доверительный интервал (ДИ) 1934-1966).
Рис. 2. Филогенетическое дерево с максимальным доверием к кладам для нуклеотидных последовательностей ЭВ Коксаки А10 (полная последовательность VP1 = 894 н.о.).
На дереве отражено время существования предшественников отдельных групп вирусов с использованием ДИ наибольшей апостериорной плотности 95%. KHV — Хабаровский край, YKT — Республика Саха (Якутия), SAH — Сахалинская область, PRIM — Приморский край, MGD — Магаданская область, AMUR — Амурская область, JAR — Еврейская автономная область, IRKT — Иркутская область, KJA — Красноярский край.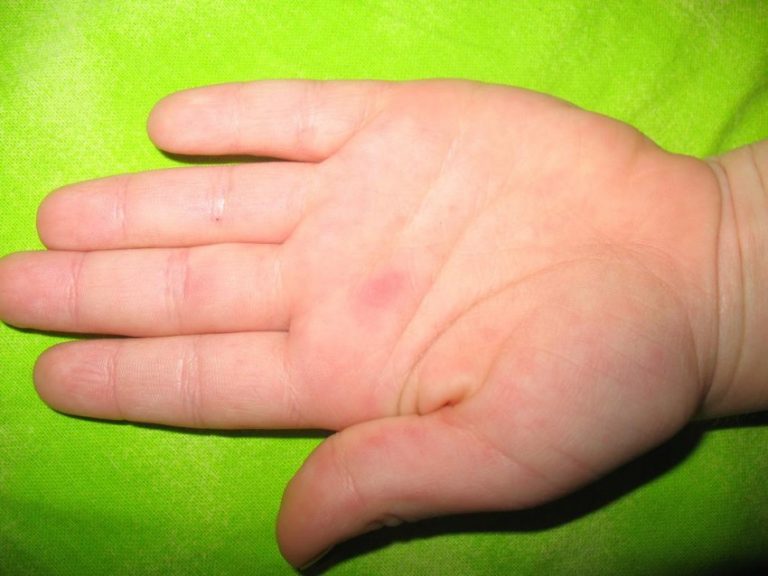 Для обозначения некоторых стран использована система ISO 3166-1 alpha-3.
Для обозначения некоторых стран использована система ISO 3166-1 alpha-3.
Fig. 2. Maximum clade credibility tree for the Coxsackievirus A10 nucleotide sequences (complete sequence of VP1 = 894 b.p.).
The tree shows the age of the ancestors of certain groups of viruses using the confidence interval of the highest posterior density of 95%. KHV — Khabarovsk Territory, YKT — Republic of Sakha (Yakutia), SAH — Sakhalin Region, PRIM — Primorsky Territory, MGD — Magadan Region, AMUR — Amur Region, JAR — Jewish Autonomous Region, IRKT — Irkutsk Region, KJA — Krasnoyarsk Territory. For some countries, the ISO 3166-1 alpha-3 system is used.
В состав генетической линии А вошли штаммы Коксаки А10, выявленные в Республике Саха (Якутия), Еврейской автономной и Сахалинской областях, Хабаровском и Приморском краях. На дендрограмме видно, что штаммы линии А разделились на 2 кластера (условно А1 и А2) с отличием нуклеотидных последовательностей 7-8%. Расхождение между ними возникло приблизительно в 2003 г. (95% ДИ 1999-2006). В состав кластера А1 вошли вирусы, изолированные в Еврейской автономной области и Республике Саха (Якутия) в 2014 г. и в Хабаровском крае в 2016 г. На филогенетическом дереве с ними сгруппировались штаммы Коксаки А10, выделенные во Франции в 2010 г., что позволяет предполагать их европейское происхождение.
(95% ДИ 1999-2006). В состав кластера А1 вошли вирусы, изолированные в Еврейской автономной области и Республике Саха (Якутия) в 2014 г. и в Хабаровском крае в 2016 г. На филогенетическом дереве с ними сгруппировались штаммы Коксаки А10, выделенные во Франции в 2010 г., что позволяет предполагать их европейское происхождение.
Кластер А2 представлен вирусами, идентифицированными в Республике Саха (Якутия) в 2016 г., Сахалинской области в 2017 г. и Приморском крае в 2018 г. Кроме того, штамм Коксаки А10, относящийся к данному кластеру, был выявлен в субъекте Сибирского федерального округа (Красноярском крае) в 2017 г. при расследовании завозного случая ЭВИ из Турции.
Генетическая линия В на дендрограмме отличается более широким разнообразием относящихся к ней штаммов Коксаки А10 и также представлена двумя кластерами — условно В1 и В2. Расхождение между кластерами линии В произошло около 2002 г. (95% ДИ 1999-2005), а различие между нуклеотидными последовательностями составляет также 7-8%. В кластер В1 вошли большинство выделенных нами штаммов Коксаки А10. Это вирусы, циркулировавшие в 2015 г. в Хабаровском крае, в 2016 г. — в Приморском крае, в 2017 г. — в Хабаровском и Приморском краях, Еврейской автономной, Сахалинской и Магаданской областях, в Республике Саха (Якутия). С ними сгруппировались Коксаки А10, изолированные в Китае в 2010-2018 гг., в США в 2016 г., в Австралии в 2016-2017 гг., а также другие российские штаммы 2013, 2016 и 2017 гг. Вероятнее всего, дальневосточные Кокса- ки А10 из кластера В1 были завезены на территорию округа из соседнего государства — Китайской Народной Республики.
В кластер В1 вошли большинство выделенных нами штаммов Коксаки А10. Это вирусы, циркулировавшие в 2015 г. в Хабаровском крае, в 2016 г. — в Приморском крае, в 2017 г. — в Хабаровском и Приморском краях, Еврейской автономной, Сахалинской и Магаданской областях, в Республике Саха (Якутия). С ними сгруппировались Коксаки А10, изолированные в Китае в 2010-2018 гг., в США в 2016 г., в Австралии в 2016-2017 гг., а также другие российские штаммы 2013, 2016 и 2017 гг. Вероятнее всего, дальневосточные Кокса- ки А10 из кластера В1 были завезены на территорию округа из соседнего государства — Китайской Народной Республики.
Следует отметить, что основное количество штаммов Коксаки А10 из кластера В1, выделенных в ДФО в 2017 г., образовали единую группу со штаммом LC412978, который был изолирован во время вспышки HFMD в китайской провинции Юньнань в 2017 г. Их общий предок существовал в 2014 г. (95% ДИ 2013-2015), что свидетельствует в пользу того, что подъем заболеваемости ЭВИ в 2017 г. в ряде субъектов ДФО (в Хабаровском крае и Сахалинской области), связанный с ростом выявля- емости Коксаки А10 в клиническом материале, мог быть обусловлен завозом «нового» эпидемического варианта вируса, который на протяжении ряда лет циркулирует в Китае с формированием вспышечных очагов.
в ряде субъектов ДФО (в Хабаровском крае и Сахалинской области), связанный с ростом выявля- емости Коксаки А10 в клиническом материале, мог быть обусловлен завозом «нового» эпидемического варианта вируса, который на протяжении ряда лет циркулирует в Китае с формированием вспышечных очагов.
В состав кластера В2 вошли штаммы Коксаки А10, изолированные в Республике Саха (Якутия) и Амурской области в 2016 г., которые сгруппировались с вирусами, выделенными во Вьетнаме в 2014 г. и Китае в 2017 г. соответственно. Дальневосточные вирусы Коксаки А10 из кластера В2 имеют общего предшественника с французскими вирусами 2010 г., который существовал приблизительно в 2004 г. (95% ДИ 2001-2007). Рассматривая группу, образованную штаммами 98_AMUR_2016/LC430226_China_2017, можно предположить, что активные миграционные и социально-экономические связи между государствами способствуют не только завозу ЭВ на территорию России, но и их распространению с ее территории в соседние страны, что в целом отражает обширную циркуляцию ЭВ среди населения мира без учета географических границ.
Заключение
Коксаки А10 можно считать одним из наиболее актуальных для Дфо типом НПЭВ, учитывая его непрерывную циркуляцию в округе с 2014 по 2018 г. Проведенный филогенетический анализ позволил выявить генетическое разнообразие этого ЭВ в ДФО, а также одновременное присутствие вирусов из разных линий (А2 и В1) в одном субъекте — Сахалинской области в 2017 г. Вероятнее всего, полученные дальневосточные штаммы Коксаки А10 имели как европейское, так и азиатское происхождение. Появляющиеся «новые» эпидемические варианты способствуют возникновению подъемов заболеваемости. Кроме того, филогенетический анализ показал, что существует возможность распространения Коксаки А10 из России в сопредельные государства.
К сожалению, среди представленных в GenBank нуклеотидных последовательностей Коксаки А10, подходивших по размеру и качеству для филогенетического анализа в данной работе, нет большого географического разнообразия, что не позволило более широко рассмотреть пути циркуляции данного вируса. Тем не менее дальнейший надзор за ЭВИ в целом и за отдельными типами НПЭВ, в том числе Коксаки А10, а также размещение в GenBank полученных нами нуклеотидных последовательностей позволят пополнить международную базу данных и расширить представление об их молекулярной эпидемиологии.
Тем не менее дальнейший надзор за ЭВИ в целом и за отдельными типами НПЭВ, в том числе Коксаки А10, а также размещение в GenBank полученных нами нуклеотидных последовательностей позволят пополнить международную базу данных и расширить представление об их молекулярной эпидемиологии.
1. Pallansch M.A., Roos R. Enteroviruses: Polioviruses, coxsackieviruses, echoviruses, and newer enteroviruses. In: Knipe D.M., Howley P.M., eds. Fields Virology. Philadelphia: Lippincott Williams & Wilkins; 2007: 839-93.
2. EV-A Prototypes. Available at: http://www.picornaviridae.com/enterovirus/prototypes/ev-a_prototypes.htm
3. Tapparel C., Siegrist F., Petty T.J., Kaiser L. Picornavirus and enterovirus diversity with associated human diseases. Infect. Genet. Evol. 2013; 14: 282-93. DOI: http://doi.org/10.1016/j.meegid.2012.10.016
Infect. Genet. Evol. 2013; 14: 282-93. DOI: http://doi.org/10.1016/j.meegid.2012.10.016
4. Chen M., He S., Yan Q., Xu X., Wu W., Ge S., et al. Severe hand, foot and mouth disease associated with Coxsackievirus A10 infections in Xiamen, China in 2015. J. Clin. Virol. 2017; 93: 20‐4. DOI: http://doi.org/10.1016/j.jcv.2017.05.011
5. Fuschino M.E., Lamson D.M., Rush K., Carbone L.S., Taff M.L., Hua Z., et al. Detection of coxsackievirus A10 in multiple tissues of a fatal infant sepsis case. J. Clin. Virol. 2012; 53(3): 259-61. DOI: http://doi.org/10.1016/j.jcv.2011.12.011
6. Lu Q.B., Zhang X.A., Wo Y., Xu H.M., Li X.J., Wang X.J., et al. Circulation of Coxsackievirus A10 and A6 in hand-foot-mouth disease in China, 2009–2011. PLoS One. 2012; 7(12): e52073. DOI: http://doi.org/10.1371/journal.pone.0052073
PLoS One. 2012; 7(12): e52073. DOI: http://doi.org/10.1371/journal.pone.0052073
7. Blomqvist S., Klemola P., Kaijalainen S., Paananen A., Simonen M.L., Vuorinen T., et al. Co-circulation of coxsackieviruses A6 and A10 in hand, foot and mouth disease outbreak in Finland. J. Clin. Virol. 2010; 48(1): 49-54. DOI: http://doi.org/10.1016/j.jcv.2010.02.002
8. Davia J.L., Bel P.H., Ninet V.Z., Bracho M.A., González-Candelas F., Salazar A., et al. Onychomadesis outbreak in Valencia, Spain associated with hand, foot, and mouth disease caused by enteroviruses. Pediatr. Dermatol. 2011; 28(1): 1-5. DOI: http://doi.org/10.1111/j.1525-1470.2010.01161.x
9. Wu Y., Yeo A., Phoon M.C., Tan E.L., Poh C.L., Quak S.H., et al. The largest outbreak of hand; foot and mouth disease in Singapore in 2008: the role of enterovirus 71 and coxsackievirus A strains. Int. J. Infect. Dis. 2010; 14(12): e1076-81. DOI: http://doi.org/10.1016/j.ijid.2010.07.006
Int. J. Infect. Dis. 2010; 14(12): e1076-81. DOI: http://doi.org/10.1016/j.ijid.2010.07.006
10. Mirand A., Henquell C., Archimbaud C., Ughetto S., Antona D., Bailly J.L., et al. Outbreak of hand, foot and mouth disease/herpangina associated with coxsackievirus A6 and A10 infections in 2010, France: a large citywide, prospective observational study. Clin. Microbiol. Infect. 2012; 18(5): E110-8. DOI: http://doi.org/10.1111/j.1469-0691.2012.03789.x
11. Yang Q., Ding J., Cao J., Huang Q., Hong C., Yang B. Epidemiological and etiological characteristics of hand, foot, and mouth disease in Wuhan, China from 2012 to 2013: outbreaks of coxsackieviruses A10. J. Med. Virol. 2015; 87(6): 954-60. DOI: http://doi.org/10.1002/jmv.24151
12. Лукашев А.Н., Голицына Л.Н., Вакуленко Ю.А., Ахмадишина Л.В., Романенкова Н.И., Сапега Е.Ю. и др. Современные возможности и направления развития молекулярно-эпидемиологического мониторинга в надзоре за энтеровирусными инфекциями. Опыт Российской Федерации. Инфекция и иммунитет. 2018; 8(4): 452-64. DOI: http://doi.org/10.15789/2220-7619-2018-4-452-464
Лукашев А.Н., Голицына Л.Н., Вакуленко Ю.А., Ахмадишина Л.В., Романенкова Н.И., Сапега Е.Ю. и др. Современные возможности и направления развития молекулярно-эпидемиологического мониторинга в надзоре за энтеровирусными инфекциями. Опыт Российской Федерации. Инфекция и иммунитет. 2018; 8(4): 452-64. DOI: http://doi.org/10.15789/2220-7619-2018-4-452-464
Энтеровирусные инфекции — причины, симптомы, диагностика и лечение
Энтеровирусные инфекции — это группа инфекционных заболеваний, развивающихся при поражении человека вирусами рода Enterovirus, характеризующаяся многообразием клинических проявлений. Заражение энтеровирусами может произойти пищевым путем, реже — аэрозольным. Характерны высокая температура, недомогание, диарея, полиморфные кожные высыпания. Энтеровирусные инфекции могут протекать в виде герпангины, миалгии, вирусного менингита. К редким формам относятся энтеровирусный панкреатит, нефрит, энцефалит, перикардит и поражение глаз. Диагностика основана на выявлении возбудителя в биологических средах. Лечение в основном симптоматическое.
Диагностика основана на выявлении возбудителя в биологических средах. Лечение в основном симптоматическое.
Общие сведения
Термином «энтеровирусные инфекции» обозначают различные заболевания, вызываемые энтеровирусами Коксаки и ECHO и протекающие с поражение слизистых оболочек, кожи, мышц, нервной системы. Восприимчивость всеобщая, однако массовые вспышки обычно регистрируются в детских коллективах. Большинство детей переносит хотя бы один эпизод энтеровирусной инфекции в возрасте до 5 лет. В разных регионах процентное соотношение здоровых носителей колеблется в пределах 17-46%.
Энтеровирусные инфекции
Причины
Энтеровирусы — РНК-содержащие вирусы, многие из них патогенны для человека: 23 типа вируса Коксаки А, 6 типов – Коксаки В. В эту же группу входит вирус ЕСНО и с 68-го по 71-й типы энтеровирусов. Все возбудители энтеровирусных инфекций отличаются мелкими размерами (от 15 до 35 НМ), устойчивостью к замораживанию и некоторым химическим дезинфицирующим средствам: эфиру, 70%-му спирту, лизолу. В фекалиях могут сохранять жизнеспособность более полугода.
В фекалиях могут сохранять жизнеспособность более полугода.
Инактивация энтеровирусов происходит при нагревании до 50°С, при высушивании, действии ультрафиолета, дезинфекции раствором формальдегида (0,3%), хлорсодержащими средствами. Резервуаром и источником энтеровирусных инфекций является больной человек или носитель. Заразность отмечается на протяжении недель и месяцев, пик выделения возбудителя приходится на первые дни клинических проявлений. Энтеровирусы передаются с помощью фекально-орального механизма пищевым путем.
Чаще всего заражение происходит при употреблении в пищу загрязненных вирусами овощей. Вирусы попадают на овощи и фрукты при удобрении необеззараженными сточными водами. Некоторые энтеровирусы выделяются с секретом слизистых оболочек дыхательных путей, что может способствовать реализации аэрозольного механизма передачи. Отмечаются случаи заражения контактно-бытовым путем (загрязненные руки, предметы быта, личной гигиены). В случае заражения энтеровирусной инфекцией беременной женщины возможна вертикальная передача возбудителя ребенку. Естественная восприимчивость человека к энтеровирусам высокая, иммунитет обычно типоспецифический, в редких случаях может отмечаться перекрестный.
В случае заражения энтеровирусной инфекцией беременной женщины возможна вертикальная передача возбудителя ребенку. Естественная восприимчивость человека к энтеровирусам высокая, иммунитет обычно типоспецифический, в редких случаях может отмечаться перекрестный.
Классификация
В связи с полиморфизмом клинической симптоматики единая классификация энтеровирусов отсутствует. В нашей стране применяют классифицирование по формам заболевания: типичным и атипичным. К типичным формам течения энтеровирусной инфекции относят герпангину, эпидемическую миалгию, экзантему, асептический серозный менингит.
Кроме того, заболевание может протекать в катаральной, энцефалической, спинальной (полиомиелитоподобной) форме. К атипичным формам также относится энтеровирусный увеит, нефрит, панкреатит, энцефаломиокардит новорожденных, инаппарантную и малую формы, микст-инфекции.
Симптомы энтеровирусных инфекций
Инкубационный период энтеровирусных инфекций может продолжаться 2-7 дней. Клиника заболевания настолько разнообразна, что можно предположить присутствие нескольких различных патологий. Самые распространенные признаки: интоксикация, повышение температуры, катаральная и абдоминальная симптоматика, полиморфная экзантема.
Клиника заболевания настолько разнообразна, что можно предположить присутствие нескольких различных патологий. Самые распространенные признаки: интоксикация, повышение температуры, катаральная и абдоминальная симптоматика, полиморфная экзантема.
При остром начале лихорадка может быстро нарастать и достигать 39-40 градусов, после чего сохраняться на протяжении нескольких дней, сопровождается симптомами общей интоксикации (слабость, головная боль, миалгии, возможна рвота и тошнота центрального генеза). Может отмечаться энтеритная диарея. Лихорадка может протекать волнообразно, в особенности при рецидивирующем течении инфекции. При внешнем осмотре отмечают гиперемию лица, инъекции склер, на слизистой ротоглотки отмечают умеренное покраснение, на задней стенке глотки – зернистость. Могут отмечаться разнообразные высыпания.
Энтеровирусная ангина
Для энтеровирусной герпангины характерна гиперемированность миндалин и небных дужек, возникающая на фоне общей лихорадочной реакции. Вскоре на пораженной слизистой зева образуются герпетоподобные пузырьки, которые лопаются и образуют участки эрозий, покрытые сероватым налетом и имеющие гиперемированный ободок по краю. Пузырьки и эрозии склонны к распространению и слиянию. В течение последующих дней элементы энантемы постепенно заживают. Герпангина нередко сочетается с серозным менингитом.
Вскоре на пораженной слизистой зева образуются герпетоподобные пузырьки, которые лопаются и образуют участки эрозий, покрытые сероватым налетом и имеющие гиперемированный ободок по краю. Пузырьки и эрозии склонны к распространению и слиянию. В течение последующих дней элементы энантемы постепенно заживают. Герпангина нередко сочетается с серозным менингитом.
Эпидемическая миалгия
Эпидемическая миалгия, которую так же называют плевродинией, болезнью Сюльвеста-Финсена и борнхольской болезнью, проявляется, помимо общих признаков инфекции, приступами мышечных болей (являющихся симптомом миозита). Болезненность отмечается в мышцах груди, живота и конечностей. Болевой симптом при энтеровирусном поражении довольно разнообразен по течению. При развитии миозита грудной мускулатуры возможны затруднения дыхания, боль в мышцах брюшной стенки иногда имитирует клинику «острого живота». Как правило, боли длятся около 2-3 дней, после чего стихают. Могут отмечаться случаи рецидива миалгий.
Энтеровирусный менингит
Вирусный менингит представляет собой наиболее распространенную и тяжелую форму энтеровирусной инфекции. Как и всякое воспаление мозговой оболочки, характеризуется положительными менингеальными симптомами: ригидность затылочных мышц, симптомы Брудзинского и Кернига. Пациенты обычно апатичны, вялы, может отмечаться повышенная чувствительность к свету, звукам. Иногда отмечают судороги, психоэмоциональное возбуждение, сознание, как правило, сохранено. Менингеальная симптоматика и повышенная температура тела сохраняется обычно не более 4-7 дней.
Энтеровирусная экзантема
Может как проявляться самостоятельным преимущественным симптомокомплексом, так и сопровождать другие формы энтеровирусных инфекций (серозный менингит, герпангину). Сыпь появляется на 2-3 день лихорадки и интоксикации, локализуется преимущественно на лице, туловище, конечностях, стопах. Сыпь полиморфна, может напоминать экзантему при кори, скарлатине или краснухе, быть розеолезной, пятнисто-папулезной, петехиальной.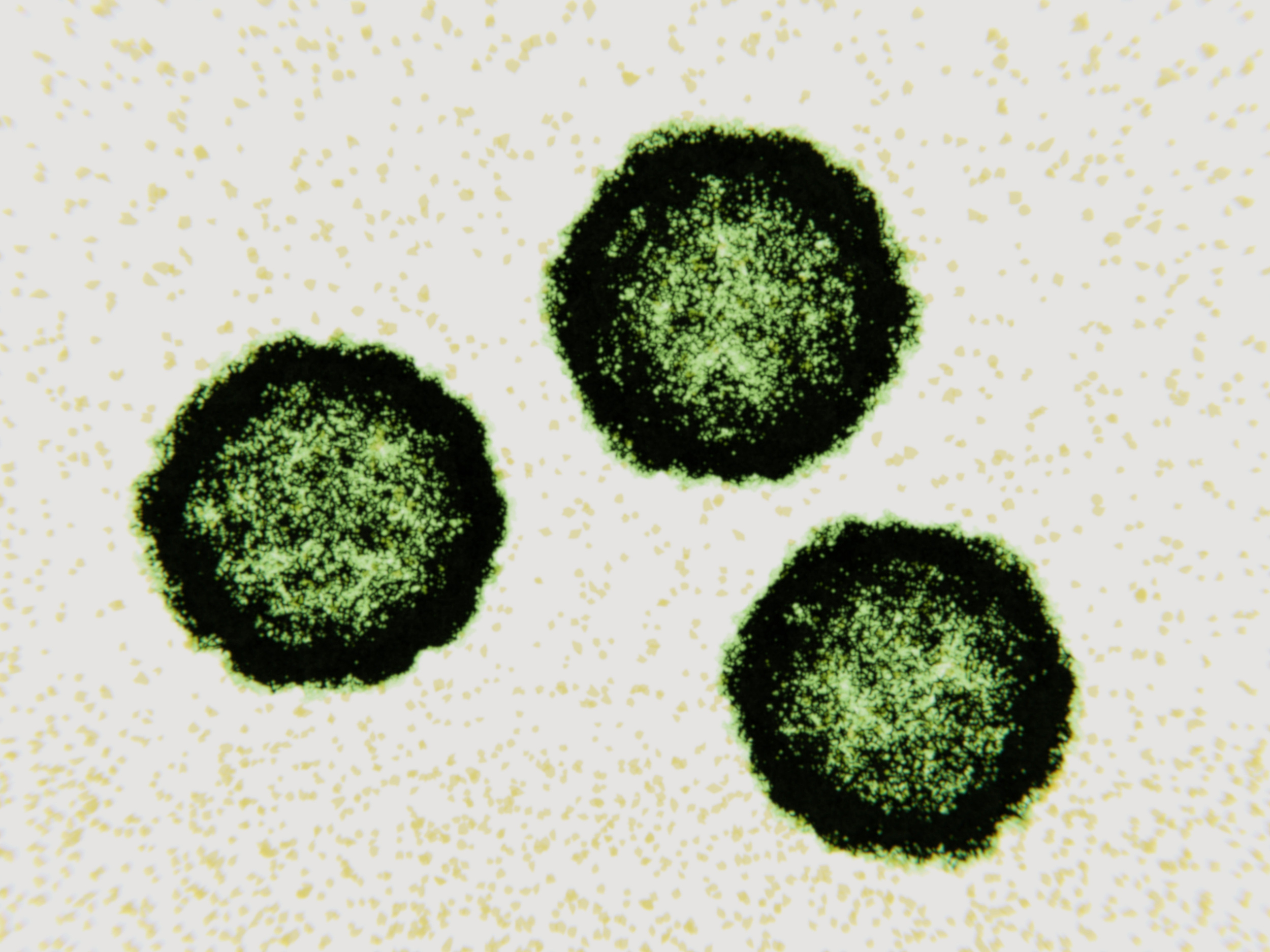 Часто экзантема сопровождается энантемой в ротовой полости. Могут отмечаться симптомы конъюнктивита, менингизм.
Часто экзантема сопровождается энантемой в ротовой полости. Могут отмечаться симптомы конъюнктивита, менингизм.
Энтеровирусная лихорадка
Энтеровирусная инфекция может протекать без каких-либо местных проявлений, единственным симптомом при этом является лихорадка и общая интоксикация. Такую форму еще называют малой болезнью, либо летним гриппом. По типу гриппозного поражения также протекает катаральная (респираторная) форма энтеровирусной инфекции. Лихорадка сопровождается сухим кашлем, саднением в горле и умеренной гиперемией зева, ринитом с серозно-слизистым отделяемым.
Энцефаломиокардит новорожденных
Наиболее тяжело протекает энцефаломиокардит новорожденных. Лихорадка может как присутствовать (обычно имеет двухволновый характер), так и отсутствовать. Отмечается общая выраженная слабость, вялость, сонливость, анорексия, рвота. Кожные покровы цианотичны, одышка, тахикардия. При перкуссии сердца отмечается расширение его границ, при аускультации слышны глухие аритмичные тоны, систолический шум. Печень увеличена, отмечаются отеки. При энцефаломиокардите высока вероятность развития судорожного синдрома, комы. Довольно сложно поддается дифференциальной диагностике с паралитической формой полиомиелита энтеровирусный миелит. Основное отличие – более легкое и кратковременное течение, нередко последующее восстановление двигательной функции.
Печень увеличена, отмечаются отеки. При энцефаломиокардите высока вероятность развития судорожного синдрома, комы. Довольно сложно поддается дифференциальной диагностике с паралитической формой полиомиелита энтеровирусный миелит. Основное отличие – более легкое и кратковременное течение, нередко последующее восстановление двигательной функции.
Энтеровирусная диарея
Вирусный гастроэнтерит характеризуется многократной энтеритной диареей на фоне субфебрилитета, реже – лихорадки. Отмечается боль в животе (преимущественно в правой подвздошной области) со вздутием, может отмечаться рвота. Нередко энтеритная симптоматика сочетается с катаральными явлениями. Может обнаруживаться гепатолиенальный синдром. Заболевание обычно продолжается от нескольких дней до двух недель.
Вирусный конъюнктивит
Для энтеровирусного геморрагического конъюнктивита характерное острое, внезапное начало, отмечается боль в глазах, слезоточивость, светобоязнь. При осмотре конъюнктива гиперемирована, отмечаются многочисленные кровоизлияния, серозные или серозно-гнойные обильные выделения, веки выражено отечны. Первоначально поражается один глаз, позднее заболевание распространяется на второй.
При осмотре конъюнктива гиперемирована, отмечаются многочисленные кровоизлияния, серозные или серозно-гнойные обильные выделения, веки выражено отечны. Первоначально поражается один глаз, позднее заболевание распространяется на второй.
Помимо вышеназванных форм, энтеровирусная инфекция может проявляться в виде энцефалита, безжелтушного гепатита, лимфаденитов различных групп лимфоузлов, поражать сердечную сумку (перикардит), брыжейку кишечника, провоцировать развитие других заболеваний.
Осложнения
Диагностика
Выделение возбудителя из крови, секрета слизистой носоглотки, ликвора или испражнений и вирусологическое исследование возможно, но в широкой клинической практике применяется редко ввиду сложности, длительности и малой диагностической ценности, поскольку выявление и идентификация энтеровируса не всегда является доказательством того, что именно этот возбудитель является этиологической причиной заболевания (в связи с высокой частотой бессимптомного носительства энтеровирусов среди населения).
Основной методикой специфической диагностики энтеровирусов является выявление 4-кратного и большего нарастания титра антител к возбудителю в парных сыворотках. Антитела выявляют с помощью РСК и РТГА.
Лечение энтеровирусных инфекций
Этиотропное лечение для энтеровирусных инфекций не разработано, терапия включает применение дезинтоксикационной терапии и симптоматических средств по показаниям. Тяжелая форма инфекции с поражением нервной системы является показанием к назначению кортикостероидных препаратов и мочегонных средств для коррекции водно-электролитного и кислотно-щелочного баланса. При развитии угрожающих жизни состояний может потребоваться интенсивная терапия и реанимационные меры.
Для стабилизации сосудистого тонуса и улучшения реологических характеристик крови назначают винпоцетин, пентоксифиллин активно применяют витаминотерапию. В зависимости от симптоматики назначают анальгетики, седативные препараты. Развитие вторичной бактериальной инфекции является показанием к назначению курса антибиотикотерапии в соответствии с чувствительностью бактерий к препаратам.
Развитие вторичной бактериальной инфекции является показанием к назначению курса антибиотикотерапии в соответствии с чувствительностью бактерий к препаратам.
Прогноз и профилактика
Энтеровирусные инфекции преимущественно протекают легко, либо в среднетяжелой форме, выздоровление наступает в сроки от нескольких дней, до 2-3 недель. Прогноз ухудшается в случае тяжелого течения, развития осложнений. Некоторые осложнения энтеровирусной инфекции (в основном со стороны нервной системы) могут закончиться летальным исходом, либо оставить после себя неустранимые функциональные нарушения.
Общая профилактика энтеровирусных инфекций включает мероприятия по контролю над загрязненностью объектов окружающей среды канализационными отходами, соблюдением санитарно-гигиенических требований при обезвреживании сточных вод, предоставлением населению пищевых продуктов должной степени эпидемической безопасности.
Индивидуальная профилактика заключается в строгом следовании правилам личной гигиены, необходимой обработке пищевых продуктов. Специфических мер профилактики энтеровирусных инфекций не разработано. Детям до 3 лет, имевшим контакт с больным, назначается интерферон и иммуноглобулин интраназально на 7 дней. В очаге инфекции производится комплекс дезинфицирующих мероприятий.
Специфических мер профилактики энтеровирусных инфекций не разработано. Детям до 3 лет, имевшим контакт с больным, назначается интерферон и иммуноглобулин интраназально на 7 дней. В очаге инфекции производится комплекс дезинфицирующих мероприятий.
Вирусная диарея
Причины вирусных диарей. О том, что вирусы могут вызывать диарею, стали говорить еще в тридцатые годы прошлого века на основании описаний вспышек диарей среди детей, было высказано предположение о том, что поносы вызывают именно вирусы, и данные диареи стали называть «кишечным гриппом», «эпидемическим поносом», вирусной дизентерией или зимним поносом. На сегодня накоплено достаточно данных о том, что вирусы могут провоцировать поносы и расстройства пищеварения у детей и у взрослых. Как причина развития вирусного поноса сегодня рассматривается энтеровирусная, ротавирусная и реовирусная этиологии болезни. Вирусные диареи широко распространены во всем мире, ими ежегодно переболевают до миллионов детей и взрослых, они могут возникать как единичные случаи, так и эпидемические вспышки, в основном среди детей раннего возраста или среди закрытых организованных коллективов. Особенности вирусов Одной из самых характерных особенностей вирусов, которые способны вызвать поражения пищеварения и диарею, является их относительная устойчивость во внешней среде, а также хорошая способность к сохранению при низкой температуре воды и воздуха. Они выживают при 20˚С воды более 2 недель, а при 10˚С – до нескольких месяцев. Многим вирусам безразлична кислая среда желудка, они спокойно проходят ее, не разрушаясь., сохраняются вирусы в открытых водоемах и водохранилищах, морях и реках, а оттуда могут попадать в источники питьевого водоснабжения. Также вирусы выделяются из организма пораженных с фекалиями, где сохраняются длительное время, и могут загрязнять окружающую среду и воду водоемов. Как можно заразиться? — источниками инфекции при любой вирусной диарее могут стать люди, которые болеют, или выздоравливающие, выделяющие вирусы в окружающую среду, либо носители вируса, сами не болеющие, но вирусы выделяющие. При некоторых из вирусных диарей актуальным путем заражения может стать перенос инфекции от домашних животных и крупного рогатого скота, такие вирусы в зависимости от способа попадания в организм могут давать разные симптомы – при воздушно-капельном инфицировании — клинику простудной инфекции с поражением органов дыхания, а при попадании в пищеварение фекально-оральным путем – поражение системы пищеварения.
Особенности вирусов Одной из самых характерных особенностей вирусов, которые способны вызвать поражения пищеварения и диарею, является их относительная устойчивость во внешней среде, а также хорошая способность к сохранению при низкой температуре воды и воздуха. Они выживают при 20˚С воды более 2 недель, а при 10˚С – до нескольких месяцев. Многим вирусам безразлична кислая среда желудка, они спокойно проходят ее, не разрушаясь., сохраняются вирусы в открытых водоемах и водохранилищах, морях и реках, а оттуда могут попадать в источники питьевого водоснабжения. Также вирусы выделяются из организма пораженных с фекалиями, где сохраняются длительное время, и могут загрязнять окружающую среду и воду водоемов. Как можно заразиться? — источниками инфекции при любой вирусной диарее могут стать люди, которые болеют, или выздоравливающие, выделяющие вирусы в окружающую среду, либо носители вируса, сами не болеющие, но вирусы выделяющие. При некоторых из вирусных диарей актуальным путем заражения может стать перенос инфекции от домашних животных и крупного рогатого скота, такие вирусы в зависимости от способа попадания в организм могут давать разные симптомы – при воздушно-капельном инфицировании — клинику простудной инфекции с поражением органов дыхания, а при попадании в пищеварение фекально-оральным путем – поражение системы пищеварения. Источником вирусов при вирусных диареях могут стать продукты питания и вода, обсемененные вирусами, вещи и игрушки детей, которые они тянут в рот, ротавирусы можно выделить из водопроводной воды, которую не кипятили и пили дети.
Источником вирусов при вирусных диареях могут стать продукты питания и вода, обсемененные вирусами, вещи и игрушки детей, которые они тянут в рот, ротавирусы можно выделить из водопроводной воды, которую не кипятили и пили дети.
Входными воротами для диарейных вирусных инфекций является ротовая полость и желудочно-кишечный тракт.
Механизм развития вирусных диарей — вирусы попадают в эпителий в области верхних дыхательных путей, и заглатываются со слюной, проникая в желудок и кишечник. Там происходит поражение клеток эпителия желудка, кишки, и вирусы начинают размножаться на эпителии энтероцитов, клеток кишки, они проникают в кровь, вызывая проявления общего токсикоза и лихорадку, могут поражать отдельные органы и системы – нервную, легочную, печень. Идеальными условиями для размножения кишечных вирусов являются двенадцатиперстная и тонкая кишка, происходит формирование обильных и частых диарей. Нарушается всасывание воды клетками, происходит реакция брожения из-за проблем с расщеплением пищи, это и дает в комплексе симптомы диареи ( диареи обильные, водянистые, без примесей крови и зелени).
Проявления вирусных диарей зависят от того, каким вирусом и в каком возрасте вызвана диарея. При энтеровирусных диареях поражаются дети до 2 лет, может быть как только диарея, так и сочетание ее с поражением мышц, менингитом, ангиной или миокардитом. Изолированные формы энтеровируса дают легкую не длительную диарею, проходят самостоятельно. Опасны только энтеровирусы с диарейным синдромом у новорожденных и ослабленных детей. При диареях, вызванных вирусом Коксаки, может быть различная клиническая картина, зависит от возраста ребенка (легкие диареи у детей от 2 до 5 лет практически без температуры и токсикоза, с приступообразными болями животе и жидким стулом до 3-10 раз в сутки без примесей). Через 1-2 дня состояние нормализуется.
Иногда болезнь протекает с повышением температуры, простудными явлениями, с болями в животе, жидким стулом и повторной рвотой, состояние с лихорадкой длится до 3 суток, а понос первые 2-3 суток. Тяжело вирусы Коксаки протекают в первые 2 года жизни, лечение только в условиях стационара. Вирусные повреждения ЕСНО-этиологии возникают в любом возрасте, протекают не тяжело, обычно проявляясь в форме гастрита и энтерита, при этом дисфункции кишечника бывают незначительными и не длительными (тошнота, рвота , учащение стула в пределах 1-2 дней, нарушение аппетита, невысокая температура, стул разжиженный, без примесей, 5-6 раз в сутки) . В грудном возрасте или у детей в период новорожденности вирусные заболевания могут протекать тяжело, но обычно они начинаются как простудные заболевания, а кишечная симптоматика возникает позднее (повторное срыгивание, рвота, вздутие живота, разжижение стула). За счет потерь жидкости развивается токсикоз с эксикозом, обезвоживанием, нарастает тяжесть состояния.
Вирусные повреждения ЕСНО-этиологии возникают в любом возрасте, протекают не тяжело, обычно проявляясь в форме гастрита и энтерита, при этом дисфункции кишечника бывают незначительными и не длительными (тошнота, рвота , учащение стула в пределах 1-2 дней, нарушение аппетита, невысокая температура, стул разжиженный, без примесей, 5-6 раз в сутки) . В грудном возрасте или у детей в период новорожденности вирусные заболевания могут протекать тяжело, но обычно они начинаются как простудные заболевания, а кишечная симптоматика возникает позднее (повторное срыгивание, рвота, вздутие живота, разжижение стула). За счет потерь жидкости развивается токсикоз с эксикозом, обезвоживанием, нарастает тяжесть состояния.
Респираторные инфекции с кишечными синдромом
Расстройства кишечника могут быть одним из симптомов острых респираторных вирусных инфекций, изначально начинающимся как простуда. Расстройства кишечника при них возникают как результат токсического воздействия на кишку, нарушения ферментов, присоединение микробной флоры на фоне ослабления иммунитета, формирование дисбактериоза. В таких случаях как таковой вирусной диареи быть уже не может, но говорят тога об ОРВИ с кишечными проявлениями.
В таких случаях как таковой вирусной диареи быть уже не может, но говорят тога об ОРВИ с кишечными проявлениями.
Особенность вирусных диарей — расстройства работы кишечника, при которых в процесс поражения вовлекается тонкий кишечник, течение протекает по типу гастроэнтерита или энтерита (с рвотой или без нее). При вирусных диареях в крови детей — лимфоцитоз и лейкопения, нет выраженного воспаления стенок кишки (толстой), возникает диарея без примесей (слизь, кровь, зелень, в копрограмме нет лейкоцитов и эритроцитов). Стул с частицами непереваренной пищи, жирный из-за проблем с поджелудочной железой, обильный. Вирусные диареи протекают не длительно, не дают тяжелого течения и нарушения микробного равновесия. Ротавирусные диареи м.б. достаточно тяжелыми ( в раннем детском возрасте), поэтому, сегодня и в отношении вирусных диарей ведется разработка активных методов профилактики и разработка вакцин.
Автор: гл. м/с Стрига Т.В.
Недавний прогресс в понимании репликации, распространения и патогенеза вируса Коксаки
Abstract
Вирусы Коксаки (CV) — относительно распространенные вирусы, связанные с рядом серьезных заболеваний человека, включая миокардит и менингоэнцефалит.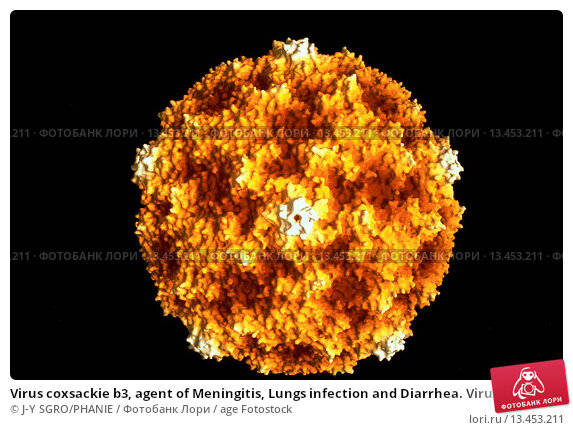 Эти вирусы считаются цитолитическими, но могут сохраняться в течение продолжительных периодов времени в определенных тканях хозяина, что требует уклонения от иммунного ответа хозяина и значительно сниженной скорости репликации. Являясь членом семейства Picornaviridae , CV исторически считались вирусами без оболочки, хотя недавние данные свидетельствуют о том, что CV и другие пикорнавирусы захватывают мембраны хозяина и приобретают оболочку.Получение оболочки может обеспечить явные преимущества для вирионов CV, такие как устойчивость к нейтрализующим антителам и эффективное нелитическое распространение вируса. CV демонстрирует уникальный тропизм для клеток-предшественников в хозяине, который может помочь объяснить восприимчивость молодого хозяина к инфекции и развитие хронического заболевания у взрослых. Также было показано, что CV используют аутофагию для максимального увеличения репликации вируса и содействия нетрадиционному высвобождению из клеток-мишеней. В этой статье мы рассмотрим недавний прогресс в выяснении репликации и распространения вируса в клетке-хозяине, выявлении детерминант тропизма и определении стратегий, используемых вирусом для уклонения от иммунного ответа хозяина.Кроме того, мы выделим оставшиеся без ответа вопросы и предоставим перспективы относительно потенциальных механизмов патогенеза сердечно-сосудистых заболеваний.
Эти вирусы считаются цитолитическими, но могут сохраняться в течение продолжительных периодов времени в определенных тканях хозяина, что требует уклонения от иммунного ответа хозяина и значительно сниженной скорости репликации. Являясь членом семейства Picornaviridae , CV исторически считались вирусами без оболочки, хотя недавние данные свидетельствуют о том, что CV и другие пикорнавирусы захватывают мембраны хозяина и приобретают оболочку.Получение оболочки может обеспечить явные преимущества для вирионов CV, такие как устойчивость к нейтрализующим антителам и эффективное нелитическое распространение вируса. CV демонстрирует уникальный тропизм для клеток-предшественников в хозяине, который может помочь объяснить восприимчивость молодого хозяина к инфекции и развитие хронического заболевания у взрослых. Также было показано, что CV используют аутофагию для максимального увеличения репликации вируса и содействия нетрадиционному высвобождению из клеток-мишеней. В этой статье мы рассмотрим недавний прогресс в выяснении репликации и распространения вируса в клетке-хозяине, выявлении детерминант тропизма и определении стратегий, используемых вирусом для уклонения от иммунного ответа хозяина.Кроме того, мы выделим оставшиеся без ответа вопросы и предоставим перспективы относительно потенциальных механизмов патогенеза сердечно-сосудистых заболеваний.
Введение
Энтеровирусы (ЭВ) широко распространены в природе и часто вызывают заболевания сердца и центральной нервной системы (ЦНС) (Whitton, Cornell et al., 2005) (Muir & van Loon, 1997). ЭМ являются членами семейства Picornaviridae, в которое входят такие известные представители, как вирус ящура, полиовирус (PV), риновирус и гепатит А.Некоторые ЭВ, особенно энтеровирус-71 (EV71) в Азии, считаются серьезными появляющимися патогенами ЦНС (Shih, Stollar et al., 2011). Род EV включает важный член, вирус Коксаки (CV), который вызывает тяжелую заболеваемость и смертность у новорожденных и молодых хозяев (Tebruegge & Curtis, 2009) (Romero, 2008). Эти вирусы имеют небольшой геном одноцепочечной РНК с положительным смыслом, и инфицирование происходит в основном фекально-оральным путем (Whitton, Cornell et al., 2005) (Feng, Langereis et al., 2014б). В 1996 г. в США произошло около 15 миллионов диагностированных случаев инфекции EV, что свидетельствует о том, что EV остается серьезной проблемной вирусной инфекцией (Sawyer, 2002). Первоначальная классификация электромобилей включала четыре группы: вирусы Коксаки A, вирусы Коксаки B (CVB), вирусы ECHO ( E nteric C ytopathic H uman O rphan) и вирусы. PV. Была разработана новая система классификации с использованием последовательных номеров для каждого нового изолята (например, EV71, EV72 и т. Д.).) из-за значительного совпадения между исторически названными электромобилями (Oberste, Maher et al., 2002).
In utero и детская инфекция недооценивается, но влечет за собой долгосрочные последствия, в результате которых интеллектуальные и когнитивные способности пациента могут быть поставлены под угрозу (Chiriboga-Klein, Oberfield et al., 1989) (Euscher, Davis et al., 2001; Чанг, Хуанг и др., 2007) (Чемберлен, Кристи и др., 1983). Относительно распространенный педиатрический вирус, CV обычно вызывает легкие инфекции от субклинических до гриппоподобных симптомов и легкого гастроэнтерита (Weller, Simpson et al., 1989). Было показано, что CV поражает сердце, поджелудочную железу и ЦНС (Arnesjo, Eden et al., 1976) (Rhoades, Tabor-Godwin et al., 2011). В редких случаях сердечно-сосудистые заболевания вызывают тяжелые системные воспалительные заболевания, такие как менингоэнцефалит, панкреатит и миокардит, все из которых могут быть фатальными или привести к длительной дисфункции органов, включая дилатационную кардиомиопатию и энцефаломиелит (David, Baleriaux et al., 1993) (Hyypia, Kallajoki et al., 1993). Заметное распространение сердечно-сосудистых инфекций можно оценить по высокой серологической распространенности во многих странах мира.В одном исследовании антитела IgG к сердечно-сосудистым заболеваниям были обнаружены у 6,7–21,6% людей в различных регионах Греции (Mavrouli, Spanakis et al., 2007). Анализ франко-канадской популяции в Монреале показал, что серологическая распространенность некоторых штаммов CV достигает 60-80% (Payment P., 1991). В одном из регионов Китая было показано, что распространенность одного серотипа ССЗ превышает 50% в группах в возрасте 15 лет и старше (Tao, Li et al., 2013). Широкое распространение CV, их генетическая изменчивость и способность сохраняться в организме человека-хозяина затрудняют для эпидемиологов возможность связать предыдущую вирусную инфекцию и последующую патологию, предполагая потенциальную роль этих вирусов в хронических идиопатиях человека (Victoria, Kapoor et al., 2009) в дополнение к признанным заболеваниям. Разработка вакцины против CV и EV остается сложной задачей по ряду причин, в том числе их значительной генетической изменчивости и непоследовательной патологии у людей.
Самопроизвольные аборты, миокардит плода и задержка нервного развития у новорожденного остаются серьезными исходами, если сердечно-сосудистая инфекция происходит во время беременности (Ornoy & Tenenbaum, 2006) (Euscher, Davis et al., 2001). Младенцы, инфицированные сердечно-сосудистыми заболеваниями, имеют более высокую вероятность развития миокардита, менингита и энцефалита; а уровень смертности может достигать 10%.Кроме того, многие хронические заболевания могут быть конечным результатом перенесенной ранее сердечно-сосудистой инфекции. Эти хронические заболевания включают хронический миокардит (Chapman & Kim, 2008), шизофрению (Rantakallio, Jones et al., 1997), летаргический энцефалит (Cree, Bernardini et al., 2003) и боковой амиотрофический склероз (Woodall, Riding et al. , 1994) (Woodall & Graham, 2004). Молекулярные механизмы, определяющие тропизм CV и их способность сохраняться в организме хозяина, остаются неясными. Долгосрочные последствия сердечно-сосудистой инфекции для выживших людей остаются в значительной степени неизвестными, несмотря на очевидные опасности, связанные с инфекцией и цитолитической природой вируса.
Многие публикации предполагают связь между ранней сердечно-сосудистой инфекцией и инсулинозависимым диабетом (IDDM) (Laitinen, Honkanen et al., 2014) (Jaidane & Hober, 2008) (Christen, Bender et al., 2012), хотя дополнительно данные необходимы для поддержки этих коррелятивных исследований. Кроме того, модель на мышах показала, что развитие инсулинозависимого диабета (IDDM) связано с сердечно-сосудистым панкреатитом и эффективностью репликации (Drescher, Kono et al., 2004), хотя факторы, определяющие вирусный тропизм и механизм заболевания не совсем понятны (Tracy, Drescher et al., 2011) (Канно, Ким и др., 2006).
Вирусы Коксаки типа B (CVB) включают шесть серотипов, каждый из которых связан с острым заболеванием человека, включая острый вирусный миокардит и панкреатит. Хотя CVB обычно считается литическим вирусом, новые данные свидетельствуют о том, что может быть установлена стойкая инфекция, которая может быть причиной хронического воспаления в органах-мишенях. Более того, латентный период и эпизодическая реактивация также могут способствовать развитию болезни (Feuer, Mena et al., 2002) (Ruller, Tabor-Godwin et al., 2012) (Feuer & Whitton, 2008). Ранее мы описали природу вирусного генома CVB в покоящихся клетках, посредством чего было установлено вирусное состояние, подобное латентному (Feuer, Mena et al., 2002) (Feuer, Mena et al., 2004). После стимуляции покоящихся клеток путем повреждения или добавления факторов роста была обнаружена экспрессия вирусного белка и продуцирован инфекционный вирус, что позволяет предположить, что латентный CVB может реактивироваться в ответ на активацию клеток.Параллельно CVB эволюционировал, чтобы модулировать клеточные сигнальные сети, чтобы уклоняться от противовирусного иммунитета хозяина, проникать в клетки и подвергаться репликации, даже когда клетка-хозяин страдает от последствий цитолитической вирусной инфекции (Esfandiarei, Luo et al., 2004) (Jensen, Garmaroudi et al., 2013) (Esfandiarei & McManus, 2008).
Наш обзор будет охватывать недавний прогресс, в частности, в исследованиях CVB, а также признание достижений в других областях исследования EV, которые способствовали лучшему пониманию репликации CVB и патогенеза.
Молекулярная биология CVB
CVB и электромобили в целом — это вирусы без оболочки, которые способны выживать в суровых условиях окружающей среды. Инфекция происходит фекально-оральным путем, и, следовательно, стабильность вириона в кислой среде желудка становится необходимостью для эффективной передачи. Структура вириона демонстрирует икосаэдрическую симметрию с размером диаметра примерно 30 нм (Jiang, Liu et al., 2014). Четыре капсидных белка (VP1-VP4) составляют структуру вириона, и эти вирусные белки являются основными антигенными детерминантами после активации гуморального ответа хозяина.Геном вирусной РНК с положительной цепью имеет размер ~ 7-8 т.п.н. и ковалентно связан на 5’-конце с вирусным белком, называемым VPg (вирусный белок генома). VPg, один из вирусных белков 3B, играет важную роль в синтезе РНК как с положительной, так и с отрицательной цепью, ковалентно присоединяясь к 5’-концу вирусного генома и выступая в качестве праймера для синтеза РНК. Остается неясным, как относительно большие количества генома с положительной цепью продуцируются для каждого генома с отрицательной цепью во время инфекции EV (Novak & Kirkegaard, 1991).Тем не менее, соотношение генома с положительной цепью к геному с отрицательной цепью снижается после установления персистенции CVB в ЦНС (Feuer, Ruller et al., 2009) (Tam & Messner, 1999). Эти результаты предполагают, что двухцепочечная структура РНК может способствовать стабилизации вирусного генома и способствовать устойчивой инфекции.
CVB включает несколько цис-действующих элементов РНК (CRE), которые необходимы для эффективной репликации вируса (Steil & Barton, 2009). CRE способствуют превращению VPg в VPgpUpU OH , который действует как праймер для вирусной РНК-полимеразы, чтобы инициировать репликацию.Как и в случае других EV, геном РНК CVB содержит внутренний сайт входа в рибосому (IRES) в 5’-нетранслируемой области (NTR). У РНК CVB отсутствует структура кэпа 7-метилгуанозина, однако рибосомы клетки-хозяина могут напрямую взаимодействовать с IRES РНК CVB, чтобы инициировать трансляцию вирусного генома (Pelletier & Sonenberg, 1988). Вирусный геном транслируется в длинный полипротеин, который подвергается серии расщеплений вирусными протеазами 2A pro и 3CD pro с образованием зрелых вирусных белков.Эти вирусные белки включают капсидные белки VP1-VP4 и семь неструктурных белков (2A-C, 3A-D и 3D Pol — РНК-полимераза) (Kitamura, Semler et al., 1981). После трансляции вирусного белка начинается репликация отрицательной цепи (Gamarnik & Andino, 1998), и образуется комплекс вирусной репликации, обеспечивающий синтез как положительной, так и отрицательной цепи в 5′-структуре клеверного листа 5′-NTR (Vogt & Andino, 2010). Поли (A) связывающий белок 1 (PABP1) взаимодействует с поли (A) хвостом вируса, что приводит к циркуляризации вирусного генома во время синтеза отрицательной цепи (Herold & Andino, 2001).Белок вируса 2A расщепляет клеточный белок eIF-4G, фактор-хозяин, необходимый для кэп-зависимой трансляции (Etchison, Milburn et al., 1982). Таким образом, CVB максимизирует репликацию, используя почти все доступные ресурсы клетки-хозяина. Вирусная РНК-полимераза 3D Pol взаимодействует с вирусным белком 3AB после прикрепления к везикулам вирусной мембраны, которые образуются после инфекции (Fujita, Krishnakumar et al., 2007).
Комплексы репликации CVB и ремоделирование внутриклеточных мембран
В общем, вирусы с положительной цепью РНК нуждаются в клеточных мембранах для репликации генома и активно модифицируют внутриклеточные мембраны для создания своих собственных органелл репликации (Belov & van Kuppeveld, 2012).CVB перенаправляет ряд факторов клетки-хозяина на ремоделирование внутриклеточных мембран для эффективной репликации вирусов (Wessels, Duijsings et al., 2007) (Hsu, Ilnytska et al., 2010) (Lanke, van der Schaar et al., 2009). Эти белки-хозяева включают фосфатидилинозитол-4-киназу (PI4KIII), фактор обмена гуаниновых нуклеотидов — GBF1 и ARF1, которые помогают собрать мембранный репликационный комплекс, поддерживающий инфекцию CVB и PV (Belov, Altan-Bonnet et al., 2007) (Lanke, van der Schaar et al., 2009). Современная модель инициации органелл репликации CVB в клетке-хозяине включает рекрутирование PI4KIIIβ после связывания вирусного белка 3A с GBF1 / Arf1, поскольку COPI, белок, который регулирует почкование мембраны, замещается.PI4KIIIβ катализирует производство липидной микросреды фосфатидилинозитол-4-фосфата (PI4P), что приводит к привлечению вирусного белка 3D pol и синтезу вирусной РНК (Hsu, Ilnytska et al., 2010). Холестерин активно передается от плазматической мембраны к органеллам репликации вирусов посредством клатрин-опосредованного эндоцитоза, указывая тем самым, что модуляция холестерина необходима для поддержания повышенных уровней репликации вирусов (Ilnytska, Santiana et al., 2013). Детальное исследование белков-хозяев и липидов, участвующих в формировании органелл вирусной репликации, обеспечивает средства борьбы с инфекцией путем разработки нового класса терапевтических малых молекул, нацеленных на эти белки-хозяева (такие как ингибиторы киназы PI4) (Hsu, Ilnytska et al., 2010), или блокируя поглощение холестерина. Тем не менее, как и в случае с любыми противовирусными препаратами-кандидатами, склонность РНК-вирусов к развитию устойчивости остается очевидной (van der Schaar, van der Linden et al., 2012). Кроме того, можно ожидать, что противовирусные препараты, действующие на белки хозяина, будут способствовать клеточному антипролиферативному действию и цитотоксичности (Lamarche, Borawski et al., 2012). Кроме того, терапевтические небольшие молекулы, снижающие репликацию вируса в культуре за счет ингибирования белков-хозяев, могут быть не столь эффективны in vivo. Недавние результаты показали, что ингибиторы киназ, используемые в модели инфекции на мышах, могут задерживать, а не предотвращать заболевание, хотя введение препарата было отменено из-за токсичности (Ford Siltz, Viktorova et al., 2014).
Вход CVB в клетки-мишени
Были идентифицированы два клеточных рецептора, которые способствуют проникновению CVB в клетки-мишени. CVB использует трансмембранный белок, обнаруживаемый в плотных контактах поляризованных клеток, называемый вирусом Коксаки и рецептором аденовируса (CAR) (Bergelson, Cunningham et al., 1997). Также было показано, что человеческий фактор ускорения распада (DAF) действует как корецептор для входа CVB для некоторых вирусных изолятов (Bergelson, Chan et al., 1994). В поляризованных клетках CVB связывается с DAF на апикальной поверхности клетки, и связывание стимулирует внутриклеточную передачу сигналов, которая помогает перемещению вирионов через клеточную мембрану к плотным контактам (Coyne & Bergelson, 2006). Впоследствии связывание вириона с CAR внутри плотных контактов приводит к CAR-зависимому входу кавеолин-зависимым, динамин-независимым образом.Напротив, проникновение CVB в неполяризованные клетки требует экспрессии CAR динамин-зависимым, независимым от кавеолина способом (Patel, Coyne et al., 2009). Хотя CVB может легко инфицировать мышей внутрибрюшинным путем, желудочно-кишечный путь действует как барьер для инфекции (Loria, Shadoff et al., 1976). Эти данные проливают свет на четкие различия между естественным человеческим хозяином и мышиной моделью инфекции. Экспрессия человеческой формы DAF на кишечном эпителии у трансгенных мышей не способствовала инфицированию энтеральным путем (Pan, Zhang et al., 2015), предполагая, что другие препятствия, такие как реакция на интерферон I типа (Ohka, Igarashi et al., 2007) и взаимодействие с кишечной флорой (Kuss, Etheredge et al., 2008), могут ограничивать инфекцию CVB на мышиной модели.
Экспрессия рецептора
необходима для проникновения вириона в возможные клетки-мишени (Kallewaard, Zhang et al., 2009). Например, мыши, у которых отсутствует экспрессия CAR в сердечной ткани, полностью устраняют вирусную репликацию в сердце и предотвращают миокардит (Shi, Chen et al., 2009). Эти результаты показывают важность in vivo и экспрессии CAR для инфекции и заболевания CVB. Кроме того, снижение экспрессии CAR по мере того, как первичные нейроны дифференцируются в культуре, коррелирует со снижением инфекции CVB (Ahn, Jee et al., 2008). Авторы пришли к выводу, что восприимчивость к инфекции зависит от уровня экспрессии CAR, а изменения в экспрессии CAR во время развития могут ограничивать количество клеток-мишеней для CVB. Кроме того, подавление CAR может происходить во время инфекции в состоянии носителя в клетках, выращенных в культуре, что со временем приводит к преобладанию устойчивых клеток (Pinkert, Klingel et al., 2011). Поскольку CAR широко экспрессируется в организме хозяина, но распространение инфекции гораздо более ограничено, дополнительные факторы могут в конечном итоге контролировать тропизм. Например, экспрессия CAR обнаруживается на высоких уровнях в ЦНС новорожденных мышей (Venkatraman, Behrens et al., 2005) (Honda, Saitoh et al., 2000) (Hotta, Honda et al., 2003). Однако во время ранней инфекции CVB в значительной степени ограничивается нейральными клетками-предшественниками (NPCs) или инфильтрирующими миелоидными клетками (Feuer, Pagarigan et al., 2005). Предпочтительное нацеливание на эти клетки может быть связано с их пролиферативным статусом (Feuer, Mena et al., 2002) (Feuer, Mena et al., 2003) (Feuer & Whitton, 2008) (Feuer, Pagarigan et al., 2005) и повышенной аутофагической активности (Tabor-Godwin, Tsueng et al., 2012). В то время как CVB и аденовирус (ДНК-вирус) используют один и тот же рецептор хозяина (CAR), тропизм для каждого вируса выглядит совершенно разным in vivo , что указывает на другие факторы, такие как тканеспецифический ответ интерферона типа I в организме человека. контроль тропизма тканей (Wessely, Klingel et al., 2001).
Роль аутофагии во время репликации CVB
Аутофагия — это процесс, при котором клетки разрушают долгоживущие, распадающиеся или поврежденные органеллы и белки.Несколько исследователей определили аутофагию как решающий компонент для репликации и выживания различных ЭМ, включая CVB, который подрывает аутофагию хозяина при инфекции (Alirezaei, Flynn et al., 2012a). Эта точка зрения продемонстрирована на хозяине в отчете, показывающем снижение патологии поджелудочной железы и более низкие титры вируса у мышей, лишенных экспрессии ATG5 в поджелудочной железе после инфекции CVB (Alirezaei, Flynn et al., 2012b). Аутофагия начинается с активации передачи сигналов фосфатидилинозитол-3 киназы класса III (PtdIns3K).Передача сигналов PtdIns3K делает возможным зарождение фагофоров — чашеобразной двойной мембраны, которая удлиняется вокруг клеточных компонентов и разрушается. Считается, что структура фагофоров происходит из эндоплазматического ретикулума (ER) (Hamasaki, Furuta et al., 2013). ATG4 усекает связанный с микротрубочками белок 1A / 1B-легкая цепь 3 (LC3-I), чтобы обнажить C-концевой глицин, который становится конъюгированным с фосфатидилэтаноламином с образованием LC3-II. Затем LC3-II рекрутируется на удлиняющийся фагофор, и поэтому LC3-II является обычным маркером, используемым для обнаружения аутофагии с помощью вестерн-блоттинга и иммуноокрашивания (Gustafsson & Gottlieb, 2008) (Klionsky, Abdalla et al., 2012). Как только аутофагосома завершена, структура сливается с лизосомой с образованием автолизосомы, и груз внутри разрушается кислыми гидролазами.
Предыдущая работа показала, что некоторые EV, такие как PV, CVB и EV71, запускают аутофагию и захватывают аутофагосомные мембраны для усиления репликации вируса (Suhy, Giddings, Jr. et al., 2000) (Wong, Zhang et al., 2008a) (Хуанг, Чанг и др., 2009). Кроме того, факторы клетки-хозяина, которые подавляли аутофагию, ингибировали репликацию CVB (Delorme-Axford, Morosky et al., 2014). Было показано, что белки PV 3A и 2BC удлиняют ER и индуцируют образование аутофагосом, соответственно. Считается, что многие вирусы собирают фабрики репликации на мембранах аутофагосом для повышения эффективности репликации (Wileman, 2006). Имея это в виду, было показано, что CVB предотвращает аутофагический поток, вызывающий накопление заполненных вирусом аутофагосом и слияние их в «мегафагосомы» (Kemball, Alirezaei et al., 2010a). Кроме того, индукция аутофагии может способствовать нецитолитическому ускользанию ЭВ из клетки-хозяина (Taylor & Kirkegaard, 2008) (Bird, Maynard et al., 2014).
Аутофагия имеет решающее значение для поддержания клеточного гомеостаза и, как было показано, предотвращает клеточное повреждение ЦНС после активации посредством кратковременного голодания (Simonsen, Cumming et al., 2008) (Alirezaei, Kemball et al., 2010). Индукция аутофагии в первичных нейронах крыс была связана с усилением репликации CVB (Yoon, Ha et al., 2008). Любопытно, что обратная корреляция между аутофагией и апоптозом наблюдалась, когда первичные нейроны крысы были инфицированы CVB4 (Yoon, Ha et al., 2009). Следовательно, расшифровка роли аутофагии во время прогрессирования инфекции CVB в быстро меняющихся клетках / клетках-предшественниках и во время установления персистенции вируса в сердце и ЦНС может иметь решающее значение в борьбе с заболеванием.
CVB способен разрушать аутофагию хозяина с помощью протеазы 2A, которая расщепляет секвестосому 1 (SQSTM1) / p62 (Shi, Wong et al., 2013). Этот белок служит для доставки убиквитинированных белков в аутофагосому путем присоединения к LC3-II. Нарушение SQSTM1 приводит к нарушению избирательной аутофагии и позволяет CVB обходить передачу сигналов защиты хозяина.Однако также было показано, что CVB активно передается в аутофагосомы, что, возможно, способствует распространению вируса за счет высвобождения внутриклеточных пузырьков. Как и почему CVB предотвращает поглощение общего груза клеточных компонентов в аутофагосомах, при этом позволяя собственное поглощение, неясно, но эти процессы могут варьироваться в зависимости от конкретных типов клеток и условий окружающей среды. Было показано, что ингибиторы аутофагии снижают внеклеточные титры полиовируса по сравнению с внутриклеточными (Jackson, Giddings, Jr.et al., 2005a). Следовательно, модуляция аутофагии лекарствами-кандидатами может действовать как терапевтические противовирусные препараты во время острой или стойкой инфекции CVB.
CVB-инфекция нейральных клеток-предшественников (NPC)
Ранее мы создали педиатрическую модель CVB-инфекции в ЦНС и сердце, чтобы изучить вирусный тропизм и болезнь (Feuer, Mena et al., 2003) (Feuer, Pagarigan et al., 2005) (Feuer, Ruller et al., 2009). Мы продемонстрировали способность CVB воздействовать на нейральные клетки-предшественники (NPC) в ЦНС новорожденных (Feuer, Mena et al., 2003), или выращенные в культуре как нейросферы (Tsueng, Tabor-Godwin et al., 2011) (Rhoades, Tabor-Godwin et al., 2011). Нейросферы или свободно плавающие сферы, генерируемые NPC в культуре, можно дифференцировать на нейроны, астроциты и олигодендроциты (Eriksson, Bjorklund et al., 2003). NPC были очень восприимчивы к инфекции, и цитопатические эффекты легко наблюдались после заражения. Напротив, дифференцированные NPC были менее восприимчивы к инфекции CVB. Мы предположили, что снижение восприимчивости к инфекции CVB было связано со снижением их пролиферативного статуса и клеточными изменениями, связанными с дифференцировкой (Feuer, Mena et al., 2002). Истощение NPC из-за вирус-опосредованного апоптоза привело к дефектам развития ЦНС у хозяина (Ruller, Tabor-Godwin et al., 2012), а CVB мог установить стойкую инфекцию, вызывающую хроническое воспаление в головном мозге (Feuer, Ruller et al., 2009 г.). Мы предположили, что клетки-предшественники могут пережить первоначальную инфекцию и способствовать сохранению вируса либо косвенно (способствуя ослаблению вируса), либо напрямую (клетки-предшественники, содержащие вирусные материалы) (Rhoades, Tabor-Godwin et al., 2011).
Процесс аутофагии считается критическим для поддержания стволовых клеток и во время фиксации клеточных клонов (Guan, Simon et al., 2013) (Vessoni, Muotri et al., 2012). Было показано, что роль аутофагии во время инфекции CVB является клеточно-специфической, а NPC поддерживают более высокие уровни вирусной инфекции (Tabor-Godwin, Tsueng et al., 2012). Как ранее продемонстрировали другие группы, использующие трансформированные клеточные линии (Wong, Zhang et al., 2008b), клетки HL-1 (трансформированная клеточная линия кардиомиоцитов) показали усиление аутофагической передачи сигналов после инфицирования CVB; титры вирусов увеличивались после индукции аутофагии и снижались после ингибирования аутофагии.Напротив, никаких изменений в передаче сигналов аутофагии не наблюдалось у NPC после инфицирования, хотя базальные уровни аутофагии были выше по сравнению с клетками HL-1. Более того, более высокие уровни передачи сигналов аутофагии могут быть индуцированы в NPC без увеличения уровней репликации вируса. У дифференцированных предшественников NPC аутофагия увеличивается во время дифференцировки. Неожиданно после инфекции CVB наблюдалось снижение аутофагии в нейронах, астроцитах и олигодендроцитах. Эти наблюдения были довольно неожиданными, поскольку было показано, что пикорнавирусы последовательно активируют аутофагию во время инфекции (Kirkegaard, 2009), а аутофагосомы могут потребоваться для оптимальной репликации пикорнавирусов (Taylor & Kirkegaard, 2008).
CVB можно ожидать нацеливания на NPC по разным причинам. Естественно высокие базальные уровни аутофагической активности у NPC могут объяснить их относительно большую восприимчивость к инфекции CVB. NPCs обычно подвергаются быстрой экспансии и пролиферации во время развития и регенерации ткани, и было показано, что CVB преимущественно реплицируется в клетках, претерпевающих активную пролиферацию (Feuer, Mena et al., 2002) (Feuer, Pagarigan et al., 2005). Когда NPC дифференцируются в нейроны, эти клетки мигрируют в области гиппокампа и обонятельной луковицы.Ожидается, что миграция инфицированных NPC будет способствовать распространению вируса, а обонятельная луковица может обеспечить путь выхода вируса через обонятельный нейроэпителий. Мы предполагаем, что вирусная инфекция может изменять NPC и нейроны, полученные от инфицированных NPC, что приводит к возможным модификациям поведения внутри хозяина с целью максимальной передачи вируса. Кроме того, покоящиеся NPC могут нести стойкую / латентную инфекцию до тех пор, пока активный нейрогенез не будет стимулировать реактивацию вируса (Rhoades, Tabor-Godwin et al., 2011). Наконец, иммунные привилегированные области, такие как ЦНС, могут ограничивать антивирусные реакции против CVB, обеспечивая плодотворную и защищенную область репликации вируса.
Использование рекомбинантных CVB, экспрессирующих чужеродные белки
Ряд исследовательских групп создали рекомбинантные CVB (rCVB), экспрессирующие молекулярные маркеры, цитокины и другие чужеродные белки (Slifka, Pagarigan et al., 2001) (Feuer, Mena et al. , 2002) (Henke, Zell et al., 2001). Многие из этих рекомбинантных вирусных конструкций оказались довольно стабильными, хотя потеря чужеродной вставки может проявиться в вирусной популяции в течение пяти пассажей, в зависимости от размера вставки, нуклеотидной последовательности, природы гена и условий пассажа.Использование этих rCVB в культуре ткани и in vivo прояснило вопросы, касающиеся вирусного тропизма (Feuer, Pagarigan et al., 2005) (Puccini, Ruller et al., 2014), активации адаптивного иммунного ответа против инфекции (Kemball , Harkins et al., 2009), механизмы вирулентности и заболевания (Zeng, Chen et al., 2013), а также возможное использование CVB в качестве терапевтических / вакцинных векторов (Kim, Kim et al., 2012) (Miller, Geng et al., др., 2009).
Важность временного отслеживания вирусной инфекции с использованием минимально инвазивных инструментов и инструментов в реальном времени может привести к лучшему пониманию патогенеза CVB.Временные исследования других вирусов продемонстрировали роль эффективного распространения вируса в усилении репликации вируса. Например, вирус осповакцины максимизирует распространение вируса, поражая неинфицированные клетки, а не повторно заражая близлежащие клетки (Doceul, Hollinshead et al., 2010). Другая стратегия используется человеческим Т-лимфотропным вирусом-1 (HTLV-1), который создает специализированную область межклеточного контакта — вирусологический синапс, способствуя передаче вируса между клетками (Nejmeddine & Bangham, 2010).Чтобы проверить прогрессирование распространения CVB, мы разработали уникальный rCVB, экспрессирующий белок «флуоресцентного таймера» (Timer-CVB) для отслеживания распространения вируса в клетках, выращенных в культуре, и в нашей модели инфекции на животных (Robinson, Tsueng et al., 2014 ). Белок «флуоресцентный таймер» (Терских, Фрадков и др., 2000) преобразуется из зеленой флуоресценции в красную в течение ~ 48 часов, что позволяет наблюдать распространение вируса в реальном времени на основе изменения цвета ( ) .С помощью стандартного анализа бляшек, бляшки Timer-CVB продемонстрировали картину «бычий глаз» с помощью флуоресцентной микроскопии, при этом первоначальная инфекция была представлена красной флуоресценцией, а вновь инфицированные клетки, распространившиеся от клетки к клетке, выявлялись зеленой флуоресценцией. Timer-CVB3 может быть особенно полезен при оценке антивирусных соединений в клетках-мишенях и расшифровке механизма их действия. Например, противовирусные соединения, которые ингибируют высвобождение инфекционного вируса из клетки-хозяина, могут быть представлены инфицированными зелеными клетками, затем желтыми и, наконец, эритроцитами, при этом новых зеленых клеток не наблюдается.Напротив, противовирусные соединения, действующие просто для снижения уровня продукции инфекционного вируса, будут показывать новые зеленые клетки, хотя и на более низком уровне по сравнению с необработанными культурами.
Клетки HeLa, инфицированные Timer-CVB, медленно меняют флуоресценцию с зеленой на красную
Ген белка «флуоресцентного таймера» был вставлен в инфекционный клон плазмиды для CVB. A) После заражения рекомбинантным CVB3, экспрессирующим белок «флуоресцентного таймера» (Timer-CVB), медленное превращение зеленой флуоресцирующей формы белка таймера в красный цвет происходило с течением времени в клетках, покрытых агаром.Первоначальные очаги инфекции светились красным светом, а вновь инфицированные клетки — зеленым. B) Клетки HeLa, инфицированные Timer-CVB (moi = 0,1), первоначально флуоресцируют зеленым (недавний вирусный белок) через 24 часа PI, как определено с помощью флуоресцентной микроскопии. К 32 часам ИП в инфицированных клетках HeLa наблюдалась как зеленая, так и красная флуоресценция (созревший вирусный белок), а к 48 часам ИП большинство клеток ярко флуоресцировало в красном канале. Меньшее количество зеленых и красных инфицированных клеток наблюдали с помощью флуоресцентной микроскопии для клеток HeLa, обработанных противовирусным препаратом рибавирином (100 мкг / мл) в каждый момент времени.
Использование Timer-CVB выявило удивительные аспекты репликации вируса, которых мы не ожидали. Сначала, создав покадровые видеоролики, мы выявили обширное ремоделирование внутриклеточной мембраны в инфицированных клетках-предшественниках (Robinson, Tsueng et al., 2014), напоминающее органеллы репликации вируса, ранее описанные другими исследовательскими группами (Hsu, Ilnytska et al., 2010). Эти интервальные видеоролики показали, что органеллы репликации вируса флюоресцируют асинхронно, и выявили динамику реорганизации внутриклеточной мембраны после инфекции.Белок «флуоресцентного таймера» и вирусный белок 3A тесно коализовались, что позволяет предположить, что молекулярный маркер оставался захваченным в органеллах репликации вируса вскоре после трансляции. Вирусный белок 3A может связывать и модулировать факторы клетки-хозяина, такие как PI4KIII, GBF1 и ARF1, и способствовать ремоделированию внутриклеточной мембраны для эффективной репликации вируса (Wessels, Duijsings et al., 2007) (Hsu, Ilnytska et al., 2010) (Lanke, van der Schaar et al., 2009). Ранее было показано, что вирусный белок 3A не только участвует в формировании органелл вирусной репликации, но и останавливает трафик и секрецию белка, нарушая работу аппарата Гольджи (de Jong, Visch et al., 2006) (Cornell, Kiosses et al., 2006) (Cornell, Kiosses et al., 2007). Мы ожидаем, что Timer-CVB может иметь значение для идентификации образования вирусных органелл репликации в реальном времени внутри клетки и для отслеживания распространения вируса в нашей модели инфекции на животных.
CVB ускользает из клетки-хозяина с помощью выброшенных аутофагосом
Классически считалось, что как вирус без оболочки, инкапсулированный в белок, EV, такие как CVB, ускользают от инфицированного хозяина посредством цитолиза, в результате чего высвободившиеся вирионы быстро подвергаются действию нейтрализующих антител хозяина.Интересно, что мы наблюдали внеклеточные микровезикулы (EMV), содержащие инфекционный вирус, высвобождаемый из различных типов клеток-предшественников, инфицированных Timer-CVB (Robinson, Tsueng et al., 2014) ( ). При дальнейшем анализе было показано, что эти структуры обогащены LC3-II, общим маркером аутофагосом. Присутствие LC3-II в вирусно-индуцированных EMV и отсутствие LC3-II в базально высвобождаемых экзосомах из неинфицированных клеток предполагают, что CVB может активно передаваться в аутофагосомы, что впоследствии способствует их высвобождению из клетки.Эта модель была бы сродни ранее описанному феномену опосредованного аутофагосомами выхода без лизиса (AWOL) после инфекции PV (Taylor, Burgon et al., 2009) (Richards & Jackson, 2012). В то время как CVB, по-видимому, ускользнул из клеток, связанных в неповрежденных мембранах, в случае инфекции PV эти микровезикулы были предположительно нестабильными, хотя и вносили свой вклад в высвобождение вирусных частиц из клетки-хозяина в отсутствие лизиса клеток. Наши результаты показывают, что CVB координирует уникальный метод распространения вируса, используя путь аутофагии, и что эти EMV могут быть более стабильными, чем предлагалось ранее.Было показано, что CVB увеличивает накопление аутофагосом в поджелудочной железе инфицированных мышей, при этом аутофагосомы сливаются в мегафагосомы (Kemball, Alirezaei et al., 2010a). Ранее мы задокументировали уменьшение количества аутофагосом в цитоплазме частично дифференцированных NPC, инфицированных CVB; однако при более внимательном рассмотрении оказалось, что многочисленные EMV отпочковываются с поверхности этих инфицированных клеток, возможно, в результате изгнания внутриклеточных аутофагосом во внеклеточное пространство (Tabor-Godwin, Tsueng et al., 2012). Совсем недавно было показано, что PV, CVB и частицы риновируса высвобождаются в везикулах фосфатидилсерина клетками-хозяевами нелитическим образом (Chen, Du et al., 2015). Внутри отдельных везикул наблюдались множественные вирусные частицы, которые могут обеспечивать взаимодействие между квазивидами вируса и приводить к более эффективному инфицированию по сравнению со свободными вирусными частицами.
Обнаружение вирусного белка LC3 и CVB в сброшенных EMV
Дифференцированные NPSC, трансдуцированные адено-LC3-GFP, инфицировали dsRED-CVB (moi = 0.1) и наблюдали с помощью флуоресцентной микроскопии через 3 дня PI. (A) Легко наблюдались обильные сбрасываемые EMV (белые стрелки), экспрессирующие вирусный белок (красный) и маркер аутофагосом (LC3-GFP, зеленый). (E-F) Более высокое увеличение (C) показало совместную локализацию вирусного белка и LC3-GFP в сброшенных EMV.
Использование EMV может способствовать распространению вируса и инфицированию несколькими способами ( ). Поскольку EMV-опосредованное распространение вируса позволяет CVB связываться с мембраной, этот метод высвобождения потенциально может расширить диапазон чувствительных клеток-мишеней, минуя канонический рецептор-опосредованный эндоцитоз и вместо этого сливаясь с клетками, в которых может отсутствовать CAR или DAF.Несмотря на эту возможность, экспрессия CAR в некоторых тканях-мишенях, таких как сердце, остается критическим детерминантом тропизма и возможного прогрессирования заболевания (Shi, Chen et al., 2009). Тем не менее, EMV могут по-прежнему вносить вклад в инфицирование других клеток или тканей до возможного распространения в сердце или во время закрепления вируса в сердечной ткани. Например, было показано, что CVB эффективно заражает и использует B-лимфоциты для распространения, несмотря на едва обнаруживаемые уровни экспрессии CAR на этих важных клетках-мишенях (Mena, Perry et al., 1999). Поскольку выход через EMV обеспечивает нецитолитический метод ускользания CVB, этот механизм потенциально может продлить репликацию вируса в клетке-хозяине. EMV могут также повышать стабильность вируса во внеклеточном пространстве, а также маскировать вирус от нейтрализующих антител хозяина (Inal & Jorfi, 2013) (Masciopinto, Giovani et al., 2004). Хотя интактные вирионы наблюдались в EMV, наблюдаемых под электронной микроскопией (Robinson, Tsueng et al., 2014), эти структуры предположительно могут содержать свободную вирусную РНК и по-прежнему оставаться инфекционными.Это позволит CVB инфицировать клетки во время персистенции (Feuer, Ruller et al., 2009) без необходимости сборки вирусных капсидов или индукции клеточной цитопатичности (Taylor, Burgon et al., 2009) (Bird, Maynard et al., 2014) . Этот новый путь распространения будет аналогичен РНК-содержащим экзосомам, процессу, посредством которого РНК и микро-РНК хозяина транспортируются для целей межклеточной коммуникации (Meckes, Jr. & Raab-Traub, 2011) (Gallo, Tandon et al. al., 2012) (Delorme-Axford, Donker et al., 2013).
Модель распространения CVB в организме хозяина за счет выделения EMV
Большое количество внеклеточных микровезикул (EMV) LC3II + , содержащих инфекционный вирус, недавно наблюдали после инфицирования клеток-предшественников в культуре. И процесс дифференцировки, и вирусная инфекция могут усиливать выделение одиночных мембранных EMV, происходящих от пути аутофагии. A) Вирус-ассоциированные EMV могут увеличивать естественный тропизм CV к клеткам-мишеням, которые не могут экспрессировать канонические вирусные рецепторы.Б) Нейтрализующие антитела могут быть неэффективными против инфекционного вируса, изолированного в защищенной среде внеклеточной микровезикулы. Кроме того, связанные с вирусом EMV могут повышать стабильность инфекционного вируса в организме хозяина во время гематогенного распространения. C) EMV могут способствовать распространению вирусной РНК во время персистирующей стадии инфекции, в результате чего может быть ограничено присутствие интактных вирионов и / или структурных вирусных белков. D) EMV могут помочь вирионам перемещаться и проникать в новые ткани-мишени и преодолевать избирательно проницаемые барьеры.
CVB, как было показано, преимущественно нацелен на многочисленные клетки-предшественники, такие как NPC и сердечные клетки-предшественники (CPC). Поскольку эти типы клеток часто мобилизуются в области необходимого восстановления тканей после активации, CVB может быть в состоянии «путешествовать автостопом» внутри этих клеток, чтобы получить доступ к новым тканям, в которые вирус обычно не может проникнуть. Точно так же EMV могут позволить CVB проникать в избирательно проницаемые ткани, такие как ЦНС, минуя гематоэнцефалический барьер или гематоэнцефалический барьер (Sampey, Meyering et al., 2014). Несмотря на это, механизмы защиты хозяина, по-видимому, эволюционировали совместно в ответ на высвобождение связанных с вирусом EMV. Было показано, что связанная с экзосомами РНК гепатита С активирует плазматические дендритные клетки, обеспечивая защитный врожденный иммунитет у хозяина (Dreux, Garaigorta et al., 2012). Кроме того, фагоцитарные иммунные клетки, такие как макрофаги, распознают специфические маркеры «съешь меня», которые могут украшать CVB-ассоциированные EMV и нацеливаться на них для деградации (Miyanishi, Tada et al., 2007).
Недавнее открытие пикорнавирусов, захватывающих мембраны, к которым теперь относится гепатит А (Feng, Hensley et al., 2013), может указывать на двойную стратегию для семейства вирусов, которые могут покидать хозяина в виде вириона без оболочки, а также сохранять скрытую оболочку — по крайней мере, после заражения определенных клеток-хозяев. Почему вирус может использовать эту двойную стратегию? Возможно, некоторые пикорнавирусы сохраняют эту двойственность, чтобы максимизировать стабильность в различных средах (Feng & Lemon, 2013). Например, форма вируса без оболочки может иметь большую стабильность в неблагоприятно сухой или гипотонической среде.Напротив, форма вируса в оболочке может быть более предпочтительной для гематогенного распространения в организме хозяина, где циркулирующие нейтрализующие антитела могут в противном случае нейтрализовать вирионы открытыми антигенными белками.
Модель «автобусная остановка / троянский конь» для входа CVB через плотные соединения
Один из парадоксов использования рецепторов большим количеством вирусов, включая CVB, заключается в их зависимости от рецепторов, расположенных в, казалось бы, недоступных плотных контактах поляризованного эпителия. клетки (Bergelson, 2009) (Delorme-Axford & Coyne, 2011).Для многих вирусов, включая CVB, слой эпителиальных клеток может быть первым препятствием для проникновения в хозяина. Хотя поляризованные эпителиальные клетки, выращенные в культуре, использовались для моделирования проникновения CVB в клетки-мишени (Coyne & Bergelson, 2006) (Coyne, Shen et al., 2007), эти клетки, по-видимому, не поддерживают высокие уровни репликации CVB и вирусного белка. экспрессия in vivo — несмотря на экспрессию CAR. Вместо этого ацинарные клетки поджелудочной железы, кардиомиоциты, костный мозг и активированные лимфоциты в маргинальных областях селезенки, инфильтрирующие миелоидные клетки нестина + , клетки-предшественники у молодых мышей и незрелые нейроны ЦНС являются основными мишенями для инфекции CVB. в хосте.
Мы предполагаем, что связывание вируса с внутрисегментными белками может представлять собой общую стратегию для вирусов нацеливания на мигрирующие клетки, проходящие через плотные соединения нескольких тканей ( ). Напр., Мы ранее показали, что CVB инфицировали миелоидные клетки нестина + , которые проникали через плотные соединения эпителиальных клеток сосудистого сплетения (Tabor-Godwin, Ruller et al., 2010). Сосудистое сплетение образует гемато-ликворный барьер в ЦНС, а проникновение активированных иммунных клеток контролируется плотными соединениями кубовидного эпителия сосудистого сплетения (Ransohoff, Kivisakk et al., 2003). Сосудистое сплетение регулирует производство спинномозговой жидкости, а транстиретин (TTR), гормон-связывающий белок, активно транспортируется сосудистым сплетением в спинномозговую жидкость (Dickson, Aldred et al., 1986). Сосудистое сплетение также выполняет уникальные функции хозяина (Emerich, Skinner et al., 2005), включая секрецию факторов роста (Shingo, Gregg et al., 2003) и участие в нейрогенезе (Falk & Frisen, 2002). Привлечению этих новых миелоидных клеток предшествовала индукция CCL12, хемокина, который, как известно, привлекает моноцитарные клетки (Sarafi, Garcia-Zepeda et al., 1997) и фиброциты (Moore, Murray et al., 2006). Хотя эпителиальные клетки оказались защищены от инфекции, CVB вызывал значительное острое повреждение сосудистого сплетения (Puccini, Ruller et al., 2014). Также было показано, что инфицированные миелоидные клетки нестина + мигрируют в ЦНС и способствуют распространению вируса.
Модель «автобусная остановка / троянский конь» для входа CVB через плотные соединения барьера кровь-CSF
Мы предполагаем, что CVB первоначально связывается с CAR, белком плотных контактов, но не проникает в эпителиальные клетки сосудистого сплетения.После связывания CCL12 и другие хемокины высвобождаются эпителиальными клетками, тем самым привлекая нестин + миелоидных клеток, которые подвергаются экстравазации через плотные соединения эпителиальных клеток сосудистого сплетения. Вирионы CVB проникают в миелоидные клетки нестина + , которые поддерживают инфекцию и способствуют проникновению вируса в ЦНС.
Почему CVB может нацеливаться на интраункциональные белки, которые изолированы в очень недоступных областях эпителиальных клеток? Мы предполагаем, что CVB и другие вирусы прикрепляются к внутрисоединившимся белкам, чтобы «зацикливаться» на мигрирующих иммунных клетках, реагирующих на раннюю инфекцию.Использование иммунных клеток для распространения вируса в первичные органы-мишени ранее было описано другими (Mena, Perry et al., 1999) (Noda, Aguirre et al., 2006). Зараженные иммунные клетки могут защищать вирус от нейтрализующих антител при миграции во вторичные ткани. Эта стратегия не может быть уникальной для CVB, хотя конкретный внутрисоединительный белок, используемый каждым вирусом, может быть отдельным (Bergelson, 2009). Другие семейства вирусов, возможно, эволюционировали, следуя аналогичному методу распространения через иммунные клетки-мишени «троянских коней», хотя, возможно, с использованием уникального сигнатурного профиля хемокинов и сопоставления отвечающих иммунных клеток.
CVB Инфекция сердечных клеток-предшественников (CPC) И патологическое ремоделирование сердца
Хотя частоту воздействия CVB в популяции трудно оценить из-за ее часто бессимптомной природы, эпидемиологическое исследование Petitjean et al. Показало, что 39,1% здоровых людей содержат энтеровирусную РНК (Petitjean, Kopecka et al., 1992). Эти данные подчеркивают распространенность инфекций CVB, которые остаются невыявленными; однако не меньшее беспокойство вызывало обнаружение энтеровирусной РНК у 66.7% пациентов с идиопатической дилатационной кардиомиопатией. Хотя связь между острым миокардитом и дилатационной кардиомиопатией хорошо задокументирована (Satoh, Tamura et al., 1994) (Mason, 2002) (Kearney, Cotton et al., 2001) (Cheng, 2006), причинно-следственная связь между легкой субклинической инфекция и последующая дилатационная кардиомиопатия — например, в случае идиопатической кардиомиопатии — менее изучены.
Наша группа недавно опубликовала исследование, которое может пролить свет на связь между легкой острой инфекцией и сердечной недостаточностью с поздним началом (Sin, Puccini et al., 2014). Мы разработали модель легкой инфекции CVB у молодых мышей, в которой вирусная РНК и инфекционные частицы могут быть обнаружены на высоком уровне в сердце сразу после заражения, а также клетки-предшественники сердечных клеток c-kit + и Sca-1 + ( CPC) были предпочтительными клетками-мишенями для инфицирования сердца ( ). Было показано, что клетки Sca-1 + в сердцах инфицированных мышей совместно экспрессируют маркеры зрелых сосудистых клеток, такие как фактор фон Виллебранда (эндотелиальный) и SM22 (гладкие мышцы).Клиренс вируса произошел до взрослой фазы, и имитирующие и инфицированные CVB животные выглядели здоровыми, нормально кормились и росли с одинаковой скоростью. Вес сердца был нормальным, и воспаление сердца не могло быть обнаружено с помощью окрашивания гематоксилином и эозином в течение 11 недель после инфицирования. Тем не менее, окрашивание на антиген c-kit в срезах сердца выявило 50% сокращение популяции клеток-предшественников через 11 недель после инфицирования. После воздействия CVB CPC показали сильную предрасположенность к дифференцировке в сосудистые клетки.Ранее было показано, что CVB активирует аутофагию, процесс, который может быть важным во время дифференцировки клеток (Guan, Simon et al., 2013). Следовательно, помимо нацеливания CPC на инфекцию, CVB может стимулировать их преждевременную дифференциацию и снижать их способность к самообновлению. Этот эффект в конечном итоге может привести к истощению пула CPC, наблюдаемому у взрослых инфицированных молодых мышей, в дополнение к любым цитолитическим эффектам.
CVB продуктивно инфицированные клетки-предшественники в ювенильном сердце
Трехдневных мышей инфицировали eGFP-CVB (10 5 БОЕ IP) или ложно инфицировали, и сердца выделяли через 2 дня ИП.Залитые парафином срезы сердечной ткани депарафинизировали и окрашивали с использованием антитела против Sca-1 (зеленый) и вирусного белка (красный). Было показано, что многие клетки Sca-1 + в сердечной ткани инфицированы eGFPCVB. DAPI (синий) использовался для мечения ядер клеток. Показаны репрезентативные изображения трех инфицированных мышей.
Что означает скомпрометированная популяция CPC для сердца взрослого человека? Взрослые мыши, которым вводили низкий инокулят CVB во время ювенильного периода, казались здоровыми и неотличимыми от контрольных мышей, имитирующих заражение.Действительно, сердечная гипертрофия и расширение, указывающие на прогрессирование сердечной недостаточности, наблюдались только тогда, когда эти инфицированные несовершеннолетними взрослые мыши подвергались физическим нагрузкам или фармакологически индуцированному сердечному стрессу. У инфицированных животных наблюдались признаки гипертрофии сердца и рубцевания миокарда после плавания или лечения изопротеренолом. Дальнейшее исследование показало, что имитационно инфицированные животные были способны увеличивать образование кровеносных сосудов после увеличения сердечной нагрузки, тогда как CVB-инфицированные животные не могли выполнять этот тип ремоделирования сосудов.Стволовые клетки непосредственно участвуют в ангиогенезе и неоваскуляризации посредством паракринной передачи сигналов и прямой дифференцировки (Huang, Zhang et al., 2010) (Lu, Pompili et al., 2013) (Leeper, Hunter et al., 2010). Мы предполагаем, что уменьшение популяции CPC в сердце, инфицированном CVB, привело к нарушению адаптивного ремоделирования сосудов. Это нарушение ремоделирования сосудов не позволяет обеспечить надлежащую перфузию миокарда под нагрузкой, что приводит к ишемии мышц и вызывает патологическую гипертрофию и повреждение сердца ( ).
Модель сердечной недостаточности у взрослых мышей, инфицированных CVB
(A) Популяция CPC, восприимчивых к инфекции CVB, находится в миокарде. При увеличении сердечного стресса потребность в кислороде увеличивается в сердечной ткани. CPC привлекаются для управления ангиогенезом и неоваскуляризацией, что увеличивает плотность сосудов в мышцах, обеспечивая эффективную перфузию насыщенной кислородом крови. (B) Когда сердце подвергается легкой инфекции CVB, CPC преимущественно становятся мишенью вируса, что приводит к истощению популяции CPC; однако миокард в остальном нормальный.После сердечного стресса ограниченное количество оставшихся CPC не может в достаточной степени стимулировать образование кровеносных сосудов, и миокард становится ишемическим. Отсутствие васкуляризации приводит к гипертрофии сердца, что приводит к образованию рубцов и сердечной дисфункции.
Нацеливание на CPC с помощью CVB не является полностью неожиданным, исходя из известной восприимчивости клеток-предшественников к инфекции (Feuer, Pagarigan et al., 2005) (Feuer & Whitton, 2008) (Feuer, Mena et al., 2002) (Willcox , Ричардсон и др., 2011). CVB может проявлять предпочтительный тропизм для клеток-предшественников, а инфекция может изменять приверженность клеточного клона или уменьшать их восстановительную способность (Feuer, Mena et al., 2003) (Feuer, Pagarigan et al., 2005) (Tabor-Godwin, Tsueng et al. , 2012) (Feuer & Whitton, 2008) (Rhoades, Tabor-Godwin et al., 2011) (Ruller, Tabor-Godwin et al., 2012) (Tsueng, Tabor-Godwin et al., 2011) (Althof & Whitton , 2012). Заражение клеток-предшественников может также привести к усиленному распространению вируса через выход без лизиса, опосредованный аутофагосомами (AWOL) (Robinson, Tsueng et al., 2014) (Jackson, Giddings, Jr. et al., 2005b). Учитывая, что сердце состоит в основном из постмитотических миоцитов, пул циклических CPC может обеспечить оптимальные мишени для инфекции. Конечная судьба инфицированных клеток-предшественников неизвестна, хотя инфекция вызвала преждевременную дифференцировку CPC в направлении сосудистого происхождения.
Избегание врожденного противовирусного иммунного ответа
CVB и другие EV развили много уникальных механизмов, позволяющих уклоняться от иммунного ответа хозяина (Harris & Coyne, 2013) (Feng, Langereis et al., 2014b) (Kemball, Alirezaei et al., 2010b). Например, было показано, что вирусные протеазы CVB, которые включают протеиназы 3C и 2A, ослабляют ответ IFN типа I, расщепляя киназу фокальной адгезии, MDA5, RIG-1 и белки-хозяева MAVS (Bozym, Delorme-Axford et al., 2012) (Mukherjee, Morosky et al., 2011) (Feng, Langereis et al., 2014a). Общая характеристика после любой инфекции клетки-хозяина включает индукцию стрессовой реакции, которая действует против вирусной инфекции, подавляя синтез белка (Lloyd, 2012).Вирусная инфекция может запускать стрессовые гранулы (SG), которые содержат трансляционно подавленные рибонуклеопротеины-мессенджеры, тем самым подавляя трансляцию вирусного генома (Onomoto, Yoneyama et al., 2014) (Lloyd, 2013). Протеиназа полиовируса 3C может расщеплять RasGAP-Sh4-связывающий белок (G3BP), необходимый компонент образования SG (Reineke & Lloyd, 2015). CVB, подобно полиовирусу, нарушает процессинговые тельца (P-тельца), участвующие в декапировании, распаде и подавлении трансляции мРНК (Dougherty, White et al., 2011). P-тельца содержат белки Xrn1, Dcp1a и Pan3, которые участвуют в деэпиляции и деградации 5’-конца мРНК. Было обнаружено, что эти белки разлагаются в клетках-мишенях после заражения CVB. Распад ключевых компонентов P-телец может обеспечить механизм для CVB, чтобы реплицироваться до высоких уровней в клетке-хозяине, несмотря на инициирование стрессовой реакции после инфекции.
CVB также может противодействовать апоптотическому пути в клетках, позволяя репликации вируса продолжаться в течение более длительного периода времени, необходимого для максимизации потомства (Harris & Coyne, 2014).Например, CVB может расщеплять клеточные компоненты проапоптотического семейства, включая TRIF (Mukherjee, Morosky et al., 2011), а вирусный белок 2B может действовать как виропорин, нарушая градиенты Ca 2+ , необходимые для инициации апоптоза (Campanella, де Йонг и др., 2004). Уклонение от противовирусного ответа хозяина максимизирует репликацию вируса во время острой инфекции, а также может иметь решающее значение для установления устойчивости вируса. Недавно было показано, что удаление in vivo рецептора интерферона типа I в кардиомиоцитах ускоряет миокардит, хотя инфекция в сердечной ткани остается в высокой степени очаговой (Althof, Harkins et al., 2014). Эти результаты показывают, что другие неустановленные противовирусные факторы могут предотвратить более широкое распространение в сердце.
Недавнее исследование прояснило роль матриксной металлопротеиназы-12 (MMP-12) в противовирусном иммунитете (Marchant, Bellac et al., 2014) против CVB. Хотя интерферон-α (IFN-α) необходим для противовирусного иммунитета, активированный iκBα (кодируемый NFKBIA) необходим для экспорта IFN-α из инфицированных вирусом клеток. MMP-12 опосредует транскрипцию NFKBIA, которая индуцирует секрецию IFN-α и защиту от инфекции CVB.Одновременно ММР-12 ограничивает противовирусный иммунный ответ, отщепляя сайт связывания рецептора 2 IFN-α. Однако было показано, что непроницаемый для мембран ингибитор MMP-12 увеличивает уровни IFN-α и снижает титры CVB в поджелудочной железе. Эти исследования предполагают, что модуляция противовирусного ответа ингибиторами ММР-12 может помочь контролировать инфекцию CVB у хозяина.
Несколько исследований изучали способность клеток-предшественников обеспечивать эффективный противовирусный ответ и защищаться от микробной инфекции.Используя нашу модель инфекции ЦНС in vivo , уникальные изменения экспрессии иммунного гена хозяина наблюдались для CVB по сравнению с другим нейротропным вирусом — LCMV — аренавирусом, который, как считается, активирует прототипный иммунный ответ у хозяина (Puccini, Ruller et al., 2014). CCL12, CCL7, CCL4, CXCL4 и CCL2 были активированы в ранние моменты времени после инфекции CVB. Напротив, экспрессия гена MHC класса I, некоторых связанных с развитием Hox-генов и TTR специфически подавлялась после инфекции CVB.Интересно, что толл-подобные рецепторы, как было обнаружено, модулируют нейрогенез гиппокампа взрослых через активацию MyD88 (Rolls, Shechter et al., 2007), а инфекция CVB в развивающейся ЦНС может изменять нормальное развитие как путем воздействия на клетки-предшественники (Ruller, Tabor-Godwin) et al., 2012), и вызывая местный воспалительный противовирусный ответ.
Адаптивный иммунный ответ после инфекции CVB
Существенный вклад нейтрализующего ответа антител в контроль инфекций EV можно увидеть в отчетах о лицах, страдающих агаммаглобулимией, у которых развиваются хронические невропатии после инфекции CVB (Misbah, Spickett et al., 1992). Было показано, что антитела жизненно важны для удаления инфекционного вируса у мышей, лишенных В-клеток (Mena, Perry et al., 1999). В-клетки также способствуют распространению вируса посредством распространения «троянского коня». Высокие уровни вирусной РНК наблюдались в краевой зоне селезенки, что свидетельствует об активной инфекции пролиферирующих лимфоцитов. Активированные микроглии и макрофаги также вносят вклад в ответ хозяина против инфекции активно охвативших вирус-инфицированных клеток (Feuer, Ruller и др., 2009).
Активация Т-клеточного ответа у хозяина может зависеть от рода EV (Slifka, Pagarigan et al., 2001). Хотя Т-клетки имеют решающее значение для борьбы с вирусными инфекциями, CVB разработал множество стратегий, чтобы избежать CD8 + Т-клеток, например, путем ингибирования презентации антигена MHC класса I (Kemball, Harkins et al., 2009). Также было показано, что CVB изменяет стимулирующую способность дендритных клеток, что может нарушать способность хозяина вызывать защитные противовирусные Т-клеточные ответы (Kemball, Flynn et al., 2012). Кроме того, CVB может инфицировать костный мозг и популяции эритроидных и лимфоидных клеток-предшественников, дополнительно влияя на иммунные ответы хозяина (Althof & Whitton, 2012).
CVB Вакцины и противовирусные кандидаты
Многие исследователи разработали эффективные вакцины против CVB, используя различные стратегии вакцин, включая ДНК-плазмиды, экспрессирующие вирусные белки, инактивированный вирус или живые аттенуированные формы вируса, хотя в настоящее время клинически доступной вакцины не существует. Было показано, что безопасная и эффективная вакцина на основе РНК защищает мышей от заражения вирусом, хотя нейтрализующие антитела обнаружены не были (Hunziker, Harkins et al., 2004). Вакцины на основе РНК могут быть более безопасными, чем вакцины на основе ДНК, из-за их неспособности интегрироваться в клеточную ДНК. Также было показано, что ослабленные вирусы защищают мышей от летального повторного заражения (Dan & Chantler, 2005). Рекомбинантные плазмиды, экспрессирующие капсидные белки после электропорации in vivo , могут индуцировать защитные вирус-специфические антитела (Park, Kim et al., 2009). Новые ловушки вирусных рецепторов были разработаны на основе слитых белков растворимых вирусных рецепторов, которые были способны снижать воспаление миокарда, фиброз и вирусные титры у мышей, инфицированных CVB (Lim, Choi et al., 2006).
Новорожденные пациенты, инфицированные ЭВ, получали лечение иммуноглобулином, хотя немногие исследования показали клиническую эффективность, которая остается спорной на основании низких титров антител и внутритиповых вариаций против определенных серотипов, циркулирующих в сообществе (Abzug, 2004) (Galama, Vogels et al. , 1997). Метод приготовления иммуноглобулинов включает объединение продуктов плазмы от нормальных доноров (Cheng, Chen et al., 2008), и неспецифические противовоспалительные, но защитные реакции могут быть вызваны после внутривенного лечения иммуноглобулином (Ooi, Wong et al., 2010).
Стратегии на основе интерференции
РНК (РНКи) были использованы для ограничения репликации CVB в культуре, а in vivo . Возможность использования РНКи в качестве эффективного противовирусного препарата против РНК-вирусов была впервые показана в 2003 году (Gitlin & Andino, 2003). Основанный на РНКи иммунитет против вирусной инфекции зависит от распознавания Дайсером вирусной дцРНК, образованной во время репликации вируса (Aliyari & Ding, 2009). Было показано, что малые интерферирующие РНК (миРНК), направленные против протеазы 2A, ингибируют инфекцию CVB в клетках HeLa и кардиомиоцитах мышей (Yuan, Cheung et al., 2005). Молекулы миРНК, разработанные для нацеливания на вирусную область 2A CVB, успешно снижали вирусные титры и увеличивали выживаемость у восприимчивых мышей (Merl, Michaelis et al., 2005). Кроме того, молекулы миРНК, разработанные для нацеливания на вирусную область 3C Pro CVB, снижали репликацию вируса без признаков токсичности (Tan, Wong et al., 2010). Основываясь на способности РНК-вирусов быстро развиваться и становиться устойчивыми к молекулам миРНК, другие исследователи объединили три различных противовирусных молекулы миРНК, чтобы ограничить появление мутантов, ускользающих от CVB (Merl & Wessely, 2007).Напротив, нацеливание на хозяина-хозяина-специфические белки может обойти появление мутантов, ускользающих от CVB, но при этом снизить репликацию вируса, например, в клетках, обработанных CAR-специфическими молекулами миРНК (Werk, Schubert et al., 2005).
Рибавирин (1 — (_- d-рибофуранозил) -1H-1,2,4-триазол-3-карбоксамид) представляет собой противовирусное соединение широкого спектра действия, первоначально предложенное в качестве ингибитора нуклеозидов, хотя недавно было показано, что оно действует, действуя как мутаген и вызывающий «катастрофу ошибок» во время репликации EV (Crotty, Maag et al., 2000) (Crotty & Andino, 2002) (Crotty, Cameron et al., 2001) (Vignuzzi, Stone et al., 2006). Ранее мы показали, что рибавирин может улучшить восстановление сырого веса мозга при хронической инфекции ЦНС (Ruller, Tabor-Godwin et al., 2012). Плеконарил, 3- (3,5-диметил-4 ((3- (3-метил-5-изоксазолил) пропил] олу) фенил) -5- (трифторметил) -1,2,4-оксадиазол первоначально был разработан как антипикорнавирусный препарат, который предотвращает прикрепление вирионов к клеткам-хозяевам (Pevear, Tull et al., 1999) (Chen, Weng et al., 2008). Плеконарил оказался эффективным противовирусным соединением против штаммов CVB, содержащих изолейцин или валин в положении 1092 в области VP1, тогда как лейцин в этом положении был связан с устойчивостью (Schmidtke, Hammerschmidt et al., 2005).
Совсем недавно были разработаны новые противовирусные кандидаты против CVB и EV в целом с использованием преимуществ новых открытий, касающихся морфогенеза вирионов. Глутатион (GSH), наиболее распространенный небелковый тиол в животной клетке, был идентифицирован как важный стабилизирующий кофактор во время образования вирионных частиц (Thibaut, van der Linden et al., 2014). Недавно открытый ингибитор TP219 связывает GSH и истощает внутриклеточные запасы, тем самым препятствуя сборке вируса, но не репликации РНК. Были разработаны дополнительные противовирусные кандидаты, такие как 1,2-фтор-4- (2-метил-8- (3- (метилсульфонил) бензиламино) имидазо (1,2-а) пиразин-3-ил) фенол, которые непосредственно ингибируют фосфатидилинозитол-4-киназу, фермент, необходимый для репликации EV (van der Schaar, Leyssen et al., 2013). Кроме того, итраконазол был идентифицирован как ингибитор ЭВ широкого спектра действия, нарушая функции оксистерин-связывающего белка (OSBP) и связанного с OSBP белка 4 (Strating, van der Linden et al., 2015). Было показано, что нокдаун этих белков ингибирует репликацию EV, предотвращая перемещение холестерина и фосфатидилинозитол-4-фосфата между мембранами во время образования органелл репликации вируса.
Флуоксетин, селективный ингибитор обратного захвата серотонина, был идентифицирован путем скрининга библиотек малых молекул как эффективный ингибитор репликации EV (Zuo, Quinn et al., 2012). Кроме того, флуоксетин может проявлять эффективность при хронической инфекции, и недавно было показано, что эта противовирусная молекула «лечит» клетки поджелудочной железы человека, инфицированные в культуре CVB (Alidjinou, Sane et al., 2015). Механизм действия остается неясным, и использование флуоксетина в качестве противовирусного препарата может быть проблематичным из-за его неврологического воздействия на захват серотонина и участия с повышенным риском кровотечения при применении с ингибиторами функции тромбоцитов (Alderman, Moritz et al., 1992). Мы можем ожидать, что некоторые противовирусные препараты будут иметь большую эффективность или побочные эффекты в зависимости от генетических различий между людьми. Концепция молекулярного профилирования хозяина и персонализированная медицина для лечения заболеваний, включая вирусные инфекции, станет важной областью в будущем (Law, Korth et al., 2013). С появлением индуцированных плюрипотентных стволовых клеток (ИПСК) и генерации кардиомиоцитов, полученных из ИПСК, эффективность противовирусных соединений и вирусного миокардита, вызванного CVB, можно количественно оценить на кардиомиоцитах, полученных от пациентов (Sharma, Marceau et al., 2014) .
Расщепление белков-хозяев протеазами CVB
Было показано, что помимо белков-хозяев, необходимых для аутофагии и противовирусного ответа, CVB расщепляет дистрофин, жизненно важный белок в сердце, который поддерживает силу мышечных волокон (Badorff, Berkely et al. ., 2000). Считается, что расщепление дистрофина протеазой 2A вируса CVB после инфекции способствует развитию дилатационной кардиомиопатии после инфекции (Badorff, Lee et al., 1999). Были получены трансгенные мыши с заменой гена дистрофина на вариантный ген, больше не содержащий сайт расщепления вирусной протеазой 2A CVB. Эти трансгенные мыши показали снижение титров сердечного вируса после инфицирования и не страдали дилатационной кардиомиопатией, обычно индуцированной ограниченной кардиомиоцитами экспрессией вирусной протеазы 2A CVB (Lim, Peter et al., 2013).
Нацеливание вирусных протеаз CVB на множественные белки-хозяева демонстрирует невероятную способность РНК-вирусов ограниченного размера конструировать белки, выполняющие множество функций во время репликации. Тем не менее, точное нацеливание на белки хозяина и уклонение от противовирусного иммунного ответа хозяина вирусными протеазами, необходимое для максимальной репликации и распространения вируса, также может ограничивать способность CVB и других EV формировать облако разнообразных квазивидов для быстрой адаптации к новым условиям. .Разработка ингибиторов против протеаз CVB может предоставить возможность ограничить репликацию вируса и уменьшить патологию, связанную с вирусом. Было показано, что растворимый ингибитор протеазы CVB 3C предотвращает кардиомиопатию после инфекции (Lim, Yun et al., 2014).
Устойчивость РНК CVB и хроническое заболевание
Интересно, что стойкие инфекции CVB были связаны с заболеваниями аутоиммунного типа, такими как хронический миокардит (Chapman & Kim, 2008), диабет (Sane, Moumna et al., 2011) и хронические воспалительные процессы. миопатия (Tam, Fontana et al., 2003). Персистенция вируса в тканях-мишенях связана с хроническим заболеванием, хотя механизм персистенции не ясен и может включать постоянное присутствие вирусной РНК, а не активную репликацию вируса. Тем не менее, присутствие вирусной РНК с ограниченной репликацией, как было показано, вносит вклад в процесс заболевания, возможно, после продукции вирусных протеиназ или индукции врожденного иммунитета против вирусного генома (Wessely, Klingel et al., 1998). Многочисленные исследования показывают, что стойкие вирусы, особенно такие как CVB, могут вызывать хронические воспалительные явления, в результате которых аутореактивные Т-клетки стимулируются и секретируют воспалительные цитокины с помощью множества потенциальных механизмов, включая молекулярную мимикрию и активацию стороннего наблюдателя (Oldstone, 1998) (Horwitz, Bradley и другие., 1998). Неясно, какой эффект стойкая инфекция и связанные с ней воспалительные события могут иметь на резидентные клетки-предшественники, во время развития или у взрослых.
Некоторые исследования показали, что отсутствие инфекционного вируса во время персистирующей стадии инфекции указывает на то, что заболевания, связанные с CVB, включая миокардит, возникают через аутоиммунные механизмы. Однако в недавнем исследовании миокардит не смог проявиться у мышей, у которых отсутствует экспрессия CAR конкретно на кардиомиоцитах — предполагая, что миокардит требует инфицирования кардиомиоцитов (Shi, Chen et al., 2009). Поскольку другие ткани, такие как поджелудочная железа, были легко инфицированы в их модели, предполагаемые аутореактивные Т-клетки против сердечных белков могли быть продуцированы, но не появились. Эти результаты ставят под сомнение представление о том, что инфекция CVB вызывает перекрестный иммунный ответ против сердечных белков. Скорее прямая вирусная инфекция, вызывающая повреждение клеток, и сопутствующий вирус-опосредованный иммунный ответ в значительной степени способствуют развитию заболевания в инфицированной сердечной ткани.
Немногие рассматривали возможность того, что РНК-вирусы могут вызывать «латентную» инфекцию с периодической реактивацией — чаще наблюдаемую для ретровирусов или ДНК-вирусов семейства Herpesviridae (Feuer, Ruller et al., 2009) (Feuer & Whitton, 2008). Мы ранее опубликовали исследования, предполагающие, что CVB остается в «латентном» состоянии в покоящихся клетках тканевых культур (Feuer, Mena et al., 2004) (Feuer, Mena et al., 2002). Кроме того, CVB легко устанавливает инфекцию в состоянии носителя в клетках, выращенных в культуре, включая клетки HL-1 и NPC, непрерывно пассированные в культуре (Pinkert, Klingel et al., 2011) (Tsueng, Tabor-Godwin et al., 2011) ( Tsueng, Rhoades et al., 2014). Мы предполагаем, что нейрогенные области ЦНС могут поддерживать стойкую инфекцию CVB, а реактивация вируса может происходить в результате периодической экспансии и пролиферации клеток-предшественников (Rhoades, Tabor-Godwin et al., 2011).
Вирусы с геномами на основе РНК, как правило, менее стабильны, хотя некоторые РНК-вирусы, возможно, разработали сложные стратегии стабилизации путем ограничения распада РНК (Iwakawa, Mizumoto et al., 2008) или образования двухцепочечных комплексов РНК (Tam & Messner, 1999). Молекулярный механизм персистенции CVB с ограниченной репликацией вируса в сердце и поджелудочной железе может включать образование нецитолитических вариантов, несущих 5’-концевые мутации и делеции (Lee, Kono et al., 2005) (Kim, Tracy et al., 2005) (Chapman & Kim, 2008) (Chapman, Kim et al., 2008) (Tracy, Smithee et al., 2015). Спорадическая экспрессия вирусных белков во время персистенции CVB в отсутствие значительной вирусной репликации может, тем не менее, привести к хроническому иммунному ответу и иммунопатологии (Whitton & Feuer, 2004).
Недавние исследования показали клиническую опасность подавления гуморального иммунного ответа моноклональными антителами к CD20, такими как ритуксимаб. Лечение ритуксимабом обычно назначают пациентам, страдающим лимфомами, лейкемиями, отторжением трансплантата и некоторыми аутоиммунными заболеваниями.Однако количество историй болезни, описывающих менингоэнцефалит ЭВ после лечения ритуксимабом, увеличивается (Servais, Caers et al., 2010; Schilthuizen, Berenschot et al., 2010). Зависимая от В-клеток иммуносупрессия после введения ритуксимаба в качестве терапии лимфом или лейкозов естественным образом снижает уровень циркулирующих антител против CVB. Если эти защитные антитела подавляют репликацию CVB в тканях-мишенях, таких как ЦНС, несущая стойкую вирусную РНК, менингоэнцефалит может быть исходом для некоторых пациентов (Kiani-Alikhan, Skoulidis et al., 2009).
Паспорта безопасности патогенов: инфекционные вещества — Coxsackievirus
РАЗДЕЛ I — ИНФЕКЦИОННЫЙ АГЕНТ
НАЗВАНИЕ: Coxsackievirus
СИНОНИМ ИЛИ ПЕРЕКРЕСТНАЯ ССЫЛКА: Пикорнавирус, энтеровирус, вирус Коксаки группы A (серотипы 1-22 и 24), вирус Коксаки группы B (серотипы 1-6), энтеровирусный везикулярный фарингит (герпангина), энтеровирусный везикулярный стоматит с экзантемой и заболевание ротовой полости), энтеровирусный лимфоузловой фарингит (острый лимфоузловой фарингит), болезнь Борнхольма (синонимы: эпидемическая миалгия, эпидемическая плевродиния, болезнь Сильвеста, болезнь Бэмбла и дьявольская хватка) Footnote 1Footnote 2 .
ХАРАКТЕРИСТИКИ: Икосаэдрические, безоболочечные, линейные одноцепочечные вирусы с положительной смысловой РНК семейства Picornaviridae и Enterovirus рода Footnote 1Footnote 3 .
РАЗДЕЛ II — ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
ПАТОГЕННОСТЬ / ТОКСИЧНОСТЬ: Большинство инфекций протекают бессимптомно и проходят самостоятельно; тем не менее, инфекции могут приводить к множеству редких состояний, некоторые из которых опасны для жизни. Сноска 1 Сноска 2. Клиническое течение может варьироваться в пределах и между штаммами вируса Коксаки Сноска 1 Сноска 2 Сноска 4 .
Сопутствующие состояния, связанные с вирусом Коксаки, группа А: ящур, герпангина, острый лимфатический или узловой фарингит, асептический менингит, паралич, экзантема, ящур и ящур (A10, A16), пневмонит младенцев » простуда », гепатит, детская диарея, острый геморрагический конъюнктивит (A24) Footnote 1Footnote 5 .
Состояния, ассоциированные с вирусом Коксаки группы B: диабет, плевродиния, асептический менингит, паралич, тяжелая системная инфекция у младенцев, менингоэнцефалит, миокардит, перикардит, заболевания верхних дыхательных путей и пневмония, сыпь, гепатит и панкреатит, сноска 1Footnote 6-8.Недифференцированное лихорадочное заболевание и вирусный паркинсонизм также могут быть связаны с инфекцией группы В, вызванной вирусом Коксаки; однако они более спорны.
Наиболее распространенными состояниями, требующими госпитализации, являются:
Заболевание рук и ног: характеризуется лихорадкой и пузырьками во рту и конечностях, болью в горле, лихорадкой и анорексией. Footnote 5 . Обычно самоограничение и требует только симптоматического лечения. Footnote 5 .
Асептический менингит / менингоэнцефалит: наиболее частый клинический синдром, связанный с энтеровирусами, требующий медицинской помощи. Footnote 1 .Вирус вызывает небактериальное воспаление мозговых оболочек, связанное с лихорадкой, головной болью, светобоязнью и без явного поражения паренхимы. Footnote 1 . Инфекция может прогрессировать до менингоэнцефалита с инфицированием паренхимы, характеризующимся нарушением сознания, очаговыми неврологическими признаками и судорогами. Footnote 1 . В то время как тяжелое менингеальное заболевание обычно проходит само по себе, зарегистрированы случаи смерти. Footnote 1 .
Миокардит и дилатационная кардиомиопатия: миокардит — это воспаление миокарда, связанное с повреждением, которое не связано с ишемическим повреждением. Если инфекция / воспаление сохраняется, синдром может прогрессировать до дилатационной кардиомиопатии (при которой сердце увеличено), потенциально приводящей к сердечной недостаточности [ очень редко] Footnote 1Footnote 7 .
ЭПИДЕМИОЛОГИЯ: Вирусы Коксаки распространены по всему миру, и инфекции преобладают летом и осенью, спорадические случаи встречаются круглый год. Footnote 2Footnote 5 . Инфицированы все возрастные группы, но маленькие дети более восприимчивы к инфекции. Например, вирусный менингит у младенцев встречается в 5-8 раз чаще, чем у взрослых. Footnote 2 .
ДИАПАЗОН ХОЗЯЙСТВА: Человек, обезьяна, мышь Сноска 1 .
ИНФЕКЦИОННАЯ ДОЗА: Неизвестно; однако было показано, что 15-50 TCID50 заразны у взрослых добровольцев. Примечание 9.
СПОСОБ ПЕРЕДАЧИ: Заражение происходит при контакте с инфекционными выделениями или выделениями и последующей аутоинокуляцией в рот, нос или глаза. Сноска 1 . Вполне возможно, что употребление загрязненной воды может способствовать заражению. Footnote 1 . Интраназальная и аэрозольная передача возможна для некоторых вариантов через загрязненные респираторные выделения. Footnote 1Footnote 9Footnote 10 . Попав внутрь организма, вирусы Коксаки реплицируются в лимфоидных тканях, а затем распространяются в крови. Footnote 2 .
ПЕРИОД ИНКУБАЦИИ: Варьируется от дней (например, ящура рук и рта) до лет (например, миокардит), в зависимости от клинического течения Footnote 5Footnote 7Footnote 8 .
СВЯЗЬ: Передача от человека к человеку может происходить легко оральным, глазным, респираторным или фекально-оральным путями Footnote 1Footnote 9Footnote 10 .
РАЗДЕЛ III — РАСПРОСТРАНЕНИЕ
РЕЗЕРВУАР: Человек Сноска 1 .
ЗООНОЗ: Нет.
ВЕКТОРОВ: Нет.
РАЗДЕЛ IV — УСТОЙЧИВОСТЬ И ЖЕСТКОСТЬ
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ / УСТОЙЧИВОСТЬ: В настоящее время противовирусные препараты не одобрены. Хотя Плеконарил® использовался в клинических испытаниях для лечения тяжелых инфекций, вызванных вирусом Коксаки, они не показали значительного воздействия на заболеваемость или смертность. Footnote 4Footnote 11 .
УСТОЙЧИВОСТЬ / УСТОЙЧИВОСТЬ К ДЕЗИНФЕКЦИОННЫМ СРЕДСТВАМ: Чувствительность к формальдегиду, глютеральдегиду, сильным кислотам, гипохлориту натрия (отбеливателю) и свободному остаточному хлору. Footnote 1Footnote 12 .Чувствительность зависит от достаточной концентрации, pH и времени контакта и снижается в присутствии посторонних органических материалов. Footnote 1 . Инфекционные вирусы обычно устойчивы ко многим распространенным лабораторным дезинфицирующим средствам, включая 70% этанол, изопропанол, разбавленный лизол и соединения четвертичного аммония. Footnote 1Footnote 13 . Нечувствительность к липидным растворителям, включая эфир и хлороформ. Footnote 1 . Стабильно ко многим моющим средствам при температуре окружающей среды. Footnote 1 .
ФИЗИЧЕСКАЯ ИНАКТИВАЦИЯ: Чувствительность к УФ-опосредованной инактивации Footnote 1 . Условия сушки снижают вирусные титры, степень которых зависит от пористости поверхности и присутствия посторонних органических веществ. Footnote 1 . Большинство из них легко инактивируются при 42 ° C, но стабильность и термостойкость повышаются в присутствии сульфидных восстановителей и катионов магния. Footnote 1 .
ВЫЖИВАНИЕ ВНЕ ХОЗЯЙСТВА: Может выживать месяцами в благоприятных условиях нейтрального pH, влажности и низкой температуры; усиливается присутствием органических веществ. Примечание 1.Выживание было документально подтверждено в морепродуктах из источников воды с вирусом Коксаки в течение 3 недель при температурах от 1 ° C до 20 ° C. Footnote 1Footnote 14 .
РАЗДЕЛ V — ПЕРВАЯ ПОМОЩЬ / МЕДИЦИНСКАЯ
НАБЛЮДЕНИЕ: Наблюдение за симптомами; подтвердить серологическим исследованием, выделением вируса или ПЦР из поражений или образцов из носоглотки и кала. Сноска 2 Сноска 11. Использование вирусных культур сокращается, поскольку не все серотипы будут хорошо расти в культуре. Молекулярное типирование в значительной степени заменило серотипирование.
Примечание. Не все методы диагностики доступны во всех странах.
ПЕРВАЯ ПОМОЩЬ / ЛЕЧЕНИЕ: Специального лечения не существует. Сноска 1 Сноска 11 .
ИММУНИЗАЦИЯ: Общей вакцины нет; однако один из них находится в стадии разработки для болезни сердца, вызванной вирусом Коксаки. Footnote 3Footnote 11 .
ПРОФИЛАКТИКА: Нет.
РАЗДЕЛ VI — ЛАБОРАТОРНЫЕ ОПАСНОСТИ
ИНФЕКЦИИ, ПОЛУЧЕННЫЕ В ЛАБОРАТОРИИ: Ответственный за 39 зарегистрированных случаев до 2006 г. Сноска 15-17 .
ИСТОЧНИКИ / ОБРАЗЦЫ: Мазки из горла, ректальные мазки, образцы кала, цереброспинальные жидкости при асептическом менингите Сноска 2 Сноска 16 Сноска 17 .
ОСНОВНЫЕ ОПАСНОСТИ: Проглатывание или вдыхание аэрозолей, контакт слизистых оболочек с инфекционными агентами Сноска 1 Сноска 2 Сноска 9 Сноска 10 .
ОСОБЫЕ ОПАСНОСТИ: Нет.
РАЗДЕЛ VII — КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
КЛАССИФИКАЦИЯ ГРУПП РИСКА: Группа риска 2 Сноска 18 .
ТРЕБОВАНИЯ К СРЕДЕ : Помещения, оборудование и операционные методы Уровня 2 для работы с инфекционными или потенциально инфекционными материалами, животными или культурами.
ЗАЩИТНАЯ ОДЕЖДА : Лабораторный халат. Перчатки при неизбежном прямом контакте кожи с инфицированными материалами или животными. При наличии известного или потенциального риска воздействия брызг необходимо использовать средства защиты глаз. Footnote 19 .
ДРУГИЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ : Все процедуры, которые могут привести к образованию аэрозолей, или связаны с высокими концентрациями или большими объемами, должны проводиться в шкафу биологической безопасности ( BSC ).Использование игл, шприцев и других острых предметов должно быть строго ограничено. Дополнительные меры предосторожности следует учитывать при работе с животными или крупномасштабной деятельности. Footnote 19 .
РАЗДЕЛ VIII — ОБРАЩЕНИЕ И ХРАНЕНИЕ
РАЗЛИВЫ : Дайте аэрозолям осесть и, надев защитную одежду, аккуратно накройте разлив бумажными полотенцами и нанесите соответствующее дезинфицирующее средство, начиная с периметра и двигаясь к центру. Прежде чем приступить к очистке, дайте достаточно времени для контакта. Footnote 19 .
УТИЛИЗАЦИЯ : Обеззараживайте все отходы, которые содержат или вступили в контакт с инфекционным организмом, с помощью автоклава, химической дезинфекции, гамма-облучения или сжигания перед утилизацией. Footnote 19 .
ХРАНЕНИЕ : Инфекционный агент должен храниться в герметичных контейнерах, имеющих соответствующую маркировку Сноска 19 .
РАЗДЕЛ IX — НОРМАТИВНАЯ И ДРУГАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ: Импорт, транспортировка и использование патогенных микроорганизмов в Канаде регулируется многими регулирующими органами, включая Агентство общественного здравоохранения Канады, Министерство здравоохранения Канады, Канадское агентство по инспекции пищевых продуктов, Министерство окружающей среды Канады и Министерство транспорта Канады.Пользователи несут ответственность за соблюдение всех соответствующих законов, постановлений, руководств и стандартов.
ОБНОВЛЕНО: ноябрь 2011
ПОДГОТОВЛЕНО: Управление по регулированию патогенов, Агентство общественного здравоохранения Канады
Хотя информация, мнения и рекомендации, содержащиеся в этом Паспорте безопасности патогенов, собраны из источников, которые считаются надежными, мы не несем ответственности за точность, достаточность или надежность, а также за любые убытки или травмы, возникшие в результате использования информации.Часто обнаруживаются новые опасности, и эта информация может быть не полностью актуальной.
Авторские права © Агентство общественного здравоохранения Канады, 2011 г.
Вспышка болезни рук, ягодиц и рта в Китае
Вспышка болезней рук, ягодиц и рта в Китае привела к 41 000 инфекциям и 18 смертельным исходам в этом году. Что это за болезнь и что ее вызывает?
Болезнь рук, ног и рта (HFMD) — довольно распространенная вирусная инфекция у детей. Только в Китае в 2007 году было зарегистрировано 80 000 случаев заболевания.Заболевание встречается повсеместно, проявляя сезонность (лето, начало осени) в умеренном климате. Это вызвано представителями рода энтеровирусов, вирусом Коксаки A10 и A16 или энтеровирусом типа 71, вирусами, относящимися к полиовирусу. Вирионы состоят из РНК с положительным смыслом, окруженной капсидом, состоящим из четырех различных вирусных белков. Преобладающим вирусом во время вспышки 2007 года в Китае был энтеровирус типа 71. Идентификация вируса, вызвавшего текущую вспышку, неизвестна, но энтеровирус 71 уже был идентифицирован у нескольких пациентов.
HFMD обычно передается при тесном контакте с инфицированным человеком. Он начинается с неспецифических симптомов, таких как лихорадка и недомогание, а за ним следует образование язвочек на языке, деснах и внутренней стороне щек. Затем появляется кожная сыпь на руках и подошвах ног. Инфекция передается другим людям с помощью вируса, который присутствует в глоточных выделениях, слюне и жидкости из волдырей на коже.
Вспышки HFMD обычно затрагивают детей, поскольку они не обладают иммунитетом к инфекции, а также потому, что физическое взаимодействие детей способствует передаче инфекции, особенно в летние месяцы, когда игры на открытом воздухе являются обычным явлением.Заболевание гораздо реже встречается у взрослых, потому что они защищены иммунитетом, полученным от детской инфекции.
HFMD — острая вирусная инфекция, которая проходит в течение 1-2 недель. Заболевание, вызванное вирусами Коксаки, обычно протекает без осложнений. Однако энтеровирус 71 может попасть в центральную нервную систему, где он может вызвать энцефалит или полиомиелитный паралич. Как вирус попадает на этот сайт, неизвестно. По аналогии с полиовирусом мы предполагаем, что вирус попадает в кровоток — возможно, после репликации в кишечнике — а затем попадает в спинной мозг.Этот вирус стал значительным неврологическим патогеном на Тайване.
Нет доступных вакцин или противовирусных препаратов для лечения HFMD, и мало исследований проводится в отношении вирусов, вызывающих это заболевание. Эта ситуация, вероятно, изменится с появлением энтеровируса 71 как наиболее значимого нейротропного энтеровируса в некоторых регионах мира.
Zhang, Y., Tan, X., Wang, H., Yan, D., Zhu, S., Wang, D., Ji, F., Wang, X., Gao, Y., & Chen, L . (2009). Вспышка заболеваний рук, ног и рта, связанных с субгенотипом C4 энтеровируса человека 71, в Шаньдуне, Китайский журнал клинической вирусологии, 44 (4), 262-267 DOI: 10.1016 / j.jcv.2009.02.002
QIU, J. (2008). Инфекция, вызванная энтеровирусом 71: новая угроза общественному здоровью во всем мире? The Lancet Neurology, 7 (10), 868-869 DOI: 10.1016 / S1474-4422 (08) 70207-2
Арита, М., Вакита, Т., и Симидзу, Х. (2008). Характеристика фармакологически активных соединений, которые ингибируют инфекционность полиовируса и энтеровируса 71 Journal of General Virology, 89 (10), 2518-2530 DOI: 10.1099 / vir.0.2008 / 002915-0
Протеаза 2A вызывает образование стрессовых гранул при инфицировании вирусом Коксаки B3 и энтеровирусом 71 | Virology Journal
Клеточные линии и вирусы
Клетки HeLa выращивали в среде Игла, модифицированной Дульбекко (DMEM) (Invitrogen, Carlsbad, CA), с добавлением 8% (питательная среда) или 5% (поддерживающая среда) фетальной бычьей сыворотки (FBS) (Биологическая промышленность Израиля).Клеточная линия HeLa, стабильно экспрессирующая EGFP-TIA1, была создана, как описано ранее [27]. Клетки HeLa культивировали в 12-луночных планшетах примерно до 60% слияния и трансфицировали плазмидой pEGFP-TIA1 с использованием Lipofectamine 2000 (Invitrogen). Затем клетки выращивали в среде, содержащей G418 (500 мкг / мл). Мы заменяли культуральную среду каждые 2 дня, пока не наблюдались колонии. Мы приобрели стабильную клеточную линию HeLa EGFP-TIA1 через 8 недель отбора. Клетки HeLa EGFP-TIA1 , стабильно экспрессирующие EGFP-TIA1, выращивали в среде DMEM, содержащей 10% FBS и 500 мкг / мл G418.Штамм CVB3 Woodruff пассировали в клетках HeLa и титровали с помощью анализов бляшек, как описано ранее [28]. Штамм EV71 BrCr был пассирован в клетки Vero и титрован с использованием анализа 50% -ной инфицирующей дозы культуры ткани (TCID50), как описано в нашем предыдущем исследовании [29].
Конструирование плазмиды
Плазмида, экспрессирующая EGFP-tagged TIA1 или eIF4G, была сконструирована в нашей лаборатории. Сначала последовательность, кодирующую EGFP, получали из pEGFP-N1 (Clontech, Mountain View, CA) с помощью полимеразной цепной реакции (ПЦР).Ампликоны pcDNA3.1 (Invitrogen) и EGFP переваривали Nhe I и Hind III, а затем лигировали при 16 ° C в течение ночи с лигазой Т4. Полученная плазмида была обозначена как pEGFP-C1. КДНК TIA1 и eIF4G амплифицировали с помощью ПЦР с обратной транскрипцией (RT-PCR) из экстрактов РНК, полученных из клеток HeLa с использованием реагентов TRIzol (Invitrogen), а затем клонировали в pEGFP-C1. Полученные плазмиды были обозначены как pEGFP-TIA1 и pEGFP-eIF4G соответственно. Точно так же плазмида pmCherry-HuR, кодирующая гибридный белок HuR и красный флуоресцентный белок mCherry, была сконструирована на основе pmCherry-C1 (Clontech).Плазмиды были подтверждены секвенированием ДНК. Праймеры для амплификаций перечислены в Дополнительном файле 1: Таблица S1.
Девять плазмид, экспрессирующих EGFP-tagged VP1, VP4-VP2-VP3, 2A pro , 2B, 2C, 3A, 3B, 3C pro или 3D CVB3, были сконструированы, как описано ранее [28], [30] и обозначены как pEGFP-VP1, pEGFP-VP4-3, pEGFP-2A, pEGFP-2B, pEGFP-2C, pEGFP-3A, pEGFP-3B, pEGFP-3C и pEGFP-3D соответственно. Праймеры перечислены в Дополнительном файле 1: Таблица S2 и Таблица S3.
Сайт-направленный мутагенез
Восемь мутантов CVB3 2A pro , в том числе 2A D39E , 2A L40F , 2A S67F , 2A Y89L , 2A Y90L , 2A V120M , 2A G122E и 2A D136N были созданы с помощью ПЦР с перекрытием. Вкратце, для создания 2A D39E ДНК pEGFP-2A амплифицировали с помощью смыслового праймера 2A и антисмыслового праймера 2A D39E , а также смыслового праймера 2A D39E и антисмыслового праймера 2A, соответственно (дополнительный файл 1: Таблица S3) .Продукты ПЦР очищали и смешивали. Смесь амплифицировали смысловым и антисмысловым праймерами 2А. Полученную ДНК расщепляли Hind III и Xba I и вставляли в сайт клонирования pEGFP-C1. Эти плазмиды были обозначены как pEGFP-2A D39E , pEGFP-2A L40F , pEGFP-2A S67F , pEGFP-2A Y89L , pEGFP-2A Y90L , pEGFP-2A V120M A, pEGFP-2A V120M A, pEGFP-2A V120M A. G122E и pEGFP-2A D136N соответственно.Расщепленные фрагменты смешивали и лигировали с pEGFP-C1 / Hind III + Xba I. Все плазмиды подтверждали секвенированием ДНК.
Трансфекция
Для вирусной инфекции клетки HeLa высевали в 24-луночные планшеты и выращивали до примерно 60% конфлюэнтности. Затем клетки котрансфицировали 0,1 мкг pmCherry-HuR и 0,5 мкг pEGFP-C1 или pEGFP-eIF4G, используя 1 мкл Lipofectamine 2000 (Invitrogen) на лунку. Для экспрессии вирусных белков клетки высевали в 24-луночные планшеты и выращивали до примерно 70% конфлюэнтности.Затем клетки котрансфицировали 0,3 мкг pmCherry-HuR и 0,3 мкг плазмиды, кодирующей EGFP-tagged CVB3 2A pro , 2B, 2C, 3A, 3B, 3C pro , 3D, VP1, VP4-VP2-VP3, 2A. D39E , 2A L40F , 2A S67F , 2A Y89L , 2A Y90L , 2A V120M , 2A G122E или 2A D136N ; EV71 2A pro ; или пустой вектор pEGFP-C1. Через пять часов культуральные среды были удалены и заменены свежими. Изображения получали с использованием флуоресцентного микроскопа Axiovert 200 (Carl Zeiss, Геттинген, Германия) через 24 часа после трансфекции.Некоторые клетки высевали в 48-луночные планшеты и трансфицировали плазмидой, кодирующей EGFP-tagged CVB3 2A pro , 2A G122E или 3C pro . Контрольные клетки трансфицировали pEGFP-C1. Через 24 часа после трансфекции клетки фиксировали для иммунофлуоресцентного анализа HuR и G3BP1. Для исследования расщепления eIF4G клетки HeLa трансфицировали плазмидой, кодирующей EGFP-меченый CVB3 2A pro , 2A D39E , 2A L40F , 2A S67F , 2A Y89L , 2A Y90L 120, 2A , 2A G122E или 2A D136N .Клетки собирали через 24 часа после трансфекции. Лизаты целых клеток подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттингу.
Вирусная инфекция
Клетки HeLa EGFP-TIA1 были ложно инфицированы или инфицированы CVB3 или EV71 при умножении инфекции (MOI) 10. Через 3 ч после инфицирования клетки HeLa EGFP-TIA1 были зафиксированы для иммунофлуоресцентные анализы. Клетки HeLa, котрансфицированные pmCherry-HuR и pEGFP-C1, или pEGFP-eIF4G, или pEGFP-eIF4G G681E , были ложно инфицированы или инфицированы CVB3 (MOI = 10).Через 3, 4 или 6 часов p.i. клетки промывали один раз фосфатно-солевым буфером (PBS) и обрабатывали для визуализации с использованием флуоресцентного микроскопа Axiovert 200.
Обработка арсенитом (Ars)
Ars широко используется в качестве стимулятора SG [2]. Для индукции SG клетки обрабатывали арсенитом натрия (NaArs) (Sigma-Aldrich, Сент-Луис, Миссури) в концентрации 0,5 мМ в среде для выращивания в течение 30 мин.
Иммунофлуоресценция
После вирусной инфекции, обработки Ars или трансфекции плазмиды, как описано выше, клетки промывали один раз PBS, а затем фиксировали 4% параформальдегидом при комнатной температуре в течение 30 минут.Клетки обрабатывали 0,25% Triton X-100 в течение 10 минут и блокировали PBS, содержащим 1% бычий сывороточный альбумин (BSA), в течение 30 минут при комнатной температуре. Затем клетки инкубировали в течение ночи при 4 ° C с первичным антителом, разведенным в блокирующем буфере, и с вторичным антителом в течение 2 часов при комнатной температуре в темноте. G3BP1 детектировали с помощью моноклонального антитела против G3BP1 (611126, BD Transduction Labs, Сан-Хосе, Калифорния) в разведении 1: 200 и меченного CF555 козьего вторичного антитела против мыши (20231, Biotium, Hayward, CA) при разведение 1: 1000.HuR детектировали с помощью поликлонального антитела (11910-1-AP, Proteintech Group Inc., Чикаго, Иллинойс) в разведении 1: 200 и меченного CF555 вторичного антитела против кролика (20232, Biotium) в разведении 1 : 1000. Затем клетки трижды промывали PBS и окрашивали Hoechst 33342 (0,4 мкг / мл в PBS). Изображения получали с помощью флуоресцентного микроскопа Axiovert 200.
Вестерн-блоттинг
Белки экстрагировали из обработанных клеток с использованием буфера Pierce RIPA с коктейлем PMSF.Приблизительно 2 мкг экстрагированных белков наносили на SDS-PAGE. Разделенные белки переносили на мембрану из поливинилиденфторида (PVDF) (0,45 мкм, Millipore, Billerica, MA), которую блокировали 5% обезжиренным молоком в течение 2 ч при 37 ° C и инкубировали с первичным антителом в течение ночи при 4 ° C. Поликлональное кроличье антитело против eIF4G (15704-1-AP, Proteintech Group Inc.) было разведено 1: 1000 для обнаружения eIF4G; поликлональное антитело против β-актина (sc-130301, Santa Cruz Biotechnology, Санта-Круз, Калифорния) было разведено 1: 1000 для обнаружения β-актина.После стандартной промывки мембрану инкубировали с меченным пероксидазой хрена (HRP) вторичным антителом (Zhongshan Goldenbridge Biotech, Пекин, Китай) в течение 1 ч при комнатной температуре и снова промывали. Блоты окрашивали с использованием набора Super Signal (Pierce, Rockford, IL) и отображали с помощью камеры с зарядовой связью LAS4000 (Fujifilm, Tokyo, Japan). Β-актин использовали в качестве контроля нагрузки.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Протеаза 2A вызывает образование стрессовых гранул при инфекциях, вызванных вирусом Коксаки B3 и энтеровирусом 71.
ИССЛЕДОВАНИЯ Открытый доступ
Протеаза 2A вызывает образование стрессовых гранул при инфицировании вирусом Коксаки B3 и энтеровирусом 71
Шо Ву1, Ян Ван1, Лексун Линь1, Сяонин Си1, Тяньин Ван1, Сяоянь Чжун1, Лэй Тонг1, Ин Луань1, Ян Чен1, Сяоюй Ли3, Фэнминь Чжан1, Венран Чжао2 * и Чжаохуа Чжун1 *
Аннотация
Предпосылки: Стресс-гранулы (SG) представляют собой гранулированные агрегаты в цитоплазме, которые образуются в различных стрессовых ситуациях, включая вирусную инфекцию.Предыдущие исследования показали, что полиовирус, член Picornaviridae, может вызывать образование SG. Однако точный механизм, с помощью которого пикорнавирусы вызывают образование SG, неизвестен. Метод. Локализацию маркеров SG в клетках, инфицированных вирусом Коксаки B3 (CVB3) или энтеровирусом 71 (EV71), и в клетках, экспрессирующих каждый вирусный белок, определяли с помощью иммунофлуоресцентных анализов или плазмидной трансфекции. Восемь плазмид, экспрессирующих мутанты протеазы 2A (2Apro) CVB3, были созданы с использованием стратегии сайт-направленного мутагенеза.Эффективность расщепления eIF4G с помощью CVB3 2Apro и его мутантов определяли с помощью анализов вестерн-блоттинга.
Результаты: В этом исследовании мы обнаружили, что инфекция CVB3 индуцировала образование SG, о чем свидетельствует совместная локализация некоторых принятых маркеров SG в гранулах, вызванных вирусной инфекцией. Кроме того, мы определили, что 2Apro из CVB3 был ключевым вирусным компонентом, который запускал образование SG. Мутант 2Apro с мутацией G122E, который демонстрирует очень низкую эффективность расщепления в отношении eIF4G, значительно ослабляет его способность к индукции SG, указывая на то, что протеазная активность необходима для 2Apro, чтобы инициировать образование SG.Наконец, мы наблюдали, что SG также образуются в клетках, инфицированных EV71. Экспрессии только EV71 2Apro было достаточно, чтобы вызвать образование SG. Заключение: инфекции CVB3 и EV71 могут индуцировать образование SG, и 2Apro играет решающую роль в индукции образования SG во время этих инфекций. Это открытие может помочь нам лучше понять, как пикорнавирусы инициируют ответ SG.
Ключевые слова: стрессовая гранула, протеаза 2A, вирус Коксаки B, энтеровирус 71
Фон
Стресс-гранулы (SG) представляют собой гранулированные агрегаты, образующиеся в цитоплазме эукариотических клеток, подверженных различным стрессовым условиям окружающей среды, например.ж., тепловой шок, УФ-облучение, гипоксия, стресс эндоплазматического ретикулума и вирусная инфекция [1,2]. SG обычно содержат трансляционно молчащие мРНК, 40S рибосомные субъединицы, факторы эукариотической инициации (eIFs), такие как eIF4E, eIF4G, eIF4A, eIF4B, eIF3 и eIF2, и РНК-связывающие белки (RBP), включая
* Для переписки: [email protected]; [email protected] 2 Кафедра клеточной биологии, Харбинский медицинский университет, Харбин 150081, Китайское отделение микробиологии, Харбинский медицинский университет, Харбин 150081, Китай
Полный список информации об авторах доступен в конце статьи
Bio Med Central
поли (A) -связывающий белок (PABP1), эмбриональный летальный патологический вид (ELAV), белок Hu (HuR), полисомальная рибонуклеаза 1 (PMR-1), тристетрапролин (TTP), внутриклеточный антиген 1, ограниченный Т-клетками (TIA1) ), TIA-1-родственный белок (TIAR), ломкий X-белок умственной отсталости (FMRP) и Sh4-связывающий белок Ras-Gap (G3BP1) [1,2].Среди этих задействованных белков HuR, TIA1 и G3BP1 могут действовать как маркеры SG [1-4].
Было показано, что многочисленные вирусы взаимодействуют с SG с различными эффектами [5-7]. Некоторые вирусы индуцируют стабильное образование SG во время инфекции, например респираторно-синцитиальный вирус (RSV). Некоторые вирусы, например ортореовирусы млекопитающих (MRV), вирусы леса Семлики (SFV) и вирусы гепатита C (HCV), вызывают индукцию SG
.
© 2014 Wu et al .; лицензиат BioMed Central Ltd.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/4.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа правильно зачислен. Отказ Creative Commons Public Domain Dedication (http://creativecommons.org/publicdomain/zero/1.0/) распространяется на данные, представленные в этой статье, если не указано иное.
, но разбирать эти гранулы по мере распространения инфекции.Полиовирус (PV) индуцирует образование SG на ранней стадии инфицирования, а затем ингибирует SG посредством вирусного 3Cpro-опосредованного расщепления G3BP1. Между тем, TIA1-содержащие очаги, лишенные других SG-определяющих компонентов, таких как факторы инициации и большинство мРНК, наблюдались на поздней стадии постинфекции. Было обнаружено, что некоторые вирусы, например вирус Западного Нила (WNV), вирус денге (DV), ротавирус резуса (RRV), вирусы Т-клеточного лейкоза человека 1 типа (HTLV-1) и вирусы иммунодефицита человека (ВИЧ), способны для подавления образования SG [5-7].Кардиовирусы с мутантными лидерными белками (L), такими как вирус мышиного энцефаломиелита Тейлера (TMEV), вирус энцефаломиокардита (EMCV) и вирус Саффолда (SAFV), индуцируют образование SG на протяжении всей инфекции, в то время как экспрессия белка L во время инфекции эффективно блокирует образование SG. Точно так же инфекция вируса гриппа A (IAV) не может индуцировать SG, если не используются вирусы с мутациями NS1 [5-9]. В некоторых случаях SG играют важную роль в противовирусной защите хозяина, например, IAV, MRV и вирус коровьей оспы (VV).Однако SG, индуцированные RSV, могут способствовать репликации вируса [5-7].
Вирусы Коксаки группы B (CVB) являются основными возбудителями вирусного миокардита человека и дилатационной кардиомиопатии [10,11]. Энтеровирус 71 (EV71) является основным возбудителем болезней рук, ног и рта человека (HFMD) [12]. И CVB, и EV71 принадлежат к роду энтеровирусов семейства Picornaviridae. Геном пикорнавируса представляет собой одноцепочечную позитивно-смысловую РНК (+ оцРНК) размером от ~ 7,0 т.п.н. до 8,5 т.п. 3 ‘фланги.Геном может действовать как мРНК, кодирующая полипротеин, который протеолитически процессируется вирусными протеиназами в структурные и неструктурные белки [13]. Пикорнавирусы вызывают множественные изменения в клетках-хозяевах, чтобы облегчить его репликацию. Подавление клеточного биосинтеза вирусными протеиназами 2A (2Apro) и 3C (3Cpro) является одним из наиболее заметных изменений [13-17]. При расщеплении eIF4G, eIF5B и PABP 3Cpro и 2Apro пикорнавирузы могут отключать кэп-зависимую трансляцию и прекращать клеточный биосинтез [13-17].Кроме того, через расщепление белков комплекса ядерных пор (Nups), 2Apro может изменять РНК и перенос белков между ядром и цитоплазмой [13]. Недавнее сообщение показывает, что 2Apro из PV, члена Picornaviridae, может вызывать драматическую локализацию в ядерной цитоплазме SRp20, фактора клеточного сплайсинга, который также определяется как транс-действующий фактор IRES (ITAF) [18].
Недавние исследования показывают, что PV индуцирует уникальные SG в инфицированных клетках [19-21]. PV-индуцированные SG содержат определенные компоненты, которые не локализуются в SG, вызванных окислительным стрессом, например.г., Sam68 и SRp20 [20,22]. Однако точный механизм, с помощью которого пикорнавирус индуцирует образование SG, неизвестен. В этом исследовании мы подтвердили, что CVB типа 3 (CVB3) и EV71 также индуцируют SG
формирование. Мы обнаружили, что 2Apro играет решающую роль в индукции SG, поскольку одного 2Apro достаточно для запуска образования SG. Наши результаты могут помочь нам лучше понять механизм, с помощью которого пикорнавирусы инициируют образование SG.
Результаты
Инфекция CVB3 вызывает образование SG
Чтобы облегчить наблюдение за образованием SG во время инфекции CVB3, мы сконструировали клеточную линию HeLa (HeLaEGFP-TIA1),
, конститутивно экспрессирующий EGFP-TIA1.Формирование SG было сначала определено путем наблюдения за экспрессией и локализацией TIA1 и HuR. Клетки HeLaEGFP-TIA1 инфицировали CVB3 (MOI = 10) или обрабатывали 0,5 мМ NaAr в течение 30 мин. В клетках, подвергнутых ложной обработке, EGFP-TIA1 распределялся как в цитоплазме, так и в ядре. В обработанных Ars и инфицированных CVB3 клетках EGFP-TIA1 был гранулярно распределен в цитоплазме. Гранулы начали появляться в цитоплазме клеток, инфицированных CVB3, через 3 часа после инфицирования (p.i.) (Рисунок 1).
Используя антитело против HuR или против G3BP1, мы обнаружили, что HuR преимущественно локализовался в ядре ложно инфицированных клеток, но повторно локализовался в цитоплазматических гранулах после обработки Ars и инфекции CVB3 (рис. 1A. ).G3BP1 равномерно распределялся в цитоплазме ложно-инфицированных клеток, но образовывал гранулы в инфицированных CVB3 клетках через 3 часа p.i. но G3BP1-положительные гранулы диспергировались при 6 часах на дюйм. (Рисунок 1B). EGFP-TIA1 и HuR были совместно локализованы в гранулах в обработанных Ars и инфицированных CVB3 клетках (рис. 1A). G3BP1 также был совместно локализован с EGFP-TIA1 в гранулах обработанных Ars (данные не показаны) и инфицированных CVB3 клеток (рис. 1B).
Кроме того, в клетках HeLa, котрансфицированных с помощью pEGFP-eIF4G и pmCherry-HuR, как mCherry-HuR, так и EGFP-eIF4G перемещались из ядра в цитоплазматические гранулы после заражения CVB3 (MOI = 10) в течение 3 ч ( Рисунок 1С).Мы также заметили, что SG содержали HuR, но не содержали eIF4G при 6 часах на дюйм. (Рисунок 1С). Эти данные демонстрируют, что CVB3 индуцировал типичные SG.
2Apro — ключевой белок, запускающий образование SG
Чтобы идентифицировать вирусный компонент, который запускал образование SG во время инфекции CVB3, клетки HeLa были котрансфицированы pmCherry-HuR и одной из девяти плазмид, экспрессирующих вирусные белки, меченные EGFP (VP1, VP4-3, 2Apro, 2B, 2C, 3A , 3B, 3Cpro и 3D). Мы наблюдали, что mCherry-HuR перемещался из ядра в цитоплазматические гранулы в клетках, трансфицированных pEGFP-2A, через 24 часа после трансфекции (рис. 2А).Мы наблюдали аналогичный результат в ячейках Vero (дополнительный файл 1: рисунок S1). Ядерная локализация mCherry-HuR не была затронута в клетках, экспрессирующих EGFP, VP1, VP4-3, 2B, 2C, 3A, 3B, 3Cpro или 3D (рис. 2A). Количественная оценка этих экспериментов показала, что 93% (± 2% [стандартное отклонение])
Рисунок 1 Инфекция CVB3 вызывает образование SG. (А) HeLaEI
клеток были ложно инфицированы, подвергнуты воздействию 0,5 мМ NaAr в течение 30 мин или инфицированы
Затем
фиксировали и окрашивали на G3BP1.(C) Клетки HeLa, котрансфицированные pEGFP-eIF4G и pmCherry-HuR, инфицировали CVB3, как описано в (A). Затем клетки фиксировали и отображали. Ядра идентифицировали окрашиванием Hoechst 33342. Клетки исследовали с помощью флуоресцентной микроскопии (X400).
с CVB3 (MOI = 10) в течение 3 часов. Затем клетки фиксировали и окрашивали на HuR. (B) Клетки HeLaEGFP-IIA1 были инфицированы CVB3, как описано в (A). Клетки
клеток, экспрессирующих CVB3 2Apro, демонстрировали SG, в то время как мониторинг эндогенного распределения HuR с использованием процентного содержания SG в других группах клеток не давал анти-HuR антитела, аналогичный результат наблюдался, превышая 5%.клетки, трансфицированные только вирусным белком
Рисунок 2 CVB3 2Apro идентифицируется как вирусный компонент, который индуцирует образование SG в клетках HeLa. (A) Клетки HeLa были котрансфицированы плазмидой pmCherry-HuR и одной из следующих плазмид: pEGFP-2A, pEGFP-2B, pEGFP-2C, pEGFP-3A, pEGFP-3B, pEGFP-3C, pEGFP-3D, pEGFP-VP1 или pEGFP-VP4-3. Через 24 часа после трансфекции клетки были визуализированы. Количественную оценку образования SG для каждой группы определяли путем анализа процента клеток, экспрессирующих EGFP, которые содержали три или более гранул.Для каждого эксперимента подсчитывали не менее 100 клеток. Среднее значение трех независимых экспериментов указано в нижней части каждой панели. (B) Клетки HeLa трансфицировали pEGFP-Cl, pEGFP-2A или pEGFP-3C. Затем клетки фиксировали через 24 часа после трансфекции и окрашивали на HuR с помощью поликлонального антитела кролика против HuR и вторичного антитела козы против кролика, меченного CF555. (C) Клетки HeLa обрабатывали, как описано в (B), а затем окрашивали на G3BP1 с помощью мышиного моноклонального антитела против G3BP1 и меченного CF555 козьего антимышиного вторичного антитела.Hoechst 33342 использовался для контрастирования ядер. SG определяли, наблюдая гранулярное распределение mCherry-HuR (A), HuR (B) и G3BP1 (C) в цитоплазме под флуоресцентным микроскопом (X400). Цитоплазматические гранулы обозначены стрелками.
плазмиды (рис. 2В). Точно так же обнаружение G3BP1 показало, что G3BP1 был распределен в цитоплазматических гранулах только в клетках, экспрессирующих 2Apro (рис. 2C). Эти результаты предполагают, что 2Apro является ключевым вирусным компонентом, который запускает образование SG во время инфекции CVB3.
Активность протеазы необходима для того, чтобы 2Apro запускал образование SG
Поскольку аминокислотные последовательности CVB3 2Apro и PV 2Apro были высокогомологичными (Рисунок 3), восемь мутантов CVB3 2Apro, меченных EGFP, включая D39E, L40F, S67F,
Y89L, Y90L, V120M, G122E и D136N (отмечены звездочками на фиг. 3) были созданы в соответствии с вариантами PV 2Apro, которые проявляли различную активность расщепления по отношению к eIF4G (дополнительный файл 1: таблица S4).Была оценена их протеазная активность, о чем свидетельствует их эффективность в расщеплении eIF4G [23-25]. В таблице 1 показаны результаты их оценки активности расщепления eIF4G. В клетках, экспрессирующих эти мутанты, только 2AG122E проявлял ослабленную протеазную активность по сравнению с прототипом (рис. 4С и таблица 1). Мутанты, включая L40F, S67F, V120M, G122E и D136N, вели себя так, как ожидалось [24,25], в то время как
Мутанты
D39E, Y89L и Y90L, по-видимому, вели себя не так, как ожидалось [23].
Чтобы определить, требуется ли протеиназная активность 2Apro для образования SG, клетки HeLa котрансфицировали pmCherry-HuR и каждой из экспрессирующих мутант плазмид. Мы обнаружили, что только несколько SG образовывались в клетках, экспрессирующих 2AG122E. Напротив, в клетках, экспрессирующих другие мутанты 2Apro, образовались обильные SG (рис. 4A). Количественный анализ этих данных показал, что только 7% (± 3%) клеток, экспрессирующих EGFP-2AG122E, содержали SG, и более 90% клеток, экспрессирующих другие мутанты 2A, оставались положительными по SG.Аналогичные результаты наблюдались для G3BP1 в качестве маркера SG (рис. 4B). Таким образом, мы пришли к выводу, что протеазная активность необходима для того, чтобы 2Apro индуцировал SG.
EV71 и его 2Apro также вызывают образование SG
Затем мы исследовали, образуются ли SG в клетках, инфицированных EV71. Клетки HeLaEGFP-TIA1 были ложно инфицированы или инфицированы EV71 при MOI 10. В инфицированных клетках
Таблица 1 Активность расщепления eIF4G, полученная с различными вариантами CVB3 2Apro
Активность расщепления мутантного 2A eIF4G *
Дикий тип + + +
D39E + + +
L40F + + +
S67F + +
Y89L +++
Y90L ++
V120M +++
G122E +/-
D136N +++
* Активность протеазы 2A была определена как необнаруживаемая (-), обнаруживаемая в некоторых анализах (+/-) или положительная (от + до + + +).
, как EGFP-TIA1, так и HuR подверглись перераспределению и совместно локализовались в цитоплазматических гранулах (рис. 5А). Через 3 часа после операции примерно 34% инфицированных клеток показали гранулы. Гранулы также содержали G3BP1 и eIF4G (данные не показаны), что указывает на то, что инфекция EV71 также индуцировала образование SG. Подобно экспериментам, описанным в предыдущем разделе, клетки HeLa также котрансфицировали pmCherry-HuR и pEGFP-C1 или pEGFP-EV71 2A. Мы обнаружили, что 91% (± 4%) клеток, экспрессируемых EV71 2Apro, были положительными по SG (рис. 5B).Аналогичный результат был получен в инфицированных клетках Vero (дополнительный файл 1: Рисунок S1). Таким образом, EV71 2Apro может действовать в образовании SG.
Обсуждение
Взаимодействие между вирусами и клетками-хозяевами имеет решающее значение для понимания патогенеза вирусных инфекций. Образование SG — одно из замечательных клеточных событий, когда клетки ощущают неблагоприятную стимуляцию [1,2]. Множественные вирусы по-разному взаимодействуют с SG [5-7]. Сообщалось, что PV может вызывать образование SG.CVB3, EV71 и PV являются представителями рода Entero-virus; однако они вызывают совершенно разные типы заболеваний [10,12,26]. В этом исследовании мы обнаружили, что CVB3 и EV71 могут эффективно индуцировать образование SG. 2Apro обоих вирусов были идентифицированы как ключ к запуску образования SG. Наши результаты могут помочь нам лучше понять механизм, с помощью которого пикорнавирусы инициируют образование SG.
Согласно предыдущим исследованиям, TIA1, HuR, G3BP1 и eIF4G были выбраны в качестве маркеров SG для наших наблюдений.Было показано, что TIA1 и HuR постоянно рекрутируются в SG во время инфекции PV, тогда как G3BP1 и eIF4G могут быть обнаружены в SG на ранней стадии инфекции PV, но не позже [19–21]. Чтобы облегчить наблюдение за влиянием вируса на образование SG, мы
Рис. 4 Активность протеазы необходима для того, чтобы 2Apro индуцировал SG. (A) Клетки HeLa были котрансфицированы pmCherry-HuR и одним из
Плазмиды
(pEGFP-2AD39E, pEGFP-2AL40F, pEGFP-2AS67F, pEGFP-2AY89L, pEGFP-2AY90L, pEGFP-2AV120M, pEGFP-2AG122E или pEGFP-2AD136N).Клетки наблюдали через 24 часа после трансфекции. Процент клеток, экспрессирующих EGFP, с гранулами был определен количественно, как показано на рисунке 2A. Среднее значение трех независимых экспериментов указано в правом нижнем углу каждой панели. (B) Клетки HeLa трансфицировали pEGFP-C1 или pEGFP-2AG122E. Клетки фиксировали через 24 часа после трансфекции и затем окрашивали на G3BP1. Ядра идентифицировали окрашиванием Hoechst 33342. Локализацию белков mCherry-HuR (A) или G3BP1 (B) определяли с помощью флуоресцентного микроскопа (X400).(C) Определяли протеазную активность мутантов 2Apro на основе эффективности расщепления eIF4G. Клетки HeLa трансфицировали этими плазмидами, экспрессирующими мутант 2Apro, и целостность eIF4G определяли вестерн-блоттингом через 24 часа после трансфекции.
впервые сконструировал клеточную линию HeLaEGFP-TIA1, конститутивно экспрессирующую TIA1. EGFP-TIA1 был распределен в цитоплазматических гранулах в клетках HeLaEGFP-TIA1, инфицированных CVB3 и EV71 (Фигуры 1 и 4). Гранулы были дополнительно подтверждены как SG, поскольку в гранулах также были обнаружены HuR, G3BP1 и eIF4G (рис. 1).SG появляются уже через 3 часа после инфицирования клеток CVB3 или EV71 (MOI = 10) (рисунки 1 и 5), что позволяет предположить, что CVB3 и EV71 могут эффективно индуцировать образование SG. Мы также
обнаружил, что G3BP1 и eIF4G не были локализованы в SG на поздних стадиях инфекции CVB3 или EV71 (данные не показаны), что было аналогично результатам во время инфекции PV [19,21]. Таким образом, вполне вероятно, что образование SG может быть обычным явлением в ответ на пикорнавирусные инфекции.
Было бы интересно узнать, как пикорнавирусы инициируют образование SG. Образование SG может быть вызвано непосредственно одним вирусным компонентом или косвенно.
A EGFP-TIA1 HuR Hoechst Merge
Рисунок 5 EV71 и его 2Apro также вызывают образование SG. (A) Клетки HeLaEGFP-TIA1 были ложно инфицированы или инфицированы EV71 (MOI = 10) в течение 3 часов. После фиксации клетки окрашивали на HuR. Количественная оценка образования SG определялась путем анализа более 100 ячеек, которые содержали три или более гранул в нескольких полях для каждого эксперимента.Среднее значение трех независимых экспериментов указано в правом нижнем углу каждой панели. (B) Клетки HeLa котрансфицировали pmCherry-HuR и pEGFP-EV71 2A или pEGFP-C1, и клетки фиксировали через 24 часа после трансфекции, а затем визуализировали. Ядра окрашивали Hoechst 33342. Локализацию EGFP-TIA1 (A), HuR (A) или mCherry-HuR (B) определяли под флуоресцентным микроскопом (X400). Процент зеленых клеток, обладающих SG, был количественно определен, как на рисунке 2A.
, вызванный искаженной клеточной средой при возникновении пикорнавирусных инфекций.При наблюдении клеточного ответа на каждый белок CVB3 SG, отслеживаемые с помощью mCherry-HuR или эндогенного HuR, можно было увидеть только в клетках, экспрессирующих 2Apro (рис. 2). HuR преимущественно локализуется в ядре. Известно, что 2Apro может нарушать перенос макромолекул из ядра в цитоплазму за счет расщепления белков ядерных пор [13]. Таким образом, транслокация HuR может быть следствием нарушения переноса ядро-цитоплазма, вызванного 2Apro. По этой причине мы подтвердили наше наблюдение, используя цитоплазматический маркер SG G3BP1.Интересно, что SG, меченные G3BP1, также можно было наблюдать только в клетках, экспрессирующих 2Apro (Рисунок 2).
Для дальнейшей проверки роли 2Apro в формировании SG мы создали восемь мутантов 2Apro на основе исследований PV 2Apro [20,21,23]. Среди них протеазная активность 2AG122E была ослаблена, что было показано путем измерения эффективности расщепления eIF4G. Соответственно, 2AG122E не индуцирует образование SG, что указывает на то, что протеазная активность необходима для 2Apro, чтобы запускать образование SG (фиг. 4).Наши результаты показывают, что 2Apro может быть ключевым вирусным белком CVB3 и EV71, вызывающим образование SG.
Роль 2Apro в образовании SG может быть аналогичной при инфекции PV. Недавнее исследование показало, что инфекция PV может вызывать перераспределение SRp20, фактора сплайсинга ядерно-цитоплазматических челночных [18]. Эктопической экспрессии PV 2Apro было достаточно, чтобы вызвать повторную локализацию
SRp20 от ядра к цитоплазматическим гранулам [18]. Более позднее исследование продемонстрировало, что SRp20 может совместно локализоваться с TIA1 в цитоплазматических гранулах PV-инфицированных клеток, подтверждая, что SRp20 также может быть компонентом SG [22].Эти наблюдения предоставляют дополнительные доказательства роли 2Apro в формировании SG во время пикорнавирусных инфекций.
Таким образом, наши результаты помогают нам лучше понять механизм, с помощью которого пикорнавирусы инициируют образование SG в инфицированных клетках. Однако клеточные компоненты, на которые нацелен 2Apro, запускают образование SG, остаются неизвестными. Дальнейшие исследования необходимы, чтобы идентифицировать эти цели, чтобы выяснить это клеточное событие.
Заключение
В этом исследовании мы продемонстрировали, что инфекции CVB3 и EV71 могут индуцировать образование SG и что 2Apro играет решающую роль в индукции образования SG во время этих инфекций.Активность протеазы была необходима для того, чтобы 2Apro запускал образование SG. Это новое открытие может помочь нам лучше понять механизм, с помощью которого пикорнавирусы инициируют ответ SG.
Методы
Клеточные линии и вирусы
клеток HeLa выращивали в среде Игла, модифицированной Дульбекко (DMEM) (Invitrogen, Carlsbad, CA), с добавлением 8% (ростовая среда) или 5% (поддержание
medium) фетальная бычья сыворотка (FBS) (Biological Industries Israel).Клеточная линия HeLa, стабильно экспрессирующая EGFP-TIA1, была создана, как описано ранее [27]. Клетки HeLa культивировали в 12-луночных планшетах примерно до 60% слияния и трансфицировали плазмидой pEGFP-TIA1 с использованием Lipofectamine 2000 (Invitrogen). Затем клетки выращивали в среде, содержащей G418 (500 фг / мл). Мы заменяли культуральную среду каждые 2 дня, пока не наблюдались колонии. Мы приобрели стабильную клеточную линию HeLaEGFP-TIA1 через 8 недель отбора.
клеток HeLaEGFP-TIA1, стабильно экспрессирующих EGFP-TIA1, составили
, выращенный в среде DMEM, содержащей 10% FBS и 500 фг / мл G418.Штамм CVB3 Woodruff пассировали в клетках HeLa и титровали с помощью анализов бляшек, как описано ранее [28]. Штамм EV71 BrCr был пассирован в клетки Vero и титрован с использованием анализа 50% -ной инфицирующей дозы культуры ткани (TCID50), как описано в нашем предыдущем исследовании [29].
Конструкция плазмиды
Плазмида, экспрессирующая EGFP-tagged TIA1 или eIF4G, была сконструирована в нашей лаборатории. Сначала последовательность, кодирующую EGFP, получали из pEGFP-N1 (Clontech, Mountain View, CA) с помощью полимеразной цепной реакции (ПЦР).Ампликоны pcDNA3.1 (Invitrogen) и EGFP переваривали Nhe I и Hind III, а затем лигировали при 16 ° C в течение ночи с лигазой Т4. Полученная плазмида была обозначена как pEGFP-C1. КДНК TIA1 и eIF4G амплифицировали с помощью ПЦР с обратной транскрипцией (RT-PCR) из экстрактов РНК, полученных из клеток HeLa с использованием реагентов TRIzol (Invitrogen), а затем клонировали в pEGFP-C1. Полученные плазмиды были обозначены как pEGFP-TIA1 и pEGFP-eIF4G соответственно. Точно так же плазмида pmCherry-HuR, кодирующая гибридный белок HuR и красный флуоресцентный белок mCherry, была сконструирована на основе pmCherry-C1 (Clontech).Плазмиды были подтверждены секвенированием ДНК. Праймеры для амплификаций перечислены в Дополнительном файле 1: Таблица S1.
Девять плазмид, экспрессирующих EGFP-tagged VP1, VP4-VP2-VP3, 2Apro, 2B, 2C, 3A, 3B, 3Cpro или 3D CVB3, были сконструированы, как описано ранее [28,30], и обозначены как pEGFP-VP1, pEGFP- VP4-3, pEGFP-2A, pEGFP-2B, pEGFP-2C, pEGFP-3A, pEGFP-3B, pEGFP-3C и pEGFP-3D соответственно. Праймеры перечислены в Дополнительном файле 1: Таблица S2 и Таблица S3.
Сайт-направленный мутагенез
Восемь мутантов CVB3 2Apro, в том числе 2AD39E
2AS67F, 2AY89L, 2AY90L, 2AV120M, 2AG122E и 2AD136N были созданы с помощью ПЦР с перекрытием.Вкратце, для создания 2AD39E ДНК pEGFP-2A амплифицировали с помощью 2A sense
.
Праймер
и антисмысловой праймер 2AD39E и со смысловым праймером 2AD39E и антисмысловым праймером 2A, соответственно (дополнительный файл 1: таблица S3). Продукты ПЦР очищали и смешивали. Смесь усилили
2A смысловой и антисмысловой праймеры. Полученную ДНК расщепляли Hind III и Xba I и вставляли в сайт клонирования pEGFP-Cl. Эти плазмиды были обозначены как pEGFP-2AD39E, pEGFP-2AL40F, pEGFP-2AS67F, pEGFP-2AY89L, pEGFP-2AY90L, pEGFP-2AV120M, pEGFP-2AG122E и pEGFP-2AD136N соответственно.Расщепленные фрагменты смешивали и лигировали с pEGFP-Cl / Hind III + Xba I. Все плазмиды подтверждали секвенированием ДНК.
Трансфекция
Для вирусной инфекции клетки HeLa высевали в 24-луночные планшеты и выращивали примерно до 60% слияния. Затем клетки котрансфицировали 0,1 мкг pmCherry-HuR и 0,5 мкг pEGFP-C1 или pEGFP-eIF4G, используя 1 мкл липофектамина 2000 (Invitrogen) на лунку. Для экспрессии вирусных белков клетки высевали в 24-луночные планшеты и выращивали до примерно 70% конфлюэнтности.Затем клетки котрансфицировали 0,3 мкг pmCherry-HuR и 0,3 мкг плазмиды, кодирующей EGFP-меченный CVB3 2Apro, 2B, 2C, 3A, 3B, 3Cpro, 3D, VP1, VP4-VP2-VP3, 2AD39E, 2AL40F,
.
я D136N
2AS67F, 2A, 2A, 2A, 2A или 2AD EV71 2Apro; или пустой вектор pEGFP-C1. Через пять часов культуральные среды были удалены и заменены свежими. Изображения получали с использованием флуоресцентного микроскопа Axiovert 200 (Carl Zeiss, Геттинген, Германия) через 24 часа после трансфекции.Некоторые клетки высевали в 48-луночные планшеты и трансфицировали плазмидой, кодирующей EGFP-меченный CVB3 2Apro, 2AG122E или 3Cpro. Контрольные клетки трансфицировали pEGFP-C1. Через 24 часа после трансфекции клетки фиксировали для иммунофлуоресцентного анализа HuR и G3BP1. Для исследования расщепления eIF4G клетки HeLa трансфецировали плазмидой, кодирующей EGFP-меченный CVB3 2Apro, 2AD39E, 2AL40F, 2AS67F, 2AY89L, 2AY90L, 2AV120M, 2AG122E или 2AD136N. Клетки собирали через 24 часа после трансфекции. Лизаты целых клеток подвергали электрофорезу в геле додецилсульфата натрия в полиакриламидном геле (SDS-PAGE) и вестерн-блоттингу.
Вирусная инфекция
клеток HeLaEGFP-TIA1
были ложно инфицированы или инфицированы CVB3 или EV71 при умножении инфекции (MOI) на
.
10. Через 3 часа p.i. клетки HeLaEGFP-TIA1 фиксировали для im-
.
мунофлуоресцентных анализов. Клетки HeLa, котрансфицированные pmCherry-HuR и pEGFP-C1, или pEGFP-eIF4G, или pEGFP-eIF4GG681E, были ложно инфицированы или инфицированы CVB3 (MOI = 10).Через 3, 4 или 6 часов p.i. клетки промывали один раз фосфатно-солевым буфером (PBS) и обрабатывали для визуализации с использованием флуоресцентного микроскопа Axiovert 200.
Обработка арсенита (Ars)
Ars широко используется в качестве стимулятора SG [2]. Для индукции SG клетки обрабатывали арсенитом натрия
.
(NaArs) (Sigma-Aldrich, Сент-Луис, Миссури) в концентрации 0,5 мМ в питательной среде в течение 30 мин.
Иммунофлуоресценция
После вирусной инфекции, обработки Ars или трансфекции плазмиды, как описано выше, клетки промывали один раз PBS, а затем фиксировали 4% параформальдегидом при комнатной температуре в течение 30 мин.Клетки обрабатывали 0,25% Triton X-100 в течение 10 минут и блокировали PBS, содержащим 1% бычий сывороточный альбумин (BSA), в течение 30 минут при комнатной температуре. Затем клетки инкубировали в течение ночи при 4 ° C с первичным антителом, разведенным в блокирующем буфере, и с вторичным антителом в течение 2 часов при комнатной температуре в темноте. G3BP1 детектировали с помощью моноклонального антитела против G3BP1 (611126, BD Transduction Labs, Сан-Хосе, Калифорния) в разведении 1: 200 и меченного CF555 козьего вторичного антитела против мыши (20231, Biotium, Hayward, CA) при разведение 1: 1000.г / мл в PBS). Изображения получали с помощью флуоресцентного микроскопа Axiovert 200.
Вестерн-блоттинг
белков экстрагировали из обработанных клеток с использованием буфера Pierce RIPA с коктейлем PMSF. Приблизительно 2 мкг экстрагированных белков наносили на SDS-PAGE. Разделенные белки переносили на мембрану из поливинилиденфторида (PVDF) (0,45 мкм, Millipore, Billerica, MA), которую блокировали 5% обезжиренным молоком в течение 2 часов при 37 ° C и инкубировали с первичным антителом в течение ночи при 4 ° C. .Поликлональное кроличье антитело против eIF4G (15704-1-AP, Proteintech Group Inc.) было разведено 1: 1000 для обнаружения eIF4G; поликлональное антитело против р-актина (sc-130301, Santa Cruz Biotechnology, Санта-Круз, Калифорния) было разведено 1: 1000 для обнаружения р-актина. После стандартной промывки мембрану инкубировали с меченным пероксидазой хрена (HRP) вторичным антителом (Zhongshan Goldenbridge Biotech, Пекин, Китай) в течение 1 ч при комнатной температуре и снова промывали. Блоты окрашивали с использованием набора Super Signal (Pierce, Rockford, IL) и отображали с помощью камеры с зарядовой связью LAS4000 (Fujifilm, Токио, Япония).П-актин использовали в качестве контроля загрузки.
Дополнительный файл
Дополнительный файл 1: Таблица S1. Праймеры для ПЦР для конструирования плазмид pEGFP-C1, pEGFP-TIA1, pmCherry-HuR, pEGFP-eIF4G и pEGFP-eIF4GG681E. Таблица S2. Праймеры для ПЦР для конструирования плазмид, экспрессирующих белок CVB3 2B, 3A, 3B, 3C и 3D. Таблица S3. Последовательности праймеров ПЦР, используемые для сайт-направленного мутагенеза 2Apro, таблица S4. Активность расщепления eIF4G, полученная с различными вариантами PV 2Apro [23-25].Рисунок S1. Экспрессия CVB3 2Apro или EV71 2Apro в клетках Vero приводит к образованию SG. Vero Cells
были котрансфицированы pmCherry-HuR и pEGFP-C1, или pEGFP-CVB3 2A, или pEGFP-EV71 2A. Ядра идентифицировали с помощью Hoechst 33342. Экспрессию 2A и mCherry-HuR-позитивные SG определяли с использованием флуоресцентного микроскопа (x 400) через 24 часа после трансфекции.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.Вклад авторов
SW участвовал в разработке исследования, выполнил конструирование плазмиды, иммунофлуоресцентные анализы и вестерн-блоттинг, а также подготовил рукопись. YW координировала экспериментальный план и помогала редактировать рукопись. LL выполняла вирусную инфекцию и трансфекцию клеток. XS участвовал в разработке исследования. TW и XZ проводили обработку арсенитом. LT, YL и YC проводили трансфекцию клеток. XL и FZ помогли согласовать экспериментальный дизайн.WZ и ZZ внесли существенный вклад в экспериментальный дизайн и координацию. Все авторы прочитали и одобрили окончательную рукопись.
Благодарности
Это исследование было поддержано Китайским фондом естественных наук (NSFC) (81271825 — Z. Zhong, 31270198 — W. Zhao, 81101234 — T. Lei, 81101235 — Y. Wang и 31300144 — T. Wang). Мы благодарим ключевую лабораторию патогенов и иммунитета провинции Хэйлунцзян и группу научно-технических инноваций провинции Хэйлунцзян в Высших учебных заведениях по инфекционным заболеваниям, Харбинский медицинский университет, Харбин 150081, Китай, за техническую поддержку.
Сведения об авторе
Кафедра микробиологии, Харбинский медицинский университет, Харбин 150081, Китай. 2 Кафедра клеточной биологии, Харбинский медицинский университет, Харбин 150081, Китай. 3 Отделение гастроэнтерологии и гепатологии медицинского факультета Университета Флориды в Джексонвилле, Джексонвилл, Флорида 32206, США.
Получено: 12 апреля 2014 г. Принято: 26 октября 2014 г. Опубликовано в Интернете: 20 ноября 2014 г.
Список литературы
1.Андерсон П., Кедерша Н.: Гранулы напряжения. Curr Biol 2009, 19: R397-R398.
2. Бьюкен Дж. Р., Паркер Р.: Эукариотические стрессовые гранулы: тонкости трансляции. Mol Cell 2009, 36: 932-941.
3. Гилкс Н., Кедерша Н., Айоделе М., Шен Л., Стоклин Г., Дембер Л. М., Андерсон П. Сборка стрессовых гранул опосредуется прионоподобной агрегацией TIA-1. Mol Biol Cell 2004, 15: 5383-5398.
4. фон Рорец К., Ди Марко С., Мазруи Р., Галлузи И. Е.: Оборот мРНК, богатых AU, во время стресса: вопрос выживания.Wiley Interdiscip RevRNA 2011, 2: 336-347.
5. Уайт Дж. П., Ллойд Р. Е.: Регулирование стрессовых гранул в вирусных системах.
Trends Microbiol 2012, 20: 175-183.
6. Lloyd RE: Как вирусы взаимодействуют с гранулами стресс-ассоциированной РНК? PLoSPathog 2012, 8: e1002741.
7. Valiente-Echeverria F, Melnychuk L, Mouland AJ: Вирусная модуляция стрессовых гранул. Virus Res 2012, 169: 430-437.
8.Боргезе Ф., Михильс Т .: Лидерный белок кардиовирусов подавляет сборку стрессовых гранул. Дж. Вирол 2011, 85 (18): 9614-9622.
9. Langereis MA, Feng Q, van Kuppeveld FJ: MDA5 локализуется в стрессовых гранулах, но эта локализация не требуется для индукции интерферона I типа. Дж. Вирол 2013, 87 (11): 6314-6325.
10. Ноултон К.У .: Инфекция CVB и механизмы вирусной кардиомиопатии. Curr Top Microbiol Immunol 2008, 323: 315-335.
11.Фэйрвезер Д., Стаффорд К.А., Сун Ю.К.: Обновленная информация о миокардите, вызванном вирусом Коксаки B3. Curr Opin Rheumatol 2012, 24: 401-407.
12. Вонг С.С., Ип С.К., Лау С.К., Юэн К.Ю.: Энтеровирус человека 71 и болезнь рук, ящура и рта. Epidemiol Infect 2010, 138: 1071-1089.
13. Кастелло А., Альварес Э., Карраско Л.: Многогранная протеаза полиовируса 2А: регуляция экспрессии генов протеазами пикорнавируса. J Biomed Biotechnol 2011, 2011: 369648.
14.Kuyumcu-Martinez NM, Joachims M, Lloyd RE: Эффективное расщепление связанного с рибосомами поли (A) -связывающего белка протеазой 3C энтеровируса. Дж. Вирол 2002, 76: 2062-2074.
15. Рассман А., Хенке А., Зобава М., Карлсон М., Салуз Х. П., Грабли С., Лотцпейх Ф., Мундер Т.: Изменения протеома в человеческих клетках-хозяевах, инфицированных вирусом Коксаки В3. J Gen Virol 2006, 87: 2631-2638.
16. Chau DH, Yuan J, Zhang H, Cheung P, Lim T, Liu Z, Sail A, Yang D: протеазы 2A и 3C вируса Коксаки В3 вызывают апоптотическую гибель клеток из-за повреждения митохондрий и расщепления eIF4GI, но не DAP5 / p97 / NAT1.Апоптоз 2007, 12: 513-524.
17. де Брейн С., Бондерофф Дж. М., Чумаков К. М., Ллойд Р. Э., Хеллен К. У .: Расщепление эукариотического фактора инициации eIF5B протеазами энтеровируса 3С. Вирусология 2008, 378: 118-122.
18. Фитцджеральд К.Д., Чейз А.Дж., Кэткарт А.Л., Тран Г.П., Семлер Б.Л.: Требования вирусной протеиназы для нуклеоцитоплазматической релокализации фактора клеточного сплайсинга SRp20 во время пикорнавирусных инфекций. J Virol 2013, 87: 2390-2400.
19.Уайт Дж. П., Карденас А. М., Мариссен В. Е., Ллойд Р. Е.: Ингибирование образования стрессовых гранул цитоплазматической мРНК вирусной протеиназой. Клеточный микроб-хозяин 2007, 2: 295-305.
20. Piotrowska J, Hansen SJ, Park N, Jamka K, Sarnow P, Gustin KE: стабильное образование уникальных по составу стрессовых гранул в инфицированных вирусом клетках. Дж. Вирол 2010, 84: 3654-3665.
21. White JP, Lloyd RE: Полиовирус не связывает агрегацию TIA1 и образование стрессовых гранул мРНК. Дж. Вирол 2011, 85: 12442-12454.
22. Фицджеральд К.Д., Семлер Б.Л.: Инфекция полиовируса индуцирует совместную локализацию клеточного белка SRp20 с TIA-1, цитоплазматическим белком гранул стресса. Virus Res 2013, 176: 223-231.
23. Ю. С. Ф., Ллойд Р. Е.: Определение незаменимых аминокислотных остатков в функциональной активности протеазы полиовируса 2А. Virology 1991, 182: 615-625.
24. Барко А., Вентосо И., Карраско Л.: Дрожжи Saccharomyces cerevisiae как генетическая система для получения вариантов протеазы 2А полиовируса.J Biol Chem 1997, 272: 12683-12691.
25. Ventoso I, Barco A, Carrasco L: Мутационный анализ полиовируса 2Apm. Отчетливые ингибирующие функции 2Apm в отношении трансляции и транскрипции. J Biol Chem 1998, 273: 27960-27967.
26. Мюллер С., Виммер Э., Виолончель Дж .: Полиовирус и полиомиелит: история кишок, мозга и случайного события. Virus Res 2005, 111: 175-193.
27. Wu S, Lin L, Zhao W, Li X, Wang Y, Si X, Wang T, Wu H, Zhai X, Zhong X, Gao S, Tong L, Xu Z, Zhong Z: AUF1 принят на работу в стрессовые гранулы, вызванные вирусом Коксаки B3.Virus Res 2014, 192: 52-61.
28. Wang L, Qin Y, Tong L, Wu S, Wang Q, Jiao Q, Guo Z, Lin L, Wang R, Zhao W., Zhong Z: MiR-342-5p подавляет биосинтез вируса Коксаки B3, воздействуя на 2C- кодирующая область. Antiviral Res 2012, 93: 270-279.
29. Го З, Чжун Х, Линь Л., Ву С, Ван Т, Чен И, Чжай Х, Ван И, Ву Х, Тонг Л, Хань И, Пан Би, Пэн И, Си Х, Чжан Ф, Чжао В. , Zhong Z: 3Cpro-зависимая биолюминесцентная визуализация для оценки in vivo агентов против энтеровируса 71.Antiviral Res 2014, 101: 82-92.
30. Wang T, Yu B, Lin L, Zhai X, Han Y, Qin Y, Guo Z, Wu S, Zhong X, Wang Y, Tong L, Zhang F, Si X, Zhao W, Zhong Z: функциональный последовательность ядерной локализации в капсидном белке VP1 вируса Коксаки В3. Вирусология 2012, 433: 513-521.
DOI: 10.1186 / s12985-014-0192-1
Процитируйте эту статью как: Wu et al.: Протеаза 2A вызывает образование стрессовых гранул при инфицировании вирусом Коксаки B3 и энтеровирусом 71.
Журнал вирусологии 2014 11: 192.
Отправьте следующую рукопись в BioMed Central и воспользуйтесь всеми преимуществами:
• Удобная онлайн-подача
• Тщательная экспертная оценка
• Отсутствие ограниченного пространства или платы за цветные рисунки
• Немедленная публикация о приемке
• Включение в PubMed, CAS, Scopus и Google Scholar
• Исследование, свободно распространяемое
Отправьте вашу рукопись на РПНТ БинМели, i
www.biomedcentral.com/submit v-c «Lml
Случаи заболеваний рук, ног и рта вспыхивают в нескольких штатах
Заразные детские болезни с запоминающимся названием, похоже, распространяются в нескольких штатах. По сообщениям, врачи наблюдают все больше и больше случаев заболеваний рук, ног и рта, и это касается не только детей.
Согласно многочисленным сообщениям, врачи наблюдают вспышки в Индиане, Южной Каролине, Теннесси и Вирджинии.И двум игрокам Высшей лиги бейсбола в Нью-Йорке также был поставлен диагноз.
На прошлой неделе газета New York Mets сообщила, что питчер Ной Синдергаард заразился болезнью рук, ног и рта во время своего выступления в бейсбольном лагере для детей во время перерыва на Матч всех звезд. А буквально вчера было объявлено, что стартер из New York Yankees J.A. Как сообщает CBS Sports, у Хаппа заболевание протекает в легкой форме.
«В этом году мы получаем много случаев (случаев) заболеваний рук, ящура и рта», -Кейт Толар из отделения неотложной помощи педиатра диакониссы в Эвансвилле, штат Индиана, сообщил Courier-Press. «Мы наблюдали это все лето и небольшой всплеск за последнюю неделю или две».
Заболевания рук, ног и рта, вызываемые вирусом, получили свое название от маленьких красных язв или высыпаний, которые часто появляются во рту и на ладонях рук и подошвах ног. Это распространенное заболевание среди детей в возрасте до 5 лет, но дети старшего возраста и взрослые также могут заразиться им.
Заболевания рук, ног и рта могут привести к высыпанию, которое может превратиться в волдыри.CDC
Доктор Элизабет Мак, адъюнкт-профессор педиатрической реанимации Медицинского университета Южной Каролины, говорит, что симптомы могут появиться через несколько дней после заражения человека.
«Для него характерно … очень часто лихорадка, затем боль в горле, затем часто насморк и затем сыпь», — сказал Мак членской организации CBS WCSC. «Сыпь может быть пузырчатой … что касается рта, она может быть на внутренней стороне щек, языка, десен, а затем может быть на пальцах, ладонях рук, подошвах ног и даже на ягодицах.«
Руки, ступни и рот, которые часто связаны с плохой гигиеной среди маленьких детей, могут передаваться через поцелуи, объятия или совместное использование еды и напитков.

 Когда высыпание на руках, ногах и во рту. Не стоит паниковать, а больше внимания уделять ребенку. Детский возраст. Часто болеют. Самое главное получать правильный уход и медикаментозную помощь. Как можно больше питья. Чаи комнатной температуры, водичка, фруктовые напитки, даже газировка.
Когда высыпание на руках, ногах и во рту. Не стоит паниковать, а больше внимания уделять ребенку. Детский возраст. Часто болеют. Самое главное получать правильный уход и медикаментозную помощь. Как можно больше питья. Чаи комнатной температуры, водичка, фруктовые напитки, даже газировка.