Вирусы Коксаки B1–6 как этиологический фактор энтеровирусной инфекции | Романенкова
1. Лобзин, Ю.В. Энтеровирусные инфекции: руководство для врачей / Ю.В. Лобзин, Н.В. Скрипченко, Е.А. Мурина. – СПб.: НИИДИ, 2012. – 432 с.
2. Романенкова, Н.И. Надзор за полиомиелитом и энтеровирусной инфекцией на ряде территорий Российской Федерации / Н.И. Романенкова, М.А. Бичурина, Н.Р. Розаева // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2011. – № 6. – С. 32–36.
3. Kemball CC, Alirezaei M, Whitton JL. Type B coxsackieviruses and their interactions with the innate and adaptive immune systems. Future Microbiol. 2010 Sep; 5(9):1329-47.
4. Euscher E, Davis J, Holzman I, Nuovo GJ. Coxsackie virus infection of the placenta associated with neurodevelopmental delays in the newborn. Obstet. Gynecol. 2001 Dec; 98(6): 1019–26.
Coxsackie virus infection of the placenta associated with neurodevelopmental delays in the newborn. Obstet. Gynecol. 2001 Dec; 98(6): 1019–26.
5. Schlapbach LJ, Ersch J, Balmer C, et al. Enteroviral myocarditis in neonates. J. Paediatr. Child. Health. 2013 Sep; 49(9): 451-4.
6. Бичурина, М.А. Сезонный подъем заболеваемости энтеровирусным менингитом в Новгородской области / М.А. Бичурина [и др.] // Инфекция и иммунитет. – 2012. – Т. 2, № 4. – С. 747–752.
7. Бичурина, М.А. Роль энтеровируса ECHO30 в этиологии энтеровирусной инфекции на Северо-Западе России в 2013 году / М.А. Бичурина [и др.] // Журнал инфектологии. – 2014. – Т. 6, № 3. – С. 84–91.
8. Шишко, Л.А. Этиология сезонных подъёмов заболеваемости энтеровирусной инфекцией в Архангельской области / Л. А. Шишко [и др.] // Инфекция и иммунитет. – 2013. – Т. 3, № 1. – C. 65–72.
А. Шишко [и др.] // Инфекция и иммунитет. – 2013. – Т. 3, № 1. – C. 65–72.
9. Rhoades RE, Tabor-Godwin JM, Tsueng G, Feuer R. Enterovirus Infections of the Central Nervous System. Virology. 2011 Mar; 411(2): 288-305.
10. Лукашев, А.Н. Социально-экономическая значимость энтеровирусной инфекции и ее роль в структуре инфекционной патологии в мире / А.Н. Лукашев, О.Е. Иванова, Л.В. Худякова // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2010. – № 5. – С. 113–120.
11. Lee BE, Davies HD. Aseptic meningitis. Curr. Opin. Infect. Dis. 2007 Jun; 20(3): 272-7.
12. Бессергенева, И.К. Тенденция эпидемического процесса неполиомиелитных энтеровирусных заболеваний в условиях мегаполиса / И. К. Бессергенева [и др.] // ЗНиСО. – 2010. – №6. – С. 25–28.
К. Бессергенева [и др.] // ЗНиСО. – 2010. – №6. – С. 25–28.
13. Сапега, Е.Ю. Анализ проявлений эпидемического процесса энтеровирусной инфекции в Дальневосточном регионе в 2010 году / Е.Ю. Сапега [и др.] // Дальневосточный Журнал инфекционной патологии. – 2011. – № 19. – C. 18–22.
14. CDC. Outbreaks of aseptic meningitis associated with echovirus 9 and 30 and preliminary surveillance reports on enterovirus activity – United States, 2003. Morbid. Mortal. Wkly Rep. 2003 Aug; 52(32): 761-4.
15. Лукашев, А.Н. Молекулярная эпидемиология вируса ECHO 30 на территории России и стран СНГ / А.Н. Лукашев [и др.] // Вопросы вирусологии. – 2004. – Т. 49, № 5. – С. 12–16.
16. Лукашев, А.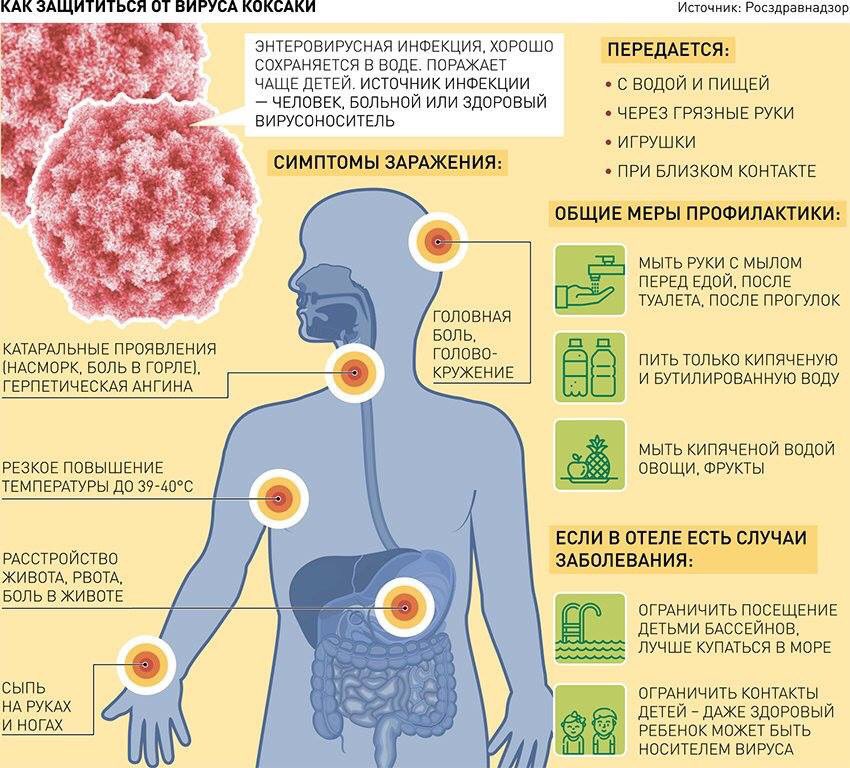 Н. Молекулярная эпидемиология вируса ECHO 6 – возбудителя вспышки серозного менингита в Хабаровске в 2006 г. / А.Н. Лукашев [и др.] // Вопросы вирусологии – 2008. – Т. 53, № 1. – С. 16–21.
Н. Молекулярная эпидемиология вируса ECHO 6 – возбудителя вспышки серозного менингита в Хабаровске в 2006 г. / А.Н. Лукашев [и др.] // Вопросы вирусологии – 2008. – Т. 53, № 1. – С. 16–21.
17. Khetsuriani N, LaMonte-Fowlkes A, Oberste MS, Pallansch MA. Enterovirus surveillance – United States, 1970–2005. Morbid. Mortal. Wkly Rep. 2006 Sep; 55(8): 1–20.
18. Романенкова, Н.И. Детекция неполиомиелитных энтеровирусов у больных острыми вялыми параличами, детей из организованных коллективов и детей из семей мигрантов / Н.И. Романенкова [и др.] // Журнал инфектологии. – 2014. – Т. 6, № 4. – С. 43–48.
19. Tam PE. Coxsackievirus myocarditis: interplay between virus and host in the pathogenesis of heart disease. Viral Immunol. 2006 Summer; 19(2):133-46.
20. Polio laboratory manual. WHO/IVB/04.10.World Health Organization, Geneva, Switzerland. c 2004. 157 p.
Polio laboratory manual. WHO/IVB/04.10.World Health Organization, Geneva, Switzerland. c 2004. 157 p.
21. Голицына, Л.Н. Эпидемические варианты неполиомиелитных энтеровирусов в России / Л.Н. Голицына [и др.] // Медицинский альманах. – 2015. – № 5. – С. 136–140.
Вирус Коксаки что делать? | Travel Club
С начала этой недели тема вируса Коксаки, якобы бушующего на курортах Турции, прочно вошла в новостную повестку. Отдельные СМИ сообщают и о «случаях массовых отказов» от поездок на турецкие курорты, другие — о десятках заболевших в различных отелях, ссылаясь на данные соцсетей.
В Турции действительно эпидемия?
Официально информация о массовом заражении вирусом Коксаки не подтверждена ни одним из ведомств ни с российской, ни с турецкой стороны. Роспотребнадзор на следующий день после появления сообщений о заболевших в Турции открыл горячую линию для пострадавших. На момент написания материала на нее было зафиксировано пять обращений.
На момент написания материала на нее было зафиксировано пять обращений.
Но ведь люди все равно заболевают?
Да, страховые компании, которые обладают наиболее полной информацией об обращениях российских туристов в медицинские учреждения Турции, действительно фиксируют случаи заболевания, симптоматику которого можно отнести к вирусу Коксаки. Например, «Ингосстрах» за два летних месяца зафиксировал 10 (десять) таких обращений. Компания «Европейское туристическое страхование» (сотрудничает с такими массовыми операторами, как TUI, Anex Tour, Pegas Touristik) за аналогичный период зафиксировал около 80 подобных случаев. Учитывая, что с начала года Турцию посетили более 1 млн российских туристов, о массовом заражении говорить не приходится.
А если турист все-таки заболеет?
При первых симптомах любой болезни, сразу обращайтесь к врачу. Это страховой случай, и лечение будет покрыто страховкой. Экстренной эвакуации типичный договор страховки обычно не предусматривает. В крайнем случае авиакомпания может отказаться сажать в самолет носителя вируса. Придется лечиться в Турции до выписки — на это может уйти около 10 дней.
В крайнем случае авиакомпания может отказаться сажать в самолет носителя вируса. Придется лечиться в Турции до выписки — на это может уйти около 10 дней.
Но если в отеле будут заболевшие, туриста переселят?
Туроператор не может выполнить просьбу о переселении, хотя есть смысл на всякий случай позвонить своему менеджеру в турагентстве. С другой стороны, даже профессиональный врач не может однозначно утверждать, что кашляющий человек в отеле пострадал от вируса Коксаки, а не простудился под кондиционером.
Если же турист захочет досрочно вернуться домой, то это будет только его решение. На какие-либо компенсации за досрочно завершенный отпуск он рассчитывать не сможет.
А если все-таки турист отказался ехать, ему вернут деньги?
Пока российские власти не выпустят распоряжение о нежелательности поездок в Турцию, у туриста не будет оснований требовать деньги за аннулированный тур. При заблаговременном отказе туристы могут быть возвращены средства за вычетом фактических понесенных расходов турагента и туроператора.
Может ли турист попросить заменить тур в Турцию на другое направление?
Это не гарантирует, что он не заразится на других курортах. Вирус Коксаки относится к группе кишечных вирусов, которые активно распространяются в жаркую погоду. Сообщения о пострадавших от данного вируса появлялись и на российском Юге, и в Болгарии. Разница в том, что они не предавались такой огласке, как заболевания в Турции.
Тогда откуда вообще появилась информация о заболевших в Турции?
Пока все следы ведут к этой новости на телеканале Рен ТВ, который ссылается на двух туристов, якобы видевших «десятки заболевших» в своем отеле. Каких-либо подтверждений этих слов ни в первоисточнике, ни где-либо еще не приводится.
Вирус Коксаки способен уничтожить рак мочевого пузыря
Исследователи из Университета Суррея (Великобритания) описали новый способ борьбы с раком мочевого пузыря. Они установили, что один из штаммов вируса Коксаки — CVA21 — избирательно инфицирует и уничтожает раковые клетки. Результаты исследования опубликованы в журнале Clinical Cancer Research.
Результаты исследования опубликованы в журнале Clinical Cancer Research.
Ученые отмечают, что этот тип опухолей отличается стремительным развитием. Новообразования можно удалить с помощью инвазивных процедур, но более чем в половине случаев у пациентов наблюдаются рецидивы, и они вынуждены проходить дорогостоящий мониторинг, чтобы убедиться, что болезнь не вернулась. Альтернативный вид лечения (иммунотерапия) подходит лишь трети пациентов: у остальных он либо вызывает серьезные побочные эффекты, либо не дает вообще никакого результата.
Новая методика, которую испытали ученые, оказалась эффективной для 15 человек, принявших участие в исследовании. Всем этим пациентам, которые готовились к операции по удалению опухоли, за неделю до процедуры в ткани мочевого пузыря через катетер были введены вирусы штамма CVA21. Изучив удаленные в ходе операции образцы тканей, исследователи выяснили, что вирус сработал очень избирательно: он уничтожил раковые клетки, не повредив здоровые.
Анализы мочи, взятой у пациентов в разные дни, показали, что вирус выделялся из организма постепенно. Это значит, что после гибели инфицированных раковых клеток, вирус размножился и продолжил атаковать другие раковые клетки в органе. Кроме того, отмечается, что у пациентов повысилось количество цитокинов — информационных молекул, обеспечивающих мобилизацию воспалительного ответа.
Несмотря на небольшое количество участников исследования, важно, что метод лечения оказался эффективным для всех этих людей и не вызвал никаких серьезных побочных эффектов. В дальнейшем специалисты планируют расширить клинические испытания метода и оценить эффективность его комбинации с иммунотерапией.
«Пик в начале сентября». Опасен ли вирус Коксаки для жителей Среднего Урала | Советы | ЗДОРОВЬЕ
Взрослые чаще всего переносят энтеровирусные инфекции легко. Они не обращают внимания на легкое недомогание, не лечатся, выходят «в люди» и распространяют вирус направо и налево. Об опасности энтеровирусных инфекций и их профилактике рассказывает главный эпидемиолог Екатеринбурга, руководитель Городского центра медицинской профилактики Александр ХАРИТОНОВ.
Об опасности энтеровирусных инфекций и их профилактике рассказывает главный эпидемиолог Екатеринбурга, руководитель Городского центра медицинской профилактики Александр ХАРИТОНОВ.
Группа риска — дети
Рада БОЖЕНКО, «АиФ-Урал»: Александр Николаевич, энтеровирусная инфекция переходит в наступление летом…
Александр ХАРИТОНОВ: Да, это сезонная инфекция. Вирус очень хорошо живёт в тёплых условиях. Заболеваемость у нас начинается в конце мая — июне и, нарастая, достигает пика в августе — начале сентября. Основной путь его передачи – водный, но, кроме этого, актуальны и пищевой, контактно-бытовой, даже пылевой пути передачи.
Что касается водного пути, то заражение чаще всего происходит во время купания. Лето прошлого года было чрезвычайно жарким, уральцы купались, извините, в любой луже, везде, где только можно. Отсюда и заболеваемость энтеровирусными инфекциями была высокой.
Вакцины против энтеровирусной инфекции нет. Лучшая её профилактика – это элементарное соблюдение правил личной гигиены. Это регулярное мытье рук, например мытьё овощей и фруктов под проточной водой. Причём воду в кране нужно предварительно пропустить в течение 10 минут. К сожалению, сколько бы мы ни говорили об этом, приходится наблюдать, как мамы, купив фрукты, сразу же дают их ребёнку. Ребёнка к тому же нужно учить не заглатывать воду во время купания, а после купания в водоёмах и бассейнах (особенно при отелях) нужно всем обязательно принимать душ. А ведь дети более всего подвержены этому заболеванию.
Лучшая её профилактика – это элементарное соблюдение правил личной гигиены. Это регулярное мытье рук, например мытьё овощей и фруктов под проточной водой. Причём воду в кране нужно предварительно пропустить в течение 10 минут. К сожалению, сколько бы мы ни говорили об этом, приходится наблюдать, как мамы, купив фрукты, сразу же дают их ребёнку. Ребёнка к тому же нужно учить не заглатывать воду во время купания, а после купания в водоёмах и бассейнах (особенно при отелях) нужно всем обязательно принимать душ. А ведь дети более всего подвержены этому заболеванию.
— То есть взрослые не болеют?
энтеровирусной инфекции в области за 6 месяцев.
— Болеют, но чаще всего в лёгкой форме, и при этом они являются носителями инфекции. То есть заражают окружающих, прежде всего детей. А больные дети заносят инфекцию в организованные коллективы. Поэтому я всегда обращаюсь к родителям: если ребёнок недомогает, не стоит его «подлечивать» и на следующий день отправлять в детский сад.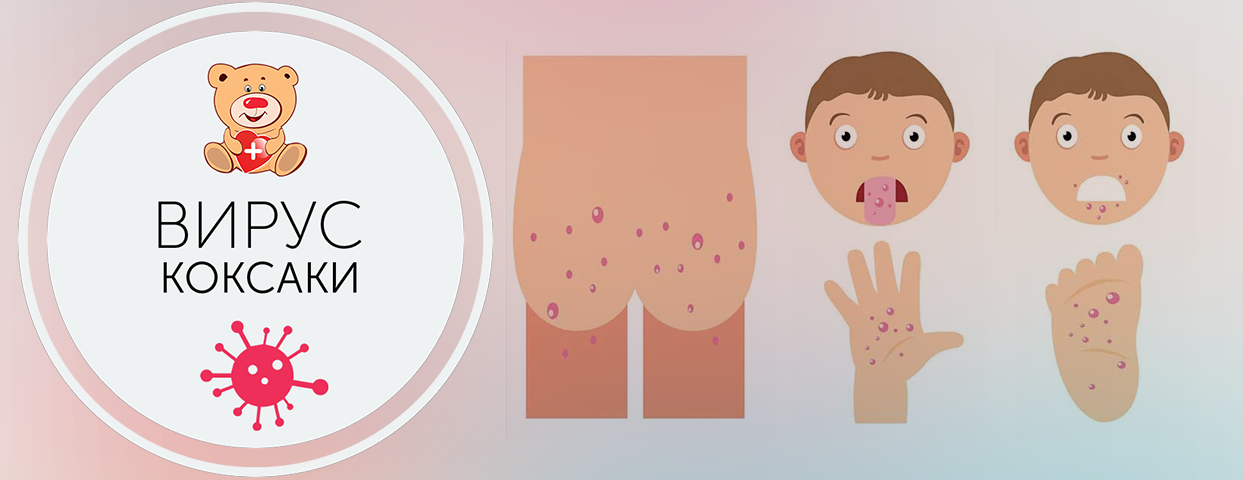 Больного ребёнка нужно лечить! И тем самым думать, во-первых, о его здоровье, а во-вторых, о здоровье других детей.
Больного ребёнка нужно лечить! И тем самым думать, во-первых, о его здоровье, а во-вторых, о здоровье других детей.
Сами виноваты
— Насколько это серьёзное заболевание?
— Любое заболевание серьёзно. А энтеровирусная инфекция способна поразить различные органы. Это может быть герпангина, заболевания глаз, неврологические заболевания, это может быть кишечная форма и, самое опасное, вирусные менингиты. Вообще, энтеровирусную инфекцию называют летним гриппом. О её опасности мы говорим постоянно, но всё равно настороженности у людей нет. Твёрдо убежден, в распространении энтеровирусной инфекции мы сами виноваты (исключение – проблемы с водоснабжением). Повторюсь, не нужно больному человеку выходить «в люди»: в общественные места, в организованные коллективы. Источником заболевания является больной человек или вирусоноситель.
— Активизация вируса Коксаки в Турции что-то из ряда вон выходящее? Этот вирус имеет свои особенности?
— Это разновидность энтеровирусов, один из многочисленных его видов. Вирус Коксаки вполне обычный, который встречается и на нашей территории. То есть говорить о том, что это какой-то видоизменённый вирус, вирус нового типа, который именно «из Турции», — неправильно.
Вирус Коксаки вполне обычный, который встречается и на нашей территории. То есть говорить о том, что это какой-то видоизменённый вирус, вирус нового типа, который именно «из Турции», — неправильно.
Но меры профилактики, находясь на отдыхе, конечно, соблюдать необходимо. При сложившейся ситуации не стоит посещать бэби-клубы, купаться в бассейнах и контактировать с больными детьми.
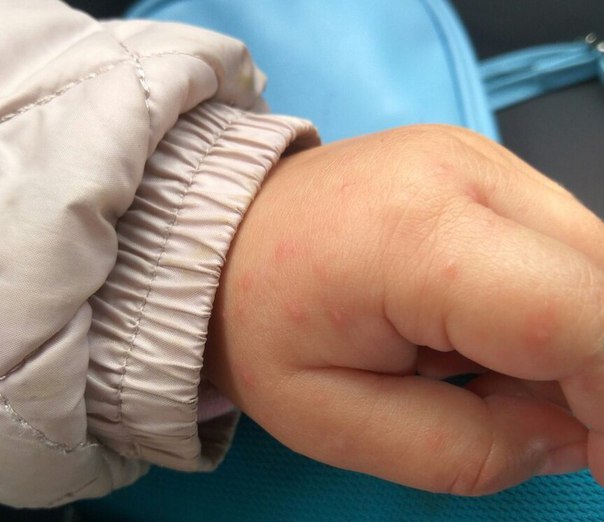
— Как проявляется вирус Коксаки?
— Как любая энтеровирусная инфекция. Обычно возникают катаральные явления, общее недомогание. При разных формах может наблюдаться подъём температуры тела, при кишечных его формах возможен жидкий стул. Возможно также появление сыпи. Особенность экзантемной формы определяется «формулой» «нога-рука-рот». Сыпь распространяется на ногах (преимущественно стопах), на руках (может быть на ладошках), и может быть воспаление зева, герпангина. И тяжёлая форма энтеровирусной инфекции – поражение центральной нервной системы, головного мозга. Для вирусного менингита характерны подъём температуры, общая слабость, мышечная боль. В этом случае, конечно, необходимо лечение в стационаре.
Для вирусного менингита характерны подъём температуры, общая слабость, мышечная боль. В этом случае, конечно, необходимо лечение в стационаре.
Но, ещё раз настаиваю, обращаться к врачу необходимо при любых симптомах энтеровирусной инфекции.
Смотрите также:
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ДИАГНОСТИКИ, ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЭНТЕРОВИРУСНОЙ ИНФЕКЦИИ КОКСАКИ У ДЕТЕЙ | Ботвиньева
1. Сейбиль В. Б., Малышкина Л. П. Всемирная организация здравоохранения и проблема ликвидации инфекционных заболеваний в мире. Вопросы вирусологии. 2005; 50: 3.
2. Амвросьева Т. В., Богуш З. Ф. и др. Вспышка энтеровирусной инфекции в Витебске в условиях загрязнения питьевой воды. Вопросы вирусологии. 2004; 1: 7–9.
3. Ежлова Е. Б., Чернявская О. П., Михайлов М. И. Эпидемио логический надзор и профилактика энтеровирусной (неполио) инфекции. Методические указания 3.1.1.2363-08. Москва. 2008.
И. Эпидемио логический надзор и профилактика энтеровирусной (неполио) инфекции. Методические указания 3.1.1.2363-08. Москва. 2008.
4. Кузнецова В. Г., Мечетина А. А. и др. Клинико-эпидемиологическая характеристика энтеровирусного менингита по данным вспышки 2004 года. Сборник материалов XV Научно-практической конференции врачей. Новосибирск. 2005. С. 415–416.
5. Лашкевич В. А., Дроздов С. Г., Грачев В. П. и др. Неполиомиелитные энтеровирусные инфекции: Эпидемиология, характеристика энтеровирусов, клиника, диагностика, профилактика. Методическое пособие. Федеральный центр Госсанэпиднадзора РФ. Москва. 2004.
6. Melnick J. L., Shaw E. W., Curnen E. C. A virus irom patients diagnosed as non-paralytic poliomyelitis or aseptic meningitis. Proc. Soc. Exp. Biol. 1949; 71: 344–349.
1949; 71: 344–349.
7. Abubakar S., Chee H. Y., Shafee N. et al. Molecular detection of enteroviruses from an outbreak of hand, foot and mouth disease in Malaysia in 1997. Scand. J. Infect. Dis. 1999; 31 (4): 331–335.
8. Ang L. W., Koh B.K., Chan K. P. et al. Epidemiology and control of hand, foot and mouth disease in Singapore, 2001–2007. Ann. Acad. Med. Singapore. 2009; 38 (2): 106–112.
9. Энтеровирусные заболевания: клиника, лабораторная диагностика, эпидемиология, профилактика. Методические указания (МУ 3.1.1.2130-06). Москва. 2006.
10. Ding N. Z., Wang X. M., Sun S. W. et al. Appearance of mosaic enterovirus 71 in the 2008 outbreak of China. Virus Res. 2009; 45 (1): 157–161.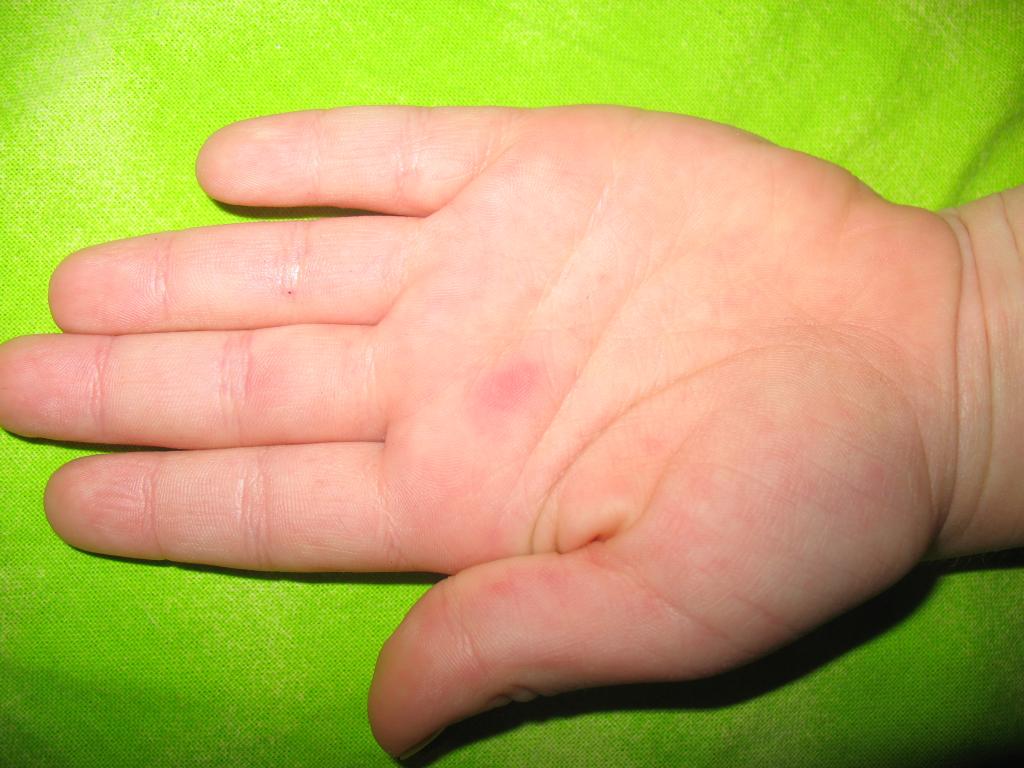
11. Osterback R., Vuorinen T., Linna M. et al. Coxsackievirus A6 and hand, foot and mouth disease, Finland. Emerg. Infect. Dis. 2009; 15 (9): 1485–1488.
12. Yamashita T., Ito M., Taniguchi A., Sakae K. Prevalence of coxsackievirus A5, A6, and A10 in patients with herpangina in aichi prefecture. J. Infect. Dis. 2005; 58: 390–391.
13. Бочаров Е. Ф., Ерман Б. А., Фомин В. В. и др. Энтеровирусная инфекция: Новые аспекты. Новосибирск: Наука. Сибирское отделение РАМН. 1990. С. 224.
14. Лозовская Л. С. и др. Значение вертикальной передачи энтеровирусов в эпидемиологии врожденных вирусных инфекций. Акушерство и гинекология. 1995; 2: 26–30.
15. Mori M., Takagi K., Kuwabara S. et al. Guillain-Barre syndrome following hand-foot-and-mouth disease. Intern. Med. 2000; 39 (6).
16. Cabral L. A., Almeida J. D., de Oliveria M. L., Meza A. C. Hand, foot and mouth disease: a case report. Quintessence Int. 1998; 29: 194–196.
17. Злобин В. И. Энтеровирусные инфекции. Инфекционные болезни. 1999. С. 302–307.
18. Демина А. В., Маркович Н. А., Нетесов С.В. Энтеровирусы. Часть 1. История открытия, таксономия, строение генома, эпидемиология. Бюллетень СО РАМН. 2008; 1 (129): 92–100.
19. Демина А. В. и др. Энтеровирусы. Часть 2. Энтеровирусные инфекции: Многообразие клинических проявлений. Бюллетень СО РАМН. 2009; 6 (140): 116–125.
20. Лобзин Ю. В., Пилипенко В. В., Громыко Ю. Н. Менингиты и энцефалиты. СПб.: Фолиант. 2001. С. 55–110.
21. Михайлов Е. В., Штейнберг А. В., Еремеева И. Г. Менингиты энтеровирусной этиологии у детей: Современные подходы к диагностике и особенности клинического течения. Инфекционные болезни. 2008; 6 (1): 31–34.
22. McMinn P., Stratov I., Nagarajan L., Davis S. Neurological manifestations of enterovirus 71 infection in children during an outbreak of hand, foot, and mouth disease in western australia. Clin. Infect. Dis. 2001; 32 (2): 236–242.
23. Nix W. A., Oberste M. S., Pallansch M. A. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens. J. Clin. Microbiol. 2006; 44 (8): 2698–2704.
24. Logotheti M., Pogka V., Horefti E. et al. Laboratory investigation and phylogenetic analysis of enteroviruses involved in an aseptic meningitis outbreak in greece during the summer of 2007. J. Clin. Virol. 2009; 46 (3): 270–274.
25. Sasidharan C. K., Sugathan P., Agarwal R. et al. Hand-foot-andmouth disease in calicut. Indian J. Pediatr. 2005; 72 (1): 17–21.
26. Tu P., Thao N., Perera D. et al. Epidemiologic and virologic investigation of hand, foot, and mouth disease, southern vietnam, 2005. Emerging Infectious Diseases. 2007; 13 (11).
27. Zhang Y., Nan L. J., Wu G. S. et al. The epidemiologic and virological analysis of an outbreak of hand, foot, and mouth disease in inner Mongolia in 2007. Bing Du Xue Bao. 2009; 25 (3): 159–165.
Диабетогенные вирусы и система гистосовместимости при инсулинзависимом сахарном диабете | Расовский
Аннотация
Обследовано 46 больных (25 мужчин и 21 женщина) с впервые диагностированным инсулинзависимым сахарным диабетом (ИЗСД) в возрасте 27,2 ± 2,7 года. Исследовали фенотип системы HLA и титр антител к вирусам эпидемического паротита и Коксаки В. У больных ИЗСД была достоверно повышена встречаемость антигенов HLA, DR3, DR4, DQ2 и DQ3. Не получено убедительных данных о связи манифестации ИЗСД с паротитной инфекцией. Достоверно чаще, чем у здоровых, выявлялись диагностически значимые титры антител к вирусам Коксаки В. Установлена тесная ассоциация высоких титров антител к вирусам Коксаки В и носительством достоверно учащенных специфичностей системы HLA. Для первичной профилактики ИЗСД предлагается вакцинация носителей иммуногенетических маркеров заболевания.
Проблема этиологии и патогенеза инсулинзависимого сахарного диабета (ИЗСД) еще далека от разрешения, однако общая концепция гетерогенности заболевания единодушно разделяется всеми ведущими диабетологами. У части больных инициатором заболевания признается вирусная инфекция, которую могут вызывать вирусы Коксаки (серогруппа В) или эпидемического паротита. Согласно современным представлениям, развитие ИЗСД может быть спровоцировано вирусной инфекцией у лиц с генетической предрасположенностью к заболеванию. Ключевым моментом патогенеза ИЗСД является воздействие диабетогенного вируса на иммуногенетически детерминированную к низкому иммунному ответу р-клетку островковой ткани поджелудочной железы. Предполагают, что отдельные эпитопы вирусной молекулы гомологичны сабсетам некоторых антигенов системы HLA, маркеров ИЗСД, которые экспрессируются иммунокомпетентными клетками, индъюсерами аутоиммунного инсулита. Именно это обстоятельство, по-видимому, препятствует распознаванию вируса как чужеродного агента у лиц, предрасположенных к ИЗСД [5, 7, 8, 12].
Вопрос о связи вирусной инфекции с антигенами гистосовместимости при ИЗСД в литературе освещен недостаточно и противоречиво. По данным некоторых исследователей [4], при манифестном ИЗСД выявлена тесная ассоциация между носительством отдельных специфичностей (особенно DR3 и DR4) системы HLA и титром антител к вирусам Коксаки. В свою очередь в других работах [10, 11, 14] установлено, что, хотя у больных с впервые выявленным ИЗСД встречаются антитела к вирусам Коксаки В!_5 с высоким титром, однако не найдено связи между наличием и титром этих антител и HLA-фенотипом.
Целью настоящей работы было сопоставление титров антител к некоторым диабетогенным вирусам и носительства отдельных антигенов системы HLA при ИЗСД в период манифестации заболевания.
Материалы и методы
Обследовано 48 больных с впервые диагностированным заболеванием (25 мужчин и 21 женщина). Средний возраст больных составил 27,2 ± 2,7 года.
Фенотипирование антигенов HLA проводили в лаборатории иммунологического типирования тканей Свердловской областной станции переливания крови с помощью стандартного микролим- фоцитотоксического теста [13] с использованием анти-НLA-сывороток Санкт- Петербургского института гематологии и переливания крови. Фенотипирование каждого больного осуществлялось не менее 2 раз и позволяло открывать 40 антигенов I класса и 14 антигенов II класса системы HLA. Для удобства статистического анализа антигены- сплиты были отнесены к более широкой специфичности. Иммуногенетическим контролем служили 500 доноров крови. Все обследованные были русские, коренные жители среднеуральского региона, не состоящие в кровном родстве. Группы больных и здоровых оказались достаточно репрезентативными, поскольку по полу, возрасту, национальной и региональной принадлежности относились к одной генеральной совокупности.
Серологические исследования с вирусами эпидемического паротита и Коксаки В выполняли в лаборатории энтеральных вирусных инфекций
Таблица 1
Иммуногенетическая характеристика некоторых (достоверно встречающихся) антигенов системы HLA у больных ИЗСД
Антиген HLA | Частота встречаемости антигена в популяции, %, (л = 500) | Частота встречаемости антигена у больных ИЗСД, %, (л = 46) | Частота встречаемости гена (р) | Относительный риск (RR) | Атрибутивный риск (8) | X2 (боль- ные/здо- ровые) |
АЗ | 33,40 | 50,00 | 0,2929 | 1,99 | 0,249 | 5,12 |
B8 | 14,60 | 26,09 | 0,1402 | 2,20 | 0,143 | 5,03 |
Cw6 | 24,20 | 2,17 | 0,0109 | 0,16 | — | 11,78 |
DR2 | 35,40 | 15,21 | 0,0792 | 0,33 | — | 7,68 |
DR3 | 26,20 | 54,35 | 0,3244 | 3,26 | 0,381 | 16,35 |
DR4 | 19,20 | 56,52 | 0,3406 | 5,48 | 0,482 | 33,82 |
DR5 | 25,60 | 8,70 | 0,0445 | 0,28 | — | 6,41 |
DQ1 | 52,40 | 26,09 | 1,1403 | 0,32 | — | 11,67 |
DQ2 | 37,20 | 58,70 | 0,3573 | 2,50 | 0,342 | 8,18 |
DQ3 | 44,20 | 67,39 | 0,4289 | 2,59 | 0,416 | 9,12 |
DQ7 | 48,40 | 17,39 | 0,0911 | 0,22 | — | 16,32 |
Примечание. хо,о5 =3,84; Хо>о1 =6,63; Xo.ooi = 10>82i Xo,oooi = 16,41.
Екатеринбургского института вирусных инфекций. Серологическую диагностику эпидемического паротита проводили в реакции торможения гемагглютинации [1] с использованием паротитного антигена Санкт-Петербургского института эпидемиологии и микробиологии им. Л. Пастера. Антитела к вирусам Коксаки В определяли в реакции непрямой гемагглютинации [2] с групповым эритроцитарным диагностикумом Екатеринбургского института вирусных инфекций. Парные сыворотки брали с интервалом в 2—3 нед. Положительными считали сыворотки, дававшие задержку гемагглютинации в разведении 1:10 и выше. Титры антител выражали с помощью отрицательных логарифмов этих чисел с основанием 2 (—log2). Серологическим контролем служили 20 практически здоровых лиц. Статистическую обработку результатов исследования проводили по общепринятым методикам.
Результаты и их обсуждение
При HLA-типировании больных ИЗСД (табл. 1) отмечено статистически высокодостоверное учащение носительства HLA-антигенов DR3, DR4, DQ2 и DQ3 по сравнению со здоровыми, в то время как антигены Cw6 и DQ7 встречались существенно реже. Наиболее высокий относительный риск (RR) развития ИЗСД выявили специфичности HLA DR4 (RR = 5,48) и DR3 (RR = 3,26), а показатель атрибутивного риска (5) оказался самым высоким для антигенов DR4 (5 = 0,482) и DQ3 (5 = 0,416).
Серологическое обследование пациентов (табл. 2) выявило низкие титры антител к вирусу эпидемического паротита (не более 1:40 у 77% больных ИЗСД) без прироста в повторных исследованиях. Средняя геометрическая титра антител к паротитному антигену составила 5,00, что достоверно (р < 0,05) ниже, чем в группе здоровых (6,40). Это обстоятельство с большой вероятностью исключает вирус эпидемического паротита как возможный этиологический фактор развития ИЗСД в исследуемой группе больных среднеуральского региона. Ранее мы показали [3], что вирус эпидемического паротита значительно чаще вызывает поражение экзокринной части поджелудочной железы, чем эндокринной. У больных ИЗСД чаще, чем в контрольной группе, выявлялись диагностически значимые титры антител к вирусам Коксаки В (средние геометрические соответственно 5,80 и 3,81), что указывает на определенную причинную связь заболевания с этими вирусами.
При сопоставлении титров антител к эпидемическому паротиту в подгруппах больных — носителей HLA-антигенов DR3, DR4, DQ2 и DQ3 (см. табл. 2) достоверного различия между подгруппами и общей группой больных не выявлено (/? > 0,1). В противоположность этому средние геометрические титров антител к вирусам Коксаки В у больных — носителей достоверно чаще встречающихся антигенов HLA (соответственно 7,61, 7,88, 7,15, 7,18) оказались существенно выше (р < 0,05), чем в общей группе больных (5,80), и значительно выше (р < 0,01), чем у здоровых (3,81). Таким образом, в обследованной группе отмечена надежная сопряженность между носительством антигенов системы HLA, маркеров ИЗСД и иммунным ответом на энтеровирусную атаку.
В литературе неоднократно обсуждался вопрос о возможности и целесообразности специфической вакцинации как средства первичной профилактики ИЗСД. Однако создание поливалентной вакцины и массовая вакцинация населения (преимущественно детей и подростков) даже по самым скромным подсчетам — весьма дорогостоящее мероприятие [6]. Более перспективным и экономичным может стать предварительный скрининг носителей иммуногенетических маркеров ИЗСД с последующей вакцинопрофилакти- кой, которую следует проводить с обязательным учетом региональной эпидемической обстановки.
Выводы
- У больных ИЗСД достоверно повышена встречаемость антигенов HLA, DR3, DR4, DQ2 и DQ
- Не получено убедительных данных о связи манифестации ИЗСД с паротитной инфекцией.
Таблица 2
Титры антител к вирусам эпидемического паротита и Коксаки В у больных ИЗСД — носителей некоторых (достоверно чаще встречающихся) антигенов HLA (—log2)
Больные ИЗСД
Вирус | Здоро вые (и = 20) | общая группа (л = 46) | носители HLA- DR3 (и = 25) | носители HLA- DR4 (л = 26) | носители HLA- DQ2 (л = 27) | носители HLA- DQ3 (л = 31) |
Эпиде | ||||||
мический | ||||||
паротит | 6,40 | 5,00 | 5,17 | 5,23 | 4,98 | 5,08 |
Pl | < 0,05 | < 0,05 | < 0,05 | < 0,05 | < 0,05 | |
Р2 | > 0,1 | > 0,1 | > 0,1 | > 0,1 | ||
Коксаки В | 3,81 | 5,80 | 7,61 | 7,88 | 7,15 | 7,18 |
Pl | < 0,05 | < 0,01 | < 0,01 | < 0,01 | < 0,01 | |
Р2 | < 0,05 | < 0,05 | < 0,05 | < 0,05 |
Примечание. — достоверность различий с группой здоровых; Р2 — достоверность различий с общей группой больных.
- Достоверно чаще, чем в контрольной группе, выявлены диагностически значимые титры антител к вирусам Коксаки (серологическая группа В).
- Установлена тесная ассоциация высоких титров антител к вирусам Коксаки В и носительства достоверно чаще встречающихся специфичностей системы HLA.
1. Васильева Г. А., Зотин В. В. // Острые вирусные инфекции у детей. — Л., 1981. — С. 119—123.
2. Венедиктова Н. Я., Сергеев А. Г. и др. Использование РИГА в диагностике энтеровирусных инфекций: Метод, рекомендации / Закирова С. Ф. — Свердловск, 1986.
3. Северина Т. И., Колпакова В. Е., Венедиктова Н. Я. и др. // Пробл. эндокринол. — 1993. — № 5. — С. 14—16.
4. Banatvala J. Е., Schemthaner G., Schober Е. et al. // Lancet. — 1985. — Vol. 1, N 8483. — P. 1409-1412.
5. Botazzo G. F., Bosi E., Bonifacio E. et al. // Brit. med. Bull. — 1989. — Vol. 45, N 1. — P. 37-57.
6. Colman P. G., Elsenbarth G. S. // The Diabetes Annual / Eds K. Alberti, L. Krall. — New York. — P. 17-45.
7. Flier J. S., Underhill L. H., Eisenbarth G. S. et al. // N. Engl. J. Med. — 1986. — Vol. 314, N 12. — P. 1360-1368.
8. Harrison L. C., Campbell I. L., Allison J., Miller J. F. // Diabetes. — 1989. — Vol. 38, N 7. — P. 815-818.
9. Kawara A., Hirose Y., Hasegawa S. et al. // J. Jap. Diabet. Soc. — 1984. — Vol. 27, N 5. — P. 637-637.
10. Platz P-, Jacobsen В. K, Svejgaard A. et al. // Diabetologia. — 1982. — Vol. 23, N 1. — P. 16-18.
11. Sakurami T., Nabeja N., Nagaoka K. et al. // Ibid. — 1982. — Vol. 22, N 5. — P. 333-337.
12. Scherthaner G., Mayr Ж. R. // Exp. clin. Endocrinol. — 1984. -Vol. 83, N 2. — P. 184-191.
13. Terasaki P. P., Me Clelland J. // Nature. — 1964. — Vol. 204, N 4960. — P. 998-1000.
14. West R., Colle E., Belmonte M. M. et al. // Diabetologia. — 1981. — Vol. 30, N 7. — P. 584-589.
— редкий доброкачественный вирус внезапно становится неприятным и направляется в США
.
Вирусологи уже несколько лет выражают озабоченность по поводу вируса Зика, но только после его прибытия в Пуэрто-Рико во время курортного сезона о нем начали появляться новости.
Некоторые заголовки были сосредоточены на очевидной связи между инфекцией Зика у беременных женщин и рождением детей с маленьким мозгом — состоянием, известным как микроцефалия. Эта ассоциация по-прежнему во многом косвенная, но если бы это было правдой, было бы чрезвычайно тревожно.Зика также, по-видимому, изменил свое поведение и в других отношениях: он быстрее распространяется, распространяется половым путем, а также вызывает у некоторых выживших неприятный поствирусный синдром Гийена-Барре. Хотя СГБ может быть фатальным, наихудшим проявлением СГБ у выздоровевших пациентов с вирусом Зика до сих пор был частичный временный паралич.
Судя по предыдущему опыту, вирус Зика казался маловероятным кандидатом на новую большую глобальную вирусную эпидемию. Обнаруженный у макак в 1947 году в лесу Зика в Уганде, первый случай заболевания человека был обнаружен почти десятью годами позже.Зика, передаваемый через укус комара, протекал в легкой форме по сравнению с другими представителями семейства флавивирусов, которое включает опасную желтую лихорадку, лихорадку денге и вирус Западного Нила. Никто не умер в результате заражения вирусом Зика, а клинический интерес был настолько низким, что в медицинской литературе было описано не более десятка подтвержденных случаев. Кратковременная высокая температура, сыпь, небольшая боль в суставах и, в худшем случае, небольшая головная боль и тошнота — Зика была едва ли хуже, чем доза гриппа.
Поворотный момент
Предупреждающие колокола начали тихо звучать в 2007 году.Хотя до этой даты работники общественного здравоохранения, проводящие плановую диагностику, выявляли антитела против вируса Зика в самых разных местах тропической Африки и Юго-Восточной Азии, что указывает на то, что довольно много людей сталкивались с вирусом Зика в какой-то момент своего детства. жизни. Но не было никаких предположений, что вирус был особенно распространен или быстро распространялся. В 2007 году вирус Зика вырвался из установленного ареала и впервые появился на изолированном микронезийском острове Яп в Тихом океане, примерно в 1800 км к востоку от Филиппин.Вспышка вируса Яп составила 180 случаев, и это был первый случай, когда случаи вируса Зика были зарегистрированы в любом кластере.
Все снова затихло до 2013 года. В течение этого промежутка времени исследование эволюции вируса Зика пришло к выводу, что он, вероятно, возник в Восточной Африке в начале 20 века и распространился в Юго-Восточную Азию во время Второй мировой войны. Микронезийский штамм явно азиатского происхождения.
Затем, в 2013 году, массовая вспышка болезни произошла в Полинезии, в восточной части Тихого океана.С появлением вируса Зика на острове Пасхи в начале 2014 года его распространение в Южной Америке было лишь вопросом времени. Точная точка входа неизвестна — обсуждались международные соревнования по гребле на каноэ или чемпионат мира 2014 года, — но как только вирус Зика закрепился в Бразилии, он взорвался таким образом, что даже вспышки на островах Тихого океана выглядели небольшими. Потенциально зарегистрировано более миллиона случаев, включая первые смертельные случаи и очевидную связь между вирусом Зика и микроцефалией.Сигнальные колокола теперь были на полной громкости.
Направление в США
В то время как вирусу Зика потребовалось столетие, чтобы охватить территорию от Центральной Африки до Дальнего Востока, а затем еще восемь лет, чтобы пересечь Тихий океан, теперь он повернул на север, как вирус в спешке. К концу 2015 года вирус Зика достиг Мексики и Карибского бассейна. Сообщение о первом случае к северу от Рио-Гранде может быть лишь вопросом времени.
Через Рио-Гранде — часть границы США и Мексики.www.shutterstock.com
Неистовый прогресс вируса Зика теперь находит отражение во все более интенсивных исследованиях. Есть несколько важных, но пока еще не решенных вопросов. Реальна ли связь с микроцефалией, или всплеск микроцефалии в Бразилии — это просто параллельная эпидемия, вызванная чем-то другим? Почему во время вспышек заболеваний на островах в Тихом океане не сообщалось о микроцефалии? Если связь с микроцефалией доказана, что это означает для затронутых сообществ? Может ли вирус Зика установить постоянное присутствие в США, как его относительный вирус Западного Нила, или, в качестве альтернативы, он остановится на границе с Мексикой, как его двоюродный брат, лихорадка денге? Что означает аналогичное расширение ареала комаров Aedes на север как для вируса Зика, так и для денге?
События происходят почти ежедневно.2016 год может оказаться годом Зика.
В более ранней версии этой статьи говорилось: «… а также о том, что у некоторых выживших был тяжелый поствирусный синдром Гийена-Барре, который в худшем случае может привести к частичному временному параличу».
Это исправлено на:
«… а также нагромождение некоторых выживших с отвратительным поствирусным синдромом Гийена-Барре (СГБ). Хотя СГБ может быть фатальным, наихудшим проявлением СГБ у выздоровевших пациентов с вирусом Зика до сих пор был частичный временный паралич.”
Wattpad — Где живут истории
- Просматривать
- Просмотр
- Платные истории
- Историческая фантастика
- Поэзия
- Выбор редактора
- Фильм ужасов
- Романтика
- Ватт 2020
- Юмор
- Научная фантастика
- Приключение
- ЛГБТК +
- Короткий рассказ
- Современное освещение
- Тайна
- Подростковая фантастика
- Разнообразный горит
- Новый взрослый
- Триллер
- Фанфики
- Нехудожественная литература
- Оборотень
- Фантазия
- Паранормальное явление
- Выбор Wattpad
- Выбор редактора
- Доступно в книжных магазинах
- От наших звезд
- Хиты Wattpad Studios
- Куратор сообщества: @grendelthegood
- Сообщество
Награды Уотти
- Писать
Создать новую историю
- Мои истории
- Возможности писателя
- Соревнования по писательству
Попробовать Премиум
Авторизоваться
Зарегистрироваться
Мы не смогли найти то, что вы искали.Вы можете попробовать поискать что-нибудь еще, что вам нравится!
Обзор тем
платные истории
историческая фантастика
поэзия
Выбор редактора
фильм ужасов
романтика
ватт2020
юмор
научная фантастика
приключение
лгбт
короткий рассказ
современный
тайна
подростковая
Диверселит
новый взрослый
триллер
фанфикшн
документальная литература
оборотень
фантазия
Паранормальное явление
Открой для себя больше
- Платные истории
- Попробовать Премиум
- Скачать приложение
- Язык
- Писатели
- Бизнес
- Работа
- Пресс
- Условия
- Конфиденциальность
- Доступность
- Справка
- © 2021 Wattpad
JCM | Август 2019 — Обзор статей
Цели.Две трети пациентов с сердечной недостаточностью и сохраненной фракцией выброса (HFpEF) имеют показания к пероральной антикоагуляции (OAC) для предотвращения тромбоэмболических событий. Однако данные о безопасности OAC при HFpEF ограничены. Поэтому нашей целью было описать случаи кровотечения и найти предикторы кровотечения в большой когорте HFpEF. Методы и результаты. Мы зарегистрировали случаи кровотечений в проспективной когорте HFpEF. Из 328 пациентов (средний возраст 71 год (межквартильный размах (IQR) 67–77)) 64.6% ( n = 212) получали ОАК. Из них 65,1% ( n = 138) получали антагонисты витамина K (VKA) и 34,9% ( n = 72) пероральные антикоагулянты без витамина K (NOAC). В течение среднего периода наблюдения 42 месяца (IQR 17–63) месяца произошло 54 кровотечения. У пациентов, получавших ОАК, наблюдалось больше кровотечений ( n, = 49 (23,1%) по сравнению с n, = 5 (4,3%), p, , n, = 18 (36,7%)]. HAS-BLED (гипертензия, нарушение функции почек) / Функция печени, инсульт, кровотечение в анамнезе или предрасположенность, лабильное МНО, пожилые люди, одновременное употребление наркотиков / алкоголя) оценка (отношение рисков (HR) 2.15 (95% доверительный интервал (ДИ) 1,65–2,79, p p = 0,013)) и оценка HAS-BLED (HR 1,74 (95% ДИ 1,15–2,64, p = 0,009)] оставались значимо связанными с кровотечением после корректировки. mRAP обеспечил дополнительную прогностическую ценность помимо оценки HAS-BLED с улучшением с 0,63 до 0,71 (95% ДИ 0,58–0,84, p для сравнения 0,032) по C-статистике. подтверждается значительными улучшениями в чистом индексе реклассификации (61.3%, p = 0,019) и интегрированное улучшение дискриминации (3,4%, p = 0,015). Заключение. Пациенты с HFpEF, принимающие OAC, имеют высокий риск желудочно-кишечного кровотечения. Высокий показатель mRAP как индикатор поздней стадии заболевания был прогнозирующим для событий желудочно-кишечного кровотечения и предоставил дополнительную информацию о стратификации риска помимо той, которая была получена по шкале HAS-BLED.
Полная статья
.
