Внутриутробная инфекция | Детская городская больница №17
Внутриутробная инфекция — болезнь плода или новорождённого, возникшая вследствие его антенатального или интранатального заражения возбудителем какого-либо инфекционного заболевания.
В настоящее время адекватные статистические данные по внутриутробным инфекциям отсутствуют. Однако существуют отдельные исследования, косвенно свидетельствующие о значительной распространённости внутриутробных инфекций. Та
к, в среднем у 33% женщин детородного возраста и у 60-80% пациенток, относимых к группе высокого риска, в слизи из цервикального канала обнаруживают цитомегаловирус и вирус простого герпеса. Нормальную влагалищную микрофлору выявляют менее чем у 50% беременных. В последнее десятилетие прослеживается отчётливая тенденция к увеличению доли внутриутробны
х инфекций в структуре перинатальной смертности (главным образом за счёт улучшения диагностики). Частота инфицирования в определённой степени зависит от эпидемиологической ситуации и особенно высока среди групп населения с низким социальным статусом.
При генерализованной внутриутробной инфекции прогноз неблагоприятен: летальность достигает 80%. У детей, выживших после тяжёлых форм менингоэнцефалита или фетального гепатита, формируется грубая задержка психомоторного развития или хронический гепатит соответственно. При локализованных формах внутриутробных инфекций прогноз главным образом зависит от нали
чия сопутствующих патологических состояний, своевременности и адекватности лечения. К наиболее тяжёлым последствиям приводит поражение ЦНС. Однако и при иной локализации процесса не исключено серьёзное поражение многих органов (кардиомиопатия, фиброэластоз эндокарда, интерстициальный нефрит, бронхо-лёгочная дисплазия с формированием хронической патологии органов дыхания, хронический гепатит с исходом в цирроз и т.п.). Мало- или бессимптомное течение внутриутробных инфекций в дальнейшем приводит к развитию отсроченной патологии.
Источник: Детские болезни. Баранов А.А. // 2002.
Диагностика внутриутробных инфекций у новорожденных в раннем неонатальном периоде | Аксенов А.
 Н., Бочарова И.И., Башакин Н.Ф., Троицкая М.В., Якубина А.А., Букина М.Ю., Будыкина Т.С.
Н., Бочарова И.И., Башакин Н.Ф., Троицкая М.В., Якубина А.А., Букина М.Ю., Будыкина Т.С.
Внутриутробная инфекция (ВУИ) занимает одно из ведущих мест в структуре неонатальной смертности, являясь основной причиной смерти или осложняя течение основного заболевания у 37,5% умерших новорожденных.
Достоверных данных об истинной распространенности ВУИ нет. Однако, согласно данным ряда исследований, инфекционные заболевания выявляют у 50–60% госпитализированных доношенных и 70% недоношенных новорожденных [1]. Основной причиной ВУИ являются инфекционные урогенитальные заболевания матери, частота которых в структуре заболеваемости беременных сохраняется высокой в течение последних 10 лет и составляет 88–100 на 1000 беременных. К сожалению, в настоящее время мы не имеем достоверных сведений о вероятности заражения плода от инфицированной матери, но риск инфицирования плода различными микроорганизмами, выделенными у матери, колеблется от 5 до 70%, а данные о частоте реализации инфекции у новорожденного недостаточны и крайне противоречивы [2, 3].
Ранняя диагностика инфекционно-воспалительных заболеваний у новорожденных остается актуальной до настоящего времени, в связи с чем в последние годы применяются новые информативные диагностические методики. К ним относятся исследование цитокинового статуса [4, 5], определение белков острой фазы (С-реактивный белок) [6, 7] и прокальцитонина (ПКТ) [8, 9], а также другие диагностические тесты, характеризующиеся выявлением того или иного достоверно отличающегося параметра [10–14].
Большой интерес представляет исследование роли про- и противовоспалительных цитокинов в патогенезе инфекционных заболеваний у новорожденных [15–17]. Во многих работах [18–20] сообщается о высокой диагностической и прогностической ценности определения уровней ФНО и ИЛ-8 при неонатальном сепсисе. Некоторые авторы [21, 22] для повышения информативности теста на С-реактивный белок предлагают использовать его комбинацию с определением уровня ИЛ-6, который играет важную роль в запуске синтеза С-реактивного белка гепатоцитами, при диагностике неонатальных бактериальных инфекций.
Доказано, что ПКТ является чувствительным маркером системной воспалительной реакции у новорожденных на 3-7-е сут жизни, а после 14-го дня жизни отмечается увеличение диагностической значимости провоспалительных цитокинов. Однако ПКТ может превосходить C-реактивный белок в определении и оценке тяжести инфекции, о чем свидетельствует опыт многих исследований. Несмотря на большое число публикаций, посвященных диагностической значимости ПКТ при системных инфекциях, в т. ч. и у новорожденных, нет однозначного мнения о возможности использования этого показателя при диагностике инфекционно-воспалительных заболеваний в первые 2 сут жизни в связи с большим разбросом его контрольных диапазонов в данный возрастной период [8, 23, 24].
Цель настоящего исследования: повысить качество диагностики ВУИ и оптимизировать тактику ведения новорожденных высокого инфекционного риска в раннем неонатальном периоде путем применения алгоритма обследования с использованием доступных и информативных тестов.
Материалы и методы
Было проведено обследование 240 доношенных и 10 недоношенных новорожденных, родившихся у матерей с инфекционно-воспалительными заболеваниями урогенитального тракта. Среди беременных преимущественно вирусные инфекции отмечались в 35 (14%) наблюдениях, бактериальные — в 30 (12%), а в 185 (74%) — встречались смешанные вирусно-бактериальные инфекции. Урогенитальный хламидиоз диагностирован у 85 (34%) пациенток, уреаплазма выявлялась в 75 (30%) наблюдениях, микоплазмы — в 30 (12%) случаях. ВПГ-2 инфекция обнаружена у 135 (54%) матерей, цитомегаловирусная инфекция (ЦМВИ) — у 180 (72%). Хронические заболевания почек и мочевыводящих путей имели 45 (18%) женщин, у каждой пятой пациентки (20%) к моменту родоразрешения сохранялись проявления кольпита, у 40 (16%) — цервицита.
Течение настоящей беременности осложнилось присоединением преэклампсии у 50 (20%) матерей, с такой же частотой была диагностирована анемия беременных, угроза прерывания беременности имела место примерно у половины (46%) пациенток. По результатам комплексной оценки нарушения функции фетоплацентарного комплекса были диагностированы у 100 (40%) беременных, многоводие — в 30 (12%) наблюдениях.
По результатам комплексной оценки нарушения функции фетоплацентарного комплекса были диагностированы у 100 (40%) беременных, многоводие — в 30 (12%) наблюдениях.
Роды были самопроизвольными в 160 (64%) наблюдениях, путем операции кесарева сечения родоразрешение было выполнено 86 (34,4%) беременным, у 4 (1,6%) рожениц была применена вакуум-экстракция плода. Продолжительность родов колебалась от 2,75 до 18 ч, длительность безводного промежутка — от 2,5 до 24 ч. Роды осложнились слабостью родовой деятельности в 40 (16%) наблюдениях, дородовое излитие околоплодных вод отмечалось у 30 (12%) рожениц. У 20 (8%) пациенток в родах развился хориоамнионит.
Для выявления клинико-лабораторных корреляций новорожденные были разделены на 6 групп в зависимости от основного клинического диагноза.
1-ю группу составили 45 (18%) новорожденных с генерализованными и тяжелыми локализованными формами ВУИ, которые включали сепсис, менингоэнцефалит, пневмонию, гастроэнтероколит.
2-я группа состояла из 30 (12%) новорожденных с локализованными инфекционными процессами средней степени тяжести, а именно: везикулопустулез, конъюнктивит, ринит, омфалит, вульвовагинит, локальные формы кандидоза.
3-я группа объединила 25 (10%) новорожденных с выявленными при ультразвуковых исследованиях морфологическими изменениями в центральной нервной системе (ЦНС) и внутренних органах, что позволило предположить перенесенную ВУИ.
4-ю группу составили 30 (12%) новорожденных с гипоксическими повреждениями ЦНС разной степени тяжести.
5-я группа включала 28 (11,2%) новорожденных с задержкой внутриутробного развития (ЗВУР).
6-я группа состояла из 92 (36,8%) клинически здоровых новорожденных.
Наряду со стандартным клинико-лабораторным обследованием, которое проводилось всем новорожденным, 158 детям было проведено ультразвуковое исследование вилочковой железы (ВЖ) — ультразвуковая тимометрия, у 90 новорожденных в рамках иммунологического обследования было проведено исследование интерферонового статуса (ИФС) и концентрации цитокинов (ФНО-α, ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8, α- и γ-ИФН) в сыворотке крови, спонтанных и стимулированных культурах клеток крови, у 50 детей определялся уровень ПКТ экспресс-методом.
Частота выделения представителей аэробной микрофлоры в мазках со слизистой носоглотки, из ануса у новорожденных высокого инфекционного риска в момент рождения составила от 40,2% (у клинически здоровых новорожденных) до 62,2% (у детей с тяжелыми формами ВУИ). Для тяжелых форм ВУИ была характерна высокая частота контаминации новорожденных представителями инфекций, передающихся половым путем: ВПГ-2 — 43,6%, ЦМВИ — 58,2%, хламидии — 41,8%, уреаплазма — 52,7%, микоплазма — 32,7%.
Результаты исследования
На основании оценки клинических данных и показателей иммунитета с использованием перцентильной шкалы основных иммунологических показателей у обследованных новорожденных были выделены следующие варианты иммунного реагирования и состояния цитокинового статуса в раннем неонатальном периоде.
У новорожденных с тяжелыми формами ВУИ (обследовано 14 детей) были выявлены два варианта иммунного реагирования. Первый вариант (8 новорожденных) характеризовался активацией клеток врожденного и адаптивного иммунитета в сочетании с их незрелостью, повышением ИФН в сыворотке крови и способности лейкоцитов к продукции α-ИФН при низкой способности лимфоцитов к выработке γ-ИФН. У 2-х новорожденных, умерших в раннем неонатальном периоде, выявлялось наиболее выраженное угнетение как α-(4–8 МЕ/мл), так и γ-(<4 МЕ/мл) интерфероногенеза при низкой концентрации ИФН в сыворотке крови (<4 МЕ/мл), что позволяет рассматривать эти показатели в качестве прогноза неблагоприятного исхода (р=0,03) у новорожденных с ВУИ. В сыворотке крови у всех детей определялся ИЛ-8 (в 75% наблюдений его количество превышало 50 пкг/мл), имело место снижение продукции ИЛ-6, ИЛ-1, ФНО-α.
У 2-х новорожденных, умерших в раннем неонатальном периоде, выявлялось наиболее выраженное угнетение как α-(4–8 МЕ/мл), так и γ-(<4 МЕ/мл) интерфероногенеза при низкой концентрации ИФН в сыворотке крови (<4 МЕ/мл), что позволяет рассматривать эти показатели в качестве прогноза неблагоприятного исхода (р=0,03) у новорожденных с ВУИ. В сыворотке крови у всех детей определялся ИЛ-8 (в 75% наблюдений его количество превышало 50 пкг/мл), имело место снижение продукции ИЛ-6, ИЛ-1, ФНО-α.
Второй вариант (6 новорожденных) отличался отсутствием активации иммунитета и повышения ИФН, дефицитом фагоцитов, зрелых Т- и В-лимфоцитов. Способность лейкоцитов к продукции α-ИФН была в пределах нормативных значений, а способность лимфоцитов к продукции γ-ИФН — несколько выше, чем при первом варианте. ИЛ-8 в сыворотке крови определялся в 30% наблюдений (уровень не превышал 50 пкг/мл). Данный вариант иммунного реагирования был характерен для таких форм течения заболевания, которые возникали в результате аспирации и заглатывания околоплодных вод с развитием аспирационных пневмоний, что больше свидетельствовало об интранатальном инфицировании и подтверждалось высокой частотой осложнений в родах, более поздними сроками манифестации ВУИ в раннем неонатальном периоде, отсутствием генерализованных форм инфекции и летальных исходов.
Отличительными чертами иммунного ответа у новорожденных с локализованными инфекционно-воспалительными заболеваниями средней степени тяжести (обследовано 10 новорожденных) являлись: отсутствие изменений количества и зрелости клеток врожденного и адаптивного иммунитета с преобладанием провоспалительного иммунного ответа в виде повышения уровня IgM и сывороточного ИФН, высокой способности к продукции α-ИФН, преобладанием продукции γ-ИФН над продукцией ИЛ-4 (<10 пкг/мл) без иммунологических критериев системной инфекции (отсутствие ИЛ-8 и провоспалительных цитокинов в сыворотке крови, неизмененная продукция лимфокинов и монокинов).
Состояние иммунитета у новорожденных с выявленными при ультразвуковых исследованиях морфологическими изменениями в ЦНС и внутренних органах (обследовано 8 детей) характеризовало законченный к моменту рождения инфекционный процесс. Иммунный ответ характеризовался повышением числа зрелых иммунокомпетентных клеток и уровня IgG, показатели ИФС не отличались от нормативных значений. Была снижена индуцированная продукция ИЛ-1 и ФНО-α, повышена продукция α-ИФН и ИЛ-4, преобладала противовоспалительная направленность иммунного ответа.
Была снижена индуцированная продукция ИЛ-1 и ФНО-α, повышена продукция α-ИФН и ИЛ-4, преобладала противовоспалительная направленность иммунного ответа.
Результаты микробиологического исследования у матерей (герпес-вирусная этиология инфекции в 90,9% случаев) и их новорожденных (выделение ВПГ-2 в 43,6%, ЦМВИ — в 58,2%) в сочетании с нарушениями в цитокиновом статусе в виде усиления продукции α-ИФН, снижения продукции ИЛ-1 и ФНО-α подтверждали вирусную этиологию заболевания. Изменения со стороны ЦНС и внутренних органов, выявленные при рождении, в сочетании с показателями иммунитета позволяют предположить раннее внутриутробное инфицирование, преимущественно вирусной этиологии, с благоприятным исходом для жизнеспособности плода на фоне проводимой этиотропной терапии в антенатальном периоде, но с формированием стойких структурных изменений, преимущественно ЦНС, к моменту рождения.
У новорожденных с гипоксическими повреждениями ЦНС (обследовано 15 новорожденных) гипоксия являлась дополнительным повреждающим фактором, способствующим увеличению антигенной нагрузки, и в условиях низкого риска внутриутробного инфицирования (у 8 детей) приводила к активации клеток врожденного иммунитета без изменений в цитокиновом статусе. При сочетании гипоксии с микробной контаминацией у 7 новорожденных иммунный ответ характеризовался повышенным потреблением макрофагов из кровеносного русла, увеличением уровня IgM в сыворотке крови, усилением продукции провоспалительных цитокинов, снижением способности лимфоцитов к продукции γ-ИФН, что не исключало манифестацию ВУИ, клинические проявления которой на фоне симптомов повреждения ЦНС и проводимой противоинфекционной терапии могли быть стертыми.
При сочетании гипоксии с микробной контаминацией у 7 новорожденных иммунный ответ характеризовался повышенным потреблением макрофагов из кровеносного русла, увеличением уровня IgM в сыворотке крови, усилением продукции провоспалительных цитокинов, снижением способности лимфоцитов к продукции γ-ИФН, что не исключало манифестацию ВУИ, клинические проявления которой на фоне симптомов повреждения ЦНС и проводимой противоинфекционной терапии могли быть стертыми.
Иммунный ответ у новорожденных со ЗВУР (обследовано 14 детей) характеризовался снижением количества клеток врожденного и адаптивного иммунитета (CD3+, CD20+, CD8+, CD16+, моноцитов). Были установлены два типа ИФС. Отличительными особенностями первого типа ИФС были отсутствие ИФН в сыворотке крови и высокая способность лимфоцитов к продукции γ-ИФ. Второй тип ИФС был сопряжен с повышением сывороточного ИФН (16 МЕ/мл) и низкой способностью лимфоцитов к продукции γ-ИФН (<4 МЕ/мл). Имелась статистически значимая зависимость (р=0,004) между вторым типом ИФС и частотой постнатальной инфекции у новорожденных со ЗВУР, которая составила 64,3% (заболели 9 новорожденных).
Показатели иммунитета и цитокинового статуса у клинически здоровых новорожденных без микробной контаминации (обследовано 17 детей) не отличались от нормативных значений. Микробная контаминация у клинически здоровых новорожденных (12 детей) иммунологически характеризовалась увеличением числа зрелых клеток адаптивного иммунитета (CD3+, CD20+, CD4+, CD8+, CD16+), уровня IgG, уменьшением числа клеток врожденного иммунитета (нейтрофилов и моноцитов), повышением способности лейкоцитов к продукции α-ИФН (128 МЕ/мл и 545,3 пкг/мл), ИЛ-1 (329,6 пкг/мл) и ФНО-α (748,6 пкг/мл) в 1,5–2 раза. Продукция γ-ИФН, ИЛ-6 и ИЛ-4 не отличалась от нормативных значений, сохранялся баланс продукции γ-ИФН (22,5 пкг/мл) и ИЛ-4 (23,5 пкг/мл). Изменения показателей иммунитета у здоровых новорожденных от матерей с урогенитальными инфекциями зависели от наличия микробной контаминации, которая характеризовалась повышением числа зрелых иммунокомпетентных клеток, способных к выработке про- и противовоспалительных цитокинов, поддержание баланса которых препятствовало манифестации ВУИ.
Иммунологическими критериями ранней диагностики тяжелых форм ВУИ у новорожденных являются: повышение уровня IgM более 1,0 г/л и снижение уровня IgG менее 6,6 г/л в сыворотке крови; повышение в периферическом кровотоке ранних предшественников Т- и В-лимфоцитов — более 70,4%, незрелых Т-лимфоцитов — более 19,4%; повышение ИФН в сыворотке крови до 16 МЕ/мл и более в сочетании со снижением способности лимфоцитов к продукции γ-ИФН менее 4 МЕ/мл или менее 3,0 пкг/мл; увеличение содержания ИЛ-8 в сыворотке крови более 50 пкг/мл и (или) снижение продукции γ-ИФН менее 3,0 пкг/мл в сочетании с низкой продукцией ИЛ-4 (менее 10 пкг/мл).
Поскольку основным органом иммунной системы у плода и новорожденного является тимус, были сопоставлены морфологические особенности ВЖ и иммунного статуса новорожденных группы высокого инфекционного риска для выявления информативных и доступных критериев ранней диагностики ВУИ и иммунной недостаточности. Проведенные исследования показали четкую взаимосвязь между объемом ВЖ, наличием и тяжестью клинических проявлений ВУИ и дефектами иммунитета у новорожденных в раннем неонатальном периоде (табл. 1).
1).
Выявленная эхоскопически тимомегалия с объемом ВЖ более 2,5 мл/кг была статистически значимой для тяжелых форм ВУИ с нарушениями иммунного ответа в виде незрелости и активации клеток врожденного и адаптивного иммунитета с глубоким нарушением их эффекторных функций. Уменьшение объема ВЖ менее 1 мл/кг коррелировало с дисфункцией иммунитета в виде дефицита зрелых иммунокомпетентных клеток и недостаточности провоспалительного иммунного ответа, что клинически характеризовалось затяжным течением ВУИ и высокой частотой постнатальных инфекционно-воспалительных заболеваний у новорожденных.
Учитывая диагностическую значимость ПКТ при системных инфекциях, в т. ч. и у новорожденных, а также большой разброс контрольных диапазонов этого показателя в первые 2 сут жизни, было проведено исследование уровня ПКТ экспресс-методом у 40 доношенных и 10 недоношенных новорожденных.
Новорожденные были разделены на 4 группы с учетом характера патологии.
1-я группа состояла из 21 новорожденного с внутриутробной пневмонией.
2-я группа включала 6 новорожденных, у которых по сумме данных анамнеза, клинических симптомов и результатов лабораторного обследования была диагностирована ВУИ без четко установленного очага.
3-я группа объединила 13 новорожденных с патологией неинфекционного характера.
В 4-ю группу были включены 10 клинически здоровых новорожденных.
Исследование ПКТ у новорожденных проводилось на 1-е, 2-е и 3-и сут жизни (табл. 2).
Повышение уровня ПКТ более 2 нг/мл в первые сутки жизни было статистически значимым для тяжелых форм ВУИ, сопровождающихся системной воспалительной реакцией и симптомами органной недостаточности. В то же время у новорожденных без симптомов инфекционно-воспалительных заболеваний не отмечалось повышения уровня ПКТ в сыворотке крови в первые 48 ч жизни. Полученные результаты исследования позволяют использовать повышение уровня ПКТ более 2 нг/мл в качестве раннего диагностического критерия тяжелых форм ВУИ у новорожденных, начиная с первых суток жизни.
Заключение
Таким образом, в нашем исследовании показана четкая взаимосвязь между наличием и тяжестью клинических проявлений ВУИ, дефектами иммунитета, состоянием ВЖ и результатами полуколичественного экспресс-теста на определение ПКТ. Предложенные иммунологические показатели нарушений цитокинового статуса и ультразвуковые критерии патологии ВЖ, повышение ПКТ более 2 нг/мл с первых суток жизни могут быть использованы в качестве критериев ранней диагностики и тяжести ВУИ.
Литература
- Сидорова И.С., Макаров И.О., Матвиенко Н.А. Внутриутробные инфекции. М.: МИА, 2006. 176 с.
- Фризе К., Кахель В. Инфекционные заболевания беременных и новорожденных. Пер. с нем. М.: Медицина, 2003. 424 с.
- Неонатология – национальное руководство / Под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2008. 749 с.
- Ахматова Н.К., Киселевский М.В. Врожденный иммунитет: противоопухолевый и противоинфекционный.
 М.: Практическая медицина, 2008. 256 с.
М.: Практическая медицина, 2008. 256 с. - Akira S., Uematsu S., Takeuchi O. Pathogen recognition and innate immunity // Cell. 2006. Vol. 124 (4). P. 783–801.
- Липагина А.А. Диагностическое и прогностическое значение исследования белков острой фазы и иммуноглобулинов у новорожденных детей из группы риска по развитию гнойно-септических заболеваний: автореф. дис. на соиск. учен. степ. к.м.н. М., 2000.19 с.
- Hofer N., Zacharias E., Müller W., Resch B. An update on the use of C-reactive protein in early-onset neonatal sepsis: current insights and new tasks // Neonatol. 2012. Vol. 102(1). P. 25–36.
- Бирюкова Т.В., Солдатова И.Г., Милева О.И. и др. Диагностическая информативность уровня прокальцитонина в сыворотке крови новорожденных при раннем неонатальном сепсисе // Вопросы практической педиатрии. 2007. № 3. С. 5–11.
- Casado-Flores J., Blanco-Quirós A., Asensio J. et al. Serum procalcitonin in children with suspected sepsis: a comparison with C-reactive protein and neutrophil count // Pediatr.
 Crit. Care Med. 2003. P.190–195.
Crit. Care Med. 2003. P.190–195. - Дегтярева М.В. Современные возможности иммунокорригирующей терапии тяжелых инфекционно-воспалительных и иммунопатологических состояний у новорожденных // Иммунокоррекция в педиатрии / Под ред. М.П. Костинова, М.: Медицина для всех, 2001. С.182–194.
- Ганковская Л.В., Макаров О.В., Ковальчук Л.В. и др. Система цитокинов амниотической жидкости при внутриутробной инфекции // Новые технологии в перинатологии: материалы ежегодного конгресса специалистов перинатальной медицины. М., 2008. С. 19.
- Shozushima T., Takahashi G., Matsumoto N. et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diag¬nostic criteria of systemic inflammatory response syndrome // J. Infect. Chemother. 2011. Vol.17(6). P. 764–769.
- Adly A.A., Ismail E.A., Andrawes N.G., El-Saadany M.A. Circulating soluble triggering receptor expressed on myeloid cells-1 (sTREM-1) as diagnostic and prognostic marker in neonatal sepsis // Cytokine.
 2014. Vol. 65(2). P.184–191.
2014. Vol. 65(2). P.184–191. - Fanos V., Caboni P., Corsello G. et al. Urinary (1)H-NMR and GC-MS metabolomics predicts early and late onset neonatal sepsis // Early Hum. Dev. 2014. Vol. 90 (Suppl. 1). S78–S83.
- Дегтярева М.В. Современные возможности иммунокорригирующей терапии тяжелых инфекционно-воспалительных и иммунопатологических состояний у новорожденных // Иммунокоррекция в педиатрии / Под ред. М.П. Костинова. М.: Медицина для всех, 2001. С.182–194.
- Hoebe K., Janssen E., Beutler B. The interface between innate and adaptive immunity // Nat. Immunol. 2004. Vol. 5. P. 971–974.
- Ng P.C., Li K., Wong R.P. Proinflammatory and anti-inflammatory cytokine responses in preterm infants with systemic infections // Arch. Dis. Child. Fetal. Neonatal. Ed. 2003. P. 209–213.
- Володин Н.Н., Дегтярева М.В., Симбирцев А.С. и др. Роль про- и противовоспалительных цитокинов в иммунной адаптации новорожденных детей // Intern.
 J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185.
J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185. - Santana C., Guindeo M.C., Gonzakz G. Cord blood levels of cytokines as predictors of early neonatal sepsis // Acta Paediatr. 2001. Vol. 90. P.1176–1181.
- Witt A., Berger A., Gruber C.J., Petricevic L. et al. IL-8 concentrations in maternal serum, amniotic fluid and cord blood in relation to different within the amniotic cavity // J. Perinatal. Med. 2005. Vol. 33 (1). P. 22–26.
- Mehr S., Doyle L.W. Cytokines as markers of bacterial sepsis in newborn infants: a review // Pediatr. Infect. Dis. J. 2000. Vol. 19. P. 879–887.
- Pavcnik-Arnol M., Hojker S., Derganc M. Lipopolysaccharide-binding protein in critically ill neonates and children with suspected infection: comparison with procalcitonin, interleukin-6, and C-reactive protein // Intens. Care Med. 2004. Vol. 30(7). P.1454–1460.
- Черняховский О.Б., Абрамова И.В., Полянчикова О.Л. Внутриутробные инфекции у новорожденных, факторы риска // Российский вестник перинатологии и педиатрии.
 2009. № 1. С. 80–88.
2009. № 1. С. 80–88. - McGuire W., Clerihew L., Fowlie P.W. Infection in the preterm infant // BMJ. 2004. Vol. 2. P. 329–341.
.
Советы для пациентов
Права граждан Республики Беларусь в области охраны здоровья по профилактике инфекционных заболеваний.
Право на охрану здоровья регламентируется Конституцией Республики Беларусь, ст. 45 «Гражданам Республики Беларусь гарантируется право на охрану здоровья, включая бесплатное лечение в государственных учреждениях здравоохранения. Государство создает условия доступного для всех граждан медицинского обслуживания».
Каждый гражданин Республики Беларусь обязан беспокоиться о сохранении своего здоровья. Государство предоставляет каждому возможность защитить себя от заражения инфекционными заболеваниями.
Вакцины – имеют в нашей стране статус лекарственных средств (Закон «О Лекарственных средствах»), предназначенных для профилактики инфекционных заболеваний и относятся к группе иммунобиологических лекарственных средств (далее – ИЛС). Каждая партия вакцины, поступающая в страну, проходит тщательную проверку качества.
Каждая партия вакцины, поступающая в страну, проходит тщательную проверку качества.
Вакцины – это ИЛС, предназначенные для проведения профилактики инфекционных заболеваний у здоровых людей, поэтому и требования к их качеству жесткие, соответствующие международным стандартам безопасности.
В стране функционирует система надзора за регистрацией побочных реакций после применения вакцин, предусматривающая учет и расследование серьёзных побочных реакций.
Для предотвращения возникновения побочных реакций проводится комплекс мероприятий, направленных на исключение вероятности ненадлежащего использования вакцин. Эта система включает следующие компонеты:
1. Вакцины, применяемые для иммунизации населения – на территории Республики Беларусь используются только зарегистрированные и/или разрешенные к применению в установленном порядке ИЛС.
2. Порядок назначения ИЛС, проведения профилактических прививок и наблюдения за пациентом после их проведения.
Профилактические прививки – введение в организм пациента ИЛС для создания специфической невосприимчивости к инфекционным заболеваниям.
Профилактические прививки назначает врач-специалист: врач-терапевт, врач общей практики, врач-педиатр при обращении пациентов за оказанием медицинской помощи с учетом показаний и противопоказаний к их проведению, в строгом соответствии с инструкцией, прилагаемой к ИЛС. В детском возрасте проводятся прививки против: гепатита В, туберкулёза, дифтерии, столбняка, коклюша, полиомиелита, пневмококковой и гемофильной инфекций, кори, краснухи, эпидемического паротита. Взрослым в обязательном порядке необходимо повторное введение вакцин против дифтерии и столбняка. Кроме того некоторые категории граждан имеют право на бесплатную вакцинацию против вирусного гепатита В, гриппа.
Сведения о профилактических прививках вносятся в медицинскую документацию. Уточнить сведения о прививочном статусе можно в территориальной организации здравоохранения по месту жительства.
При обращении за медицинской помощью в территориальную организацию здравоохранения пациент имеет право уточнить свой прививочный статус и уточнить необходимость проведения профилактических прививок в соответствии с возрастом.
Вакцинация населения Республики Беларусь осуществляется в рамках оказания медицинской помощи гражданам. Услуга «вакцинация» входит в стандарт оказания медицинской амбулаторно-поликлинической помощи населению и осуществляется бесплатно в соответствии с Национальным календарем профилактических прививок (далее – Национальный календарь).
3. Календарь профилактических прививок. В 1974 году Всемирная организация здравоохранения (далее – ВОЗ) начала осуществлять крупную международную акцию, которая получила название Расширенная Программа Иммунизации (РПИ), с целью обеспечения своевременной и полной вакцинации детей против наиболее важных инфекционных болезней. В 2012 году 194-ми государствами-членами Всемирной ассамблеи здравоохранения был утвержден Глобальный план действий в отношении вакцин (ГПДВ), целью которого является претворение в жизнь концепции Десятилетия вакцин за счет обеспечения всеобщего доступа к иммунизации.
ГПДВ направлен на укрепление плановой иммунизации для достижения следующих целей:
- достижение целевых показателей по охвату вакцинацией;
- наращивание темпов борьбы с болезнями, предотвратимыми с помощью вакцин, и первым рубежом этой борьбы является ликвидация полиомиелита;
- внедрение новых и улучшенных вакцин;
- внедрение разработок для получения вакцин и технологий следующего поколения.
Национальный календарь профилактических прививок (далее – Национальный календарь) включает 12 инфекций: гемофильная инфекция, гепатит В, дифтерия, коклюш, корь, краснуха, полиомиелит, столбняк, туберкулез, эпидемический паротит – всем лицам в указанном возрасте, а также грипп, пневмококковая инфекция – контингентам риска. В Республике Беларусь регламентировано проведение профилактических прививок по эпидемическим показаниям против 18 инфекций.
4. Финансирование. В Республике Беларусь проведение иммунизации в рамках Национального календаря полностью финансируется государством. Кроме того, бесплатно проводятся профилактические прививки по эпидемическим показаниям для «групп риска» (против бешенства, против кори в очагах инфекции, против желтой лихорадки, против гепатита В для медработников, против гриппа и пр.). По желанию граждан вакцинацию против инфекций, не входящих в Национальный календарь, можно провести за счет собственных средств граждан в организациях здравоохранения.
Кроме того, бесплатно проводятся профилактические прививки по эпидемическим показаниям для «групп риска» (против бешенства, против кори в очагах инфекции, против желтой лихорадки, против гепатита В для медработников, против гриппа и пр.). По желанию граждан вакцинацию против инфекций, не входящих в Национальный календарь, можно провести за счет собственных средств граждан в организациях здравоохранения.
5. Согласие и отказ от профилактических прививок.
В соответствии со ст. 44 Закона РБ «О здравоохранении» согласие на иммунизацию (как простое медицинское вмешательство) дается пациентом или в отношении несовершеннолетних – одним из родителей, усыновителей, опекунов, попечителей (далее – законные представители) устно, а медицинским работником делается отметка в медицинской документации пациента.
Вместе с тем, в соответствии со ст. 45 Закона РБ «О здравоохранении» пациент или его законный представитель имеет право отказаться от проведения прививки. В этом случае лечащим врачом в доступной форме разъясняются возможные последствия отказа, отказ оформляется записью в медицинской документации пациента, подписывается лечащим врачом и пациентом, которому должны быть разъяснены возможные последствия отказа.
Если все же у Вас возникают сомнения в необходимости проведения профилактических прививок, не спешите оформлять отказ. Не забывайте, что именно Вы несете ответственность за свое здоровье и здоровье Вашего ребенка.
По данным ВОЗ:
- в 2017 году было вакцинировано 116,2 миллиона детей, что стало беспрецедентным показателем за всю историю;
- с 2010 года новые вакцины были внедрены в 113 странах, при этом число вакцинированных детей увеличилось на 20 миллионов;
- с 2002 года Европейский регион ВОЗ сертифицирован как свободный от полиомиелита, а число случаев кори снизилось на 90%;
- по различным причинам 19,9 миллионов детей в возрасте до одного года не были охвачены вакциной КДС-3.
Основные факты об иммунизации.
- Иммунизация спасает жизни людей.
Плановая иммунизация против таких болезней, как полиомиелит, столбняк, дифтерия, коклюш, корь ежегодно спасает жизни от 2 до 3 миллионов человек во всем мире. Кроме того, она предотвращает миллионы людей от тяжелых страданий, связанных с изнурительными болезнями и пожизненной инвалидностью.
Кроме того, она предотвращает миллионы людей от тяжелых страданий, связанных с изнурительными болезнями и пожизненной инвалидностью.
Вакцины способны не только спасать, но и преобразовывать жизнь людей, предоставляя детям возможности для здорового развития, посещения школ и улучшения их жизненных перспектив.
С помощью вакцин можно ограничить распространение устойчивости к антибиотикам. Глобальный рост заболеваемости, вызванный бактериями с устойчивостью к лекарственным средствам в результате чрезмерного использования антибиотиков и злоупотребления ими, является серьезной проблемой здравоохранения. Иммунизация является очень действенным способом остановить инфицирование населения и, тем самым, исключить потребность в антибиотиках. Повышение эффективности вакцинации и разработка новых вакцин являются неотъемлемой частью борьбы с устойчивостью к антибиотикам и сокращения числа предотвратимых заболеваний и случаев смерти.
2. Вспышки инфекционных заболеваний создают постоянную серьезную угрозу, продолжают уносить жизни людей, многих оставляют инвалидами.
Вакцинация позволяет предотвращать страдания, инвалидность и смерть от болезней, предотвратимых с помощью вакцин. Вместе с тем, как это ни парадоксально, но тот факт, что благодаря эффективным программам вакцинации многие инфекционные болезни стали редкими или практически совсем исчезли, может способствовать распространению среди родителей мнения о том, что иммунизация больше не является необходимой, что она более опасна, чем сама болезнь. Эти ошибочные представления привели к значительному снижению уровней охвата и возвращению таких болезней, как дифтерия, корь, коклюш, полиомиелит. Вспышки болезней затрагивают каждого человека.
Корь
Число таких заболеваний, как корь, статистически значительно снизилось, но даже в странах с высоким уровнем охвата профилактическими прививками вспышки поражают группы непривитых лиц. В 2016 г. Американский регион ВОЗ стал первым в мире регионом, в котором была элиминирована корь. Это достижение – результат 22-х лет работы и массовой вакцинации населения стран Америки против кори, краснухи и эпидемического паротита.
По данным ВОЗ в странах Европейского региона (53 страны) в
2018 г. зарегистрировано более 80-ти тысяч случаев заболевания корью, из них более 70 закончились летальным исходом. Основная доля заболеваний корью принадлежит Украине, где в 2018 г. корью переболело более 53 тысяч человек, в том числе 16 с летальным исходом. Напряженная ситуация отмечалась в Сербии (4 175 случаев, включая 15 летальных), Израиле (3 119 случаев, включая 2 летальных), Франции (2 913 случаев, включая 3 летальных), Италии (2 517 случаев, включая 8 летальных), Грузии (2 203 случая), Греции (2 193 случая, включая 2 летальных), Российской Федерации (2 256 случаев), Албании (1 466 случаев), Румынии (1 087 случаев).
По результатам заключения Европейской региональной комиссии по верификации элиминации кори с 2012 г. Республика Беларусь отнесена к группе стран, где данная инфекция элиминирована.
В 2018 г. в 7-ми регионах Республики Беларусь было зарегистрировано 259 случаев кори, из них 74% у взрослых./preemie-vaccine-56be414d3df78c0b138b1d7b.jpg) В подавляющем большинстве – это завозные случаи (большинство из Украины) и случаи у контактных с заболевшими лицами. Более 73 % заболевших корью лиц были не привиты (в том числе по причине отказа от вакцинации) или не полностью привиты против кори. Распространение заболевания было предотвращено благодаря поддержанию высокого уровня охвата профилактическими прививками против кори населения, а также своевременно и в полном объеме проведенным санитарно-противоэпидемическим мероприятиям.
В подавляющем большинстве – это завозные случаи (большинство из Украины) и случаи у контактных с заболевшими лицами. Более 73 % заболевших корью лиц были не привиты (в том числе по причине отказа от вакцинации) или не полностью привиты против кори. Распространение заболевания было предотвращено благодаря поддержанию высокого уровня охвата профилактическими прививками против кори населения, а также своевременно и в полном объеме проведенным санитарно-противоэпидемическим мероприятиям.
Полиомиелит
Ситуация по полиомиелиту в мире в 2018 г. оставалась достаточно стабильной. За последние пять лет в мире уменьшилось количество зарегистрированных случаев паралитического полиомиелита: с 359 случаев в 2014 г. до 33 случаев в 2018 г. Имеются основания говорить о том, что из трех штаммов дикого полиовируса уже элиминировано два. Индия и весь Регион стран Юго-Восточной Азии ВОЗ были объявлены свободными от полиомиелита, а вспышки, начавшиеся в 2013-2014 гг. на Ближнем Востоке и в районе Африканского Рога, были остановлены.
За 2018 г. все случаи паралитического полиомиелита были зарегистрированы в двух эндемичных странах: Афганистан (21 случай) и Пакистан (12 случаев). Также эндемичной по полиомиелиту остается Нигерия, где случаев паралитического полиомиелита в 2017-2018 гг. не зарегистрировано.
С 2002 года Республика Беларусь входит в список стран свободных от полиомиелита.
В 2018 г. рекомендованный показатель регистрации случаев неполиомиелитных ОВП (не менее 1 на 100 тысяч детей до 15 лет) достигнут во всех регионах республики и составил от 1,6 до 3,3 на 100 тысяч возрастного контингента.
Острые респираторные инфекции, грипп
Острые респираторные инфекции (далее – ОРИ) и грипп, остаются одной из самых актуальных медицинских и социально-экономических проблем. В структуре ежегодно регистрируемых в Республике Беларусь инфекционных заболеваний (3,3-3,5 миллионов случаев) на долю ОРИ и гриппа приходится около 97%.
Прошедший сезон заболеваемости гриппом 2017-2018 гг. характеризовался умеренным эпидемическим подъемом заболеваемости.
характеризовался умеренным эпидемическим подъемом заболеваемости.
Для обеспечения эпидемиологического благополучия в сентябре-ноябре 2017 г. проведена кампания вакцинации населения против гриппа, по результатам которой специфическую защиту от гриппа получило 40,5% населения Республики Беларусь (более 3,7 миллионов человек), в том числе:
- за счет средств республиканского и местных бюджетов вакцинировано 32,4% населения;
- за счет средств предприятий, организаций и личных средств граждан 8,1% населения.
Охват профилактическими прививками населения из групп повышенного риска неблагоприятных последствий заболевания гриппом достиг регламентируемого уровня (не менее 75%) и составил 75,3% от численности данного контингента.
Выполнена задача по вакцинации не менее 75% от численности медицинских работников (привито 84,3% от численности контингента), лиц из учреждений с круглосуточным пребыванием детей и взрослых (привито 82,9%), работников служб по обеспечению жизнедеятельности и безопасности государства (привито 78,5%).
Анализ данных о заболеваемости гриппом среди привитого и непривитого населения в эпидемический период активности респираторных вирусов в 2018 г. показал высокую эффективность мероприятий, направленных на профилактику и снижение заболеваемости среди населения.
Забота о здоровье граждан – это не только обязанность государства, но и в первую очередь руководителей предприятий и самих граждан, которые также должны быть заинтересованы в предотвращении гриппа методами, подтвердившими свою эффективность и безопасность.
3. Болезни, предупреждаемые вакцинацией, можно победить и ликвидировать.
При стабильном и высоком уровне охвата вакцинацией показатели заболеваемости снижаются, и болезни могут быть даже полностью ликвидированы. Натуральная оспа, от которой ежегодно погибало 5 миллионов человек во всем мире. Последний случай оспы был зарегистрирован 25 октября в 1977 г. в Сомали, а в 1980 г. на XXXIII сессии Ассамблеи ВОЗ было официально объявлено о ликвидации натуральной оспы во всем мире. И сегодня об этой болезни уже почти все забыли.
И сегодня об этой болезни уже почти все забыли.
В XIX веке и первой половине ХХ века эпидемии полиомиелита свирепствовали в Европе и США. За один только 1916 год полиомиелитом в США заразились 27 тысяч человек. После широкого применения полиомиелитной вакцины во многих промышленно развитых странах заболеваемость резко сократилась. В 2002 г. ВОЗ провозгласила Европейский регион свободным от полиомиелита, и задача полной ликвидации полиомиелита во всем мире в настоящее время близка к достижению.
Благодаря иммунизации почти ликвидированы эпидемии менингита А в Африке. Менингит А – инфекция, которая может вызывать тяжелое поражение мозга и нередко заканчивается смертельным исходом. С тех пор, как в декабре 2010 г. в Африке начала применяться вакцина против менингита А, массовые кампании вакцинации позволили поставить под контроль и практически элиминировать заболеваемость смертельно опасным менингитом А в 26 африканских странах так называемого «менингитного пояса». В настоящее время вакцина внедряется в национальные программы плановой иммунизации.
В настоящее время вакцина внедряется в национальные программы плановой иммунизации.
4. Иммунизация является эффективной мерой с точки зрения затрат.
Иммунизация, несомненно, является одной из наиболее эффективных и экономически целесообразных мер медицинского вмешательства, существующих в настоящее время. Она является одной из немногих мер, требующих небольших затрат, но обеспечивающих получение значительных положительных результатов для здоровья и благополучия всего населения. Ежегодно иммунизация спасает миллионы жизней, предотвращая случаи смерти и инвалидности, связанные с инфекционными заболеваниями, хотя затраты на нее намного ниже, чем стоимость лечения.
За последние годы финансовое бремя, связанное с заболеваемостью, значительно снизилось в большинстве государств-членов. Каждый доллар США, израсходованный на вакцину против кори-паротита-краснухи, экономит более 21 долларов США в качестве прямых затрат на оказание медицинской помощи. Согласно оценкам, проведенным в ходе анализа затрат, связанных со вспышкой кори в Западной Европе в 2002-2003 гг., прямые издержки составили 9,9-12,4 миллионов евро, что равно сумме, необходимой для вакцинации 1 358 100 детей двумя дозами вакцины при уровне охвата 95%.
Согласно оценкам, проведенным в ходе анализа затрат, связанных со вспышкой кори в Западной Европе в 2002-2003 гг., прямые издержки составили 9,9-12,4 миллионов евро, что равно сумме, необходимой для вакцинации 1 358 100 детей двумя дозами вакцины при уровне охвата 95%.
По данным экономистов, на 1 доллар, потраченный на вакцинацию против краснухи, приходится 7,7 долларов, которые надо было бы потратить на борьбу с самим заболеванием. Расходы на ребенка с синдромом врожденной краснухи (СВК) в течение его жизни в среднем составляют более 200 тысяч долларов США. В эту сумму входят расходы на содержание детей с тяжелыми патологиями (врожденная глухота, катаракта, психическая неполноценность, физические уродства), а также на обучение детей и подростков с нарушениями зрения и слуха.
Поскольку иммунизация способствует предупреждению заболеваний, она обеспечивает значительную, хотя и не поддающуюся оценке, экономию средств в отношении производительности труда, трудоспособности и доступа к образованию, а также снижения расходов на лечение болезней, поддающихся предупреждению.
5. Успехи и достижения иммунопрофилактики в ХХ-XXI вв.
Благодаря успешно проводимым программам иммунизации, в нашей стране сохраняется стабильная ситуация по ряду инфекций, управляемых средствами вакцинопрофилактики:
|
Инфекция
|
Год начала проведения массовой иммунизации
|
Число заболеваний в довакцинальном периоде
|
Число случаев за 2018 год в Республике Беларусь
|
|---|---|---|---|
|
Натуральная оспа
|
1798/1918
|
102 000
|
ликвидирована
|
|
Полиомиелит
|
1959
|
1 000
|
элиминирован
|
|
Корь
|
1967
|
58 620 (1966 г.
|
259
|
|
Дифтерия
|
1957
|
11 367 (1956 г.)
|
0
|
|
Столбняк
|
1957
|
67 (1955 г.)
|
0
|
|
Краснуха
|
1967/1995
|
65 562 (1994 г.)
|
0
|
|
Туберкулёз
|
1963
|
11 187
|
1 855
|
|
Коклюш
|
1957
|
17 880
|
648
|
|
Эпидемический паротит
|
1963/1974
|
32 526 (1973 г.
|
1
|
|
Вирусный гепатит В (острая форма)
|
1996
|
1 687
|
66
|
В ближайшем будущем, несмотря на развитие систем здравоохранения, появление новейших средств и способов диагностики, лечения и профилактики, инфекционные заболевания будут существовать. Их распространению будут способствовать вооруженные конфликты, экономические кризисы, глобальные миграционные процессы, изменения климата и т.д.
Поэтому создание и совершенствование вакцин против инфекционных заболеваний – одно из главных направлений развития медицины.
Сейчас разрабатываются вакцины против возбудителя язвенной болезни (Helicobacter pylori), грибковых заболеваний (грибы рода Candida), вирусов герпеса и папилломы человека, ВИЧ-инфекции.
В нескольких странах была лицензирована новая вакцина против лихорадки Денге, а в 3-х африканских странах началась апробация первой вакцины для защиты детей от малярии. Также увеличилось число вакцин, находящихся в разработке на стадии клинических испытаний.
Также увеличилось число вакцин, находящихся в разработке на стадии клинических испытаний.
Информация для населения, которая может быть использована при подготовке информационно-образовательных материалов (брошюры, памятки, буклеты) к Европейской неделе иммунизации
Корь
Корь – это крайне заразная болезнь, которую вызывает вирус, распространяющийся посредством кашля и чихания при тесном или непосредственном контакте с инфицированными выделениями из носоглотки больного. Заболевший может распространять вирус, начиная с четвертого дня до появления сыпи и в течение четырех дней с момента ее появления.
Признаки и симптомы:
Ранние признаки включают:
высокую температуру, насморк, кашель, воспаленные глаза, слезотечение, мелкие белые пятнышки, которые развиваются на первичной стадии на внутренней стороне щек.
Через несколько дней появляется сыть обычно на лице и верхней части шеи. Сыпь распространяется, в конце концов, достигая рук и ног, держится пять-шесть дней, затем подсыхает.
Самыми серьезными осложнениями являются:
- слепота,
- энцефалит (инфекция, которая вызывает отёчность мозга),
- острая диарея и последующее обезвоживание,
- ушные инфекции,
- серьезные респираторные инфекции, такие как пневмония.
В большинстве тяжелых случаев кори, осложнения могут привести к летальному исходу.
Краснуха
Краснуха – это вирусное заболевание, которое передается при контакте с заболевшим посредством кашля и чихания. Болезнь особенно заразна в период наличия сыпи, но может передаваться и в течение 7 дней до момента появления сыпи. Лица при отсутствии симптомов, все равно могут распространять краснуху.
Признаки и симптомы:
Краснуха может начинаться с легкой лихорадки в течение 1-2 дней, болезненности и увеличения лимфатических узлов обычно с задней стороны шеи и за ушами. Далее на лице появляется сыпь, которая распространяется ниже. Однако некоторые заболевшие краснухой не имеют никаких симптомов.
У детей краснуха обычно проходит в легкой форме, хотя в редких случаях могут возникнуть серьезные проблемы. Сюда входят менингит и кровотечения. Краснуха особенно опасна для плода, если заболевает женщина в период беременности. Синдром врожденной краснухи может стать причиной выкидыша или врожденных дефектов развития, таких как глухота, отставание в психическом развитии и развитии таких органов, как сердце.
Эпидемический паротит
Эпидемический паротит (свинка) передается при вдыхании вируса, выделяемого в воздух при кашле или чихании заболевшим. Вирус может передаваться также через слюну. Паротит может распространяться до появления клинических симптомов и в течение пяти дней после.
Признаки и симптомы:
Обычные симптомы паротита включают: температуру, потерю аппетита, утомляемость, мышечные боли, головную боль, за которыми следует увеличение околоушной слюнной железы или подчелюстных желез. У некоторых болезнь, протекает бессимптомно.
У большинства детей паротит протекает в легкой форме, однако заболевание может стать причиной серьезных проблем, таких как менингит и глухота. В редких случаях паротит может привести к летальному исходу.
Полиомиелит
Причиной полиомиелита является вирус, который поражает нервную систему. Вирус попадает в организм через рот и размножается в кишечнике. Передается фекально-оральным путем. Источником инфекции чаще всего становится пища или питьевая вода. Способствующие факторы: несоблюдение правил личной гигиены, плохие санитарные условия или недостаточный контроль за сточными водами. Вирус полиомиелита также распространяется при кашле и чихании.
Признаки и симптомы:
Симптомы на начальной стадии включают:
- температуру,
- утомляемость,
- головную боль,
- рвоту,
- ригидность шеи и боль в конечностях.
Полиомиелит, в основном, поражает детей, но может также привести к параличу у подростков и взрослых, не обладающих иммунитетом.
Полиомиелит может вызвать полный паралич в течение нескольких часов, так как болезнь поражает спинной и/или головной мозг. Такой паралич может быть необратимым. В случае паралича может возникнуть неподвижность дыхательных мышц, что приводит к смерти. Специфического лечения против полиомиелита не существует.
Дифтерия
Дифтерия – острая инфекционная болезнь, возникающая в результате попадания в организм Corynebacterium diphtheria и выделения дифтерийного токсина, характеризующаяся острым воспалением верхних дыхательных путей, преимущественно ротоглотки (примерно 90% случаев), носа. Возможно поражение кожи в местах ее повреждения, глаз или половых органов.
Характерной особенностью заболевания является возможность формирования так называемого носительства возбудителя дифтерии, когда симптоматика отсутствует или минимальна и практически не доставляет проблем человеку.
Передаётся возбудитель инфекции от человека к человеку воздушно-капельным путём при чихании, кашле, разговоре. Возможна передача возбудителя контактно-бытовым путем через предметы обихода и возникновение кожных форм дифтерии, что чаще отмечается в странах с жарким климатом. Инкубационный период дифтерии длится от 2 до 10 дней.
Возможна передача возбудителя контактно-бытовым путем через предметы обихода и возникновение кожных форм дифтерии, что чаще отмечается в странах с жарким климатом. Инкубационный период дифтерии длится от 2 до 10 дней.
Признаки и симптомы:
высокая температура, слабость, боли в горле при глотании.
Дифтерийный токсин вызывает образование болезненных плотных пленок (скопление некротизированных тканей) на задней стенке горла и на миндалинах, затрудняя глотание и дыхание, приводя к развитию так называемого дифтерийного крупа, кроме того, поражает нервную, сердечно-сосудистую и выделительную системы, тем самым представляя опасность для здоровья и жизни.
Единственным способом лечения дифтерии, позволяющим добиться выздоровления и избежать необратимых последствий вплоть до летального исхода, является безотлагательное введение противодифтерийной сыворотки. Вакцинация против дифтерии и даже перенесенное заболевание не приводит к формированию стойкого пожизненного иммунитета, со временем происходит его угасание. Поэтому вакцинация против дифтерии проводится на протяжении всей жизни человека.
Поэтому вакцинация против дифтерии проводится на протяжении всей жизни человека.
Столбняк
Инфекционное заболевание, вызываемое токсигенными бактериями Clostridium tetani, не передается от человека к человеку.
Важной особенностью возбудителя является его способность образовывать споры, которые могут сохранять жизнеспособность годами. Споры бактерии обнаруживаются в окружающей среде – в почве, на поверхности ржавых инструментов, в фекалиях животных, человека.
Споры возбудителя столбняка могут попасть в организм человека через повреждения на коже: ссадины, царапины, раны или укусы животных, при ожогах, обморожениях, через пупочную ранку у новорожденных.
Инкубационный период столбняка длится от 3 до 21 дня после инфицирования (в среднем, 14 дней).
Признаки и симптомы:
Болезнь начинается с общей слабости, раздражительности, головной боли, тянущие боли вокруг раны, ригидность затылочных мышц.
Первым и наиболее часто встречающимся симптомом является тоническое напряжение (тризм) жевательных мышц с затруднением открывания рта. Следом за тризмом появляются другие признаки столбняка, образующие классическую триаду: «сардоническая улыбка» вследствие спазма мимической мускулатуры и дисфагия (нарушение глотания) в результате сокращения мышц глотки.
Следом за тризмом появляются другие признаки столбняка, образующие классическую триаду: «сардоническая улыбка» вследствие спазма мимической мускулатуры и дисфагия (нарушение глотания) в результате сокращения мышц глотки.
Поражение мускулатуры идет по нисходящему типу. Впоследствии судороги охватывают все мышцы туловища, от чего больной выгибается дугой.
При заболевании столбняком требуется неотложная медицинская помощь в условиях больничных организаций здравоохранения.
От 1 до 8 человек из 10 заболевших столбняком умирает от остановки дыхания, а в случае выздоровления длительное время сохраняются нарушения речи и памяти;
После перенесенного заболевания иммунитет против столбняка нестойкий и непродолжительный, возможно повторное инфицирование.
Способ специфической профилактики столбняка только один – вакцинация столбнячным анатоксином.
Заболевания, вызываемые гемофильной инфекцией типа b (Hib)
Гемофильная инфекция типа b вызывается бактерией. Обычно бактерии находятся в носоглотке человека и не вызывают заболевание. Но, при определенных условиях, если бактерии попадают в легкие или в кровь, человек может заболеть. Болезнь распространяется при кашле и чихании от заболевшего.
Обычно бактерии находятся в носоглотке человека и не вызывают заболевание. Но, при определенных условиях, если бактерии попадают в легкие или в кровь, человек может заболеть. Болезнь распространяется при кашле и чихании от заболевшего.
Признаки и симптомы:
Симптомы заболевания зависят от того, какая часть тела поражена. Температура характерна для всех форм заболевания:
- менингит (воспаление оболочек головного и спинного мозга),
- эпиглоттит (отек надгортанника на задней стенке глотки),
- пневмония (воспаление легких),
- остеомиелит (воспаление костей и суставов),
- целлюлит (воспаление подкожной клетчатки, обычно на лице).
Заболевание может развиваться быстро, а менингит и эпиглоттит могут привести к летальному исходу. Большинство детей с этим заболеванием нуждаются в госпитализации. Даже при условии лечения остается риск летального исхода или инвалидизации.
Пневмококковая инфекция
Бактерия Streptococcus pneumoniae вызывает пневмококковое заболевание. Заболевание распространяется воздушно-капельным путем при кашле или чихании от заболевшего человека или человека, который является носителем бактерии.
Заболевание распространяется воздушно-капельным путем при кашле или чихании от заболевшего человека или человека, который является носителем бактерии.
Признаки и симптомы:
Существует много видов пневмококковой инфекции, и симптомы зависят от того, какая система организма поражена. Пневмония является наиболее распространенной и тяжелой формой заболевания. Для нее характерны следующие признаки: температура, озноб, кашель, учащенное или затрудненное дыхание, боль в грудной клетке.
Еще одной серьезной формой заболевания является вызванный пневмококковой инфекцией менингит, который представляет собой поражение оболочек головного и спинною мозга. Симптомами менингита являются: ригидность затылочных мышц, температура, головная боль и резь в глазах от яркого света. Менингит, вызванный пневмококком, приводит к длительной потере трудоспособности или смерти. Пневмококковые инфекции иногда трудно поддаются лечению, особенно из-за того, что некоторые бактерии устойчивы к антибиотикам.
В Новосибирске мать обвиняет врачей в гибели новорожденного сына — Российская газета
Мать ищет виновных в гибели новорожденного сына. 33-летняя Виктория Аратова подала в суд на Государственную Новосибирскую областную клиническую больницу — она утверждает, что ее мальчик, проживший девять дней, умер в роддоме из-за недобросовестности медперсонала.
Коротенькую «биографию» умершего ребенка Виктория изложила на нескольких бумажных страничках. Судя по этим записям, молодой женщине не в чем упрекнуть себя — она тщательно готовилась к беременности, обратившись к врачам еще до ее наступления. Забеременев, наблюдалась с первых дней. Неоднократно проходила ПЦР-диагностику на все инфекции («плод не страдает, лечения не требуется» — цитирует она заключения инфекциониста). Неукоснительно выполняла рекомендации врачей. В общем, делала все, чтобы родить здорового ребенка. Почему ее старания оказались напрасными, Виктория не понимает до сих пор.
— За день до родов мне сделали УЗИ, все было в норме, — рассказывает она. — Десятого октября я родила мальчика весом четыре с половиной килограмма. Мне сказали, что с сыном все хорошо, и приложили к груди. Но уже через час, судя по той же истории болезни, ему был выставлен диагноз — внутриутробная инфекция неуточненной этиологии, двухсторонний конъюнктивит.
— Десятого октября я родила мальчика весом четыре с половиной килограмма. Мне сказали, что с сыном все хорошо, и приложили к груди. Но уже через час, судя по той же истории болезни, ему был выставлен диагноз — внутриутробная инфекция неуточненной этиологии, двухсторонний конъюнктивит.
Три следующих дня мальчик провел в боксе детской комнаты — через капельницу ему вводили антибиотик. Кроме того, новорожденному был сделан рентген грудной клетки, не выявивший пневмонии. Наконец, вечером 13 октября ребенка отдали матери — дежурный врач нашел, что его состояние удовлетворительное. «В дальнейшем ни врач, ни медсестра ни разу не приходили к нам в палату, и я не была предупреждена о том, что лечение продолжается, — говорит Виктория. — Хотя в истории болезни написано, что антибактериальная терапия продолжалась даже ночью».
Утром сын затемпературил, и его снова забрали в бокс. Виктория утверждает — крохе пытались сбить температуру, оставляя раздетым на пеленальном столе. По ее словам, в боксе малыш провел почти двое суток, и только в час ночи 15 октября к нему вызвали врача отделения патологии новорожденных и реаниматолога. «После осмотра сына забрали в отделение патологии, заявив, что это нужно было сделать давно, — говорит Виктория Аратова. — На следующие сутки у него обнаружили пневмонию, перевели в реанимацию, а утром 19 октября он умер».
«После осмотра сына забрали в отделение патологии, заявив, что это нужно было сделать давно, — говорит Виктория Аратова. — На следующие сутки у него обнаружили пневмонию, перевели в реанимацию, а утром 19 октября он умер».
По мнению специалистов облбольницы, они сделали все возможное для спасения малыша. А причина его смерти — сепсис, возникший из-за глубокого поражения органов внутриутробной инфекцией, передавшейся ребенку от матери.
— Я считаю, что шанс у новорожденного был, — возражает представитель Виктории Аратовой, врач и юрист медико-страхового права Валерий Иевлев. — Даже если допустить, что он действительно был инфицирован внутриутробно, ребенок мог бы выжить при условии своевременной диагностики и правильного выбора лечения.
Кто прав, будут решать эксперты, — Виктория и ее представители настаивают, чтобы экспертизу проводили в Томске или Тюмени. Мать уверена, что ни о какой внутриутробной инфекции речи и быть не может — в первые минуты после родов у нее брали пуповинную кровь специалисты Института клинической иммунологии СО РАН. По их заключениям, кровь была стерильна.
По их заключениям, кровь была стерильна.
Комментарий
Александр Шаклеин, главный акушер-гинеколог департамента здравоохранения Новосибирской области:
— Смерть ребенка — всегда трагедия, и для врачей в не меньшей степени, чем для родителей. Ведь мы стараемся спасти каждого пациента, использовав для этого все имеющиеся возможности.
Мама утверждает, что она была здорова, а ребенок погибает от внутриутробной инфекции. Возможно ли такое? Возможно, но только в одном случае: если беременная женщина не знает о том, что у нее есть некая инфекция, представляющая угрозу для будущего ребенка. В данном же случае, как свидетельствует медицинская документация, будущая мама трижды в течение срока беременности проходила стационарное лечение. И по данным представленной документации есть подтверждения того, что у пациентки имелись признаки урогенитальной инфекции, угрожающего самопроизвольного выкидыша и родов, по поводу которых она проводила соответствующее лечение.
Когда у новорожденного в течение первых двух часов жизни проявляется конъюнктивит (воспаление слизистой оболочки глаз), это признак реализации внутриутробной инфекции. Наиболее точно диагноз «внутриутробная инфекция» можно подтвердить или опровергнуть только после морфологического изучения различных тканей, а исследование крови является вспомогательным и не абсолютно достоверным методом диагностики. В частности, исследуются ткани плаценты — «детского места», органа, осуществляющего связь между организмом матери и плода в период внутриутробного развития. Серьезные изменения в плаценте, обнаруженные патологоанатомами в данном случае, могут быть вызваны именно инфекционным агентом.
Говорить о том, что диагноз поставлен не вовремя и лечение начато с опозданием, некорректно. Лечить малыша в Областном перинатальном центре начали сразу же, как только у него были обнаружены признаки инфекции, то есть с первых суток жизни. Терапия продолжалась постоянно, врачи применяли разные методы с учетом состояния ребенка, которое то нормализовалось, то ухудшалось.
Вообще, давая оценку работе врачей, следует учитывать, что все люди имеют одинаковую анатомию и физиологию, но каждый человеческий организм уникален. И предсказать течение болезни у конкретного пациента не всегда представляется возможным. В этом — сложность медицины и ее принципиальное отличие от работы с механизмами, где все действия четко укладываются в определенную схему.
Беременность у женщин часто наступает на фоне хронической инфекции, причем носителями ее бывают как мать, так и отец. Коварство инфекции в том, что она может никак себя не проявлять, не вызывать беспокойства до тех пор, пока ее что-то не спровоцирует на активность. У людей с сильным иммунитетом и людей с иммунитетом ослабленным изначально может быть один и тот же инфекционный фон, но один болеет, а другой — нет. Сегодня ваши анализы хорошие, а завтра болезнь вдруг себя проявит.
К сожалению, детей с внутриутробной инфекцией рождается много, и часть из них погибает. Организм малыша еще настолько слаб, что не в силах справиться с такой агрессией. И даже сильные лекарства не всегда помогают в этом.
Справка «РГ»
В Новосибирской области за девять месяцев текущего года мертвыми родилось 44 ребенка, в прошлом году 43, в 2006 году — 46 детей. У 55 процентов из них обнаружены признаки внутриутробной инфекции. Еще один печальный показатель — ранняя неонатальная смертность, то есть гибель ребенка в течение первых семи суток после рождения. В 2006 году умерло 42 ребенка, в 2007 году — 35 детей, с начала этого года уже 43. У каждого пятого из них причиной смерти стала внутриутробная пневмония, причем, у двух процентов — генерализованная внутриутробная инфекция, то есть тотальное поражение всех органов.
Лечение интереферонами детей с внутриутробными инфекциями Текст научной статьи по специальности «Клиническая медицина»
В ПОМОЩЬ ПРАКТИЧЕСКОМУ ВРАЧУ
Лечение интереферонами детей с внутриутробными инфекциями
О. В. Шамшева, И. В. Полеско
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Министерства здравоохранения Российской Федерации, Москва
В статье приведены результаты клинико-диагностических методов оценки риска рождения ребенка с внутриутробной инфекцией, данные клинических исследований с доказанной эффективностью препарата ВИФЕРОН® в комплексной терапии недоношенных детей с тяжелыми внутриутробными вирусными инфекциями. Ключевые слова: внутриутробные инфекции, интерферонотерапия, ВИФЕРОН®, дети
Interferon Treatment of Infants with Intrauterine Infections
O. V. Shamsheva, I. V Polesko
Russian National Research Medical University named after N. I. Pirogov, Moscow
The article describes the results of clinical diagnostic methods for risk assessment childbirth with intrauterine infection, data from clinical trials with a high level of evidence efficacy VIFERON® in adjuvant therapy in preterm infants with severe intrauterine viral infections. Keywords: intrauterine infections, interferonotherapy, VIFERON®, infants
Контактная информация: Шамшева Ольга Васильевна — д.м.н.,
Москва, 4-й Добрынинский пер., 1, МДГКБ; (499) 236-25-51
УДК 616.931-053.2
Ведущая роль в ранней детской смертности принадлежит перинатальной инфекции. В России частота перинатальной смертности в результате инфекцион-но-воспалительных процессов составляет около 10— 1 8%, уступая лишь внутриутробной асфиксии, респираторным расстройствам и врожденным аномалиям [1]. Процент рождения детей с проявлениями внутриутробной инфекции от матерей с инфекционно-воспалитель-ными заболеваниями не имеет тенденции к снижению, а наоборот, возрастает, составляя, по данным разных исследователей, от 10 до 58% [2]. В первую очередь речь идет о вирусно-бактериальных инфекциях урогени-тальной сферы беременных, в этиологии которых преобладают патогенные стафилококки, условно-патогенные микробы, такие как Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealiticum, Candida albicans. Отмечается также неуклонный рост рецидивирующих форм инфекции с преобладанием экстрагенитальных поражений, как то генитальный герпес, папилломавирусная и ци-томегаловирусная инфекции. Иногда инфекционный процесс принимает бессимптомное, но доброкачественное течение, например, при Micoplasma hominis, исходом которого является спонтанное выздоровление. В то же время, при герпетической инфекции, нередко происходит окклюзия, фиброз маточных труб и образование тубоова-риальных абсцессов.
Выявление только бактериальной или вирусной инфекции в акушерстве явление довольно редкое (13 — 15%), в то время как так называемый TORCH-комплекс* имеет место в 72% случаев среди всех ВУИ [3]. Определить лидирующий патоген и этиологически значимый микроорганизм затруднительно. И, тем не менее, по данным И.И. Бочаровой и соавт., среди всех возбудителей, вызывающих этот комплекс, превалировал цитомегалови-рус, доля которого приближалась к 90%, в остальных
проф., зав. кафедрой инфекционных болезней у детей №2 РНИМУ; 1 17049,
случаях диагностировались урогенитальный хламидиоз (60%), уреаплазмоз (66%), микоплазмоз (19%), вирус простого герпеса (71%) [3].
В большинстве случаев, инфекционно-воспалительные заболевания у беременных характеризуются инаппа-рантным течением и отсутствием параллелизма между тяжестью инфекционного процесса у матери и плода.
По существу, только наличие симптомов острого инфекционного процесса (нескольких очагов инфекции) в урогенитальной сфере матери к моменту родов является фактором риска рождения ребенка с внутриутробной инфекцией (ВУИ). Реализация же инфекционно-воспалитель-ного процесса в неонатальном периоде имеет место лишь у одного из 10 внутриутробно инфицированных детей. Так, если общая заболеваемость новорожденных от матерей с урогенитальной инфекцией колеблется в пределах 50—100%, то число случаев рождения детей с проявлениями внутриутробной инфекции составляет от 30 до 58% [3]. Существенную роль также играет и состояние иммунитета беременной женщины, которое в свою очередь может определять нарушения иммунного гомеоста-за плода, что увеличивает вероятность внутриутробного инфицирования и повышает восприимчивость к инфекции у новорожденных.
По данным И.И. Бочаровой и соавт., здоровыми рождаются 35,5% новорожденных, ВУИ диагностируется у 30,5% детей, из них в 17,5% — в тяжелой форме (пневмония, гастроэнтероколит, менингоэнцефалит, сепсис), в
* TORCH-комплекс*: Т — токсоплазмоз (toxoplazmosis), О — другие инфекции (others), R — краснуха (rubella), С — цитомега-ловирусная инфекция (cytomegalovirus), Н — герпес (herpes simplex virus). Others — гепатит В и С, сифилис, хламидиоз, гонококковая инфекция, листериоз, ВИЧ-инфекция, ветряная оспа, энтеровирусная инфекция.
13% случаев — в виде локальных инфекционных процессов (пиодермия, конъюнктивит, ринит, омфалит, вульвит). Исследователями выявлены факторы риска рождения ребенка с ВУИ, к которым относятся выделение таких возбудителей, как хламидии и уреаплазма, обострение уро-генитальных инфекций (УГИ) у матери в III триместре беременности в сочетании с отсутствием этиотропной и им-мунокорригирующей терапии, а также слабость родовой деятельности и дородовое излитие околоплодных вод. При бессимптомных формах у 5—15% детей в ближайшие 1—2 года и в более поздние сроки регистрируются нарушения со стороны ЦНС, слуха, зрения, отставание в умственном развитии, плохая успеваемость в школе [4].
Наиболее информативным в диагностике ВУИ является микробиологическое исследование околоплодных вод, полученных при помощи амниоцентеза. Для уточнения этиологии заболевания проводится исследование содержимого цервикального канала и мочи с использованием стандартных микробиологических методов для определения характера микробной колонизации, включая внутриклеточные микроорганизмы, в крови выявляют специфические IgM и IgG-антитела. С учетом микробиологических данных проводят оценку фетоплацентарного комплекса (ФПК). Косвенно судить о ВУИ можно по кли-нико-лабораторным признакам, к которым относятся многоводие, утолщение плаценты, увеличение размеров живота, изменение в органах плода по данным УЗИ, нарушение гормональной функции ФПК.
Диагностика ВУИ у новорожденных детей зачастую представляет довольно сложную задачу, что связано с отсутствием дифференцирующих клинических признаков инфекции. Показано, что при цитомегаловирусной инфекции (ЦМВИ) у недоношенных новорожденных детей наиболее часто ДНК вируса обнаруживалась в моче (18,7%), реже в крови — 13,3% и слюне (1 1,5%), еще реже в ликворе (8,2%). В целом, в моче ЦМВ обнаруживается в количествах в 1 80 раз больших, чем в крови [4].
Обнаружение ЦМВ у ребенка в течение 3-х недель жизни свидетельствует о внутриутробной передаче вируса от матери плоду. Выявление вируса после 3 недели жизни ребенка может отражать как врожденную, так и постнатальную инфекцию. По данным М.В. Павловой и соавт., у недоношенных новорожденных детей с клиническими признаками ВУИ в первые недели жизни цитомега-ловирус выделялся лишь в 26,2% случаев, в то время как через 1—6 месяцев — в 30,8% случаев. В.К. Котлуков с соавт. обращают внимание на отягощенный анамнез (заболевания урогенитального тракта и экстрагенитальные заболевания) у 80% матерей, чьи дети заболели цитомегаловирусной инфекцией в возрасте от 5 месяцев до 3-х лет жизни [5].
Не всегда обнаружение одной только ДНК свидетельствует об инфекционной активности вируса, в связи с чем предпочтение отдается комплексному лабораторному исследованию, включающему в себя выявление антител класса IgM и IgG, определение авидности анти-ЦМВ-АТ
класса IgG, детекцию ДНК ЦМВ методом ПЦР и определение инфекционной активности ЦМВ культуральным методом. При этом выявление высокоавидных анти-ЦМВ-АТ имеет положительное прогностическое значение, так как в большинстве случаев сопровождается элиминацией маркеров ЦМВИ.
По сравнению с ЦМВИ, выявляемой на более поздних сроках неонатального развития, инфекция, ассоциированная с вирусом простого герпеса (ВПГ), в подавляющем числе случаев диагностируется уже на 1-ой недели жизни, что можно объяснить экспрессией ВПГ при крайне низкой вирусной нагрузке. По данным Р.Р. Климовой, В.В. Малиновской, Т.Г. Гусевой и соавт., выявление маркеров герпесвирусных инфекций у недоношенных новорожденных детей без клинических признаков ВУИ коррелирует с высокими уровнями ИЛ-6, что может рассматриваться как предиктор ВУИ [6]. По мнению этих же авторов, при повышении концентрации этого цитокина > 96 пг/мл существует 100% вероятность неонатального сепсиса у новорожденных. Необходимо отметить, что частота неонатального герпеса невысока и составляет, по разным данным, от 1:2500 до 1:60 000 живорожденных. При первичном генитальном герпесе во время беременности до 50% детей, а при рецидивах герпеса до 5% детей рождаются с признаками очагового или генерализованного герпеса. В случае нелеченого герпеса, протекающего в виде локализованной формы с поражением кожи, глаз и рта, у 50—70% новорожденных может развиться генерализованная форма или энцефалит, часто имеющий рецидивирующее течение на 1-м году жизни и высокую — до 50% — летальность.
Состояние беременности в 2,3 раза увеличивает риск развития острой папилломавирусной инфекции (ПВИ), что подтверждается десятикратным повышением вирусной ДНК, по сравнению с небеременными. Риск передачи ВПЧ от матери плоду варьирует, по данным разных исследователей, от 4 до 87%. ДНК ВПЧ находят в синцити-отрофобластах, амниотической жидкости, носоглоточном аспирате новорожденных, но крайне редко в лейкоцитах крови, что свидетельствует об инфицировании плода во время беременности или в родах. Проведенный в 2005 г. мета-анализ 9 исследований, включивший в себя более 2-х тысяч беременных женщин и новорожденных, выявил возможность вертикальной трансмиссии вируса в процессе родового акта.
Обсуждается вопрос о вероятности передачи ВПЧ от матери к плоду трансплацентарно. Симптомы ювенильно-го респираторного папилломатоза, вызываемого серова-рами 6 и 11 типов, могут диагностироваться уже в раннем детском возрасте, что нередко сопровождается тяжелыми клиническими проявлениями и частыми рецидивами [7]. Тем не менее, вероятность самопроизвольной элиминации вируса и незначительный риск перинатального инфицирования обуславливают отсутствие показаний к прерыванию беременности. Так, по данным Солдатовой И.Г. и соавт., из 124 женщин в III триместре беременнос-
ти ВПЧ (включая онкогенные серотипы 16 и 18) методом ПЦР соскоба шейки матки был обнаружен в 67,7% случаев, но только в 32,3% случаев с помощью реакции транскрипционной амплификации NASBA-Reаl-time была определена клинически значимая концентрация вируса в ткани. Именно от этих женщин родились дети, инфицированные ВПЧ в 14,6% случаев [8]. По мнению Н.В. Зароченцевой и соавт., прегравидарная подготовка женщин, в которую входит выявление ВПЧ с типированием, а при необходимости цитологическое исследование PAP-тестом, позволяет проводить профилактику обострения ПВИ [9].
В развитии, клиническом течении и исходе инфекционных заболеваний у новорожденных детей ведущую роль играет состояние иммунной системы, в том числе ин-терфероновый статус, имеющий свои отличительные черты, что может спровоцировать срыв защитных реакций и развитие бактериальных и вирусных инфекций. Так, имеется указание на более высокое содержание ИФН в периферической крови доношенных новорожденных по сравнению с их матерями, а также на усиленную способность к продукции лейкоцитами крови ИФН альфа/бета и ИФН-гамма [10]. Прослеживается связь между значительным количеством «раннего» ИФН плода, его высоким содержанием в плаценте, амниотической жидкости на самых ранних сроках беременности и крови рожениц, что свидетельствует о повышенной его продукции фетопла-центарным комплексом. Однако, в отличие от ИФН-а взрослых, «ранний» ИФН плода и новорожденных в большей степени обеспечивает регуляцию, чем противовирусную или антибактериальную защиту. В тоже время по данным В.В. Малиновской и соавт., способность отвечать на индуцирующий стимул продукцией ИФН-а и ИФН-гамма подавляется под действием ВПГ и ЦМВ, особенно у недоношенных новорожденных детей с ВУИ [11].
Не вызывает сомнения тот факт, что в основе лечения любого инфекционного заболевания лежит принцип эти-отропности. Не менее важная роль принадлежит интер-феронам или индукторам интерферонов, которые способны решать несколько задач одновременно, в т.ч. повышать эффективность этиотропной терапии, уменьшать побочные эффекты, а также восстанавливать функции нарушенных звеньев иммунной системы.
По данным многочисленных исследователей, ИФН обладают разнообразными иммунобиологическими свойствами, выявляемыми на клеточном уровне. ИФН способны индуцировать невосприимчивость к вирусной инфекции, усиливать фагоцитарную активность макрофагов и нейтрофилов, а также обладают антипролифера-тивным действием, повышают синтез простагландинов [12, 13]. Биологические эффекты ИФН распространяются практически на все клетки организма и характеризуются незначительной видовой специфичностью, что способствует усилению индуцированного влияния на всю протективную систему организма. Это позволяет рассматривать ИФН как медиатор иммунных реакций с
практически универсальным иммуномодулирующим действием [14]. Всем этим требованиям отвечает препарат ВИФЕРОН®, известный как рекомбинатный интерферон в комплексе с антиоксидантами — витаминами Е и С, усиливающими его противовирусную активность в десятки раз.
Препарат представлен в форме суппозитория с основой в виде масла какао, что с одной стороны, облегчает его введение, а с другой — соответствует по эффективности внутривенному введению. Последнее связано с механизмом действия препарата ВИФЕРОН®, которое заключается во всасывании действующего начала в геморроидальных венах прямой кишки. В отличие от парентерального введения, данный метод предохраняет вводимый интерферон от быстрой инактивации в ретикулоэндотелиальной системе печени. Исключительно широкий спектр действия интерферона, отсутствие резистентных штаммов дают основание считать ИФН перспективным в профилактики и лечении вирусно-бак-териальных инфекций.
В настоящее время накоплен достаточно большой опыт по изучению клинико-иммунологической эффективности препарата ВИФЕРОН® в комплексной терапии урогенитальных инфекций у матерей во время беременности, который сводится к снижению антигенной нагрузки и антенатальной иммунокоррекции у их новорожденных, что приводит к снижению частоты патологических состояний в раннем неонатальном периоде. Так, лечение препаратом ВИФЕРОН® беременных с герпес-вирусными инфекциями во II и III триместрах беременности приводило к снижению количества ЕК, клеток с фенотипом CD 16+ CD 18+, а также уровней IgA и IgM, частоты инфекционных осложнений у новорожденных в 1,5 раза как за счет тяжелых форм (с 20 до 12%), так и за счет локализованных инфекционных процессов (с 17,5 до 9%) [15]. Включение препарата в больших дозах в комплексную противовирусную терапию инфицированных беременных женщин с папилломавирусной инфекцией полностью предотвратило инфицирование их новорожденных детей [16].
В работах Абаевой З.Р. и соавт. (2001) было показано, что включение препарата ВИФЕРОН® в комплексную терапию дородовой подготовки беременных женщин инфицированных ЦМВ или ВПГ способствовало антенатальной иммунокоррекции у их новорожденных детей, проявлявшейся в нормализации иммунорегуля-торных механизмов c усилением Th 1 типа иммунного ответа (повышением индуцированной продукции гам-ма-ИФН и ИЛ-2), не снижая уровня Th3 (> ИЛ-4). Кроме того, лечение беременных уменьшало вирусопосредо-ванную стимуляцию иммунитета плода (снижение NK и CD16+ CD8+ кл.) и выраженность вторичного Т- и В-кле-точного иммунодефицита (тенденция к нормализации CD8+ DR+ кл., нормализация CD20+ кл, экспресии HLA DR АГ) с активацией гуморального иммунитета (увеличение IgG и IgM). Антенатальная иммунокоррекция препа-
ратом ВИФЕРОН® в итоге приводила к положительному клиническому результату. У новорожденных от леченых матерей снижалась частота тяжелых форм ВУИ в 1,5 раза, с 17,8 до 11,9%; малых форм ВУИ в 1,5 раза, с 13,3 до 9%; уменьшалась частота перинатальной патологии неинфекционного генеза в 1,6 раз, с 48,9 до 31,3%. Дети от не леченых матерей в 7,4 раз чаще рождались в асфиксии (11,1%), чем дети от матерей после вифероноте-рапии (1,5%) [17].
Еще более впечатляющие результаты получены при включении препарата ВИФЕРОН® в комплексную терапию недоношенных детей с тяжелыми внутриутробными герпетическими инфекциями. Раннее начало специфической противовирусной терапии в комбинации с интерфероном способствовало снижению летальности у недоношенных детей с 30,6 до 8,3% по сравнению с группой контроля. При этом статистически значимо сокращалось число таких тяжелых жизнеугрожающих состояний, как энтероколит и пневмония [18].
Таким образом, неуклонный рост рождения детей с проявлениями внутриутробной инфекции от матерей с ин-фекционно-воспалительными заболеваниями, в том числе вирусными, низкий уровень диагностики и отсутствие широкого выбора этиотропных средств, требует особого внимания к данной проблеме.
На сегодняшний день препаратом выбора в комплексном лечении и профилактике урогенитальных инфекций у матерей во время беременности, по-прежнему, остается препарат ВИФЕРОН®, действие которого не ограничивается лишь снижением антигенной нагрузки и нормализацией интерферонового статуса, но также заключается в антенатальной иммунокоррекции их новорожденных детей. Собранная доказательная база, включающая в себя зарегистрированные и опубликованные клинические исследования с высоким уровнем доказательности, наряду с удобным способом введения и отсутствием побочных эффектов, позволяет рекомендовать препарат ВИФЕРОН® в лечении внутриутробных инфекций у детей.
Рекомендуемая доза препарата ВИФЕРОН®, суппозитории ректальные, для новорожденных детей, в том числе недоношенных с гестационным возрастом более 34 недель, в составе комплексной терапии инфекци-онно-воспалительных заболеваниях, включая менингит (бактериальный, вирусный), сепсис, внутриутробную инфекцию (хламидиоз, герпес, цитомегаловирусную инфекцию, энтеровирусную инфекцию, кандидоз, в том числе висцеральный, микоплазмоз) — 150 000 МЕ ежедневно по 1 суппозиторию 2 раза в сутки через 12 ч. Курс лечения — 5 суток.
Недоношенным новорожденным детям с гестацион-ным возрастом менее 34 недель рекомендовано применение препарата ВИФЕРОН® 150 000 МЕ ежедневно по 1 суппозиторию 3 раза в сутки через 8 ч. Курс лечения — 5 суток.
Рекомендуемое количество курсов при различных ин-фекционно-воспалительных заболеваниях, в т.ч. сепсис — 2-3 курса, менингит — 1-2 курса, герпетическая инфекция — 2 курса, энтеровирусная инфекция — 1-2 курса, цитомегаловирусная инфекция — 2-3 курса, микоплаз-моз, кандидоз, в том числе висцеральный — 2-3 курса. Перерыв между курсами составляет 5 суток. По клиническим показаниям терапия может быть продолжена.
Рекомендуемая доза для взрослых препарата ВИФЕРОН®, включая беременных, в составе комплексной терапии инфекционно-воспалительных заболеваний урогенитального тракта (хламидиоз, цитомегаловирус-ная инфекция, уреаплазмоз, трихомониаз, гарднереллез, папилломавирусная инфекция, бактериальный вагиноз, рецидивирующий влагалищный кандидоз, микоплазмоз) — 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 5-10 суток. По клиническим показаниям терапия может быть продолжена. Беременным со II триместра беременности (начиная с 14 недели гестации) рекомендован препарат ВИФЕРОН® в дозе 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 10 суток, затем по 1 суппозиторию 2 раза в сутки через 12 ч каждый четвертый день в течение 10 суток; далее каждые 4 недели до родоразре-шения ВИФЕРОН® в дозе 150 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 5 суток. При необходимости препарат показан перед родо-разрешением (с 38 недели гестации в дозе 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 10 суток.
Рекомендуемая доза для взрослых препарата ВИФЕРОН® при первичной или рецидивирующей герпетической инфекции кожи и слизистых оболочек, локализованной форме, легком и среднетяжелом течении, в том числе урогенитальной форме — 1 000 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 10 суток и более при рецидивирующей инфекции. По клиническим показаниям терапия может быть продолжена. Рекомендуется начинать лечение сразу при появлении первых признаков поражений кожи и слизистых оболочек (зуд, жжение, покраснение). При лечении рецидивирующего герпеса желательно начинать лечение в продромальном периоде или в самом начале проявления признаков рецидива.
Беременным со II триместра беременности (начиная с 14 недели гестации) рекомендован препарат ВИФЕРОН® в дозе 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 10 суток, затем по 1 суппозиторию 2 раза в сутки через 12 ч каждый четвертый день в течение 10 суток; далее каждые 4 недели до родо-разрешения в дозе 150 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 5 суток. При необходимости перед родоразрешением (с 38 недели гестации) препарат ВИФЕРОН® вводится в дозе 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 10 суток.
Литература:
1. Буданов П.В., Стрижаков А.Н. Этиология, патогенез, диагностика и лечение внутриутробной инфекции // Вопросы гинекологии, акушерства и перинатологии. — 2010. — Т.9, №3. С.— 61—71.
2. Хашукоева А.З., Ибрагимова М.И., Хашукоева З.З., Бурденко М.В. Возможности применения Виферона в акушерско-гинеко-логической практике / / Эффективная фармакотерапия в акушерстве и гинекологии. — №4, сентябрь. — 2007. — С. 22—27.
3. Бочарова И.И., Аксенов А.Н., Башакин Н.Ф. и др. Итоги и перспективы научных исследований по проблеме внутриутробных инфекций новорожденных // Российский вестник акушера-гинеколога. — №5. — 2007. — С. 60—63.
4. Павлова М.В., Федорова Н.Е., Гаджиева З.С. и др. Алгоритм лабораторной диагностики врожденной цитомегаловирусной инфекции у недоношенных детей и влияние терапии вифероном на течение внутриутробной инфекции // Педиатрия. — 2009. — Т. 87, №2. — С. 55—62.
5. Котлуков В.К., Кузьменко Л.Г., Блохин Б.М. и др. Иммуноре-абилитация детей раннего возраста с цитомегаловирусной инфекцией, протекающей с синдромом бронхиальной обструкции // Педиатрия. — 2007. — Т. 86, №1. — С. 45—52.
6. Климова Р.Р., Малиновская В.В., Гусева Т.Г. и др. Влияние гер-песвирусных инфекций на уровень провоспалительных цитоки-нов у недоношенных новорожденных детей / / Вопросы вирусологии. — №4, 2011. — С. 23—26.
7. Роговская С.И. Папилловирусная инфекция у женщин и патология шейки матки. — М.: ГЭОТАР Медиа, 2005.
8. Солдатова И.Г., Гетия Е.Г., Ашиткова Н.В. и др. Клиническая эффективность препарата Виферон-1 в комплексной терапии пневмоний у новорожденных детей различного гестационного возраста // Педиатрия. — 2007. — Т. 86, №4. — С. 106—1 10.
9. Зароченцева Н.В., Малиновская В.В., Серова О.Ф. и др. Па-пилломавирусная инфекция у беременных // Российский вестник акушерства-гинекологии. — №6, 2011. — С. 77—80.
10. Соколов С.А., Королева Л.И., Тишков А.В. и др. Применение современных статистических методов для оценки взаимосвязи интер-феронового статуса здорового новорожденного и его матери // Инфекция и иммунитет. — 2011. — Т. 1, №4. — С. 331—340.
1 1. Малиновская В.В., Гусева Т.С., Паршина О.В. и др. Интерферо-новый статус недоношенных новорожденных детей с клиническими признаками внутриутробной инфекции и его коррекция препаратами рекомбинатного интерферона — а2Ь (вифероном) // Российский Аллергологический Журнал. — №6, 2008. — С. 71—78.
12. Кешинян Е.С., Касохоа Т.Б. Система интерферона и ее возрастные особенности. Применение препаратов в неонатальном периоде // Российский вестник перинатологии и педиатрии. — 1993. — Т. 38, №2. — С.15—17.
13. Петров Р.В., Хаитов Р.М., Пинегин Б.В. и др. Оценка иммунного статуса человека при массовых обследованиях: Методические рекомендации для научных работников и врачей практического здравоохранения // Иммунология. — 1992. — №6. — С. 51—56.
14. Змызгова А.В. Современные аспекты применения интреферо-нов и других иммуномодуляторов. — М., 1990. — С. 42—43.
15. Бочарова И.И., Малиновская В.В., Аксенов А.Н. и др. Применение Виферона в комплексном лечении урогенитальных инфекций у новорожденных // Эффективная фармакотерапия в акушерстве и гинекологии. — № 6, ноябрь, 2009. — С. 28 — 32.
16. Тапильская Н.И., Воробцова И.Н., Гайдуков С.Н. Применение Виферона в III триместре беременности для профилактики инфицирования новорожденных вирусом папилломы человека// TERRA MEDICA NOVA. — №3, 2006. — С. 1—2.
17. Абаева З.Р. Влияние Виферона на иммунитет новорожденных от матерей, инфицированных цитомегаловирусом вирусом простого герпеса: Автореф. дисс. … к.м.н. — М., 2001. — 28 с.
1 8. Куш А.А., Дегтярева М.В., Малиновская В.В. и др. Эффективность лечения рекомбинантным интерфероном альфа-2 (Вифероном) недоношенных детей с тяжелыми внутриутробными инфекциями // Детские инфекции. — 2009, №3. — С. 40—44.
Лечение и профилактика широкого спектра вирусных и вирусно-бактериальных инфекций (ОРИ, в том числе грипп, герпесвирусные и урогенитальные инфекции, вирусные гепатиты В, С и 0).фброн I (499)1933060 | viferon.su
MEDISON.RU — Пренатальная вирусная инфекция
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Различают внутриутробную инфекцию и внутриутробное инфицирование плода и новорожденного. При этих состояниях заражение происходит во время беременности или в родах, и его источником является мать. Внутриутробное инфицирование плода характеризуется только тем, что в организм плода проникает возбудитель инфекции, но плод при этом не заболевает, что, вероятно, связано с активацией защитных механизмов в системе мать-плацента-плод. При внутриутробной инфекции вследствие инфицирования развивается заболевание с соответствующими клиническими проявлениями и поражением плода и новорожденного. При этом внутриутробная инфекция занимает одно из ведущих мест в структуре причин перинатальной заболеваемости и смертности плода и новорожденных. Характер клинических проявлений и тяжесть течения заболевания зависят от вида возбудителя, его активности, массивности заражения, путей проникновения инфекции в организм беременной и степени выраженности защитных сил ее организма.
При внутриутробном инфицировании, которое происходит в первые 3 месяца беременности, возникают истинные пороки развития, формируется первичная фетоплацентарная недостаточность, неразвивающаяся беременность, происходят самопроизвольные выкидыши. При развитии внутриутробной инфекции после 3 месяцев беременности формируется внутриутробная задержка развития, вторичная фетоплацентарная недостаточность, отмечаются признаки инфекционного поражения плода. Наиболее характерными клиническими симптомами внутриутробной инфекции являются: многоводие или маловодие, стойкая тахикардия у плода, задержка развития плода, нарушение его дыхательной и двигательной активности.
В диагностике внутриутробного инфицирования используют иммунологические тесты для выявления специфических антител к возбудителям, культуральный метод (посев), а также метод полимеразной цепной реакции (ПЦР). Для исследования используют кровь и материал, взятый из влагалища и из канала шейки матки. В ряде случаев для исследования используют околоплодные воды, полученные путем амниоцентеза. Для диагностики широко используется также и ультразвуковое исследование. Остановимся на наиболее типичных вирусных заболеваниях эмбриона и плода.
Краснуха
Вирус краснухи представляет, пожалуй, наибольшую опасность для эмбриона и плода с точки зрения возникновения аномалий развития и существенного повреждения плода. Риск заражения краснухой беременной отмечается при отсутствии в крови матери антител к вирусу краснухи. Если заболевание краснухой происходит в первые 2 месяца беременности, то вероятность инфицирования эмбриона достигает 80 %, а возникновение аномалий развития возможно с вероятностью 25%. Заражение эмбриона вирусом краснухи может привести к его гибели или приводит к формированию врожденных пороков сердца, глухоты, катаракты, микроофтальмии, хориоретинита и микроцефалии. Инфицирование плода в более поздние сроки может сопровождаться появлением у новорожденного типичных кожных высыпаний, которые исчезают через некоторое время.
Принимая во внимание высокий риск возникновения аномалий развития при заболевании в первые 2-3 месяца беременности, ее необходимо прерывать. Ребенок, который родился у женщины, перенесшей во время беременности краснуху, сам является носителем вируса, и поэтому необходима его изоляция. В случае контакта беременной с больным краснухой, если она не болела ею ранее, необходима вакцинация, но не ранее 8-10 недели беременности, так как с этой целью используют живую ослабленную вакцину, и возможно негативное влияние на эмбрион.
Цитомегаловирус (ЦМВ)
Цитомегаловирус (ЦМВ) является одним из наиболее распространенных вирусов, передающихся плоду. При заражении ЦМВ велика вероятность неразвивающейся беременности, самопроизвольного ее прерывания, преждевременных родов, гибели плода, аномалий его развития. Выявление ЦМВ в организме беременной еще не означает наличия у нее острого заболевания, так как в большинстве случаев имеет место только бессимптомное вирусоносительство или субклиническая хроническая инфекция. У 10-20 %, у которых выявляются в крови специфические антитела к ЦМВ, может возникать обострение заболевания, а развитие внутриутробной инфекции только у 1-2 % среди этих беременных. Заражение ЦМВ впервые происходит у 1-4% беременных, и соответственно у 40-50% из них возникает риск развития внутриутробной инфекции.
Летальность при врожденной ЦМВ-инфекции достигает 20-30 %. У 90 % выживших детей отмечаются такие поздние осложнения, как потеря слуха, задержка умственного и физического развития, атрофия зрительного нерва, дефекты роста зубов и т.д. При ведении беременных с ЦМВ специфический противовирусный препарат ацикловир применяют только по строгим жизненным показаниям, обусловленным состоянием матери и новорожденного. Возможно также применение иммуномодуляторов на основе рекомбинантного альфа-2 интерферона, который вводят в виде свечей в прямую кишку в течение 10 дней.
Вирус простого герпеса (ВПГ)
Возбудителем генитального герпеса чаще всего служит ВПГ 2-го типа. В 15 % случаев заболевание обусловлено ВПГ 1-го типа. В 90 % наблюдений инфицирование детей происходит во время родов вследствие непосредственного контакта с инфицированными тканями родовых путей. Около 5% детей инфицируются еще во время беременности. В остальных 5 % наблюдений инфицирование происходит уже после родов в результате контактов с окружающими и в основном с больной матерью. Риск инфицирования во время беременности зависит от характера проявления инфекции. Так, риск передачи вируса к ребенку при впервые возникшей инфекции с клиническими проявлениями к моменту родов составляет до 50%. При первичной инфекции с бессимптомным течением — 40 %. Если во время беременности имел место рецидив генитального герпеса с клиническими проявлениями, то риск составляет — 3 %, а при рецидивирующем бессимптомном течении — 0,05 %. Под воздействием герпетической инфекции возникают поражения плаценты и плода, что может приводить к образованию пороков его развития, неразвивающейся беременности, самопроизвольному ее прерыванию в различные сроки.
При заражении ребенка после 32 недель у новорожденного отмечаются кожные проявления в виде герпетических высыпаний или изъязвлений, поражение глаз — катаракта, микрофтальмия, выраженные нарушения со стороны центральной нервной системы — гидроцефалия, микроцефалия, некроз тканей, известковые включения. У детей могут иметь место такие тяжелые проявления инфекции, как менингоэнцефалит и сепсис. В последующем у детей нередко возникают тяжелые неврологические расстройства, нарушения зрения, отставание в развитии. Беременную с генитальным герпесом следует информировать о возможном риске передачи герпетической инфекции к плоду и о возможности кесарева сечения. Во время беременности противовирусные препараты применяют только при наличии тяжелой формы генитального герпеса. Лечение во время беременности должно быть направлено на профилактику рецидивов и антенатального инфицирования плода. С этой целью внутривенно капельно вводят иммуноглобулин, применяют иммуностимуляторы, гомеопатические средства. При осмотрах беременных в III триместре обязательно следует проверить наличие характерных высыпаний на половых органах.
Метод родоразрешения зависит от наличия или отсутствия поражения половых органов в конце беременности, выделения вируса герпеса и времени, прошедшего с момента разрыва плодных оболочек. При выявлении признаков свежего герпетического поражения половых органов незадолго до родов целесообразно провести родоразрешение путем кесарева сечения. В послеродовом периоде рекомендуется обязательное грудное вскармливание новорожденных вне зависимости от вида герпетической инфекции у матери, так как грудное молоко является источником противогерпетических антител, даже при выявлении в нем антигена ВПГ.
Вирусный гепатит
Вирусный гепатит представляет собой тяжелое заболевание печени. В зависимости от разновидности вируса вызывающего гепатит, различают следующие их типы: гепатит А, гепатит В, гепатит С, гепатит D, гепатит Е, гепатит F и гепатит G.
Гепатит А. Заболевание вызывается РНК-содержащим вирусом. Инфекция к матери передается фекально-оральным путем. Заражение плода происходит редко. Заражение новорожденного происходит при кормлении грудью в период нахождения вируса в крови у пациентки. Инкубационный период составляет 15-45 дней. У беременной заболевание протекает обычно в легкой или в среднетяжелой форме. Отмечается тошнота, рвота, увеличение печени, желтуха, боль в правом подреберье. В связи с тем, что вирус гепатита А не проникает через плаценту, он не приводит к возникновению пороков развития у плода. Острый вирусный гепатит А излечивается после короткой вирусемической фазы, не переходит в хроническую форму и не вызывает цирроз печени. Диагностику острого гепатита А проводят путем определения специфических антител в крови, которые выявляются уже через 2 недели после инфицирования. Лечение гепатита А проводят по общетерапевтическим, симптоматическим критериям. В случае контакта беременной с больным гепатитом А с профилактической целью вводят g-глобулин.
Гепатит В в настоящее время представляет одну из важных проблем здравоохранения, что связано с увеличением частоты заболевания и с развитием неблагоприятных исходов в виде формирования хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы. Возбудителем гепатита В является ДНК-содержащий вирус. Предполагается, что этот вирус является онкогенным. У беременных регистрируется 1-2 случая острого гепатита В на 1000 беременностей и 5-15 случаев хронического гепатита В. Источником инфекции являются больные с острым и хроническим гепатитом и вирусоносители. Передается вирус при переливании крови и препаратов крови, при половых контактах. Также возможно заражение при тесных бытовых контактах (использование общих зубных щеток, расчесок, носовых платков) и при использовании плохо обработанных медицинских инструментов.
В 85-95 % случаев инфицирование плода происходит во время родов вследствие контакта с кровью, инфицированными выделениями родовых путей или путем заглатывания инфицированных выделений. В 2-10 % случаев инфицирование происходит во время беременности путем проникновения вируса через плаценту, особенно при нарушении функции плаценты при фетоплацентарной недостаточности или при отслойке плаценты. В остальных случаях инфицирование происходит через зараженное материнское молоко. После родов возможно также заражение ребенка контактно-бытовым путем от матери. Тяжесть заболевания у новорожденных зависит от срока беременности, когда произошло инфицирование. Если инфицирование произошло в I или II триместре беременности, вероятность инфицирования составляет до 10 %. Если инфицирование имело место в III триместре, то риск передачи инфекции составляет 70 %. Если у матери в крови определяется антиген НВsAg, то риск заражения плода равен 20-40 . При дополнительном наличии антигена НBеАg, риск возрастает до 70-90 %.
При гепатите В отмечается повышенная частота преждевременных родов и самопроизвольных абортов, число преждевременных родов возрастает втрое. У большинства инфицированных детей острый гепатит В протекает в легкой форме. В подавляющем большинстве случаев (90 %) у детей в последующем развивается состояние хронического носительства вируса с риском последующей передачи инфекции. Имеет место также и риск последующего возникновения первичной карциномы или цирроза печени.
Диагностика гепатита В основана на выявлении в крови пациентки различных антигенов и антител к вирусу. При развитии острого гепатита В во время беременности терапия состоит из поддерживающего лечения (диета, коррекция водно-электролитного баланса, постельный режим). При развитии коагулопатии переливается свежезамороженная плазма, криопреципитат. Беременным с различными формами гепатита В следует избегать проведения различных инвазивных процедур во время беременности и в родах. Следует также стремиться к уменьшению продолжительности безводного промежутка и родов в целом.
Наличие гепатита В не является показанием к родоразрешению путем кесарева сечения, так как оно также не исключает вероятности инфицирования (контакт с инфицированной кровью). В послеродовом периоде вакцинации подлежат все новорожденные, родившиеся от матерей — носительниц вируса гепатита В. Новорожденным также показано введение протективного иммуноглобулина «Гепатотект» в первые 12 ч жизни. В случае вакцинации сразу после родов не следует избегать грудного вскармливания. Основным методом профилактики заражения ребенка вирусным гепатитом В является 3-кратное обследование беременных на наличие НВsAg. При риске инфицирования вирусом гепатита В беременной целесообразна 3-кратная вакцинация пациентки рекомбинантной вакциной без риска для ребенка и матери.
Гепатит С характеризуется тенденцией к развитию хронического процесса, ограниченными клиническими симптомами и плохой реакцией на противовирусную терапию. В последствии высока вероятность развития гепатоцеллюлярной карциномы.
Возбудителем гепатита С является РНК-содержащий вирус. Источниками инфекции являются больные с хронической и острой формами гепатита С, а также латентные носители вируса. Вирус передается при трансфузии зараженной крови или ее компонентов. Контактно-бытовой и половой пути заражения являются довольно редкими. Основным путем инфицирования детей является вертикальный путь передачи инфекции от матери. Инкубационный период составляет в среднем 7- 8 нед. Заболевание делится на три фазы: острую, латентную и фазу реактивации. Острая фаза в большинстве наблюдений протекает без клинических проявлений и приблизительно в 60-85 % случаев переходит в хроническую форму гепатита с риском развития цирроза печени и гепатоцеллюлярной карциномы.
Острый гепатит С как латентный, так и клинически проявляющийся в 30-50 % случаев может закончиться выздоровлением с полной элиминацией НСV. Однако в большинстве случаев он сменяется латентной фазой В период латентной фазы инфицированные лица считают себя здоровыми и никаких жалоб не предъявляют. Фаза реактивации соответствует началу новых клинических проявлений гепатита С с последующим развитием хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы.
Вакцины от гепатита С на сегодняшний день не существует. Всем беременным проводится обязательное скрининговое обследование на гепатит С трижды за беременность. Несмотря на то, что возможна вертикальная передача вируса плоду, гепатит С не является противопоказанием к беременности. Риск заражения плода гепатитом С не зависит от времени заражения матери и составляет около 6%. Передача вируса возможна как во время беременности, так и во время родов.
Нет единого мнения об оптимальном способе родоразрешения беременных с гепатитом С. Некоторые специалисты считают, что кесарево сечение снижает риск инфицирования плода, тогда как другие отрицают это. Преждевременный разрыв плодного пузыря и длительный безводный промежуток увеличивает риск передачи инфекции.
Вирус гепатита С обнаруживается и в грудном материнском молоке, и в этой связи нет также единого мнения о безопасности грудного вскармливания. У всех детей, рожденных от матерей с гепатитом С, в крови также будут отмечаться антитела к вирусу в течение первых 12 мес жизни. Если антитела сохраняются более чем через 18 мес после рождения, то это является подтверждением инфицированности ребенка гепатитом С.
Гепатит D. Возбудителем заболевания является вирус гепатита D, который представляет собой дефектный РНК-содержащий вирус, который способен производить репликацию только с помощью HBsAg-антигена вируса гепатита В. Инфекция передается при трансфузии крови или ее компонентов, а также половым путем. Инфицирование плода происходит вертикальным путем. Диагностика вирусного гепатита D основывается на выявлении антител в сыворотке крови. При инфицировании у новорожденного развивается хронический гепатит D с высоким риском цирроза печени. При гепатите D беременную следует иммунизировать по схеме вакцинации как при гепатите В. Лечение заболевания проводится в рамках общетерапевтических мероприятий.
Гепатит Е. Возбудителем инфекции является РНК-содержащий вирус, который распространяется фекально-оральным путем и вызывает острый гепатит. К плоду вирус попадает путем вертикальной передачи. При гепатите Е повышена частота самопроизвольных выкидышей. Диагноз заболевания основан на прямом выявлении вируса и определении специфических антител. Лечение острого гепатита Е проводят по общим принципам симптоматической терапии.
Гепатит G. Отмечается высокий инфекционный риск для новорожденного при данном заболевании. При наличии гепатита G у беременных в 33 % имеется вертикальная передача плоду и новорожденному. Однако у новорожденных до настоящего времени пока ни в одном случае не было выявлено клинических симптомов гепатита. НЕ обнаружено также наличие вируса в молоке, однако по аналогии с гепатитом С целесообразно воздержаться от кормления ребенка грудью. Диагноз устанавливают путем выявления вируса методом ПЦР. Лечение и профилактика острой и хронической форм вирусного гепатита G до сих пор окончательно не разработаны.
Грипп
Грипп, который может протекать у беременных в тяжелой форме, способен приводить к поражению эмбриона и плода. При данном заболевании может происходить самопроизвольное прерывание беременности, гибель плода, аномалии его развития. В результате инфекции возможно рождение недоношенных и функционально незрелых детей, а также детей с недостаточной массой тела.
Влияние вируса гриппа при внутриутробной инфекции обусловлено воздействием возбудителей на плаценту и плод, а также выраженной интоксикацией, повышенной температурой тела, нарушением маточно-плацентарного кровообращения с развитием в последующем гипоксии плода. Во время вспышек гриппа беременных следует иммунизировать поливалентной убитой вакциной.
Парвовирусная инфекция
Возбудителем инфекции является парвовирус В19 (ДНК-содержащий вирус, семейство парвовирусов, род эритровирусов), который вызывает системное заболевание — инфекционную эритему. Инфекция чаще передается воздушно-капельным путем. Особой опасности инфицирования подвержены лица, работающие в детских коллективах, а также имеющие детей в возрасте до 10 лет. Возможна также парентеральная передача при переливании крови или ее компонентов. При инфекции во время беременности вирус может передаваться трансплацентарно.
Во время беременности для клинической картины характерны кожная сыпь, боли в горле, артралгия, артрозы, транзиторная апластическая анемия, субфебрилитет. Беременность не влияет на течение заболевания. Однако при инфицировании во время беременности повышается вероятность преждевременного прерывания беременности и внутриутробного инфицирования плода. Частота передачи вируса плоду при острой инфекции — 33 %. Под влиянием вируса, воздействующего на эритроциты плода, у него снижается уровень гемоглобина. Развивающаяся при этом тяжелая анемия является причиной водянки, сердечно-сосудистой декомпенсации и смерти плода. Риск внутриутробной инфекции в III триместре уменьшается, что связано с формированием защитных сил организма плода. Возможно, что существует взаимосвязь между заболеванием инфекционной эритемой в I триместре и с различными аномалиями глаз плода.
Диагностика осуществляется путем использования ПЦР. Обнаружение специфических антител к вирусу в крови подтверждает диагноз. Обнаружение и IgG, и IgМ свидетельствует об острой инфекции, обнаружение только IgG подтверждает перенесенную в прошлом парвовирусную инфекцию. Специфического лечения заболевания не существует. Внутриматочную терапию концентратом эритроцитов проводят при уровне гемоглобина меньше 80 г/л. Перед лечением берут пробы крови с целью выявления ДНК парвовируса.
Коксаки-вирусная инфекция
При коксаки-вирусной инфекции внутриутробное инфицирование в I триместре беременности происходит редко. Однако, если это происходит, то могут сформироваться пороки развития желудочно-кишечного тракта, мочеполовой системы и центральной нервной системы. При инфицировании в поздние сроки беременности у новорожденного возможны такие проявления, как: лихорадка, отказ от еды, рвота, кожные высыпания, судороги. У некоторых новорожденных может отмечаться отит, назофарингит, пневмония.
ВИЧ-инфекция
Возбудителем является вирус иммунодефицита человека (ВИЧ) — РНК-содержащий вирус. Различают два типа ВИЧ — ВИЧ-1 и ВИЧ-2, которые приводят к развитию синдрома приобретенного иммунодефицита (СПИД). При ВИЧ-1-инфекции — у 20-40 %, а при ВИЧ-2-инфекции заболевание развивается у 4-10 % инфицированных. Это заболевание, связанное с выраженным нарушением Т-клеточного иммунитета у взрослых и Т- и В-клеточного иммунитета у детей. Источником инфекции являются больные СПИД-ом и вирусоносители. При этом срок вирусоносительства может быть очень длительным (годы). Вирус в основном распространяется половым путем, а также при трансфузии крови и ее компонентов. Плод может инфицироваться вследствие проникновения вируса через плаценту, а также во время родов и после родов через инфицированное молоко и при тесных бытовых контактах между матерью и новорожденным.
Течение ВИЧ-инфекции во время беременности может усугубляться в связи с естественным ослаблением иммунной защиты организма беременной. Наиболее частыми и выраженными осложнениями при ВИЧ-инфекции во время беременности являются: генитальный кандидоз; цервикальная неоплазия; преждевременные роды; преждевременный разрыв плодного пузыря; задержка развития плода; хориоамнионит. Наиболее опасным осложнением беременности является инфицирование плода ВИЧ-инфекцией, которое наблюдается в 30-60 % случаев независимо от наличия симптомов заболевания у матери. Заражение ВИЧ может происходить во время беременности, в родах и в послеродовом периоде. При этом возможны 3 пути переноса вируса к плоду.
Инфекция к плоду может передаваться через плаценту при ее повреждении вследствие фетоплацентарной недостаточности или при отслойке плаценты. Инфицирование возможно также при первичном заражении плаценты и накоплении вируса в клетках Гофбауэра с последующим размножением вируса и переходом его к плоду. Инфицирование плода может происходить и в родах при контакте слизистых оболочек плода с инфицированной кровью или выделениями родового канала. После родов инфицируется от 15 до 45 % детей от ВИЧ-инфицированных матерей. Большинство из этих женщин не знают о наличии у себя инфекции и в основном инфицируют детей при грудном вскармливании.
Заражение ВИЧ-инфекцией плода или новорожденного приводит к развитию у него иммунодефицита, который отличается от такового у взрослых. До 5 лет жизни СПИД развивается у 80 % детей, инфицированных ВИЧ во время беременности. Первыми признаками внутриутробной ВИЧ-инфекции являются недостаточная масса тела, гипотрофия и различная неврологическая симптоматика. Вскоре после рождения присоединяются: упорный понос, лимфаденопатия, увеличение печени и селезенки, грибковое поражение ротовой полости, задержка развития. Часто отмечаются пневмонии и рецидивирующие инфекции. Симптомы поражения центральной нервной системы связаны с диффузной энцефалопатией, атрофией мозжечка, микроцефалией, отложением внутричерепных кальцификатов.
Диагностика ВИЧ-инфекции основана на выявления факторов риска или клинических симптомов заболевания с подтверждением диагноза с помощью серологических тестов. Серологические исследования проводят с использованием твердофазного иммуноферментного анализа в сочетании с подтверждающими тестами. В настоящее время назначение беременным специфических противовирусных препаратов позволяет снизить риск внутриутробного инфицирования до 5-10 %. Таким противовирусным препаратом у беременных является зидовудин — аналог нуклеозидов ВИЧ.
ВИЧ-инфекция у пациентки, получающей противовирусные препараты, не является показанием для кесарева сечения у женщин, так как риск инфицирования плода при кесаревом сечении и естественных родах примерно одинаков. У ВИЧ-инфицированных женщин, не получавших терапии во время беременности, в настоящее время методом выбора является кесарево сечение. В случае ведения родов через естественные пути следует придерживаться правил ведения родов при любых вирусных инфекциях. Для предотвращения постнатального инфицирования естественное вскармливание при ВИЧ-инфекции противопоказано.
С целью сокращения случаев внутриутробного инфицирования проводят обязательное обследование всех беременных женщин на ВИЧ-инфекцию трижды за беременность: при постановке на учет, при сроке 24-28 недель и перед родами. Также рекомендуется обследование на ВИЧ половых партнеров беременных пациенток.
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
ЛЕЧЕНИЕ ИНТЕРЕФЕРОНАМИ ДЕТЕЙ С ВНУТРИУТРОБНЫМИ ИНФЕКЦИЯМИ | Шамшева
1. Буданов П.В., Стрижаков А.Н. Этиология, патогенез, диагностика и лечение внутриутробной инфекции // Вопросы гинекологии, акушерства и перинатологии. — 2010. — Т.9, №3. С.— 61—71.
2. Хашукоева А.З., Ибрагимова М.И., Хашукоева З.З., Бурденко М.В. Возможности применения Виферона в акушерско-гинекологической практике // Эффективная фармакотерапия в акушерстве и гинекологии. — №4, сентябрь. — 2007. — С. 22—27.
3. Бочарова И.И., Аксенов А.Н., Башакин Н.Ф. и др. Итоги и перспективы научных исследований по проблеме внутриутробных инфекций новорожденных // Российский вестник акушера-гинеколога. — №5. — 2007. — С. 60—63.
4. Павлова М.В., Федорова Н.Е., Гаджиева З.С. и др. Алгоритм лабораторной диагностики врожденной цитомегаловирусной инфекции у недоношенных детей и влияние терапии вифероном на течение внутриутробной инфекции // Педиатрия. — 2009. — Т. 87, №2. — С. 55—62.
5. Котлуков В.К., Кузьменко Л.Г., Блохин Б.М. и др. Иммунореабилитация детей раннего возраста с цитомегаловирусной инфекцией, протекающей с синдромом бронхиальной обструкции // Педиатрия. — 2007. — Т. 86, №1. — С. 45—52.
6. Климова Р.Р., Малиновская В.В., Гусева Т.Г. и др. Влияние герпесвирусных инфекций на уровень провоспалительных цитокинов у недоношенных новорожденных детей // Вопросы вирусологии. — №4, 2011. — С. 23—26.
7. Роговская С.И. Папилловирусная инфекция у женщин и патология шейки матки. — М.: ГЭОТАР Медиа, 2005.
8. Солдатова И.Г., Гетия Е.Г., Ашиткова Н.В. и др. Клиническая эффективность препарата Виферон-1 в комплексной терапии пневмоний у новорожденных детей различного гестационного возраста // Педиатрия. — 2007. — Т. 86, №4. — С. 106—110.
9. Зароченцева Н.В., Малиновская В.В., Серова О.Ф. и др. Папилломавирусная инфекция у беременных // Российский вестник акушерства-гинекологии. — №6, 2011. — С. 77—80.
10. Соколов С.А., Королева Л.И., Тишков А.В. и др. Применение современных статистических методов для оценки взаимосвязи интерферонового статуса здорового новорожденного и его матери // Инфекция и иммунитет. — 2011. — Т. 1, №4. — С. 331—340.
11. Малиновская В.В., Гусева Т.С., Паршина О.В. и др. Интерфероновый статус недоношенных новорожденных детей с клиническими признаками внутриутробной инфекции и его коррекция препаратами рекомбинатного интерферона — D2b (вифероном) // Российский Аллергологический Журнал. — №6, 2008. — С. 71—78.
12. Кешинян Е.С., Касохоа Т.Б. Система интерферона и ее возрастные особенности. Применение препаратов в неонатальном периоде // Российский вестник перинатологии и педиатрии. — 1993. — Т. 38, №2. — С.15—17.
13. Петров Р.В., Хаитов Р.М., Пинегин Б.В. и др. Оценка иммунного статуса человека при массовых обследованиях: Методические рекомендации для научных работников и врачей практического здравоохранения // Иммунология. — 1992. — №6. — С. 51—56.
14. Змызгова А.В. Современные аспекты применения интреферонов и других иммуномодуляторов. — М., 1990. — С. 42—43.
15. Бочарова И.И., Малиновская В.В., Аксенов А.Н. и др. Применение Виферона в комплексном лечении урогенитальных инфекций у новорожденных // Эффективная фармакотерапия в акушерстве и гинекологии. — № 6, ноябрь, 2009. — С. 28— 32.
16. Тапильская Н.И., Воробцова И.Н., Гайдуков С.Н. Применение Виферона в III триместре беременности для профилактики инфицирования новорожденных вирусом папилломы человека// TERRA MEDICA NOVA. — №3, 2006. — С. 1—2.
17. Абаева З.Р. Влияние Виферона на иммунитет новорожденных от матерей, инфицированных цитомегаловирусом вирусом простого герпеса: Автореф. дисс. … к.м.н. — М., 2001. — 28 с.
18. Куш А.А., Дегтярева М.В., Малиновская В.В. и др. Эффективность лечения рекомбинантным интерфероном альфа-2 (Вифероном) недоношенных детей с тяжелыми внутриутробными инфекциями // Детские инфекции. — 2009, №3. — С. 40—44.
Внутриутробная инфекция (хориоамнионит) | Tommy’s
Внутриутробная инфекция — это инфекция в утробе матери , что в контексте беременности обычно означает инфицирование:
- оболочки, которые окружают ребенка
- пуповина
- и / или околоплодные воды.
Исследования показывают, что внутриутробная инфекция может быть причиной до 40 процентов преждевременных родов, с более высокими показателями на более ранних сроках беременности (очень недоношенные дети).
Что такое внутриутробная инфекция?
Матка, околоплодные воды и окружающая среда, в которой развивается ребенок, могут быть инфицированы бактериями. Обычно это естественные бактерии, которые многие женщины переносят во влагалище или на коже, которые обычно безвредны, но мигрировали в те части тела, где их быть не должно. Наиболее частая причина внутриутробной инфекции — через влагалище и шейку матки, но она также может передаваться через плаценту, маточные трубы или через инвазивные процедуры, такие как амниоцентез.
Инфекции, которые могут проникнуть в матку, включают E-Coli и стрептококк группы B (GBS), бактериальный вагиноз, хламидиоз, трихомону, гонорею, сифилис и ВИЧ.
Если инфекция достигает матки, это может вызвать воспаление и инфицирование плодных оболочек (оболочки мешочка, окружающего ребенка в утробе матери, также называемого амнионом или хорионом). Это называется хориоамнионитом. Если поражена пуповина, это называется фунизитом.
Каковы последствия хориоамнионита?
Это инфекция оболочек мешочка, в котором находится ребенок, и воды, и обычно возникает, когда нераспознанная инфекция проникает в матку из влагалища.Инфекция вызывает воспаление плодных оболочек, что само по себе может вызвать преждевременные схватки. Это также может привести к преждевременному отрыву воды (также известному как преждевременный преждевременный разрыв плодных оболочек, или сокращенно PPROM). Ребенку, возможно, придется скоро родиться, чтобы предотвратить более серьезную инфекцию.
Обратите внимание на следующие симптомы хориоамнионита:
- высокая температура
- выделения из влагалища с неприятным запахом
- высокая частота пульса
- боль в животе.
Если у вас есть какие-либо из этих симптомов, как можно скорее обратитесь за советом к своему лечащему врачу, поскольку вам может потребоваться лечение.
Инфекции мочевыводящих путей (ИМП)
ИМП, часто вызываемые вирусом E-Coli, поражают около пяти процентов беременных женщин. Примерно от одной трети до половины этих женщин ИМП попадают в почки, вызывая острый пиелонефрит, инфекцию почек, которая может вызвать преждевременные роды и низкий вес при рождении. Следите за этими симптомами ИМП:
- высокая температура
- тошнота
- рвота
- Боль в боках или пояснице
- дискомфорт или боль при мочеиспускании
- кровь в моче
Если у вас есть какие-либо из этих симптомов, как можно скорее свяжитесь с вашим лечащим врачом, так как вам могут потребоваться антибиотики.
Лечение инфекций
Не всегда легко обнаружить инфекцию; на ранних стадиях явных симптомов может не быть. Если есть какие-либо признаки инфекции, например, если у вас высокая температура, ваша медицинская бригада проверит вас либо с помощью анализа крови, либо с помощью простого мазка.
Если у вас преждевременный отток воды (PPROM), вам, конечно же, могут дать таблетки антибиотика, чтобы снизить риск хориоамнионита.
Если инфекция прогрессировала за определенное время или если вы очень плохо себя чувствуете, вам может потребоваться госпитализация для внутривенного введения антибиотиков, а в некоторых случаях может потребоваться роды.В большинстве случаев PPROM прием антибиотиков помогает снизить вероятность хориоамнионита, снижает количество родов в течение 48 часов после выхода воды и снижает вероятность развития инфекции у ребенка.
Подробнее о водах, разрушающих ранний / преждевременный разрыв плодных оболочек (PPROM)
Внутриутробная инфекция и недоношенность — PubMed
Обзор
Ment Retard Dev Disabil Res Rev
.2002; 8 (1): 3-13.
DOI: 10.1002 / mrdd.10008.
Принадлежности
Расширять
Принадлежность
- 1 Отделение перинатологических исследований, NICHD, больница Hutzel, отделение акушерства и гинекологии, Детройт, Мичиган 48201, США.
Элемент в буфере обмена
Обзор
Луис Ф. Гонсалвес и др.
Ment Retard Dev Disabil Res Rev.
2002 г.
Показать детали
Показать варианты
Показать варианты
Формат
АннотацияPubMedPMID
Ment Retard Dev Disabil Res Rev
.2002; 8 (1): 3-13.
DOI: 10.1002 / mrdd.10008.
Принадлежность
- 1 Отделение перинатологических исследований, NICHD, больница Hutzel, отделение акушерства и гинекологии, Детройт, Мичиган 48201, США.
Элемент в буфере обмена
Опции CiteDisplay
Показать варианты
Формат
АннотацияPubMedPMID
Абстрактный
Внутриутробная инфекция — основная причина преждевременных родов с неповрежденными плодными оболочками и без них.Внутриутробная инфекция присутствует примерно в 25% всех преждевременных родов, и чем раньше наступает срок беременности, тем выше частота внутриамниотической инфекции. Микроорганизмы также могут получить доступ к плоду до родов. Синдром воспалительной реакции плода, вызванный микробными продуктами, связан с приближающимся началом преждевременных родов, а также с мультисистемным поражением органов плода человека и более высокой частотой перинатальной заболеваемости. Наиболее распространенными микроорганизмами, вызывающими внутриутробные инфекции, являются Ureaplasma urealyticum, виды Fusobacterium и Mycoplasma hominis.Роль Chlamydia trachomatis и вирусов в преждевременных родах еще предстоит определить. Использование методов молекулярной микробиологии для диагностики внутриутробной инфекции может раскрыть роль привередливых микроорганизмов, которые еще не были обнаружены. Назначение антибиотиков пациентам с бессимптомной бактериурией связано со значительным снижением частоты преждевременных родов. Однако такая польза не была продемонстрирована для пациентов с бактериальным вагинозом или женщин-носителей Streptococcus agalactia, Ureaplasma urealyticum или Trichomonas vaginalis.Назначение антибиотиков пациентам с преждевременным преждевременным разрывом плодных оболочек связано с продлением беременности и снижением частоты клинического хориоамнионита и неонатального сепсиса. Польза не была продемонстрирована у пациентов с преждевременными родами и неповрежденными плодными оболочками. Требуются серьезные усилия, чтобы определить, почему у одних женщин развивается восходящая внутриутробная инфекция, а у других — нет, а также какие меры могут уменьшить пагубное влияние системного воспаления плода.
Авторские права 2002 Wiley-Liss, Inc.
Похожие статьи
Назначение антибиотиков пациентам с преждевременными родами и неповрежденными плодными оболочками: есть ли положительный эффект у пациентов с эндоцервикальным воспалением?
Овалле А., Ромеро Р., Гомес Р., Мартинес М.А., Ниен Дж. К., Ферран П., Аспиллага С., Фигероа Х.Ovalle A, et al.
J Matern Fetal Neonatal Med. 2006 август; 19 (8): 453-64. DOI: 10.1080 / 14767050600852668.
J Matern Fetal Neonatal Med. 2006 г.PMID: 16966109
Клиническое испытание.
Идиопатическое вагинальное кровотечение при беременности как единственное клиническое проявление внутриутробной инфекции.
Гомес Р., Ромеро Р., Ниен Дж. К., Медина Л., Карстенс М., Ким Ю. М., Чайворапонгса Т., Эспиноза Дж., Гонсалес Р.Гомес Р. и др.
J Matern Fetal Neonatal Med. 2005 июл; 18 (1): 31-7. DOI: 10.1080 / 14767050500217863.
J Matern Fetal Neonatal Med. 2005 г.PMID: 16105789
Внутриутробная инфекция и самопроизвольный аборт в середине беременности: похож ли спектр микроорганизмов на таковой при преждевременных родах?
Макдональд Х.М., Чемберс Х.М.
Макдональд Х.М. и др.
Заражение Dis Obstet Gynecol.2000; 8 (5-6): 220-7. DOI: 10.1155 / S10647440314.
Заражение Dis Obstet Gynecol. 2000 г.PMID: 11220481
Бесплатная статья PMC.Лечение антибиотиками внутриамниотической инфекции, вызванной Ureaplasma urealyticum. Отчет о болезни и обзор литературы.
Smorgick N, Frenkel E, Zaidenstein R, Lazarovitch T, Sherman DJ.
Сморгик Н. и др.
Fetal Diagn Ther. 2007; 22 (2): 90-3.DOI: 10,1159 / 000097103. Epub 2006 27 ноября.
Fetal Diagn Ther. 2007 г.PMID: 17135751
Обзор.
[Ведение угрожающих преждевременных родов с неповрежденными плодными оболочками: показания к применению антибиотиков].
Винер Н.
Винер Н.
J Gynecol Obstet Biol Reprod (Париж). 2002 ноя; 31 (7 доп.): 5С74-83.
J Gynecol Obstet Biol Reprod (Париж). 2002 г.PMID: 12454629
Обзор.Французский язык.
Процитировано
173
статьи
Этиологические пути преждевременных родов: подход к анализу байесовских сетей и медиации.
Элиас Д., Кампанья Х, Полетта Ф.А., Хайсеке С.Л., Гили Дж. А., Ратовецки Дж., Павлюк М., Сантос М.Р., Косентино В., Уранга Р., Салем С., Риттлер М., Крупицки Г.Б., Лопес Камело Д.С., Хименес Л.Г.Элиас Д. и др.
Pediatr Res. 2021, 19 июля. Doi: 10.1038 / s41390-021-01659-4. Онлайн до печати.
Pediatr Res. 2021 г.PMID: 34282276
Материнские прогностические факторы преждевременных родов: исследование случай-контроль в Южном Иране.
Алави А., Размджоу П., Сафари-Морадабади А., Дадипур С., Шахсавари С.
Алави А. и др.
J Education Health Promoot. 2021 20 мая; 10: 124.DOI: 10.4103 / jehp.jehp_668_20. Электронная коллекция 2021 г.
J Education Health Promoot. 2021 г.PMID: 34222499
Бесплатная статья PMC.Пародонтологические патогены и преждевременные роды: текущие знания и дальнейшие вмешательства.
Терзич М., Аймагамбетова Г., Терзич С., Радунович М., Бапаева Г., Лагана А.С.
Terzic M, et al.
Возбудители. 2021 г., 9 июня; 10 (6): 730. DOI: 10.3390 / pathogens10060730.Возбудители. 2021 г.PMID: 34207831
Бесплатная статья PMC.Обзор.
Полезность рутинного тестирования на хламидиоз и гонорею при преждевременных родах или преждевременном разрыве мембран.
Эбисутани К., Ван С.К., Джун Ан Х., Броуди А.Дж., Канеширо Б.
Эбисутани К. и др.
Гавайи J Health Soc Welf. 2021 июнь; 80 (6): 134-139.
Гавайи J Health Soc Welf.2021 г.PMID: 34195620
Бесплатная статья PMC.Антимикробная активность плодных оболочек человека: от биологической функции до клинического использования.
Рамута Ту, Шкет Т., Старчич Ерявец М., Крефт МЭ.
Рамута То и др.
Фронт Bioeng Biotechnol. 2021 31 мая; 9: 6. DOI: 10.3389 / fbioe.2021.6. Электронная коллекция 2021 г.
Фронт Bioeng Biotechnol. 2021 г.PMID: 34136474
Бесплатная статья PMC.Обзор.
Условия MeSH
- Амниотическая жидкость / микробиология
- Антибактериальные агенты / терапевтическое применение
- Хориоамнионит / медикаментозная терапия
- Хориоамнионит / микробиология
- Микоплазма / выделение и очистка
- Акушерские роды, преждевременные роды / этиология *
- Осложнения беременности, Инфекционная / медикаментозная терапия
- Осложнения беременности, инфекционные / этиология *
[Икс]
цитировать
Копировать
Формат:
AMA
APA
ГНД
NLM
Материнская внутриутробная инфекция, цитокины и повреждение мозга у недоношенных новорожденных
Всемирная организация здравоохранения 1977 Международная классификация болезней.Руководство по международной классификации болезней, травм и причин смерти, Том 1 . ВОЗ, Женева, стр. 764
Berkowitz GS, Papiernik E 1993 Эпидемиология преждевременных родов. Epidemiol Rev 15 : 414–443.
Артикул
CAS
Google Scholar
Lee KS, Khoshnood B, Hsieh HL, Kim BI, Schreiber MD, Mittendorf R 1995 Какие группы веса при рождении внесли наибольший вклад в общее снижение уровня неонатальной смертности в Соединенных Штатах с 1960 по 1986 год ?. Paediatr Perinat Epidemiol 9 : 420–430.
Артикул
CAS
Google Scholar
Ромеро Р., Локвуд С., Оярсун Э., Хоббинс Дж. С. 1988 Токсемия: новые концепции в старой болезни. Семин Перинатол 12 : 302–323.
CAS
PubMed
Google Scholar
Бротон Пипкин Ф. 1995 Гипертонические расстройства беременности. BMJ 311 : 609–613.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Гомес Р., Хеззи Ф., Ромеро Р., Муньос Х., Толоса Дж. Э., Рохас И. 1995 г. Преждевременные роды и внутриамниотическая инфекция. Клинические аспекты и роль цитокинов в диагностике и патофизиологии. Clin Perinatol 22 : 281–342.
Артикул
CAS
Google Scholar
Guinn DA, Goldenberg RL, Hauth JC, Andrews WW, Thom E, Romero R 1995 Факторы риска развития преждевременного разрыва плодных оболочек после остановки преждевременных родов. Am J Obstet Gynecol 173 : 1310–1315.
Артикул
CAS
Google Scholar
Seo K, McGregor JA, French JI 1992 Преждевременные роды связаны с повышенным риском материнской и неонатальной инфекции. Obstet Gynecol 79 : 75–80.
CAS
PubMed
Google Scholar
Hillier SL, Nugent RP, Eschenbach DA, Krohn MA, Gibbs RS, Martin Dh, Cotch MF, Edelman R, Pastorek JG, Rao AV, McNellis D, Regan JA, Carey JC, Klebanoff MA, для вагинального Группа по изучению инфекций и недоношенности, 1995 г. Связь между бактериальным вагинозом и преждевременными родами новорожденного с низкой массой тела. N Engl J Med 333 : 1737–1742.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Hauth JC, Goldenberg RL, Andrews WW, DuBard MB, Copper RL 1995 Снижение частоты преждевременных родов при применении метронидазола и эритромицина у женщин с бактериальным вагинозом. N Engl J Med 333 : 1732–1736.
Артикул
CAS
Google Scholar
Andrews WW, Hauth JC, Goldenberg RL, Gomez R, Romero R, Cassell GH 1995 Интерлейкин-6 в околоплодных водах: корреляция с микробной колонизацией верхних половых путей и гестационным возрастом у женщин, родивших после спонтанных родов против указанных родов . Am J Obstet Gynecol 173 : 606–612.
Артикул
CAS
Google Scholar
Голденберг Р.Л., Эндрюс У.В. 1996 От редакции: Внутриутробная инфекция и почему программы преждевременной профилактики потерпели неудачу. Am J Public Health 86 : 781–783.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Панет Н., Пинто-Мартин Дж. 1990 Эпидемиология зародышевого матрикса / внутрижелудочкового кровоизлияния.В: Kiely M (ed) Репродуктивная и перинатальная эпидемиология . CRC Press, Бока-Ратон, Флорида, стр. 371–399.
Google Scholar
Панет Н., Руделли Р., Казам Э., Монте В. 1994 Повреждение мозга у недоношенных детей . MacKeith Press, Лондон, 171–185.
Google Scholar
Volpe JJ 1992 Эпидемиология зародышевого матрикса / внутрижелудочкового кровоизлияния. Biol Neonate 62 : 231–242.
Артикул
CAS
Google Scholar
Левитон А., Панет Н. 1990 Повреждение белого вещества у недоношенных новорожденных — эпидемиологическая перспектива. Early Hum Dev 24 : 1–22.
Артикул
CAS
Google Scholar
Morales WJ 1987 Влияние хориоамнионита на исход развития недоношенных детей в возрасте одного года. Obstet Gynecol 70 : 183–186.
CAS
PubMed
PubMed Central
Google Scholar
Yoon BH, Romero R, Kim CJ, Jun JK, Gomez R, Choi JH, Syn HC 1995 Интерлейкин-6 в околоплодных водах: чувствительный тест для антенатальной диагностики острых воспалительных поражений недоношенной плаценты и прогнозирования перинатальной заболеваемости . Am J Obstet Gynecol 172 : 960–970.
Артикул
CAS
Google Scholar
Salafia CM, Minior VK, Rosenkrantz TS, Pezzullo JC, Popek EJ, Cusick W., Vintzileos AM 1995 Материнские, плацентарные и неонатальные ассоциации с ранним зародышевым матриксом / внутрижелудочковым кровотечением у младенцев, родившихся до 32 недель беременности. Am J Perinatol 12 : 429–436.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Mercer BM, Arheart KL 1995 Антимикробная терапия в выжидательной тактике преждевременного преждевременного разрыва плодных оболочек. Ланцет 346 : 1271–1279.
Артикул
CAS
Google Scholar
Эгартер С., Лейтич Х., Карас Х., Визер Ф., Хуслейн П., Кайдер А., Шемпер М. 1996 Лечение антибиотиками при преждевременном преждевременном разрыве плодных оболочек и неонатальной заболеваемости: метаанализ. Am J Obstet Gynecol 174 : 589–597.
Артикул
CAS
Google Scholar
Bejar R, Wozniak P, Allard M, Benirschke K, Vaucher Y, Coen R, Berry C, Schragg P, Villegas I, Resnik R 1988 Антенатальное происхождение неврологических повреждений у новорожденных. Am J Obstet Gynecol 159 : 357–363.
Артикул
CAS
Google Scholar
Kothadia JM, O’Shea TM, Del Paggio D, Dillard RG 1994 Факторы пренатального риска перивентрикулярной эхоплотности у новорожденных с очень низкой массой тела при рождении. Paediatr Perinat Epidemiol 8 : A7.
Google Scholar
Zupan V, Gonzalez P, Lacaze-Masmonteil T, Boithias C, D’Allest AM, Dehan M, Gabilan JC 1996 Перивентрикулярная лейкомаляция: еще раз о факторах риска. Dev Med Child Neurol 38 : 1061–1067.
Артикул
CAS
Google Scholar
Майс Дж., Верма У., Кляйн С., Теджани Н. 1995 Острый аппендицит во время беременности и возникновение большого внутрижелудочкового кровоизлияния и перивентрикулярной лейкомаляции. Obstet Gynecol 86 : 650–652.
Артикул
CAS
Google Scholar
Перлман Дж. М., Роллинз Н., Бернс Д., Риссер Р. 1993 Взаимосвязь между перивентрикулярной интрапаренхимальной эхоплотностью и внутрижелудочковым кровоизлиянием зародышевого матрикса у новорожденного с очень низкой массой тела. Педиатрия 91 : 474–480.
CAS
PubMed
Google Scholar
Trounce JQ, Rutter N, Levene MI 1986 Перивентрикулярная лейкомаляция и внутрижелудочковое кровотечение у недоношенных новорожденных. Arch Dis Child 61 : 1196–1202.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Armstrong DL, Sauls CD, Goddard-Finegold J 1987 Невропатологические находки у пациентов, перенесших внутрижелудочковое кровоизлияние в короткий срок. Am J Dis Child 141 : 617–621.
CAS
PubMed
Google Scholar
Dambska M, Laure-Kamionowska M, Schmidt-Sidor B 1989 Ранние и поздние невропатологические изменения при перинатальном повреждении белого вещества. J Детский нейрол 4 : 291–298.
Артикул
CAS
Google Scholar
Йокочи К., Айба К., Хорие М., Инукай К., Фудзимото С., Кодама М., Кодама К. 1991 Магнитно-резонансная томография у детей со спастической диплегией: корреляция с тяжестью их двигательных и психических отклонений. Dev Med Child Neurol 33 : 18–25.
Артикул
CAS
Google Scholar
Krägeloh-Mann I, Petersen D, Hagberg G, Vollmer B, Hagberg B, Michaelis R 1995 Двусторонний спастический церебральный паралич — патология и происхождение МРТ.Анализ репрезентативной серии из 56 случаев. Dev Med Child Neurol 37 : 379–397.
Артикул
Google Scholar
Мерфи Д.Д., Селлерс С., Маккензи И.З., Юдкин П.Л., Джонсон А.М. 1995 Исследование факторов риска дородового и интранатального риска церебрального паралича у очень недоношенных детей-одиночек. Ланцет 346 : 1449–1454.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Grether JK, Nelson KB, Emery ES, Cummins SK 1996 Пренатальные и перинатальные факторы и церебральный паралич у младенцев с очень низкой массой тела при рождении. J Pediatr 128 : 407–414.
Артикул
CAS
Google Scholar
MacDonald PC, Casey ML 1996 Преждевременные роды. Sci Am Март / апрель: 42–51.
Lockwood CJ 1994 Последние достижения в выяснении патогенеза преждевременных родов, выявлении пациентов из группы риска и профилактических методах лечения. Curr Opin Obstet Gynecol 6 : 7–18.
Артикул
CAS
Google Scholar
Mazor M, Cohen J, Romero R, Ghezzi F, Tolosa JE, Gomez R 1995 Цитокины и преждевременные роды. Fetal Maternal Med. Ред. 7 : 207–233.
Артикул
Google Scholar
Адинолфи М. 1993 Инфекционные болезни при беременности, цитокины и неврологические нарушения: гипотеза. Dev Med Child Neurol 35 : 549–553.
Артикул
Google Scholar
Leviton A 1993 Преждевременные роды и церебральный паралич: фактор некроза опухоли — недостающее звено ?. Dev Med Child Neurol 35 : 553–558.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Inglis SR, Jeremias J, Kuno K, Lescale K, Peeper Q, Chervenak FA, Witkin SS 1994 Обнаружение фактора некроза опухоли α, интерлейкина-6 и фибронектина плода в нижних половых путях во время беременности: соотношение к результату. Am J Obstet Gynecol 171 : 5–10.
Артикул
CAS
Google Scholar
Hillier SL, Witkin SS, Krohn MA, Watts DH, Kiviat NB, Eschenbach DA 1993 Взаимосвязь цитокинов околоплодных вод и преждевременных родов, инфекции околоплодных вод, гистологического хориоамнионита и инфекции хориоамниона. Obstet Gynecol 81 : 941–948.
CAS
Google Scholar
Фигероа Р., Мартинес Э., Сегал П., Гарри Д., Патель К., Верма У., Визинтайнер П., Реале М., Кляйн С., Теджани Н. 1996 Повышенный уровень интерлейкина-6 в околоплодных водах прогнозирует перивентрикулярную гемокаляцию новорожденных и внутрижелудочковую лейкомаляцию. Am J Obstet Gynecol 174 : 330
Google Scholar
Yoon BH, Romero R, Yang SH, Jun JK, Kim IO, Choi JH, Syn HC 1996 Концентрации интерлейкина-6 в плазме пуповины повышены у новорожденных с поражениями белого вещества, связанными с перивентрикулярной лейкомаляцией. Am J Obstet Gynecol 174 : 1433–1440.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Opsjøn SL, Wathen NC, Tingulstad S, Wiedswang G, Sundan A, Waage A, Austgulen R 1993 Фактор некроза опухоли, интерлейкин-1 и интерлейкин-6 при нормальной беременности человека. Am J Obstet Gynecol 169 : 397–404.
Артикул
Google Scholar
Mitchell MD, Trautman MS, Dudley DJ 1993 Сеть цитокинов в плаценте. Плацента 14 : 249–275.
Артикул
CAS
Google Scholar
Ромеро Р., Мазор М., Сепульведа В., Авила С., Коупленд Д., Уильямс Дж. 1992 Фактор некроза опухоли при преждевременных и срочных родах. Am J Obstet Gynecol 166 : 1576–1587.
Артикул
CAS
Google Scholar
Saito S, Kasahara T, Kato Y, Ishihara Y, Ichijo M 1993 Повышение уровня интерлейкина-6 (IL-6), IL-8 и фактора, стимулирующего колонию гранулоцитов (G-CSF) в околоплодных водах, у доношенных и недоношенных роды. Цитокин 5 : 81–88.
Артикул
CAS
Google Scholar
Stallmach T, Hebisch G, Joller-Jemelka HI, Orban P, Schwaller J, Engelmann M 1995 Производство цитокинов и визуализированные эффекты в фето-материнском отделении. Lab Invest 73 : 384–392.
CAS
Google Scholar
Greig PC, Ernest JM, Teot L, Erikson M, Talley R 1993 Уровни интерлейкина-6 в околоплодных водах коррелируют с гистологическим хориоамнионитом и посевами околоплодных вод у пациентов с преждевременными родами с неповрежденными мембранами. Am J Obstet Gynecol 169 : 1035–1044.
Артикул
CAS
Google Scholar
Сингх Б., Торговец П., Уокер С. Р., Криворучко М., Диаз-Митома Ф. 1996 Экспрессия интерлейкина-6 в пуповинной крови пациентов с клиническим хориоамнионитом. Pediatr Res 39 : 976–979.
Артикул
CAS
Google Scholar
Мияно А., Миямичи Т., Накаяма М., Китадзима Х., Симидзу А. 1996 Влияние хориоамнионита на уровни сывороточных белков в пуповинной крови недоношенных детей. Arch Pathol Lab Med 120 : 245–248.
CAS
PubMed
Google Scholar
Ячи А., Такано Н., Йокои Т., Като К., Касахара Ю., Мияваки Т., Танигучи Н. 1990 Способность лейкоцитов новорожденных вырабатывать IL-6 при стимуляции, оцениваемая с помощью культуры цельной крови. Pediatr Res 27 : 227–233.
Артикул
CAS
Google Scholar
Liechty KW, Koenig JM, Mitchell MD, Romero R, Christensen RD 1991 Производство интерлейкина-6 фетальными и материнскими клетками in vivo во время интраамниотической инфекции и in vitro после стимуляции интерлейкином-1. Pediatr Res 29 : 1–4.
Артикул
CAS
Google Scholar
Drews K, Szczapa J, Zak J, Andrzejewska R, Zak L, Mackiewicz A 1995 Концентрация С-реактивного белка и интерлейкина-6 в сыворотке крови при диагностике неонатальной инфекции. Ann NY Acad Sci 762 : 398–399.
Артикул
CAS
Google Scholar
Williams PA, Bohnsack JF, Augustine NH, Drummond WK, Rubens CE, Hill HR 1993 Производство фактора некроза опухоли человеческими клетками in vitro, и in vivo, , индуцированное стрептококками группы B. J Pediatr 123 : 292–300.
Артикул
CAS
Google Scholar
Girardin EP, Berner ME, Grau GE, Suter S, Lacourt G, Paunier L 1990 Фактор некроза опухоли сыворотки у новорожденных из группы риска по инфекциям. Eur J Pediatr 149 : 645–647.
Артикул
CAS
Google Scholar
Мессер Дж., Эйер Д., Донато Л., Галлати Х, Матис Дж., Симеони Ю. 1996 Оценка интерлейкина-6 и растворимых рецепторов фактора некроза опухоли для ранней диагностики неонатальной инфекции. J Pediatr 129 : 574–580.
Артикул
CAS
Google Scholar
Hopkins SJ, Rothwell NJ 1995 Цитокины и нервная система. I. Выражение и признание. Trends Neurosci 18 : 83–88.
Артикул
CAS
Google Scholar
Ransohoff RM, Benveniste EN (eds) 1996 Cytokines and the CNS .CRC Press, Бока-Ратон, Флорида
Google Scholar
Chao CC, Hu S, Close K, Choi CS, Molitor TW, Novick WJ, Peterson PK 1992 Высвобождение цитокинов из микроглии: дифференциальное ингибирование пентоксифиллином и дексаметазоном. J Infect Dis 166 : 847–853.
Артикул
CAS
Google Scholar
Lee SC, Liu W, Dickson DW, Brosnan CF, Berman JW 1993 Производство цитокинов микроглией и астроцитами плода человека. J Immunol 150 : 2659–2667.
CAS
Google Scholar
Casey ML, Cox SM, Beutler B, Milewich L, MacDonald PC 1989 Кахектин / фактор некроза опухоли α в децидуальной оболочке человека. Возможная роль цитокинов в преждевременных родах, вызванных инфекцией. Дж. Клин Инвест 83 : 430–436.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Dudley DJ, Chen CL, Branch DW, Hammond E, Mitchell MD 1993 Модель преждевременных родов на мышах: медиаторы воспаления регулируют продукцию простагландина E2 и интерлейкина-6 децидуальной оболочкой мыши. Biol Reprod 48 : 33–39.
Артикул
CAS
Google Scholar
Kauma SW, Herman K, Wang Y, Walsh SW 1993 Дифференциальная экспрессия мРНК и продукция интерлейкина-6 в компартментах трофобласта плаценты и ядра ворсинок. Am J Reprod Immunol 30 : 131–135.
Артикул
CAS
Google Scholar
Matsuzaki N, Taniguchi T, Shimoya K, Neki R, Okada T, Saji F, Nakayama M, Suehara N, Tanizawa O 1993 Плацентарная продукция интерлейкина-6 увеличивается при внутриутробной инфекции, но не во время родов. Am J Obstet Gynecol 168 : 94–97.
Артикул
CAS
Google Scholar
Kent ASH, Sullivan MHF, Sun MY, Zosmer A, Elder MG 1993 Влияние интерлейкина-6 и фактора некроза опухоли-α на продукцию простагландинов культивированными плодными оболочками человека. Простагландины 46 : 351–359.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Mitchell MD, Trautman MS, Donald DJ 1993 Сеть цитокинов в плаценте. Плацента 14 : 249–275.
Артикул
CAS
Google Scholar
Ala Y, Palluy O, Favero J, Bonne C, Modat G, Dornand J, 1992 Гипоксия / реоксигенация стимулирует эндотелиальные клетки, чтобы способствовать промотированию интерлейкина-1 и интерлейкина-6. Воздействие на поглотителей свободных радикалов. Действия агентов 37 : 134–139.
Артикул
CAS
Google Scholar
Fortunato SJ, Menon RP, Swan KF, Menon R 1996 Высвобождение воспалительных цитокинов (интерлейкинов 1, 6 и 8 и фактор некроза опухоли α) из культивируемых плодных мембран человека в ответ на эндотоксические липополисахариды отражает концентрацию околоплодных вод. Am J Obstet Gynecol 174 : 1855–1862.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Адинольфи М. 1985 Развитие гематоэнцефалического барьера человека. Dev Med Child Neurol 27 : 532–537.
Артикул
CAS
Google Scholar
Бэнкс В.А., Кастин А.Дж., Гутьеррес Э.Г. 1993 Интерлейкин-1α в крови имеет прямой доступ к кортикальным клеткам головного мозга. Neurosci Lett 163 : 41–44.
Артикул
CAS
Google Scholar
Banks WA, Ortiz L, Plotkin SR, Kastin AJ 1991 Человеческий интерлейкин (IL) 1α, мышиный IL-1α и мышиный IL-1β переносятся из крови в мозг мышей с помощью общего механизма насыщения. J Pharmacol Exp Ther 259 : 988–996.
CAS
PubMed
Google Scholar
Бэнкс В.А., Кастин А.Дж., Гутьеррес Э.Г. 1994 Проникновение интерлейкина-6 через гематоэнцефалический барьер мыши. Neurosci Lett 179 : 53–56.
Артикул
CAS
Google Scholar
Gutierrez EG, Banks WA, Kastin AJ 1993 Фактор-α некроза опухоли мышей переносится из крови в мозг у мышей. J Нейроиммунол 47 : 169–176.
Артикул
CAS
Google Scholar
Miller LC, Isa S, LoPreste G, Schaller JG, Dinarello CA 1990 Неонатальный интерлейкин-1β, интерлейкин-6 и фактор некроза опухоли: уровни пуповинной крови и производство клеток. J Pediatr 117 : 961–965.
Артикул
CAS
Google Scholar
McCracken GH, Mustafa MM, Ramilo O, Olsen KO, Risser RC 1989 Концентрации интерлейкина 1-β в спинномозговой жидкости и фактора некроза опухоли и исход неонатального грамотрицательного кишечного бактериального менингита. Pediatr Infect Dis J 8 : 155–159.
PubMed
PubMed Central
Google Scholar
Мацузоно Ю., Нарита М., Акуцу Ю., Тогаши Т. 1995 Интерлейкин-6 в спинномозговой жидкости пациентов с инфекциями центральной нервной системы. Acta Paediatr 84 : 879–883.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Тарлоу М.Дж., Дженкинс Р., Комис С.Д., Осборн М.П., Стивенс С., Стэнли П., Крокер Дж. 1993 Эпендимные клетки сосудистого сплетения экспрессируют фактор некроза опухоли-α. Neuropathol Appl Neurobiol 19 : 324–328.
Артикул
CAS
Google Scholar
Merrill JE 1992 Фактор некроза опухоли-α, интерлейкин 1 и родственные цитокины в развитии мозга: нормальные и патологические. Dev Neurosci 14 : 1–10.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Ван Дам А.М., Бауэр Дж., Тилдерс Ф.Дж., Беркенбош Ф. 1995 Эндотоксин-индуцированное появление иммунореактивного интерлейкина-1β в разветвленной микроглии в головном мозге крысы: световое и электронно-микроскопическое исследование. Неврология 65 : 815–826.
Артикул
CAS
Google Scholar
Bartanusz V, Jezova D 1992 Роль некоторых околожелудочковых органов в действии и секреции гормонов. Endocr Regul 26 : 3–9.
CAS
PubMed
Google Scholar
Рисау В. 1994 Молекулярная биология онтогенеза и функции гематоэнцефалического барьера. Acta Neurochir Suppl 60 : 109–112.
CAS
PubMed
Google Scholar
Møllgård K, Saunders NR 1986 Развитие барьеров кровь-мозг и кровь-спинномозговая жидкость человека. Neuropathol Appl Neurobiol 12 : 337–358.
Артикул
Google Scholar
Møllgård K, Balslev Y, Lauritzen B, Saunders NR 1987 Клеточные соединения и специализация мембран в желудочковой зоне (зародышевый матрикс) развивающегося мозга овцы: CSF-мозговой барьер. Дж. Нейроцитол 16 : 433–444.
Артикул
Google Scholar
Quagliarello VJ, Wispelwey B, Long WJ Jr, Scheld WM 1991 Рекомбинантный человеческий интерлейкин-1 вызывает менингит и повреждение гематоэнцефалического барьера у крыс.Характеристика и сравнение с фактором некроза опухоли. J Clin Invest 87 : 1360–1366.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Wright JL, Merchant RE 1994 Изменения гематоэнцефалического барьера после внутримозгового введения крысам рекомбинантного фактора некроза опухоли-α человека. J Neurooncol 20 : 17–25.
Артикул
CAS
Google Scholar
Saija A, Princi P, Lanza M, Scalese M, Aramnejad E, DeSarro A 1995 Системное введение цитокинов может повлиять на проницаемость гематоэнцефалического барьера у крыс. Life Sci 56 : 775–784.
Артикул
CAS
Google Scholar
Бретт Ф.М., Мизисин А.П., Пауэлл Х.С., Кэмпбелл Иллинойс, 1995 г. Развитие невропатологических нарушений, связанных с разрушением гематоэнцефалического барьера у трансгенных мышей, экспрессирующих интерлейкин-6 в астроцитах. J Neuropathol Exp Neurol 54 : 766–775.
Артикул
CAS
Google Scholar
Sharief MK, Ciardi M, Thompson EJ 1992 Гематоэнцефалический барьер у пациентов с бактериальным менингитом: связь с фактором некроза опухоли-α, но не с интерлейкином-1β. J Infect Dis 166 : 350–358.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Ment LR, Oh W, Ehrenkranz RA, Philip AGS, Vohr B, Allan W., Duncan CC, Scott DT, Taylor KJW, Katz KH, Schneider KC, Makuch RW 1994 Низкие дозы индометацина и предотвращение внутрижелудочкового кровотечения : многоцентровое рандомизированное исследование. Педиатрия 93 : 543–550.
CAS
PubMed
PubMed Central
Google Scholar
Ment LR, Stewart WB, Ardito TA, Huang E, Madri JA 1992 Индометацин способствует созреванию микрососудов зародышевого матрикса у новорожденного щенка гончей. Инсульт 23 : 1132–1137.
Артикул
CAS
Google Scholar
Цукерман С.Л., Мирро Р., Армстед В.М., Шибата М., Леффлер К.В. 1992 Индометацин снижает вызванное ишемией нарушение транспорта гематоэнцефалического барьера у поросят. Am J Physiol 266 : h3198 – h3203.
Google Scholar
DeVries HE, Blom-Roosemalen MC, Van Oosten M, De Boer AG, Van Berkel TJ, Breimer DD, Kuiper J 1996 Влияние цитокинов на целостность гематоэнцефалического барьера in vitro . J Neuroimmunol 64 : 37–43.
Артикул
CAS
Google Scholar
Hurwitz AA, Lyman WD, Guida MP, Calderon TM, Berman JW 1992 Фактор некроза опухоли-α индуцирует экспрессию молекул адгезии на эмбриональных человеческих астроцитах. J Exp Med 176 : 1631–1636.
Артикул
CAS
Google Scholar
Merrill JE, Benveniste EN 1996 Цитокины при воспалительных поражениях головного мозга: полезные и вредные. Trends Neurosci 19 : 331–338.
Артикул
CAS
Google Scholar
Ransohoff RM, Hamilton TA, Tani M, Stoler MH, Shick HE, Major JA, Estes ML, Thomas DM, Tuohy VK 1993 Экспрессия астроцитами мРНК, кодирующей цитокины IP-10 и JE / MCP-1 в экспериментальных аутоиммунных заболеваниях энцефаломиелит. FASEB J 7 : 592–600.
Артикул
CAS
Google Scholar
Ohmori Y, Wyner L, Narumi S, Armstrong D, Stoler M, Hamilton TA 1993 Фактор некроза опухоли-α индуцирует клеточный тип и тканеспецифичную экспрессию хемоаттрактантных цитокинов in vivo . Am J Pathol 142 : 861–870.
CAS
PubMed
PubMed Central
Google Scholar
Strieter RM, Kunkel SL, Arenberg DA, Burdick MD, Polverini PJ 1995 Интерферон-γ-индуцируемый белок 10 (IP-10), член семейства хемокинов C-X-C, является ингибитором ангиогенеза. Biochem Biophys Res Commun 210 : 51–57.
Артикул
CAS
Google Scholar
Angiolillo AL, Sgadari C, Taub DD, Liao F, Farber JM, Maheshwari S, Kleinman HK, Reaman GH, Tosato G. 1995 Человеческий интерферон-индуцируемый белок 10 является мощным ингибитором ангиогенеза in vivo . J Exp Med 182 : 155–162.
Артикул
CAS
Google Scholar
Slungaard A, Vercellotti GM, Walker G, Nelson RD, Jacob HS 1990 Фактор некроза опухоли α / кахектин стимулирует выработку эозинофилов оксидантами и токсичность по отношению к эндотелию человека. J Exp Med 171 : 2025–2041.
Артикул
CAS
Google Scholar
Westlin WF, Gimbrone MA Jr 1993 Опосредованное нейтрофилами повреждение эндотелия сосудов человека.Роль активации цитокинов. Am J Pathol 142 : 117–128.
CAS
PubMed
PubMed Central
Google Scholar
Carswell EA, Old LJ, Kassel FL, Green S, Fiore N, Williamson B 1975 Индуцированный эндотоксином сывороточный фактор, который вызывает некроз опухолей. Proc Natl Acad Sci USA 72 : 3666–3671.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Grau GE, Lou J 1993 TNF в сосудистой патологии: важность взаимодействий тромбоцитов. Res Immunol 144 : 355–363.
Артикул
CAS
Google Scholar
Esmon CT 1994 Возможное участие цитокинов в диффузном внутрисосудистом свертывании и тромбозе. Baillieres Clin Haematol 7 : 453–468.
Артикул
CAS
Google Scholar
Bevilacqua MP, Pober JS, Majeau GR, Fiers W., Cotran RS, Gimbrone MA Jr 1986 Рекомбинантный фактор некроза опухоли индуцирует прокоагулянтную активность в культивируемом эндотелии сосудов человека: характеристика и сравнение с действиями интерлейкина 1. Proc Natl Acad Sci USA 83 : 4533–4537.
Артикул
CAS
Google Scholar
Каваками М., Ишибаши С., Огава Х, Мурас Т, Такаху Ф, Шибата С. 1986 Кахектин / ФНО, а также интерлейкин-1 индуцируют синтез простациклина в культивируемых эндотелиальных клетках сосудов. Biochem Biophys Res Commun 141 : 482–487.
Артикул
CAS
Google Scholar
Schleef RR, Bevilacqua MP, Sawdey M, Gimbrone MA Jr 1988 Цитокиновая активация эндотелия сосудов.Воздействие на активатор плазминогена тканевого типа и ингибитор активатора плазминогена 1 типа. J Biol Chem 263 : 5797–5809.
CAS
PubMed
Google Scholar
Dosne AM, Dubor F, Lutcher F, Parant M, Chedid L 1988 Фактор некроза опухоли (TNF) стимулирует выработку ингибитора активатора плазминогена (PAI) эндотелиальными клетками и снижает фибринолитическую активность крови у крыс. Thromb Res 51 : 115–122.
Артикул
Google Scholar
Van Hinsbergh VWM, Kooistra T, Vanderberg EA, Princer HMG, Fiers W, Emeis JJ 1988 Фактор некроза опухоли увеличивает выработку ингибитора активатора плазминогена в эндотелиальных клетках человека in vitro, и у крыс, in vivo, . Кровь 72 : 1467–1473.
Артикул
CAS
Google Scholar
Wada H, Tanigawa M, Wakita Y, Nakase T, Minamikawa K, Kaneko T, Ohiwa M, Kageyama S, Kobayashi T, Noguchi T, Deguchi K, Shirakawa S 1993 Повышенный уровень интерлейкина-6 в плазме при распространении внутрисосудистая коагуляция. Фибринолиз свертывания крови 4 : 583–590.
Артикул
CAS
Google Scholar
Oleksowicz L, Mrowiec Z, Zuckerman D, Isaacs R, Dutcher J, Puszkin E 1994 Активация тромбоцитов, индуцированная интерлейкином-6: доказательства механизма, включающего метаболизм арахидоновой кислоты. Thromb Haemost 72 : 302–308.
Артикул
CAS
Google Scholar
Camussi G, Bussolino F, Salvidio G, Baglioni C 1987 Фактор некроза опухоли / кахектин стимулирует перитонеальные макрофаги, полиморфно-ядерные нейтрофилы и эндотелиальные клетки сосудов для синтеза и высвобождения фактора активации тромбоцитов. J Exp Med 166 : 1390–1404.
Артикул
CAS
Google Scholar
Armstead WM, Pourcyrous M, Mirro R, Leffler CW, Busija DW 1988 Фактор активации тромбоцитов: сильное сужение церебральной артериолы у новорожденных свиней. Circ Res 62 : 1–7.
Артикул
CAS
Google Scholar
Кикучи Т., Окуда Й., Кайто Н., Абе Т. 1995 Производство цитокинов в спинномозговой жидкости после субарахноидального кровоизлияния. Neurol Res 17 : 106–108.
Артикул
CAS
Google Scholar
Rinkel GJE, VanGijn J, Wijdicks EFM 1993 Субарахноидальное кровоизлияние без обнаруживаемой аневризмы. Обзор причин. Инсульт 24 : 1403–1409.
Артикул
CAS
Google Scholar
DelBigio MR, Bruni JE 1988 Изменения перивентрикулярной сосудистой сети головного мозга кроликов после индукции гидроцефалии и после шунтирования. J Neurosurg 69 : 115–120.
Артикул
CAS
Google Scholar
Sarnat HB 1992 Роль эпендимы плода человека. Pediatr Neurol 8 : 163–178.
Артикул
CAS
Google Scholar
Sarnat HB 1995 Эпендимальные реакции на травму. Обзор. J Neuropathol Exp Neurol 54 : 1–15.
Артикул
CAS
Google Scholar
Веллер Р.О., Митчелл Дж. 1980 Отек спинномозговой жидкости и его последствия при гидроцефалии. Adv Neurol 28 : 111–123.
CAS
PubMed
Google Scholar
Панет Н., Руделли Р., Казам Э., Монте В. 1994 Повреждение мозга у недоношенных детей . MacKeith Press, Лондон, 119–137.
Google Scholar
Rypens F, Avni EF, Dussaussois L, David P, Vermeylen D, Van Bogaert P, Matos C 1994 Гиперэхогенная утолщенная эпендима: сонографическая демонстрация и значение у новорожденных. Pediatr Radiol 24 : 550–553.
Артикул
CAS
Google Scholar
Kasper M, Goertchen R, Stosiek P, Perry G, Karsten U 1986 Сосуществование цитокератина, виментина и белка нейрофиламентов в сосудистом сплетении человека.Иммуногистохимическое исследование промежуточных филаментов в нейроэпителиальных тканях. Арка Вирхова Патол Анат Гистопатол 410 : 173–177.
Артикул
CAS
Google Scholar
Blennow M, Rosengren L, Jonsson S, Forssberg H, Katz-Salamon M, Hagberg H, Hesser U, Lagercrantz H 1996 Глиальный фибриллярный кислый белок повышен в спинномозговой жидкости недоношенных детей с аномальными неврологическими данными. Acta Paediatr 85 : 485–489.
Артикул
CAS
Google Scholar
Фукумизу М., Такашима С., Беккер Л. Е. 1995 Неонатальная постгеморрагическая гидроцефалия: невропатологические и иммуногистохимические исследования. Pediatr Neurol 13 : 230–234.
Артикул
CAS
Google Scholar
Иида К., Такашима С., Такеучи Й, Оно Т., Уэда К. 1993 Невропатологическое исследование новорожденных с пренатальной лейкомаляцией. Pediatr Neurol 9 : 45–48.
Артикул
CAS
Google Scholar
Gilles FH, Leviton A, Kerr CS 1976 Эндотоксиновая лейкоэнцефалопатия в конечном мозге новорожденного котенка. J Neurol Sci 27 : 183–191.
Артикул
CAS
Google Scholar
Balasingam V, Tejada-Berges T, Wright E, Bouckova R, Yong VW 1994 Реактивный астроглиоз в головном мозге новорожденных мышей и его модуляция цитокинами. J Neurosci 14 : 846–856.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Дегучи К., Мидзогучи М., Такашима С. 1996 Иммуногистохимическая экспрессия фактора некроза опухоли α при лейкомаляции новорожденных. Pediatr Neurol 14 : 13–16.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Chao CC, Hu S, Sheng WS, Peterson PK 1995 Производство фактора некроза опухоли-α фетальными микроглиальными клетками человека: регуляция другими цитокинами. Dev Neurosci 17 : 97–105.
Артикул
CAS
Google Scholar
Ли С.К., Диксон Д.В., Лю В., Броснан С.Ф. 1993 Индукция активности синтазы оксида азота в человеческих астроцитах интерлейкином-1β и интерфероном-γ. J Нейроиммунол 46 : 19–24.
Артикул
CAS
Google Scholar
Chao CC, Hu S, Ehrlich L, Peterson PK 1995 Интерлейкин-1 и фактор некроза опухоли альфа синергетически опосредуют нейротоксичность: участие оксида азота и N- рецепторов метил-D-аспартата. Иммунное поведение мозга 9 : 355–365.
Артикул
CAS
Google Scholar
Okusawa S, Gelfand JA, Ikejima T., Connolly RJ, Dinarello CA 1988 Интерлейкин 1 вызывает состояние, подобное шоку у кроликов. Синергизм с фактором некроза опухоли и эффект ингибирования циклооксигеназы. Дж. Клин Инвест 81 : 1162–1172.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Peterson PK, Hu S, Anderson WR, Chao CC 1994 Производство оксида азота и нейротоксичность, опосредованные активированной микроглией из мозга человека по сравнению с мозгом мыши . J Infect Dis 170 : 457–460.
Артикул
CAS
Google Scholar
Hattori H, Wasterlain CG 1990 Возбуждающие аминокислоты в развивающемся мозге: онтогенез, пластичность и эксайтотоксичность. Pediatr Neurol 6 : 219–228.
Артикул
CAS
PubMed
PubMed Central
Google Scholar
Макдональд Дж. В., Джонстон М. В. 1990 Физиологические и патофизиологические роли возбуждающих аминокислот во время развития центральной нервной системы. Brain Res Brain Res Ред. 15 : 41–70.
Артикул
Google Scholar
Hagberg H, Gilland E, Bona E, Hanson LÅ, Hahn-Zoric M, Blennow M, Holst M, McRae A, Söder O 1996 Повышенная экспрессия интерлейкина (IL) -1 и РНК-мессенджера IL-6 и биоактивный белок после гипоксии-ишемии у новорожденных крыс. Pediatr Res 40 : 603–609.
Артикул
CAS
Google Scholar
Romero R, Tartakovsky B 1992 Природный антагонист рецептора интерлейкина-1 предотвращает индуцированную интерлейкином-1 преждевременную доставку у мышей. Am J Obstet Gynecol 167 : 1041–1045.
Артикул
CAS
Google Scholar
Shi Y, Li HQ, Chen CK, Wang JH, Pan J, Qin SW, Liu R 1993 Связь между защитной эффективностью антител к фактору некроза опухоли и подавлением продукции оксида азота у новорожденных крыс со смертельной инфекцией. Pediatr Res 34 : 345–348.
Артикул
CAS
Google Scholar
Mattsby-Baltzer I, Roseanu A, Motas C, Elverfors J, Engberg I, Hanson LÅ 1996 Лактоферрин или его фрагмент ингибирует индуцированный эндотоксином ответ интерлейкина-6 в моноцитарных клетках человека. Pediatr Res 40 : 257–262.
Артикул
CAS
Google Scholar
Внутриутробная инфекция / воспаление во время беременности и повреждения головного мозга у потомства: возможные механизмы | Репродуктивная биология и эндокринология
Volpe JJ: Перинатальное повреждение головного мозга: от патогенеза к нейропротекции. Ment Retard Devel Disab Res Rev.2001, 7: 56-64. 10.1002 / 1098-2779 (200102) 7: 1 <56 :: AID-MRDD1008> 3.0.CO; 2-А.
CAS
Статья
Google Scholar
Бергер Р., Гарнье Й., Дженсен А: Перинатальное повреждение головного мозга: основные механизмы и нейрозащитные стратегии. J Soc Gynecol Investig. 2002, 9: 319-328. 10.1016 / S1071-5576 (02) 00164-8.
CAS
Статья
PubMed
Google Scholar
Wu YW, Colford JM: Хориоамнионит как фактор риска церебрального паралича: метаанализ.ДЖАМА. 2000, 284: 1417-1424. 10.1001 / jama.284.11.1417.
CAS
Статья
PubMed
Google Scholar
Pang Y, Cai Z, Rhodes PG: Действие липополисахарида на клетки-предшественники олигодендроцитов опосредуется астроцитами и микроглией. J Neurosci Res. 2000, 62: 510-520. 10.1002 / 1097-4547 (20001115) 62: 4 <510 :: AID-JNR5> 3.3.CO; 2-6.
CAS
Статья
PubMed
Google Scholar
Гарнье Y, Coumans ABC, Jensen A, Hassart THM, Berger R: Перинатальное повреждение головного мозга, связанное с инфекцией: патогенная роль нарушения контроля сердечно-сосудистой системы плода. J Soc Gynecol Investing. 2003, 10: 450-459. 10.1016 / S1071-5576 (03) 00150-3.
CAS
Статья
Google Scholar
Шендель Д., Шухат А., Торсен П. Вопросы общественного здравоохранения, связанные с инфекциями, беременностью и церебральным параличом. Ment Retard Dev Disabil Res Rev.2002, 8: 39-45. 10.1002 / mrdd.10011.
Артикул
PubMed
Google Scholar
Ньякас К., Бувальда Б., Луитен PGM: Гипоксия и развитие мозга. Prog Neurobiol. 1996, 49: 1-51.
CAS
Статья
PubMed
Google Scholar
Рикманн М., Вольф JR: Пренатальный олигенез в неопаллии крысы. Adv Anat Embryol Cell Biol. 1985, 93: 1-10.
CAS
Статья
PubMed
Google Scholar
Санчо-Телло М., Валлес С., Монтолиу С., Ренау-Пикерас Дж., Герри С. Паттерн развития экспрессии генов GFAP и виментина в мозге крыс и культурах радиальной глии. Глия. 1995, 15: 157-166.
CAS
Статья
PubMed
Google Scholar
Чамак Б., Доббертин А., Маллат М.: Иммуногистохимическое определение тромбоспондина в микроглии в развивающемся мозге крысы. Неврология. 1995, 69: 177-187. 10.1016 / 0306-4522 (95) 00236-С.
CAS
Статья
PubMed
Google Scholar
Мерфи Д.Дж., Селлерс С., Маккензи И.З., Юдкин П.Л., Джонсон А.М.: Исследование факторов риска дородового и внутриродового риска церебрального паралича у очень недоношенных детей-одиночек. Ланцет. 1995, 346: 1449-1454. 10.1016 / S0140-6736 (95)
- -Х.
CAS
Статья
PubMed
Google Scholar
Zupan V, Gonzales P, Lacaze-Masmonteil T, Boithias C, d’Allest AM, Dehan M, Gabilan JC: Перивентрикулярная лейкомаляция: еще раз о факторах риска.Dev Med Child Neurol. 1996, 38: 1061-1067.
CAS
Статья
PubMed
Google Scholar
Verma U, Tejani N, Klein S, Reale MR, Beneck D, Figueroa R, Visintainer P: Акушерские предшественники внутрижелудочкового кровоизлияния и перивентрикулярной лейкомаляции у новорожденных с низкой массой тела при рождении. Am J Obstet Gynecol. 1997, 176: 275-281.
CAS
Статья
PubMed
Google Scholar
Berger R, Bender S, Sefkow S, Klingmüller V, Künzel W, Jensen A: Пери / внутрижелудочковое кровотечение: краниальное ультразвуковое исследование 5286 новорожденных. Eur J Obstet Gynecol Reprod Biol. 1997, 75: 191-203. 10.1016 / S0301-2115 (97) 00135-8.
CAS
Статья
PubMed
Google Scholar
Дамманн О., Левитон А. Материнская внутриутробная инфекция, цитокины и повреждение головного мозга у недоношенных новорожденных. Pediatr Res. 1997, 42: 1-8.
CAS
Статья
PubMed
Google Scholar
Юн Б.Х., Ромеро Р., Пак Дж. С., Ким С.Дж., Ким С.Х., Чой Дж. Х., Хан Т.Р.: Воздействие внутриамниотического воспаления плода и развитие церебрального паралича в возрасте трех лет. Am J Obstet Gynecol. 2000, 182: 675-681.
CAS
Статья
PubMed
Google Scholar
Жиль Ф.Х., Левитон А., Керр С.С.: Эндотоксиновая лейкоэнцефалопатия в конечном мозге новорожденного котенка.J Neurol Sci. 1976, 27: 183-191. 10.1016 / 0022-510X (76)
-5.
CAS
Статья
PubMed
Google Scholar
Янг Р.С., Ягель С.К., Товфиги Дж .: Системные и невропатологические эффекты эндотоксина E. coli у новорожденных собак. Pediatr Res. 1983, 17: 349-353.
CAS
Статья
PubMed
Google Scholar
Debillon T, Gras-Leguen C, Verielle V, Winer N, Caillon J, Roze J-C, Gressens P: Межутробная инфекция вызывает запрограммированную гибель клеток в перивентрикулярном белом веществе кролика.Pediatr Res. 2000, 47: 736-742.
CAS
Статья
PubMed
Google Scholar
Юн Б.Х., Ким С.Дж., Ромеро Р., Джун Дж.К., Пак К.Х., Чой С.Т., Чи Дж.Г .: Экспериментально индуцированная внутриутробная инфекция вызывает поражения белого вещества мозга плода у кроликов. Am J Obstet Gynecol. 1997, 177: 797-802.
CAS
Статья
PubMed
Google Scholar
Bunge RP: Глиальные клетки и центральная миелиновая оболочка.Physiol Rev.1968, 48: 197-251.
CAS
PubMed
Google Scholar
Jacobson L, Ek U, Fernell E, Flodmark O, Broberger U: Нарушение зрения у недоношенных детей с перивентрикулярной лейкомаляцией — визуальные, когнитивные и нейропедиатрические характеристики, связанные с церебральной визуализацией. Dev Med Child Neurol. 1996, 38: 724-735.
CAS
Статья
PubMed
Google Scholar
Бервальд К.Д., Попко Б. Развивающиеся и зрелые олигодендроциты по-разному реагируют на иммунный цитокин интерферон-γ. J Neurosci Res. 1998, 52: 230-239. 10.1002 / (SICI) 1097-4547 (19980415) 52: 2 <230 :: AID-JNR11> 3.3.CO; 2-P.
CAS
Статья
PubMed
Google Scholar
Хельфаер М.А., Кирш Дж. Р., Трайстман Р. Дж.: Поглотители радикалов: проникновение в мозг после ишемии и реперфузии. В кн .: Фармакология церебральной ишемии.Под редакцией: Krieglstein J, Oberpichler-Schwenk H. 1994, Medpharm Scientific, Штутгарт, 297-309.
Google Scholar
Палмер К., Товфиги Дж., Робертс Р.Л., Хейтджан Д.Ф.: Аллопуринол, вводимый после индукции гипоксии / ишемии, снижает повреждение мозга у 7-дневных крыс. Pediatr Res. 1993, 33: 405-411.
CAS
PubMed
Google Scholar
Сайто К., Пакианатан С., Лонго Л.Д. Повышение активности орнитиндекарбоксилазы, вызванное свободными радикалами, в развивающихся срезах головного мозга крысы.Brain Res. 1997, 763: 232-238. 10.1016 / S0006-8993 (97) 00414-9.
CAS
Статья
PubMed
Google Scholar
Banker BQ, Larroche JC: Перивентрикулярная лейкомаляция младенчества. Форма неонатальной аноксической энцефалопатии. Arch Neurol. 1962, 7: 386-610.
CAS
Статья
PubMed
Google Scholar
Максвелл WL, Follows R, Ashhurst DE, Berry M: Реакция полушария головного мозга крысы на травму: I.Зрелая крыса. Philos Trans R Soc Lond Biol Sci. 1990, 328: 479-500.
CAS
Статья
Google Scholar
Balasingam V, Tejada-Berges T, Wright E, Bouchova R, Yong VW: Реактивный астроглиоз в головном мозге новорожденных мышей и его модуляция цитокинами. J Neurosci. 1994, 14: 846-856.
CAS
PubMed
Google Scholar
Дегучи К., Огучи К., Такашима С.: Характерная невропатология лейкомаляции у младенцев с крайне низкой массой тела при рождении.Pediatr Neurol. 1997, 16: 296-300. 10.1016 / S0887-8994 (97) 00041-6.
CAS
Статья
PubMed
Google Scholar
Feldhaus B, Dietzel ID, Berger R: TNF-a индуцирует гибель клеток в первичных культурах предшественников олигодендроцитов. J Soc Gynecol Investig. 2001, 8: 248A-
Google Scholar
Cai Z, Pan ZO, Pang Y, Evans OB, Rhodes PG: Индукция цитокинов в мозге плода крысы и повреждение головного мозга у новорожденных крыс после введения материнскому липопоисахариду.Pediatr Res. 2000, 47: 64-72.
CAS
Статья
PubMed
Google Scholar
Merrill JE: Фактор некроза опухоли альфа, интерлейкин 1 и родственные цитокины в развитии мозга: нормальные и патологические. Dev Neurosci. 1992, 14: 1-10.
CAS
Статья
PubMed
Google Scholar
Merrill JE: Эффекты IL-1 и TNF альфа на астроциты, микроглию, олигодендроциты и глиальные предшественники in vitro.Dev Neurosci. 1991, 13: 130-137.
CAS
Статья
PubMed
Google Scholar
Джулиан Д., Янг Д.Г., Вудворд Дж., Браун Д.К., Лахман Л.Б. Интерлейкин-1 является фактором роста астроглии в развивающейся нервной системе. J Neurosci. 1988, 8: 709-714.
CAS
PubMed
Google Scholar
Юн Б.Х., Ромеро Р., Ким С.Дж., Ку Дж.Н., Чхве Г., Син ХК, Чи Дж. Г.: Высокая экспрессия фактора некроза опухоли-а и интерлейкина-6 при перивентрикулярной лейкомаляции.Am J Obstet Gynocol. 1997, 177: 406-411.
CAS
Статья
Google Scholar
Юн Б.Х., Джун Дж.К., Ромеро Р., Парк К.Х., Гомес Р., Чой Дж. Х., Ким И.О .: Воспалительные цитокины околоплодных вод (интерлейкин-6, интерлейкин-1β и фактор некроза опухоли-а), мозг новорожденного поражения белого вещества и церебральный паралич. Am J Obstet Gynecol. 1997, 177: 19-26.
CAS
Статья
PubMed
Google Scholar
Megyeri P, Abraham CS, Temesvari P, Kovacs J, Vas T, Speer CP: Рекомбинантный фактор некроза опухоли человека альфа сужает пиальные артериолы и увеличивает проницаемость гематоэнцефалического барьера у новорожденных поросят. Neurosci Lett. 1992, 148: 137-140. 10.1016 / 0304-3940 (92)
-П.
CAS
Статья
PubMed
Google Scholar
Уно Х, Мацуяма Т., Акита Х, Нишимура Х, Сугита М: Индукция фактора некроза опухоли альфа в гиппокампе мыши после временной ишемии переднего мозга.J Cereb Blood Flow Metab. 1997, 17: 491-499. 10.1097 / 00004647-199705000-00002.
CAS
Статья
PubMed
Google Scholar
Tureen J: Влияние рекомбинантного фактора некроза опухоли альфа человека на церебральное потребление кислорода, лактат спинномозговой жидкости и церебральный кровоток у кроликов: роль оксида азота. J Clin Invest. 1995, 95: 1086-1091.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Duchini A, Govindarajan S, Santucci M, Zampi G, Hofman FM: Влияние фактора некроза опухоли альфа и интерлейкина-6 на проницаемость жидкой фазы и диффузию аммиака в эндотелиальных клетках, происходящих из ЦНС. J Investig Med. 1996, 44: 474-482.
CAS
PubMed
Google Scholar
Ботчкина Г.И., Геймонен Э., Биллоф М.Л., Вильярреал О., Трейси К.Дж.: Потеря активности NF-kappaB во время церебральной ишемии и цитотоксичность TNF. Mol Med.1999, 5: 372-381.
PubMed Central
CAS
PubMed
Google Scholar
Белл MJ, Hallenbeck JM: Влияние внутриутробного воспаления на развивающийся мозг крысы. J Neurosci Res. 2002, 70: 570-579. 10.1002 / jnr.10423.
CAS
Статья
PubMed
Google Scholar
Cammer W. Эффекты TNF-α на незрелые и зрелые олигодендроциты и их предшественники in vitro.Brain Res. 2000, 864: 213-219. 10.1016 / S0006-8993 (00) 02178-8.
CAS
Статья
PubMed
Google Scholar
Ladiwala U, Hewei L, Antel J, Nalbantoglu J: индукция p53 фактором некроза опухоли -a и участие p53 в гибели клеток олигодендроцитов человека. J Neurochem. 1999, 73: 605-611. 10.1046 / j.1471-4159.1999.0730605.x.
CAS
Статья
PubMed
Google Scholar
Berger R, Garnier Y, Pfeiffer D, Jensen A: Липополисахариды не изменяют метаболические нарушения в срезах гиппокампа плодных морских свинок после кислородно-глюкозной депривации. Pediatr Res. 2000, 48: 531-535.
CAS
Статья
PubMed
Google Scholar
Kaukola T, Satyaraj E, Patel DD, Tchernev VT, Grimwade BG, Kingsmore SF, Koskela P, Vainionpaa L, Pihko H, Aarimaa T, Hallman M: Церебральный паралич характеризуется белковыми посредниками в пуповинной сыворотке.Энн Нейрол. 2004, 55: 186-194. 10.1002 / ana.10809.
CAS
Статья
PubMed
Google Scholar
Oppenheim RW, Prevette D, Yin QW: Контроль выживаемости эмбриональных мотонейронов in vivo с помощью цилиарного нейротрофического фактора. Наука. 1991, 251: 1616-1618.
CAS
Статья
PubMed
Google Scholar
Knusel B, Rabin SJ, Hefti F: Регулируемая реакция рецептора нейротрофина во время миграции нейронов и ранней дифференцировки.J Neurosci. 1994, 14: 1542-1554.
CAS
PubMed
Google Scholar
Han BH, Holtzman DM: BDNF защищает мозг новорожденного от гипоксически-ишемического повреждения in vivo через путь ERK. J Neurosci. 2000, 20: 5775-5781.
CAS
PubMed
Google Scholar
Киршнер П.Б., Дженкинс Б.Г., Шульц Дж.Б.: NGF, BDNF и NT-5, но не NT-3, защищают новорожденных животных от токсичности MPP + и окислительного стресса.Brain Res. 1996, 713: 178-185. 10.1016 / 0006-8993 (95) 01513-2.
CAS
Статья
PubMed
Google Scholar
Уолтон М., Коннор Б., Лоулор П., Янг Д., Сириманн Е., Глюкман П., Коул Г., Драгунов М.: Смерть и выживаемость нейронов в двух моделях гипоксически-ишемического повреждения мозга. Brain Res Brain Res Rev.1999, 29: 137-168. 10.1016 / S0165-0173 (98) 00053-8.
CAS
Статья
PubMed
Google Scholar
Schwartz JP, Nishiyama N: Экспрессия гена нейротрофического фактора в астроцитах во время развития и после травмы. Brain Res Bull. 1994, 35: 403-407. 10.1016 / 0361-9230 (94)
-1.
CAS
Статья
PubMed
Google Scholar
Камигучи Х., Йошида К., Сагох М., Сасаки Х., Инаба М., Вакамото Х., Отани М., Тоя С. Высвобождение цилиарного нейротрофического фактора из культивированных астроцитов и его модуляция цитокинами. Neurochem Res.1995, 20: 1187-1193.
CAS
Статья
PubMed
Google Scholar
Кан М.А., де Веллис Дж .: Факторы роста в ЦНС и их влияние на олигодендроглии. Prog Brain Res. 1995, 105: 145-169.
CAS
Статья
PubMed
Google Scholar
Генрих М., Горат М., Ландсберг CR: Нейротрофин-3 (NT-3) модулирует раннюю дифференцировку олигодендроцитов в кортикальной культуре головного мозга крысы.Глия. 1999, 28: 244-255. 10.1002 / (SICI) 1098-1136 (199912) 28: 3 <244 :: AID-GLIA8> 3.3.CO; 2-N.
CAS
Статья
PubMed
Google Scholar
Патан С: Васкулогенез и ангиогенез как механизмы формирования, роста и ремоделирования сосудистой сети. J Neurooncol. 2000, 50: 1-15. 10.1023 / А: 10064
855.
CAS
Статья
PubMed
Google Scholar
Miquerol L, Langille BL, Nagy A: Эмбриональное развитие нарушается умеренным увеличением экспрессии гена фактора роста эндотелия сосудов. Разработка. 2000, 127: 3941-3946.
CAS
PubMed
Google Scholar
Янкопулос Г.Д., Дэвис С., Гейл Н.В., Радж Дж. С., Виганд С.Дж., Холаш Дж. Сосудистые факторы роста и формирование кровеносных сосудов. Природа. 2000, 407: 242-248. 10.1038 / 35025215.
CAS
Статья
PubMed
Google Scholar
Taylor CM, Stevens H, Anthony FW, Wheeler T: Влияние гипоксии на клеточные линии, производные от фактора роста эндотелия сосудов: JEG, Jar и BeWo. Плацента. 1997, 18: 451-458.
CAS
Статья
PubMed
Google Scholar
Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Yazaki Y, Goto K, Masaki T: новый мощный сосудосуживающий пептид, продуцируемый эндотелиальными клетками сосудов. Природа. 1988, 332: 411-415.10.1038 / 332411a0.
CAS
Статья
PubMed
Google Scholar
Hirata Y, Takagi Y, Fukuda Y, Marumo F: Эндотелин является мощным митогеном для гладкомышечных клеток сосудов крыс. Атеросклероз. 1989, 78: 225-228.
CAS
Статья
PubMed
Google Scholar
Шичири М., Марумо Ф, Хирата Y: Подавление эндотелиального апоптоза, опосредованное рецептором эндотелина-B.J Cardiovasc Pharmacol. 1998, 31: S138-S141. 10.1097 / 00005344-199800001-00041.
CAS
Статья
PubMed
Google Scholar
Lee ME, de la Monte SM, Ng SC, Bloch KD, Quertermous T: Экспрессия сильнодействующего вазоконстриктора эндотелина в центральной нервной системе человека. J Clin Invest. 1990, 86: 141-147.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Накамура С., Нарус М., Нарус К., Шиода С., Накай Ю., Уэмура Х: Совместная локализация иммунореактивного эндотелина-1 и нейрогипофизических гормонов в аксонах нервной доли гипофиза крысы. Эндокринология. 1993, 132: 530-533. 10.1210 / en.132.2.530.
CAS
PubMed
Google Scholar
Kuwaki T, Kurihara H, Cao WH, Kurihara Y, Unekawa M, Yazaki Y, Kumada M: физиологическая роль эндотелина мозга в центральном вегетативном контроле: от нейрона до нокаутированной мыши.Prog Neurobiol. 1997, 51: 545-579. 10.1016 / S0301-0082 (96) 00063-9.
CAS
Статья
PubMed
Google Scholar
Ямасита К., Катаока Ю., Ямасита Ю.С., Химено А., Цуцуми К., Нива М., Танияма К.: Система глиального эндотелина / оксида азота участвует в гибели нейронов SHRSP в гиппокампе CA1 после временной ишемии переднего мозга. Clin Exp Pharmacol Physiol. 1995, 22: S277-S278.
CAS
Статья
Google Scholar
Zhang WW, Badonic T, Hoog A, Jiang MH, Ma KC, Nie XJ, Olsson Y: Астроциты при болезни Альцгеймера проявляют иммунореактивность к вазоконстриктору эндотелину-1. J Neurol Sci. 1994, 122: 90-96. 10.1016 / 0022-510X (94)
CAS
Статья
PubMed
Google Scholar
Josko J: Церебральный ангиогенез и экспрессия VEGF после субарахноидального кровоизлияния (SAH) у крыс. Brain Res. 2003, 981: 58-69. 10.1016 / S0006-8993 (03) 02920-2.
CAS
Статья
PubMed
Google Scholar
Dirnagl D, Iadecola C, Moskowitz MA: Патобиология ишемического инсульта: комплексный взгляд. Trends Neurosci. 1999, 22: 391-397. 10.1016 / S0166-2236 (99) 01401-0.
CAS
Статья
PubMed
Google Scholar
Векслер З.С., Ферриеро Д.М.: Молекулярные и биохимические механизмы перинатального повреждения головного мозга.Semin Neonatol. 2001, 6: 99-108. 10.1053 / siny.2001.0041.
CAS
Статья
PubMed
Google Scholar
Marks N, Berg MJ: Последние достижения в области развития нейрональных каспаз и нейродегенерации. Neurochem Int. 1999, 35: 195-220. 10.1016 / S0197-0186 (99) 00061-3.
CAS
Статья
PubMed
Google Scholar
Han BH, D’Costa A, Back SA, Parsadanian M, Shah AR, Gidday JM, Srinivasan A, Deshmukh M, Holtzman DM: BDNF блокирует активацию каспазы-3 при неонатальной гипоксии-ишемии.Neurobiol Dis. 2000, 7: 38-53. 10.1006 / nbdi.1999.0275.
CAS
Статья
PubMed
Google Scholar
Felderhoff-Mueser U, Taylor DL, Greenwood K, Kozma M, Stibenz D, Joashi UC, Edwards AD, Mehmet H: Fas / CD95 / APO-1 может действовать как рецептор смерти для нейрональных клеток in vitro и in vivo и активируется после церебрального гипоксически-ишемического повреждения развивающегося мозга крысы. Brain Pathol. 2000, 10: 17-29.
CAS
Статья
PubMed
Google Scholar
Lipton JM, Катания A: Противовоспалительное действие нейроиммуномодулятора альфа-МСГ. Иммунол сегодня. 1997, 18: 140-145. 10.1016 / S0167-5699 (97) 01009-8.
CAS
Статья
PubMed
Google Scholar
Октар Б.К., Эркан Ф., Йеген Британская Колумбия, Аликан I. Влияние гормона, стимулирующего альфа-меланоциты, на воспаление толстой кишки у крыс. Пептиды. 2000, 21: 1271-1277. 10.1016 / S0196-9781 (00) 00269-2.
CAS
Статья
PubMed
Google Scholar
Rajora N, Boccoli G, Catania A, Lipton JM: альфа-МСГ модулирует экспериментальное воспалительное заболевание кишечника. Пептиды. 1997, 18: 381-385. 10.1016 / S0196-9781 (96) 00345-2.
CAS
Статья
PubMed
Google Scholar
Taherzadeh S, Sharma S, Chhajlani V, Gantz I, Rajora N, Demitri MT, Kelly L, Zhao H, Ichiyama T, Catania A, Lipton JM: альфа-МСГ и его рецепторы в регуляции некроза опухолей производство фактора альфа моноцитами / макрофагами человека.Am J Physiol. 1999, 276: R1289-1294.
CAS
PubMed
Google Scholar
Редондо П., Гарсия-Фонсиллас Дж., Окружнов И., Бандрес Е: Альфа-МСГ регулирует экспрессию интерлейкина-10 кератиноцитами человека. Arch Dermatol Res. 1998, 290: 425-428. 10.1007 / s004030050330.
CAS
Статья
PubMed
Google Scholar
Magnoni S, Stocchetti N, Colombo G, Carlin A, Colombo A, Lopton JM, Catania A: уровень альфа-меланоцит-стимулирующего гормона снижается в плазме у пациентов с острым повреждением головного мозга.J Neurotrauma. 2003, 20: 251-260. 10.1089 / 089771503321532833.
Артикул
PubMed
Google Scholar
Lipton JM, Catania A, Delgado R: Пептидная модуляция воспалительных процессов Пептидная модуляция воспалительных процессов в головном мозге. Нейроиммуномодуляция. 1998, 5: 178-83. 10.1159 / 000026335.
CAS
Статья
PubMed
Google Scholar
Катания А., Липтон Дж. М.: Пептидная модуляция лихорадки и воспаления в головном мозге. Ann N Y Acad Sci. 1998, 856: 62-68.
CAS
Статья
PubMed
Google Scholar
Lipton JM, Катания A: Механизмы противовоспалительного действия нейроиммуномодулирующего пептида альфа-MSH. Ann N Y Acad Sci. 1998, 1: 373-380.
Артикул
Google Scholar
Wong KY, Rajora N, Boccoli G, Catania A, Lipton JM: Потенциальный механизм местного противовоспалительного действия альфа-меланоцит-стимулирующего гормона в головном мозге: модуляция производства фактора некроза опухоли-альфа астроцитарными клетками человека. Нейроиммуномодуляция. 1997, 4: 37-41.
CAS
PubMed
Google Scholar
Дамманн О., Кубанский КСК, Левитон А: Перинатальная инфекция, воспалительная реакция плода, повреждение белого вещества и когнитивные ограничения у недоношенных детей.Ment Retard Dev Disabil Res Rev. 2002, 8: 46-50. 10.1002 / мрдд.10005.
Артикул
PubMed
Google Scholar
Оберт А., Вега С., Данцер Р., Гудолл Г. Пирогены специально препятствуют усвоению задачи, связанной с когнитивной обработкой, у крысы. Иммунное поведение мозга. 1995, 9: 129-148. 10.1006 / brbi.1995.1013.
CAS
Статья
PubMed
Google Scholar
Уход за новорожденными: 12.Инфекция
Пройдите тест по главе до и после прочтения этой главы.
Викторина по открытию главы
Закрыть викторину
Первый раз? Бесплатная регистрация. Просто введите свой адрес электронной почты или номер мобильного и придумайте пароль.
Закрыть викторину
Содержание
Цели
Когда вы завершите это задание, вы сможете:
- Объясните, почему инфекция часто встречается у новорожденных.
- Предотвратить заражение.
- Перечислите распространенные второстепенные инфекции.
- Перечислите основные инфекции.
- Лечит как легкие, так и серьезные инфекции.
- Диагностируйте хориоамнионит при рождении.
- Диагностика и лечение врожденного сифилиса.
- Вести ребенка, рожденного от ВИЧ-инфицированной женщины.
Профилактика инфекций
12-1 Что такое инфекция?
Инфекция — это вторжение в организм таких организмов, как бактерии, вирусы, грибы, спирохеты и простейшие. Это может привести к заболеванию, вызвав воспаление, аномальный рост, повреждение или гибель тканей.Напротив, колонизация — это просто рост организмов на поверхности тела, такой как кожа, кишечник или дыхательные пути, без вторжения в ткани.
12-2 Как организм предотвращает заражение?
Иммунную систему, которая помогает защитить организм от инфекций, можно разделить на 4 части:
- Антитела (иммуноглобулины), такие как IgG, IgA и IgM, которые повреждают организмы и привлекают фагоцитарные клетки.
- Лимфоциты, вырабатывающие антитела и убивающие организмы.
- Фагоцитарные клетки, такие как макрофаги и полиморфы, которые поглощают и тем самым убивают организмы.
- Дополнение. Это группа белков, которые помогают антителам повреждать организмы и привлекать фагоцитарные клетки.
Эти различные части иммунной системы действуют вместе, чтобы уничтожить вторгшиеся организмы и, таким образом, защитить младенца от инфекции.
12-3 Часто ли инфекция встречается у новорожденных?
Да. Новорожденные младенцы часто инфицируются, поскольку риск заражения новорожденного намного выше, чем у детей старшего возраста или взрослых.Инфекция важна, поскольку это одна из самых распространенных причин смерти младенцев в течение первых нескольких месяцев жизни. Инфекция особенно распространена и опасна у недоношенных детей.
Инфекция — важная причина смерти младенцев.
12-4 Почему новорожденные младенцы часто заражаются?
Инфекция у новорожденных часто встречается из-за незрелости их иммунной системы. Следующие недостатки иммунной системы делают новорожденных младенцев восприимчивыми к инфекции:
- Антитела IgA и IgM слишком велики, чтобы проникнуть через плаценту от матери.Следовательно, у плода и новорожденного ребенка нет материнских IgA и IgM для защиты от инфекции. Однако в течение первых 6 месяцев жизни ребенок постепенно вырабатывает собственные IgA и IgM.
- Антитела IgG действительно проникают через плаценту, но чаще всего переносятся только на последних неделях беременности. Следовательно, у недоношенных детей очень мало IgG. После рождения ребенок начинает вырабатывать собственный IgG, так как количество материнского IgG уменьшается.
- У доношенных и недоношенных детей есть лимфоциты.Однако эти лимфоциты незрелые и поэтому плохо функционируют. Зрелый лимфоцит нуждается в предыдущем контакте с конкретным организмом, прежде чем он сможет распознать и убить его. Функция лимфоцитов улучшается по мере взросления младенца.
- У новорожденных, особенно недоношенных, концентрация комплемента в крови низкая.
- Фагоцитарные клетки присутствуют как у доношенных, так и у недоношенных детей, но они не функционируют нормально из-за низких концентраций комплемента.
При всех этих недостатках незрелой иммунной системы новорожденного, особенно если он родился недоношенным, неудивительно, что инфекции являются обычным явлением. К возрасту нескольких месяцев иммунная система функционирует лучше, и растущий младенец становится менее восприимчивым к инфекциям по мере взросления.
12-5 Как можно предотвратить заражение новорожденных?
Существует много простых способов предотвращения инфекций у новорожденного:
Распыление и мытье рук перед прикосновением к младенцу — самый важный метод предотвращения заражения в детской.При входе в детскую или при загрязнении стулом руки следует мыть карболовым мылом (например, спасательным кругом). Перед тем, как брать ребенка в детскую, опрыскайте руки антисептическим спреем, содержащим хлоргексидин и спирт (например, D-Germ). Лучше всего как можно реже обращаться с младенцами в детской, так как большинство инфекций передается через руки. Нет никаких доказательств того, что халаты или маски уменьшают перекрестную инфекцию.
Каждый должен всегда мыть или опрыскивать руки перед тем, как брать ребенка в руки.
Грудное вскармливание. Грудное молоко содержит антитела, лимфоциты, фагоциты и комплемент и, следовательно, защищает кишечник младенца от инфекций. Грудное молоко также способствует росту безвредных бактерий в кишечнике и, таким образом, уменьшает рост вредных бактерий.
Грудное молоко защищает младенцев от инфекций.
- Асептическое приготовление смесей, кипячение бутылочек и сосков на молочной кухне имеет важное значение для предотвращения заражения кормов.Также важно чистое приготовление смеси в домашних условиях. Лучше использовать чашку, чем бутылку, так как ее легче мыть.
Vernix обладает антибактериальными свойствами, поэтому его не следует смывать при родах. Через несколько часов он впитывается кожей.
Не следует регулярно смывать верникс после родов.
- Купание младенцев с помощью карболового мыла (например, спасательного круга) или хлоргексидина (например, биоскраба) уменьшает колонизацию вредными бактериями.Белое или цветное мыло со сладким запахом часто не обладает антибактериальными свойствами.
- Стетоскопы и другие инструменты следует обработать антисептическим спреем (например, D-Germ) перед обследованием младенца.
- Регулярный уход за пуповиной спиртом (хирургический спирт) предотвращает инфицирование.
- Иммунизация всех беременных женщин столбнячным анатоксином предотвращает столбняк новорожденных, осложняющий инфекцию пуповины.
- Регулярный профилактический уход за глазами после родов с помощью мази с тетрациклином, хлоромицетином или эритромицином или повидон-йодными каплями предотвращает конъюнктивит, возникший в результате колонизации гонококками во время родов.
- Избегайте поцелуев новорожденных, так как это может распространять вредоносные вирусы, такие как Herpes simplex . Родители или персонал с активной герпетической инфекцией губ должны быть очень осторожны при обращении с младенцами.
Избегайте переполненности яслей, по возможности держите нормальных младенцев с их матерями.
Риск перекрестного заражения в питомнике увеличивается с переполненностью.
Косметический уход (уход за матерью-кенгуру), направленный на заселение младенца материнскими бактериями (а не больничными бактериями), является важным методом снижения серьезной инфекции.
Кожный уход снижает риск серьезных инфекций в больнице.
- Изоляция инфицированных младенцев обычно не требуется, если в яслях практикуется частое мытье рук. Однако младенцев с гастроэнтеритом не следует кормить грудью рядом с здоровыми младенцами. По возможности, новорожденных следует кормить не в обычном отделении для детей, а в специальной ясли для новорожденных.
- Нет необходимости ограничивать посещения родителями и семьей в детской при условии строгого мытья рук и опрыскивания рук.Посетителям не нужно надевать маски или халаты. Детям с кашлем и простудой посещать не следует.
12-6 Каковы источники инфекции?
Младенец может быть колонизирован или инфицирован:
- Перед доставкой. Это может быть связано с инфекцией, проникающей через плаценту из кровотока матери и вызывающей хроническую внутриматочную инфекцию (небактериальную) у плода, например сифилис и ВИЧ, или из-за острой инфекции (бактериальной), распространяющейся из влагалища на мембраны и ликвор, т.е.е. хориоамнионит.
- Во время доставки. Младенец колонизируется, поскольку он проходит через шейку матки и влагалище во время родов, и у него может появиться инфекция через несколько часов или дней после родов, например Гонококковый конъюнктивит.
- После доставки. Когда новорожденный становится колонизированным и впоследствии может быть инфицирован дома или в детской, например Стафилококковая инфекция пуповины.
- Примечание
- Нозокомиальные инфекции — это инфекции, приобретенные в больнице, когда организмы передаются от одного младенца к другому.Обычно они появляются через 72 часа или более после рождения. Более ранние инфекции обычно возникают в результате колонизации во время родов.
Младенцы, рожденные дома и доставленные в больницу вскоре после родов, часто ошибочно считаются инфицированными и, следовательно, не допускаются в детскую. Эти младенцы редко инфицируются и не передают инфекцию младенцам, родившимся в больнице. За ними следует ухаживать в яслях, а не в общей палате с детьми старшего возраста.
12-7 Как классифицируются инфекции?
Для удобства инфекции у новорожденного ребенка можно разделить на:
- Незначительные острые инфекции, которые обычно не приводят к смерти младенца.
- Серьезные острые инфекции, которые могут убить младенца.
- Хронические внутриматочные инфекции, при которых плод инфицирован через плаценту.
Незначительные инфекции
12-8 Какие бывают распространенные незначительные инфекции?
Распространенные незначительные острые инфекции у новорожденных:
- Конъюнктивит
- Инфекция пуповины
- Кожная инфекция
- Молочница полости рта
12-9 Какие признаки конъюнктивита?
Конъюнктивит проявляется на одном или обоих глазах с:
- Экссудат (выделения) из глаз
- Покраснение конъюнктивы
- Отек век
Степень конъюнктивита можно разделить на легкую, среднюю и тяжелую:
- Легкий конъюнктивит состоит из небольших слизисто-гнойных выделений, вызывающих сухой экссудат на ресницах.Веки имеют свойство слипаться.
- Умеренный конъюнктивит проявляется покраснением конъюнктивы с явным гнойным отделяемым. Гной присутствует в глазу, когда веки разделены.
- Тяжелый конъюнктивит с выраженными гнойными выделениями с отеком век. Гной вырывается из глаза и стекает по щекам, когда веки открыты. В самых тяжелых случаях невозможно разделить веки из-за отека.
Легкий конъюнктивит является наиболее распространенной, а тяжелый конъюнктивит — наименее распространенной формой конъюнктивита.
12-10 Каковы причины конъюнктивита?
У новорожденных конъюнктивит обычно вызывается:
Chlamydia trachomatis . Он передается половым путем и вызывает инфицирование шейки матки. Во время родов через естественные родовые пути глаза младенца могут быть колонизированы хламидиозом, поскольку ребенок проходит через шейку матки. Хламидийный конъюнктивит, который обычно протекает в легкой форме, развивается в одном или обоих глазах через несколько дней после родов. Инфекция длится несколько недель, а затем проходит спонтанно, если ее не лечить.Хламидиоз, вероятно, является самой частой причиной конъюнктивита у новорожденного.
- Примечание
- У некоторых младенцев организм Chlamydia может распространяться и инфицировать верхние дыхательные пути через носослезный канал. Отсюда инфекция распространяется в легкие и может вызвать пневмонию через несколько недель после рождения. Другой штамм хламидиоза вызывает трахому. Хламидиоз — необычный организм, в котором присутствуют как бактерии, так и вирусы. Он реагирует на антибиотики, как бактерии, но может выращиваться только в культуре клеток, как вирус.
Гонококк ( Neisseria gonorrhoeae ). Эти бактерии вызывают конъюнктивит легкой, средней или тяжелой степени. Наиболее важен тяжелый конъюнктивит, так как он может привести к слепоте. Как и хламидиоз, гонококк передается половым путем и вызывает цервицит. Глаза младенца колонизируются во время родов через естественные родовые пути, и через несколько часов или дней после этого развивается конъюнктивит.
Гонококк вызывает тяжелый конъюнктивит, который может привести к слепоте.
Стафилококк. Эта и другие бактерии, приобретенные в питомнике после родов, также могут вызывать конъюнктивит.
Очень трудно определить причину конъюнктивита при клиническом осмотре глаза, хотя в большинстве случаев тяжелая инфекция вызывается гонококком. Гонококки и стафилококки можно увидеть на мазке гноя, вытертом с глаза по Граму. Их также можно культивировать в лаборатории. К сожалению, хламидиоз не выявляется при окраске по Граму, и его очень трудно культивировать.Таким образом, клинический диагноз хламидийного конъюнктивита подтверждается редко.
- Примечание
- Хламидийную инфекцию можно подтвердить с помощью иммунофлуоресцентного теста, проводимого на мазке гноя из глаза.
12-11 Как лечить конъюнктивит?
Выбор лечения зависит от тяжести конъюнктивита, так как возбудитель часто не известен на момент постановки диагноза.
- Легкий конъюнктивит обычно можно лечить, промывая глаза физиологическим раствором или теплой водой, если ресницы становятся липкими.Местный антибиотик часто не требуется. Однако, если инфекция не исчезнет в течение нескольких дней, следует использовать мазь с тетрациклином или хлоромицетином каждые 6 часов в течение 5 дней. Тетрациклиновая, хлоромициновая и эритромициновая мази убивают гонококки, но только эритромицин и тетрациклин могут лечить хламидиоз.
- Умеренный конъюнктивит следует лечить, промывая глаз, а затем вводя мазь тетрациклина или хлоромицетина 3 раза в час или чаще, если необходимо. Обычно требуется 5-дневный курс лечения.
- Тяжелый конъюнктивит требует неотложной медицинской помощи, поскольку при отсутствии своевременного и эффективного лечения он может привести к слепоте. Инфекция обычно возникает из-за гонококка, и лечение заключается в орошении глаза и внутримышечном введении цефтриаксона.
- Гной необходимо вымыть из глаза физиологическим раствором или теплой водой. Это нужно начинать немедленно и повторять достаточно часто, чтобы в глаза не попал гной. Самый простой способ промыть глаз — использовать раствор физиологического раствора с помощью набора для введения.
- Необходимо вводить цефтриаксон внутримышечно ежедневно в течение 3 дней. Многие штаммы гонококков теперь устойчивы к пенициллину. Поэтому внутримышечный или внутривенный пенициллин следует использовать только в том случае, если цефтриаксон недоступен. Одни только местные капли с антибиотиком не подходят для лечения тяжелого конъюнктивита, поскольку инфекция, возможно, уже распространилась и охватила весь глаз.
- Только после того, как это лечение было начато, младенца следует срочно направить в больницу для дальнейшего лечения.
- Если возможно, перед началом лечения следует взять мазок из гноя для подтверждения диагноза гонококкового конъюнктивита. В случае положительного результата необходимо лечение матери и ее партнера. Также обратите внимание на другие заболевания, передающиеся половым путем, например, сифилис.
Цефтриаксон для внутримышечного введения используется для лечения тяжелого конъюнктивита.
12-12 Каковы признаки инфицированной пуповины?
Здоровая культя пуповины при родах белая и мягкая.При правильном уходе за пуповиной он становится темно-коричневым и обезвоживается в течение нескольких дней, и ни на каком этапе он не пахнет и не имеет экссудата.
Инфекция пуповины (омфалит) представлена:
- Зловонное (зловонное) выделение на поверхности пуповины.
- Отсутствие обезвоживания пуповины (т. Е. Пуповина остается влажной и мягкой).
- Эритема кожи у основания пуповины (блик).
Наиболее частое место инфекции — у основания, где пуповина встречается с кожей.При неосложненной инфекции пуповины отека кожи вокруг основания пуповины нет. Младенец обычно здоров, если инфекция локализуется только на пуповине.
Инфекция пуповины может распространиться на переднюю брюшную стенку (целлюлит), откуда она может вызвать перитонит или сепсис. Признаки того, что инфекция пуповины распространилась на брюшную стенку:
- Покраснение и отек кожи вокруг основания пуповины.
- Вздутие живота, часто со сниженным шумом кишечника и рвотой (перитонит).
- Младенец в целом нездоров с признаками сепсиса.
Целлюлит, перитонит и сепсис — это не незначительные, а серьезные инфекции, и младенец может умереть, если не лечить немедленно.
Инфекция пуповины может также вызвать столбняк у новорожденного, если мать не была полностью иммунизирована.
12-13 Каковы причины инфекции пуповины?
Инфекция пуповины обычно вызывается:
- Бактерии, колонизирующие кишечник младенца, такие как Escherichia coli
- Стафилококк
- Clostridium tetani , вызывающий столбняк
12-14 Как лечить инфекцию пуповины?
При правильном профилактическом уходе за пуповиной инфекция не должна возникать.Профилактика заключается в регулярном нанесении спирта (хирургический спирт) на пуповину каждые 6 часов до тех пор, пока она не обезвоживается. Порошок антибиотика не используется. Никогда не накрывайте шнур, так как он сохраняет влажность.
Если инфекция локализована в пуповине и нет признаков целлюлита, перитонита, сепсиса или столбняка, то лечение заключается просто в частой очистке пуповины хирургическим спиртом. Не нужны ни местные, ни системные антибиотики. Пуповину следует тщательно очищать тампоном и достаточным количеством спирта каждые 3 часа, чтобы избавиться от инфекции и ускорить обезвоживание.Особое внимание следует уделять складкам у основания шнура, которые часто остаются влажными. В течение 24 часов инфекция должна была исчезнуть. Внимательно следите за признаками возможного распространения инфекции за пределы пупка.
Целлюлит брюшной стенки вокруг основания пуповины (покраснение и отек кожи), перитонит или сепсис необходимо лечить парентеральными антибиотиками.
12-15 Что такое столбняк?
Столбняк у новорожденного (столбняк новорожденных) вызывается бактерией Clostridium tetani , которая поражает мертвые ткани, такие как пуповина. Clostridium tetani обычно встречается в почве и фекалиях, которые в соответствии с традиционной практикой можно поместить на пуповину или другие раны. Он производит мощный токсин, поражающий нервную систему.
Столбняк представляет:
- Повышение мышечного тонуса, особенно мышц челюсти и живота.
- Генерализованные мышечные спазмы и судороги, часто спровоцированные стимуляцией, такой как прикосновение рук или громкий шум.
- Дыхательная недостаточность и смерть у нелеченных младенцев из-за спазма дыхательных мышц.
12–16 Как справиться со столбняком?
Столбняк можно предотвратить с помощью:
- Хороший уход за пуповиной
- Иммунизация всех беременных женщин столбнячным анатоксином, если столбняк распространен в регионе.
В группу неотложной помощи при столбняке входят:
- Обеспечение чистоты дыхательных путей и обеспечение кислородом.
- Не стимулирует младенца.
- Купирование спазмов с помощью 1 мг диазепама (валиума) внутривенно или ректально, многократно до тех пор, пока спазмы не прекратятся.Возможно, вам придется использовать маску для вентиляции младенца.
- Срочно доставить младенца в ближайшую больницу уровня 2 или 3.
- Примечание
- Больничное лечение столбняка включает пенициллин, человеческий противостолбнячный иммуноглобулин, трахеотомию, паралич и вентиляцию легких.
12-17 Каковы признаки и причины кожной инфекции?
Две самые распространенные формы кожной инфекции у новорожденного:
- Буллезное импетиго, вызванное стафилококком, которое проявляется в виде пузырей, заполненных гноем, которые обычно наблюдаются вокруг пупка или в области подгузников.
- Сыпь, вызванная грибком Candida albicans . Это почти всегда происходит в области подгузников и проявляется в виде красной, слегка приподнятой «бархатистой» сыпи, которая наиболее заметна на складках кожи.
Сыпь, которая часто имитирует кожные инфекции:
- Токсическая эритема, которая обычно появляется на 2 или 3 день после родов в виде красных пятен, в центре которых образуются небольшие желтые пустулы. Сыпь наиболее заметна на лице и груди и исчезает примерно через неделю.Причина неизвестна, младенцы в целом здоровы, лечение не требуется. Эта сыпь важна, поскольку может выглядеть как стафилококковая инфекция.
- Сыпь из-под подгузников возникает из-за раздражения кожи калом и мочой и, в отличие от кандидозной сыпи, обычно щадит складки.
- Сыпь от пота может проявляться в виде небольших прозрачных волдырей на лбу или мелкой красной сыпи на шее и туловище. И то и другое происходит из-за чрезмерного потоотделения, когда младенца слишком тепло. Волдыри возникают из-за капель пота, которые не могут пройти через верхний слой кожи, а красная сыпь возникает из-за раздражающего воздействия соленого пота на кожу.Обработайте обе высыпания, вымыв ребенка, чтобы удалить пот и предотвратить перегрев.
- Пустулезный меланоз обычно проявляется при рождении в виде маленьких волдырей, которые вскоре лопаются, оставляя небольшой шелушащийся пигментированный участок кожи. Иногда волдыри лопаются еще до родов. Младенцы здоровы, и сыпь медленно исчезает без лечения.
- Примечание
- Пузыри при буллезном импетиго заполнены грамположительными кокками и гнойными клетками, тогда как пустулы при токсической эритеме заполнены только эозинофилами.
12-18 Как лечить кожные инфекции?
Если верникс регулярно не смывается сразу после рождения и если мыть руки и опрыскивание уделяется строгое внимание, кожная инфекция не должна быть проблемой в детской.
- Буллезное импетиго лечится путем мытья младенца хлоргексидином (например, Bioscrub) два раза в день в течение 5 дней. Не накрывайте инфицированный участок подгузником. Лечите любую инфекцию пуповины. Тщательно мойте руки после контакта с младенцем, чтобы предотвратить распространение инфекции на других младенцев.Если ребенок в целом здоров, местные или системные антибиотики не нужны. Однако, если младенец почувствует недомогание и у него появятся признаки сепсиса, показано срочное лечение парентеральными антибиотиками.
- Кандидозную сыпь следует лечить кремом с микостатином (нистатином) для местного применения, при этом не закрывать эту область. Позвольте младенцу спать в подгузнике, чтобы инфицированный участок кожи оставался открытым. Немного солнечного света также поможет, но не позволяйте ребенку становиться слишком горячим или обгоревшим.Если сыпь не исчезнет в течение 48 часов, дайте пероральные капли микостатина, чтобы уменьшить количество спор Candida в стуле.
12-19 Каковы причины и клинические проявления молочницы полости рта?
Молочница полости рта (кандидоз или монилиоз) вызывается грибком Candida albicans , который также может вызывать кожные инфекции. Молочница во рту проявляется в виде пятен белого налета на языке и слизистой оболочке рта. В отличие от отложений молочного творога, которые иногда наблюдаются после кормления, молочницу нелегко стереть.Степень заражения варьирует от легкой до тяжелой:
- При легкой форме инфекции есть только отдельные участки молочницы, а остальная часть слизистой оболочки выглядит здоровой. Младенец тоже хорошо сосет. Легкая форма молочницы очень распространена, особенно у младенцев, находящихся на грудном вскармливании.
- Напротив, при тяжелой инфекции возникают обширные участки молочницы. Язык и слизистая оболочка красные, ребенок плохо ест из-за болезненных ощущений во рту. Младенец выглядит несчастным и может похудеть или даже обезвоживаться.
Повторяющийся тяжелый кандидоз полости рта у грудного ребенка всегда должен указывать на СПИД.
12-20 Как бы вы вылечили молочницу полости рта?
Лечение молочницы во рту зависит от степени инфицирования:
- Легкая форма молочницы обычно не требует лечения, так как она не вызывает дискомфорта и младенец ест нормально. Инфекция обычно проходит спонтанно. Иногда инфекция может стать серьезной.
- Молочница тяжелой степени требует лечения, так как мешает кормлению.Лечение выбора — это 1 мл капель микостатина (нистатин) в рот после каждого кормления. Также можно использовать мазь микостатина, которую следует протереть на слизистую оболочку полости рта тампоном или чистым пальцем. Лечение следует продолжить в течение недели. Генцианвиолет можно использовать, если микостатин недоступен. Однако это очень грязно и иногда может вызвать повреждение слизистой оболочки.
Также необходимо искать и лечить источник инфекции:
- У младенцев, находящихся на грудном вскармливании, источником обычно является колонизация сосков матери Candida.Мазь микостатина следует мазать на соски и ареолы после каждого кормления. Если у матери наблюдаются монилиальные выделения из влагалища, их следует обработать вагинальным кремом с микостатином, чтобы уменьшить колонизацию кожи Candida.
- У детей, находящихся на искусственном вскармливании, бутылочки и соски необходимо кипятить после кормления. Дезинфицирующие растворы, такие как Milton и Jik, очень полезны для предотвращения бактериального заражения бутылочек, но не могут убить Candida. Лучше используйте для кормления чашку, чем бутылочку, так как ее легче мыть.Соус следует отваривать.
Если младенец лечится, но источник не лечится должным образом, кандидоз во рту вернется после прекращения лечения.
Основные инфекции
12-21 Какие основные инфекции у новорожденных?
Наиболее частые серьезные острые инфекции у новорожденных:
- Септицемия
- Пневмония
- Менингит
- Некротический энтероколит
К другим менее распространенным серьезным инфекциям относятся инфекции мочевыводящих путей и остит.
12-22 Что вызывает сепсис?
Септицемия — это инфицирование кровотока бактериями, которые могли колонизировать младенца до, во время или после рождения. Септицемия часто является осложнением местной инфекции, например пневмония, инфекция пуповины или кожи.
Септицемия может быть вызвана грамположительными бактериями (например, стафилококком и стрептококком группы B) или грамотрицательными бактериями (например, Escherichia coli , клебсиеллой и псевдомонадой).
- Примечание
- Бактерии делятся на 2 группы в зависимости от их внешнего вида под микроскопом после воздействия красителя по Граму. Если они примут пятно и станут пурпурными, их называют грамположительными. Напротив, грамотрицательные бактерии не впитывают пятно и поэтому выглядят розовыми.
12-23 Каковы клинические признаки сепсиса?
Клинические признаки сепсиса часто неспецифичны, что затрудняет раннюю диагностику сепсиса.Общие клинические признаки:
- Вялость. Младенец выглядит менее активным, чем раньше, и в целом плохо себя чувствует. Обычно это самый ранний признак сепсиса, но, к сожалению, для его распознавания требуется опыт, и он может быть вызван многими другими состояниями.
- Плохое кормление или плохое сосание. Младенец также может не набрать вес или даже похудеть. Эти признаки имеют особое значение, если раньше младенец хорошо кормил.
- Вздутие живота, рвота и снижение кишечных шумов (кишечная непроходимость).
- Бледность. Это лишь частично объясняется анемией.
- Желтуха, которая может быть вызвана повышенной концентрацией как неконъюгированного, так и конъюгированного билирубина в крови.
- Пурпура (петехии) из-за слишком малого количества тромбоцитов. Часто также кровотечение из мест проколов (из-за диссеминированной внутрисосудистой коагулопатии). Это указывает на то, что младенец тяжело болен.
- Рецидивирующее апноэ.
- Гипотермия. Лихорадка встречается гораздо реже.
- Отек или склерема (ощущение деревца на коже).
У младенца также могут быть признаки местной инфекции, например инфекция пуповины, пневмония или менингит.
Младенец с сепсисом может иметь один или несколько из этих признаков. Когда присутствует большинство клинических признаков и диагноз легко поставить, часто бывает слишком поздно спасти младенца. Следовательно, очень важен ранний клинический диагноз.
Ранняя диагностика сепсиса у новорожденного часто затруднена.
Диагноз сепсиса подтверждается посевом крови.Однако лечение необходимо начинать немедленно, так как результаты посева крови могут быть получены за несколько дней.
- Примечание
- К сожалению, лабораторные исследования мало помогают в ранней диагностике сепсиса. Положительный посев крови должен произойти через 48 часов. Общее количество лейкоцитов менее 5000 или отношение незрелых нейтрофилов к общему количеству нейтрофилов более 20% с большой вероятностью указывает на сепсис. Нормальный CRP (C-реактивный белок) не исключает сепсиса, поскольку для получения положительного результата может потребоваться много часов.Анализ мочи на антиген стрептококковой группы B (набор Wellcogen Strep B) имеет лишь ограниченную помощь в диагностике сепсиса, поскольку может просто указывать на колонизацию.
12-24 Как лечить сепсис?
В ведение сепсиса входят:
- Общая поддерживающая помощь больному младенцу. Часто требуется переход в отряд 3-го уровня.
- Антибиотики. Когда доступны результаты посева и чувствительности, выбирается наиболее подходящий антибиотик.Однако в ожидании этих результатов наиболее часто используются следующие антибиотики:
- Бензилпенициллин 50 000 единиц / кг / доза плюс гентамицин (гарамицин) 5 мг / кг / доза; или клоксациллин 50 мг / кг / доза плюс амикацин (амикин) 5 мг / кг / доза. Обычно это первые предпочтительные комбинации препаратов.
- Цефотаксим (Клафоран) 50 мг / кг / доза или цефтриаксон (роцефин) 50 мг / кг / доза. Обычно это второй вариант антибиотика.
Пенициллин, клоксациллин и цефотаксим вводятся в разделенных дозах внутривенно или внутримышечно каждые 12 часов для младенцев в возрасте до одной недели и каждые 8 часов после достижения возраста одной недели.Цефтриаксон имеет то преимущество, что его вводят один раз в день внутривенно или внутримышечно. Гентамицин и амикацин также вводятся внутривенно ежедневно. Прием антибиотиков следует продолжать в течение 10 дней.
Очень важно, чтобы каждая больница имела политику в отношении антибиотиков, которая включала рекомендации по применению соответствующих антибиотиков для тяжелобольных новорожденных. Выбор антибиотиков может варьироваться в зависимости от больницы в зависимости от местных моделей устойчивости к антибиотикам.
12-25 Что вызывает пневмонию?
Пневмония может быть приобретена в результате колонизации верхних дыхательных путей до, во время или после родов:
- Перед родами плод может быть инфицирован путем вдыхания ликвора, который заселен бактериями, распространившимися от хориоамнионита.
- Легкие могут быть инфицированы организмами, которые колонизируют верхние дыхательные пути младенца во время родов.
- В большинстве случаев пневмония в яслях возникает из-за бактерий, которые передаются младенцу через руки матери и персонала.
- Примечание
- Анаэробные бактерии, E. coli и стрептококки группы B являются наиболее распространенными организмами, заражающими плод перед родами, в то время как стрептококки группы B и хламидии могут колонизировать ребенка во время родов.В питомнике важны золотистый стафилококк и кишечные организмы.
12-26 Как следует диагностировать пневмонию?
- Диагноз обычно ставится на основании типичных клинических признаков.
- У младенца появляются признаки респираторной недостаточности (тахипноэ, цианоз, рецессия и хрюканье).
- Признаки пневмонии можно или не услышать с помощью стетоскопа. Прослушивание грудной клетки не является надежным методом диагностики пневмонии у младенцев.
- Обычно также есть признаки сепсиса.
- Рентген грудной клетки покажет типичные признаки пневмонии с участками уплотнения.
12-27 Как лечить пневмонию?
- Общая поддерживающая терапия важна. Может потребоваться перевод в отряд 3-го уровня.
- Обычно требуется кислород.
- Ввести антибиотики внутривенно или внутримышечно. Обычно назначают цефотаксим или цефтриаксон или пенициллин и гентамицин.
12-28 Как диагностировать бактериальный менингит?
Диагностика менингита у новорожденного часто бывает очень сложной, поскольку обычно он не проявляется признаками жесткости шеи, полным родничком, светобоязнью, рвотой и головной болью, характерными для детей старшего возраста с менингитом. Младенец обычно болен и может иметь признаки сепсиса. Дополнительно младенец может:
- Будьте раздражительны пронзительным криком.
- Есть ненормальные движения или судороги.
- Обычно смотрят и держат кулаки сжатыми.
- Повторяющиеся приступы апноэ или синюшные приступы.
При подозрении на менингит необходимо сделать люмбальную пункцию для подтверждения или исключения диагноза. Образец спинномозговой жидкости (CSF) должен быть исследован на химический состав и клетки, и он должен быть культивирован на наличие бактерий.
- Примечание
- В первую неделю жизни нормальные значения:
| Белок | 0.25–2,5 г / л |
| Глюкоза | 2,2–3,3 ммоль / л |
| Полиморфы | 0–15 на мм³ |
| Лимфоциты | 0–15 на мм³ |
12-29 Как лечить бактериальный менингит?
- Бактериальный менингит у новорожденного обычно вызывается грамотрицательными бациллами (например, E. coli, или клебсиелла) или стрептококками группы B.Выбор антибиотиков должен охватывать обе эти группы бактерий, а также хорошо проникать из кровотока в спинномозговую жидкость. Обычно используются следующие препараты: цефотаксим 50 мг / кг / доза внутривенно или внутримышечно каждые 12 часов или цефтриаксон 100 мг / кг / доза в качестве суточной дозы. Антибиотик следует давать в течение 14 дней. Половина младенцев с бактериальным менингитом умирает, несмотря на лечение, в то время как половина выживших получает необратимое повреждение мозга. Глухота, судороги и церебральный паралич — частые осложнения.
- Чтобы предотвратить или лечить судороги, введите 20 мг / кг фенобарбитона внутривенно или внутримышечно, а затем перорально по 5 мг / кг ежедневно, пока ребенок не станет клинически здоровым.
- Эти больные младенцы нуждаются в хорошей поддерживающей терапии и могут нуждаться в переводе в отделение 3 уровня.
12-30 Что такое некротический энтероколит?
Некротический энтероколит (НЭК) — это некроз (отмирание) части или всей тонкой и толстой кишки. Обычно наблюдается у 2 групп новорожденных:
- Доношенные дети, перенесшие тяжелую гипоксию во время родов, вызвавшую ишемию и повреждение кишечника.
- Недоношенные дети, инфицированные в яслях. Эта форма некротизирующего энтероколита может возникать во время эпидемий.
12-31 Каковы клинические признаки некротизирующего энтероколита?
Ишемия или инфекция повреждают стенку кишечника, и ребенок поступает с:
- Признаки сепсиса и часто шока.
- Вздутие живота и кишечная непроходимость. Живот болезненный при пальпации.
- Рвота, часто с пятнами желчи.
- Кровь в стуле. Это может быть обнаружено только при исследовании стула на скрытую кровь.
Рентген брюшной полости может показать воздух в стенке кишечника. Это открытие подтвердит клинический диагноз некротического энтероколита. Всем младенцам с одним или несколькими клиническими признаками некротизирующего энтероколита необходимо сделать рентген брюшной полости.
Всегда думайте о некротизирующем энтероколите, когда у ребенка вздутие живота.
В то время как некоторые младенцы с некротизирующим энтероколитом выздоравливают после лечения, у других развиваются осложнения, которые могут привести к смерти:
- Перфорация кишечника
- Массивное кровотечение из кишечника
- Септицемия
- Мальабсорбция и множественные стриктуры как поздние осложнения острого заболевания
12-32 Как лечить некротизирующий энтероколит?
Это тяжелобольные младенцы, которых необходимо направить в больницу уровня 2 или 3.Перед их передачей необходимо следующее управление:
- Необходимо ввести назогастральный зонд, чтобы уменьшить вздутие кишечника.
- Не давать в рот и начать внутривенное вливание. Для лечения шока может потребоваться стабилизированная человеческая сыворотка или свежезамороженная плазма.
- Окажите общую поддерживающую терапию.
- Ввести пенициллин, гентамицин и метронидизол внутривенно.
- Примечание
- В специализированном отделении обычно требуется парентеральное питание в течение недели или двух, пока поврежденный кишечник выздоравливает.Резекция кишечника может потребоваться при обширном некрозе или перфорации. Смертность после операции высока. Метронидазол (Флагил) 25 мг / кг / день вводится перорально или внутривенно каждые 8 часов.
Хориоамнионит
12-33 Что такое хориоамнионит?
Хориоамнионит — распространенное острое воспаление хориона, амниона и плаценты. Обычно внутриматочная полость во время беременности стерильна. Однако бактерии из влагалища иногда распространяются по цервикальному каналу и заражают хорион, амнион и плаценту, что приводит к хориоамниониту.Затем инфекция может распространиться на околоплодные воды (синдром инфекции околоплодных вод) и колонизировать плод. К счастью, большинство бактерий, вызывающих хориоамнионит (анаэробы), колонизируют, но обычно не заражают плод. Однако некоторые бактерии, такие как E. coli и стрептококк группы B, могут инфицировать плод, вызывая пневмонию и сепсис.
Хориоамнионит может развиться при неповрежденных плодных оболочках, хотя чаще всего он возникает после длительного разрыва плодных оболочек. Хориоамнионит ослабляет плодные оболочки и поэтому часто является причиной, а не осложнением преждевременного или предродового разрыва плодных оболочек.
Большинство бактерий, вызывающих хориоамнионит, стимулируют хорион и амнион на производство простагландинов и, таким образом, вызывают роды. Хориоамнионит является наиболее частой причиной преждевременных родов, поэтому его следует подозревать у всех недоношенных детей, родившихся после спонтанных родов или предродового разрыва плодных оболочек.
Хориоамнионит может вызвать преждевременные роды и предродовой разрыв плодных оболочек.
12-34 Как можно диагностировать хориоамнионит после родов?
Хориоамнионит у матери обычно протекает бессимптомно и поэтому часто не диагностируется до родов.Только в случае тяжелой инфекции у матери разовьется температура, болезненность в животе и, возможно, появятся зловонные выделения из влагалища. Если инфекция распространилась на околоплодные воды, при родах ребенок может пахнуть зловонным. Большинство этих младенцев с колонией будут клинически здоровыми, но у некоторых появятся признаки инфекции во время родов или вскоре после них. Тяжелый хориоамнионит также может вызвать отек плаценты и привести к гипоксии плода.
- Примечание
- Диагноз хориоамнионита можно поставить при рождении, исследуя образец желудочного аспирата, взятый в течение 30 минут после родов, под микроскопом.Наличие гнойных клеток указывает на хориоамнионит, в то время как бактерии на окраске по Граму также указывают на колонизацию околоплодных вод. Очищенный амнион кажется мутным. Вопрос о том, инфицирован ли младенец или только колонизирован, следует решать при клиническом обследовании.
12-35 Как вы лечите ребенка с хориоамнионитом?
Обычно ребенок выглядит здоровым и не требует лечения. Однако парентеральные антибиотики следует назначать, если:
- Младенец клинически болен с признаками пневмонии или сепсиса.
- Младенец весит менее 1500 г.
- Примечание
- Желудочный аспират с парами грамположительных кокков свидетельствует об инфицировании стрептококком группы B. Этим младенцам следует вводить парентеральный ампициллин в течение 48 часов, если ребенок выглядит здоровым, и полный 5-дневный курс, если он клинически болен.
Хроническая внутриматочная инфекция
12-36 Что такое хроническая внутриматочная инфекция?
Хроническая внутриматочная инфекция — это инфекция плода, которая присутствует в течение недель или месяцев до родов и вызывается организмами, которые проникают через плаценту от матери к плоду во время беременности.Инфекция может привести к:
- Выкидыш
- Мертворождение
- Больной младенец, который может умереть после родов. Выжившие больные младенцы могут полностью выздороветь или получить необратимые повреждения.
- Очевидно здоровый младенец, который, однако, инфицирован и у него будут развиваться признаки болезни через несколько недель или месяцев после родов.
12-37 Что вызывает хронические внутриматочные инфекции?
Важными причинами хронической внутриматочной инфекции являются:
- Сифилис
- Краснуха (немецкая корь), которая очень важна, поскольку вызывает врожденные пороки развития, если инфицирование происходит в течение первых 16 недель беременности (например,г. пороки сердца, глухота и слепота). После этого он вызывает только инфицирование плода с повреждением многих органов. Поскольку врожденная краснуха не лечится, ее необходимо предотвращать путем иммунизации всех детей, особенно девочек, до полового созревания.
- Цитомегаловирусная (ЦМВ) инфекция обычно протекает бессимптомно. Однако это может вызвать инфекцию многих органов, особенно серьезное повреждение головного мозга плода, приводящее к умственной отсталости и церебральному параличу. Врожденная ЦМВ-инфекция чаще встречается, если мать больна СПИДом.
- Токсоплазмоз, который встречается редко и вызывает те же проблемы, что и инфекция ЦМВ.
Сифилис
12-38 Что такое врожденный сифилис?
Врожденный сифилис — это хроническая внутриутробная инфекция, вызываемая спирохетой, Treponema pallidum . Если мать заболела сифилисом во время беременности, вероятность инфицирования плода составляет 50%.
Сифилис вызывает инфекцию и повреждение многих органов, но, в отличие от инфекции краснухи, не вызывает врожденных пороков развития.Мертворождение и неонатальная смерть — обычное явление.
Материнское лечение сифилиса состоит из 2,4 миллиона единиц бензатин-пенициллина, вводимых внутримышечно еженедельно в течение 3 недель.
12-39 Каковы признаки врожденного сифилиса?
Младенец, рожденный с врожденным сифилисом, может иметь один или несколько из следующих признаков:
- Низкая масса тела при рождении
- Волдыри и шелушение кистей и стоп
- Увеличение печени и селезенки
- Бледность от анемии
- Петехии из-за недостатка тромбоцитов
- Желтуха, вызванная гепатитом
- Дыхательная недостаточность, вызванная пневмонией
- Тяжелая бледная плацента весом более одной пятой веса младенца
- Рентгеновский снимок ног, показывающий остит костей вокруг колена
- Примечание
- Остит (метафизит) нижней части бедра, верхней большеберцовой кости и верхней малоберцовой кости — очень частая рентгенологическая находка и полезный диагностический признак при врожденном сифилисе.
12-40 Все ли дети с врожденным сифилисом имеют клинические признаки болезни при рождении?
Нет. У некоторых младенцев, инфицированных сифилисом на поздних сроках беременности, могут отсутствовать клинические признаки и нормальный рентгеновский снимок ног при рождении. При отсутствии лечения у большинства этих бессимптомных младенцев клинические признаки сифилиса разовьются в течение нескольких месяцев после родов.
12-41 Как можно подтвердить клинический диагноз врожденного сифилиса у младенца после рождения?
- Если у младенца есть клинические или рентгенологические признаки сифилиса, а результаты экспресс-теста VDRL, RPR или сифилиса положительны как у матери, так и у ребенка, то клинический диагноз врожденного сифилиса подтверждается.
- Часто бывает трудно подтвердить диагноз врожденного сифилиса, если ребенок выглядит клинически здоровым при родах и рентгеновские снимки в норме. Если у матери нелеченный или частично пролеченный сифилис или сифилис, пролеченный в течение последних нескольких месяцев беременности, экспресс-тест на VDRL, RPR и сифилис будет положительным как у матери, так и у ребенка при родах. Даже если младенец не инфицирован, материнские IgG-антитела, дающие положительный результат, проникают через плаценту. Таким образом, положительный результат у бессимптомного младенца указывает на то, что ребенок подвергся воздействию сифилиса у матери, но не доказывает, что у ребенка врожденный сифилис.
- Если результаты экспресс-теста на VDRL, RPR или сифилис отрицательны у матери или ребенка, врожденный сифилис исключается.
Положительный тест на антитела подтверждает, что младенец заразился сифилисом.
- Примечание
- Все женщины должны пройти обследование на сифилис при обращении за дородовой помощью. Положительный результат VDRL (или RPR, или экспресс-теста на сифилис) плюс TPHA (или FTA) у матери или ребенка подтверждает, что у матери сифилис. Ложноотрицательный тест может произойти, если мать была инфицирована только в последние несколько недель беременности.Специальные тесты крови младенца на антитела IgM, такие как общий IgM или ревматоидный фактор (т. Е. IgM против антиспирохетного IgG), имеют лишь ограниченную помощь в диагностике врожденного сифилиса, поскольку существует много ложноположительных и ложноотрицательных результатов. Результаты. Специфический тест на IgM покажет, вырабатывает ли ребенок антитела против трепонемы, поскольку материнские антитела IgM не проникают через плаценту. Если тесты на специфические антитела IgM у младенца положительны, то инфекция младенца подтверждается.Однако некоторые младенцы с ранней инфекцией могут не вырабатывать IgM.
12-42 Как лечить врожденный сифилис?
Метод лечения зависит от того, есть ли у ребенка с положительным тестом на антитела к сифилису клинические признаки врожденного сифилиса:
- Если у младенца есть клинические признаки сифилиса, вводите 50 000 единиц / кг прокаина пенициллина ежедневно внутримышечно в течение 10 дней. Этим младенцам следует дать десять дней лечения, даже если мать полностью пролечена.Бензатин-пенициллин не подходит для лечения младенцев с клиническими признаками врожденного сифилиса. Эти младенцы часто очень больны и нуждаются в хорошей общей поддерживающей терапии в больнице второго уровня.
- Если у матери нелеченный сифилис, она не прошла полный курс лечения или проходила лечение только на последнем месяце беременности и у ребенка нет клинических признаков сифилиса, то его можно лечить однократной внутримышечной дозой 50 000 единиц бензатин-пенициллина.
- Если мать получила полный курс пенициллина, а у ребенка нет признаков сифилиса, то он обычно не требует лечения.
- Примечание
- Иногда на рентгенограмме у младенцев без клинических признаков сифилиса обнаруживается метафизит. Этим младенцам следует назначать прокаин-пенициллин в течение 10 дней. Эритромицин, назначенный матери от сифилиса, не проникает через плаценту и не лечит плод.
Не забывайте лечить и родителей, если у младенца врожденный сифилис. Всегда ищите другие заболевания, передающиеся половым путем.
Младенцам с клиническими признаками врожденного сифилиса необходимо вводить 50 000 единиц прокаина пенициллина внутримышечно ежедневно в течение 10 дней.
ВИЧ-инфекция
12-43 Что такое ВИЧ и СПИД?
СПИД (синдром приобретенного иммунодефицита) — тяжелое заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ). У взрослых вирус обычно передается половым путем и вызывает бессимптомную инфекцию в течение месяцев или лет до появления клинических признаков хронической ВИЧ-инфекции. Только тогда, когда ВИЧ-инфекция вызывает тяжелое заболевание, это называется СПИДом. ВИЧ-инфекция обычно подтверждается у взрослых и детей старшего возраста при обнаружении антител к вирусу в крови пациента.В Южной Африке более 25% беременных женщин инфицированы ВИЧ.
Общие клинические признаки ВИЧ-инфекции у беременных включают:
- Похудание и общая вялость
- Хроническая лихорадка
- Генерализованная лимфаденопатия (увеличение лимфатических узлов)
- Стойкая диарея
- Повторные острые бактериальные инфекции (например, пневмония), туберкулез или необычные (условно-патогенные) инфекции
- Рецидивирующий кандидоз полости рта
- Деменция (потеря памяти и изменения поведения)
ВИЧ-инфекцию невозможно вылечить, но с этим хроническим заболеванием можно успешно бороться в течение многих лет с помощью антиретровирусной терапии, в то время как многие из осложняющих инфекций можно лечить.Необходимо приложить все усилия для предотвращения распространения ВИЧ половым путем. Важное значение имеют образование, более безопасный секс и использование презервативов.
12-44 Может ли младенец заразиться ВИЧ?
Да. Если женщина с ВИЧ-инфекцией забеременеет или заразится ВИЧ во время беременности или кормления грудью, ее плод или новорожденный также может заразиться. Если не назначена правильная антиретровирусная (АРВ) профилактика:
- Риск передачи ВИЧ через плаценту от матери к ее плоду во время беременности составляет 5%.
- Риск заражения младенца в результате контакта с вирусом материнской крови и выделений во время родов через естественные родовые пути составляет 15%.
- Риск заражения ВИЧ у младенца в результате смешанного грудного вскармливания (грудное молоко плюс другие жидкости или твердые вещества) в течение двух лет составляет 15% (5% в течение первых 6 месяцев, 5% в течение вторых 6 месяцев и 5% в течение второго года. ). Риск от исключительно грудного вскармливания (только грудным молоком) в течение 6 месяцев намного меньше.
12-45 Как можно предотвратить передачу ВИЧ от матери ребенку?
Риск передачи инфекции от матери ребенку (ПМР) можно снизить примерно с 25% до менее 2% с помощью АРВ-профилактики во время беременности и родов.Обычно всем ВИЧ-положительным женщинам с 14 недель беременности и во время родов ежедневно назначают одну таблетку комбинации фиксированной дозы (FDC). Таблетка FDC состоит из тенофовира (TDF), эмтрицитабина (FTC) и эфавиренца (EFV).
Как можно скорее после рождения ребенку следует дать пероральную дозу невирапина, а затем суточную дозу невирапина до 6-недельного возраста. Следует поощрять мать кормить исключительно грудью и продолжать прием КПФ до недели после последнего кормления грудью. Женщины, получающие АРВ-терапию, будут продолжать принимать АРВ-препараты на всю жизнь.
ВИЧ-инфекцию младенцев можно предотвратить, если все женщины будут проходить обследование на ВИЧ при бронировании и назначать антиретровирусную профилактику или лечение всем ВИЧ-инфицированным женщинам во время беременности и родов, а также во время грудного вскармливания.
12-46 Как узнать, есть ли у младенца ВИЧ-инфекция?
Младенец с ВИЧ-инфекцией обычно выглядит нормальным и здоровым при родах. Однако в период между 2 месяцами и 2 годами после рождения у большинства младенцев, инфицированных ВИЧ, не будет развиваться и будут повторяться инфекции, если они не будут получать АРВ-терапию.Большинство этих младенцев умрут в возрасте до 3 лет, если им не будут давать правильные АРВ-препараты.
12-47 Что такое ведение ребенка, контактировавшего с ВИЧ?
Все младенцы, контактировавшие с ВИЧ (т.е. младенцы, рожденные от матери с ВИЧ-инфекцией), должны продолжать получать невирапин ежедневно и проходить тест ПЦР (полимеразная цепная реакция) в возрасте 6 недель. Через 6 недель прием невирапина прекращают, даже если мать кормит грудью. Если результат ПЦР отрицательный, младенец не инфицирован ВИЧ и может получать обычную первичную медицинскую помощь.Если результат ПЦР положительный, младенец инфицирован ВИЧ и должен быть направлен в клинику ВИЧ для пожизненного АРВ-лечения.
Большинству доношенных детей потребуется 1,5 мл невирапина от рождения до шести недель (см. Дозировку в таблице 12-1).
Всем младенцам, контактировавшим с ВИЧ, следует давать суточную дозу невирапина в течение шести недель после родов.
Таблица 12-1: Рекомендации по дозировке невирапина для новорожденных: сироп невирапина 10 мг / мл
| Масса при рождении | Суточная доза | Кол. Акций |
|---|---|---|
| Менее 2.0 кг | Первые 2 недели: 2 мг / кг Следующие 4 недели: 4 мг / кг | 0,2 мл / кг 0,4 мл / кг |
| 2,0 — 2,5 кг | От рождения до 6 недель: 10 мг | 1,0 мл |
| Более 2,5 кг | От рождения до 6 недель: 15 мг | 1,5 мл |
Всем младенцам, контактировавшим с ВИЧ, следует давать суточную дозу невирапина в течение шести недель после родов.
12-48 Как ВИЧ-инфицированным женщинам следует кормить своих младенцев?
Исключительно грудное вскармливание по-прежнему рекомендуется ВИЧ-инфицированным женщинам, получающим КПД для профилактики или лечения.Кормление смесью дорого и часто небезопасно в бедных общинах, где недоедание и гастроэнтерит являются обычным явлением.
12-49 Может ли медицинский и медперсонал заразиться ВИЧ во время родов?
Да. Кровь матери и выделения из влагалища заразны, если женщина инфицирована ВИЧ. При влагалищных обследованиях и родах необходимо соблюдать надлежащие меры инфекционной безопасности. При обращении с младенцем и плацентой при рождении следует носить перчатки. Хорошая сушка всех младенцев после родов снизит риск заражения персонала.Нет необходимости купать этих младенцев сразу после рождения.
12-50 Может ли персонал заразиться ВИЧ от новорожденного?
Да. Кровь младенца, инфицированного ВИЧ, даже при отсутствии клинических признаков болезни заразна. Следовательно, персонал может заразиться ВИЧ, если уколется иглой или ланцетом («острым»), который использовался для взятия пробы крови у инфицированного младенца.
Особая осторожность требуется при заборе крови у ВИЧ-инфицированной матери или ребенка.Сразу после того, как игла или ланцет вынут из кожи, их необходимо поместить в контейнер для острых предметов. Никогда не оставляйте иглу или ланцет рядом с пациентом, так как медсестра или врач могут уколоть себя во время уборки после процедуры. При сборе крови всегда держите контейнер для острых предметов у постели больного. Хотя во время процедур рекомендуется надевать перчатки, это не всегда защитит человека от уколов иглой.
Любой, кто укололся при взятии крови у ВИЧ-положительного пациента, должен немедленно начать АРВ-профилактику.
Все иглы и ланцеты должны быть помещены в контейнер для острых предметов сразу после использования.
Пример из практики 1
Младенца рожает на дом бабушка. На 3-е сутки у ребенка развивается двусторонний гнойный конъюнктивит. Когда младенца доставляют в местную клинику, веки опухают из-за отека.
1. Какая вероятная причина конъюнктивита?
Гонококк ( Neisseria gonorrhoeae ). Это наиболее частая причина гнойного конъюнктивита (конъюнктивита с гноем).Большинство младенцев заражаются во время родов.
2. Как можно было предотвратить конъюнктивит?
Путем закапывания тетрациклиновой или хлоромицетиновой мази в глаза младенца после родов.
3. Конъюнктивит легкий, средний или тяжелый? Назовите свои причины.
Тяжелая, поскольку веки опухли.
4. Чем опасен тяжелый гнойный конъюнктивит?
Роговица может стать мягкой и перфорированной, что приведет к слепоте.
5.Как правильно лечить тяжелый конъюнктивит?
Глаза необходимо промыть физиологическим раствором, водой или каплями пенициллина для удаления гноя. Затем их следует многократно промыть или промыть, пока гной не перестанет образовываться. Кроме того, цефотаксим или цефтриаксон следует вводить внутримышечно ежедневно в течение 3 дней. Только после того, как глаза будут чистыми и будет введена первая доза антибиотика, младенца можно направить в больницу для дальнейшего лечения.
Пример из практики 2
На 10-е сутки в клинику доставлен ребенок, находящийся на грудном вскармливании.Мать сообщает, что младенец отказывается от груди и плачет, когда она пытается кормить. При осмотре ребенок в целом здоров, но имеет белый налет на языке и слизистой оболочке рта.
1. Какой диагноз?
Тяжелая форма молочницы полости рта (или кандидоз), вызванная грибком Candida albicans . Младенец голоден, но не ест из-за боли во рту. Молочницу полости рта всегда следует отличать от молочного творога, который можно легко вытереть, оставив под собой здоровую слизистую оболочку.
2. Чем опасна тяжелая форма молочницы?
Младенец может обезвоживаться из-за того, что не ест.
3. Как правильно лечить?
Микостатин (нистатин) капли по 1 мл следует поместить в рот и повторять после каждого кормления. В течение нескольких часов молочница должна улучшиться. Продолжайте лечение в течение недели. Если ребенок обезвожен, может потребоваться назогастральное кормление или внутривенное введение жидкости в течение нескольких часов. Мать должна нанести микостатиновый крем на соски, чтобы предотвратить повторное заражение ребенка.
Пример из практики 3
Недоношенный 5-дневный ребенок становится вялым и у него случается короткий приступ апноэ. Живот слегка вздут, кишечные шумы отсутствуют. Температура кожи 35 ° C.
1. Как вы думаете, что не так с этим младенцем?
У младенца, вероятно, сепсис, поскольку он может проявляться летаргией, апноэ, кишечной непроходимостью и переохлаждением. Однако у него также может быть менингит, который может проявляться апноэ, или некротизирующий энтероколит, который может проявляться летаргией и кишечной непроходимостью.
2. Какие исследования необходимы?
Посев крови для диагностики сепсиса, люмбальная пункция для диагностики бактериального менингита, а также рентгенография брюшной полости и исследование кала на скрытую кровь для диагностики некротизирующего энтероколита имеют важное значение.
3. Как лечить сепсис?
Бензилпенициллин 50 000 единиц / кг / день и гентамицин 7,5 мг / кг / день обычно вводятся в разделенных дозах внутривенно или внутримышечно каждые 8–12 часов. Также можно использовать цефотаксим или цефтриаксон.Выбор антибиотика может быть изменен после получения результатов анализа чувствительности посева крови. Антибиотики обычно продолжают в течение 10 дней.
Также важна хорошая поддерживающая терапия. Этому младенцу потребуется внутривенное введение жидкости, назогастральный дренаж, уход в инкубаторе и тщательное наблюдение. У этого младенца необходимо тщательно контролировать температуру кожи и частоту дыхания. Младенца необходимо перевести в больницу уровня 2 или 3.
Пример использования 4
Пациент без регистрации родил ребенка массой 2000 г с шелушащейся кожей на руках и ногах, а также с увеличенными печенью и селезенкой.Плацента бледная, вес 680 г.
1. Какой клинический диагноз?
Врожденный сифилис. Об этом свидетельствует шелушащаяся сыпь на руках и ногах, гепатоспленомегалия и тяжелая бледная плацента у новорожденного с низкой массой тела. Также следует подозревать сифилис у всех незарегистрированных пациентов.
2. Как бы вы подтвердили диагноз?
VDRL и TPHA у матери и ребенка будут положительными. Рентгеновский снимок ног почти наверняка покажет типичные признаки сифилического остита.
3. Как лечится ребенок с клиническими признаками врожденного сифилиса?
Прокаин пенициллин 50 000 единиц / кг внутримышечно ежедневно в течение 10 дней.
4. Как лечить ребенка, если он выглядит здоровым, но мать не лечится сифилисом?
Если у младенца нет клинических признаков сифилиса, лечение представляет собой разовую дозу 50 000 единиц бензатин-пенициллина.
5. Как предотвратить врожденный сифилис?
Все беременные женщины должны пройти скрининг с использованием анализов крови VDRL (или RPR) и TPHA (или FTA) в первом триместре, если это возможно, и получить полное лечение бензатин-пенициллином, если обнаружен сифилис.
Пример использования 5
У ВИЧ-положительной матери роды естественным путем. На 14 неделе беременности она получала АРВ-профилактику. Младенец выглядит клинически нормальным, но на 5-й день у него развивается легкая желтуха. Образец крови берется из пятки младенца для измерения общего билирубина в сыворотке крови.
1. Какова вероятность того, что этот младенец заразился вирусом ВИЧ?
Риск составляет менее 2%, так как мать правильно лечилась с помощью АРВ-профилактики.Риск составляет около 20%, если и матери, и ребенку не назначают АРВ-профилактику.
2. Ожидаете ли вы клинических признаков ВИЧ при рождении у этого младенца?
Нет. Младенцы, инфицированные ВИЧ, обычно выглядят здоровыми при рождении и остаются здоровыми в течение первых нескольких месяцев жизни.
3. Как диагностируется ВИЧ-инфекция у новорожденного?
Все младенцы, контактировавшие с ВИЧ, будут иметь положительный результат скрининга на ВИЧ. Однако тест ПЦР положительный только у ВИЧ-инфицированных младенцев. ПЦР-тест обычно проводится в возрасте 6 недель у младенцев, рожденных от ВИЧ-инфицированных матерей.
4. Следует ли рекомендовать этой матери кормить грудью или кормить смесью?
Ее следует поощрять кормить исключительно грудью и продолжать АРВ-профилактику в течение недели после последнего кормления грудью.
5. В чем опасность для персонала, если у этого младенца будет взят образец крови?
Если младенец инфицирован ВИЧ, медсестра или врач могут также заразиться ВИЧ, если уколют палец после взятия пробы крови младенца.
6.Как персонал может защитить себя?
Поместив иглу или ланцет в контейнер для острых предметов сразу после того, как они были использованы.
Видео
Сепсис
Видео проекта Global Health Media, доступное по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives License
Кожная инфекция
Видео проекта Global Health Media, доступное по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives License
Дрозд
Видео проекта Global Health Media, доступное по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives License
Пупочные инфекции
Видео проекта Global Health Media, доступное по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives License
Сепсис у новорожденных: симптомы, причины, лечение
Обзор
Что такое сепсис у новорожденных?
Сепсис — серьезное заболевание, вызванное реакцией организма на инфекцию.У новорожденного, у которого развивается инфекция и развивается сепсис, может быть воспаление (опухоль) по всему телу, что приводит к органной недостаточности.
Симптомы и причины
Что вызывает сепсис у новорожденных?
Бактериальные инфекции — наиболее частая причина сепсиса. Однако сепсис также может быть вызван грибами, паразитами или вирусами. Инфекция может располагаться в любом из множества мест по всему телу.
Как новорожденные заболевают сепсисом?
Новорожденные могут заразиться сепсисом несколькими способами:
- Если у матери инфекция околоплодных вод (состояние, известное как хориоамнионит)
- Преждевременные роды (недоношенные дети имеют более высокий риск сепсиса)
- Низкая масса тела ребенка при рождении (фактор риска сепсиса)
- Если вода у матери отходит рано (более чем за 18 часов до рождения ребенка)
- Если ребенка лечат от другого заболевания, пока он еще находится в больнице
- Если родовые пути матери колонизированы бактериями
Какие симптомы инфекций у новорожденных?
Симптомы инфекций у новорожденных включают:
- Плохое питание
- Очень хочется спать
- Быть очень раздражительным
- Учащенное дыхание или пауза в дыхании (апноэ)
- Рвота или диарея
- Лихорадка (температура выше 100.4 градуса F или более 38,1 градуса C)
- Неспособность оставаться в тепле — низкая температура тела, несмотря на то, что он одет и завернут в одеяла
- Бледный вид
Диагностика и тесты
Как диагностируют сепсис у новорожденных?
Тесты на сепсис у новорожденных могут включать:
- Анализы крови (подсчет клеток крови, посев крови)
- Анализы мочи (общий анализ мочи и посев)
- Кожные мазки
- Спинальная пункция (также известная как люмбальная пункция) для проверки на менингит.Спинальная пункция — это процедура, при которой очень маленькая игла вводится в пространство вокруг позвоночника вашего ребенка для забора спинномозговой жидкости для проверки на инфекции.
Ведение и лечение
Как лечится сепсис у новорожденных?
Младенцы с сепсисом поступают в отделение интенсивной терапии. Лечение может включать следующее:
- Внутривенные (в / в, непосредственно в вену) жидкости
- Внутривенные антибиотики
- Лекарства от лихорадки (редко применяются у новорожденных)
- Дополнительный кислород и другие формы респираторной поддержки, при необходимости
Иногда младенцам может потребоваться переливание крови.
Профилактика
Можно ли предотвратить сепсис у новорожденных?
Чтобы предотвратить инфицирование ребенка, беременным женщинам можно вводить антибиотики внутривенно за несколько часов до родов, если на это указывают пренатальные обследования или клинические признаки, такие как лихорадка у матери или болезненность матки. Ваш акушер решит, следует ли вам давать антибиотики перед родами.
Жить с
Как мне проконсультироваться с врачом после выписки новорожденного из больницы?
После выписки обратитесь к педиатру через 2–3 дня, чтобы проверить наличие дальнейших признаков выздоровления.
Когда мне следует позвонить поставщику медицинских услуг по поводу моего новорожденного?
Позвоните своему врачу, если ваш новорожденный:
- Плохо питается.
- Становится более раздражительным или вялым (сонным).
- Дышит слишком быстро или с трудом.
- Дышит слишком медленно, с паузами.
Новая коронавирусная инфекция у новорожденных в возрасте
В редакцию :
Вспышка коронавирусной болезни 2019 г. (COVID-19) быстро распространяется [1–8].31 января 2020 года Всемирная организация здравоохранения объявила COVID-19 чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение. К 13 марта 2020 года COVID-19 был подтвержден в 127 странах, при этом во всем мире зарегистрировано 145 166 случаев заболевания и 5428 смертей.
Сообщалось, что на ранней стадии эпидемии у пожилых людей выше вероятность инфицирования [1–8]. Впоследствии сообщалось об инфекциях у младенцев в возрасте до 1 года [8]. На сегодняшний день мало что известно об инфекции у новорожденных. Кроме того, данные о внутриматочной передаче очень скудны [9].В этом исследовании мы идентифицировали всех инфицированных новорожденных в Китае к 13 марта 2020 года и описали клинические особенности, лечение, исходы и потенциал внутриутробной передачи.
Для этого ретроспективного исследования мы выявили все неонатальные инфекции, вызванные вирусом COVID-19, SARS-CoV-2, в период с 8 декабря 2019 года по 13 марта 2020 года в Китае. Сводное число новых случаев инфицирования публикуется ежедневно Национальной комиссией здравоохранения Китая [10]. Мы систематически исследовали все 81 026 случаев, которые были лабораторно подтверждены к 13 марта 2020 года, как описано ранее [8].Короче говоря, мы получили сводные данные из центрального правительства и местных департаментов здравоохранения и провели скрининг новорожденных младше 28 дней. Были опрошены местные больницы, административные офисы и семьи пациентов с помощью средств связи по телефону или через Интернет. Это исследование было одобрено институциональным наблюдательным советом Школы медицинских наук Уханьского университета. Необходимость получения информированного согласия была отменена в рамках расследования вспышки заболевания в области общественного здравоохранения.
Данные о демографии, начале заболевания, диагнозе, лечении и исходах были собраны с использованием стандартных форм.Чтобы проанализировать потенциал внутриутробной передачи, были собраны данные о начале болезни матери (симптомы, время появления симптомов относительно родов), диагнозе, связи с Уханью (проживание или посещение Ухани или непосредственное общение с посетителями из Ухани), родах (способы доставки , уровень стационара, уровень защиты, гестационный возраст при родах) и контакт мать-ребенок (разлучение, кормление грудью).
Для выявления неонатальной инфекции во время госпитализации брали мазки из носоглотки или из анального канала.Количественная ПЦР в реальном времени использовалась согласно рекомендованному протоколу [11]. Антитела IgM / IgG не использовались в настоящем исследовании, потому что эта технология была разработана недавно и не получила широкого распространения на данном этапе.
Для матерей новорожденных использовалась компьютерная томография (КТ) для предварительного обследования. Аномальные результаты включали непрозрачность матового стекла и двустороннее пятнистое затемнение. Подозрение на инфекцию определялось как отклонение от нормы результатов компьютерной томографии в сочетании с типичными клиническими симптомами, включая жар, кашель, головную боль, боль в горле, одышку и выделение мокроты.Были собраны мазки из носоглотки для обнаружения нуклеиновой кислоты SARS-CoV-2. Подтверждение наличия инфекции у матери было основано на тестах на нуклеиновую кислоту.
На основе источников данных, которые мы использовали в этом ретроспективном исследовании, с помощью систематического и всестороннего поиска среди 81 026 подтвержденных случаев в Китае по состоянию на 13 марта 2020 года было выявлено четыре подтвержденных нуклеиновой кислотой неонатальной инфекции (таблица 1). Все четыре пациента госпитализированы. Трое были мужчинами. Возраст постановки диагноза колебался от 30 часов до 17 дней.
ТАБЛИЦА 1
Характеристики четырех госпитализированных подтвержденных нуклеиновой кислотой инфекций у новорожденных
У двух новорожденных была лихорадка, у одного была одышка, у одного был кашель, а у одного не было заметных симптомов. Заболевание началось в больнице у двух новорожденных и дома у двух новорожденных. Два новорожденных ребенка были изолированы, а двое не изолированы на момент начала болезни.
Обнаружение нуклеиновых кислот проводилось с использованием мазков из носоглотки для двух новорожденных и мазков из ануса для двух новорожденных.Все четверо новорожденных дали положительный результат на нуклеиновую кислоту SARS-CoV-2. КТ были выполнены у трех новорожденных. У всех наблюдалась повышенная маркировка легких. Время между датами поступления / появления симптомов и постановкой диагноза составляло 0–2 дня.
Поддерживающая терапия была предоставлена всем четырем новорожденным. Ни один не требовал интенсивной терапии или искусственной вентиляции легких. Ни у кого не было серьезных осложнений. Считалось, что трое новорожденных выздоровели после двух последовательных отрицательных тестов на нуклеиновую кислоту (с интервалом ≥24 ч).Их пребывание в больнице составило 16, 23 и 30 дней соответственно.
Матери всех четырех новорожденных детей были диагностированы как инфицированные. У трех матерей симптомы проявились до родов и у одной — после родов. Наиболее частыми симптомами у матерей были лихорадка, за которой следовали кашель, снижение аппетита и непереносимость масел. Компьютерная томография была проведена всем четырем матерям, у трех — до родов, а у одной — после родов. У всех матерей были обнаружены отклонения от нормы. Обнаружение нуклеиновых кислот проводилось у всех четырех матерей, у трех после родов и у одной перед родами.Все четыре матери дали положительный результат на нуклеиновую кислоту SARS-CoV-2.
Кесарево сечение было выполнено всем четырем матерям, трем в больницах уровня III и одной в больнице уровня II. Уровень защиты был III для трех матерей и II для одной матери. Трое новорожденных были разлучены с матерями сразу после рождения и не находились на грудном вскармливании; один новорожденный не был отделен от матери и находился на грудном вскармливании в течение 16 дней до появления симптомов.
На основании этих данных, симптомы неонатальной инфекции, как правило, незначительны по сравнению со взрослыми пациентами.У новорожденных не наблюдалось серьезных клинических осложнений или летальных исходов по сравнению с уровнем летальности около 4–15% у взрослых [1–4]. Обратите внимание, что у младенцев в возрасте до 1 года также наблюдались легкие симптомы или их отсутствие и редко — тяжелые осложнения [8]. С одной стороны, обнадеживает тот факт, что у новорожденных и младенцев появляются легкие симптомы, хотя по-прежнему необходим тщательный мониторинг клинического ухудшения. С другой стороны, легкие симптомы или их отсутствие у самых молодых затрудняют обнаружение и предотвращение дальнейшей передачи этого вируса среди населения в целом.
Число неонатальных инфекций составило четыре, по сравнению с ранее зарегистрированными девятью инфекциями у младенцев в возрасте от 28 дней до 1 года [8]. Пропорционально частота инфицирования у новорожденных может быть выше, чем у младенцев. Различная вероятность заражения может частично объяснять разную частоту инфицирования, но разные пути передачи могут быть другим объяснением. Вертикальная передача может быть дополнительным путем заражения новорожденных, но невозможна для младенцев, хотя предыдущее исследование шести беременных женщин не нашло прямых доказательств [9].
Результаты настоящего исследования указывают на возможность внутриутробной передачи инфекции. Все четверо новорожденных были доставлены посредством кесарева сечения, и трое находились под защитой III уровня. Возможность передачи инфекции от матери ребенку во время родов через естественные родовые пути была исключена. За исключением пациента 2, контактировавшего с инфицированным посетителем, все остальные три новорожденных находились в изоляции, когда появились симптомы. У этих трех новорожденных не было контакта матери и ребенка или кормления грудью.Время между рождением и постановкой диагноза было ограничено — от 30 часов до 5 дней. В совокупности вероятность заражения другими путями, кроме внутриутробной передачи, считается низкой. Однако есть и другие объяснения неонатальных инфекций. Во-первых, нельзя полностью исключить возможность внутрибольничного заражения. Во-вторых, мазки из носоглотки и ануса не могут напрямую указывать на внутриутробную инфекцию, а вирусные частицы не были обнаружены в околоплодных водах или пуповинной крови у шести пациентов [9].В-третьих, количество неонатальных инфекций невелико, хотя возможно, что выявление случаев было неполным из-за отсутствия идентифицирующей информации для новорожденных. В-четвертых, SARS-CoV, другой коронавирус с аналогичной последовательностью генома [12], не передается вертикально [13, 14]. Требуются дальнейшие исследования.
Настоящее исследование имеет ограничения. Во-первых, хотя был проведен систематический и всесторонний поиск инфекции SARS-CoV-2 у новорожденных младше 28 дней, возможна неполная идентификация случаев.Во-вторых, настоящее исследование выявило в основном пациентов с симптомами. Однако существует бессимптомная инфекция COVID-19 [8, 15].

 М.: Практическая медицина, 2008. 256 с.
М.: Практическая медицина, 2008. 256 с. Crit. Care Med. 2003. P.190–195.
Crit. Care Med. 2003. P.190–195. 2014. Vol. 65(2). P.184–191.
2014. Vol. 65(2). P.184–191. J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185.
J. Immunorehabilit. 2000. Vol. 2, № 1. P.175–185.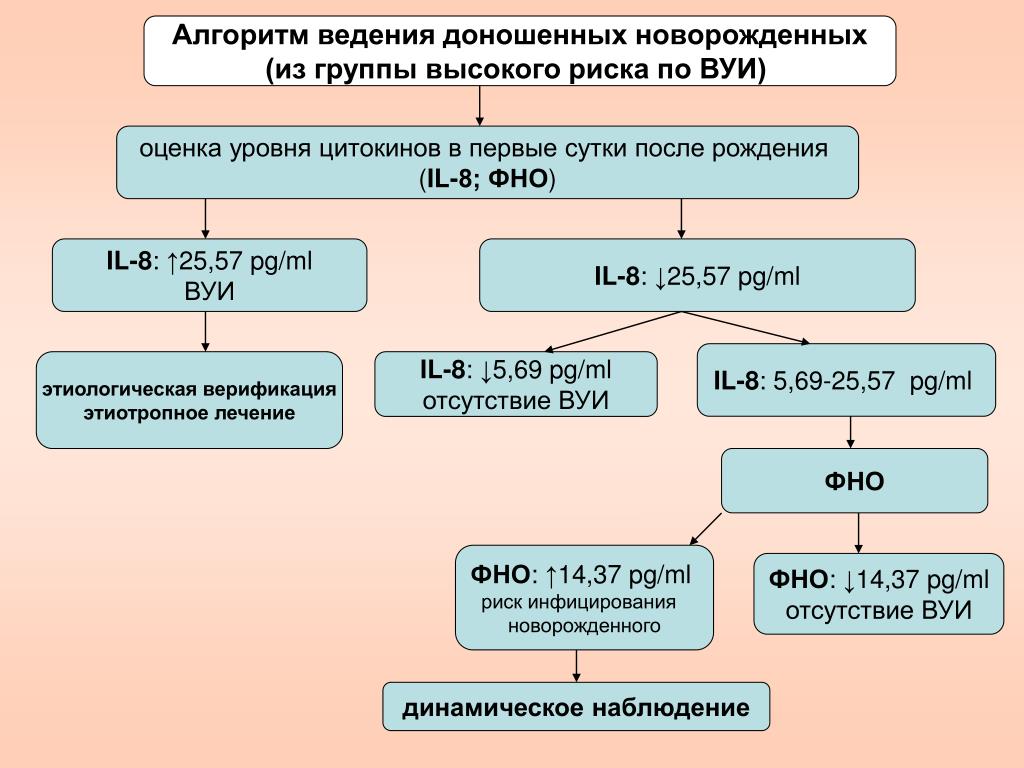 2009. № 1. С. 80–88.
2009. № 1. С. 80–88. )
) )
)