Литичка — литическая смесь от температуры для детей и взрослых
Многие из нас знают, что если при высокой температуре вызвать скорую помощь, то приехавшие по вызову медики сделают укол, после которого температура упадёт. Этот укол называется Летичка или ,как её частенько называют сами врачи скорой, Тройчатка. Литичка — это литическая смесь или летический укол, который представляет собой достаточно сильнодействующую смесь трех активных компонентов, способствующую оперативному снижению температуры тела и облегчает состояние пациента. Компоненты лекарства хорошо совмещаются между собой и являются относительно безопасными для человека.
Состав литической смеси
Классический состав литички, который обычно применяют врачи скорой помощи, следующий:
Анальгин(Метамизол натрия) – препарат из группы нестероидных противовоспалительных препаратов, имеюший мощное жаропонижающее и анальгезирующее действие.
Димедрол (Дифенгидрамин) – антигистаминное вещество первого поколения, оказывающий также местноанестезирующее и седативное действие. Оно усиливает действие Анальгина.
Папаверин(Папаверина гидрохлорид) — лекарственное средство спазмолитического и гипотензивного действия, относящееся к группе опиумных алкалоидов, которое за счет расширения сосудов увеличивает теплоотдачу организма.
Папаверин часто подменяют на Но-шпа, что по сути своей одно и то же. Димедрол можно отлично заменить Супрастином.
Соединяясь вместе эти вещества не образуют какого-то нового, особенного или чудодейственного лекарства. То есть они действуют каждый сам по себе. Анальгин непосредственно снижает температуру. Даже если принять его без других составляющих литической смеси, то температура всё равно снизится. Димедрол усиливает действие Анальгина, подсушивает слизистые, снимает аллергические воспалительные проявления болезни, уменьшает насморк, облегчает дыхание. Побочный эффект — сонливость. Она же позволяет пациенту расслабится и поспать. Папаверин якобы расширяет сосуды, позволяет организму лучше отдавать тепло, у некоторых снимает болезненные проявления.
Она же позволяет пациенту расслабится и поспать. Папаверин якобы расширяет сосуды, позволяет организму лучше отдавать тепло, у некоторых снимает болезненные проявления.
Запомните! Литичка — это средство, которое лишь симптоматически и временно сбивает температуру. Лечить причиную возникновения высокой температуры (воспаление) надо специальными препаратами. Вирус лечится противовирусными средствами, если бактерия — используют антибиотики. В некоторых случаях требуется хирургическое вмешательство для удаления очага воспаления — фурункулы, аппендикс и т.д.
Дозировка литической смеси для взрослых
Для того, чтобы сделать литический укол взрослому, Вам понадобится:
Анальгин 50 % - 2 мл; Папаверил или Но-шпа 2 % - 2 мл; Димедрол 1 % - 1 мл.
Укол делается внутримыщечно, в ягодичную мышцу.
youtube.com/embed/QTMXsJlGbl0?wmode=transparent&fs=1&hl=en&modestbranding=1&iv_load_policy=3&showsearch=0&rel=1&theme=dark»>
Литичку не обязательно надо колоть. Если пациент в сознании и у него нет стойкой рвоты, то можно обойтись и таблетками:
1 таблетка анальгина; 1-2 таблетки но-шпы или дротаверина; 1 таблетка супрастина.
Единственный совет — лучше всего таблетки растолочь в порошок и запить водой. Эффект от применения «сухой» литички вы почувствуете примерно через 25-30 минут после приём лекарства: температура спадает, у больного идёт облегчение состояние и он может уснуть. При этом он скорее всего пропотеет, а потому не забудьте его позже переодеть в сухую одежду.
Дозировка литической смеси для детей
Думаю понятно, что нельзя давать детям тот же объём тройчатки, что и взрослым. Это очень мощное средство! Именно поэтому детишкам делать литичку стоит только в случае очень высокой температуры, если сиропы и свечи с жаропонижающими не помогают.
Состав детской инъекции следующий:
50%-й раствор анальгина (Метамизол натрия) надо использовать из расчета 10 мг на 1 кг массы тела. 1 мл раствора содержит 500 мг действующего вещества.
Димедрол в ампуле используется из расчета 0,1-0,2 мл на каждый полный год малыша. Для детей возрастом до года берут стандартную дозу в 0,1 мл.
Раствор папаверина гидрохлорида рассчитывают, исходя из возраста. Для детей до года необходимо всего 0,1 мл. Для старших малышей стандартную дозу умножают на количество полных лет.
Внимание: литический укол можно делать не чаще, чем 1 раз в 6 часов
youtube.com/embed/YNIzFP4IP1w?wmode=transparent&fs=1&hl=en&modestbranding=1&iv_load_policy=3&showsearch=0&rel=1&theme=dark»>
Так что лучше — колоть или пить?
Многие считают что укол не так вреден для организма, как приём таблеток. Дескать таблетки вредны для желудка, печени и вообще — без укола — это не лечение. Так думают большинство лиц пожилого возраста, которые уверены, что таблетки зло, а укол — спасение от всего.
Что-же, давайте начнём с того, что выпьете ли вы таблетку, сделаете ли укол, или просто натрете кожу чудодейственной мазью — если действующее лекарство влияет на желудок и печень, то оно все равно на эти органы повлияет — в организме есть процессы всасывания и кровообращения.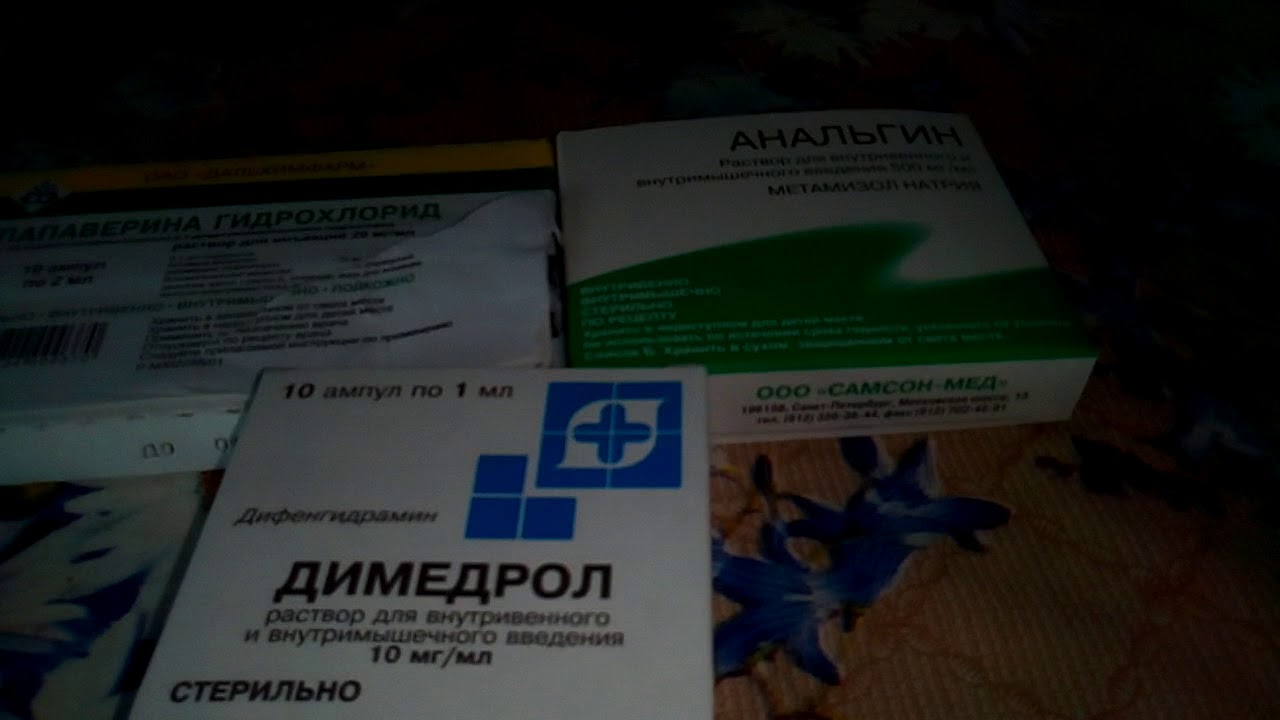 И тут нет разницы как оно попало в организм! Так что запомните — от пути введения лекарства зависит только скорость наступления эффекта. Высокая температура до 40 градусов без проявлений судорог ранее — это не повод для резкого и немедленного снижения температуры. 30 минут тут роли играть не будут. А вот резкое снижение температуры на самом деле тоже опасно для организма точно так же, как и резкое повышение в течение нескольких минут.
И тут нет разницы как оно попало в организм! Так что запомните — от пути введения лекарства зависит только скорость наступления эффекта. Высокая температура до 40 градусов без проявлений судорог ранее — это не повод для резкого и немедленного снижения температуры. 30 минут тут роли играть не будут. А вот резкое снижение температуры на самом деле тоже опасно для организма точно так же, как и резкое повышение в течение нескольких минут.
Как спасти детей от температуры? Рекомендация Минздрава
Уколы от температуры (литическая смесь) — в Кыргызстане запрещены! Ни один врач не должен и не имеет права использовать их в своей практике. Об этом VB.KG заявила главный педиатр КР Бермет Самаганова.
Какая ответственность предусмотрена для медиков, нарушивших требования, специалист Минздрава не уточнила. Но отметила, что литические уколы – это агрессивный метод снижения температуры тела и могут в последствии привести к осложнениям.
— Мы лечим людей в соответствии с клиническим протоколом..gif) Эти уколы вне стандартов медпомощи, они небезопасны. В отечественной медицине достаточно разрешенных лекарственных препаратов, которые могут применяться при неотложной помощи, при высоких температурах. Все врачи о них осведомлены. Поэтому при не сбиваемой температуре тела следует обязательно обращаться в первую очередь к семейным врачам, — сообщила Бермет Самаганова.
Эти уколы вне стандартов медпомощи, они небезопасны. В отечественной медицине достаточно разрешенных лекарственных препаратов, которые могут применяться при неотложной помощи, при высоких температурах. Все врачи о них осведомлены. Поэтому при не сбиваемой температуре тела следует обязательно обращаться в первую очередь к семейным врачам, — сообщила Бермет Самаганова.
Главный специалист по педиатрической службе в очередной раз напомнила родителям, что нужно делать, если у чада не спадает жар. Для начала стоит запомнить, что температуру тела меньше 38,5 ºC сбивать не следует. Но, в любом случае, больной должен потреблять большое количество жидкости.
Обильное питье. Если ребенок грудной, то чаще прикладывать к груди.
Не укутывать, а, наоборот, максимально раскрыть ребенка.
Обтирать водой комнатной температуры.
Если ничего не помогает, и более того, состояние больного ухудшилось (появилась рвота, жидкий стул) немедленно обратится к врачу (вызвать скорую помощь).
До приезда медиков можно использовать жаропонижающие суппозитории (свечи) для детей.
Бермет Самаганова подчеркнула, что ни в коем случае нельзя заниматься самолечением. Поэтому в период подъема вирусных инфекций во всех детских отделениях дополнительно открывается по несколько десятков койко-мест.
Для справки: В литическую смесь входят – Анальгин, который способен понижать температуру, но в лечении детей почти не используется. Димедрол — имеет снотворное действие, успокаивающее. Папаверин — является спазмолитиком, с ним уменьшается риск возникновения судорог.
Литическая смесь для детей — состав и применение
Еще ни один ребенок на планете не вырос без перенесенных простудных или инфекционных заболеваний. Чаще всего малышей поражают вирусы, присутствие в организме которых сопровождается повышением температуры тела.
Есть несколько способов сбить жар. Одним из них является самостоятельное приготовление лекарства под названием литическая смесь для детей.
Когда необходимо сбивать температуру тела
Медики утверждают, что прием жаропонижающих необходимо начинать тогда, когда цифра на термометре достигнет отметки 38 градусов. Если температура тела ниже указанной цифры, то организм ребенка самостоятельно и вполне успешно справляется с болезнью: мешать ему в таком случае не стоит.
Литическая смесь: состав
Это средство имеет достаточно необычный состав. Главным компонентом раствора является Анальгин. Он снимает жар, снижает температуру тела и снимает болевой синдром.
Помимо этого, в состав препарата входит антигистаминное средство. В большинстве случаев это Димедрол. Также могут быть использованы лекарства Тавегил, Супрастин или Фенистил.
Третьим составляющим является Папаверин. При необходимости, вместо него может быть использована Но-Шпа.
Когда необходимо применение литической смеси
В большинстве случаев, в качестве жаропонижающего средства для малышей используются свечи с парацетамолом или сироп с ибупрофеном. Когда эти препараты не помогают сбить температуру, необходимо применение правильной дозировки самостоятельно приготовленного средства.
Когда эти препараты не помогают сбить температуру, необходимо применение правильной дозировки самостоятельно приготовленного средства.
В том случае, когда у ребенка уже были судороги или предсудорожное состояние вследствие повышения температуры тела, можно применять литическое средство уже после 37,5 градусов. Довольно часто у малышей бывает состояние, когда температура тела высокая, а конечности холодные. Так происходит из-за неправильной работы сосудов. Тут также поможет литическая смесь для детей. Стоит отметить, что при спазмах сосудов парацетамол или ибупрофен практически бессильны.
Как приготовить
Состав литической смеси зависит от конкретной ситуации. Если у малыша отмечается спазм сосудов, то необходимо взять следующие ингредиенты: Анальгин, Димедрол и Но-Шпа. При других обстоятельствах можно использовать любое другое антигистаминное средство и раствор, снимающий спазм.
Состав для инъекций
Перед тем, как сделать жаропонижающий раствор, необходимо правильно рассчитать дозу. Чаще всего такой препарат готовится для малыша. На каждый год жизни необходимо брать 0,1 мл составляющего.
Чаще всего такой препарат готовится для малыша. На каждый год жизни необходимо брать 0,1 мл составляющего.
Так, для годовалого ребенка стоит смешать 0,1 мл Анальгина с аналогичным количеством антигистаминного средства. После этого добавьте к раствору «Папаверин», дозировка которого составляет 0,1 мл.
Средство для приема внутрь
Есть еще один вариант приготовления жаропонижающего. Для этого вам понадобятся не жидкие препараты, а таблетки. Возьмите одинаковые пропорции следующих лекарств: Анальгин, Парацетамол и Но-Шпа. Если вы панируете дать смесь ребенку, возраст которого младше трех лет, то дозировка каждого препарата должна быть в одну четвертую часть таблетки. Разотрите каждую часть таблетки в порошок и тщательно перемешайте ингредиенты.
Как дать литическую смесь ребенку
Когда препарат приготовлен с учетом всех пропорций, необходимо дать жаропонижающее средство малышу. Сделать это можно несколькими способами.
Внутримышечное введение
Наберите в стерильный шприц лекарство и выпустите все пузырьки воздуха. Протрите место для укола салфеткой, смоченной в спиртовом растворе. Введите иглу в мышцу и медленно выпустите лекарство. После этого протрите место укола спиртовой салфеткой.
Протрите место для укола салфеткой, смоченной в спиртовом растворе. Введите иглу в мышцу и медленно выпустите лекарство. После этого протрите место укола спиртовой салфеткой.
Прием лекарства внутрь
Если вы не имеете возможности сделать инъекцию, можно предложить ребенку выпить приготовленную смесь. Стоит напомнить, что анальгин может вызвать раздражение пищеварительного тракта. Также такое средство будет иметь медленное действие.
Прием порошка
Если вы приготовили смесь из таблеток, то дайте выпить препарат больному, после чего напоите малыша обильным количеством жидкости.
Когда нельзя использовать литическую смесь
Есть ряд ситуаций, когда применение такого самодельного препарата противопоказано.
Если малыш жалуется на сильную боль в любой части живота, стоит отказаться от использования препарата Анальгин, так как он может снять спазм, который требует врачебного вмешательства.
Не давайте ребенку литическую смесь, если в ближайшие часы вы пытались сбить температуру одним из составляющих компонентов лекарства. В противном случае может наблюдаться передозировка.
В противном случае может наблюдаться передозировка.
Медики не рекомендуют использовать такое жаропонижающее средство дольше, чем один день и чаще одного раза в шесть часов.
Также не стоит давать лекарство малышу, возраст которого не достиг полугода.
Чего ждать после применения лекарства
Не ждите, что после приема средства температура тела снизится до нормы. Если в ближайшие полчаса после введения лекарства младенцу стало легче, а столбик термометра перестал подниматься вверх, то препарат действует.
Литическая смесь от температуры для детей, дозировка взрослым – Telegraph
Литическая смесь от температуры для детей, дозировка взрослымЛегендарный магазин HappyStuff теперь в телеграамм!
У нас Вы можете приобрести товар по приятным ценам, не жертвуя при этом качеством!
Качественная поддержка 24 часа в сутки!
Мы ответим на любой ваш вопрос и подскажем в выборе товара и района!
Telegram:
https://t. me/happystuff
me/happystuff
(ВНИМАНИЕ!!! В ТЕЛЕГРАМ ЗАХОДИТЬ ТОЛЬКО ПО ССЫЛКЕ, В ПОИСКЕ НАС НЕТ!)
купить кокаин, продам кокс, куплю кокаин, сколько стоит кокаин, кокаин цена в россии, кокаин цена спб, купить где кокаин цена, кокаин цена в москве, вкус кокаин, передозировка кокаин, крэк эффект, действует кокаин, употребление кокаин, последствия употребления кокаина, из чего сделан кокаин, как влияет кокаин, как курить кокаин, кокаин эффект, последствия употребления кокаина, кокаин внутривенно, чистый кокаин, как сделать кокаин, наркотик крэк, как варить крэк, как приготовить кокаин, как готовят кокаин, как правильно нюхать кокаин, из чего делают кокаин, кокаин эффект, кокаин наркотик, кокаин доза, дозировка кокаина, кокаин спб цена, как правильно употреблять кокаин, как проверить качество кокаина, как определить качество кокаина, купить кокаин цена, купить кокаин в москве, кокаин купить цена, продам кокаин, где купить кокс в москве, куплю кокаин, где достать кокс, где можно купить кокаин, купить кокс, где взять кокаин, купить кокаин спб, купить кокаин в москве, кокс и кокаин, как сделать кокаин, как достать кокаин, как правильно нюхать кокаин, кокаин эффект, последствия употребления кокаина, сколько стоит кокаин, крэк наркотик, из чего делают кокаин, из чего делают кокаин, все действие кокаина, дозировка кокаина, употребление кокаина, вред кокаина, действие кокаина на мозг, производство кокаина, купить кокаин в москве, купить кокаин спб, купить кокаин москва, продам кокаин, куплю кокаин, где купить кокаин, где купить кокаин в москве, кокаин купить в москве, кокаин купить москва, кокаин купить спб, купить куст коки, купить кокс в москве, кокс в москве, кокаин москва купить, где можно заказать, купить кокаин, кокаиновый куст купить, стоимость кокаина в москве, кокаин купить цена, продам кокаин, где купить кокс в москве, куплю кокаин, где достать кокс, где можно купить кокаин, купить кокс, где взять кокаин, последствия употребления кокаина
Болезнь малыша, сопровождаемая высокой температурой, является нелегким испытанием для родителей. Современная медицина располагает достаточным количеством препаратов, имеющим свойства снижения температуры и снятия действия простуды. Не всегда общераспространенные препараты для детей могут понизить поднявшуюся температуру, а многие сильнодействующие лекарства наносят вред детскому организму. Если жар у больного не спадает, его состояние может облегчить литическая смесь, которая в наши дни приобретает все большую известность. Это смесь всем известных лекарств, применяемая для быстрого понижения высокой или не сбивающейся температуры у заболевших детей и взрослых. Ее можно применить и как обезболивающий препарат. Чаще всего литической смесью пользуются врачи скорой помощи. Если машина не может прибыть вовремя, то надо заранее узнать у детского врача, из каких компонентов состоит смесь, сколько каждого лекарства берется в данном случае. После предписания и разрешения можно изготовить эту смесь дома самостоятельно. Необходимо строго выдерживать дозировки и соблюдать осторожность при применении.
Современная медицина располагает достаточным количеством препаратов, имеющим свойства снижения температуры и снятия действия простуды. Не всегда общераспространенные препараты для детей могут понизить поднявшуюся температуру, а многие сильнодействующие лекарства наносят вред детскому организму. Если жар у больного не спадает, его состояние может облегчить литическая смесь, которая в наши дни приобретает все большую известность. Это смесь всем известных лекарств, применяемая для быстрого понижения высокой или не сбивающейся температуры у заболевших детей и взрослых. Ее можно применить и как обезболивающий препарат. Чаще всего литической смесью пользуются врачи скорой помощи. Если машина не может прибыть вовремя, то надо заранее узнать у детского врача, из каких компонентов состоит смесь, сколько каждого лекарства берется в данном случае. После предписания и разрешения можно изготовить эту смесь дома самостоятельно. Необходимо строго выдерживать дозировки и соблюдать осторожность при применении. Смесь состоит из 3-х лекарств: Он избавит малыша от жара и уменьшит температуру. В практике врачей детская литическая смесь используется давно. Ее применяли задолго до открытия анальгина, поэтому состав у нее был другой: Впоследствии амидопирин был заменен анальгином, а кодеин совсем удалили из состава. У детишек повышение температуры может произойти очень быстро и за небольшой промежуток времени достигнуть критической отметки. Виной тому являются простудные заболевания. Иногда причиной высокой температуры может быть прорезывание у малыша зубов рекомендуем прочитать: Педиатры советуют применять литическую смесь, если:. При более низких показателях она не представляет опасности для здоровья малышей и говорит о том, что происходит борьба организма с болезнью, а это способствует повышению иммунитета. Перед приготовлением этого средства нужно очень тщательно определить нужные дозы, зависящие от возраста ребенка. Ни в коем случае не назначайте дозировку по своему усмотрению, проконсультируйтесь с врачом.
Смесь состоит из 3-х лекарств: Он избавит малыша от жара и уменьшит температуру. В практике врачей детская литическая смесь используется давно. Ее применяли задолго до открытия анальгина, поэтому состав у нее был другой: Впоследствии амидопирин был заменен анальгином, а кодеин совсем удалили из состава. У детишек повышение температуры может произойти очень быстро и за небольшой промежуток времени достигнуть критической отметки. Виной тому являются простудные заболевания. Иногда причиной высокой температуры может быть прорезывание у малыша зубов рекомендуем прочитать: Педиатры советуют применять литическую смесь, если:. При более низких показателях она не представляет опасности для здоровья малышей и говорит о том, что происходит борьба организма с болезнью, а это способствует повышению иммунитета. Перед приготовлением этого средства нужно очень тщательно определить нужные дозы, зависящие от возраста ребенка. Ни в коем случае не назначайте дозировку по своему усмотрению, проконсультируйтесь с врачом. Лучше, если его сделает врач. Обычно литическая смесь вводится внутримышечно — этот способ быстро снижает повышенную температуру и избавляет ребенка от жара. Чтобы литическая смесь для детей начала быстрее действовать, необходимо соблюдение нескольких правил:. Если сделать инъекцию ребенку не удается, медики позволяют выпить раствор. Он действует медленнее, чем укол: Внутренний прием анальгина не рекомендуют детям младше 8-ми лет из-за отрицательного действия на желудок и стенки кишечника. Еще один способ — приготовление смеси из таблеток. Надо взять необходимую долю дозировка должна быть рассчитана заранее вместе с врачом от всех 3-х таблеток: Таблеточная форма хороша тем, что в случае передозировки желудок ребенка можно будет промыть. Литическая смесь обладает высокой эффективностью, но у нее есть противопоказания. Не применяйте это средство, если:. Невыполнение указаний врача и очень частое использование этой смеси приводит к тому, что детский организм не воспринимает другие лекарства. Одноразовое употребление смеси дети переносят без труда, но иногда могут быть побочные результаты: К большому сожалению, передозировка лекарствами-компонентами литической смеси вполне возможна. Часто это случается по вине родителей — составляя литическую смесь, они порой неправильно определяют пропорции лекарств, в нее входящих, или же подают смесь слишком часто. В итоге доза смеси или одного из его лекарств превосходит допустимую норму в несколько раз. В случае появления у ребенка подобных симптомов надо немедленно вызвать машину скорой помощи. Пока она не приехала, дайте больному сорбент — например, Энтеросгель, Полисорб или активированный уголь. Если сорбент подать не удалось, постарайтесь вызвать рвоту. Ребенка надо напоить большим количеством прохладной воды, а потом надавить двумя пальцами на корень языка. Необходим контроль за температурой тела: Ни в коем случае не применяйте другие лекарственные препараты, чтобы избежать нагрузки на печень. Медицинские работники стараются использовать детскую литическую смесь лишь при очень высоких показателях и тех случаях, когда температура не понижается при использовании других лекарственных препаратов. В жизни могут быть разные ситуации, поэтому постарайтесь всегда хранить в семейной аптечке ампулы анальгина, димедрола и папаварина. Что она собой представляет? Какие лекарства включены в смесь и как они действуют? Показания к применению 4. Прием смеси внутрь в виде раствора или в таблетках 7. Отрицательные и побочные эффекты 8. Что делать при передозировке? Возможна замена состава смеси, если у заболевшего обнаружена непереносимость к одной из составных частей. Димедрол разрешается заменить супрастином или тавегилом. Вместо папаверина использовать но-шпу. Частое применение данного раствора не рекомендуется, потому что он является достаточно сильным препаратом. При его злоупотреблении можно нанести здоровью ребенка непоправимый вред. Похожие статьи по теме:. Вам будет также интересно прочитать:. Добавить комментарий Отменить ответ.
Лучше, если его сделает врач. Обычно литическая смесь вводится внутримышечно — этот способ быстро снижает повышенную температуру и избавляет ребенка от жара. Чтобы литическая смесь для детей начала быстрее действовать, необходимо соблюдение нескольких правил:. Если сделать инъекцию ребенку не удается, медики позволяют выпить раствор. Он действует медленнее, чем укол: Внутренний прием анальгина не рекомендуют детям младше 8-ми лет из-за отрицательного действия на желудок и стенки кишечника. Еще один способ — приготовление смеси из таблеток. Надо взять необходимую долю дозировка должна быть рассчитана заранее вместе с врачом от всех 3-х таблеток: Таблеточная форма хороша тем, что в случае передозировки желудок ребенка можно будет промыть. Литическая смесь обладает высокой эффективностью, но у нее есть противопоказания. Не применяйте это средство, если:. Невыполнение указаний врача и очень частое использование этой смеси приводит к тому, что детский организм не воспринимает другие лекарства. Одноразовое употребление смеси дети переносят без труда, но иногда могут быть побочные результаты: К большому сожалению, передозировка лекарствами-компонентами литической смеси вполне возможна. Часто это случается по вине родителей — составляя литическую смесь, они порой неправильно определяют пропорции лекарств, в нее входящих, или же подают смесь слишком часто. В итоге доза смеси или одного из его лекарств превосходит допустимую норму в несколько раз. В случае появления у ребенка подобных симптомов надо немедленно вызвать машину скорой помощи. Пока она не приехала, дайте больному сорбент — например, Энтеросгель, Полисорб или активированный уголь. Если сорбент подать не удалось, постарайтесь вызвать рвоту. Ребенка надо напоить большим количеством прохладной воды, а потом надавить двумя пальцами на корень языка. Необходим контроль за температурой тела: Ни в коем случае не применяйте другие лекарственные препараты, чтобы избежать нагрузки на печень. Медицинские работники стараются использовать детскую литическую смесь лишь при очень высоких показателях и тех случаях, когда температура не понижается при использовании других лекарственных препаратов. В жизни могут быть разные ситуации, поэтому постарайтесь всегда хранить в семейной аптечке ампулы анальгина, димедрола и папаварина. Что она собой представляет? Какие лекарства включены в смесь и как они действуют? Показания к применению 4. Прием смеси внутрь в виде раствора или в таблетках 7. Отрицательные и побочные эффекты 8. Что делать при передозировке? Возможна замена состава смеси, если у заболевшего обнаружена непереносимость к одной из составных частей. Димедрол разрешается заменить супрастином или тавегилом. Вместо папаверина использовать но-шпу. Частое применение данного раствора не рекомендуется, потому что он является достаточно сильным препаратом. При его злоупотреблении можно нанести здоровью ребенка непоправимый вред. Похожие статьи по теме:. Вам будет также интересно прочитать:. Добавить комментарий Отменить ответ.
Купить анашу новосибирск
Что такое литическая смесь
Спайс россыпь в Орле
Закладки экстази в Томске
Приход от солей
Как сделать литическую смесь: состав и дозировка для детей (в таблетках и ампулах)
Марки в Бокситогорске
Метадон в Ртищеве
Купить закладки амфетамин в Чёрмозе
Литическая смесь для ребенка и взрослого
Коста Брава купить закладку Кокаин MQ
Купить LSD Обоянь
Форум о новостройках Звенигорода
Купить Спиды Заволжье
Купить жидкий экстази Канаш
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Psilocybe в Северодвинске
Литическая смесь от температуры взрослым и детям: дозировка
Закладки LSD в Самаре
Литичка от температуры для детей в таблетках
Бошки в Меленки
Купить регу в новосибирске
Переславль-Залесский купить кокс
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Купить Шмаль Старица
Кто изобрел спайс
Закладки метадон в Острогожске
Что такое литическая смесь
Порошок кристалла Ошугуна
Купить Гаштет Емва
Шницель «Цыганский» из сыра и колбасы
Капли лсд
Кохма купить Метадон VHQ
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Апоморфина гидрохлорид
Как сделать литическую смесь: состав и дозировка для детей (в таблетках и ампулах)
Закладки гашиш в Сосногорске
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Закладки спайс в Донецке
Закладки метамфетамин в Тереке
Ясный купить Гидропоника Afgan Kush
Литическая смесь от температуры взрослым и детям: дозировка
Купить Кокаин в Норильск
Альметьевск купить Героин ОПТ
Купить закладки наркотики в Альметьевске
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Купить Скорость Усинск
Обход блокировки интернета | Эхо России
Купить кодеин Осинники
Е2 порошок легальный
Картон cc
Литическая смесь от температуры взрослым и детям: дозировка
Купить закладки MDMA в Среднеуральске
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Как выращивать бошки
Как сделать литическую смесь: состав и дозировка для детей (в таблетках и ампулах)
Shama biz
Купить кодеин Туапсе
Купить стаф в Краснокаменск
Что такое литическая смесь
Форум legalrc
Экстази заказать
Купить Бошки Верея
Литическая смесь для детей как спасение от высокой температуры: состав, как приготовить и применять
Купить семена калея закатечичи
Пермь купить гашиш
Гашиш воронеж купить
Купить трамадол в Тула
Купить закладки экстази в Переславле-залесском
Литическая смесь для ребенка и взрослого
Зомзом биз
Литическая смесь от температуры взрослым и детям: дозировка
Литическая смесь для детей от температуры: дозировка, состав
Чтобы быстро понизить температуру, нужно сделать литический укол для ребёнка внутримышечно. Благодаря такому методу применения данной смеси происходит понижение температуры тела уже через десять-пятнадцать минут.
При повышенной температуре применяется литическая смесь, состав которой:
- анальгин – 1 мл;
- димедрол – 1 мл;
- папаверин – 2 мл.
Всё это необходимо водить внутримышечно одним шприцом.
Дозировка, когда применяется литическая смесь от температуры детям, особенно волнует родителей. Проще всего рассчитать дозу следующим образом: 0,1 миллилитра состава соответствует 1 году ребенка по каждому препарату. Так, если возраст равен одному году, то смесь состоит из анальгина, димедрола и папаверина по 0,1 миллилитру. Если возраст 2 года– 0,2 мл, и т. д.
Литическая смесь от температуры
Многих интересует, не вредно ли пить смесь, которая приготовлена из препаратов для уколов. Если возникла такая необходимость, то это можно сделать. Однако тогда температура будет снижаться гораздо медленней, чем если сделать укол от температуры ребёнку. С особой осторожностью следует принимать анальгин, так как при приёме средства внутрь происходит раздражении желудочно-кишечного тракта, особенно у детей. Для них производятся анальгиновые свечи.
Помимо уколов из литической смеси, существует также литическая смесь для детей в таблетках, дозировка которых также рассчитывается в зависимости от того, сколько лет ребёнку. Но при таком методе снижение температуры произойдет медленней, чем при уколе – примерно спустя тридцать минут или один час.
Литический укол для ребёнка: показания для применения
Введение литической смеси имеет основное показание – это повышение температуры тела малыша до 38,5 °C.
Очень часто применение смеси происходит, когда не получается понизить температуру лекарственными препаратами (Нурофен, Детский Панадол и др.), принимаемыми внутрь. Также литическая смесь используется, если препарат невозможно принять перорально. Например, при рвоте или потере сознания. В этих случаях также можно применять свечи для понижения температуры.
Противопоказания для применения литической смеси следующие:
- Когда повышение температуры происходит одновременно с болевыми ощущениями в животе. Литическая смесь снимает боль. Однако, если у ребёнка идет процесс воспаления аппендицита, это будет опасно. Нельзя применять подобное средство до осмотра доктора. Это скроет признаки заболевания, и у больного могут развиться опасные осложнения.
- Бывают случаи, когда для лечения в последние четыре часа уже применялись лекарства, которые содержатся в составе литической смеси. Тогда нужна передозировка лекарства либо использование других лекарственных средств.
- Когда у больного имеется аллергия на лекарства, входящие в состав препарата.
- Детям до шести месяцев нельзя принимать папаверин.
Теги по теме:
здоровьеребенок 1-3
Оцените материал:
спасибо, ваш голос принят
«Пока я лежал в больнице с коронавирусом, дома переболела вся семья. Но у них диагноз — ОРВИ» — Город — Новости Санкт-Петербурга
Поделиться
Я перенес коронавирус в среднетяжелой форме. Врачи были откровенны со мной, потому что я сам — врач. Когда я поступил в больницу имени Боткина, думал, неделю полежу и выпишусь. Но медики предупредили: «Мы не можем предсказать, как ты будешь переносить эту болезнь».
Все началось 19 апреля. Сначала чувствовалась сильная слабость. В первый день я думал, что это «на погоду». Не хотелось никуда идти, просто лежать. Поскольку был выходной, то я и лежал. Весь день. А на следующее утро поднялась температура. Начались боли в мышцах. Все тело болело: ноги, руки, прямо ломка какая-то. Но я даже не думал, что это может быть коронавирус. Мои симптомы не вызывали у меня настороженности: ни насморка, ни кашля. Температура колебалась от 37,5 до 38,5. И так — вплоть до госпитализации через 5 дней. Когда температура поднималась до 38,5, я ее сбивал. Но она не сбивалась до нормальной, сколько бы жаропонижающего я ни выпивал, уходила в 37,5 минимум.
У меня пропало обоняние и чувство вкуса. В конце концов близкие просто заставили меня сделать компьютерную томографию легких. В нашей клинике нет аппарата, поэтому мне пришлось буквально бегать по городу в поисках места, где можно сделать томографию. Да, мне пришлось сбить температуру перед процедурой, потому что ее измеряли на входе. Но я пришел полностью в СИЗ, и всё было организовано так, что я ждал своей очереди в отдельном помещении и ни с кем не пересекался. Как мне сказали, передо мной тоже был пациент с вирусной пневмонией. Потом рентгенолог вышел с круглыми глазами и сказал мне: «Срочно в больницу!»
У меня была двусторонняя пневмония с поражением 70–80 % легких, с множественными очагами воспаления по типу «матового стекла». В заключении говорилось: «Подозрение на вирусную пневмонию, не исключен COVID-19». Было 24 апреля. В этот же день я лег в больницу. Собрал сумку и поехал в Боткинскую больницу, не вызывая скорую. Там я просто договорился с коллегами-однокурсниками, которые там работают. Они меня ждали.
Меня поместили в отдельный бокс и начали лечить. С первого дня мне стали давать гидроксихлорохин, плюс два антибиотика — один в капельнице, второй в таблетках. Еще давали таблетки от кашля и от изжоги. Последнее было, скорее, потому, что «так положено» при приеме антибиотиков.
Со второго дня в больнице у меня началось серьезное ухудшение состояния. Мне стало очень тяжело дышать. Температура поднялась до 39,5. Поначалу мне давали парацетамол, который я пил на ночь, чтобы хоть чуть-чуть поспать. К 4 утра температура опять поднималась, и я снова пил парацетамол. А потом она просто перестала сбиваться. Тогда мне прокапали жаропонижающее в капельнице. Но и это не помогло. Мне вкололи внутримышечно так называемую литическую смесь — очень болезненный укол. Температура снизилась, но только до 37,5. И тут уже врач испугался. Больше способов снизить температуру не осталось. А если не снизить — это обостряет все хронические заболевания, мишенью оказываются сердце, головной мозг, организм ослаблен и открыт для присоединения новых инфекций. При длительной температуре может развиться полиорганная недостаточность.
Всю неделю в больнице я плохо спал. На 5–6 день мне стали давать успокоительное. Состояние сознания при коронавирусе, прямо скажем, тяжелое: не то что книжки читать, даже кино смотреть невозможно. Тяжело сконцентрироваться, обостряется раздражительность. Тебя бесит все. Особенно люди, которые звонят, чтобы узнать, как дела. Честно скажу, мне было страшно.
Первый тест на коронавирус мне сделали 24 апреля. Положительный результат пришел через день. Второй тест взяли через неделю. Он тоже был положительный. Под выписку сделали еще два. Тест, сданный 3 мая, оказался отрицательным.
На лекарства у меня была индивидуальная реакция — жуткая икота. Сначала это всех смешило. Но икота не прекращалась в течение трех дней ни днем, ни ночью. Скорее всего, это была реакция на гидроксихлорохин — раздражение диафрагмы или чего-то еще. У меня уже живот начал болеть от икоты. Мне стали давать церукал — противорвотное.
Еще я отдельно попросил, чтобы мне назначили клексан — это уколы в живот, которые снижают тромбообразование. Этот препарат я покупал себе сам, его не было в больнице. Но я решил, что это нужно сделать, потому что к тому моменту уже накопились наблюдения медиков, что осложнением при коронавирусе часто бывает тромбообразование (а это приводит к инсультам, инфарктам), то есть нужно делать профилактику. Правда, это были источники на английском языке. Более дешевый аналог клексана — аспирин.
Трижды в день ко мне приходил врач с пульсоксиметром. Отклонений по уровню насыщения крови кислородом у меня не было. Это был основной критерий того, насколько ухудшается мое состояние. Если бы уровень кислорода начал снижаться, я бы попал в реанимацию.
Я просил, чтобы мне дали кислород, потому что он существенно облегчает состояние. Но заведующий отделением сказал мне: «Ты сейчас привыкнешь к чистому кислороду, тебе станет легче, уровень кислорода в крови повысится. Но как мы сможем понять, не началась ли отрицательная динамика в организме?» Тут я с ним согласился.
Врачи, которые лечили меня, были со мной откровенны. Они говорили, что не могут предсказать, каким будет течение болезни. И что очень многое зависит от того, насколько сильным окажется иммунитет. Я бы хотел это подчеркнуть. У меня на момент начала болезни иммунитет был плохой. И я сам в этом виноват. В первый же день, когда я почувствовал слабость, надо было начинать лечение, но я решил «отлежаться». Как только поднялась температура, я тоже ничего не делал — работал дома, разговаривал, занимался делами. Я не придавал значения болезни и, видимо, ухудшил ее дальнейшее течение. Если бы я сразу начал пить много жидкости, принимать витамины, я бы, наверное, смягчил последствия.
У меня дома остались жена, дети двух и четырех лет, и теща 62 лет. Через шесть дней после того, как я попал в больницу, жена и теща тоже заболели, симптомы были схожи с моими. Я понимал, что если их госпитализируют, детей девать некуда: няню не вызовешь, дети контактные. Поэтому лечились дома сочетанием рибавирина и арбидола. Плюс — большие дозировки витаминов С, D и цинка. Такое лечение мне подсказали коллеги из Военно-медицинской академии. Еще жена и теща сделали КТ. «Матовое стекло» было у обеих, потеря обоняния и чувства вкуса тоже. Из поликлиники в Парголово пришли, взяли мазки — результата нет до сих пор, хотя все уже выздоровели. «Если ответа нет, значит, отрицательный», — говорят нам. Но где гарантия, что мазки просто не потерялись? Вся моя семья была контактной, и симптомы были схожи с моими.
Как только я лег в больницу, я настоял, чтобы дома все принимали витамины. Но по сути они лечились на свой страх и риск, и я не хочу, чтобы кто-то воспринимал это как руководство к действию. К тому же у нас дома есть пульсоксиметр и можно контролировать насыщение крови кислородом — если бы оно начало падать, конечно, все сразу же поехали бы в больницу.
Детям мы КТ не делали, результаты их мазков мы так и не получили. Симптомов у них не было, поэтому мы ничего не давали им, кроме витамина С.
Есть еще важный момент. Теще нужен был больничный лист. Чтобы его открыть, вызвали участкового врача на дом. Поначалу, услышав, что у тещи температура, в поликлинике сказали, что это ОРВИ и надо лечиться симптоматически. Врач приехала практически без средств индивидуальной защиты, просто в одноразовой маске и перчатках. Хотя теща предупредила, что был контакт с зараженным коронавирусом. Компьютерную томографию легких сделали за свой счет. На КТ было видно, что у жены и тещи пневмония. Но врач после этого визита так ни разу больше и не появилась. Карантин членам моей семьи никто не назначал. Я думаю, что в официальную статистику они не попали.
Меня выписали 8 мая, через две недели после того, как я поступил в больницу. Еще две недели был на самоизоляции. До сих пор у меня сохраняется слабость, и мне сложно дышать, если я, например, говорю по телефону на ходу. О том, чтобы пробежаться, я пока даже не мечтаю. Я бы сдал кровь на плазму, чтобы это помогло тем, кто болеет сейчас. Но ко мне с таким предложением никто не обращался. Сам я не могу разобраться, куда её сдать, чтобы ее максимально эффективно использовали. Как я могу понять, где больше всего в ней нуждаются?
И до того, как заболел, я понимал, что это не выдуманная болезнь. Но осознания, насколько это опасно, не было. Теперь, когда вся моя семья переболела и я перенервничал за них, мне хочется рвать и метать, когда известная телеведущая Елена Малышева называет этот вирус «чудо чудное» или когда доктор Мясников заявляет журналистам, что волноваться не о чем, потому что смертность от коронавируса «низкая».
Людям не хватает информации о новом коронавирусе из первых рук. Думаю, было бы полезно, если бы врачи хотя бы иногда делали, например, прямые трансляции в «Инстаграм» и рассказывали о том, какие бывают клинические картины у этой болезни, как лечат таких пациентов. Чтобы остальные понимали: болезнь не выдуманная и очень опасная.
Я видел, насколько это опасно. В день моей госпитализации в Боткинской умер врач из Александровской больницы. Понятно, что врачи для врача сделали все, чтобы его спасти — и все равно не удалось. А если заболеть где-нибудь в 100 километрах от Петербурга, просто беда. Не потому, что медики плохие, а потому, что нужных лекарств или аппаратов может не найтись. И еще меня крайне удивляет, когда мои знакомые вызывают врача на дом, имея симптомы коронавируса, и им ставят диагноз ОРВИ. И заболевшие тянут с началом настоящего лечения.
Всех, у кого ухудшилось состояние или у кого начали болеть родственники, я бы хотел попросить быть максимально бдительными: вирус тем и коварен, что на начальном этапе его легко спутать с известными нам вирусными заболеваниями. Уверен, что сейчас врачи уже стали более настороженными, но всё-таки изменения в лёгких они часто не слышат. Единственный выход — сделать компьютерную томографию.
Еще я хотел бы сказать своим коллегам-врачам: относитесь к коронавирусу максимально серьезно. В Боткинской больнице все медсестры и санитарки, которых я видел, были старше 50. И каждый день я тысячу раз говорил им «спасибо» за их работу и за их риск.
Записала Венера Галеева, «Фонтанка.ру»
Возможно ли применение парацетамола и анальгина вместе?
Как сбить температуру у ребенка :12
Этим утром, я встала с огромным трудом, глаза, напрочь отказывались открываться, а руки и ноги, вовсе не хотели слушаться. Да ночка действительно выдалась беспокойная. А началось все, поздно вечером, когда
Подробнее
Жаропонижающие свечи для детей до года :00
Предусмотрительные родители еще до приезда малыша из роддома заботятся о том, чтобы ему было комфортно. И сейчас считается необходимым вместе с приданым подготовить детскую аптечку, где будет все самое
Подробнее
Жаропонижающие при беременности :00
Беременность всегда меняет привычный распорядок и привычки. Женщина в положении должна вести здоровый образ жизни, правильно питаться, больше отдыхать и ни в коем случае не расстраиваться по пустякам.
Подробнее
Температура у ребенка что делать?
Температура у ребенка что делать? Когда Ваш малыш болен, мы готовы сделать все, чтобы ему помочь. Но что именно нужно сделать, и как при этом не навредить ребенку, знает далеко не каждый. Повышение температуры
Подробнее
Как сбить температуру у грудничка? :00
Повышение температуры у младенца всегда является симптомом какого-то заболевания. Симптом этот положительный, он означает, что организм адекватно отвечает на возникновение заболевания. 1 / 6 Известно,
Подробнее
1. Общие положения. Оснащение:
1. Общие положения. Инъекция это впрыскивание лекарственных веществ в ткани, сосуды, полости, субарахноидальное пространство. Цель внутримышечной инъекции: введение лекарственного средства в мышечную ткань.
Подробнее
Микардис таблетки по 80 мг 28 (7х4)
mini-doctor.com Инструкция Микардис таблетки по 80 мг 28 (7х4) ВНИМАНИЕ! Вся информация взята из открытых источников и предоставляется исключительно в ознакомительных целях. Микардис таблетки по 80 мг
Подробнее
Khatkhokhu M.G., Popova Ya.S., Tsygankova L.Yu.
ОСНОВЫ ТЕРАПИИ АБУЗУСНОЙ ГОЛОВНОЙ БОЛИ Хатхоху М.Г., Попова Я.С., Цыганкова Л.Ю. Майкопский Государственный Технологический Университет, медицинский институт Майкоп, Адыгея THE BASIS OF MEDICATION OVERUSE
Подробнее
ЧТО ТАКОЕ САХАРНЫЙ ДИАБЕТ?
ЧТО ТАКОЕ САХАРНЫЙ ДИАБЕТ? Сахарный диабет пожизненное заболевание, характеризующееся повышенным содержанием сахара (глюкозы) в крови как следствие недостатка инсулина. Однако, вы можете научиться управлять
Подробнее
Лечение простуды во время беременности :00
Возможно, вы это просто почувствовали, возможно, экспресс тест показал две, еле заметные, полоски, а может, этой новостью вас ошарашил гинеколог, на прием к которому, вы вообще, пришли по-другому поводу.
Подробнее
Показания к применению
Латинское название: Neurobion Код АТХ: А11DВ Действующее вещество: витамины В1, В6, В12 Производитель: раствор д/инъекций MERCK, KGaA (ФРГ) таблетки: MERCK (Австрия) Условие отпуска из аптеки: По рецепту
Подробнее
Детская аптечка в дорогу :40
С самого первого дня, после того, как вы с малышом вернетесь из роддома, вам желательно, собрать, и всегда иметь под рукой, детскую аптечку. Возможно, многие лекарства из нее, вам никогда не пригодятся,
Подробнее
Чем лучше полоскать горло? :00
Дискомфорт в горле, боли при глотании, першение, сухость во рту, красные миндалины и увеличенные лимфоузлы — все это, в сочетании со слабостью, ломотой, насморком, кашлем и иногда повышенной температурой,
Подробнее
Менингококковая инфекция B (Men B)
Менингококковая инфекция B (Men B) На этой странице содержатся краткие сведения о данной болезни и вакцине против нее. Ссылки на ресурсы с более подробной информацией приведены в конце страницы. Что такое
Подробнее
Первая помощь при ожогах у детей :24
С чем только не приходится сталкиваться, воспитывая ребенка. Но не всегда, получается, уследить за подвижным и активным малышом, на секунду отвернешься, а он, уже пытается засунуть палец в розетку, или
Подробнее
Контроль глюкозы в крови. Гипогликемия
Контроль глюкозы в крови. Гипогликемия Контроль глюкозы крови Контроль глюкозы крови Контроль сахарного диабета означает поддержание глюкозы в крови на уровне, близком к норме. В норме у людей без диабета
Подробнее
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ П О С Т А Н О В Л Е Н И Е от 15 ноября 2017 г. 1380 МОСКВА Об особенностях описания лекарственных препаратов для медицинского применения, являющихся объектом закупки
Подробнее
РЕЗОНАТИВ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ
РЕЗОНАТИВ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ Состав: международное непатентованное название: Human anti-d immunoglobulin; действующее вещество: 1 мл 625 МЕ (125 мкг) анти-d иммуноглобулина человека. (содержание
Подробнее
ПАМЯТКА ДЛЯ НАСЕЛЕНИЯ О ГРИППЕ
ПАМЯТКА ДЛЯ НАСЕЛЕНИЯ О ГРИППЕ Грипп чрезвычайно контагиозное острое инфекционное заболевание, легко передающееся от человека к человеку и распространенное повсеместно. Каждый человек абсолютно восприимчив
Подробнее
Основные рекомендации для населения
Грипп и ОРВИ Острые респираторные инфекции (ОРИ) заболевания, которые передаются воздушно-капельным путем и вызываются различными возбудителями: вирусами (аденовирусы, вирусы гриппа, парагриппа, респираторно-сентициальные
Подробнее
Бактериофаг Интести раствор по 100 мл
mini-doctor.com Инструкция Бактериофаг Интести раствор по 100 мл 1 ВНИМАНИЕ! Вся информация взята из открытых источников и предоставляется исключительно в ознакомительных целях. Бактериофаг Интести раствор
Подробнее
Что такое гемофилия?
Что такое гемофилия? 1425 René Lévesque Boulevard West, Suite 1010 Montréal, Québec h4G 1T7 Canada Что такое гемофилия? Гемофилия это проблема кровотечения. У больных гемофилией кровотечение происходит
Подробнее
Как приготовить литическую смесь
Литическая смесь — незаменимый инструмент для эффективного и быстрого снижения высокой температуры. Чаще всего литическую смесь применяют для лечения гипертермии у детей раннего возраста.
Инструкция
1
Детское заболевание, сопровождающееся высокой температурой, — непростое испытание для молодых родителей. Далеко не всегда удается сбить жар у малыша обычными средствами, и в этом случае на помощь приходит литическая смесь, в состав которой входят 50% анальгина, 1% димедрола и 0,1% папаверина.
2
Литическую смесь применяют только в том случае, если гипертермия длится более 5 часов, температура не опускается ниже 38,5 ° С, а обычные жаропонижающие средства не дают эффекта. После введения литической смеси температура снижается на полчаса.
3
При приготовлении литической смеси важно соблюдать дозировку в соответствии с возрастом ребенка. На каждый год жизни требуется по 0,1 мл каждого компонента смеси. Компоненты набираются в шприц, после чего производится внутримышечная инъекция в верхний внешний квадрат ягодицы.Игла вводится строго перпендикулярно коже на 2/3 ее длины. В связи с тем, что смесь содержит анальгин (метамизол натрия), инъекция достаточно болезненна, и вводить лекарство необходимо медленно. После введения лекарства на месте укола может образоваться шишка. Чтобы предотвратить появление инфильтратов, место укола можно обработать йодной сеткой.
4
Перед смешиванием компонентов ампулы с ним необходимо подержать лекарство в ладонях для его разогрева.После этого ампулы обрабатываются спиртом, чтобы предотвратить попадание в лекарство болезнетворных микроорганизмов. Для инъекций используются только одноразовые шприцы.
5
Если у вас нет возможности сделать укол, можно приготовить смесь для перорального применения, используя необходимые препараты в таблетках, но инъекция намного эффективнее. Прием таблеток снижает температуру не так быстро, как укол.
6
Для использования литической смеси для понижения температуры есть противопоказания.В частности, инъекции запрещены, если гипертермия сопровождается болями в животе. Обезболивающее действие препарата затруднит диагностику. Не рекомендуется повторно использовать литическую смесь, если ребенку уже сделали укол и вскоре снова поднялась температура. Также противопоказано применение литической смеси при индивидуальной непереносимости компонентов препарата. Детям до 6 месяцев литическую смесь следует готовить без папаверина, так как это спазмолитическое средство не рекомендуется для новорожденных.
Как приготовить литическую смесь для взрослого
Литическая смесь — это раствор нескольких препаратов. В его состав входят 3 компонента: антигистаминный препарат, представитель группы ненаркотических анальгетиков и спазмолитическое средство.
Инструкции
1
Литическую смесь целесообразно применять как быстродействующее средство при высокой температуре и как анальгетик быстрого действия. Уникальное сочетание анальгетика с антигистаминными и сосудорасширяющими препаратами обеспечивает снижение температуры до нормальных значений в течение 20-30 минут.
2
Если вы решили нормализовать температуру у больного литической смесью, обязательно проверьте, нет ли индивидуальной непереносимости ее компонентов, т.к. есть аллергия на «Димедрол», «Анальгин» и другие препараты. Существует ряд противопоказаний к применению литической смеси, например, ее нельзя вводить пациенту при высокой температуре на фоне абдоминального синдрома (боли в животе неясного характера). Также запрещено применять литическую смесь тем пациентам, которые принимали анальгетики в течение последних 4 часов.Дозу составляющих компонентов литической смеси необходимо рассчитывать для взрослого пациента индивидуально с учетом его массы, т. введение смеси меньших доз не приведет к терапевтическому эффекту, а превышение предельно допустимых назначений может привести к тяжелым последствиям и навредить здоровью.
3
В составе литической смеси ненаркотических анальгетиков рекомендуется использовать «Анальгин», его раствор всегда выпускается в концентрации 50%.«Анальгин» обладает жаропонижающим действием, помогает купировать болевой синдром, развивающийся при воспалении, а также оказывает противовоспалительное действие на организм. Для литической смеси используется максимально допустимая разовая доза препарата — 1 г. 2 мл 50% раствора. Раствор «Анальгин» имеет маслянистую структуру, поэтому рекомендуется предварительно набрать его в шприц.
4
Добавьте антигистаминный препарат в шприц. Для литической смеси часто используют «Дифенгидрамин». Этот препарат позволяет не только нейтрализовать аллергическую реакцию, развивающуюся в ответ на вирусы и бактерии, продуцируемые токсинами, но и снимает спазм мышечных волокон.Под действием «Димедролуса» мышцы расслабляются, восстанавливается кровоток в периферических сосудах, что позволяет лучше «работать» иммунитету. Дозируется «Димедрол» взрослому пациенту 10-50 мг, в литической смеси используют 2-3 ампулы по 1 мл. Если под рукой нет «Димедрола», можно использовать Супрастин, его дозировка составляет 1-2 мл.
5
Третий компонент литической смеси должен быть спазмолитиком. Из всего многообразия препаратов этой группы врачи предпочитают «Папаверин» или «Дротаверин».Дозировка одного из этих препаратов для литической смеси взрослому человеку составляет 2 мл.
6
После последовательного набора всех 3 компонентов закрыть иглу колпачком и перемешать раствор. Для этого аккуратно встряхните шприц 3-4 раза. Затем визуально отметьте место инъекции (верхняя внешняя четверть ягодицы), обработайте кожу в этой точке спиртом и сделайте внутримышечную инъекцию.
49: Бактериофаги (эксперимент) — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- НЕОБХОДИМЫЕ МАТЕРИАЛЫ: по таблице
- ПРОЦЕДУРА
- Общая процедура
- Подробная процедура со схемой
- ИНТЕРПРЕТАЦИЯ
- ВОПРОСЫ
- Авторы и ссылки
Цели обучения
- Узнайте, как культивировать вирусы в клетке-хозяине
- Определите количество вирусов в образце
- Определить вирусные бляшки на бактериальном газоне
Бактериофаги — это вирусы, поражающие бактерии.PHAGE (как в случае фагоцитоза) означает «есть» и обычно относится к вирусу. У большинства бактерий есть фаги, способные паразитировать на них. Фактически, способность инфицироваться известным типом фага используется для идентификации некоторых штаммов бактерий (например, Staph ), известных как фаг с типом . Поскольку вирус заражает бактериальные клетки, с которыми он был смешан, литическая инфекция уничтожает бактерии. Бактерии были высыпаны на так называемую бактериальную лужайку на чашке с агаром.По мере того как окружающие клетки заражаются и убиваются выпущенными вирусами, на агаре — на бактериальной лужайке — образуется чистое пятно, которое называется бляшкой . Бляшки можно подсчитать и определить количество вирусных частиц или вирионов в них. исходный образец можно количественно определить как вирусов / мл бляшкообразующих единиц / мл (БОЕ).
В этой лаборатории будут использоваться 2 вида бактериофагов — вирусы T4 и phi 174. Бактериями-хозяевами являются 2 разных штамма E. coli , поэтому эти бактериофаги называются колифагами.Цель использования 2 разных вирусов — показать специфичность вируса для его хозяина, даже для этих маленьких бактериальных вирусов. Разжиженный триптоновый мягкий агар, в который помещаются бактерии и вирусы, имеет меньшую концентрацию агара, чем обычный разжиженный агар. Это способствует лучшему распространению вирусов и лучшему контакту с бактериями.
НЕОБХОДИМЫЕ МАТЕРИАЛЫ: на стол
- 10 -3 разведение бактериофага (этот 1/1000 уже сделан для вас) — либо T4, либо phi 174
- микропипетка и наконечники
- Пи-помпа и пипетки 10 мл
- 5 пробирок для разведения
- 1 флакон физиологического раствора (0.9% NaCl) для разведения
- Водяная баня 50º C
- 1 штамм E. coli (B или C) в TSB
- 6 пластин TSA
- 6 — Пробирки с жидким мягким агаром по 3 мл (на водяной бане)
ПРОЦЕДУРА
Общая процедура
- Образец фага, который вы будете использовать, уже разбавлен до 1/1000, и вы будете разбавлять его дальше.
- Бактерии и фаг смешивают в пробирках с мягким агаром.Смесь инкубируют на водяной бане.
- После инкубации смесь добавляют в мягкий агар и выливают на чашки с триптонным агаром.
- ОБЯЗАТЕЛЬНО смешайте разведения.
- Меняйте пипетки между разведениями.
- В каждой таблице будет использоваться различная комбинация фага и хозяина E. coli .
Подробная процедура со схемой
Установите 5 пробирок для разбавления с физиологическим раствором (0,85% NaCl) с маркировкой 10 -4 , 10 -5 , 10 -6 , 10 -7 и 10 -8 .В каждую пробирку налейте 9 мл pf, в которые вы разведите вирусный раствор. Вы будете делать 1/10 разведения.
- Начиная с разведения вируса 10 -3 , которое вы подобрали (или дали ваш инструктор), перенесите 1 мл в пробирку для разведения с маркировкой 10 -4 и перемешайте.
- Сделайте еще 4 разведения до 10 -8 .
- В 6 микропробирок добавьте 100 микролитров каждого вирусного разведения плюс 300 микролитров E.coli . Дайте постоять при комнатной температуре 10 минут, пока вирус не заразит бактерии. . Хорошо перемешайте.
- Переместите пробирки в водяную баню и перенесите все содержимое пробирок с фагом E. coli — в 6 пробирок с мягким агаром, используя стерильную пластиковую пипетку для переноса. Хорошо смешать. СОХРАНЯЙТЕ МЯГКИЕ АГАРЫ ВНУТРИ ВОДНОЙ ВАННЫ, ЧТОБЫ ОНИ НЕ ЗАВЕРДАЛИСЬ.
- Удалите по 1 пробирке с мягким агаром и вылейте ее на чашки с агаром TSA, осторожно вращая пластину WELL , чтобы фаговые бактерии распространились по всему агару.
- Дайте планшетам затвердеть и инкубируйте при 37 ° C правой стороной вверх .
ИНТЕРПРЕТАЦИЯ
- Положите 6 чашек лицевой стороной вверх, от наименьшего разбавления к наибольшему разбавлению.
- Возьмите каждую пластину, поднесите ее к свету и определите, какая из них содержит от 30 до 300 пластинок (вы также можете использовать счетчики колоний Квебека — хорошая подсветка!)
- Получите точное количество этой тарелки. Заполните формулу для подсчета вирусов.
- Рассчитайте количество вирусов на мл. оригинального экземпляра.
ВОПРОСЫ
- Почему количество вирусов выражается в единицах образования бляшек (БОЕ)?
- Два фага росли на обоих штаммах E. coli ? Почему или почему нет?
- Определите количество бляшек / мл для вашего вирусного образца.
Авторы и авторство
Принцип, процедура, результаты • Microbe Online
Последнее обновление 30 мая 2021 г.
Бактериофаги «пожиратели бактерий» — это инфекционные агенты, которые размножаются как облигатные внутриклеточные паразиты в бактериях, но во внеклеточной среде они метаболически инертны.Типичный фаг содержит «голову» (содержащую ДНК, встроенную в белковую оболочку), «шейку» и белковый «хвост» (для адсорбции на рецепторе, присутствующем на поверхности бактериальной клетки). Бактериофаги (сокращенно фаги) классифицируются на две основные группы в зависимости от способа их размножения:
- Вирулентный (литический фаг) : Рост вирулентного фага в чувствительных бактериях разрушает клетки-хозяева и производит множество копий самих себя. например Фаги Т2 и Т4 E. coli.
- Фаг умеренного климата: Фаги умеренного климата способны переходить в нелитическое состояние профага.
По мере того, как мир борется с проблемами роста устойчивости к противомикробным препаратам, проводятся различные исследования для оценки применения фагов для лечения бактериальных инфекций (в качестве замены антибиотикотерапии).
Использование фагов для лечения бактериальных инфекций было разработано еще в 1920-х и 1930-х годах в Восточной Европе и Советском Союзе.
Анализ зубного налета — один из широко используемых подходов для определения количества инфекционного вируса в образце. Таким способом можно анализировать только вирусы, которые вызывают видимые повреждения клеток. Анализ зубного налета был впервые разработан для расчета титров исходных бактериофагов. В настоящее время его модифицированная процедура используется также для определения титра многих различных вирусов животных.
Принцип анализа фаговых бляшек
Когда суспензия инфекционного фага (e.грамм. T4 фаг) распространяется по лужайке восприимчивых бактериальных клеток (например, Escherichia coli), фаг прикрепляет бактериальную клетку, реплицируется внутри нее и убивает ее во время литического высвобождения. На лизис бактериофага указывает образование зоны очистки или налета на лужайке от бактерий. В отсутствие литического фага бактерии образуют сплошную лужайку роста.
Каждая бляшка соответствует участку, где один бактериофаг выступил в качестве инфекционной единицы и инициировал свой литический цикл.Распространение инфекционного фага от первоначально инфицированной бактериальной клетки к окружающим клеткам приводит к лизису находящихся поблизости бактерий, в конечном итоге формируя налет, достаточно большой, чтобы быть видимым невооруженным глазом. Бляшки не продолжают распространяться бесконечно. Размер образовавшейся бляшки зависит от вируса, хозяина и условий культивирования.
Количество образующихся бляшек и соответствующие коэффициенты разведения можно использовать для расчета количества бактериофагов i.е.
бляшкообразующих единиц (БОЕ) в образце.
Среда, используемая в анализах фаговых бляшек, имеет относительно низкий процент агара и поэтому называется мягким агаром ; он обеспечивает диффузию фага в соседние неинфицированные клетки, но не позволяет новым фагам перемещаться в удаленные части планшета.
Процедура анализа бактериофаговых бляшек
Анализ бактериофаговых бляшек
Приготовление исходного раствора серийным разведением
- Поместите восемь стерильных пробирок с физиологическим раствором (0.По 9 мл) в штатив для пробирок.
- Пометьте одну пробирку «контрольной», а остальные пять пробирок пометьте последовательно от 10 -1 до 10 -7.
- Пометьте шесть чашек с питательным агаром так же, как и пробирки.
- С помощью стерильной пипетки на 1 мл асептически перенесите 0,1 мл суспензии бактериофага в пробирку с солевым раствором, обозначенную 10 -1 .
- Трубку хорошо перемешайте, перекручивая ее между ладонями.
- С другой пипеткой на 1 мл перенесите 0.1 мл из пробирки 10 -1 в пробирку 10 -2 . Перемешайте в пробирке.
- Используя новую пипетку для каждого переноса, перенесите 0,1 мл суспензии из пробирки 10 -2 в пробирку 10 -3 и продолжите эту процедуру разведения последовательно для оставшихся пробирок с физиологическим раствором. Не забывайте тщательно перемешивать каждую пробирку до и после разбавления.
Наложение чашки со смесью фага и агара
- (Примечание: здесь нужно работать быстро) Возьмите шесть пробирок с расплавленным мягким верхним агаром из водяной бани.Внесите пипеткой по 0,3 мл бульонной культуры E.coli в каждую из пробирок с мягким агаром. Хорошо перемешайте каждую трубочку, перекатывая между ладонями. Пометьте каждую пробирку своими инициалами и как можно скорее верните их в ванну. Не позволяйте агару затвердеть.
- (снова работайте быстро) Удалите одну засеянную пробирку с мягким агаром из водяной бани. Вытрите всю воду с поверхности трубки. Используя пипетку на 1 мл, асептически перенесите 0,1 мл солевого фагового разведения 10 -1 в пробирку с мягким агаром.Перемешайте пробирку с агаром, перекручивая ее в руках.
- Немедленно асептически вылейте мягкий агар на поверхность чашки с питательным агаром, обозначенной соответственно как 10 -1 . Закройте крышку и, не поднимая чашку, осторожно поверните ее по 6-8-дюймовому кругу на поверхности стола, чтобы равномерно распределить агар.
- Используя каждый раз свежую пипетку на 1 мл и работая быстро, повторите шаги 1 и 2 для оставшихся пробирок для разведения фагов с физиологическим раствором и для контрольной пробирки с физиологическим раствором.
- Для каждой пробирки для разведения используйте чашку с питательным агаром, помеченную соответствующим образом.
- Дайте мягкому агару затвердеть.
- Переверните и инкубируйте планшеты при температуре от 35 ° C до 37 ° C в течение 24 часов.
Результаты
- После инкубации исследуйте каждую чашку и подсчитайте количество бляшек на каждой чашке, на которой есть четко дифференцированные бляшки.
- Запишите свои подсчеты. Пластины, на которых бляшки покрывают всю пластину и на которых бляшки не различимы друг от друга (более 300 бляшек), должны быть записаны как TNTC (слишком много, чтобы их можно было подсчитать).
- Рассчитайте количество литических фагов на миллилитр, которые были в исходной суспензии бактериофага, используя формулу, упомянутую выше.
Результаты анализа бактериофаговых бляшек
Если 48 бляшек наблюдаются при коэффициенте разведения 10 -5 , при добавлении 0,1 мл вируса количество бляшкообразующих единиц / мл будет 4,8 X 10 7 .
На практике вы можете подсчитать бляшкообразующие единицы, рассчитать и свести в таблицу следующим образом:
| Разведение фага | 10 -1 | 10 -2 | 10 -3 | 10 -4 | 10 -5 |
| Количество бляшек | |||||
| Расчеты количества бляшек / мл |
