Что такое расщепленная или СПЛИТ–вакцина («split» – расщеплять)?
Выделенные вирусы (вирионы) очищают, а затем разрушают каким–нибудь химическим веществом (например, диэтиловым эфиром). Такая вакцина содержит все вирусные белки: гемагглютинин, нейраминидазу и белки нуклеопротеида вируса. За счет дополнительной очистки в такой вакцине еще меньше токсичных субстанций, в т.ч. липидов, по сравнению с любой цельновирионной вакциной. Следовательно, она значительно менее реактогенная, при этом сплит–вакцина сохраняет максимальную иммуногенность.
Типичными представителями сплит–вакцин являются французский «Ваксигрип».
Наличие в вакцине внутренних антигенов вируса (нуклеокапсида и матриксного белка), по мнению создателей вакцины «Ваксигрип», защищает не только от ежегодных вариантов вируса гриппа, но частично и от всех возможных разновидностей вируса, поскольку внутренние антигены не особенно подвержены мутациям.
Итак, теоретически сплит–вакцины выигрывают в иммуногенности, которая напрямую связана с эффективностью вакцины, за счет наличия внутренних антигенов вируса.
Сплит–вакцины разрешено применять у детей с 6–ти месячного возраста, а также у пожилых людей, страдающих хроническими заболеваниями, в том числе у больных бронхиальной астмой.
Что лучше – сплит–вакцина или субъединичная вакцина?
Современные инактивированные вакцины мало отличаются между собой по иммуногенности, т.е. способности вызывать выработку антител и создавать иммунитет против гриппа.
Один из основных доводов в пользу сплит–вакцин – внутренние антигены вируса гриппа имеют определенное, но не основное, значение в формировании противогриппозного иммунитета. Встречаются утверждения, что ввиду отсутствия в субъединичных вакцинах внутренних антигенов вируса, защитная эффективность субъединичных вакцин несколько ниже, чем у сплит–вакцин (на 10–15%). Таким образом, скорее теоретически, сплит–вакцины имеют некоторый «запас» профилактической эффективности по сравнению с субъединичными вакцинами.
Сравнивая реактогенность, т.е. переносимость Сплит– и субъединичных вакцин, исследователи показали очень хорошую безопасность для всех сравниваемых вакцин, но результат был лучше у поколения субъединичных вакцин (0,9–1,3% против 1–1,8% для Сплит–вакцин; результаты исследования SVEVA, Италия). Вероятно, Сплит–вакцины проигрывают в безопасности, поскольку все таки содержат некоторое количество липидов вируса.
|
Типы и отличительные особенности вакцин разных поколений
4 этап – создание субъединичных адъювантных вакцин.
Эволюция гриппозных вакцин шла по пути повышения безопасности – совершенствовались технологии очистки вирусного материала от балластных соединений. Однако ВОЗ до сих пор ставит перед разработчиками вакцин задачу повышения эффективности препаратов и, главное, их безопасности для всех контингентов населения. Поэтому, последние 15 лет усилия ученых во всем мире направлены на поиск безопасного адъюванта, способного усилить иммунный ответ, увеличить скорость его развития и длительность.
Поэтому, последние 15 лет усилия ученых во всем мире направлены на поиск безопасного адъюванта, способного усилить иммунный ответ, увеличить скорость его развития и длительность.
Включение Полиоксидония, в состав противогриппозной субъединичной вакцины Гриппол позволило создать новый тип вакцин (субъединичные адъювантные), отличающихся высокой иммуногенностью и самым высоким профилем безопасности.
Инактивированные вакцины I-III типа обычно содержат по 15 мкг на штамм гемагглютинина, поскольку при
меньшей дозе, они были бы не эффективны. Состав и качество вакцин регламентирует Европейская или
Национальная фармакопея, и в Европейской фармакопее специально оговаривается, что содержание
антигенов должно составлять 15 мг, если результатами клинических исследований не обоснована иная
дозировка. Таким образом, использование антигена гемагглютинина в количестве меньшем, чем 15 мкг на
дозу вакцины против гриппа, допускается и европейской, и российской Фармакопеями, если клинические
исследования подтверждают эффективность использования меньшего количества.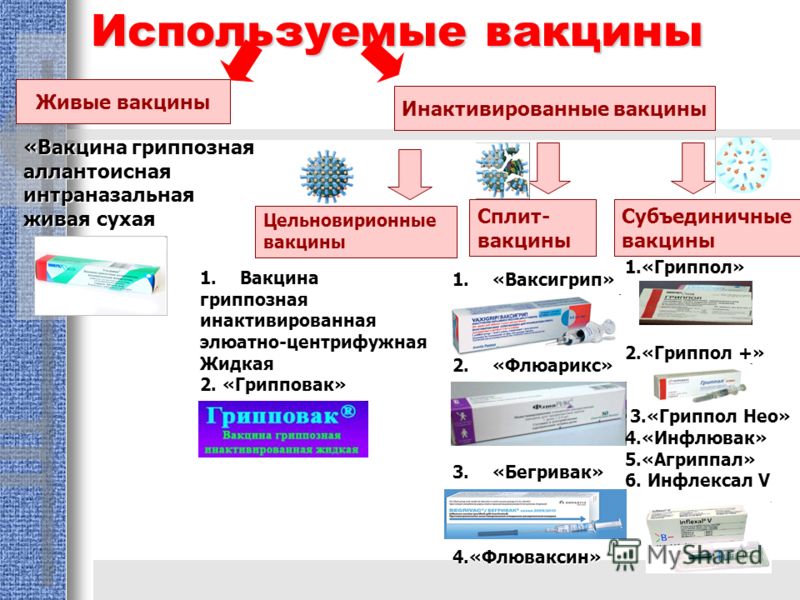
Использование адъюванта Полиоксидоний в вакцине Гриппол® плюс позволяет в три раза снизить дозу
вирусных антигенов, а значит сделать прививку более безопасной. Эта уникальная технология
более 20 лет используется для производства вакцин Гриппол, которые широко применяются
при массовой иммунизации населения.
Клинические и эпидемиологические исследования вакцин против гриппа убедительно доказали, что доза 5
мкг каждого штамма в сочетании с адъювантом Полиоксидоний является достаточной и эффективной,
обеспечивает высокий иммунный ответ и повышенный профиль безопасности за счет снижения антигенной
нагрузки на организм.
Не передавайте никому…грипп!!! – СПб ГБУЗ «Городская поликлиника № 97»
Не передавайте никому…грипп!!!
Грипп – это острая вирусная инфекция, поражающая дыхательные пути и протекающая с выраженными общими симптомами – лихорадкой, головной болью, мышечной болью и слабостью. Источником инфекции является больной человек. Вирус передается воздушно-пылевым путем при кашле и чихании, а также контактным и даже контактно-бытовым путем.
Источником инфекции является больной человек. Вирус передается воздушно-пылевым путем при кашле и чихании, а также контактным и даже контактно-бытовым путем.
Вспышки гриппа случаются каждый год, но тяжесть его течения и число заболевших колеблются. Эпидемии возникают с разной периодичностью, обычно каждые 1-3 года. Эпидемии, охватывающие весь земной шар (пандемии), с 1918-1919 гг. наблюдались примерно каждые 10-15 лет.
Почти ежегодно грипп вызывает эпидемии с большим числом осложнений и высокой смертностью больных группы риска, в основном от пневмонии. Во время эпидемии вирусом гриппа может заразиться более 10-20% всего населения и 40-50% пожилых людей. Грипп является причиной
3-5 миллионов случаев тяжелых заболеваний и 250-500 тысяч случаев смерти по всему миру.
Заболеваемость гриппом и острыми респираторными вирусными инфекциями (ОРВИ) превышает суммарную заболеваемость всеми остальными инфекциями.
Основным средством профилактики гриппа является иммунизация противогриппозными вакцинами против вирусов А и В. ВОЗ рекомендует ежегодную вакцинацию людей из группы высокого риска как наилучшую и наиболее дешевую стратегию сокращения случаев болезни и смертности, связанных с гриппом. Вот об этом мы сегодня и поговорим.
ВОЗ рекомендует ежегодную вакцинацию людей из группы высокого риска как наилучшую и наиболее дешевую стратегию сокращения случаев болезни и смертности, связанных с гриппом. Вот об этом мы сегодня и поговорим.
Чем отличаются вакцины друг от друга?
Все противогриппозные вакцины получают путем инактивации вируса, выращенного на куриных эмбрионах, и отличаются степенью очистки. Живые и инактивированные вакцины содержат цельные вирусы гриппа (цельновирионные). Фрагменты вируса содержат сплит-вакцины, а поверхностные антигены вируса – субъединичные вакцины (гриппол, инфлювак). Субъединичные и сплит-вакцины имеют достаточно хорошую степень очистки, высокую эффективность и очень маленькое число побочных эффектов, вследствие чего могут применяться у детей с 6-ти месячного возраста. Для других вакцин применение до 3-х летнего возраста является противопоказанием.
Как ВОЗ определяет, какие штаммы должна содержать вакцина против гриппа?
Всемирная сеть лабораторий позволяет четырем сотрудничающим центрам ВОЗ по гриппу (Атланта, Лондон, Мельбурн и Токио) выявить вирусы, циркулирующие по миру. Антигенный состав гриппозной вакцины ежегодно обновляется согласно рекомендациям Всемирной организации здравоохранения, и вакцины содержат актуальные штаммы вируса, которые могут вызвать распространение тяжелого заболевания.
Антигенный состав гриппозной вакцины ежегодно обновляется согласно рекомендациям Всемирной организации здравоохранения, и вакцины содержат актуальные штаммы вируса, которые могут вызвать распространение тяжелого заболевания.
Как вакцина защищает нас?
Вакцина против гриппа содержит вирусные белки, после попадания которых в организм, он воспринимает их как чужеродные и начинается выработка специфических антител. Если после этого произойдет заражение настоящим вирусом, эти антитела прикрепляются к частицам проникшего вируса гриппа и ликвидируют его до того, как будут повреждены ткани; в результате люди не заболевают или болезнь протекает в менее тяжелой форме.
Насколько безопасна вакцинация?
Современные вакцины хорошо очищены и редко вызывают побочные реакции. Не более чем у 5% вакцинированных отмечаются субфебрильная температура и легкие общие симптомы через 8-24 часа после вакцинации, у трети – небольшое покраснение и болезненность на месте введения вакцины.
Какова эффективность вакцинации?
Если вакцина соответствует действующим штаммам, то снижает заболеваемость гриппом среди привитых здоровых людей моложе 65 лет на 50-80%. Среди пожилых людей, не живущих в заведениях постоянного ухода (таких, как дома престарелых), и среди людей с длительными (хроническими) заболеваниями на 30-70%. Кроме того, вакцинация предотвращает госпитализацию по поводу пневмонии и других осложнений.
Среди пожилых людей, не живущих в заведениях постоянного ухода (таких, как дома престарелых), и среди людей с длительными (хроническими) заболеваниями на 30-70%. Кроме того, вакцинация предотвращает госпитализацию по поводу пневмонии и других осложнений.
Как быстро начинает действовать вакцина против гриппа?
Для выработки антител в организме, которые обеспечат защиту против инфекции вируса гриппа, требуется от двух недель до одного месяца после прививки. Риск заболеть гриппом сохраняется в течение всего периода выработки антител, поэтому необходимо защитить себя от вируса задолго до ожидаемой вспышки заболевания.
Когда лучше всего делать прививку?
Трудно планировать кампанию по вакцинации, поскольку эпидемия каждый год начинается в разное время. В Северном полушарии лучшим временем для проведения вакцинации считается – сентябрь- ноябрь.
Если сделана прививка в прошлом году, защитит ли она от гриппа в этом году?
Особенностью всех гриппозных вакцин является то, что они не обеспечивают длительной иммунной защиты. Антитела, образующиеся после вакцинации, носят временный характер и постепенно исчезают. Только небольшое их количество остается в циркулирующей крови, но его, как правило, бывает недостаточно для обеспечения иммунной защиты.
Антитела, образующиеся после вакцинации, носят временный характер и постепенно исчезают. Только небольшое их количество остается в циркулирующей крови, но его, как правило, бывает недостаточно для обеспечения иммунной защиты.
Прошлогодняя вакцинация не защитит вас от гриппа в этом году, так как иммунитет, развивающийся вследствие вакцинации против гриппа, сохраняется от 6 до 12 месяцев, а антигенный состав вакцины, скорее всего, отличается от ожидаемых в этом году штаммов вируса гриппа.
Таким образом, стремление обеспечить непрерывную защиту от инфекции требует регулярного повторения вакцинации против гриппа, следовательно, вакцинацию нужно проводить каждый год. Сделайте прививку и не болейте!
Будьте здоровы!
Заместитель главного врача по ЭКМП
СПБ ГБУЗ «Городская поликлиника № 97 КАСЬКО В.Г.
Детская поликлиника «Консультант» — Вакцины — Ваксигрип
Гриппозная сплит-вакцина предназначена для профилактики гриппа у взрослых и детей с 6-месячного возраста.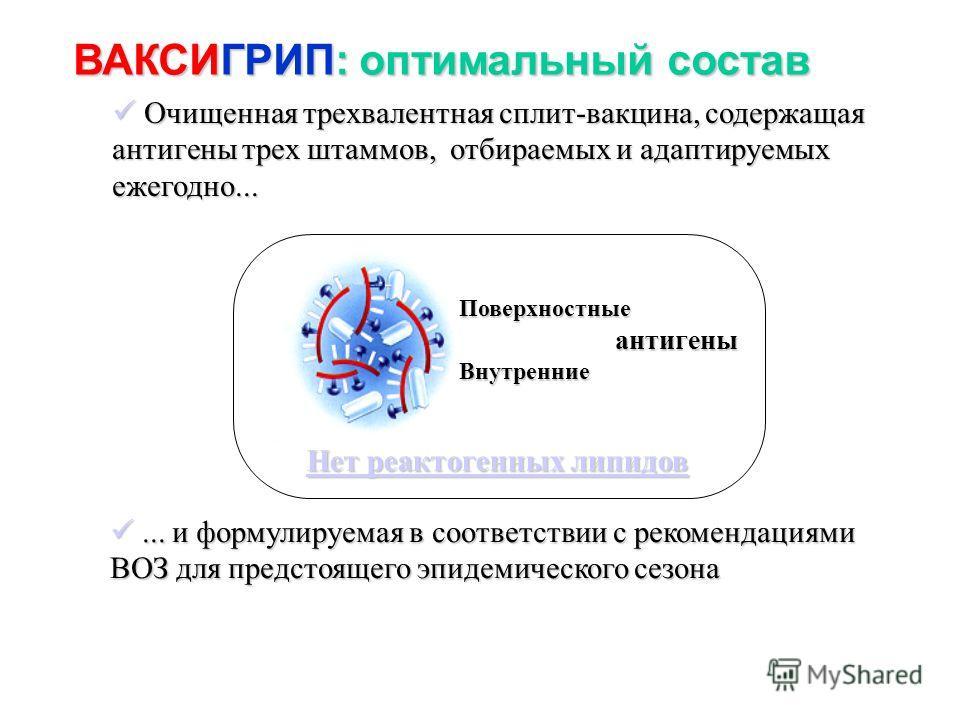
Производитель «Санофи Пастер» Франция.
«Ваксигрип» — это противогриппозная инактивированная вакцина, ыпускается она с 1969 года и успешно зарекомендовала себя во всём мире. В России «Ваксигрип» применяется с 1992 года.
Вирусы для вакцины «Ваксигрип» выращиваются на куриных эмбрионах, затем расщепляются и инактивируется. Для вакцины берутся 2 штамма вируса типа A и 1 типа B. Компоненты, полученные из каждого типа вируса, затем смешиваются. Состав антигенов вируса ежегодно меняется в зависимости от того, какой штамм вируса гриппа ожидается в этом году в Европе и Азии, по сведениям ВОЗ (Всемирной организации Здравоохранения).
Ваксигрип формирует развитие специфического иммунитета к эпидемически актуальным штаммам вируса гриппа типов А и В, содержащихся в данной вакцине. Иммунитет вырабатывается между 2-ой и 3-ей неделей после вакцинации и сохраняется от 6 до 12 месяцев.
Заболеваемость гриппом имеет сезонный характер, поэтому рекомендуется ежегодно проводить вакцинацию в осенне-зимний период, когда риск заболеваемости гриппом максимален.
Вакцина приводит к выработке иммунитета только против 3-х штаммов вируса гриппа, содержащихся в препарате или против штаммов, сходных с указанными. Ваксигрип не обеспечивает формирование иммунитета против гриппа при вакцинации в инкубационном периоде заболевания, а также против гриппа, вызванного другими штаммами вируса. Ваксигрип не формирует развитие иммунитета против заболеваний, сходных по симптоматике с гриппом, но вызванных иными возбудителями. Вакцинация против гриппа, осуществленная во время предшествующего эпидемического сезона, не может обеспечивать надежную защиту на следующий сезон, т.к. для каждого эпидемического сезона характерны свои наиболее распространенные штаммы вируса гриппа.
Использование данной вакцины не влияет на способность управлять автомобилем или другой техникой.
Вакцина может использоваться в период грудного вскармливания.
Противопоказания к вакцинации
Гиперчувствительность к кому-либо из компонентов вакцины, а также компонентам куриного мяса или куриного яйца, неомицину, формальдегиду. Заболевания, сопровождающиеся повышением температуры тела, а также острые или обострении хронического заболевания.
Заболевания, сопровождающиеся повышением температуры тела, а также острые или обострении хронического заболевания.
Необходимо информировать врача о наличии иммунодефицита, аллергии или необычной реакции на предыдущую вакцинацию а также о любом лечении, совпадавшим по времени с вакцинацией, либо предшествующем вакцинации.
Способ применения и дозы
Дозировка: для детей старше 36 месяцев и взрослых-0.5 мо однократно ; для детей в возрасте от 6 месяцев до 35 месяцев включительно-0.25 мл однократно.
Детям младше 9 лет, впервые вакцинируемым против гриппа, показано двукратное введение Ваксигрипа с интервалом 4 недели.
Ваксигрип может применяться одновременно (в один день) с другими вакцинами. При этом препараты водятся в разные участки тела с использованием разных шприцов.
У пациентов, проходящих иммуносупрессивную терапию (кортикостероиды, цитотоксические или радиоактивные препараты), иммунный ответ после прививки может быть недостаточным.
Вакцины против сезонного гриппа
ВАКЦИНАЦИЯ ПРОТИВ ГРИППА: вопросы и ответы
В.К.Таточенко
Каковы особенности разных вакцин против гриппа?
Все гриппозные вакцины содержат актуальные штаммы вирусов гриппа А1, А2 и В, которые с наибольшей
вероятностью будут обусловливать основную массу заболеваний в текущем году (в этом отношении все
вакцины одинаковы). Различия состоят в типе вакцины — используются как инактивированные, так и живые
вакцины. Инактивированные вакцины бывают цельновирионными, расщепленными (сплит-вакцины) и
субъединичными; последние два вида предпочтительны, поскольку они очищены от неиммуногенных липидов
вириона, с которыми связаны основные побочные реакции. Российская субъединичная вакцина Грипол
содержит также иммуностимулятор полиоксидоний. Живые аттенуированные вакцины, в отличие от
инактивированных, способны вызывать местный иммунный ответ.
Различаются вакцины и по наличию консерванта: с учетом настороженности населения в отношении ртутных
соединений, многие вакцины зарубежного производства (Ваксигрип, Инфлювак, Бегривак, Флюарикс)
выпускаются без ртутного консерванта — мертиолята.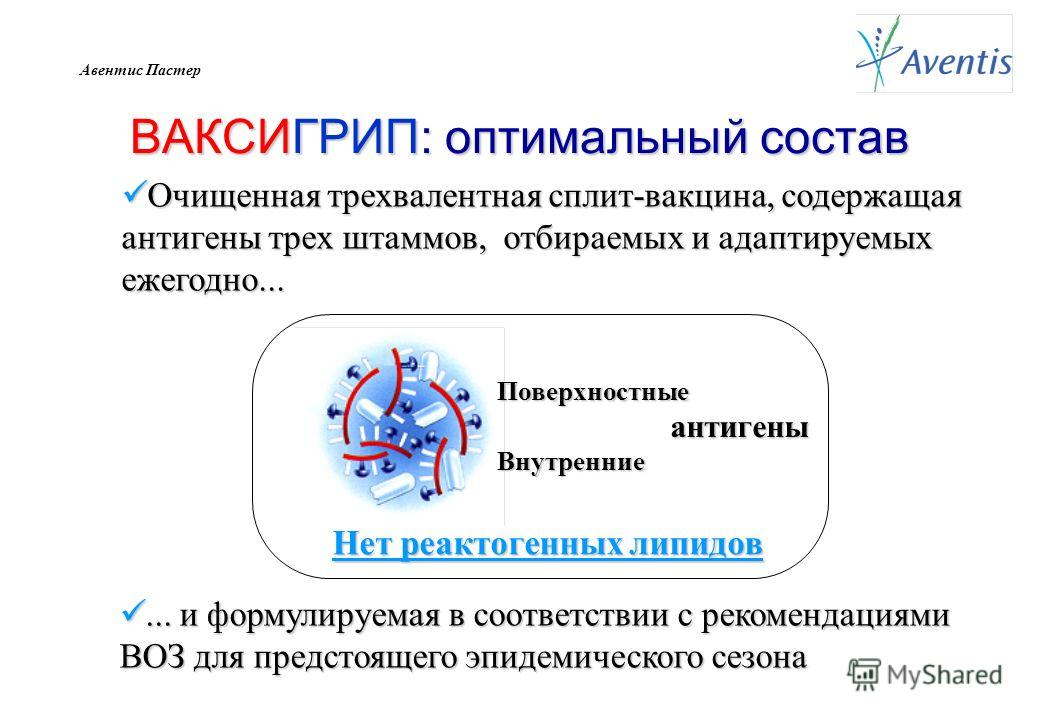
Кто относится к группам высокого риска по гриппу?
Наиболее восприимчивы к гриппу дети, начиная со второго полугодия жизни, еще не имеющие
иммунологического опыта (до 6 месяцев они защищены материнскими антителами). Другой особо
восприимчивой возрастной группой являются пожилые люди, особенно в домах престарелых, у которых
происходит естественное ослабление иммунитета. Помимо возрастных групп риска, грипп опасен для лиц с
хроническими болезнями. Это, в первую очередь, дети с поражениями ЦНС, с сердечной декомпенсацией
(врожденные пороки сердца), патологией органов дыхания (бронхоэктазы, бронхо-легочная дисплазия,
муковисцидоз, бронхиальная астма), почечными и метаболическими заболеваниями, болезнями крови,
иммунокомпрометированные пациенты. Опасен грипп и для взрослых, страдающих хроническими
заболеваниями, в первую очередь, сердечно сосудистой и дыхательной систем, диабетом, рассеянным
склерозом. К сожалению, многими именно хронические болезни рассматриваются как противопоказания к
вакцинации против гриппа.
Вакцинация этих групп является наиболее важной, но и для здоровых детей, подростков и взрослых она
далеко небесполезна: грипп опасен для каждого, во время эпидемий погибают и вполне здоровые люди.
Какие группы населения в наибольшей степени участвуют в распространении инфекции?
Большая восприимчивость к гриппу детей в условиях организованных коллективов обуславливает
взрывоподобные вспышки. Однако высокая мобильность детей школьного возраста вне школы, делает именно
их ведущим источником распространения инфекции среди остального населения. Помимо этого,
распространяют инфекцию лица «публичных» профессий (работники сферы обслуживания, учебных,
медицинских заведений и др.). Именно эти категории подлежат вакцинации в соответствии с Календарем
вакцинопрофилактики по эпидпоказаниям.
Означает ли включение в Календарь прививок против гриппа только организованных детей нецелесообразность иммунопрофилактики у всех остальных детей?
Нет, прививать желательно всех детей в возрасте старше 6 мес. , однако в качестве первоочередной меры
, однако в качестве первоочередной меры
вакцинации подлежат организованные дети. Большая восприимчивость к гриппу детей в условиях
организованных коллективов обуславливает взрывоподобные вспышки, а высокая мобильность детей,
особенно школьного возраста вне школы делает именно их ведущим источником распространения инфекции
среди остального населения. Опыт вакцинации школьников в Японии показал, что вакцинация школьников
снижает заболеваемость гриппом и смертность от него взрослого населения – 420 прививок школьников
«спасают» от летального исхода 1 взрослого (обычно пожилого).
Наблюдается ли при вакцинации против гриппа развитие коллективного иммунитета?
Безусловно, при вакцинации значительной части (70-80%) коллектива передача инфекции затухает, о чем
имеются вполне достоверные сведения. Вакцинация детей вместе со всеми членами семьи также повышает
эффект прививок. Имеется опыт высокого (около 70%) охвата вакциной целого региона (Свердловская
область) с очень хорошими результатами.
Каковы перспективы расширения вакцинации против гриппа в следующем сезоне в России?
Федеральными властями выделены суммы для закупки вакцин, в т.ч. гриппозных, что позволит существенно
расширить охват прививками детского населения, включив их в Национальный календарь
иммунопрофилактики. В первую очередь, важно привить организованных дошкольников и школьников, что
может существенно повлиять на эпидемический процесс в стране.
Сезонный подъем заболеваемости гриппом наблюдается ежегодно. Значит ли это, что и прививаться от гриппа следует ежегодно?
Этот вопрос часто задают прививаемые от гриппа лица, осведомляясь, через сколько лет можно сделать
перерыв в прививках. Вряд ли на него можно дать однозначный ответ, основанный на строгих исследованиях.
Думается все же, что ежегодная прививка от гриппа должна стать «обычной профилактической мерой» – в
конце концов, мы же не задаем вопрос о том, сколько дней или лет подряд надо чистить зубы для
профилактики кариеса, или мыть руки для профилактики кишечных инфекций. Это тем более очевидно, что
современные вакцины против гриппа очень слабо реактогенны. То, что в будущем будет создана вакцина с
большим сроком защиты – маловероятно из-за известной изменчивости вируса гриппа, но можно быть
уверенным в том, что новые вакцины будут еще более безопасны и, главное, удобны в применении (не будут
требовать инъекции).
Как часто наблюдаются серьезные побочные реакции на введение гриппозных вакцин?
При применении субъединичных и сплит-вакцин — крайне редко, обычно речь идет о покраснении кожи в месте
введения и о невысокой температуре в течение 1-2 дней; в редких случаях возникают нетяжелые
аллергические (возможно также и параллергические) реакции. По итогам вакцинации 2006 г. таких реакций на
почти 30 млн. доз вакцины было около 300, т.е. порядка 1:100 000 доз вакцины. Кратковременная
госпитализация потребовалась единичным детям. Живые гриппозные вакцины также редко дают побочные
эффекты. Поскольку вакцины готовят на куриных эмбрионах, они противопоказаны лицам с анафилактическим
типом реакций на куриный белок.
Профилактика гриппа
Ежегодно в России проводится вакцинация против гриппа, и безусловно, ввиду современных тенденций, огромного количества противоречивой информации, перед каждым из нас встает вопрос, стоит ли вакцинироваться и какую вакцину выбрать. Исследования показывают, что за предыдущие 20 лет охват населения вакцинацией возрос в разы (примерные цифры – 6 млн человек в 2002 году и почти 50 млн человек в 2020 году), при этом отмечается очевидное снижение количества заболевших гриппом. При решении вопроса о целесообразности вакцинации необходимо помнить, что риск побочных реакций после прививки намного меньше, чем риск развития осложнения гриппа.
Прививаться или нет?
Основополагающим фактором для каждого, безусловно является личный опыт или опыт знакомых привитых людей (реакции на вакцинацию и эффективность вакцинации — «заболел или не заболел»). Однако, опыт перенесенной болезни или болезни близких, порой с печальным исходом, для нас часто становится более важным критерием для решения в пользу современного и безопасного способа защиты от гриппа.
Прививаться следует всем, кто имеет широкий круг общения, и тем, для кого грипп смертельно опасен – пожилые люди, дети младше 6ти лет, беременные (по согласованию с наблюдающим врачом), люди с хроническими болезнями дыхательных путей, людям, страдающим аллергией.
Когда прививаться?
Основной пик заболеваемости гриппом приходится на январь-февраль, однако единичные случаи наблюдаются в ноябре и марте. Эффект от вакцинации наступает примерно через 2 недели от введения вакцины (для каждого человека это могут быть индивидуальные сроки) и длится до 12 месяцев (показатель усредненный).
Какую вакцину выбрать?
В России разрешены к применению несколько видов вакцин, однако наибольшую распространенность приобрели сплит-вакцины (Ваксигрип, Ультрикс) и субьединичные (Инфлювак, Гриппол плюс, Совигрип). Каждая вакцина содержит три штамма вируса, которые выращиваются на куриных эмбрионах, инактивируются и центрифугируются (расщепляются). Ежегодно состав обновляется по рекомендациям Всемирной организацией здравоохранения (процесс определения состава вакцины осуществляется на основании длительного мониторинга циркулирующих штаммов). В течение длительного времени (более 20 лет), на основании полученного опыта, было определено, что количество антигена (основного компонента вакцины, который дает сигнал иммунной системе для выработки защитных веществ — антител) каждого штамма гриппа должно быть не менее 15 мкг для большинства стран северного полушария. Сплит-вакцина содержит в себе части оболочки вируса (поверхностные «сигнальные» антигены – гемаглютинин и нейраминидазу) часть белка матрикса вируса и часть генетического материала вируса в то время, как субъединичная вакцина содержит только поверхностные антигены (гемагглютинин и нейраминидазу). После вакцинации у привитого вырабатываются специальные защитные вещества – антитела, — которые в случае атаки «настоящего» вируса блокируют его прикрепление к клетке, способствуют слипанию вирусных частиц и способствуют их удалению. Человек защищен уже через 2 недели после вакцинации. Исследования показывают, что нарастание количества защитных антител при использовании сплит-вакцин происходит несколько быстрее, чем субъединичных (почти вдвое), однако и спад титра происходит быстрее (6-9 месяцев в случае сплит-вакцин, против субъединичных – 9-12 месяцев). Но эти показатели усреднены, ввиду того, что каждый человек индивидуален и отклик иммунной системы у каждого специфичен.
Кому нельзя вакцинироваться?
- Беременным в 1м триместре, однако ведутся активные исследования и, возможно, что скоро и эту группу населения охватит вакцинация;
- людям в разгар острых инфекций, причем вакцинироваться можно уже сразу после выздоровления, не выжидая 2х недельный период;
- тем, у кого документально зафиксирована тяжелая аллергия на яйца. Если в прошлом были легкие реакции на куриный желток и белок, то это не будет являться противопоказанием к вакцинации;
- и тем, у кого в анамнезе сильные реакции (аллергические, подъем температуры выше 40) на предыдущее введение вакцины;
Как готовится к вакцинации?
Вакцинация не терпит суеты!
Детям до 6 лет и впервые проводящим вакцинопрофилактику, желательно предварительно сдать общий анализ крови и мочи, чтобы максимально предотвратить возможные реакции и осложнения
Сообщить врачу о своих хронических заболеваниях и об опыте предыдущих прививок
После прививки находится в медицинском учреждении не менее 30 минут. Вакцинальные кабинеты оснащены всем необходимым для предотвращения немедленных реакций. После истечения этого времени бояться аллергических реакций уже не стоит.
В день прививки не принимать ванну, отменить посещение бань, саун, спортивных секций.
Возможные реакции на прививку:
Могут отмечаться в первые 2-3 дня после прививки и проходят самостоятельно – повышение температуры (при 37,5 уже можно принять жаропонижающие средства), боль в месте инъекции, слабость. Сравнение вакцин показывает, что подобные явления могут отмечаться в случае применения как сплит-вакцин, так субъединичных в равной степени.
| Осмотр перед вакцинацией | |
| Осмотр врача перед вакцинацией | 1500 |
| Наименование услуги | |
|---|---|
| Ваксигрип — вакцинация против гриппа | 1000 |
| Инфлювак — вакцинация против гриппа | 1000 |
| Ультрикс — вакцинация против гриппа | 1000 |
| Ультрикс квадри — вакцинация против гриппа | 1200 |
Позвоните нам, мы расскажем все подробнее: 8 (499) 955-48-27
Оставьте заявку
мы подберем для вас удобное время
Адрес и схема проезда:
109147, Москва, ул. Нижегородская, д. 2, к. 1
Опытные квалифицированные врачи
Современные медицинские технологии
Заботливый персонал
Комплексное лечение
Диагностика по выгодным ценам
Удобное расположение около метро Таганская и Жулебино
новая французская 4-х валентная сплит-вакцина для профилактики ГРИППа
ВАКЦИНАЦИЯ – ЭТО САМАЯ ДОСТУПНАЯ ЗАЩИТА ОТ ГРИППА
Почему мы прививаем 4-валентной вакциной?
Вирус гриппа эволюционирует. Вакцинная композиция отражает эволюцию вируса:
• моновакцина в 1933,
• 2-компонентная в 1942,
• 3-компонентная в 1978,
• 4-компонентная в 2013
С 2000-х гг. линии Виктория и Ямагата вирусов гриппа B распространялись совместно. Оба штамма гриппа В могут распространяться одновременно в одном и том же сезоне и даже в рамках одной и той же страны/региона/полушария.
3-х валентная вакцина против гриппа включает два штамма вируса типа А и один штамм вируса типа В.
4-х валентная вакцина против гриппа обеспечивает более широкую защиту, так как включает два штамма вируса типа А и два штамма вируса типа В.
При интенсивной активности гриппа В он может оказать воздействие, схожее с гриппом А (клинические признаки инфекции гриппа B практически неотличимы от гриппа А). Соответственно, 3- компонентная вакцина не сможет дать оптимальную защиту.
С 2018 года 4-валентные вакцины рекомендуются ВОЗ в приоритетном порядке, так как содержат четыре штамма вируса гриппа (A/h2N1, A/h4N2, и оба штамма B/Виктория и B/Ямагата)
Когда прививаться?
Вакцинация против гриппа начинается с конца октября и продолжается в течение всего сезона, т.к. его продолжительность варьируется, а активность гриппа может проявиться и в феврале, и в марте.
Постановлением Министерства здравоохранения Республики Беларусь 17.05.2018 г. № 42 о профилактических прививках разработан «Национальный календарь профилактических прививок».
Кому рекомендована вакцинация от гриппа?
Дети в возрасте от 6 месяцев до 3 лет;
Дети в возрасте от 3 лет и взрослые с хроническими заболеваниями;
Лица с иммуносупрессией;
Лица в возрасте старше 65 лет;
Беременные женщины;
Медицинские, фармацевтические работники;
Дети и взрослые, находящиеся в учреждениях с круглосуточным режимом пребывания;
Работники государственных органов, обеспечивающие безопасность государства и жизнедеятельность населения
Вакцина против гриппа с расщепленным вирусом быстро активирует иммунные клетки через рецепторы Fcγ
Резюме
Сезонная вакцинация против гриппа — одна из наиболее распространенных медицинских процедур, и тем не менее, степень, в которой она активирует иммунную систему, помимо индукции выработки антител, до конца не изучена. В Соединенных Штатах наиболее распространенные составы вакцины состоят из деградированных или «расщепленных» вирусных частиц, распределенных без каких-либо адъювантов. Основываясь на предыдущих отчетах, мы попытались определить, активирует ли сплит-вакцина против гриппа рецепторы врожденного иммунитета, в частности рецепторы, подобные Toll.Высокомерное протеомное профилирование цельной крови человека с использованием цитометрии по времени пролета (CyTOF) было использовано для сравнения активации сигнального пути и продукции цитокинов между сплит-вакциной против гриппа и прототипным ответом TLR ex vivo . Этот анализ показал, что сплит-вакцина быстро и эффективно активирует несколько типов иммунных клеток, но дает протеомную сигнатуру, совершенно отличную от активации TLR. Важно отметить, что активность, индуцированная вакциной, зависела от присутствия сыворотки человека, что указывало на то, что сывороточный фактор необходим для вакцино-зависимой иммунной активации.Мы обнаружили, что этот сывороточный фактор представляет собой человеческие антитела, специфичные к белкам гриппа, и поэтому немедленная иммунная активация сплит-вакциной зависит от иммунного комплекса. Эти исследования демонстрируют, что «расщепление» вируса гриппа инактивирует любые потенциальные адъюванты, эндогенные для гриппа, такие как РНК, но у ранее подвергшихся воздействию людей может вызвать мощный иммунный ответ, способствуя быстрому образованию иммунных комплексов.
Ключевые слова: грипп, вакцина, рецепторы Fcγ, иммунология, массовая цитометрия
Введение
Грипп — вирусный респираторный патоген, вызывающий значительную заболеваемость и смертность во всем мире.Ежегодно от сезонных инфекций гриппа умирает от 250 000 до 500 000 человек, и многие другие госпитализируются [1]. Вакцинация в настоящее время является основной стратегией, используемой для снижения заболеваемости и смертности [2].
Первая вакцина против гриппа, лицензированная в США, состояла из фиксированных формалином частиц цельного инактивированного вируса (WIV) [3]. Препарат WIV, хотя и считался высоко иммуногенным, также был очень реактогенным, что часто приводило к воспалению в момент инъекции и лихорадке [4].Из-за этих побочных реакций препарат WIV был заменен вакциной на основе расщепленного вируса (SV), в которой вирусные частицы сначала инактивируются, а затем разрушаются детергентом или эфиром [5]. Расщепление частиц гриппа повышает безопасность вакцины, но снижает иммуногенность, особенно у людей, в основном у детей, которые иммунологически не восприимчивы к гриппу [6,7].
В настоящее время вакцина сплит-вируса является наиболее распространенной вакциной против гриппа, назначаемой для взрослых, и распространяется в США без адъюванта.Клинические исследования вакцины против гриппа в первую очередь сосредоточены на количественной оценке адаптивных иммунных реакций, которые развиваются в течение нескольких дней или недель. Фундаментальные исследования врожденного иммунного ответа на инфекцию гриппа обычно концентрируются на том, как инфекционные вирусные частицы (не расщепленные частицы вакцины) активируют рецепторы распознавания образов (PRR), такие как Toll-подобные рецепторы (TLR). Поэтому мало что известно о точных механизмах, посредством которых СВ активирует ранние или врожденные иммунные ответы.
Врожденная иммунная активация считается ключевой особенностью успешных вакцин для человека, таких как вакцина против вируса осповакцины и желтой лихорадки [8,9].Таким образом, мы стремились оценить немедленный ответ иммунных клеток на SV ex vivo . Предыдущие исследования, проведенные в основном на моделях грызунов, предполагают, что вирусная РНК является основным ассоциированным с патогеном молекулярным паттерном, генерируемым WIV, и что расщепление частиц инактивирует вирусную РНК [10–12]. Другие исследователи оспорили этот вывод и утверждают, что вирусная РНК активна в сплит-вакцине [13]. У людей Panda et al. выявил связанное с возрастом снижение функции TLR, которое может предсказывать in vivo серологических ответов у иммунизированных SV [14].До сих пор остается неясным, является ли эта связь причинной или вакцина против гриппа SV может задействовать TLR. Недавнее исследование показало, что вакцинация против SV вызывает транскрипционную активность in vivo в течение нескольких часов после вакцинации человека [15]. Эта ранняя транскрипционная сигнатура включает моноциты, NK-клетки и интерфероны (IFN). Инициирующее событие (я), вызывающее эту раннюю сигнатуру in vivo , неизвестно [15].
Высокоразмерное протеомное профилирование с использованием масс-цитометрии и технологии luminex было использовано для количественной оценки активации сигнального пути и продукции цитокинов во всех основных популяциях иммунных клеток цельной крови человека, стимулированных SV ex vivo .В качестве положительного контроля мы сравнили SV с активацией TLR на основе прототипной РНК через TLR 7/8.
Неожиданно SV быстро и сильно индуцировал сигнальные реакции в иммунной системе. Анализируя подмножество параметров, можно сказать, что активация иммунной системы, вызванная SV, была подобна передаче сигналов TLR7 / 8; однако более широкий анализ сигнальных путей продемонстрировал, что SV вызывает протеомную сигнатуру, перекрывающуюся с активацией TLR, но очень отличную от нее. Последующие исследования показали, что стимулирующая активность вакцины зависела от присутствия сыворотки человека, поскольку активность SV была очевидна в цельной крови человека, но отсутствовала, когда человеческие клетки культивировали в клеточной среде с бычьей сывороткой.Наконец, было обнаружено, что антитела иммуноглобулина G (IgG), специфичные к белкам гриппа, необходимы для индуцированных SV ответов, и, таким образом, образование иммунных комплексов и активация рецептора Fc являются начальным событием при вакцинации против гриппа SV.
Эти данные позволяют предположить, что вирусная РНК, скорее всего, не имеет отношения к вакцинации против SV человека, а также подчеркивает потенциальную важность образования иммунных комплексов в контексте вакцинации против гриппа и других вакцин, нацеленных на ранее подвергшихся воздействию людей.Концептуально это важный вывод для исследований, направленных на создание более эффективных противогриппозных вакцин и на определение прогностических биомаркеров эффективности вакцинации против гриппа в группах риска.
Материалы и методы
Участники исследования
Все доноры были взрослыми и участвовали в исследовании по анализу цельной крови или в исследовании вакцинации, проводимом программой Stanford-LPCH Vaccine Program. Все участники исследования были здоровыми взрослыми, средний возраст составил 32 года.Субъекты с плохим здоровьем были исключены. 70% участников были мужчинами, 30% — женщинами. Субъекты были включены независимо от истории вакцинации. Концентрации анти-SV IgG в донорской плазме варьировали от 25 до 500 мкг / мл. Протоколы исследования были одобрены институциональным наблюдательным советом Управления по соблюдению требований исследований в Стэнфордском университете. Информированное согласие было получено от всех субъектов. Данные были проанализированы с помощью W.O.G или H.H.
Вакцины и вирусы
В исследованиях стимуляции использовались трехвалентные инактивированные вакцины против гриппа 2011–2012 и / или 2012–2013 годов (Fluzone; Sanofi Pasteur).Цельный инактивированный вирус получали из очищенных аттенуированных штаммов гриппа (Medimmune), которые обрабатывали 0,02% формальдегидом при 37 ° C в течение 12 часов. Были использованы следующие штаммы: A / California / 07/2009 h2N1, A / Victoria / 210/2009 h4N2, A / Victoria / 361/2011 h4N2, B / Brisbane / 60/2008, B / Texas / 6/2011. Мы рассчитали, что общая концентрация белка Fluzone составляет 300 мкг / мл, используя анализ Брэдфорда.
Клетки и стимулы
Свежевыделенную цельную кровь человека собирали в гепаринизированные вакутайнеры (BD) и использовали в неизмененном виде или промывали средой RPMI 1640 (Life Technologies) при комнатной температуре 2–3 раза для получения обедненной плазмой цельной крови.Промытые клетки WB ресуспендировали в среде RPMI без добавок. Мононуклеарные клетки периферической крови (PBMC) получали центрифугированием в градиенте плотности (Ficoll-Paque; GE healthcare) и культивировали в среде RPMI 1640 + 10% FBS или AIM V (Life Technologies). Клетки стимулировали при различных концентрациях SV в течение 30 минут или 6 часов, а затем фиксировали в течение 15 минут при 37 ° C с помощью буфера для лизиса / фиксации Phosflow (BD). В исследованиях предварительной инкубации SV SV разводили 1:10 в 100% плазме человека в течение 30 минут при 4 ° C, а затем добавляли к промытым WB или PBMC в разведении 1:20.SV был образован комплексом с белком A / G, очищенным на спин-колонке (Pierce), поликлональным IgG в соотношении 0,3 мкг SV (1 мкл неразбавленной вакцины) на 75 мкг IgG в течение 30 минут (при 7,5 мг / мл) перед добавлением SV + IgG к PBMC в концентрации 0,75–3 мкг / мл SV. HAG генерировали нагреванием очищенного IgG до концентрации 5 мкг / мл в течение 20 минут при 63 ° C. Рекомбинантный гемагглютинин гриппа h2N1 и собственные белки были приобретены в Sino Biological. R848 был куплен у Invivogen. Поликлональный F (ab ‘) 2 получали с использованием набора для микроизоляции F (ab’) 2 (Pierce).
Массово-проточная цитометрия
Информация о клонах и конъюгации для всех используемых mAb показана на рисунке S1. Числа, связанные с mAb на Фигуре S1, представляют собой атомные массы изотопов лантаноидов, которые были хелатированы с полимерами, а затем конъюгированы с указанными mAb. Поверхность клеток окрашивали и затем подвергали проницаемости либо ледяным метанолом для анализа сигналов, либо буфером Perm / Wash I (BD) для анализа цитокинов. Для проточной цитометрии клетки анализировали на LSRII (BD).Для массовой цитометрии клетки обрабатывали интеркалятором иридия (DVS Sciences) перед анализом на CyTOF (DVS Sciences). Данные были проанализированы с помощью Flowjo (Treestar). Сигнальные ответы на основе масс-цитометрии определяли количественно, как описано ранее [16]. Ответы цитокинов на основе масс-цитометрии и ответы, основанные на проточной цитометрии, количественно оценивали с помощью пороговых сигнальных ответов на основе 100 отсчетов или 99 -го процентиля для контролей, обработанных PBS.
Luminex (наборы для ELISA с захватывающими гранулами)
В соответствии с рекомендациями производителя использовали человеческий набор 51-plex luminex (Affymetrix).Цитокиновые ответы количественно оценивали путем деления средней интенсивности флуоресценции (MFI) шариков захвата из стимулированной плазмы на MFI шариков из нестимулированной плазмы.
Результаты
Сравнение активации сигнальной сети между вакциной SV и агонистом TLR7 / 8
Активность SV и TLR сравнивали с использованием массовой цитометрии для проведения систематического анализа сигнальных путей. В массовой цитометрии элементарные метки используются для обеспечения беспрецедентного уровня размерности в анализе отдельных клеток [16,17].Одновременно измеряли 30 параметров, чтобы разобрать сложность клеток в крови человека и контролировать ключевые пути передачи сигналов с использованием специфичных для фосфорилирования моноклональных антител (mAb). Используя этот подход, были определены 8 клеточных популяций с 19 поверхностными маркерами и зондированы с помощью 11 mAb, специфичных к отдельным сигнальным молекулам (рисунок S1). В частности, пути ERK / mTOR, гистонов, стресса, NFκB и STAT отслеживались в моноцитах CD14hi, моноцитах CD16hi, гранулоцитах, плазматических дендритных клетках (pDC), обычных дендритных клетках (cDC), естественных клетках-киллерах (NK), B-клетках. , и Т-клетки.Использовались методы цельной крови, поскольку было обнаружено, что центрифугирование фиколла в плотной среде активирует моноциты CD14hi (как описано ранее [18]).
Частицы инфекционного гриппа активируют множественные PRR [19]; однако инактивация вируса посредством фиксации ограничивает иммунное обнаружение только чувствительностью TLR7 к вирусной РНК в pDC [10]. В некоторых исследованиях сообщалось, что расщепление вируса инактивирует вирусные РНК [11,12], но недавний отчет предполагает, что вирусная РНК присутствует в сплит-вакцинах и служит внутренним адъювантом [13].Мы использовали коммерческие составы сплит-вакцины против гриппа 2011–2012 и 2012–2013 годов (Fluzone; Sanofi Pasteur) для моделирования клинического воздействия на человека. В качестве положительного контроля для индуцированной РНК активации мы стимулировали клетки крови ex vivo с помощью низкомолекулярного агониста резиквимода (R848), который специфичен для TLR 7 и 8. Было показано, что РНК гриппа активирует человеческие TLR 7 и 8 [20 ].
Неожиданно SV быстро активировал множественные сигнальные пути в различных популяциях клеток, но в целом дал протеомную сигнатуру, отличную от стимуляции TLR7 / 8 ().В миелоидных клетках SV индуцировал фосфорилирование ERK, рибосомного белка S6 (S6), CREB и гистона h4 — молекул, участвующих в передаче сигналов MEK, PI3K и mTOR [21]. Однако SV не стимулировал стресс-киназы, такие как p38 и MAPKAPK2, или путь NFκB, на что указывает отсутствие общей деградации IκBα. Напротив, R848 активирует почти все сигнальные пути в миелоидном клоне. Важно отметить, что фосфорилирование p38 является отличительной чертой почти всех ответов TLR и, таким образом, является ключевым различием между этими профилями передачи сигналов.
Сравнение активации сигнальной сети, вызванной либо SV, либо агонистом TLR7 / 8 . (A и B) Свежевыделенную цельную кровь человека стимулировали PBS, SV (15 мкг / мл) или R848 (10 мкг / мл) в течение 30 минут до лизиса и фиксации эритроцитов. Затем клетки окрашивали меченными изотопами mAb против поверхностных белков и сигнальных белков и готовили для 31-параметрического масс-цитометрического анализа. Популяции клеток были идентифицированы как CD11c + CD33 + HLADR + CD14hi Моноциты, CD11c + CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, HLADR + CD623 s + CD123 s + , HLADR + CD1c + cDC, CD3 — CD7 + NK-клетки, CD19 + CD20 + B-клетки и CD3 + T-клетки.См. Рисунок S1 для подробной стратегии стробирования. Индукция передачи сигналов рассчитывалась как разница средней интенсивности arcsinh по сравнению с контролем PBS. Репрезентативный эксперимент показан из 4 независимых экспериментов по массовой цитометрии, проведенных на 7 взрослых донорах.
Активность, индуцированная
SV, также отличалась от стимуляции TLR7 / 8 в лимфоцитах. NK-клетки были активированы вакциной, но не ответили на R848, что согласуется с отсутствием экспрессии TLR7 / 8 в этих клетках [22]. B-клетки были активированы R848, но лишь слабо затронуты SV.Ни один из стимулов не активировал Т-клетки. И SV, и R848 также индуцировали шеддинг CD16 (FcγRIII) в моноцитах и NK-клетках (данные не показаны). Ответы SV в моноцитах наблюдались у всех отобранных доноров, в то время как ответы NK-клеток и дендритных клеток наблюдались стабильно, но только у отдельных доноров. Никакой ранней активности в путях STAT не наблюдали ни в одном типе клеток через 30 минут (данные не показаны).
Затем мы попытались сравнить чувствительность иммунных клеток человека к SV и R848, чтобы убедиться, что SV активен при низких концентрациях.Подобно R848, SV демонстрирует высокую активность при концентрациях нанограмм на миллилитр, что составляет 1/500 th разовой дозы вакцины (). Чтобы убедиться, что активность SV не связана с компонентами вакцины, не связанными с гриппом, мы стимулировали цельную кровь желатином, этоксилатом октилфенола и тимеросалом и не обнаружили обнаруживаемой активности (данные не показаны).
Динамика доза-ответ СВ по сравнению со стимуляцией TLR7 / 8. Цельную кровь стимулировали при различных концентрациях SV или R848 и отслеживали фосфорилирование S6 с помощью 10-параметрической проточной цитометрии.Популяции клеток были определены как CD33 + HLADR + CD14hi Моноциты, CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, CD33 + HLADR + CD14 — CD16 — c , CD56 + NK-клетки, CD20 + B-клетки и CD3 + T-клетки. Индукцию передачи сигналов рассчитывали как% клеток, демонстрирующих более высокое, чем базальное фосфорилирование S6. Показаны средние точки данных реплик от 1 донора.
Сравнение продукции цитокинов вакциной SV и агонистом TLR7 / 8
Активация сигнального пути в иммунных клетках часто вызывает выработку цитокинов, которые опосредуют межклеточную коммуникацию. Панель окрашивания на основе массовой цитометрии, способная измерять продукцию паниммунных цитокинов, использовалась для сравнения SV со стимуляцией TLR7 / 8. Эта панель внутриклеточного окрашивания цитокинов (ICS) состоит из поверхностных маркеров, упомянутых ранее, а также mAb против IL-1β, IL-1RA, IL-2, IL-4, IL-6, IL-12 (p40), IL-17A. , MCP1 (CCL2), TNFα, IFNγ, IFNα, перфорин и GM-CSF.Цельную кровь стимулировали либо SV, либо R848 в течение 6 часов перед лизисом и фиксацией эритроцитов (RBC). И брефельдин, и монензин добавляли в кровь в начале анализа или после 2–3 часов стимуляции.
Систематическое профилирование продукции цитокинов показало, что SV и R848 индуцируют разные паттерны экспрессии цитокинов (). В моноцитах CD14hi оба стимула индуцировали выработку хемокина MCP1 — молекулы, способной привлекать моноциты и дендритные клетки к участкам воспаления [23].IL-1RA, противовоспалительный цитокин, также индуцировался обоими стимулами, но гораздо сильнее R848. Важно отметить, что основные провоспалительные цитокины (IL-1β, IL-6, TNFα и IL-12), исследованные в моноцитах, индуцировались только стимуляцией TLR7 / 8, а не SV. В NK-клетках SV индуцировал продукцию TNFα, а также IFNγ. Хотя R848 не активировал сигнальные пути в NK-клетках, он действительно вызывал некоторую продукцию цитокинов, скорее всего, вызванную паракринным механизмом. Продукция IFNα в pDC является отличительным признаком активации TLR7 [10] и, как и ожидалось, вызывается R848.Напротив, SV не вызывал продукции IFNα, что согласуется с отсутствием SV-зависимой активации p38 в pDC. изображает разницу в этих ответах от 3 разных доноров. Кинетика дозы для продукции внутриклеточных цитокинов показана на рисунке S2A.
Сравнение продукции цитокинов SV и агониста TLR7 / 8. (A) Свежевыделенную цельную кровь человека стимулировали PBS, 15 мкг / мл SV или 5 мкг / мл R848 в течение 6 часов до лизиса и фиксации эритроцитов. Ингибиторы секреции добавляли либо для всей стимуляции (SV), либо через 2 часа (R848).Затем фиксированные клетки готовили для 34-параметрического масс-цитометрического анализа внутриклеточного окрашивания цитокинов (ICS). Цитокин-положительные моноциты и pDC определялись как клетки, показывающие сигнал, превышающий 10 2 отсчетов. Цитокин-положительные NK-клетки были определены как клетки, показывающие сигнал выше 99 -го процентиля нестимулированных клеток. SV также не индуцировал IFNα в pDC, когда ингибиторы секреции добавляли через 2 часа. Показан один репрезентативный эксперимент. (B) Количественная оценка дисперсии продукции цитокинов на основе 5 независимых экспериментов, проведенных на 3 взрослых донорах.Гистограммы показывают среднее значение ± стандартное отклонение.
Анализы окрашивания внутриклеточных цитокинов ограничены тем, что они оценивают продукцию цитокинов, но не секрецию из-за обязательной потребности в ингибиторах секреции. Чтобы убедиться, что MCP1 секретируется моноцитами, активированными SV, и для обнаружения цитокинов, не включенных в нашу панель массовой цитометрии, мы использовали технологию luminex для количественного определения секреции 51 цитокина в плазме человека [24]. Цельную кровь собирали у 15 взрослых добровольцев и стимулировали ex vivo SV в течение 6 часов.Цитокины, демонстрирующие как минимум 5-кратное увеличение среднего сигнала флуоресценции после усреднения всех 15 субъектов, показаны на рисунке S2B. В частности, Mip1α (CCL3), IP-10 (CXCL10), IL-8, TNFα, Mip1β (CCL4), MCP1 и IL-1RA секретировались на высоких уровнях у большинства субъектов.
Иммунные комплексы, полученные из белка гриппа, ответственны за индуцированную SV активность
ex vivo
При исследовании механизмов, посредством которых SV стимулирует иммунные клетки человека, было обнаружено, что SV не может стимулировать мононуклеарные клетки периферической крови (PBMC) в стандартной культуре ткани. условия ().Впоследствии мы предположили, что фактор в плазме крови человека необходим для активации иммунной системы, вызванной SV. Чтобы оценить эту гипотезу, SV сначала предварительно инкубировали с плазмой, а затем добавляли либо к обедненной плазмой цельной крови, либо к PBMC, чтобы определить, спасает ли это нечувствительность SV. Поскольку рибосомный белок S6 является почти концевым ответным элементом в передаче сигналов ERK / mTOR [25], мы отслеживали его фосфорилирование как общий маркер активации для множества типов клеток. Примечательно, что SV, предварительно инкубированный с плазмой, может стимулировать моноциты CD16hi ().Таким образом, фактор сыворотки человека в дополнение к SV необходим для активации иммунных клеток.
Активность передачи сигналов SV индуцируется иммунными комплексами, производными от белка гриппа. (A) Цельную кровь и PBMC, полученные с помощью центрифугирования с плотностью фиколла, стимулировали либо PBS, SV, либо R848 при 10 мкг / мл в течение 30 минут перед фиксацией и анализом проточной цитометрии, как в. Показаны репрезентативные данные, изображающие моноциты CD16hi из 3 экспериментов (2 донора). (B) Цельная цельная кровь или цельная кровь без плазмы стимулировалась либо SV, SV, предварительно инкубированной с аутологичной плазмой, SV, предварительно инкубированной с аутологичным очищенным поликлональным человеческим IgG, либо рекомбинантным гемагглютинином h2N1 (5 мкг / мл) для За 30 минут до фиксации и анализа проточной цитометрии.См. Раздел «Методы» для получения подробной информации о предварительной инкубации. Показаны репрезентативные данные из 7 экспериментов.
Учитывая обилие антител против белков гриппа, особенно гемагглютинина (HA), в плазме человека казалось вероятным, что активность SV может быть связана с образованием иммунных комплексов и активацией рецептора Fc. В соответствии с этим предсказанием, предварительная инкубация SV с очищенным поликлональным человеческим IgG может также восстановить активность SV в истощенных сывороткой моноцитах цельной крови ().Аналогичные результаты были получены для NK-клеток, стимулированных в формате PBMC, а также в популяциях обогащенных NK-клеток и моноцитов CD16hi (фиг. S3). В концентрациях, используемых для восстановления активности SV, ни IgG, ни плазма по отдельности не активировали S6 (данные не показаны). IgG был единственным плазменным фактором, необходимым для активности SV, поскольку обедненная по IgG плазма не проявляла активности при предварительной инкубации с SV (данные не показаны). Фигура S4 демонстрирует, что продукция цитокинов в ответ на SV также зависела от присутствия IgG.Эти эксперименты в значительной степени предполагают, что иммунные комплексы, полученные из белков гриппа, ответственны за активацию сигнального пути, индуцированную SV, и продукцию цитокинов. Данные о моноцитах CD16hi показаны потому, что фосфорилирование S6 в моноцитах CD14hi может быть активировано центрифугированием, а моноциты CD16hi — нет.
Чтобы продемонстрировать, что эта активность зависит от белка гриппа, мы стимулировали интактную цельную кровь и цельную кровь с обедненной плазмой рекомбинантным НА из штамма h2N1. Подобно SV, HA проявляет активность только в моноцитах в присутствии плазмы человека ().Рекомбинантные белки человека (LAMP1 и HER2), полученные в тех же условиях, использовали в качестве отрицательного контроля и не стимулировали цельную кровь (данные не показаны). Основываясь на этих доказательствах, запуск рецептора Fcγ (FcγR) иммунными комплексами SV был наиболее правдоподобным объяснением активности SV.
FcγR экспрессируются во всей иммунной системе в соответствии с наблюдаемыми моделями стимуляции SV (Рисунок S5) [26]. В частности, CD64 (FcγRI), CD32 (FcγRII) и CD16 (FcγRIII) все по-разному экспрессируются в разных популяциях моноцитов.CD16 экспрессируется большинством NK-клеток. В-клетки экспрессируют только CD32, а большинство Т-клеток не экспрессируют никаких FcγR. Затем мы попытались определить, зависит ли активность SV от Fc-части IgG. Были продуцированы поликлональные белки F (ab ‘) 2 , которые, как и ожидалось, не смогли восполнить недостаток активности SV в условиях отсутствия сыворотки человека (). Чтобы подтвердить, что белки F (ab ‘) 2 все еще могут связываться с SV, иммобилизованную вакцину инкубировали с F (ab’) 2 и использовали антитела против легкой цепи для количественного определения связывания с помощью ELISA.Поликлональный F (ab ‘) 2 связывается с SV, подтверждая, что обработка пепсином не делала белки F (ab’) 2 неспособными реагировать с SV (данные не показаны). Важно отметить, что блокирующие mAb против FcγR были способны специфически ингибировать фосфорилирование рибосомного белка S6 в ответ на иммунные комплексы SV (). Стимуляция иммунного комплекса SV моноцитов CD16hi и NK-клеток (формат PBMC) блокировалась mAb, нацеленными на CD16 и CD32, но не контрольными mAB изотипа. Таким образом, активность SV в этих типах клеток зависит от интактной области Fc IgG, а также от CD16 и CD32.
Активация SV зависит от Fc и FcγR. (A) Цельную кровь без плазмы стимулировали PBS, SV предварительно инкубировали с поликлональным F (ab ‘) 2 или SV предварительно инкубировали с интактным IgG. Показаны репрезентативные данные из 2 экспериментов. (B) PBMC, обработанные блокирующими mAb против CD16 и CD32 или mAb изотипического контроля, стимулировали 0,75–3 мкг / мл комплексов SV + IgG в течение 30 минут перед фиксацией и анализом фосфорилирования S6. Показаны репрезентативные данные из 3 экспериментов, проведенных на 2 донорах.
Чтобы независимо оценить, является ли протеомная сигнатура, индуцированная SV, зависимой от FcγR, мы проанализировали эффекты агрегированного при нагревании IgG (HAG) на иммунные клетки человека. HAG, как и иммунные комплексы гриппа, избирательно стимулировал передачу сигналов ERK / mTOR, но не пути p38 или NFκB в миелоидных клетках (рисунок S6). HAG также вызывал моноцитарную продукцию MCP1 в цельной крови человека и продукцию IFNγ и TNFα NK-клетками в PBMC (данные не показаны).
Составы противогриппозной вакцины различаются по протеомным ответам
Мы оценили, зависела ли секреция цитокинов, индуцированная SV, также от человеческой сыворотки, используя luminex ().Подобно фосфорилированию рибосомного белка S6, SV-зависимая секреция цитокинов происходила только в формате цельной крови. Напротив, весь инактивированный вирус имел активность как в цельной крови, так и в PBMC. В целом, WIV индуцировал такие же цитокины, как SV, за исключением IL-8 и IFNα. WIV-зависимая продукция IFNα предполагалась на основании предыдущих исследований, которые показали, что эта активность зависит от РНК [10]. Мы также обнаружили, что лечение WIV РНКазой снижает продукцию IFNα (данные не показаны).
Сравнение различных вакцин. (A) Цельную кровь или PBMC стимулировали 15 мкг / мл SV или WIV в течение 6 часов перед центрифугированием и выделением плазмы или супернатанта. Кратное изменение MFI рассчитывали, как показано на рис. S2B. Показаны репрезентативные данные из 4 независимых экспериментов; гистограммы показывают среднее значение ± стандартное отклонение от 3 доноров. (B) Цельную кровь стимулировали (0,3 мкг / мл HA) расщепленными или живыми аттенуированными вирусными частицами в течение 40 минут и анализировали на активацию сигнального пути, как в. Показано среднее отклонение дуги ± стандартное отклонение от 3 доноров.
Наконец, мы попытались определить, вызывает ли сплит-вакцина более быстрые и сильные ответы FcγR, чем интактные вирусные частицы. SV сравнивали с живым ослабленным вирусом гриппа (LAIV) в анализах передачи сигналов (). Было обнаружено, что при эквивалентных концентрациях HA SV является гораздо более мощным индуктором немедленных сигнальных ответов, чем LAIV. Однако в более поздние моменты времени (3 часа) LAIV вызывал заметную активность, но все еще менее устойчиво, чем SV (данные не показаны).
Обсуждение
Транскрипционная активность крови, индуцированная иммунизацией in vivo SV, обнаруживается в течение нескольких часов и достигает пика через день после вакцинации [15].Модульный анализ этой активности показывает, что пути, участвующие в биологии моноцитов, NK-клеток и интерферона, нарушаются на ранних этапах вакцинации против гриппа. Однако эти транскриптомные подходы еще не показали, какие механизмы вызывают эти ответы. Наши анализы показывают, что вакцина против гриппа активирует моноциты и NK-клетки через FcγR и вызывает продукцию IFNγ, но не IFN типа I. Как сообщалось ранее [10–12], мы также не нашли доказательств того, что РНК в вакцине против SV способна активировать рецепторы TLR.Таким образом, образование иммунных комплексов и активация FcγR, скорее всего, является немедленным иммунным ответом на вакцинацию против SV у людей с уже существующими IgG-антителами против белков гриппа.
Вопрос о том, инактивирует ли расщепление вирусных частиц активность TLR, важен, поскольку было показано, что очень успешные вакцины, такие как вакцина против желтой лихорадки (YFV) и коровьей оспы, активируют множественные PRR [8,9]. Кампании по иммунизации против оспы и YFV были направлены на индукцию иммунитета у субъектов, которые были в значительной степени иммунологически не восприимчивы к этим патогенам.Напротив, вакцинация против гриппа у взрослых обычно происходит при наличии ранее существовавшей иммунологической памяти, вызванной естественным воздействием гриппа. Таким образом, мы обнаружили, что непосредственным эффектом добавления SV в кровь человека было образование иммунных комплексов. Это поднимает важный вопрос о том, как уже существующие специфичные для гриппа АТ влияют на иммунизацию SV. Из-за природы ex vivo этих исследований следует проявлять осторожность, предполагая, что активация миелоидных и NK-клеток иммунными комплексами SV обязательно усилит вакцинацию.Существуют доказательства того, что связывание IgG и образование иммунных комплексов могут как усиливать [27–30], так и ингибировать [31–35] серологические ответы на различные формы антигена. Если активация рецептора Fc может усиливать ответ на вакцинацию, то важно, что SV имел гораздо более непосредственную активность в анализах передачи сигналов, чем LAIV (). Вызванная детергентом диссоциация частиц вируса гриппа, вероятно, обнажит дополнительные вирусные белки (особенно матричные белки), которые маскируются липидными бислоями, полученными из яиц, и, таким образом, будет способствовать более сильному иммунному ответу, опосредованному рецептором Fc, у ранее подвергшихся воздействию хозяев.
В контексте вакцинации против гриппа одним из наиболее прогностических показателей плохого серологического ответа является высокий уровень антител против гемагглютинина гриппа до вакцинации [36–38]. Таким образом, возможно, что предсуществующие Ат против белков SV активно подавляют иммунизационные ответы посредством ингибирования по обратной связи. Степень, в которой такой супрессивный механизм потребует активации FcγR, не совсем ясна, но было показано, что связывание FcγRIIb может подавлять ответы В-клеток на вирусные антигены, связанные с IgG [33].Необходимы дополнительные исследования, чтобы понять, как существующие антитела влияют на реакцию на вакцинацию против гриппа и могут ли определенные адъюванты преодолеть подавление обратной связи, основанное на иммунных комплексах.
Недавний метаанализ клинических исследований показал, что на основании серологических ответов SV более эффективен у взрослых, чем у детей, и, наоборот, LAIV более эффективен у детей, чем у взрослых [39]. Наши наблюдения могут объяснить эту разницу тем, что отсутствие лигандов PRR в SV сделало бы его слабым праймером для инициации иммунных ответов у детей, но он был бы более эффективным у взрослых, потому что ответы зрелой памяти гораздо меньше зависят от активации врожденного иммунитета [10 ].Ключевой вопрос заключается в том, как реактивные или перекрестно-реактивные Т-клетки памяти, В-клетки памяти и уже существующие АТ влияют на последующую вакцинацию против SV или LAIV. Плохой серологический ответ у взрослых, вакцинированных LAIV, можно объяснить нейтрализацией IgA вирусных частиц в слизистой оболочке дыхательных путей до репликации вируса. В целом формирование иммунного комплекса, скорее всего, является важным событием в понимании вакцинации взрослых от гриппа.
Выводы
Эти исследования позволяют по-новому взглянуть на то, как вакцина против SV способствует иммунному ответу, и демонстрируют, как любая вакцина, вводимая ранее контактировавшим с ней людям, вероятно, вызовет аналогичный FcγR-опосредованный ранний ответ.
Вакцина против гриппа с расщепленным вирусом быстро активирует иммунные клетки через рецепторы Fcγ
Резюме
Сезонная вакцинация против гриппа — одна из наиболее распространенных медицинских процедур, но степень, в которой она активирует иммунную систему, помимо индукции выработки антител, не совсем понятна. В Соединенных Штатах наиболее распространенные составы вакцины состоят из деградированных или «расщепленных» вирусных частиц, распределенных без каких-либо адъювантов. Основываясь на предыдущих отчетах, мы попытались определить, активирует ли сплит-вакцина против гриппа рецепторы врожденного иммунитета, в частности рецепторы, подобные Toll.Высокомерное протеомное профилирование цельной крови человека с использованием цитометрии по времени пролета (CyTOF) было использовано для сравнения активации сигнального пути и продукции цитокинов между сплит-вакциной против гриппа и прототипным ответом TLR ex vivo . Этот анализ показал, что сплит-вакцина быстро и эффективно активирует несколько типов иммунных клеток, но дает протеомную сигнатуру, совершенно отличную от активации TLR. Важно отметить, что активность, индуцированная вакциной, зависела от присутствия сыворотки человека, что указывало на то, что сывороточный фактор необходим для вакцино-зависимой иммунной активации.Мы обнаружили, что этот сывороточный фактор представляет собой человеческие антитела, специфичные к белкам гриппа, и поэтому немедленная иммунная активация сплит-вакциной зависит от иммунного комплекса. Эти исследования демонстрируют, что «расщепление» вируса гриппа инактивирует любые потенциальные адъюванты, эндогенные для гриппа, такие как РНК, но у ранее подвергшихся воздействию людей может вызвать мощный иммунный ответ, способствуя быстрому образованию иммунных комплексов.
Ключевые слова: грипп, вакцина, рецепторы Fcγ, иммунология, массовая цитометрия
Введение
Грипп — вирусный респираторный патоген, вызывающий значительную заболеваемость и смертность во всем мире.Ежегодно от сезонных инфекций гриппа умирает от 250 000 до 500 000 человек, и многие другие госпитализируются [1]. Вакцинация в настоящее время является основной стратегией, используемой для снижения заболеваемости и смертности [2].
Первая вакцина против гриппа, лицензированная в США, состояла из фиксированных формалином частиц цельного инактивированного вируса (WIV) [3]. Препарат WIV, хотя и считался высоко иммуногенным, также был очень реактогенным, что часто приводило к воспалению в момент инъекции и лихорадке [4].Из-за этих побочных реакций препарат WIV был заменен вакциной на основе расщепленного вируса (SV), в которой вирусные частицы сначала инактивируются, а затем разрушаются детергентом или эфиром [5]. Расщепление частиц гриппа повышает безопасность вакцины, но снижает иммуногенность, особенно у людей, в основном у детей, которые иммунологически не восприимчивы к гриппу [6,7].
В настоящее время вакцина сплит-вируса является наиболее распространенной вакциной против гриппа, назначаемой для взрослых, и распространяется в США без адъюванта.Клинические исследования вакцины против гриппа в первую очередь сосредоточены на количественной оценке адаптивных иммунных реакций, которые развиваются в течение нескольких дней или недель. Фундаментальные исследования врожденного иммунного ответа на инфекцию гриппа обычно концентрируются на том, как инфекционные вирусные частицы (не расщепленные частицы вакцины) активируют рецепторы распознавания образов (PRR), такие как Toll-подобные рецепторы (TLR). Поэтому мало что известно о точных механизмах, посредством которых СВ активирует ранние или врожденные иммунные ответы.
Врожденная иммунная активация считается ключевой особенностью успешных вакцин для человека, таких как вакцина против вируса осповакцины и желтой лихорадки [8,9].Таким образом, мы стремились оценить немедленный ответ иммунных клеток на SV ex vivo . Предыдущие исследования, проведенные в основном на моделях грызунов, предполагают, что вирусная РНК является основным ассоциированным с патогеном молекулярным паттерном, генерируемым WIV, и что расщепление частиц инактивирует вирусную РНК [10–12]. Другие исследователи оспорили этот вывод и утверждают, что вирусная РНК активна в сплит-вакцине [13]. У людей Panda et al. выявил связанное с возрастом снижение функции TLR, которое может предсказывать in vivo серологических ответов у иммунизированных SV [14].До сих пор остается неясным, является ли эта связь причинной или вакцина против гриппа SV может задействовать TLR. Недавнее исследование показало, что вакцинация против SV вызывает транскрипционную активность in vivo в течение нескольких часов после вакцинации человека [15]. Эта ранняя транскрипционная сигнатура включает моноциты, NK-клетки и интерфероны (IFN). Инициирующее событие (я), вызывающее эту раннюю сигнатуру in vivo , неизвестно [15].
Высокоразмерное протеомное профилирование с использованием масс-цитометрии и технологии luminex было использовано для количественной оценки активации сигнального пути и продукции цитокинов во всех основных популяциях иммунных клеток цельной крови человека, стимулированных SV ex vivo .В качестве положительного контроля мы сравнили SV с активацией TLR на основе прототипной РНК через TLR 7/8.
Неожиданно SV быстро и сильно индуцировал сигнальные реакции в иммунной системе. Анализируя подмножество параметров, можно сказать, что активация иммунной системы, вызванная SV, была подобна передаче сигналов TLR7 / 8; однако более широкий анализ сигнальных путей продемонстрировал, что SV вызывает протеомную сигнатуру, перекрывающуюся с активацией TLR, но очень отличную от нее. Последующие исследования показали, что стимулирующая активность вакцины зависела от присутствия сыворотки человека, поскольку активность SV была очевидна в цельной крови человека, но отсутствовала, когда человеческие клетки культивировали в клеточной среде с бычьей сывороткой.Наконец, было обнаружено, что антитела иммуноглобулина G (IgG), специфичные к белкам гриппа, необходимы для индуцированных SV ответов, и, таким образом, образование иммунных комплексов и активация рецептора Fc являются начальным событием при вакцинации против гриппа SV.
Эти данные позволяют предположить, что вирусная РНК, скорее всего, не имеет отношения к вакцинации против SV человека, а также подчеркивает потенциальную важность образования иммунных комплексов в контексте вакцинации против гриппа и других вакцин, нацеленных на ранее подвергшихся воздействию людей.Концептуально это важный вывод для исследований, направленных на создание более эффективных противогриппозных вакцин и на определение прогностических биомаркеров эффективности вакцинации против гриппа в группах риска.
Материалы и методы
Участники исследования
Все доноры были взрослыми и участвовали в исследовании по анализу цельной крови или в исследовании вакцинации, проводимом программой Stanford-LPCH Vaccine Program. Все участники исследования были здоровыми взрослыми, средний возраст составил 32 года.Субъекты с плохим здоровьем были исключены. 70% участников были мужчинами, 30% — женщинами. Субъекты были включены независимо от истории вакцинации. Концентрации анти-SV IgG в донорской плазме варьировали от 25 до 500 мкг / мл. Протоколы исследования были одобрены институциональным наблюдательным советом Управления по соблюдению требований исследований в Стэнфордском университете. Информированное согласие было получено от всех субъектов. Данные были проанализированы с помощью W.O.G или H.H.
Вакцины и вирусы
В исследованиях стимуляции использовались трехвалентные инактивированные вакцины против гриппа 2011–2012 и / или 2012–2013 годов (Fluzone; Sanofi Pasteur).Цельный инактивированный вирус получали из очищенных аттенуированных штаммов гриппа (Medimmune), которые обрабатывали 0,02% формальдегидом при 37 ° C в течение 12 часов. Были использованы следующие штаммы: A / California / 07/2009 h2N1, A / Victoria / 210/2009 h4N2, A / Victoria / 361/2011 h4N2, B / Brisbane / 60/2008, B / Texas / 6/2011. Мы рассчитали, что общая концентрация белка Fluzone составляет 300 мкг / мл, используя анализ Брэдфорда.
Клетки и стимулы
Свежевыделенную цельную кровь человека собирали в гепаринизированные вакутайнеры (BD) и использовали в неизмененном виде или промывали средой RPMI 1640 (Life Technologies) при комнатной температуре 2–3 раза для получения обедненной плазмой цельной крови.Промытые клетки WB ресуспендировали в среде RPMI без добавок. Мононуклеарные клетки периферической крови (PBMC) получали центрифугированием в градиенте плотности (Ficoll-Paque; GE healthcare) и культивировали в среде RPMI 1640 + 10% FBS или AIM V (Life Technologies). Клетки стимулировали при различных концентрациях SV в течение 30 минут или 6 часов, а затем фиксировали в течение 15 минут при 37 ° C с помощью буфера для лизиса / фиксации Phosflow (BD). В исследованиях предварительной инкубации SV SV разводили 1:10 в 100% плазме человека в течение 30 минут при 4 ° C, а затем добавляли к промытым WB или PBMC в разведении 1:20.SV был образован комплексом с белком A / G, очищенным на спин-колонке (Pierce), поликлональным IgG в соотношении 0,3 мкг SV (1 мкл неразбавленной вакцины) на 75 мкг IgG в течение 30 минут (при 7,5 мг / мл) перед добавлением SV + IgG к PBMC в концентрации 0,75–3 мкг / мл SV. HAG генерировали нагреванием очищенного IgG до концентрации 5 мкг / мл в течение 20 минут при 63 ° C. Рекомбинантный гемагглютинин гриппа h2N1 и собственные белки были приобретены в Sino Biological. R848 был куплен у Invivogen. Поликлональный F (ab ‘) 2 получали с использованием набора для микроизоляции F (ab’) 2 (Pierce).
Массово-проточная цитометрия
Информация о клонах и конъюгации для всех используемых mAb показана на рисунке S1. Числа, связанные с mAb на Фигуре S1, представляют собой атомные массы изотопов лантаноидов, которые были хелатированы с полимерами, а затем конъюгированы с указанными mAb. Поверхность клеток окрашивали и затем подвергали проницаемости либо ледяным метанолом для анализа сигналов, либо буфером Perm / Wash I (BD) для анализа цитокинов. Для проточной цитометрии клетки анализировали на LSRII (BD).Для массовой цитометрии клетки обрабатывали интеркалятором иридия (DVS Sciences) перед анализом на CyTOF (DVS Sciences). Данные были проанализированы с помощью Flowjo (Treestar). Сигнальные ответы на основе масс-цитометрии определяли количественно, как описано ранее [16]. Ответы цитокинов на основе масс-цитометрии и ответы, основанные на проточной цитометрии, количественно оценивали с помощью пороговых сигнальных ответов на основе 100 отсчетов или 99 -го процентиля для контролей, обработанных PBS.
Luminex (наборы для ELISA с захватывающими гранулами)
В соответствии с рекомендациями производителя использовали человеческий набор 51-plex luminex (Affymetrix).Цитокиновые ответы количественно оценивали путем деления средней интенсивности флуоресценции (MFI) шариков захвата из стимулированной плазмы на MFI шариков из нестимулированной плазмы.
Результаты
Сравнение активации сигнальной сети между вакциной SV и агонистом TLR7 / 8
Активность SV и TLR сравнивали с использованием массовой цитометрии для проведения систематического анализа сигнальных путей. В массовой цитометрии элементарные метки используются для обеспечения беспрецедентного уровня размерности в анализе отдельных клеток [16,17].Одновременно измеряли 30 параметров, чтобы разобрать сложность клеток в крови человека и контролировать ключевые пути передачи сигналов с использованием специфичных для фосфорилирования моноклональных антител (mAb). Используя этот подход, были определены 8 клеточных популяций с 19 поверхностными маркерами и зондированы с помощью 11 mAb, специфичных к отдельным сигнальным молекулам (рисунок S1). В частности, пути ERK / mTOR, гистонов, стресса, NFκB и STAT отслеживались в моноцитах CD14hi, моноцитах CD16hi, гранулоцитах, плазматических дендритных клетках (pDC), обычных дендритных клетках (cDC), естественных клетках-киллерах (NK), B-клетках. , и Т-клетки.Использовались методы цельной крови, поскольку было обнаружено, что центрифугирование фиколла в плотной среде активирует моноциты CD14hi (как описано ранее [18]).
Частицы инфекционного гриппа активируют множественные PRR [19]; однако инактивация вируса посредством фиксации ограничивает иммунное обнаружение только чувствительностью TLR7 к вирусной РНК в pDC [10]. В некоторых исследованиях сообщалось, что расщепление вируса инактивирует вирусные РНК [11,12], но недавний отчет предполагает, что вирусная РНК присутствует в сплит-вакцинах и служит внутренним адъювантом [13].Мы использовали коммерческие составы сплит-вакцины против гриппа 2011–2012 и 2012–2013 годов (Fluzone; Sanofi Pasteur) для моделирования клинического воздействия на человека. В качестве положительного контроля для индуцированной РНК активации мы стимулировали клетки крови ex vivo с помощью низкомолекулярного агониста резиквимода (R848), который специфичен для TLR 7 и 8. Было показано, что РНК гриппа активирует человеческие TLR 7 и 8 [20 ].
Неожиданно SV быстро активировал множественные сигнальные пути в различных популяциях клеток, но в целом дал протеомную сигнатуру, отличную от стимуляции TLR7 / 8 ().В миелоидных клетках SV индуцировал фосфорилирование ERK, рибосомного белка S6 (S6), CREB и гистона h4 — молекул, участвующих в передаче сигналов MEK, PI3K и mTOR [21]. Однако SV не стимулировал стресс-киназы, такие как p38 и MAPKAPK2, или путь NFκB, на что указывает отсутствие общей деградации IκBα. Напротив, R848 активирует почти все сигнальные пути в миелоидном клоне. Важно отметить, что фосфорилирование p38 является отличительной чертой почти всех ответов TLR и, таким образом, является ключевым различием между этими профилями передачи сигналов.
Сравнение активации сигнальной сети, вызванной либо SV, либо агонистом TLR7 / 8 . (A и B) Свежевыделенную цельную кровь человека стимулировали PBS, SV (15 мкг / мл) или R848 (10 мкг / мл) в течение 30 минут до лизиса и фиксации эритроцитов. Затем клетки окрашивали меченными изотопами mAb против поверхностных белков и сигнальных белков и готовили для 31-параметрического масс-цитометрического анализа. Популяции клеток были идентифицированы как CD11c + CD33 + HLADR + CD14hi Моноциты, CD11c + CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, HLADR + CD623 s + CD123 s + , HLADR + CD1c + cDC, CD3 — CD7 + NK-клетки, CD19 + CD20 + B-клетки и CD3 + T-клетки.См. Рисунок S1 для подробной стратегии стробирования. Индукция передачи сигналов рассчитывалась как разница средней интенсивности arcsinh по сравнению с контролем PBS. Репрезентативный эксперимент показан из 4 независимых экспериментов по массовой цитометрии, проведенных на 7 взрослых донорах.
Активность, индуцированная
SV, также отличалась от стимуляции TLR7 / 8 в лимфоцитах. NK-клетки были активированы вакциной, но не ответили на R848, что согласуется с отсутствием экспрессии TLR7 / 8 в этих клетках [22]. B-клетки были активированы R848, но лишь слабо затронуты SV.Ни один из стимулов не активировал Т-клетки. И SV, и R848 также индуцировали шеддинг CD16 (FcγRIII) в моноцитах и NK-клетках (данные не показаны). Ответы SV в моноцитах наблюдались у всех отобранных доноров, в то время как ответы NK-клеток и дендритных клеток наблюдались стабильно, но только у отдельных доноров. Никакой ранней активности в путях STAT не наблюдали ни в одном типе клеток через 30 минут (данные не показаны).
Затем мы попытались сравнить чувствительность иммунных клеток человека к SV и R848, чтобы убедиться, что SV активен при низких концентрациях.Подобно R848, SV демонстрирует высокую активность при концентрациях нанограмм на миллилитр, что составляет 1/500 th разовой дозы вакцины (). Чтобы убедиться, что активность SV не связана с компонентами вакцины, не связанными с гриппом, мы стимулировали цельную кровь желатином, этоксилатом октилфенола и тимеросалом и не обнаружили обнаруживаемой активности (данные не показаны).
Динамика доза-ответ СВ по сравнению со стимуляцией TLR7 / 8. Цельную кровь стимулировали при различных концентрациях SV или R848 и отслеживали фосфорилирование S6 с помощью 10-параметрической проточной цитометрии.Популяции клеток были определены как CD33 + HLADR + CD14hi Моноциты, CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, CD33 + HLADR + CD14 — CD16 — c , CD56 + NK-клетки, CD20 + B-клетки и CD3 + T-клетки. Индукцию передачи сигналов рассчитывали как% клеток, демонстрирующих более высокое, чем базальное фосфорилирование S6. Показаны средние точки данных реплик от 1 донора.
Сравнение продукции цитокинов вакциной SV и агонистом TLR7 / 8
Активация сигнального пути в иммунных клетках часто вызывает выработку цитокинов, которые опосредуют межклеточную коммуникацию. Панель окрашивания на основе массовой цитометрии, способная измерять продукцию паниммунных цитокинов, использовалась для сравнения SV со стимуляцией TLR7 / 8. Эта панель внутриклеточного окрашивания цитокинов (ICS) состоит из поверхностных маркеров, упомянутых ранее, а также mAb против IL-1β, IL-1RA, IL-2, IL-4, IL-6, IL-12 (p40), IL-17A. , MCP1 (CCL2), TNFα, IFNγ, IFNα, перфорин и GM-CSF.Цельную кровь стимулировали либо SV, либо R848 в течение 6 часов перед лизисом и фиксацией эритроцитов (RBC). И брефельдин, и монензин добавляли в кровь в начале анализа или после 2–3 часов стимуляции.
Систематическое профилирование продукции цитокинов показало, что SV и R848 индуцируют разные паттерны экспрессии цитокинов (). В моноцитах CD14hi оба стимула индуцировали выработку хемокина MCP1 — молекулы, способной привлекать моноциты и дендритные клетки к участкам воспаления [23].IL-1RA, противовоспалительный цитокин, также индуцировался обоими стимулами, но гораздо сильнее R848. Важно отметить, что основные провоспалительные цитокины (IL-1β, IL-6, TNFα и IL-12), исследованные в моноцитах, индуцировались только стимуляцией TLR7 / 8, а не SV. В NK-клетках SV индуцировал продукцию TNFα, а также IFNγ. Хотя R848 не активировал сигнальные пути в NK-клетках, он действительно вызывал некоторую продукцию цитокинов, скорее всего, вызванную паракринным механизмом. Продукция IFNα в pDC является отличительным признаком активации TLR7 [10] и, как и ожидалось, вызывается R848.Напротив, SV не вызывал продукции IFNα, что согласуется с отсутствием SV-зависимой активации p38 в pDC. изображает разницу в этих ответах от 3 разных доноров. Кинетика дозы для продукции внутриклеточных цитокинов показана на рисунке S2A.
Сравнение продукции цитокинов SV и агониста TLR7 / 8. (A) Свежевыделенную цельную кровь человека стимулировали PBS, 15 мкг / мл SV или 5 мкг / мл R848 в течение 6 часов до лизиса и фиксации эритроцитов. Ингибиторы секреции добавляли либо для всей стимуляции (SV), либо через 2 часа (R848).Затем фиксированные клетки готовили для 34-параметрического масс-цитометрического анализа внутриклеточного окрашивания цитокинов (ICS). Цитокин-положительные моноциты и pDC определялись как клетки, показывающие сигнал, превышающий 10 2 отсчетов. Цитокин-положительные NK-клетки были определены как клетки, показывающие сигнал выше 99 -го процентиля нестимулированных клеток. SV также не индуцировал IFNα в pDC, когда ингибиторы секреции добавляли через 2 часа. Показан один репрезентативный эксперимент. (B) Количественная оценка дисперсии продукции цитокинов на основе 5 независимых экспериментов, проведенных на 3 взрослых донорах.Гистограммы показывают среднее значение ± стандартное отклонение.
Анализы окрашивания внутриклеточных цитокинов ограничены тем, что они оценивают продукцию цитокинов, но не секрецию из-за обязательной потребности в ингибиторах секреции. Чтобы убедиться, что MCP1 секретируется моноцитами, активированными SV, и для обнаружения цитокинов, не включенных в нашу панель массовой цитометрии, мы использовали технологию luminex для количественного определения секреции 51 цитокина в плазме человека [24]. Цельную кровь собирали у 15 взрослых добровольцев и стимулировали ex vivo SV в течение 6 часов.Цитокины, демонстрирующие как минимум 5-кратное увеличение среднего сигнала флуоресценции после усреднения всех 15 субъектов, показаны на рисунке S2B. В частности, Mip1α (CCL3), IP-10 (CXCL10), IL-8, TNFα, Mip1β (CCL4), MCP1 и IL-1RA секретировались на высоких уровнях у большинства субъектов.
Иммунные комплексы, полученные из белка гриппа, ответственны за индуцированную SV активность
ex vivo
При исследовании механизмов, посредством которых SV стимулирует иммунные клетки человека, было обнаружено, что SV не может стимулировать мононуклеарные клетки периферической крови (PBMC) в стандартной культуре ткани. условия ().Впоследствии мы предположили, что фактор в плазме крови человека необходим для активации иммунной системы, вызванной SV. Чтобы оценить эту гипотезу, SV сначала предварительно инкубировали с плазмой, а затем добавляли либо к обедненной плазмой цельной крови, либо к PBMC, чтобы определить, спасает ли это нечувствительность SV. Поскольку рибосомный белок S6 является почти концевым ответным элементом в передаче сигналов ERK / mTOR [25], мы отслеживали его фосфорилирование как общий маркер активации для множества типов клеток. Примечательно, что SV, предварительно инкубированный с плазмой, может стимулировать моноциты CD16hi ().Таким образом, фактор сыворотки человека в дополнение к SV необходим для активации иммунных клеток.
Активность передачи сигналов SV индуцируется иммунными комплексами, производными от белка гриппа. (A) Цельную кровь и PBMC, полученные с помощью центрифугирования с плотностью фиколла, стимулировали либо PBS, SV, либо R848 при 10 мкг / мл в течение 30 минут перед фиксацией и анализом проточной цитометрии, как в. Показаны репрезентативные данные, изображающие моноциты CD16hi из 3 экспериментов (2 донора). (B) Цельная цельная кровь или цельная кровь без плазмы стимулировалась либо SV, SV, предварительно инкубированной с аутологичной плазмой, SV, предварительно инкубированной с аутологичным очищенным поликлональным человеческим IgG, либо рекомбинантным гемагглютинином h2N1 (5 мкг / мл) для За 30 минут до фиксации и анализа проточной цитометрии.См. Раздел «Методы» для получения подробной информации о предварительной инкубации. Показаны репрезентативные данные из 7 экспериментов.
Учитывая обилие антител против белков гриппа, особенно гемагглютинина (HA), в плазме человека казалось вероятным, что активность SV может быть связана с образованием иммунных комплексов и активацией рецептора Fc. В соответствии с этим предсказанием, предварительная инкубация SV с очищенным поликлональным человеческим IgG может также восстановить активность SV в истощенных сывороткой моноцитах цельной крови ().Аналогичные результаты были получены для NK-клеток, стимулированных в формате PBMC, а также в популяциях обогащенных NK-клеток и моноцитов CD16hi (фиг. S3). В концентрациях, используемых для восстановления активности SV, ни IgG, ни плазма по отдельности не активировали S6 (данные не показаны). IgG был единственным плазменным фактором, необходимым для активности SV, поскольку обедненная по IgG плазма не проявляла активности при предварительной инкубации с SV (данные не показаны). Фигура S4 демонстрирует, что продукция цитокинов в ответ на SV также зависела от присутствия IgG.Эти эксперименты в значительной степени предполагают, что иммунные комплексы, полученные из белков гриппа, ответственны за активацию сигнального пути, индуцированную SV, и продукцию цитокинов. Данные о моноцитах CD16hi показаны потому, что фосфорилирование S6 в моноцитах CD14hi может быть активировано центрифугированием, а моноциты CD16hi — нет.
Чтобы продемонстрировать, что эта активность зависит от белка гриппа, мы стимулировали интактную цельную кровь и цельную кровь с обедненной плазмой рекомбинантным НА из штамма h2N1. Подобно SV, HA проявляет активность только в моноцитах в присутствии плазмы человека ().Рекомбинантные белки человека (LAMP1 и HER2), полученные в тех же условиях, использовали в качестве отрицательного контроля и не стимулировали цельную кровь (данные не показаны). Основываясь на этих доказательствах, запуск рецептора Fcγ (FcγR) иммунными комплексами SV был наиболее правдоподобным объяснением активности SV.
FcγR экспрессируются во всей иммунной системе в соответствии с наблюдаемыми моделями стимуляции SV (Рисунок S5) [26]. В частности, CD64 (FcγRI), CD32 (FcγRII) и CD16 (FcγRIII) все по-разному экспрессируются в разных популяциях моноцитов.CD16 экспрессируется большинством NK-клеток. В-клетки экспрессируют только CD32, а большинство Т-клеток не экспрессируют никаких FcγR. Затем мы попытались определить, зависит ли активность SV от Fc-части IgG. Были продуцированы поликлональные белки F (ab ‘) 2 , которые, как и ожидалось, не смогли восполнить недостаток активности SV в условиях отсутствия сыворотки человека (). Чтобы подтвердить, что белки F (ab ‘) 2 все еще могут связываться с SV, иммобилизованную вакцину инкубировали с F (ab’) 2 и использовали антитела против легкой цепи для количественного определения связывания с помощью ELISA.Поликлональный F (ab ‘) 2 связывается с SV, подтверждая, что обработка пепсином не делала белки F (ab’) 2 неспособными реагировать с SV (данные не показаны). Важно отметить, что блокирующие mAb против FcγR были способны специфически ингибировать фосфорилирование рибосомного белка S6 в ответ на иммунные комплексы SV (). Стимуляция иммунного комплекса SV моноцитов CD16hi и NK-клеток (формат PBMC) блокировалась mAb, нацеленными на CD16 и CD32, но не контрольными mAB изотипа. Таким образом, активность SV в этих типах клеток зависит от интактной области Fc IgG, а также от CD16 и CD32.
Активация SV зависит от Fc и FcγR. (A) Цельную кровь без плазмы стимулировали PBS, SV предварительно инкубировали с поликлональным F (ab ‘) 2 или SV предварительно инкубировали с интактным IgG. Показаны репрезентативные данные из 2 экспериментов. (B) PBMC, обработанные блокирующими mAb против CD16 и CD32 или mAb изотипического контроля, стимулировали 0,75–3 мкг / мл комплексов SV + IgG в течение 30 минут перед фиксацией и анализом фосфорилирования S6. Показаны репрезентативные данные из 3 экспериментов, проведенных на 2 донорах.
Чтобы независимо оценить, является ли протеомная сигнатура, индуцированная SV, зависимой от FcγR, мы проанализировали эффекты агрегированного при нагревании IgG (HAG) на иммунные клетки человека. HAG, как и иммунные комплексы гриппа, избирательно стимулировал передачу сигналов ERK / mTOR, но не пути p38 или NFκB в миелоидных клетках (рисунок S6). HAG также вызывал моноцитарную продукцию MCP1 в цельной крови человека и продукцию IFNγ и TNFα NK-клетками в PBMC (данные не показаны).
Составы противогриппозной вакцины различаются по протеомным ответам
Мы оценили, зависела ли секреция цитокинов, индуцированная SV, также от человеческой сыворотки, используя luminex ().Подобно фосфорилированию рибосомного белка S6, SV-зависимая секреция цитокинов происходила только в формате цельной крови. Напротив, весь инактивированный вирус имел активность как в цельной крови, так и в PBMC. В целом, WIV индуцировал такие же цитокины, как SV, за исключением IL-8 и IFNα. WIV-зависимая продукция IFNα предполагалась на основании предыдущих исследований, которые показали, что эта активность зависит от РНК [10]. Мы также обнаружили, что лечение WIV РНКазой снижает продукцию IFNα (данные не показаны).
Сравнение различных вакцин. (A) Цельную кровь или PBMC стимулировали 15 мкг / мл SV или WIV в течение 6 часов перед центрифугированием и выделением плазмы или супернатанта. Кратное изменение MFI рассчитывали, как показано на рис. S2B. Показаны репрезентативные данные из 4 независимых экспериментов; гистограммы показывают среднее значение ± стандартное отклонение от 3 доноров. (B) Цельную кровь стимулировали (0,3 мкг / мл HA) расщепленными или живыми аттенуированными вирусными частицами в течение 40 минут и анализировали на активацию сигнального пути, как в. Показано среднее отклонение дуги ± стандартное отклонение от 3 доноров.
Наконец, мы попытались определить, вызывает ли сплит-вакцина более быстрые и сильные ответы FcγR, чем интактные вирусные частицы. SV сравнивали с живым ослабленным вирусом гриппа (LAIV) в анализах передачи сигналов (). Было обнаружено, что при эквивалентных концентрациях HA SV является гораздо более мощным индуктором немедленных сигнальных ответов, чем LAIV. Однако в более поздние моменты времени (3 часа) LAIV вызывал заметную активность, но все еще менее устойчиво, чем SV (данные не показаны).
Обсуждение
Транскрипционная активность крови, индуцированная иммунизацией in vivo SV, обнаруживается в течение нескольких часов и достигает пика через день после вакцинации [15].Модульный анализ этой активности показывает, что пути, участвующие в биологии моноцитов, NK-клеток и интерферона, нарушаются на ранних этапах вакцинации против гриппа. Однако эти транскриптомные подходы еще не показали, какие механизмы вызывают эти ответы. Наши анализы показывают, что вакцина против гриппа активирует моноциты и NK-клетки через FcγR и вызывает продукцию IFNγ, но не IFN типа I. Как сообщалось ранее [10–12], мы также не нашли доказательств того, что РНК в вакцине против SV способна активировать рецепторы TLR.Таким образом, образование иммунных комплексов и активация FcγR, скорее всего, является немедленным иммунным ответом на вакцинацию против SV у людей с уже существующими IgG-антителами против белков гриппа.
Вопрос о том, инактивирует ли расщепление вирусных частиц активность TLR, важен, поскольку было показано, что очень успешные вакцины, такие как вакцина против желтой лихорадки (YFV) и коровьей оспы, активируют множественные PRR [8,9]. Кампании по иммунизации против оспы и YFV были направлены на индукцию иммунитета у субъектов, которые были в значительной степени иммунологически не восприимчивы к этим патогенам.Напротив, вакцинация против гриппа у взрослых обычно происходит при наличии ранее существовавшей иммунологической памяти, вызванной естественным воздействием гриппа. Таким образом, мы обнаружили, что непосредственным эффектом добавления SV в кровь человека было образование иммунных комплексов. Это поднимает важный вопрос о том, как уже существующие специфичные для гриппа АТ влияют на иммунизацию SV. Из-за природы ex vivo этих исследований следует проявлять осторожность, предполагая, что активация миелоидных и NK-клеток иммунными комплексами SV обязательно усилит вакцинацию.Существуют доказательства того, что связывание IgG и образование иммунных комплексов могут как усиливать [27–30], так и ингибировать [31–35] серологические ответы на различные формы антигена. Если активация рецептора Fc может усиливать ответ на вакцинацию, то важно, что SV имел гораздо более непосредственную активность в анализах передачи сигналов, чем LAIV (). Вызванная детергентом диссоциация частиц вируса гриппа, вероятно, обнажит дополнительные вирусные белки (особенно матричные белки), которые маскируются липидными бислоями, полученными из яиц, и, таким образом, будет способствовать более сильному иммунному ответу, опосредованному рецептором Fc, у ранее подвергшихся воздействию хозяев.
В контексте вакцинации против гриппа одним из наиболее прогностических показателей плохого серологического ответа является высокий уровень антител против гемагглютинина гриппа до вакцинации [36–38]. Таким образом, возможно, что предсуществующие Ат против белков SV активно подавляют иммунизационные ответы посредством ингибирования по обратной связи. Степень, в которой такой супрессивный механизм потребует активации FcγR, не совсем ясна, но было показано, что связывание FcγRIIb может подавлять ответы В-клеток на вирусные антигены, связанные с IgG [33].Необходимы дополнительные исследования, чтобы понять, как существующие антитела влияют на реакцию на вакцинацию против гриппа и могут ли определенные адъюванты преодолеть подавление обратной связи, основанное на иммунных комплексах.
Недавний метаанализ клинических исследований показал, что на основании серологических ответов SV более эффективен у взрослых, чем у детей, и, наоборот, LAIV более эффективен у детей, чем у взрослых [39]. Наши наблюдения могут объяснить эту разницу тем, что отсутствие лигандов PRR в SV сделало бы его слабым праймером для инициации иммунных ответов у детей, но он был бы более эффективным у взрослых, потому что ответы зрелой памяти гораздо меньше зависят от активации врожденного иммунитета [10 ].Ключевой вопрос заключается в том, как реактивные или перекрестно-реактивные Т-клетки памяти, В-клетки памяти и уже существующие АТ влияют на последующую вакцинацию против SV или LAIV. Плохой серологический ответ у взрослых, вакцинированных LAIV, можно объяснить нейтрализацией IgA вирусных частиц в слизистой оболочке дыхательных путей до репликации вируса. В целом формирование иммунного комплекса, скорее всего, является важным событием в понимании вакцинации взрослых от гриппа.
Выводы
Эти исследования позволяют по-новому взглянуть на то, как вакцина против SV способствует иммунному ответу, и демонстрируют, как любая вакцина, вводимая ранее контактировавшим с ней людям, вероятно, вызовет аналогичный FcγR-опосредованный ранний ответ.
Вакцина против гриппа с расщепленным вирусом быстро активирует иммунные клетки через рецепторы Fcγ
Резюме
Сезонная вакцинация против гриппа — одна из наиболее распространенных медицинских процедур, но степень, в которой она активирует иммунную систему, помимо индукции выработки антител, не совсем понятна. В Соединенных Штатах наиболее распространенные составы вакцины состоят из деградированных или «расщепленных» вирусных частиц, распределенных без каких-либо адъювантов. Основываясь на предыдущих отчетах, мы попытались определить, активирует ли сплит-вакцина против гриппа рецепторы врожденного иммунитета, в частности рецепторы, подобные Toll.Высокомерное протеомное профилирование цельной крови человека с использованием цитометрии по времени пролета (CyTOF) было использовано для сравнения активации сигнального пути и продукции цитокинов между сплит-вакциной против гриппа и прототипным ответом TLR ex vivo . Этот анализ показал, что сплит-вакцина быстро и эффективно активирует несколько типов иммунных клеток, но дает протеомную сигнатуру, совершенно отличную от активации TLR. Важно отметить, что активность, индуцированная вакциной, зависела от присутствия сыворотки человека, что указывало на то, что сывороточный фактор необходим для вакцино-зависимой иммунной активации.Мы обнаружили, что этот сывороточный фактор представляет собой человеческие антитела, специфичные к белкам гриппа, и поэтому немедленная иммунная активация сплит-вакциной зависит от иммунного комплекса. Эти исследования демонстрируют, что «расщепление» вируса гриппа инактивирует любые потенциальные адъюванты, эндогенные для гриппа, такие как РНК, но у ранее подвергшихся воздействию людей может вызвать мощный иммунный ответ, способствуя быстрому образованию иммунных комплексов.
Ключевые слова: грипп, вакцина, рецепторы Fcγ, иммунология, массовая цитометрия
Введение
Грипп — вирусный респираторный патоген, вызывающий значительную заболеваемость и смертность во всем мире.Ежегодно от сезонных инфекций гриппа умирает от 250 000 до 500 000 человек, и многие другие госпитализируются [1]. Вакцинация в настоящее время является основной стратегией, используемой для снижения заболеваемости и смертности [2].
Первая вакцина против гриппа, лицензированная в США, состояла из фиксированных формалином частиц цельного инактивированного вируса (WIV) [3]. Препарат WIV, хотя и считался высоко иммуногенным, также был очень реактогенным, что часто приводило к воспалению в момент инъекции и лихорадке [4].Из-за этих побочных реакций препарат WIV был заменен вакциной на основе расщепленного вируса (SV), в которой вирусные частицы сначала инактивируются, а затем разрушаются детергентом или эфиром [5]. Расщепление частиц гриппа повышает безопасность вакцины, но снижает иммуногенность, особенно у людей, в основном у детей, которые иммунологически не восприимчивы к гриппу [6,7].
В настоящее время вакцина сплит-вируса является наиболее распространенной вакциной против гриппа, назначаемой для взрослых, и распространяется в США без адъюванта.Клинические исследования вакцины против гриппа в первую очередь сосредоточены на количественной оценке адаптивных иммунных реакций, которые развиваются в течение нескольких дней или недель. Фундаментальные исследования врожденного иммунного ответа на инфекцию гриппа обычно концентрируются на том, как инфекционные вирусные частицы (не расщепленные частицы вакцины) активируют рецепторы распознавания образов (PRR), такие как Toll-подобные рецепторы (TLR). Поэтому мало что известно о точных механизмах, посредством которых СВ активирует ранние или врожденные иммунные ответы.
Врожденная иммунная активация считается ключевой особенностью успешных вакцин для человека, таких как вакцина против вируса осповакцины и желтой лихорадки [8,9].Таким образом, мы стремились оценить немедленный ответ иммунных клеток на SV ex vivo . Предыдущие исследования, проведенные в основном на моделях грызунов, предполагают, что вирусная РНК является основным ассоциированным с патогеном молекулярным паттерном, генерируемым WIV, и что расщепление частиц инактивирует вирусную РНК [10–12]. Другие исследователи оспорили этот вывод и утверждают, что вирусная РНК активна в сплит-вакцине [13]. У людей Panda et al. выявил связанное с возрастом снижение функции TLR, которое может предсказывать in vivo серологических ответов у иммунизированных SV [14].До сих пор остается неясным, является ли эта связь причинной или вакцина против гриппа SV может задействовать TLR. Недавнее исследование показало, что вакцинация против SV вызывает транскрипционную активность in vivo в течение нескольких часов после вакцинации человека [15]. Эта ранняя транскрипционная сигнатура включает моноциты, NK-клетки и интерфероны (IFN). Инициирующее событие (я), вызывающее эту раннюю сигнатуру in vivo , неизвестно [15].
Высокоразмерное протеомное профилирование с использованием масс-цитометрии и технологии luminex было использовано для количественной оценки активации сигнального пути и продукции цитокинов во всех основных популяциях иммунных клеток цельной крови человека, стимулированных SV ex vivo .В качестве положительного контроля мы сравнили SV с активацией TLR на основе прототипной РНК через TLR 7/8.
Неожиданно SV быстро и сильно индуцировал сигнальные реакции в иммунной системе. Анализируя подмножество параметров, можно сказать, что активация иммунной системы, вызванная SV, была подобна передаче сигналов TLR7 / 8; однако более широкий анализ сигнальных путей продемонстрировал, что SV вызывает протеомную сигнатуру, перекрывающуюся с активацией TLR, но очень отличную от нее. Последующие исследования показали, что стимулирующая активность вакцины зависела от присутствия сыворотки человека, поскольку активность SV была очевидна в цельной крови человека, но отсутствовала, когда человеческие клетки культивировали в клеточной среде с бычьей сывороткой.Наконец, было обнаружено, что антитела иммуноглобулина G (IgG), специфичные к белкам гриппа, необходимы для индуцированных SV ответов, и, таким образом, образование иммунных комплексов и активация рецептора Fc являются начальным событием при вакцинации против гриппа SV.
Эти данные позволяют предположить, что вирусная РНК, скорее всего, не имеет отношения к вакцинации против SV человека, а также подчеркивает потенциальную важность образования иммунных комплексов в контексте вакцинации против гриппа и других вакцин, нацеленных на ранее подвергшихся воздействию людей.Концептуально это важный вывод для исследований, направленных на создание более эффективных противогриппозных вакцин и на определение прогностических биомаркеров эффективности вакцинации против гриппа в группах риска.
Материалы и методы
Участники исследования
Все доноры были взрослыми и участвовали в исследовании по анализу цельной крови или в исследовании вакцинации, проводимом программой Stanford-LPCH Vaccine Program. Все участники исследования были здоровыми взрослыми, средний возраст составил 32 года.Субъекты с плохим здоровьем были исключены. 70% участников были мужчинами, 30% — женщинами. Субъекты были включены независимо от истории вакцинации. Концентрации анти-SV IgG в донорской плазме варьировали от 25 до 500 мкг / мл. Протоколы исследования были одобрены институциональным наблюдательным советом Управления по соблюдению требований исследований в Стэнфордском университете. Информированное согласие было получено от всех субъектов. Данные были проанализированы с помощью W.O.G или H.H.
Вакцины и вирусы
В исследованиях стимуляции использовались трехвалентные инактивированные вакцины против гриппа 2011–2012 и / или 2012–2013 годов (Fluzone; Sanofi Pasteur).Цельный инактивированный вирус получали из очищенных аттенуированных штаммов гриппа (Medimmune), которые обрабатывали 0,02% формальдегидом при 37 ° C в течение 12 часов. Были использованы следующие штаммы: A / California / 07/2009 h2N1, A / Victoria / 210/2009 h4N2, A / Victoria / 361/2011 h4N2, B / Brisbane / 60/2008, B / Texas / 6/2011. Мы рассчитали, что общая концентрация белка Fluzone составляет 300 мкг / мл, используя анализ Брэдфорда.
Клетки и стимулы
Свежевыделенную цельную кровь человека собирали в гепаринизированные вакутайнеры (BD) и использовали в неизмененном виде или промывали средой RPMI 1640 (Life Technologies) при комнатной температуре 2–3 раза для получения обедненной плазмой цельной крови.Промытые клетки WB ресуспендировали в среде RPMI без добавок. Мононуклеарные клетки периферической крови (PBMC) получали центрифугированием в градиенте плотности (Ficoll-Paque; GE healthcare) и культивировали в среде RPMI 1640 + 10% FBS или AIM V (Life Technologies). Клетки стимулировали при различных концентрациях SV в течение 30 минут или 6 часов, а затем фиксировали в течение 15 минут при 37 ° C с помощью буфера для лизиса / фиксации Phosflow (BD). В исследованиях предварительной инкубации SV SV разводили 1:10 в 100% плазме человека в течение 30 минут при 4 ° C, а затем добавляли к промытым WB или PBMC в разведении 1:20.SV был образован комплексом с белком A / G, очищенным на спин-колонке (Pierce), поликлональным IgG в соотношении 0,3 мкг SV (1 мкл неразбавленной вакцины) на 75 мкг IgG в течение 30 минут (при 7,5 мг / мл) перед добавлением SV + IgG к PBMC в концентрации 0,75–3 мкг / мл SV. HAG генерировали нагреванием очищенного IgG до концентрации 5 мкг / мл в течение 20 минут при 63 ° C. Рекомбинантный гемагглютинин гриппа h2N1 и собственные белки были приобретены в Sino Biological. R848 был куплен у Invivogen. Поликлональный F (ab ‘) 2 получали с использованием набора для микроизоляции F (ab’) 2 (Pierce).
Массово-проточная цитометрия
Информация о клонах и конъюгации для всех используемых mAb показана на рисунке S1. Числа, связанные с mAb на Фигуре S1, представляют собой атомные массы изотопов лантаноидов, которые были хелатированы с полимерами, а затем конъюгированы с указанными mAb. Поверхность клеток окрашивали и затем подвергали проницаемости либо ледяным метанолом для анализа сигналов, либо буфером Perm / Wash I (BD) для анализа цитокинов. Для проточной цитометрии клетки анализировали на LSRII (BD).Для массовой цитометрии клетки обрабатывали интеркалятором иридия (DVS Sciences) перед анализом на CyTOF (DVS Sciences). Данные были проанализированы с помощью Flowjo (Treestar). Сигнальные ответы на основе масс-цитометрии определяли количественно, как описано ранее [16]. Ответы цитокинов на основе масс-цитометрии и ответы, основанные на проточной цитометрии, количественно оценивали с помощью пороговых сигнальных ответов на основе 100 отсчетов или 99 -го процентиля для контролей, обработанных PBS.
Luminex (наборы для ELISA с захватывающими гранулами)
В соответствии с рекомендациями производителя использовали человеческий набор 51-plex luminex (Affymetrix).Цитокиновые ответы количественно оценивали путем деления средней интенсивности флуоресценции (MFI) шариков захвата из стимулированной плазмы на MFI шариков из нестимулированной плазмы.
Результаты
Сравнение активации сигнальной сети между вакциной SV и агонистом TLR7 / 8
Активность SV и TLR сравнивали с использованием массовой цитометрии для проведения систематического анализа сигнальных путей. В массовой цитометрии элементарные метки используются для обеспечения беспрецедентного уровня размерности в анализе отдельных клеток [16,17].Одновременно измеряли 30 параметров, чтобы разобрать сложность клеток в крови человека и контролировать ключевые пути передачи сигналов с использованием специфичных для фосфорилирования моноклональных антител (mAb). Используя этот подход, были определены 8 клеточных популяций с 19 поверхностными маркерами и зондированы с помощью 11 mAb, специфичных к отдельным сигнальным молекулам (рисунок S1). В частности, пути ERK / mTOR, гистонов, стресса, NFκB и STAT отслеживались в моноцитах CD14hi, моноцитах CD16hi, гранулоцитах, плазматических дендритных клетках (pDC), обычных дендритных клетках (cDC), естественных клетках-киллерах (NK), B-клетках. , и Т-клетки.Использовались методы цельной крови, поскольку было обнаружено, что центрифугирование фиколла в плотной среде активирует моноциты CD14hi (как описано ранее [18]).
Частицы инфекционного гриппа активируют множественные PRR [19]; однако инактивация вируса посредством фиксации ограничивает иммунное обнаружение только чувствительностью TLR7 к вирусной РНК в pDC [10]. В некоторых исследованиях сообщалось, что расщепление вируса инактивирует вирусные РНК [11,12], но недавний отчет предполагает, что вирусная РНК присутствует в сплит-вакцинах и служит внутренним адъювантом [13].Мы использовали коммерческие составы сплит-вакцины против гриппа 2011–2012 и 2012–2013 годов (Fluzone; Sanofi Pasteur) для моделирования клинического воздействия на человека. В качестве положительного контроля для индуцированной РНК активации мы стимулировали клетки крови ex vivo с помощью низкомолекулярного агониста резиквимода (R848), который специфичен для TLR 7 и 8. Было показано, что РНК гриппа активирует человеческие TLR 7 и 8 [20 ].
Неожиданно SV быстро активировал множественные сигнальные пути в различных популяциях клеток, но в целом дал протеомную сигнатуру, отличную от стимуляции TLR7 / 8 ().В миелоидных клетках SV индуцировал фосфорилирование ERK, рибосомного белка S6 (S6), CREB и гистона h4 — молекул, участвующих в передаче сигналов MEK, PI3K и mTOR [21]. Однако SV не стимулировал стресс-киназы, такие как p38 и MAPKAPK2, или путь NFκB, на что указывает отсутствие общей деградации IκBα. Напротив, R848 активирует почти все сигнальные пути в миелоидном клоне. Важно отметить, что фосфорилирование p38 является отличительной чертой почти всех ответов TLR и, таким образом, является ключевым различием между этими профилями передачи сигналов.
Сравнение активации сигнальной сети, вызванной либо SV, либо агонистом TLR7 / 8 . (A и B) Свежевыделенную цельную кровь человека стимулировали PBS, SV (15 мкг / мл) или R848 (10 мкг / мл) в течение 30 минут до лизиса и фиксации эритроцитов. Затем клетки окрашивали меченными изотопами mAb против поверхностных белков и сигнальных белков и готовили для 31-параметрического масс-цитометрического анализа. Популяции клеток были идентифицированы как CD11c + CD33 + HLADR + CD14hi Моноциты, CD11c + CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, HLADR + CD623 s + CD123 s + , HLADR + CD1c + cDC, CD3 — CD7 + NK-клетки, CD19 + CD20 + B-клетки и CD3 + T-клетки.См. Рисунок S1 для подробной стратегии стробирования. Индукция передачи сигналов рассчитывалась как разница средней интенсивности arcsinh по сравнению с контролем PBS. Репрезентативный эксперимент показан из 4 независимых экспериментов по массовой цитометрии, проведенных на 7 взрослых донорах.
Активность, индуцированная
SV, также отличалась от стимуляции TLR7 / 8 в лимфоцитах. NK-клетки были активированы вакциной, но не ответили на R848, что согласуется с отсутствием экспрессии TLR7 / 8 в этих клетках [22]. B-клетки были активированы R848, но лишь слабо затронуты SV.Ни один из стимулов не активировал Т-клетки. И SV, и R848 также индуцировали шеддинг CD16 (FcγRIII) в моноцитах и NK-клетках (данные не показаны). Ответы SV в моноцитах наблюдались у всех отобранных доноров, в то время как ответы NK-клеток и дендритных клеток наблюдались стабильно, но только у отдельных доноров. Никакой ранней активности в путях STAT не наблюдали ни в одном типе клеток через 30 минут (данные не показаны).
Затем мы попытались сравнить чувствительность иммунных клеток человека к SV и R848, чтобы убедиться, что SV активен при низких концентрациях.Подобно R848, SV демонстрирует высокую активность при концентрациях нанограмм на миллилитр, что составляет 1/500 th разовой дозы вакцины (). Чтобы убедиться, что активность SV не связана с компонентами вакцины, не связанными с гриппом, мы стимулировали цельную кровь желатином, этоксилатом октилфенола и тимеросалом и не обнаружили обнаруживаемой активности (данные не показаны).
Динамика доза-ответ СВ по сравнению со стимуляцией TLR7 / 8. Цельную кровь стимулировали при различных концентрациях SV или R848 и отслеживали фосфорилирование S6 с помощью 10-параметрической проточной цитометрии.Популяции клеток были определены как CD33 + HLADR + CD14hi Моноциты, CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, CD33 + HLADR + CD14 — CD16 — c , CD56 + NK-клетки, CD20 + B-клетки и CD3 + T-клетки. Индукцию передачи сигналов рассчитывали как% клеток, демонстрирующих более высокое, чем базальное фосфорилирование S6. Показаны средние точки данных реплик от 1 донора.
Сравнение продукции цитокинов вакциной SV и агонистом TLR7 / 8
Активация сигнального пути в иммунных клетках часто вызывает выработку цитокинов, которые опосредуют межклеточную коммуникацию. Панель окрашивания на основе массовой цитометрии, способная измерять продукцию паниммунных цитокинов, использовалась для сравнения SV со стимуляцией TLR7 / 8. Эта панель внутриклеточного окрашивания цитокинов (ICS) состоит из поверхностных маркеров, упомянутых ранее, а также mAb против IL-1β, IL-1RA, IL-2, IL-4, IL-6, IL-12 (p40), IL-17A. , MCP1 (CCL2), TNFα, IFNγ, IFNα, перфорин и GM-CSF.Цельную кровь стимулировали либо SV, либо R848 в течение 6 часов перед лизисом и фиксацией эритроцитов (RBC). И брефельдин, и монензин добавляли в кровь в начале анализа или после 2–3 часов стимуляции.
Систематическое профилирование продукции цитокинов показало, что SV и R848 индуцируют разные паттерны экспрессии цитокинов (). В моноцитах CD14hi оба стимула индуцировали выработку хемокина MCP1 — молекулы, способной привлекать моноциты и дендритные клетки к участкам воспаления [23].IL-1RA, противовоспалительный цитокин, также индуцировался обоими стимулами, но гораздо сильнее R848. Важно отметить, что основные провоспалительные цитокины (IL-1β, IL-6, TNFα и IL-12), исследованные в моноцитах, индуцировались только стимуляцией TLR7 / 8, а не SV. В NK-клетках SV индуцировал продукцию TNFα, а также IFNγ. Хотя R848 не активировал сигнальные пути в NK-клетках, он действительно вызывал некоторую продукцию цитокинов, скорее всего, вызванную паракринным механизмом. Продукция IFNα в pDC является отличительным признаком активации TLR7 [10] и, как и ожидалось, вызывается R848.Напротив, SV не вызывал продукции IFNα, что согласуется с отсутствием SV-зависимой активации p38 в pDC. изображает разницу в этих ответах от 3 разных доноров. Кинетика дозы для продукции внутриклеточных цитокинов показана на рисунке S2A.
Сравнение продукции цитокинов SV и агониста TLR7 / 8. (A) Свежевыделенную цельную кровь человека стимулировали PBS, 15 мкг / мл SV или 5 мкг / мл R848 в течение 6 часов до лизиса и фиксации эритроцитов. Ингибиторы секреции добавляли либо для всей стимуляции (SV), либо через 2 часа (R848).Затем фиксированные клетки готовили для 34-параметрического масс-цитометрического анализа внутриклеточного окрашивания цитокинов (ICS). Цитокин-положительные моноциты и pDC определялись как клетки, показывающие сигнал, превышающий 10 2 отсчетов. Цитокин-положительные NK-клетки были определены как клетки, показывающие сигнал выше 99 -го процентиля нестимулированных клеток. SV также не индуцировал IFNα в pDC, когда ингибиторы секреции добавляли через 2 часа. Показан один репрезентативный эксперимент. (B) Количественная оценка дисперсии продукции цитокинов на основе 5 независимых экспериментов, проведенных на 3 взрослых донорах.Гистограммы показывают среднее значение ± стандартное отклонение.
Анализы окрашивания внутриклеточных цитокинов ограничены тем, что они оценивают продукцию цитокинов, но не секрецию из-за обязательной потребности в ингибиторах секреции. Чтобы убедиться, что MCP1 секретируется моноцитами, активированными SV, и для обнаружения цитокинов, не включенных в нашу панель массовой цитометрии, мы использовали технологию luminex для количественного определения секреции 51 цитокина в плазме человека [24]. Цельную кровь собирали у 15 взрослых добровольцев и стимулировали ex vivo SV в течение 6 часов.Цитокины, демонстрирующие как минимум 5-кратное увеличение среднего сигнала флуоресценции после усреднения всех 15 субъектов, показаны на рисунке S2B. В частности, Mip1α (CCL3), IP-10 (CXCL10), IL-8, TNFα, Mip1β (CCL4), MCP1 и IL-1RA секретировались на высоких уровнях у большинства субъектов.
Иммунные комплексы, полученные из белка гриппа, ответственны за индуцированную SV активность
ex vivo
При исследовании механизмов, посредством которых SV стимулирует иммунные клетки человека, было обнаружено, что SV не может стимулировать мононуклеарные клетки периферической крови (PBMC) в стандартной культуре ткани. условия ().Впоследствии мы предположили, что фактор в плазме крови человека необходим для активации иммунной системы, вызванной SV. Чтобы оценить эту гипотезу, SV сначала предварительно инкубировали с плазмой, а затем добавляли либо к обедненной плазмой цельной крови, либо к PBMC, чтобы определить, спасает ли это нечувствительность SV. Поскольку рибосомный белок S6 является почти концевым ответным элементом в передаче сигналов ERK / mTOR [25], мы отслеживали его фосфорилирование как общий маркер активации для множества типов клеток. Примечательно, что SV, предварительно инкубированный с плазмой, может стимулировать моноциты CD16hi ().Таким образом, фактор сыворотки человека в дополнение к SV необходим для активации иммунных клеток.
Активность передачи сигналов SV индуцируется иммунными комплексами, производными от белка гриппа. (A) Цельную кровь и PBMC, полученные с помощью центрифугирования с плотностью фиколла, стимулировали либо PBS, SV, либо R848 при 10 мкг / мл в течение 30 минут перед фиксацией и анализом проточной цитометрии, как в. Показаны репрезентативные данные, изображающие моноциты CD16hi из 3 экспериментов (2 донора). (B) Цельная цельная кровь или цельная кровь без плазмы стимулировалась либо SV, SV, предварительно инкубированной с аутологичной плазмой, SV, предварительно инкубированной с аутологичным очищенным поликлональным человеческим IgG, либо рекомбинантным гемагглютинином h2N1 (5 мкг / мл) для За 30 минут до фиксации и анализа проточной цитометрии.См. Раздел «Методы» для получения подробной информации о предварительной инкубации. Показаны репрезентативные данные из 7 экспериментов.
Учитывая обилие антител против белков гриппа, особенно гемагглютинина (HA), в плазме человека казалось вероятным, что активность SV может быть связана с образованием иммунных комплексов и активацией рецептора Fc. В соответствии с этим предсказанием, предварительная инкубация SV с очищенным поликлональным человеческим IgG может также восстановить активность SV в истощенных сывороткой моноцитах цельной крови ().Аналогичные результаты были получены для NK-клеток, стимулированных в формате PBMC, а также в популяциях обогащенных NK-клеток и моноцитов CD16hi (фиг. S3). В концентрациях, используемых для восстановления активности SV, ни IgG, ни плазма по отдельности не активировали S6 (данные не показаны). IgG был единственным плазменным фактором, необходимым для активности SV, поскольку обедненная по IgG плазма не проявляла активности при предварительной инкубации с SV (данные не показаны). Фигура S4 демонстрирует, что продукция цитокинов в ответ на SV также зависела от присутствия IgG.Эти эксперименты в значительной степени предполагают, что иммунные комплексы, полученные из белков гриппа, ответственны за активацию сигнального пути, индуцированную SV, и продукцию цитокинов. Данные о моноцитах CD16hi показаны потому, что фосфорилирование S6 в моноцитах CD14hi может быть активировано центрифугированием, а моноциты CD16hi — нет.
Чтобы продемонстрировать, что эта активность зависит от белка гриппа, мы стимулировали интактную цельную кровь и цельную кровь с обедненной плазмой рекомбинантным НА из штамма h2N1. Подобно SV, HA проявляет активность только в моноцитах в присутствии плазмы человека ().Рекомбинантные белки человека (LAMP1 и HER2), полученные в тех же условиях, использовали в качестве отрицательного контроля и не стимулировали цельную кровь (данные не показаны). Основываясь на этих доказательствах, запуск рецептора Fcγ (FcγR) иммунными комплексами SV был наиболее правдоподобным объяснением активности SV.
FcγR экспрессируются во всей иммунной системе в соответствии с наблюдаемыми моделями стимуляции SV (Рисунок S5) [26]. В частности, CD64 (FcγRI), CD32 (FcγRII) и CD16 (FcγRIII) все по-разному экспрессируются в разных популяциях моноцитов.CD16 экспрессируется большинством NK-клеток. В-клетки экспрессируют только CD32, а большинство Т-клеток не экспрессируют никаких FcγR. Затем мы попытались определить, зависит ли активность SV от Fc-части IgG. Были продуцированы поликлональные белки F (ab ‘) 2 , которые, как и ожидалось, не смогли восполнить недостаток активности SV в условиях отсутствия сыворотки человека (). Чтобы подтвердить, что белки F (ab ‘) 2 все еще могут связываться с SV, иммобилизованную вакцину инкубировали с F (ab’) 2 и использовали антитела против легкой цепи для количественного определения связывания с помощью ELISA.Поликлональный F (ab ‘) 2 связывается с SV, подтверждая, что обработка пепсином не делала белки F (ab’) 2 неспособными реагировать с SV (данные не показаны). Важно отметить, что блокирующие mAb против FcγR были способны специфически ингибировать фосфорилирование рибосомного белка S6 в ответ на иммунные комплексы SV (). Стимуляция иммунного комплекса SV моноцитов CD16hi и NK-клеток (формат PBMC) блокировалась mAb, нацеленными на CD16 и CD32, но не контрольными mAB изотипа. Таким образом, активность SV в этих типах клеток зависит от интактной области Fc IgG, а также от CD16 и CD32.
Активация SV зависит от Fc и FcγR. (A) Цельную кровь без плазмы стимулировали PBS, SV предварительно инкубировали с поликлональным F (ab ‘) 2 или SV предварительно инкубировали с интактным IgG. Показаны репрезентативные данные из 2 экспериментов. (B) PBMC, обработанные блокирующими mAb против CD16 и CD32 или mAb изотипического контроля, стимулировали 0,75–3 мкг / мл комплексов SV + IgG в течение 30 минут перед фиксацией и анализом фосфорилирования S6. Показаны репрезентативные данные из 3 экспериментов, проведенных на 2 донорах.
Чтобы независимо оценить, является ли протеомная сигнатура, индуцированная SV, зависимой от FcγR, мы проанализировали эффекты агрегированного при нагревании IgG (HAG) на иммунные клетки человека. HAG, как и иммунные комплексы гриппа, избирательно стимулировал передачу сигналов ERK / mTOR, но не пути p38 или NFκB в миелоидных клетках (рисунок S6). HAG также вызывал моноцитарную продукцию MCP1 в цельной крови человека и продукцию IFNγ и TNFα NK-клетками в PBMC (данные не показаны).
Составы противогриппозной вакцины различаются по протеомным ответам
Мы оценили, зависела ли секреция цитокинов, индуцированная SV, также от человеческой сыворотки, используя luminex ().Подобно фосфорилированию рибосомного белка S6, SV-зависимая секреция цитокинов происходила только в формате цельной крови. Напротив, весь инактивированный вирус имел активность как в цельной крови, так и в PBMC. В целом, WIV индуцировал такие же цитокины, как SV, за исключением IL-8 и IFNα. WIV-зависимая продукция IFNα предполагалась на основании предыдущих исследований, которые показали, что эта активность зависит от РНК [10]. Мы также обнаружили, что лечение WIV РНКазой снижает продукцию IFNα (данные не показаны).
Сравнение различных вакцин. (A) Цельную кровь или PBMC стимулировали 15 мкг / мл SV или WIV в течение 6 часов перед центрифугированием и выделением плазмы или супернатанта. Кратное изменение MFI рассчитывали, как показано на рис. S2B. Показаны репрезентативные данные из 4 независимых экспериментов; гистограммы показывают среднее значение ± стандартное отклонение от 3 доноров. (B) Цельную кровь стимулировали (0,3 мкг / мл HA) расщепленными или живыми аттенуированными вирусными частицами в течение 40 минут и анализировали на активацию сигнального пути, как в. Показано среднее отклонение дуги ± стандартное отклонение от 3 доноров.
Наконец, мы попытались определить, вызывает ли сплит-вакцина более быстрые и сильные ответы FcγR, чем интактные вирусные частицы. SV сравнивали с живым ослабленным вирусом гриппа (LAIV) в анализах передачи сигналов (). Было обнаружено, что при эквивалентных концентрациях HA SV является гораздо более мощным индуктором немедленных сигнальных ответов, чем LAIV. Однако в более поздние моменты времени (3 часа) LAIV вызывал заметную активность, но все еще менее устойчиво, чем SV (данные не показаны).
Обсуждение
Транскрипционная активность крови, индуцированная иммунизацией in vivo SV, обнаруживается в течение нескольких часов и достигает пика через день после вакцинации [15].Модульный анализ этой активности показывает, что пути, участвующие в биологии моноцитов, NK-клеток и интерферона, нарушаются на ранних этапах вакцинации против гриппа. Однако эти транскриптомные подходы еще не показали, какие механизмы вызывают эти ответы. Наши анализы показывают, что вакцина против гриппа активирует моноциты и NK-клетки через FcγR и вызывает продукцию IFNγ, но не IFN типа I. Как сообщалось ранее [10–12], мы также не нашли доказательств того, что РНК в вакцине против SV способна активировать рецепторы TLR.Таким образом, образование иммунных комплексов и активация FcγR, скорее всего, является немедленным иммунным ответом на вакцинацию против SV у людей с уже существующими IgG-антителами против белков гриппа.
Вопрос о том, инактивирует ли расщепление вирусных частиц активность TLR, важен, поскольку было показано, что очень успешные вакцины, такие как вакцина против желтой лихорадки (YFV) и коровьей оспы, активируют множественные PRR [8,9]. Кампании по иммунизации против оспы и YFV были направлены на индукцию иммунитета у субъектов, которые были в значительной степени иммунологически не восприимчивы к этим патогенам.Напротив, вакцинация против гриппа у взрослых обычно происходит при наличии ранее существовавшей иммунологической памяти, вызванной естественным воздействием гриппа. Таким образом, мы обнаружили, что непосредственным эффектом добавления SV в кровь человека было образование иммунных комплексов. Это поднимает важный вопрос о том, как уже существующие специфичные для гриппа АТ влияют на иммунизацию SV. Из-за природы ex vivo этих исследований следует проявлять осторожность, предполагая, что активация миелоидных и NK-клеток иммунными комплексами SV обязательно усилит вакцинацию.Существуют доказательства того, что связывание IgG и образование иммунных комплексов могут как усиливать [27–30], так и ингибировать [31–35] серологические ответы на различные формы антигена. Если активация рецептора Fc может усиливать ответ на вакцинацию, то важно, что SV имел гораздо более непосредственную активность в анализах передачи сигналов, чем LAIV (). Вызванная детергентом диссоциация частиц вируса гриппа, вероятно, обнажит дополнительные вирусные белки (особенно матричные белки), которые маскируются липидными бислоями, полученными из яиц, и, таким образом, будет способствовать более сильному иммунному ответу, опосредованному рецептором Fc, у ранее подвергшихся воздействию хозяев.
В контексте вакцинации против гриппа одним из наиболее прогностических показателей плохого серологического ответа является высокий уровень антител против гемагглютинина гриппа до вакцинации [36–38]. Таким образом, возможно, что предсуществующие Ат против белков SV активно подавляют иммунизационные ответы посредством ингибирования по обратной связи. Степень, в которой такой супрессивный механизм потребует активации FcγR, не совсем ясна, но было показано, что связывание FcγRIIb может подавлять ответы В-клеток на вирусные антигены, связанные с IgG [33].Необходимы дополнительные исследования, чтобы понять, как существующие антитела влияют на реакцию на вакцинацию против гриппа и могут ли определенные адъюванты преодолеть подавление обратной связи, основанное на иммунных комплексах.
Недавний метаанализ клинических исследований показал, что на основании серологических ответов SV более эффективен у взрослых, чем у детей, и, наоборот, LAIV более эффективен у детей, чем у взрослых [39]. Наши наблюдения могут объяснить эту разницу тем, что отсутствие лигандов PRR в SV сделало бы его слабым праймером для инициации иммунных ответов у детей, но он был бы более эффективным у взрослых, потому что ответы зрелой памяти гораздо меньше зависят от активации врожденного иммунитета [10 ].Ключевой вопрос заключается в том, как реактивные или перекрестно-реактивные Т-клетки памяти, В-клетки памяти и уже существующие АТ влияют на последующую вакцинацию против SV или LAIV. Плохой серологический ответ у взрослых, вакцинированных LAIV, можно объяснить нейтрализацией IgA вирусных частиц в слизистой оболочке дыхательных путей до репликации вируса. В целом формирование иммунного комплекса, скорее всего, является важным событием в понимании вакцинации взрослых от гриппа.
Выводы
Эти исследования позволяют по-новому взглянуть на то, как вакцина против SV способствует иммунному ответу, и демонстрируют, как любая вакцина, вводимая ранее контактировавшим с ней людям, вероятно, вызовет аналогичный FcγR-опосредованный ранний ответ.
Вакцина против гриппа от сплит-вируса быстро активирует иммунные клетки через рецепторы Fcγ
. 2014 Октябрь 14; 32 (45): 5989-97.
DOI: 10.1016 / j.vaccine.2014.07.115.
Epub 2014 6 сентября.
Уильям Э. О’Горман
1
, Хуан Хуан
1
, Ю-Лин Вэй
1
, Кара Л. Дэвис
2
, Майкл Д. Лейпольд
3
, Шон С. Бендалл
1
, Брайан Кидд
4
, Корнелия Л. Деккер
2
, Холден Т. Меккер
3
, Юэ-Сю Цзянь
1
, Марк М. Дэвис
5
Принадлежности
Расширять
Принадлежности
- 1 Кафедра микробиологии и иммунологии, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 2 Кафедра педиатрии, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 3 Центр мониторинга иммунитета человека, Стэнфордский университет, Стэнфорд, Калифорния 94305, США; Институт иммунитета, трансплантации и инфекций, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 4 Институт иммунитета, трансплантации и инфекций, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 5 Кафедра микробиологии и иммунологии Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Институт иммунитета, трансплантации и инфекций, Стэнфордский университет, Стэнфорд, Калифорния 94305, США; Медицинский институт Говарда Хьюза, Стэнфордский университет, Стэнфорд, Калифорния 94305, США. Электронный адрес: [email protected].
Бесплатная статья PMC
Элемент в буфере обмена
Уильям Э. О’Горман и др.Вакцина.
.
Бесплатная статья PMC
Показать детали
Показать варианты
Показать варианты
Формат
АннотацияPubMedPMID
.2014 Октябрь 14; 32 (45): 5989-97.
DOI: 10.1016 / j.vaccine.2014.07.115.
Epub 2014 6 сентября.
Авторы
Уильям Э. О’Горман
1
, Хуан Хуан
1
, Ю-Лин Вэй
1
, Кара Л. Дэвис
2
, Майкл Д. Лейпольд
3
, Шон С. Бендалл
1
, Брайан Кидд
4
, Корнелия Л. Деккер
2
, Холден Т. Меккер
3
, Юэ-Сю Цзянь
1
, Марк М. Дэвис
5
Принадлежности
- 1 Кафедра микробиологии и иммунологии, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 2 Кафедра педиатрии, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 3 Центр мониторинга иммунитета человека, Стэнфордский университет, Стэнфорд, Калифорния 94305, США; Институт иммунитета, трансплантации и инфекций, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 4 Институт иммунитета, трансплантации и инфекций, Стэнфордский университет, Стэнфорд, Калифорния 94305, США.
- 5 Кафедра микробиологии и иммунологии Стэнфордского университета, Стэнфорд, Калифорния 94305, США; Институт иммунитета, трансплантации и инфекций, Стэнфордский университет, Стэнфорд, Калифорния 94305, США; Медицинский институт Говарда Хьюза, Стэнфордский университет, Стэнфорд, Калифорния 94305, США. Электронный адрес: [email protected].
Элемент в буфере обмена
Полнотекстовые ссылки
Опции CiteDisplay
Показать варианты
Формат
АннотацияPubMedPMID
Абстрактный
Вакцинация против сезонного гриппа — одна из наиболее распространенных медицинских процедур, но степень, в которой она активирует иммунную систему, помимо индукции выработки антител, не совсем понятна.В Соединенных Штатах наиболее распространенные составы вакцины состоят из деградированных или «расщепленных» вирусных частиц, распределенных без каких-либо адъювантов. Основываясь на предыдущих отчетах, мы попытались определить, активирует ли сплит-вакцина против гриппа рецепторы врожденного иммунитета, особенно Toll-подобные рецепторы. Высокомерное протеомное профилирование цельной крови человека с использованием цитометрии по времени пролета (CyTOF) было использовано для сравнения активации сигнального пути и продукции цитокинов между сплит-вакциной против гриппа и прототипным ответом TLR ex vivo.Этот анализ показал, что сплит-вакцина быстро и эффективно активирует несколько типов иммунных клеток, но дает протеомную сигнатуру, совершенно отличную от активации TLR. Важно отметить, что активность, индуцированная вакциной, зависела от присутствия сыворотки человека, что указывало на то, что сывороточный фактор необходим для вакцино-зависимой иммунной активации. Мы обнаружили, что этот сывороточный фактор представляет собой человеческие антитела, специфичные к белкам гриппа, и поэтому немедленная иммунная активация сплит-вакциной зависит от иммунного комплекса.Эти исследования демонстрируют, что «расщепление» вируса гриппа инактивирует любые потенциальные адъюванты, эндогенные для гриппа, такие как РНК, но у ранее подвергшихся воздействию людей может вызвать мощный иммунный ответ, способствуя быстрому образованию иммунных комплексов.
Ключевые слова:
Рецепторы Fcγ; Иммунология; Грипп; Массовая цитометрия; Вакцина.
Copyright © 2014 Elsevier Ltd. Все права защищены.
Заявление о конфликте интересов
Заявление о конфликте интересов:
Нет конфликтов для объявления.
Цифры
Рисунок 1
Сравнение активации сети сигнализации…
Рисунок 1
Сравнение активации сигнальной сети, вызванной либо SV, либо агонистом TLR7 / 8…
фигура 1
Сравнение активации сигнальной сети, вызванной либо SV, либо агонистом TLR7 / 8 .(A и B) Свежевыделенную цельную кровь человека стимулировали PBS, SV (15 мкг / мл) или R848 (10 мкг / мл) в течение 30 минут до лизиса и фиксации эритроцитов. Затем клетки окрашивали меченными изотопами mAb против поверхностных белков и сигнальных белков и готовили для 31-параметрического масс-цитометрического анализа. Популяции клеток были идентифицированы как CD11c + CD33 + HLADR + CD14hi Моноциты, CD11c + CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, HLADR + CD623 s + CD123 s + , HLADR + CD1c + cDC, CD3 — CD7 + NK-клетки, CD19 + CD20 + B-клетки и CD3 + T-клетки.См. Рисунок S1 для подробной стратегии стробирования. Индукция передачи сигналов рассчитывалась как разница средней интенсивности arcsinh по сравнению с контролем PBS. Репрезентативный эксперимент показан из 4 независимых экспериментов по массовой цитометрии, проведенных на 7 взрослых донорах.
Рисунок 2
Дозовая динамика КА…
Рисунок 2
Динамика доза-ответ SV по сравнению со стимуляцией TLR7 / 8.Цельную кровь стимулировали при разной…
фигура 2
Динамика доза-ответ SV по сравнению со стимуляцией TLR7 / 8. Цельную кровь стимулировали при различных концентрациях SV или R848 и отслеживали фосфорилирование S6 с помощью 10-параметрической проточной цитометрии. Популяции клеток были определены как CD33 + HLADR + CD14hi Моноциты, CD33 + HLADR + CD16hi Моноциты, CD66 + Гранулоциты, CD33 + HLADR + CD14 — CD16 — c , CD56 + NK-клетки, CD20 + B-клетки и CD3 + T-клетки.Индукцию передачи сигналов рассчитывали как% клеток, демонстрирующих более высокое, чем базальное фосфорилирование S6. Показаны средние точки данных реплик от 1 донора.
Рисунок 3
Сравнение производства цитокинов между…
Рисунок 3
Сравнение продукции цитокинов SV и агониста TLR7 / 8. (A) Свежеизолированный…
Рисунок 3
Сравнение продукции цитокинов SV и агониста TLR7 / 8. (A) Свежевыделенную цельную кровь человека стимулировали PBS, 15 мкг / мл SV или 5 мкг / мл R848 в течение 6 часов до лизиса и фиксации эритроцитов. Ингибиторы секреции добавляли либо для всей стимуляции (SV), либо через 2 часа (R848). Затем фиксированные клетки готовили для 34-параметрического масс-цитометрического анализа внутриклеточного окрашивания цитокинов (ICS).Цитокин-положительные моноциты и pDC определялись как клетки, показывающие сигнал, превышающий 10 2 отсчетов. Цитокин-положительные NK-клетки были определены как клетки, показывающие сигнал выше 99 -го процентиля нестимулированных клеток. SV также не индуцировал IFNα в pDC, когда ингибиторы секреции добавляли через 2 часа. Показан один репрезентативный эксперимент. (B) Количественная оценка дисперсии продукции цитокинов на основе 5 независимых экспериментов, проведенных на 3 взрослых донорах.Гистограммы показывают среднее значение ± стандартное отклонение.
Рисунок 4
Индуцируется сигнальная активность SV…
Рисунок 4
Сигнальная активность
SV индуцируется иммунными комплексами, производными от белка гриппа. (A) Цельная кровь…
Рисунок 4
Сигнальная активность
SV индуцируется иммунными комплексами, производными от белка гриппа. (A) Цельную кровь и PBMC, полученные с помощью центрифугирования с плотностью фиколла, стимулировали либо PBS, SV, либо R848 при 10 мкг / мл в течение 30 минут перед фиксацией и проточно-цитометрическим анализом, как на рисунке 2. Типичные данные, изображающие моноциты CD16hi из 3 показаны эксперименты (2 донора). (B) Цельная цельная кровь или цельная кровь без плазмы стимулировалась либо SV, либо SV, предварительно инкубированной с аутологичной плазмой, SV, предварительно инкубированной с аутологичным очищенным поликлональным человеческим IgG, или рекомбинантным гемагглютинином h2N1 (5 мкг / мл) для За 30 минут до фиксации и анализа проточной цитометрии. См. Раздел «Методы» для получения подробной информации о предварительной инкубации. Показаны репрезентативные данные из 7 экспериментов.
Рисунок 5
SV активация Fc и…
Рисунок 5
Активация
SV зависит от Fc и FcγR. (A) Стимулировалась цельная кровь с обедненной плазмой…
Рисунок 5.
Активация
SV зависит от Fc и FcγR. (A) Цельную кровь с обедненной плазмой стимулировали PBS, SV предварительно инкубировали с поликлональным F (ab ‘) 2 или SV, предварительно инкубированные с интактным IgG. Показаны репрезентативные данные из 2 экспериментов. (B) PBMC, обработанные блокирующими mAb против CD16 и CD32 или mAb изотипического контроля, стимулировали.75–3 мкг / мл комплексов SV + IgG в течение 30 минут до фиксации и анализа фосфорилирования S6. Показаны репрезентативные данные из 3 экспериментов, проведенных на 2 донорах.
Рисунок 6
Сравнение различных вакцин.…
Рисунок 6
Сравнение различных вакцин. (A) Цельную кровь или PBMC стимулировали 15 мкг / мл…
Рисунок 6
Сравнение различных вакцин. (A) Цельную кровь или PBMC стимулировали 15 мкг / мл SV или WIV в течение 6 часов перед центрифугированием и выделением плазмы или супернатанта. Кратное изменение MFI рассчитывали, как показано на рис. S2B. Показаны репрезентативные данные из 4 независимых экспериментов; гистограммы показывают среднее значение ± стандартное отклонение от 3 доноров. (B) Цельную кровь стимулировали (0,3 мкг / мл HA) либо расщепленными, либо живыми аттенуированными вирусными частицами в течение 40 минут и анализировали на активацию сигнального пути, как показано на фиг.1. Показана средняя разница дуги ± стандартное отклонение от 3 доноров.
Похожие статьи
Длительная продукция провоспалительных цитокинов в моноцитах, модулируемая интерлейкином 10, после вакцинации против гриппа у пожилых людей.
Моханти С., Джоши С.Р., Уэда И., Уилсон Дж., Блевинс Т.П., Сиконолфи Б., Мэн Х., Дивайн Л., Раддасси К., Цанг С., Белше Р.Б., Хафлер Д.А., Кеч С.М., Кляйнштейн С.Х., Тренталанж М., Аллоре Х.Г., Шоу А.С. .
Моханти С. и др.
J Infect Dis. 2015 1 апреля; 211 (7): 1174-84. DOI: 10.1093 / infdis / jiu573. Epub 2014 2 ноября.
J Infect Dis. 2015 г.PMID: 25367297
Бесплатная статья PMC.Универсальная вакцина против вируса гриппа: связь передачи сигналов TLR с противовирусной защитой.
Schmitz N, Beerli RR, Bauer M, Jegerlehner A, Dietmeier K, Maudrich M, Pumpens P, Saudan P, Bachmann MF.
Schmitz N, et al.
Eur J Immunol. 2012 Апрель; 42 (4): 863-9. DOI: 10.1002 / eji.201041225.
Eur J Immunol. 2012 г.PMID: 22531913
Влияние активности слияния вирусной мембраны на индукцию антител вакциной на основе цельного инактивированного вируса гриппа H5N1.
Гираэдтс Ф., тер Вир В., Вильшут Дж., Хакриде А., де Хаан А.Geeraedts F, et al.
Вакцина. 2012 5 октября; 30 (45): 6501-7. DOI: 10.1016 / j.vaccine.2012.07.036. Epub 2012 27 июля.
Вакцина. 2012 г.PMID: 22841974
[Сравнение сезонных противогриппозных вакцин: состав и свойства].
Аллвинн Р., Дорр Х.В.
Allwinn R, et al.
Dtsch Med Wochenschr. 2011 ноя; 136 (45): 2315-8. DOI: 10.1055 / с-0031-12. Epub 2011 2 ноября.Dtsch Med Wochenschr. 2011 г.
PMID: 22048938
Обзор.
Немецкий.Иммунологические корреляты защиты и потенциальной роли адъювантов в улучшении противогриппозных вакцин у пожилых людей.
Макэлхейни Дж. Э., Колер Р. Н., Болдуин С. Л..
McElhaney JE, et al.
Экспертные ревакцины. 2013 июл; 12 (7): 759-66. DOI: 10.1586 / 14760584.2013.811193.
Экспертные ревакцины. 2013.PMID: 23885821Обзор.
Процитировано
15
статей
Подход к разработке вакцины против гриппа, основанный на антигенной экономии.
Болтон Дж.С., Клим Х., Велленс Дж., Эдманс М, Обольски У., Томпсон С.П.
Болтон Дж. С. и др.
Вакцины (Базель). 2021 16 июня; 9 (6): 657.DOI: 10.3390 / Vacines57.
Вакцины (Базель). 2021 г.PMID: 34208489
Бесплатная статья PMC.Обзор.
Одноклеточное периферическое иммунопрофилирование болезней Альцгеймера и Паркинсона.
Фонгприча Т., Фернандес Р., Мрджен Д., Кулос А., Гаджера С.Р., Вавро А.М., Стэнли Н., Годильер Б., Постон К.Л., Агаипур Н., Монтин Т.Дж.
Фонгприча Т. и др.
Sci Adv. 2020 25 ноября; 6 (48): eabd5575.DOI: 10.1126 / sciadv.abd5575. Печать 2020 Ноябрь.
Sci Adv. 2020.PMID: 33239300
Бесплатная статья PMC.Системная вакцинология для живой вакцины против аттенуированной туляремии выявляет уникальные транскрипционные сигнатуры, которые предсказывают гуморальные и клеточные иммунные ответы.
Натраджан М.С., Руфаэль Н., Лай Л., Казмин Д., Дженсен Т.Л., Вайс Д.С., Ибегбу С., Штейн М.Б., Хупер В.Ф., Хилл Х., Андерсон Э.Д., Джонсон Р., Санс П., Пулендран Б., Голл Дж. Б., Маллиган М.Дж.Натраджан М.С. и др.
Вакцины (Базель). 2019 декабря 24; 8 (1): 4. DOI: 10.3390 / Vacines8010004.
Вакцины (Базель). 2019.PMID: 31878161
Бесплатная статья PMC.Набор данных FluPRINT — многомерный анализ воздействия вакцины против гриппа на иммунную систему.
Tomic A, Tomic I, Dekker CL, Maecker HT, Davis MM.
Томич А. и др.
Научные данные. 2019 21 октября; 6 (1): 214.DOI: 10.1038 / s41597-019-0213-4.
Научные данные. 2019.PMID: 31636302
Бесплатная статья PMC.Роль подходов системной биологии в определении молекулярных сигнатур для разработки более эффективных вакцин.
Пезешки А, Овсянникова И.Г., МакКинни Б.А., Польша Г.А., Кеннеди РБ.
Пезешки А. и др.
Экспертные ревакцины. 2019 Март; 18 (3): 253-267. DOI: 10.1080 / 14760584.2019.1575208. Epub 2019 11 февраля.
Экспертные ревакцины. 2019.PMID: 30700167
Бесплатная статья PMC.Обзор.
Типы публикаций
- Научно-исследовательская поддержка, N.I.H., заочная форма
- Поддержка исследований, за пределами США. Правительство
Условия MeSH
- Антитела, вирусные / кровь
- GPI-Linked Proteins / иммунология
- Вакцины против гриппа / иммунология *
- Грипп, человек / профилактика и борьба *
- Рецепторы, IgG / иммунология *
- Передача сигналов / иммунология *
- Толл-подобный рецептор 7 / агонисты
- Толл-подобный рецептор 8 / агонисты
LinkOut — дополнительные ресурсы
Полнотекстовые источники
Другие источники литературы
Медицинские
Разное
[Икс]
цитировать
Копировать
Формат:
AMA
APA
ГНД
NLM
Типы вакцины против сезонного гриппа
Подробный обзор имеющихся вакцин против сезонного гриппа в ЕС / ЕЭЗ не будет доступен для программ вакцинации 2020/21 года из-за ограниченных ресурсов ECDC после реагирования на COVID-19.
Инъекционные трехвалентные инактивированные вакцины против гриппа наиболее широко используются во всем мире. Препараты антигена гриппа различаются у разных производителей. Инактивированные вакцины против гриппа, доступные в ЕС / ЕЭЗ, могут содержать либо продукты вируса гриппа расщепленного вириона, либо продукты субъединичного гриппа. Адъювантные инактивированные субъединичные вакцины против гриппа для пожилых людей доступны в некоторых государствах-членах ЕС / ЕЭЗ.
Ожидается, что инъекционные четырехвалентные инактивированные вакцины против гриппа, доступные с сезона 2014/2015 в некоторых странах ЕС / ЕЭЗ, со временем заменят трехвалентные вакцины.Хотя вакцина доступна на частном рынке в некоторых европейских странах, разрешение на вакцину, доступность вакцины, наблюдаемая эффективность вакцины и стоимость могут повлиять на скорость этой замены.
В 2011 г. живая аттенуированная вакцина против гриппа (LAIV) для интраназального применения была одобрена в ЕС / ЕЭЗ для детей и подростков (от 2 до 17 лет). Все доступные в настоящее время живые аттенуированные противогриппозные вакцины представляют собой четырехвалентные комбинированные вакцины, содержащие два штамма гриппа A (подтипы h2N1 и h4N2) и два штамма гриппа B (линии Victoria и Yamagata) в соответствии с рекомендациями ВОЗ.
Универсальные педиатрические программы, организованные в Финляндии и Великобритании, предлагают четырехвалентный LAIV детям в возрасте 2–3 или 2–11 лет соответственно.
Поскольку вакцины против сезонного гриппа обычно рекомендуются для нескольких уязвимых групп населения, которые имеют более низкий иммунный ответ из-за возраста или заболевания, за последние 10-15 лет было изучено несколько попыток улучшить вакцины, такие как: увеличение вводимой дозы антигена, внутрикожное введение для активации других звеньев иммунной системы и добавления иммуностимулирующих соединений, таких как адъюванты (см. ссылки 1-4).
Продукты, в которых используются эти новые технологии, теперь разрешены и доступны в некоторых странах ЕС / ЕЭЗ. См. Таблицу ниже. Для вакцин против гриппа человека MF59 (сквален) и AS03 (сквален и α-токоферол) были одобрены в качестве адъювантов регулирующими органами в ЕС, Канаде и США. Данные нескольких обсервационных исследований, указывающие на улучшение показателей и сокращение количества госпитализаций пожилых людей против гриппа и госпитализаций, были включены в этикетку трехвалентной противогриппозной вакцины с адъювантом.
Большинство противогриппозных вакцин, как инактивированных, так и живых аттенуированных, основаны на продукции вирусов / антигенов гриппа в оплодотворенных куриных яйцах. Следовательно, эти вакцины нельзя вводить лицам с аллергией на яйца, у которых развиваются тяжелых симптомов при воздействии яичных белков. Поэтому несколько производителей разработали вакцины против гриппа на клеточной основе, которые можно вводить людям с тяжелой аллергией на яйца. Использование продуктов на основе клеток может лучше соответствовать циркулирующим штаммам гриппа, поскольку они позволяют избежать проблем с адаптацией яиц.
Обзор имеющихся вакцин против сезонного гриппа в ЕС / ЕЭЗ (сезон 2019/20)
Рекомбинантная вакцина на основе HA превосходит сплит-вакцины и субъединичные вакцины в выявлении гриппоспецифических Т-клеток CD4 и зависимых от Т-лимфоцитов антител у людей
Бувье, Нью-Мексико. . Vaccines (Basel) https://doi.org/10.3390/vaccines6030058 (2018).
Барберис И., Майлс П., Олт С. К., Брагацци Н. Л. и Мартини М. История и эволюция борьбы с гриппом посредством вакцинации: от первой моновалентной вакцины до универсальных вакцин. J. Prev. Med. Hyg. 57 , E115 – E120 (2016).
CAS
PubMed
PubMed Central
Google Scholar
Моа, А. М., Чухтай, А. А., Мускателло, Д. Дж., Тернер, Р. М. и Макинтайр, С. Р. Иммуногенность и безопасность инактивированной четырехвалентной вакцины против гриппа у взрослых: систематический обзор и метаанализ рандомизированных контролируемых испытаний. Вакцина 34 , 4092–4102 (2016).
CAS
PubMed
Google Scholar
Del Giudice, G. & Rappuoli, R. Инактивированные и адъювантные противогриппозные вакцины. Curr. Вершина. Microbiol. Иммунол. 386 , 151–180 (2015).
PubMed
Google Scholar
Хегде, Н. Р. Вакцины против гриппа на основе клеточных культур: необходимые и незаменимые инвестиции в будущее. Хум. Vaccin Immunother. 11 , 1223–1234 (2015).
PubMed
PubMed Central
Google Scholar
Schotsaert, M. & Garcia-Sastre, A. Вакцины против гриппа: подвижная междисциплинарная область. Вирусы 6 , 3809–3826 (2014).
CAS
PubMed
PubMed Central
Google Scholar
Робертсон, Дж.S. et al. Изменения гемагглютинина, связанные с адаптацией вируса гриппа B к росту в яйцах. Вирусология 143 , 166–174 (1985).
CAS
PubMed
Google Scholar
Robertson, J. S. et al. Структурные изменения гемагглютинина, сопровождающие адаптацию яиц вируса гриппа A (h2N1). Virology 160 , 31–37 (1987).
CAS
PubMed
Google Scholar
Wu, N.C. et al. Структурное объяснение низкой эффективности вакцины против сезонного гриппа h4N2. PLoS Pathog. 13 , e1006682 (2017).
PubMed
PubMed Central
Google Scholar
Montomoli, E. et al. Гриппозные вакцины, полученные из клеточных культур из клеток Vero: новые горизонты для производства вакцин. Expert Rev. Vaccines 11 , 587–594 (2012).
CAS
PubMed
Google Scholar
Manini, I. et al. Флусельвакс (Оптафлю) от сезонного гриппа. Expert Rev. Vaccines 14 , 789–804 (2015).
CAS
PubMed
Google Scholar
Кокс, М. М., Патриарка, П. А. и Треанор, Дж. FluBlok, рекомбинантная вакцина против гриппа с гемагглютинином. Influenza Other Respir. Вирусы 2 , 211–219 (2008).
PubMed
PubMed Central
Google Scholar
Кокс, М. М., Изиксон, Р., Пост, П. и Дункл, Л. Безопасность, эффективность и иммуногенность Флублока в профилактике сезонного гриппа у взрослых. Ther. Adv. Вакцины 3 , 97–108 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Frenck, R. W. Jr. et al. Сравнение иммуногенности и безопасности инактивированной трехвалентной противогриппозной вакцины с расщепленным вирионом (Fluzone®), вводимой внутрикожно и внутримышечно здоровым взрослым. Vaccine 29 , 5666–5674 (2011).
CAS
PubMed
PubMed Central
Google Scholar
Дункл, Л. М. и Изиксон, Р. Рекомбинантная вакцина против гриппа с гемагглютинином обеспечивает более широкий спектр защиты. Expert Rev. Vaccines 15 , 957–966 (2016).
CAS
PubMed
Google Scholar
Кулькарни Р.R. et al. Активация пути RIG-I во время вакцинации против гриппа усиливает реакцию зародышевого центра, способствует индукции Т-фолликулярных хелперных клеток и обеспечивает эффект снижения дозы и защитный иммунитет. J. Virol. 88 , 13990–14001 (2014).
PubMed
PubMed Central
Google Scholar
Jeisy-Scott, V. et al. Распознавание TLR7 необязательно при инфекции вируса гриппа А, но важно для индукции гемагглютинин-специфических антител в ответ на пандемическую сплит-вакцину 2009 года у мышей. J. Virol. 86 , 10988–10998 (2012).
CAS
PubMed
PubMed Central
Google Scholar
An, Y. et al. N-гликозилирование гемагглютининов вакцины против сезонного гриппа: значение для тестирования активности и иммунной обработки. Дж. Вирол . https://doi.org/10.1128/JVI.01693-18 (2019).
de Vries, R.P. et al. Гликан-зависимая иммуногенность рекомбинантного растворимого тримерного гемагглютинина. J. Virol. 86 , 11735–11744 (2012).
PubMed
PubMed Central
Google Scholar
Lin, S.C. et al. Другой иммунитет, вызываемый рекомбинантными белками гемагглютинина H5N1, содержащими паукиманнозу, высокоманнозу или N-гликаны сложного типа. PLoS ONE 8 , e66719 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Лэмб, Ю. Н. Клеточная четырехвалентная инактивированная вакцина против вируса гриппа (Flucelvax ((R)) Tetra / Flucelvax Quadrivalent ((R))): обзор профилактики гриппа. Наркотики 79 , 1337–1348 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Кокс, М. М. и Холлистер, Дж. Р. FluBlok, вакцина против гриппа нового поколения, производимая на основе клеток насекомых. Биологические препараты 37 , 182–189 (2009).
CAS
PubMed
Google Scholar
Бакстер, Д. Оценка случая использования трехвалентных или четырехвалентных вакцин против гриппа. Хум. Vaccin Immunother. 12 , 2712–2717 (2016).
PubMed
PubMed Central
Google Scholar
Белше Р. Б. Потребность в четырехвалентной вакцине против сезонного гриппа. Вакцина 28 (Приложение 4), D45 – D53 (2010).
PubMed
Google Scholar
Ричардс, К. А., Треанор, Дж. Дж., Наяк, Дж. Л. и Сант, А. Дж. Общие паттерны иммунодоминирования и значительное разнообразие специфичности и функциональности в репертуаре циркулирующих Т-клеток вируса гриппа A и B CD4 человека. J. Infect. Дис. https://doi.org/10.1093/infdis/jiy288 (2018).
Creary, L.E. et al. HLA-типирование следующего поколения 382 эталонных линий b-лимфобластоидных клеток международной рабочей группы по гистосовместимости: отчет 17-го международного семинара по HLA и иммуногенетике. Хум. Иммунол. 80 , 449–460 (2019).
PubMed
PubMed Central
Google Scholar
Мейер, Д., В. Р., К. А., Битарелло, Б. Д., Д. Ю., К. Б. и Нунес, К. Геномная перспектива эволюции HLA. Immunogenetics 70 , 5–27 (2018).
CAS
PubMed
Google Scholar
Guthmiller, J. J. & Wilson, P.C. Использование иммунного анамнеза для борьбы с вирусами гриппа. Curr. Opin. Иммунол. 53 , 187–195 (2018).
CAS
PubMed
Google Scholar
Zhang, A. et al. Антигенный грех: как первое воздействие формирует пожизненный иммунный ответ против вируса гриппа. J. Immunol. 202 , 335–340 (2019).
CAS
PubMed
Google Scholar
Нельсон, С. А. и Сант, А. Дж. Импринтинг и редактирование Т-клеточного ответа CD4 человека на вирус гриппа. Front Immunol. 10 , 932 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Robertson, C.A. et al. Высокодозная вакцина против гриппа Fluzone®. Expert Rev. Vaccines 15 , 1495–1505 (2016).
CAS
PubMed
Google Scholar
Katz, J. M. et al. Иммунитет к гриппу: проблемы защиты стареющего населения. Immunol. Res. 29 , 113–124 (2004).
CAS
PubMed
Google Scholar
Lee, J. K. H. et al. Эффективность и эффективность вакцинации против гриппа высокими дозами по сравнению со стандартной дозой для пожилых людей: систематический обзор и метаанализ. Expert Rev. Vaccines 17 , 435–443 (2018).
CAS
PubMed
Google Scholar
Monto, A. S. et al. Контроль над гриппом в 21 веке: оптимизация защиты пожилых людей. Vaccine 27 , 5043–5053 (2009).
PubMed
Google Scholar
Салливан, С. Дж., Якобсон, Р. и Поланд, Г. А. Достижения в вакцинации пожилых людей от гриппа: роль высокодозной вакцины. Expert Rev. Vaccines 9 , 1127–1133 (2010).
CAS
PubMed
Google Scholar
Хак, К. и МакЭлхейни, Дж. Э. Иммунное старение: вакцинация против гриппа и пожилые люди. Curr. Opin. Иммунол. 29 , 38–42 (2014).
CAS
PubMed
Google Scholar
Lovelace, P. & Maecker, H.T. Многопараметрическое внутриклеточное окрашивание цитокинов. Methods Mol. Биол. 1678 , 151–166 (2018).
CAS
PubMed
Google Scholar
Beebe, E. A. и Orr, M. T. Оценка антиген-специфической клеточной иммуногенности с использованием окрашивания внутриклеточных цитокинов, ELISpot и культуральных супернатантов. Methods Mol. Биол. 1494 , 313–320 (2017).
CAS
PubMed
Google Scholar
Сант, А. Дж., ДиПиацца, А. Т., Наяк, Дж. Л., Раттан, А. и Ричардс, К. А. Т-клетки CD4 в защите от вируса гриппа: специфичность вирусного антигена и функциональный потенциал. Immunol. Ред. 284 , 91–105 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Ascough, S., Paterson, S. & Chiu, C. Индукция и подрыв защитного иммунитета человека: контрастирование гриппа и респираторно-синцитиального вируса. Front Immunol. 9 , 323 (2018).
PubMed
PubMed Central
Google Scholar
Valkenburg, S. A. et al. Защита универсальной противогриппозной вакциной обеспечивается Т-клетками памяти CD4. Вакцина 36 , 4198–4206 (2018).
CAS
PubMed
Google Scholar
Кокс, Р. Дж. Корреляты защиты от вируса гриппа, что нам делать дальше? Хум.Vaccin Immunother. 9 , 405–408 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Trombetta, C. M. & Montomoli, E. Оценка иммунологии гриппа и корреляты защиты: акцент на вакцинах. Expert Rev. Vaccines 15 , 967–976 (2016).
CAS
PubMed
Google Scholar
Sicca, F., Неппеленбрук, С. и Хакриде, А. Эффекторные механизмы грипп-специфических антител: нейтрализация и не только. Expert Rev. Vaccines 17 , 785–795 (2018).
CAS
PubMed
Google Scholar
Gao, R., Sheng, Z., Sreenivasan, C.C, Wang, D. & Li, F. Антитела к вирусу гриппа A с функцией антителозависимой клеточной цитотоксичности. Вирусов https://doi.org/10.3390/v12030276 (2020).
Тай, М. З., Вие, К. и Поллара, Дж. Антителозависимый клеточный фагоцитоз при противовирусных иммунных ответах. Front Immunol. 10 , 332 (2019).
CAS
PubMed
PubMed Central
Google Scholar
An, Y. et al. Сравнительный гликомический анализ гемагглютинина гриппа (H5N1), продуцируемого на клеточных платформах, соответствующих вакцинам. J. Proteome Res. 12 , 3707–3720 (2013).
CAS
PubMed
PubMed Central
Google Scholar
van Dinther, D. et al. Ориентация на лектиновые рецепторы С-типа: высокоуглеводная диета для дендритных клеток для улучшения противораковых вакцин. J. Leukoc. Биол. 102 , 1017–1034 (2017).
PubMed
PubMed Central
Google Scholar
Королева М. и др. Взаимодействие гетерологичных вирусных белков в лицензированных вакцинах против сезонного гриппа. NPJ Vaccines 5 , 3 (2020).
PubMed
PubMed Central
Google Scholar
Кокс, Р. Дж. И Брокстад, К. А. Поствакцинальный ответ антител на белки вируса гриппа. APMIS 107 , 289–296 (1999).
CAS
PubMed
Google Scholar
Co, M. D. et al. Доказательства in vitro того, что коммерческие вакцины против гриппа не похожи по своей способности активировать человеческие Т-клеточные ответы. Vaccine 27 , 319–327 (2009).
PubMed
Google Scholar
Terajima, M. et al. Вирус гриппа A, специфичный к белку 1 матрикса CD8 + Т-клеток человека, индуцированный у реципиентов трехвалентной инактивированной вакцины. J. Virol. 82 , 9283–9287 (2008).
CAS
PubMed
PubMed Central
Google Scholar
Nienen, M. et al. Роль ранее существовавших перекрестно-реактивных CD4 Т-клеток центральной памяти в вакцинации ранее неизвестными штаммами гриппа. Front Immunol. 10 , 593 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Yang, J. et al. CD4 + Т-клетки распознают уникальные и консервативные эпитопы гемагглютинина гриппа 2009 h2N1 после естественной инфекции и вакцинации. Внутр.Иммунол. 25 , 447–457 (2013).
CAS
PubMed
PubMed Central
Google Scholar
Ge, X. et al. Оценка ответов Т-лимфоцитов CD4, специфичных для сезонного вируса гриппа A, на пандемический вирус гриппа A свиного происхождения 2009 г. J. Virol. 84 , 3312–3319 (2010).
CAS
PubMed
PubMed Central
Google Scholar
Chen, L. et al. Иммунодоминантные CD4 + Т-клеточные ответы на вирус гриппа А у здоровых людей сосредоточены на матриксе 1 и нуклеопротеине. J. Virol. 88 , 11760–11773 (2014).
PubMed
PubMed Central
Google Scholar
Babon, J. A. et al. Полногеномный скрининг человеческих Т-клеточных эпитопов вируса гриппа А выявляет широкий спектр CD4 (+) Т-клеточных ответов на внутренние белки, гемагглютинины и нейраминидазы. Хум. Иммунол. 70 , 711–721 (2009).
CAS
PubMed
PubMed Central
Google Scholar
Сангстер М. Ю., Нгуен П. К. Т. и Топхэм Д. Дж. Роль В-клеток памяти в продукции гемагглютинин-специфических антител после инфицирования вирусом гриппа А. Патогены https://doi.org/10.3390/pathogens8040167 (2019).
Палм, А. Э. и Генри, К. Воспоминания о прошлом: долговременная память В-клеток после инфекции и вакцинации. Фронт. Иммунол. 10 , 1787 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Краммер Ф. Реакция антител человека на инфекцию вируса гриппа А и вакцинацию. Nat. Ред. Иммунол . https://doi.org/10.1038/s41577-019-0143-6 (2019).
Eichelberger, M. C., Morens, D. M. & Taubenberger, J. K. Нейраминидаза как антиген противогриппозной вакцины: низко висящий плод, готовый к сбору для повышения эффективности вакцины. Curr. Opin. Иммунол. 53 , 38–44 (2018).
CAS
PubMed
PubMed Central
Google Scholar
Коуч Р. Б. Обзор сывороточных ответов антител на антигены вируса гриппа. Dev. Биол. (Базель) 115 , 25–30 (2003).
CAS
Google Scholar
Эллебеди А. Х. Иммунизация иммунитета: можем ли мы преодолеть самую серьезную проблему гриппа? Vaccines (Базель). https://doi.org/10.3390/vaccines6040068 (2018).
Belongia, E. A. et al. Ежегодная повторная вакцинация против гриппа и эффективность вакцины: обзор доказательств. Expert Rev. Vaccines 16 , 1–14 (2017).
PubMed
Google Scholar
Richards, K. A. et al. Доказательства того, что притупленные ответы Т-лимфоцитов CD4 лежат в основе недостаточных защитных ответов антител на вакцины против гриппа у повторно вакцинированных людей. J. Infect. Dis . https://doi.org/10.1093/infdis/jiz433 (2019).
Sasaki, S. et al. Влияние предшествующей вакцинации против гриппа на антитела и В-клеточные ответы. PLoS ONE 3 , e2975 (2008 г.).
PubMed
PubMed Central
Google Scholar
Andrews, S. F. et al. Высокие ранее существовавшие уровни серологических антител коррелируют с разнообразием ответа на вакцину против гриппа. J. Virol. 89 , 3308–3317 (2015).
CAS
PubMed
PubMed Central
Google Scholar
Клеменс, Э. Б., ван де Сандт, К., Вонг, С. С., Ваким, Л. М. и Валкенбург, С. А. Использование силы Т-клеток: многообещающая надежда на универсальную вакцину против гриппа. Vaccines (Базель). https://doi.org/10.3390/vaccines6020018 (2018).
Джанчекки Э., Торелли А.И Монтомоли, Э. Использование клеточного иммунитета для оценки противогриппозных вакцин: грядущая необходимость. Хум. Vaccin Immunother. 15 , 1021–1030 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Yang, J. H. M. et al. Фенотипический анализ лимфатических узлов человека у субъектов с впервые возникшим диабетом 1 типа и у здоровых людей с помощью проточной цитометрии. Front Immunol. 10 , 2547 (2019).
CAS
PubMed
PubMed Central
Google Scholar
Shannon, I. et al. Различия в иерархии и функциональном потенциале гриппоспецифического иммунодоминирования Т-лимфоцитов CD4 у детей и молодых людей. Sci. Отчетность 9 , 791 (2019).
PubMed
PubMed Central
Google Scholar
Lamoreaux, L., Roederer, M. & Koup, R. Оптимизация внутриклеточных цитокинов и стандартная операционная процедура. Nat. Protoc. 1 , 1507–1516 (2006).
CAS
PubMed
Google Scholar
Nayak, J. L. et al. Экспансия CD4 + T-клеток предсказывает нейтрализующие реакции антител на вакцину подтипа h2N1 вируса пандемического гриппа A (h2N1) 2009 г., инактивированную моновалентной инактивированной. J. Infect. Дис. 207 , 297–305 (2013).
CAS
PubMed
Google Scholar
Сплит-инактивированная вакцина COBRA выявляет защитные антитела против вирусов гриппа h2N1 и h4N2
Abstract
Разработка широко реактивных или универсальных противогриппозных вакцин станет событием, меняющим парадигму в области вакцин против гриппа. Эти вакцины следующего поколения могут заменить нынешний стандарт лечения вакцинами, которые вызывают перекрестные иммунные ответы в широком смысле.Тем не менее, необходимо множество моделей in vitro и in vivo для наилучшей оценки этих вакцинных составов для определения механизмов их действия и обеспечения возможности выбора кандидатов до клинических испытаний на людях. Наша группа разработала вычислительно оптимизированную технологию широко реактивного антигена (COBRA) для разработки основанных на HA стратегий для выработки антител против штаммов гриппа h2, h4 и H5. Эти вакцины вызывают широко реактивные ответы антител, которые нейтрализуют не только исторические и современные вакцинные штаммы, но и варианты, совместно циркулирующие у мышей.В этом исследовании мы использовали HA-антигены h2 и h4 в составе расщепленной инактивированной вакцины (IIV) в сочетании с адъювантом эмульсии сквалена в воде AF03 у хорьков, иммунологически не восприимчивых к вирусу гриппа. Вакцина H4 COBRA IIV T11 вырабатывала антитела с активностью HAI против большего количества штаммов гриппа h4N2 по сравнению с IIV, экспрессирующими антигены HA h4 дикого типа, за исключением вакцин IIV, экспрессирующих HA из вируса A / Texas / 50/2012 (Tx / 12). Вакцины h2 COBRA IIV, P1 и X6, вырабатывали антитела, которые распознавали такое же количество вирусов h2N1, что и антитела, вызванные IIV, экспрессирующими HA A / California / 07/2009 (CA / 09).Хорьки, вакцинированные P1 или X6 COBRA IIV, были защищены от заражения CA / 09 и выводили вирус из легких хорьков, подобно хорькам, вакцинированным CA / 09 IIV.
Образец цитирования: Allen JD, Ray S, Ross TM (2018) Сплит-инактивированная вакцина COBRA выявляет защитные антитела против вирусов гриппа h2N1 и h4N2. PLoS ONE 13 (9):
e0204284.
https://doi.org/10.1371/journal.pone.0204284
Редактор: Санг-Му Канг, Центр воспаления, иммунитета и инфекций, Институт биомедицинских наук, СОЕДИНЕННЫЕ ШТАТЫ
Поступила: 11 июня, 2018; Дата принятия: 4 сентября 2018 г .; Опубликован: 28 сентября 2018 г.
Авторские права: © 2018 Allen et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Эта работа, включая усилия TMR, финансировалась Университетом Джорджии (UGA) (UGA-001). Эта работа, включая усилия TMR, финансировалась Санофи Пастер (CROA UGA 001).Кроме того, TMR поддерживается Исследовательским альянсом Джорджии как выдающийся ученый. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Вакцинация против гриппа — наиболее экономичный метод предотвращения заражения гриппом и его распространения в обществе. Современные стратегии вакцинации против гриппа в первую очередь вырабатывают антитела, которые связываются с гликопротеинами гемагглютинина (HA) и нейраминидазы (NA) гриппа на поверхности вируса и блокируют вирусную инфекцию и распространяются от клетки к клетке [1, 2].Хотя живые аттенуированные и рекомбинантные вакцины на основе НА одобрены для использования человеком, большинство вакцин против сезонного гриппа разрабатываются для Северного и Южного полушария каждый год, при этом большая часть вакцин выращивается производителями на оплодотворенных куриных яйцах. После роста в яйцах вирус гриппа собирают из аллантоисной жидкости и концентрируют зональным ультрацентрифугированием. Впоследствии промежуточный сыпучий материал инактивируется и готовится перед стерильной фильтрацией, наполнением и отделкой.В случае сплит-вакцины вирус разделяется, а расщепляющий агент удаляется перед составлением и стерильной фильтрацией за счет иммуногенности [3–6]. Сплит-вакцины против гриппа производятся чаще, чем вакцины на основе цельного инактивированного вируса (WIV), поскольку сплит-вакцины имеют меньше побочных эффектов [7, 8]. Введенные почти 60 лет назад, первоначальные протоколы расщепления основывались на экстракции вируса диэтиловым эфиром [9, 10]. Однако диэтиловый эфир (эфир) летуч, обладает опасностью взрыва, может вызывать раздражение кожи и глаз и может привести к системному поражению органов после длительного и многократного воздействия.Производители также столкнулись с трудностями при определении концентрации ГК в сплит-вакцине с помощью этого метода [11]. Поэтому сегодня большинство вакцин против гриппа производится с использованием дезоксихолата (Афлурия, Флулаваль, Флуарикс) или TritonX-100 (Флузон).
Несмотря на то, что вакцины против гриппа используются уже около 50 лет, все еще существует ряд ограничений, связанных как с их доступностью, так и с их эффективностью [12]. Антигенная изменчивость циркулирующих штаммов из-за эволюции вирусных белков HA и NA приводит к уклонению от иммунитета за счет предотвращения связывания антител и последующей нейтрализации инфекции.Дважды в год Всемирная организация здравоохранения (ВОЗ) [13] дает рекомендации производителям противогриппозных вакцин и национальным правительственным учреждениям относительно того, какие из циркулирующих штаммов следует включить в сезон гриппа в следующем полушарии. В настоящее время рекомендуются два штамма вируса гриппа A, представляющие подтипы h2N1 и h4N2, а также два штамма вируса гриппа B, представляющие линии Yamagata и Victoria (http://www.who.int/influenza/vaccines/virus/recommendations / en /).Тем не менее, существует необходимость в разработке стратегий вакцины против гриппа, которые будут вызывать более широко реагирующие или более универсальные ответы для распознавания большего числа циркулирующих вариантов гриппа внутри и между подтипами в любой сезон и в течение нескольких сезонов [1, 2].
Чтобы удовлетворить потребность в вакцинах против гриппа с более широкой реакцией, наша группа ранее сообщала о методологии конструирования антигена, называемой оптимизированным с помощью вычислений широко реактивным антигеном (COBRA), с использованием нескольких раундов построения многослойного консенсуса для создания иммуногенов HA вакцины против гриппа [14– 21].Антигены COBRA HA способны вызывать сильные, широко реактивные HA-специфические ответы антител, которые защищают как от отобранных вакцинами, так и от дрейфующих вариантов штаммов гриппа. В этом отчете живые вирусы, экспрессирующие антигены COBRA HA, были использованы для создания вакцин на основе инактивированного сплит-вируса (IIV). В отличие от предыдущих исследований на мышах с использованием вакцин IIV или вирусоподобных частиц (VLP) [22], вакцины IIV, использованные в этом исследовании, вызвали снижение титров антител с ограниченной широтой активности ингибирования гемагглютинизации (HAI) против панелей h2N1 или h4N2. вирусы гриппа у хорьков, иммунологически невосприимчивых к гриппу.Тем не менее, эти вакцинированные IIV хорьки были защищены от заражения гриппом и демонстрировали быстрое снижение выделения вируса из слизистой оболочки носа после заражения.
Материалы и методы
Вакцинация и вакцинация
хорьков Fitch ( Mustela putorius furo , самка, от 6 до 12 месяцев), отрицательных по антителам к циркулирующим вирусам гриппа A (h2N1, h4N2) и гриппа B, были получены и приобретены в Triple F Farms (Сайр, Пенсильвания). .Пара хорьков содержалась в клетках из нержавеющей стали (Shor-line, Kansas City, KS), содержащих подстилки для лабораторных животных Sani-Chips (P.J. Murphy Forest Products, Montville, NJ). Хорькам давали Teklad Global Ferret Diet (Харлан Теклад, Мэдисон, Висконсин) и пресную воду ad libitum . Хорьков ( n = 8) вакцинировали инактивированными сплит-вакцинами IIV, экспрессирующими одну из двух вакцин h4N2 COBRA IIV (T7, T11), одну из 4 вакцин IIV дикого типа (HK / 2014, Switz / 2013, TX / 2012). , Uru / 2007, Wisc / 2005), одной из 3 h2N1 COBRA (X3, X6 или P1) или вакцины CA / 2009 IIV дикого типа.Вакцину с расщепленным вирионом инактивировали 0,1% бета-пропиолактоном (BPL) в течение 24 часов при 18-22 ° C и 1% Triton X-100 в присутствии 500 мг / л Tween 80, который перемешивали в течение 1 часа при 20 ° C [23]. Вакцины содержали 15 мкг антигена гемагглютинина, приготовленного с эмульгированным адъювантом сквален-в-воде AF03 (Sanofi Pasteur, Лион, Франция) в конечной смеси 1: 1 с IIV (таблица 1). Хорькам сделали повторную вакцинацию через 28 дней после первоначальной вакцинации. Кровь собирали у всех анестезированных хорьков через переднюю полую вену до вакцинации, а также на 28 и 56 дни после первоначальной вакцинации.Сыворотку переносили в центрифужную пробирку и центрифугировали при 6000 об / мин. Осветленную сыворотку удаляли и замораживали при -20 ± 5 ° C. Хорьки, вакцинированные плацебо, состояли из фосфатно-солевого буфера (PBS), pH 7,4, приготовленного в смеси 1: 1 с AF03 [15, 16, 21]. Все вакцины и плацебо хранили в холодильнике при температуре от 2 ° C до 8 ° C до использования.
Вирусы и антигены НА
вирусов h2N1 и h4N2 были получены либо через Ресурсы реагентов гриппа (IRR), BEI Resources, Центры по контролю за заболеваниями (CDC), либо предоставлены Virapur, LLC (Сан-Диего, Калифорния, США).Вирусы пассировали один раз в тех же условиях роста, в которых они были получены, либо в куриных яйцах с эмбрионами, либо в полуконфлюэнтной культуре клеток Madin-Darby Canine Kidney (MDCK) в соответствии с инструкциями, предоставленными ВОЗ [13]. Партии вирусов титровали как с эритроцитами морской свинки, так и с эритроцитами индейки, и делали аликвоты для одноразового применения. Панель вакцины против h4N2 включает следующие штаммы после пассирования яиц: A / Nanchang / 933/1995 (Nan / 95), A / Sydney / 05/1997 (Syd / 97), A / Panama / 2007/1999 (Pan / 99), A / Fujian / 411/2002 (Fuj / 02), A / New York / 55/2004 (NY / 04), A / Wisonsin / 67/2005 (Wis / 05), A / Brisbane / 10/2007 (Bris / 07), A / Perth / 16/2009 (Per / 09), A / Victoria / 361/2011 (Vic / 11), A / Texas / 50/2012 (TX / 12), A / Switzerland / 9715293/2013 ( Sz / 13), A / Hong Kong / 4801/2014 (HK / 14) и A / Singapore / IFNIMH-16-0019 / 2016 (Sing / 16).
Панель из 13 совместно циркулирующих повторно пассированных клеток MDCK (7: 1) вариантов h4N2 за период 2010–2016 гг. Включала: A / Alabma / 05/2010 (AL / 10), A / Netherlands / 009/2010 (NL / 10), A / Hessen / 5/2010 (Hes / 10), A / Norway / 1330/2010 (Nor / 10), A / Madagascar / 0648/2011 (Mad / 11), A / Utah / 12/2011 (Юта / 11), A / Norway / 1186/2011 (Nor / 11), A / Athens / 112/2012 (Ath / 12), A / Jordan / 30502/2012 (Jor / 12), A / Minnesota / 10 / 2012 (MN / 12), A / Denmark / 96/2013 (Den / 13), A / Hong Kong / 12/2014 (HK / 12/14), A / Stockholm / 28/2016 (Stock / 16).Реассортантные вирусы были созданы с использованием системы обратной генетики из восьми плазмид, как описано ранее [24, 25].
Было использовано
вирусов h2N1, пассированных из яиц: A / Chile / 1/1983 (Chile / 83), A / Singapore / 6/1986 (Sing / 86), A / Texas / 36/1991 (TX / 91), A / Beijing / 262/1995 (Bei / 95), A / New Caledonia / 20/1999 (NC / 99) A / Solomon Islands / 3/2006 (SI / 06), A / Brisbane / 59/2007 (Bris / 07), A / California / 07/2009 (CA / 09), A / Michigan / 45/2015 (Mich / 15). Панель из 9 человек включала вирусные антигены, представляющие вирусы человека с 1983 по 2015 годы.Вирусы, спасенные НА P1, X6 и X3 (7: 1) (коровые белки PR8 и NA из CA / 09), были обнаружены с помощью анализа гемагглютинации и были полностью секвенированы, чтобы гарантировать отсутствие нежелательных мутаций.
Вирусные заражения предварительно иммунизированных хорьков
На 56-й день после вакцинации хорькам интраназально вводили 5 × 10 4 БОЕ CA / 09 (h2N1) или 1 × 10 7 БОЕ вируса Wisc / 05 (h4N2) в объеме 1 мл. Ежедневно наблюдали за хорьками на предмет потери веса, признаков болезни и смерти в течение 14 дней после заражения.Индивидуальный вес тела и смерть регистрировали для каждой группы каждый день после заражения вирусом. Экспериментальные конечные точки были определены как потеря веса> 20%. Промывание носа проводили путем закапывания 3 мл PBS в ноздри анестезированных хорьков каждый день в течение 14 дней после инокуляции. Промывки собирали и хранили при -80 ° C до использования. Комитет по институциональному уходу и использованию животных Университета Джорджии одобрил все эксперименты в соответствии с Протоколом об использовании животных № 2016 02–011, которые проводились в соответствии с Руководством Национального исследовательского совета по уходу и использованию лабораторных животных , Закон о благополучии животных. и руководство CDC / NIH по биобезопасности в микробиологических и биомедицинских лабораториях .
Анализ ингибирования гемагглютинации
Анализ ингибирования гемагглютинации использовали для оценки функциональных антител, вызванных вакцинами против h4N2, к HA, способным ингибировать агглютинацию эритроцитов морской свинки и индейки. Протоколы были адаптированы из руководства ВОЗ по лабораторному эпиднадзору за гриппом [13], и в них используется вид-хозяин, морская свинка, который часто используется для характеристики современных штаммов h4N2 из-за их преимущественного связывания с альфа (2,6) связанными рецепторами сиаловой кислоты [ 26, 27].Мы также сравнили результаты HAI с эритроцитами индейки, чтобы сравнить, существует ли разница в ответе HAI в зависимости от используемых эритроцитов. Для инактивации неспецифических ингибиторов сыворотки перед тестированием обрабатывали разрушающим рецептор ферментом (RDE) (Denka Seiken, Co., Япония). Вкратце, три части RDE добавляли к одной части сыворотки и инкубировали в течение ночи при 37 ° C. RDE инактивировали инкубацией при 56 ° C в течение ~ 30 мин. Сыворотки, обработанные RDE, доводили до конечной смеси 1:10 в физиологическом растворе и разводили серией двукратных серийных разведений в 96-луночных микротитровальных планшетах с v-образным дном.В каждую лунку добавляли равный объем каждого вируса h4N2, доведенный до приблизительно 8 единиц гемагглютинации (HAU) / 50 мкл в присутствии 20 нМ осельтамивира. Планшеты накрывали и инкубировали при комнатной температуре в течение 30 мин, а затем добавляли 0,75% эритроцитов морских свинок (Lampire Biologicals, Pipersville, PA, USA) в PBS. Эритроциты хранили при 4 ° C и использовали в течение 24 часов после приготовления. Чашки перемешивали встряхиванием и накрывали, а эритроцитам давали возможность осесть в течение 1 ч при комнатной температуре.Титр HAI определяли путем обратного разведения последней лунки, содержащей неагглютинированные эритроциты. Положительный и отрицательный сывороточные контроли были включены в каждую чашку. Все хорьки были отрицательными (HAI ≤ 1:10) на ранее существовавшие антитела к циркулирующим в настоящее время вирусам гриппа человека до вакцинации, а серопротекция определялась как титр HAI> 1:40, а сероконверсия — как 4-кратное увеличение титра по сравнению с исходным уровнем. в соответствии с рекомендациями ВОЗ и Европейского комитета по лекарственным средствам для оценки противогриппозных вакцин [28]; однако мы часто проверяли более строгий порог> 1:80.Хорьки были наивными и серонегативными к гриппу во время вакцинации, поэтому уровни сероконверсии и серопротекции в этом исследовании взаимозаменяемы. Для вакцин против h2N1 процедура была модифицирована таким образом, что сыворотку и вирус инкубировали при комнатной температуре в течение 20 минут, а затем добавляли 0,8% эритроцитов индейки (Lampire Biologicals, Pipersville, PA) в PBS. Эритроциты хранили при 4 ° C и использовали в течение 72 часов после приготовления. Остальная часть процедуры не была изменена.
Анализ зубного налета
клеток MDCK и MDCK-SIAT1 поддерживали в среде Игла, модифицированной Дульбекко (DMEM), с добавлением пенициллин-стрептомицина, фракции V 7 бычьего сывороточного альбумина.5% раствор, 25 мМ буфер HEPES и 10% инактивированная нагреванием фетальная бычья сыворотка (FBS, Atlanta Biologicals , GA, USA). Все добавки, кроме FBS, были приобретены у Thermo Fisher Scientific . Для определения титра вируса был проведен анализ бляшек аналогично ранее описанным протоколам [16]. Клетки MDCK высевали в количестве (5 × 10 5 ) в каждую лунку шестилуночного планшета. Образцы разбавляли (факторы конечного разведения от 10 0 до 10 -6 ) и накладывали на клетки в 100 мкл DMEM с добавлением пенициллина-стрептомицина и инкубировали в течение 1 ч с периодическим встряхиванием каждые 15 минут.Образцы удаляли, клетки дважды промывали и среду заменяли 2 мл среды L15 плюс 0,8% агарозы (Cambrex, East Rutherford, NJ, USA) и инкубировали в течение 72 часов при 37 ° C с 5% CO2. Затем агарозу удаляли и утилизировали. Клетки фиксировали 10% забуференным формалином, а затем окрашивали 1% кристаллическим фиолетовым в течение 15 мин. Затем планшеты тщательно промывали в дистиллированной воде (dH 2 O) для удаления избытка кристаллического фиолетового перед сушкой на воздухе. Затем подсчитывали количество бляшек и рассчитывали БОЕ на миллилитр для каждого вируса.
Статистический анализ
Различия в потере веса, показателях заболеваемости и титрах вирусов анализировали с помощью двухфакторного дисперсионного анализа с последующим пост-тестом Бонферрони для каждой группы вакцины в нескольких временных точках. Статистическая значимость была определена как p — значение 0,05. Статистический анализ проводился с использованием программного обеспечения GraphPad Prism.
Результаты
Вакцинация иммунологически наивных хорьков сплит-инактивированным вирусом COBRA HA
хорьков (n = 8 / группа) вакцинировали вакцинами с расщепленным инактивированным вирусом (IIV), содержащими COBRA или белки НА дикого типа, представляющие подтип h4.Предыдущие исследования описывали методологию COBRA с использованием 6340 аминокислотных последовательностей HA человека для разработки последовательностей HA h4 для учета эволюции вирусов гриппа h4N2, выделенных у людей за последние 45 лет [16, 21]. Два из этих кандидатов, идентифицированные как T7 IIV и T11 IIV, использовались в качестве вакцинных антигенов у наивных хорьков и сравнивались с хорьками, вакцинированными вакцинами IIV, содержащими антигены НА дикого типа, выделенные из пяти современных вакцинных штаммов (Wisc / 05, Uru / 07, TX / 12, Sz / 13, HK / 14) (рис.1).Как описано ранее [21], антиген T7 COBRA HA был разработан с использованием входных последовательностей HA из вирусов h4N2, выделенных между 2002–2010 гг., А последовательность HA T11 COBRA была разработана с использованием входных последовательностей HA из вирусов h4N2, выделенных между 2011–2013 гг. Антисыворотки, собранные от хорьков, вакцинированных T7 IIV, обладали активностью HAI против 3 из 12 вирусов h4N2 в панели (фиг. 2A). T7 IIV вызывал антитела с титром HAI 1:40 у 50% или более хорьков против NY / 04, Wisc / 05 и Uru / 07 (таблица 2).Хорьки, вакцинированные T11 IIV, имели антисыворотку с активностью HAI против четырех (Perth / 09, Vic / 11, TX / 12 и HK / 14) из 12 вирусов в панели (фиг. 2B и таблица 2). Хорьки, вакцинированные одной из пяти вакцин HA IIV дикого типа, обычно имели наивысшую активность HAI против его гомологичного вируса, –. и . Wisc / 05 вызывал антитела с наивысшими титрами HAI против Wisc / 05. Вакцина Wisc / 05 IIV вырабатывала антитела со средним титром HAI выше 1:40 только против 1 вируса, вируса Wisc / 05 (рис. 2C).Вакцина Uru / 07 IIV вырабатывала антитела со средним титром HAI 1:40 против 5 штаммов в панели (фиг. 2D), причем все 8 хорьков обладали активностью HAI против Wisc / 05 и Uru / 07 (таблица 2). Хорьки, вакцинированные TX / 12 IIV, обладали активностью HAI против 7 из 12 штаммов (фиг. 2E). Хорьки, вакцинированные Sz / 13, не проявляли активности HAI против любого из вирусов при титре 1:40, но распознавали гомологичный штамм Sz / 13 с более высоким средним титром, чем любой другой штамм в группе. Хорьки, вакцинированные HK / 14, имели антитела только против одного вируса, гомологичного HK / 14, с титром 1:40 (фиг. 2F и 2G).
Рис. 1. Схема вакцинации IIV наивных хорьков.
Хорьков (n = 8) вакцинировали вакциной IIV в день 0 и снова на день 28. Кровь собирали до начальной инфекции, а также на 28 и 56 дни после вакцинации . На 56 день хорькам вводили вирус A / California / 07/2009 (h2N1) (5×10 4 PFU) или вирус A / Wisconsin / 67/2005 (h4N2) (1×10 7 PFU) и проводили мониторинг заболеваемость и смертность в течение 14 дней после заражения.Смывы из носа собирали в дни 0, 1, 3, 5 и 7 для оценки титров вирусов.
https://doi.org/10.1371/journal.pone.0204284.g001
Рис. 2. Титры сывороточных антител к ингибированию гемагглютинации, индуцированные вакцинацией хорьков вакцинами h4N2 IIV, экспрессирующими антигены НА COBRA или белки НА из вирусов дикого типа.
Титры
HAI определяли для каждой группы иммунологически наивных хорьков (n = 8), дважды вакцинированных (дни 0 и 28) одной из двух вакцин COBRA h4N2 IIV (T7 или T11) или вакцин h4N2 VLP, экспрессирующих НА дикого типа. белки из Wisc / 05, Uru / 07, TX / 12, Sz / 13, HK / 14 против панели из 13 вирусов гриппа h4N2.Значения представляют собой титры HAI отдельных животных от антисывороток, собранных на 56-й день. Две пунктирные линии показывают диапазон титров HAI 1: 40–1: 80. (А) Т6 IIV; (B) T11 IIV; (C) Wisc / 05 IIV; (D) Uru / 07 IIV; (E) TX / 12 IIV; (F) Sz / 13 IIV; (G) HK / 14 IIV; (H) Насмешка.
https://doi.org/10.1371/journal.pone.0204284.g002
Активность HAI против совместно циркулирующих вирусов дрейфового варианта
Чтобы продемонстрировать широту активности антител против совместно циркулирующих штаммов h4N2 influezna в период с 2010 по 2016 год, активность HAI оценивали по собранным антисывороткам после вакцинации.Последовательности гемагглютинина человека h4 были идентифицированы как представляющие различные филогенетические кластеры h4N2 гриппа, и тринадцать репрезентативных дрейфующих вирусов были использованы в панели для оценки широты активности HAI, вызванной вакцинами IIV, как описано ранее [21]. Хорьки, вакцинированные вакцинами IIV, экспрессирующими белок HA из HK / 14, Sz / 13 или Wisc / 05, имели активность HAI против 3-4 вирусов из 13 вирусов h4N2 в панели, что было аналогично активности HAI у вакцинированных хорьков. с COBRA T7 (Таблица 3).Хорьки, вакцинированные вакцинами Uru / 07 IIV, имели антитела с активностью HAI против 7 из 13 штаммов, а антисыворотки от хорьков, вакцинированных вакциной TX / 12 IIV, имели активность HAI против всех 13 штаммов (таблица 3). Хорьки, вакцинированные вакциной T11 COBRA HA IIV, имели антисыворотку с активностью HAI против всех штаммов в панели, кроме одного, Stock / 16. Титры HAI, вызванные TX / 12 IIV у наивных хорьков, были в 4-8 раз выше, чем титры HAI, вызванные вакциной T11 COBRA IIV. Однако T11 COBRA IIV вызывал титры HAI, которые были в 4–32 раза выше по сравнению с панелью дрейфующих вирусов h4N2, чем любые другие вакцины HA IIV дикого типа (таблица 3).
Вакцинация хорьков вакцинами IIV, экспрессирующими антигены HA h2
Чтобы расширить эти наблюдения, хорьков вакцинировали вакцинами IIV, экспрессирующими антигены HA h2, одной вакциной IIV, экспрессируемой как HA из вируса гриппа дикого типа (CA / 09), и тремя вакцинами IIV, экспрессируемыми как антигены HA h2 COBRA (P1, X3, или X6) (рис. 3). Эти три вакцины-кандидаты COBRA HA были разработаны на основе последовательностей вирусов h2N1 дикого типа за последние 100 лет, включая современные пандемические изоляты h2N1.Предыдущие исследования (Carter et al., 2016, JVI) продемонстрировали, что эти три белка h2 COBRA HA обладают самой широкой ингибирующей активностью гемагглютинации против панели из 17 вирусов h2N1 [22]. Хорьки (n = 8 / группа), вакцинированные CA / 09 IIV, вырабатывали антитела с высоким титром с активностью HAI против (средний титр 1: 320) гомологичного вируса CA / 09 (фиг. 3A). Около половины хорьков, вакцинированных вакциной P1 COBRA IIV, имели сероконверсию и имели антисыворотку с активностью HAI против ее гомологичных антигенов, но не проявляли активности HAI против любого из других вирусов h2N1 в панели (рис. 3B).Хорьки, вакцинированные вакциной X3 IIV, проявляли активность HAI против Sing / 86 и TX / 91 (рис. 3C), а хорьки, вакцинированные X6 IIV, имели активность HAI против гомологичного вируса X6, а также вируса NC / 99 с низкими титрами HAI против Bris / 07 (Рис. 3D). Сходные результаты наблюдались у наивных хорьков, вакцинированных вирусоподобными частицами (VLP), экспрессирующими тот же антиген дикого типа и антиген COBRA HA (15).
Рис. 3. Титры сывороточных антител ингибирования гемагглютинации, индуцированные вакцинацией хорьков вакциной h2N1 IIV, экспрессирующей антигены COBRA HA или белки HA из вирусов дикого типа.
Титры HAI определяли для каждой группы иммунологически наивных хорьков (n = 8), дважды вакцинированных (дни 0 и 28) одной из трех вакцин COBRA h2N1 IIV (P1, X3 или X6) или вакцины h2N1 IIV, экспрессирующих белки типа НА из CA / 09 против панели из 8 вирусов гриппа h2N1. Значения представляют собой титры HAI отдельных животных от антисывороток, собранных на 56-й день. Две пунктирные линии показывают диапазон титров HAI 1: 40–1: 80. (А) CA / 09 IIV; (B) P1 IIV; (C) X3 IIV; (D) X6 IIV.
https: // doi.org / 10.1371 / journal.pone.0204284.g003
Вакцинированные хорьки заражены вирусами гриппа
Чтобы определить, защищают ли эти вакцины IIV от вирусного заражения, независимо от титров HAI в вызванной антисыворотке, хорьков заражали вирусами гриппа h2 или h4 (фиг. 4). Хорьков, вакцинированных вакцинами h4 IIV, заражали Wisc / 05 (1 × 10 7 БОЕ / мл) на 8 неделе после вакцинации. Все хорьки потеряли менее 5% веса независимо от того, вакцинированы они или нет (рис. 4A и 4B).Низкие титры вируса (1 × 10 3 БОЕ / мл) были извлечены из носовых смывов от имитационно вакцинированных хорьков, инфицированных вирусом h4N2, и вирус не был обнаружен в носовых смывах от вакцинированных хорьков. Хорьков, вакцинированных вакцинами h2 IIV, заражали вирусом CA / 09 (5 × 10 4 БОЕ / мл). Невакцинированные хорьки (имитаторы) быстро теряли в весе, теряя 15–20% своей массы тела к 7 дню после инфицирования (рис. 4C). У этих хорьков наблюдались признаки заболеваемости, включая летаргию, чихание и выделения из носа, как ранее описывалось для новой инфекции h2N1 [29].Напротив, хорьки, вакцинированные гомологичными вакцинами CA / 09 IIV или P1 IIV, потеряли менее 5–6% своей первоначальной массы тела за 10 дней наблюдения. Хорьки, вакцинированные X6 IIV, потеряли ~ 10% своей первоначальной массы тела на 6 день после инфицирования, а хорьки, вакцинированные X3 IIV, потеряли ~ 15%. Все хорьки, вакцинированные X6 и X3 IIV, сохраняли этот вес в течение 2-3 дней, а затем начали восстанавливаться (рис. 4C).
Рис. 4. Заражение вакцинированных хорьков вирусами гриппа.
Вакцинированные или невакцинированные хорьки были инфицированы вирусами гриппа A / Wisconsin / 67/2005 (A и B) или A / California / 07/2009 (C). (A-C) Хорьков ежедневно наблюдали на предмет потери веса в течение 8-дневного периода наблюдения. Значения представляют собой средние проценты от исходного веса плюс SEM (планки погрешностей). (D) Титры вирусов определяли из носовых смывов, инфицированных A / California / 07/2009, и собирали на 1, 3 и 5 дни после заражения. Каждый хорек обозначен символом. Линии указывают средние титры вирусов со стандартными отклонениями (SD).Значения CA / 09, P1 и X6 все значимы (p> 0,01) по сравнению со значениями в каждый момент времени для X3 и Mock. CA / 09 был значимым по сравнению с P1 и X6 на 3-й день после инфицирования (p> 0,05). Достоверность определялась с использованием парных или непарных t-критериев (* p> 0 , 05; ** p> 0 , 01 ).
https://doi.org/10.1371/journal.pone.0204284.g004
Наивные животные имели высокие титры вируса для промывания носа на 1–5 дни после инфицирования (~ 2 × 10 5 БОЕ / мл) (Рис. 4D ).Кроме того, у хорьков, вакцинированных X3 IIV, также наблюдался устойчивый вирусный титр смыва из носа между 1–5 днями после инфицирования. Напротив, хорьки, вакцинированные CA / 09 IIV, P1 COBRA IIV или X6 COBRA IIV, имели пиковый титр вируса для промывания носа в день 1 (~ 1 × 10 4 БОЕ / мл), который быстро снижался до низких или неопределяемых уровней. к 5 дню постинфекции (рис. 4D).
Обсуждение
В этом исследовании реассортантные вирусы, экспрессирующие антигены HA h2 и h4 COBRA, были созданы путем объединения желаемого сегмента HA с 7 сегментами вируса A / Puerto Rico / 8/1934.Эти вирусы впоследствии были амплифицированы и использованы для создания инактивированных сплит-вакцин против гриппа (IIV). Первой целью было оценить эти вакцины IIV у наивных хорьков на предмет выявления антител. Ранее эти антигены COBRA HA доставлялись в иммунную систему мышей на поверхности вакцины с вирусоподобными частицами, которые вырабатывали антитела с высоким титром против группы исторических штаммов гриппа A [16, 21]. Мы предположили, что доставка тех же антигенов, что и вакцина IIV, вызовет аналогичные ответы антител у хорьков и защитит этих животных от заражения вирусом гриппа.
Два антигена COBRA HA h4 и три h2 были разработаны для охвата нескольких периодов времени и антигенных пространств в зависимости от даты их выделения, как описано ранее [16, 21]. Их филогенетическое родство с последовательностями НА дикого типа связано с эпохой их входных последовательностей и сходно со штаммами вакцин той эпохи (рис. 5 и 6). Две вакцины h4 COBRA HA представляли собой различные входные последовательности из вирусов, выделенных в период с 2002 по 2013 год. Три антигена h2 COBRA, включая X3 COBRA HA, были разработаны с использованием последовательностей из сезонных вирусов h2, выделенных за 30-летний период (с 1978 по 2008 год) X6 COBRA HA был основан на последовательностях, представляющих 10 лет до пандемии 2009 г. и 4 года после пандемии (с 2009 по 2012 г.).Последовательность P1 COBRA HA охватывает антигенное пространство h2 вирусов, выделенных с 1933 по 1957 и с 2009 по 2011 годы, а также последовательности свиней, выделенных с 1931 по 1998 год [16].
Рис. 5. Филогенетическое дерево последовательностей h2 HA.
Неукорененное филогенетическое дерево было выведено из аминокислотных последовательностей HA, полученных из 11 изолятов HA h2 и COBRA HA с использованием метода максимального правдоподобия. Последовательности выравнивали с помощью программного обеспечения MUSCLE 3.7, а выравнивание уточняли с помощью программного обеспечения Gblocks 0.91b.Филогению определяли с использованием метода максимального правдоподобия с программным обеспечением PhyML. Для рендеринга деревьев использовалась программа TreeDyn 198.3 [32].
https://doi.org/10.1371/journal.pone.0204284.g005
Рис. 6. Филогенетическое дерево последовательностей HA h4.
Неукорененное филогенетическое дерево было выведено из аминокислотных последовательностей HA, полученных из 30 последовательностей HA h4 и COBRA HA, с использованием метода максимального правдоподобия. Последовательности выравнивали с помощью программного обеспечения MUSCLE 3.7, а выравнивание уточняли с помощью Gblocks 0.91b программное обеспечение. Филогению определяли с использованием метода максимального правдоподобия с программным обеспечением PhyML. Для рендеринга деревьев использовалась программа TreeDyn 198.3 [32].
https://doi.org/10.1371/journal.pone.0204284.g006
Вакцина T7 COBRA IIV с середины 2000-х годов была более эффективна в выявлении антител с активностью HAI против вирусов h4N2, а вакцина T11 COBRA IIV была более эффективной. эффективен при выработке антител с активностью HAI против вирусов h4N2 с конца 2000-х по 2016 год.Эти результаты были аналогичны результатам, полученным от мышей, вакцинированных VLP, экспрессирующими те же самые антигены HA h4 COBRA [21]. Хорьки, вакцинированные вакцинами IIV, экспрессирующими либо антигены НА Uru / 07, либо TX / 12, были наиболее эффективны при выработке антител с активностью HAI против наибольшего количества вирусов h4N2 в панели (6–8 вирусов) по сравнению с вакцинами IIV с Sz / 13 или HK / 14 HA белков. Как сообщалось ранее [21], антигены Uru / 07 и, в частности, НА TX / 12 более тесно связаны с различными совместно циркулирующими дрейфовыми вариантными вирусами, чем другие вирусы h4N2.Сходные результаты наблюдались у хорьков при использовании вакцин h2 IIV, которые вырабатывали антитела, которые имели аналогичный образец распознавания по сравнению с антителами, вызванными вакцинами h2 COBRA VLP у мышей [16]. Вакцины как h2, так и h4 IIV вызвали самые высокие титры против гомологичного вируса. В целом, эти вакцины были эффективны при выработке антител с размахом HAI; однако, в отличие от мышей, не у всех хорьков произошла сероконверсия к негомологичным вирусам в панели. Таким образом, средний титр HAI против конкретного вируса в целом в этом исследовании был ниже, чем у мышей, вакцинированных вакцинами COBRA HA VLP [16, 21].
Чтобы решить, является ли более низкий титр, хотя и сниженное распознавание вирусов в панели антителами, вызванными вакциной, результатом экспрессии антигенов COBRA HA в составе IIV, наивные хорьки также вакцинировали вакцинами VLP. Хорьки, вакцинированные VLP, имели статистически схожие титры HAI против той же группы вирусов h2 и h4, что и антитела, вырабатываемые у хорьков, вакцинированных версиями этих же вакцин IIV. В отличие от мышей BALB / c, хорьки являются беспородными животными, и это, возможно, способствовало непостоянным темпам сероконверсии и распространению титров HAI в группе хорьков, вакцинированных одной и той же вакциной.Недавно наша группа продемонстрировала, что примирование наивных хорьков исторически сложившимися сезонными вирусами гриппа, а затем вакцинация этих примированных хорьков широко реактивными вакцинами VLP на основе h2 или h4 COBRA HA усиливали уже существующие антитела, вызванные вирусными инфекциями гриппа дикого типа. Эти антигены COBRA HA индуцировали антитела с активностью HAI против множества антигенно различных вирусных вариантов h2N1 и h4N2 [15, 30]. Следовательно, версии этих вакцин IIV могут одинаково хорошо работать у иммунологически примированных хорьков, как и вакцины VLP.В большинстве доклинических исследований для тестирования новых противогриппозных вакцин и адъювантных препаратов используются иммунологически наивные животные. Однако большинство людей не являются иммунологически наивными по отношению к вирусу гриппа и имеют уже существующие антитела, вызванные прошлыми вакцинациями и инфекциями (14). Недавно Национальный институт аллергии и инфекционных заболеваний (NIAID) объявил одним из своих высших приоритетов разработку универсальной вакцины против гриппа, которая обеспечит длительную защиту от множества штаммов вируса гриппа [31].Три основных направления разработки этих широко реактивных / универсальных противогриппозных вакцин сосредоточены на 1) исследованиях передачи, естественного анамнеза и патогенеза с использованием проспективных когорт, 2) иммунитете против гриппа и коррелятов иммунной защиты, и 3) стратегиях рационального дизайна вакцины. вызвать широкие защитные иммунные ответы. Мы предполагаем, что использование только иммунологически наивных животных, особенно хорьков, для оценки новых вакцин-кандидатов, адъювантов и схем лечения, может неточно оценить эффективность этих вакцин.И ученые, и разработчики вакцин должны использовать как наивные, так и доиммунные модели животных, чтобы оценить общую эффективность этих новых вакцин-кандидатов. Результаты этого исследования показывают, что для выполнения стратегического плана NIAID по разработке этого нового поколения противогриппозных вакцин необходимо будет использовать несколько моделей in vitro и in vivo для оценки вакцинных составов и понижающего отбора кандидатов до тех. с наиболее вероятными шансами на успех в клинических испытаниях на людях.
Благодарности
Мы благодарим Грега А. Кирхенбаума, Торстена Фогеля и Гарри Клинтоса за критические комментарии и полезные обсуждения. Мы благодарим Аманду Скарлупку, Хесун (Санни) Янг, Гуадалупе Кортес-Гарсия, Фернандо Диас, Арнел Сикам и Бенджамин Парк за техническую помощь. Вирусы h4N2 гриппа A были получены через Ресурс реагентов для гриппа, Отделение гриппа, Сотрудничающий центр ВОЗ по надзору, эпидемиологии и борьбе с гриппом, Центры по контролю и профилактике заболеваний, Атланта, Джорджия, США.
Ссылки
- 1.
Monto AS. Охват сезонным гриппом и вакцинацией. Вакцина. 2010; 28 Приложение 4: D33–44. pmid: 20713259. - 2.
Элбеди А.Х., Уэбби Р.Дж. Вакцины против гриппа. Вакцина. 2009; 27 Приложение 4: D65–8. pmid: 19837290; Идентификатор PubMed Central PMCID: PMCPMC24.
- 3.
Geeraedts F, Goutagny N, Hornung V, Severa M, de Haan A, Pool J и др. Превосходная иммуногенность вакцины против гриппа с инактивированным цельным вирусом H5N1 в первую очередь контролируется сигнализацией Toll-подобного рецептора.PLoS Pathog. 2008; 4 (8): e1000138. pmid: 18769719; Идентификатор PubMed Central PMCID: PMCPMC2516931. - 4.
Geeraedts F, Bungener L, Pool J, ter Veer W, Wilschut J, Huckriede A. Вакцина против гриппа с цельным инактивированным вирусом превосходит субъединичную вакцину в индукции иммунных ответов и секреции провоспалительных цитокинов DC. Другие вирусы гриппа респира. 2008. 2 (2): 41–51. pmid: 19453471; Идентификатор PubMed Central PMCID: PMCPMC4941893. - 5.
Ву Дж, Лю С.З., Донг С.С., Донг ХР, Чжан В.Л., Лу М. и др.Безопасность и иммуногенность адъювантных инактивированных вакцин с расщепленным вирионом и цельновирионным гриппом A (H5N1) у детей: рандомизированное исследование фазы I-II. Вакцина. 2010. 28 (38): 6221–7. pmid: 20638454. - 6.
Макэлхейни Дж. Э., Менейи Г. С., Лечелт К. Э., Бликли Р. К.. Вакцины против сплит-вируса гриппа: обеспечивают ли они адекватный иммунитет у пожилых людей? J Gerontol. 1994; 49 (2): M37–43. pmid: 8126350. - 7.
Versluis DJ, Beyer WE, Masurel N, Diderich PP, Kramer P, Weimar W.Интактный гуморальный иммунный ответ у пациентов, находящихся на постоянном амбулаторном перитонеальном диализе. Нефрон. 1988. 49 (1): 16–9. pmid: 3380215. - 8.
Эннис Ф.А., Майнер Р.Э., Барри Д.В., Манишевиц Дж.Э., Данлап Р.С., Вербониц М.В. и др. Корреляция лабораторных исследований с клиническими ответами на вакцины против гриппа A / Нью-Джерси. J Infect Dis. 1977; 136 Приложение: S397–406. pmid: 606763. - 9.
Давенпорт FM, Хеннесси А.В., Брэндон FM, Вебстер Р.Г., Барретт К.Д. мл., Аренда GO. Сравнение серологических и фебрильных реакций людей на вакцинацию вирусами гриппа А или их гемагглютининами.J Lab Clin Med. 1964; 63: 5–13. pmid: 14102904. - 10.
Лина Б., Флетчер М.А., Валетт М., Салиу П., Эймард М. Вакцина против гриппа с расщепленным вирионом TritonX-100 безопасна и соответствует рекомендациям Комитета по патентованным лекарственным средствам (CPMP) Европейского сообщества по иммуногенности у детей, взрослых и детей. старший. Биологические препараты. 2000. 28 (2): 95–103. pmid: 10885616. - 11.
Lupulescu E, Ionita E, Botez D, Matepciuc M, Tabra ME, Tecu C и др. [Исследование иммуногенности и реактогенности очищенной инактивированной трехвалентной вакцины против гриппа для парентерального введения, подготовленной для сезона 1996–1997 гг.].Bacteriol Virusol Parazitol Epidemiol. 1997. 42 (1–2): 110–2. pmid: 9235136. - 12.
Барберис I, Майлс П., Олт С.К., Брагацци Н.Л., Мартини М. История и эволюция борьбы с гриппом с помощью вакцинации: от первой моновалентной вакцины до универсальных вакцин. J Prev Med Hyg. 2016; 57 (3): E115 – E20. pmid: 27980374; Идентификатор PubMed Central PMCID: PMCPMC5139605. - 13.
Организация WH, Сеть WGIS. Руководство по лабораторной диагностике и вирусологическому надзору за гриппом: Всемирная организация здравоохранения; 2011 г. - 14.
Аллен Дж. Д., Овино С. О., Картер Д. М., Кварар С. Дж., Риз В. А., Фокс С. Б. и др. Повышенный иммунитет и защитные реакции с вакцинами H5 COBRA-VLP с эмульсионным адъювантом. Вакцина. 2017; 35 (38): 5209–16. pmid: 28789850. - 15.
Картер Д.М., Дарби К.А., Джонсон С.К., Карлок М.А., Кирхенбаум Г.А., Аллен Д.Д. и др. Выявление защитных антител против широкого набора вирусов h2N1 у хорьков, обладающих иммунитетом к историческим вирусам гриппа h2N1. J Virol. 2017; 91 (24). pmid: 28978709; Идентификатор PubMed Central PMCID: PMCPMC5709581. - 16.
Картер Д.М., Дарби К.А., Лефоли BC, Кварар С.Дж., Алефантис Т., Оомен Р. и др. Дизайн и характеристика оптимизированной с помощью вычислений широко реактивной гемагглютининовой вакцины против вирусов гриппа h2N1. J Virol. 2016; 90 (9): 4720–34. pmid: 264; Идентификатор PubMed Central PMCID: PMCPMC4836330.
- 17.
Кварар CJ, Картер DM, Ли К.Ю., Росс TM. Коктейль вакцин H5N1 COBRA HA вырабатывает защитные антитела против вирусов H5N1 из нескольких клад. Hum Vaccin Immunother.2015; 11 (3): 572–83. pmid: 25671661; Идентификатор PubMed Central PMCID: PMCPMC4514363. - 18.
Джайлз Б.М., Биссел С.Дж., Деалмейда Д.Р., Вили, Калифорния, Росс TM. Широта антител и защитная эффективность увеличиваются за счет вакцинации гемагглютинином, оптимизированным с точки зрения вычислительной техники, но не вакцинами с поливалентными вирусоподобными частицами H5N1 на основе гемагглютинина. Clin Vaccine Immunol. 2012. 19 (2): 128–39. pmid: 221; Идентификатор PubMed Central PMCID: PMCPMC3272934.
- 19.
Giles BM, Crevar CJ, Carter DM, Bissel SJ, Schultz-Cherry S, Wiley CA, et al.Вакцина из вирусоподобных частиц гемагглютинина, оптимизированная с помощью вычислений, выявляет широко реактивные антитела, которые защищают нечеловеческих приматов от инфекции H5N1. J Infect Dis. 2012. 205 (10): 1562–70. pmid: 22448011; Идентификатор PubMed Central PMCID: PMCPMC3415819. - 20.
Джайлз БМ, Росс ТМ. Оптимизированная с помощью вычислений вакцина H5N1 VLP на основе широко реактивного антигена (COBRA) выявляет широкореактивные антитела у мышей и хорьков. Вакцина. 2011. 29 (16): 3043–54. pmid: 21320540; Идентификатор PubMed Central PMCID: PMCPMC30. - 21.
Wong TM, Allen JD, Bebin-Blackwell AG, Carter DM, Alefantis T., DiNapoli J, et al. Оптимизированный с помощью вычислений широко реактивный гемагглютинин выявляет антитела, ингибирующие гемагглютинацию, против группы вариантов коциркуляции вируса гриппа h4N2. J Virol. 2017; 91 (24): e01581–17. pmid: 28978710; Идентификатор PubMed Central PMCID: PMCPMC5709590. - 22.
Росс TM, Хайронг Л., Чиа Б.С., Хилл Э., Вейрбэк Х., Циммер С. Распространенность антител против сезонных вирусов гриппа A и B во время сезонов гриппа 2009–2010 и 2010–2011 годов у жителей Питтсбурга, штат Пенсильвания, США.PLoS Curr. 2011; 3: РРН1265. pmid: 22037352; Идентификатор PubMed Central PMCID: PMCPMC3201750. - 23.
Kon TC, Onu A, Berbecila L, Lupulescu E, Ghiorgisor A, Kersten GF и др. Производство вакцины против гриппа: эффект инактивации, расщепления и место производства. Сравнение процессов производства вакцины против гриппа. PLoS One. 2016; 11 (3): e0150700. pmid: 26959983; Идентификатор PubMed Central PMCID: PMCPMC4784929. - 24.
Сонг Дж., Фэн Х., Сюй Дж., Чжао Д., Ши Дж., Ли Й и др. Белок PA непосредственно способствует вирулентности вирусов птичьего гриппа H5N1 у домашних уток.J Virol. 2011. 85 (5): 2180–8. pmid: 21177821; Идентификатор PubMed Central PMCID: PMCPMC3067757. - 25.
Ли З, Чен Х, Цзяо П, Дэн Дж, Тиан Дж, Ли Й и др. Молекулярные основы репликации вирусов гриппа H5N1 уток в модели млекопитающих мышей. J Virol. 2005. 79 (18): 12058–64. pmid: 16140781; Идентификатор PubMed Central PMCID: PMCPMC1212590. - 26.
Кац Дж. М., Хэнкок К., Сюй X. Серологические анализы для эпиднадзора за гриппом, диагностики и оценки вакцины. Эксперт Rev Anti Infect Ther. 2011. 9 (6): 669–83.Epub 23.06.2011. pmid: 21692672. - 27.
О, Д.Й., Барр И.Г., Моссе Дж.А., Лори К.Л. Клетки MDCK-SIAT1 демонстрируют улучшенные показатели изоляции недавних вирусов гриппа человека по сравнению с обычными клетками MDCK. Журнал клинической микробиологии. 2008. 46 (7): 2189–94. PubMed PMID: PMC2446904. pmid: 18480230 - 28.
Агентство ЭМ. Руководство по вакцинам против гриппа: Доклинический и клинический модуль [Проект]. В: Используйте редактор CfMPfH. EMA / CHMP / VWP / 457259/2014. Лондон E14 4HB, UK2014. - 29.
Роу Т., Леон А.Дж., Кварар С.Дж., Картер Д.М., Сюй Л., Ран Л. и др. Моделирование реакции хозяина у хорьков во время заражения гриппом A / California / 07/2009. Вирусология. 2010. 401 (2): 257–65. pmid: 20334888; Идентификатор PubMed Central PMCID: PMCPMC2862141. - 30.
Аллен Дж. Д., Росс ТМ. Выявление защитных антител против 20-летних вариантов вируса гриппа, ко-циркулирующих в будущем h4N2, у хорьков, обладающих иммунитетом к историческим вирусам гриппа h4N2. J Virol. 2018; отправлено. - 31.Эрбелдинг Э.Дж., Пост Д., Стемми Э., Робертс П.С., Августин А.Д., Фергюсон С. и др. Универсальная вакцина против гриппа: Стратегический план Национального института аллергии и инфекционных заболеваний. J Infect Dis. 2018. pmid: 29506129.
- 32.
Dereeper A, Guignon V, Blanc G, Audic S, Buffet S, Chevenet F и др. Phylogeny.fr: надежный филогенетический анализ для неспециалистов.


 Исследования, проведенные в Италии, показали, что в группе сплит–вакцин одни обладают достаточно высокой реактогенностью по сравнению с другими.
Исследования, проведенные в Италии, показали, что в группе сплит–вакцин одни обладают достаточно высокой реактогенностью по сравнению с другими.