Тимомегалия– увеличение вилочковой железы — Новости Сургутского района
Тимомегалия (лат. thymus — тимус; megalia — увеличение) — это состояние, при котором отмечается значительное увеличение размеров центрального органа иммунной системы — вилочковой железы, часто встречающееся у детей раннего возраста.
К формированию данного состояния могут приводить как внешние, так и внутренние факторы или их сочетание. Доказана и важная роль неблагоприятных факторов в дородовом периоде (гестозы I и II половины беременности, нефропатии, инфекционные заболевания у матери, воздействие неблагоприятных факторов внешней среды, поздняя беременность).
Проявления тимомегалии. Проявления синдрома увеличения тимуса бывают только при его выраженном и резком увеличении — незначительные стадии увеличения никаких симптомов не дают и могут быть обнаружены только при рентгенологическом или ультразвуковом обследовании. Если же он увеличен сильно, то у каждого ребёнка набор симптомов будет своеобразным, но всё же можно выделить четыре основных формы клинических проявлений этого нарушения: синдром сдавления жизненно важных органов; синдром нарушения иммунитета; лимфопролиферативный и синдром эндокринно-обменных нарушений.
ДАВАЙТЕ РАЗБЕРЁМ ИХ КАЖДЫЙ В ПОДРОБНОСТЯХ.
Итак, при сдавлении тимусом жизненно важных органов могут затрагиваться трахея, блуждающий нерв, верхняя полая вена, сосудистый пучок и вследствие этого будут возникать различного рода проявления. Если сдавилась трахея, могут возникать следующие признаки: одышка, шум при дыхании, особенно в возбуждённом состоянии, храпение, коклюшеподобный кашель, приступы тимусовой астмы, асфиксии или спадение участков лёгких. При сдавливании сосудистого пучка появляются расширенные вены на передней поверхности груди, набухают шейные вены, а шея выглядит отёчной, появляется шум в сосудах шеи.
При раздражении блуждающего нерва и сопутствующей этому недостаточности надпочечников появляется замедление ритма сердца, осиплость голоса, могут быть падения давления (коллапсы), «петушиный» крик, срыгивания или рвота, расстройства стула. У ребёнка возникают также защитные симптомы -сон на животе и резкое запрокидывание головы назад.
Синдром лимфопролиферации -это сопутствующие увеличению тимуса увеличенные лимфоузлы, разрастание фолликулов у корня языка, увеличение миндалин, селезёнки, а в крови — увеличение числа лимфоцитов. Это происходит из-за избытка гормонов, которые влияют ни тимус и надпочечник.
Это происходит из-за избытка гормонов, которые влияют ни тимус и надпочечник.
Нарушения в эндокринной системе и обмене веществ проявляются обычно в ожирении, нарушении аппетита, увеличенной печени, потемнении от пигмента пальцев на ногах и руках (как загорелые), снижении давления, проявлении признаков, похожих на рахит; страдает сердце. При этом при исследовании выявляется дисбаланс в гормонах надпочечника, нарушения в щитовидной железе и гипофизе. Все эти проявления должны выявляться как минимум 4 месяца подряд и более, они же должны сочетаться с рентгенологическими признаками увеличения тимуса, тогда устанавливается диагноз тимомегалии с расстройством функции.
Особенности течения болезни у таких детей. Дети с увеличением тимуса болеют по-особенному, у них отличается течение многих часто встречающихся заболеваний. Например, всем известные ОРЗ и ОРВИ у таких детей протекают в первые два-три дня с нормальной температурой или незначительным её повышением. Но затем она резко повышается до высоких цифр, проявления становятся сильными и выраженными, особенно сильно поражаются верхние дыхательные пути и бронхи с лёгкими, что может приводить к затяжному характеру болезни. При тимомегалии симптомы простуды проявляются сильнее обычного — если это кашель, он становится коклюшеобразным, с приступами, сухим и навязчивым, часто возникают признаки обструкции бронхов, ложный круп с отёком гортани. Улучшение идёт медленно, кашель зачастую остаётся надолго, на месяц и более. У части детей заболевание осложняется отитами, у половины при простудах наблюдается жидкий стул и боли в животе. Имеют отличительные особенности и пневмонии, они обычно возникают постепенно, не проявляются остро, температура при них редко бывает высокой, поэтому диагноз ставят поздно и с трудом.
При тимомегалии симптомы простуды проявляются сильнее обычного — если это кашель, он становится коклюшеобразным, с приступами, сухим и навязчивым, часто возникают признаки обструкции бронхов, ложный круп с отёком гортани. Улучшение идёт медленно, кашель зачастую остаётся надолго, на месяц и более. У части детей заболевание осложняется отитами, у половины при простудах наблюдается жидкий стул и боли в животе. Имеют отличительные особенности и пневмонии, они обычно возникают постепенно, не проявляются остро, температура при них редко бывает высокой, поэтому диагноз ставят поздно и с трудом.
Как ставят диагноз тимомегалия?
Самым основным диагностическим способом увидеть увеличенный тимус всё ещё остаётся рентген. На нём можно увидеть признаки увеличения тимуса от первой до третьей степени. Однако не всегда увеличение бывает типичным, и требуются дополнительные снимки, кроме обзорного рентгена грудной клетки.
Как это лечат?
В первую очередь немедикаментозными средствами — это, прежде всего, строгие режимные мероприятия, диета, а уж потом, на крайний случай, медикаментозная терапия. Режим у ребёнка должен быть обычный, как у всех детей, но с некоторыми оговорками -оградите такого малыша от сильных стрессовых раздражителей: переездов, ремонтов, разводов, истерик. В основе диеты — ограничение лёгких углеводов и животных жиров, а для детей на первом году жизни самым лучшим питанием и профилактикой инфекций и разрастания тимуса является кормление грудью. Если же этой возможности нет, надо выбирать для кормления детей высоко адаптированные, гипоаллергенные и кисломолочные смеси. До трёх лет не стоит давать детям яйца, шоколад, какао или мёд, а питание необходимо дополнительно обогащать витаминами. Если у ребёнка возникают эпизоды диареи, необходимо вообще резко снизить потребление жиров. Медикаментозную терапию назначают детям с сильно выраженными признаками болезни, курсами два или три раза в год, чаще всего это делают осенью и весной либо ещё зимой. Объём терапии определяет врач.
Режим у ребёнка должен быть обычный, как у всех детей, но с некоторыми оговорками -оградите такого малыша от сильных стрессовых раздражителей: переездов, ремонтов, разводов, истерик. В основе диеты — ограничение лёгких углеводов и животных жиров, а для детей на первом году жизни самым лучшим питанием и профилактикой инфекций и разрастания тимуса является кормление грудью. Если же этой возможности нет, надо выбирать для кормления детей высоко адаптированные, гипоаллергенные и кисломолочные смеси. До трёх лет не стоит давать детям яйца, шоколад, какао или мёд, а питание необходимо дополнительно обогащать витаминами. Если у ребёнка возникают эпизоды диареи, необходимо вообще резко снизить потребление жиров. Медикаментозную терапию назначают детям с сильно выраженными признаками болезни, курсами два или три раза в год, чаще всего это делают осенью и весной либо ещё зимой. Объём терапии определяет врач.
Вакцинация: тимомегалия 1 и 2 степени не является противопоказанием к вакцинации при условии клинического здоровья.
Наблюдение детей с синдромом увеличения вилочковой железы. Диспансерное наблюдение детей с тимомегалией проводится участковым врачом, который при необходимости назначит консультации специалистов. Требуются охранительные мероприятия, правильное питание, соответствующее возрасту.
К.В. ГЕРБСТ, врач аллерголог-иммунолог отделения клинической иммунологии и аллергологии Окружного кардиологического диспансера «Центр диагностики и сердечно-сосудистой хирургии» г. Сургута.
Что нужно знать о патологии тимуса
Внутренний секрет
Вилочковая железа (тимус) занимает особое место в системе желез внутренней секреции. С одной стороны, она вырабатывает целый ряд гормонов и гормоноподобных веществ (инсулиноподобного фактора роста, тимопоэтин, тимозин, тимулин). С другой стороны, тимус является центральным органом иммунитета.
Вилочковая железа — источник популяции тимусзависимых лимфоцитов (Т-лимфоцитов), которые отвечают за распознавание антигенов, регуляцию и другие функции иммунного ответа. Именно в тимусе происходит их клонирование и дифференцировка. Для обеспечения защиты созревающих Т-лимфоцитов от воздействия разнообразных антигенов даже существует гемато-тимусный барьер.
Именно в тимусе происходит их клонирование и дифференцировка. Для обеспечения защиты созревающих Т-лимфоцитов от воздействия разнообразных антигенов даже существует гемато-тимусный барьер.
Еще одной особенностью вилочковой железы является ее «недолговечность» — с пубертатного периода начинается инволюция, и у взрослых практически вся железистая ткань заменяется жировой.
Значимость этой железы трудно переоценить. При ее недоразвитии происходит снижение клеточного и гуморального иммунитета, в следствие чего возникают септические осложнения в первую очередь вирусной и грибковой природы. В детском возрасте возможно и увеличение вилочковой железы (тимомегалия), которое часто сопровождается экссудативно-катаральным диатезом, тяжелым и длительным течением бронхолегочных заболеваний. Правда, следует учитывать возможность частого физиологического увеличения вилочковой железы на первом году жизни, которое может наблюдаться почти у половины детей.
Отдельно стоят болезни тимуса у взрослых. В большинстве случаев речь идет о различных опухолях вилочковой железы, которые носят общее название — тимомы. Они являются наиболее частыми новообразованиями средостения (комплекс органов, расположенных между правой и левой плевральными полостями), хотя и составляют менее 1 % всех онкологических заболеваний. Чаще всего встречаются доброкачественные образования (65—70 %), но и они могут доставлять большие проблемы больному. Правда, на начальных стадиях и при медленном росте эти опухоли не сопровождаются какими-либо патологическими симптомами, поэтому выявить их можно только случайно, при компьютерной томографии грудной клетки. Однако значительное увеличение объема патологически измененной вилочковой железы приводит к сдавлению и нарушению функции близлежащих органов. Поскольку тимус расположен в средостении, за грудиной, его ближайшими «соседями» являются трахея, пищевод, сердце, аорта, легочная артерия, большая полая вена и нервные волокна.
В большинстве случаев речь идет о различных опухолях вилочковой железы, которые носят общее название — тимомы. Они являются наиболее частыми новообразованиями средостения (комплекс органов, расположенных между правой и левой плевральными полостями), хотя и составляют менее 1 % всех онкологических заболеваний. Чаще всего встречаются доброкачественные образования (65—70 %), но и они могут доставлять большие проблемы больному. Правда, на начальных стадиях и при медленном росте эти опухоли не сопровождаются какими-либо патологическими симптомами, поэтому выявить их можно только случайно, при компьютерной томографии грудной клетки. Однако значительное увеличение объема патологически измененной вилочковой железы приводит к сдавлению и нарушению функции близлежащих органов. Поскольку тимус расположен в средостении, за грудиной, его ближайшими «соседями» являются трахея, пищевод, сердце, аорта, легочная артерия, большая полая вена и нервные волокна.
Характерные симптомы при развитии опухоли тимуса — затруднение дыхания и глотания, кашель, отеки и цианоз верхней части туловища и лица, боль за грудиной, шум и тяжесть в голове, возможен сбой сердечного ритма. Нарушение работы тимуса, которое возможно даже при доброкачественном течении опухоли, часто приводит к развитию миастении — нарушению функции мускулатуры тела. Это нервно-мышечная патология, которая имеет аутоиммунную природу и сопровождается быстрой слабостью и утомляемостью в первую очередь скелетных мышц. Больному человеку трудно встать со стула, подняться по лестнице, руки становятся «ватными». Усталость нарастает к вечеру: нарушается речь, опускаются веки, появляется двоение в глазах, сложно сфокусировать взгляд. При выраженной симптоматике нарушается процесс жевания и глотания, изменяется голос (становится гнусавым). Характерна связь физической нагрузки одних групп мышц с нарушением других функций мышечной системы. Так, после некоторого усилия слабость ощущается не только в мышцах, которые были задействованы, но и во всех остальных. Для злокачественных опухолей, особенно на поздних стадиях, характерны отдаленные метастазы и нарастающая интоксикация.
Нарушение работы тимуса, которое возможно даже при доброкачественном течении опухоли, часто приводит к развитию миастении — нарушению функции мускулатуры тела. Это нервно-мышечная патология, которая имеет аутоиммунную природу и сопровождается быстрой слабостью и утомляемостью в первую очередь скелетных мышц. Больному человеку трудно встать со стула, подняться по лестнице, руки становятся «ватными». Усталость нарастает к вечеру: нарушается речь, опускаются веки, появляется двоение в глазах, сложно сфокусировать взгляд. При выраженной симптоматике нарушается процесс жевания и глотания, изменяется голос (становится гнусавым). Характерна связь физической нагрузки одних групп мышц с нарушением других функций мышечной системы. Так, после некоторого усилия слабость ощущается не только в мышцах, которые были задействованы, но и во всех остальных. Для злокачественных опухолей, особенно на поздних стадиях, характерны отдаленные метастазы и нарастающая интоксикация.
Лечение болезни комплексное, после хирургической операции назначается лучевая и химиотерапия. Оперативные вмешательства в настоящее время могут в ряде случаев проводиться эндоскопически (торакоскопия), что позволяет значительно сократить послеоперационный период. Современные методы лечения позволяют вернуть здоровье в 60—90 % случаев в зависимости от степени развития патологии.
Оперативные вмешательства в настоящее время могут в ряде случаев проводиться эндоскопически (торакоскопия), что позволяет значительно сократить послеоперационный период. Современные методы лечения позволяют вернуть здоровье в 60—90 % случаев в зависимости от степени развития патологии.
Зачем нужно узи тимуса? | МЦ Здоровья
Это одна из самых малознакомых структур в организме. При рождении она весит 10-20 граммов, к 12-14 годам увеличивается до тридцати- тридцати пяти грамм, в старости – едва достигает половины веса при рождении (5-6 грамм). Во времена античной медицины считалось, что именно здесь находится душа (thymus — греч. thymos -душа, настроение, чувство), позже её называли «железой детства», «железой роста», нам она знакома как вилочковая железа, а также тимус. Это важный орган иммунной системы, формирующийся в самые ранние сроки беременности – почти одновременно с сердцем. Располагается тимус в средостении, непосредственно за грудиной. Интересно, что вилочковая железа – единственный орган нашего организма, который после рождения не только больше не развивается, а, наоборот, подвергается обратному развитию и уменьшению в размере.
Тимус является своеобразной «школой» для лимфоцитов (клеток иммунной системы). Именно тимус занимается «обучением» этих клеток – здесь происходит их формирование и созревание с дальнейшим превращением в зрелые полноценные лейкоциты, которые готовы к встрече с чужеродными агентами и способны дать отпор инфекции (бактериям, вирусам, грибковым инфекциям) .
Существует несколько вариантов и видов патологии тимуса, из которых наиболее распространенными являются «Синдром увеличения вилочковой железы» — этот термин зачастую используется при незначительном увеличении тимуса, и «Тимомегалия» — используется для характеристики выраженного увеличения вилочковой железы
Очень редко педиатры вносят этот диагноз в карту развития ребенка, большинство родителей никогда о нем не слышали. Тем не менее, это патологическое состояние широко распространено среди детей раннего возраста. Именно тимомегалия является основообразующей в формировании лимфатического диатеза у детей. Название данного заболевания говорит о том, задействована лимфатическая система ребенка – это подтверждается гиперплазией (усиленным ростом) клеток всей лимфатической системы, однако, кроме этого, у детей развиваются и эндокринные нарушения, что делает этот вид диатеза более серьезным. Однако на сегодняшний день окончательно не определена роль тимуса в иммунологических процессах, поскольку и гипоплазия, и гиперплазия вилочковой железы ведут к снижению иммунитета.
Однако на сегодняшний день окончательно не определена роль тимуса в иммунологических процессах, поскольку и гипоплазия, и гиперплазия вилочковой железы ведут к снижению иммунитета.
Большинство исследователей считают тимомегалию патологическим состоянием, которое сформировалось ещё во внутриутробном периоде — при наличии осложнений беременности или в результате патологических родов, и эти факторы спровоцировали нарушение развития и становления взаимоотношений иммунной и нейроэндокринной систем. Установлено, что данное заболевание передаётся генетически. Доказано, что дети с синдромом тимомегалии проявляют высокую склонность к инфицированию вирусом Эпштейна–Барр, чаще других детей болеют вирусными респираторными инфекциями.
Родители первыми могут заподозрить наличие увеличения вилочковой железы у своего ребенка, помочь в этом могут такие симптомы, как большой вес ребёнка при рождении, чрезмерная бледность и потливость, повышение температуры тела до субфебрильных цифр (37. 0-37.3 град) без признаков респираторной инфекции, длительный кашель, не поддающийся лечению, видимая венозная сеточка на груди малыша, частые срыгивания, заметные нарушения сердечного ритма, приступы одышки. У более старших детей выявляется увеличение разных групп лимфатических узлов, увеличение миндалин, аденоидов, появление на коже малыша мраморного рисунка, постоянно влажные холодные ладони и стопы, увеличение массы тела вплоть до ожирения, частые аллергические реакции, дерматиты, такие дети мало двигаются, вялые , но чрезмерно раздражительные. При ультразвуковом исследовании (УЗИ) органов брюшной полости случайно обнаруживается увеличение селезенки; при выполнении рентгенографии органов грудной клетки выявляется расширение тени тимуса.
0-37.3 град) без признаков респираторной инфекции, длительный кашель, не поддающийся лечению, видимая венозная сеточка на груди малыша, частые срыгивания, заметные нарушения сердечного ритма, приступы одышки. У более старших детей выявляется увеличение разных групп лимфатических узлов, увеличение миндалин, аденоидов, появление на коже малыша мраморного рисунка, постоянно влажные холодные ладони и стопы, увеличение массы тела вплоть до ожирения, частые аллергические реакции, дерматиты, такие дети мало двигаются, вялые , но чрезмерно раздражительные. При ультразвуковом исследовании (УЗИ) органов брюшной полости случайно обнаруживается увеличение селезенки; при выполнении рентгенографии органов грудной клетки выявляется расширение тени тимуса.
Особенно внимательными должны быть родители новорожденных детей и детей до 1 года, так как с большой долей вероятности доказано — при этой аномалии конституции повышается риск синдрома внезапной смерти в периоде новорожденности, если в семье имели место такие случаи, такому новорожденному показано УЗИ тимуса.
Как правило, симптомы тимомегалии проявляются до достижения ребёнком возраста 3-6 лет. Позже они либо исчезают совсем, либо переходят в другие заболевания вилочковой железы и организма. Тимомегалия опасна формированием иммунодефицита, тимусно-надпочечниковой недостаточности. У детей в возрасте 4-7 лет возникают хронические заболевания (ревматизм, бронхиальная астма, пиелонефрит, хроническая пневмония. Чтобы предотвратить прогрессирование заболевания, нужно своевременно проводить лечение тимомегалии под наблюдением педиатра.
Есть версия, что небольшое увеличение тимуса для детского возраста считается нормой. Однако печальная статистика свидетельствует о большом количестве случаев тимомегалии у детей умерших до 1 года. Данный факт опровергает бытующее мнение о том, что увеличение тимуса у детей следует считать нормой и это состояние не требует коррекции.
Не следует и преувеличивать данную проблему. Если обнаружено увеличение тимуса на фоне респираторного заболевания, следует уточнить наличие клинических симптомов тимомегалии. Если таковые отсутствуют, увеличение тимуса расценивают как функциональное. После окончательного выздоровления или через 3- 4 месяца после обнаружения увеличения тимуса проводят повторное обследование, анализы крови. Если тимус не увеличен, нет изменений в клиническом анализе крови — делается вывод о функциональном увеличении тимуса . Такой ребенок считается здоровым и не имеет противопоказаний к вакцинации. Если при повторном обследовании тимус сохраняется увеличенным, имеется клиническая симптоматика и изменения в анализах крови — тогда ребенка ставят на диспансерный учет с диагнозом тимомегалия. Такие дети направляются на консультацию к иммунологу для решения вопроса о сроках вакцинации, проведения лечения и коррекции.
Если таковые отсутствуют, увеличение тимуса расценивают как функциональное. После окончательного выздоровления или через 3- 4 месяца после обнаружения увеличения тимуса проводят повторное обследование, анализы крови. Если тимус не увеличен, нет изменений в клиническом анализе крови — делается вывод о функциональном увеличении тимуса . Такой ребенок считается здоровым и не имеет противопоказаний к вакцинации. Если при повторном обследовании тимус сохраняется увеличенным, имеется клиническая симптоматика и изменения в анализах крови — тогда ребенка ставят на диспансерный учет с диагнозом тимомегалия. Такие дети направляются на консультацию к иммунологу для решения вопроса о сроках вакцинации, проведения лечения и коррекции.
До недавнего времени основным методом диагностики патологии вилочковой железы была рентгенография органов грудной клетки. Однако рентгенологический метод не учитывает индивидуальные особенности строения и положения железы, не позволяет проводить оценку структуры паренхимы. Кроме того, значительная лучевая нагрузка ограничивает широкое использование этого метода у детей раннего возраста.
Кроме того, значительная лучевая нагрузка ограничивает широкое использование этого метода у детей раннего возраста.
В последнее время для оценки тимуса у детей раннего возраста, широко используется эхография (УЗИ), которая является высокоинформативным, безопасным, доступным и относительно недорогим методом, позволяет проводить практически неограниченное количество контрольных исследований, необходимых для динамического наблюдения. Кроме того, УЗИ с использованием допплеровских технологий является приоритетным и высокоинформативным методом оценки тимуса у плодов и детей от неонатального периода до подросткового возраста.
Врач УЗД Янишевской Лилия Павловна
причины, симптомы и методы терапии
Тимомегалия (код по мкб 10 – E.32) в любом возрасте характеризуется изменением в большую сторону размеров тимуса (вилочковая железа). У взрослых это вызывает ряд внешних или внутренних причин.
Для детей является вариантом нормы. Но если причиной является какая-то болезнь, то это может приводить к нарушениям в работе, например, иммунной системы.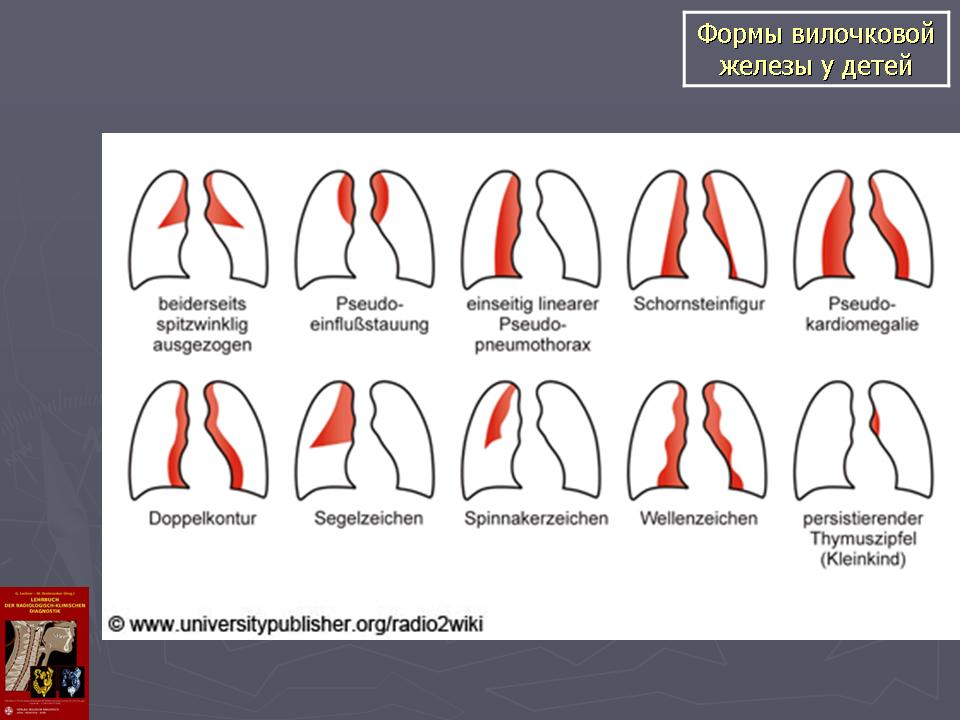 Важно обнаружить это заболевание и уже на ранних стадиях начать правильное лечение.
Важно обнаружить это заболевание и уже на ранних стадиях начать правильное лечение.
Что такое тимомегалия
Тимус – орган, где проходит развитие (начиная с созревания) T-лимфоцитов из клеток-претимоцитов, это главный орган иммунной системы человека. Отвечает за половое развитие и рост, а также регулирует обменные процессы. С возрастом заменяется жиром.
Тимомегалия – увеличение тимуса по объёму и массе, без изменения гистологической структуры. Чаще встречается в возрасте до года, у 25%. После 6 лет случаи возникновения сводятся к минимуму. Однако встречаются чаще, чем нейрогенные новообразования. По МКБ 10 имеет код Е32.0 (стойкая гиперплазия вилочковой железы), исключая аплазию/гипоплазию с иммунодефицитом (D82.1) и myasthenia gravis (G70.0).
Классификация
Известны два типа болезни, имеющей код Е32.0 по МКБ 10:
- Первичная – врождённая, тимус сформирован правильно, но размеры отклонены от нормы в большую сторону. Характеризуется неправильным функционированием.

- Вторичная – приобретённая вследствие патологий других желёз эндокринной системы (например, травм, некоторых синдромов и др.).
Выделяют ещё тимомегалию, как сопутствующее проявление. Особенно на фоне известных всем ОРВИ, бронхитов. Нормализация состояния происходит после излечения от инфекционного заболевания.
Причины развития
После рождения, вилочковая железа максимальна в размерах и занимает до 4,5% от веса новорожденного. Растёт до пятнадцатилетнего возраста, в дальнейшем инволюционирует.
Возникновение тимомегалии у детей обуславливается факторами, больше относящимися к анамнезу периода до и во время беременности: выкидыши, аборты, употребление спиртного, лекарств, облучения Х-лучами, недонашивание, травмы при родах и т.д. Тимомегалия, по МКБ 10 код Е32.0 – проявление лифатико-гипопластического диатеза. Также уже доказано, что заболевание имеет генетическую детерминированность.
Развитие патологии в старшем возрасте провоцируется некоторыми расстройствами, например, иммунодефицитным, аутоиммунным и иными. Имеют в основном эпителиальное происхождение. Есть кожные болезни, вызывающие тимомегалию: пемфигус, хронический кандидоз слизистых.
Имеют в основном эпителиальное происхождение. Есть кожные болезни, вызывающие тимомегалию: пемфигус, хронический кандидоз слизистых.
Симптоматика
При небольшом росте тимуса в детстве, симптомы не наблюдаются. Поэтому, принято небольшое увеличение характеризовать как синдром увеличенной вилочковой железы.
Для ребёнка, страдающего болезнью, имеющей код E32.0 по МКБ 10 характерны:
- Округлённость и мягкость тела.
- Наблюдается непропорциональность.
- Бледнокожесть, волосяной покров и цвет глаз – светлых оттенков.
- Мускулы плохо развиты и ходить начинает поздно.
- Постоянно хочет есть.
- Говорить начинает поздно.
- Медленно прорезываются зубы, в неправильной последовательности.
Сопутствующие дефекты – рахиты, грыжи, врождённый вывих бедра и др. Вероятны аритмии, гипотония и повышенная потливость. На фоне придавливания трахеи, сосудистого пучка и др. нарушаются эндокринные процессы, появляется иммунодефицит.
Вероятны аритмии, гипотония и повышенная потливость. На фоне придавливания трахеи, сосудистого пучка и др. нарушаются эндокринные процессы, появляется иммунодефицит.
При надавливании на внутренности, проявляется синдром полой вены. В области шеи вены набухают, слышна одышка. При сдавливании трахеи: кхеканье и хрипы. При надавливании на блуждающий нерв наблюдаются частые срыгивания, рвота, брадикардия.
Последствия тимомегалии по МКБ у взрослых – проявляются достаточно поздно. Это связано с тем, что опухоль смещается к соседствующим с ней тканям или давит на них. Распространены признаки и симптомы в виде:
- Продолжительного кашля.
- Трудностей при глотании.
- Паралича нерва в шее.
- Дисфункции сердца.
- Миастения.
- Частого безосновательного утомления.
Диагностика основного заболевания
Стопроцентно определить тимомегалию возможно только на рентгенологическом обследовании, т.к. это заболевание проявляется только на поздних стадиях. КТ или МРТ, после постановки диагноза, проводятся для определения размеров и расположения возможной опухоли. Ещё становится возможным понять, есть ли дочерние новообразования (метастазы).
КТ или МРТ, после постановки диагноза, проводятся для определения размеров и расположения возможной опухоли. Ещё становится возможным понять, есть ли дочерние новообразования (метастазы).
Характер новообразования понятен по гистологическому анализу. Что важно при подозрении на злокачественность. Есть некоторые особенности, из-за которых в некоторых случаях сложно взять образец поверхности тимуса, поэтому забор ткани проводят при операциях удаления.
При подозрении на тимомегалию, ребёнок проходит комплекс исследований, включающий консультации нескольких специалистов, в т.ч. иммунолога. Само обследование делится на основные этапы:
- Клинико-анамнестический – оценка состояния в целом, важны при этом данные по беременности и родам, чем болел и болеет ребёнок: сбор анамнеза.
- Инструментальное обследование – основной метод определения. Включает рентген торакса, УЗИ тимуса (для оценки размеров и массы) и брюшное УЗИ, включающее и надпочечники.
- Лабораторные исследования – для получения развёрнутой картины болезни, как она влияет на состояние.
 Здесь проводят общий анализ крови.
Здесь проводят общий анализ крови.
Методы лечения
Первым и главным средством в лечении болезни по МКБ – удаление, при этом, все лимфатические узлы в этой области удаляют в случае развития злокачественного новообразования. Но всегда удаляют видимые и слишком увеличенные лимфатические узлы. Есть случаи, когда операция не имеет смысла:
- Появление метастазов в некоторых отдалённых участках организма человека.
- Сердечная недостаточность, дисфункция почек или печени.
При незначительном увеличении вилочковой железы, не назначают спецмероприятия. Даются только общие рекомендации:
- Соблюдение нормального питания, соответствующего возрасту.
- Ни в коем случае нельзя подвергать организм стрессу.
- Нельзя допускать контакты с носителями инфекциями, особенно во время сезонных эпидемий.
Т.к. недостаточно разработаны рекомендации по МКБ, врач-иммунолог, наблюдающий ребёнка, назначает лечение лекарствами. Схема обычно такая:
- Адаптогены и стимуляторы биологического происхождения – раз в триместр, если часто болеет, подвержен сезонным заболеваниям.
- Экстракт тимуса крупного рогатого скота – для иммунокоррекции.
- Курс аммония глицирризината и этимизола – каждые полгода детям до шести лет.
- Кортикостероиды (например, гидрокортизон) – если окружают сильнейшие стрессы и при оперативных вмешательствах.
- Преднизолон, препараты калия – при синдроме тимусо-надпочечниковой недостаточности по МКБ.
Стандартное прививание в соответствии с возрастом не противопоказано детям с I-II степенью. Но следует придерживаться гипоаллергенной диеты. При III-й – на полгода запрет вакцин, кроме прививок от полиомиелита.
Прогноз и профилактика заболевания
Как и в случаях любых других опухолей, невозможно проводить профилактику тимомегалии. Единственная рекомендация заключается в том, что следует ежегодно проходить диспансеризацию, включающую КТ грудной клетки. При известном диагнозе: приём у врача каждый сезон в первые два года после выявления, КТ – ежегодно, не чаще.
Детскую тимомегалию регистрируют максимум до шестилетнего возраста, после периода полового созревания, ткани вилочковой железы замещаются соединительными и жировыми. Стоит учитывать, что до шести лет с таким заболеванием может умереть от гипофункции коры надпочечников. Восприимчив к:
- аллергенам и реакции на них;
- инфекционно-воспалительным процессам.
Чтобы снизить риски, исключают перинатальные вредности. При обнаружении, дети ставятся на учёт к педиатру, аллергологу, иммунологу и эндокринологу. Меры, предупреждающие дальнейшее развитие тимомегалии перечислены выше.
Тимус – что это? Роль тимуса на первому году жизни ребенка
Тимус (вилочковая железа) – важный орган иммунной системы детей. Он расположен в верхнем отделе грудной клетки и состоит из двух долей, соединяющихся в передней части трахеи. Железа растет до наступления половой зрелости, достигая массы 30–40 грамм, затем постепенно уменьшается (обратное развитие).
Она играет доминирующую роль в иммунной, эндокринной системе. Тимус продуцирует тимозин, тимопоэтин, стимулирующие выработку антител, а также производит Т-лимфоциты – белые клетки крови, уничтожающие аномальные клетки с чужеродными антигенами. Другая функция вилочковой железы – предотвращение патологического роста клеток и предупреждение рака. Следует отметить, что тимус играет ведущую роль в иммунитете ребенка до трех лет.
Роль тимуса в жизни ребёнка
До рождения и в детстве тимус ответственен за производство плюс созревание Т-лимфоцитов, защищающих организм от определенных угроз, включая вирусы, бактерии. Тимус является крупнейшим лимфоидным органом у новорожденных, так как активнее других тканей продуцирует лимфоциты. Железа выступает «первой скрипкой» в развитии и улучшении иммунной системы ребенка.
Тимус производит и секретирует тимозин – гормон, необходимый для выработки Т-клеток. После «созревания» в железе они поступают в кровь и мигрируют в лимфоузлы и селезенку, где помогают иммунной системе бороться с болезнью.
В некоторых случаях функции вилочковой железы снижены, что ослабляет иммунную систему, увеличивая склонность к инфекциям и аллергии. Ребенок страдает затяжными ОРВИ, патология легко переходит в хроническую. Недостаток Т-лимфоцитов в организме может привести к иммунодефицитным заболеваниям, характеризующимися сильной потливостью, отечностью и/или болезненностью горла, припухлостью лимфатических узлов, депрессией.
Недоедание и дефицит белка в раннем возрасте обусловливает медленный или ограниченный рост тимуса, «подрывая» тем самым нормальное функционирование лимфоцитов. Вот почему важно сбалансированное питание с достаточным количеством белка.
Доктора данного направления
Патология тимуса
Основные виды патологии тимуса:
- Аплазия – отсутствие или недоразвитие вилочковой железы
- Гипо- и дисплазия – недоразвитие тимуса
- Акцидентальная инволюция – уменьшение вилочковой железы, под влиянием гормонального дисбаланса, стресса, инфекции
- Атрофия – уменьшение, замещение железистой ткани соединительной, прекращение функционирования
- Тимомегалия – увеличение массы и объема паренхимы вилочковой железы выше возрастной нормы при сохранении ее нормального строения
- Гиперплазия – увеличение железистой ткани, с нарушением выработки иммунных клеток и функционирования тимуса.
- Тимома – опухоль вилочковой железы.
- Киста тимуса – жидкостное образование вилочковой железы.
- Патология тимуса (вилочковой железы) может вызывать: развитие ряда иммунодефицитных синдромов, аутоиммунных заболеваний и некоторых эндокринных нарушений.
Увеличение тимуса у детей
Отклонение в размере тимуса в большую сторону и снижение его функции обозначают термином «синдром увеличенной вилочковой железы» (СУВЖ) у детей. Проблему увеличенного тимуса чаще рассматривают в свете дифференциальной диагностики с плевритом, перикардитом, опухолями средостения, другими патологиями.
Ошибочно считают, что увеличенный тимус у детей грудного или раннего возраста является физиологическим состоянием. Особенности протекания инфекционных заболеваний у маленьких пациентов с СУВЖ заставляют классифицировать синдром, как патологию. Дети с СУВЖ имеют большую вероятность развития дисбаланса нейроэндокринной плюс иммунной систем. Поэтому пациенты с выявленным увеличением тимуса требуют полного обследования и диспансерного наблюдения у эндокринолога, иммунолога.
Симптомы заболевания или нарушения развития вилочкой железы
Для того, что бы вовремя выявить патологию тимуса, родителям стоит обратить внимание на отклонения, имеющие различную степень выраженности, которые могут свидетельствовать о заболевании или нарушении развития вилочковой железы:
- Частая заболеваемость ребенка простудными заболеваниями.
- Затяжное течение различных заболеваний, с частыми осложнениями.
- Увеличение лимфоидной ткани – лимфатических узлов, миндалин, аденоидов, ткани на задней поверхности глотки.
- Бледность и/или мраморный рисунок на коже ребёнка.
- Большой вес ребёнка при рождении.
- Ребёнок быстро теряет и быстро набирает вес.
- Кашель вне простудного заболевания, который усиливается в положении ребёнка горизонтально.
- Потливость, субфебрильная температура длительное время вне простудных заболеваний.
- Гипергидроз, холодные конечности.
- Видимая венозная сеточка на груди малыша.
- Цианоз (посинение) носогубного треугольника при нагрузках (плач, бег)
- Частые срыгивания, икоты, отрыжки
- Одышка
- Нарушение сердечного ритма
При возникновении подозрений на патологию тимуса, врач может назначить дополнительные методы обследования:
- УЗИ вилочковой железы,
- КТ,
- МРТ,
- рентген,
- общий анализ крови,
- иммунограмму,
- биохимический анализ крови,
- кровь на гормоны.
Тимическая недостаточность поддается иммунокорекции, которая индивидуально подбирается врачом аллергологом-иммунологом. Стоит обратить внимание, что своевременная диагностика патологии вилочковой железы особенно актуальна на первом году жизни ребенка, когда ребенку начинают проводить вакцинацию.
Для получения подробных консультаций о роли тимуса в жизни ребёнка на первом году жизни обращайтесь к педиатрам медицинских центров «Президент-Мед»
Смотрите так же по теме:
Автор: Мамунц Цовинар Алексеевна
Главный врач Президент-Мед г. Видное
Высшее медицинское, Пермский государственный медицинский институт, лечебный факультет, специальность-лечебное дело
Записаться к врачу
Средостения и вилочковой железы — ООО «ТАИС-МЕД»
Подготовка к УЗИ средостения и вилочковой железы:
не требуется
Описание:
Вилочковая железа расположена за грудиной, вес ее у новорожденного ребенка составляет около 15 грамм. По форме напоминает двузубую вилку, отсюда и получила свое название. Растет медленно, до момента полового созревания. Вес железы в это время достигает, ориентировочно, 30 грамм, а затем начинает постепенное уменьшение.
Несмотря на маленький вес и размер, от состояния вилочковой железы зависят все защитные силы человеческого организма. Она участвует в регулировке развития и роста организма в целом, в формировании иммунитета и в ходе обменных процессов.
Задача вилочковой железы – генерация, «обучение» и выбраковка Т-лимфоцитов (тимус-зависимых), которые защищают наш организм от вирусов, бактерий, опухолей.
Некоторые Т-лимфоциты содержат антигены, способные вызвать аутоимунные заболевания. Железа должна распознать и уничтожить такие клетки. Считается, что недостаточная работа вилочковой железы в детстве способствует развитию аутоиммунных заболеваний в зрелом возрасте.
Причины, оказывающие влияние на размеры железы
Иммунная система у ребенка формируется полностью к 12 годам. Именно в этом возрасте замедляется рост тимуса, а затем по ненадобности постепенно атрофируется. Работа тимуса в детском возрасте оказывает влияние на состояние иммунитета человека на протяжении всей его жизни. Чем меньше возраст ребенка и чаще заболевания, тем интенсивнее нагрузка на тимус, что вызывает его скорейший рост.
На любой вирус, попавший в детский организм, тимус активно реагирует и заставляет Т-лимфоциты вырабатывать антитела для борьбы с чужеродной средой. У детей, склонных к аллергическим реакциям и простудным заболеванием, железа может вырастать больше нормы.
К пятилетнему возрасту железа обычно приходит в нормальное состояние. Однако, это не означает, что она должна оставаться в дальнейшем без наблюдения. Надо помнить, что от этого практически незаметного органа зависит иммунитет ваших детей и их здоровье в будущем. Контроль за состоянием этого органа осуществляется в наше время преимущественно методом ультразвукового исследования.
Исследование состояния тимуса — непростой процесс. Ведь железа имеет в норме очень маленькие размеры, находится за грудинной костью, в непосредственной близости от сердца. Ранее для диагностики тимомегалии у детей использовали рентгенологическое обследование. Но рентгеновское излучение вредно, а для малышей особенно. Теперь для исследования детей применяется УЗИ метод, который является абсолютно безопасным, информативным и доступным. Для обследования вилочковой железы требуется диагностический аппарат с высокой чувствительностью и хорошей разрешающей способностью.
В медицинском центре ООО «ТАИС-МЕД» врач проводит обследование на современном ультразвуковом сканере SonoAce R 7 , обладающим высокой разрешающей способностью и имеющий набор функций, соответствующий приборам высокого класса, что помогает проводить диагностику наиболее высокого уровня.
Показания для назначения УЗИ средостения и вилочковой железы:
Сбои в работе вилочковой железы приводят к ее увеличению. Рост может быть как незначительным, так и многократным. Тимомегалия (увеличение) приводит к снижению иммунитета, частым простудным заболеваниям с осложнениями, проявлению диатеза и аллергии.
Если малыш болеет более 10 раз в год, это также является поводом для визита к врачу с целью обследования состояния тимуса. Педиатр или детский врач-иммунолог назначает УЗИ вилочковой железы при следующей симптоматике:
•частые простудные заболевания, которые могут усугубляться синуситами, бронхитами, пневмонией;
•увеличение аденоидов, миндалин, отдельных лимфоузлов;
•проявления любых аллергических реакций, в том числе диатеза, поллиноза, крапивницы, бронхиальной астмы;
•повышение температуры в пределах 37,1-37,5 градусов без видимых причин;
•четко выраженная сосудистая сеточка на грудной клетке;
•аритмия, одышка, сниженный мышечный тонус, частые срыгивания;
•общая слабость, быстрая утомляемость, болезненные ощущения в области груди неопределенного происхождения.
Ультразвуковое исследование (УЗИ) вилочковой железы у детей.
30/09/17
Несмотря на маленький размер вилочковая железа (еще ее называют тимусом) играет огромную роль в здоровье ребенка.
Если ребенок болеет часто и долго, то рекомендуется проводить исследование вилочковой железы.
Основными показаниями к исследованию вилочковой железы:
1. Частые простудные заболевания.
2. Перенесенные более серьёзные заболевания такие как: синуситы, воспаления легких — пневмонии, бронхиты.
3. Если ребенок склонен к аллергическим проявлениям таким как: диатез, крапивница, поллиноз, бронхиальная астма и т.д.
4. При увеличении лимфатических узлов, особенно длительно существующих и слабо поддающиеся лечению.
5. Если у ребенка длительное время держится температура 37,5 С.
Подготовка к УЗИ исследованию: специальная подготовка не требуется. На исследовании необходимо знать вес ребенка.
В раннем возрасте при возникновении необходимости исследования вилочковой железы у ребенка необходимо проведение именно УЗИ, а не рентгенографии:
1. УЗИ не «вредный» метод исследования,т.е. не несёт никакой лучевой нагрузки, в отличии от рентгенографии.
2. Только с помощью УЗИ возможно определение структуры паренхимы вилочковой железы (определения различных образований в ткани тимуса), что невозможно определить на рентгенографии.
3. С помощью УЗИ исследования можно рассчитать объем вилочковой железы по отношению к массе тела ребенка ( у каждого ребенка он различен), что более качественно отображает размер органа.
УЗИ вилочковой железы возможно провести только пока не произошло окостенения грудины, поэтому , чем младше ребенок, тем лучше мы может оценить орган.
Вилочковая железа в большинстве своем имеет двудолевое строение, но встречается и однодолевое. При однодолевом строении железы, так же, как и при типичном двудолевом, возможно как симметричное, так и асимметричное расположение органа. Асимметрия размеров долей железы при нормальном суммарном объеме органа не имеет принципиального клинического значения.
Бывает и такое распложение железы, что часть ткани может через яремную вырезку смещается на шею, достигая нижнего края щитовидной железы. Это является вариантом возрастной нормы и, при отсутствии других изменений, не должно расцениваться как патология.
Наиболее частой патологией является ТИМОМЕГАЛИЯ— увеличение объема вилочковой железы без нарушения структуры ткани. Это часто встречается у детей с измененным аллергическим фоном, часто причина тимомегалии и неясна. Клиническое значение тимомегалии состоит в повышенной настороженности относительно проведения плановых прививок и плановых оперативных вмешательств этим детям.
Возможно так же и уменьшения в размере вилочковой железы, что в дальнейшем требует специального обследования у иммунолога.
Нередко в детском возрасте стали встречаться и различные очаговые образования (кистозного и опухолевидного характера).
Если при ультразвуковом исследовании выявляется очаговое образование в паренхиме вилочковой железы, то необходима консультация онколога.
Ультразвуковой метод диагностики считается первым методом исследования при различный патологических состояниях или при их подозрении со стороны вилочковой железы у детей младшего возраста.
Автор: врач УЗИ Саркисова Н.Л.
Гипертрофия тимуса и внезапная неожиданная смерть у взрослых — ретроспективное исследование 56 вскрытий
Мы обнаружили, что как независимый фактор, гипертрофия тимуса значительно увеличивает риск SUDA (в 6,9 раз) как у мужчин, так и у женщин. Более того, SUDA, связанные с гипертрофией тимуса, были намного моложе (22,5 года), чем те, у которых его не было. Как и SUDA, гипертрофия вилочковой железы имела преобладание у мужчин. Считалось, что атрофия вилочковой железы происходит из-за повышенного уровня циркулирующих половых гормонов, а химическая или физическая кастрация взрослого человека приводит к увеличению размера и активности вилочковой железы 9 .Поэтому мы не удивлены, увидев, что гистологические характеристики вилочковой железы не идентичны у обоих полов 10 , и это, вероятно, объясняет половые различия в настоящем исследовании уровнями половых гормонов. В предыдущих исследованиях были обнаружены большие различия в весе нормального тимуса взрослого человека, что объяснялось смешением паренхимы и жира в инволютивных тимусах, и было трудно решить, что весить 10, 11 . В этом исследовании скорректированный вес тимуса также рассчитывался в 10 полях с малым увеличением на вес тимуса × (1 — площадь средостенного жира в%).Мы обнаружили, что вес тимуса положительно коррелировал с его скорректированным весом (r = 0,769, p <0,001), а также вес тимуса (r = -0,419, p = 0,009) и скорректированный вес (r = -0,701, p <0,001). отрицательно коррелировал с возрастом. В той же возрастной группе вес тимуса отражает количество паренхимы тимуса и может использоваться в качестве индикатора гипертрофии тимуса.
Хотя у большинства пациентов с гипертрофическим тимусом было различное количество сопутствующих аномалий, описываемых как типичные характеристики тимико-лимфатического статуса, например гиперплазия лимфатических узлов и селезенки, гипоплазия сердца и надпочечников и сужение аорты, все из них не были связаны с SUDA, поскольку значимые различия существовали только между группами SUDA с и без гипертрофии тимуса, но не между группами с гипертрофией тимуса с и без SUDA.Другие врожденные аномалии также были обнаружены у пациента с гипертрофией тимуса, например, гипоплазия почек и врожденный мегаколон, хотя они были редкими по сравнению с аномалиями, связанными с лимфатическим узлом. По этим сопутствующим аномалиям не было выявлено никаких болезненных состояний и случаев смерти. Наши данные показали, что сердечно-сосудистые заболевания вызывают немного больше SUDA, чем другие причины у пациентов с гипертрофией тимуса. Кендалл также сообщил о связи между сердечно-сосудистыми заболеваниями и массой тимуса.Он обнаружил, что смерти, при которых сердечно-сосудистые заболевания были причиной смерти или способствующим фактором смерти, были связаны с более высоким влажным и липидным весом тимуса 3 . Известно, что мутации гена сердечного рианодинового рецептора типа 2 (RyR2) вызывают фатальную желудочковую аритмию, обмороки и внезапную смерть. Когда Нишио исследовал мутации RyR2 в 18 случаях вскрытия SUD, он обнаружил, что все 2 случая с гетерозиготной миссенс-мутацией RyR2 имели характеристики тимиколимфатического статуса.Возможно, мутация участвует в гипертрофии тимуса 11 . Множественные аномалии у пациентов с гипертрофией тимуса могут быть вызваны генными мутациями. Тем не менее, какие мутации, мутации одного гена или комбинированные, а также их связь с различными клиническими проявлениями и SUDA, все еще остаются неясными.
Неожиданным открытием стала корреляция между надпочечниками и тимусом. Вакуолизация коры надпочечников чаще проявляется у пациентов с гипертрофией тимуса с SUDA, чем у пациентов без SUDA, однако нет разницы между SUDA с гипертрофией тимуса и без него.Поэтому мы предпочитаем это изменение, связанное с SUDA, а не комбинированную аномалию гипертрофии тимуса. Было задокументировано, что вакуолизация, по-видимому, указывает на гиперактивность желез к выработке гормонов, а ось гипоталамус-гипофиз-надпочечники может реагировать на стресс увеличением выработки кортизола 12 . Уменьшение массы надпочечников с истончением коры и тимомегалией с гиперплазией коры тимуса наблюдалось при внезапной детской смерти. Гипофункция коры надпочечников косвенно подтверждена наличием тимомегалии.Длительный дефицит глюкокортикоидов при вторичном гипокортицизме может вызвать внезапную смерть по незначительным экологическим причинам 13 . В настоящем исследовании гипоплазия надпочечников была обнаружена у 11 из 56 пациентов с гипертрофией тимуса. Однако у одного пациента с гипертрофией тимуса наблюдалась узловая гиперплазия коры надпочечников, в то время как опухоли надпочечников (аденома надпочечников и феохромоцитома надпочечников) наблюдались у трех пациентов с гипертрофией тимуса, которые не были зарегистрированы.Тимус 27-летнего мужчины, умершего от тромбоза коронарной артерии и сопровождавшегося феохромоцитомой надпочечника, весил даже 183 г. Кажется, что развитие и инволюция вилочковой железы тесно связаны с функцией надпочечников и различными гормонами. Влияние сложно и может варьироваться в зависимости от возраста или других состояний организма.
Сообщалось о
SUDA, вызванных острым геморрагическим панкреатитом, диагноз которых нельзя было поставить до вскрытия. Цокос и др. сообщили о 27 случаях острого панкреатита, которые протекали как внезапная неожиданная смерть.Во всех случаях диагноз был впервые поставлен при вскрытии, и большинство пострадавших умерло на очень ранней стадии заболевания 14, 15 . В настоящем исследовании участвовали 6 пациентов, причина смерти которых была связана с острым геморрагическим панкреатитом. Все они были мужчинами в возрасте от 20 до 53 лет. Заметное преобладание мужчин согласуется с исследованием Шетти, в котором соотношение мужчин и женщин из 7 SUDA из-за острого геморрагического панкреатита составляло 6: 1 16 .Мы также обнаружили, что у пациентов с гипертрофией тимуса больше SUDA были вызваны острым геморрагическим панкреатитом, чем без него. До сих пор не было документально подтверждено взаимосвязь между гипертрофией тимуса и острым геморрагическим панкреатитом. Хотя многое было известно о факторах риска, точные триггерные события или патогенез все еще остаются неясными 16 . Местное воспаление, вызванное активацией трипсиногена до трипсина, последующей активацией медиаторов воспаления и высвобождением большого количества кислородных радикалов, играет ключевую роль в некровоспалительном поражении поджелудочной железы 17 .Тимус — специализированный первичный лимфоидный орган иммунной системы. Нарушение функции тимуса может вызвать аномальную воспалительную / иммунную реакцию, что может увеличить риск острого геморрагического панкреатита у пациентов с гипертрофией тимуса. Аналогичным образом, инфекционные заболевания и заболевания, связанные с иммунитетом, являются причиной более высокой доли смертей у пациентов с гипертрофией тимуса, чем у пациентов без нее.
Тимус — сложный эпителиальный орган, состоящий из гетерогенных типов клеток, экспрессирующих разные CK 18 .В этом исследовании маркеров, связанных с SUDA, обнаружено не было. Есть расхождение между нашими результатами по выражению CK и опубликованными ранее 19, 20, 21 . Большинство предыдущих исследований было сосредоточено на тимусах младенцев и детей, и было задокументировано несколько случаев иммуногистохимических исследований вилочковой железы взрослых. Было обнаружено, что на разных стадиях инволюции тимуса наблюдались изменения экспрессии цитокератина в эпителиальных клетках, что может быть связано со старением, снижением пролиферации тимоцитов 19 .С другой стороны, наше исследование показало, что CK демонстрируют совершенно разные паттерны экспрессии у людей, у которых были разные причины смерти и разные фоновые заболевания. Похоже, что морфология и молекулярные характеристики гипертрофированных тимусов у взрослых тесно связаны с состоянием организма. Каждая гипертрофия вилочковой железы имеет свой собственный механизм, который различается у людей со сложными сочетаниями нарушений и / или поражений. Точно так же неудивительно, что Смит не обнаружил лимфоидных фолликулов ни в одном из 100 взрослых тимусов даже с иммунными заболеваниями, тогда как многие другие авторы обнаружили увеличение лимфоидных фолликулов при аутоиммунных заболеваниях у людей 10 .В настоящем исследовании из 5 пациентов с аутоиммунными заболеваниями только один (с болезнью Крона) имел лимфоидные фолликулы в гипертрофическом тимусе. Связь между лимфоидными фолликулами тимуса и связанными с иммунитетом заболеваниями, а также динамическими биомаркерами во время инволюции тимуса и различных болезненных состояний, возможно, потребуются крупномасштабные систематические исследования, особенно на гипертрофических тимусах у взрослых.
Таким образом, взрослые с гипертрофией тимуса имеют значительно повышенный риск SUDA в молодом возрасте.По нашему мнению, вместо болезненного состояния «тимико-лимфатический статус» является систематическая аномалия с гипертрофией тимуса как признак, затрагивающий в основном иммунную и / или сердечно-сосудистую систему, вероятно, вызванный генными мутациями. Развитие и инволюция вилочковой железы может быть связана с функцией эндокринных органов и гормонов. Пациенты с гипертрофией тимуса отличаются разнообразием гистологии, патологических состояний и причин смерти. В большинстве случаев увеличение тимуса невозможно было диагностировать в течение жизни до вскрытия.Как эффективно обследовать это бессимптомное, но потенциально смертельное состояние, остается проблемой. С другой стороны, гипертрофический тимус может использоваться в качестве индикатора некоторых связанных с иммунитетом заболеваний и сердечно-сосудистых заболеваний при клиническом диагнозе.
Тимус | Справочная статья по радиологии
Тимус (во множественном числе: тимус) — лимфоидный орган, продуцирующий Т-клетки, в переднем средостении, который играет роль в развитии иммунной системы, в частности, созревании Т-клеток.Обычно он располагается загрудинно и, следовательно, может имитировать загрудинную патологию.
В младенчестве он относительно велик (весит 25 г при рождении), значительно вырастает сразу после рождения и достигает максимального веса в подростковом возрасте между 12 и 19 годами (35 г). С возрастом (от 20 до 60 лет) он постепенно инвертируется с прогрессирующей жировой заменой клеточных компонентов (15 г в возрасте 60 лет). Жировозамещение начинается в период полового созревания и происходит быстрее у мужчин, чем у женщин.Размер пациентов может сильно различаться 3 .
При большом размере он состоит из двух соприкасающихся по средней линии боковых долей, расположенных частично в грудной клетке, частично в шее. Две доли обычно асимметричны по размеру. Иногда они объединяются, образуя единую массу. Иногда их разделяет промежуточная лопасть.
Железа простирается вниз от нижней границы щитовидной железы до четвертого реберного хряща.
Отношения
РЕКЛАМА: Сторонники видят меньше / нет рекламы
- волокна блуждающего нерва
- Симпатические волокна, входящие в вазомоторные кровеносные сосуды
Тимус розовато-серого цвета, мягкий, на поверхности дольчатый.
Эмбриологически происходит от третьего глоточного мешка. Тимус — это первый из лимфоидных органов, который формируется. Значительный рост происходит сразу после рождения в ответ на стимуляцию антигеном и потребность в зрелых Т-клетках. Генетические факторы также влияют на зависимость иммунологической функции тимуса. После атрофии фиброзного жира вилочковая железа может вырасти в любой момент жизни, особенно после периодов стресса.
- различное расположение: эктопическая и / или добавочная ткань тимуса может располагаться в любом месте на пути опускания тимофарингеальных протоков, например.грамм. ретрокавальный, шейный, задний средостение
- переменная форма: например, однолопастные, трехлопастные, X-образные, перевернутые V-образные и т. д.
РЕКЛАМА: Сторонники видят меньше / нет рекламы
Рентгенограмма без изображения
Тимус виден как треугольный парус (знак тимуса), часто справа от средостения. Не оказывает массового воздействия на сосудистые структуры и дыхательные пути. Размер может варьироваться в зависимости от вдохновения.
Ультразвук
обычно относительно однородный фон по эхогенности, подобный или немного меньший, чем у печени и селезенки, с разбросанными гиперэхогенными очагами, напоминающими звездное небо
на его форму могут повлиять / исказить пульсация сердца и дыхательные движения, поскольку он податлив и не должен сжимать или смещать соседние структуры
CT
- обычно однородная плотность мягких тканей, приблизительно 80 HU и изоаттенуирующая к окружающим мышцам
- плавный контур с выпуклыми границами в детстве
- треугольник в зрелом возрасте
- пересекают мелкие кровеносные сосуды
MRI
- обычно демонстрирует артефакт химического сдвига между изображениями в фазе и вне фазы
- Отличить нормальный тимус от гиперпластического может быть сложно, и рекомендации по проведению этого различия и проверке наличия нормального тимуса включают 5 :
- Отсутствие округлых образований мягких тканей> 7 мм
- Отсутствие выпуклого контура вилочковой железы> 19 лет
- Отсутствие дольки мягких тканей
- Отсутствие чрезмерной толщины тимуса (должно быть ≤1.3 см для детей старше 20 лет)
- Отсутствие диагноза, связанного с увеличением или гиперплазией тимуса, например миастения гравис
РЕКЛАМА: Сторонники видят меньше / нет рекламы
История и этимология
«Тимус» в конечном итоге происходит от греческого слова, обозначающего растение «тимьян» θύμος («приносить в жертву»), предположительно потому, что растение было сожжено на жертвенниках. Гален подумал, что вилочковая железа похожа на «бородавчатый нарост» и напоминает пучок растений 7 .
Первое хорошее описание вилочковой железы было записано Беренгариусом в 1524 году.
Молекулярные доказательства редактирования генома в модели иммунодефицита на мышах
Разработка и производство ZFN
ZFN, нацеленных на Prkdc , экзон 85 был разработан путем модульной сборки используя архив белков цинкового пальца. Оптимизированные домены с цинковыми пальцами были связаны с обязательными гетеродимерными доменами Fok I 38 . Гены ZFN были клонированы и первоначально протестированы на плазмидных каркасах pVAX, а затем перенесены на самоинактивирующиеся лентивирусные переносящие плазмиды pCCLsc_S_W (где трансген управляется промотором SFFV, за которым следует посттранскрипционный регуляторный элемент вируса гепатита сурка, WPRE) или pRRLsc_C_W (промотор CMV. и WPRE).
Направляющие конструкции
Были изготовлены две репарационные матрицы Prkdc : (i) классическая длинная конструкция на основе плазмиды pBlueScript, включающая ген neo в области гомологии, и (ii) короткая ПЦР на основе лентивирусного вектора. -усиленный шаблон восстановления с диагностическим сайтом ограничения. Длинная конструкция включала фрагмент Hin dIII размером 7,5 т.п.н., охватывающий Prkdc экзоны 82–86, субклонированный из искусственной хромосомы дрожжей дикого типа (YAC), как было показано ранее, как комплемент к мутации scid в культуре клеток 39 .Кассета neo , экспрессируемая с промотора PGK, была вставлена в интрон 85, в сайт Pml I, что сделало возможным положительный отбор после трансфекции плазмиды, опосредованной фосфатом кальция. Короткую матрицу Prkdc конструировали с помощью ПЦР-амплификации последовательности 1,626 п.н. из геномной ДНК фибробластов мыши Balb / c дикого типа с использованием прямого и обратного праймеров 5′-AATGTTTAGTTTTTATGAGTGTTTTGC-3 ‘и 5’-CAAGCCATCTCTCTAGCCCTAC-3 соответственно. Две молчащие точечные мутации вводили посредством сайт-направленного мутагенеза на 3 и 6 п.н. выше сайта scid для создания диагностического сайта рестрикции Bsa WI (Site-Directed Mutagenesis Kit, Stratagene, США).Короткую матрицу Prkdc клонировали в самоинактивирующиеся лентивирусные векторные плазмиды, которые затем кодировали либо только матрицу Prkdc , либо один мономер ZFN и матрицу Prkdc вместе. Матрицу клонировали выше центральной последовательности полипуринового тракта / центральной терминирующей последовательности (cPPT / cTS) и в обратной ориентации.
Клетки, трансфекция и трансдукция
HEK293T, HeLa, фибробласты дикого типа и scid мыши поддерживали в DMEM со стабильным глутамином и 4.5 г / л глюкозы с добавлением 10% FBS и 1% пенициллина / стрептомицина при 37 ° C и 5% CO 2 . Tert -иммортализованные фибробласты scid , полученные трансдукцией ретровирусным вектором, кодирующим мышиный Tert и пуромицин-ацетилтрансферазу ( pac ), поддерживали аналогичным образом, но в присутствии 3 мкг / мл пуромицина и использовали во всех экспериментах с фибробластами. . HSPC дикого типа и scid были получены из костного мозга промыванием бедренной и большеберцовой костей мышей Balb / cOlaHsd или Balb / cJHan ™ Hsd- Prkdc scid в возрасте от 6 до 8 недель.Lin — HSPC выделяли с использованием набора для истощения клеток линии MACS (Miltenyi Biotec, Германия) в соответствии с указаниями производителя. HSPC культивировали без разделения в 24-луночных планшетах, не обработанных культурой ткани, при 37 ° C и 5% CO 2 , используя бессывороточную среду StemSpan (Stemcell Technologies), содержащую 100 нг / мл мышиного фактора стволовых клеток (SCF ), 100 нг / мл мышиной Fms-родственной тирозинкиназы 3 (Flt-3), 20 нг / мл человеческого интерлейкина-6 (IL-6) и 1% пенициллина / стрептомицина. Трансфекцию фибробластов для экспериментов по редактированию генома проводили с использованием 10 6 клеток / планшет ( n = 3), соосаждения фосфатом кальция и 10 мкг (матричная плазмида в экспериментах по трансфекции / трансдукции) или 30 мкг ДНК (10 мкг каждый при котрансфекции мономера ZFN и матричных плазмид с использованием нерелевантной плазмиды для нормализации общего количества ДНК в контроле).Клетки трансдуцировали IPLV или IDLV в присутствии (HeLa, фибробласты) или в отсутствие (HSPC) 8 мкг / мл полибрена, а затем обрабатывали для анализа или инъекции, как указано. Эксперименты по редактированию генома фибробластов, включающие трансдукцию вектора ZFN и трансфекцию матричной плазмиды, проводили с оптимальной 48-часовой задержкой перед последним проведением. 800 мкг / мл G418, добавленного через 48 часов после трансфекции, использовали для отбора, и колонии либо окрашивали кристаллическим фиолетовым для подсчета 9 дней после трансфекции, либо собирали и размножали для ПЦР-анализа редактирования гена Prkdc .
Производство лентивирусных векторов
Лентивирусные векторы третьего поколения получали, как описано 40,41 . Вкратце, клетки HEK293T котрансфицировали четырьмя плазмидами путем осаждения фосфатом кальция при молярном соотношении 1: 1: 1: 2 (упаковка: оборот: оболочка: перенос). Для IPLV упаковывающей плазмидой была pMDLg / pRRE, а для IDLV — pMDLg / pRRE-intD64V 41 . Rev доставляли на pRSV-rev, и векторы были псевдотипированы белком VSV-G с использованием плазмиды pMD2.VSV-G. Плазмиды для переноса кодировали либо только короткую матрицу Prkdc , либо один из двух мономеров ZFN, либо матрицу и один из мономеров. Векторные частицы концентрировали ультрацентрифугированием и титровали с помощью ПЦР в реальном времени с использованием трансдукций клеток HeLa 41 .
Вестерн-блот
Клетки гомогенизировали в буфере для лизиса RIPA, содержащем ингибиторы протеаз и фосфатаз. Концентрации белка определяли с помощью анализа белка DC (Bio-Rad), и белки анализировали в гелях с градиентом акриламида 5–12%.Для обнаружения эпитопа FLAG перенесенную мембрану инкубировали с мышиным моноклональным антителом против FLAG M2 (Stratagene, Великобритания) в разведении 1: 1000 с использованием козьих антимышей IRDye® 800CW (Li-cor GmbH, Германия) в разведении 1: 2000. как вторичное антитело. Для контроля загрузки в качестве первичного антитела использовали кроличий поликлональный анти-α-тубулин (Abcam, Великобритания) в разведении 1: 2000, а затем козий анти-кроличий антитело Alexa Fluor® 680 (Invitrogen, США) в разведении 1: 5000 в качестве вторичного антитела. Блоты сканировали на каналах 700 и 800 нм на наличие α-тубулина и анти-FLAG, соответственно, с использованием имидж-сканера Odyssey (Li-cor Bioscience, Германия).
Cel -I assay
Индели, индуцированные ZFN, были обнаружены с использованием набора для обнаружения мутаций SURVEYOR (Transgenomic, США), как описано ранее 42 . На 3 день после трансдукции геномную ДНК из 1 × 10 6 фибробластов scid или HSPC, обработанных ложным или ZFN, экстрагировали с помощью набора DNeasy (Qiagen, Германия) и амплифицировали с помощью ПЦР с использованием прямого и обратного праймеров 5′- GCAGACAATGCTGAGAAAAGG-3 ‘и 5′-GCACAAAACAGACAAGGGTGT-3’ соответственно.Условия термоциклирования были следующими: 95 ° C, 5 мин; 95 ° C, 30 с, 60 ° C, 30 с и 68 ° C, 40 с для 35 циклов; и последняя стадия удлинения 68 ° C в течение 2 мин. Продукт ПЦР денатурировали, давали возможность повторно отжигать и обрабатывали в соответствии с инструкциями набора Surveyor. Конечные продукты анализировали электрофорезом в полиакриламидном геле для оценки индуцированных ZFN инделей с использованием программного обеспечения Image J / V2 для количественной оценки интенсивности полос.
ПЦР-скрининг на основанное на плазмиде редактирование гена
Prkdc
После трансфекции плазмиды или лентивирусной трансдукции / плазмидной трансфекции генов мономера ZFN и длинной целевой матрицы Prkdc-neo колонии, устойчивые к G418, были подвергнуты скринингу изнутри наружу. Стратегия ПЦР.Геномную ДНК экстрагировали с помощью набора DNeasy ® (Qiagen). Прямой праймер (5′-TCGCCTTCTTGACGAGTTCT-3 ‘) гибридизировался в кассете neo , тогда как обратный праймер (5′-TTTTCCCCCTCATGTCACTC-3′) был направлен на геномную ДНК Prkdc ниже правого плеча гомологии матрицы. Длина ампликона составляла 1335 п.н. Для ПЦР-амплификации готовили 50 мкл реакционной смеси, содержащей 10 мкл реакционного буфера 5X GoTaq ® (Promega, UK), 1,5 мкл 10 мМ dNTP, 4 мкл 25 мМ MgCl 2, мкл.5 мкл 10 мкМ каждого прямого и обратного праймера, 200 нг ДНК-матрицы и 0,5 мкл 5 мкл / мкл ДНК-полимеразы GoTaq. Условия термоциклирования: начальная денатурация при 95 ° C в течение 2 минут, затем 35 циклов при 95 ° C в течение 45 секунд, 59 ° C в течение 60 секунд, 72 ° C в течение 30 секунд, с последующим окончательным удлинением при 72 ° C в течение 5 мин. Продукты ПЦР очищали с использованием набора для очистки ПЦР (Qiagen) и расщепляли рестрикционными ферментами, которые, как предполагается, разрезают ампликоны.
Bsa WI assay
Редактирование гена Prkdc измеряли с помощью гель-анализа, как описано ранее 26 .Вкратце, геномная ДНК из фибробластов scid или HSPC, обработанных ложным или ZFN / матрицей, экстрагировалась с использованием набора DNeasy (Qiagen, Германия) и 100 нг подвергались ПЦР с использованием праймеров, внешних по отношению к матрице Prkdc (вперед 5′- AACAATCCTCCTCCGAACCT-3 ‘и обратный 5′-TGGAGGTGGAAGAACCAAAC-3’). Условия термоциклирования были следующими: 95 ° C, 30 с; 95 ° C, 30 с, 59 ° C, 60 с и 65 ° C, 75 с для 35 циклов; и последняя стадия удлинения при 65 ° C в течение 10 мин. Продукты ПЦР расщепляли в течение ночи с помощью Bsa WI (NEB, UK) и разделяли на 0.7% агарозный гель. ДНК переносили в течение ночи на мембрану GeneScreen Plus (Perkin Elmer, США), гибридизовали в течение ночи, используя в качестве зонда [α-32P] -ATP, меченую матрицу Prkdc , промывали и подвергали скринингу с фосфорно-визуализатором. Экран сканировали с использованием Typhon-8600 (Amersham Pharmacia Biotech, UK) и количественно определяли полосы с использованием программного обеспечения Image J / V2 26 .
Анализ ДНК-PKcs
Систему анализа ДНК-зависимых протеинкиназ SignaTECT (Promega, США) использовали, как описано ранее 27 .Ядерные белки из фибробластов scid , трансдуцированных ложно или ZFN / матрицей, экстрагировали с использованием набора CelLytic Nuclear Extraction (Sigma Aldrich, США) и обрабатывали в соответствии с инструкциями системы SignaTECT. Биотинилированные пептидные субстраты захватывали путем нанесения реакционных пятен на отдельные квадраты захватывающей мембраны с высокой связывающей способностью. После нескольких промывок мембраны активность ДНК-ПК определяли количественно с использованием вышеуказанной системы фосфо-визуализации.
Анализ МТТ
Жизнеспособность клеток определяли с помощью анализа МТТ, как описано ранее 43 .Фибробласты дикого типа и scid подвергали воздействию увеличивающихся концентраций мелфалана в течение 1 часа, промывали и затем культивировали в течение следующих 5 дней. Затем клетки подвергали воздействию тетразолиевой соли МТТ в течение 4 ч при 37 ° C, и образование формазана измеряли при 560 нм с использованием считывающего устройства для микропланшетов (Promega, США). Для отбора была выбрана концентрация, дающая максимальное различие между жизнеспособностью фибробластов дикого типа и scid . Все значения являются средними значениями 3 независимых экспериментов, каждый из которых проводился в двух экземплярах.
Анализ колониеобразующих единиц (КОЕ)
10 5 фиктивных или трансдуцированных ZFN / матрицей фибробластов scid культивировали в присутствии 10 мкМ мелфалана (оптимальная доза, определенная с помощью анализа МТТ) в течение 1 ч, и лечение повторяли один раз в неделю в течение трех недель до образования колоний. Колонии либо окрашивали кристаллическим фиолетовым и подсчитывали, либо объединяли для анализа с использованием анализа для редактирования генов Bsa WI; n = 3.
Анализ глубокого секвенирования
Глубокое секвенирование выполняли с использованием системы MiSeq (Illumina, San Diego CA).Были сконструированы конкретные пары праймеров (дополнительная таблица 3), каждая из которых амплифицировала фрагменты размером 100-200 п.н., охватывающие целевой сайт или один из прогнозируемых 10 предполагаемых нецелевых сайтов (дополнительная таблица 3), и каждая включала последовательности адаптеров для обработки MiSeq. Вкратце, образцы геномной ДНК первоначально были амплифицированы с использованием праймеров, перечисленных в дополнительной таблице 3, затем была проведена ПЦР с вложенным адаптером с использованием праймеров, перечисленных в сноске к дополнительной таблице 3. После амплификации продукты ПЦР были закодированы с помощью 14-цикловой ПЦР со штрих-кодом. .Продукты ПЦР со штрих-кодом очищали с использованием набора для очистки ПЦР (Qiagen), объединяли и секвенировали с использованием платформы Illumina MiSeq. Написанный на заказ компьютерный сценарий использовался для извлечения «считываний высококачественной последовательности» на основе их сопоставления с последовательностью шаблона дикого типа. Последовательности, которые содержали делецию или вставку, приводящую к более коротким или более длинным ампликонам, которые включают любое основание в сайте расщепления ZFN, были классифицированы как NHEJ-опосредованная делеция или вставка, соответственно; вместе такие мутации классифицируются как «инделы».Последовательности с ожидаемыми изменениями (3 замены, 1 для сайта дикого типа и 2 для нового сайта Bsa WI (рис. 1a) были классифицированы как «исправленные».
Трансплантация HSPC
Все процедуры эксперимента были одобрены институциональными исследованиями Комитет по этике (Институт здоровья детей, Университетский колледж Лондона, Великобритания) и выполнялся в соответствии с законодательством Министерства внутренних дел Великобритании о защите животных. Для первичной трансплантации клетки собирали через 16 часов после трансдукции, дважды промывали в фосфатно-солевом буфере (PBS) и ресуспендировали в PBS.Самок мышей BALB / cJHan ™ Hsd- Prkdc scid подвергали сублетальному облучению (2,5 Гр), а затем трансплантировали ~ 1 × 10 6 мужских клеток в 200 мкл PBS путем инъекции в хвостовую вену ( n = 5). на группу трансплантата; дополнительная таблица 1). Для вторичной трансплантации через 32 недели после первичной трансплантации был выделен цельный костный мозг контрольных мышей и мышей-респондентов и ~ 1 × 10 6 клеток трансплантировали путем инъекции в хвостовую вену самкам мышей Balb / cJHan ™ Hsd- Prkdc scid . ранее сублетально облученные (2.5 Гр; n = 2 для трансплантата дикого типа, n = 3 для трансплантата IPLV-eGFP, n = 4 для групп IPLV-ZFN и IDLV-ZFN). Образцы крови собирали через разные промежутки времени путем взятия хвостовой вены. Таблица 2 включает животных, по которым доступны молекулярные данные.
Приживление клеток и измерение числа копий вектора
Приживление клеток мужского пола, полученных из донора, у самок мышей-реципиентов рассчитывали по стандартной кривой с известным процентом мужской ДНК, выделенной из костного мозга мышей-самцов C57 Balb / c.ДНК экстрагировали с помощью набора Qiagen DNeasy®. Определяющий пол участок длиной 102 п.н. ( Sry ) на Y-хромосоме амплифицировали с помощью кПЦР с использованием праймеров прямого 5′-TCATCGGAGGGCTAAAGTGTCAC-3 ‘и обратного 5′-TGGCATGTGGGTTCCTGTCC-3’. Условия термоциклирования были следующими: 95 ° C в течение 10 минут, 40 циклов при 95 ° C в течение 15 с, 60 ° C в течение 20 секунд, 72 ° C в течение 20 секунд. В конце был проведен анализ кривой плавления при постоянном считывании от 50 до 100 ° C. Титин использовали в качестве контрольного гена для нормализации общего количества клеток.qPCR проводили с использованием праймеров прямого 5′-AAAACGAGCAGTGACGTGAGC-3 ‘и обратного 5′-TTCAGTCATGCTGCTAGCGC-3’. Условия цикла были следующими: 95 ° C в течение 10 минут, 40 циклов при 95 ° C в течение 15 секунд, 60 ° C в течение 60 секунд, 72 ° C в течение 15 секунд, с последующим анализом кривой плавления.
Для анализа числа событий интеграции вектора (числа копий вектора) ДНК получали с использованием набора DNeasy (Qiagen) в соответствии с инструкциями производителя. Вектор-специфичный WPRE амплифицировали с прямым праймером 5′-TGGATTCTGCGCGGGA-3 ‘и обратным 5′-GAAGGAAGGTCCGCTGGATT-3′ с зондом 5’-FAM-CTTCTGCTACGTCCCTTCGGCCCT-TAMRA-3 ‘(Eurofins).Число копий WPRE нормализовали относительно продукта ПЦР мышиного , тайтина , экзона 5, который амплифицировали с праймерами, описанными выше, с добавлением зонда 5′-FAM-TGCACGGAAGCGTCTCGTCTCAGTC-TAMRA-3 ‘(Eurofins) для количественной оценки. ПЦР в реальном времени выполняли на образцах и стандартах плазмид, которые содержали оба гена-мишени, с использованием 2 мкл ДНК, 1x Taqman Universal Mastermix (Applied Biosystems), 900 нМ каждого из прямых и обратных праймеров и 200 нМ FAM-меченого зонда в 20 мкл реакции (в трех экземплярах) и анализировали с использованием системы ПЦР в реальном времени ABI Prism 7000 (Applied Biosystems, Калифорния, США).
Анализ проточной цитометрии
Мононуклеарные клетки периферической крови метили антителом против CD3-PECy7 (или Тихоокеанского синего), антителом против CD4-PE мыши или против CD8-APC мыши. Данные проточной цитометрии получали с помощью CyAn ADP (Beckman Coulter, США) и анализировали с помощью программного обеспечения FlowJo (TreeStar Inc, Ashland, OR, США).
Анализ пролиферации Т-клеток с помощью анализа разбавления CFSE
Спленоциты CD3 Т-клеток очищали магнитным захватом и инкубировали в RPMI-1640 (Sigma) с добавлением 100 МЕ / мл пенициллина, 100 мкг / мл стрептомицина, 2 мМ L- глутамин, 0.01 M Hepes, 50 мкМ 2-β-меркаптоэтанола (Gibco-Invitrogen), 10% инактивированной нагреванием FCS (EuroClone, Великобритания), с добавлением 1 мкМ CFSE (Celltrace, Invitrogen). Эффективность окрашивания CFSE превышала 99%. Затем меченные CFSE клетки инкубировали в присутствии 3 мкл / мл ConA (Sigma) и 100 МЕ / мл IL-2 (R&D Systems) или 0,5 мкл мышиного CD3 / CD28 T Expander (Dynal Biotech, Invitrogen) и 100 МЕ / мл / мл ИЛ-2. Через 72 часа размноженные клетки метили анти-CD3-PE (клон 145–2C11; BD Pharmingen). Разбавление CFSE в популяции Т-клеток измеряли проточной цитометрией с использованием анализатора клеток LSR Fortessa (Becton Dickinson), работающего с программным обеспечением FACSDiva, и данные обрабатывали с помощью программного обеспечения FlowJo (TreeStar Inc, Ashland, OR, США).
Доступность данных
Наборы данных, созданные в ходе текущего исследования, включены в эту опубликованную статью (и ее файлы с дополнительной информацией) или доступны у соответствующего автора по разумному запросу.
Генетическая и эпигенетическая эволюция как фактор, способствующий лейкемогенезу мутантов WT1
Автор связывает открытую накладную панельElodiePronier 1, 2 Роберт Боуман 1, 2 JihaeAhn 1, 2 Jacob 2 CyriacKandoth 1, 2, 3, 4 Тиффани Р.Мерлински 1, 2 Джастин Т. Уитфилд 1, 2 Бенджамин Х. Дарем 1 Антуан Грут 2 Амрита Варшини Ханасог Сомасундара 1, 5 Ричард П.Коче 2 Барри С. Тейлор 1, 2, 3, 4 Росс Л. Левин 1, 2, 5, 6, 7 , Подробнее https://doi.org / 10.1182 / blood-2018-03-837468Права и содержание
Abstract
Генетические исследования выявили повторяющиеся соматические мутации у пациентов с острым миелоидным лейкозом (ОМЛ), в том числе в гене опухоли Вильмса 1 ( WT1 ). Молекулярные механизмы, с помощью которых мутации WT1 способствуют лейкемогенезу, еще полностью не выяснены. Мы исследовали роль дозировки гена Wt1 в стационарном и патологическом гематопоэзе. Wt1 гетерозиготная потеря усиливала самообновление стволовых клеток в зависимости от возраста, что со временем усиливало функцию стволовых клеток и приводило к возрастной лейкемической трансформации. Wt1 -гаплонедостаточные лейкозы характеризовались прогрессирующими генетическими и эпигенетическими изменениями, в том числе известными аллелями, ассоциированными с лейкемией, что демонстрирует потребность в дополнительных событиях, способствующих гематопоэтической трансформации. В соответствии с этим наблюдением мы обнаружили, что истощение Wt1 кооперируется с мутацией Flt3-ITD , чтобы вызвать полностью пенетрантный AML. Наши исследования обеспечивают понимание механизмов лейкемогенеза с потерей Wt1 и эволюционных событий, необходимых для индукции трансформации Wt1 -гаплонедостаточных стволовых клеток / клеток-предшественников.
Рекомендуемые статьи Цитирующие статьи (0)
Авторское право © 2018 Американское гематологическое общество
Рекомендуемые статьи
Цитирующие статьи
Синдром циклической рвоты у детей
Волосовец А.П. Ацетонемический синдром у детей: современный взгляд на проблему / А.П. Волосовец, С.П. Кривопустов, А.Н. Кожина, Е. Щербинская // Здоровье ребенка. — 2009. — №6 (21). — С. 76–81.
Квашнина Л.В Нейроартритическая аномалия конституции, нарушения пуринового обмена и ацетонемический синдром у детей / Л. В. Квашнина, Н. Б. Евграфова // Доктор. — 2003. — №3. —С. 79–82.
Курило Л. В. Ацетонемический синдром: болезнь или образ жизни? / Л. В. Курило // Здоровье Украины. — 2008. — №10. — С. 34–35
.
УНИФИКОВАНИ КЛИНИЧНИ ПРОТОКОЛИ МЕДИЧНОЙ ДОПОМОГИ ДИТЯМ Из захворюван нями организаций травлення », утверждени Наказом Министерства охорони здоровья України вид 29.01.2013 г. — № 59.
Оказание стационарной помощи детям. Руководство по ведению наиболее распространенных заболеваний в условиях ограниченных ресурсов: Карманный справочник. — Всемирная организация здравоохранения, 2006. — С. 179.
.
Боулс Р., Ито М: Вариации последовательности контрольной области митохондриальной ДНК при синдроме циклической рвоты с нервно-мышечным заболеванием / Р. Боулс, С. Ле, А. Маслим, К. Адамс, Б. Ли, Т. Хигашимото, 2002 (представлено) .
Стенд I. Рекомендации по составу перорального раствора регидратации от детей Европы. Отчет рабочей группы ESPGAN / I. Booth, R. Cunha Ferreira, J.F. Desjeux // J. Pediatr. Гастроэнтерол. Nutr. — 1992. — Т. 14. — С. 113–115.
Brown J. Рецидивирующая рвота у детей. Клинические перспективы / Дж. Браун, Б. Ли // Гастроэнтерология 5,: 2002. С. 35-39.
Дроссман Д.А. Функциональные расстройства желудочно-кишечного тракта.Диагностика, патофизиология и лечение. Многонациональный консенсус. Маленький, коричневый и компания. Бостон / Нью-Йорк / Торонто / Лондон, 1994, 370 с.
Ли Б.У.К., Ховард Дж. CME: Новая надежда для детей с синдромом циклической рвоты / Б.У.К. Ли., Дж. Ховард // Современная педиатрия. — 2002. — № 3. — Р. 121.
Фактор транскрипции Ets-1 необходим для развития естественных клеток-киллеров у мышей
Ссылки
3 апреля 1992 г. · Cell · HR RodewaldE L Reinherz
1 января 1992 г. · Ежегодный обзор иммунологии · YY YuM Bennett
12 июля 1991 · Наука · NS LiaoD Raulet
3 ноября 1989 · Наука · C OhlénK Kärre
20 февраля 1986 · Природа · K KärreR Kiessling
16 ноября 1995 · Природа · JE Gumperz, P Parham
1 августа 1994 г. · Журнал экспериментальной медицины · MJ SánchezJ H Phillips
19 октября 1995 г. · Nature · JC BoriesF W Alt
19 октября 1995 г. · Nature · N MuthusamyJ M Leiden
17 января 1995 г. · Труды Национальной академии наук Соединенных Штатов Америки · JP DiSantoK Rajewsky
7 октября 1994 · Cell · K GeorgopoulosA Sharpe
15 сентября 1993 · Журнал Национального института рака · WJ MurphyD L Longo
1 мая 1996 г. · Иммунитет · J MagramM K Gately
1 апр. , 1996 · Текущее мнение в иммунологии · JC Zúñiga-Pflücker, MJ Lenardo
1 января 1996 г. · Иммунологические исследования · TA MooreV Kumar
1 февраля 1997 г. · Текущее мнение в иммунологии · CA Biron
3 февраля 1997 г. Журнал экспериментальной медицины · H SuzukiT W Mak
1 марта 1997 г. · Журнал клинических исследований · WE CarsonM A Caligiuri
1 апреля 1997 г. · Текущее мнение в области клеточной биологии · D Qian, A Weiss
1 июня 1997 г. · Иммунитет · PJ Leibson
21 июля 1997 г. · The Journal of Experimental Medicine · JR CarlyleJ C Zúñiga-Pflücker
7 апреля 1998 г. · Иммунитет · K TakedaS Akira
Цитирования
4 июля 2001 г. · European Журнал иммунологии · EE RosmarakiJ P Di Santo
10 февраля 2000 г. · Семинары Springer по иммунопатологии · JD FarrarK M Murphy
5 августа 2003 г. · Международный журнал гематологии · Акира Сибуя
7 мая 2003 г. · Международный журнал гематологии · Джон Д. Шонесси
90 002 13 февраля 2008 г. · Иммунологические исследования · Маркус Д. Боос-Барбара Л. Ки
22 марта 2005 г. · Biochimica Et Biophysica Acta · Свапнил В. Вайдья, Порунеллор А. Мэтью
17 октября 2001 г. · Иммунология развития и сравнительная иммунология · Д. Р. Барреда, М. Белозевич
17 октября 2001 г. · Экспериментальная гематология · JS Miller
1 февраля 2003 г. · Джин · Цунэюки Оикава, Тосиюки Ямада
19 декабря 2001 г. · Сотовая сигнализация · Кнут Мартин Торгерсен Иммунология · M BusslingerA G Rolink
30 ноября 2002 г. · Семинары по иммунологии · Ребекка Х. Лиан, Виней Кумар
26 ноября 2003 г. · Международный журнал биохимии и клеточной биологии · E LelièvreB Vandenbunder
13 июня 2008 г. · Гены и иммунитет · A AwasthiS Malarkannan
15 сентября 2009 г. · Иммунология природы · Дункан М. ГаскойнХью JM Brady
11 мая 2004 г. · Природа Имму nology · Тэцуя ЯмагатаКристоф Бенуа
2 ноября 2004 г. · Nature Reviews.Иммунология · Лори Х. ГлимчерГрэм М. Лорд
19 ноября 2005 г. · Смерть и дифференциация клеток · V LulliG Marziali
6 сентября 2006 г. · Исследования клеток · Цзин Де Чжусуэ Бяо Яо
25 января 2003 г. · Скандинавский журнал иммунологии · K Koskela, O Lassila
31 августа 2010 г. · Журнал биологической химии · Дэвид ХорстТоуиа Либерманн
10 декабря 1999 г. · Журнал экспериментальной медицины · T KaishoS Akira
10 декабря 1999 г. · Журнал экспериментальной медицины · Т. Икава Кацура
25 февраля 2005 г. · Журнал экспериментальной медицины · Роланд Греннингло Хо
12 апреля 2006 г. · Журнал экспериментальной медицины Аарон Г. Фрейд Майкл Калиджури
25 апреля 2007 г. · Журнал экспериментальной медицины Медицина · Маркус Д. БоосБарбара Л. Ки
31 октября 2007 г. · Журнал экспериментальной медицины · Жак Мойзани-Ченг Хо
18 ноября 2009 г. · Журнал экспериментальной медицины · Моника ЗамишРеми Босселут
10 декабря 2009 г. · The Журнал экспериментальной медицины · Shintaro KamizonoTak W Mak
30 ноября 2011 г. · Журнал экспериментальной медицины · Натали А. Безман, Льюис Л. Ланье,
29 марта 2012 г. · Журналы геронтологии.Серия A, Биологические и медицинские науки · Шоко НогусаЭлизабет М. Гарднер
28 ноября 2009 г. · Молекулярная генетика человека · Маоцин ЕПол Гроссфельд
23 октября 2004 г. · Исследования нуклеиновых кислот · Питер Холленхорст Барбара Дж. Грейвс
24 октября 2009 г. · Исследования нуклеиновых кислот · Алексис Ванденбон, Кента Накаи
10 июня 2004 г. · Иммунология и клеточная биология · Маргарет А. Джордан Алан Дж. Бакстер
7 марта 2007 г. · Молекулярная и клеточная биология · Цукаса Хигучи Деметри Д. Спиропулос
14 декабря 1999 г. и клеточная биология · TL GoetzB J Graves
14 декабря 1999 г. · Молекулярная и клеточная биология · TL GuN A Speck
16 декабря 2003 г. · Молекулярная и клеточная биология · Jun LuKatya Ravid
3 июня 2000 г. · Ежегодный обзор иммунологии · KM MurphyT L Murphy
26 декабря 2002 г. · Ежегодный обзор иммунологии · Susanne J SzaboLaurie H Glimcher
23 марта 2004 г. · Ежегодный обзор иммунологии · Wayne M YokoyamaAnthony R French
18 марта 2005 г. · Ежегодный обзор иммунологии · Эллен В. Ротенберг, Том Тагон
23 марта 2006 г. · Ежегодный обзор иммунологии · Бьянка Блом, Херген Спитс
23 марта 2006 г. · Ежегодный обзор иммунологии · Джеймс П. Ди Санто
11 мая 2010 г. · Журнал онкологии · Питер Оттген
11 мая 2010 г. · Артериосклероз, тромбоз и сосудистая биология · Ионела Якобас, Карен К. Хирши,
31 июля 2010 г. · Артериосклероз, тромбоз и биология сосудов , 2011 · Артериосклероз, тромбоз и биология сосудов · Mariela SivinaH Daniel Lacorazza
УЗИ вилочковой железы: методика, нормы
Сложная система организма человека — иммунная.Она отвечает за все процессы, происходящие с человеком с момента его рождения до его смерти. Если в системе есть какие-то сбои, это обязательно сказывается на состоянии здоровья. УЗИ вилочковой железы позволит выявить возможные проблемы с этой частью иммунной системы и вовремя устранить их.
Тимус «Няня»
Здоровье — самое главное богатство человека. В организме существует целая система, которая следит за тем, чтобы вовремя убирать ненужных «гостей» в виде вирусов, бактерий, «плохих» клеток, несущих проблемы и болезни.Огромную роль в иммунной системе играет вилочковая железа — вилочковая железа. Если есть проблемы в работе этого органа, следует сделать УЗИ вилочковой железы. Показания к такой процедуре — отклонения в самочувствии человека.
Тимус — это своеобразный инкубатор, где на свету появляются, растут, изучают дальнейшую работу Т-клеток иммунной системы. Так что вилочковая железа — это своего рода няня для важнейшего компонента защитной системы человеческого организма.
Т-клетки безопасности
Т-клетки, выращенные в тимусе (Т-лимфоциты), играют очень важную роль для здоровья человека.В процессе своего развития они делятся на несколько групп, две из которых — Т-хелперы и Т-клетки-киллеры. Кроме того, вилочковая железа производит определенные лимфоциты, распознающие липидные антигены. Их роли хоть и разные, но они друг без друга никуда. Т-хелперы (хелперы) помогают распознать опасность в виде антигенов, заставляя организм активно реагировать на такое вторжение. Т-клетки-киллеры (киллеры) охотятся за поврежденными клетками организма и уничтожают их. Т-супрессоры, а тимус отвечает за производство этих клеток, и они регулируют иммунный ответ организма на работу других Т-клеток.
Тимус и здоровье ребенка
Все органы и системы человеческого тела закладываются во время беременности. Вилочковая железа появляется и начинает развиваться примерно с 6 недели беременности. Но даже после рождения маленького человечка этот важный орган не останавливается в своем развитии. Примерно к 14 годам, то есть до полового созревания, развивается вилочковая железа.
УЗИ вилочковой железы у детей позволяет выявить возможные патологии ее развития, предотвратить проблемы со здоровьем.Для годовалой крохи этот орган служит основной защитой от патогенных микроорганизмов, которые пытаются навредить малышу. С развитием всех систем организма роль вилочковой железы у детей младшего и среднего возраста не уменьшается, он по-прежнему производит Т-клетки для здоровья. Бывает, что вилочковая железа у новорожденных имеет увеличенные размеры, может отсутствовать вовсе или быть патологически маленькой, что негативно сказывается на иммунной системе ребенка в целом. Именно поэтому так важно своевременно провести УЗИ вилочковой железы у малыша.
Тимус у взрослых
После наступления полового созревания активность вилочковой железы постепенно отмирает, и к старости максимально сокращается. И сама вилочковая железа тоже претерпевает непроизвольные изменения — в возрасте 75-80 лет практически полностью замещается соединительной и жировой тканью, приобретая желтоватый цвет.
Почему перестает работать вилочковая железа?
Тимус — неотъемлемая часть иммунной и эндокринной систем организма. С возрастом все органы и ткани претерпевают неблагоприятные изменения, что активно отражается на вилочковой железе.Поэтому оно перестает развиваться, хотя работает всю жизнь человека в регрессивном порядке. Если провести УЗИ вилочковой железы у взрослых, вы увидите изменение ткани органа с постепенным замещением стромы и жира и значительным уменьшением в размерах.
К чему может привести патология вилочковой железы?
Неправильное развитие вилочковой железы, нарушение ее функций негативно сказывается на здоровье человека, особенно ребенка. Иногда бывает, что малыш рождается без этого важного органа или с недоразвитым тимусом.Тогда ребенку грозит большая опасность — здоровью и жизни крохи угрожают вирусные и бактериальные инфекции, аутоиммунные заболевания и новообразования. Однако к тем же проблемам приводит угашение функции вилочковой железы у взрослого человека. УЗИ вилочковой железы — адекватный метод своевременного распознавания ее патологий.
Что такое УЗИ вилочковой железы?
Существует несколько методов исследования состояния тимуса — рентгенография, томография, УЗИ. Самый популярный и доступный способ обследования этого органа — УЗИ вилочковой железы.Что это за опрос? Ультразвуковая диагностика позволяет щадящим методом исследовать необходимые и доступные для данного варианта исследуемые органы. Во время процедуры выявляются патологии размеров вилочковой железы, его тканей, а также локализации. Это позволяет получить достоверную информацию о работе вилочковой железы, а также назначить дополнительные методы обследования, если какие-либо параметры отличаются от нормы. Комплексное обследование работы важной иммунной системы человека поможет предотвратить развитие серьезных осложнений.
Симптомы проблемы с тимусом
Одна из патологий, которая хорошо видна при проведении ультразвуковой диагностики, — тимомегалия. Это называется увеличением размеров вилочковой железы. В принципе вилочковая железа у детей делится на два отдела — шейный и грудной, хотя у взрослых шейный сегмент вилочковой железы полностью отсутствует. Увеличение вилочковой железы, как и его отсутствие, приводит к серьезным проблемам со здоровьем. Симптомы проблем с работой и развитием вилочковой железы следующие:
- нарушение иммунной системы, ребенок очень часто болеет;
- понижение артериального давления — гипотония;
- тахикардия — нарушение ритмической работы сердца;
- Дисплазия половых органов как у мальчиков, так и у девочек;
- крипторхизм;
- ожирение;
- гипергидроз — потливость;
- субфебрильная температура, которая держится долго;
- ребенок может кашлять без причины;
- на груди виден капиллярный узор.
Проявление этих симптомов, как вместе, так и по отдельности, требует направления к специалисту. Врач назначит комплекс необходимых анализов и исследований для обследования малыша, в том числе УЗИ вилочковой железы.
Как проводится УЗИ вилочковой железы у детей и взрослых?
При подозрении на патологию развития вилочковой железы ребенку назначается обследование, включающее ультразвуковое исследование органа. Делать УЗИ вилочковой железы ребенку необходимо по рекомендации врача, не отклоняясь от данного вида исследования.Для детей разного возраста методика проведения этого опроса будет немного отличаться. Обязательное обследование по определенным показаниям следует проводить как можно скорее.
Доступен и основной метод — УЗИ вилочковой железы. Особенности процедуры соответствуют возрасту пациента. Итак, если ребенок еще слишком мал, ему еще нет 9 месяцев, то его следует уложить на медицинскую кушетку на спину, слегка запрокинув голову назад. Для удобства процедуры под шею малыша следует подложить специальную узкую подушечку или валик, скрученный из обычного подгузника.
Если ребенок уже хорошо сидит, а ему больше 9 месяцев, то его можно сажать на исследования. Дети в возрасте от полутора до двух лет могут проходить УЗИ вилочковой железы стоя. Взрослые проходят диагностику вилочковой железы либо лежа, либо стоя. Гонка на время длится недолго, но может потребовать дополнительных методов и областей исследования. Однако УЗИ вилочковой железы, методика которого уже тщательно разработана, позволяет получить достаточно четкую информацию об этом органе.
Норма и отклонения
Тимус наиболее активен в период детства человека. У новорожденного он имеет вес 15-17 грамм, а размеры в пределах 4-5 см при толщине 6 мм. В начале полового созревания, когда вилочковая железа прекращает свое развитие, его масса должна составлять от 28 до 34 граммов, а размер — от 7,5 до 16 сантиметров.
Методика обследования позволяет определить расположение вилочковой железы, ее размер по трехмерной системе, а также структуру ткани.При тех же параметрах рассчитывается масса тимуса по специальной методике и соответствующие коэффициенты.
У детей вес этого органа более 30 граммов считается увеличенным. Подсчет массы тимуса специалистом по определенным методикам позволяет ему понять, нужно ли дальнейшее обследование другими способами или ребенок развивается в пределах нормы.
Норма — это среднестатистическая наука, установленная научными размерами: высотой, шириной и длиной вилочковой железы, а также ее массой.Таким образом, вес вилочковой железы должен соответствовать в среднем 0,18-0,38% от массы тела ребенка. Изменение параметров в ту или иную сторону требует дополнительных методов диагностики. УЗИ вилочковой железы у детей позволяет изучить консистенцию тканей, составляющих тело вилочковой железы, чтобы вовремя выявить возможные новообразования, однако этого недостаточно для получения конкретного результата в этой области ультразвуковой диагностики.
Что делать, если возникла проблема?
Если вы подозреваете проблему с иммунной системой малыша, педиатр обязательно должен назначить УЗИ вилочковой железы.У детей норма размера и веса — главный показатель здоровья вилочковой железы. И если отсутствие этого органа или его недоразвитие требует обязательного медицинского вмешательства в виде гормональной терапии, то вот тимомегалия — увеличение размеров и массы вилочковой железы — чаще всего не требует экстренного вмешательства. Обычно эта проблема возникает к 6 годам, когда вилочковая железа становится такого размера, каким должен быть к возрасту малыша.
Но тем детям, которым поставлен диагноз «тимомегалия», показано регулярное наблюдение, лечебно-профилактические мероприятия в виде лечебной физкультуры, диеты, богатой витамином С и иммуностимулирующими компонентами.При необходимости ребенку назначают гормональную терапию. Способы поддерживающей терапии тимомегалии определяются по степени заболевания — 1, 2 и 3.
Особенностью жизни детей новорожденного, молодого и среднего возраста является регулярная вакцинация. При диагностировании тимомегалии 1 или 2 степени проведение этих профилактических мероприятий допустимо после консультации с педиатром и эндокринологом. Увеличение вилочковой железы на третьем этапе предполагает медицинское руководство от вакцинации.
Метод УЗИ: плюсы и минусы
При обнаружении проблем со здоровьем, особенно у ребенка, необходимо обратиться к врачу. Казалось бы, такие незначительные на первый взгляд отклонения, как частый плач малыша, кашель, потливость, могут быть первыми признаками серьезной проблемы, например, с состоянием иммунной системы и вилочковой железы в частности. Одним из наиболее часто проводимых методов исследования является УЗИ вилочковой железы. Нормы здоровья этого органа определяются в соответствии с возрастом ребенка.А метод ультразвуковой диагностики может выявить реальное состояние вилочковой железы. Как и все методы диагностики, УЗИ имеет свои достоинства и недостатки.
УЗИ с положительной стороны как метод исследования вилочковой железы:
- доступность и техническая простота метода;
- безболезненность;
- неинвазивность;
- высокая точность результатов съемки;
- Разработана методика расчета параметров вилочковой железы при проведении данного обследования методом.


 Здесь проводят общий анализ крови.
Здесь проводят общий анализ крови.